| Hypersensitivitätsreaktionen (Coombs-Schema) |
|||
| Typ |
Mediator |
Pathomechanismus |
Beispiel |
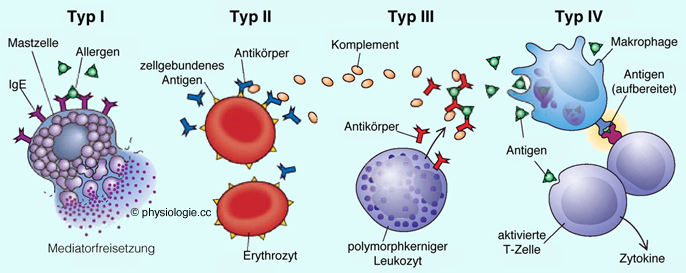
| I (Allergie) |
IgE |
Mastzellen (Aktivierung & Degranulierung) |
Lebensmittelallergie Asthma bronchiale allergische Rhinitis |
| II (Hämolyse) |
IgG |
Lyse durch * IgG + Komplement * IgG + NK-Zellen * IgG + Phagozyten mit Fc-Rezeptor |
Medikamentenallergie |
| III (Immunkomplexe) |
IgG |
Immunkomplexablagerung + Komplementaktivierung (+ Entzündung) |
Serumkrankheit Arthus-Reaktion |
| IV (Delayed-type) |
T-Zellen |
proinflammatorische Zytokine, Chemokine Zytotoxizität |
Gluten-Enteropathie (Zöliakie) Kontaktdermatitis |

 Anaphylaktische allergische Reaktion: Typ I-Allergie
Anaphylaktische allergische Reaktion: Typ I-Allergie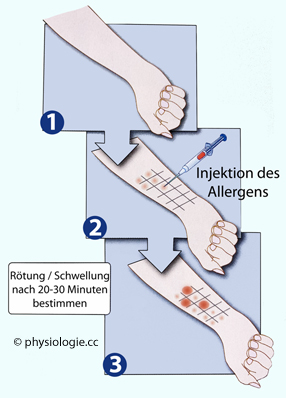

 Zytotoxisch-allergische Reaktion (Hämolyse): Typ II-Allergie
Zytotoxisch-allergische Reaktion (Hämolyse): Typ II-Allergie Immunkomplexe: Typ III-Allergie
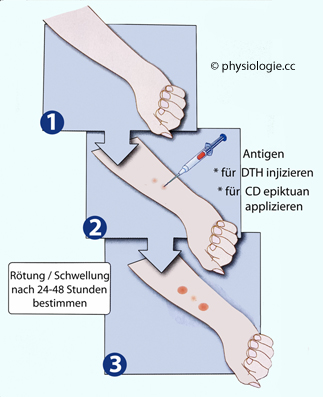
Immunkomplexe: Typ III-Allergie Bildung immunreaktiver Lymphozyten (Delayed-type hypersensitivity): Typ IV-Allergie
Bildung immunreaktiver Lymphozyten (Delayed-type hypersensitivity): Typ IV-Allergie