




| So wie die angeborene verfügt auch die adaptive Immunität über zelluläre und humorale Mechanismen: -- Zelluläre Immunität wird durch T-Lymphozyten umgesetzt, sie richtet sich gegen Mikroben (Viren), die in die Zelle eingedrungen sind -- Humorale Immunität erfolgt im Wesentlichen durch Antikörper (B-Lymphozyten), sie bekämpft extrazelluläre Mikroben und deren Toxine. Antikörper sind modifizierte Rezeptormoleküle, die von Plasmazellen an den extrazellulären Raum abgegeben werden - sie binden an antigene Epitope (passende Molekülstellen z.B. an einem Bakterium). Antikörper bestehen aus einem antigenbindenden Fab-Teil und einem Fc-Teil, der - falls aktiviert - Komplement binden oder Phagozyten anregen kann. Antikörper können monomer (z.B. IgG), dimer (IgA) oder pentamer vorliegen (IgM). IgG gelangt durch Kapillarwände, IgA wird an Schleimhäuten sezerniert, IgM eignet sich mit seinen 10 Antigen-Bindungsstellen besonders zur Agglutination von Antigenträgern. Antikörper können dem angeborenen Immunsystem helfen, z.B. bei antikörpervermittelter Phagozytose: Haben sie Antigen gebunden, modifizieren sie ihren Fc-Teil so, dass er von Fc-Rezeptoren an Phagozyten erkannt wird und diese aktiviert. |
 Immunglobulin-Superfamilie
Immunglobulin-Superfamilie  Adaptive Immunität und Lymphozyten
Adaptive Immunität und Lymphozyten  Epitop und Bindungsspezifität
Epitop und Bindungsspezifität  Humorale Abwehr
Humorale Abwehr  B-Zell-Rezeptorkomplex
B-Zell-Rezeptorkomplex  Anergie
Anergie  Aufbau und Funktionen des Antikörpermoleküls
Aufbau und Funktionen des Antikörpermoleküls  Immunglobulinklassen
Immunglobulinklassen  ADCC
ADCC  Isotypenwechsel, Somatische Hypermutation
Isotypenwechsel, Somatische Hypermutation  Klonselektion
Klonselektion  B-Zellen
B-Zellen
 Antikörper
Antikörper  Affinitätsreifung
Affinitätsreifung  Naive Lymphozyten
Naive Lymphozyten  Gedächtniszellen
Gedächtniszellen  Hypervariable Region (CDR)
Hypervariable Region (CDR)  Serokonversion, Seroreversion
Serokonversion, Seroreversion  Immunkomplex
Immunkomplex  Agglutination
Agglutination  Isotyp
Isotyp  Antikörperabhängige zellvermittelte Zytotoxizität (ADCC)
Antikörperabhängige zellvermittelte Zytotoxizität (ADCC)  Antikörpertiter
Antikörpertiter 
 Core messages
Core messages| Eigenschaften des adaptiven Immunsystems Nach Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024 |
|
| Eigenschaft |
Funktionelle Bedeutung |
| Spezifität |
Nur aktuell bedeutsame Merkmale werden attackiert |
| Diversität |
Großes Lymphozytenrepertoire |
| Gedächtnis |
Wiederholte Exposition zum Antigen führt zu verstärkter und beschleunigter Reaktion |
| Immunologische Toleranz |
Immunologischer Schutz ohne Gefährdung körpereigener Antigene (horror autotoxicus) |
 Jeder naive Lymphozyt produziert eine bestimmte Rezeptorvariante, die
(vor allem oder ausschließlich) ein bestimmtes Epitop erkennen und
binden kann - unabhängig davon, ob dieses Epitop (Antigen) jemals im
Körper auftaucht. Falls das passiert, proliferieren - aus der riesigen Auswahl von Millionen Lymphozyten unterschiedlicher Spezifität -
diejenigen mit passenden Rezeptoren. Das liegt am Mechanismus der
Klonselektion und ermöglicht eine entsprechende spezifische
Abwehrreaktion, die nach einigen Tagen der Vermehrung der "passenden"
Lymphozyten ihren Höhepunkt erreicht.
Jeder naive Lymphozyt produziert eine bestimmte Rezeptorvariante, die
(vor allem oder ausschließlich) ein bestimmtes Epitop erkennen und
binden kann - unabhängig davon, ob dieses Epitop (Antigen) jemals im
Körper auftaucht. Falls das passiert, proliferieren - aus der riesigen Auswahl von Millionen Lymphozyten unterschiedlicher Spezifität -
diejenigen mit passenden Rezeptoren. Das liegt am Mechanismus der
Klonselektion und ermöglicht eine entsprechende spezifische
Abwehrreaktion, die nach einigen Tagen der Vermehrung der "passenden"
Lymphozyten ihren Höhepunkt erreicht. Als Klon (clone)
Als Klon (clone) bezeichnet man eine Gruppe genotypisch und phänotypisch identer Zellen
(z.B. Lymphozyten), die sämtlich von einer einzelnen Zelle abstammen.
Die Klonselektionstheorie postuliert, dass die Diversität der Lymphozyten schon vor
dem Erstkontakt mit einem bestimmten Antigen vorhanden ist und dass
dieser Kontakt entsprechende Lymphozyten lediglich zur Teilung (und
Bildung eines großen antigenspezifischen Zellklons) anregt.
bezeichnet man eine Gruppe genotypisch und phänotypisch identer Zellen
(z.B. Lymphozyten), die sämtlich von einer einzelnen Zelle abstammen.
Die Klonselektionstheorie postuliert, dass die Diversität der Lymphozyten schon vor
dem Erstkontakt mit einem bestimmten Antigen vorhanden ist und dass
dieser Kontakt entsprechende Lymphozyten lediglich zur Teilung (und
Bildung eines großen antigenspezifischen Zellklons) anregt.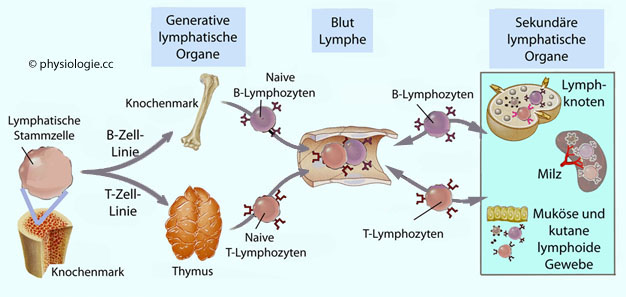
 Abbildung: Lymphozyten: Reifung und Gewebeverteilung
Abbildung: Lymphozyten: Reifung und Gewebeverteilung
 Als Antikörper bezeichnet man Immunglobulinmoleküle, die spezifisch an Antigene
(z.B. an Mikroben) binden. Sie erkennen - und binden an -
Kohlenhydrate, Proteine, Lipide und Nukleinsäuren (und gegebenenfalls
weitere Stoffe). Antikörper werden von Plasmazellen (eines
entsprechenden "selektionierten" B-Zell-Klons) gebildet und an Blutplasma, extrazelluläre und Lymphflüssigkeit, oder die Oberfläche von Schleimhäuten (z.B. Atemwege, Darmschleimhaut, Urogenitaltrakt, Perikard, Pleura, Peritoneum, Auge, Mittelohr..) abgegeben. Antikörper
Als Antikörper bezeichnet man Immunglobulinmoleküle, die spezifisch an Antigene
(z.B. an Mikroben) binden. Sie erkennen - und binden an -
Kohlenhydrate, Proteine, Lipide und Nukleinsäuren (und gegebenenfalls
weitere Stoffe). Antikörper werden von Plasmazellen (eines
entsprechenden "selektionierten" B-Zell-Klons) gebildet und an Blutplasma, extrazelluläre und Lymphflüssigkeit, oder die Oberfläche von Schleimhäuten (z.B. Atemwege, Darmschleimhaut, Urogenitaltrakt, Perikard, Pleura, Peritoneum, Auge, Mittelohr..) abgegeben. Antikörper regen die Phagozytose von Mikroben durch Opsonisierung an,
regen die Phagozytose von Mikroben durch Opsonisierung an, verhindern zelluläre Infektion: Durch Bindung von Antikörpern
können Mikroben nicht mehr an somatische Zellen andocken,
verhindern zelluläre Infektion: Durch Bindung von Antikörpern
können Mikroben nicht mehr an somatische Zellen andocken, geben die Zerstörung
durch andere Elemente des Immunsystems frei (antigenabhängige
Zytotoxizität, z.B. durch NK-Zellen),
geben die Zerstörung
durch andere Elemente des Immunsystems frei (antigenabhängige
Zytotoxizität, z.B. durch NK-Zellen), neuralisieren bakterielle Toxine,
neuralisieren bakterielle Toxine,  verbinden Zellen
oder Partikel zu Komplexen, wodurch die angegriffenen Strukturen unbeweglich
und leichter abbaubar werden (Agglutination).
verbinden Zellen
oder Partikel zu Komplexen, wodurch die angegriffenen Strukturen unbeweglich
und leichter abbaubar werden (Agglutination). Sind
Mikroben einmal in Zellen gelangt, können Antikörper nichts mehr gegen
sie ausrichten. Hier können nur T-Lymphozyten weiterhelfen: Sie können
Zytokine produzieren (T-Helferzellen) und infizierte Zellen vernichten
(zytotoxische T-Zellen).
Sind
Mikroben einmal in Zellen gelangt, können Antikörper nichts mehr gegen
sie ausrichten. Hier können nur T-Lymphozyten weiterhelfen: Sie können
Zytokine produzieren (T-Helferzellen) und infizierte Zellen vernichten
(zytotoxische T-Zellen).| Eigenschaften von Lymphozyten im adaptiven Immunsystem Nach Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024 |
||||
| Klasse |
Funktion |
Prozentueller Anteil (100% = alle Lymphozyten) |
||
| αβ-T-Lymphozyten |
Blut |
Lymphknoten |
Milz |
|
| CD4+ Helferzellen |
B-Zell-Aktivierung Makrophagenaktivierung Entzündungsanregung |
20-60% |
50-60% |
50-60% |
| CD8+ zytotoxische Zellen (CTL) |
Abtötung infizierter oder Tumorzellen |
15-40% |
15-20% |
10-15% |
| Regulatorische T-Zellen (Treg) |
Suppression anderer T-Zellen (Selbsttoleranz, Regulierung von Immunantworten) |
0,5-2% |
5-10% |
5-10% |
| B-Lymphozyten |
Blut |
Lymphknoten |
Milz |
|
| B-Zellen / Plasmazellen |
Antikörperproduktion (humorale Immunität) |
5-20% |
20-25% |
40-45% |
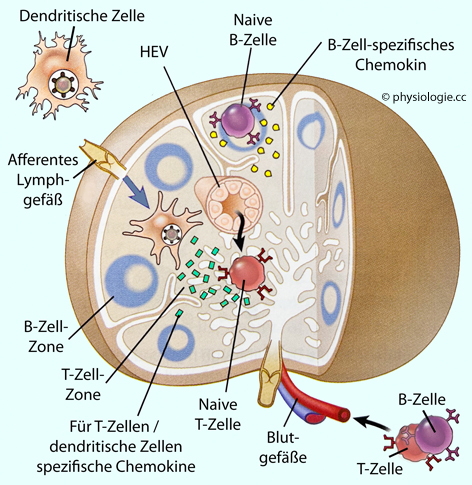
 Abbildung: Aufteilung von B- und T-Lymphozyten in einem peripheren lymphatischen Organ
Abbildung: Aufteilung von B- und T-Lymphozyten in einem peripheren lymphatischen Organ
 Abbildung), zu der neben B- und T-Zell-Rezeptoren u.a. MHC-Moleküle und zahlreiche CD-Proteine gehören.
Abbildung), zu der neben B- und T-Zell-Rezeptoren u.a. MHC-Moleküle und zahlreiche CD-Proteine gehören. 
 Abbildung: Mitglieder der Immunglobulin- Superfamilie
Abbildung: Mitglieder der Immunglobulin- Superfamilie Fc-Rezeptor s. dort, MHC s. dort, CD s. dort
Fc-Rezeptor s. dort, MHC s. dort, CD s. dort
 Zu Rezeptoren der adaptiven Abwehr s. dort, zur Rezeptordiversität s. auch dort
Zu Rezeptoren der adaptiven Abwehr s. dort, zur Rezeptordiversität s. auch dort Abbildung):
Abbildung):
 Abbildung: Produktion zellspezifischer Immunglobulinketten (Beispiel IGH: immunglobulin heavy locus)
Abbildung: Produktion zellspezifischer Immunglobulinketten (Beispiel IGH: immunglobulin heavy locus)
 s. unten)
an. Solche Mutationen der B-Zell-DNA können die Antigenbindung der
Immunglobuline (Epitoperkennung) verändern bzw. verstärken (Affinitätsreifung). Isotypenwechsel und somatische Hypermutation erfolgen nur in B-, nicht in T-Lymphozyten.
s. unten)
an. Solche Mutationen der B-Zell-DNA können die Antigenbindung der
Immunglobuline (Epitoperkennung) verändern bzw. verstärken (Affinitätsreifung). Isotypenwechsel und somatische Hypermutation erfolgen nur in B-, nicht in T-Lymphozyten. Als Affinitätsreifung (affinity maturation) bezeichnet man einen Vorgang, der -T-Zell-abhängig - zu einer Steigerung der Affinität
von Antikörpern für ein bestimmtes Antigen führt und sich in
follikulären Keimzentren peripherer Gewebe abspielt. Er ist das
Ergebnis somatischer Hypermutation in Immunglobulingenen und darauf folgender Selektion von B-Zellen, welche die jeweils höchste Affinität zum Antigen aufweisen.
Als Affinitätsreifung (affinity maturation) bezeichnet man einen Vorgang, der -T-Zell-abhängig - zu einer Steigerung der Affinität
von Antikörpern für ein bestimmtes Antigen führt und sich in
follikulären Keimzentren peripherer Gewebe abspielt. Er ist das
Ergebnis somatischer Hypermutation in Immunglobulingenen und darauf folgender Selektion von B-Zellen, welche die jeweils höchste Affinität zum Antigen aufweisen. Zur somatischen Rekombination (Immunglobuline / T-Zell-Rezeptoren) s. auch dort
Zur somatischen Rekombination (Immunglobuline / T-Zell-Rezeptoren) s. auch dort bezeichnet man im adaptiven System jeden Stoff, der Lymphozyten dazu veranlassen kann, eine
(spezifische / adaptive) Immunantwort gegen ihn zu bilden.
bezeichnet man im adaptiven System jeden Stoff, der Lymphozyten dazu veranlassen kann, eine
(spezifische / adaptive) Immunantwort gegen ihn zu bilden. s. dort).
s. dort). "Naive" Zellen:
"Naive" Zellen: Als naive Lymphozyten (naive lymphocytes) bezeichnet
man immunkompetente (mit speziellen Immunglobulinen ausgestattete) B-
oder T-Lymphozyten, die "ihrem" Antigen noch nicht begegnet sind. Sie
proliferieren durch Kontakt mit passendem Antigen und werden zu
Effektorzellen, die z.B. Antikörper produzieren (Plasmazellen),
Zytokine sezernieren (Helfer-T-Zellen) oder angegriffene Zellen töten
(Killerzellen). Ihre Oberflächenmarker verleihen ihnen ein anderes
Rezirkulationsverhalten als Effektor- oder Gedächtniszellen.
Als naive Lymphozyten (naive lymphocytes) bezeichnet
man immunkompetente (mit speziellen Immunglobulinen ausgestattete) B-
oder T-Lymphozyten, die "ihrem" Antigen noch nicht begegnet sind. Sie
proliferieren durch Kontakt mit passendem Antigen und werden zu
Effektorzellen, die z.B. Antikörper produzieren (Plasmazellen),
Zytokine sezernieren (Helfer-T-Zellen) oder angegriffene Zellen töten
(Killerzellen). Ihre Oberflächenmarker verleihen ihnen ein anderes
Rezirkulationsverhalten als Effektor- oder Gedächtniszellen. Effektorzellen (effector cells)
- T oder B, zellulär oder humoral aktiv - können u.a. Pathogene
eliminieren. Ihre Lebensdauer beträgt einige Tage bis viele Jahre.
Effektorzellen (effector cells)
- T oder B, zellulär oder humoral aktiv - können u.a. Pathogene
eliminieren. Ihre Lebensdauer beträgt einige Tage bis viele Jahre. Gedächtniszellen:
Gedächtniszellen:  Gedächtniszellen (memory lymphocytes) - B oder T - überleben nach einer spezifischen Abwehrphase (Elimination des Antigens) und verbleiben für viele Jahre in einem funktionellen Ruhezustand.
Einige siedeln sich sich in Lymphknoten an, andere in epithelialem
Gewebe (Haut, Schleimhäute), wieder andere an entzündeten Stellen. Bei
nochmaligem Kontakt mit "ihrem" Antigen können sie sich rasch vermehren
und einen verstärkten Immunschutz bereitstellen.
Gedächtniszellen (memory lymphocytes) - B oder T - überleben nach einer spezifischen Abwehrphase (Elimination des Antigens) und verbleiben für viele Jahre in einem funktionellen Ruhezustand.
Einige siedeln sich sich in Lymphknoten an, andere in epithelialem
Gewebe (Haut, Schleimhäute), wieder andere an entzündeten Stellen. Bei
nochmaligem Kontakt mit "ihrem" Antigen können sie sich rasch vermehren
und einen verstärkten Immunschutz bereitstellen. 
 Abbildung: Produktion und Wirkung von Antikörpern
Abbildung: Produktion und Wirkung von Antikörpern
 B: Rotes Knochenmark
(Bone marrow - bei Vögeln Bursa Fabricii
B: Rotes Knochenmark
(Bone marrow - bei Vögeln Bursa Fabricii  , daher "B")
, daher "B") T: Thymusdrüse (im Blut überwiegen T-Zellen mit ca.
80% der Lymphozyten)
T: Thymusdrüse (im Blut überwiegen T-Zellen mit ca.
80% der Lymphozyten)
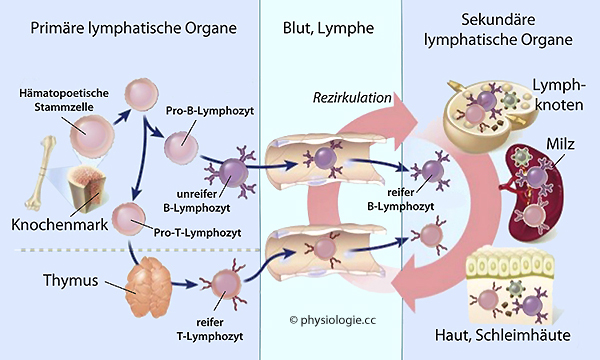
 Abbildung: Lymphozytenreifung
Abbildung: Lymphozytenreifung zu sekundären lymphatischen Organen (Milz, Lymphknoten, MALT) und reifen dort zu B-Zellen,
zu sekundären lymphatischen Organen (Milz, Lymphknoten, MALT) und reifen dort zu B-Zellen, zum Thymus und reifen dort zu T-Zellen.
zum Thymus und reifen dort zu T-Zellen.
 Abbildung). Dann treten sie aus
diesen als naive Lymphozyten (die noch keiner Begegnung mit "ihrem" Antigen ausgesetzt waren) aus und wandern in sekundäre lymphatische Organe (Lymphknoten, Milz). Hier werden einige von ihnen durch Antigene aktiviert und werden zu Effektor- und Gedächtniszellen.
Abbildung). Dann treten sie aus
diesen als naive Lymphozyten (die noch keiner Begegnung mit "ihrem" Antigen ausgesetzt waren) aus und wandern in sekundäre lymphatische Organe (Lymphknoten, Milz). Hier werden einige von ihnen durch Antigene aktiviert und werden zu Effektor- und Gedächtniszellen.  Reife Lymphozyten, die noch keinen Kontakt mit dem Antigen hatten, das
auf ihre Rezeptoren (Antikörpermoleküle) passt, werden als naiv
(immunologisch unerfahren) bezeichnet (sie exprimieren zahlreiche IL7-Rezeptoren).
Man findet sie im Kreislauf und in peripheren lymphatischen Organen;
ihr Durchmesser beträgt 8-10 µm. Kernphysiologisch befinden sie sich in
der G0-Phase und können von dieser aus zur G1-Phase zurückkehren, um sich zu teilen (GS-Phase:
Mitose). Um zu überleben, benötigen sie die Reizung durch Zytokine (sie
verfügen über Zytokinrezeptoren), vor allem IL-7.
Reife Lymphozyten, die noch keinen Kontakt mit dem Antigen hatten, das
auf ihre Rezeptoren (Antikörpermoleküle) passt, werden als naiv
(immunologisch unerfahren) bezeichnet (sie exprimieren zahlreiche IL7-Rezeptoren).
Man findet sie im Kreislauf und in peripheren lymphatischen Organen;
ihr Durchmesser beträgt 8-10 µm. Kernphysiologisch befinden sie sich in
der G0-Phase und können von dieser aus zur G1-Phase zurückkehren, um sich zu teilen (GS-Phase:
Mitose). Um zu überleben, benötigen sie die Reizung durch Zytokine (sie
verfügen über Zytokinrezeptoren), vor allem IL-7. | Homöostatische Proliferation nennt man den Mechanismus, der dafür sorgt, dass die Zahl zirkulierender naiver Lymphozyten weitgehend stabil bleibt. |

 Abbildung: Lymphozytenaktivierung
Abbildung: Lymphozytenaktivierung
 Haben sie das passende Antigen
"gefunden", gebunden und dadurch eine Aktivierung erfahren,
differenzieren sie sich zu 10-12 µm großen, zytoplasmareicheren Effektorzellen (zur Eliminierung von Mikroben). Zu Effektor-T-Lymphozyten gehören CD4-positive Helferzellen und CD8-positive zytotoxische Zellen; Effektor-B-Lymphozyten sind vor allem Plasmazellen.
Haben sie das passende Antigen
"gefunden", gebunden und dadurch eine Aktivierung erfahren,
differenzieren sie sich zu 10-12 µm großen, zytoplasmareicheren Effektorzellen (zur Eliminierung von Mikroben). Zu Effektor-T-Lymphozyten gehören CD4-positive Helferzellen und CD8-positive zytotoxische Zellen; Effektor-B-Lymphozyten sind vor allem Plasmazellen. Gedächtniszellen exprimieren
auf eine spezifische Reaktion zurückzuführende Membranproteine und sind
bei weiterem Antigenkontakt zu rascher Reaktion und
Abwehr befähigt. Sie exprimieren (wie naive Lymphozyten) intensiv
IL-7-Rezeptoren. Der Gedächtniszellenpool besteht aus mehreren Subsets unterschiedlich mit Markern versehenen Lymphozyten.
Gedächtniszellen exprimieren
auf eine spezifische Reaktion zurückzuführende Membranproteine und sind
bei weiterem Antigenkontakt zu rascher Reaktion und
Abwehr befähigt. Sie exprimieren (wie naive Lymphozyten) intensiv
IL-7-Rezeptoren. Der Gedächtniszellenpool besteht aus mehreren Subsets unterschiedlich mit Markern versehenen Lymphozyten.  Hypervariable Regionen (hypervariable regions, complementarity determining regions CDRs) sind kurze (~10
Aminosäuren) Sequenzen innerhalb der variablen Ketten von Antikörpern
oder T-Zell-Rezeptoren. Sie formen schleifenförmige Strukturen, die auf
antigene Epitope passen. Sie sind größtenteils für die Vielfalt der
variablen Regionen verantwortlich und binden direkt an entsprechende
Epitope von Antigenen, die vom B-Zell-Rezeptor bzw. Antikörper erkannt
werden. Die Sequenzvariabilität konzentriert sich auf die hypervariablen Regionen; so bleibt die prinzipielle Struktur des Rezeptormoleküls bzw. Antikörpers trotz hoher Variabilität seiner der Antigenerkennung erhalten.
Hypervariable Regionen (hypervariable regions, complementarity determining regions CDRs) sind kurze (~10
Aminosäuren) Sequenzen innerhalb der variablen Ketten von Antikörpern
oder T-Zell-Rezeptoren. Sie formen schleifenförmige Strukturen, die auf
antigene Epitope passen. Sie sind größtenteils für die Vielfalt der
variablen Regionen verantwortlich und binden direkt an entsprechende
Epitope von Antigenen, die vom B-Zell-Rezeptor bzw. Antikörper erkannt
werden. Die Sequenzvariabilität konzentriert sich auf die hypervariablen Regionen; so bleibt die prinzipielle Struktur des Rezeptormoleküls bzw. Antikörpers trotz hoher Variabilität seiner der Antigenerkennung erhalten. bezeichnet man kleine (<2,5 kDa) Moleküle, die zwar an Antikörper binden, aber keine T-Zell-Hilfe und Immunantwort auslösen - außer, sie binden an ein größeres Trägermolekül (was z.B. Nebenwirkungen mancher Pharmaka erklärt).
bezeichnet man kleine (<2,5 kDa) Moleküle, die zwar an Antikörper binden, aber keine T-Zell-Hilfe und Immunantwort auslösen - außer, sie binden an ein größeres Trägermolekül (was z.B. Nebenwirkungen mancher Pharmaka erklärt).Antigenbindung durch Rezeptoren Nach Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018 |
||
| Eigenschaft |
Immunglobuline (frei oder als B-Zell-Rezeptoren) |
T-Zell-Rezeptoren |
| Antigenbindung |
Je 3 CDRs in der VH- und VL-Domäne |
Je 3 CDRs in der Vα- und Vβ-Domäne |
| Antigen |
Makromoleküle (Proteine, Lipide, Polysaccharide), Peptide, kleine Chemikalien |
Peptid-MHC-Komplexe |
| Affinität der Bindung |
Dissoziationskonstante KD 10-7 - 10-11 M Affinität steigt mit Immunantwort |
KD 10-5 - 10-7 M |

 Abbildung: Wie Antikörper wirken (Beispiele)
Abbildung: Wie Antikörper wirken (Beispiele) Folgen einer Antikörperbindung: Antikörper können an Mikroben multipel binden und sie so über die gesamte Oberfläche mit
einer Schichte aus IgM oder IgG überziehen. Das aktiviert
typischerweise den klassischen Komplementweg und zerstört die Mikrobe
durch Lyse.
Folgen einer Antikörperbindung: Antikörper können an Mikroben multipel binden und sie so über die gesamte Oberfläche mit
einer Schichte aus IgM oder IgG überziehen. Das aktiviert
typischerweise den klassischen Komplementweg und zerstört die Mikrobe
durch Lyse.  Abbildung).
Abbildung).| Zytokine für Klassenwechsel (isotype switching)  Nach Doan / Lievano / Swanson-Mungerson / Viselli (2022), Immunology. Lippincott Illustrated Reviews, Wolters Kluwer |
|
| Zytokin |
fördert Wechsel zu |
| IL-4 |
IgG1, IgG3, IgG4, IgE |
| IL-17 |
IgG1, IgG3 |
| TGF-β |
IgA |
| IFN-γ |
IgG1, IgG3 |
 Serokonversion ist
die Bildung von veränderten Antikörpern, die bei einer Infektion bzw.
Immunisierung im Serum nachweisbar werden. Während der Serokonversion -
in deren Rahmen auch ein Isotypenwechsel von IgM zu IgG erfolgt -
werden Antikörper bereits gebildet, sind aber noch nicht nachweisbar;
nach Abschluss der Serokonversion sind entsprechende Antikörper mit
Standardmethoden nachweisbar (Seropositivität). Verschwindet die Nachweisberkeit wieder, spricht man von Seroreversion (diese bedingt Seronegativität).
Serokonversion ist
die Bildung von veränderten Antikörpern, die bei einer Infektion bzw.
Immunisierung im Serum nachweisbar werden. Während der Serokonversion -
in deren Rahmen auch ein Isotypenwechsel von IgM zu IgG erfolgt -
werden Antikörper bereits gebildet, sind aber noch nicht nachweisbar;
nach Abschluss der Serokonversion sind entsprechende Antikörper mit
Standardmethoden nachweisbar (Seropositivität). Verschwindet die Nachweisberkeit wieder, spricht man von Seroreversion (diese bedingt Seronegativität). B-Zellen, T-Zellen und Antigen
treffen sich in lymphatischen Organen an der Grenze der B- und T-Lymphozytenzonen.
B-Zellen, T-Zellen und Antigen
treffen sich in lymphatischen Organen an der Grenze der B- und T-Lymphozytenzonen.  TI-1-Antigene - diese binden nicht an den B-Rezeptor (BCR), sondern an andere Oberflächenmoleküle der B-Zelle und können (sowohl unreife als auch reife) B-Zellen unabhängig
von der Epitopspezifität des BCR aktivieren. Es handelt sich meist um
Lipopolysaccharide mikrobiellen Ursprungs. Weil sie die B-Zelle zur
Teilung anregen können, nennt man sie auch B-Zell-Mitogene.
TI-1-Antigene - diese binden nicht an den B-Rezeptor (BCR), sondern an andere Oberflächenmoleküle der B-Zelle und können (sowohl unreife als auch reife) B-Zellen unabhängig
von der Epitopspezifität des BCR aktivieren. Es handelt sich meist um
Lipopolysaccharide mikrobiellen Ursprungs. Weil sie die B-Zelle zur
Teilung anregen können, nennt man sie auch B-Zell-Mitogene. TI-2-Antigene
enthalten repetitive Epitope (oft Polysaccharide). Sie aktivieren nur
reife B.Zellen und bewirken Clustering der Rezeptoren an der
Bindungsstelle ("capping"), was zahlreiche Rezeptoren zusammenbringt und das Triggern der intrazellulären Signalkaskade erleichtert.
TI-2-Antigene
enthalten repetitive Epitope (oft Polysaccharide). Sie aktivieren nur
reife B.Zellen und bewirken Clustering der Rezeptoren an der
Bindungsstelle ("capping"), was zahlreiche Rezeptoren zusammenbringt und das Triggern der intrazellulären Signalkaskade erleichtert.
 Abbildung: Phasen der humoralen Immunantwort
Abbildung: Phasen der humoralen Immunantwort
 Abbildung). Die Affinität der Antikörper nimmt
im Rahmen dieses Vorgangs zu (Affinitätsreifung); im Rahmen der Hypermutation allenfalls
autoaggressiv gewordene B-Zellen werden durch T-Zellen nicht weiter
unterstützt und sterben ab.
Abbildung). Die Affinität der Antikörper nimmt
im Rahmen dieses Vorgangs zu (Affinitätsreifung); im Rahmen der Hypermutation allenfalls
autoaggressiv gewordene B-Zellen werden durch T-Zellen nicht weiter
unterstützt und sterben ab. Aus einer B-Zelle wird innerhalb einer Woche ein Klon aus ~5000 Zellen, die zusammen mehr
als eine Billion (1012)
Antikörpermoleküle pro Tag sezernieren. Eine Person verfügt
größenordnungsmäßig über 10 Millionen unterschiedliche
Antikörperspezifitäten, diese können an die ~107 unterschiedliche Epitope erkennen.
Aus einer B-Zelle wird innerhalb einer Woche ein Klon aus ~5000 Zellen, die zusammen mehr
als eine Billion (1012)
Antikörpermoleküle pro Tag sezernieren. Eine Person verfügt
größenordnungsmäßig über 10 Millionen unterschiedliche
Antikörperspezifitäten, diese können an die ~107 unterschiedliche Epitope erkennen. Abbildung, s. auch weiter oben). Antigene mit
vielen Bindungsstellen (multivalente Antigene, z.B. Polysaccharide) können B-Zellen direkt aktivieren; die Antikörperreaktion ist T-Zell-unabhängig und relativ schwach - hauptsächlich bewerkstelligt durch niedrigaffine IgM-Moleküle -, aber sie erfolgt rasch.
Abbildung, s. auch weiter oben). Antigene mit
vielen Bindungsstellen (multivalente Antigene, z.B. Polysaccharide) können B-Zellen direkt aktivieren; die Antikörperreaktion ist T-Zell-unabhängig und relativ schwach - hauptsächlich bewerkstelligt durch niedrigaffine IgM-Moleküle -, aber sie erfolgt rasch.
 Abbildung: T-Zell-abhängige und T-Zell-unabhängige Antikörperreaktionen
Abbildung: T-Zell-abhängige und T-Zell-unabhängige Antikörperreaktionen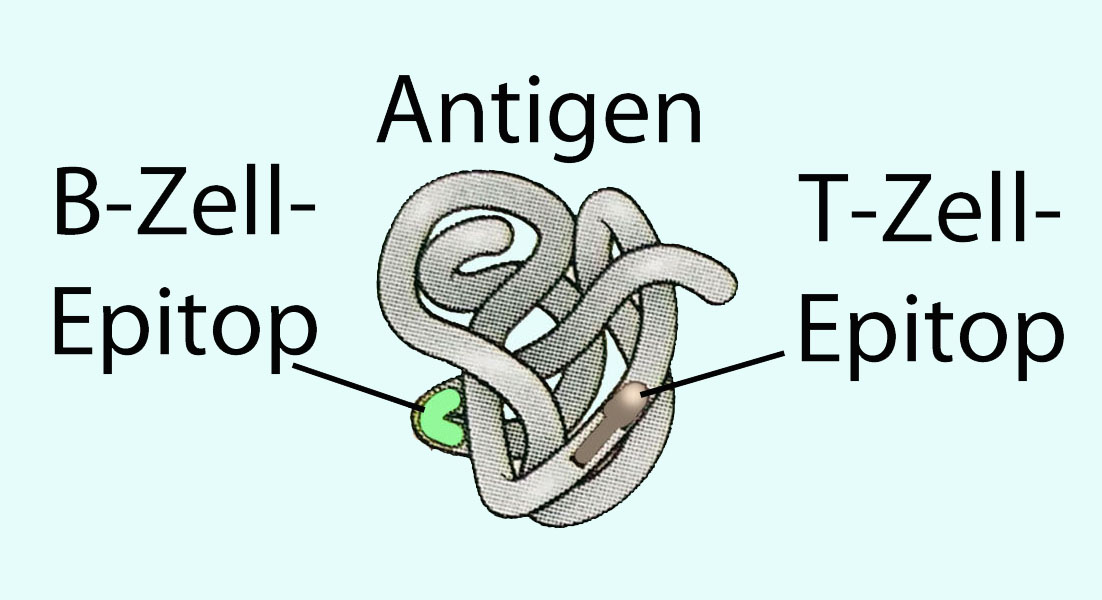 T-Zell-abhängige Antikörperreaktionen auf Proteinantigene betreffen
hauptsächlich follikuläre B-Zellen - d.h. solche, die in
Lymphknotenfollikeln konzentriert sind. Das B-Rezeptor-Epitop ist
hellgrün, das T-Rezeptor-Epitop in braunem Farbton angedeutet.
T-Zell-abhängige Antikörperreaktionen auf Proteinantigene betreffen
hauptsächlich follikuläre B-Zellen - d.h. solche, die in
Lymphknotenfollikeln konzentriert sind. Das B-Rezeptor-Epitop ist
hellgrün, das T-Rezeptor-Epitop in braunem Farbton angedeutet.
 Abbildung). Das erhöht die Breite der Reaktion, da unterschiedliche Isotypen unterschiedliche Wirkprofile haben (Tabelle).
Abbildung). Das erhöht die Breite der Reaktion, da unterschiedliche Isotypen unterschiedliche Wirkprofile haben (Tabelle).| IgM |
IgG1, IgG3 |
IgE, IgG4 |
IgA |
|
| Effektor- funktionen (hauptsächlich) |
Komplement- aktivierung |
Opsonisierung Phagozytose Komplement- aktivierung Plazentarer Transfer |
Mastzell- degranulierung Wirkung gegen Wurmbefall |
Submuköse Immunität (transepithelialer IgA-Transport) |
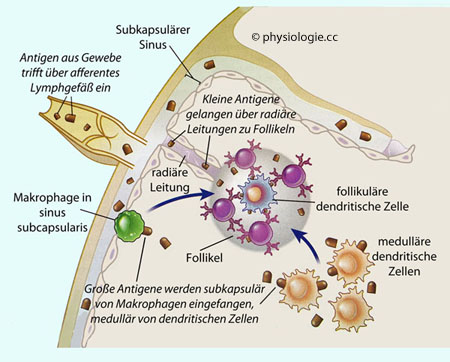
 Abbildung: Pfade des Antigentransportes zu B-Zellen in Lymphfollikeln
Abbildung: Pfade des Antigentransportes zu B-Zellen in Lymphfollikeln
 Abbildung):
Abbildung): Der Großteil der Antigene gelangt über afferente Lymphgefäße in
regionale Lymphknoten - zunächst in den subkapsulären Sinus und dann
über radiär verlaufende Leitungsbahnen zu Lymphfollikeln. Lösliche
Antigene sind meist kleiner als 70 kD
Der Großteil der Antigene gelangt über afferente Lymphgefäße in
regionale Lymphknoten - zunächst in den subkapsulären Sinus und dann
über radiär verlaufende Leitungsbahnen zu Lymphfollikeln. Lösliche
Antigene sind meist kleiner als 70 kD Subkapsulär liegende Makrophagen fangen Mikroben und Antigen-Antikörper-Komplexe ein und transportieren diese zu den Follikeln
Subkapsulär liegende Makrophagen fangen Mikroben und Antigen-Antikörper-Komplexe ein und transportieren diese zu den Follikeln Antigene, die nicht von Makrophagen abgefangen werden und zu groß für
die Passage durch radiäre Leitungsbahnen sind, können in der Markregion
von dendritischen Zellen gebunden und zu Follikeln transportiert werden
Antigene, die nicht von Makrophagen abgefangen werden und zu groß für
die Passage durch radiäre Leitungsbahnen sind, können in der Markregion
von dendritischen Zellen gebunden und zu Follikeln transportiert werden Antigene in Immunkomplexen können über Komplementrezeptoren von
B-Zellen gebunden werden, die in der Randzone der Follikel sitzen, oder
an dendritische Zellen. Beide bringen den Immunkomplex in einen
Follikel, wo im günstigen Fall B-Zellen mit passenden Rezeptoren
vorhanden sind.
Antigene in Immunkomplexen können über Komplementrezeptoren von
B-Zellen gebunden werden, die in der Randzone der Follikel sitzen, oder
an dendritische Zellen. Beide bringen den Immunkomplex in einen
Follikel, wo im günstigen Fall B-Zellen mit passenden Rezeptoren
vorhanden sind.  Polysaccharid-Antigene können von Makrophagen eingefangen und ebenfalls
in Follikel zu B-Zellen transportiert und hier präsentiert werden.
Polysaccharid-Antigene können von Makrophagen eingefangen und ebenfalls
in Follikel zu B-Zellen transportiert und hier präsentiert werden. Immunkomplexe
sind Zusammenlagerungen von Antikörpermolekülen und gebundenem Antigen.
Sie sind unterschiedlich groß (Zahl möglicher Bindungsstellen: 2 bis 10
pro Antikörper) und können Immunreaktionen triggern, z.B.
Komplementaktivierung oder Phagozytose (Fc-Rezeptor).
Immunkomplexe
sind Zusammenlagerungen von Antikörpermolekülen und gebundenem Antigen.
Sie sind unterschiedlich groß (Zahl möglicher Bindungsstellen: 2 bis 10
pro Antikörper) und können Immunreaktionen triggern, z.B.
Komplementaktivierung oder Phagozytose (Fc-Rezeptor). 
 Abbildung: Abfolge humoraler Immunantworten auf T-Zell-abhängige Proteinantigene
Abbildung: Abfolge humoraler Immunantworten auf T-Zell-abhängige Proteinantigene Abbildung). Dann interagieren die beiden Zellen, um eine humorale
Immunantwort einzuleiten:
Abbildung). Dann interagieren die beiden Zellen, um eine humorale
Immunantwort einzuleiten: Abbildung).
Abbildung). 
 Abbildung: Der B-Zell-Antigenrezeptor-Komplex
Abbildung: Der B-Zell-Antigenrezeptor-Komplex s. dort)
s. dort) 
 Abbildung) - ihre Anwesenheit ist für die
rezeptorgetriggerte Signaltransduktion erforderlich.
Abbildung) - ihre Anwesenheit ist für die
rezeptorgetriggerte Signaltransduktion erforderlich. Abbildung). So wirken
eine spezifische (Epitop-BCR) und eine unspezifische Komponente
(Komplementrezeptor-Komplementfragment) zusammen.
Abbildung). So wirken
eine spezifische (Epitop-BCR) und eine unspezifische Komponente
(Komplementrezeptor-Komplementfragment) zusammen. 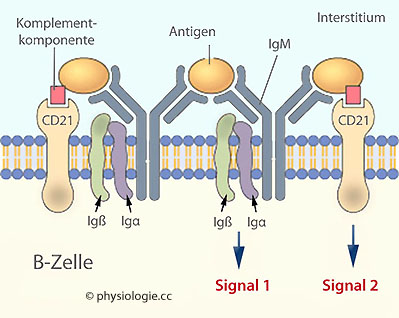
 Abbildung: B-Zell-Antigen-Rezeptorkomplex
Abbildung: B-Zell-Antigen-Rezeptorkomplex
 Abbildung). Das löst in der T-Zelle die Produktion und
Freisetzung von Zytokinen aus; die B-Zelle exprimiert entsprechende
Zytokinrezeptoren.
Abbildung). Das löst in der T-Zelle die Produktion und
Freisetzung von Zytokinen aus; die B-Zelle exprimiert entsprechende
Zytokinrezeptoren.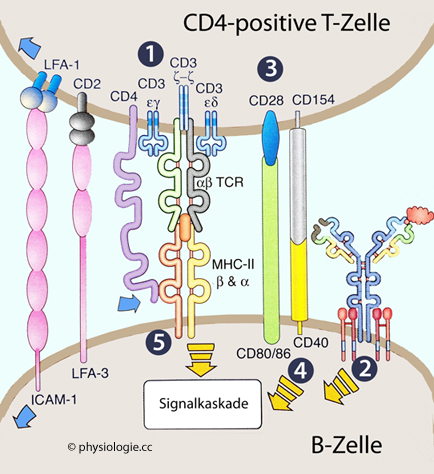
 Abbildung: Immunologische Synapse zwischen CD4+- und B-Zelle
Abbildung: Immunologische Synapse zwischen CD4+- und B-Zelle
 Abbildung).
Abbildung). Die Bindung von Epitopen an den BCR löst Endozytose, enzymatischen
Abbau des Antigens und die Präsentation von Peptidfragmenten an MHC-II
aus; außerdem exprimiert die B-Zelle costimulatorische Moleküle, was
aus dem B-Lymphozyten eine antigenpräsentierende Zelle macht - eine
Voraussetzung für das Erkennen einer immunologischen Herausforderung durch CD4-positive T-Lymphozyten.
Die Bindung von Epitopen an den BCR löst Endozytose, enzymatischen
Abbau des Antigens und die Präsentation von Peptidfragmenten an MHC-II
aus; außerdem exprimiert die B-Zelle costimulatorische Moleküle, was
aus dem B-Lymphozyten eine antigenpräsentierende Zelle macht - eine
Voraussetzung für das Erkennen einer immunologischen Herausforderung durch CD4-positive T-Lymphozyten. Abbildung).
Abbildung).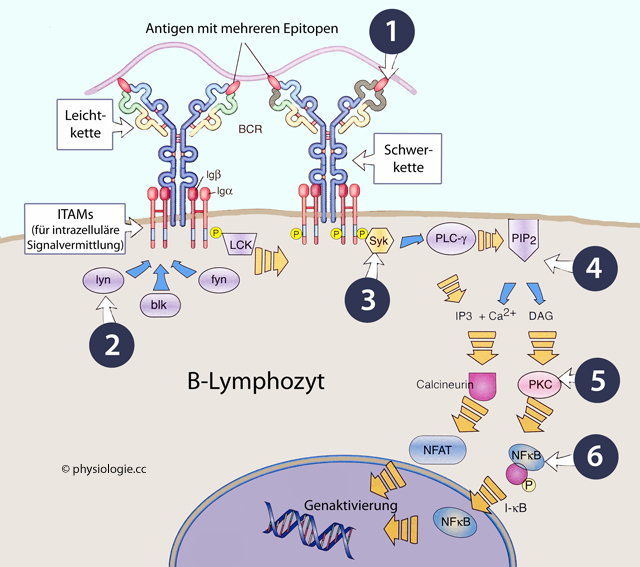
 Abbildung: Signaltransduktion durch den B-Zell- Rezeptorkomplex
Abbildung: Signaltransduktion durch den B-Zell- Rezeptorkomplex
 Zwei identischen schweren Ketten (H, heavy chains) und
Zwei identischen schweren Ketten (H, heavy chains) und Zwei identischen leichten Ketten (L, light chains).
Zwei identischen leichten Ketten (L, light chains). Einer variablen Region (V), bestehend aus einer Ig-Domäne, welche an der Antigenerkennung mitwirkt - die beiden VH-Domänen
der leichten und der schweren Kette eines Y-Armes bilden zusammen
jeweils eine antigenbindende Struktur (
Einer variablen Region (V), bestehend aus einer Ig-Domäne, welche an der Antigenerkennung mitwirkt - die beiden VH-Domänen
der leichten und der schweren Kette eines Y-Armes bilden zusammen
jeweils eine antigenbindende Struktur ( Abbildung) -, und
Abbildung) -, und einer konstanten Region (C), bestehend aus 3 oder 4 Ig-Domänen, die an der Antigenerkennung nicht teilnimmt, aber bei den schweren Ketten protektive und effektorische Aufgaben erfüllt.
einer konstanten Region (C), bestehend aus 3 oder 4 Ig-Domänen, die an der Antigenerkennung nicht teilnimmt, aber bei den schweren Ketten protektive und effektorische Aufgaben erfüllt.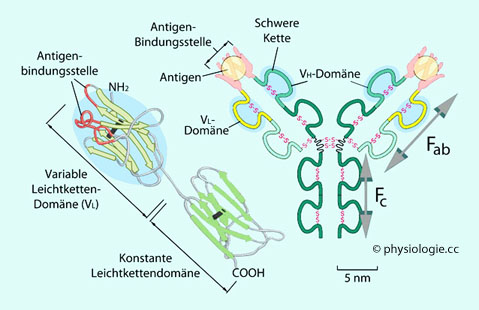
 Abbildung: Funktioneller Aufbau eines Antikörpermoleküls
Abbildung: Funktioneller Aufbau eines Antikörpermoleküls| An das Fc-Fragment des IgG binden Komplementfaktoren (C1q, C3b, C4b) und leukozytäre Fc-Rezeptoren (Glykoproteine) |
 Frei
in den Extrazellulärraum sezerniert wirken sie antimikrobiell (in
Blutplasma, Sekreten, interstitiellen und transzellulären Räumen);
Frei
in den Extrazellulärraum sezerniert wirken sie antimikrobiell (in
Blutplasma, Sekreten, interstitiellen und transzellulären Räumen); Eingelagert in die Zellmembran von B-Lymphozyten wirken sie als Antigenrezeptoren (naive B-Zellen werden durch Bindung eines "passenden" Antigens zu Plasmazellen).
Eingelagert in die Zellmembran von B-Lymphozyten wirken sie als Antigenrezeptoren (naive B-Zellen werden durch Bindung eines "passenden" Antigens zu Plasmazellen). Abbildung) stellen Adapter dar, welche spezifische
und
unspezifische Funktionen in einem Molekül vereinen. Sie erkennen - und
binden an - Antigene (bzw. deren spezifische Bindungsstellen: Epitope
Abbildung) stellen Adapter dar, welche spezifische
und
unspezifische Funktionen in einem Molekül vereinen. Sie erkennen - und
binden an - Antigene (bzw. deren spezifische Bindungsstellen: Epitope  oder antigene Determinanten).
oder antigene Determinanten).  Ein Antigen bindet an spezifische
Enden von Antikörpern bzw. T-Zell-Rezeptoren ("Schlüssel-Schloss-Prinzip").
Ein Antigen bindet an spezifische
Enden von Antikörpern bzw. T-Zell-Rezeptoren ("Schlüssel-Schloss-Prinzip").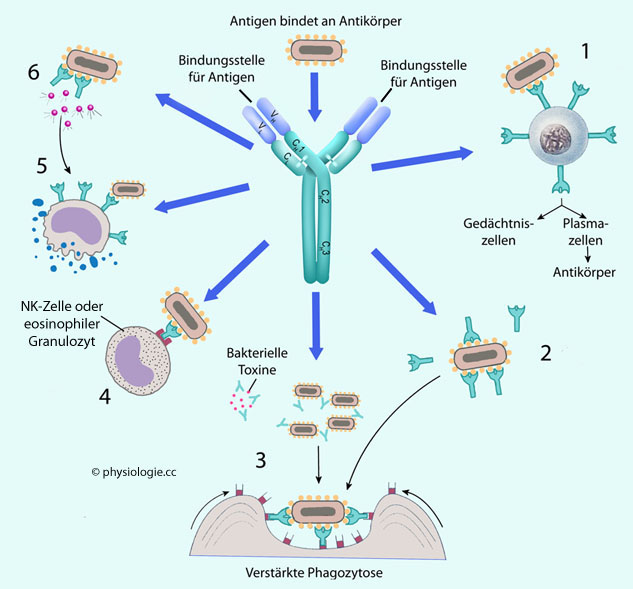
 Abbildung: Antikörper haben vielfache Funktionen
Abbildung: Antikörper haben vielfache Funktionen opsonisierend wirken (2), d.h. sich an lösliche Antigene anlagern und dadurch die Erkennung und Aufnahme durch Immunzellen fördern,
opsonisierend wirken (2), d.h. sich an lösliche Antigene anlagern und dadurch die Erkennung und Aufnahme durch Immunzellen fördern, Antigene agglutinieren - das intensiviert die Aktivität von Phagozyten
- und einige bakterielle Toxine inaktivieren (3).
Antigene agglutinieren - das intensiviert die Aktivität von Phagozyten
- und einige bakterielle Toxine inaktivieren (3). Mastzellen aktivieren (5)
- diese verfügen über IgE-Antikörper und degranulieren (setzen den
Inhalt ihrer Granula frei), wenn Antigene oder Komplementfaktoren an
diese binden,
Mastzellen aktivieren (5)
- diese verfügen über IgE-Antikörper und degranulieren (setzen den
Inhalt ihrer Granula frei), wenn Antigene oder Komplementfaktoren an
diese binden, Komplementfaktoren aktivieren (6) - antigengebundene Antikörper nutzen ihren Fc-Teil zur Aktivierung des Komplementsystems.
Komplementfaktoren aktivieren (6) - antigengebundene Antikörper nutzen ihren Fc-Teil zur Aktivierung des Komplementsystems. Rezeptoren an Immunzellen binden über den Fc-Teil Antikörper, die Antigene gebunden haben. Handelt es sich um Phagozyten, nehmen diese das mit Antikörpern markierte Antigen auf (3).
Sind es zytotoxische Zellen (NK-Zellen oder eosinophile Granulozyten),
wird die Zielzelle abgetötet; NK-Zellen leiten deren Apoptose ein
(ADCC, antibody-dependent cell-mediated cycotoxicity, 4).
Rezeptoren an Immunzellen binden über den Fc-Teil Antikörper, die Antigene gebunden haben. Handelt es sich um Phagozyten, nehmen diese das mit Antikörpern markierte Antigen auf (3).
Sind es zytotoxische Zellen (NK-Zellen oder eosinophile Granulozyten),
wird die Zielzelle abgetötet; NK-Zellen leiten deren Apoptose ein
(ADCC, antibody-dependent cell-mediated cycotoxicity, 4).  Bei B-Lymphozyten ist der Antikörper ein integraler Bestandteil der Zellmembran (1)
- bindet er ein Antigen, entstehen aus dem Lymphozyten einerseits
Plasmazellen (die Antikörper produzieren), andererseits
Gedächtniszellen (memory cells)
Bei B-Lymphozyten ist der Antikörper ein integraler Bestandteil der Zellmembran (1)
- bindet er ein Antigen, entstehen aus dem Lymphozyten einerseits
Plasmazellen (die Antikörper produzieren), andererseits
Gedächtniszellen (memory cells)

 Der
Fab-Teil (Antigen-binding fragment) mit einem chemischen “Abdruck” des Antigenmoleküls an
den Enden des "Y" für die Antigen-Antikörper-Reaktion. Aufgrund
ihrer Größe sind Fab-Fragmente ziemlich gut nierengängig und haben eine
geringe Halbwertszeit
Der
Fab-Teil (Antigen-binding fragment) mit einem chemischen “Abdruck” des Antigenmoleküls an
den Enden des "Y" für die Antigen-Antikörper-Reaktion. Aufgrund
ihrer Größe sind Fab-Fragmente ziemlich gut nierengängig und haben eine
geringe Halbwertszeit Der Fc-Teil (Fragment Crystallizable region) am
"Stiel" des Y bindet an diverse Fc-Rezeptoren - z.B. phagozytierender Zellen - und
aktiviert Komplement. Fc-Fragmente sind weiters beteiligt an Opsonisation, Zytolyse, sowie Degranulierung (Mastzellen, Eosinophile, Basophile -
Der Fc-Teil (Fragment Crystallizable region) am
"Stiel" des Y bindet an diverse Fc-Rezeptoren - z.B. phagozytierender Zellen - und
aktiviert Komplement. Fc-Fragmente sind weiters beteiligt an Opsonisation, Zytolyse, sowie Degranulierung (Mastzellen, Eosinophile, Basophile -  s. auch dort). Ohne Fc-Fragment können Fab-Fragmente kein
Komplement aktivieren und daher keine zytotoxischen Reaktionen
hervorrufen.
s. auch dort). Ohne Fc-Fragment können Fab-Fragmente kein
Komplement aktivieren und daher keine zytotoxischen Reaktionen
hervorrufen.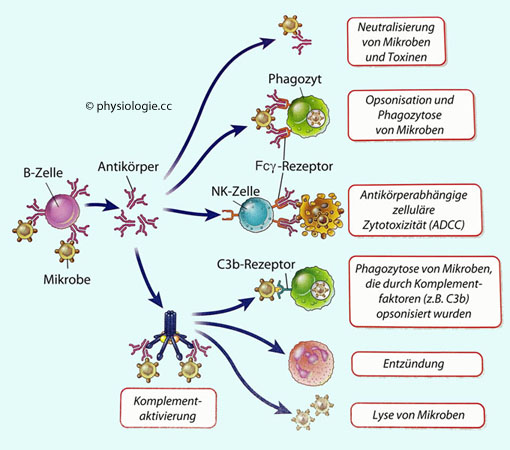
 Abbildung: Effektorfunktionen von Antikörpern
Abbildung: Effektorfunktionen von Antikörpern
 Antikörperabhängige zelluläre Zytotoxizität (ADCC: Antibody-dependent cellular cytotoxicity -
Antikörperabhängige zelluläre Zytotoxizität (ADCC: Antibody-dependent cellular cytotoxicity -  Abbildung) bedeutet das Anlagern von NK-Zellen
(oder anderen zytotoxischen Zellen) an spezifisch "antikörpermarkierte"
andere Zellen. Die Fc-Rezeptoren werden dann querverbunden (cross-linking) und können ihrerseits Mediatoren sezernieren.
Abbildung) bedeutet das Anlagern von NK-Zellen
(oder anderen zytotoxischen Zellen) an spezifisch "antikörpermarkierte"
andere Zellen. Die Fc-Rezeptoren werden dann querverbunden (cross-linking) und können ihrerseits Mediatoren sezernieren. .
. Abbildung) von Phagozyten erkannt und
aufgenommen werden.
Abbildung) von Phagozyten erkannt und
aufgenommen werden. Unter Agglutination versteht
man die Aneinanderlagerung ("Verklumpung") von Antigenträgern
(Partikeln, Bakterien, Zellen u.a.) durch Antikörper (Agglutinine). Agglutination reduziert bakterielle Ausbreitung und wird auch als Methode bei Blutgruppenbestimmungen verwendet.
Unter Agglutination versteht
man die Aneinanderlagerung ("Verklumpung") von Antigenträgern
(Partikeln, Bakterien, Zellen u.a.) durch Antikörper (Agglutinine). Agglutination reduziert bakterielle Ausbreitung und wird auch als Methode bei Blutgruppenbestimmungen verwendet.Charakteristika von Immunglobulin-Klassen Modifiziert nach Alberts et al, Molekularbiologie der Zelle, 6. Aufl. 2017 |
|||||
| Klasse |
IgM |
IgD |
IgG |
IgA |
IgE |
| Schwere Ketten |
μ | δ | γ | α | ε |
| Leichte Ketten |
κ / λ |
||||
| Anzahl 4-Ketten- Einheiten (ein "Y") |
5 |
1 |
1 |
1 / 2 |
1 |
| Anzahl Epitop- Bindungsstellen |
10 |
2 |
2 |
2 / 4 |
2 |
| Anteil an Ig im Blut |
~10% |
<1% |
~75% |
~15% |
<1% |
| Komplement- aktivierend? |
ja |
nein |
einige Unter- klassen |
nein |
nein |
| Plazentagängig? |
nein | nein | einige Unter- klassen |
nein | nein |
| Bindung an Makro- phagen / Neutrophile? |
nur Makro- phagen |
nein | einige Unter- klassen |
nein | nein |
| Bindung an Mast- zellen / Basophile? |
nein | nein | einige Unter- klassen |
nein | ja |
 Immunglobuline werden in verschiedene Klassen oder Isotype eingeteilt: Ein Isotyp
- im immunologischen Sinne - ist einer von 5 Antikörpertypen, abhängig
von der jeweiligen schweren Kette - α bei IgA, δ bei IgD, γ bei IgG, ε
bei IgE, μ bei IgM (variable Regionen gibt es in zahllosen Spielarten,
daher ihre Epitopspezifität). Jeder Isotyp erfüllt eine andere Effektorfunktion. IgA (IgA1, IgA2) und
IgG (IgG1 bis IgG4) zeigen Subtypen je nach zusätzlichen strukturellen Unterschieden.
Immunglobuline werden in verschiedene Klassen oder Isotype eingeteilt: Ein Isotyp
- im immunologischen Sinne - ist einer von 5 Antikörpertypen, abhängig
von der jeweiligen schweren Kette - α bei IgA, δ bei IgD, γ bei IgG, ε
bei IgE, μ bei IgM (variable Regionen gibt es in zahllosen Spielarten,
daher ihre Epitopspezifität). Jeder Isotyp erfüllt eine andere Effektorfunktion. IgA (IgA1, IgA2) und
IgG (IgG1 bis IgG4) zeigen Subtypen je nach zusätzlichen strukturellen Unterschieden.Immunglobulin-Isotypen und ihre Funktionen Nach Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press) |
||
| Isotyp |
Aktive Form |
Funktion(en) |
| IgM |
Monomer: B-Zell-Rezeptor Pentamer: Antikörper |
Erster produzierter Antikörper aktiviert Komplement |
| IgD |
Nur B-Zell-Rezeptor |
Zweiter produzierter Antikörper Funktion unklar |
| IgA |
B-Zell-Rezeptor Antikörper (vorwiegend) |
Führender Antikörper in Sekreten (Speichel, Tränen, Milch, Schleim) |
| IgG |
Führender Serumantikörper, bindet an Fc-Rezeptoren von Phagozyten, aktiviert Komplement |
|
| IgE |
Bindet an Fc-Rezeptoren von Basophilen / Mastzellen, vermittelt Typ-I-Allergie |
|
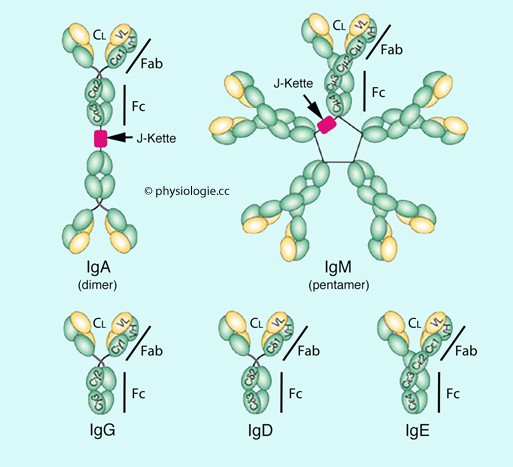
 Abbildung: Immunglobulinklassen
Abbildung: Immunglobulinklassen
 Abbildung) ist ein pentamerer Antikörper (970 kDa, Serumkonzentration ~1500 mg/l, biologische Halbwertszeit im Serum 10 Tage). Er wird
bei der spezifischen humoralen Immunantwort als erstes Immunglobulin
gebildet und hat den Vorteil, mit seiner "Schneeflockenform" mehrere Epitope gleichzeitig binden zu können.
Abbildung) ist ein pentamerer Antikörper (970 kDa, Serumkonzentration ~1500 mg/l, biologische Halbwertszeit im Serum 10 Tage). Er wird
bei der spezifischen humoralen Immunantwort als erstes Immunglobulin
gebildet und hat den Vorteil, mit seiner "Schneeflockenform" mehrere Epitope gleichzeitig binden zu können. | IgG wird aktiv über die Plazentaschranke transportiert |
 Abbildung).
Abbildung). 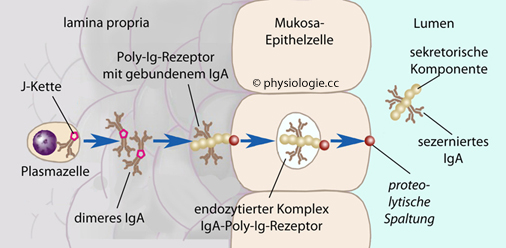
 Abbildung: Transzytose von IgA über eine Schleimhaut
Abbildung: Transzytose von IgA über eine Schleimhaut
 Abbildung): An der Basis der Epithelien
wird das IgA-Dimer über die J-Kette an einen Fc-Rezeptor, den Poly-Ig-Rezeptor,
gebunden. Dieses Glykoprotein der basolateralen Membran der
Epithelzellen transportiert IgA durch die Epithelzelle auf die Lumenseite der Schleimhaut (Atemwege, Speicheldrüsen, Verdauungssystem, Urogenitaltrakt, Tränendrüsen, Milchdrüsen).
Mit jeweils 5 extrazellulären Ig-Domänen kann dieser Rezeptor auch (das
pentamere) IgM über Epithelbarrieren in das Lumen transportieren
(daher "Poly") - s. oben.
Abbildung): An der Basis der Epithelien
wird das IgA-Dimer über die J-Kette an einen Fc-Rezeptor, den Poly-Ig-Rezeptor,
gebunden. Dieses Glykoprotein der basolateralen Membran der
Epithelzellen transportiert IgA durch die Epithelzelle auf die Lumenseite der Schleimhaut (Atemwege, Speicheldrüsen, Verdauungssystem, Urogenitaltrakt, Tränendrüsen, Milchdrüsen).
Mit jeweils 5 extrazellulären Ig-Domänen kann dieser Rezeptor auch (das
pentamere) IgM über Epithelbarrieren in das Lumen transportieren
(daher "Poly") - s. oben.  s. dort).
s. dort).| Vernetzen sich IgE-Moleküle, degranulieren Mastzellen und setzen Histamin frei Histamin erhöht die Endothelpermeabilität kleiner Blutgefäße Immunglobuline vom Typ IgE spielen bei Hypersensitivität vom Typ I (Soforttyp - anaphylaktische Reaktion) eine Schlüsselrolle |
Immunglobuline in Körperflüssigkeiten Gerundete Mittelwerte nach: Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. 2024; Duale Reihe Innere Medizin, Thieme 2013; Deuschl H, Johansson SGO, Immunoglobulins in tracheo-bronchial secretion with special referencde to IgE. Clin Exp Immunol 1974; 16: 401-12 |
|||||
| IgG |
IgA |
IgM |
IgD |
IgE |
|
| Serum (mg/ml) |
13,5 |
3,5 |
1,5 |
<0,1 |
0,05 |
| Darmsaft (µg/ml) |
200 |
300 |
1 |
0 |
<0,4 |
| Liquor (µg/ml) | 8-25 |
<3 |
1 |
0 |
0 |
| Kolostrum (µg/ml) | 30 |
10000 |
800 |
0 |
0 |
| Tracheo- bronchiales Sekret (µg/ml) |
60 |
240 |
- |
- |
0,01 |
 Als Agglutination
Als Agglutination  bezeichnet man die Aneinanderlagerung partikulärer Bestandteile im Blut. Agglutinine sind Stoffe im Blut, die partikuläre Bestandteile (z.B. Erythrozyten bei Blutgruppenunverträglichkeit) zur
Aggregation (Aneinanderlagerung) bringen und dadurch das Blut koagulieren (von flüssiger zu gelartiger Konsistenz überführen).
bezeichnet man die Aneinanderlagerung partikulärer Bestandteile im Blut. Agglutinine sind Stoffe im Blut, die partikuläre Bestandteile (z.B. Erythrozyten bei Blutgruppenunverträglichkeit) zur
Aggregation (Aneinanderlagerung) bringen und dadurch das Blut koagulieren (von flüssiger zu gelartiger Konsistenz überführen).  Präzipitine sind Antikörper, die durch Bindung ihres Antigens Antigen-Antikörper-Komplexe entstehen lassen. Diese sind besser phagozytierbar als gelöste Antigene. Präzipitationsreaktionen haben in der Labormedizin die ersten quantitativen Antikörperassays ermöglicht.
Präzipitine sind Antikörper, die durch Bindung ihres Antigens Antigen-Antikörper-Komplexe entstehen lassen. Diese sind besser phagozytierbar als gelöste Antigene. Präzipitationsreaktionen haben in der Labormedizin die ersten quantitativen Antikörperassays ermöglicht. Virusneutralisierende Antikörper: Mittels Neutralisationstests kann die antivirale Kapazität von Blutseren bestimmt werden.
Virusneutralisierende Antikörper: Mittels Neutralisationstests kann die antivirale Kapazität von Blutseren bestimmt werden. Antikörperabhängige zellvermittelte Zytotoxizität (antibody-dependent cell-mediated cytotoxicity ADCC) ist ein Vorgang, durch den sich natürliche
Killerzellen (NKC) gegen IgG-markierte Zellen wenden und diese lysieren. NKC und andere Leukozyten docken an durch Antikörper
"markierte" (z.B. infizierte) Zellen (freie Antikörper lösen keine
Reaktion aus). Dazu exprimieren NK-Zellen CD16 (=FcγRIII), spezifische Rezeptoren für die konstante Domäne des IgG-Moleküls
(FcR), mit denen die Bindung an das Immunglobulin vermittelt wird. Resultat
dieser Bindung ist die Freisetzung des Inhalts von Granula sowie die
Sekretion
von Zytokinen, das Ziel ist die Abtötung der markierten Zelle.
Antikörperabhängige zellvermittelte Zytotoxizität (antibody-dependent cell-mediated cytotoxicity ADCC) ist ein Vorgang, durch den sich natürliche
Killerzellen (NKC) gegen IgG-markierte Zellen wenden und diese lysieren. NKC und andere Leukozyten docken an durch Antikörper
"markierte" (z.B. infizierte) Zellen (freie Antikörper lösen keine
Reaktion aus). Dazu exprimieren NK-Zellen CD16 (=FcγRIII), spezifische Rezeptoren für die konstante Domäne des IgG-Moleküls
(FcR), mit denen die Bindung an das Immunglobulin vermittelt wird. Resultat
dieser Bindung ist die Freisetzung des Inhalts von Granula sowie die
Sekretion
von Zytokinen, das Ziel ist die Abtötung der markierten Zelle.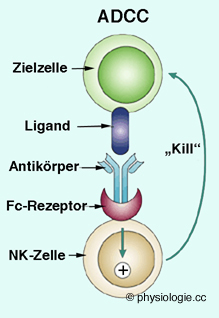
 Abbildung: Antikörperabhängige zellvermittelte Zytotoxizität
Abbildung: Antikörperabhängige zellvermittelte Zytotoxizität
 Abbildung).
Abbildung).  Antikörperabhängige zellvermittelte Zytotoxizität ist die Fc-Rezeptor-vermittelte Ausschüttung von NK-Zell-Granula und Abtötung von Zielzellen, die mit Antigenen beladen und mit
IgG-Molekülen markiert sind.
Antikörperabhängige zellvermittelte Zytotoxizität ist die Fc-Rezeptor-vermittelte Ausschüttung von NK-Zell-Granula und Abtötung von Zielzellen, die mit Antigenen beladen und mit
IgG-Molekülen markiert sind.  Abbildung). Das erfordert eine neue Anordnung der entsprechenden
Gensegmente im Chromosom 14.
Abbildung). Das erfordert eine neue Anordnung der entsprechenden
Gensegmente im Chromosom 14.
 Abbildung: Somatische Hypermutation und Isotypenwechsel
Abbildung: Somatische Hypermutation und Isotypenwechsel 
 werden - meist nach dem Isotypenwechsel - zusätzlich die antigenbindenden Enden der Antikörpermoleküle
variiert und die Vielfalt der möglichen Epitoperkennungen wesentlich
erhöht (
werden - meist nach dem Isotypenwechsel - zusätzlich die antigenbindenden Enden der Antikörpermoleküle
variiert und die Vielfalt der möglichen Epitoperkennungen wesentlich
erhöht ( Abbildung).
Abbildung).  Je besser der hypermutierte Antikörper mit dem Antigen zusammenpasst,
desto stärker proliferiert der betreffende B-Zell-Klon
(Selektionierung).
Je besser der hypermutierte Antikörper mit dem Antigen zusammenpasst,
desto stärker proliferiert der betreffende B-Zell-Klon
(Selektionierung).  Zerstörung von Mikroorganismen und Tumorzellen durch Phagozytose und Lyse
Zerstörung von Mikroorganismen und Tumorzellen durch Phagozytose und Lyse Entzündlich
erhöhter Durchtritt von Abwehrstoffen und Leukozyten ins Gewebe durch
Erweiterung der Gefäße und Steigerung ihrer Permeabilität
Entzündlich
erhöhter Durchtritt von Abwehrstoffen und Leukozyten ins Gewebe durch
Erweiterung der Gefäße und Steigerung ihrer Permeabilität Umbau und
Heilung (Reparation) durch das Zusammenwirken von Immunsystem,
Komplementfaktoren, Gerinnungs- und Fibrinolysemechanismus, Kininen;
Wachstum, Teilung und Neuformierung von Fibroblasten und Epithelzellen
bei der Wundheilung.
Umbau und
Heilung (Reparation) durch das Zusammenwirken von Immunsystem,
Komplementfaktoren, Gerinnungs- und Fibrinolysemechanismus, Kininen;
Wachstum, Teilung und Neuformierung von Fibroblasten und Epithelzellen
bei der Wundheilung. Abbildung):
Abbildung): 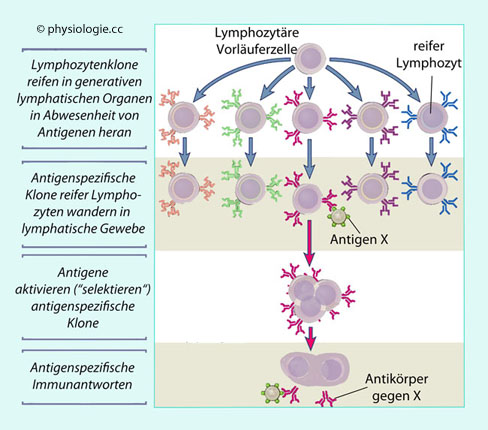
 Abbildung: Klonale Selektion
Abbildung: Klonale Selektion
| Klonale Selektion: Axiome (Beispiel B-Zelle) |
| Antikörper sind primär divers, unabhängig von einem Antigenkontakt |
| Jeder B-Lymphozyt exprimiert Antikörper einer bestimmten Spezifität |
| Reife B-Zellen vermehren sich, wenn sie "ihr" Antigen binden, und bilden einen Plasmazell-Klon |
| Plasmazellen eines Klons produzieren Antikörper identer Spezifität |
| B-Zellen im Knochenmark, die
sich noch entwickeln, dürfen ihr (in diesem Fall wahrscheinlich
körpereigenes) Antigen nicht (stark) binden, sonst werden sie eliminiert
(zentrale Toleranz) |
 - beim Menschen zutreffender: bone marrow für Knochenmark) recken ihre antikörperähnlichen Rezeptoren (B-Cell-Receptors, BCR; ~105 pro Zelle) - die wie Fühler in der Zellmembran stecken - nach außen, mit dem antigenerkennenden Fab-Teil voran.
Sie "angeln" sozusagen nach einem passenden Antigenmolekül (meist
freilich vergeblich, und ein Teilungssignal bleibt aus).
- beim Menschen zutreffender: bone marrow für Knochenmark) recken ihre antikörperähnlichen Rezeptoren (B-Cell-Receptors, BCR; ~105 pro Zelle) - die wie Fühler in der Zellmembran stecken - nach außen, mit dem antigenerkennenden Fab-Teil voran.
Sie "angeln" sozusagen nach einem passenden Antigenmolekül (meist
freilich vergeblich, und ein Teilungssignal bleibt aus). | Nach Doan / Lievano / Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott Illustrated Reviews, Wolters Kluwer 2022 |
B-1 B-Zellen |
B-2 B-Zellen |
| Erstmaliges Auftreten |
Fetalperiode |
peri-/postnatal |
| Vorkommen |
Respirations- / Gastrointestinal- system |
multipel |
| Diversität |
niedrig |
hoch |
| immunologisches Gedächtnis |
kaum |
ja |
| typische Antigene |
Kohlenhydrate |
Proteine |
| Dominanter Isotyp auf naiver B-Zelle |
IgM > IgD |
IgD > IgM |
| Isotypenwechsel |
begrenzt |
typisch |
| T-Zell-Hilfe benötigt? |
fast niemals |
fast immer |
| Ersatz |
selbsterneuernd in der Peripherie |
kontinuierlicher Nachschub aus dem Knochenmark |

 Abbildung: Plasmazelle
Abbildung: Plasmazelle
 Abbildung), die pro Sekunde mehrere tausend (je nach Antikörperart bis zu ~104) Antikörpermoleküle (die nicht mehr wie der BCR in der Membran stecken bleiben) sezernieren.
Auf diese Weise wird in den extrazellulären Flüssigkeiten ein spezifischer Immunschutz aufgebaut.
Abbildung), die pro Sekunde mehrere tausend (je nach Antikörperart bis zu ~104) Antikörpermoleküle (die nicht mehr wie der BCR in der Membran stecken bleiben) sezernieren.
Auf diese Weise wird in den extrazellulären Flüssigkeiten ein spezifischer Immunschutz aufgebaut. | Antigenkontakt macht betreffende B-Lymphozyten zu Plasmazellen |
 - Bestandteile der Hülle Gram-positiver Bakterien (
- Bestandteile der Hülle Gram-positiver Bakterien ( Abbildung) - die Sekretion von IgG2 an.
Abbildung) - die Sekretion von IgG2 an.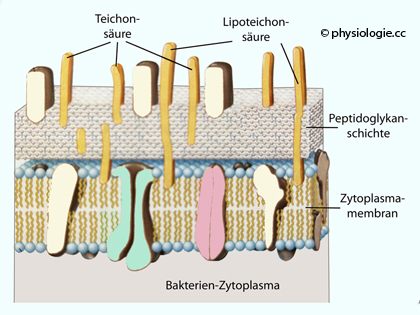

 Abbildung: Teichon- und Lipoteichonsäuren in der Außenwand (Peptidoglykanschichte) eines grampositiven Bakteriums
Abbildung: Teichon- und Lipoteichonsäuren in der Außenwand (Peptidoglykanschichte) eines grampositiven Bakteriums vgl. dort
vgl. dort
| Die Membran von B-Lymphozyten enthält IgM und IgD |
| Plasmazellen sezernieren (gegen das betreffende Antigen gerichtete) Antikörper |
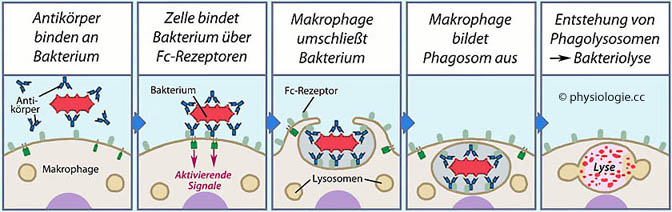
 Abbildung: Antikörpervermittelte Phagozytose
Abbildung: Antikörpervermittelte Phagozytose
 Abbildung). So können etwa Viren
abgefangen werden, bevor sie Zellen infizieren. Tatsächlich dient die
erworbene ("spezifische") Immunität zu einem guten Teil der
Virusbekämpfung.
Abbildung). So können etwa Viren
abgefangen werden, bevor sie Zellen infizieren. Tatsächlich dient die
erworbene ("spezifische") Immunität zu einem guten Teil der
Virusbekämpfung. 
 Der Antikörpertiter (Serumtiter) ist das Ergebnis eines immunhämatologischen Verdünnungsverfahrens - meist jeweils auf das doppelte Volumen, also in Zweierstufen (1:2n) im Rahmen einer geometrischen Verdünnungsreihe: 1:2, 1:4, 1:8, 1:16, 1:32 etc.
Die Fragestellung lautet: Bis zu welchem Verdünnungsgrad ist die
spezifische Wirksamkeit des Antikörpers im Serum einer untersuchten
Person gegen ein bestimmtes Antigen in vitro nachweisbar?
Der Antikörpertiter (Serumtiter) ist das Ergebnis eines immunhämatologischen Verdünnungsverfahrens - meist jeweils auf das doppelte Volumen, also in Zweierstufen (1:2n) im Rahmen einer geometrischen Verdünnungsreihe: 1:2, 1:4, 1:8, 1:16, 1:32 etc.
Die Fragestellung lautet: Bis zu welchem Verdünnungsgrad ist die
spezifische Wirksamkeit des Antikörpers im Serum einer untersuchten
Person gegen ein bestimmtes Antigen in vitro nachweisbar?  Immunität lässt sich durch Impfung erreichen, ohne dass bzw. bevor es zu einer Erkrankung kommt:
Immunität lässt sich durch Impfung erreichen, ohne dass bzw. bevor es zu einer Erkrankung kommt: Aktive
Schutzimpfung: In der krankmachenden (pathogenen) Wirkung
abgeschwächte, aber antigen wirksame Erreger - oder Giftstoffe (Toxine) - werden
injiziert. Vorteil: Das Immunsystem baut einen lang anhaltenden
spezifischen Schutz gegen den Antigenträger auf. Gedächtniszellen
bewirken bei nochmaliger Infektion ein rasches Wiederaufleben der
Immunantwort. Dieser Mechanismus kann durch wiederholte Impfung
(Boosterung) verstärkt werden.
Aktive
Schutzimpfung: In der krankmachenden (pathogenen) Wirkung
abgeschwächte, aber antigen wirksame Erreger - oder Giftstoffe (Toxine) - werden
injiziert. Vorteil: Das Immunsystem baut einen lang anhaltenden
spezifischen Schutz gegen den Antigenträger auf. Gedächtniszellen
bewirken bei nochmaliger Infektion ein rasches Wiederaufleben der
Immunantwort. Dieser Mechanismus kann durch wiederholte Impfung
(Boosterung) verstärkt werden. Passive
Schutzimpfung: Antikörper werden in Form eines Immunserums injiziert.
Die Antikörper werden durch Immunisierung von Tieren gewonnen.
Vorteil: Sofortige Wirkung, die aber nicht anhält, da die Antikörper
innerhalb einiger Wochen wieder abgebaut werden.
Passive
Schutzimpfung: Antikörper werden in Form eines Immunserums injiziert.
Die Antikörper werden durch Immunisierung von Tieren gewonnen.
Vorteil: Sofortige Wirkung, die aber nicht anhält, da die Antikörper
innerhalb einiger Wochen wieder abgebaut werden.
 B-Zellen verleihen humorale Immunität - diese schützt vor
extrazellulären Mikroben und ihren Toxinen; T-Zellen verleihen
zelluläre Immunität - diese ist gegen intrazelluläre Mikroben gerichtet
B-Zellen verleihen humorale Immunität - diese schützt vor
extrazellulären Mikroben und ihren Toxinen; T-Zellen verleihen
zelluläre Immunität - diese ist gegen intrazelluläre Mikroben gerichtet Lymphozyten sind mobil: Etwa 500 Milliarden durchstreifen pro Tag
Blutbahn, Gewebe und Lymphsystem. Das ergibt eine ausreichende
Wahrscheinlichkeit, dass T-Zellen MHC-gebundene Antigene auf
antigenpräsentierenden Zellen vorfinden, durch die sie aktiviert werden
Lymphozyten sind mobil: Etwa 500 Milliarden durchstreifen pro Tag
Blutbahn, Gewebe und Lymphsystem. Das ergibt eine ausreichende
Wahrscheinlichkeit, dass T-Zellen MHC-gebundene Antigene auf
antigenpräsentierenden Zellen vorfinden, durch die sie aktiviert werden Die Zahl zirkulierender naiver Lymphozyten bleibt weitgehend stabil (homöostatische Proliferation) Die Zahl zirkulierender naiver Lymphozyten bleibt weitgehend stabil (homöostatische Proliferation) Lymphozyten erkennen Antigene über T-Zell-Rezeptoren oder Immunglobuline (B-Zellen) Lymphozyten erkennen Antigene über T-Zell-Rezeptoren oder Immunglobuline (B-Zellen)  Haptene sind kleine Moleküle, die an Antikörper binden, ohne Immunantworten auszulösen Haptene sind kleine Moleküle, die an Antikörper binden, ohne Immunantworten auszulösen Antikörper werden von B-Zellen bzw. Plasmazellen gebildet und binden
einerseits Antigene, andererseits lösen sie Effektormechanismen - wie
Komplementaktivierung - aus. So vereinen sie spezifische und
unspezifische Funktionen. Frei in den Extrazellulärraum sezerniert,
wirken sie antimikrobiell (in Blutplasma, Sekreten, interstitiellen und
transzellulären Räumen); in der B-Zellmembran sind sie
Antigenrezeptoren. Sie bestehen aus leichten (L) und schweren (H)
Ketten mit variablen (V) und konstanten (C) Regionen. Ihr Fab-Teil
trägt einen “Abdruck” eines Antigenmoleküls, der Fc-Teil bindet an
Fc-Rezeptoren z.B. phagozytierender Zellen, aktiviert Komplement und
kann Opsonisation, Degranulation und Zytolyse bewirken
Antikörper werden von B-Zellen bzw. Plasmazellen gebildet und binden
einerseits Antigene, andererseits lösen sie Effektormechanismen - wie
Komplementaktivierung - aus. So vereinen sie spezifische und
unspezifische Funktionen. Frei in den Extrazellulärraum sezerniert,
wirken sie antimikrobiell (in Blutplasma, Sekreten, interstitiellen und
transzellulären Räumen); in der B-Zellmembran sind sie
Antigenrezeptoren. Sie bestehen aus leichten (L) und schweren (H)
Ketten mit variablen (V) und konstanten (C) Regionen. Ihr Fab-Teil
trägt einen “Abdruck” eines Antigenmoleküls, der Fc-Teil bindet an
Fc-Rezeptoren z.B. phagozytierender Zellen, aktiviert Komplement und
kann Opsonisation, Degranulation und Zytolyse bewirken Antigene werden von Lymphozyten, Makrophagen oder dendritischen Zellen zu Lymphfollikeln gebracht Antigene werden von Lymphozyten, Makrophagen oder dendritischen Zellen zu Lymphfollikeln gebracht Antikörper liegen in Form verschiedener Klassen
(Immunglobulin-Isotypen) vor: IgM (pentamer, erstes Immunglobulin bei
Klonselektion), IgG (monomer, höchste Serumkonzentration), IgA (am
intensivsten produzierte Immunglobulinklasse, besonders von
Schleimhäuten), IgD und IgE
Antikörper liegen in Form verschiedener Klassen
(Immunglobulin-Isotypen) vor: IgM (pentamer, erstes Immunglobulin bei
Klonselektion), IgG (monomer, höchste Serumkonzentration), IgA (am
intensivsten produzierte Immunglobulinklasse, besonders von
Schleimhäuten), IgD und IgE Antikörperabhängige zellvermittelte Zytotoxizität (ADCC) bedeutet
Fc-Rezeptor-vermittelte Ausschüttung von NK-Zell-Granula und Abtötung
von Zielzellen, die mit Antigenen beladen und mit IgG markiert sind
Antikörperabhängige zellvermittelte Zytotoxizität (ADCC) bedeutet
Fc-Rezeptor-vermittelte Ausschüttung von NK-Zell-Granula und Abtötung
von Zielzellen, die mit Antigenen beladen und mit IgG markiert sind Somatische Hypermutation verändert die antigenbindenden Enden der
Antikörper und steigert so die Vielfalt möglicher Epitoperkennungen
Somatische Hypermutation verändert die antigenbindenden Enden der
Antikörper und steigert so die Vielfalt möglicher Epitoperkennungen
|
