

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

MHC-System: T-Lymphozyten bekommen Antigene präsentiert
© H. Hinghofer-Szalkay
 Chaperone: chaperone = Begleiter, Anstandsdame (von lat. cappa, Kappe)
Chaperone: chaperone = Begleiter, Anstandsdame (von lat. cappa, Kappe)
Histokompatibilität: ἱστός = Gewebe, compatire = mitleiden
HLA: Human Leukocyte Antigen
MHC: Major Histocompatibility Complex
Fast alle Zellen des Körpers exprimieren MHC-I-Moleküle (MHC: Major Histocompatibility Complex,
Haupthistokompatibilitätskomplex), lagern sie in ihre Zellmembran ein
und präsentieren hier Peptide aus intrazellulärem Proteinabbau. Dies bescheinigt die Zugehörigkeit der
präsentierten Peptide zum eigenen Körper ("Ausweis") mit dem Ergebnis immunologischer Toleranz.
Treten fremde (virale) Peptide auf, wird das von CD8-positiven Lymphozyten
erkannt und die "auffällige" (virusinfizierte, Tumor-) Zelle wird
angegriffen und zerstört.
Spezielle antigenpräsentierende Immunzellen (dendritische Zellen, Makrophagen, B-Lymphozyten) bilden MHC-II-Moleküle; diese präsentieren Peptide, die aus dem Abbau aufgenommener extrazellulärer (phagozytierter) Moleküle stammen.
CD4-positive Immunzellen (T-Helferzellen, Monozyten, Makrophagen) wirken als "immunologische Exekutive": Sie identifizieren über spezifische Rezeptoren zusammen mit CD4- (und anderen) Rezeptoren antigenbeladene MHC-II-Moleküle (MHC-II-Erkennungsvorgang). Nur
Peptide externer Herkunft (z.B. bakteriell) werden an MHC-II angelagert, endogene Peptide
werden von der Bindung ferngehalten.
Eine Erkennung in diesem Rahmen führt zu
verschiedenen Hilfsmechanismen der Immunabwehr, z.B. bei der
Antigenpräsentation - und zur Freisetzung von Zytokinen.
|
Einleitung  MHC und Antigenpräsentation
MHC und Antigenpräsentation  Antigen processing
Antigen processing  MHC-I
MHC-I  MHC-II
MHC-II  Physiologische Bedeutung MHC-gekoppelter Antigenpräsentation
Physiologische Bedeutung MHC-gekoppelter Antigenpräsentation

MHC  Haplotyp, Polymorphismus
Haplotyp, Polymorphismus  HLA
HLA  TAP
TAP  MHC-Restriktion
MHC-Restriktion  Ortho / heterotop, autolog, syngen, allogen, alloreaktiv
Ortho / heterotop, autolog, syngen, allogen, alloreaktiv  Corezeptor
Corezeptor
 Core messages
Core messages
Alle
kernhaltigen Zellen des Körpers bauen laufend Eiweißmoleküle ab, die
sie synthetisiert oder von außen aufgenommen haben. Darunter können
auch solche mikrobieller Natur sein (von Viren, die in die Zelle
gelangt sind und deren Anweisungen zur Proteinsynthese sie befolgt,
oder anderen Mikroorganismen, die sie aufnimmt und abbaut). Unterscheiden
sich die entstandenen Bruchstücke - Peptide - von körpereigenen, ist
das ein Hinweis, dass die Zelle von potenziellen Krankheitserregern
befallen ist oder sich mit diesen auseinandersetzt. Die
"Peptidinformation" des zellulären Proteinabbaus ist daher
immunologisch bedeutsam. Wie wird diese Information an Zellen des
adaptiven Immunsystems (T-Lymphozyten) mitgeteilt?
Die fraglichen Peptide müssen vom Ort ihrer Entstehung (Zytoplasma bzw.
Phagolysosomen) an die Zelloberfläche transportiert und hier in
geeigneter Weise an T-Zellen präsentiert werden. Letzteres geschieht über MHC-Moleküle ( Abbildung). Die Antigenpräsentation ist
ein besonderes Kennzeichen des adaptiven Immunsystems.
Abbildung). Die Antigenpräsentation ist
ein besonderes Kennzeichen des adaptiven Immunsystems.

 Abbildung: Wie Lymphozyten Antigene präsentiert bekommen
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Abbildung: Wie Lymphozyten Antigene präsentiert bekommen
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Oben:
Blick von der Seite, an der ein Lymphozyt andocken kann, auf die
Präsentationsstelle des MHC-Moleküls. Peptide
(gelb) werden an der Zellmembran aller
kernhältigen Körperzellen über MHC-I-Moleküle "vorgezeigt".
Dazu werden sie in taschenförmige Gruben des MHC-Proteins - umrahmt von
zwei Alpha-Helices - eingelagert. Das funktioniert am besten, wenn die
Peptide 8 bis 11 Aminosäuren lang sind. Eine Beta-Faltblatt-Struktur bildet - wie bei MHC-II - den Boden der Einlagerungsnische für das Peptid.
Spezielle
Immunzellen - sogenannte professionelle antigenpräsentierende Zellen
(dendritische Zellen, Makrophagen, B-Lymphozyten u.a.) - exprimieren
zusätzlich MHC-II-Moleküle. Diese präsentieren Abbauprodukte aus dem Extrazellulärraum aufgenommener (mikrobieller) Proteine - typischerweise 13 bis 25 Aminosäuren lang.
Die Aufnahmebucht für das antigene Peptid ist von einer
Alpha- und einer Beta-Helix umrahmt.
Unten: Ein an MHC-II gebundenes Peptid

B- und T-Lymphozyten folgen unterschiedlichen Abwehrstrategien:
 B-Zellen
reagieren auf ganz verschiedene Typen
mikrobieller Kennzeichen und produzieren Immunglobuline - diese erkennen und binden Epitope
(antigene Determinanten) an Pathogenen -
auf Mikroben oder in gelöster Form. Lösliche Immunglobuline (Antikörper) breiten sich
über den Extrazellulärraum (Blutplasma, Interstitium)
aus und können so ihre Wirkung im ganzen Körper entfalten.
B-Zellen
reagieren auf ganz verschiedene Typen
mikrobieller Kennzeichen und produzieren Immunglobuline - diese erkennen und binden Epitope
(antigene Determinanten) an Pathogenen -
auf Mikroben oder in gelöster Form. Lösliche Immunglobuline (Antikörper) breiten sich
über den Extrazellulärraum (Blutplasma, Interstitium)
aus und können so ihre Wirkung im ganzen Körper entfalten.
 T-Zellen hingegen wirken auf ihre unmittelbare Umgebung, wo sie z.B. Zielzellen abtöten (zytotoxische T-Effektorzellen); Makrophagen, dendritische Zellen oder B-Zellen aktivieren (Helfer-T-Zellen); oder die Aktivität anderer Immunzellen beeinflussen (regulatorische T-Zellen).
Sie benötigen zu ihrer Aktivierung die Aufbereitung und Präsentation
von Antigenen über MHC-Proteine (z.B. durch dendritische Zellen in
lymphatischen Organen).
T-Zellen hingegen wirken auf ihre unmittelbare Umgebung, wo sie z.B. Zielzellen abtöten (zytotoxische T-Effektorzellen); Makrophagen, dendritische Zellen oder B-Zellen aktivieren (Helfer-T-Zellen); oder die Aktivität anderer Immunzellen beeinflussen (regulatorische T-Zellen).
Sie benötigen zu ihrer Aktivierung die Aufbereitung und Präsentation
von Antigenen über MHC-Proteine (z.B. durch dendritische Zellen in
lymphatischen Organen).
T-Lymphozyten sind auf die
Erkennung von Peptiden spezialisiert,
die mikrobiellen Ursprungs
sein könnten (Viren, Bakterien..). Eine exakte Passung von Antigen,
präsentierendem
MHC-Molekül sowie T-Zell-Rezeptor ( Abbildung)
soll dabei garantieren, dass dieser Vorgang sicher ist, indem er
spezifisch potenzielle Gefahrenträger bekämpft, ohne eigenes Gewebe (körpereigene Proteine) zu
attackieren.
Abbildung)
soll dabei garantieren, dass dieser Vorgang sicher ist, indem er
spezifisch potenzielle Gefahrenträger bekämpft, ohne eigenes Gewebe (körpereigene Proteine) zu
attackieren.

 Abbildung: Antigenerkennung am T-Zell-Rezeptor
Abbildung: Antigenerkennung am T-Zell-Rezeptor
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Modellvorstellung
der Erkennung eines Antigen-MHC-Molekülkomplexes durch einen
T-Zell-Rezeptor. Zellen exprimieren
MHC-Moleküle (im Bild unten), über die sie T-Zell-Rezeptoren (im Bild oben) Peptide aus ihrem intrazellulären Antigenabbau präsentieren.
Diese Peptide haben Seitenketten (anchor residues), über die sie sich in Vertiefungen (pockets)
im MHC-Molekül verankern. Andere lagern sich
in taschenförmige Einbuchtungen des T-Zell-Rezeptors an. Zusätzlich
fixieren sich polymorphe Strukturen des MHC an Bindungsnischen des
T-Zell-Rezeptors. Die Tasche eines MHC-Komplexes kann jeweils nur ein Peptidmolekül binden - mehrere Moleküle verdrängen einander kompetitiv an der Bindungsstelle.
Jeder T-Zell-Rezeptor (jeder Lymphozytenklon) erkennt spezifisch Peptide nur in Kombination mit einem MHC-Molekül (MHC-Restriktion). MHC dienen als relativ unspezifische "Gefäße" zum Zweck der Präsentation - sofern die anchor residues auf
ihre Bindungsstellen passen. Auf diese Weise kann eine große Zahl
verschiedener Antigene über eine begrenzte Zahl unterschiedlicher MHC-Moleküle präsentiert werden
 Die Anlagerung
von Peptiden an MHC-Moleküle erfolgt innerhalb der
antigenpräsentierenden Zelle. Der MHC-Antigen-Komplex rückt
anschließend in die Zellmembran, wo er von T-Lymphozyten mit passenden Rezeptoren erkannt wird.
Die Anlagerung
von Peptiden an MHC-Moleküle erfolgt innerhalb der
antigenpräsentierenden Zelle. Der MHC-Antigen-Komplex rückt
anschließend in die Zellmembran, wo er von T-Lymphozyten mit passenden Rezeptoren erkannt wird.
MHC sind Membranproteine, die T-Zellen Peptide präsentieren
 MHC (major histocompatibility complex) ist
ein großer, den Organismus individuell kennzeichnender Genkomplex.
Dieser befindet sich auf Chromatiden, die sich im Metaphasenkern als
Chromosom 6 darstellen. MHC codiert membranständige Glykoproteine, die von Lymphozyten als "Trägermoleküle" präsentierter Peptide erkannt werden. Man
unterscheidet MHC-I-Moleküle, die von allen kernhaltigen
Zellen des Körpers, und MHC-II-Moleküle, die nur von
"professionell" antigenpräsentierenden Zellen (insbesondere
dendritische Zellen, Makrophagen und B-Lymphozyten) exprimiert werden.
MHC (major histocompatibility complex) ist
ein großer, den Organismus individuell kennzeichnender Genkomplex.
Dieser befindet sich auf Chromatiden, die sich im Metaphasenkern als
Chromosom 6 darstellen. MHC codiert membranständige Glykoproteine, die von Lymphozyten als "Trägermoleküle" präsentierter Peptide erkannt werden. Man
unterscheidet MHC-I-Moleküle, die von allen kernhaltigen
Zellen des Körpers, und MHC-II-Moleküle, die nur von
"professionell" antigenpräsentierenden Zellen (insbesondere
dendritische Zellen, Makrophagen und B-Lymphozyten) exprimiert werden.
MHC-Moleküle lagern
molekulare Bruchstücke zellulären Abbaus (meist Peptide) in grubenförmige
Furchen ein (Abbildungen oben - üblicherweise 8-11 Aminosäuren lang bei MHC-I, 13-25 Aminosäuren bei MHC-II). Sinn ist
die Identifizierung von
Körperzellen auf immunologische Intaktheit ("selbst") einerseits, die
Anwesenheit veränderter oder fremder Peptide (Antigene) andererseits.
Links:
MHC-I-Moleküle finden sich auf
der Membran aller kernhaltigen Körperzellen, sie präsentieren intrazelluläre Antigene
an zytotoxische (CD8+) Lymphozyten mit passenden T-Zell-Rezeptoren (TR). ß2M = beta-2-Mikroglobulin.
Rechts: Professionelle antigenpräsentierende Zellen (dendritische
Zellen, Makrophagen, B-Zellen u.a.) präsentieren CD4+-Lymphozyten aufgenommene (extrazelluläre) Antigene mittels
MHC-II-Molekülen.
Die Boxen zeigen die betreffenden HLA-Gene (HLA-A bis HLA-C für MHC-I-Moleküle, HLA-D für MHC-II-Moleküle).
 Zum CD-System s. dort
Zum CD-System s. dort
 Antigenpräsentierende Zellen zeigen nicht nur das Produkt ihres Abbaus in den
"Furchen" des MHC-Moleküls her, sondern produzieren auch costimulatorische
Signale an der Berührungsstelle zwischen ihnen und der "informierten"
T-Zelle (Abbildungen oben). Auch steuern sie durch die Freisetzung eines entsprechenden
Zytokin-"Cocktails" die Qualität der Immunreaktion, die von der
Kombination T-Zell-Rezeptor / MHC-Molekül abhängt.
Solange keine Sensibilisierung gegen das zu erkennende Merkmal stattgefunden hat, reicht die Anzahl der ein bestimmtes Antigen spezifisch erkennenden Lymphozyten nicht aus, um
gleichzeitig überall auf Patrouille zu gehen. Für jedes Antigen gibt es im Körper zunächst nur sehr
wenige naive Lymphozyten mit passenden Rezeptoren. Es braucht einen Mechanismus, der in der Peripherie
Antigene "einfängt" und in lymphatische Organe bringt, wo naive
Lymphozyten auf ihre mögliche Aktivierung warten.
Diese Aufgabe übernehmen professionelle antigenpräsentierende
Zellen (vor allem dendritische Zellen, Makrophagen, B-Zellen). Sie nehmen mikrobielle Antigene auf,
spalten Peptidbruchstücke ab und präsentieren diese an Rezeptoren in der Zellmembran
von T-Lymphozyten. T-Lymphozyten
erkennen keine
"freien" (gelösten) Antigene, sondern nur solche, die an MHC-Moleküle
gebunden
sind und solchermaßen von betreffenden Zellen präsentiert werden.
Passende naive T-Lymphozyten (deren
Rezeptoren das Antigen erkennen und die spezifisch zur Abwehr dieses
Antigens
geeignet sind) beginnen sich in der Folge zu teilen (Proliferation), und ein spezifischer,
das Antigen erkennender Zellklon
entsteht (Klonselektion). Innerhalb weniger Tage ist dieser Zellklon stark genug, das betreffende
Antigen bzw. seine Träger wirksam zu bekämpfen.
Antigenpräsentierende Zellen zeigen nicht nur das Produkt ihres Abbaus in den
"Furchen" des MHC-Moleküls her, sondern produzieren auch costimulatorische
Signale an der Berührungsstelle zwischen ihnen und der "informierten"
T-Zelle (Abbildungen oben). Auch steuern sie durch die Freisetzung eines entsprechenden
Zytokin-"Cocktails" die Qualität der Immunreaktion, die von der
Kombination T-Zell-Rezeptor / MHC-Molekül abhängt.
Solange keine Sensibilisierung gegen das zu erkennende Merkmal stattgefunden hat, reicht die Anzahl der ein bestimmtes Antigen spezifisch erkennenden Lymphozyten nicht aus, um
gleichzeitig überall auf Patrouille zu gehen. Für jedes Antigen gibt es im Körper zunächst nur sehr
wenige naive Lymphozyten mit passenden Rezeptoren. Es braucht einen Mechanismus, der in der Peripherie
Antigene "einfängt" und in lymphatische Organe bringt, wo naive
Lymphozyten auf ihre mögliche Aktivierung warten.
Diese Aufgabe übernehmen professionelle antigenpräsentierende
Zellen (vor allem dendritische Zellen, Makrophagen, B-Zellen). Sie nehmen mikrobielle Antigene auf,
spalten Peptidbruchstücke ab und präsentieren diese an Rezeptoren in der Zellmembran
von T-Lymphozyten. T-Lymphozyten
erkennen keine
"freien" (gelösten) Antigene, sondern nur solche, die an MHC-Moleküle
gebunden
sind und solchermaßen von betreffenden Zellen präsentiert werden.
Passende naive T-Lymphozyten (deren
Rezeptoren das Antigen erkennen und die spezifisch zur Abwehr dieses
Antigens
geeignet sind) beginnen sich in der Folge zu teilen (Proliferation), und ein spezifischer,
das Antigen erkennender Zellklon
entsteht (Klonselektion). Innerhalb weniger Tage ist dieser Zellklon stark genug, das betreffende
Antigen bzw. seine Träger wirksam zu bekämpfen.
MHC-Gene sind codominant: Jeder
Mensch hat (und exprimiert) zwei Allele pro
HMC-Gen. MHC enthält auch Gene für Zytokine,
Komplementfaktoren und die Verarbeitung von Antigenen (antigen processing).
Vererbung als Haplotyp: Die
Allele einzelner MHC-Genloci liegen auf dem Chromatid / Chromosom 6
nahe beieinander, sodass sie gruppenweise vererbt werden (als Allelkombination, der als Haplotyp bezeichnet wird).
 Als Haplotypen bezeichnet man DNA-Sequenzen (Kombination von Allelen oder Sequenzvariationen) einer Chromatide / eines Chromosoms, die meist zusammen vererbt werden. Haplotypen stammen entweder von der Mutter oder vom Vater des betreffenden Organismus.
Als Haplotypen bezeichnet man DNA-Sequenzen (Kombination von Allelen oder Sequenzvariationen) einer Chromatide / eines Chromosoms, die meist zusammen vererbt werden. Haplotypen stammen entweder von der Mutter oder vom Vater des betreffenden Organismus.
HMC-Gene sind polymorph, d.h. die menschliche Population weist eine
hohe Zahl unterschiedlicher Allele für MHC auf: Die Gesamtzahl der
HLA-Proteine in der Bevölkerung wird auf über 18.000 geschätzt (ca.
13.000 Klasse-I und 5400 Klasse-II-MHC-Polypeptide). Da diese Varianten
codominant vererbt werden, exprimiert z.B. jeder Organismus sechs
verschiedene MHC-I-Moleküle (drei MHC-I-Gene vom Vater und drei von der Mutter) usw.
Die Gene,
die für MHC codieren, sind am kurzen Arm des Chromosoms 6 als MHC-Locus
in Regionen angeordnet ( Abbildung). Sie werden bezeichnet als
Abbildung). Sie werden bezeichnet als
 MHC-Klasse I-Region (mit HLA-A, HLA-B,
HLA-C sowie HLA-E, HLA-F und HLA-G),
MHC-Klasse I-Region (mit HLA-A, HLA-B,
HLA-C sowie HLA-E, HLA-F und HLA-G),
 MHC-Klasse-II-Region (mit HLA-DP, HLA-DQ und HLA-DR für α- und ß-Ketten, DM und DO für die Aufbereitung von Antigenpeptiden) und
MHC-Klasse-II-Region (mit HLA-DP, HLA-DQ und HLA-DR für α- und ß-Ketten, DM und DO für die Aufbereitung von Antigenpeptiden) und
 MHC-Klasse-III-Region (mit
HLA-D und anderen Genen).
MHC-Klasse-III-Region (mit
HLA-D und anderen Genen).
 Abbildung: MHC-Genkarte auf dem kurzen Arm des Chromosoms 6 des Menschen
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Abbildung: MHC-Genkarte auf dem kurzen Arm des Chromosoms 6 des Menschen
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Gene im
MHC-Locus über eine Strecke von 4000 kb. Gezeigt sind Gene der HLA-Region des Menschen.
Klasse-II-Region (class II HMC locus, oben): Das transmembranale Glykoprotein Tapasin, die Chaperone DM und DO,
die Antigenpeptid-Transporter TAP-1 und TAP-2 sowie Proteasom- Untereinheiten beteiligen sich an der Verarbeitung (Spaltung)
von Antigenen. DP und DQ codieren Aminosäureketten von MHC-Klasse-II-Molekülen (die von professionellen antigenpräsentierenden Zellen exprimiert werden).
Klasse-III-Region (class III HMC locus, Mitte): C4, B, C2 sind Komplementfaktoren, TNF, LT (Lymphotoxin) sind Zytokine
Klasse-I-Region (class I HMC locus, unten):
Diese Region codiert HLA-Proteine. Es bibt drei (polymorphe)
Klasse-I-Gene: HLA-A, HLA-B und HLA-C. Jeder Mensch erbt von jedem
Elternteil je eines dieser Gene (in der menschlichen Polulation kommen
etwa 13.000 verschiedene Basensequenzen für HLA-Klasse I-Gene vor), exprimiert also insgesamt sechs verschiedene Klasse-I-Moleküle.
In den Zwischenabschnitten befinden sich zahlreiche Gene
mit unbekannter Funktion
 Als HLA (human leukocyte antigens)
bezeichnet man MHC-Moleküle, die zuerst
auf Leukozyten festgestellt wurden (daher das "L"). MHC-I-Moleküle
werden über codominante Klasse-I-Gene vererbt (jeder Mensch erbt von
seinen Eltern jeweils ein HLA-A, HLA-B und HLA-C-Gen - jede seiner
Zellen exprimiert 6
verschiedene dieser Klasse-I-Moleküle). Die Zahl der von einem Individuum exprimierten Klasse-II-Molekülen
(die von professionellen antigenpräsentierenden Zellen exprimiert
werden) ist meist größer als 6 (separate Gene DP und DQ für DRα und
eine
unterschiedliche Zahl - meist 1 bis 3 - von Genen für DRß). Die Allele
werden (nach molekularer Typisierung) mit einem Buchstaben-Zahlen-Code
gekennzeichnet (z.B. HLA-A*0201, HLA-DRB1*0401 etc).
Als HLA (human leukocyte antigens)
bezeichnet man MHC-Moleküle, die zuerst
auf Leukozyten festgestellt wurden (daher das "L"). MHC-I-Moleküle
werden über codominante Klasse-I-Gene vererbt (jeder Mensch erbt von
seinen Eltern jeweils ein HLA-A, HLA-B und HLA-C-Gen - jede seiner
Zellen exprimiert 6
verschiedene dieser Klasse-I-Moleküle). Die Zahl der von einem Individuum exprimierten Klasse-II-Molekülen
(die von professionellen antigenpräsentierenden Zellen exprimiert
werden) ist meist größer als 6 (separate Gene DP und DQ für DRα und
eine
unterschiedliche Zahl - meist 1 bis 3 - von Genen für DRß). Die Allele
werden (nach molekularer Typisierung) mit einem Buchstaben-Zahlen-Code
gekennzeichnet (z.B. HLA-A*0201, HLA-DRB1*0401 etc).
Eine Blutprobe genügt für einen MHC-Nachweis (Leukozyten: HLA-Typisierung).
Jede Person verfügt nur über einige wenige unterschiedliche MHC-Proteine - sie trägt sozusagen ein individuelles "MHC-Schicksal" und kann bestimmte Peptide möglicherweise nicht effektiv
präsentieren. Auf der Ebene der Population
ist die Wahrscheinlichkeit hoch, dass im Fall neuer immunologischer
Herausforderungen zumindest ein Teil der betreffenden Population über
geeingnete HLA-Transportmoleküle verfügt,
in die z.B. durch Mutationen neu entstandene mikrobielle Proteine
passen. Dieser Polymorphismus der MHC-Proteine äußert sich in der hohen Anzahl von möglichen Allelen je Genlocus (Tabelle):
Sequenzvariation der am meisten polymorphen HLA-Loci

Nach Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
|
HLA-Locus
|
A
|
B
|
C
|
DPB1
|
DQB1
|
DRB1
|
Allele (DNA-Varianten)
|
4340
|
5212
|
3930
|
1014
|
1237
|
2593
|
Proteinvarianten
|
2980
|
3700
|
2661
|
692
|
838
|
1978
|
Gene der Klasse MHC-I und MHC-II haben die größte Polymorphie aller Säugetiergene. Beim Menschen finden sich etwa 104 unterschiedliche MHC-Aminosäuresequenzen (alleine der HLA-B-Locus hat über 3000 Varianten). Da Produkte verschiedener HLA-Allele unterschiedliche
Bindungscharakteristika aufweisen, ist die Variabilität an Möglichkeiten in einer gegebenen Population enorm hoch - die Zellen präsentieren je nach individueller Gen-Ausstattung unterschiedliche Epitope derselben Antigene. Das
beeinflusst sowohl die Bindung zu präsentierender Peptide als auch die
Bindung an bestimmte T-Zell-Rezeptoren.
Kernlose
Zellen (Erythrozyten) haben keine Möglichkeit zur Synthese von Protein
mehr - auch nicht von viralen oder Krebsantigenen -, und exprimieren
auch keine MHC-Moleküle.
Erythrozyten sind kernlos und haben keine MHC-Moleküle in ihrer Membran
|
Zytokine stimulieren die Expression
von MHC-Molekülen - sowohl im System der angeborenen als auch in dem
der adaptiven Abwehr. Dies erfolgt über die Bindung zytokinaktivierter Transkriptionsfaktoren an entsprechende DNA-Sequenzen in der Promoterregion von MHC-Genen.

 Abbildung: Eigenschaften von MHC-Genen und Molekülen
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Abbildung: Eigenschaften von MHC-Genen und Molekülen
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
 Polymorphie: In der menschlichen Population werden zahlreiche (insgesamt >1,8.104) verschiedene Allele von MHC-Genen vererbt - MHC-Moleküle weisen die höchste Polymorphie aller Proteine bei Säugetieren auf.
Polymorphie: In der menschlichen Population werden zahlreiche (insgesamt >1,8.104) verschiedene Allele von MHC-Genen vererbt - MHC-Moleküle weisen die höchste Polymorphie aller Proteine bei Säugetieren auf.
 Codominanz: Zellen exprimieren vom Vater und von der Mutter vererbte MHC-Allele gleich stark.
Codominanz: Zellen exprimieren vom Vater und von der Mutter vererbte MHC-Allele gleich stark.
 Alle kernhaltigen Zellen exprimieren MHC-I, professionelle
antigenpräsentierende Zellen (Makrophagen, dendritische Zellen,
B-Lymphozyten u.a.) darüber hinaus MHC-II
Alle kernhaltigen Zellen exprimieren MHC-I, professionelle
antigenpräsentierende Zellen (Makrophagen, dendritische Zellen,
B-Lymphozyten u.a.) darüber hinaus MHC-II

 Der MHC wurde durch die Beobachtung entdeckt, dass
Menschen, die mehrfach Bluttransfusionen erhalten hatten oder eine
Niere transplantiert bekamen, Antikörper bildeten, die transfundierte /
transplantierte Fremdzellen erkennen. Man suchte nach diesen zellulären Merkmalen - die vom Immunsystem als "fremd" erkannt werden - und nannte sie HLA (human leucocyte antigen): Leukozytär, weil man mit den Antikörpern Fremdleukozyten binden konnte; und Antigen, weil die Reaktionspartner Antikörper waren. Es stellte sich heraus, dass diese Eigenschaften von MHC-Genen codiert werden.
Der MHC wurde durch die Beobachtung entdeckt, dass
Menschen, die mehrfach Bluttransfusionen erhalten hatten oder eine
Niere transplantiert bekamen, Antikörper bildeten, die transfundierte /
transplantierte Fremdzellen erkennen. Man suchte nach diesen zellulären Merkmalen - die vom Immunsystem als "fremd" erkannt werden - und nannte sie HLA (human leucocyte antigen): Leukozytär, weil man mit den Antikörpern Fremdleukozyten binden konnte; und Antigen, weil die Reaktionspartner Antikörper waren. Es stellte sich heraus, dass diese Eigenschaften von MHC-Genen codiert werden.
Zwei Jahrzehnte lang kannte man für das MHC-System nur eine Rolle für
Blutgruppenunverträglichkeit und Transplantatabstoßung. Erst in den
1960er- bis 1970erjahren entdeckte man seine fundamentale Bedeutung für
sämtliche Immunantworten auf Proteinantigene. Ein Schlüsselfaktor ist
die Bindung von Peptiden an MHC-Proteine, die wie Sendeantennen in den
Extrazellulärraum ragen und dort von T-Zellen - ihrerseits mit
passenden Rezeptoren - erkannt werden können.
Schließlich wurde das Phänomen der MHC-Restriktion entdeckt (Zinkernagel und Doherty 1974): Virusinfizierte Zellen werden von den T-Lymphozyten (CD8+)
nur angegriffen, wenn erstere körpereigene MHC-Merkmale tragen. Für
diese Entdeckung erhielten sie 1996 den Nobelpreis für Physiologie oder
Medizin.
Jedes MHC-Molekül besteht aus drei Teilen:
 Einer großen extrazellulären Portion mit zwei unterschiedlichen Hälften (ein Heterodimer) - entsprechend dem jeweiligen Haplotyp auf den beiden Allelen: Bei MHC-II α- und β-Polypeptid, bei MHC-I ein aus drei Domänen bestehendes α-Polypeptid sowie ein angelagertes (nicht-MHC-codiertes) β-Mikroglobulin
(s. weiter unten). Die äußeren Strukturen bieten dem präsentierten
Peptid
(Epitop) eine Art Mulde, in die es sich einlagern kann und die enorme
Diversität aufweist. Dieser Teil dient der Präsentation und Bindung an
passende T-Zell-Rezeptoren. Die nichtpolymorphen (zellnahen) Sequenzen
enthalten Bindungsstellen für CD4 und CD8 (
Einer großen extrazellulären Portion mit zwei unterschiedlichen Hälften (ein Heterodimer) - entsprechend dem jeweiligen Haplotyp auf den beiden Allelen: Bei MHC-II α- und β-Polypeptid, bei MHC-I ein aus drei Domänen bestehendes α-Polypeptid sowie ein angelagertes (nicht-MHC-codiertes) β-Mikroglobulin
(s. weiter unten). Die äußeren Strukturen bieten dem präsentierten
Peptid
(Epitop) eine Art Mulde, in die es sich einlagern kann und die enorme
Diversität aufweist. Dieser Teil dient der Präsentation und Bindung an
passende T-Zell-Rezeptoren. Die nichtpolymorphen (zellnahen) Sequenzen
enthalten Bindungsstellen für CD4 und CD8 ( Abbildung oben);
Abbildung oben);
 einer Transmembran-Sequenz (transmembrane region, etwa 25 hydrophobe Aminosäuren, α-helikal angeordnet) für die Verankerung in der Zellmembran;
einer Transmembran-Sequenz (transmembrane region, etwa 25 hydrophobe Aminosäuren, α-helikal angeordnet) für die Verankerung in der Zellmembran;
 einer kurzen hydrophilen zytoplasmatischen Domäne mit rund 30
Aminosäuren (hauptsächlich als ß-Faltblatt). Dieser Abschnitt des
MHC-Moleküls (cytoplasmic tail) kann u.a. HLA-Molekülen dabei helfen, das endoplasmatische Retikulum zu verlassen.
einer kurzen hydrophilen zytoplasmatischen Domäne mit rund 30
Aminosäuren (hauptsächlich als ß-Faltblatt). Dieser Abschnitt des
MHC-Moleküls (cytoplasmic tail) kann u.a. HLA-Molekülen dabei helfen, das endoplasmatische Retikulum zu verlassen.
Eigenschaften von MHC-Molekülen (Klasse I und II)
Nach Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
|
|
Klasse-I-MHC
(HLA-A, HLA-B, HLA-C)
|
Klasse-II-MHC
(HLA-D)
|
Polypeptidketten
|
α und β2-Mikroglobulin |
α und β |
Lage der polymorphen Sequenzen
|
α1- und α2-Domänen |
α1- und β1-Domänen |
Bindungsstelle für T-Zell-Korezeptor
|
CD8 bindet hauptsächlich an α3-Domäne |
CD4 bindet an eine von Teilen der α2- und β2-Domänen geformte Tasche |
Größe der peptidbindenden Mulde
|
Bindet Peptide aus 8-11 Aminosäuren
|
Bindet Peptide aus 10 bis über 30 Aminosäuren |
MHC-Molekül und T-Zell-Rezeptor erkennen unterschiedliche Epitope am präsentierten Peptid. Die Spezifität der MHC-Antigen-Bindung ist nicht sonderlich hoch (im Gegensatz zur Spezifität der Bindung lymphozytärer Antigenrezeptoren). Das
bedeutet, ein gegebenes MHC-Allell (z.B. HLA-A2) kann der Präsentation
zahlreicher unterschiedlicher Peptide dienen, während T-Lymphozyten nur
jeweils einen von vielen möglichen (in diesem Beispiel HLA-A2/Peptid-) Komplexen erkennen und
binden. Im Gegensatz zur
Zahl der MHC-Allele eines Individuums ist die Zahl an T-Zell-Rezeptorvarianten fast unbegrenzt.
Beim Abbau der antigenen Proteine entstehen mehrere potenzielle Epitope, die für die Bindung an MHC und Präsentation an
Lymphozyten in Frage kommen. Tatsächlich zur Präsentation
gelangende (am besten an MHC bindende) Peptide nennt man immundominant.
Die Affinität der MHC-Moleküle zu bestimmten Peptiden ist jeweils
unterschiedlich - wie die individuellen Reaktionen auf immunologische
Reizmuster.
MHC-I lagern Peptide aus zytoplasmatischer Synthese an, die also intrazellulären Ursprungs sind (körpereigen oder viral, z.T. nach Abbau durch Proteasomen); MHC-II hingegen aus Endosomen, die Proteine endozytiert haben (Phagozyten), d.h. extrazellulären Ursprungs sind.
 Indem
MHC-Moleküle einen Unterschied in der Herkunft der von ihnen
präsentierten Peptide machen (MHC-I: zytoplasmatisch, MHC-II: endosomal),
können sie mikrobielle Antigene gezielt zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene durch Phagozytose und
Antikörperbildung) anbieten und damit die jeweils optimale Abwehr
adressieren.
Indem
MHC-Moleküle einen Unterschied in der Herkunft der von ihnen
präsentierten Peptide machen (MHC-I: zytoplasmatisch, MHC-II: endosomal),
können sie mikrobielle Antigene gezielt zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene durch Phagozytose und
Antikörperbildung) anbieten und damit die jeweils optimale Abwehr
adressieren.
Antigen processing und Präsentation von Proteinkomponenten
Körperzellen bauen markierte (ubiquitinierte) oder phago/endozytierte Proteine ab und laden die dabei entstandenen Peptide auf
MHC-Moleküle. Der MHC-Peptid-Komplex gelangt in die
Zellmembran, um T-Lymphozyten vorgezeigt zu werden (antigen display,  Abbildung). MHC-I präsentiert Bruchstücke von der Zelle selbst
synthetisierter Proteine, MHC-II aus dem phago/lysosomalen Abbau
stammende Peptide von Proteinen extrazellulären Ursprungs.
Abbildung). MHC-I präsentiert Bruchstücke von der Zelle selbst
synthetisierter Proteine, MHC-II aus dem phago/lysosomalen Abbau
stammende Peptide von Proteinen extrazellulären Ursprungs.

 Abbildung: Antigenverarbeitung und Präsentation über MHC
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Abbildung: Antigenverarbeitung und Präsentation über MHC
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Oben: Der MHC-I-Weg läuft an allen kernhaltigen Zellen ab. Zuerst werden Proteine durch die Anlagerung von Ubiquitinen zum Abbau freigegeben. Proteasomen bauen solche markierte körpereigene
Proteine ab (wenn vorhanden, auch virale Proteine). Dabei entstehen kurze, lineare
Peptide (dreidimensionale Charakteristika
des Proteins sind
verlorengegangen - "entfaltetes Protein").
Deren Einlagerung in die Wand des endoplasmatischen Retikulums erfolgt
über membranassoziierte Proteine wie TAP-1/TAP2, die Übertragung auf
MHC-I über weitere Proteine in der Membran des endoplasmatischen Retikulums (Tapasin,
Calnexin, Calreticulin).
Die pMHC-I-Komplexe gelangen durch
Golgi-Apparat und Exozytose in die Außenmembran und werden dort
Lymphozyten präsentiert. Autoreaktive Lymphozyten wurden im Thymus
bereits eliminiert, daher rufen körpereigene Epitope normalerweise
keine Reaktion aus. Die Anwesenheit viraler Epitope hingegen aktiviert
zytotoxische Lymphozyten zur Abtötung der virenbefallenen Zelle.
Unten: Der von professionellen antigenpräsentierenden Zellen genützte MHC-II-Weg präsentiert CD4+-Lymphozyten Peptide von endozytierten
Mikroben. MHC-II-Proteine lagern im endoplasmatischen Retikulum eine
"invariante Kette" Ii an - über eine Peptidsequenz, die als CLIP
bezeichnet wird und in der
Antigenbindungsgrube gebunden bleibt, bis sie gegen ein antigenes Peptid
ausgetauscht wird. Das Peptid wird schließlich CD4+-Lymphozyten
präsentiert, was diese zur Anregung von Makrophagen (Phagozytose
der infizierten Zelle) und B-Zellen (Bildung von antimikrobiellen
Antikörpern) veranlasst
 Die
beiden Pfade der Antigenpräsentation stellen gemeinsam sicher, dass
sämtliche relevanten Proteine im Körper - sowohl intrazelluläre
(Proteinsynthese, proteasomaler Abbau, MHC-I, CD8+ Lymphozyten) als
auch extrazelluläre (Endozytose, endolysosomaler Abbau, MHC-II, CD4+
Lymphozyten) - stetig gesammelt und überprüft werden.
Die
beiden Pfade der Antigenpräsentation stellen gemeinsam sicher, dass
sämtliche relevanten Proteine im Körper - sowohl intrazelluläre
(Proteinsynthese, proteasomaler Abbau, MHC-I, CD8+ Lymphozyten) als
auch extrazelluläre (Endozytose, endolysosomaler Abbau, MHC-II, CD4+
Lymphozyten) - stetig gesammelt und überprüft werden.
 Der
Mechanismus der Antigenverarbeitung lässt Peptide von richtiger Größe
zur Bindung an MHC entstehen und bringt Peptide und MHC-Moleküle in der
Zelle
zusammen, bevor sie gemeinsam an die Zelloberfläche
wandern und hier präsentiert / von entsprechenden (mit passenden Rezeptoren ausgestatteten) T-Zellen erkannt werden.
Der
Mechanismus der Antigenverarbeitung lässt Peptide von richtiger Größe
zur Bindung an MHC entstehen und bringt Peptide und MHC-Moleküle in der
Zelle
zusammen, bevor sie gemeinsam an die Zelloberfläche
wandern und hier präsentiert / von entsprechenden (mit passenden Rezeptoren ausgestatteten) T-Zellen erkannt werden.

 Abbildung: Charakteristika der Antigenpräsentation
Abbildung: Charakteristika der Antigenpräsentation
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
TAP, Antigenpeptid-Transporter
 Als MHC-Restriktion bezeichnet man die Tatsache, dass T-Zell-Rezeptoren Peptidantigene ausschließlich in Kombination mit MHC-Molekülen erkennen.
Als MHC-Restriktion bezeichnet man die Tatsache, dass T-Zell-Rezeptoren Peptidantigene ausschließlich in Kombination mit MHC-Molekülen erkennen.
Beispiel: T-Killerzellen töten nur virusinfizierte (oder anderweitig
veränderte) Zellen mit MHC-Merkmalen des Trägerorganismus ab, Zellen
mit nicht-eigenen MHC-Merkmalen bleiben unangetastet.
| Die spezifische Erkennung erfordert auf beiden Seiten
Hilfsmoleküle: MHC-Moleküle auf der präsentierenden Zelle, T-Zell-Rezeptoren auf dem Lymphozyten, CD-Moleküle auf beiden Zellen
|
Zytoplasmatische Proteine werden laufend proteasomal abgebaut und ihre Peptidbruchstücke an der Zelloberfläche an αβ-T-Zellen präsentiert (Abgleich mit der körpereigenen "Proteinbibliothek"). Die positive Selektion
der T-Zellen im Thymus stellt sicher, dass nur T-Zellen für den Kreislauf "zugelassen"
werden, deren Rezeptoren körperfremde Antigene in Kombination mit
körpereigenem MHC erkennen. MHC-Proteine können als individueller molekularer "Ausweis" der Zelle gesehen werden, der die Präsentation von Peptiden an Lymphozyten erlaubt (immunologische Individualität) - codiert vom Histokompatibilitätskomplex (Histokompatibilität  = Gewebeverträglichkeit).
= Gewebeverträglichkeit).
Klinisch ist der Histokompatibilitätskomplex für die Gewebeverträglichkeit bei Transplantationen
ausschlaggebend: MHC von Fremdzellen kann antigen wirken, daher spricht man von Histokompatibilitäts- oder Transplantationsantigenen.
 Von orthotoper Transplantation spricht man, wenn Gewebe auf seine natürliche anatomische Position verpflanzt wird (z.B. Herztransplantation) - andernfalls ist die Transplantation heterotop. Bei Übertragung auf den identen Organismus ist das Transplantat autolog; verpflanzt man es auf einen genetisch identen Zwilling, nennt man es syngen; ist es ein genetisch verschiedener Organismus derselben Spezies, nennt man es allogen. Die als fremd erkannten Antigene sind Alloantigene, die entsprechenden erkennenden / reagierenden Antikörper und Lymphozyten sind alloreaktiv. Xenogene Transplantate stammen von einer anderen Spezies, die Immunabwehr ist dann xenoreaktiv.
Von orthotoper Transplantation spricht man, wenn Gewebe auf seine natürliche anatomische Position verpflanzt wird (z.B. Herztransplantation) - andernfalls ist die Transplantation heterotop. Bei Übertragung auf den identen Organismus ist das Transplantat autolog; verpflanzt man es auf einen genetisch identen Zwilling, nennt man es syngen; ist es ein genetisch verschiedener Organismus derselben Spezies, nennt man es allogen. Die als fremd erkannten Antigene sind Alloantigene, die entsprechenden erkennenden / reagierenden Antikörper und Lymphozyten sind alloreaktiv. Xenogene Transplantate stammen von einer anderen Spezies, die Immunabwehr ist dann xenoreaktiv.
Das MHC-I-Protein
besteht aus zwei Teilen mit unterschiedlichen Aufgaben:
 einer α-Kette
- diese präsentiert Peptide aus dem proteasomalen Abbau verschiedener
Proteine, die von der Zelle synthetisiert wurden und im Zytoplasma
vorkommen - normale zelleigene (inklusive nukleäre - insbesondere in
Tumorzellen - und membranständige), fehlgefaltete und allenfalls
mikrobielle. Assoziiert
(nicht-kovalent) ist ein
einer α-Kette
- diese präsentiert Peptide aus dem proteasomalen Abbau verschiedener
Proteine, die von der Zelle synthetisiert wurden und im Zytoplasma
vorkommen - normale zelleigene (inklusive nukleäre - insbesondere in
Tumorzellen - und membranständige), fehlgefaltete und allenfalls
mikrobielle. Assoziiert
(nicht-kovalent) ist ein

 β2-Mikroglobulin (sein
Gen liegt außerhalb des MHC-Locus), welches sich auch an andere
Moleküle anlagert (z.B. CD1), Immunfunktionen moduliert und
intrazelluläre Signalwege aktiviert.
β2-Mikroglobulin (sein
Gen liegt außerhalb des MHC-Locus), welches sich auch an andere
Moleküle anlagert (z.B. CD1), Immunfunktionen moduliert und
intrazelluläre Signalwege aktiviert.
Menschen verfügen pro Chromosom 6 über jeweils drei Gene für
die MHC-I-α-Kette:
 HLA-A (codiert am HLA-A Genlocus, ~480 Varianten bekannt)
HLA-A (codiert am HLA-A Genlocus, ~480 Varianten bekannt)

 HLA-B
(HLA-B Gene, ~800 Varianten)
HLA-B
(HLA-B Gene, ~800 Varianten)

 HLA-C (~260 Varianten)
HLA-C (~260 Varianten)
- das macht für einen diploiden Chromosomensatz 6 Gene. Die große Zahl möglicher MHC-Variationen bedingt
unterschiedliche Bindungsstärke für verschiedene zu präsentierende
Peptide (nur solche mit 8-11 Aminosäuren Länge passen in die
entsprechende Mulde des MHC-I-Moleküls, und sie müssen bindungsfreudige
Aminosäuren an ihren Enden aufweisen). Dieser Komplex gelangt über
Transportvesikel an die Zelloberfläche, wo die an MHC angelagerten
Peptide präsentiert werden.

 Abbildung: MHC-I-Molekül
Abbildung: MHC-I-Molekül
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Links schematische Darstellung, rechts röntgenkristallographische Modellstruktur. Die α-Kette ist in der Membran verankert (mittels einer Sequenz von ~25 hydophoben Aminosäuren) und hat drei extrazelluläre Domänen: Die polymorphen α1- und α2-Domäne, deren Aminosäuresequenz äußerst variabel, und die nicht-polymorphe α3-Domäne, deren Aminosäuresequenz invariabel ist. Das ß2-Mikroglobulin ist ein assoziiertes Protein, das intrazelluläre Signalwege aktivieren kann.
Die α1- und α2-Domäne bilden zusammen jeweils eine Furche, in die 8-11 Aminosäuren lange zu präsentierende Peptide passen (rechts). Der Boden der Furche bindet unterschiedliche
Antigen-Epitope (deren anchor residues befestigen das Antigen am Boden der MHC-"Grube", andere binden an den T-Zell-Rezeptor, wie auch Strukturen am Rand der "Grube", vgl. Abbildung ganz oben).
Die α3-Domäne assoziiert mit ß2-Mikroglobulin und enthält mit diesem
Bindungsstellen für den CD8-Corezeptor (nicht CD4). CD8-positive
T-Zellen reagieren nur auf Peptide, die ihnen via MHC-I-Moleküle
präsentiert werden. Der Komplex aus MHC-I-α-Kette und ß2-Mikroglobulin
ist kurzlebig und wird durch Bindung des (zu präsentierenden) Peptids
stabilisiert, anschließend über den Golgi-Apparat in die Zellmembran
exportiert und kann hier von CD8+- (zytotoxischen) Lymphozyten erkannt werden

Die im Rahmen
des proteasomalen Abbaus intrazellulärer Proteine entstandenen Peptide
befinden sich zunächst im Zytoplasma und müssen in das endoplasmatische
Retikulum befördert, an MHC-I gekoppelt, via Golgi-System und exozytotische Vesikel in die Zellmembran integriert werden, damit sie für zytotoxische (CD8+) T-Zellen - die sich im Falle passender Rezeptoren an den Peptid-MHC I-Komplex anlagern - sichtbar sind (zum CD-System  s. dort).
s. dort).
Die wichtigsten Schritte der Antigenpräsentation über MHC-I sind ( Abbildung)
Abbildung)
 die Markierung eines Proteins für die Proteolyse (Ubiquitinierung),
die Markierung eines Proteins für die Proteolyse (Ubiquitinierung),
 die Abspaltung von Peptidfragmenten durch Proteasomen,
die Abspaltung von Peptidfragmenten durch Proteasomen,
 der Transport der Peptide in das endoplasmatische Retikulum,
der Transport der Peptide in das endoplasmatische Retikulum,
 die Bindung der Peptide an (neu gebildete) MHC-I-Moleküle,
die Bindung der Peptide an (neu gebildete) MHC-I-Moleküle,
 der Transport des MHC-I-Peptid-Komplexes an die Zelloberfläche.
der Transport des MHC-I-Peptid-Komplexes an die Zelloberfläche.
| MHC-I-Moleküle
befinden sich in der Membran aller kernhaltigen Zellen. Sie werden von
CD8-positiven (zytotoxischen) Lymphozyten erkannt
|

Abbildung: Der Klasse-I MHC-Weg der Präsentation zytoplasmatischer Antigene
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Fremdproteine gelangen durch endogene Synthese (über RNS intrazellulärer Viren, links oben) oder durch Aufnahme mikrobieller Proteine (links unten) in die Zelle.
Mitte: Die Proteine werden entfaltet,
ubiquitiert und von P
roteasomen
zerstückelt. Nun müssen die entstandenen Peptide (die sich im
Zytoplasma befinden) mit MHC-Molekülen (die im ER entstehen)
zusammenkommen. Dies erfolgt im endoplasmatische
Retikulum (ER), wo sie weiter
gespalten und anschließend an MHC-I gebunden werden. Der Transport dorthin erfolgt über den Antigentransporter TAP (Transporter associated with antigen processing).
Chaperone stabilisieren neu synthetisierte MHC-Klasse I-Moleküle und fixieren sie über Tapasin - ein Verbindungsmolekül - an TAP. Die MHC-Moleküle
sind optimal für Bindung und Transport der Peptide über
endoplasmatisches Retikulum und Golgi-System zur Zellmembran positioniert. ß
2m = Beta-2-Mikroglobulin.
Rechts: Via Golgi-Apparat und Exozytosevesikel werden die MHC-I-Peptid-Komplexe an die Zelloberfläche gebracht und zytotoxischen CD8+-T-Zellen vorgezeigt

Ubiquitinierung: Ubiquitine sind Proteine, die an Zielproteine binden und diese für den Abbau durch Proteasomen markieren.
Korrekt strukturierte zelleigene Proteine entgehen der Ubiquitinierung
und werden an ihren Zielort (z.B.
Zellmembran, Extrazellulärraum, Lysosom u.a.) weitergeleitet, sind sie
fehlerhaft gefaltet, werden sie proteolytisch zerstückelt. Das
gilt auch für mikrobielle Proteine, die in das Zytoplasma gelangt sind
(die Bruchstücke können in der Folge Antigenpräsentation und
Lymphozytenaktivierung triggern).
Abspaltung von Peptidfragmenten durch Proteasomen: Proteasomen
dienen als "Protein-Reißwolf", sie verwandeln - insbesondere
beschädigte oder fehlerhaft gefaltete zytoplasmatische - Proteine (vermutlich ~20% der
routinemäßigen Eiweißsynthese) in 6 bis 24 Aminosäuren lange Peptide, auch
(falls vorhanden) Peptide mikrobieller Herkunft.
Transport der Peptide in das endoplasmatische Retikulum: Die anfallenden Peptide befinden sich zunächst im Zytoplasma, die MHC-Moleküle (noch mit leerer Bindungsstelle) im endoplasmatischen Retikulum (ER). Diese beiden Komponenten müssen zusammengeführt werden - durch Antigentransporter (TAP, transporter associated with antigen processing - Dimere aus TAP-1 und TAP-2) in der Wand des ER. Sie koppeln ein Peptid an ein MHC-I-Molekül (das mittels Tapasin an TAP befestigt ist) und transportieren den entstandenen Proteinkomplex aktiv in das Innere des ER. Die Chaperone Calnexin und Calreticulin (das den Weitertransport fehlgefalteter Proteine zum Golgi-Apparat aufhält) beteiligen sich an dem "rendez-vous" von Peptid und HMC-I-Molekül. Zu lange
Peptide können durch Peptidasen des endoplasmatischen
Retikulums (ERAP, endoplasmatic reticulum-resident aminopeptidase) "zurechtgestutzt" werden.
Die Bindung antigener Peptide ist Bedingung für die Interaktion von α-Kette und β-Mikroglobulin, und damit für Expression und Stabilität von MHC-I-Molekülen an der Zelloberfläche; Einzelkomponenten werden rasch wieder abgebaut. Nur stabile Kombinationen aus α-Kette, β2-Mikroglobulin und präsentiertem Peptid sind stabil, verlieren ihre Affinität für Tapasin (schwach gebundene Peptide sind dazu nicht in der Lage), und der
MHC-I-Peptid-Komplex wandert aus dem endoplasmatischen Retikulum via
Golgi-Apparat an die Zelloberfläche, wo sie mit einer Halbwertszeit von mehreren Tagen verbleiben (und Antigene präsentieren). Das erhöht die Chance für ein erfolgreiches
Treffen mit einem passenden T-Lymphozyten. MHC-Moleküle,
die kein Peptid geladen haben, werden rasch abgebaut und
stehen für den Peptidtransport zur Zellmembran nicht länger zur
Verfügung.
 Der Antigenpeptid-Transporter (TAP) - ein Mitglied der ABC-Transporter-Familie - ist eine energieverbrauchende Molekülpumpe in der Wand des endoplasmatischen Retikulums (ER). TAP bindet proteasomgenerierte Peptide an die zytoplasmatische Seite des ER und befördert sie in dessen Inneres. Das Brückenmolekül Tapasin koppelt sie dann an frisch synthetisierte, peptidfreie ("leere") MHC-Moleküle und stellt die Verbindung mit passendem Peptid her.
Der Antigenpeptid-Transporter (TAP) - ein Mitglied der ABC-Transporter-Familie - ist eine energieverbrauchende Molekülpumpe in der Wand des endoplasmatischen Retikulums (ER). TAP bindet proteasomgenerierte Peptide an die zytoplasmatische Seite des ER und befördert sie in dessen Inneres. Das Brückenmolekül Tapasin koppelt sie dann an frisch synthetisierte, peptidfreie ("leere") MHC-Moleküle und stellt die Verbindung mit passendem Peptid her.
Der Transport über TAP kann durch Herpes-simplex-Viren
(HSV) blockiert werden. Sie unterlaufen dadurch die Immunabwehr, indem
sie die Antikörperpräsentation über MHC-I-Moleküle an CD8+-Lymphozyten verhindern. Adenoviren können die Synthese der MHC-Moleküle blockieren, und Zytomegalieviren die Abkopplung vom endoplasmatischen Retikulum (Voraussetzung für den Einbau in die Zellmembran). Das Epstein-Barr-Virus (EBV) ist der
Erreger des Pfeiffer-schen Drüsenfiebers (infektiöse Mononukleose). Die
meisten Menschen sind mit EBV infiziert, es ist meist inaktiviert, kann
aber bei Immunschwäche reaktiviert werden. Das Virus hemmt die
Proteasomenaktivität und blockiert dadurch die Peptidpräsentation an CD8+-Lymphozyten über MHC-I-Moleküle. Das können auch Zytomegalieviren
(diese kommen in der Bevölkerung zu >50% vor, bleiben lebenslang in
lymphatischem Gewebe erhalten und können bei Immunschwäche reaktiviert
werden).
Zellen teilen über MHC-I-Moleküle mit, was (in Bezug auf
Proteinsynthese) in ihrem Inneren vorgeht. Dabei werden die Moleküle
ständig erneuert, die Mitteilungen über das Geschehen sind immer
aktuell, die intrazelluläre Eiweißwelt für
Lymphozyten wie ein "offenes Buch" lesbar.
Viren
haben zahlreiche Wege gefunden, der Präsentation ihrer Peptide über
MHC-I-Moleküle zu entgehen, z.B. durch Verhinderung der Transkription
von MHC-Genen, Entfernung neu gebildeter MHC-Moleküle aus dem
endoplasmatischen Retikulum oder Blockade des Peptidtransports durch
TAP.
Anregung der Produktion:
MHC-I-Moleküle werden zwar konstitutionell exprimiert - sie sind an
kernhaltigen Zellen immer vorhanden -, vermehrt allerdings durch die
Wirkung von Zytokinen, vor allem Typ-I-Interferonen (IFN-α und IFN-β). Das verstärkt z.B. die antivirale Abwehr.
Immunologische Toleranz: Das Immunsystem
reagiert normalerweise nicht auf die Abbauprodukte normaler zytosolischer Proteine, weil T-Zellen, deren Rezeptoren solche körpereigene Peptide
erkennen würden, im Rahmen der Selektionsvorgänge im Thymus eliminiert oder zumindest ruhiggestellt worden sind.
Autoimmunerkrankungen treten auf, wenn Lymphozyten durch normale körpereigene Proteinabbauprodukte aktiviert werden.
Das MHC-II-System
MHC-II findet sich vor allem auf professionellen antigenpräsentierenden Zellen (dendritischen Zellen, Makrophagen
und
B-Lymphozyten), auch an einigen anderen (z.B. Endothel-) Zellen. Dendritische Zellen und Makrophagen
verfügen über Rezeptoren (z.B. Lektine), mit denen sie Mikroben binden
können, Makrophagen auch über Fc-Rezeptoren (Bindung antigenbeladener
Antikörper) und Rezeptoren für C3b. B-Zellen tragen Ig-Moleküle als Rezeptoren, mit denen sie an ihrer Oberfläche auch stark verdünntes Antigen anreichern können. Die
entstandenen Peptide präsentieren sie CD4-positiven Lymphozyten - vorwiegend Helfer- und regulatorischen (CD4+) T-Zellen - über MHC-II-Moleküle.
Professionelle antigenpräsentierende Zellen exprimieren sowohl MHC-II als auch MHC-I-Moleküle und können damit sowohl Helfer- als auch zytotoxische T-Zellen aktivieren.
MHC-II-Proteine werden durch HLA-D-Gene codiert.
Von jedem Elternteil erbt man je ein DPA- (für die α-Kette) und DPB-Gen (für die β-Kette)
sowie ein DQA-, ein DQB-, ein DRA- und ein oder zwei DRB-Gene. Zusammen
exprimiert jeder heterozygote Mensch 6-8 Paare von MHC-II-α- und β-Ketten-Molekülarten,
jeweils ein Set DP- und DQ-, und ein oder zwei Set(s) DR-Moleküle.
Zwar
werden die Haplotypen meist geschlossen vererbt, aber nicht immer,
sodass die Zahl von einem Individuum exprimierter MHC-II-Molekülarten
auch größer als 8 sein kann. Am DR-Locus des Chromosoms 6 liegen
zwei ß-Gene vor (bei allen anderen Loci nur eines), daher ist die Zahl
der möglichen Klasse-II-MHC-Proteine >6.
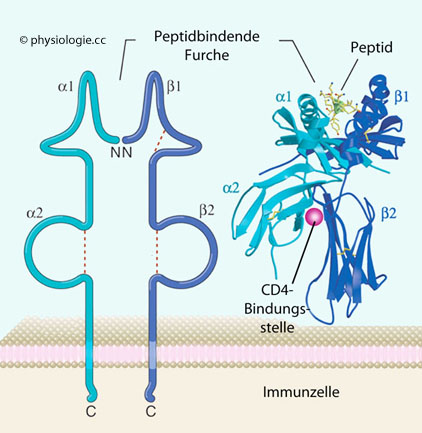
 Abbildung: MHC-II-Molekül
Abbildung: MHC-II-Molekül
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Links schematische Darstellung, rechts röntgenkristallographische Modellstruktur. α- und β-Kette sind beide in der Membran verankert, glykosyliert und nichtkovalent aneinander gebunden. Die polymorphen α1- und β1-Domänen formen zusammen eine taschenförmige Bindungsstelle für das zu präsentierende Peptid (das
größer ist als bei MHC-I: 8 bis über 30, meist 13-25 Aminosäuren
lang). Die Polymorphie liegt beim Menschen vor allem in der ß1-Domäne.
Im endoplasmatischen Retikulum ist die Peptidbindungsstelle durch Anlagerung einer invarianten Kette
blockiert. Diese sorgt dadurch für das "Routing" des Komplexes durch
Endosomen, in deren saurem Milieu die invariante Kette anschließend bis
auf einen kleinen Rest (CLIP) abgebaut und dann gegen das zu präsentierende Peptid ausgetauscht wird.
Die nischenförmige Bindungsstelle für den CD4-Corezeptor (rechts) wird durch die nicht-polymorphen α2- und β2-Domänen
bereitgestellt. CD4 bindet nur an MHC-II-Moleküle (nicht MHC-I), und
CD4-positive T-Zellen können nur an Peptide binden, die ihnen über
MHC-II-Moleküle präsentiert werden

Die wichtigsten Schritte der Antigenpräsentation über MHC-II sind
 die Endozytose von Antigen,
die Endozytose von Antigen,
 der proteolytische Abbau von Antigen in endozytotischen Vesikeln,
der proteolytische Abbau von Antigen in endozytotischen Vesikeln,
 die Bindung der Peptide an MHC-II-Moleküle,
die Bindung der Peptide an MHC-II-Moleküle,
 der Transport des MHC-II-Peptid-Komplexes an die Zelloberfläche.
der Transport des MHC-II-Peptid-Komplexes an die Zelloberfläche.
Endozytose und proteolytischer Abbau von Antigenen:
Zum Unterschied vom MHC-I-System werden für MHC-II extrazelluläre
Proteine abgebaut - nicht durch Proteasomen, sondern in Endo- und
Lysosomen. Makrophagen und dendritische Zellen
nehmen extrazelluläre bzw. mikrobielle Proteine über mehrere
Mechanismen auf (Bindung von Mikroben an spezifische
Oberflächenrezeptoren, an antigenerkennende Rezeptoren oder an opsoninerkennende Rezeptoren nach Komplementaktivierung). B-Lymphozyten binden Proteine, die ihre (klonspezifischen) Rezeptoren erkennen. Einige antigenpräsentierende (vor allem dendritische) Zellen können Proteine auch ohne spezifische Erkennung aufnehmen (Pinozytose).
Nach ihrer Aufnahme in die antigenpräsentierende Zelle gelangen
mikrobielle Proteine in saure Vesikel (Endosomen bzw. Phagosomen). Phagosomen enthalten phagozytierte Antigene und verschmelzen mit Lysosomen zu Phagolysosomen. Hier erfolgt der Abbau extrazellulärer (körpereigener oder mikrobieller) Proteine oder Toxine in saurem Milieu durch endosomale und
lysosomale Proteasen mit niedrigen pH-Optima, wie z.B. Kathepsine.
Es entstehen Bruchstücke unterschiedlicher Länge, MHC-II binden Peptide
mit einer Kettenlänge von 8 bis über 30 (meist 13-25, optimal: 8-16) Aminosäuren.
Nicht alle
phagozytierten Bakterien werden zerstört, manche können sich auch in
Lysosomen vermehren.
Synthese und Transport von MHC-II: Die MHC-Synthese (Translation) erfolgt im rauen endoplasmatischen Retikulum. Anders als bei MHC-I sind die Bindungsstellen des MHC-II
im endoplasmatischen Retikulum (ER) zunächst nicht leer, sondern von
einem Begleitprotein besetzt, das in der Form von CD74 (Ii,, HL-DR antigens-associated invariant chain) oder dessen aus 24 Aminosäuren bestehende Bruchstück (CLIP, Class II-associated invariant chain peptide) als "Dummy" am Molekül bleibt, bis es gegen ein zu präsentierendes Peptid ausgetauscht wird.
Das Ii-bestückte MHC-II-Molekül begibt sich via
Golgi-Apparat und von dort nicht direkt zur Zellmembran, sondern -
gesteuert durch den Schweif des Ii-Begleitmoleküls - in das endo- / lysosomale Kompartiment, wo Proteasen den Großteil des Ii-Moleküls entfernen. CLIP bleibt erhalten und in der
Antigenbindungsgrube des MHC-II gebunden (Peptide im endoplasmatischen Retikulum können so nur an MHC-I binden).
Transport der Peptid-MHC II-Komplexe zur Zelloberfläche: Erst durch die Beteiligung von HLA-codierten
Chaperonen (HLA-DM,  Abbildung) wird CLIP gegen ein antigenes Peptid
ausgetauscht. Das DM-Molekül stellt sicher, dass nur Peptide
mit hoher Affinität an die Nische des MHC-II gebunden werden. Nur dann hat der Peptid-MHC II-Komplex eine hohe Stabilität erlangt und wird an der Zellmembran CD4+-Lymphozyten präsentiert.
Abbildung) wird CLIP gegen ein antigenes Peptid
ausgetauscht. Das DM-Molekül stellt sicher, dass nur Peptide
mit hoher Affinität an die Nische des MHC-II gebunden werden. Nur dann hat der Peptid-MHC II-Komplex eine hohe Stabilität erlangt und wird an der Zellmembran CD4+-Lymphozyten präsentiert.
MHC-II-Moleküle
befinden sich in der Membran von dendritischen Zellen, mononukleären Phagozyten und
B-Lymphozyten. Sie werden von CD4-positiven Lymphozyten (Helferzellen)
erkannt
|
MHC-II-Moleküle präsentieren CD4-positiven Immunzellen Antigene aus der Umgebung
|

 Abbildung: MHC-II-Weg der Verarbeitung und Präsentation exogener (endozytierter) Antigene
Abbildung: MHC-II-Weg der Verarbeitung und Präsentation exogener (endozytierter) Antigene
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Extrazelluläre
(mikrobielle) Proteine werden von professionellen
antigenpräsentierenden Zellen (dendritischen Zellen, Makrophagen,
B-Lymphozyten) endozytiert und lysosomal zu Peptidfragmenten abgebaut.
Im endoplasmatischen Retikulum (ER) bindet die invariante Kette Ii (CD74) an MHC-II-Moleküle und begleitet sie via Trans-Golgi-Kompartiment in dasjenige der Endo- / Lysosomen - nunmehr mit dem Ii-Bruchstück CLIP (class II-associated invariant chain peptide) gebunden.
Im Vesikel verdrängen die Peptide das CLIP an der MHC-II-Bindungsstelle. Endo/lysosomale
Chaperone regulieren und
beschleunigen den Antigen-Kopplungsvorgang auf MHC-II-Moleküle, und
HLA-DM stabilisiert das MHC-II-Molekül, beteiligt sich an der Auswahl
des Peptids und festigt dessen Bindung an MHC.
Der
antigenbeladene MHC-II-Komplex wird anschließend zur Zellmembran befördert und an CD4+-Helferzellen präsentiert

Anregung der Produktion:
"Ruhende" antigenpräsentierende Zellen produzieren kaum
MHC-II-Moleküle. Ihre Expression unterliegt der Steuerung durch
Zytokine, vor allem Typ-II-Interferon (IFN-γ) regt sie an. Dieses kann sowohl aus angeregten NK-Zellen (angeborene Abwehr, frühe Phase) als auch CD4+-T-Zellen (adaptive Abwehr, späte Phase) stammen.
 MHC-II wird von Zellen erkannt (T-Helferzellen, Monozyten, Makrophagen), die über CD4-Rezeptoren verfügen. CD4 ist ein Corezeptor, der gemeinsam mit dem T-Zell-Rezeptor antigenbeladene MHC-II-Moleküle erkennt (Anfangsphase des MHC-II-Erkennungsvorgangs).
MHC-II wird von Zellen erkannt (T-Helferzellen, Monozyten, Makrophagen), die über CD4-Rezeptoren verfügen. CD4 ist ein Corezeptor, der gemeinsam mit dem T-Zell-Rezeptor antigenbeladene MHC-II-Moleküle erkennt (Anfangsphase des MHC-II-Erkennungsvorgangs).
 Corezeptoren
befinden sich in der Membran von Lymphozyten und binden an Antigen
- gemeinsam mit Immunglobulin (B-Zelle) oder dem T-Zell-Rezeptor (TCR).
Dadurch optimieren sie die Aktivierung des Lymphozyten. T-Zellen haben
CD4 oder CD8 als Corezeptoren, sie binden an nicht-polymorphe Teile des
MHC-Moleküls (an polymorphe bindet der TCR); CR2 auf B-Zellen bindet
komplementbedeckte Antigene (das Immunglobulin koppelt an einen anderen
Teil des Anigens).
Corezeptoren
befinden sich in der Membran von Lymphozyten und binden an Antigen
- gemeinsam mit Immunglobulin (B-Zelle) oder dem T-Zell-Rezeptor (TCR).
Dadurch optimieren sie die Aktivierung des Lymphozyten. T-Zellen haben
CD4 oder CD8 als Corezeptoren, sie binden an nicht-polymorphe Teile des
MHC-Moleküls (an polymorphe bindet der TCR); CR2 auf B-Zellen bindet
komplementbedeckte Antigene (das Immunglobulin koppelt an einen anderen
Teil des Anigens).
MHC-II-positive Zellen exprimieren einen Transkriptions-Coaktivator mit der Bezeichnung CIITA (Class II TransActivator). CIITA findet sich nur in MHC-II-positiven Zellen und aktiviert den Transkriptionsfaktor RFX5, der die Transkription und Synthese von MHC-II Molekülen anregt. Veränderungen von CIITA oder RFX5 bzw. der betreffenden Gene bewirken Formen von Immunschwäche bzw. Lymphomen.
MHC-gekoppelte Antigenpräsentation: Physiologische Bedeutung
 Die MHC-Restriktion
garantiert, dass T-Zellen nicht auf freie (gelöste), sondern nur auf
zell-assoziierte Antigene ansprechen. MHC-Moleküle können nur innerhalb
von Zellen synthetisiert und mit Antigenpeptiden beladen werden.
Die MHC-Restriktion
garantiert, dass T-Zellen nicht auf freie (gelöste), sondern nur auf
zell-assoziierte Antigene ansprechen. MHC-Moleküle können nur innerhalb
von Zellen synthetisiert und mit Antigenpeptiden beladen werden.

 Abbildung: Präsentation mikrobieller Antigene im Vergleich
Abbildung: Präsentation mikrobieller Antigene im Vergleich
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Oben: MHC-I-Weg.
In der Zelle vorhandene mikrobielle Proteine werden proteasomal zu
Peptiden abgebaut und diese über den MHC-I-Weg an CD8+ Lymphozyten
präsentiert. Diese töten die infizierte Zelle ab.
Mitte: Makrophagen endozytieren
Mikroben, bauen diese endosomal ab und präsentieren Peptidbruchstücke
CD4+ Lymphozyten (Helferzellen). Diese sezernieren Zytokine, welche den
Makrophagen aktivieren und die Abtötung phagozytierter Mikroben
unterstützen.
Unten: Antigenspezifische B-Zellen präsentieren Peptidfragmente endozytierter (extrazellulärer) Antigene und präsentieren sie CD4+ Lymphozyten. Diese bilden Zytokine, und der betreffende B-Zell-Klon sezerniert spezifische Antikörper gegen das Antigen

 Indem der MHC-I- und MHC-II-Mechanismus in der Zelle funktionell
separiert sind, kann das Immunsystem unterschiedlich auf intrazelluläre
und extrazelluläre Antigene reagieren (
Indem der MHC-I- und MHC-II-Mechanismus in der Zelle funktionell
separiert sind, kann das Immunsystem unterschiedlich auf intrazelluläre
und extrazelluläre Antigene reagieren ( Abbildung).
Werden CD8-positive Lymphozyten (über MHC-I-Peptid-Komplexe) aktiviert,
können mikrobeninfizierte oder auch Tumorzellen abgetötet werden - das
gilt für alle kernhaltigen Zellen. Andererseits können Makrophagen
Bakterien, Pilze und auch Viren aus dem Extrazellulärraum aufnehmen und
ihre Antigene über MHC-II-Moleküle an CD4-positive Lymphozyten
präsentieren - und diese helfen den Makrophagen, aufgenommene Mikroben
zu zerstören. Diese "Helferzellen" können auch B-Lymphozyten anregen,
via Antikörper spezifisch extrazelluläre Mikroben anzugreifen.
Abbildung).
Werden CD8-positive Lymphozyten (über MHC-I-Peptid-Komplexe) aktiviert,
können mikrobeninfizierte oder auch Tumorzellen abgetötet werden - das
gilt für alle kernhaltigen Zellen. Andererseits können Makrophagen
Bakterien, Pilze und auch Viren aus dem Extrazellulärraum aufnehmen und
ihre Antigene über MHC-II-Moleküle an CD4-positive Lymphozyten
präsentieren - und diese helfen den Makrophagen, aufgenommene Mikroben
zu zerstören. Diese "Helferzellen" können auch B-Lymphozyten anregen,
via Antikörper spezifisch extrazelluläre Mikroben anzugreifen.
Solange Mikroben im Extrazellulärraum verbleiben, werden sie über
MHC-II-abhängige Mechanismen bekämpft; haben sie Zutritt zum
Zellinneren erlangt, greift der MHC-I-Mechanismus die infizierte Zelle
selbst an.


 Peptide, die stark an MHC-Moleküle binden, stellen immundominante Antigene dar. Das entsprechende Muster variiert von Mensch zu Mensch - wegen des ausgeprägten Polymorphismus von MHC in der Bevölkerung.
Peptide, die stark an MHC-Moleküle binden, stellen immundominante Antigene dar. Das entsprechende Muster variiert von Mensch zu Mensch - wegen des ausgeprägten Polymorphismus von MHC in der Bevölkerung.
Die Aktivierung von
T-Lymphozyten und entsprechende adaptive Immunantworten sind daher an folgende Bedingungen geknüpft:
 Antigene müssen an MHC-IMoleküle gekoppelt sein
Antigene müssen an MHC-IMoleküle gekoppelt sein
 Sie werden von antigenpräsentierenden
Zellen “vorgezeigt”
Sie werden von antigenpräsentierenden
Zellen “vorgezeigt”
 Eine "Passung" entsprechender CD-Corezeptoren ist gegeben
Eine "Passung" entsprechender CD-Corezeptoren ist gegeben
 T-Zell-Rezeptoren sind vorhanden, die auf die entsprechende Peptid-MHC-Kombination passen
T-Zell-Rezeptoren sind vorhanden, die auf die entsprechende Peptid-MHC-Kombination passen
 Eine bestimmte T-Zelle erkennt - mittels ihrer T-Zell-Rezeptoren - nur eine bestimmte chemische Struktur
(Schlüssel-Schloss-Prinzip). In jedem Organismus gibt es eine Unzahl von
T-Zellen mit verschiedensten Rezeptoren, davon verfügen (vielleicht)
einige über passende Rezeptoren. Es kann Tage dauern, bis die
“richtigen” T-Lymphozyten durch Phagozytose und Peptid-Präsentation
aktiviert worden sind.
Eine bestimmte T-Zelle erkennt - mittels ihrer T-Zell-Rezeptoren - nur eine bestimmte chemische Struktur
(Schlüssel-Schloss-Prinzip). In jedem Organismus gibt es eine Unzahl von
T-Zellen mit verschiedensten Rezeptoren, davon verfügen (vielleicht)
einige über passende Rezeptoren. Es kann Tage dauern, bis die
“richtigen” T-Lymphozyten durch Phagozytose und Peptid-Präsentation
aktiviert worden sind.
Die Folgewirkungen der "Alarmierung" von T-Helferzellen können sehr vielfältig sein und hängen von der Art der Helferzellen ab ( s. dort).
s. dort).


 T-Zellen erkennen mit ihren Rezeptoren Infektionen durch intrazelluläre
Mikroben oder Abweichungen vom normalen Proteinstoffwechsel anhand von
Peptiden, die ihnen von einer antigenpräsentierenden Zelle über
MHC-Proteine vorgezeigt werden. Sie aktivieren darauf hin andere
Immunzellen (Makrophagen, B-Lymphozyten), um die betreffende Zelle
auszuschalten. T-Zellen erkennen nur MHC-gebundene (keine freien)
Antigene
T-Zellen erkennen mit ihren Rezeptoren Infektionen durch intrazelluläre
Mikroben oder Abweichungen vom normalen Proteinstoffwechsel anhand von
Peptiden, die ihnen von einer antigenpräsentierenden Zelle über
MHC-Proteine vorgezeigt werden. Sie aktivieren darauf hin andere
Immunzellen (Makrophagen, B-Lymphozyten), um die betreffende Zelle
auszuschalten. T-Zellen erkennen nur MHC-gebundene (keine freien)
Antigene
 Spezielle antigenpräsentierende Zellen nehmen im Gewebe mikrobielle
Antigene auf und präsentieren Peptidbruchstücke naiven T-Lymphozyten.
Bei Passung der Moleküle teilen
sich diese, ein selektionierter Lymphozytenklon entsteht, der innerhalb
einiger Tage effiziente spezifische Abwehr gegen das
betreffende Antigen aufbaut
Spezielle antigenpräsentierende Zellen nehmen im Gewebe mikrobielle
Antigene auf und präsentieren Peptidbruchstücke naiven T-Lymphozyten.
Bei Passung der Moleküle teilen
sich diese, ein selektionierter Lymphozytenklon entsteht, der innerhalb
einiger Tage effiziente spezifische Abwehr gegen das
betreffende Antigen aufbaut
 Zytokine aktivieren Transkriptionsfaktoren an entsprechenden DNA-Sequenzen in der Promotorregion von MHC-Genen und regen so die Expression
von MHC-Molekülen an. MHC I-Moleküle präsentieren Peptide
zytoplasmatischen Ursprungs und kommen in der Membran aller
kernhaltigen Zellen vor (nicht in Erythrozyten), MHC II präsentieren
Peptide lysosomalen Ursprungs auf antigenpräsentierenden Immunzellen
Zytokine aktivieren Transkriptionsfaktoren an entsprechenden DNA-Sequenzen in der Promotorregion von MHC-Genen und regen so die Expression
von MHC-Molekülen an. MHC I-Moleküle präsentieren Peptide
zytoplasmatischen Ursprungs und kommen in der Membran aller
kernhaltigen Zellen vor (nicht in Erythrozyten), MHC II präsentieren
Peptide lysosomalen Ursprungs auf antigenpräsentierenden Immunzellen
 MHC zeigen mikrobielle Antigene zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene) her. Die spezifische Erkennung
erfordert auf beiden Seiten Hilfsmoleküle: MHC-Moleküle auf der
präsentierenden Zelle, T-Zell-Rezeptoren auf dem Lymphozyten,
CD-Moleküle auf beiden Zellen MHC zeigen mikrobielle Antigene zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene) her. Die spezifische Erkennung
erfordert auf beiden Seiten Hilfsmoleküle: MHC-Moleküle auf der
präsentierenden Zelle, T-Zell-Rezeptoren auf dem Lymphozyten,
CD-Moleküle auf beiden Zellen
 Ubiquitine binden reversibel an Zielproteine, um diese zu überprüfen:
Richtig strukturierte gelangen an ihren Zielort, fehlerhaft gefaltete
werden durch Proteasomen abgebaut. Freie MHC-I-Moleküle sind instabil
und werden rasch durch Proteasomen abgebaut, peptidbeladene sind stabil
und gelangen an die Zelloberfläche zur Präsentation an CD8+-zytotoxische Lymphozyten
Ubiquitine binden reversibel an Zielproteine, um diese zu überprüfen:
Richtig strukturierte gelangen an ihren Zielort, fehlerhaft gefaltete
werden durch Proteasomen abgebaut. Freie MHC-I-Moleküle sind instabil
und werden rasch durch Proteasomen abgebaut, peptidbeladene sind stabil
und gelangen an die Zelloberfläche zur Präsentation an CD8+-zytotoxische Lymphozyten
 MHC-II-Moleküle auf dendritischen Zellen, Makrophagen, Monozyten und
B-Lymphozyten, die Mikroben bzw. Antigene binden ("professionelle"
Antigenpräsentierer), zeigen CD4-positiven T-Helferzellen Antigene aus
ihrer (extrazellulären) Umgebung. Antigene werden nur in Kombination
mit dem eigenen MHC-Komplex erkannt (MHC-Restriktion). Aktivierte
Helferzellen wirken dann in vielfacher Weise regulierend auf weitere
Immunprozesse ein
MHC-II-Moleküle auf dendritischen Zellen, Makrophagen, Monozyten und
B-Lymphozyten, die Mikroben bzw. Antigene binden ("professionelle"
Antigenpräsentierer), zeigen CD4-positiven T-Helferzellen Antigene aus
ihrer (extrazellulären) Umgebung. Antigene werden nur in Kombination
mit dem eigenen MHC-Komplex erkannt (MHC-Restriktion). Aktivierte
Helferzellen wirken dann in vielfacher Weise regulierend auf weitere
Immunprozesse ein
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Chaperone: chaperone = Begleiter, Anstandsdame (von lat. cappa, Kappe)
Chaperone: chaperone = Begleiter, Anstandsdame (von lat. cappa, Kappe) MHC und Antigenpräsentation
MHC und Antigenpräsentation  Antigen processing
Antigen processing  MHC-I
MHC-I  MHC-II
MHC-II  Physiologische Bedeutung MHC-gekoppelter Antigenpräsentation
Physiologische Bedeutung MHC-gekoppelter Antigenpräsentation
 Haplotyp, Polymorphismus
Haplotyp, Polymorphismus  HLA
HLA  TAP
TAP  MHC-Restriktion
MHC-Restriktion  Ortho / heterotop, autolog, syngen, allogen, alloreaktiv
Ortho / heterotop, autolog, syngen, allogen, alloreaktiv  Corezeptor
Corezeptor
 Abbildung). Die Antigenpräsentation ist
ein besonderes Kennzeichen des adaptiven Immunsystems.
Abbildung). Die Antigenpräsentation ist
ein besonderes Kennzeichen des adaptiven Immunsystems. 
 Abbildung: Wie Lymphozyten Antigene präsentiert bekommen
Abbildung: Wie Lymphozyten Antigene präsentiert bekommen
 B-Zellen
reagieren auf ganz verschiedene Typen
mikrobieller Kennzeichen und produzieren Immunglobuline - diese erkennen und binden Epitope
(antigene Determinanten) an Pathogenen -
auf Mikroben oder in gelöster Form. Lösliche Immunglobuline (Antikörper) breiten sich
über den Extrazellulärraum (Blutplasma, Interstitium)
aus und können so ihre Wirkung im ganzen Körper entfalten.
B-Zellen
reagieren auf ganz verschiedene Typen
mikrobieller Kennzeichen und produzieren Immunglobuline - diese erkennen und binden Epitope
(antigene Determinanten) an Pathogenen -
auf Mikroben oder in gelöster Form. Lösliche Immunglobuline (Antikörper) breiten sich
über den Extrazellulärraum (Blutplasma, Interstitium)
aus und können so ihre Wirkung im ganzen Körper entfalten.  T-Zellen hingegen wirken auf ihre unmittelbare Umgebung, wo sie z.B. Zielzellen abtöten (zytotoxische T-Effektorzellen); Makrophagen, dendritische Zellen oder B-Zellen aktivieren (Helfer-T-Zellen); oder die Aktivität anderer Immunzellen beeinflussen (regulatorische T-Zellen).
Sie benötigen zu ihrer Aktivierung die Aufbereitung und Präsentation
von Antigenen über MHC-Proteine (z.B. durch dendritische Zellen in
lymphatischen Organen).
T-Zellen hingegen wirken auf ihre unmittelbare Umgebung, wo sie z.B. Zielzellen abtöten (zytotoxische T-Effektorzellen); Makrophagen, dendritische Zellen oder B-Zellen aktivieren (Helfer-T-Zellen); oder die Aktivität anderer Immunzellen beeinflussen (regulatorische T-Zellen).
Sie benötigen zu ihrer Aktivierung die Aufbereitung und Präsentation
von Antigenen über MHC-Proteine (z.B. durch dendritische Zellen in
lymphatischen Organen). Abbildung)
soll dabei garantieren, dass dieser Vorgang sicher ist, indem er
spezifisch potenzielle Gefahrenträger bekämpft, ohne eigenes Gewebe (körpereigene Proteine) zu
attackieren.
Abbildung)
soll dabei garantieren, dass dieser Vorgang sicher ist, indem er
spezifisch potenzielle Gefahrenträger bekämpft, ohne eigenes Gewebe (körpereigene Proteine) zu
attackieren.
 Abbildung: Antigenerkennung am T-Zell-Rezeptor
Abbildung: Antigenerkennung am T-Zell-Rezeptor
 MHC (major histocompatibility complex) ist
ein großer, den Organismus individuell kennzeichnender Genkomplex.
Dieser befindet sich auf Chromatiden, die sich im Metaphasenkern als
Chromosom 6 darstellen. MHC codiert membranständige Glykoproteine, die von Lymphozyten als "Trägermoleküle" präsentierter Peptide erkannt werden. Man
unterscheidet MHC-I-Moleküle, die von allen kernhaltigen
Zellen des Körpers, und MHC-II-Moleküle, die nur von
"professionell" antigenpräsentierenden Zellen (insbesondere
dendritische Zellen, Makrophagen und B-Lymphozyten) exprimiert werden.
MHC (major histocompatibility complex) ist
ein großer, den Organismus individuell kennzeichnender Genkomplex.
Dieser befindet sich auf Chromatiden, die sich im Metaphasenkern als
Chromosom 6 darstellen. MHC codiert membranständige Glykoproteine, die von Lymphozyten als "Trägermoleküle" präsentierter Peptide erkannt werden. Man
unterscheidet MHC-I-Moleküle, die von allen kernhaltigen
Zellen des Körpers, und MHC-II-Moleküle, die nur von
"professionell" antigenpräsentierenden Zellen (insbesondere
dendritische Zellen, Makrophagen und B-Lymphozyten) exprimiert werden. 
 Abbildung: Antigenpräsentation
Abbildung: Antigenpräsentation Zum CD-System s. dort
Zum CD-System s. dort Antigenpräsentierende Zellen zeigen nicht nur das Produkt ihres Abbaus in den
"Furchen" des MHC-Moleküls her, sondern produzieren auch costimulatorische
Signale an der Berührungsstelle zwischen ihnen und der "informierten"
T-Zelle (Abbildungen oben). Auch steuern sie durch die Freisetzung eines entsprechenden
Zytokin-"Cocktails" die Qualität der Immunreaktion, die von der
Kombination T-Zell-Rezeptor / MHC-Molekül abhängt.
Antigenpräsentierende Zellen zeigen nicht nur das Produkt ihres Abbaus in den
"Furchen" des MHC-Moleküls her, sondern produzieren auch costimulatorische
Signale an der Berührungsstelle zwischen ihnen und der "informierten"
T-Zelle (Abbildungen oben). Auch steuern sie durch die Freisetzung eines entsprechenden
Zytokin-"Cocktails" die Qualität der Immunreaktion, die von der
Kombination T-Zell-Rezeptor / MHC-Molekül abhängt. Als Haplotypen bezeichnet man DNA-Sequenzen (Kombination von Allelen oder Sequenzvariationen) einer Chromatide / eines Chromosoms, die meist zusammen vererbt werden. Haplotypen stammen entweder von der Mutter oder vom Vater des betreffenden Organismus.
Als Haplotypen bezeichnet man DNA-Sequenzen (Kombination von Allelen oder Sequenzvariationen) einer Chromatide / eines Chromosoms, die meist zusammen vererbt werden. Haplotypen stammen entweder von der Mutter oder vom Vater des betreffenden Organismus.  Abbildung). Sie werden bezeichnet als
Abbildung). Sie werden bezeichnet als  MHC-Klasse I-Region (mit HLA-A, HLA-B,
HLA-C sowie HLA-E, HLA-F und HLA-G),
MHC-Klasse I-Region (mit HLA-A, HLA-B,
HLA-C sowie HLA-E, HLA-F und HLA-G),  MHC-Klasse-II-Region (mit HLA-DP, HLA-DQ und HLA-DR für α- und ß-Ketten, DM und DO für die Aufbereitung von Antigenpeptiden) und
MHC-Klasse-II-Region (mit HLA-DP, HLA-DQ und HLA-DR für α- und ß-Ketten, DM und DO für die Aufbereitung von Antigenpeptiden) und MHC-Klasse-III-Region (mit
HLA-D und anderen Genen).
MHC-Klasse-III-Region (mit
HLA-D und anderen Genen).
 Abbildung: MHC-Genkarte auf dem kurzen Arm des Chromosoms 6 des Menschen
Abbildung: MHC-Genkarte auf dem kurzen Arm des Chromosoms 6 des Menschen Als HLA (human leukocyte antigens)
bezeichnet man MHC-Moleküle, die zuerst
auf Leukozyten festgestellt wurden (daher das "L"). MHC-I-Moleküle
werden über codominante Klasse-I-Gene vererbt (jeder Mensch erbt von
seinen Eltern jeweils ein HLA-A, HLA-B und HLA-C-Gen - jede seiner
Zellen exprimiert 6
verschiedene dieser Klasse-I-Moleküle). Die Zahl der von einem Individuum exprimierten Klasse-II-Molekülen
(die von professionellen antigenpräsentierenden Zellen exprimiert
werden) ist meist größer als 6 (separate Gene DP und DQ für DRα und
eine
unterschiedliche Zahl - meist 1 bis 3 - von Genen für DRß). Die Allele
werden (nach molekularer Typisierung) mit einem Buchstaben-Zahlen-Code
gekennzeichnet (z.B. HLA-A*0201, HLA-DRB1*0401 etc).
Als HLA (human leukocyte antigens)
bezeichnet man MHC-Moleküle, die zuerst
auf Leukozyten festgestellt wurden (daher das "L"). MHC-I-Moleküle
werden über codominante Klasse-I-Gene vererbt (jeder Mensch erbt von
seinen Eltern jeweils ein HLA-A, HLA-B und HLA-C-Gen - jede seiner
Zellen exprimiert 6
verschiedene dieser Klasse-I-Moleküle). Die Zahl der von einem Individuum exprimierten Klasse-II-Molekülen
(die von professionellen antigenpräsentierenden Zellen exprimiert
werden) ist meist größer als 6 (separate Gene DP und DQ für DRα und
eine
unterschiedliche Zahl - meist 1 bis 3 - von Genen für DRß). Die Allele
werden (nach molekularer Typisierung) mit einem Buchstaben-Zahlen-Code
gekennzeichnet (z.B. HLA-A*0201, HLA-DRB1*0401 etc).

 Abbildung: Eigenschaften von MHC-Genen und Molekülen
Abbildung: Eigenschaften von MHC-Genen und Molekülen Polymorphie: In der menschlichen Population werden zahlreiche (insgesamt >1,8.104) verschiedene Allele von MHC-Genen vererbt - MHC-Moleküle weisen die höchste Polymorphie aller Proteine bei Säugetieren auf.
Polymorphie: In der menschlichen Population werden zahlreiche (insgesamt >1,8.104) verschiedene Allele von MHC-Genen vererbt - MHC-Moleküle weisen die höchste Polymorphie aller Proteine bei Säugetieren auf. Codominanz: Zellen exprimieren vom Vater und von der Mutter vererbte MHC-Allele gleich stark.
Codominanz: Zellen exprimieren vom Vater und von der Mutter vererbte MHC-Allele gleich stark. Alle kernhaltigen Zellen exprimieren MHC-I, professionelle
antigenpräsentierende Zellen (Makrophagen, dendritische Zellen,
B-Lymphozyten u.a.) darüber hinaus MHC-II
Alle kernhaltigen Zellen exprimieren MHC-I, professionelle
antigenpräsentierende Zellen (Makrophagen, dendritische Zellen,
B-Lymphozyten u.a.) darüber hinaus MHC-II
 Der MHC wurde durch die Beobachtung entdeckt, dass
Menschen, die mehrfach Bluttransfusionen erhalten hatten oder eine
Niere transplantiert bekamen, Antikörper bildeten, die transfundierte /
transplantierte Fremdzellen erkennen. Man suchte nach diesen zellulären Merkmalen - die vom Immunsystem als "fremd" erkannt werden - und nannte sie HLA (human leucocyte antigen): Leukozytär, weil man mit den Antikörpern Fremdleukozyten binden konnte; und Antigen, weil die Reaktionspartner Antikörper waren. Es stellte sich heraus, dass diese Eigenschaften von MHC-Genen codiert werden.
Der MHC wurde durch die Beobachtung entdeckt, dass
Menschen, die mehrfach Bluttransfusionen erhalten hatten oder eine
Niere transplantiert bekamen, Antikörper bildeten, die transfundierte /
transplantierte Fremdzellen erkennen. Man suchte nach diesen zellulären Merkmalen - die vom Immunsystem als "fremd" erkannt werden - und nannte sie HLA (human leucocyte antigen): Leukozytär, weil man mit den Antikörpern Fremdleukozyten binden konnte; und Antigen, weil die Reaktionspartner Antikörper waren. Es stellte sich heraus, dass diese Eigenschaften von MHC-Genen codiert werden.  Einer großen extrazellulären Portion mit zwei unterschiedlichen Hälften (ein Heterodimer) - entsprechend dem jeweiligen Haplotyp auf den beiden Allelen: Bei MHC-II α- und β-Polypeptid, bei MHC-I ein aus drei Domänen bestehendes α-Polypeptid sowie ein angelagertes (nicht-MHC-codiertes) β-Mikroglobulin
(s. weiter unten). Die äußeren Strukturen bieten dem präsentierten
Peptid
(Epitop) eine Art Mulde, in die es sich einlagern kann und die enorme
Diversität aufweist. Dieser Teil dient der Präsentation und Bindung an
passende T-Zell-Rezeptoren. Die nichtpolymorphen (zellnahen) Sequenzen
enthalten Bindungsstellen für CD4 und CD8 (
Einer großen extrazellulären Portion mit zwei unterschiedlichen Hälften (ein Heterodimer) - entsprechend dem jeweiligen Haplotyp auf den beiden Allelen: Bei MHC-II α- und β-Polypeptid, bei MHC-I ein aus drei Domänen bestehendes α-Polypeptid sowie ein angelagertes (nicht-MHC-codiertes) β-Mikroglobulin
(s. weiter unten). Die äußeren Strukturen bieten dem präsentierten
Peptid
(Epitop) eine Art Mulde, in die es sich einlagern kann und die enorme
Diversität aufweist. Dieser Teil dient der Präsentation und Bindung an
passende T-Zell-Rezeptoren. Die nichtpolymorphen (zellnahen) Sequenzen
enthalten Bindungsstellen für CD4 und CD8 ( Abbildung oben);
Abbildung oben); einer Transmembran-Sequenz (transmembrane region, etwa 25 hydrophobe Aminosäuren, α-helikal angeordnet) für die Verankerung in der Zellmembran;
einer Transmembran-Sequenz (transmembrane region, etwa 25 hydrophobe Aminosäuren, α-helikal angeordnet) für die Verankerung in der Zellmembran; einer kurzen hydrophilen zytoplasmatischen Domäne mit rund 30
Aminosäuren (hauptsächlich als ß-Faltblatt). Dieser Abschnitt des
MHC-Moleküls (cytoplasmic tail) kann u.a. HLA-Molekülen dabei helfen, das endoplasmatische Retikulum zu verlassen.
einer kurzen hydrophilen zytoplasmatischen Domäne mit rund 30
Aminosäuren (hauptsächlich als ß-Faltblatt). Dieser Abschnitt des
MHC-Moleküls (cytoplasmic tail) kann u.a. HLA-Molekülen dabei helfen, das endoplasmatische Retikulum zu verlassen.
 Indem
MHC-Moleküle einen Unterschied in der Herkunft der von ihnen
präsentierten Peptide machen (MHC-I: zytoplasmatisch, MHC-II: endosomal),
können sie mikrobielle Antigene gezielt zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene durch Phagozytose und
Antikörperbildung) anbieten und damit die jeweils optimale Abwehr
adressieren.
Indem
MHC-Moleküle einen Unterschied in der Herkunft der von ihnen
präsentierten Peptide machen (MHC-I: zytoplasmatisch, MHC-II: endosomal),
können sie mikrobielle Antigene gezielt zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene durch Phagozytose und
Antikörperbildung) anbieten und damit die jeweils optimale Abwehr
adressieren. Abbildung). MHC-I präsentiert Bruchstücke von der Zelle selbst
synthetisierter Proteine, MHC-II aus dem phago/lysosomalen Abbau
stammende Peptide von Proteinen extrazellulären Ursprungs.
Abbildung). MHC-I präsentiert Bruchstücke von der Zelle selbst
synthetisierter Proteine, MHC-II aus dem phago/lysosomalen Abbau
stammende Peptide von Proteinen extrazellulären Ursprungs. 
 Abbildung: Antigenverarbeitung und Präsentation über MHC
Abbildung: Antigenverarbeitung und Präsentation über MHC Die
beiden Pfade der Antigenpräsentation stellen gemeinsam sicher, dass
sämtliche relevanten Proteine im Körper - sowohl intrazelluläre
(Proteinsynthese, proteasomaler Abbau, MHC-I, CD8+ Lymphozyten) als
auch extrazelluläre (Endozytose, endolysosomaler Abbau, MHC-II, CD4+
Lymphozyten) - stetig gesammelt und überprüft werden.
Die
beiden Pfade der Antigenpräsentation stellen gemeinsam sicher, dass
sämtliche relevanten Proteine im Körper - sowohl intrazelluläre
(Proteinsynthese, proteasomaler Abbau, MHC-I, CD8+ Lymphozyten) als
auch extrazelluläre (Endozytose, endolysosomaler Abbau, MHC-II, CD4+
Lymphozyten) - stetig gesammelt und überprüft werden.  Der
Mechanismus der Antigenverarbeitung lässt Peptide von richtiger Größe
zur Bindung an MHC entstehen und bringt Peptide und MHC-Moleküle in der
Zelle
zusammen, bevor sie gemeinsam an die Zelloberfläche
wandern und hier präsentiert / von entsprechenden (mit passenden Rezeptoren ausgestatteten) T-Zellen erkannt werden.
Der
Mechanismus der Antigenverarbeitung lässt Peptide von richtiger Größe
zur Bindung an MHC entstehen und bringt Peptide und MHC-Moleküle in der
Zelle
zusammen, bevor sie gemeinsam an die Zelloberfläche
wandern und hier präsentiert / von entsprechenden (mit passenden Rezeptoren ausgestatteten) T-Zellen erkannt werden. 
 Abbildung: Charakteristika der Antigenpräsentation
Abbildung: Charakteristika der Antigenpräsentation Als MHC-Restriktion bezeichnet man die Tatsache, dass T-Zell-Rezeptoren Peptidantigene ausschließlich in Kombination mit MHC-Molekülen erkennen.
Als MHC-Restriktion bezeichnet man die Tatsache, dass T-Zell-Rezeptoren Peptidantigene ausschließlich in Kombination mit MHC-Molekülen erkennen. = Gewebeverträglichkeit).
= Gewebeverträglichkeit). Von orthotoper Transplantation spricht man, wenn Gewebe auf seine natürliche anatomische Position verpflanzt wird (z.B. Herztransplantation) - andernfalls ist die Transplantation heterotop. Bei Übertragung auf den identen Organismus ist das Transplantat autolog; verpflanzt man es auf einen genetisch identen Zwilling, nennt man es syngen; ist es ein genetisch verschiedener Organismus derselben Spezies, nennt man es allogen. Die als fremd erkannten Antigene sind Alloantigene, die entsprechenden erkennenden / reagierenden Antikörper und Lymphozyten sind alloreaktiv. Xenogene Transplantate stammen von einer anderen Spezies, die Immunabwehr ist dann xenoreaktiv.
Von orthotoper Transplantation spricht man, wenn Gewebe auf seine natürliche anatomische Position verpflanzt wird (z.B. Herztransplantation) - andernfalls ist die Transplantation heterotop. Bei Übertragung auf den identen Organismus ist das Transplantat autolog; verpflanzt man es auf einen genetisch identen Zwilling, nennt man es syngen; ist es ein genetisch verschiedener Organismus derselben Spezies, nennt man es allogen. Die als fremd erkannten Antigene sind Alloantigene, die entsprechenden erkennenden / reagierenden Antikörper und Lymphozyten sind alloreaktiv. Xenogene Transplantate stammen von einer anderen Spezies, die Immunabwehr ist dann xenoreaktiv. einer α-Kette
- diese präsentiert Peptide aus dem proteasomalen Abbau verschiedener
Proteine, die von der Zelle synthetisiert wurden und im Zytoplasma
vorkommen - normale zelleigene (inklusive nukleäre - insbesondere in
Tumorzellen - und membranständige), fehlgefaltete und allenfalls
mikrobielle. Assoziiert
(nicht-kovalent) ist ein
einer α-Kette
- diese präsentiert Peptide aus dem proteasomalen Abbau verschiedener
Proteine, die von der Zelle synthetisiert wurden und im Zytoplasma
vorkommen - normale zelleigene (inklusive nukleäre - insbesondere in
Tumorzellen - und membranständige), fehlgefaltete und allenfalls
mikrobielle. Assoziiert
(nicht-kovalent) ist ein 
 β2-Mikroglobulin (sein
Gen liegt außerhalb des MHC-Locus), welches sich auch an andere
Moleküle anlagert (z.B. CD1), Immunfunktionen moduliert und
intrazelluläre Signalwege aktiviert.
β2-Mikroglobulin (sein
Gen liegt außerhalb des MHC-Locus), welches sich auch an andere
Moleküle anlagert (z.B. CD1), Immunfunktionen moduliert und
intrazelluläre Signalwege aktiviert.  HLA-A (codiert am HLA-A Genlocus, ~480 Varianten bekannt)
HLA-A (codiert am HLA-A Genlocus, ~480 Varianten bekannt)
 HLA-B
(HLA-B Gene, ~800 Varianten)
HLA-B
(HLA-B Gene, ~800 Varianten)
 HLA-C (~260 Varianten)
HLA-C (~260 Varianten)
 Abbildung: MHC-I-Molekül
Abbildung: MHC-I-Molekül
 s. dort).
s. dort).  Abbildung)
Abbildung) die Markierung eines Proteins für die Proteolyse (Ubiquitinierung),
die Markierung eines Proteins für die Proteolyse (Ubiquitinierung),  die Abspaltung von Peptidfragmenten durch Proteasomen,
die Abspaltung von Peptidfragmenten durch Proteasomen,  der Transport der Peptide in das endoplasmatische Retikulum,
der Transport der Peptide in das endoplasmatische Retikulum,  die Bindung der Peptide an (neu gebildete) MHC-I-Moleküle,
die Bindung der Peptide an (neu gebildete) MHC-I-Moleküle, der Transport des MHC-I-Peptid-Komplexes an die Zelloberfläche.
der Transport des MHC-I-Peptid-Komplexes an die Zelloberfläche.
 Abbildung: Der Klasse-I MHC-Weg der Präsentation zytoplasmatischer Antigene
Abbildung: Der Klasse-I MHC-Weg der Präsentation zytoplasmatischer Antigene
 Der Antigenpeptid-Transporter (TAP) - ein Mitglied der ABC-Transporter-Familie - ist eine energieverbrauchende Molekülpumpe in der Wand des endoplasmatischen Retikulums (ER). TAP bindet proteasomgenerierte Peptide an die zytoplasmatische Seite des ER und befördert sie in dessen Inneres. Das Brückenmolekül Tapasin koppelt sie dann an frisch synthetisierte, peptidfreie ("leere") MHC-Moleküle und stellt die Verbindung mit passendem Peptid her.
Der Antigenpeptid-Transporter (TAP) - ein Mitglied der ABC-Transporter-Familie - ist eine energieverbrauchende Molekülpumpe in der Wand des endoplasmatischen Retikulums (ER). TAP bindet proteasomgenerierte Peptide an die zytoplasmatische Seite des ER und befördert sie in dessen Inneres. Das Brückenmolekül Tapasin koppelt sie dann an frisch synthetisierte, peptidfreie ("leere") MHC-Moleküle und stellt die Verbindung mit passendem Peptid her.
 Abbildung: MHC-II-Molekül
Abbildung: MHC-II-Molekül
 die Endozytose von Antigen,
die Endozytose von Antigen,  der proteolytische Abbau von Antigen in endozytotischen Vesikeln,
der proteolytische Abbau von Antigen in endozytotischen Vesikeln,  die Bindung der Peptide an MHC-II-Moleküle,
die Bindung der Peptide an MHC-II-Moleküle, der Transport des MHC-II-Peptid-Komplexes an die Zelloberfläche.
der Transport des MHC-II-Peptid-Komplexes an die Zelloberfläche. Abbildung) wird CLIP gegen ein antigenes Peptid
ausgetauscht. Das DM-Molekül stellt sicher, dass nur Peptide
mit hoher Affinität an die Nische des MHC-II gebunden werden. Nur dann hat der Peptid-MHC II-Komplex eine hohe Stabilität erlangt und wird an der Zellmembran CD4+-Lymphozyten präsentiert.
Abbildung) wird CLIP gegen ein antigenes Peptid
ausgetauscht. Das DM-Molekül stellt sicher, dass nur Peptide
mit hoher Affinität an die Nische des MHC-II gebunden werden. Nur dann hat der Peptid-MHC II-Komplex eine hohe Stabilität erlangt und wird an der Zellmembran CD4+-Lymphozyten präsentiert. 
 Abbildung: MHC-II-Weg der Verarbeitung und Präsentation exogener (endozytierter) Antigene
Abbildung: MHC-II-Weg der Verarbeitung und Präsentation exogener (endozytierter) Antigene
 MHC-II wird von Zellen erkannt (T-Helferzellen, Monozyten, Makrophagen), die über CD4-Rezeptoren verfügen. CD4 ist ein Corezeptor, der gemeinsam mit dem T-Zell-Rezeptor antigenbeladene MHC-II-Moleküle erkennt (Anfangsphase des MHC-II-Erkennungsvorgangs).
MHC-II wird von Zellen erkannt (T-Helferzellen, Monozyten, Makrophagen), die über CD4-Rezeptoren verfügen. CD4 ist ein Corezeptor, der gemeinsam mit dem T-Zell-Rezeptor antigenbeladene MHC-II-Moleküle erkennt (Anfangsphase des MHC-II-Erkennungsvorgangs). Corezeptoren
befinden sich in der Membran von Lymphozyten und binden an Antigen
- gemeinsam mit Immunglobulin (B-Zelle) oder dem T-Zell-Rezeptor (TCR).
Dadurch optimieren sie die Aktivierung des Lymphozyten. T-Zellen haben
CD4 oder CD8 als Corezeptoren, sie binden an nicht-polymorphe Teile des
MHC-Moleküls (an polymorphe bindet der TCR); CR2 auf B-Zellen bindet
komplementbedeckte Antigene (das Immunglobulin koppelt an einen anderen
Teil des Anigens).
Corezeptoren
befinden sich in der Membran von Lymphozyten und binden an Antigen
- gemeinsam mit Immunglobulin (B-Zelle) oder dem T-Zell-Rezeptor (TCR).
Dadurch optimieren sie die Aktivierung des Lymphozyten. T-Zellen haben
CD4 oder CD8 als Corezeptoren, sie binden an nicht-polymorphe Teile des
MHC-Moleküls (an polymorphe bindet der TCR); CR2 auf B-Zellen bindet
komplementbedeckte Antigene (das Immunglobulin koppelt an einen anderen
Teil des Anigens). Die MHC-Restriktion
garantiert, dass T-Zellen nicht auf freie (gelöste), sondern nur auf
zell-assoziierte Antigene ansprechen. MHC-Moleküle können nur innerhalb
von Zellen synthetisiert und mit Antigenpeptiden beladen werden.
Die MHC-Restriktion
garantiert, dass T-Zellen nicht auf freie (gelöste), sondern nur auf
zell-assoziierte Antigene ansprechen. MHC-Moleküle können nur innerhalb
von Zellen synthetisiert und mit Antigenpeptiden beladen werden. 
 Abbildung: Präsentation mikrobieller Antigene im Vergleich
Abbildung: Präsentation mikrobieller Antigene im Vergleich
 Indem der MHC-I- und MHC-II-Mechanismus in der Zelle funktionell
separiert sind, kann das Immunsystem unterschiedlich auf intrazelluläre
und extrazelluläre Antigene reagieren (
Indem der MHC-I- und MHC-II-Mechanismus in der Zelle funktionell
separiert sind, kann das Immunsystem unterschiedlich auf intrazelluläre
und extrazelluläre Antigene reagieren ( Abbildung).
Werden CD8-positive Lymphozyten (über MHC-I-Peptid-Komplexe) aktiviert,
können mikrobeninfizierte oder auch Tumorzellen abgetötet werden - das
gilt für alle kernhaltigen Zellen. Andererseits können Makrophagen
Bakterien, Pilze und auch Viren aus dem Extrazellulärraum aufnehmen und
ihre Antigene über MHC-II-Moleküle an CD4-positive Lymphozyten
präsentieren - und diese helfen den Makrophagen, aufgenommene Mikroben
zu zerstören. Diese "Helferzellen" können auch B-Lymphozyten anregen,
via Antikörper spezifisch extrazelluläre Mikroben anzugreifen.
Abbildung).
Werden CD8-positive Lymphozyten (über MHC-I-Peptid-Komplexe) aktiviert,
können mikrobeninfizierte oder auch Tumorzellen abgetötet werden - das
gilt für alle kernhaltigen Zellen. Andererseits können Makrophagen
Bakterien, Pilze und auch Viren aus dem Extrazellulärraum aufnehmen und
ihre Antigene über MHC-II-Moleküle an CD4-positive Lymphozyten
präsentieren - und diese helfen den Makrophagen, aufgenommene Mikroben
zu zerstören. Diese "Helferzellen" können auch B-Lymphozyten anregen,
via Antikörper spezifisch extrazelluläre Mikroben anzugreifen. 
 Abbildung: Charakteristika der Peptidbindung an MHC-Moleküle
Abbildung: Charakteristika der Peptidbindung an MHC-Moleküle MHC-Moleküle binden / präsentieren hauptsächlich Peptide. Daher
erkennen CD4+ / CD8+ Lymphozyten hauptsächlich Peptidantigene.
MHC-Moleküle binden / präsentieren hauptsächlich Peptide. Daher
erkennen CD4+ / CD8+ Lymphozyten hauptsächlich Peptidantigene. Jedes
MHC-Molekül kann viele verschiedene Peptide präsentieren, aber nur
jeweils eines zu einem gegebenen Zeitpunkt (gegenseitige Verdrängung
der Peptide von der Bindungsstelle). Die Bindung erfolgt über eine oder
zwei Seitenketten des Peptids.
Jedes
MHC-Molekül kann viele verschiedene Peptide präsentieren, aber nur
jeweils eines zu einem gegebenen Zeitpunkt (gegenseitige Verdrängung
der Peptide von der Bindungsstelle). Die Bindung erfolgt über eine oder
zwei Seitenketten des Peptids.  Der
Präsentationsmechanismus erklärt, warum Lymphozyten nicht freie,
sondern zellassoziierte Antigene erkennen und nur auf deren Anwesenheit
reagieren.
Der
Präsentationsmechanismus erklärt, warum Lymphozyten nicht freie,
sondern zellassoziierte Antigene erkennen und nur auf deren Anwesenheit
reagieren. Nur
peptidbeladene MHC-Moleküle sind für mehrere Tage stabil (freie werden
rasch abgebaut) und in der Lage, Immunantworten zu stimulieren.
Nur
peptidbeladene MHC-Moleküle sind für mehrere Tage stabil (freie werden
rasch abgebaut) und in der Lage, Immunantworten zu stimulieren. Lymphozyten,
die Selbst-Antigene (Peptidbruchstücke aus eigenen Proteinen) erkennen,
werden schon im Vorfeld ausgesondert (Auslase im Thymus).
Lymphozyten,
die Selbst-Antigene (Peptidbruchstücke aus eigenen Proteinen) erkennen,
werden schon im Vorfeld ausgesondert (Auslase im Thymus).
 Peptide, die stark an MHC-Moleküle binden, stellen immundominante Antigene dar. Das entsprechende Muster variiert von Mensch zu Mensch - wegen des ausgeprägten Polymorphismus von MHC in der Bevölkerung.
Peptide, die stark an MHC-Moleküle binden, stellen immundominante Antigene dar. Das entsprechende Muster variiert von Mensch zu Mensch - wegen des ausgeprägten Polymorphismus von MHC in der Bevölkerung.  Antigene müssen an MHC-IMoleküle gekoppelt sein
Antigene müssen an MHC-IMoleküle gekoppelt sein Sie werden von antigenpräsentierenden
Zellen “vorgezeigt”
Sie werden von antigenpräsentierenden
Zellen “vorgezeigt” Eine "Passung" entsprechender CD-Corezeptoren ist gegeben
Eine "Passung" entsprechender CD-Corezeptoren ist gegeben T-Zell-Rezeptoren sind vorhanden, die auf die entsprechende Peptid-MHC-Kombination passen
T-Zell-Rezeptoren sind vorhanden, die auf die entsprechende Peptid-MHC-Kombination passen  Eine bestimmte T-Zelle erkennt - mittels ihrer T-Zell-Rezeptoren - nur eine bestimmte chemische Struktur
(Schlüssel-Schloss-Prinzip). In jedem Organismus gibt es eine Unzahl von
T-Zellen mit verschiedensten Rezeptoren, davon verfügen (vielleicht)
einige über passende Rezeptoren. Es kann Tage dauern, bis die
“richtigen” T-Lymphozyten durch Phagozytose und Peptid-Präsentation
aktiviert worden sind.
Eine bestimmte T-Zelle erkennt - mittels ihrer T-Zell-Rezeptoren - nur eine bestimmte chemische Struktur
(Schlüssel-Schloss-Prinzip). In jedem Organismus gibt es eine Unzahl von
T-Zellen mit verschiedensten Rezeptoren, davon verfügen (vielleicht)
einige über passende Rezeptoren. Es kann Tage dauern, bis die
“richtigen” T-Lymphozyten durch Phagozytose und Peptid-Präsentation
aktiviert worden sind.  s. dort).
s. dort).

 T-Zellen erkennen mit ihren Rezeptoren Infektionen durch intrazelluläre
Mikroben oder Abweichungen vom normalen Proteinstoffwechsel anhand von
Peptiden, die ihnen von einer antigenpräsentierenden Zelle über
MHC-Proteine vorgezeigt werden. Sie aktivieren darauf hin andere
Immunzellen (Makrophagen, B-Lymphozyten), um die betreffende Zelle
auszuschalten. T-Zellen erkennen nur MHC-gebundene (keine freien)
Antigene
T-Zellen erkennen mit ihren Rezeptoren Infektionen durch intrazelluläre
Mikroben oder Abweichungen vom normalen Proteinstoffwechsel anhand von
Peptiden, die ihnen von einer antigenpräsentierenden Zelle über
MHC-Proteine vorgezeigt werden. Sie aktivieren darauf hin andere
Immunzellen (Makrophagen, B-Lymphozyten), um die betreffende Zelle
auszuschalten. T-Zellen erkennen nur MHC-gebundene (keine freien)
Antigene Spezielle antigenpräsentierende Zellen nehmen im Gewebe mikrobielle
Antigene auf und präsentieren Peptidbruchstücke naiven T-Lymphozyten.
Bei Passung der Moleküle teilen
sich diese, ein selektionierter Lymphozytenklon entsteht, der innerhalb
einiger Tage effiziente spezifische Abwehr gegen das
betreffende Antigen aufbaut
Spezielle antigenpräsentierende Zellen nehmen im Gewebe mikrobielle
Antigene auf und präsentieren Peptidbruchstücke naiven T-Lymphozyten.
Bei Passung der Moleküle teilen
sich diese, ein selektionierter Lymphozytenklon entsteht, der innerhalb
einiger Tage effiziente spezifische Abwehr gegen das
betreffende Antigen aufbaut Zytokine aktivieren Transkriptionsfaktoren an entsprechenden DNA-Sequenzen in der Promotorregion von MHC-Genen und regen so die Expression
von MHC-Molekülen an. MHC I-Moleküle präsentieren Peptide
zytoplasmatischen Ursprungs und kommen in der Membran aller
kernhaltigen Zellen vor (nicht in Erythrozyten), MHC II präsentieren
Peptide lysosomalen Ursprungs auf antigenpräsentierenden Immunzellen
Zytokine aktivieren Transkriptionsfaktoren an entsprechenden DNA-Sequenzen in der Promotorregion von MHC-Genen und regen so die Expression
von MHC-Molekülen an. MHC I-Moleküle präsentieren Peptide
zytoplasmatischen Ursprungs und kommen in der Membran aller
kernhaltigen Zellen vor (nicht in Erythrozyten), MHC II präsentieren
Peptide lysosomalen Ursprungs auf antigenpräsentierenden Immunzellen MHC zeigen mikrobielle Antigene zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene) her. Die spezifische Erkennung
erfordert auf beiden Seiten Hilfsmoleküle: MHC-Moleküle auf der
präsentierenden Zelle, T-Zell-Rezeptoren auf dem Lymphozyten,
CD-Moleküle auf beiden Zellen
MHC zeigen mikrobielle Antigene zytotoxischen (CD8+: Abtötung befallener Zellen) oder Helferzellen (CD4+:
Abwehr extrazellulärer Antigene) her. Die spezifische Erkennung
erfordert auf beiden Seiten Hilfsmoleküle: MHC-Moleküle auf der
präsentierenden Zelle, T-Zell-Rezeptoren auf dem Lymphozyten,
CD-Moleküle auf beiden Zellen Ubiquitine binden reversibel an Zielproteine, um diese zu überprüfen:
Richtig strukturierte gelangen an ihren Zielort, fehlerhaft gefaltete
werden durch Proteasomen abgebaut. Freie MHC-I-Moleküle sind instabil
und werden rasch durch Proteasomen abgebaut, peptidbeladene sind stabil
und gelangen an die Zelloberfläche zur Präsentation an CD8+-zytotoxische Lymphozyten
Ubiquitine binden reversibel an Zielproteine, um diese zu überprüfen:
Richtig strukturierte gelangen an ihren Zielort, fehlerhaft gefaltete
werden durch Proteasomen abgebaut. Freie MHC-I-Moleküle sind instabil
und werden rasch durch Proteasomen abgebaut, peptidbeladene sind stabil
und gelangen an die Zelloberfläche zur Präsentation an CD8+-zytotoxische Lymphozyten MHC-II-Moleküle auf dendritischen Zellen, Makrophagen, Monozyten und
B-Lymphozyten, die Mikroben bzw. Antigene binden ("professionelle"
Antigenpräsentierer), zeigen CD4-positiven T-Helferzellen Antigene aus
ihrer (extrazellulären) Umgebung. Antigene werden nur in Kombination
mit dem eigenen MHC-Komplex erkannt (MHC-Restriktion). Aktivierte
Helferzellen wirken dann in vielfacher Weise regulierend auf weitere
Immunprozesse ein
MHC-II-Moleküle auf dendritischen Zellen, Makrophagen, Monozyten und
B-Lymphozyten, die Mikroben bzw. Antigene binden ("professionelle"
Antigenpräsentierer), zeigen CD4-positiven T-Helferzellen Antigene aus
ihrer (extrazellulären) Umgebung. Antigene werden nur in Kombination
mit dem eigenen MHC-Komplex erkannt (MHC-Restriktion). Aktivierte
Helferzellen wirken dann in vielfacher Weise regulierend auf weitere
Immunprozesse ein