



 Chemotaxis: χυμεια = Chemie, τάξις = Ordnung, Aufmarsch
Chemotaxis: χυμεια = Chemie, τάξις = Ordnung, Aufmarsch| Angeborene Abwehrmechanismen sind schon Minuten nach Eintritt eines Pathogens verfügbar: Sie töten einerseits Mikroben durch Phagozyten (Entzündung), andererseits wehren sie Viren ab - durch dendritische Zellen sowie natürliche Killerzellen. Sie kommen ohne "spezifische" (adaptive) Komponenten
aus, bedürfen keiner Lernphase und wirken unmittelbar nach dem
Eindringen von Fremdorganismen in das Innere des Organismus. Erkennen Zellen Moleküle, die typisch für Pathogene (aber untypisch für körpereigene Zellen) sind, sezernieren sie Zytokine - einige haben Alarmfunktion, andere können die Replikation von Viren verhindern (Interferone). Primäre lymphatische Organe dienen dem Nachschub von Granulozyten (Knochenmark) und Lymphozyten (Thymus); sekundäre haben spezielle Aufgaben an strategisch exponierten Stellen (Lymphknoten, Milz, lymphatische Gewebe in Nasen-Rachen-Raum und Darm). Die angeborene Immunität verfügt über mehrere Komponenten:  -- Haut und Schleimhäute als erste Barriere (zusammen mit Begleitstoffen, wie Surfactant, Defensine, Lactoferrin, Lysozyme) -- Phagozyten (Granulozyten, Monozyten, Makrophagen) -- Dendritische Zellen -- Natürliche Killerzellen -- Plasmaeiweiße, insbesondere im Komplementsystem. Das Komplementsystem - etwa 20 Plasmaproteine, die vorwiegend als inaktive Vorstufe vorliegen - ist ein Hilfsmechanismus, der sowohl die angeborene als auch die adaptive Abwehr unterstützt (daher der Name) und auf verschiedenen Wegen aktiviert werden kann (alternativer, klassischer und Lektin-Weg). |
 Lymphatische Organe, primäre vs. sekundäre Abwehr
Lymphatische Organe, primäre vs. sekundäre Abwehr  Schutzfaktoren
Schutzfaktoren  Phagozyten und ihre Rezeptoren
Phagozyten und ihre Rezeptoren  Opsonisierung
Opsonisierung
 Monozyten, Makrophagen, Granulozyten
Monozyten, Makrophagen, Granulozyten  Spezielle Immunzellen
Spezielle Immunzellen  Lösliche Effektormoleküle
Lösliche Effektormoleküle  Entzündung und Virenschutz
Entzündung und Virenschutz  Begrenzung angeborener Immunantworten
Begrenzung angeborener Immunantworten

 Makropinozytose
Makropinozytose  Opsonisierung
Opsonisierung  NK-Zelle
NK-Zelle  KIRs
KIRs
 Core messages
Core messages in den Körper
eingedrungene Pathogene
abtöten,
in den Körper
eingedrungene Pathogene
abtöten,  die Aufnahme der Reste durch Phagozyten anregen,
die Aufnahme der Reste durch Phagozyten anregen, Entzündung
(inflammation)
auslösen, die zur Infektionsbekämpfung und
Gewebereparatur beiträgt,
Entzündung
(inflammation)
auslösen, die zur Infektionsbekämpfung und
Gewebereparatur beiträgt, Reparaturen an geschädigtem Gewebe vornehmen.
Reparaturen an geschädigtem Gewebe vornehmen. Abbildung).
Abbildung).
 Abbildung: Vergleich angeborenes - adaptives Immunsystem
Abbildung: Vergleich angeborenes - adaptives Immunsystem
 Das
angeborene Immunsystem unterhält antimikrobielle (physische und
chemische) Abwehrstrategien an epithelialen Barrieren (Haut,
Schleimhäute).
Das
angeborene Immunsystem unterhält antimikrobielle (physische und
chemische) Abwehrstrategien an epithelialen Barrieren (Haut,
Schleimhäute). Hier
erfolgen frühe präventive (hemmende antimikrobielle) und
eliminatorische Abwehrschritte sowie Reparatur beschädigten Gewebes.
Hier
erfolgen frühe präventive (hemmende antimikrobielle) und
eliminatorische Abwehrschritte sowie Reparatur beschädigten Gewebes. Das
angeborene Immunsystem regt die adaptive ("spezifische") Abwehr an,
beeinflusst deren Strategie und steigert ihre Wirksamkeit (Kooperation).
Das
angeborene Immunsystem regt die adaptive ("spezifische") Abwehr an,
beeinflusst deren Strategie und steigert ihre Wirksamkeit (Kooperation). Die wichtigsten Schutzmechanismen des angeborenen Systems sind Entzündung (Zusammenwirken von aktivierten Leukozyten und Plasmaproteinen an Stellen von Infektion und Gewebeschädigung) und antivirale Abwehr (Abtötung virusinfizierter Zellen durch natürliche Killerzellen, Blockade intrazellulärer Virusreplikation durch Interferone).
Die wichtigsten Schutzmechanismen des angeborenen Systems sind Entzündung (Zusammenwirken von aktivierten Leukozyten und Plasmaproteinen an Stellen von Infektion und Gewebeschädigung) und antivirale Abwehr (Abtötung virusinfizierter Zellen durch natürliche Killerzellen, Blockade intrazellulärer Virusreplikation durch Interferone). Epitheliale Barrieren, die den Übertritt von Mikroorganismen in den Körper verhindern (inklusive deren Begleitstoffe, wie das Surfactant
in der Lunge): Haut, gastrointestinales System, Respirationstrakt,
Urogenitaltrakt u.a. Epithelien können Mikroben über lokal
synthetisierte antimikrobielle Stoffe (z.B. Defensine, Cathelicidine) abtöten, und auch mikrobiell infizierte Zellen mittels intraepithelialer Lymphozyten.
Epitheliale Barrieren, die den Übertritt von Mikroorganismen in den Körper verhindern (inklusive deren Begleitstoffe, wie das Surfactant
in der Lunge): Haut, gastrointestinales System, Respirationstrakt,
Urogenitaltrakt u.a. Epithelien können Mikroben über lokal
synthetisierte antimikrobielle Stoffe (z.B. Defensine, Cathelicidine) abtöten, und auch mikrobiell infizierte Zellen mittels intraepithelialer Lymphozyten. Phagozyten
(vor allem neutrophile Granulozyten und Makrophagen) nehmen Reste
abgestorbener Zellen sowie von extrazellulärer Matrix auf. Sie können
rasch an
jeden beliebigen Entzündungsort rekrutiert werden und ermöglichen frühe Erkennung und Bekämpfung von Infektionserregern (lysosomale Verdauung, Sekretion toxischer Substanzen, Bildung von Zytokinen).
Phagozyten
(vor allem neutrophile Granulozyten und Makrophagen) nehmen Reste
abgestorbener Zellen sowie von extrazellulärer Matrix auf. Sie können
rasch an
jeden beliebigen Entzündungsort rekrutiert werden und ermöglichen frühe Erkennung und Bekämpfung von Infektionserregern (lysosomale Verdauung, Sekretion toxischer Substanzen, Bildung von Zytokinen).  Im Gewebe angesiedelte lymphoide Zellen (innate lymphoid cells ILCs) - ähnlich wie T-Helferzellen produzieren sie Zytokine, haben aber keine antigenspezifischen Rezeptoren.
Im Gewebe angesiedelte lymphoide Zellen (innate lymphoid cells ILCs) - ähnlich wie T-Helferzellen produzieren sie Zytokine, haben aber keine antigenspezifischen Rezeptoren.
 Abbildung: Angeborene und adaptive Abwehr
Abbildung: Angeborene und adaptive Abwehr
 Polymorphkernige Leukozyten sind im
gesunden Gewebe kaum vorhanden, Infektionen regen ihre Bildung im
Knochenmark an. Neutrophile Granulozyten reichern sich in betreffenden
Geweben an und bekämpfen Pathogene mit Sauerstoffradikalen und Toxinen,
und sie bilden NETs (neutrophil extracellular traps),
in denen Mikroorganismen fixiert und z.T. abgetötet werden. Eosinophile
und basophile Granulozyten sezernieren Toxine, Eosinophile sind gegen
große Parasiten (z.B. Würmer) besonders wirksam.
Polymorphkernige Leukozyten sind im
gesunden Gewebe kaum vorhanden, Infektionen regen ihre Bildung im
Knochenmark an. Neutrophile Granulozyten reichern sich in betreffenden
Geweben an und bekämpfen Pathogene mit Sauerstoffradikalen und Toxinen,
und sie bilden NETs (neutrophil extracellular traps),
in denen Mikroorganismen fixiert und z.T. abgetötet werden. Eosinophile
und basophile Granulozyten sezernieren Toxine, Eosinophile sind gegen
große Parasiten (z.B. Würmer) besonders wirksam. Monozyten - Makrophagen-Vorläufer - befinden sich für kurze Zeit im Blut, bevor sie in das Gewebe auswandern und zu Makrophagen werden. Es gibt gewebespezifische Formen, wie Alveolarmakrophagen in der Lunge, Osteoklasten im Knochen, Kupffer'sche Sternzellen in der Leber oder Mikroglia im Gehirn. Mastzellen
- vor allem in Haut und Schleimhäuten - speichern Granula und können
diese innerhalb von Sekunden freisetzen. Sie sezernieren auch Zytokine.
Monozyten - Makrophagen-Vorläufer - befinden sich für kurze Zeit im Blut, bevor sie in das Gewebe auswandern und zu Makrophagen werden. Es gibt gewebespezifische Formen, wie Alveolarmakrophagen in der Lunge, Osteoklasten im Knochen, Kupffer'sche Sternzellen in der Leber oder Mikroglia im Gehirn. Mastzellen
- vor allem in Haut und Schleimhäuten - speichern Granula und können
diese innerhalb von Sekunden freisetzen. Sie sezernieren auch Zytokine. Dendritische Zellen
Dendritische Zellen  sind nach ihrer Form
(zahlreiche antennenartige Verästelungen des Zellkörpers, mit denen sie
ihre Umgebung überprüfen) benannt. Unreife dendritische Zellen sind wie Wächter strategisch
über die Gewebe verteilt. Sie fangen Antigene ein und präsentieren Fragmente davon an T-Zellen. Sie exprimieren PRRs (pattern recognition receptors), z.B. TLRs oder Lectinrezeptoren, mit denen sie - wie andere Phagozyten und auch Epithelzellen - PAMPs (pathogen-associated molecular patterns) erkennen und binden. Sind Mikroben anwesend, produzieren dendritische Zellen zahlreiche Zytokine. Damit regen sie entzündliche Vorgänge und adaptive Reaktionen an. Orten dendritische Zellen antigene Reize, reifen sie,
verlassen das Gewebe über Lymphbahnen und betreten (periphere)
Lymphknoten. Hier teilen sie T- und B-Lymphozyten mit passenden
Rezeptoren den Immunreiz mit, worauf hin diese über den Kreislauf zum
Ort antigener Reizung wandern.
sind nach ihrer Form
(zahlreiche antennenartige Verästelungen des Zellkörpers, mit denen sie
ihre Umgebung überprüfen) benannt. Unreife dendritische Zellen sind wie Wächter strategisch
über die Gewebe verteilt. Sie fangen Antigene ein und präsentieren Fragmente davon an T-Zellen. Sie exprimieren PRRs (pattern recognition receptors), z.B. TLRs oder Lectinrezeptoren, mit denen sie - wie andere Phagozyten und auch Epithelzellen - PAMPs (pathogen-associated molecular patterns) erkennen und binden. Sind Mikroben anwesend, produzieren dendritische Zellen zahlreiche Zytokine. Damit regen sie entzündliche Vorgänge und adaptive Reaktionen an. Orten dendritische Zellen antigene Reize, reifen sie,
verlassen das Gewebe über Lymphbahnen und betreten (periphere)
Lymphknoten. Hier teilen sie T- und B-Lymphozyten mit passenden
Rezeptoren den Immunreiz mit, worauf hin diese über den Kreislauf zum
Ort antigener Reizung wandern. Naive Lymphozyten sind (nach ihrer "Thymusprüfung"
immunkompetente) T- oder B-Zellen , die noch keinen Kontakt mit "ihrem"
Antigen hatten. Treffen sie auf ein passendes Antigen, entwickeln sie
sich zu Effektorzellen.
Naive Lymphozyten sind (nach ihrer "Thymusprüfung"
immunkompetente) T- oder B-Zellen , die noch keinen Kontakt mit "ihrem"
Antigen hatten. Treffen sie auf ein passendes Antigen, entwickeln sie
sich zu Effektorzellen. Natürliche Killerzellen schützen unmittelbar vor Viren und intrazellulären Bakterien.
Natürliche Killerzellen schützen unmittelbar vor Viren und intrazellulären Bakterien. Verschiedene Plasmaeiweisse, vor allem des Komplementsystems, erfüllen "unspezifische" Abwehrmechanismen.
Verschiedene Plasmaeiweisse, vor allem des Komplementsystems, erfüllen "unspezifische" Abwehrmechanismen. Thrombozyten nehmen Bakterien auf und bilden Mikroben inaktivierende Stoffe. Sie haben so direkte antimikrobielle Wirkung.
Thrombozyten nehmen Bakterien auf und bilden Mikroben inaktivierende Stoffe. Sie haben so direkte antimikrobielle Wirkung. Virusabwehr durch dendritische Zellen und natürliche Killerzellen,
Virusabwehr durch dendritische Zellen und natürliche Killerzellen,  Entzündung
(=Rekrutierung von Leukozyten und Plasmaproteinen an infizierten /
beschädigten Orten) zwecks Abtötung von Mikroben durch phagozytäre
Leukozyten.
Entzündung
(=Rekrutierung von Leukozyten und Plasmaproteinen an infizierten /
beschädigten Orten) zwecks Abtötung von Mikroben durch phagozytäre
Leukozyten. Primäre lymphatische Organe beinhalten die Vorläuferzellen, aus denen Immunzellen nachgebildet werden (Knochenmark nach der Geburt).
Primäre lymphatische Organe beinhalten die Vorläuferzellen, aus denen Immunzellen nachgebildet werden (Knochenmark nach der Geburt). Sekundäre lymphatische
Gewebe und Organe sind an strategisch wichtigen Stellen postiert:
Sekundäre lymphatische
Gewebe und Organe sind an strategisch wichtigen Stellen postiert:  Blut: Milz
Blut: Milz Nasen-Rachen-Raum: Lymphatischer Rachenring
Nasen-Rachen-Raum: Lymphatischer Rachenring
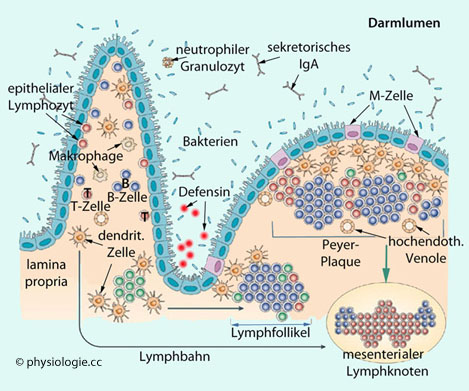
 Verdauungssystem: Peyer´sche Plaques
Verdauungssystem: Peyer´sche Plaques  im Dünndarm,
Appendix
im Dünndarm,
Appendix Haut, Schleimhäute, Organe: Lymphknoten
Haut, Schleimhäute, Organe: Lymphknoten| Angeborene vs. erworbene Immunität |
||
| Charakteristikum |
angeboren |
erworben |
| Spezifität |
gering |
hoch |
| Gedächtnis |
keines |
ja |
| humorale Mediatoren |
* Komplement * Zytokine * Antimikrobielle Peptide (Defensine, Lysozym) * Akutphasen- proteine (z.B. CRP) |
* Immunglobuline (Antikörper) * Zytokine |
| zelluläre Mediatoren |
* Granulozyten * Makrophagen / Monozyten * NK-Zellen * Dendritische Zellen |
* T-Lymphozyten (zelluläre Immunität): Zytotoxische (TC), Helfer- (TH) * B-Lymphozyten / Plasmazellen (Antikörper- produktion) |
| Erkennungs- Rezeptoren |
* Pattern Recognition Receptors (PRR) |
* T-Zell-Rezeptoren (TCR) * B-Zell-Rezeptoren (BCR = membran- ständige Antikörper) |
| Kinetik |
sofort bis 3 Tage |
mehr als 3 Tage |
 Cathelicidine
Cathelicidine  Lysozyme
Lysozyme  Lactoferrin
Lactoferrin  Antivirale Proteine
Antivirale Proteine  Proteolytische Enzyme
Proteolytische Enzyme  Oxidativer Burst
Oxidativer Burst  NETs
NETs (
( Abbildung) - α und β - sind kleine (29-34 Aminosäuren),
cysteinreiche (positiv geladene), amphipathische antimikrobielle Proteine. Sie werden von Epithelien auf der Haut und mukösen Oberflächen (Darm, Lunge...) sowie Granulozyten,
NK-Zellen und zytotoxischen T-Zellen
gebildet, insbesondere bei Anregung durch Zytokine und mikrobielle
Produkte (u.a. über Toll-like Rezeptoren) - der Defensin-Plasmaspiegel steigt bei Entzündungen an.
Abbildung) - α und β - sind kleine (29-34 Aminosäuren),
cysteinreiche (positiv geladene), amphipathische antimikrobielle Proteine. Sie werden von Epithelien auf der Haut und mukösen Oberflächen (Darm, Lunge...) sowie Granulozyten,
NK-Zellen und zytotoxischen T-Zellen
gebildet, insbesondere bei Anregung durch Zytokine und mikrobielle
Produkte (u.a. über Toll-like Rezeptoren) - der Defensin-Plasmaspiegel steigt bei Entzündungen an.
 Näherers s. dort
Näherers s. dort 
 (vom c-Typ, nach conventional oder chicken- type)
befinden sich in
praktisch allen Sekreten und Körperflüssigkeiten (Blutserum,
Tränenflüssigkeit, Speichel, Atemtrakt, Zerebrospinalflüssigkeit,
Zervixschleim, Fruchtwasser, Milch) und werden von
verschiedenen Zellen (Schleimhaut- und Tubulusepithel, Leukozyten u.a.)
gebildet.
Die Peptidoglycanzellwand gram-positiver Bakterien wird durch Lysozym direkt angegriffen,
diejenige gram-negativer Bakterien wird für den Angriff durch Lysozyme
durch Faktoren wie Lactoferrin und Defensine vorbereitet.
(vom c-Typ, nach conventional oder chicken- type)
befinden sich in
praktisch allen Sekreten und Körperflüssigkeiten (Blutserum,
Tränenflüssigkeit, Speichel, Atemtrakt, Zerebrospinalflüssigkeit,
Zervixschleim, Fruchtwasser, Milch) und werden von
verschiedenen Zellen (Schleimhaut- und Tubulusepithel, Leukozyten u.a.)
gebildet.
Die Peptidoglycanzellwand gram-positiver Bakterien wird durch Lysozym direkt angegriffen,
diejenige gram-negativer Bakterien wird für den Angriff durch Lysozyme
durch Faktoren wie Lactoferrin und Defensine vorbereitet. Mittels
Röntgenstrukturanalyse (Röntgenkristallographie) lässt sich der
dreidimensionale Aufbau u.a. von Proteinmolekülen aufklären. Lysozym
war das erste Enzym, bei dem dies gelang (1965, David C. Phillips)
Mittels
Röntgenstrukturanalyse (Röntgenkristallographie) lässt sich der
dreidimensionale Aufbau u.a. von Proteinmolekülen aufklären. Lysozym
war das erste Enzym, bei dem dies gelang (1965, David C. Phillips) ist
sowohl antiviral als auch antimikrobiell aktiv. Es entzieht
Mikroorganismen, die phagozytiert wurden, Eisen, das für deren
Metabolismus lebensnotwendig ist (Lactoferrin ist normalerweise nur zu
<20% mit Eisen gesättigt). Auch hat es Proteaseaktivität und kann
bakterielle Eiweiße abbauen. Darüber hinaus wirkt es auf Lymphozyten
wachstumsfördernd.
ist
sowohl antiviral als auch antimikrobiell aktiv. Es entzieht
Mikroorganismen, die phagozytiert wurden, Eisen, das für deren
Metabolismus lebensnotwendig ist (Lactoferrin ist normalerweise nur zu
<20% mit Eisen gesättigt). Auch hat es Proteaseaktivität und kann
bakterielle Eiweiße abbauen. Darüber hinaus wirkt es auf Lymphozyten
wachstumsfördernd.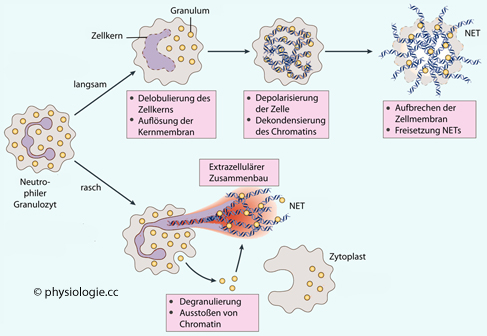
 Abbildung: Freisetzung von NETs
Abbildung: Freisetzung von NETs
 Über Immunrezeptoren s. auch dort
Über Immunrezeptoren s. auch dort Monozyten
Monozyten  Makrophagen
Makrophagen  Osteoklasten
Osteoklasten  Dendritische Zellen
Dendritische Zellen NOD-like Rezeptoren
NOD-like Rezeptoren  Fc-Rezeptoren
Fc-Rezeptoren  Komplementrezeptoren
Komplementrezeptoren haben die Aufgabe, Mikroben aufzunehmen und zu zerstören, sowie
Produkte von Gewebeschäden wegzuräumen. Zu ihnen zählen neutrophile Granulozyten und Monozyten (die einzigen Phagozyten im Blutkreislauf) sowie Makrophagen, Osteoklasten und dendritische Zellen, die man nur im Gewebe findet. Einkernige Phagozyten werden als mononuclear phagocytes bezeichnet.
haben die Aufgabe, Mikroben aufzunehmen und zu zerstören, sowie
Produkte von Gewebeschäden wegzuräumen. Zu ihnen zählen neutrophile Granulozyten und Monozyten (die einzigen Phagozyten im Blutkreislauf) sowie Makrophagen, Osteoklasten und dendritische Zellen, die man nur im Gewebe findet. Einkernige Phagozyten werden als mononuclear phagocytes bezeichnet.| Charakteristika intravaskulär zirkulierender Phagozyten Nach Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024 |
||
| Komponente / Eigenschaft |
Neutrophile Granulozyten |
Monozyten |
| Herkunft (s. Abbildung) |
Hämatopoetische Stammzellen im roten Knochenmark |
Knochenmark (Entzündungen) Dottersack, fetale Leber (Gewebemakrophagen) |
| Lebensspanne im Gewebe |
1-2 Tage |
Entzündungen: Tage bis Wochen Gewebe: Jahre |
| Reaktionen auf Aktivierung |
Rasch, kurz Enzymatische Aktivität |
Andauernd, langsamer, oft abhängig von Transkription neuer Gene |
| NO (Stickstoffmonoxid) |
Gering bis gar nicht |
Induktion durch Transkription von iNOS |
| ROS (Sauerstoffradikale) |
Rasch durch Oxidase (respiratory burst) |
Weniger bedeutsam |
| Degranulierung | Durch Umstellung des Zytoskeletts | Kaum vorhanden |
| Zytokinproduktion |
Gering (pro Zelle) |
Umfangreich, Zytokingene werden transkribiert |
| Extrazelluläre "Fallen" (NETs) |
Rasch aufgebaut durch Extrusion von Kerninhalt |
Kaum |
 Abbildung) und so den Abbau des aufgenommenen Partikels einleiten.
Abbildung) und so den Abbau des aufgenommenen Partikels einleiten. 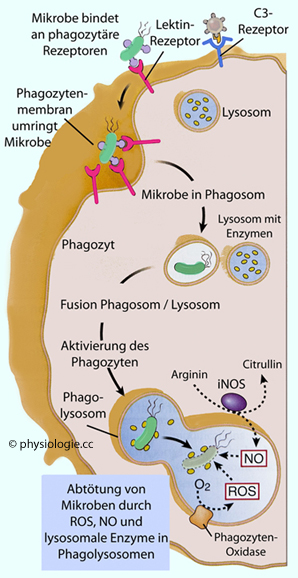
 Abbildung: Phagozytose und intrazelluläre Abtötung von Mikroben
Abbildung: Phagozytose und intrazelluläre Abtötung von Mikroben
 Immunologische Scavenger-Rezeptoren SR (scavenger (engl) = Aasfresser) sind als Mustererkennungsrezeptoren
in die - über PAMPs / DAMPs vermittelte - Clearance von
Lipopolysaccariden, Lipoproteinen, Phospholipiden, Cholesterinestern
und weiteren Stoffen involviert. Sie sind sehr divers, man
unterscheidet die Rezeptorklassen A bis L. Kupffer-Zellen in der Leber exprimieren besonders viele SR.
Immunologische Scavenger-Rezeptoren SR (scavenger (engl) = Aasfresser) sind als Mustererkennungsrezeptoren
in die - über PAMPs / DAMPs vermittelte - Clearance von
Lipopolysaccariden, Lipoproteinen, Phospholipiden, Cholesterinestern
und weiteren Stoffen involviert. Sie sind sehr divers, man
unterscheidet die Rezeptorklassen A bis L. Kupffer-Zellen in der Leber exprimieren besonders viele SR. Unter Makropinozytose versteht man clathrinunabhängige Endozytose, die Zellen durch Aktivierung membranständiger Rezeptoren in bestimmten Fällen (u.a. zur Aufnahme apoptotischer
Zellreste) und für definierte Transportgüter (z.B. Integrine,
Wachstumsfaktoren) vorübergehend nutzen. Die aufgenommenen Liganden
aktivieren komplexe intrazelluläre Mechanismen, inklusive die
aktinvermittelte Bildung zellulärer Ausstülpungen und vermehrte
Flüssigkeitsaufnahme der Zelle. Makropinozytose dient dem Abbau des
aufgenommenen Inhalts, Recycling findet nicht statt.
Unter Makropinozytose versteht man clathrinunabhängige Endozytose, die Zellen durch Aktivierung membranständiger Rezeptoren in bestimmten Fällen (u.a. zur Aufnahme apoptotischer
Zellreste) und für definierte Transportgüter (z.B. Integrine,
Wachstumsfaktoren) vorübergehend nutzen. Die aufgenommenen Liganden
aktivieren komplexe intrazelluläre Mechanismen, inklusive die
aktinvermittelte Bildung zellulärer Ausstülpungen und vermehrte
Flüssigkeitsaufnahme der Zelle. Makropinozytose dient dem Abbau des
aufgenommenen Inhalts, Recycling findet nicht statt.
 Abbildung: Rezeptoren auf Alveolarmakrophagen
Abbildung: Rezeptoren auf Alveolarmakrophagen R, Rezeptor
R, Rezeptor
 CD200R, Cell surface transmembrane glycoprotein CD200 receptor, reguliert die Expression entzündungsfördernder Stoffe
CD200R, Cell surface transmembrane glycoprotein CD200 receptor, reguliert die Expression entzündungsfördernder Stoffe
 SIRPα, signal-regulatory protein-α, ein regulatorisches Glykoprotein, dessen Aktivierung die Phagozytose hemmt
SIRPα, signal-regulatory protein-α, ein regulatorisches Glykoprotein, dessen Aktivierung die Phagozytose hemmt
 TREM2, triggering receptor expressed on myeloid cells,
wird von zahlreichen Zellen exprimiert (Makrophagen, Granulozyten,
dendritische Zellen, Mikrogila, Osteoklasten), bindet extrazellulär
Glykoproteine, Lipide, DNA u.a.; intrazellulär braucht es
Zusatzfaktoren, um wirksam zu werden
TREM2, triggering receptor expressed on myeloid cells,
wird von zahlreichen Zellen exprimiert (Makrophagen, Granulozyten,
dendritische Zellen, Mikrogila, Osteoklasten), bindet extrazellulär
Glykoproteine, Lipide, DNA u.a.; intrazellulär braucht es
Zusatzfaktoren, um wirksam zu werden
 Abbildung) binden an PAMPs und regen die Transkription von
Zytokingenen und anderer antimikrobieller Stoffe an. Das
fördert Entzündungsvorgänge und lockt Leukozyten zum "Kampfplatz"; TLRs
werden vor allem von strategisch positionierten "Melderzellen"
exprimiert, wie dendritischen Zellen, Makrophagen, Mastzellen,
Epithelzellen in der Darmschleimhaut (die auf Aktivierung ihrer TLRs
mit der Produktion von Zytokinen reagieren).
Abbildung) binden an PAMPs und regen die Transkription von
Zytokingenen und anderer antimikrobieller Stoffe an. Das
fördert Entzündungsvorgänge und lockt Leukozyten zum "Kampfplatz"; TLRs
werden vor allem von strategisch positionierten "Melderzellen"
exprimiert, wie dendritischen Zellen, Makrophagen, Mastzellen,
Epithelzellen in der Darmschleimhaut (die auf Aktivierung ihrer TLRs
mit der Produktion von Zytokinen reagieren). 
 Abbildung: Toll-like Rezeptoren (TLR)
Abbildung: Toll-like Rezeptoren (TLR) CpG, Dinkuleotid aus Cytosin bzw. Guanin
CpG, Dinkuleotid aus Cytosin bzw. Guanin  CREB, cAMP-responsives Element-Bindeprotein
CREB, cAMP-responsives Element-Bindeprotein  IKK, Inhibitor of nuclear factor kappa kinase, regulatorische Enzyme
IKK, Inhibitor of nuclear factor kappa kinase, regulatorische Enzyme  IL-1R, Interleukin-1-Rezeptor
IL-1R, Interleukin-1-Rezeptor  IRAK, Interleukin-1 receptor-associated kinases, Proteinkinasen
IRAK, Interleukin-1 receptor-associated kinases, Proteinkinasen  RF, Interferon regulatory factor, Proteine,welche die Transkription von Interferon regulieren
RF, Interferon regulatory factor, Proteine,welche die Transkription von Interferon regulieren  JNK, c-Jun N-terminale Kinasen, signalübermittelnde Proteine
JNK, c-Jun N-terminale Kinasen, signalübermittelnde Proteine  miRNA, Mikro-RNA, kurze, nichtkodierende RNA
miRNA, Mikro-RNA, kurze, nichtkodierende RNA  MKK, Mitogen-activated protein kinase kinase, phosphorylieren MAPK
MKK, Mitogen-activated protein kinase kinase, phosphorylieren MAPK  MyD88, Myeloid differentiation primary response 88, Signalprotein im Immunsystem
MyD88, Myeloid differentiation primary response 88, Signalprotein im Immunsystem  NF-κB, nuclear factor kappa-light-chain-enhancer of activated B cells, Transkriptionsfaktor
NF-κB, nuclear factor kappa-light-chain-enhancer of activated B cells, Transkriptionsfaktor  PI3K, Phosphoinositid-3-Kinase, signalübermittelndes Protein
PI3K, Phosphoinositid-3-Kinase, signalübermittelndes Protein  TRAF, TNF receptor associated factors, Signaltransduktionsproteine
TRAF, TNF receptor associated factors, Signaltransduktionsproteine  TRIF, TIR-domain-containing adapter-inducing interferon-β, Adapterprotein
TRIF, TIR-domain-containing adapter-inducing interferon-β, Adapterprotein

| Lage, Organisation und Funktion von Toll-Like Rezeptoren (TLR)  Nach Abbas / Lichtman / Pillai,Basic Immunology, 7th ed. 2024 |
|
| In der Zellmembran |
|
| TLR1-TLR2- Komplex |
bindet bakterielle Lipopeptide |
| TLR2 |
bindet bakterielle Peptidoglykane |
| TLR2-TLR6- Komplex |
bindet bakterielle Lipopeptide |
| TLR4 |
bindet Lipopolysaccharide |
| TLR5 |
bindet bakterielles Flagellin |
| In der Endosomenmembran |
|
| TLR3 |
bindet doppelsträngige RNA (dsRNA) |
| TLR7 |
bindet einzelsträngige RNA (ssRNA) |
| TLR8 |
bindet einzelsträngige RNA (ssRNA) |
| TLR9 |
bindet Cytosin-Guanin-reiche DNA (CpG DNA) |
 Abbildung).
Abbildung).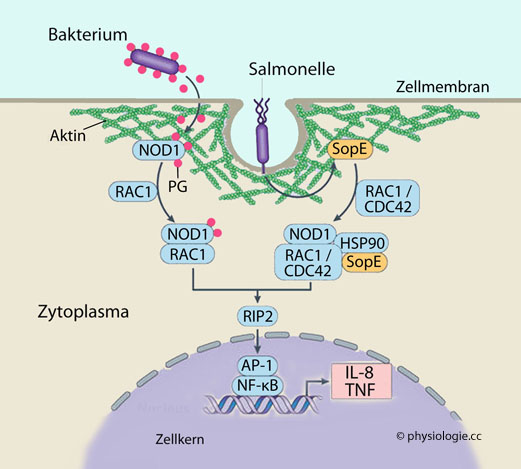
 Abbildung: Die Detektion eines bakteriellen Angriffs führt zur Bildung von Zytokinen
Abbildung: Die Detektion eines bakteriellen Angriffs führt zur Bildung von Zytokinen
 Abbildung), oder weil der Antikörper (vom Typ IgG, IgA oder
IgM) durch Bindung eines Komplementbruchstücks durch Konformationsänderung "scharf gemacht" worden ist.
Abbildung), oder weil der Antikörper (vom Typ IgG, IgA oder
IgM) durch Bindung eines Komplementbruchstücks durch Konformationsänderung "scharf gemacht" worden ist.
 Abbildung: Fc-Rezeptoren
Abbildung: Fc-Rezeptoren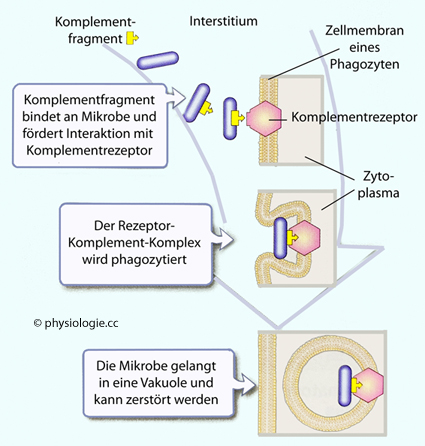
 Abbildung: Komplementrezeptoren
Abbildung: Komplementrezeptoren
 Abbildung),
Komplementfaktoren (z.B. C5a), mannosebindendes Lektin (MBL) oder
Surfactant-Protein. Dadurch
wird - neben der Exprimierung von pathogene Strukturen erkennenden
Rezeptoren (vor allem TLRs) auf Monozyten, Makrophagen und Granulozyten
- die Erkennung körperfremder Strukturen ermöglicht.
Abbildung),
Komplementfaktoren (z.B. C5a), mannosebindendes Lektin (MBL) oder
Surfactant-Protein. Dadurch
wird - neben der Exprimierung von pathogene Strukturen erkennenden
Rezeptoren (vor allem TLRs) auf Monozyten, Makrophagen und Granulozyten
- die Erkennung körperfremder Strukturen ermöglicht.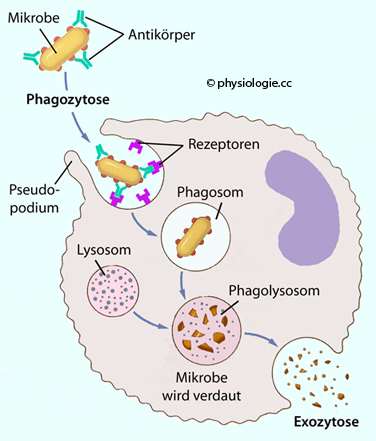
 Abbildung: Beispiel einer Opsonisierung
Abbildung: Beispiel einer Opsonisierung Opsonisierung ist
die Anlagerung von Opsoninen (z.B. Immunglobulinen,
Komplementfragmenten, MBL) an mikrobielle Oberflächen zwecks leichterer
Phagozytierbarkeit (
Opsonisierung ist
die Anlagerung von Opsoninen (z.B. Immunglobulinen,
Komplementfragmenten, MBL) an mikrobielle Oberflächen zwecks leichterer
Phagozytierbarkeit ( Abbildung). Opsonine sind Moleküle, die an mikrobielle Oberflächen angelagert werden und dadurch die Effizienz der Phagozytose erhöhen.
Abbildung). Opsonine sind Moleküle, die an mikrobielle Oberflächen angelagert werden und dadurch die Effizienz der Phagozytose erhöhen. Der russische Forscher Elias Metschnikow erhielt 1908 zusammen mit Paul Ehrlich
"in Anerkennung ihrer Arbeiten über die Immunität" den Nobelpreis für
Physiologie oder Medizin. Er konnte u.a. beobachten, wie in
Seesternlarven eingestochene Baumnadeln von Zellen umringt und
aufgelöst wurden. Er nannte diese Zellen (nach Konsultation mit dem
sprachlich besonders versierten Zoologen Carl Claus)
Phagozyten, also "Fresszellen". Heute weiss man, dass zu den Aufgaben
der Phagozyten auch die Antigenpräsentation an T-Lymphozyten gehört.
Der russische Forscher Elias Metschnikow erhielt 1908 zusammen mit Paul Ehrlich
"in Anerkennung ihrer Arbeiten über die Immunität" den Nobelpreis für
Physiologie oder Medizin. Er konnte u.a. beobachten, wie in
Seesternlarven eingestochene Baumnadeln von Zellen umringt und
aufgelöst wurden. Er nannte diese Zellen (nach Konsultation mit dem
sprachlich besonders versierten Zoologen Carl Claus)
Phagozyten, also "Fresszellen". Heute weiss man, dass zu den Aufgaben
der Phagozyten auch die Antigenpräsentation an T-Lymphozyten gehört.
 Makrophagen
Makrophagen  Granulozyten
Granulozyten Abbildung).
Abbildung). 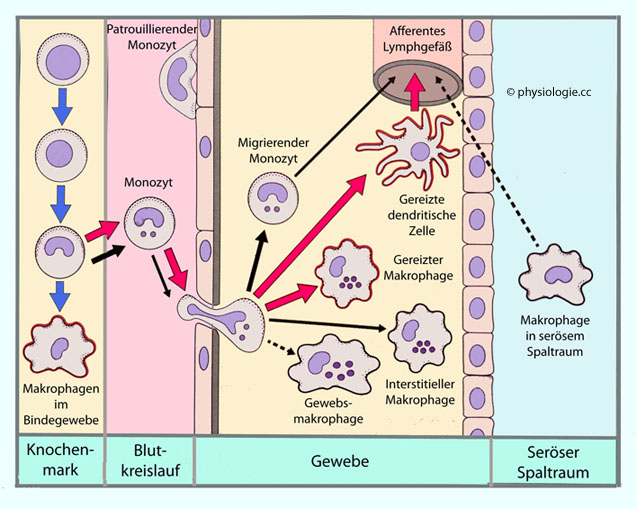
 Abbildung: Differenzierung und Verteilung von Makrophagen
Abbildung: Differenzierung und Verteilung von Makrophagen
 MCP-1 (monocyte chemoattractant protein) - das auch dendritische Zellen und T-Gedächtniszellen anlockt - oder
MCP-1 (monocyte chemoattractant protein) - das auch dendritische Zellen und T-Gedächtniszellen anlockt - oder  RANTES (regulated on activation normal T cell expressed and secreted), das ebenfalls - außer auf Monozyten - auf zahlreiche weitere Zellen (dendritische Zellen, NK-Zellen, Granulozyten) chemotaktisch wirkt.
RANTES (regulated on activation normal T cell expressed and secreted), das ebenfalls - außer auf Monozyten - auf zahlreiche weitere Zellen (dendritische Zellen, NK-Zellen, Granulozyten) chemotaktisch wirkt. 
 Abbildung: "Patrouille" und Rekrutierung von Monozyten
Abbildung: "Patrouille" und Rekrutierung von Monozyten
 "Klassische" Monozyten - sie exprimieren CD14 und CCR2 (Marker), werden in der roten
Milzpulpa gespeichert, von dort vor allem bei akuten Entzündungen
freigesetzt und sezernieren Entzündungsmediatoren.
"Klassische" Monozyten - sie exprimieren CD14 und CCR2 (Marker), werden in der roten
Milzpulpa gespeichert, von dort vor allem bei akuten Entzündungen
freigesetzt und sezernieren Entzündungsmediatoren.  "Nichtklassische" Monozyten exprimieren die Marker CD14, CD16 und den Chemokinrezeptor CX3CR1 (
"Nichtklassische" Monozyten exprimieren die Marker CD14, CD16 und den Chemokinrezeptor CX3CR1 ( Abbildung). Sie patrouillieren kontinuierlich die Mikrozirkulation und können durch Endothelbarrieren dringen.
Abbildung). Sie patrouillieren kontinuierlich die Mikrozirkulation und können durch Endothelbarrieren dringen. Ein drittes Subset hat entzündungsfördernde Funktion und exprimiert die Marker CD14 und CD16.
Ein drittes Subset hat entzündungsfördernde Funktion und exprimiert die Marker CD14 und CD16. entstehen entweder aus Monozyten, die aus dem Kreislauf ausgewandert
sind und
sich der Abwehr widmen - oder sie stammen von Vorstufen ab, die während
der embryonalen Entwicklung in verschiedene Gewebe "eingestreut"
wurden. Sie sind sowohl in lymphatischem als auch
nichtlymphatischem Gewebe weit verbreitet und haben herausragende
Kapazität zur Aufnahme von Material (phagozytotisch und pinozytotisch, 'big eaters'). Das macht sie sowohl für Homöostase (z.B. bauen sie apoptotische Zelltrümmer sowie 2.1011
Erythrozyten pro Tag ab) als auch für die Immunabwehr (Aufnahme von
Mikroorganismen, Reduktion von Entzündungen) unverzichtbar.
entstehen entweder aus Monozyten, die aus dem Kreislauf ausgewandert
sind und
sich der Abwehr widmen - oder sie stammen von Vorstufen ab, die während
der embryonalen Entwicklung in verschiedene Gewebe "eingestreut"
wurden. Sie sind sowohl in lymphatischem als auch
nichtlymphatischem Gewebe weit verbreitet und haben herausragende
Kapazität zur Aufnahme von Material (phagozytotisch und pinozytotisch, 'big eaters'). Das macht sie sowohl für Homöostase (z.B. bauen sie apoptotische Zelltrümmer sowie 2.1011
Erythrozyten pro Tag ab) als auch für die Immunabwehr (Aufnahme von
Mikroorganismen, Reduktion von Entzündungen) unverzichtbar.  Abbildung):
Abbildung):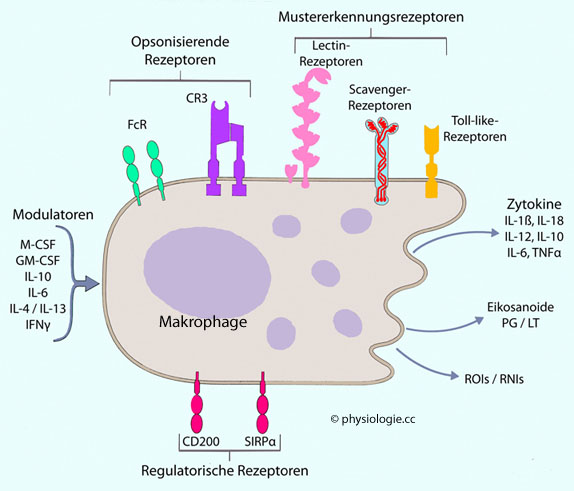
 Abbildung: Reaktion von Makrophagen auf Reize in ihrer Umgebung
Abbildung: Reaktion von Makrophagen auf Reize in ihrer Umgebung
 Makrophagen benötigen zu ihrer Differenzierung das Zytokin M-CSF (macrophage colony stimulating factor). Dieser ist für Überleben und Wachstum von Monozyten und Makrophagen essentiell; diese Zellen exprimieren (wie auch Mikroglia und Osteoklasten) entsprechende Rezeptoren (CSF1R).
Makrophagen benötigen zu ihrer Differenzierung das Zytokin M-CSF (macrophage colony stimulating factor). Dieser ist für Überleben und Wachstum von Monozyten und Makrophagen essentiell; diese Zellen exprimieren (wie auch Mikroglia und Osteoklasten) entsprechende Rezeptoren (CSF1R). 
 Abbildung: Makrophagen erfüllen vielfache Funktionen
Abbildung: Makrophagen erfüllen vielfache Funktionen
 Pro Sekunde stirbt etwa
eine Million Zellen im Körper ab - Makrophagen räumen Gewebereste ab (z.B. auch beim Knochenabbau) und wirken bei der
Wundheilung (
Pro Sekunde stirbt etwa
eine Million Zellen im Körper ab - Makrophagen räumen Gewebereste ab (z.B. auch beim Knochenabbau) und wirken bei der
Wundheilung ( Abbildung). Dabei nutzen sie verschiedene Mustererkennungsrezeptoren (wie TLRs), die beschädigte Zellen erkennen und Makrophagen aktivieren, die Reste zu phagozytieren und abzubauen.
Abbildung). Dabei nutzen sie verschiedene Mustererkennungsrezeptoren (wie TLRs), die beschädigte Zellen erkennen und Makrophagen aktivieren, die Reste zu phagozytieren und abzubauen. Gleichzeitig warten Makrophagen auf potentielle
Pathogene
(Haut und Schleimhäute als erste Verteidigungslinie!). Liegt keine mikrobielle Herausforderung vor, sind die Makrophagen im "Ruhezustand".
Ihre Bedeutung wird oft unterschätzt, weil sie in den
meisten Fällen die Gefahr einer Infektion eindämmen, ohne dass der
Wirtsorganismus davon etwas merkt ("stille Helden" der Immunabwehr).
Gleichzeitig warten Makrophagen auf potentielle
Pathogene
(Haut und Schleimhäute als erste Verteidigungslinie!). Liegt keine mikrobielle Herausforderung vor, sind die Makrophagen im "Ruhezustand".
Ihre Bedeutung wird oft unterschätzt, weil sie in den
meisten Fällen die Gefahr einer Infektion eindämmen, ohne dass der
Wirtsorganismus davon etwas merkt ("stille Helden" der Immunabwehr). Makrophagen beteiligen sich an der Eindämmung von Entzündungseffekten sowie an der Reparatur beschädigten Gewebes.
Makrophagen beteiligen sich an der Eindämmung von Entzündungseffekten sowie an der Reparatur beschädigten Gewebes.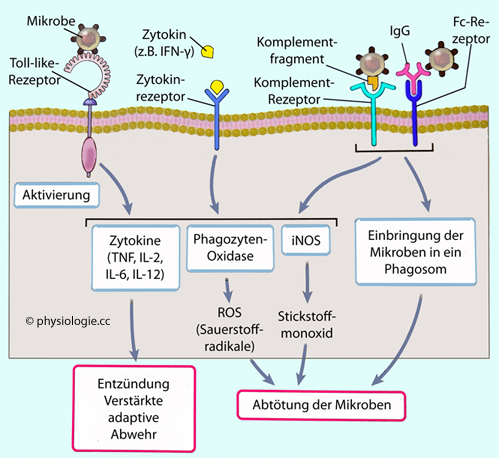
 Abbildung: Aktivierung und Funktion von Makrophagen
Abbildung: Aktivierung und Funktion von Makrophagen
 die Mikroglia im Gehirn,
die Mikroglia im Gehirn,  Monozyten im Blut und Knochenmark,
Monozyten im Blut und Knochenmark,  Kupffer-Sternzellen in der Leber,
Kupffer-Sternzellen in der Leber,  Histiozyten in Lymphknotensinus,
Histiozyten in Lymphknotensinus,  Osteoklasten im Knochen,
Osteoklasten im Knochen,  Makrophagen im Bindegewebe (Histiozyten),
Makrophagen im Bindegewebe (Histiozyten),  in den Lungenalveolen,
in den Lungenalveolen,  im Fettgewebe,
im Fettgewebe,  Mesangiumzellen in Nierenglomeruli,
Mesangiumzellen in Nierenglomeruli,  Peritonealmakrophagen.
Peritonealmakrophagen. Abbildung).
Abbildung).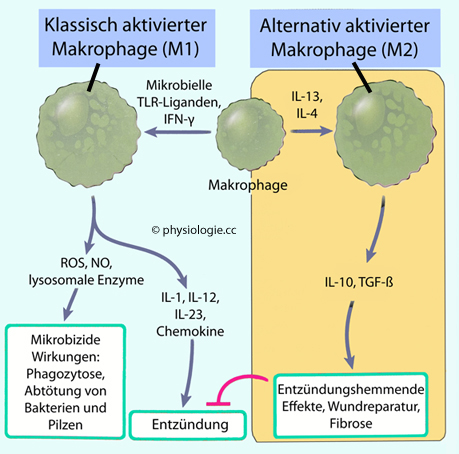
 Abbildung: Klassische und alternative Makrophagenaktivierung
Abbildung: Klassische und alternative Makrophagenaktivierung IFN = Interferon
IFN = Interferon  IL = Interleukin
IL = Interleukin  ROS = Sauerstoffradikale
ROS = Sauerstoffradikale  NO = Stickstoffmonoxid
NO = Stickstoffmonoxid  TGF = Transformierender Wachstumsfaktor
TGF = Transformierender Wachstumsfaktor
 Abbildung), die sich im Sinne eines Kräftegleichgewichts ergänzen:
Abbildung), die sich im Sinne eines Kräftegleichgewichts ergänzen: M1 - getriggert durch Faktoren wie TLRs und IFN-γ, die sowohl im angeborenen als auch im adaptivern System wirksam sind. Die zugrunde liegende klassische Makrophagenaktivierung wird durch angeborene Mechanismen (wie TLRs) oder durch IFN-γ (sowohl im adaptiven als auch im angeborenen System) ausgelöst. M1-Makrophagen gelten generell als proinflammatorisch und zerstören auf diesem Wege Mikroben.
M1 - getriggert durch Faktoren wie TLRs und IFN-γ, die sowohl im angeborenen als auch im adaptivern System wirksam sind. Die zugrunde liegende klassische Makrophagenaktivierung wird durch angeborene Mechanismen (wie TLRs) oder durch IFN-γ (sowohl im adaptiven als auch im angeborenen System) ausgelöst. M1-Makrophagen gelten generell als proinflammatorisch und zerstören auf diesem Wege Mikroben. M2 - bei Abwesenheit starker TLR-Signale sowie durch IL-4 und IL-13
angeregt, sind M2-Makrophagen vermutlich eher auf Reparatur und Heilung
des Gewebes spezialisiert. Die alternative Makrophagenaktivierung funktioniert auch bei nur schwachen TLR-Signalen und wird durch Zytokine angeregt.
M2 - bei Abwesenheit starker TLR-Signale sowie durch IL-4 und IL-13
angeregt, sind M2-Makrophagen vermutlich eher auf Reparatur und Heilung
des Gewebes spezialisiert. Die alternative Makrophagenaktivierung funktioniert auch bei nur schwachen TLR-Signalen und wird durch Zytokine angeregt. Makrophagen sind routinemäßige Phagozytierer, haben immunologische
"Melderfunktion" und setzen entsprechend Chemokine und Zytokine frei.
Sie können sowohl exogene (über MHC-II) als auch endogene Peptide
präsentieren (über MHC-I) und auch "kreuzpräsentieren" (exogene Peptide
über MHC-I) - und zwar nicht nur an naive (wie dendritische Zellen),
sondern auch an bereits aktivierte T-Tellen.
Makrophagen sind routinemäßige Phagozytierer, haben immunologische
"Melderfunktion" und setzen entsprechend Chemokine und Zytokine frei.
Sie können sowohl exogene (über MHC-II) als auch endogene Peptide
präsentieren (über MHC-I) und auch "kreuzpräsentieren" (exogene Peptide
über MHC-I) - und zwar nicht nur an naive (wie dendritische Zellen),
sondern auch an bereits aktivierte T-Tellen.  Phagozytose und Abtötung von Mikroben. Dazu konfluieren Endozytosevesikel mit Lysosomen, wo Radikale (reactive oxygen / nitrogen species) phagozytierte Mikroben zerstören und proteolytische Enzyme ihre Eiweißmoleküle abbauen
Phagozytose und Abtötung von Mikroben. Dazu konfluieren Endozytosevesikel mit Lysosomen, wo Radikale (reactive oxygen / nitrogen species) phagozytierte Mikroben zerstören und proteolytische Enzyme ihre Eiweißmoleküle abbauen Phagozytose und Abbau nekrotischer / apoptotischer / abgestorbener Wirtszellen sowie abgestorbener neutrophiler Granulozyten
Phagozytose und Abbau nekrotischer / apoptotischer / abgestorbener Wirtszellen sowie abgestorbener neutrophiler Granulozyten Sekretion von Zytokinen, die u.a. die Passage von Leukozyten über die endotheliale Barriere in entzündetem Gewebe erleichtern
Sekretion von Zytokinen, die u.a. die Passage von Leukozyten über die endotheliale Barriere in entzündetem Gewebe erleichtern Antigenpräsentation an T-Lymphozyten
Antigenpräsentation an T-Lymphozyten Anregung der Gefäßneubildung (Angiogenese) und Kollagensynthese im Rahmen der Wundheilung
Anregung der Gefäßneubildung (Angiogenese) und Kollagensynthese im Rahmen der Wundheilung

 Abbildung: Reifung mononukleärer Phagozyten
Abbildung: Reifung mononukleärer Phagozyten
 Eosinophile
Eosinophile  Basophile
Basophile| Neutrophile Granulozyten und Makrophagen im Vergleich Nach Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024 |
||
| Komonpente / Eigenschaft |
Neutrophile |
Makrophagen |
| Ursprung |
Hämatopoetische Stammzelle (Knochenmark) |
Viele Gewebemakrophagen: Stammzellen in Dottersack / fetaler Leber Entzündung: Knochenmark-Stammzelle |
| Lebenszeit im Gewebe |
1-2 Tage |
Gewebemakrophagen: Jahre Entzündungsmakrophagen: Tage bis Wochen |
| Reaktion auf Aktivierung |
Rasch, kurzdauernd, Enzymwirkung |
Langsam, langanhaltend, hängt oft von neuer Gentranskription ab |
| ROS |
Rasch durch Phagozytenoxidase (respiratory burst) |
relativ gering |
| NO |
gering bis nicht vorhanden |
Transkription von iNOS |
| Degranulierung |
Hauptwirkung durch Umlagerung des Zytoskeletts | gering |
| Zytokinproduktion |
Niedrig pro Zelle |
Hauptfunktion, intensiv, Zytokingene müssen transkribiert werden |
| Extrazelluläre traps |
Rasch verfügbar durch Extrusion des Kerninhalts |
kaum |
| Neutrophile Granulozyten bilden mittels Enzymen wie Myeloperoxidase Sauerstoffradikale, mit denen sie Bakterien abtöten können |
 Die begrenzte
Lebenszeit aktivierter neutrophiler Granulozyten mindert das
Risiko gewebeschädigender Nebeneffekte.
Die begrenzte
Lebenszeit aktivierter neutrophiler Granulozyten mindert das
Risiko gewebeschädigender Nebeneffekte.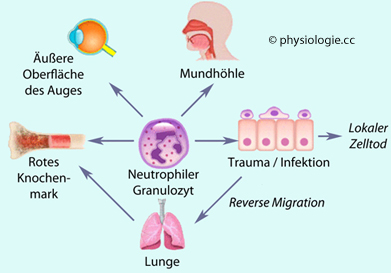
 Abbildung: Clearance von Neutrophilen
Abbildung: Clearance von Neutrophilen
 Abbildung).
Abbildung).| Basophile Granulozyten werden über ihre IgE-Rezeptoren aktiviert, worauf sie Histamin, Heparin und Proteasen freisetzen |
 Sowohl eosinophile als auch basophile Granulozyten beteiligen sich an Entzündungsvorgängen und Parasitenabwehr.
Sowohl eosinophile als auch basophile Granulozyten beteiligen sich an Entzündungsvorgängen und Parasitenabwehr. Über das weiße Blutbild und Referenzwerte s. dort
Über das weiße Blutbild und Referenzwerte s. dort Über die Rolle von Leukozyten bei immunologischen Hypersensitivitätsreaktionen
Über die Rolle von Leukozyten bei immunologischen Hypersensitivitätsreaktionen  s. dort
s. dort Auch Thrombozyten beteiligen sich an der Abwehr von Mikroben (
Auch Thrombozyten beteiligen sich an der Abwehr von Mikroben ( s. dort).
s. dort). NK-Zellen
NK-Zellen  Nichtadaptive Lymphozyten
Nichtadaptive Lymphozyten  Mastzellen
Mastzellen ILCs der Gruppe I (ILC1) produzieren Interferon-γ,
ILCs der Gruppe I (ILC1) produzieren Interferon-γ,
 ILCsder Gruppe II (ILC2) produzieren IL-5 und IL-13,
ILCsder Gruppe II (ILC2) produzieren IL-5 und IL-13,  ILCs der Gruppe III (ILC3) produzieren IL-17 und IL-22).
ILCs der Gruppe III (ILC3) produzieren IL-17 und IL-22). Zytokinproduzierende Innate Lymphoid Cells (ILCs) Nach Abbas / Lichtman / Pillai, Cellular and Molecular Immunology, 9th ed. 2018 |
||||
| Gruppe |
Differenzierung angeregt durch |
Aktivierung angeregt durch |
produzieren hauptsächlich |
Effektorfunktion (beispielhaft) |
| ILC1 |
IL-15, IL-7 |
IL-12, IL-18 |
Interferon γ | Virenschutz |
| ILC2 |
IL-7 |
IL-25, IL-33 |
IL-5, IL-13 |
Schutz vor Parasiten |
| ILC3 |
IL-7 |
IL-1, IL-23 |
IL-17, IL-22 |
Barrierefunktion im Darm |
 NK (natürliche Killer-) Zellen (natural killer cells NKC) sind kurzlebige (~1 Woche) lymphoide Zellen. Sie gelten als Untergruppe von ILC-Zellen und machen 5-20% der Zellen mit Lymphozytenmorphologie
in Blut und sekundären lymphatischen Organen aus (in Leber und Plazenta
kommen sie häufiger, in anderen lymphatischen Geweben seltener vor).
NK (natürliche Killer-) Zellen (natural killer cells NKC) sind kurzlebige (~1 Woche) lymphoide Zellen. Sie gelten als Untergruppe von ILC-Zellen und machen 5-20% der Zellen mit Lymphozytenmorphologie
in Blut und sekundären lymphatischen Organen aus (in Leber und Plazenta
kommen sie häufiger, in anderen lymphatischen Geweben seltener vor).  mikrobenbefallene (oft virusinfizierte) Zellen abtöten und
mikrobenbefallene (oft virusinfizierte) Zellen abtöten und  Zytokine sezernieren (vor allem Interferon-γ, das Makrophagen aktiviert), um die
Replikation von Viren zu stoppen.
Zytokine sezernieren (vor allem Interferon-γ, das Makrophagen aktiviert), um die
Replikation von Viren zu stoppen.  Auch erkennen sie gestresste Zellen,
die sie ebenfalls Makrophagen "schmackhaft machen" können.
Auch erkennen sie gestresste Zellen,
die sie ebenfalls Makrophagen "schmackhaft machen" können. Abbildung), Typ 1-Interferone
(beide verstärken die Abtötungskapazität der NKC) und IL-15 (wichtig
für ihre Entwicklung und Reifung). Das verstärkt den Schutz vor
Infektionen und wird besonders dann wichtig, wenn virusbefallene
Zellen es nicht alleine schaffen, die virale Reproduktion zu stoppen.
Der Abtötungsmechanismus der NKC gleicht demjenigen zytotoxischer (CD8+) T-Zellen, NKC können sich damit auch an der Abtötung von Tumorzellen beteiligen.
Abbildung), Typ 1-Interferone
(beide verstärken die Abtötungskapazität der NKC) und IL-15 (wichtig
für ihre Entwicklung und Reifung). Das verstärkt den Schutz vor
Infektionen und wird besonders dann wichtig, wenn virusbefallene
Zellen es nicht alleine schaffen, die virale Reproduktion zu stoppen.
Der Abtötungsmechanismus der NKC gleicht demjenigen zytotoxischer (CD8+) T-Zellen, NKC können sich damit auch an der Abtötung von Tumorzellen beteiligen.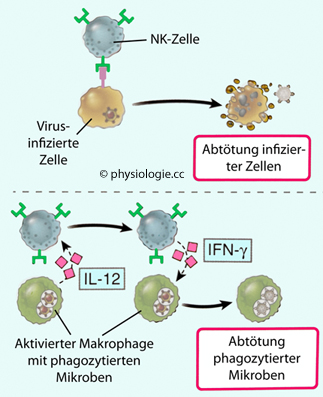
 Abbildung: Funktionen von NK-Zellen
Abbildung: Funktionen von NK-Zellen

 KIRs (killer cell immunoglobulin-like receptors) sind Rezeptoren auf NK-Zellen, die der Immunglobulin-Superfamilie
zugerechnet werden. Sie erkennen unterschiedliche Allele von HLA-A-,
HLA-B- und HLA-C-Molekülen. KIRs sind polymorph, d.h. sie kommen in verschiedenen allelen
Varianten vor - einige agieren im Rahmen aktivierender, andere im
Rahmen inhibierender Rezeptormechanismen. Einige KIRs verfügen über Komponenten mit
ITIMs auf ihrem zytoplasmatischen Ende, welche die Aktivität der
NKC blockieren,
andere haben eine verkürzte zytoplasmatische Sequenz, assoziieren aber
mit anderen Peptiden, die ITAMs enthalten. Dann wirken sie aktivierend auf die NK-Zelle.
KIRs (killer cell immunoglobulin-like receptors) sind Rezeptoren auf NK-Zellen, die der Immunglobulin-Superfamilie
zugerechnet werden. Sie erkennen unterschiedliche Allele von HLA-A-,
HLA-B- und HLA-C-Molekülen. KIRs sind polymorph, d.h. sie kommen in verschiedenen allelen
Varianten vor - einige agieren im Rahmen aktivierender, andere im
Rahmen inhibierender Rezeptormechanismen. Einige KIRs verfügen über Komponenten mit
ITIMs auf ihrem zytoplasmatischen Ende, welche die Aktivität der
NKC blockieren,
andere haben eine verkürzte zytoplasmatische Sequenz, assoziieren aber
mit anderen Peptiden, die ITAMs enthalten. Dann wirken sie aktivierend auf die NK-Zelle.
 Inhibitorische NKC-Rezeptoren erkennen MHC-I-Moleküle
körpereigener Zellen und aktivieren Phosphatasen (das hemmt
Kinasen und damit die Aktivierung von NK-Zellen). Zu diesem Rezeptortyp gehören
Inhibitorische NKC-Rezeptoren erkennen MHC-I-Moleküle
körpereigener Zellen und aktivieren Phosphatasen (das hemmt
Kinasen und damit die Aktivierung von NK-Zellen). Zu diesem Rezeptortyp gehören KIRs als die größte Gruppe der inhibitorischen Rezeptoren an NKCs,
KIRs als die größte Gruppe der inhibitorischen Rezeptoren an NKCs, Rezeptoren, die aus CD94-Protein sowie einer Lektineinheit (NKG2) bestehern.
Rezeptoren, die aus CD94-Protein sowie einer Lektineinheit (NKG2) bestehern. Abbildung).
Abbildung). Aktivierende
NKC-Rezeptoren (auch KARs: Killer cell activating ligands genannt) haben kein ITIM-Motiv und kommen nicht an allen NK-Zellen vor. Zu ihnen gehören
Aktivierende
NKC-Rezeptoren (auch KARs: Killer cell activating ligands genannt) haben kein ITIM-Motiv und kommen nicht an allen NK-Zellen vor. Zu ihnen gehören  KIR2DS, KIR3DS (D = Zahl extrazellulärer Domänen, S / L = kurze / lange intrazelluläre Domäne),
KIR2DS, KIR3DS (D = Zahl extrazellulärer Domänen, S / L = kurze / lange intrazelluläre Domäne), NKG2D (erkennt MHC I-ähnliche Moleküle, die bei zellulärer Belastung exprimiert werden),
NKG2D (erkennt MHC I-ähnliche Moleküle, die bei zellulärer Belastung exprimiert werden), CD16 (erkennt den Fc-Teil von IgG-Antikörpern, die an Zellen gekoppelt sind). Die Aktivität von NK-Zellen richtet sich gegen infizierte oder
Tumorzellen - ohne vorangegangenen Antigenkontakt. NKC lysieren Zielzellen, gegen die solche
IgG gerichtet sind, entfalten also antikörperabhängige zellvermittelte Zytotoxizität (ADCC),
CD16 (erkennt den Fc-Teil von IgG-Antikörpern, die an Zellen gekoppelt sind). Die Aktivität von NK-Zellen richtet sich gegen infizierte oder
Tumorzellen - ohne vorangegangenen Antigenkontakt. NKC lysieren Zielzellen, gegen die solche
IgG gerichtet sind, entfalten also antikörperabhängige zellvermittelte Zytotoxizität (ADCC), Lektine (Proteine, die spezifische Kohlenhydrate und damit an Zellmembranen binden),
Lektine (Proteine, die spezifische Kohlenhydrate und damit an Zellmembranen binden), NCRs (natural cytotoxicity receptors) - binden u.a. virale Haemagglutinine.
NCRs (natural cytotoxicity receptors) - binden u.a. virale Haemagglutinine.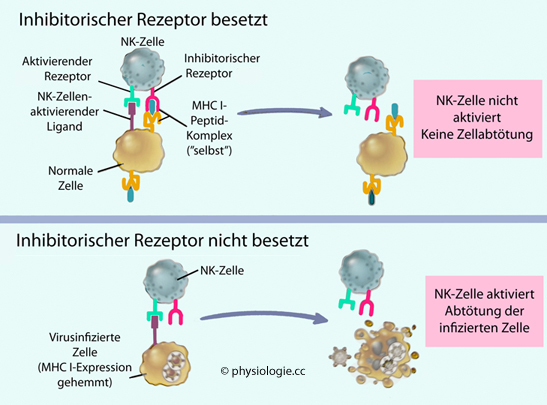
 Abbildung: Rezeptoren, die natürliche Killerzellen aktivieren und inhibieren
Abbildung: Rezeptoren, die natürliche Killerzellen aktivieren und inhibieren
| NK-Zellen stammen von der lymphatischen Zelllinie ab NK-Zellen können virusinfizierte, Tumor- oder Fremdzellen direkt töten, indem sie deren Apoptose auslösen |
 Abbildung unten). Zur Abtötung von Mikroben und suspekten Zellen durch NKC sind Antikörper (im Gegensatz zu Killer-T-Zellen) nicht
notwendig. So sind sehr rasche Immunantworten möglich, Mikroben (allogene Zellen) können unmittelbar abgetötet werden.
Abbildung unten). Zur Abtötung von Mikroben und suspekten Zellen durch NKC sind Antikörper (im Gegensatz zu Killer-T-Zellen) nicht
notwendig. So sind sehr rasche Immunantworten möglich, Mikroben (allogene Zellen) können unmittelbar abgetötet werden.  Zahlreiche
Virenarten haben Mechanismen gefunden, die Expression von MHC-I ihrer
Wirtszellen zu blockieren und dadurch der Zerstörung durch
virusspezifische CD8+-Killerzellen
zu entkommen. Das Fehlen von MHC-I
bedeutet aber auch, dass inhibitorische NKC-Rezeptoren nicht aktiviert
werden (keine Präsentation von "selbst"), und die virusbefallene Zelle
kann (statt durch CD8+-Killerzellen) durch NK-Zellen eliminiert werden - ein Beispiel für die
Kompensation eines Mechanismus (Ausfall der Wirkung zytotoxischer
T-Zellen der adaptiven Abwehr) durch einen anderen (erhöhte Zytotoxizität von NK-Zellen der angeborenen Immunität).
Zahlreiche
Virenarten haben Mechanismen gefunden, die Expression von MHC-I ihrer
Wirtszellen zu blockieren und dadurch der Zerstörung durch
virusspezifische CD8+-Killerzellen
zu entkommen. Das Fehlen von MHC-I
bedeutet aber auch, dass inhibitorische NKC-Rezeptoren nicht aktiviert
werden (keine Präsentation von "selbst"), und die virusbefallene Zelle
kann (statt durch CD8+-Killerzellen) durch NK-Zellen eliminiert werden - ein Beispiel für die
Kompensation eines Mechanismus (Ausfall der Wirkung zytotoxischer
T-Zellen der adaptiven Abwehr) durch einen anderen (erhöhte Zytotoxizität von NK-Zellen der angeborenen Immunität).
 Abbildung: Wie NK-Zellen Zielzellen zerstören
Abbildung: Wie NK-Zellen Zielzellen zerstören

 Granzyme
Granzyme  sind Proteasen in Granula von zytotoxischen Zellen, welche in die
angegriffene (viren- oder bakterieninfizierte oder anderweitig
gestresste) Zelle eindringen und diese zur Apoptose veranlassen.
sind Proteasen in Granula von zytotoxischen Zellen, welche in die
angegriffene (viren- oder bakterieninfizierte oder anderweitig
gestresste) Zelle eindringen und diese zur Apoptose veranlassen. Perforin
ist ein Protein, das von NK-Zellen und zytotoxischen (CD8 positiven)
Zellen gebildet und in Granula gespeichert wird. Bei Degranulierung oligomeriert es (Ca++-abhängig) zu Poren in der Zellmembran der Zielzelle. Dadurch können zytotoxische Stoffe eindringen -
Perforin
ist ein Protein, das von NK-Zellen und zytotoxischen (CD8 positiven)
Zellen gebildet und in Granula gespeichert wird. Bei Degranulierung oligomeriert es (Ca++-abhängig) zu Poren in der Zellmembran der Zielzelle. Dadurch können zytotoxische Stoffe eindringen -  s. auch dort
s. auch dort Weiters
verfügen NK-Zellen über Fc-Rezeptoren
(Membranstrukturen, die Antikörper an ihrem Fc-Teil binden), d.h. sie
können antikörperabhängige zellvermittelte Zytotoxizität (ADCC) auslösen.
Weiters
verfügen NK-Zellen über Fc-Rezeptoren
(Membranstrukturen, die Antikörper an ihrem Fc-Teil binden), d.h. sie
können antikörperabhängige zellvermittelte Zytotoxizität (ADCC) auslösen. | NK-Zellen
wirken in der angeborenen Immunabwehr Sie töten mit Viren oder intrazellulären Bakterien infizierte Zellen ab und produzieren Interferon-γ Ihre zytotoxischen Wirkungen ähneln denen von CD8+-Zellen und werden durch eine Balance zwischen aktivierenden und inhibierenden Rezeptoren gesteuert Sie haben T-Lymphozyten-ähnliche Effektorfunktionen, aber keine T-Zell-Antigenrezeptoren |
 Abbildung)
und werden daher auch der Gruppe der Granulozyten zugerechnet. Ihre
Granula enthalten vasoaktive Amine, welche die Gefäße weiten und
Kapillaren durchgängiger machen (Vasodilatation, erhöhte Permeabilität)
- ein für Entzündungen charakteristisches Muster (vgl. dazu dort). Proteolytische Enzyme der Granula können Toxine inaktivieren und Mikroben abtöten.
Abbildung)
und werden daher auch der Gruppe der Granulozyten zugerechnet. Ihre
Granula enthalten vasoaktive Amine, welche die Gefäße weiten und
Kapillaren durchgängiger machen (Vasodilatation, erhöhte Permeabilität)
- ein für Entzündungen charakteristisches Muster (vgl. dazu dort). Proteolytische Enzyme der Granula können Toxine inaktivieren und Mikroben abtöten.
 Abbildung: Rezeptoren auf / in Mastzellen und Produkte der Mastzellen
Abbildung: Rezeptoren auf / in Mastzellen und Produkte der Mastzellen
 Bei entsprechender Reizung (Komplementfaktor C3a, Lipopolysaccharide, Bindung von Allergen an gebundene IgE-Moleküle, aber auch physikalische Beschädigung)
Bei entsprechender Reizung (Komplementfaktor C3a, Lipopolysaccharide, Bindung von Allergen an gebundene IgE-Moleküle, aber auch physikalische Beschädigung)  setzen sie durch Ca++-vermittelte Exozytose Histamin, Heparin, Kinine, Proteasen (Tryptase), TNF, PAF, IL 4, 5 und 6, Leukotriene (Prostaglandine wie PGD2, Thromboxane), NGF, einige Interleukine und Proteasen frei.
setzen sie durch Ca++-vermittelte Exozytose Histamin, Heparin, Kinine, Proteasen (Tryptase), TNF, PAF, IL 4, 5 und 6, Leukotriene (Prostaglandine wie PGD2, Thromboxane), NGF, einige Interleukine und Proteasen frei.
 dendritische
Zellen (Anregung),
dendritische
Zellen (Anregung),  Makrophagen (Inhibition),
Makrophagen (Inhibition),  NK-Zellen (Steigerung der
Zytotoxizität),
NK-Zellen (Steigerung der
Zytotoxizität),  T-Lymphozyten (Wirkung je nach Zelltyp),
T-Lymphozyten (Wirkung je nach Zelltyp),
 Endothelzellen (Anregung),
Endothelzellen (Anregung),  glatte Muskulatur
(Kontraktilitätssteigerung),
glatte Muskulatur
(Kontraktilitätssteigerung),  Fibroblasten (Kollagensynthese),
Fibroblasten (Kollagensynthese),
 Osteoklasten (Knochenabbau),
Osteoklasten (Knochenabbau),  Nervenzellen (Anregung).
Nervenzellen (Anregung). vgl. NETs).
vgl. NETs). Muköse Mastzellen in Alveolarsepten und Darmschleimhaut: Ihre Granula enthalten vor allem Chondroitinsulfat (ein Glycosaminoglycan) und Tryptase (eine Serinprotease, die speziell von Mastzellen gebildet wird),
Muköse Mastzellen in Alveolarsepten und Darmschleimhaut: Ihre Granula enthalten vor allem Chondroitinsulfat (ein Glycosaminoglycan) und Tryptase (eine Serinprotease, die speziell von Mastzellen gebildet wird),  Bindegewebsmastzellen
in Haut und intestinaler Submukosa haben Granula, die reich an Histamin
und neutraler Protease (funktioniert am besten im Bereich pH ~7) sind.
Bindegewebsmastzellen
in Haut und intestinaler Submukosa haben Granula, die reich an Histamin
und neutraler Protease (funktioniert am besten im Bereich pH ~7) sind. Durch Bindung an Mikroben wirken sie als Opsonine.
Durch Bindung an Mikroben wirken sie als Opsonine.  Nach der Bindung an Mikroben regen sie entzündliche Reaktionen an, wodurch mehr Phagozyten an den Ort der Abwehr gelangen.
Nach der Bindung an Mikroben regen sie entzündliche Reaktionen an, wodurch mehr Phagozyten an den Ort der Abwehr gelangen. Collectine und Ficoline
Collectine und Ficoline  Komplementsystem
Komplementsystem  Zytokine
Zytokine

 Abbildung: Komplementaktivierung durch C1q, MBL und Ficolin
Abbildung: Komplementaktivierung durch C1q, MBL und Ficolin
 mannosebindendes Lektin
(mannan-binding lectin MBL) - ein löslicher Mustererkennungsrezeptor, der auch als Opsonin wirkt. MBL im Blutplasma erkennt mikrobielle Kohlenhydrate und kann Mikroben opsonisieren oder die Komplementkaskade über den Lektinweg aktivieren;
mannosebindendes Lektin
(mannan-binding lectin MBL) - ein löslicher Mustererkennungsrezeptor, der auch als Opsonin wirkt. MBL im Blutplasma erkennt mikrobielle Kohlenhydrate und kann Mikroben opsonisieren oder die Komplementkaskade über den Lektinweg aktivieren; die Surfactantproteine SP-A und SP-D. Diese sind nicht nur lipophil und oberflächenaktiv (und erleichtern die
Inspiration), sondern hemmen auch das Wachstum von Bakterien und
unterstützen deren Phagozytose;
die Surfactantproteine SP-A und SP-D. Diese sind nicht nur lipophil und oberflächenaktiv (und erleichtern die
Inspiration), sondern hemmen auch das Wachstum von Bakterien und
unterstützen deren Phagozytose; weitere Faktoren mit dem Kürzel CL (-L: hepatisch, -P: plazentar u.a.).
weitere Faktoren mit dem Kürzel CL (-L: hepatisch, -P: plazentar u.a.). Abbildung)
erkennen und binden sie Lipoteichonsäuren grampositiver Bakterien.
Abbildung)
erkennen und binden sie Lipoteichonsäuren grampositiver Bakterien.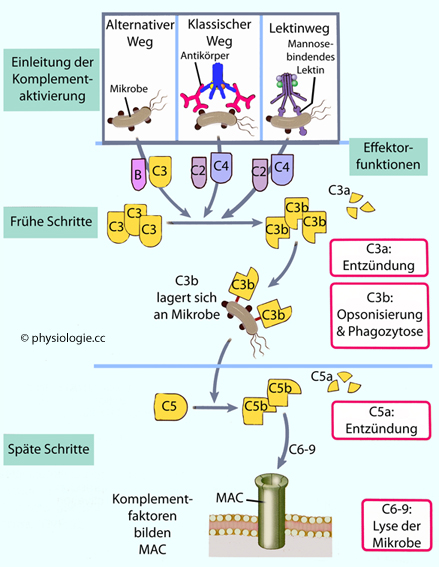
 Abbildung: Wege der Komplementaktivierung
Abbildung: Wege der Komplementaktivierung
 einen alternativen Weg (alternative pathway) der Komplementaktivierung, der an mikrobiellen Oberflächen stattfindet und der angeborenen Abwehr zuzurechnen ist;
einen alternativen Weg (alternative pathway) der Komplementaktivierung, der an mikrobiellen Oberflächen stattfindet und der angeborenen Abwehr zuzurechnen ist; einen klassischen Weg (classical pathway), meist durch Antikörper ausgelöst, die an ihre Antigene (z.B. auf Bakterien) binden (adaptive Abwehr),
einen klassischen Weg (classical pathway), meist durch Antikörper ausgelöst, die an ihre Antigene (z.B. auf Bakterien) binden (adaptive Abwehr), einen Lektinweg (lectin pathway), der über mannosebindendes Lektin (MBL) oder Ficoline getriggert wird - ohne Antikörper, weshalb man diesen Weg der angeborenen Abwehr zurechnet.
einen Lektinweg (lectin pathway), der über mannosebindendes Lektin (MBL) oder Ficoline getriggert wird - ohne Antikörper, weshalb man diesen Weg der angeborenen Abwehr zurechnet. Funktion
Funktion Die größeren Spaltprodukte werden mit dem Buchstaben "b" bezeichnet (z.B. C3b) und wirken als Proteasen,
die sich an Zelloberflächen binden, dadurch lokal begrenzt wirksam
bleiben und hier weitere Aktivierungsschritte anregen
(Kaskadenprinzip);
Die größeren Spaltprodukte werden mit dem Buchstaben "b" bezeichnet (z.B. C3b) und wirken als Proteasen,
die sich an Zelloberflächen binden, dadurch lokal begrenzt wirksam
bleiben und hier weitere Aktivierungsschritte anregen
(Kaskadenprinzip);  Die kleineren Spaltprodukte werden mit dem Buchstaben "a" bezeichnet (z.B. C3a) und wirken als lösliche Mediatoren.
Die kleineren Spaltprodukte werden mit dem Buchstaben "a" bezeichnet (z.B. C3a) und wirken als lösliche Mediatoren. Abbildung: Organisation und Funktionen des Komplementsystems
Abbildung: Organisation und Funktionen des Komplementsystems
 Abbildung) wirken (Lektinweg II).
Abbildung) wirken (Lektinweg II). Die enzymatischen Aktivierungskaskaden erinnern an die Abläufe im Gerinnungssystem. Dies ist ein präzise regulierterAblauf
mit dem Ergebnis einer effizienten Elimination von Mikroben einerseits,
Schutz für das Gewebe andererseits.
Die enzymatischen Aktivierungskaskaden erinnern an die Abläufe im Gerinnungssystem. Dies ist ein präzise regulierterAblauf
mit dem Ergebnis einer effizienten Elimination von Mikroben einerseits,
Schutz für das Gewebe andererseits.  Chemotaxine
Chemotaxine  - sie regen die Freisetzung von Entzündungsmediatoren an (Faktor C5!). Als Chemokine bezeichnet man Stoffe, die Chemotaxis induzieren (z.B. Faktor C5a)
- sie regen die Freisetzung von Entzündungsmediatoren an (Faktor C5!). Als Chemokine bezeichnet man Stoffe, die Chemotaxis induzieren (z.B. Faktor C5a)  Opsonine
- körpereigene Proteine, welche an Pathogene binden und die Phagozytose
anregen (Opsonisierung). Antikörper, Komplementfaktoren (wie z.B. Faktor C3b) und
zirkulierende Eiweißmoleküle (sezernierte Mustererkennungsrezeptoren)
Opsonine
- körpereigene Proteine, welche an Pathogene binden und die Phagozytose
anregen (Opsonisierung). Antikörper, Komplementfaktoren (wie z.B. Faktor C3b) und
zirkulierende Eiweißmoleküle (sezernierte Mustererkennungsrezeptoren)  Porenbildende Eiweiße - sie lagern sich in die Membran ein (Membran-Angriffskomplex MAC, Membrane attack complex,
eine aus den Komplementfaktoren 5, 6, 7, 8 und 9 aufgebaute,
schwimmreifenähnliche Struktur, die eine offene Pore in der
angegriffenen Zellmembran bildet (Abbildungen).
Porenbildende Eiweiße - sie lagern sich in die Membran ein (Membran-Angriffskomplex MAC, Membrane attack complex,
eine aus den Komplementfaktoren 5, 6, 7, 8 und 9 aufgebaute,
schwimmreifenähnliche Struktur, die eine offene Pore in der
angegriffenen Zellmembran bildet (Abbildungen). Abbildung) als auch eine C5-Konvertase.
Abbildung) als auch eine C5-Konvertase.  Innerhalb
von Sekunden kann das aktivierte Komplementsystem pathogene Mikroben
(mit Reproduktionszeiten von ~20 Minuten) erfolgreich angreifen und
zerstören.
Innerhalb
von Sekunden kann das aktivierte Komplementsystem pathogene Mikroben
(mit Reproduktionszeiten von ~20 Minuten) erfolgreich angreifen und
zerstören.
 Abbildung: Frühe Schritte der Komplementaktivierung
Abbildung: Frühe Schritte der Komplementaktivierung

 Opsonisierung (opsonization) und Phagozytose (phagocytosis) - Mikroben werden mittels C3b-Fragmenten "markiert" und mittels entsprechender Rezeptoren auf Phagozyten in diese aufgenommen
Opsonisierung (opsonization) und Phagozytose (phagocytosis) - Mikroben werden mittels C3b-Fragmenten "markiert" und mittels entsprechender Rezeptoren auf Phagozyten in diese aufgenommen Entzündung (inflammation) - proteolytische Fragmente (vor allem C3a und C5a) wirken auf Leukozyten (vor allem Neutrophile und Monozyten) als Chemoattraktoren und aktivieren Endothelzellen und Mastzellen. Dadurch werden Plasmaproteine und Leukozyten an der Stelle der Komplementaktivierung in entzündetes Gewebe gebracht
Entzündung (inflammation) - proteolytische Fragmente (vor allem C3a und C5a) wirken auf Leukozyten (vor allem Neutrophile und Monozyten) als Chemoattraktoren und aktivieren Endothelzellen und Mastzellen. Dadurch werden Plasmaproteine und Leukozyten an der Stelle der Komplementaktivierung in entzündetes Gewebe gebracht Zerstörung von Mikroben (cell lysis). Durch Bildung von MACs wird die mikrobielle Zellmembran durchlöchert, wodurch es zu osmotischer Zytolyse der Mikroben kommt.
Zerstörung von Mikroben (cell lysis). Durch Bildung von MACs wird die mikrobielle Zellmembran durchlöchert, wodurch es zu osmotischer Zytolyse der Mikroben kommt. Das Akutphasenprotein (die
Produktion kann von der Leber hochreguliert werden) MBL, das Glykolipide (Bakterien, Pilze) oder Glykoproteine (Mannose- oder Fukosekomplexe) bindet,
Das Akutphasenprotein (die
Produktion kann von der Leber hochreguliert werden) MBL, das Glykolipide (Bakterien, Pilze) oder Glykoproteine (Mannose- oder Fukosekomplexe) bindet, oder (dem MBL strukturell und funktionell ähnliche) Ficoline,
die N-Acetylglucosamin binden.
oder (dem MBL strukturell und funktionell ähnliche) Ficoline,
die N-Acetylglucosamin binden. Komplementfaktoren: Konzentrationsbereiche, Aktivierungsprodukte und Funktionen Nach Abbas / Lichtman / Pillai, Cellular and Molecular Immunology, 3rd ed., Saunders 2018 |
|||
| Komponente |
Konzentration im Serum (µg/ml, gerundet) |
Aktivierungs- produkt |
Funktion |
| Klassischer Weg |
|||
| C1q |
50-150 |
Bindet an Fc von Antikörpern, die an Antigen, apoptotische Zellen oder kationische Oberflächen gebunden haben |
|
| C1r |
50 |
aktives C1r |
Serinprotease, spaltet C1s, macht daraus aktive Protease |
| C1s |
50 |
aktives C1s |
Serinprotease, spaltet C4 und C2 |
| C4 |
300-600 |
C4a, C4b |
C4a: Anaphylatoxin, regt Entzündung an C4b bindet an Mikroben oder Zellen, die Antikörper binden und Komplement aktivieren C4b bindet C2 zur Spaltung von C1s |
| C2 |
20 |
C2a, C2b |
Serinprotease, wirkt als aktives Enzym der C3- und C5-Konvertase zur Spaltung von C3 und C5 |
| C3 |
1400-1700 |
C3a, C3b |
C3a: Anaphylatoxin, regt Entzündung an C3b: Opsonin, bindet an Mikroben, wirkt als Teil der C3- und C5-Konvertase |
| Später Abschnitt der Komplementaktivierung (Bildung des MAC) |
|||
| C5 |
80 |
C5a, C5b |
C5a: Anaphylatoxin, regt Entzündung an C5b startet MAC-Konfigurierung |
| C6 |
45 |
MAC (membrane attack complex) |
MAC-Komponente: Bindet an C5b und nimmt C7 an |
| C7 |
90 |
MAC-Komponente: Bindet an C5b,6 und verankert in Lipidmembranen |
|
| C8 |
60 |
MAC-Komponente: Bindet an C6b,6,7 und initiiert die Bindung und Polymerisierung von C9 |
|
| C9 |
60 |
MAC-Komponente: Bindet an C5b,6,7,8 und polymerisiert zu Membranporen |
|
| Alternativer Weg |
|||
| C3 | 1400-1700 | C3a, C3b | C3a: Anaphylatoxin, regt Entzündung an C3b bindet an Mikroben, wirkt als Opsonin und Teil der C3- und C5-Konvertase |
| Faktor B |
200-400 |
Ba/Bb |
Bb: Serinprotease, aktives Enzym der C3- und C5-Konvertase |
| Faktor D |
1-3 |
akt. D |
Plasma- Serinprotease, spaltet bei Bindung an C3b Faktor B |
| Properdin |
20-35 |
Stabilisiert C3-Konvertase (C3bBb) auf Mikroben |
|
| Lektinweg |
|||
| MBL |
1-8 |
Agglutinin, Opsonin, Komplementfixierung |
|
| M-Ficolin (Ficolin-1) |
- |
Agglutinin, Opsonin, Komplementfixierung | |
| L-Ficolin (Ficolin-2) |
1-7 |
Agglutinin, Opsonin, Komplementfixierung | |
| L-Ficolin (Ficolin-3) |
6-83 |
Agglutinin, Opsonin, Komplementfixierung | |
| MASP1 |
2-13 |
Bildet Komplex mit MASP2, Collectinen und Ficolinen Aktiviert MASP3 |
|
| MASP2 |
2-13 |
Bildet Komplex mit Lektinen, insbesondere Ficolin-3 |
|
| MASP3 |
0,02-1,0 |
Assoziiert mit Collectinen oder Ficolinen und MASP1 Spaltet C4 |
|

 Abbildung: Wirkungen des Komplementsystems
Abbildung: Wirkungen des Komplementsystems
 Es lockt Leukozyten ins
Gewebe und aktiviert sie (Chemotaxis: Beeinflussung der Migration durch extrazelluläre Stoffkonzentrationsgradienten;
diese führen zu entsprechenden gerichteten Aktivitäten in der Zelle,
was zu Bewegung in oder gegen die Richtung des Konzentrationsgefälles
führt, z.B. eines Leukozyten zu einem Entzündungsherd -
Es lockt Leukozyten ins
Gewebe und aktiviert sie (Chemotaxis: Beeinflussung der Migration durch extrazelluläre Stoffkonzentrationsgradienten;
diese führen zu entsprechenden gerichteten Aktivitäten in der Zelle,
was zu Bewegung in oder gegen die Richtung des Konzentrationsgefälles
führt, z.B. eines Leukozyten zu einem Entzündungsherd -  s. auch unter Diapedese)
s. auch unter Diapedese)  Das Komplementsystem aktiviert Gewebezellen
Das Komplementsystem aktiviert Gewebezellen es bewirkt Lyse, wenn IgG oder IgM an Antigene binden (komplementbindende Antikörper), insbesondere von Krankheitserregern
es bewirkt Lyse, wenn IgG oder IgM an Antigene binden (komplementbindende Antikörper), insbesondere von Krankheitserregern Aktivierte Komplementfaktoren wirken außerdem
auf Gefäßwände (Vasodilatation, erhöhte Permeabilität, Austritt von
Proteinen, Entzündungsreaktion), Bronchien (Bronchokonstriktion) und
andere Zellen
Aktivierte Komplementfaktoren wirken außerdem
auf Gefäßwände (Vasodilatation, erhöhte Permeabilität, Austritt von
Proteinen, Entzündungsreaktion), Bronchien (Bronchokonstriktion) und
andere Zellen Abbildung),
und die
dabei frei werdenden Stoffe bewirken Vasodilatation und die
Exprimierung von Adhäsionsrezeptoren - Leukozyten können dadurch aus
der Blutbahn in die betroffenen Gewebe austreten.
Abbildung),
und die
dabei frei werdenden Stoffe bewirken Vasodilatation und die
Exprimierung von Adhäsionsrezeptoren - Leukozyten können dadurch aus
der Blutbahn in die betroffenen Gewebe austreten.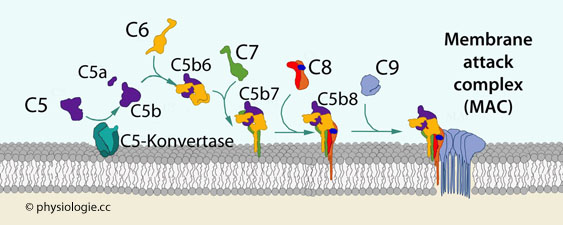
 Abbildung: Schrittweiser Aufbau des MAC (membrane attack complex)
Abbildung: Schrittweiser Aufbau des MAC (membrane attack complex)
Komplementaktivierung im Vergleich Nach Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press) |
||
| Weg |
Auslöser |
Wann und wo? |
| Alternativ |
Oberfläche des Pathogens |
Nur im angeborenen Immunsystem, mit Beginn der Infektion |
| Lektin |
MBL (Plasma) erkennt für pathogene Mikroorganismen typische Kohlenhydratmuster |
Nur im angeborenen Immunsystem, verzögert |
| Klassisch |
CRP im angeborenen, Antigen-Antikörper-Bindung im adaptiven System |
Angeborenes und adaptives System, Aktivierung am langsamsten |
| Zytokine des angeborenen Immunsystems Nach Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024 |
||
| Zytokin |
Quelle (hauptsächlich) |
Ziele / Effekte |
| TNF |
Makrophagen T-Zellen Mastzellen |
Endothel: Entzündung, Thrombenbildung (hohe Konzentration) Neutrophile: Aktivierung Leber: Synthese Akutphasenproteine Muskel-, Fettgewebe: Katabolismus Herz: Reduzierte Kontraktilität → Blutdrucksenkung |
| IL-1 |
Makrophagen Dendritische Zellen Endothelzellen Einige Epithelzellen Mastzellen |
Endothel: Entzündung, Gerinnung Hypothalamus: Fieber Leber: Synthese Akutphasenproteine T-Zellen: Differenzierung Th17 |
| Chemokine |
Makrophagen Dendritische Zellen Endothelzellen T-Lymphozyten Fibroblasten Thrombozyten |
Leukozyten: Erhöhte Integrinaffinität, Chemotaxis, Aktivierung |
| IL-12 |
Dendritische Zellen Makrophagen |
NK- und T-Zellen: Produktion IFN-γ, erhöhte zytotoxische Aktivität T-Zellen: Differenzierung Th1 |
| IFN-γ | NK-Zellen T-Lymphozyten |
Makrophagen: Klassische Aktivierung |
| Typ I- Interferone |
IFN-α: Dendritische Zellen, Makrophagen IFN-β: Fibroblasten, Epithelzellen |
Alle Zellen: Antiviraler Status, erhöhte MHC-Expression NK-Zellen: Aktivierung |
| IL-10 |
Makrophagen Dendritische Zellen T-Zellen |
Makrophagen, dendritische Zellen: Gehemmte Zytokin- und Chemokinproduktion, herabgesetzte Expression von Costimulatoren und HMC-II |
| IL-6 |
Makrophagen Endothelzellen T-Zellen |
Leber: Synthese Akutphasenproteine B-Zellen: Proliferation antikörperproduzierender Zellen |
| IL-15 |
Makrophagen u.a. |
NK-Zellen, T-Zellen: Proliferation |
| IL-18 |
Makrophagen |
NK-Zellen, T-Zellen: Synthese IFN-γ |
| TGF-β | Viele Zelltypen |
Hemmung entzündlicher Reaktionen T-Zellen: Differenzierung von Treg |
 vgl. dort
vgl. dort Abbildung:
Abbildung: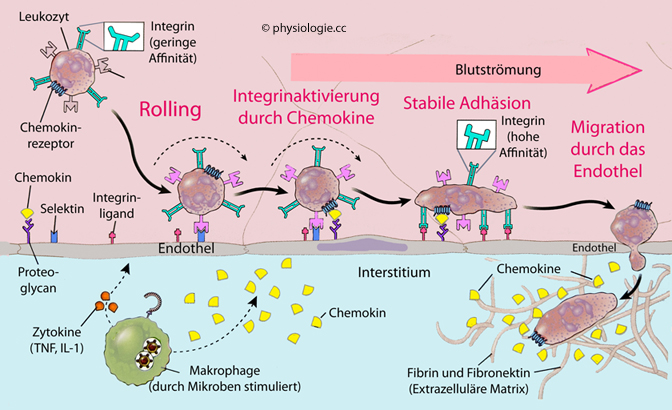
 Abbildung: Wie Leukozyten an Stellen einer Entzündung das Blut verlassen
Abbildung: Wie Leukozyten an Stellen einer Entzündung das Blut verlassen
 Abbildung skizzierten Vorgänge der Leukozytenmigration in das betreffende Gewebe:
Abbildung skizzierten Vorgänge der Leukozytenmigration in das betreffende Gewebe: Abbildung), darunter die Immunglobulin-Zelladhäsionsproteine VCAM und ICAM. Damit beginnen Umformungsprozesse im Zytoskelett der Leukozyten, welche in die dritte Phase münden:
Abbildung), darunter die Immunglobulin-Zelladhäsionsproteine VCAM und ICAM. Damit beginnen Umformungsprozesse im Zytoskelett der Leukozyten, welche in die dritte Phase münden: s. dort).
s. dort).  Rötung (rubor) - Vasodilatation
Rötung (rubor) - Vasodilatation  Erwärmung (calor) - Hyperämie
Erwärmung (calor) - Hyperämie Schwellung (tumor) - erhöhte Kapillarpermeabilität, vermehrte Filtration von Flüssigkeit in das Gewebe
Schwellung (tumor) - erhöhte Kapillarpermeabilität, vermehrte Filtration von Flüssigkeit in das Gewebe Schmerz (dolor) - Freisetzung von Mediatoren, die Nozizeptoren erregen
Schmerz (dolor) - Freisetzung von Mediatoren, die Nozizeptoren erregen Lokale Entzündungen folgen einem stereotypen Ablauf:
Lokale Entzündungen folgen einem stereotypen Ablauf: Histaminbedingte lokale Vasodilatation.
Diese erhöht den Zustrom von Blut zur Stelle der Irritation,
Plasmaproteine und weiße Blutkörperchen gelangen rasch zum
"Kampfgebiet".
Histaminbedingte lokale Vasodilatation.
Diese erhöht den Zustrom von Blut zur Stelle der Irritation,
Plasmaproteine und weiße Blutkörperchen gelangen rasch zum
"Kampfgebiet". Permeabilitätszunahme
postkapillärer Venolen. Proinflammatorische Zytokine (TNF-α, Histamin)
verursachen Lücken zwischen den Endothelzellen, Proteine treten
vermehrt in das Interstitium über, Mastzellen degranulieren und
Phagozyten werden aktiv.
Permeabilitätszunahme
postkapillärer Venolen. Proinflammatorische Zytokine (TNF-α, Histamin)
verursachen Lücken zwischen den Endothelzellen, Proteine treten
vermehrt in das Interstitium über, Mastzellen degranulieren und
Phagozyten werden aktiv. Endotheliale Expression von (die Leukozyten bremsenden) Adhäsionsmolekülen sowie Austritt (Diapedese) und zum Entzündungsherd gerichtete Migration von Leukozyten durch chemotaktisch wirkende Mediatoren.
Endotheliale Expression von (die Leukozyten bremsenden) Adhäsionsmolekülen sowie Austritt (Diapedese) und zum Entzündungsherd gerichtete Migration von Leukozyten durch chemotaktisch wirkende Mediatoren. 
 Abbildung: Anregung der adaptiven Immunität durch angeborene Immunantwort
Abbildung: Anregung der adaptiven Immunität durch angeborene Immunantwort
 Abbildung).
Abbildung). mittels Kostimulatoren (s. Definition - für die Aktivierung von T-Zellen: Aktivierung von Makrophagen),
mittels Kostimulatoren (s. Definition - für die Aktivierung von T-Zellen: Aktivierung von Makrophagen), mittels Komplementfaktoren (für die Aktivierung von B-Zellen: Opsonisierung),
mittels Komplementfaktoren (für die Aktivierung von B-Zellen: Opsonisierung), mittels Zytokinen (für die Aktivierung von T- und B-Zellen; entzündliche Reaktion).
mittels Zytokinen (für die Aktivierung von T- und B-Zellen; entzündliche Reaktion).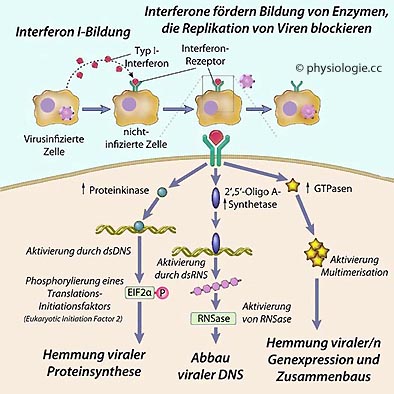
 Abbildung: Virenschutz durch Interferone
Abbildung: Virenschutz durch Interferone
 Abbildung).
Abbildung). 

 Das angeborene ("unspezifische") Immunsystem erkennt mikrobielle oder
die Abwesenheit körpereigener Merkmale. Zu den Komponenten gehören
intakte epitheliale Barrieren (Haut und Schleimhäute), Phagozyten,
Granulozyten, Monozyten und dendritische Zellen (diese regen naive
T-Zellen an und entscheiden über die Differenzierung von T-Helferzellen)
Das angeborene ("unspezifische") Immunsystem erkennt mikrobielle oder
die Abwesenheit körpereigener Merkmale. Zu den Komponenten gehören
intakte epitheliale Barrieren (Haut und Schleimhäute), Phagozyten,
Granulozyten, Monozyten und dendritische Zellen (diese regen naive
T-Zellen an und entscheiden über die Differenzierung von T-Helferzellen) Primäre lymphatische Organe (Knochenmark, Thymus) bilden frische
Immunzellen nach, sekundäre (Milz, Lymphknoten, lymphatische Gewebe)
fangen eindringende Pathogene ab und koordinieren die Aktivitäten des
Immunsystems. Täglich patrouillieren etwa 500 Milliarden Lymphozyten
durch sekundäre lymphatische Organe
Primäre lymphatische Organe (Knochenmark, Thymus) bilden frische
Immunzellen nach, sekundäre (Milz, Lymphknoten, lymphatische Gewebe)
fangen eindringende Pathogene ab und koordinieren die Aktivitäten des
Immunsystems. Täglich patrouillieren etwa 500 Milliarden Lymphozyten
durch sekundäre lymphatische Organe An primären Barrieren wirken An primären Barrieren wirken -- Defensine (aus Epithelien, Granulozyten, NK-Zellen, zytotoxischen T-Zellen), sie erkennen cholesterinarme Membranen und anionische Moleküle und wirken ähnlich wie Perforine; -- Cathelicidine (aus Epithelien und neutrophilen Granulozyten); -- Lysozyme (in Blutserum, Tränenflüssigkeit, Speichel, Atemtrakt, Zerebrospinalflüssigkeit, Zervixschleim, Fruchtwasser, Milch), greifen die Wand gram-positiver Bakterien an; -- Lactoferrin (antibakteriell und antiviral, entzieht phagozytierten Mikroorganismen Eisen); -- weitere Faktoren, wie saure Hydrolasen, Lysozym, Elastase (Abbau phagozytierter Mikroorganismen)  Entzündung führt zu Ansammlung von Plasmaproteinen, Leukozyten und Flüssigkeit mit
zellulären (Leukozyten) und humoralen Komponenten (Akutphasenproteine,
später Antikörper)
Entzündung führt zu Ansammlung von Plasmaproteinen, Leukozyten und Flüssigkeit mit
zellulären (Leukozyten) und humoralen Komponenten (Akutphasenproteine,
später Antikörper) Natürliche Killerzellen und das Komplementsystem schützen vor Viren und intrazellulären
Bakterien, Thrombozyten
nehmen Bakterien auf und wirken antimikrobiell Natürliche Killerzellen und das Komplementsystem schützen vor Viren und intrazellulären
Bakterien, Thrombozyten
nehmen Bakterien auf und wirken antimikrobiell Angeregt durch bakterielle Stoffwechselprodukte wie z.B.
Lipopolysaccharide, bilden Makrophagen und Monozyten lysosomal
Sauerstoffradikale und Stickoxid, diese
inaktivieren bakterielle Moleküle (oxidativer Burst) Angeregt durch bakterielle Stoffwechselprodukte wie z.B.
Lipopolysaccharide, bilden Makrophagen und Monozyten lysosomal
Sauerstoffradikale und Stickoxid, diese
inaktivieren bakterielle Moleküle (oxidativer Burst) Phagozyten nehmen rezeptorvermittelt (Mustererkennungsrezeptoren, z.B.
Toll-like Rezeptoren) Mikroorganismen auf, deren MAMPs
(microbe-associated molecular patterns) sie erkennen. Das aktiviert
u.a. das Komplementsystem, regt die Gerinnung an und beeinflusst
Entzündungsvorgänge
Phagozyten nehmen rezeptorvermittelt (Mustererkennungsrezeptoren, z.B.
Toll-like Rezeptoren) Mikroorganismen auf, deren MAMPs
(microbe-associated molecular patterns) sie erkennen. Das aktiviert
u.a. das Komplementsystem, regt die Gerinnung an und beeinflusst
Entzündungsvorgänge Opsonisierung erleichtert die Phagozytose durch Anlagerung von
Antikörpern oder Faktoren des Komplementsystems und erleichtert
Erkennung und Abwehr körperfremder Strukturen
Opsonisierung erleichtert die Phagozytose durch Anlagerung von
Antikörpern oder Faktoren des Komplementsystems und erleichtert
Erkennung und Abwehr körperfremder Strukturen Monozyten (kurzlebig, beteiligen sich an Phagozytose und
Antigenpräsentation), Makrophagen (wirken als Wächterzellen, töten
Erreger ab) und Granulozyten (neutrophile: antimikrobielle Kampfzellen,
eosinophile und basophile: bekämpfen Parasiten) beteiligen sich an
angeborener Immunität ebenso wie spezielle Zellen (lymphoide,
natürliche Killerzellen, nichtadaptive T- und B-Lymphozyten, Mastzellen)
Monozyten (kurzlebig, beteiligen sich an Phagozytose und
Antigenpräsentation), Makrophagen (wirken als Wächterzellen, töten
Erreger ab) und Granulozyten (neutrophile: antimikrobielle Kampfzellen,
eosinophile und basophile: bekämpfen Parasiten) beteiligen sich an
angeborener Immunität ebenso wie spezielle Zellen (lymphoide,
natürliche Killerzellen, nichtadaptive T- und B-Lymphozyten, Mastzellen) Zu Effektormolekülen gehören Pentraxine (z.B. C-reaktives Protein), Kollektine und Ficoline, sowie Komplementfaktoren Zu Effektormolekülen gehören Pentraxine (z.B. C-reaktives Protein), Kollektine und Ficoline, sowie Komplementfaktoren Das Komplementsystem wird durch aktivierte Antikörper oder Mikroben
aktiviert, über mehrere Pfade: Klassischer, alternativer oder
Lektinweg. Gemeinsam ist diesen Wegen die Aktivireung von C3, was
bereits Phagozyten rekrutiert, opsonisiert und / oder Immunkomplexe
entfernt; weitere Aktivierungsschritte (C5 bis C9) resultiert in
Membran-Angriffskomplexen und Lyse von Zielzellen
Das Komplementsystem wird durch aktivierte Antikörper oder Mikroben
aktiviert, über mehrere Pfade: Klassischer, alternativer oder
Lektinweg. Gemeinsam ist diesen Wegen die Aktivireung von C3, was
bereits Phagozyten rekrutiert, opsonisiert und / oder Immunkomplexe
entfernt; weitere Aktivierungsschritte (C5 bis C9) resultiert in
Membran-Angriffskomplexen und Lyse von Zielzellen |
