




 Atemgastransport im Blut; Hämatopoese
Atemgastransport im Blut; Hämatopoese
 Allosterischer Effekt: ἄλλως = anders, στερεός = Ort (Konformationsänderung)
Allosterischer Effekt: ἄλλως = anders, στερεός = Ort (Konformationsänderung)| 1
ml arterielles Blut kann 0,2 ml Sauerstoff aufnehmen - 70mal mehr als Blutplasma. Hämoglobin
(Hb) nimmt Sauerstoff in der Lunge auf und gibt ihn bei sinkendem
Partialdruck im Gewebe wieder ab. Die Sauerstoffabgabe des Hämoglobins an das Gewebe erfolgt bei einem relativ hohen Partialdruck, der eine gute O2-Versorgung der Zellen ermöglicht. Das zeigt sich in der sigmoiden Bindungskurve (O2-Bindung als Funktion des pO2), die auf einem allosterischen Effekt beruht. Das Bindungs-Abgabe-Verhalten des Hämoglobins ist von mehreren Faktoren beeinflusst: pCO2, pH (Bohr-Effekt), 2,3-DPG (2,3-Diphosphoglycerat), Temperatur. Feten müssen mit niedrigen pO2-Werten zurechtkommen. Sauerstoff wird in der Plazenta vom Blut der Mutter abgegeben, vom Blut des Feten aufgenommen: Fetales Hämoglobin (HbF) hat eine höhere O2-Bindungskraft als adultes (HbA). Auch hier wird Sauerstoff leichter abgegeben, wenn es der Stoffwechsel erfordert (pCO2, pH, 2,3-DPG). Sauerstoffbeladenes (oxygeniertes) Hämoglobin hat andere optische (spektrale) Eigenschaften als desoxygeniertes; auf diesem Prinzip beruht die Oximetrie, d.h. die nichtinvasive (transkutane) Messung der Sauerstoffsättigung des Blutes. Die Neubildung von Blutkörperchen (Hämatopoese) erfolgt im roten Knochenmark und ist gesteuert durch Wachstumsfaktoren und Interleukine (Leukozyten, Thrombozyten) sowie Erythropoetin (Erythrozyten). Die Freisetzung von Erythropoetin hängt von der Sauerstoffverfügbarkeit im Gewebe ab. Erythropoetin kann den Output an jungen Erythrozyten um ein Mehrfaches steigern (wie nach Blutverlust oder infolge chronischer Hypoxie, z.B. bei Höhenaufenthalt). |
 Löslichkeit, Henry-Gesetz
Löslichkeit, Henry-Gesetz  Temperatur, pH, pCO2, 2,3-DPG
Temperatur, pH, pCO2, 2,3-DPG  Fetales Hämoglobin
Fetales Hämoglobin  CO2-Transport im Blut
CO2-Transport im Blut  Bohr-, Haldane- und Hamburger-Effekt
Bohr-, Haldane- und Hamburger-Effekt  Arteriovenöse Sauerstoffdifferenz
Arteriovenöse Sauerstoffdifferenz  Hämatopoese
Hämatopoese  Erythropoetin
Erythropoetin  Kohlenmonoxid
Kohlenmonoxid Spektroskopie und Pulsoximetrie
Spektroskopie und Pulsoximetrie  Formen der Hypoxie
Formen der Hypoxie 
 Hüfner'sche Zahl
Hüfner'sche Zahl  Anämie
Anämie  Sauerstoffextraktion, arterio-venöse Sauerstoffdifferenz
Sauerstoffextraktion, arterio-venöse Sauerstoffdifferenz 
 Core messages
Core messages
 Abbildung: Umsatz der Atemgase
Abbildung: Umsatz der Atemgase
 - der rote Blutfarbstoff in den Erythrozyten (65 kDa molare Masse) - besteht aus jeweils vier eisenhältigen Häm- (
- der rote Blutfarbstoff in den Erythrozyten (65 kDa molare Masse) - besteht aus jeweils vier eisenhältigen Häm- ( Abbildung)
und Globinmolekülen (bei adultem Hämoglobin zwei α-Ketten zu jeweils
30,5 kDa und zwei ß-Ketten zu jeweils 32 kDa). Diese fügen sich in
einem tetrameren Arrangement zu einem Gesamtkomplex, nicht-kovalent zusammengehalten (Wasserstoffbrücken, ionale Bindungen). Die einzelnen Globinmoleküle haben eine sehr ähnliche Tertiärstruktur
wie Myoglobinmoleküle, die jeweils ein Sauerstoffmolekül anlagern
können (Hämoglobinmoleküle deren vier). Jeder Erythrozyt enthält
ungefähr eine Viertelmillion Hämoglobinmoleküle.
Abbildung)
und Globinmolekülen (bei adultem Hämoglobin zwei α-Ketten zu jeweils
30,5 kDa und zwei ß-Ketten zu jeweils 32 kDa). Diese fügen sich in
einem tetrameren Arrangement zu einem Gesamtkomplex, nicht-kovalent zusammengehalten (Wasserstoffbrücken, ionale Bindungen). Die einzelnen Globinmoleküle haben eine sehr ähnliche Tertiärstruktur
wie Myoglobinmoleküle, die jeweils ein Sauerstoffmolekül anlagern
können (Hämoglobinmoleküle deren vier). Jeder Erythrozyt enthält
ungefähr eine Viertelmillion Hämoglobinmoleküle.
 Hämoglobin (Hb) befindet sich in roten Blutkörperchen.
Hämoglobin (Hb) befindet sich in roten Blutkörperchen. Ein Hb-Molekül transportiert bis zu 4 O2-Moleküle von der Lunge zum Gewebe.
Ein Hb-Molekül transportiert bis zu 4 O2-Moleküle von der Lunge zum Gewebe. Es transportiert weiters H+ und CO2 aus dem Gewebe zur Lunge.
Es transportiert weiters H+ und CO2 aus dem Gewebe zur Lunge.
 Abbildung: Struktur eines Häms
Abbildung: Struktur eines Häms
 Abbildung). Das
kommt dem oxidativen Stoffwechsel zugute; der O2-Halbsättigungsdruck liegt (bei normalen Begleitumständen, wie pCO2,
Temperatur etc) bei 27 mmHg (3,6 kPa) - bei Myoglobin löst sich der
Sauerstoff erst bei viel niedrigeren Partialdruckwerten vom
Trägermolekül.
Abbildung). Das
kommt dem oxidativen Stoffwechsel zugute; der O2-Halbsättigungsdruck liegt (bei normalen Begleitumständen, wie pCO2,
Temperatur etc) bei 27 mmHg (3,6 kPa) - bei Myoglobin löst sich der
Sauerstoff erst bei viel niedrigeren Partialdruckwerten vom
Trägermolekül.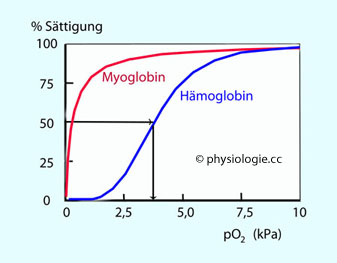
 Abbildung: Sauerstoffsättigung als Funktion des Sauerstoffpartialdrucks (Bindungskurve)
Abbildung: Sauerstoffsättigung als Funktion des Sauerstoffpartialdrucks (Bindungskurve) Sauerstoffsättigung ist der (prozentuale) Anteil von O2-Bindungsstellen
am Hämoglobin, die zu einem gegebenen Zeitpunkt mit Sauerstoffmolekülen
besetzt sind. Sie gibt an, wie stark im gegebenen Fall die Sauerstofftransportkapazität des Hämoglobins (ml O2 / g Hb) ausgenützt wird. Diese Kapazität beträgt normalerweise ~20 Volumsprozent (200 ml Sauerstoff pro Liter Blut; 1 g Hb bindet bis zu 1,34 ml O2, 1 l Blut enthält ~150 g Hb).
Sauerstoffsättigung ist der (prozentuale) Anteil von O2-Bindungsstellen
am Hämoglobin, die zu einem gegebenen Zeitpunkt mit Sauerstoffmolekülen
besetzt sind. Sie gibt an, wie stark im gegebenen Fall die Sauerstofftransportkapazität des Hämoglobins (ml O2 / g Hb) ausgenützt wird. Diese Kapazität beträgt normalerweise ~20 Volumsprozent (200 ml Sauerstoff pro Liter Blut; 1 g Hb bindet bis zu 1,34 ml O2, 1 l Blut enthält ~150 g Hb).
| Die Sauerstoffbindungskurve des Hämoglobins hat S-Form (sigmoide Form) Hämoglobin ist bei 27 mmHg pO2 zur Hälfte der verfügbaren Bindungsstellen mit Sauerstoff beladen |
 Über Diffusion s. dort
Über Diffusion s. dort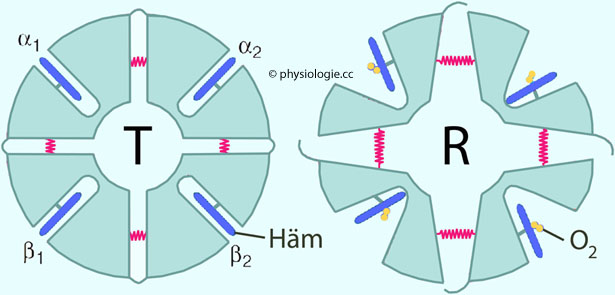
 Abbildung: Schema der quaternären Struktur des Hämoglobins mit vier Globin- und vier Häm-Molekülen
Abbildung: Schema der quaternären Struktur des Hämoglobins mit vier Globin- und vier Häm-Molekülen Abbildung oben) entweder mit
niedriger oder mit hoher Affinität angelagert (kooperative Bindung). Die Sauerstoffaffinität ist in der R-Form (relaxed) des Hämoglobins (rechts) etwa 150-mal größer als in der T-Form (tense) (links).
Abbildung oben) entweder mit
niedriger oder mit hoher Affinität angelagert (kooperative Bindung). Die Sauerstoffaffinität ist in der R-Form (relaxed) des Hämoglobins (rechts) etwa 150-mal größer als in der T-Form (tense) (links).

| 1g Hämoglobin kann 1,34 ml O2 binden |
 Die Hüfner'sche Zahl (Hüfner number) gibt an, wieviel Sauerstoff ein Gramm Hämoglobin binden kann - maximal 1,34 ml (ca. 60 µmol) pro g Hb.
Die Hüfner'sche Zahl (Hüfner number) gibt an, wieviel Sauerstoff ein Gramm Hämoglobin binden kann - maximal 1,34 ml (ca. 60 µmol) pro g Hb. Unter Anämie versteht
man eine reduzierte Sauerstofftransportkapazität des Blutes. Ein
häufiger Grund ist Mangel an biologisch verwertbarem Eisen
(Eisenmangelanämie), dieser macht sich in einer Reduktion der
Hämoglobinmenge im Blut bemerkbar.
Unter Anämie versteht
man eine reduzierte Sauerstofftransportkapazität des Blutes. Ein
häufiger Grund ist Mangel an biologisch verwertbarem Eisen
(Eisenmangelanämie), dieser macht sich in einer Reduktion der
Hämoglobinmenge im Blut bemerkbar.| Ein Gramm Hämoglobin bindet bis zu 1,34 Milliliter Sauerstoff (Hüfner'sche Zahl) Bei 150 g/l Hämoglobinkonzentration ergibt sich eine Transportkapazität von 200 ml O2/l Blut Mit der Hämoglobinkonzentration steigt / sinkt das Sauerstofftransportvermögen (O2-Bindungskapazität) des Blutes Gemischt-venöses Blut bei körperlicher Ruhe enthält zu ~75% O2-gesättigtes Hämoglobin Der Sauerstoffpartialdruck des Blutes alleine sagt nichts über seinen Sauerstoffgehalt aus. Bei einer Anämie ist die O2-Transportkapazität auch bei vollständiger O2-Sättigung des Hb reduziert |
 ): Nimmt eine der vier Hämgruppen O2 auf, wechselt das Molekül in eine Form, die O2 leichter bindet (hohe Sauerstoffaffinität besteht in der R-Form (relaxed), niedrige in der T-Form (tense) des Moleküls,
): Nimmt eine der vier Hämgruppen O2 auf, wechselt das Molekül in eine Form, die O2 leichter bindet (hohe Sauerstoffaffinität besteht in der R-Form (relaxed), niedrige in der T-Form (tense) des Moleküls,  Abbildung). Dadurch nimmt die Bindungskurve für Sauerstoff eine sigmoide Form an.
Abbildung). Dadurch nimmt die Bindungskurve für Sauerstoff eine sigmoide Form an.

 Abbildung: Sauerstoffsättigung des Hämoglobins als Funktion des Sauerstoff- (Abszisse) und CO2-Partialdrucks (Bindungskurven)
Abbildung: Sauerstoffsättigung des Hämoglobins als Funktion des Sauerstoff- (Abszisse) und CO2-Partialdrucks (Bindungskurven)
 Abbildung: Nimmt der pCO2 ab (Hypokapnie, Folge vermehrter Atmung), verlagert sich die Bindungskurve nach links, d.h. Hämoglobin gibt den Sauerstoff erst bei niedrigerem pO2 ab; nimmt er zu (Hyperkapnie), verlagert sich die Kurve nach rechts, und Sauerstoff wird schon bei höheren pO2-Werten an das Gewebe abgegeben (das in einer solchen Situation auch dringend mehr O2 braucht).
Abbildung: Nimmt der pCO2 ab (Hypokapnie, Folge vermehrter Atmung), verlagert sich die Bindungskurve nach links, d.h. Hämoglobin gibt den Sauerstoff erst bei niedrigerem pO2 ab; nimmt er zu (Hyperkapnie), verlagert sich die Kurve nach rechts, und Sauerstoff wird schon bei höheren pO2-Werten an das Gewebe abgegeben (das in einer solchen Situation auch dringend mehr O2 braucht).| Der Sauerstoff-Halbsättigungsdruck des Hämoglobins beträgt 3,6 kPa (27 mmHg) Steigt der Halbsättigungsdruck (Rechtsverschiebung der Bindungskurve), erfolgt in den Kapillaren die Abgabe von Sauerstoff an das Gewebe schon bei höheren pO2-Werten |
| H = c / p |
 Kapazitätskoeffizient β (µM / kPa) Kapazitätskoeffizient β (µM / kPa) Nach Dejours P, Principles of Comparative Respiratory Physiology. 2nd ed. Elsevier 1981 |
|||
| in Wasser (37°C) |
in Luft (37°C) |
||
| O2 | CO2 |
O2 | CO2 |
| 10,6 |
250 |
388 |
388 |
 Abbildung), wie
Abbildung), wie 
 Abbildung: Einflüsse auf die Hb-O2-Bindungskurve
Abbildung: Einflüsse auf die Hb-O2-Bindungskurve der pH-Wert (links): Höhere H+-Konzentration
- in diesem Beispiel pH 7,2, rosa Kurve - führt zu rascherem Freigeben
des Sauerstoffs, was den oxidativen Energiestoffwechsel erleichtert
der pH-Wert (links): Höhere H+-Konzentration
- in diesem Beispiel pH 7,2, rosa Kurve - führt zu rascherem Freigeben
des Sauerstoffs, was den oxidativen Energiestoffwechsel erleichtert die Temperatur (Mitte): Die O2-Bindungsfähigkeit nimmt mit sinkender Temperatur zu - niedrige
Temperaturen verlangsamen den Stoffwechsel und reduzieren den
Sauerstoffbedarf des Gewebes, was die Linksverschiebung der
Bindungskurve tolerierbar macht
die Temperatur (Mitte): Die O2-Bindungsfähigkeit nimmt mit sinkender Temperatur zu - niedrige
Temperaturen verlangsamen den Stoffwechsel und reduzieren den
Sauerstoffbedarf des Gewebes, was die Linksverschiebung der
Bindungskurve tolerierbar macht der pCO2-Wert (rechts): Die O2-Bindungsfähigkeit nimmt mit steigendem pCO2 ab, Sauerstoff rascher abgegeben, der oxidative Stoffwechsel wird durch das bessere Sauerstoffangebot unterstützt
der pCO2-Wert (rechts): Die O2-Bindungsfähigkeit nimmt mit steigendem pCO2 ab, Sauerstoff rascher abgegeben, der oxidative Stoffwechsel wird durch das bessere Sauerstoffangebot unterstützt
 pH-Wert (O2-Bindung steigt mit pH - Bohr-Effekt → je basischer das Blut, desto weiter nach links ist die Bindungskurve verschoben, Sauerstoff wird erst bei niedrigerem pO2 abgegeben).
pH-Wert (O2-Bindung steigt mit pH - Bohr-Effekt → je basischer das Blut, desto weiter nach links ist die Bindungskurve verschoben, Sauerstoff wird erst bei niedrigerem pO2 abgegeben).  Temperatur - die O2-Bindung nimmt mit abnehmender Temperatur zu (niedrige Temperaturen bremsen den Stoffwechsel, der Sauerstoffbedarf der Zellen nimmt ab)
Temperatur - die O2-Bindung nimmt mit abnehmender Temperatur zu (niedrige Temperaturen bremsen den Stoffwechsel, der Sauerstoffbedarf der Zellen nimmt ab)  CO2-Partialdruck (O2-Bindung sinkt mit pCO2 → Rechtsverschiebung der Sauerstoffbindungskurve mit steigendem Kohlendioxidpartialdruck)
CO2-Partialdruck (O2-Bindung sinkt mit pCO2 → Rechtsverschiebung der Sauerstoffbindungskurve mit steigendem Kohlendioxidpartialdruck)| Steigt die CO2-Abgabe (Hyperventilation), sinkt der pCO2 und nimmt die O2-Affinität des Hämoglobins zu |
 Konzentration an 2,3-Biphosphoglyzerat (2,3-BPG, 2,3-Diphosphoglyzerat 2,3-DPG)
in den Erythrozyten (
Konzentration an 2,3-Biphosphoglyzerat (2,3-BPG, 2,3-Diphosphoglyzerat 2,3-DPG)
in den Erythrozyten ( Abbildung).
Wie auch andere organische Phosphate (solche werden in den Erythrozyten
produziert), beeinflusst 2,3-DPG (als führender Vertreter) den
Halbsättigungswert des Hämoglobins: Die Hb-Affinität für Sauerstoff
nimmt ab, die O2-Versorgung des Gewebes zu.
Abbildung).
Wie auch andere organische Phosphate (solche werden in den Erythrozyten
produziert), beeinflusst 2,3-DPG (als führender Vertreter) den
Halbsättigungswert des Hämoglobins: Die Hb-Affinität für Sauerstoff
nimmt ab, die O2-Versorgung des Gewebes zu.
 Abbildung: Sauerstoffbindungskurve in Abhängigkeit von der 2,3-DPG-Konzentration in Erythrozyten
Abbildung: Sauerstoffbindungskurve in Abhängigkeit von der 2,3-DPG-Konzentration in Erythrozyten
 Abbildung oben) gebundenes 2,3-BPG
stabilisiert diese Form und verhindert den Übergang in die
sauerstoffaffine R-Form, die Bindungskurve verlagert sich nach rechts.
Abbildung oben) gebundenes 2,3-BPG
stabilisiert diese Form und verhindert den Übergang in die
sauerstoffaffine R-Form, die Bindungskurve verlagert sich nach rechts.| Steigt [2,3-BPG] in den Erythrozyten, nimmt die O2-Affinität des Hämoglobins ab |
 2,3-DPG bindet an ß-Ketten des adulten (HbA), nicht (oder nur geringgradig) an γ-Ketten, welche die ß-Ketten in fetalem Hämoglobin
(HbF) ersetzen. Daher wirkt 2,3-DPG (obzwar vorhanden) im fetalen Kreislauf kaum rechtsverschiebend auf die Bindungskurve - das fetale Blut hat
eine höhere Sauerstoffaffinität als das adulte, nimmt daher Sauerstoff in der Plazenta auf (wo es das Hämoglobin der Mutter schon abgibt) und transportiert O2 aus der Plazenta zum Feten, wo es den Sauerstoff erst bei niedrigerem pO2
an das fetale Gewebe abgibt (pränatal spielt sich das Leben relativ
hypoxisch ab). Nach der Geburt wird das HbF allmählich durch HbA
ersetzt, nach 4 bis 6 Monaten ist es aus dem Kreislauf komplett
verschwunden.
2,3-DPG bindet an ß-Ketten des adulten (HbA), nicht (oder nur geringgradig) an γ-Ketten, welche die ß-Ketten in fetalem Hämoglobin
(HbF) ersetzen. Daher wirkt 2,3-DPG (obzwar vorhanden) im fetalen Kreislauf kaum rechtsverschiebend auf die Bindungskurve - das fetale Blut hat
eine höhere Sauerstoffaffinität als das adulte, nimmt daher Sauerstoff in der Plazenta auf (wo es das Hämoglobin der Mutter schon abgibt) und transportiert O2 aus der Plazenta zum Feten, wo es den Sauerstoff erst bei niedrigerem pO2
an das fetale Gewebe abgibt (pränatal spielt sich das Leben relativ
hypoxisch ab). Nach der Geburt wird das HbF allmählich durch HbA
ersetzt, nach 4 bis 6 Monaten ist es aus dem Kreislauf komplett
verschwunden.

 Abbildung). Höhenakklimatisierte
Menschen haben erhöhte 2,3-DPG-Spiegel in ihren Erythrozyten, wie auch
Patienten mit Herz- oder Lungenerkrankungen mit verringerter
Sauerstoffzufuhr an das Gewebe.
Abbildung). Höhenakklimatisierte
Menschen haben erhöhte 2,3-DPG-Spiegel in ihren Erythrozyten, wie auch
Patienten mit Herz- oder Lungenerkrankungen mit verringerter
Sauerstoffzufuhr an das Gewebe. 
 Biphosphoglycerat-Mutase (BPGM) in Erythrozyten wandelt 1,3-DPG in 2,3-DPG um
Biphosphoglycerat-Mutase (BPGM) in Erythrozyten wandelt 1,3-DPG in 2,3-DPG um Chronische Hypoxie / Anämie steigert die BPGM-Aktivität und damit [2,3-DPG] in Erys
Chronische Hypoxie / Anämie steigert die BPGM-Aktivität und damit [2,3-DPG] in Erys Dadurch gibt Hämoglobin seinen Sauerstoff früher (bei höherem pO2) ab als sonst
Dadurch gibt Hämoglobin seinen Sauerstoff früher (bei höherem pO2) ab als sonst s. auch dort
s. auch dort Abbildung). Der Sinn liegt in einer besseren
Sauerstoffversorgung des Feten, der ja sonst aufgrund der
Partialdruckverhältnisse bei der Konkurrenz um Sauerstoff das Nachsehen
hätte.
Abbildung). Der Sinn liegt in einer besseren
Sauerstoffversorgung des Feten, der ja sonst aufgrund der
Partialdruckverhältnisse bei der Konkurrenz um Sauerstoff das Nachsehen
hätte.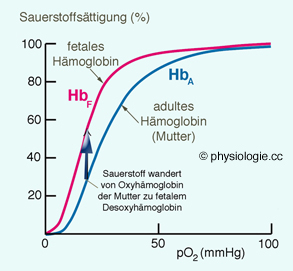
 Abbildung: HbF bindet Sauerstoff bei niedrigeren pO2-Werten als HbA...
Abbildung: HbF bindet Sauerstoff bei niedrigeren pO2-Werten als HbA...
 Näheres zum Sauerstofftransport im Neugeborenen und zum fetalen Hämoglobin s. dort
Näheres zum Sauerstofftransport im Neugeborenen und zum fetalen Hämoglobin s. dort Abbildung):
Abbildung):
 Abbildung: Kohlendioxidtransport im Blut
Abbildung: Kohlendioxidtransport im Blut Zu ~70% als Bicarbonat (dazu ist Carboanhydrase notwendig, sie beschleunigt die Umwandlung zwischen Kohlensäure einerseits, Kohlendioxid und Wasser andererseits), davon ~1/3 in den Erythrozyten und ~2/3 im Blutplasma (im Austausch gegen Chlorid: Hamburger-Effekt)
Zu ~70% als Bicarbonat (dazu ist Carboanhydrase notwendig, sie beschleunigt die Umwandlung zwischen Kohlensäure einerseits, Kohlendioxid und Wasser andererseits), davon ~1/3 in den Erythrozyten und ~2/3 im Blutplasma (im Austausch gegen Chlorid: Hamburger-Effekt) Zu ~23% in den Erythrozyten als Carbaminohämoglobin (Hb-CO2 - proteingebunden)
Zu ~23% in den Erythrozyten als Carbaminohämoglobin (Hb-CO2 - proteingebunden) Zu ~7% physikalisch gelöst (der pCO2 steigt von ~40 auf ~46 mmHg an).
Zu ~7% physikalisch gelöst (der pCO2 steigt von ~40 auf ~46 mmHg an).
 ~70% als Bicarbonat, das durch Einwirkung von Carboanhydrase rasch aus CO2 entsteht und dann zu 2/3 mittels eines HCO3-/Cl-Austauschers
in der Membran der Erythrozyten in das Blutplasma überwechselt
(Chlorid-shift, Hamburger-Effekt); 1/3 des Bicarbonats verbleibt in den Erythrozyten. In der Lunge läuft dieser Vorgang umgekehrt ab (s. weiter unten).
~70% als Bicarbonat, das durch Einwirkung von Carboanhydrase rasch aus CO2 entsteht und dann zu 2/3 mittels eines HCO3-/Cl-Austauschers
in der Membran der Erythrozyten in das Blutplasma überwechselt
(Chlorid-shift, Hamburger-Effekt); 1/3 des Bicarbonats verbleibt in den Erythrozyten. In der Lunge läuft dieser Vorgang umgekehrt ab (s. weiter unten). Als CO2 physikalisch gelöst, vorwiegend im Blutplasma (4-8%). Die in dieser Form transportierte Menge hängt vom herrschenden pCO2-Wert ab (Henry-Gesetz).
Als CO2 physikalisch gelöst, vorwiegend im Blutplasma (4-8%). Die in dieser Form transportierte Menge hängt vom herrschenden pCO2-Wert ab (Henry-Gesetz).  Als Carbaminohämoglobin - proteingebunden (an eine NH2-Gruppe des Hämoglobins) - in den Erythrozyten (20-27% des transportierten Kohlendioxids).
Als Carbaminohämoglobin - proteingebunden (an eine NH2-Gruppe des Hämoglobins) - in den Erythrozyten (20-27% des transportierten Kohlendioxids).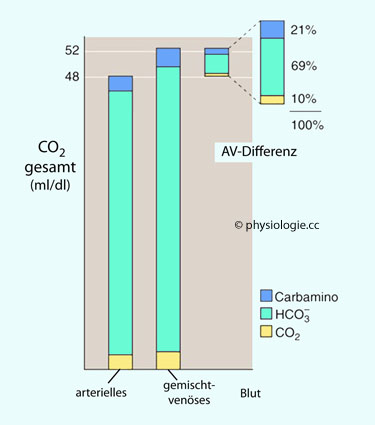
 Abbildung: CO2-Transport in arteriellem und gemischt-venösem Blut
Abbildung: CO2-Transport in arteriellem und gemischt-venösem Blut  Im Vollblut werden etwa 50 ml CO2 je 100 ml transportiert (
Im Vollblut werden etwa 50 ml CO2 je 100 ml transportiert ( Abbildung, arteriell ~48, gemischt-venös ~52) - zum Vergleich: 100 ml arterielles Blut transportieren etwa 20 ml O2 (s. oben).
Abbildung, arteriell ~48, gemischt-venös ~52) - zum Vergleich: 100 ml arterielles Blut transportieren etwa 20 ml O2 (s. oben).| Arterielles Blut enthält mehr als doppelt so viel CO2 als O2 |

 Abbildung: CO2-Bindungskurven in vollständig desoxygeniertem (blau), gemischt-venösem (violett) und arteriellem Blut (rot)
Abbildung: CO2-Bindungskurven in vollständig desoxygeniertem (blau), gemischt-venösem (violett) und arteriellem Blut (rot)
 Abbildung gezeigte Zusammenhang. Diese
Bindungskurven sind im physiologischen Partialdruckbereich wesentlich
steiler als diejenigen für Sauerstoff (Hämoglobin), der arterio-venöse
Partialdruckunterschied (~40 und ~46 mmHg) beträgt nur etwa ein Zehntel
dessen, was für Sauerstoff gilt (~40 und ~100 mmHg,
Abbildung gezeigte Zusammenhang. Diese
Bindungskurven sind im physiologischen Partialdruckbereich wesentlich
steiler als diejenigen für Sauerstoff (Hämoglobin), der arterio-venöse
Partialdruckunterschied (~40 und ~46 mmHg) beträgt nur etwa ein Zehntel
dessen, was für Sauerstoff gilt (~40 und ~100 mmHg,  s. oben).
s. oben). H2CO3
H2CO3  H+ + HCO3-). Daraus ergeben sich zwei Effekte, die als Bohr- und Haldane-Effekt bezeichnet werden:
H+ + HCO3-). Daraus ergeben sich zwei Effekte, die als Bohr- und Haldane-Effekt bezeichnet werden:
 Abbildung: "Hämoglobin-Muli"
Abbildung: "Hämoglobin-Muli" Der Hämoglobin-Muli kann die
Last von O2 und CO2 / H+ nicht gleichzeitig voll tragen
- wird eine Seite aufgefüllt, fällt an der Gegenseite ein Teil wieder herunter... Fazit:
Der Hämoglobin-Muli kann die
Last von O2 und CO2 / H+ nicht gleichzeitig voll tragen
- wird eine Seite aufgefüllt, fällt an der Gegenseite ein Teil wieder herunter... Fazit: (Lact-) Azidose treibt Sauerstoff von Hämoglobin (Bohr-Effekt), das kommt der oxidativen Energiegewinnung des Gewebes zugute
(Lact-) Azidose treibt Sauerstoff von Hämoglobin (Bohr-Effekt), das kommt der oxidativen Energiegewinnung des Gewebes zugute Abnehmender pO2 erhöht den H+-Transport des Hämoglobins (Haldane-Effekt), Säuren werden besser abgepuffert
Abnehmender pO2 erhöht den H+-Transport des Hämoglobins (Haldane-Effekt), Säuren werden besser abgepuffert
 Bohr-Effekt:
Bohr-Effekt:  Die O2-Bindungsfähigkeit
des Hämoglobins ist abhängig von pH-Wert (und damit indirekt von pCO2), Ansäuerung senkt die Sauerstoff-Affinität, Alkalisierung steigert sie.
Die O2-Bindungsfähigkeit
des Hämoglobins ist abhängig von pH-Wert (und damit indirekt von pCO2), Ansäuerung senkt die Sauerstoff-Affinität, Alkalisierung steigert sie. 1904 beschrieben Christian Bohr, Karl Hasselbalch und August Krogh den Einfluss des Kohlendioxidpartialdrucks auf den Sauerstoff-Halbsättigungswert des Hämoglobins: Durch Lösung von CO2 in Wasser entstandene Protonen binden an Aminosäuren der Globinmoleküle ("Bohr-Protonen") und verändern so die O2-Affinität des Hämoglobins (Stabilisierung der T-Form: "Normaler" Bohr-Effekt).
1904 beschrieben Christian Bohr, Karl Hasselbalch und August Krogh den Einfluss des Kohlendioxidpartialdrucks auf den Sauerstoff-Halbsättigungswert des Hämoglobins: Durch Lösung von CO2 in Wasser entstandene Protonen binden an Aminosäuren der Globinmoleküle ("Bohr-Protonen") und verändern so die O2-Affinität des Hämoglobins (Stabilisierung der T-Form: "Normaler" Bohr-Effekt). Haldane-Effekt:
Haldane-Effekt:  Das CO2-Transportvermögen
des Blutes nimmt mit steigendem O2-Partialdruck ab und umgekehrt.
Das CO2-Transportvermögen
des Blutes nimmt mit steigendem O2-Partialdruck ab und umgekehrt. Der nach ihm benannte Effekt wurde 1914 von J.S. Haldane
und seinen Mitarbeitern beschrieben. Die Stärke des Haldane-Effekts
kann über den Quotienten Mol freigesetzte Protonen pro Mol an Hb
gebundener Sauerstoff quantifiziert werden.
Der nach ihm benannte Effekt wurde 1914 von J.S. Haldane
und seinen Mitarbeitern beschrieben. Die Stärke des Haldane-Effekts
kann über den Quotienten Mol freigesetzte Protonen pro Mol an Hb
gebundener Sauerstoff quantifiziert werden.
 In arteriellem Blut (pO2 von ~15 kPa) beträgt die pro Liter gelöste Sauerstoffmenge 3 ml/l (das ist knapp 1,5% der Gesamtmenge, der Großteil - rund 200 ml/l - ist an Hämoglobin angelagert); in venösem Blut hängt die Menge vom Partialdruck ab, bei körperlicher Ruhe ist es ~1 ml/l.
In arteriellem Blut (pO2 von ~15 kPa) beträgt die pro Liter gelöste Sauerstoffmenge 3 ml/l (das ist knapp 1,5% der Gesamtmenge, der Großteil - rund 200 ml/l - ist an Hämoglobin angelagert); in venösem Blut hängt die Menge vom Partialdruck ab, bei körperlicher Ruhe ist es ~1 ml/l. Kohlendioxid
löst sich wesentlich besser; bei 40 mmHg (~5 kPa) Partialdruck ergibt
sich ein Wert von ~20 ml/l (das sind etwa 4% der Gesamtmenge von ~500 ml/l).
Kohlendioxid
löst sich wesentlich besser; bei 40 mmHg (~5 kPa) Partialdruck ergibt
sich ein Wert von ~20 ml/l (das sind etwa 4% der Gesamtmenge von ~500 ml/l). ) bezeichnet.
) bezeichnet. | Chlorid-shift: Bicarbonat wird gegen Chlorid über die Zellmembran (z.B. des Erythrozyten) ausgetauscht |
 Desoxygeniertes Hämoglobin kann wesentlich mehr Kohlendioxid in Form von HbCO2 binden als oxygeniertes; etwa 30% des CO2, welches das Gewebe verlässt, tut dies in der Form von Carbaminohämoglobin.
Desoxygeniertes Hämoglobin kann wesentlich mehr Kohlendioxid in Form von HbCO2 binden als oxygeniertes; etwa 30% des CO2, welches das Gewebe verlässt, tut dies in der Form von Carbaminohämoglobin. So verbrauchen die Nieren
nur 6-7% des arteriell
angebotenen Sauerstoffs (hoher Anteil funktioneller Durchblutung,
geringer Anteil nutritiver Durchblutung), das Blut in der v. renalis
ist weitgehend sauerstoffgesättigt
So verbrauchen die Nieren
nur 6-7% des arteriell
angebotenen Sauerstoffs (hoher Anteil funktioneller Durchblutung,
geringer Anteil nutritiver Durchblutung), das Blut in der v. renalis
ist weitgehend sauerstoffgesättigt Der Herzmuskel hingegen ~60% des arteriell
angebotenen Sauerstoffs (ausbelastete Muskulatur bis zu ~90%)
Der Herzmuskel hingegen ~60% des arteriell
angebotenen Sauerstoffs (ausbelastete Muskulatur bis zu ~90%) Das Gehirn nimmt im Schnitt weniger als 30% des arteriell angebotenen
Sauerstoffs in Anspruch; aktive graue Substanz verbraucht deutlich mehr als weiße und hat eine O2-Extraktion von ~35%
Das Gehirn nimmt im Schnitt weniger als 30% des arteriell angebotenen
Sauerstoffs in Anspruch; aktive graue Substanz verbraucht deutlich mehr als weiße und hat eine O2-Extraktion von ~35% Skelettmuskeln
verbrauchen im Ruhezustand etwa 28%, bei Ausbelastung bis zu 90% des
arteriell angebotenen Sauerstoffs. Das bedeutet auch, dass die O2-Sättigung des gemischt-venösen Blutes
bei körperlicher Belastung abnimmt - von ~75% bei körperlicher Ruhe)auf ~10% bei Ausbelastung (die Skelettmuskulatur konsumiert
dann den Großteil des Herzminutenvolumens).
Skelettmuskeln
verbrauchen im Ruhezustand etwa 28%, bei Ausbelastung bis zu 90% des
arteriell angebotenen Sauerstoffs. Das bedeutet auch, dass die O2-Sättigung des gemischt-venösen Blutes
bei körperlicher Belastung abnimmt - von ~75% bei körperlicher Ruhe)auf ~10% bei Ausbelastung (die Skelettmuskulatur konsumiert
dann den Großteil des Herzminutenvolumens).| Körperliche Belastung reduziert die Sauerstoffsättigung gemischt-venösen Blutes |
 Unter Sauerstoffextraktion (oxygen extraction ratio OER) versteht man den Quotienten zwischen O2-Antransport und O2-Verbrauch (delivery / consumption) - der als Fraktion oder in % angegeben werden kann -, unter arterio-venöser Sauerstoffdifferenz (AVDO2) den Unterschied
zwischen arterieller und venöser O2-Konzentration (
Unter Sauerstoffextraktion (oxygen extraction ratio OER) versteht man den Quotienten zwischen O2-Antransport und O2-Verbrauch (delivery / consumption) - der als Fraktion oder in % angegeben werden kann -, unter arterio-venöser Sauerstoffdifferenz (AVDO2) den Unterschied
zwischen arterieller und venöser O2-Konzentration ( Näheres s. dort). In der Niere beträgt die arterio-venöse Differenz ~1 Vol%, im Gehirn <6
Vol%, im Herzmuskel ≥12 Vol% (entsprechend einer OER von ca. 60%).
Näheres s. dort). In der Niere beträgt die arterio-venöse Differenz ~1 Vol%, im Gehirn <6
Vol%, im Herzmuskel ≥12 Vol% (entsprechend einer OER von ca. 60%).  vgl. dort
vgl. dort Abbildung).
Abbildung).
 Abbildung: Hämatopoese
Abbildung: Hämatopoese CFU, colony forming unit (B:
basophil, E: erythroid, Eo: eosinophil, G: granulozytär, GEMM:
granulozytär, erythroid, megakaryozytär, makrophagisch, GM:
granulozytär / makrophagisch, M: makrophagisch, Meg: megakaryozytär,
MegE: megakaryozytär / erythroid)
CFU, colony forming unit (B:
basophil, E: erythroid, Eo: eosinophil, G: granulozytär, GEMM:
granulozytär, erythroid, megakaryozytär, makrophagisch, GM:
granulozytär / makrophagisch, M: makrophagisch, Meg: megakaryozytär,
MegE: megakaryozytär / erythroid)  CMP, common myeloid progenitor
CMP, common myeloid progenitor  CLP, common lymphoid progenitor
CLP, common lymphoid progenitor  GMP, granulocyte-macrophage progenitor
GMP, granulocyte-macrophage progenitor  MEP, megakaryocyte-erythroid progenitor
MEP, megakaryocyte-erythroid progenitor  Eosinophile, basophile, neutrophile Granulozyten
Eosinophile, basophile, neutrophile Granulozyten  Monozyten
Monozyten EPO, Erythropoetin
EPO, Erythropoetin  TPO, Thrombopoetin
TPO, Thrombopoetin  IL, Interleukin
IL, Interleukin
 Abbildung: Erythropoese
Abbildung: Erythropoese CMP, common myeloid progenitor
CMP, common myeloid progenitor  MEP, megakaryocyte-erythroid progenitor
MEP, megakaryocyte-erythroid progenitor  BFU-E,
burst forming unit-erythroid
BFU-E,
burst forming unit-erythroid  EPO, Erythropoetin
EPO, Erythropoetin  CFU-E, colony forming unit - erythroid
CFU-E, colony forming unit - erythroid
 Abbildung zeigt die Schritte bei der Entstehung von Erythrozyten
aus Stammzellen (Erythropoese). Der Schritt zu Proerythroblasten kann nur unter der
Wirkung von Erythropoetin vollzogen werden. Hämoglobin
taucht erst in polychromatischen Erythroblasten auf, seine Menge wächst
(bis auf 5,5 mM, ein vergleichsweise extrem hoher Wert, entsprechend ca. 34 g/dl MCHC), bis Zellkern und Ribosomen abgegeben werden und deshalb keine weitere Proteinsynthese stattfinden kann.
Abbildung zeigt die Schritte bei der Entstehung von Erythrozyten
aus Stammzellen (Erythropoese). Der Schritt zu Proerythroblasten kann nur unter der
Wirkung von Erythropoetin vollzogen werden. Hämoglobin
taucht erst in polychromatischen Erythroblasten auf, seine Menge wächst
(bis auf 5,5 mM, ein vergleichsweise extrem hoher Wert, entsprechend ca. 34 g/dl MCHC), bis Zellkern und Ribosomen abgegeben werden und deshalb keine weitere Proteinsynthese stattfinden kann.| Sauerstoffmangel (wie bei Blutverlust oder Höhenaufenthalt) führt zu verstärkter Bildung von Erythropoetin |
 Abbildung).
Abbildung).
 Hypoxie steigert die Menge des verfügbaren HIF, und HIF-1α erhöht die Produktion von EPO-mRNS.
Hypoxie steigert die Menge des verfügbaren HIF, und HIF-1α erhöht die Produktion von EPO-mRNS.| Bei Sauerstoffmangel intensiviert HIF die Expression des Erythropoetin-Gens |
 Erythropoetin ist für die Differenzierung von BFU-Es essentiell,
Erythropoetin ist für die Differenzierung von BFU-Es essentiell, 
 Abbildung: Erythropoetin im Blutplasma als Funktion des Hämatokrit
Abbildung: Erythropoetin im Blutplasma als Funktion des Hämatokrit
 Erythropoetin (Serum)
Erythropoetin (Serum)
 Abbildung: Sauerstoffverfügbarkeit und Erythropoetin
Abbildung: Sauerstoffverfügbarkeit und Erythropoetin
 Abbildung)
Abbildung)  lokalen pO2-Abfall, z.B. bei verringerter Nierendurchblutung,
lokalen pO2-Abfall, z.B. bei verringerter Nierendurchblutung,  zentrale Hypoxie (niedriger arterieller pO2
- z.B. Höhenaufenthalt),
zentrale Hypoxie (niedriger arterieller pO2
- z.B. Höhenaufenthalt), bei ungewöhnlich hoher Sauerstoffaffinität des Hämoglobins: So führt Zufuhr von
alkalotischem oder von konserviertem Blut mit niedrigem 2,3-DPG-Spiegel
beim Empfänger zu gesteigerter Produktion von Erythropoetin.
bei ungewöhnlich hoher Sauerstoffaffinität des Hämoglobins: So führt Zufuhr von
alkalotischem oder von konserviertem Blut mit niedrigem 2,3-DPG-Spiegel
beim Empfänger zu gesteigerter Produktion von Erythropoetin.  FLT-3/FLK-2 = Rezeptor-Tyrosinkinase, diese aktiviert zusammen mit Interleukinen und anderen Wachstumsfaktoren (SCF = stem cell factor, G-CSF = granulocyte-colony stimulating factor u.a.) Stammzellen zu pluripotenten CFUs
FLT-3/FLK-2 = Rezeptor-Tyrosinkinase, diese aktiviert zusammen mit Interleukinen und anderen Wachstumsfaktoren (SCF = stem cell factor, G-CSF = granulocyte-colony stimulating factor u.a.) Stammzellen zu pluripotenten CFUs Andererseits wird einigen Faktoren eine bremsende Wirkung auf die Aktivierung von Stammzellen zugeschrieben (MIP = macrophage inflammatory protein, TGF = transforming growth factor).
Andererseits wird einigen Faktoren eine bremsende Wirkung auf die Aktivierung von Stammzellen zugeschrieben (MIP = macrophage inflammatory protein, TGF = transforming growth factor). Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort CO bindet ~240mal stärker an Hämoglobin
als Sauerstoff. In der Nähe von dichtbefahrenen Straßen oder in
verrauchten Räumen kann der COHb-Anteil im Blut über 5% betragen. Bei
Tauchern kann es zu Vergiftungen kommen, wenn CO-hältige Luft als
Atemgas komprimiert und über längere Zeit aus dem SCUBA-System geatmet wird -
CO bindet ~240mal stärker an Hämoglobin
als Sauerstoff. In der Nähe von dichtbefahrenen Straßen oder in
verrauchten Räumen kann der COHb-Anteil im Blut über 5% betragen. Bei
Tauchern kann es zu Vergiftungen kommen, wenn CO-hältige Luft als
Atemgas komprimiert und über längere Zeit aus dem SCUBA-System geatmet wird -  s. auch dort.
s. auch dort.| VCO = DCO x ΔpCO |
 Über Kohlenmonoxid als Signalstoff s. dort
Über Kohlenmonoxid als Signalstoff s. dort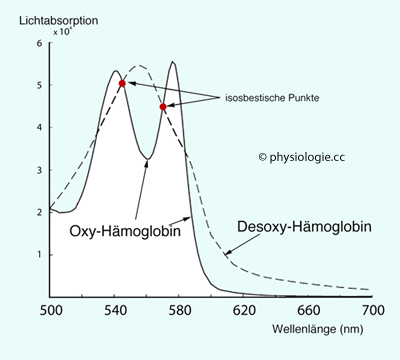
 Abbildung: Spektroskopie von Hämoglobin
Abbildung: Spektroskopie von Hämoglobin Punkte
befinden sich bei Wellenlängen, bei denen sich die Lichtabsorption eines
Systems im Verlauf einer Reaktion nicht ändert - in diesem Fall
zwischen oxygeniertem und desoxygeniertem Zustand.
Punkte
befinden sich bei Wellenlängen, bei denen sich die Lichtabsorption eines
Systems im Verlauf einer Reaktion nicht ändert - in diesem Fall
zwischen oxygeniertem und desoxygeniertem Zustand. 
 Abbildung). Dies macht man sich in der Pulsoximetrie zunutze, mit der man in der Klinik die Sauerstoffsättigung des Blutes
perkutan abschätzen kann. Normalerweise beträgt der Sättigungswert (SpO2, saturation of peripheral oxygen) mindestens 95%.
Abbildung). Dies macht man sich in der Pulsoximetrie zunutze, mit der man in der Klinik die Sauerstoffsättigung des Blutes
perkutan abschätzen kann. Normalerweise beträgt der Sättigungswert (SpO2, saturation of peripheral oxygen) mindestens 95%.  Abbildung).
Abbildung).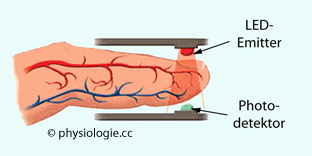
 Abbildung: Pulsoximetrie-Aufbau zur Ermittlung der Sauerstoffsättigung des Hämoglobins
Abbildung: Pulsoximetrie-Aufbau zur Ermittlung der Sauerstoffsättigung des Hämoglobins
 Diffusionsbedingte Hypoxie (peripher): Zu große Diffusionsstrecken
(Hypertophie des Gewebes) und / oder zu geringe Kapillarisierung
erschweren den physikalischen Übertritt des Sauerstoffs aus dem Blut zu
den Zellen
Diffusionsbedingte Hypoxie (peripher): Zu große Diffusionsstrecken
(Hypertophie des Gewebes) und / oder zu geringe Kapillarisierung
erschweren den physikalischen Übertritt des Sauerstoffs aus dem Blut zu
den Zellen Ischämische Hypoxie: Unterdurchblutung (Herzinsuffizienz, Atherosklerose u.a.)
Ischämische Hypoxie: Unterdurchblutung (Herzinsuffizienz, Atherosklerose u.a.) Anämische Hypoxie: Verringerte Sauerstofftransportkapazität des Blutes (Anämie)
Anämische Hypoxie: Verringerte Sauerstofftransportkapazität des Blutes (Anämie) Hypoxische Hypoxie: Reduzierter arterieller Sauerstoffpartialdruck (Sauerstoffmangel in der Atemluft, gestörte Ventilation - neurogen? - oder Diffusion in der Lunge)
Hypoxische Hypoxie: Reduzierter arterieller Sauerstoffpartialdruck (Sauerstoffmangel in der Atemluft, gestörte Ventilation - neurogen? - oder Diffusion in der Lunge)

 Normale Hämoglobinkonzentration (~150 g/l)
vorausgesetzt, nimmt Blut bei 100 mmHg pO2 70-mal mehr (~200 ml/l: Transportkapazität) Sauerstoff auf als sich bei diesem Partialdruck physikalisch (~3 ml/l) löst (der pO2 alleine sagt nichts über den O2-Gehalt des Blutes aus). Grund ist die Bindung von O2 an das (eisenhaltige) Häm (Hüfner'sche Zahl: 1g Hämoglobin kann 1,34 ml O2 binden). O2 wird von Hämoglobin (4 Häm-Gruppen) bei höherem pO2 entkoppelt / an das Gewebe abgegeben (S-förmige Bindungskurve) als bei Myoglobin: Der Halbsättigungsdruck (Hälfte der verfügbaren Bindungsstellen mit O2 beladen) liegt bei
~27 mmHg (Allosterie: Nimmt eine der Hämgruppen O2 auf, nehmen die anderen O2 leichter auf - R-Form = hohe, T-Form = niedrige Affinität). Die Hämoglobinkonzentration bestimmt das Sauerstofftransportvermögen des Blutes. Bei körperlicher Ruhe enthält gemischt-venöses Blut ~75% O2-gesättigtes Hämoglobin. Hämoglobin transportiert auch CO2 und nimmt an der Blutpufferung teil. Bohr-Effekt: Mit steigendem pCO2 verläuft die O2-Bindungskurve flacher (rechtsverschoben), O2 wird leichter an das Gewebe abgegeben Normale Hämoglobinkonzentration (~150 g/l)
vorausgesetzt, nimmt Blut bei 100 mmHg pO2 70-mal mehr (~200 ml/l: Transportkapazität) Sauerstoff auf als sich bei diesem Partialdruck physikalisch (~3 ml/l) löst (der pO2 alleine sagt nichts über den O2-Gehalt des Blutes aus). Grund ist die Bindung von O2 an das (eisenhaltige) Häm (Hüfner'sche Zahl: 1g Hämoglobin kann 1,34 ml O2 binden). O2 wird von Hämoglobin (4 Häm-Gruppen) bei höherem pO2 entkoppelt / an das Gewebe abgegeben (S-förmige Bindungskurve) als bei Myoglobin: Der Halbsättigungsdruck (Hälfte der verfügbaren Bindungsstellen mit O2 beladen) liegt bei
~27 mmHg (Allosterie: Nimmt eine der Hämgruppen O2 auf, nehmen die anderen O2 leichter auf - R-Form = hohe, T-Form = niedrige Affinität). Die Hämoglobinkonzentration bestimmt das Sauerstofftransportvermögen des Blutes. Bei körperlicher Ruhe enthält gemischt-venöses Blut ~75% O2-gesättigtes Hämoglobin. Hämoglobin transportiert auch CO2 und nimmt an der Blutpufferung teil. Bohr-Effekt: Mit steigendem pCO2 verläuft die O2-Bindungskurve flacher (rechtsverschoben), O2 wird leichter an das Gewebe abgegeben  Henry-Gesetz: Mit
steigendem Partialdruck nimmt die Lösung von Gasen zu. Über den Löslichkeitskoeffizienten kann die gelöste Gasmenge aus
dem Partialdruck berechnet werden. In Blut ist die Löslichkeit von CO2
~20-mal höher als die von O2 (und diese viel höher als die von N2). Die O2-Bindung des Hämoglobins hängt ab von Temperatur, pH, pCO2 und 2,3-DPG (~5 mM) im Ery - die Sauerstoffabgabe an das Gewebe wird begünstigt durch CO2, H+-Ionen, 2,3-DPG und Temperaturanstieg. Fetale Hämoglobine (HbF, unmittelbar postpartal ~80%) haben eine stärkere O2-Bindung als HbA. Kohlenmonoxid (CO) bindet >200mal stärker an Hämoglobin als O2,
bei 0,1% Volumenanteil in der Luft ist >50% des Hämoglobins
blockiert. Dazu kommt, dass CO die S-Form der Bindungskurve
verschwinden lässt (linksverschiebt) Henry-Gesetz: Mit
steigendem Partialdruck nimmt die Lösung von Gasen zu. Über den Löslichkeitskoeffizienten kann die gelöste Gasmenge aus
dem Partialdruck berechnet werden. In Blut ist die Löslichkeit von CO2
~20-mal höher als die von O2 (und diese viel höher als die von N2). Die O2-Bindung des Hämoglobins hängt ab von Temperatur, pH, pCO2 und 2,3-DPG (~5 mM) im Ery - die Sauerstoffabgabe an das Gewebe wird begünstigt durch CO2, H+-Ionen, 2,3-DPG und Temperaturanstieg. Fetale Hämoglobine (HbF, unmittelbar postpartal ~80%) haben eine stärkere O2-Bindung als HbA. Kohlenmonoxid (CO) bindet >200mal stärker an Hämoglobin als O2,
bei 0,1% Volumenanteil in der Luft ist >50% des Hämoglobins
blockiert. Dazu kommt, dass CO die S-Form der Bindungskurve
verschwinden lässt (linksverschiebt) 100 ml Blut enthalten etwa 50 ml CO2, venöses
~10% mehr als arterielles. CO2 ist zu ~4% physikalisch gelöst (pCO2 40 → 46 mmHg), zu ~6% proteingebunden
(Carbaminohämoglobin), 90% als Bicarbonat (Carboanhydrase) - davon 1/3
in Erythrozyten, 2/3 im Blutplasma (Austausch gegen Chloridionen:
Chloride shift). Die Lage der Bindungskurve hängt vom pO2 ab (Haldane-Effekt): Erys können CO2
umso leichter aufnehmen, je geringer die Sauerstoffbeladung des
Hämoglobins ist, was den Transport aus dem Gewebe zur Lunge erleichtert. Sauerstoff einerseits, H+-Ionen / CO2 andererseits beeinflussen einander gegenseitig: Azidose treibt O2 von Hämoglobin (Bohr-Effekt), sinkender pO2 erhöht den H+-Transport (Pufferung) des Hämoglobins (Haldane-Effekt) - und umgekehrt. CO2
wird durch die Wirkung der Carboanhydrase rasch zu Bicarbonat
umgewandelt und gelangt im Austausch gegen Chloridionen in das
Blutplasma ("Hamburger-shift"), H+-Ionen
binden an Hämoglobin. Die Vorgänge kehren sich in der Lunge um,
Sauerstoff gelangt in das Blut und Kohlendioxid in die Alveolarluft 100 ml Blut enthalten etwa 50 ml CO2, venöses
~10% mehr als arterielles. CO2 ist zu ~4% physikalisch gelöst (pCO2 40 → 46 mmHg), zu ~6% proteingebunden
(Carbaminohämoglobin), 90% als Bicarbonat (Carboanhydrase) - davon 1/3
in Erythrozyten, 2/3 im Blutplasma (Austausch gegen Chloridionen:
Chloride shift). Die Lage der Bindungskurve hängt vom pO2 ab (Haldane-Effekt): Erys können CO2
umso leichter aufnehmen, je geringer die Sauerstoffbeladung des
Hämoglobins ist, was den Transport aus dem Gewebe zur Lunge erleichtert. Sauerstoff einerseits, H+-Ionen / CO2 andererseits beeinflussen einander gegenseitig: Azidose treibt O2 von Hämoglobin (Bohr-Effekt), sinkender pO2 erhöht den H+-Transport (Pufferung) des Hämoglobins (Haldane-Effekt) - und umgekehrt. CO2
wird durch die Wirkung der Carboanhydrase rasch zu Bicarbonat
umgewandelt und gelangt im Austausch gegen Chloridionen in das
Blutplasma ("Hamburger-shift"), H+-Ionen
binden an Hämoglobin. Die Vorgänge kehren sich in der Lunge um,
Sauerstoff gelangt in das Blut und Kohlendioxid in die Alveolarluft Die Nieren verbrauchen nur 6-7% des arteriell angebotenen Sauerstoffs, Gehirn (graue > weiße Substanz) und Skelettmuskeln im Ruhezustand <30%, Herzmuskel ~60% (ausbelastet bis ~90%). Der Unterschied zwischen arterieller und venöser O2-Menge heißt Sauerstoffextraktion oder arterio-venöse Sauerstoffdifferenz (AVDO2).
Der Körper verbraucht in Ruhe nbur 1/4 des arteriell angelieferten
Sauerstoffs (25% Ausnützung, 75% Reserve); mit zunehmender körperlicher
Belastung steigt die AVDO2 auf bis zu 90% Ausnützung Die Nieren verbrauchen nur 6-7% des arteriell angebotenen Sauerstoffs, Gehirn (graue > weiße Substanz) und Skelettmuskeln im Ruhezustand <30%, Herzmuskel ~60% (ausbelastet bis ~90%). Der Unterschied zwischen arterieller und venöser O2-Menge heißt Sauerstoffextraktion oder arterio-venöse Sauerstoffdifferenz (AVDO2).
Der Körper verbraucht in Ruhe nbur 1/4 des arteriell angelieferten
Sauerstoffs (25% Ausnützung, 75% Reserve); mit zunehmender körperlicher
Belastung steigt die AVDO2 auf bis zu 90% Ausnützung  Spezifische Wachstumsfaktoren steuern die Hämatopoese: Aus einer pluripotenten Stammzelle entstehen >103 Erys. An Verzweigungspunkten entscheiden Wachstumsfaktoren über den weiteren Weg der Teilung. Peritubuläre Zellen der Niere bilden bei Sauerstoffmangel / vermindertem Hämatokrit vermehrt Erythropoetin (der hypoxie-induzierbare Faktor intensiviert die Expression des EPO-Gens); dieses wirkt über Janus-Kinase- Rezeptoren (Zytokinrezeptorfamilie). [EPO] kann bei Sauerstoffmangel um das ~1000-fache zunehmen. Noradrenalin,
Schilddrüsenhormone, Androgene, Adenosin, PGE2 fördern die
EPO-Freisetzung, Östrogene hemmen sie (niedrigerer Hämatokrit bei
Frauen) Spezifische Wachstumsfaktoren steuern die Hämatopoese: Aus einer pluripotenten Stammzelle entstehen >103 Erys. An Verzweigungspunkten entscheiden Wachstumsfaktoren über den weiteren Weg der Teilung. Peritubuläre Zellen der Niere bilden bei Sauerstoffmangel / vermindertem Hämatokrit vermehrt Erythropoetin (der hypoxie-induzierbare Faktor intensiviert die Expression des EPO-Gens); dieses wirkt über Janus-Kinase- Rezeptoren (Zytokinrezeptorfamilie). [EPO] kann bei Sauerstoffmangel um das ~1000-fache zunehmen. Noradrenalin,
Schilddrüsenhormone, Androgene, Adenosin, PGE2 fördern die
EPO-Freisetzung, Östrogene hemmen sie (niedrigerer Hämatokrit bei
Frauen) Oxigeniertes
und desoxigeniertes Blut haben unterschiedliche optische
Absorptionsspektren (Pulsoximetrie: Arterieller Sättigungswert ≥95% -
an Finger, Ohrläppchen, bei Kleinkindern Fuß oder Handgelenk) Oxigeniertes
und desoxigeniertes Blut haben unterschiedliche optische
Absorptionsspektren (Pulsoximetrie: Arterieller Sättigungswert ≥95% -
an Finger, Ohrläppchen, bei Kleinkindern Fuß oder Handgelenk) |
