

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Physiologie der Nierenfunktion
und der ableitenden Harnwege

 Tubuläre Resorption, Vorgänge entlang des Nephrons
Tubuläre Resorption, Vorgänge entlang des Nephrons
© H. Hinghofer-Szalkay
 Claudin: claudere = schließen
Claudin: claudere = schließen
Cubilin: CUB steht für Domänen von Komplement (C), Uegf (EGF repeats) und Bone morphogenic protein-1
Fanconi-Syndrom: Guido Fanconi
Inulin: Von inula helenium, seit dem Altertum als Heilpflanze und Gewürz verwendet (Apicius)
Resorption: re = zurück, sorbere = Flüssiges zu sich nehmen, hinunterschlucken
Glomerulär
filtrierte Stoffe werden tubulär rückresorbiert - vorausgesetzt, es
gibt für
sie entsprechende Wege: Entweder durch die Tubuluszellen hindurch
(Transportmechanismen über die apikale und basolaterale Membran der
Tubuluszellen, oder sie sind primär membrangängig) oder zwischen ihnen
(parazellulärer Weg).
Manche Stoffe - wie das Kreatinin aus dem Muskelstoffwechsel oder der Indikatorstoff
Inulin (ein pflanzlicher Zucker) - werden nicht rückresorbiert, das heißt, sie werden nach ihrer Filtration vollständig ausgeschieden (die Kreatinin-
bzw. Inulinclearance dient als Maß für die glomeruläre
Filtrationsleistung).
Fast alle im Filtrat vorhandenen Stoffe werden rückresorbiert, meist zum Großteil in den proximalen Tubuli.
Die dafür vorhandenen Transporter können gelegentlich überfordert sein, Beispiel:
Bei erhöhtem Blutzuckerspiegel (Hyperglykämie) kann nicht die gesamte filtrierte Glucose bewältigt werden, das tubuläre Maximum für Glucose ist dann überschritten, und Glucose tritt in den Harn über (Glukosurie).
60-70% des glomerulär filtrierten Wassers wird in den proximalen Tubuli
zurückgewonnen. Das erfolgt isoton, osmotisch an die Rückresorption von Salzen (vor allem Kochsalz) geknüpft. Neben Natrium und Chlorid (zu ~65%) werden im proximalen Tubulus vor allem Kalium (~80%), Calcium (~65%), Magnesium (~60%) und Phosphat (~80%) rückresorbiert. Glucose und Aminosäuren gelangen proximal-tubulär vollständig in den Kreislauf zurück (soferne ihr tubuläres Maximum nicht überschritten wurde).
Die Ausscheidung der Salze hängt vom jeweiligen Elektrolytstatus ab: So werden bei minimaler Kaliumversorgung nur 2% der glomerulär filtrierten Menge mit dem Harn ausgeschieden (Clearance etwa 2,5 ml/min), bei
hohem Kaliumangebot hingegen bis zu 150% (blockierte Rückresorption
plus Sekretion: Clearance ca. 180 ml/min). Das heißt, die
Clearanceleistung hat in diesem Fall eine Spanne von etwa 1:70.
Harnsäure
wird sowohl rückresorbiert - so gut wie vollständig, dann wieder zur
Hälfte sezerniert und dann nochmals zum größeren Teil resorbiert, im
Endeffekt werden 10% der glomerulär filtrierten Menge ausgeschieden (~10-fach
konzentriert im Vergleich zur Plasmakonzentration). Etwa 40% des filtrierten Harnstoffs werden mit dem Harn ausgeschieden.
|
Der
in den Millionen Glomeruli aus dem Blutplasma filtrierte "Primärharn"
(150-200 Liter pro Tag) wird in den Tubuli der Nephrone weitgehend
zurückgewonnen. Dabei haben die verschiedenen Tubulusabschnitte
spezielle Eigenschaften und Funktionen, bedingt einerseits durch ihre
unterschiedliche Ausstattung mit Transportsystemen (ohne diese sind die
Tubuluswände praktisch undurchlässig), andererseits durch Spezifitäten
(Konzentrationsverhältnisse) ihrer Umgebung; auch elektrische Gradienten über die Tubuluswände spielen eine Rolle.
Die Energie für den transepithelialen Transport stammt - direkt oder
indirekt - von der Aktivität der Na/K-ATPase in der basolateralen
Membran der Epithelzellen. Einige Tubulusabschnitte unterliegen
außerdem hormoneller Kontrolle.
Die Rückresorption filtrierter Stoffe aus den Tubuli hängt mit folgenden Funktionsprinzipien zusammen:
 Aktive Rückresorption von Kochsalz (diese macht den Löwenanteil des renalen Energieaufwandes und damit des renalen Sauerstoffbedarfs aus)
Aktive Rückresorption von Kochsalz (diese macht den Löwenanteil des renalen Energieaufwandes und damit des renalen Sauerstoffbedarfs aus)
 Wasser folgt osmotisch nach
Wasser folgt osmotisch nach
 Elektrische Gradienten (Lumen vs. peritubuläre Flüssigkeit) entstehen durch Ungleichgewichte resorbierter Ladungen
Elektrische Gradienten (Lumen vs. peritubuläre Flüssigkeit) entstehen durch Ungleichgewichte resorbierter Ladungen
 Die
im Tubulus verbleibende Flüssigkeitsmenge nimmt ab, das erhöht die
Konzentration von Stoffen, die weniger rasch (oder gar nicht)
resorbiert werden (und ausgeschieden werden).
Die
im Tubulus verbleibende Flüssigkeitsmenge nimmt ab, das erhöht die
Konzentration von Stoffen, die weniger rasch (oder gar nicht)
resorbiert werden (und ausgeschieden werden).

 Abbildung: Renale Sauerstoffaufnahme als Funktion der tubulären Natriumresorption
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology (1st ed.). Philadelphia, Saunders, 2003
Abbildung: Renale Sauerstoffaufnahme als Funktion der tubulären Natriumresorption
Nach einer Vorlage in Boron W, Boulpaep E: Medical Physiology (1st ed.). Philadelphia, Saunders, 2003
Die
Kochsalzresorption der Tubuli wurde experimentell durch Manipulation
der glomerulären Filtration (Diuretika, Hypoxie) verändert. Die
Sauerstoffaufnahme wurde über die Sauerstoffextraktion (AVDO2) ermittelt.
Natriumresorption und Sauerstoffkonsum der Niere sind linear korreliert
 Die Nieren verbrauchen fast ihre gesamte
Stoffwechselenergie für die Rückgewinnung von Kochsalz aus dem primären
Filtrat (
Die Nieren verbrauchen fast ihre gesamte
Stoffwechselenergie für die Rückgewinnung von Kochsalz aus dem primären
Filtrat ( Abbildung).
Ohne diese Funktion käme es zu akutem Salz- und damit Volumenverlust
und Kreislaufversagen: Fiele z.B. die tubuläre Rückresorption auf die
Hälfte (statt 99%) der filtrierten Flüssigkeit (GFR 120 ml/min),
verlöre der Körper innerhalb knapp einer Stunde eine Flüssigkeitsmenge,
die dem Volumen des Blutplasmas im Kreislauf (ca. 3 Liter) entspricht.
Abbildung).
Ohne diese Funktion käme es zu akutem Salz- und damit Volumenverlust
und Kreislaufversagen: Fiele z.B. die tubuläre Rückresorption auf die
Hälfte (statt 99%) der filtrierten Flüssigkeit (GFR 120 ml/min),
verlöre der Körper innerhalb knapp einer Stunde eine Flüssigkeitsmenge,
die dem Volumen des Blutplasmas im Kreislauf (ca. 3 Liter) entspricht.
Orte und Mechanismen der Rückresorption
Aus
funktioneller und morphologischer Sicht unterteilt man den Tubulus in
mehrere Segmente: Proximaler Tubulus, Henle-Schleife, distaler Tubulus
und Sammelrohr. In all diesen Abschnitten findet sich
eine Lage Tubulusepithelzellen einerseits zwischen dem Innenraum (lumen), der
(modifizierten) Primärharn enthält, andererseits dem Interstitium mit
Blutgefäßen (vor allem vasa recta, also Kapillaren). Die Epithelzellen sind polar strukturiert: Ihre Zellmembran hat einen apikalen (lumenwärts gerichteten) und einen basolateralen (zum Blut hin gerichteten) Abschnitt.

Epithelzellen:
apikale /
basolaterale Membran vgl.
dort
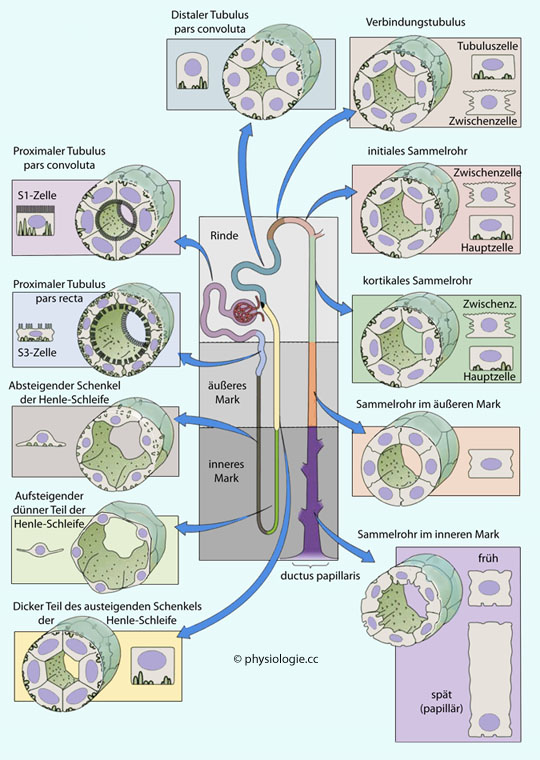
 Abbildung: Abschnitte eines Nephrons
Abbildung: Abschnitte eines Nephrons
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Proximaler
Tubulus: pars convoluta, pars recta. S = Segment (der Bürstensaum
verliert von S1 zu S3 an Dichte und fehlt den Tubuluszellen der tiefen
Henle-Schleife gänzlich)
Intermediärer Tubulus: pars descendens, pars ascendens der Henle-Schleife
Distaler Tubulus : medullärer, kortikaler dicker aufsteigender Schenkel, distale pars convoluta
Sammelrohrsystem: Verbindungsstück, initiales / kortikales / äußeres medulläres / inneres medulläres Sammelrohr
Bis zu 10 Nephrone münden in ein Sammelrohr (Rindenzone), anschließend
vereinigen sich mehrere Sammelrohre (Nierenmark) und münden an einer
Papille (papilla renalis) in einen Nierenkelch bzw. das Nierenbecken
(pelcis renalis)
 Proximaler Tubulus: Resorption von Wasser und allen Stoffen, die im
Körper verbleiben sollen; reich an Mitochondrien (besonders hoher Stoffwechselaufwand). 60-80% der filtrierten Flüssigkeitsmenge werden im proximalen Tubulus zurückgewonnen; 20-40% betreten die Henle-Schleife.
Proximaler Tubulus: Resorption von Wasser und allen Stoffen, die im
Körper verbleiben sollen; reich an Mitochondrien (besonders hoher Stoffwechselaufwand). 60-80% der filtrierten Flüssigkeitsmenge werden im proximalen Tubulus zurückgewonnen; 20-40% betreten die Henle-Schleife.
 Henle-Schleife, bestehend aus einem dünnwandigen absteigenden und einem dickwandigen aufsteigenden Schenkel: Aufbau eines osmotischen Gradienten, Harnstoffzirkulation, Resorption von 5-10% der filtrierten Flüssigkeitsmenge.
Henle-Schleife, bestehend aus einem dünnwandigen absteigenden und einem dickwandigen aufsteigenden Schenkel: Aufbau eines osmotischen Gradienten, Harnstoffzirkulation, Resorption von 5-10% der filtrierten Flüssigkeitsmenge.
 Distaler Tubulus / Sammelrohr: Feineinstellung der Stoffmengen
(Ausscheidung / Rückgewinnung) und der osmotischen Konzentration. Hier greifen Vasopressin (Wasserresorption), Aldosteron
(Natriumresorption) und natriuretische Peptide an (Natriumausscheidung).
Distaler Tubulus / Sammelrohr: Feineinstellung der Stoffmengen
(Ausscheidung / Rückgewinnung) und der osmotischen Konzentration. Hier greifen Vasopressin (Wasserresorption), Aldosteron
(Natriumresorption) und natriuretische Peptide an (Natriumausscheidung).
 Erniedrigte Osmolalität im Blut regt die Freisetzung von Aldosteron an, erhöhte Osmolalität die von Vasopressin.
Erniedrigte Osmolalität im Blut regt die Freisetzung von Aldosteron an, erhöhte Osmolalität die von Vasopressin.
Tubulusabschnitte. Die Bezeichnungen der einzelnen Segmente der Tubuli sind in der folgenden Tabelle zusammengestellt (vgl.  Abbildung):
Abbildung):
Bezeichnungen tubulärer Nephronsegmente
|
deutsch
|
englisch
|
Abkürzung
|
Proximaler Tubulus, pars convoluta
|
Proximal convoluted tubule
|
PCT
|
| Proximaler Tubulus, pars recta |
Proximal straight tubule
|
PST
|
Absteigender Schenkel der Henle-Schleife
|
Thin descending limb of loop of Henle
|
tDLH
|
Dünner aufsteigender Schenkel der Henle-Schleife
|
Thin ascending limb of loop of Henle |
tALH
|
| Dicker aufsteigender Schenkel der Henle-Schleife |
Thick ascending limb of loop of Henle |
TAL
|
| Distaler Tubulus, pars convoluta |
Distal convoluted tubule
|
DCT
|
Verbindungstubulus
|
Connecting tubule
|
CNT
|
Initiales Sammelrohr
|
Initial collecting tubule
|
ICT
|
Kortikales Sammelrohr
|
Cortical collecting tubule
|
CCT
|
Sammelrohr im äußeren Mark
|
Outer medullary collecting tubule
|
OMCD
|
| Sammelrohr im inneren Mark |
Inner medullary collecting tubule |
IMCD
|
Im Glomerulus filtrierte und im Tubulus nicht
oder nur geringfügig rückresorbierte Stoffe werden im Nephron automatisch angereichert: Soferne sie zu
einem geringeren Prozentsatz rückresorbiert werden als Wasser (~99%),
nimmt ihre Konzentration in
der Tubulusflüssigkeit zu. Die schließlich verbleibende Flüssigkeit (~1% des Filtratvolumens) wird
als Harn ausgeschieden, und die Konzentration von Stoffen, die tubulär
überhaupt nicht rückresorbiert wurden, erhöht sich im Vergleich zum
Blutplasma auf etwa das Hundertfache. Dies
trifft z.B. für Kreatinin (eine körpereigene Substanz aus dem Muskelstoffwechsel) und Inulin  (ein körperfremdes Kohlenhydrat) zu.
Tubuluszellen haben auch über Rückresorption und Sekretion hinausgehende
Funktionen, wie den Abbau von Peptidhormonen.
(ein körperfremdes Kohlenhydrat) zu.
Tubuluszellen haben auch über Rückresorption und Sekretion hinausgehende
Funktionen, wie den Abbau von Peptidhormonen.
Bei Nierenversagen
steigen die entsprechenden Hormonkonzentrationen im Blut an.
Tubuluszellen verfügen über je mehrere Tausend (bis ~7.10
3) Mikrovilli. Die Nephrone einer Niere haben eine Gesamtlänge von ~50 km; ihre innere Gesamtoberfläche beträgt ~20 m
2.
Die Filtrationskräfte, die zum Rückstrom von Wasser
aus dem Tubulus in das Blut der vasa recta führen, setzen sich aus
hydrostatischen und kolloidosmotischen Druckkomponenten zusammen:
Tubuläre Filtrations- / Resorptionskräfte
(+ in die Kapillare, - in das Interstitium gerichtet)
|
Blutplasma: Kolloid-
osmotischer Druck
|
Peritubuläre Kapillare: Hydrostatischer Druck (Blutdruck)
|
Interstitium: Hydro-
statischer Druck (Gewebe-
druck)
|
Interstitium: Kolloid-
osmotischer Druck
|
|
~ +30 mmHg
|
~ -20 mmHg
|
~ +10 mmHg
|
~ -5 mmHg
|
Gesamt +15 mmHg
|
In Summe ergibt sich aus diesen Zahlen ein tubulärer Resorptionsdruck (in die peritubuläre Kapillare gerichtet) von etwa 15 mmHg (2 kPa).
Dieser führt zu einem Rückstrom filtrierten Wassers aus den Tubuli in
den Blutkreislauf.

 Abbildung: Resorption aus dem proximalen Tubulus
Nach einer Vorlage bei uic.edu/classes
Abbildung: Resorption aus dem proximalen Tubulus
Nach einer Vorlage bei uic.edu/classes
Elektrolyte, Glucose, Aminosäuren, Vitamine werden z.T. durch sekundär-aktiven (durch den Na+-Gradienten
angetriebenen) Transport resorbiert (apikale Membran am Tubuluslumen,
oben) und über die basolaterale Membran (unten) an das Blut
weitergegeben. Seitlich sind die Epithelzellen über tight junctions
verknüpft. Wasser folgt dem osmotischen Gradienten

Mit dem Wasser bewegen sich einige Ionen auf dem
parazellulären Weg mit (solvent drag), Wasser kann aber auch
transzellulär zum Blut gelangen (Aquaporine).
Welche gelösten Stoffe
wie stark parazellulär und/oder transzellulär Richtung Blut gelangen,
hängt von Druck- und Ladungsverhältnissen, Teilchengröße und
insbesondere Ausstattung der Tubulusepithelien mit Transportmolekülen
ab.
Die meisten der glomerulär filtrierten Moleküle werden in den Tubuli (weitgehend oder vollständig)
zurückgewonnen und in den Kreislauf retourniert. Dazu haben die Zellen des proximalen Tubulus gemeinsame Eigenschaften:

Die luminale Membran der Tubulusepithelzellen ist
reichlich mit
Mikrovilli ausgestattet ( Abbildung), das vergrößert die für die Resorption
verfügbare Oberfläche; auch die basolaterale Membran verfügt über
zahlreiche Einstülpungen
Abbildung), das vergrößert die für die Resorption
verfügbare Oberfläche; auch die basolaterale Membran verfügt über
zahlreiche Einstülpungen.

Zellmembran voller Carriermoleküle (vor allem apikal)

Zahlreiche Mitochondrien (Antrieb ATP-verbrauchender Transportvorgänge in der basolateralen Membran)

Seitliche interzelluläre Kontakte (tight junctions) sind für Wasser durchgängig (parazelluläre Resorption)

Membranen enthalten zahlreiche Aquaporin 1-Kanäle (transzelluläre Passage von Wasser)
 Transepitheliales Potential: Die Transportvorgänge durch das Tubulusepithel führen zunächst zu einer leichten (-3 mV) negativen Aufladung des Lumens
gegenüber dem Interstitium (es werden - transzellulär - etwas mehr
positive als negative Ladungen resorbiert). Dieses Potential zieht zwar
Chloridionen -
parazellulär - Richtung Interstitium, aber nicht genug, um mit der
Resorption anderer Ionen Schritt zu halten.
Im weiteren Verlauf des
Tubulus reichert sich Chlorid im Lumen an (Cl--Gradient), und das transepitheliale Potential kehrt sich um, es wird in distalen Teilen des proximalen Tubulus lumen-positiv
(+3 mV) Damit wandern nun Kationen zusammen mit Wasser vermehrt
parazellulär Richtung Interstitium (solvent drag). Das treibt in
distalen Teilen des proximalen Tubulus einen beträchtlichen Teil der
Resorption sowohl von organischen Molekülen als auch von Ionen an.
So werden die
meisten Inhaltsstoffe des
Primärharns in
peritubuläre Kapillaren iso-osmotisch zurückgeholt - Wasser,
Elektrolyte, Zucker, Aminosäuren etc. Auch werden jeden Tag 150-200 mg Albumin glomerulär filtriert und von den Tubuluszellen endozytiert.
Transepitheliales Potential: Die Transportvorgänge durch das Tubulusepithel führen zunächst zu einer leichten (-3 mV) negativen Aufladung des Lumens
gegenüber dem Interstitium (es werden - transzellulär - etwas mehr
positive als negative Ladungen resorbiert). Dieses Potential zieht zwar
Chloridionen -
parazellulär - Richtung Interstitium, aber nicht genug, um mit der
Resorption anderer Ionen Schritt zu halten.
Im weiteren Verlauf des
Tubulus reichert sich Chlorid im Lumen an (Cl--Gradient), und das transepitheliale Potential kehrt sich um, es wird in distalen Teilen des proximalen Tubulus lumen-positiv
(+3 mV) Damit wandern nun Kationen zusammen mit Wasser vermehrt
parazellulär Richtung Interstitium (solvent drag). Das treibt in
distalen Teilen des proximalen Tubulus einen beträchtlichen Teil der
Resorption sowohl von organischen Molekülen als auch von Ionen an.
So werden die
meisten Inhaltsstoffe des
Primärharns in
peritubuläre Kapillaren iso-osmotisch zurückgeholt - Wasser,
Elektrolyte, Zucker, Aminosäuren etc. Auch werden jeden Tag 150-200 mg Albumin glomerulär filtriert und von den Tubuluszellen endozytiert.
Der Großteil der Rückresorption erfolgt im proximalen Tubulus
Der
proximale Tubulus ist 12-24 mm lang, hat einen Durchmesser von
50-65 µm und ist stark geschlungen; die proximalen Tubuli machen den
Großteil der Nierenrinde aus. Sie resorbieren 60-80% des glomerulären Filtrats, das sind
etwa 130 Liter pro Tag.
Die
massive Rückresorption (pro Tag etwa 17.000 mM Natrium, 13.300 mM
Chlorid, 3.000 mM Bicarbonat, 250 mM
Calcium etc) erfolgt osmotisch ausgeglichen
(isoosmotisch), da die proximalen Tubuli mit Aquaporinen ausgestattet
sind und Wasser osmotisch-passiv nachfolgt.
Das Plasma in den peritubulären Kapillaren hat infolge der starken glomerulären Filtration einen hohen kolloidosmotischen Druck
(~35
mmHg) und nimmt mit
zunehmender Rückresorption von Wasser aus den Tubuli wieder auf
"normale" 25 mmHg ab (Durchschnittswert entlang der vasa recta ~30
mmHg). Der
hydrostatische Filtrationsdruck entlang der peritubulären Kapillaren ist relativ niedrig (~20 mmHg), da den vasa
recta das vas afferens und vas efferens in Serie vorgeschaltet sind.
Im Interstitium beträgt der hydrostatische Druck ~10 mmHg, der kolloidosmotische ~5 mmHg (Proteine
werden über Lymphgefäße aus dem Interstitium entfernt).
Die
Resorption der meisten filtrierten Stoffe erfolgt - teils unterstützt
durch elektrische Gradienten - durch die Epithelzellen sowie zwischen
ihnen, je nach Ausstattung mit membranalen Proteinen und
Schlussleistensystemen:
 Transzellulärer Transport
Transzellulärer Transport
(durch die Epithelzelle - d.h. die apikale und basolaterale Membran - hindurch):
 Luminale (apikale)
Luminale (apikale) Membran

Na
+-H
+-Antiport, aktiviert durch intrazellulären pH-Abfall (zelluläre Azidose), sezerniert H
+ sekundär-aktiv im Austausch gegen Na
+

Natriumkanäle für sekundär-aktiven Kotransport mit Glucose (SGLT 1/2; zum tubulären Maximum s.
unten), Aminosäuren, Phosphat, Lactat, Acetat, Citrat

Peptide und Proteine (Albumin, Mikroglobulin, Lysozym), die glomerulär filtriert wurden, werden mittels
Endozytose zurückgewonnen - s
dort
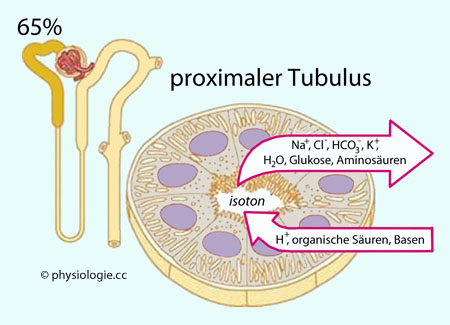

Abbildung: Proximaler Tubulus
Nach einer Vorlage in Guyton/Hall, Textbook of Medical Physiology, 12th ed. Saunders 2010
Der proximale Tubulus resorbiert ~65%
der glomerulär filtrierten Last an Wasser, Natrium, Kalium, Chlorid,
Bicarbonat, sowie das gesamte Angebot an Glucose (außer bei
Überforderung des tubulären Maximums) und Aminosäuren.
Sezerniert werden Wasserstoffionen, organische Säuren und Basen

 Basolaterale
Basolaterale Membran

Na
+-K
+-Pumpe

Na
+-Bicarbonat-Cotransport

K
+-Cl
--Symport

Zum
Bicarbonattransport im proximalen Tubulus s. auch
dort
 Parazellulärer Transport
Parazellulärer Transport
(durch den - mit
Schlussleisten abgedichteten - Spaltraum zwischen den Epithelzellen hindurch):
Frühproximal wandert Wasser - dem osmotischen Gradienten folgend - aus
dem Tubulus. Chloridionen folgen diesem osmotischen Gradienten mit
Verzögerung, vorübergehend ladet sich das Lumen leicht negativ auf. Das
lumennegative transepitheliale Potential unterstützt die Wanderung von Anionen (Cl
-) aus dem Lumen. Ein
solvent drag bringt z.B. auch Harnstoff und Na
+ Richtung Blut. Später kann das transepitheliale Potential im Tubulus (durch parazelluläre Resorption von Chloridionen)
lumenpositiv werden und dadurch die Resorption von Na
+ unterstützen.
Sekretion im proximalen Tubulus: Die proximalen Tubuli resorbieren nicht nur, sie verfügen auch über mehrere Sekretionsmechanismen. Dies betrifft organische Moleküle; sie werden über organische Ionentransporter
(Kationen über OCT, Amionen über OAT) über die Zellmembran befördert.
Diese Transporter ermöglichen die Ausscheidung z.B. von Konjugaten
(Sulfatierung, Glukuronierung in der Leber) von Katecholaminen oder Acetylcholin,
Gallensäuren, Oxalsäure oder Hippursäure. Da die organischen
Transporter nicht besonders substratspezifisch sind, können über sie
auch zahlreiche Pharmnaka ausgeschieden werden.
 Zu organischen Kationen zählen u.a. Pharmaka wie Morphine oder Chinin
(basolaterale Aufnahme durch das Membranpotential unterstützt, luminale
Sekretion über Kationen-Protonen-Austauscher),
Zu organischen Kationen zählen u.a. Pharmaka wie Morphine oder Chinin
(basolaterale Aufnahme durch das Membranpotential unterstützt, luminale
Sekretion über Kationen-Protonen-Austauscher),
 zu
organischen Anionen PAH (dieses wird an der basolateralen Membran gegen
ein Dicarboxylat, an der luminalen Membran gegen ein Anion getauscht),
Oxalsäure, Furosemid, Penicillin oder Salicylat.
zu
organischen Anionen PAH (dieses wird an der basolateralen Membran gegen
ein Dicarboxylat, an der luminalen Membran gegen ein Anion getauscht),
Oxalsäure, Furosemid, Penicillin oder Salicylat.
Der auf den proximalen Tubulus folgende absteigende
Schenkel der Henle-Schleife verfügt nur über wenige Mitochondrien und
basolaterale Na/K-ATPasen - er erscheint schmal ("dünner" Schenkel). Er
ist für Wasser und Harnstoff durchgängig - sowohl für parazelluläre ("loose junctions") als auch transzelluläre Passage (Aquaporin 1). Da das Nierenmark, in das die Schleife eintaucht, hyperton ist, verlassen von den ~60 l/d etwa 30 Liter Flüssigkeit in 24 Stunden den absteigenden Schleifenteil.
Der
dicke aufsteigende Schenkel verfügt hingegen über die Möglichkeit zur
Resorption gelöster Teilchen - ohne dass Wasser mitgeht. Dadurch wird
der Inhalt wieder "verdünnt"; etwa 75% der in den aufsteigenden
Schenkel (mehr als 13.000 mOsm pro Tag) gelangten gelösten Stoffe
(Natrium, Chlorid, Bicarbonat u.a.) werden resorbiert. Die
Epithelzellen sind dicht mit Mitochondrien bestückt, um die hohe Zahl
an Na/K-ATPasen anzutreiben (daher "dicker" Schenkel).
 Transzellulärer Transport
Transzellulärer Transport
Schließlich hat der aufsteigende Schenkel so viele Partikel resorbiert,
dass die verbleibende Flüssigkeit - die anschließend in den distalen
Tubulus gelangt - stark hypoton geworden ist (~50 mOsm - weniger als
ein Fünftel der Osmolalität des Blutes).
Distaler Tubulus (pars convoluta)
Der distale Tubulus erstreckt sich von der Kontaktstelle der macula
densa am Glomerulum (juxtaglomerulärer Apparat) bis zum Sammelrohrsystem.
Der distale Tubulus resorbiert ~5% des filtrierten
Kochsalzes via
Weiters ist der distale Tubulus wichtig für die Resorption von
Calcium, wahrscheinlich mittels apikaler Ca-Kanäle und basolateraler Na/Ca-Austauscher. Für
Wasser ist der distale Tubulus
undurchlässig.

Zum
Bicarbonattransport im distalen Tubulus s. auch
dort
Das Sammelrohrsystem kann auf verschiedene externe (vor allem
hormonelle: Vasopressin, Aldosteron) Signale reagieren - welche die
aktuellen Bedürfnisse des Körpers widerspiegeln - und übernimmt
dementsprechend die "Feinabstimmung" des renalen Stoffmanagements.
Dieses System besteht aus mehreren Abschnitten, deren Funktionen sich
weitgehend überschneiden.
Man unterscheidet Hauptzellen (principal cells), deren Wirkung sich auf die Salzresorption konzentriert, und
Zwischenzellen (intercalated cells), die sich vor allem um Säureausscheidung kümmern.
 Transzellulärer Transport - Hauptzellen (principal cells)
Transzellulärer Transport - Hauptzellen (principal cells)
 Apikale
Apikale Membran:

Na
+-Kanäle (
ENaC - durch Aldosteron angeregt, der Einstrom von Na
+ erzeugt ein lumen-negatives Potential von bis zu -50 mV)

K
+-Kanäle (ROMK -
Renal Outer Medullary Potassium (K) channel: Die Sekretion von Kalium in das Lumen wird durch das lumen-negative Potential gefördert)
 Basolaterale
Basolaterale Membran:

Na
+-K
+-Pumpe
Die
Wand der Sammelrohre ist (wie beim dicken aufsteigenden Schenkel der
Henle-Schleife) genuin wasserundurchlässig, Einlagerung von Aquaporinen
(vasopressinabhängig) kann aber die Resorption von Wasser Richtung Interstitium ermöglichen.
Die Sekretion von Kalium in das Tubuluslumen wird durch das
lumen-negative Potential angetrieben und ist an die Aktivität der
(durch Aldosteron hinaufregulierten) Na/K-ATPase geknüpft, die für einen
ausreichenden Kaliumgradienten sorgt, sodass Kalium durch Kaliumkanäle
in den Harn gelangen kann.
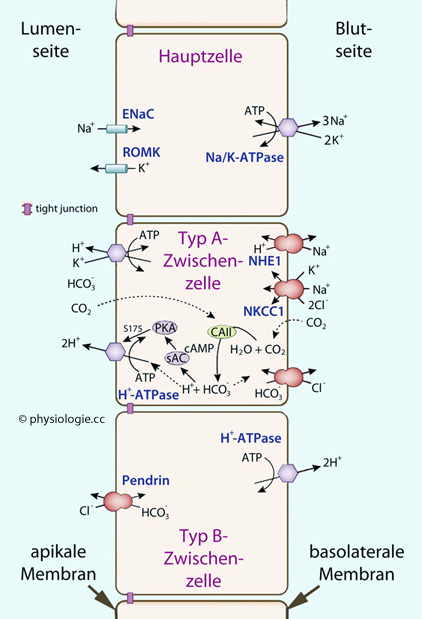
 Abbildung: Ionentransport im Sammelrohrsystem
Nach Roy A, Al-bataineh MM, Pastor-Soler NM. Collecting Duct Intercalated
Cell Function and Regulation. CJASN 2015; 10: 305-24
Abbildung: Ionentransport im Sammelrohrsystem
Nach Roy A, Al-bataineh MM, Pastor-Soler NM. Collecting Duct Intercalated
Cell Function and Regulation. CJASN 2015; 10: 305-24
Hauptzellen (principal cells) exprimieren apikal (luminal) epitheliale Natriumkanäle (ENaC) und ROMK (renal outer medullary potassium channel), basolateral Na/K-ATPase. Der Natriumeinstrom durch ENaC ist elektrogen (die lumenseitige Membran depolarisiert), das fördert den K+-Ausstrom.
Zwischenzellen vom Typ A (type A intercalated cells, A-IC) in der Rinden- und äußeren Markzone sezernieren Säure. Sie verfügen in der luminalen Membran H+-ATPase und H+/K+-ATPase; in der basolateralen Membran Chlorid-Bicarbonat-Austauscher. Der Bicarbonatsensor sAC (soluble adenylyl cyclase) und Proteinkinase A (PKA) regulieren die H+-ATPase.
Zwischenzellen vom Typ B (type B intercalated cells, B-IC) sezernieren Bicarbonat (Pendrin ist ein Chlorid-Bicarbonat-Austauscher).
Die Schlussleisten in der Grenzzone zwischen luminaler und basolateraler Membran sind wasserdurchlässig.
Luminale Transportsysteme links, basolaterale rechts

Nimmt die glomeruläre Filtration
ab, gelangt auch weniger Kochsalz in das Sammelrohr, was den Aufbau
eines ausreichenden Natriumgradienten (apikal) für den Betrieb der
Na/K-ATPase (basolateral) und damit die Sekretion von Kalium (apikal)
erschwert - die Kaliumausscheidung nimmt ab.
 Transzellulärer Transport - Typ A-Zwischenzellen
Transzellulärer Transport - Typ A-Zwischenzellen
(type A intercalated cells, A-IC)
 Apikale
Apikale Membran:

H
+/K
+-ATPase

H
+-Transporter
(beides P-Typ-ATPasen)

 Basolaterale
Basolaterale Membran:

Na
+/H
+-Austauscher (
NHE)

Na/K/2Cl-Symporter (
NK2Cl cotransporter)

Cl
-/HCO
3--Antiporter
 Transzellulärer Transport - Typ B-Zwischenzellen
Transzellulärer Transport - Typ B-Zwischenzellen
 Apikale
Apikale Membran:

Cl
-/HCO
3--Antiporter (Pendrin)
 Basolaterale
Basolaterale Membran:

H
+-Transporter

Näheres zum
Sammelrohrsystem s.
dortElektrische Potentiale entlang des Tubulus im Überblick
Die - transepithelialen - Potentiale beziehen sich auf die Ladung des Tubuluslumens:
 Im proximalen Tubulus baut sich nur ein schwaches elektrisches
Potential
auf: Pars convoluta -3 mV (es werden etwas mehr positive als negative
Ladungen resorbiert), pars recta +3 mV (Chloridanreicherung im Lumen)
Im proximalen Tubulus baut sich nur ein schwaches elektrisches
Potential
auf: Pars convoluta -3 mV (es werden etwas mehr positive als negative
Ladungen resorbiert), pars recta +3 mV (Chloridanreicherung im Lumen)
 Im dicken
aufsteigenden Schenkel der Henle-Schleife (TAL) ist das Lumen elektropositiv (+8 bis +15 mV) geladen, weil die apikale Membran stärker aufgeladen ist als die basolaterale (anders als bei den meisten anderen Epithelien).
Im dicken
aufsteigenden Schenkel der Henle-Schleife (TAL) ist das Lumen elektropositiv (+8 bis +15 mV) geladen, weil die apikale Membran stärker aufgeladen ist als die basolaterale (anders als bei den meisten anderen Epithelien).
Die basolaterale Na/K-ATPase und der apikale Na/K/2Cl-Cotransporter pumpen Kalium in die Tubulusepithelzelle, dieses "entkommt" via apikaler ROMK-Kaliumkanäle in das Tubuluslumen und ladet es positiv auf. Das lumen-positive Potential treibt die parazelluläre Resorption (Richtung Interstitium) von Kationen (Na+, K+, Ca++, Mg++) an. Es ist für etwa 50% der Natriumaufnahme im TAL verantwortlich
 im distalen Tubulus unterschiedlich (frühdistal -5 mV, später +5 mV)
im distalen Tubulus unterschiedlich (frühdistal -5 mV, später +5 mV)
 im Sammelrohrsystem durch Kaliumaustritt in das, und Natriumresorption aus dem Lumen deutlich elektronegativ
(bis zu -50 mV) geladen - verursacht durch Na+-Resorption (apikale ENaC), was die K+-Sekretion (über ROMK) antreibt.
im Sammelrohrsystem durch Kaliumaustritt in das, und Natriumresorption aus dem Lumen deutlich elektronegativ
(bis zu -50 mV) geladen - verursacht durch Na+-Resorption (apikale ENaC), was die K+-Sekretion (über ROMK) antreibt.
Rückresorption und Ausscheidung von Wasser und Kochsalz
Mit glomerulär
filtriertem Wasser (150-200 l/d) filtrieren die Nieren etwa 1,5 kg
Kochsalz (ca. 25 Mol) täglich. Diese enorme Menge wird - zusammen mit ~99% des
filtrierten Wassers - tubulär fast vollständig (bis auf mit dem Harn ausgeschiedene 8-15 g/d,
also weniger als 1% der filtrierten Menge)
wieder rückresorbiert. Diese Zahl hängt vom Kochsalzkonsum ab, sie kann
auch wesentlich weniger oder mehr als 8-15 Gramm betragen. Die
Kochsalzausscheidung steuert das extrazelluläre Flüssigkeitsvolumen und
damit auch Blutvolumen und Kreislauffunktion.
Die Salzausscheidung (NaCl) wird von den Nieren auf zwei Wegen
reguliert: Über die glomeruläre Filtration und über die tubuläre
Rückresorption. Steigt das Plasmavolumen, erhöht sich die Filtration,
es gelangt mehr Natrium in das Nephron und kann vermehrt ausgeschieden
werden (umgekehrt sinkt die Ausscheidung bei sinkendem Volumen).
Der bedeutendere Mechanismus ist die Rückresorption in proximalem
Tubulus (2/3 der filtrierten Menge) und in der Henle'schen Schleife
(1/4). Die Resorption des verbliebenen Rests im distalen Nephron
unterliegt der Regulation durch Aldosteron (Na/Cl-Cotransporter im
distalen Tubulus, Na/K- bzw. Na/H-Austauscher im Sammelrohr).

 Abbildung: Wie die Niere mit Natrium umgeht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Abbildung: Wie die Niere mit Natrium umgeht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
1: Der proximale Tubulus trägt die Hauptlast der Rückresorption.
2: Ein Viertel der filtrierten Natriummenge wird im aufsteigenden Schenkel der Henle-Schleife zurückgewonnen.
3: Der distale Tubulus beteiligt sich mit 5%...
4: ...das Sammelrohr mit 3%.
Die Ausscheidung ist meist geringer als die glomerulär filtrierte Menge, kann allerdings je nach Kochsalzangebot stark vom
hier gezeigten durchschnittlichen Wert (0,1 mol/d) abweichen

Die Regulation der Kochsalzbilanz und der Osmolalität erfolgt über mehrere parallele Wege, vor allem
 Sympathisch-katecholaminerg
Sympathisch-katecholaminerg
 Über das Renin-Angiotensin-Aldosteron-System
Über das Renin-Angiotensin-Aldosteron-System
 Aus dem Hypothalamus über das Vasopressinsystem
Aus dem Hypothalamus über das Vasopressinsystem
 Aus dem Herzen über atriale natriuretische Peptide.
Aus dem Herzen über atriale natriuretische Peptide.
Der Bestand an freien Natriumionen im Extrazellulärraum steht in enger
Proportionalität zu dessen Volumen. Auf diese Weise reguliert der
Körper über das Natriummanagement der Nieren das Blutvolumen und die
langfristige Adjustierung des Blutdrucks.
Die Tubuli befördern Kochsalz sowohl durch die Epithelzellen (transzellulär,
unter Nutzung von Permeasen, Kotransportern, Austauschern und Pumpen an
der apikalen bzw. basolateralen Membran) als auch zwischen ihnen an
tight junctions entlang (parazellulär), wobei die Richtung von den
jeweiligen elektrochemischen Gradienten abhängt:

 Abbildung: Parazelluläre und transzelluläre Kochsalzresorption
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Parazelluläre und transzelluläre Kochsalzresorption
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Links: Na+ und Cl- werden sowohl zwischen den Epithelzellen der Tubuli (parazellulär) als auch durch sie hindurch (transzellulär) resorbiert.
Rechts: Natriumionen treten zuerst über die apikale Membran - ihrer Konzentration folgend (downhill) - in die Zelle ein. An der basolateralen Membran werden die durch die Na/K-ATPase gegen ihr Konzentrationsgefälle (uphill)
aus der Zelle gebracht (Resorption). Natrium kann in das Tubuluslumen
parazellulär zurückdiffundieren, wenn dafür ein elektrochemischer
Gradient besteht
Für Natrium ergeben sich die folgenden Werte (der chemische Gradient
ist für die jeweilige Natriumkonzentration von mM in mV umgerechnet):
Treibende Kräfte für den Natriumaustausch

Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
|
[Na+] luminal
(mM)
|
trans-
epithelialer chemischer Gradient (mV)
|
trans-
epithelialer elektrischer Gradient (mV)
|
trans-
epithelialer elektro-
chemischer Gradient (mV)
|
proximaler Tubulus, pars convoluta
|
142
|
0
|
-3
|
-3
|
proximaler Tubulus, pars recta
|
142
|
0
|
+3
|
+3
|
dicker aufsteigender Schenkel der Henle-Schleife
|
100
|
-9
|
+15
|
+6
|
distaler Tubulus, pars convoluta
|
70
|
-19
|
-5 bis +5
|
-24 bis -14
|
kortikales Sammelrohr
|
40
|
-34
|
-40
|
-74
|
Ist das Tubuluslumen positiv aufgeladen, fördert das die parazelluläre Natriumaufnahme in das Interstitium. Auch besteht die Möglichkeit, dass Natrium mit dem Lösungsmittel via solvent drag Richtung Blut aufgenommen wird. (Die Resorption von Wasser wird über den aktiven transepithalialen Transport von Na+ energetisch angetrieben.)
Die transzelluläre
Natriumresorption beruht auf apikalen Kotransport- und
Austauschmechanismen sowie Natriumkanälen (wobei diese ganz verschieden
auf einzelne Tubulusabschnitte verteilt sind) sowie basolateral vor
allem über die Na/K-Pumpe:

 Abbildung: Molekularbiologie der renalen Natriumresorption
Abbildung: Molekularbiologie der renalen Natriumresorption
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Links oben:
Proximaler Tubulus, pars convoluta (PCT). Apikale Natriumaufnahme aus
dem Tubuluslumen über Symport mit Glucose, Austausch mit
Wasserstoffionen, oder parazellulär. Basale Natriumabgabe an das
Interstitium über Na/K-ATPase, Kotransport mit Bicarbonat. Wasser
gelangt über Aquaporine (apikal und basolateral) durch die Zelle. Das lumen-negative Potential zieht Na+ aus dem Interstitium an, andererseits wird es mit resorbiertem Wasser resorbiert (solvent drag).
Rechts oben: Henle-Schleife, dicker aufsteigendender Schenkel (TAL). Apikale Natriumaufnahme über Na/K/Cl-Kotransport (NKCC) oder Austausch mit Wasserstoffionen (NHE). Basale Natriumabgabe über Na/K-ATPase. Der Großteil der Na+-Resorption erfolgt hier parazellulär: Das lumen-positive Potential treibt Na+ parazellulär Richtung Interstitium und bewirkt etwa die Hälfte der gesamten Natriumresorption in diesem Tubulusabschnitt.
Links unten: Distaler Tubulus, pars convoluta (DCT). Apikale Natriumaufnahme über Na/Cl-Kotransport, basale Natriumabgabe über Na/K-ATPase.
Rechts unten: Hauptzelle eines
Zwischenstücks bzw. kortikalen Sammelrohres (CCT). Die
Natriumresorption erfolgt hier transzellulär: Apikale Natriumaufnahme
über epitheliale Natriumkanäle (ENaC), basale über Na/K-ATPase. Medulläre Sammelrohre tragen ein wenig zur Natriumresorption bei (immerhin 3% der glomerulär filtrierten Menge)

Die Na+-Rückresorption
erfolgt zu 2/3 im
proximalen Tubulus. An dieser proximalen Hälfte des Nephrons treibt der
Einstrom von Natrium (seinem Konzentrationsgradienten folgend) über die
apikale Zellmembran die (gegen den Konzentragtionsgradienten - uphill - gerichtete) Aufnahme von Glucose ( Abbildung) über den SGLT - Natrium-Glucose- Kontransporter.
Abbildung) über den SGLT - Natrium-Glucose- Kontransporter.
Der Natriumgradient wird von der Na/K-ATPase der basolateralen Membran der Tubulusepithelzellen angetrieben (was den größten Teil des Energieaufwandes der
Niere beansprucht) ( vgl. dort). Dazu kommt im proximalen Tubulus ein Natrium/Bicarbonat-Kotransport, ebenfalls über die basolaterale Membran.
vgl. dort). Dazu kommt im proximalen Tubulus ein Natrium/Bicarbonat-Kotransport, ebenfalls über die basolaterale Membran.
Kotransport treibt auch die Resorption von Aminosäuren, Sulfat, Phosphat, Citrat, Lactat an. Das bringt oft positive Ladungen in die Zelle, sie wirken elektrogen (das Lumen wird dabei leicht negativ geladen). Auch wird im proximalen Tubulus und in der Henle-Schleife Na+ gegen H+ (elektroneutral) ausgetauscht ( Abbildung), was den luminalen pH-Wert senkt.
Abbildung), was den luminalen pH-Wert senkt.
Wasser passiert
die Zellen des proximalen Tubulusepithels über Aquaporine in der
apikalen und basolateralen Membran und kann auch parazellulär osmotisch aufgenommen werden (der Natriumtransport durch die Wand der Henle-Schleife erfolgt dast ausschließlich parazellulär). Der proximale Tubulus hat eine hohe H2O-Permeabilität, und die Rückresorption von H2O ist im Wesentlichen durch die Rückresorption von NaCl bestimmt (das wegen der Menge - führendes Salz der extrazellulären Flüssigkeit
- die Resorptionsleistung am stärksten bestimmt).
Die Resorption erfolgt im proximalen Tubulus isoton, d.h. die Osmolalität von ~290 mOsm bleibt erhalten, und
die Na+-Konzentration in Tubuluslumen und Blutplasma bleiben praktisch gleich hoch. Würde keine Rückresorption
stattfinden, ginge in einer halben Stunde mehr Flüssigkeit verloren als
das gesamte Plasmavolumen beträgt (entsprechend ~5% des Körpergewichts).
Chlorid
Auch die
Resorption von Chloridionen beruht auf ganz unterschiedlichen
Transportmechanismen ( Abbildung): Teils parazellulär (proximaler
Tubulus, Hauptzellen des Sammelrohrs), teils über diverse
transzelluläre Wege.
Abbildung): Teils parazellulär (proximaler
Tubulus, Hauptzellen des Sammelrohrs), teils über diverse
transzelluläre Wege.

 Abbildung: Wie die Niere mit Chlorid umgeht
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Wie die Niere mit Chlorid umgeht
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Oben links: Proximaler Tubulus, pars contorta (S
1);
oben rechts: Proximaler Tubulus, pars recta (S
3);
Mitte links: Dicker Teil des aufsteigendenden Schenkels der Henle-Schleife (TAL);
Mitte rechts: Distaler Tubulus, pars convoluta (DCT);
unten links: Kortikales Sammelrohr, Hauptzelle;
unten rechts: Kortikales Sammelrohr, Typ B-Zwischenzelle
Die Resorption von Chlorid erfolgt
- im
proximalen Tubulus
über solvent drag, Chloridkanäle und K/Cl-Kotransport (basolateral).
Die "Base" (pars recta, rechts oben) kann z.B. OH, Bicarbonat, Oxalat
oder Formiat sein, "HBase" ist die betreffende Säure, die ihr Proton
wiederum im Austausch gegen Chlorid abgeben kann (apikal);
- in der
Henle-Schleife (dicker aufsteigender Schenkel) über Na/K/Cl- Kotransport (apikal), Chloridkanäle und Bicarbonat-Cl- Kotransport (basolateral);
- im
distalen Tubulus üner Na/Cl-Kotransport (apikal) und Chloridkanäle (basolateral);
- im
Sammelrohr elektrisch-parazellulär und transzellulär (apikal Cl/HCO
3- Austausch über Pendrin, basolateral Chloridkanäle).
CA, Carboanhydrase; HBase: z.B. Bicarbonat, Oxalat

 Im frühproximalen Tubulus gibt es keine
Chloridkanäle. Mit zunehmender Rückresorption des Filtrats steigt die
Chloridkonzentration von ~100 mM (Primärfiltrat: wie Blutplasma) auf ~120 mM an. Chlorid diffundiert parazellulär in das Interstitium des Tubulus - dies ist eine wesentliche Komponente der Chloridresorption.
Im frühproximalen Tubulus gibt es keine
Chloridkanäle. Mit zunehmender Rückresorption des Filtrats steigt die
Chloridkonzentration von ~100 mM (Primärfiltrat: wie Blutplasma) auf ~120 mM an. Chlorid diffundiert parazellulär in das Interstitium des Tubulus - dies ist eine wesentliche Komponente der Chloridresorption.
 Im spätproximalen Tubulus (pars recta) werden Chloridionen apikal mittels Anionenaustausch (wie über SLC26A6)
gegen Basen ausgetauscht - wie Oxalat-, Formiat- (Salz der
Ameisensäure), Bicarbonat- oder OH-Ionen - und verlassen die Zelle
basolateral über Chloridkanäle (auch im Austausch z.B. gegen Oxalat). Dies ist ein tertiär aktiver Transport, denn er bedarf des apikalen sekundär-aktiven Austauschs von Natrium und Wasserstoffionen (NHE3), der H+ aus der Zelle schafft und Basen im Tubuluslumen neutralisiert.
Im spätproximalen Tubulus (pars recta) werden Chloridionen apikal mittels Anionenaustausch (wie über SLC26A6)
gegen Basen ausgetauscht - wie Oxalat-, Formiat- (Salz der
Ameisensäure), Bicarbonat- oder OH-Ionen - und verlassen die Zelle
basolateral über Chloridkanäle (auch im Austausch z.B. gegen Oxalat). Dies ist ein tertiär aktiver Transport, denn er bedarf des apikalen sekundär-aktiven Austauschs von Natrium und Wasserstoffionen (NHE3), der H+ aus der Zelle schafft und Basen im Tubuluslumen neutralisiert.
 Im dicken aufsteigenden Henle-Schenkel gelangt Cl- über Na/K/Cl-Kotransport in die Zelle (apikal) und verlässt sie (basolateral) über Chloridkanäle sowie Cl/HCO3-Austauscher.
Im dicken aufsteigenden Henle-Schenkel gelangt Cl- über Na/K/Cl-Kotransport in die Zelle (apikal) und verlässt sie (basolateral) über Chloridkanäle sowie Cl/HCO3-Austauscher.
 Im distalen Tubulus (pars convoluta) erfolgt der apikale Eintritt von Chlorid zusammen mit Natrium (Kotransporter NCC), basolateral diffundiert Cl- über Chloridkanäle zum Interstitium.
Im distalen Tubulus (pars convoluta) erfolgt der apikale Eintritt von Chlorid zusammen mit Natrium (Kotransporter NCC), basolateral diffundiert Cl- über Chloridkanäle zum Interstitium.
 Durch Schaltzellen des Sammelrohres geht es - diesmal apikal - über Cl/HCO3-Austauscher (Pendrin) und basolateral wieder via Chloridkanäle.
Durch Schaltzellen des Sammelrohres geht es - diesmal apikal - über Cl/HCO3-Austauscher (Pendrin) und basolateral wieder via Chloridkanäle.
 Zwischen den Epithelzellen der Sammelrohre wandert Chlorid parazellulär
aus dem Lumen zum Interstitium. Die Hauptzellen produzieren ein
lumen-negatives Potential von ca. -40 mV Stärke; das regt die Strömung
von Chloridionen zur Seite des Interstitiums an.
Zwischen den Epithelzellen der Sammelrohre wandert Chlorid parazellulär
aus dem Lumen zum Interstitium. Die Hauptzellen produzieren ein
lumen-negatives Potential von ca. -40 mV Stärke; das regt die Strömung
von Chloridionen zur Seite des Interstitiums an.
Elektrischer Gradient: Die
parazelluläre Bewegung von Chloridionen aus dem Tubulus lässt hier
positiv geladene Valenzen zurück, was das Tubuluslumen leicht positiv
aufladet (+3 mV). Das fördert die parazelluläre Resorption
von Kationen im proximalen Tubulus: Geschätzte 50% des filtrierten K+, 60% des filtrierten Ca++, 15% des filtrierten Mg++.
Macula densa und Blutdruck
Eine spezialisierte Region des Epithels früher distaler Tubuluszellen, die macula densa,
misst die tubuläre Salzpassage
und senkt - wenn diese gering
ist - ihre Produktion von Adenosin, was den Kontraktionszustand der
vasa afferentia umgehend senkt und die glomeruläre Filtration innerhalb von Sekunden steigert ( s.
dort).
s.
dort).
 Abbildung: Wirkungen "auf Herz und Nieren"
Abbildung: Wirkungen "auf Herz und Nieren"
Herz
und Nieren sind funktionell verknüpft: Das Myokard reagiert auf
verschiedene Reize mit der Produktion natriuretischer Peptide, diese
bremsen den Reninmechanismus und wirken vasodilatierend. Beides
erniedrigt - direkt oder über die Volumenregulation - den Blutdruck.
AT II, Angiotensin II

Über mehrere Minuten andauernde Unterdurchblutung von Nephronen
steigert hier die Freisetzung von Renin aus granulären
juxtaglomerulären
Zellen.
Renin führt über Angiotensin II und Aldosteron zu einer positiven Beeinflussung der Natriumbilanz des Körpers - ein Schlüsselmechanismus für die Regulierung von
extrazellulärem Volumen und Blutdruck -, der
arterielle
Blutdruck steigt an, was die glomeruläre Filtration unterstützt ( s. dort).
s. dort).
Wie sezerniert die Niere Protonen?
Bei weitem am meisten saure Valenzen gibt der Körper über die Atmung in Form von CO2 ab (etwa 15.000 mM pro Tag). Für die Ausscheidung von einigen nichtflüchtigen Säuren (oder auch Basen) kommen nur die Nieren in Frage - sie entfernen über
den Harn saure (bei üblicher Ernährung) oder
auch basische Valenzen (bei vegetarischer Kost, metabolischer Alkalose).

 Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Alle Nephronabschnitte können H+ unter ATP-Verbrauch über die apikale Zellmembran in das Tubuluslumen sezernieren.
Oben:
Im proximalen Tubulus übernimmt der elektrogene Na/Bicarbonat- Symporter (1 Na+ und 3 HCO3-)
den Großteil der Bicarbonat- Rückresorption der basolateralen Membran.
In der pars recta arbeitet hier auch ein Chlorid-Bicarbonat-
Austauscher, so wie auch in späteren Nephronabschnitten (unten)
CA, Carboanhydrase
 Damit ist die Niere ein unverzichtbares Organ für die Säure-Basen-Regulation des Körpers. Dabei spielt das Management von Bicarbonat - dem Puffersystem, das mit der Entfernung von CO2
us dem Körper direkt verknüpft ist - eine zentrale Rolle. Der
Bicarbonatspiegel im Blutplasma hängt - direkt oder indirekt - von vier
renalen Vorgängen ab:
Damit ist die Niere ein unverzichtbares Organ für die Säure-Basen-Regulation des Körpers. Dabei spielt das Management von Bicarbonat - dem Puffersystem, das mit der Entfernung von CO2
us dem Körper direkt verknüpft ist - eine zentrale Rolle. Der
Bicarbonatspiegel im Blutplasma hängt - direkt oder indirekt - von vier
renalen Vorgängen ab:
 Glomeruläre Filtration von Bicarbonat
Glomeruläre Filtration von Bicarbonat
 Tubuläre Resorption von Bicarbonat
Tubuläre Resorption von Bicarbonat
 Ausscheidung titrierbarer Säuren
Ausscheidung titrierbarer Säuren
 Ausscheidung von Ammonium
Ausscheidung von Ammonium
Die renale Ausscheidung von titrierbaren Säuren sowie von Ammoniumionen führt zur Bildung von neuem Bicarbonat in den Tubuli (bicarbonate regeneration): Die Bicarbonatsynthese entspricht der renalen Ausscheidung saurer Valenzen (abzüglich allfällig mit dem Harn ausgeschiedenen Bicarbonats)
- bei der Bildung titrierbarer Säure entsteht Bicarbonat (unter
Mitwirkung von Carboanhydrase), das die Nierentubuli über ihre
basolateralen Membranen über Na+/3HCO3--Cotransport
(proximaler Tubulus) oder im Austausch gegen Chlorid (aufsteigende
Schenkel der Henle-Schleifen, medulläre Sammelrohre) an das Blut
abgeben ( Abbildung oben).
Abbildung oben).
 Enthält eine Urinprobe z.B. 15 mmol Ammonium und 10 mmol titrierbare
Säure, hat die Niere in der entsprechenden Zeit 25 mmol Bicarbonat
produziert.
Enthält eine Urinprobe z.B. 15 mmol Ammonium und 10 mmol titrierbare
Säure, hat die Niere in der entsprechenden Zeit 25 mmol Bicarbonat
produziert.
Der extrazelluläre bzw. Blutplasmaspiegel an Bicarbonat hängt von zwei
Faktoren ab: Der renalen Bicarbonat-"Regenerierung" (Neubildung) und
dem Verbrauch von Bicarbonat durch Pufferung endogener Säuren
(Verbrauch). Stehen diese beiden Faktoren im Gleichgewicht, bleibt der
Bicarbonatspiegel unverändert (Normalwert 24-25 mM).
 Die
Summe der mit dem Harn zu eliminierenden sauren Valenzen beträgt bei üblicher Kost 50-100
mM/Tag. Als Protonen ausgeschieden (also ohne Pufferung in Wasser
gelöst) würde der Harn dabei einen pH von ungefähr 1,3 haben - viel zu
sauer für das Gewebe des Harntrakts. Tatsächlich scheidet man mit dem
Harn täglich nur etwa 5 µM Protonen frei aus (Harn-pH meist zwischen
5,0 und 6,0); mehr als 99,99% in gepufferter Form, vorwiegend als
primäres Phosphat sowie als Ammoniumionen.
Die
Summe der mit dem Harn zu eliminierenden sauren Valenzen beträgt bei üblicher Kost 50-100
mM/Tag. Als Protonen ausgeschieden (also ohne Pufferung in Wasser
gelöst) würde der Harn dabei einen pH von ungefähr 1,3 haben - viel zu
sauer für das Gewebe des Harntrakts. Tatsächlich scheidet man mit dem
Harn täglich nur etwa 5 µM Protonen frei aus (Harn-pH meist zwischen
5,0 und 6,0); mehr als 99,99% in gepufferter Form, vorwiegend als
primäres Phosphat sowie als Ammoniumionen.

Über Ort und Mechanismus der
Säureausscheidung entlang des Nephrons s.
dort
Bicarbonatresorption

Zum
Bicarbonattransport s. auch
dort
Na+ wird mit Bicarbonat über die basolaterale Membran der proximalen Tubuluszelle durch NBC1 Richtung Blut "mitgenommen"
|
 In Summe wird so im proximalen Tubulus 85-90% des glomerulär filtrierten Natriumbicarbonats rückresorbiert (über CO2,
In Summe wird so im proximalen Tubulus 85-90% des glomerulär filtrierten Natriumbicarbonats rückresorbiert (über CO2,  Abbildung). Die Entfernung des Bicarbonats aus dem Tubuluslumen und der Austausch gegen H+-Ionen senkt im proximalen Tubulus den pH-Wert
von 7,4 (glomeruläres Filtrat) auf 6,8 (Ende des proximalen Tubulus).
Die restlichen 15% des filtrierten Bicarbonats werden weiter distal
rückresorbiert, insbesondere von Typ A-Zwischenzellen der Sammelrohre.
Abbildung). Die Entfernung des Bicarbonats aus dem Tubuluslumen und der Austausch gegen H+-Ionen senkt im proximalen Tubulus den pH-Wert
von 7,4 (glomeruläres Filtrat) auf 6,8 (Ende des proximalen Tubulus).
Die restlichen 15% des filtrierten Bicarbonats werden weiter distal
rückresorbiert, insbesondere von Typ A-Zwischenzellen der Sammelrohre.
Bicarbonat wird normalerweise nicht mit dem Harn ausgeschieden; im Gegenteil, die Nieren bilden aus CO2 täglich ~70 mM Bicarbonat neu, um den Verlust zu kompensieren, der bei der Pufferung der renal auszuscheidenden Säuren auftritt (Nierentubuluszellen vertragen pH-Werte unter ~4,5 schlecht).
Der proximale Tubulus gewinnt mittels eines luminalen Na+/H+-Antiporters ~90% des filtrierten Bicarbonats zurück
|
Carboanhydrase (CAH, carbonic anhydrase) sowohl in der Zelle als auch in der apikalen Membran wird für die Umwandlung zwischen H+ und CO2 benötigt ( Abbildung) - die Katalyse über dieses Enzym erfolgt enorm rasch (etwa 105 Reaktionen pro Sekunde).
Abbildung) - die Katalyse über dieses Enzym erfolgt enorm rasch (etwa 105 Reaktionen pro Sekunde). Im Lumen entsteht aus H+ und Bicarbonat wiederum CO2 (das wiederum leicht durch die Membran diffundiert, vgl. dort):
CO2 + H2O  H2CO3 H2CO3  H+ + HCO3- H+ + HCO3- |
Es entsteht an der apikalen Membran ein Kreislauf für Protonen (um den
Na/H-Austauscher NHE), während an der basolateralen Membran
Natriumbicarbonat die Zelle verlässt und in den Kreislauf
(zurück)gelangt. Eine Unterbrechung dieses Mechanismus stoppt die
Reklamation von filtriertem Bicarbonat (einer Pufferbase), was Azidose
zur Folge hat:
Wird die Carboanhydrase im proximalen Tubulus gehemmt, sinkt die H+-Ausscheidung, was zu einer Azidose führen kann
|
P
rotonen können
von Tubulusepithelzellen sezerniert werden - proximal und distal. Diese
Protonen werden in der Tubulusflüssigkeit gepuffert - entweder durch
Bicarbonat oder durch Nichtbicarbonat-puffer (hauptsächlich Phosphat).
In 24 Stunden scheidet die Niere etwa 45 mmol Phosphat (z.B. aus dem
Abbau von Nukleinsäuren) aus. Wieviel davon kann für die Pufferung
saurer Tubulusflüssogkeit genutzt werden? Bei einem Blut-pH von 7,4
liegen 80% des Phosphats in der monoprotischen Form (primäres Phosphat, HPO42-) vor - diese kann Protonen puffern, 20% in der diprotischen Form (sekundäres Phosphat, H2PO4-) - diese entsteht beim Verbrauch von Protonen.
Das bedeutet, dass pro Tag etwa 36 mmol pufferfähiges (monoprotosches)
Phosphat (45 x 0,8) zur Verfügung stehen (ein Harn-pH von 5,3 liegt um
1,5 pH-Einheiten unter dem pK-Wert des Puffersystems HPO42-  H2PO4-, hier ist das gesamte primäre Phosphat aufgebraucht); 36 mmol Bicarbonat wurden dabei gewonnen (
H2PO4-, hier ist das gesamte primäre Phosphat aufgebraucht); 36 mmol Bicarbonat wurden dabei gewonnen ( vgl. dort).
Neben Phosphat werden auch andere Puffersalze glomerulär filtriert:
vgl. dort).
Neben Phosphat werden auch andere Puffersalze glomerulär filtriert:
 Sulfate (aus schwefelhaltigen Aminosäuren),
Sulfate (aus schwefelhaltigen Aminosäuren),
 Harnsäuren bzw. Urate (aus Purin-Nukleotiden) (pK = 5,8),
Harnsäuren bzw. Urate (aus Purin-Nukleotiden) (pK = 5,8),
 Oxalsäure bzw. Oxalate (aus Stoffwechsel bzw. Ernährung),
Oxalsäure bzw. Oxalate (aus Stoffwechsel bzw. Ernährung),
 Milchsäure bzw. Lactate (aus unvollständigem Glucoseabbau),
Milchsäure bzw. Lactate (aus unvollständigem Glucoseabbau),
 allenfalls Ketonkörper (aus Fettsäuren).
Alle diese Nichtbicarbonat-Puffer erscheinen letztlich im Harn und ihre
Ausscheidung ermöglicht die Bestimmung der Bicarbonatsynthese (bicarbonate regeneration)
in der Niere. Das geschieht folgendermaßen: Man fügt dem Harn (der in
einer bestimmten Zeit ausgeschieden wurde, etwa in 24 Stunden) eine
starke Säure (z.B. NaOH) so lange zu, bis der pH-Wert dem im
glomerulären Filtrat herrschenden (7,4) entspricht. Diese
"Titration" macht den Ansäuerungsprozess rückgängig, der während der
Bildung des Urins abgelaufen ist. Man spricht von titrierbaren Säurevalenzen im Harn.
allenfalls Ketonkörper (aus Fettsäuren).
Alle diese Nichtbicarbonat-Puffer erscheinen letztlich im Harn und ihre
Ausscheidung ermöglicht die Bestimmung der Bicarbonatsynthese (bicarbonate regeneration)
in der Niere. Das geschieht folgendermaßen: Man fügt dem Harn (der in
einer bestimmten Zeit ausgeschieden wurde, etwa in 24 Stunden) eine
starke Säure (z.B. NaOH) so lange zu, bis der pH-Wert dem im
glomerulären Filtrat herrschenden (7,4) entspricht. Diese
"Titration" macht den Ansäuerungsprozess rückgängig, der während der
Bildung des Urins abgelaufen ist. Man spricht von titrierbaren Säurevalenzen im Harn.
 Benötigt man für die Titration des Harns auf pH=7,4 z.B. 50 mmol NaOH,
dann wurden 50 mmol Protonen gepuffert und es sind in der Niere in
dieser Zeit 50 mmol Bicarbonat entstanden.
Benötigt man für die Titration des Harns auf pH=7,4 z.B. 50 mmol NaOH,
dann wurden 50 mmol Protonen gepuffert und es sind in der Niere in
dieser Zeit 50 mmol Bicarbonat entstanden.
Ammonium-Mechanismus und Pufferbasen
 s. auch dort
s. auch dort
Ammoniumionen (NH4+) transportieren Protonen, die auf Ammoniak übertragen wurden (NH3 + H+  NH4+). Über die Niere wird H+ u.a. in Form von Ammoniumionen ausgeschieden.
NH4+). Über die Niere wird H+ u.a. in Form von Ammoniumionen ausgeschieden.
Das organische Anion stammt aus dem
Abbau von Aminosäuren (vor allem Glutamin, das aus Leber- und
Muskelzellen sowie aus dem Darm stammt).
Zwar trägt die Ammoniumausscheidung nicht direkt zur Ausscheidung von
Wasserstoffionen bei, aber wird es rückresorbiert, dann verwandelt die
Leber es zu Harnstoff - dabei entsteht H+, das wiederum
gepuffert werden muss.
 Die Ausscheidung von Ammoniumionen spart also
Bicarbonat und entlastet indirekt den Pufferverbrauch im Harn.
Die Ausscheidung von Ammoniumionen spart also
Bicarbonat und entlastet indirekt den Pufferverbrauch im Harn.
Die Ausscheidung von Ammoniumionen (NH4+) ist einer der Wege, wie saure Valenzen aus dem Körper entfernt werden können, ohne (zum Schutz der Tubuluszellen) den Harn-pH zu stark sinken zu lassen. Quelle des dazu benötigten Stickstoffs ist Glutamin, eine in Proteinen sehr häufige nicht-essentielle Aminosäure (sie bildet 1/5 des extrazellulären Aminosäurepools).
 Proximale Tubuluszellen nehmen Glutamin auf (Quelle: Filtrat, Blut / Interstitium) und
verwandeln es in Ammonium und α-Ketoglutarat - aus dem wiederum
Bicarbonat gewonnen wird. Die
renale Ammoniumausscheidung (Entfernung saurer Valenzen) ist daher
direkt mit der Bicarbonatsynthese (Bildung von Pufferbasen) verknüpft
und wirkt einer "Übersäuerung" des Körpers entgegen. Das bezieht sich
auf die relativ wenigen "nichtflüchtigen" Säuren, die über die Niere
ausgeschieden werden müssen - der Hauptteil der Entfernung saurer
Valenzen (in der Form von CO2) übernimmt die Atmung.
Proximale Tubuluszellen nehmen Glutamin auf (Quelle: Filtrat, Blut / Interstitium) und
verwandeln es in Ammonium und α-Ketoglutarat - aus dem wiederum
Bicarbonat gewonnen wird. Die
renale Ammoniumausscheidung (Entfernung saurer Valenzen) ist daher
direkt mit der Bicarbonatsynthese (Bildung von Pufferbasen) verknüpft
und wirkt einer "Übersäuerung" des Körpers entgegen. Das bezieht sich
auf die relativ wenigen "nichtflüchtigen" Säuren, die über die Niere
ausgeschieden werden müssen - der Hauptteil der Entfernung saurer
Valenzen (in der Form von CO2) übernimmt die Atmung.
 Die Hauptlast der renalen Ammoniumsynthese tragen die proximalen Tubuli. Die
renale Bildung von Ammonium kann bis auf eine tägliche Ausscheidung von
600-700 mM Säurevalenzen hinaufreguliert werden, das Zehnfache der
normalerweise anfallenden renalen Säureelimination.
Die Hauptlast der renalen Ammoniumsynthese tragen die proximalen Tubuli. Die
renale Bildung von Ammonium kann bis auf eine tägliche Ausscheidung von
600-700 mM Säurevalenzen hinaufreguliert werden, das Zehnfache der
normalerweise anfallenden renalen Säureelimination.

 Abbildung: Molekülmodelle für Ammoniak, Wasser und Harnstoff
Nach Weiner ID, Verlander JW, Ammonia transporters and their role in acid-base balance. Physiol Rev 2017; 97: 465-94
Abbildung: Molekülmodelle für Ammoniak, Wasser und Harnstoff
Nach Weiner ID, Verlander JW, Ammonia transporters and their role in acid-base balance. Physiol Rev 2017; 97: 465-94
Die Moleküle zeigen starke Polarität (positiv blau, negativ rot), obzwar sie keine Netto-Ladung aufweisen

Durch gesteuerte Rückresorption von Bicarbonat sowie Sekretion von
Ammonium
spielt der proximale Tubulus eine wichtige Rolle für den
Säure-Basen-Haushalt: Ammonium wird in das Tubuluslumen sezerniert -
getrennt als H+ und NH3; im Tubuluslumen rekombinieren diese zu NH4+-Ionen, die nur schwer in die Tubuluszelle wiederaufgenommen werden können ("Protonenfalle"). NH3 ist
zwar neutral, aber durch die asymmetrische Ladungsverteilung dennoch
ein polares Molekül mit Dipoleigenschaften (ähnlich wie Wasser oder
Harnstoff -  Abbildung), und seine Bewegung durch Zellmembranen ist spezifisch
reguliert, z.B. durch Aquaporine.
Abbildung), und seine Bewegung durch Zellmembranen ist spezifisch
reguliert, z.B. durch Aquaporine.

 Abbildung: Tubulärer Glutamin- / Ammonium- Metabolismus
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Tubulärer Glutamin- / Ammonium- Metabolismus
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Proximale Tubulusepithelzellen (A) nehmen glomerulär filtriertes Glutamin apikal aus dem Tubuluslumen über einen Natrium- Aminosäuren- Symporter (SNAT: sodium-coupled neutral amino acid transporter) so gut wie vollständig
wieder auf. Auch aus dem Interstitium gelangt Glutamin (über die basolaterale Membran) mittels SNAT3 in die Zelle.
Es gelangt dann entweder in Mitochondrien - hier entsteht
Malat, das von der Zelle zu Glucose weiterverwertet und über Glucosetransporter (GLUT2 und GLUT1) exportiert wird - oder über Austausch mit aromatischen Aminosäuren basolateral in Interstitium und Blutkreislauf.
PEPCK, Phosphoenolpyruvat- Carboxykinase
Der absteigende Schenkel der Henle-Schleife juxtamedullärer Nephrone (B) sezerniert Ammoniumionen (NH4+) vor allem in der äußeren Medulla - mittels Aquaporin 1.
Der dicke Teil des aufsteigenden Schenkels (C) nimmt das meiste NH4+
wieder auf (es rezirkuliert, erreicht die Rinde kaum), wozu es
Transporter bedarf, denn die apikale Membran ist hier für Ammonium
schlecht permeabel (Ammonium kann Chlorid am Na/K/Cl-Cotransporter
ersetzen, wie in der Abbildung gezeigt). In das Interstitium gelangt NH4+ vermutlich als NH3 (RhBG und RhCG sind Ammoniaktransporter).
Der Austausch im Mark kann über drei Wege gehen (D): Ein Teil des Ammoniums dissoziiert, Ammoniak gelangt in das Lumen des absteigenden Schenkels (1), und mit Wasserstoffionen entsteht wieder NH4+, das so recycelt wird. Ein Teil des Ammoniaks gelangt in das Sammelrohrsystem und kann als Ammonium ausgeschieden werden (2). Das toxische NH3
verbleibt im Wesentlichen im Markraum und gelangt kaum in den
Kreislauf. Ein kleiner Teil gelangt in die vasa recta und wird
anschließend von der Leber entgiftet (3).
Im Sammelrohrsystem (E) ermöglichen Ammoniaktransporter (RhCG) zusammen mit Natrium-Ammonium-Austausch (basolateral) und H+-Pumpen (apikal) die Ammoniakausscheidung Richtung Harn.
Die Expression der verschiedenen Membrantransporter erfolgt in den jeweiligen Nephronabschnitten bedarfsabhängig,
d.h. je nach Stoffwechsellage - vor allem im proximalen Tubulus. Bei
der Verwertung von Glutamin fällt u.a. Ammonium an

Ammonium wird in der Niere fast ausschliesslich (97-98%) aus dem Aminosäureabbau (vorwiegend Glutamin) gewonnen, nur 2-3% des im Harn ausgeschiedenen Ammonium kommen von den Glomeruli: Das kleine Glutaminmolekül wird in den Glomeruli filtriert und von den Tubuluszellen - mittels entsprechender Transporter, die
bedarfsgemäß exprimiert werden können - sowohl apikal (aus dem Filtrat)
als auch basolateral (aus dem Interstitium) zur Gänze rückresorbiert.
Unter Basisbedingungen wird die Hälfte des gebildeten Ammoniums mit dem
Harn ausgeschieden, die andere Hälfte in das Blut aufgenommen.
 Bei
metabolischer Azidose steigt der ausgeschiedene Anteil auf bis zu 80%
an; nur ausgeschiedenes Ammonium entlastet den Pufferstatus, da die Bildung von NH4+ und HCO3- äquimolar erfolgt, d.h. auf ein Ammonium entfällt jeweils ein Bicarbonat.
Bei
metabolischer Azidose steigt der ausgeschiedene Anteil auf bis zu 80%
an; nur ausgeschiedenes Ammonium entlastet den Pufferstatus, da die Bildung von NH4+ und HCO3- äquimolar erfolgt, d.h. auf ein Ammonium entfällt jeweils ein Bicarbonat.
 Bei
der Metabolisierung von Glutamin fällt Glucose an (
Bei
der Metabolisierung von Glutamin fällt Glucose an ( Abbildung). Im
postabsorptiven Normalzustand trägt die Niere mit etwa 20% zur Glucoseversorgung des Körpers bei (den größeren Teil übernimmt die Leber), im chronischen Hungerzustand kann dieser Anteil auf 45% ansteigen - die Niere kann zu einem bedeutenden Glucoseproduzenten werden, z.B. auch bei metabolischer Azidose oder Hypokaliämie.
Abbildung). Im
postabsorptiven Normalzustand trägt die Niere mit etwa 20% zur Glucoseversorgung des Körpers bei (den größeren Teil übernimmt die Leber), im chronischen Hungerzustand kann dieser Anteil auf 45% ansteigen - die Niere kann zu einem bedeutenden Glucoseproduzenten werden, z.B. auch bei metabolischer Azidose oder Hypokaliämie.

 Abbildung: Epithelialer Ammoniumtransport in der Niere
Nach Weiner ID, Verlander JW, Ammonia transporters and their role in acid-base balance. Physiol Rev 2017; 97: 465-94
Abbildung: Epithelialer Ammoniumtransport in der Niere
Nach Weiner ID, Verlander JW, Ammonia transporters and their role in acid-base balance. Physiol Rev 2017; 97: 465-94
Gezeigt ist der physiologische Basiszustand. Prozentzahlen (blau) relativ zur im Harn ausgeschiedenen Ammoniummenge (=100%).
Nur wenig
Ammonium (2-3%) stammt aus der glomerulären Filtration, wesentlich mehr
produzieren die proximalem Tubuli - durch Abbau von Glutamin (je zwei
mol Ammonium und Bicarbonat pro mol Glutamin). Ammonium reichert sich im
Mark an (Henle'sche Schleife) und wird im aufsteigenden Schenkel
rückresorbiert, im frühen distalen Segment verbleiben 20-40%.
Die Sammelrohre sezernieren Ammonium (60-80%) durch parallelen Transport
von H+ und NH3 (die Wand des Sammelrohrs ist für NH4+ undurchlässig).
Sulfate (grüne Kreisfläche) im renalen Interstitium binden Ammoniumionen und stabilisieren das Säure-Basen-Gleichgewicht

Renal entstandenes Ammonium wird von allen Nephronsegmenten transportiert ( Abbildung). Das fettlösliche NH3 rezirkuliert zwischen Interstitium und Tubuli (NH4+ wird im aufsteigenden Schenkel der Henle-Schleife in das Interstitium resorbiert und verwandelt sich hier wieder in NH3) und seine Konzentration bleibt dadurch relativ hoch.
Abbildung). Das fettlösliche NH3 rezirkuliert zwischen Interstitium und Tubuli (NH4+ wird im aufsteigenden Schenkel der Henle-Schleife in das Interstitium resorbiert und verwandelt sich hier wieder in NH3) und seine Konzentration bleibt dadurch relativ hoch.
 Zum tubulären Ammoniumtransport s. auch dort
Zum tubulären Ammoniumtransport s. auch dort
Bei der tubulären Ammoniumsynthese fällt Bicarbonat
an, dieses wird in das Blut exportiert und stärkt hier die
Pufferfähigkeit. Werden Säuren abgepuffert, entsteht aus Bicarbonat CO2, und dieses wird über die Atmung entfernt.
In das Blut aufgenommenes Ammonium wird normalerweise von der Leber entfernt.
Erhöhte
Ammoniumspiegel im Blut - bei Leberversagen - wirken neurotoxisch und
können u.a. Lethargie und zerebrales Ödem verursachen.
Rückresorbiert
werden weiters Glucose und Aminosäuren (vollständig; Clearance = 0), Glycerin, Lactat, Pyruvat,
Ketonkörper u.a. Dazu stehen der Tubuluszelle verschiedene Transporter (SLC: solute carrier) zur Verfügung, sowohl apikal als auch basolateral.
Transport auf Hochtouren: Das tubuläre Maximum
Transporter in Zellmembranen haben eine jeweils maximale Förderkapazität.
Übersteigt das tubulär-luminale Angebot dieses Maximum, bleibt der nicht
wiederaufgenommene Teil im Tubulussystem zurück und wird mit dem Harn
ausgeschieden.
 Als tubuläres Maximum bezeichnet man die höchste
tubuläre Transportkapazität für einen bestimmten zu transportierenden Stoff - z.B. Glucose oder Aminosäuren:
Als tubuläres Maximum bezeichnet man die höchste
tubuläre Transportkapazität für einen bestimmten zu transportierenden Stoff - z.B. Glucose oder Aminosäuren:
 Der
normale Nüchtern-Glucosespiegel im Blutplasma (und im glomerulären
Filtrat) beträgt 4-5 mM (70-100 mg/dl). Die proximalen Tubuli nehmen so
gut wie die gesamte filtrierte Menge - transzellulär - wieder auf,
verwenden sie teils für ihren
eigenen Energiestoffwechsel und exportierern den Rest in
Richtung Interstitium und Blutkreislauf.
Der
normale Nüchtern-Glucosespiegel im Blutplasma (und im glomerulären
Filtrat) beträgt 4-5 mM (70-100 mg/dl). Die proximalen Tubuli nehmen so
gut wie die gesamte filtrierte Menge - transzellulär - wieder auf,
verwenden sie teils für ihren
eigenen Energiestoffwechsel und exportierern den Rest in
Richtung Interstitium und Blutkreislauf.
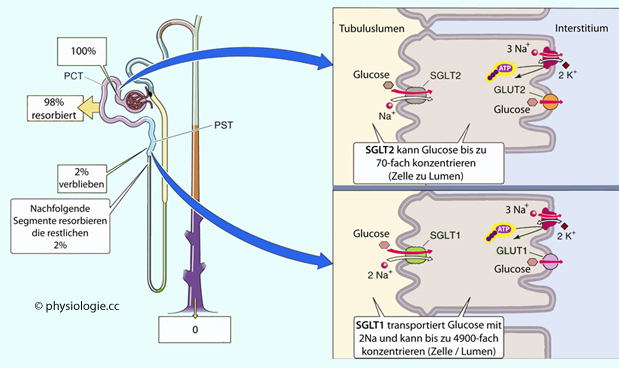
 Abbildung: Wie die Niere mit Glucose umgeht
Abbildung: Wie die Niere mit Glucose umgeht
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Die Zahlenwerte stehen in Relation zur golmerulär filtrierten Glucosemenge.
PCT = proximaler Tubulus, pasr convoluta; PST = pars recta.
SGLT = Na/Glucose-Symporter (sodium glucose transporter)

 Über die apikale Membran resorbieren die Zellen des frühproximalen Tubulus bis zu 98% der glomerulär filtrierten Glucose mittels SGLT2-Transporter
zusammen mit Natriumionen (1:1, sekundär aktiv, hohe
Transportkapazität, geringe Affinität), wobei sie eine Anreicherung bis
zum 70-fachen der Konzentration im Tubuluslumen aufbauen können. SGLT2
wird exklusiv von renalen Zellen exprimiert (SGLT2-Inhibitoren wirken
daher nur an der Niere, sie bleiben ohne Einfluss auf den
Glucosetransport in anderen Organen).
Über die apikale Membran resorbieren die Zellen des frühproximalen Tubulus bis zu 98% der glomerulär filtrierten Glucose mittels SGLT2-Transporter
zusammen mit Natriumionen (1:1, sekundär aktiv, hohe
Transportkapazität, geringe Affinität), wobei sie eine Anreicherung bis
zum 70-fachen der Konzentration im Tubuluslumen aufbauen können. SGLT2
wird exklusiv von renalen Zellen exprimiert (SGLT2-Inhibitoren wirken
daher nur an der Niere, sie bleiben ohne Einfluss auf den
Glucosetransport in anderen Organen).
Im
letzten Teil des proximalen Tubulus (pars recta) erfolgt die Aufnahme
der restlichen 2-10% über den SGLT1,
der 1 Mol Glucose mit 2 mol Natrium befördert (und damit über eine
höhere elektrochemische Energie pro mol Glucose verfügt). Er ist selektiver (10-fach höhere Affinität zu Glucose
als SGLT2), hat aber eine vergleichsweise geringe Transportkapazität (die meiste Glucose sollte ohnehin schon resorbiert sein).
Hier kann die intrazelluläre Konzentration sogar fast das 5000-fache
der tubulären erreichen ( Abbildung). SGLT-1 findet sich auch in
anderen Geweben (Herz, Lunge, Gastrointestinaltrakt).
Abbildung). SGLT-1 findet sich auch in
anderen Geweben (Herz, Lunge, Gastrointestinaltrakt).
Dysfunktionales SGLT-2 (Genschaden / Mutation) führt dazu, dass Glucose (bei normalen
Blutzuckerwerten) mit dem Harn verlorengeht (Glukosurie).
 SGLT (sodium glucose transporter) -2-Hemmer (z.B. Canagliflozin, Dapagliflozin, Empagliflozin) behindern die tubuläre Glucoseresorption und senken - insulinunabhängig - den Blutzuckerspiegel (Diabetes-II-Behandlung), sie führen auch zu Kalorienverlust.
SGLT (sodium glucose transporter) -2-Hemmer (z.B. Canagliflozin, Dapagliflozin, Empagliflozin) behindern die tubuläre Glucoseresorption und senken - insulinunabhängig - den Blutzuckerspiegel (Diabetes-II-Behandlung), sie führen auch zu Kalorienverlust.
 In der basolateralen
Membran befindet sich die Na/K-ATPase, welche den für den Betrieb des
sekundär-aktiven Transport nötigen Natriumgradienten garantiert, sowie
die insulinunabhängigen Glucosetransporter GLUT2 (frühproximal, hohe Transportkapazität )
und GLUT1 (pars recta). Anders als die SGLTs, sind diese Transporter
natriumunabhängig; sie erleichtern die Diffusion der Glucose aus den
Epithelzellen in das Interstitium.
In der basolateralen
Membran befindet sich die Na/K-ATPase, welche den für den Betrieb des
sekundär-aktiven Transport nötigen Natriumgradienten garantiert, sowie
die insulinunabhängigen Glucosetransporter GLUT2 (frühproximal, hohe Transportkapazität )
und GLUT1 (pars recta). Anders als die SGLTs, sind diese Transporter
natriumunabhängig; sie erleichtern die Diffusion der Glucose aus den
Epithelzellen in das Interstitium.
Das tubuläre Maximum für Glucose (Blutzucker)
ist mehr als doppelt so hoch (~14 mM) als für totale Rückresorption bei normalem
Nüchtern-Blutzuckerspiegel (~5 mM) erforderlich
(daraus ergibt sich eine funktionelle Reserve, die z.B. bei
postprandialer Hyperglykämie nutzbar ist).
Stark erhöhter
Blutzuckerspiegel überfordert das tubuläre Maximum ( Abbildung), der Zucker wird nur
teilweise wiederaufgenommen, der Rest tritt im Harn auf (Glukosurie: Glucosekonzentration von ≥0,8 mM oder ≥15 mg/dl Nüchternurin).
Abbildung), der Zucker wird nur
teilweise wiederaufgenommen, der Rest tritt im Harn auf (Glukosurie: Glucosekonzentration von ≥0,8 mM oder ≥15 mg/dl Nüchternurin).

 Abbildung: Glucose-Titrationskurve
Abbildung: Glucose-Titrationskurve
Nach einer Vorlage in Guyton/Hall, Textbook of Medical Physiology, 12th ed. Saunders 2010
Rote Linie: Die
filtrierte Glucoselast (Ordinate) steigt linear mit dem Glucosespiegel
im Plasma (Abszisse). Das tubuläre Transportmaximum für Glucose liegt
bei etwa 400 mg/min, normalerweise kommen höchtens ~150 mg/min in die Tubuli.
Ab einer Glucose- Schwellenkonzentration von ~200
mg/dl (bei einer GFR entsprechend 120 ml werden dann 240 mg/min Glucose
filtriert) beginnt etwas Glucose in den Harn überzutreten, viele
Nephrone sind da noch nicht an ihrem tubulären Maximum angelangt und
sind erst bei höheren Plasmaspiegeln voll ausgelastet.
Steigt der Blutzuckerspiegel weiter auf 300-400 mg/dl, gelangen
sämtliche Tubuli an ihr Transportmaximum für Glucose; die
rückresorbierte Menge (blaue Kurve) läßt sich
bei noch höheren Glucosespiegeln nicht mehr steigern, die Glucoseausscheidung mit dem Harn (grüne Kurve) nimmt bei starker
Hyperglykämie (>400 mg/dl) linear mit dem Blutzuckerspiegel zu

Bei Überschreiten des tubulären Maximums für Glucose wird nicht resorbierte Glucose mit dem Harn ausgeschieden (Glukosurie)
|
 Aminosäuren (Gesamtkonzentration im Plasma ~2,4 mM) werden glomerulär frei filtriert und im proximalen Tubulus mit Hilfe sekundär-aktiven
Transports transzellulär aus dem Tubulus zum Blut rückresorbiert (98-99%). Zunächst werden sie
apikal teils Na+- und/oder H+-gekoppelt,
teils über erleichterte Diffusion in die Tubuluszelle aufgenommen; dann
verlassen sie die Zellen über deren basolaterale Membran mittels
erleichterter Diffusion oder über (Na-abhängige) Aminosäureaustauscher.
Aminosäuren (Gesamtkonzentration im Plasma ~2,4 mM) werden glomerulär frei filtriert und im proximalen Tubulus mit Hilfe sekundär-aktiven
Transports transzellulär aus dem Tubulus zum Blut rückresorbiert (98-99%). Zunächst werden sie
apikal teils Na+- und/oder H+-gekoppelt,
teils über erleichterte Diffusion in die Tubuluszelle aufgenommen; dann
verlassen sie die Zellen über deren basolaterale Membran mittels
erleichterter Diffusion oder über (Na-abhängige) Aminosäureaustauscher.

 Abbildung: Wie die Niere mit Oligopeptiden umgeht
Abbildung: Wie die Niere mit Oligopeptiden umgeht
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
PCT = Proximaler Tubulus, pars convoluta; PST = pars recta
Etwa 99% der filtrierten Oligopeptide werden tubulär resorbiert (links):
Einerseits bauen Peptidasen im Bürstensaum Aminosäuren ab und diese werden zusammen mit Natriumionen resorbiert (rechts oben),
oder die Oligopeptide werden direkt rzusammen mit Wasserstoffionen
resorbiert (Cotransporter PepT1 und PepT2) und dann durch einer
intrazelluläre Peptidase zu Aminosäuren (AA) abgebaut (rechts unten)

Die Transporter können jeweils mehrere Aminosäuren
über die Membran bringen (neutrale, saure, basische). So bringt der
Zystintransporter auch andere basische Aminosäuren über die
Membranbarriere (Lysin, Arginin, Ornithin).
Defekte von Membrantransportern betreffen daher nicht nur eine, sondern mehrere Aminosäuren (z.B. bei Zystinurie).
Manchmal werden Aminosäuren auch aus dem Blut aufgenommen, z.B.
Glutamin für Stickstoffausscheidung und Glukoneogenese.
Die tubulären
Transportmaxima sind nicht hoch, so dass es bei gesteigerten
Aminosäuren-Konzentrationen im Blutplasma zu partieller Ausscheidung
und Stabilisierung der Plasmawerte kommt.
 Peptide im Tubuluslumen - u.a.
Angiotensin und Glutathion - werden teils am apikalen Bürstensaum
(durch Endo-, Di-, Aminopeptidasen u.a.) zu Oligopeptiden und
Aminosäuren abgebaut. Oligopeptide (2-5 Aminosäuren, z.B. das vor allem in Muskeln und Nervensystem vorhandene Dipeptid Carnosin, das als Antioxidans und Puffer wirkt) werden teils erst in der Tubulusepithelzelle zu Aminosäuren abgebaut (zytoplasmazische Peptidasen), nachdem sie über die Oligopeptid-Cotransporter PepT1 und PepT2 zusammen mit H+ aufgenommen wurden (
Peptide im Tubuluslumen - u.a.
Angiotensin und Glutathion - werden teils am apikalen Bürstensaum
(durch Endo-, Di-, Aminopeptidasen u.a.) zu Oligopeptiden und
Aminosäuren abgebaut. Oligopeptide (2-5 Aminosäuren, z.B. das vor allem in Muskeln und Nervensystem vorhandene Dipeptid Carnosin, das als Antioxidans und Puffer wirkt) werden teils erst in der Tubulusepithelzelle zu Aminosäuren abgebaut (zytoplasmazische Peptidasen), nachdem sie über die Oligopeptid-Cotransporter PepT1 und PepT2 zusammen mit H+ aufgenommen wurden ( Abbildung).
Abbildung).
Proteine
treten im Ultrafiltrat in niedriger Konzentration auf (4-20 mg/l, also
um die 0,01% der Plasmakonzentration), da sie der Filtration weitgehend
entzogen sind.

 Abbildung: Wie die Niere mit Proteinen umgeht
Abbildung: Wie die Niere mit Proteinen umgeht
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Trotz
der weitgehenden Filtrationsbarriere entkommen einige Eiweißmoleküle in
das Filtrat und werden von Tubulusepithelzellen (clathrinvermittelt) endozytiert, zum
Großteil zu Aminosäuren hydrolysiert und diese an das Interstitium
weitergegeben.
Einige Proteinmoleküle entgehen dem lysosomalen Abbau und gelangen direkt in das Interstitium

Pro Tag ergibt
das immerhin um die 1-4 Gramm Albumin; im 24-Stunden-Harn befinden sich
nur rund 30 mg Albumin, d.h. die Tubuli resorbieren 96-99% des
Albumins, das in den Glomeruli filtriert wurde.
Tatsächlich nehmen die Tubuli zahlreiche glomerulär filtrierte Proteine wieder
auf, außer Albumin auch Globuline wie z.B. Immunglobulin-Leichtketten,
ß-Mikroglobulin, Lysozym und Hormone wie Insulin, Glucagon,
Parathormon, natriuretische Peptide. Sie tun das durch
rezeptorvermittelte Endozytose (apikal) mittels clathrinbedeckter
Vesikel und anschließendem lysosomalen Abbau zu Aminosäuren, die dann
verwendet bzw. (basolateral) exportiert werden ( Abbildung). Dieser
Abbau kann Minuten bis Tage dauern. Einige Proteinmoleküle können dem
Abbau auch entgehen und gelangen transzytotisch direkt in das
Interstitium.
Abbildung). Dieser
Abbau kann Minuten bis Tage dauern. Einige Proteinmoleküle können dem
Abbau auch entgehen und gelangen transzytotisch direkt in das
Interstitium.
Der renale Abbau kleiner Proteine und Peptidhormone (renal excretion rate) ist für deren Clearance aus dem Kreiuslauf wesentlich; er kann bis zu 80% ihrer Abbaurate betragen.
Kalium
Eine der Aufgaben der Niere ist die Regulierung der Kaliumbilanz
des Körpers (Aufnahme mit der Nahrung vs. Ausscheidung über den Harn, normalerweise 60-80 mM/Tag) - die
glomerulär filtrierte Menge beträgt bei normalem Kaliumspiegel (3,5-5,0
mM/l Blutplasma) etwa 800 mM in 24 Stunden. Das heißt, die Ausscheidung
mit dem Harn beträgt 10-15% der glomerulär filtrierten Menge (~80% werden vom proximalen Tubulus, ~10% durch die Henle-Schleife rückresorbiert). Auch die Sammelrohre des Nierenmarks beteiligen sich an der Rückresorption von Kalium (einige % der filtrierten Menge).
Abhängigkeit von der Kaliumzufuhr: Bei niedriger Kaliumaufnahme (kaliumarme Ernährung) sinkt dieser Anteil auf 1-3%, andererseits kann er bei überschießender Kaliumaufnahme bis auf ~150% der filtrierten Menge zunehmen - das geht nur durch zusätzliche Sekretion in den distalen Tubuli ( s. dort).
s. dort).
Die Nieren übernehmen 85-95% der Kaliumausscheidung, der Darm 5-15%. Der extrazelluläre Kaliumpool beträgt etwa 65-75 mM, der intrazelluläre ~3000 mM (vor allem in der Skelettmuskulatur).
Mit der Nahrung aufgenommenes Kalium wandert zunächst (innerhalb von ~60 Minuten) zu ~80%
in die Zellen des Körpers, wo es zwischengespeichert wird (der Kaliumspiegel im
Blutplasma steigt nach einer typischen Mahlzeit nur um Bruchteile eines
mM und kehrt nach 2-3 Stunden wieder zum Ausgangswert zurück). Es
dauert dann etwa 12 Stunden, bis die Kaliumbilanz über vermehrte renale
Ausscheidung wieder vollständig normalisiert ist. Ohne
diesen Puffermechanismus - hormonell gesteuert durch Aldosteron,
Insulin und Adrenalin, welche die Aktivität der Na/K-Pumpe anregen -
würde der Kaliumspiegel nach größeren Mahlzeiten gefährlich ansteigen.
 Zur Steuerung der extrazellulären Kaliumstabilität durch Insulin, Adrenalin und Aldosteron s. dort
Zur Steuerung der extrazellulären Kaliumstabilität durch Insulin, Adrenalin und Aldosteron s. dort
Massive
Gewebeschäden (Quetschungen, Verletzungen) können zu lebensbedrohlichem
Anstieg des Kaliumspiegels im Blutplasma führen (Hyperkaliämie); eine
der möglichen Folgen ist Depolarisierung und Stillstand von
Herzmuskelzellen.
Der Konzentrationsgradient intrazellulär / extrazellulär (ungefähr 30 zu 1) ist entscheidend für die Aufrechterhaltung des Membranpotentials der Körperzellen.
Kaliumionen werden
 glomerulär filtriert (~0,8
M/d, d.h. 8-mal die tägliche orale Aufnahme),
glomerulär filtriert (~0,8
M/d, d.h. 8-mal die tägliche orale Aufnahme),
 im proximalen Tubulus zu ~80% (davon rund die Hälfte parazellulär durch den elektrischen Gradienten, der durch den Chlorideinstrom entsteht) und
im proximalen Tubulus zu ~80% (davon rund die Hälfte parazellulär durch den elektrischen Gradienten, der durch den Chlorideinstrom entsteht) und
 in der aufsteigenden Henle-Schleife
zu ~10% rückresorbiert,
in der aufsteigenden Henle-Schleife
zu ~10% rückresorbiert,
 im distalen Tubulus gar nicht (niedriges
Kaliumangebot) oder - abhängig von der
Kaliumbilanz unter
Einfluss von Aldosteron - zu 20-180% (der filtrierten Menge) - vom spätdistalen Tubulussystem (inklusive kortikalen Sammelrohren) sezerniert,
im distalen Tubulus gar nicht (niedriges
Kaliumangebot) oder - abhängig von der
Kaliumbilanz unter
Einfluss von Aldosteron - zu 20-180% (der filtrierten Menge) - vom spätdistalen Tubulussystem (inklusive kortikalen Sammelrohren) sezerniert,
 im
medulläres Sammelrohrsystem zu 6-40% der filtrierten Menge
rückresorbiert (höhere Werte bei exzessivem Kaliumangebot in der
Nahrung, was starke Sekretion in den distalen Tubulus zur Folge hat, s.
dort).
im
medulläres Sammelrohrsystem zu 6-40% der filtrierten Menge
rückresorbiert (höhere Werte bei exzessivem Kaliumangebot in der
Nahrung, was starke Sekretion in den distalen Tubulus zur Folge hat, s.
dort).

 Abbildung: Wie die Niere mit Kalium umgeht
Abbildung: Wie die Niere mit Kalium umgeht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Der Kaliumaustausch erfolgt para- und transzellulär, die Ausscheidung unterliegt je nach Bedarf starken Schwankungen.
Der proximale Tubulus resorbiert K+
parazellulär (durch tight junctions) über Elektrodiffusion (Lumen
negativ) und Lösungsmittelsog (es wandert mit resorbiertem Wasser).
Dazu kommen transzelluläre Vorgänge, die nicht zur Resorption von
Kalium beitragen müssen.
Im dicken aufsteigenden Schenkel der Henle-Schleife wird Kalium vorwiegend transzellulär resorbiert, der Na/K/Cl-Kotransport spielt eine tragende Rolle.
Haupt- (70%) und Schaltzellen (30%) des kortikalen Sammelrohrs nehmen K+ über die Na/K-ATPase der basolateralen Membran auf. Die apikale Membran der Hauptzellen verfügt über hohe Permeabilität für Kalium (ROMK-Kanäle), und das Tubuluslumen ist negativ geladen. Diese negative Ladung nimmt zu, wenn mehr Na+ durch ENaCs in die Zelle dringt; das erhöht den Ausstrom von K+,
wirkt also kaliuretisch. Sinkt der luminale Chloridspiegel, wirkt dies
ebenfalls kaliuretisch, vermutlich über den apikalen K/Cl-Cotransport.
Das medulläre Sammelrohr (nicht gezeigt) trägt schließlich zur Resorption (nicht Sekretion) von Kalium bei.
ENaC, epithelialer Natriumkanal

Wird Kalium vermehrt benötigt (Kaliummangel), wird es nur geringgradig
(zumindest 1-3% der filtrierten Menge) mit dem Harn
ausgeschieden.
Die Tubulusepithelzellen exprimieren Transportmoleküle in unterschiedlichem Muster, demnach unterscheiden sich die molekularen Transportmechanismen je nach Nephronabschnitt ( Abbildung):
Abbildung):
 Die Kaliumresorption erfolgt im proximalen Tubulus
weitgehend passiv und folgt der Rückresorption von Kochsalz. Der
Mechanismus ist im proximalen Abschnitt solvent drag (Mitbewegen in
Filtrat), im distalen zunehmend auch parazelluläre Diffusion (durch das lumen-negative transepitheliale elektrische Potential im frühen distalen Tubulus erleichtert).
Die Kaliumresorption erfolgt im proximalen Tubulus
weitgehend passiv und folgt der Rückresorption von Kochsalz. Der
Mechanismus ist im proximalen Abschnitt solvent drag (Mitbewegen in
Filtrat), im distalen zunehmend auch parazelluläre Diffusion (durch das lumen-negative transepitheliale elektrische Potential im frühen distalen Tubulus erleichtert).
Der
proximale Tubulus resorbiert den Hauptanteil (80-90%) des glomerulär
filtrierten Kaliums. Am Kaliumtransport des proximalen Tubulus nehmen
teil (

Abbildung):
 Basolaterale Na+-K+-Pumpe,
Basolaterale Na+-K+-Pumpe,

 basolateraler K+-Cl--Kotransport,
basolateraler K+-Cl--Kotransport,

 Diffusion durch K+-Kanäle (apikal - meist inaktiv, basolateral -
Öffnungswahrscheinlichkeit abhängig von Aktivität der Na/K-Pumpe)
Diffusion durch K+-Kanäle (apikal - meist inaktiv, basolateral -
Öffnungswahrscheinlichkeit abhängig von Aktivität der Na/K-Pumpe)

 Solvent drag (parazellulärer Weg)
Solvent drag (parazellulärer Weg)
 Im dicken aufsteigenden Schenkel der Henle-Schleife erfolgt die
Kaliumresorption jeweils zur Hälfte
Im dicken aufsteigenden Schenkel der Henle-Schleife erfolgt die
Kaliumresorption jeweils zur Hälfte
 passiv-parazellulär (unterstützt
durch die positive Aufladung des Tubuluslumens) und
passiv-parazellulär (unterstützt
durch die positive Aufladung des Tubuluslumens) und

 transzellulär, d.h.
über Na+/K+/2Cl--Kotransport (apikal) und K+-Permeasen - die basolaterale
Membran ist sowohl für K+ als auch für Cl- durchgängig.
transzellulär, d.h.
über Na+/K+/2Cl--Kotransport (apikal) und K+-Permeasen - die basolaterale
Membran ist sowohl für K+ als auch für Cl- durchgängig.
 Die Schaltzellen (intercalated cells) der kortikalen Sammelrohre spielen u.a. eine wesentliche Rolle für die H+-Sekretion. Dabei besteht eine Wechselwirkung mit der Kaliumresorption (
Die Schaltzellen (intercalated cells) der kortikalen Sammelrohre spielen u.a. eine wesentliche Rolle für die H+-Sekretion. Dabei besteht eine Wechselwirkung mit der Kaliumresorption ( Abbildung). K+
wird von der apikalen Membran aktiv in die Tubuluszelle transportiert
und verlässt sie basolateral über einen Kaliumkanal. Man unterscheidet
Schaltzellen vom Typ A (sezernieren H+ in das Tubuluslumen, z.T. im Austausch gegen Kalium,
Abbildung). K+
wird von der apikalen Membran aktiv in die Tubuluszelle transportiert
und verlässt sie basolateral über einen Kaliumkanal. Man unterscheidet
Schaltzellen vom Typ A (sezernieren H+ in das Tubuluslumen, z.T. im Austausch gegen Kalium,  Abbildung) und Typ B (sezernieren Bicarbonat im Austausch gegen Chlorid).
Abbildung) und Typ B (sezernieren Bicarbonat im Austausch gegen Chlorid).
 Die Hauptzellen (principal cells) der
späten distalen Tubuli und kortikalen Sammelrohre können Kalium über Kotransport mit Chlorid oder über Kaliumkanäle sezernieren. Hier wie
auch überall sonst spielt die Na+-K+-Pumpe der basolateralen Membran eine aktive Rolle (
Die Hauptzellen (principal cells) der
späten distalen Tubuli und kortikalen Sammelrohre können Kalium über Kotransport mit Chlorid oder über Kaliumkanäle sezernieren. Hier wie
auch überall sonst spielt die Na+-K+-Pumpe der basolateralen Membran eine aktive Rolle ( Abbildung). Die apikale Membran verfügt über epitheliale Natriumkanäle (ENaCs), durch die Natriumionen in die Zelle gelangen können; steigt der Na+-Einstrom, lässt dieser ein stärker lumen-negatives Potential zurück, was wiederum den Ausstrom von Kalium fördert, d.h. kaliuretisch wirkt.
Abbildung). Die apikale Membran verfügt über epitheliale Natriumkanäle (ENaCs), durch die Natriumionen in die Zelle gelangen können; steigt der Na+-Einstrom, lässt dieser ein stärker lumen-negatives Potential zurück, was wiederum den Ausstrom von Kalium fördert, d.h. kaliuretisch wirkt.

 Abbildung: Tubuläre Transportvorgänge und die Wirkung ausgewählter Pharmaka
Abbildung: Tubuläre Transportvorgänge und die Wirkung ausgewählter Pharmaka
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Aktiver
Transport erfolgt durch die basolateral liegende Na/K-Pumpe (P). Sie
stellt Konzentrationsgefälle her, z.B.zur luminalen Resorption von
Natriumionen.
Links oben: Proximale Tubuli erlauben die Diffusion von Ionen sowohl über die luminale als auch die basolaterale Membran. Der wichtigste Mechanismus zur Resorption von Na+ aus dem Tubuluslumen ist der Austausch gegen H+, dessen Produktion durch Carboanhydrase (CAH) in der Tubuluszelle angetrieben wird. Hemmung der Carboanhydrase (z.B. durch Acetazolamid) unterbindet dies
sowie die Resorption von Bicarbonat (steigert den pH-Wert des Harns),
da es in der Tubuluszelle nicht mehr ausreichend aus CO2, und dieses im Lumen kaum noch aus Bicarbonat nachgebildet wird.
Links unten: Schleifendiuretika (z.B. Furosemid) blockieren den Na/K/2Cl-Symporter der apikalen (luminalen) Membran (C1) und indirekt den K/Cl-Cotransport (C2).
Dadurch nimmt die tubuläre Resorptionskapazität ab (normalerweise etwa
25% der filtrierten Kochsalzmenge), die an das distale Tubulussystem
weitergereichte Salzmenge und die Natriurese zu.
Rechts oben: Im distalen Tubulus kann der apikale Na/Cl-Cotransport (C3) durch
Diuretika wie Thiazide gehemmt werden - auch damit verbleibt mehr
Kochsalz im Tubulus, was zu Diurese und Natriurese führt.
Rechts unten: Ohne ADH ist die Wand der Sammelrohre für Wasser (Diabetes insipidus!), und ohne Aldosteron für Natriumionen undurchlässig.
Die Diuretika Amilorid und Triamteren blockieren epitheliale
Natriumkanäle und reduzieren dadurch die Resorption von Kochsalz.
Basolaterale (aldosteronabhängige) Na/K-Pumpen transportieren Kalium
aus dem Interstitium (bzw. aus dem Kreislauf) in die Tubuluszellem,
über apikale Kaliumkanäle diffundieren sie Richtung Lumen; Natrium
diffundiert über apikale Natriumkanäle in die Zelle, was das
lumen-negative Potential (das zum elektrochemischen Grandienten für den
Kaliumausstrom beiträgt) verstärkt. Aufgrund dieser Verknüpfung von Natriumresorption und Kaliumsekretion gelangt mehr Kalium in den Harn, wenn mehr Na+ aus den Sammelrohren rückresorbiert wird ("Drehtüreffekt"), also wenn
* mehr Natriumionen in die Sammelrohre gelangt (allgemeine Wirkung von Diuretika),
* die Natriumresorption im Sammelrohr ansteigt (z.B. durch Hyperaldosteronismus)
 Diuretika
steigern die Harnmenge durch Erhöhung der Salzausscheidung. Sie hemmen
die Natriumresorption und steigern dadurch die Natriummenge im
Tubulussystem. Durch
die Verknüpfung von Natriumresorption und Kaliumsekretion in den
Sammelrohren kommt es hier bei Erhöhung der Natriumresorption zu einem Kaliumverlust in den Harn.
Diuretika
steigern die Harnmenge durch Erhöhung der Salzausscheidung. Sie hemmen
die Natriumresorption und steigern dadurch die Natriummenge im
Tubulussystem. Durch
die Verknüpfung von Natriumresorption und Kaliumsekretion in den
Sammelrohren kommt es hier bei Erhöhung der Natriumresorption zu einem Kaliumverlust in den Harn.
Der Kaliumverlust wird reduziert, wenn die Natriumresorption aus den Sammelrohren abnimmt. Das bewirken die Natriumkanalblocker Amilorid oder Triamteren. Diese blockieren (reversibel) epitheliale Natriumkanäle (ENaCs)
in der apikalen Membran spätdistaler Tubulus- und
Sammelrohrepithelzellen ( Abbildung), senken die Natriumresorption
im Sammelrohr und steigern (in Kombination mit anderen Diuretika, die an weiter proximal gelegenen Tubulusabschnitten - proximaler Tubulus, Henle-Schleife, frühdistaler Tubulus - angreifen) die Natriurese
bis auf 5% der glomerulär filtrierten Menge (normalerweise <1%). Sie werden also zur Verstärkung der
natriuretischen Wirkung anderer Diuretika verwendet; durch die Blockade apikaler Natriumkanäle reduzieren sie dabei das lumen-negative Potential der Sammelrohre und haben einen indirekt kaliumsparenden Effekt.
Abbildung), senken die Natriumresorption
im Sammelrohr und steigern (in Kombination mit anderen Diuretika, die an weiter proximal gelegenen Tubulusabschnitten - proximaler Tubulus, Henle-Schleife, frühdistaler Tubulus - angreifen) die Natriurese
bis auf 5% der glomerulär filtrierten Menge (normalerweise <1%). Sie werden also zur Verstärkung der
natriuretischen Wirkung anderer Diuretika verwendet; durch die Blockade apikaler Natriumkanäle reduzieren sie dabei das lumen-negative Potential der Sammelrohre und haben einen indirekt kaliumsparenden Effekt.
Lokale Einflüsse auf die Kaliumsekretion:
 Ein wesentlicher Faktor für die Kaliumausscheidung im distalen Nephron ist die Strömung
durch die Sammelrohre - je höher der Durchfluss (bei gegebener
Kaliumlast), desto mehr Kalium wird sezerniert. Aus diesem Grund wirkt
z.B. Volumenexpansion (Infusionen), osmotische Diurese (exzessives
Trinken) oder die Gabe bestimmter Diuretika (z.B. Furosemid)
kaliuretisch.
Ein wesentlicher Faktor für die Kaliumausscheidung im distalen Nephron ist die Strömung
durch die Sammelrohre - je höher der Durchfluss (bei gegebener
Kaliumlast), desto mehr Kalium wird sezerniert. Aus diesem Grund wirkt
z.B. Volumenexpansion (Infusionen), osmotische Diurese (exzessives
Trinken) oder die Gabe bestimmter Diuretika (z.B. Furosemid)
kaliuretisch.
 Eine weiterer Faktor ist das lumen-negative Potential im Sammelrohrsystem. Wird das Lumen stärker negativ - wie durch Zunahme des Eintritts von Na+ durch epitheliale Natriumkanäle (ENaCs) -, strömt mehr K+ durch apikale Kaliumkanäle aus der Epithelzelle (steigender elektrischer Gradient), die Kaliumausscheidung nimmt zu.
Eine weiterer Faktor ist das lumen-negative Potential im Sammelrohrsystem. Wird das Lumen stärker negativ - wie durch Zunahme des Eintritts von Na+ durch epitheliale Natriumkanäle (ENaCs) -, strömt mehr K+ durch apikale Kaliumkanäle aus der Epithelzelle (steigender elektrischer Gradient), die Kaliumausscheidung nimmt zu.
 Die luminale Chloridkonzentration
wirkt sich ebenfalls auf die Kaliumsekretion aus: Nimmt sie ab (z.B.
durch Substitution durch ein anderes Anion, wie Sulfat oder Bicarbonat), steigt die K+-Ausscheidung. Wahrscheinlich
wirkt dieser Effekt über den apikalen K/Cl-Cotransport (
Die luminale Chloridkonzentration
wirkt sich ebenfalls auf die Kaliumsekretion aus: Nimmt sie ab (z.B.
durch Substitution durch ein anderes Anion, wie Sulfat oder Bicarbonat), steigt die K+-Ausscheidung. Wahrscheinlich
wirkt dieser Effekt über den apikalen K/Cl-Cotransport ( Abbildung
oben), der durch niedriges luminales [Cl-] angeregt wird.
Abbildung
oben), der durch niedriges luminales [Cl-] angeregt wird.
 Zu den Kalium-Austauschmengen in den Nierenabschnitten s. dort
Zu den Kalium-Austauschmengen in den Nierenabschnitten s. dort
 Zur hormonellen Steuerung der Kaliumbilanz s. dort
Zur hormonellen Steuerung der Kaliumbilanz s. dort
Calcium
wird
glomerulär filtriert (etwa 10 Gramm pro Tag, entsprechend ~0,25 M/d) - nur der nicht an Protein gebundene
Anteil (~50%) steht für die Filtration zur Verfügung.

 Abbildung: Resorption von Ca++
Abbildung: Resorption von Ca++ im Nephron
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Rechts oben:
Resorptionsverlauf entlang der Tubulusabschnitte. PCT = proximaler
Tubulus, pars convoluta, resorbiert
~65% des filtrierten Calciums; PST = pars recta; TAL = dicker aufsteigender
Schenkel der Henle-Schleife, resorbiert
~25% des filtrierten Calciums; DCT = distaler Tubulus, pars convoluta, resorbiert
~8% des filtrierten Calciums; die Sammelrohre resorbieren ein weiteres Prozent, ~1% des filtrierten Calciums wird ausgeschieden.
Links oben:
Proximaler Tubulus. Die Calciumresorption erfolgt parazellulär durch
Transport mit parazellulär aufgenommenem Wasser (Lösungsmittelsog).
Links unten: Der Calciumsensor CaSR in der basolateralen Membran hemmt den Na/K/2Cl- Cotransporter, was die Diffusion von Kalium in das Lumen und damit das
lumenpositive Potential im aufsteigenden Schenkel der Henle-Schleife reduziert. Dadurch nimmt die treibende Kraft (+
→ -) für die parazelluläre Resorption von Ca++ ab (die "Nachfrage" steuert das "Angebot").
Rechts unten: Calciumionen werden im distalen Tubulus mittels epithelialer Ca++-Kanäle (TRPV5 und TRPV6) über die apikale Membran (passiv) aufgenommen, an Calbindin gebunden (gedämpfter [Ca++]-Anstieg)
und in Mitochondrien und endoplasmatischem Retikulum deponiert (nicht
dargestellt). Der Export erfolgt gegen einen großen elektrochemischen
Gradienten über Na/Ca-Austauscher (NCX1) einerseits, eine ATP-betriebene Calciumpumpe (PMCA1b) andererseits

 Abbildung)
Abbildung)
 zu ~65% vom proximalen Tubulus
(via parazelluläre Diffusion: Durch die Rückresorption von Flüssigkeit
steigt die Calciumkonzentration, es entsteht ein entsprechender
Konzentrationsgradient)
zu ~65% vom proximalen Tubulus
(via parazelluläre Diffusion: Durch die Rückresorption von Flüssigkeit
steigt die Calciumkonzentration, es entsteht ein entsprechender
Konzentrationsgradient)
 zu ~25% im aufsteigenden (dicken) Teil der Henle-Schleife - teils parazellulär,
angetrieben durch das lumen-positive Potential (Antrieb: Na/K/2Cl- Cotransporter und K+-Rückdiffusion in das Lumen), teils
aktiv-transzellulär unter Beteiligung des Calcium-sensing receptor CaSR in der basolateralen Membran der Tubuluszellen. Bindung von Ca++ an den CaSR reduziert die Ca++-Rückresorption
zu ~25% im aufsteigenden (dicken) Teil der Henle-Schleife - teils parazellulär,
angetrieben durch das lumen-positive Potential (Antrieb: Na/K/2Cl- Cotransporter und K+-Rückdiffusion in das Lumen), teils
aktiv-transzellulär unter Beteiligung des Calcium-sensing receptor CaSR in der basolateralen Membran der Tubuluszellen. Bindung von Ca++ an den CaSR reduziert die Ca++-Rückresorption
 Der Rest auf etwa 99% wird im distalen Tubulus (~8%) und Sammelrohr (~1%) resorbiert - apikal dem elektrochemischen Gradienten folgend über Calciumkanäle (transient receptor potential cation family subfamily V member 5 / 6, TRPV5 und TRPV6), basolateral über Na/Ca-Antiport (sodium-calcium exchanger NCX1) und eine Ca++-ATPase (PMCA1b, plasma membrane Clcium ATPase). Parathormon stimuliert in der basolateralen Membran des distalen Tubulus Ca++-Exportpumpen (PMCA) und einen Na+-Ca++-Austauscher (NCX), Calcium gelangt über die basolaterale Membran in Interstitium und Blut.
Der Rest auf etwa 99% wird im distalen Tubulus (~8%) und Sammelrohr (~1%) resorbiert - apikal dem elektrochemischen Gradienten folgend über Calciumkanäle (transient receptor potential cation family subfamily V member 5 / 6, TRPV5 und TRPV6), basolateral über Na/Ca-Antiport (sodium-calcium exchanger NCX1) und eine Ca++-ATPase (PMCA1b, plasma membrane Clcium ATPase). Parathormon stimuliert in der basolateralen Membran des distalen Tubulus Ca++-Exportpumpen (PMCA) und einen Na+-Ca++-Austauscher (NCX), Calcium gelangt über die basolaterale Membran in Interstitium und Blut.
Nur etwa 1% der filtrierten Calciummenge - entsprechend etwa 200 mg in 24 Stunden, im Darm wird die gleiche Menge netto aufgenommen - werden
im Harn ausgeschieden (~5 mM,  s. auch dort).
s. auch dort).
Anders verhält es sich bei Calcium-Überschuss
(übertriebene Zufuhr oder Immobilität → Knochenabbau): Dann wird Ca++
vermehrt ausgeschieden, was der Bildung von Nierensteinen Vorschub leisten kann (diese
können aus Calciumoxalat, Calciumphosphat, Ammonium-Magnesiumphosphat,
Harnsäure oder Zystin - oder Kombinationen davon - bestehen).
Die Resorption von Ca++ erfolgt sowohl para- als auch transzellulär, letztere Route wird durch Parathormon
(ab dem aufsteigenden Teil der Henle-Schleife) und andere Hormone
gefördert. Parathormon erhöht die Expression und
Öffnungswahrscheinlichkeit der TRPV5-Kanäle und verhindert deren
Endozytose; dadurch wird die Calciumresorption gesteigert. Auch
Calbindin und NCX1 werden durch PTH hinaufreguliert.
Ca++-Ionen dringen über ECaC (epithelial calcium channels) leicht
in die Tubuluszellen ein (starke Konzentrationsdifferenz plus
Membranpotential), müssen dann von Bindungsprotein (Calmodulin)
"abgefangen" werden, um den Konzentrationsgradienten für die
Ca++-Aufnahme aufrechtzuerhalten. Der Transfer von Ca++-Ionen über die basolaterale Membran der Tubuluszelle erfolgt direkt energieabhängig (Ca++-ATPase, die Zahl dieser Transporter steigt mit dem intrazellulären Calciumspiegel) und über Na+-Ca++-Austauscher.
 Dickwandiger Teil des aufsteigenden Schenkels der Henle-Schleife: Sogenannte Schleifendiuretika - z.B. Furosemid - hemmen den luminalen Na/K/2Cl-Symport (
Dickwandiger Teil des aufsteigenden Schenkels der Henle-Schleife: Sogenannte Schleifendiuretika - z.B. Furosemid - hemmen den luminalen Na/K/2Cl-Symport ( Abbildung oben).
Dadurch steigern sie die Natriumzufuhr an den distalen Tubulus und
können bis zu 25% des glomerulär filtrierten Natriums zur Ausscheidung
bringen (intensive Diurese / Natriurese). Furosemid verringert
das lumen-positive Potential und reduziert dadurch die Ca++-Resorption (Anwendung bei Hypercalcämie).
Abbildung oben).
Dadurch steigern sie die Natriumzufuhr an den distalen Tubulus und
können bis zu 25% des glomerulär filtrierten Natriums zur Ausscheidung
bringen (intensive Diurese / Natriurese). Furosemid verringert
das lumen-positive Potential und reduziert dadurch die Ca++-Resorption (Anwendung bei Hypercalcämie).
Distaler Tubulus: Ein Na/Cl-Symporter an der apikalen Membran fördert die Ca++-Aufnahme über TRPV5-Kanäle. Er ist thiazid-sensitiv; Thiazide (frühdistal wirkende Diuretika) werden daher eingesetzt, um den Calciumverlust bei Diuretikumbehandlung zu limitieren.
Magnesium
Magnesium liegt im Körper zum Großteil (99%) im Knochen gebunden (~54%) und in der intrazellulären Flüssigkeit (~45%) - vor allem in der Muskulatur - vor.
 Zur Kinetik des Körpermagnesiums s. dort.
Zur Kinetik des Körpermagnesiums s. dort.
Im Blutplasma - wo der Magnesiumspiegel auf 0,8-1,0 mM (1,8-2,2 mg/dl) reguliert wird - findet sich Magnesium zu 60-70% in ionisierter, nicht eiweißgebundener
Form, die - zusammen mit filtrierbaren Magnesium-Komplexsalzen
(<10%: Phosphat, Citrat, Oxalat) - glomerulär filtriert wird (~30% sind proteingebunden):
Magnesium im Blutplasma
(typisches Beispiel)
Nach Boron / Boulpaep: Concise Medical Physiology 2021 |
|
mg/dl
|
mM
|
% von gesamt
|
Ionisiertes Mg++
|
1,3
|
0,56
|
62
|
Filtrierbares Komplexsalz
|
0,1
|
0,06
|
7
|
Proteingebunden
(nicht filtrierbar)
|
0,6
|
0,28
|
31
|
Gesamt
|
2,0
|
0,90
|
100
|
Störungen des Magnesiumhaushaltes
betreffen meist abnorme Verluste (Malabsorption, Diarrhoe,
Nierenerkrankungen, Gabe von Diuretika).
Normalerweise gehen höchstens 5% der glomerulär filtrierten Magnesiummenge mit dem Harn verloren. Bei Magnesiummangel
sinkt der mit dem Harn ausgeschiedene Anteil auf 2% der glomerulär
filtrierten Menge oder wenige - bedingt durch Hinaufregulierung der
Resorptionsmechanismen im aufsteigenden Schenkel sowie im distalen
Tubulus.
Die renale Rückresorption erfolgt in verschiedenen Tubulusabschnitten unterschiedlich ( Abbildung), der größte Teil im dicken Teil des aufsteigenden Schenkels der Henle-Schleife (nicht, wie bei den meisten anderen Stoffen, im proximalen Tubulus, der nur etwa 15% der Rückresorption von Mg++ übernimmt):
Abbildung), der größte Teil im dicken Teil des aufsteigenden Schenkels der Henle-Schleife (nicht, wie bei den meisten anderen Stoffen, im proximalen Tubulus, der nur etwa 15% der Rückresorption von Mg++ übernimmt):

 Abbildung: Magnesium- Rückresorption in der Niere
Abbildung: Magnesium- Rückresorption in der Niere
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
~95% des glomerulär filtrierten Mg++ werden tubulär rückresorbiert:
 ~15% im proximalen Tubulus im Gefolge der Natrium- und Wasserresorption, welche Magnesium im Tubuluslumen anreichert, sowie durch solvent drag (mit Wasser)
~15% im proximalen Tubulus im Gefolge der Natrium- und Wasserresorption, welche Magnesium im Tubuluslumen anreichert, sowie durch solvent drag (mit Wasser)
 ~70% im dicken aufsteigenden Schenkel der Henle-Schleife - parazellulär, abhängig von der Natrium- und Kaliumresorption mittels NKCC2 (Na+-K+-2Cl−- cotransporter). Die Claudine 16 und 19 ermöglichen die Magnesium-Permeabilität.
~70% im dicken aufsteigenden Schenkel der Henle-Schleife - parazellulär, abhängig von der Natrium- und Kaliumresorption mittels NKCC2 (Na+-K+-2Cl−- cotransporter). Die Claudine 16 und 19 ermöglichen die Magnesium-Permeabilität.
 10% des filtrierten Magnesiums werden im distalen Tubulus rückresorbiert - reguliert durch hormonelle Einflüsse.
10% des filtrierten Magnesiums werden im distalen Tubulus rückresorbiert - reguliert durch hormonelle Einflüsse.
Barttin ist eine Chloridkanal- Untereinheit, unverzichtbar für die renale Chlorid-Rückresorption.
ClC-Kb, chloride channel Kb


 10-25% des filtrierten Magnesiums werden im proximalen Tubulus resorbiert - parazellulär via tight junctions -, erleichtert durch die Konzentrieriung von Mg++ durch die Resorption von Natrium (durch NHE3) und Wasser (durch Aquaporin 1).
10-25% des filtrierten Magnesiums werden im proximalen Tubulus resorbiert - parazellulär via tight junctions -, erleichtert durch die Konzentrieriung von Mg++ durch die Resorption von Natrium (durch NHE3) und Wasser (durch Aquaporin 1).
 Der
größte Teil (50-70%) des filtrierten Magnesiums wird vom dicken Teil des aufsteigenden
Schenkels der Henle-Schleife rückresorbiert (hauptsächlich
parazellulär: Claudin
16
Der
größte Teil (50-70%) des filtrierten Magnesiums wird vom dicken Teil des aufsteigenden
Schenkels der Henle-Schleife rückresorbiert (hauptsächlich
parazellulär: Claudin
16  , auch Paracellin genannt, ist ein Bestandteil von tight junctions und kontrolliert die parazelluläre Diffusion - Mutationen dieses Moleküls können zu Magnesiumverlust führen. Das lumen-positive Potential - bestimmt durch die Aktivität des Na/K/Cl-Cotransporters NKCC2 und die Sekretion von K+ an der apikalen Membran - treibt die Magnesiumionen blutwärts.
, auch Paracellin genannt, ist ein Bestandteil von tight junctions und kontrolliert die parazelluläre Diffusion - Mutationen dieses Moleküls können zu Magnesiumverlust führen. Das lumen-positive Potential - bestimmt durch die Aktivität des Na/K/Cl-Cotransporters NKCC2 und die Sekretion von K+ an der apikalen Membran - treibt die Magnesiumionen blutwärts.
Hormonelle Regulation:
Parathormon, Glucagon, Calcitonin, Vasopressin fördern die
Magnesiumresorption in den späteren Nephronabschnitten (aufsteigender
Schenkel, distaler Tubulus) über den cAMP-PKA-Weg
und / oder Erleichterung der parazellulären Aufnahme durch
Beeinflussung des NaCl-Transportes, elektrischer Potentiale, oder der
parazellulären Permeabilität.
 10% resorbiert das Sammelrohrsystem; diese komplexen Mechanismen werden durch
Insulin, Östrogene und Wachstumsfaktoren (Endothelialer Wachstumsfaktor EGF) rezeptorvermittelt (über Phosphoinositol-3-Kinase) positiv beeinflusst: Sie fördern die Expression von TRPM6 (transient receptor potential melastatin type 6), das die Mg++-Aufnahme
verstärkt.
10% resorbiert das Sammelrohrsystem; diese komplexen Mechanismen werden durch
Insulin, Östrogene und Wachstumsfaktoren (Endothelialer Wachstumsfaktor EGF) rezeptorvermittelt (über Phosphoinositol-3-Kinase) positiv beeinflusst: Sie fördern die Expression von TRPM6 (transient receptor potential melastatin type 6), das die Mg++-Aufnahme
verstärkt.
TRPM6 beeinflusst die Mg++-Aufnahme über den Spannungsgradienten, der sich aus der Diffusion von Kalium über ROMK (renal outer medulla K+ channel) und Kv1.1-Kaliumkanäle ergibt (voltage-gated K+ channel 1.1). An der basolateralen Membran passiert Mg++ möglicherweise unter dem Einfluss von CNNM2 (Cyclin M2), das als Magnesium-Sensor agiert.
Mg++ wandert abhängig vom Na+-Gradienten, der durch die Na+-K+-ATPase entsteht - deren Aktivität wiederum vom K+-Recycling via Kir4.1 abhängig ist.
 Etwa
5% des
glomerulär filtrierten Magnesiums werden im Harn ausgeschieden, abgestimmt auf die Netto-Resorption im Darm (ca. 100 mg/d).
Etwa
5% des
glomerulär filtrierten Magnesiums werden im Harn ausgeschieden, abgestimmt auf die Netto-Resorption im Darm (ca. 100 mg/d).
Phosphat
Phosphat
spielt eine entscheidende Rolle in zahlreichen Stoffwechselwegen
(Erbsubstanz, Energieträger, Knochen...). Es wird glomerulär frei
filtriert (~7 Gramm in 24 Stunden, rund das Zehnfache der gesamten in der
extrazellulären Flüssigkeit vorhandenen Menge). Das Filtrat enthält ~1 mM/l - bei pH=7,4 liegen 80% als HPO4-- (sekundäres Phosphat) und 20% als H2PO4-
(primäres Phosphat) vor. (Der pK-Wert des Phosphatpuffersystems beträgt
7,1 - bei diesem Wert liegen primäres und sekundäres Phosphat in
gleicher Konzentration - 50/50 - vor.)
Der Stoffwechsel von "anorganischem" - also nicht in organische Verbindungen wie z.B. Nukleinsäuren eingebautem - Phosphat (inorganic phosphate, Pi) hängt ab von gastrointestinalem System (Resorption), Niere
(Ausscheidung) und Knochen - wo der Großteil (ca. 85%) des
Körperphosphors (bei einer erwachsenen Person etwa 700 Gramm)
gespeichert ist. Im Blutplasma liegt Phosphat in ionisierter und
komplex gebundener Form vor, letztere teils filtrierbar, teils
proteingebunden:
Phosphat im Blutplasma
(typisches Beispiel)

Nach Boron / Boulpaep: Concise Medical Physiology 2021
|
|
mg/dl
|
mM
|
% von gesamt
|
Ionisiert
H2PO4- + HPO4-- |
2,1
|
0,7
|
50
|
Komplex gebunden, filtrierbar
|
1,5
|
0,5
|
40
|
Komplex gebunden, nicht filtrierbar
|
0,6
|
0,2
|
10
|
Gesamt
|
4,2

(2,5-4,5)
|
1,4

(0,8-1,5)
|
100
|
Etwa die Hälfte des Pi
ist ionisiert (bei physiologischem pH-Wert vorwiegend als primäres
Phosphat), 10-15% sind an Eiweiß gebunden (und damit glomerulär
normalerweise nicht filtrierbar). Die physiologische Spanne der Gesamtkonzentration an Pi im Blutplasma ist ziemlich groß (0,8-1,5 mM oder 2,5-4,5 mg/dl) - der (für die Verarbeitung im Nephron relevante) filtrierbare
Anteil liegt zwischen 0,7 und 1,3 mM. Das bedeutet die tägliche
glomeruläre Filtration von ungefähr 7000 mg Phosphat (der
extrazelluläre Phosphatpool im Körper beträgt etwa 500 mg). Ist das
Phosphatangebot gering, reabsorbiert die Niere die komplette filtrierte
Phosphatmenge, und es geht dem Körper kein Phosphat verloren (s.  Abbildung unten).
Abbildung unten).

 Abbildung: Wie die Niere mit Phosphat umgeht
Abbildung: Wie die Niere mit Phosphat umgeht
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Links:
Phosphatresorption entlang einer proximalen Tubuluszelle. NaPi-IIa,
NaPi-IIc und PiT-2 sind Na/Phosphat- Cotransporter der apikalen
(luminalen) Membran der Epithelzelle.
Rechts: Anteile rückresorbierten und ausgeschiedenen Phosphats (glomeruläre Filtration = 100%). Zahlen gerundet, bezogen auf normale Kost; bei phosphatarmer Diät werden fast 100% des filtrierten Phosphats tubulär zurückgewonnen
 80-95% des filtrierten Phosphats werden im
proximalen Tubulus ertlang seines elektrochemischen Gradienten transzellulär rückresorbiert - mittels eines (durch Parathormon hemmbaren) apikalen Na/P-Symports. Davon gibt es mindestens drei Typen (
80-95% des filtrierten Phosphats werden im
proximalen Tubulus ertlang seines elektrochemischen Gradienten transzellulär rückresorbiert - mittels eines (durch Parathormon hemmbaren) apikalen Na/P-Symports. Davon gibt es mindestens drei Typen ( Abbildung): NaPi-IIa, NaPi-IIc und PiT-2 (Pi = inorganic phosphate, "anorganisches" Phosphat). Basolateral verlässt Phosphat die Zelle über einen noch unklaren Mechanismus. Das distale Tubulussystem trägt kaum zum Phosphataustausch bei.
Abbildung): NaPi-IIa, NaPi-IIc und PiT-2 (Pi = inorganic phosphate, "anorganisches" Phosphat). Basolateral verlässt Phosphat die Zelle über einen noch unklaren Mechanismus. Das distale Tubulussystem trägt kaum zum Phosphataustausch bei.
Je
höher das filtrierte Phosphatangebot ist, desto mehr wird auch im Harn
ausgeschieden - Phosphataufnahme (Phosphat findet sich in pflanzlicher
wie tierischer Kost in
ausreichendem Maß) und Abgabe (bei Überschreiten des tubulären Maximums
für die Rückresorption) sind normalerweise ausbalanciert.
Der proximale Tubulus resorbiert Phosphat über einen Na+/Pi-Symporter
|
Phosphor
ist ein unentbehrliches Element, das in der Umwelt nur sehr begrenzt
verfügbar ist; daher geht der Organismus auch sorgsam damit um. Renal
ausgeschieden wird Phosphor nur dann, wenn die Phosphatkonzentration im
Plasma eher hoch ist (alimentäres Angebot, Knochenabbau); dann erscheint ein Teil des glomerulär filtrierten Phosphors im Harn ( Abbildung).
Abbildung).

 Abbildung: Phosphat-"Titrationskurven"
Abbildung: Phosphat-"Titrationskurven"
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Mit steigender
Phosphatkonzentration im Plasma (Abszisse) steigt (linear) die Menge an
filtriertem (ionisierten + komplex an kleine Moleküle gebundenen)
Phosphats (gelbe Linie). Die Rückresorptionsleistung steigt, bis das
tubuläre Maximum erreicht ist (rote Kurve). Ausgeschieden wird die
Differenz, diese ist bei niedrigem Phosphatangebot praktisch null -
alles Phosphat wird rückresorbiert (grüne Kurve).

Ähnlich wie für Glukose besteht auch für die Rückresorption von Phosphat ein tubuläres Maximum. Allerdings ist dieses (ungleich der Glukose) bei
einem normalen Plasmaspiegel schon erreicht, und die Niere scheidet
meist etwas Phosphat aus. Steigt der Phosphatspiegel im Blut über den
Normalwert an, nimmt die Phosphatausscheidung linear mit der
Konzentration im Plasma zu (die gelbe und grüne Linie in der  Abbildung sind um den Betrag des tubulären Maximums für Phosphat
parallel zueinander verschoben).
Abbildung sind um den Betrag des tubulären Maximums für Phosphat
parallel zueinander verschoben).
 Der wichtigste Einfluss auf die Phosphatbilanz der Niere ist das Phosphatangebot: Erhöhter
Plasma-Phosphatspiegel steigert
die renale Ausscheidung von Phosphat, während Phosphatmangel die tubulären
Phosphattransporter hinaufreguliert und die Ausscheidung minimiert.
Der wichtigste Einfluss auf die Phosphatbilanz der Niere ist das Phosphatangebot: Erhöhter
Plasma-Phosphatspiegel steigert
die renale Ausscheidung von Phosphat, während Phosphatmangel die tubulären
Phosphattransporter hinaufreguliert und die Ausscheidung minimiert.


Abbildung: Wirkungen des Parathormons
Nach Martin TJ, Parathyroid Hormone-Related Protein,
Its Regulation of Cartilage and Bone Development, and Role in Treating
Bone Diseases. Physiol Rev 2016; 96: 831-71
Parathormon
aus den Epithelkörperchen der Schilddrüse fördert die Calciumresorption in Knochen und Nieren. In der Niere regt Parathormon die Phosphatausscheidung an. Es aktiviert auch Vitamin D3,
dadurch wird Calcium und Phosphat vermehrt im Darm aufgenommen

Ferner hängt die Bilanz von
hormonellen Faktoren - vor allem Parathormon (PTH,  Abbildung) - und vom Säure-Basen-Gleichgewicht ab.
Abbildung) - und vom Säure-Basen-Gleichgewicht ab.
 Die Phosphatausscheidung steigt durch
Die Phosphatausscheidung steigt durch
 Parathormon: PTH bindet an PTH1-Rezeptoren (rasche Wirkung: G-Protein-gekoppelter Rezeptor; Gαs aktiviert Adenylatzyklase: cAMP → Proteinkinase A; Gαq aktiviert Phospholipase C → Proteinkinase C). PKA und PKC bewirken Endozytose und lysosomalen Abbau - und damit Herunterregulierung - des Na/P-Cotransporters an der apikalen Membran
der Tubuluszellen. Damit wird weniger Phosphat resorbiert (und mehr ausgeschieden)
Parathormon: PTH bindet an PTH1-Rezeptoren (rasche Wirkung: G-Protein-gekoppelter Rezeptor; Gαs aktiviert Adenylatzyklase: cAMP → Proteinkinase A; Gαq aktiviert Phospholipase C → Proteinkinase C). PKA und PKC bewirken Endozytose und lysosomalen Abbau - und damit Herunterregulierung - des Na/P-Cotransporters an der apikalen Membran
der Tubuluszellen. Damit wird weniger Phosphat resorbiert (und mehr ausgeschieden)
 hohes Angebot mit der Nahrung (über steigenden
Phosphatspiegel)
hohes Angebot mit der Nahrung (über steigenden
Phosphatspiegel)
 Calcitonin
Calcitonin
 Azidose (Phosphatpuffer reduzieren den pH-Abfall im Harn)
Azidose (Phosphatpuffer reduzieren den pH-Abfall im Harn)
 Parathormon erhöht die Phosphatresorption
in Darm und Knochen und senkt sie gleichzeitig in den Nieren (die Ausscheidung in den Harn steigt an). Diese beiden Effekte balancieren sich normalerweise aus, sodass Parathormon den Phosphatspiegel im Blut kaum beeinflusst.
Parathormon erhöht die Phosphatresorption
in Darm und Knochen und senkt sie gleichzeitig in den Nieren (die Ausscheidung in den Harn steigt an). Diese beiden Effekte balancieren sich normalerweise aus, sodass Parathormon den Phosphatspiegel im Blut kaum beeinflusst.
Parathormon reduziert die Resorption (steigert die Ausscheidung) von Phosphat in der Niere
|
Das Gleichgewicht wird u.a. zugunsten der Phosphatresorption beeinflusst durch Wachstum, Phosphatmangel, Vit. D, Alkalose.
Harnstoff: Stickstoff- und Funktionsträger
 Harnstoff (urea) stammt aus dem Eiweißabbau in der Leber; es stellt das führende stickstoffhältige Ausscheidungsprodukt aus dem Proteinstoffwechsel dar. Harnstoff wird glomerulär frei filtriert, etwa die Hälfte davon
wird im proximalen Tubulus (passiv) rückresorbiert (
Harnstoff (urea) stammt aus dem Eiweißabbau in der Leber; es stellt das führende stickstoffhältige Ausscheidungsprodukt aus dem Proteinstoffwechsel dar. Harnstoff wird glomerulär frei filtriert, etwa die Hälfte davon
wird im proximalen Tubulus (passiv) rückresorbiert ( Abbildung).
Abbildung).
 Abbildung: Wie die Niere mit Harnstoff umgeht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Abbildung: Wie die Niere mit Harnstoff umgeht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Die Zahlen gelten für juxtemedulläre
Neurone (links), die für die osmotische Regulation im Nierenmark
entscheidend sind. Die Henle-Schleifen übernehmen die Sekretion von
Harnstoff aus dem Interstitium des Nierenmarks in die Tubuli, sodass im
frühdistalen Tubulussystem die Harnstoffmenge größer als im primären
Filtrat des Nephrons sein kann.
Anschließend wird mehr als die Hälfte
der ursprünglich filtrierten Menge nochmals resorbiert (und ist im Mark
osmotisch aktiv), weniger als die Hälfte (~40%) mit dem Harn ausgeschieden

Im
Nierenmark wirkt Harnstoff wesentlich am
osmotischen Multiplikationsmechanismus mit.
 Die oberen (rindennahen) Teile der Sammelrohre sind für Harnstoff undurchlässig, daher wird Harnstoff im Sammelrohr konzentriert,
wenn Wasser in das Mark diffundiert (ermöglicht durch Aquaporine, die
durch Vasopressinwirkung in die Epithelzellen eingelagert werden).
Harnstofftransporter (UT: Urea transporter)
Die oberen (rindennahen) Teile der Sammelrohre sind für Harnstoff undurchlässig, daher wird Harnstoff im Sammelrohr konzentriert,
wenn Wasser in das Mark diffundiert (ermöglicht durch Aquaporine, die
durch Vasopressinwirkung in die Epithelzellen eingelagert werden).
Harnstofftransporter (UT: Urea transporter) werden
in mehreren Varianten exprimiert. Der Mensch verfügt über UT-A
Transporter (in epithelialen Zellen) und UT-B Transporter (in
Gefäßendothelzellen, Erythrozytenmembranen und an der
Blut-Hirn-Schranke). Es gibt mehrere Subtypen, in der Niere vor allem
UT-A1, UT-A2 und UT-A3:

UT-A1 in der apikalen Membran von Sammelrohrzellen wird
durch
Vasopressin aktiviert und resorbiert
~70% der filtrierten
Harnstoffmenge

UT-A2 transportiert Harnstoff über die apikale Membran
in das Lumen der absteigenden Henle-Schleife

UT-A3 bringt Harnstoff
aus dem inneren Sammelrohr in das Interstitium. Es wird
durch
Vasopressin aktiviert
Zwar scheidet die Niere Harnstoff aus, die Transporter sind aber
notwendig, um Harnstoff zum Zweck der Harnkonzentrierung (und damit,
falls notwendig, sparsamen Umgangs mit Wasser) im Nierenmark anreichern
zu können.
Transport von Harnstoff entlang der verschiedenen Nephronabschnitte (Abbildungen):
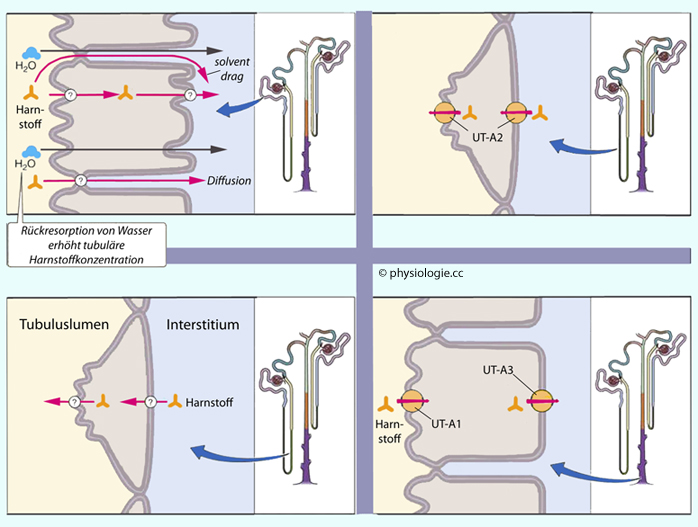
 Abbildung: Harnstofftransport über Abschnitte des Nephron
Abbildung: Harnstofftransport über Abschnitte des Nephron
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Links oben:
Proximaler Tubulus. Harnstoff wird parazellulär durch Diffusion und
Lösungsmittelsog rückresorbiert, transzellulär über unbekannte
Transporter (insgesamt ~50% der glomerulär filtrierten Menge)
Rechts oben: Absteigender Schenkel der Henle-Schleife. UT-A2 ermöglicht transzellulären Transport von Harnstoff Richtung Tubuluslumen
Links unten: Dünner aufsteigender Schenkel der Henle-Schleife. Harnstoff wandert Richtung Tubuluslumen (Transporter unklar)
Rechts unten: Medulläres Sammelrohr. Resorption von Harnstoff über UT-A1 (apikal) und UT-A3 (basolateral)


Bei geringer glomerulärer
Filtration (und Harnproduktion) nimmt auch die Ausscheidung an
Harnstoff ab, die Harnstoffwerte im Blut steigen an
(Urämie).
Harnsäure (Urate)
 Harnsäure bzw. ihre Salze (Urate) sind Abbauprodukte von Purinen. Ihre Konzentration im Blutplasma beträgt 0,2-0,4, im glomeruläre Filtrat ≤0,25 mM/l. Urat wird
Harnsäure bzw. ihre Salze (Urate) sind Abbauprodukte von Purinen. Ihre Konzentration im Blutplasma beträgt 0,2-0,4, im glomeruläre Filtrat ≤0,25 mM/l. Urat wird
 zu 99% rückresorbiert, dann
zu 99% rückresorbiert, dann
 zu ~50% (der filtrierten Menge) sezerniert und
zu ~50% (der filtrierten Menge) sezerniert und
 wieder zu ~40%
resorbiert (alles im proximalen Tubulus).
wieder zu ~40%
resorbiert (alles im proximalen Tubulus).

 Abbildung: Wie die Niere mit Harnsäure umgeht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Abbildung: Wie die Niere mit Harnsäure umgeht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Links: Gelbe Pfeile: Rückresorption; roter Pfeil: Sekretion
Rechts: Mechanismen der Urat-Rückresorption (rote Pfeile)
Ganz oben: Parazelluläre Diffusion, darunter:
(1) Urataustausch gegen OH-- oder HCO3- gekoppelt mit Na+-H+-Austausch
(tertiär und sekundär aktiver Transport)
(2) Urataustausch gegen
Monocaroboxylate wie Lactat oder ß-OH-Butyrat oder Dicarboxylate
(tertiär aktiver Transport)
(3) Urataustausch gegen organische Anionen
(tertiär aktiver Transport).
Aus der Tubuluszelle gelangt Urat über die
basolaterale Membran auf die Blutseite (Austausch gegen ein Anion)

Dabei sind mehrere Carrier im
Spiel, die Na+-unabhängig sind und Urat gegen andere Anionen
(wie Bicarbonat, OH-) sowie schwache Säuren (Monocarboxylate, wie Lactat) austauschen ( Abbildung). Im frühen proximalen Tubulus überwiegt der
transzelluläre Mechanismus (Aufnahme über die luminale Membran, s. oben). Der
parazelluläre Weg folgt dem Urat-Konzentrationsgradienten.
Abbildung). Im frühen proximalen Tubulus überwiegt der
transzelluläre Mechanismus (Aufnahme über die luminale Membran, s. oben). Der
parazelluläre Weg folgt dem Urat-Konzentrationsgradienten.
Die Ausscheidungsrate beträgt
schließlich ≤10% der filtrierten Menge. Als Referenzbereich für die Harnsäureclearance gilt 6–12 ml/min.
 Harnsäure (uric acid)
Serum
Männer 3,4-7,0 ng/dl (200-410 µM)
Frauen 2,4-5,7 ng/dl (140-340 µM), postmenopausal steigend
Ausscheidung im Harn: 0,2-1,5 g/24 h
Harnsäure (uric acid)
Serum
Männer 3,4-7,0 ng/dl (200-410 µM)
Frauen 2,4-5,7 ng/dl (140-340 µM), postmenopausal steigend
Ausscheidung im Harn: 0,2-1,5 g/24 h
Der Uratpool
im Körper eines erwachsenen Menschen wird auf ~1200 mg geschätzt; der
Tagesumsatz auf ~700 mg/d, die endogene Purin-Neusynthese auf ~400 mg/d.
Hohe Konzentrationen an Calciumoxalat im Harn bedingt Harnsteinanfälligkeit
|
Hier noch einmal eine Übersicht über die renale Filtration, Rückresorption und Sekretion einiger Ionen und organischer Stoffe:
| Intrarenale Bewegung einiger Schlüsselsubstanzen |
|
Filtration
% des glomerulären Angebots
|
Rückresorption
% des glomerulären Angebots
|
Sekretion
% des glomerulären Angebots
|
Glucose
|
100%
|
100%
(außer bei Überschreitung des tubulären Maximums)
|
-
|
Natrium
|
100%
|
>99%
(abhängig von Salzstatus und Aldosteron-
spiegel)
|
-
|
Kalium
|
100%
|
2-150%
(abhängig von Kaliumstatus und Aldosteron-
spiegel)
|
20-180%
|
Kreatinin
|
100%
|
-
|
minimal
|
Calcium
|
frei nur für Ca++
protein-
gebundenes Calcium wird nicht filtriert
|
abhängig von Parathormon- und Calcitriol-
Konzentration
|
-
|
Albumin
|
~0,03%
|
rezeptor-
vermittelte Endozytose
|
-
|
Inulin
(körperfrend)
|
frei
|
-
|
-
|
PAH
(körperfremd)
|
frei
|
-
|
fast 100%
des tubulär-
kapillären Angebots
|

Viele Medikamente
werden aus dem Blut direkt in die Tubuli sezerniert - z.B.
Penizillin.
(
Antibiotika werden auch über den Schweiß ausgeschieden - dieser
Umstand kann zur Bildung von Resistenzen beitragen.)
 Stoffe wie
Jod- oder Aminohippuran,
Para-Amino-Hippursäure (PAH -
Stoffe wie
Jod- oder Aminohippuran,
Para-Amino-Hippursäure (PAH -  Abbildung) werden aus fast der
gesamten
Plasmamenge, das durch die Niere strömt, entfernt - filtriert (zu
>80%) und vom proximalen Tubulus sezerniert (~90%, falls die
Konzentration nicht zu hoch und das tubuläre Maximum nicht
überschritten ist).
Abbildung) werden aus fast der
gesamten
Plasmamenge, das durch die Niere strömt, entfernt - filtriert (zu
>80%) und vom proximalen Tubulus sezerniert (~90%, falls die
Konzentration nicht zu hoch und das tubuläre Maximum nicht
überschritten ist).
Die PAH-Clearance entspricht annähernd dem renalen
Plasmafluss (RPF), aus diesem
kann weiters - unter Berücksichtigung des Hämatokrit - die
Nierendurchblutung
errechnet werden (z.B. RPF = 600 ml/min, Hkt = 0.4 → renale
Perfusion 1000 ml/min, errechnet aus RPF/(1-Hkt)).

 Der proximale Tubulus ist aufgrund seiner Enzymausstattung voll auf oxidative Energiegewinnung
ausgelegt - der glykolytische Weg ist ihm verschlossen. Das bedeutet,
dass ausreichende Blut- und Sauerstoffzufuhr gegeben sein
muss, sonst besteht die Gefahr eines akuten Nierenversagens.
Der proximale Tubulus ist aufgrund seiner Enzymausstattung voll auf oxidative Energiegewinnung
ausgelegt - der glykolytische Weg ist ihm verschlossen. Das bedeutet,
dass ausreichende Blut- und Sauerstoffzufuhr gegeben sein
muss, sonst besteht die Gefahr eines akuten Nierenversagens.
Schädigungen des proximalen Tubulusabschnitts äußern sich in
erhöhter
Ausscheidung von Stoffen, die hier normalerweise resorbiert werden:
Glucose, Phosphat, Aminosäuren und auch Protein. Die Säureausscheidung
ist dann ebenfalls gestört, dies führt zu einer Azidose. Diese
Kombination (Fanconi-Syndrom  ) kann durch vererbte Stoffwechseldefekte,
Sauerstoffmangel oder Vergiftungen auftreten (erniedrigtes ATP in den
Tubuluszellen .. blockierte Na-K-Pumpe).
) kann durch vererbte Stoffwechseldefekte,
Sauerstoffmangel oder Vergiftungen auftreten (erniedrigtes ATP in den
Tubuluszellen .. blockierte Na-K-Pumpe).
 Anstieg der extrazellulären Harnsäurekonzentration kann zur Präzipitation z.B. in Gelenken führen (Gicht). Urikosurika erhöhen
den ausgeschiedenen Uratanteil, der
sogar über der filtrierten Menge liegen kann (hohe Sekretion). Sie
wirken im Allgemeinen, indem sie den URAT1-Transporter hemmen.
Anstieg der extrazellulären Harnsäurekonzentration kann zur Präzipitation z.B. in Gelenken führen (Gicht). Urikosurika erhöhen
den ausgeschiedenen Uratanteil, der
sogar über der filtrierten Menge liegen kann (hohe Sekretion). Sie
wirken im Allgemeinen, indem sie den URAT1-Transporter hemmen.
Zystinurie: Da die di-basische
Aminosäure Zystin beim pH des Harns schlecht löslich ist, können bei
einem Transporterdefekt im proximalen Tubulus (die Folge ist mangelnde
Rückresorption und daher ~20-fach gesteigerte Ausscheidung von Zystin)
bei einer Zystinkonzentration von über 300 mg/l Harnsteine auftreten (betrifft jeden zweiten Zystinurie-Patienten).


 Der proximale Tubulus resorbiert 60-80% der glomerulär filtrierten Flüssigkeitsmenge; er ist reich an Mitochondrien.
20-40% des filtrierten Volumens betritt die Henle-Schleife,
bestehend aus einem dünnwandigen absteigenden (wasserdurchlässigen) und einem dickwandigen
aufsteigenden Schenkel (Resorption von 5-10% der filtrierten
Flüssigkeitsmenge, Aufbau eines osmotischen Gradienten). Im distalen Tubulus / Sammelrohr
erfolgt eine Feineinstellung von Stoffmengen und Osmolarität (Vasopressin: Wasserresorption,
Aldosteron: Natriumresorption, natriuretische Peptide: Natriumausscheidung).
Tubuluszellen bauen auch Peptidhormone (Angiotensine, Glukagon,
Bradykinin) ab
Der proximale Tubulus resorbiert 60-80% der glomerulär filtrierten Flüssigkeitsmenge; er ist reich an Mitochondrien.
20-40% des filtrierten Volumens betritt die Henle-Schleife,
bestehend aus einem dünnwandigen absteigenden (wasserdurchlässigen) und einem dickwandigen
aufsteigenden Schenkel (Resorption von 5-10% der filtrierten
Flüssigkeitsmenge, Aufbau eines osmotischen Gradienten). Im distalen Tubulus / Sammelrohr
erfolgt eine Feineinstellung von Stoffmengen und Osmolarität (Vasopressin: Wasserresorption,
Aldosteron: Natriumresorption, natriuretische Peptide: Natriumausscheidung).
Tubuluszellen bauen auch Peptidhormone (Angiotensine, Glukagon,
Bradykinin) ab
 Tubulusepithelzellen sind reichlich mit
Mikrovilli ausgestattet (große Resorptionsoberfläche), auch die basolaterale Membran verfügt
über zahlreiche Einstülpungen. Der Natriumgradient treibt im proximalen Tubulus den Symport
von Glucose und Aminosäuren an, auch die Sekretion von H+. Basolaterale Na+-Anreicherung saugt Wasser
osmotisch aus dem Tubulus, sowohl trans- (Aquaporin)
als auch parazellulär (tight junctions). Diese Strömung nimmt gelöste
Teilchen mit (solvent drag), erhöht den hydrostatischen Druck.
Die Rückresorption erfolgt isoosmotisch, die proximalen Tubuli sind mit Aquaporinen
ausgestattet Tubulusepithelzellen sind reichlich mit
Mikrovilli ausgestattet (große Resorptionsoberfläche), auch die basolaterale Membran verfügt
über zahlreiche Einstülpungen. Der Natriumgradient treibt im proximalen Tubulus den Symport
von Glucose und Aminosäuren an, auch die Sekretion von H+. Basolaterale Na+-Anreicherung saugt Wasser
osmotisch aus dem Tubulus, sowohl trans- (Aquaporin)
als auch parazellulär (tight junctions). Diese Strömung nimmt gelöste
Teilchen mit (solvent drag), erhöht den hydrostatischen Druck.
Die Rückresorption erfolgt isoosmotisch, die proximalen Tubuli sind mit Aquaporinen
ausgestattet
 Der absteigende Schenkel der Henle-Schleife ist für Wasser
und Harnstoff durchgängig - sowohl parazellulär als auch transzellulär (Aquaporin 1). Der dicke aufsteigende Schenkel ist nicht wasserdurchlässig, aber intensiv mit Ionenpumpen ausgestattet (hohe Zahl an Na/K-ATPasen, viele Mitochondrien).
Etwa 75% der gelösten Stoffe (Natrium, Chlorid, Bicarbonat u.a.) werden
in das Nierenmark befördert (Erhaltung hoher Osmolarität), der Inhalt des Tubulus gelangt
hypoosmotisch (~50 mOsm) in die Rindenzone Der absteigende Schenkel der Henle-Schleife ist für Wasser
und Harnstoff durchgängig - sowohl parazellulär als auch transzellulär (Aquaporin 1). Der dicke aufsteigende Schenkel ist nicht wasserdurchlässig, aber intensiv mit Ionenpumpen ausgestattet (hohe Zahl an Na/K-ATPasen, viele Mitochondrien).
Etwa 75% der gelösten Stoffe (Natrium, Chlorid, Bicarbonat u.a.) werden
in das Nierenmark befördert (Erhaltung hoher Osmolarität), der Inhalt des Tubulus gelangt
hypoosmotisch (~50 mOsm) in die Rindenzone
 Distaler
Tubulus und Sammelrohr übernehmen die - teils hormongesteuerte -
"Feinabstimmung" des renalen Stoffmanagements. Hauptzellen resorbieren
Kochsalz und sezernieren Kalium (lumen-negatives Potential),
Zwischenzellen sezernieren Protonen und resorbieren Kalium und
Bicarbonat. Die Wand der Sammelrohre ist genuin wasserundurchlässig,
Einlagerung von Aquaporinen (über Wirkung von Vasopressin) ermöglicht
die Resorption von Wasser (bis zu ~20 l/d) Distaler
Tubulus und Sammelrohr übernehmen die - teils hormongesteuerte -
"Feinabstimmung" des renalen Stoffmanagements. Hauptzellen resorbieren
Kochsalz und sezernieren Kalium (lumen-negatives Potential),
Zwischenzellen sezernieren Protonen und resorbieren Kalium und
Bicarbonat. Die Wand der Sammelrohre ist genuin wasserundurchlässig,
Einlagerung von Aquaporinen (über Wirkung von Vasopressin) ermöglicht
die Resorption von Wasser (bis zu ~20 l/d)
 Nichtflüchtige pH-wirksame Substanzen werden über die Nieren ausgeschieden - bei üblicher Ernährung 50-100 mM/d saure Valenzen (titrierbare"
Säure im Harn: Phosphate aus Nukleinsäuren, Sulfate aus
schwefelhaltigen Aminosäuren, Urate aus Nukleotiden, Oxalate aus
Stoffwechsel / Ernährung, Lactate aus Glucoseabbau, Ketonkörper aus
Fettsäuren), bei vegetarischer Kost oder metabolischer Alkalose basische Valenzen. Das Phosphatsystem puffert den Harn, Bicarbonat ist im Harn meist nicht vorhanden. Der proximale Tubulus gewinnt mittels Na/H-Antiport ~90% des filtrierten Bicarbonats zurück, der Rest wird distal resorbiert. Die Nieren bilden üblicherweise ~70 mM/d Bicarbonatpuffer neu, ohne Carboanhydrasewirkung sinkt die H+-Ausscheidung (Azidose). Werden Säuren abgepuffert, entsteht aus Bicarbonat CO2 (wird abgeatmet) Nichtflüchtige pH-wirksame Substanzen werden über die Nieren ausgeschieden - bei üblicher Ernährung 50-100 mM/d saure Valenzen (titrierbare"
Säure im Harn: Phosphate aus Nukleinsäuren, Sulfate aus
schwefelhaltigen Aminosäuren, Urate aus Nukleotiden, Oxalate aus
Stoffwechsel / Ernährung, Lactate aus Glucoseabbau, Ketonkörper aus
Fettsäuren), bei vegetarischer Kost oder metabolischer Alkalose basische Valenzen. Das Phosphatsystem puffert den Harn, Bicarbonat ist im Harn meist nicht vorhanden. Der proximale Tubulus gewinnt mittels Na/H-Antiport ~90% des filtrierten Bicarbonats zurück, der Rest wird distal resorbiert. Die Nieren bilden üblicherweise ~70 mM/d Bicarbonatpuffer neu, ohne Carboanhydrasewirkung sinkt die H+-Ausscheidung (Azidose). Werden Säuren abgepuffert, entsteht aus Bicarbonat CO2 (wird abgeatmet)
 Durch Ausscheidung von Ammoniumionen können saure Valenzen aus dem Körper entfernt werden (NH3
ist fettlöslich, Ammonium bleibt im Tubulus). Quelle des dazu
benötigten Stickstoffs ist Glutamin (1/5 des extrazellulären
Aminosäurepools). Der proximale Tubulus gewinnt Glutamin aus Filtrat
und Blut und verwandelt es in Ammonium und α-Ketoglutarat (aus dem
Bicarbonat gewonnen wird: nur ausgeschiedenes Ammonium entlastet den
Pufferstatus). Die Ammoniumsynthese kann fallweise 10-fach
gesteigert werden. Bei der
Metabolisierung von Glutamin fällt Glucose an (die Nieren bestreiten ~20%, im Hungerzustand, bei metabolischer Azidose oder Hypokaliämie bis zu 45% der Glucoseversorgung des Körpers) Durch Ausscheidung von Ammoniumionen können saure Valenzen aus dem Körper entfernt werden (NH3
ist fettlöslich, Ammonium bleibt im Tubulus). Quelle des dazu
benötigten Stickstoffs ist Glutamin (1/5 des extrazellulären
Aminosäurepools). Der proximale Tubulus gewinnt Glutamin aus Filtrat
und Blut und verwandelt es in Ammonium und α-Ketoglutarat (aus dem
Bicarbonat gewonnen wird: nur ausgeschiedenes Ammonium entlastet den
Pufferstatus). Die Ammoniumsynthese kann fallweise 10-fach
gesteigert werden. Bei der
Metabolisierung von Glutamin fällt Glucose an (die Nieren bestreiten ~20%, im Hungerzustand, bei metabolischer Azidose oder Hypokaliämie bis zu 45% der Glucoseversorgung des Körpers)
 Transporter haben eine begrenzte Förderkapazität (tubuläres Maximum) - wird diese überschritten, wird ein Teil der betreffenden Substanz mit dem Harn ausgeschieden. Der Nüchtern-Blutzuckerspiegel beträgt ~90 mg/dl, die Schwellenkonzentration ~200 mg/dl (~240 mg/min Glucose filtriert,
ab diesen Werten gelangt Glucose in den Harn: Glukosurie),
bei 300-400 mg/dl sind sämtliche Tubuli am Transportmaximum für Glucose
angelangt, bei weiterer Steigerung nimmt die Glucoseausscheidung linear
mit dem Blutzuckerspiegel zu. Aminosäuren haben niedrige tubuläre Transportmaxima, bei erhöhten Blutwerten kommt es zu partieller
Ausscheidung (Stabilisierung der Plasmawerte) Transporter haben eine begrenzte Förderkapazität (tubuläres Maximum) - wird diese überschritten, wird ein Teil der betreffenden Substanz mit dem Harn ausgeschieden. Der Nüchtern-Blutzuckerspiegel beträgt ~90 mg/dl, die Schwellenkonzentration ~200 mg/dl (~240 mg/min Glucose filtriert,
ab diesen Werten gelangt Glucose in den Harn: Glukosurie),
bei 300-400 mg/dl sind sämtliche Tubuli am Transportmaximum für Glucose
angelangt, bei weiterer Steigerung nimmt die Glucoseausscheidung linear
mit dem Blutzuckerspiegel zu. Aminosäuren haben niedrige tubuläre Transportmaxima, bei erhöhten Blutwerten kommt es zu partieller
Ausscheidung (Stabilisierung der Plasmawerte)
 Ca++
wird zu 65-70% im proximalen Tubulus (parazellulär) resorbiert, zu 25%
im aufsteigenden Teil der Henle-Schleife (parazellulär und
transzellulär unter Kontrolle von Parathormon), der Rest auf 99,5% im
distalen Tubulus und Sammelrohr. Ca++-Ionen
dringen über epitheliale Calciumkanäle leicht in Tubuluszellen
ein (Konzentrationsdifferenz plus Membranpotential), binden an
Calmodulin (Aufrechterhaltung des Konzentrationsgradienten) und werden aktiv über die basolaterale Membran der Tubuluszelle
transportiert (Na/Ca-Antiport und Ca-ATPase). ~200 mg/d werden im Harn ausgeschieden, bei Immobilität (→ Knochenabbau) nimmt die Ca++-Ausscheidung zu Ca++
wird zu 65-70% im proximalen Tubulus (parazellulär) resorbiert, zu 25%
im aufsteigenden Teil der Henle-Schleife (parazellulär und
transzellulär unter Kontrolle von Parathormon), der Rest auf 99,5% im
distalen Tubulus und Sammelrohr. Ca++-Ionen
dringen über epitheliale Calciumkanäle leicht in Tubuluszellen
ein (Konzentrationsdifferenz plus Membranpotential), binden an
Calmodulin (Aufrechterhaltung des Konzentrationsgradienten) und werden aktiv über die basolaterale Membran der Tubuluszelle
transportiert (Na/Ca-Antiport und Ca-ATPase). ~200 mg/d werden im Harn ausgeschieden, bei Immobilität (→ Knochenabbau) nimmt die Ca++-Ausscheidung zu
 Filtriertes Mg++
wird zu 50-70% vom dicken Teil des aufsteigenden Schenkels der
Henle-Schleife rückresorbiert (Claudin kontrolliert die parazelluläre
Diffusion), 10-25% im proximalen Tubulus, 10% im Sammelrohr, angeregt
durch Insulin, Östrogene, Wachstumsfaktoren.
~5% werden im Harn ausgeschieden Filtriertes Mg++
wird zu 50-70% vom dicken Teil des aufsteigenden Schenkels der
Henle-Schleife rückresorbiert (Claudin kontrolliert die parazelluläre
Diffusion), 10-25% im proximalen Tubulus, 10% im Sammelrohr, angeregt
durch Insulin, Östrogene, Wachstumsfaktoren.
~5% werden im Harn ausgeschieden
 Täglich werden ~7g Phosphat filtriert, das Filtrat enthält ~1 mM/l. Der proximale Tubulus resorbiert ~80%
über einen apikalen Na/P-Symporter (durch Parathormon hemmbar), der
distale Tubulus ~10%; ~10% werden ausgeschieden. Erhöhter
Phosphatspiegel steigert, Phosphatmangel reduziert die renale
Ausscheidung. Die Phosphatresorption wird unterstützt durch Wachstum,
Phosphatmangel, Vit. D, Alkalose; die Ausscheidung durch Parathormon, Calcitonin, Azidose Täglich werden ~7g Phosphat filtriert, das Filtrat enthält ~1 mM/l. Der proximale Tubulus resorbiert ~80%
über einen apikalen Na/P-Symporter (durch Parathormon hemmbar), der
distale Tubulus ~10%; ~10% werden ausgeschieden. Erhöhter
Phosphatspiegel steigert, Phosphatmangel reduziert die renale
Ausscheidung. Die Phosphatresorption wird unterstützt durch Wachstum,
Phosphatmangel, Vit. D, Alkalose; die Ausscheidung durch Parathormon, Calcitonin, Azidose
 Harnstoff (wichtigster N-Träger) wird glomerulär filtriert, etwa die Hälfte davon wird im proximalen Tubulus rückresorbiert, der Rest wird im Nierenmark als osmotischer
Verstärkungsfaktor genutzt und zirkuliert zwischen Tubulus und
Intertstitium, 15-70% (Mittelwert ~40%)
werden mit dem Harn ausgeschieden. Aus dem unteren Sammelrohr
diffundiert Harnstoff seinem Konzentrationsgradienten folgend in das
Interstitium - vorausgesetzt, Vasopressin bewirkt die Einlagerung von
Harnstofftransportern (UT1, UT4) in die Sammelrohre. Der Harnstoffmechanismus
bewirkt die Hälfte der osmotischen Konzentration des
Nierenmarks. Harnstoff diffundiert anschließend zu ≥50% der glomerulär
filtrierten Menge in den dünnen Schenkel des aufsteigenden Teils der
Henle-Schleife juxtamedullärer Nephrone. Im
distalen Tubulussystem kommen so 100-110% der filtrierten Menge an
Harnstoff an; ~30% werden im distalen Tubulus wieder rückresorbiert,
der Rest kommt wieder in das Sammelrohr. Durch Kapillarwände gelangt Harnstoff mittels
UT3-Transporter Harnstoff (wichtigster N-Träger) wird glomerulär filtriert, etwa die Hälfte davon wird im proximalen Tubulus rückresorbiert, der Rest wird im Nierenmark als osmotischer
Verstärkungsfaktor genutzt und zirkuliert zwischen Tubulus und
Intertstitium, 15-70% (Mittelwert ~40%)
werden mit dem Harn ausgeschieden. Aus dem unteren Sammelrohr
diffundiert Harnstoff seinem Konzentrationsgradienten folgend in das
Interstitium - vorausgesetzt, Vasopressin bewirkt die Einlagerung von
Harnstofftransportern (UT1, UT4) in die Sammelrohre. Der Harnstoffmechanismus
bewirkt die Hälfte der osmotischen Konzentration des
Nierenmarks. Harnstoff diffundiert anschließend zu ≥50% der glomerulär
filtrierten Menge in den dünnen Schenkel des aufsteigenden Teils der
Henle-Schleife juxtamedullärer Nephrone. Im
distalen Tubulussystem kommen so 100-110% der filtrierten Menge an
Harnstoff an; ~30% werden im distalen Tubulus wieder rückresorbiert,
der Rest kommt wieder in das Sammelrohr. Durch Kapillarwände gelangt Harnstoff mittels
UT3-Transporter
 Harnsäure bzw. Urat ist ein Abbauprodukt von Purinen (Konzentration im
Filtrat ≤0,25 mM). Urat wird im proximalen Tubulus zu 99%
rückresorbiert, dann zu ~50% (der filtrierten Menge) sezerniert, und
wieder zu ~40% resorbiert - frühproximal über mehrere Carrier, die
gegen andere Anionen und schwache Säuren austauschen, dann
parazellulär. Ausgeschieden werden ≤10% der filtrierten Menge. Der
Uratpool beträgt
~1200 mg, der Tagesumsatz ~700 mg/d, die Harnsäureclearance 6–12
ml/min. Hohe Calciumoxalatausscheidung bedingt Harnsteinanfälligkeit
Harnsäure bzw. Urat ist ein Abbauprodukt von Purinen (Konzentration im
Filtrat ≤0,25 mM). Urat wird im proximalen Tubulus zu 99%
rückresorbiert, dann zu ~50% (der filtrierten Menge) sezerniert, und
wieder zu ~40% resorbiert - frühproximal über mehrere Carrier, die
gegen andere Anionen und schwache Säuren austauschen, dann
parazellulär. Ausgeschieden werden ≤10% der filtrierten Menge. Der
Uratpool beträgt
~1200 mg, der Tagesumsatz ~700 mg/d, die Harnsäureclearance 6–12
ml/min. Hohe Calciumoxalatausscheidung bedingt Harnsteinanfälligkeit
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Tubuläre Resorption, Vorgänge entlang des Nephrons
Tubuläre Resorption, Vorgänge entlang des Nephrons
 Claudin: claudere = schließen
Claudin: claudere = schließen Elektrische Potentiale
Elektrische Potentiale Wasser und Kochsalz
Wasser und Kochsalz  Macula densa und Blutdruck
Macula densa und Blutdruck  Sekretion von Protonen
Sekretion von Protonen  Bicarbonat
Bicarbonat  "Titrierbare" Säuren
"Titrierbare" Säuren  Ammoniummechanismus, Pufferbasen
Ammoniummechanismus, Pufferbasen  Tubuläres Maximum: Glucose, Aminosäuren, Peptide
Tubuläres Maximum: Glucose, Aminosäuren, Peptide  Kalium
Kalium  Calcium
Calcium  Magnesium
Magnesium  Phosphat
Phosphat  Harnstoff
Harnstoff  Harnsäure
Harnsäure
 Core messages
Core messages Aktive Rückresorption von Kochsalz (diese macht den Löwenanteil des renalen Energieaufwandes und damit des renalen Sauerstoffbedarfs aus)
Aktive Rückresorption von Kochsalz (diese macht den Löwenanteil des renalen Energieaufwandes und damit des renalen Sauerstoffbedarfs aus) Wasser folgt osmotisch nach
Wasser folgt osmotisch nach Elektrische Gradienten (Lumen vs. peritubuläre Flüssigkeit) entstehen durch Ungleichgewichte resorbierter Ladungen
Elektrische Gradienten (Lumen vs. peritubuläre Flüssigkeit) entstehen durch Ungleichgewichte resorbierter Ladungen Die
im Tubulus verbleibende Flüssigkeitsmenge nimmt ab, das erhöht die
Konzentration von Stoffen, die weniger rasch (oder gar nicht)
resorbiert werden (und ausgeschieden werden).
Die
im Tubulus verbleibende Flüssigkeitsmenge nimmt ab, das erhöht die
Konzentration von Stoffen, die weniger rasch (oder gar nicht)
resorbiert werden (und ausgeschieden werden). 
 Abbildung: Renale Sauerstoffaufnahme als Funktion der tubulären Natriumresorption
Abbildung: Renale Sauerstoffaufnahme als Funktion der tubulären Natriumresorption Die Nieren verbrauchen fast ihre gesamte
Stoffwechselenergie für die Rückgewinnung von Kochsalz aus dem primären
Filtrat (
Die Nieren verbrauchen fast ihre gesamte
Stoffwechselenergie für die Rückgewinnung von Kochsalz aus dem primären
Filtrat ( Abbildung).
Ohne diese Funktion käme es zu akutem Salz- und damit Volumenverlust
und Kreislaufversagen: Fiele z.B. die tubuläre Rückresorption auf die
Hälfte (statt 99%) der filtrierten Flüssigkeit (GFR 120 ml/min),
verlöre der Körper innerhalb knapp einer Stunde eine Flüssigkeitsmenge,
die dem Volumen des Blutplasmas im Kreislauf (ca. 3 Liter) entspricht.
Abbildung).
Ohne diese Funktion käme es zu akutem Salz- und damit Volumenverlust
und Kreislaufversagen: Fiele z.B. die tubuläre Rückresorption auf die
Hälfte (statt 99%) der filtrierten Flüssigkeit (GFR 120 ml/min),
verlöre der Körper innerhalb knapp einer Stunde eine Flüssigkeitsmenge,
die dem Volumen des Blutplasmas im Kreislauf (ca. 3 Liter) entspricht.
 Abbildung: Abschnitte eines Nephrons
Abbildung: Abschnitte eines Nephrons
 Proximaler Tubulus: Resorption von Wasser und allen Stoffen, die im
Körper verbleiben sollen; reich an Mitochondrien (besonders hoher Stoffwechselaufwand). 60-80% der filtrierten Flüssigkeitsmenge werden im proximalen Tubulus zurückgewonnen; 20-40% betreten die Henle-Schleife.
Proximaler Tubulus: Resorption von Wasser und allen Stoffen, die im
Körper verbleiben sollen; reich an Mitochondrien (besonders hoher Stoffwechselaufwand). 60-80% der filtrierten Flüssigkeitsmenge werden im proximalen Tubulus zurückgewonnen; 20-40% betreten die Henle-Schleife. Henle-Schleife, bestehend aus einem dünnwandigen absteigenden und einem dickwandigen aufsteigenden Schenkel: Aufbau eines osmotischen Gradienten, Harnstoffzirkulation, Resorption von 5-10% der filtrierten Flüssigkeitsmenge.
Henle-Schleife, bestehend aus einem dünnwandigen absteigenden und einem dickwandigen aufsteigenden Schenkel: Aufbau eines osmotischen Gradienten, Harnstoffzirkulation, Resorption von 5-10% der filtrierten Flüssigkeitsmenge. Distaler Tubulus / Sammelrohr: Feineinstellung der Stoffmengen
(Ausscheidung / Rückgewinnung) und der osmotischen Konzentration. Hier greifen Vasopressin (Wasserresorption), Aldosteron
(Natriumresorption) und natriuretische Peptide an (Natriumausscheidung).
Distaler Tubulus / Sammelrohr: Feineinstellung der Stoffmengen
(Ausscheidung / Rückgewinnung) und der osmotischen Konzentration. Hier greifen Vasopressin (Wasserresorption), Aldosteron
(Natriumresorption) und natriuretische Peptide an (Natriumausscheidung).  Erniedrigte Osmolalität im Blut regt die Freisetzung von Aldosteron an, erhöhte Osmolalität die von Vasopressin.
Erniedrigte Osmolalität im Blut regt die Freisetzung von Aldosteron an, erhöhte Osmolalität die von Vasopressin. Abbildung):
Abbildung): (ein körperfremdes Kohlenhydrat) zu.
(ein körperfremdes Kohlenhydrat) zu. Die Na/K-ATPase in den basolateralen Membranen baut einen Natrium- und Kaliumgradienten auf wie in anderen Zellen auch: [Na+]
hoch im Interstitium (140-145 mM), [K+] hoch in der Zelle (135-150 mM).
Dies ist der tragende Energiemotor der tubulären Austauschvorgänge
Die Na/K-ATPase in den basolateralen Membranen baut einen Natrium- und Kaliumgradienten auf wie in anderen Zellen auch: [Na+]
hoch im Interstitium (140-145 mM), [K+] hoch in der Zelle (135-150 mM).
Dies ist der tragende Energiemotor der tubulären Austauschvorgänge Der Natriumgradient wird u.a. für luminalen (apikalen) Symport von Glucose, Aminosäuren oder Phosphat (Resorption) aus der Tubulusflüssigkeit in die Zelle genützt, oder auch für Austausch (z.B. für Sekretion von H+ in den Tubulus)
Der Natriumgradient wird u.a. für luminalen (apikalen) Symport von Glucose, Aminosäuren oder Phosphat (Resorption) aus der Tubulusflüssigkeit in die Zelle genützt, oder auch für Austausch (z.B. für Sekretion von H+ in den Tubulus) Die Anreicherung von Natriumionen im interzellulären Raum (zwischen den
basolateralen Teilen der Tubuluszellen) bewirkt einen osmotischen Wassereinstrom aus dem Tubulus - sowohl trans- (Aquaporin) als auch parazellulär (tight junctions). Dieser Strom nimmt gelöste Teilchen mit (solvent drag)
Die Anreicherung von Natriumionen im interzellulären Raum (zwischen den
basolateralen Teilen der Tubuluszellen) bewirkt einen osmotischen Wassereinstrom aus dem Tubulus - sowohl trans- (Aquaporin) als auch parazellulär (tight junctions). Dieser Strom nimmt gelöste Teilchen mit (solvent drag) Der osmotische Wasserstrom erhöht die Konzentration gelöster Teilchen im Tubulus, was ihnen einen elektrochemischen Gradienten Richtung Resorption
(trans- oder parazellulär) verleiht. Nicht resorbierbare Teilchen
werden im Tubulus automatisch angereichert (im Tubulus sinkt die Menge
des Lösungsmittels Wasser)
Der osmotische Wasserstrom erhöht die Konzentration gelöster Teilchen im Tubulus, was ihnen einen elektrochemischen Gradienten Richtung Resorption
(trans- oder parazellulär) verleiht. Nicht resorbierbare Teilchen
werden im Tubulus automatisch angereichert (im Tubulus sinkt die Menge
des Lösungsmittels Wasser) Die Ansammlung resorbierter Flüssigkeit zwischen den Tubuluszellen
(interzellulär) erhöht hier den hydrostatischen Druck und unterstützt
die Strömung Richtung Interstitium und Blutgefäße
Die Ansammlung resorbierter Flüssigkeit zwischen den Tubuluszellen
(interzellulär) erhöht hier den hydrostatischen Druck und unterstützt
die Strömung Richtung Interstitium und Blutgefäße

 Abbildung: Resorption aus dem proximalen Tubulus
Abbildung: Resorption aus dem proximalen Tubulus
 Die luminale Membran der Tubulusepithelzellen ist reichlich mit
Mikrovilli ausgestattet (
Die luminale Membran der Tubulusepithelzellen ist reichlich mit
Mikrovilli ausgestattet ( Abbildung), das vergrößert die für die Resorption
verfügbare Oberfläche; auch die basolaterale Membran verfügt über
zahlreiche Einstülpungen.
Abbildung), das vergrößert die für die Resorption
verfügbare Oberfläche; auch die basolaterale Membran verfügt über
zahlreiche Einstülpungen. Zellmembran voller Carriermoleküle (vor allem apikal)
Zellmembran voller Carriermoleküle (vor allem apikal) Zahlreiche Mitochondrien (Antrieb ATP-verbrauchender Transportvorgänge in der basolateralen Membran)
Zahlreiche Mitochondrien (Antrieb ATP-verbrauchender Transportvorgänge in der basolateralen Membran) Seitliche interzelluläre Kontakte (tight junctions) sind für Wasser durchgängig (parazelluläre Resorption)
Seitliche interzelluläre Kontakte (tight junctions) sind für Wasser durchgängig (parazelluläre Resorption) Membranen enthalten zahlreiche Aquaporin 1-Kanäle (transzelluläre Passage von Wasser)
Membranen enthalten zahlreiche Aquaporin 1-Kanäle (transzelluläre Passage von Wasser) Transepitheliales Potential: Die Transportvorgänge durch das Tubulusepithel führen zunächst zu einer leichten (-3 mV) negativen Aufladung des Lumens
gegenüber dem Interstitium (es werden - transzellulär - etwas mehr
positive als negative Ladungen resorbiert). Dieses Potential zieht zwar
Chloridionen -
parazellulär - Richtung Interstitium, aber nicht genug, um mit der
Resorption anderer Ionen Schritt zu halten.
Transepitheliales Potential: Die Transportvorgänge durch das Tubulusepithel führen zunächst zu einer leichten (-3 mV) negativen Aufladung des Lumens
gegenüber dem Interstitium (es werden - transzellulär - etwas mehr
positive als negative Ladungen resorbiert). Dieses Potential zieht zwar
Chloridionen -
parazellulär - Richtung Interstitium, aber nicht genug, um mit der
Resorption anderer Ionen Schritt zu halten. 

 Abbildung: Nephron und Ausscheidung
Abbildung: Nephron und Ausscheidung
 Transzellulärer Transport
Transzellulärer Transport  Luminale (apikale) Membran
Luminale (apikale) Membran Na+-H+-Antiport, aktiviert durch intrazellulären pH-Abfall (zelluläre Azidose), sezerniert H+ sekundär-aktiv im Austausch gegen Na+
Na+-H+-Antiport, aktiviert durch intrazellulären pH-Abfall (zelluläre Azidose), sezerniert H+ sekundär-aktiv im Austausch gegen Na+ Natriumkanäle für sekundär-aktiven Kotransport mit Glucose (SGLT 1/2; zum tubulären Maximum s. unten), Aminosäuren, Phosphat, Lactat, Acetat, Citrat
Natriumkanäle für sekundär-aktiven Kotransport mit Glucose (SGLT 1/2; zum tubulären Maximum s. unten), Aminosäuren, Phosphat, Lactat, Acetat, Citrat Peptide und Proteine (Albumin, Mikroglobulin, Lysozym), die glomerulär filtriert wurden, werden mittels Endozytose zurückgewonnen - s dort
Peptide und Proteine (Albumin, Mikroglobulin, Lysozym), die glomerulär filtriert wurden, werden mittels Endozytose zurückgewonnen - s dort
 Abbildung: Proximaler Tubulus
Abbildung: Proximaler Tubulus
 Basolaterale Membran
Basolaterale Membran Na+-K+-Pumpe
Na+-K+-Pumpe  Na+-Bicarbonat-Cotransport
Na+-Bicarbonat-Cotransport K+-Cl--Symport
K+-Cl--Symport Parazellulärer Transport
Parazellulärer Transport Zu organischen Kationen zählen u.a. Pharmaka wie Morphine oder Chinin
(basolaterale Aufnahme durch das Membranpotential unterstützt, luminale
Sekretion über Kationen-Protonen-Austauscher),
Zu organischen Kationen zählen u.a. Pharmaka wie Morphine oder Chinin
(basolaterale Aufnahme durch das Membranpotential unterstützt, luminale
Sekretion über Kationen-Protonen-Austauscher), zu
organischen Anionen PAH (dieses wird an der basolateralen Membran gegen
ein Dicarboxylat, an der luminalen Membran gegen ein Anion getauscht),
Oxalsäure, Furosemid, Penicillin oder Salicylat.
zu
organischen Anionen PAH (dieses wird an der basolateralen Membran gegen
ein Dicarboxylat, an der luminalen Membran gegen ein Anion getauscht),
Oxalsäure, Furosemid, Penicillin oder Salicylat.
 Abbildung: Henle'sche Schleife
Abbildung: Henle'sche Schleife
 Transzellulärer Transport
Transzellulärer Transport Apikale Membran:
Apikale Membran:  Na+-K+-2Cl--Symport (elektroneutral)
Na+-K+-2Cl--Symport (elektroneutral) Na+-H+-Antiport
Na+-H+-Antiport Basolaterale Membran:
Basolaterale Membran:  Na+-K+-Pumpe
Na+-K+-Pumpe K+-Cl--Symport
K+-Cl--Symport Parazellulärer Transport
Parazellulärer Transport
 Abbildung: Frühdistaler Tubulus
Abbildung: Frühdistaler Tubulus
 Apikale Membran:
Apikale Membran:  Na+-Cl--Symport (elektroneutral)
Na+-Cl--Symport (elektroneutral) Basolaterale Membran:
Basolaterale Membran:  Na+-K+-Pumpe
Na+-K+-Pumpe Chloridkanal
Chloridkanal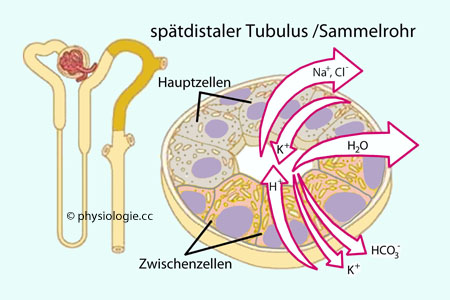
 Abbildung: Spätdistaler Tubulus und Sammelrohr
Abbildung: Spätdistaler Tubulus und Sammelrohr
 Transzellulärer Transport - Hauptzellen (principal cells)
Transzellulärer Transport - Hauptzellen (principal cells) Apikale Membran:
Apikale Membran:  Na+-Kanäle (ENaC - durch Aldosteron angeregt, der Einstrom von Na+ erzeugt ein lumen-negatives Potential von bis zu -50 mV)
Na+-Kanäle (ENaC - durch Aldosteron angeregt, der Einstrom von Na+ erzeugt ein lumen-negatives Potential von bis zu -50 mV) K+-Kanäle (ROMK - Renal Outer Medullary Potassium (K) channel: Die Sekretion von Kalium in das Lumen wird durch das lumen-negative Potential gefördert)
K+-Kanäle (ROMK - Renal Outer Medullary Potassium (K) channel: Die Sekretion von Kalium in das Lumen wird durch das lumen-negative Potential gefördert) Basolaterale Membran:
Basolaterale Membran:  Na+-K+-Pumpe
Na+-K+-Pumpe
 Abbildung: Ionentransport im Sammelrohrsystem
Abbildung: Ionentransport im Sammelrohrsystem
 Transzellulärer Transport - Typ A-Zwischenzellen
Transzellulärer Transport - Typ A-Zwischenzellen Apikale Membran:
Apikale Membran:  H+/K+-ATPase
H+/K+-ATPase  H+-Transporter (beides P-Typ-ATPasen)
H+-Transporter (beides P-Typ-ATPasen)
 Basolaterale Membran:
Basolaterale Membran:  Na+/H+-Austauscher (NHE)
Na+/H+-Austauscher (NHE) Na/K/2Cl-Symporter (NK2Cl cotransporter)
Na/K/2Cl-Symporter (NK2Cl cotransporter) Cl-/HCO3--Antiporter
Cl-/HCO3--Antiporter  Transzellulärer Transport - Typ B-Zwischenzellen
Transzellulärer Transport - Typ B-Zwischenzellen  Apikale Membran:
Apikale Membran:  Cl-/HCO3--Antiporter (Pendrin)
Cl-/HCO3--Antiporter (Pendrin) Basolaterale Membran:
Basolaterale Membran:  H+-Transporter
H+-Transporter Im proximalen Tubulus baut sich nur ein schwaches elektrisches
Potential
auf: Pars convoluta -3 mV (es werden etwas mehr positive als negative
Ladungen resorbiert), pars recta +3 mV (Chloridanreicherung im Lumen)
Im proximalen Tubulus baut sich nur ein schwaches elektrisches
Potential
auf: Pars convoluta -3 mV (es werden etwas mehr positive als negative
Ladungen resorbiert), pars recta +3 mV (Chloridanreicherung im Lumen) Im dicken
aufsteigenden Schenkel der Henle-Schleife (TAL) ist das Lumen elektropositiv (+8 bis +15 mV) geladen, weil die apikale Membran stärker aufgeladen ist als die basolaterale (anders als bei den meisten anderen Epithelien).
Im dicken
aufsteigenden Schenkel der Henle-Schleife (TAL) ist das Lumen elektropositiv (+8 bis +15 mV) geladen, weil die apikale Membran stärker aufgeladen ist als die basolaterale (anders als bei den meisten anderen Epithelien). im distalen Tubulus unterschiedlich (frühdistal -5 mV, später +5 mV)
im distalen Tubulus unterschiedlich (frühdistal -5 mV, später +5 mV) im Sammelrohrsystem durch Kaliumaustritt in das, und Natriumresorption aus dem Lumen deutlich elektronegativ
(bis zu -50 mV) geladen - verursacht durch Na+-Resorption (apikale ENaC), was die K+-Sekretion (über ROMK) antreibt.
im Sammelrohrsystem durch Kaliumaustritt in das, und Natriumresorption aus dem Lumen deutlich elektronegativ
(bis zu -50 mV) geladen - verursacht durch Na+-Resorption (apikale ENaC), was die K+-Sekretion (über ROMK) antreibt.  s. untenstehende Tabelle
s. untenstehende Tabelle
 Abbildung: Wie die Niere mit Natrium umgeht
Abbildung: Wie die Niere mit Natrium umgeht
 Sympathisch-katecholaminerg
Sympathisch-katecholaminerg  Über das Renin-Angiotensin-Aldosteron-System
Über das Renin-Angiotensin-Aldosteron-System Aus dem Hypothalamus über das Vasopressinsystem
Aus dem Hypothalamus über das Vasopressinsystem Aus dem Herzen über atriale natriuretische Peptide.
Aus dem Herzen über atriale natriuretische Peptide.
 Abbildung: Parazelluläre und transzelluläre Kochsalzresorption
Abbildung: Parazelluläre und transzelluläre Kochsalzresorption

 Abbildung: Molekularbiologie der renalen Natriumresorption
Abbildung: Molekularbiologie der renalen Natriumresorption
 Abbildung) über den SGLT - Natrium-Glucose- Kontransporter.
Abbildung) über den SGLT - Natrium-Glucose- Kontransporter. vgl. dort). Dazu kommt im proximalen Tubulus ein Natrium/Bicarbonat-Kotransport, ebenfalls über die basolaterale Membran.
vgl. dort). Dazu kommt im proximalen Tubulus ein Natrium/Bicarbonat-Kotransport, ebenfalls über die basolaterale Membran. Abbildung), was den luminalen pH-Wert senkt.
Abbildung), was den luminalen pH-Wert senkt. Abbildung): Teils parazellulär (proximaler
Tubulus, Hauptzellen des Sammelrohrs), teils über diverse
transzelluläre Wege.
Abbildung): Teils parazellulär (proximaler
Tubulus, Hauptzellen des Sammelrohrs), teils über diverse
transzelluläre Wege. 
 Abbildung: Wie die Niere mit Chlorid umgeht
Abbildung: Wie die Niere mit Chlorid umgeht
 Im frühproximalen Tubulus gibt es keine
Chloridkanäle. Mit zunehmender Rückresorption des Filtrats steigt die
Chloridkonzentration von ~100 mM (Primärfiltrat: wie Blutplasma) auf ~120 mM an. Chlorid diffundiert parazellulär in das Interstitium des Tubulus - dies ist eine wesentliche Komponente der Chloridresorption.
Im frühproximalen Tubulus gibt es keine
Chloridkanäle. Mit zunehmender Rückresorption des Filtrats steigt die
Chloridkonzentration von ~100 mM (Primärfiltrat: wie Blutplasma) auf ~120 mM an. Chlorid diffundiert parazellulär in das Interstitium des Tubulus - dies ist eine wesentliche Komponente der Chloridresorption. Im spätproximalen Tubulus (pars recta) werden Chloridionen apikal mittels Anionenaustausch (wie über SLC26A6)
gegen Basen ausgetauscht - wie Oxalat-, Formiat- (Salz der
Ameisensäure), Bicarbonat- oder OH-Ionen - und verlassen die Zelle
basolateral über Chloridkanäle (auch im Austausch z.B. gegen Oxalat). Dies ist ein tertiär aktiver Transport, denn er bedarf des apikalen sekundär-aktiven Austauschs von Natrium und Wasserstoffionen (NHE3), der H+ aus der Zelle schafft und Basen im Tubuluslumen neutralisiert.
Im spätproximalen Tubulus (pars recta) werden Chloridionen apikal mittels Anionenaustausch (wie über SLC26A6)
gegen Basen ausgetauscht - wie Oxalat-, Formiat- (Salz der
Ameisensäure), Bicarbonat- oder OH-Ionen - und verlassen die Zelle
basolateral über Chloridkanäle (auch im Austausch z.B. gegen Oxalat). Dies ist ein tertiär aktiver Transport, denn er bedarf des apikalen sekundär-aktiven Austauschs von Natrium und Wasserstoffionen (NHE3), der H+ aus der Zelle schafft und Basen im Tubuluslumen neutralisiert. Im dicken aufsteigenden Henle-Schenkel gelangt Cl- über Na/K/Cl-Kotransport in die Zelle (apikal) und verlässt sie (basolateral) über Chloridkanäle sowie Cl/HCO3-Austauscher.
Im dicken aufsteigenden Henle-Schenkel gelangt Cl- über Na/K/Cl-Kotransport in die Zelle (apikal) und verlässt sie (basolateral) über Chloridkanäle sowie Cl/HCO3-Austauscher. Im distalen Tubulus (pars convoluta) erfolgt der apikale Eintritt von Chlorid zusammen mit Natrium (Kotransporter NCC), basolateral diffundiert Cl- über Chloridkanäle zum Interstitium.
Im distalen Tubulus (pars convoluta) erfolgt der apikale Eintritt von Chlorid zusammen mit Natrium (Kotransporter NCC), basolateral diffundiert Cl- über Chloridkanäle zum Interstitium. Durch Schaltzellen des Sammelrohres geht es - diesmal apikal - über Cl/HCO3-Austauscher (Pendrin) und basolateral wieder via Chloridkanäle.
Durch Schaltzellen des Sammelrohres geht es - diesmal apikal - über Cl/HCO3-Austauscher (Pendrin) und basolateral wieder via Chloridkanäle.  Zwischen den Epithelzellen der Sammelrohre wandert Chlorid parazellulär
aus dem Lumen zum Interstitium. Die Hauptzellen produzieren ein
lumen-negatives Potential von ca. -40 mV Stärke; das regt die Strömung
von Chloridionen zur Seite des Interstitiums an.
Zwischen den Epithelzellen der Sammelrohre wandert Chlorid parazellulär
aus dem Lumen zum Interstitium. Die Hauptzellen produzieren ein
lumen-negatives Potential von ca. -40 mV Stärke; das regt die Strömung
von Chloridionen zur Seite des Interstitiums an. s.
dort).
s.
dort).
 Abbildung: Wirkungen "auf Herz und Nieren"
Abbildung: Wirkungen "auf Herz und Nieren"
 s. dort).
s. dort).
 Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
 Glomeruläre Filtration von Bicarbonat
Glomeruläre Filtration von Bicarbonat Tubuläre Resorption von Bicarbonat
Tubuläre Resorption von Bicarbonat Ausscheidung titrierbarer Säuren
Ausscheidung titrierbarer Säuren Ausscheidung von Ammonium
Ausscheidung von Ammonium Abbildung oben).
Abbildung oben). Enthält eine Urinprobe z.B. 15 mmol Ammonium und 10 mmol titrierbare
Säure, hat die Niere in der entsprechenden Zeit 25 mmol Bicarbonat
produziert.
Enthält eine Urinprobe z.B. 15 mmol Ammonium und 10 mmol titrierbare
Säure, hat die Niere in der entsprechenden Zeit 25 mmol Bicarbonat
produziert. Die
Summe der mit dem Harn zu eliminierenden sauren Valenzen beträgt bei üblicher Kost 50-100
mM/Tag. Als Protonen ausgeschieden (also ohne Pufferung in Wasser
gelöst) würde der Harn dabei einen pH von ungefähr 1,3 haben - viel zu
sauer für das Gewebe des Harntrakts. Tatsächlich scheidet man mit dem
Harn täglich nur etwa 5 µM Protonen frei aus (Harn-pH meist zwischen
5,0 und 6,0); mehr als 99,99% in gepufferter Form, vorwiegend als
primäres Phosphat sowie als Ammoniumionen.
Die
Summe der mit dem Harn zu eliminierenden sauren Valenzen beträgt bei üblicher Kost 50-100
mM/Tag. Als Protonen ausgeschieden (also ohne Pufferung in Wasser
gelöst) würde der Harn dabei einen pH von ungefähr 1,3 haben - viel zu
sauer für das Gewebe des Harntrakts. Tatsächlich scheidet man mit dem
Harn täglich nur etwa 5 µM Protonen frei aus (Harn-pH meist zwischen
5,0 und 6,0); mehr als 99,99% in gepufferter Form, vorwiegend als
primäres Phosphat sowie als Ammoniumionen. Über Ort und Mechanismus der Säureausscheidung entlang des Nephrons s. dort
Über Ort und Mechanismus der Säureausscheidung entlang des Nephrons s. dort  Zum Bicarbonattransport s. auch dort
Zum Bicarbonattransport s. auch dort Abbildung).
Abbildung).
 Abbildung: Der Natrium-Protonen-
Abbildung: Der Natrium-Protonen-
 In Summe wird so im proximalen Tubulus 85-90% des glomerulär filtrierten Natriumbicarbonats rückresorbiert (über CO2,
In Summe wird so im proximalen Tubulus 85-90% des glomerulär filtrierten Natriumbicarbonats rückresorbiert (über CO2,  Abbildung). Die Entfernung des Bicarbonats aus dem Tubuluslumen und der Austausch gegen H+-Ionen senkt im proximalen Tubulus den pH-Wert
von 7,4 (glomeruläres Filtrat) auf 6,8 (Ende des proximalen Tubulus).
Die restlichen 15% des filtrierten Bicarbonats werden weiter distal
rückresorbiert, insbesondere von Typ A-Zwischenzellen der Sammelrohre.
Abbildung). Die Entfernung des Bicarbonats aus dem Tubuluslumen und der Austausch gegen H+-Ionen senkt im proximalen Tubulus den pH-Wert
von 7,4 (glomeruläres Filtrat) auf 6,8 (Ende des proximalen Tubulus).
Die restlichen 15% des filtrierten Bicarbonats werden weiter distal
rückresorbiert, insbesondere von Typ A-Zwischenzellen der Sammelrohre.  Abbildung) - die Katalyse über dieses Enzym erfolgt enorm rasch (etwa 105 Reaktionen pro Sekunde).
Abbildung) - die Katalyse über dieses Enzym erfolgt enorm rasch (etwa 105 Reaktionen pro Sekunde). H2CO3
H2CO3  H+ + HCO3-
H+ + HCO3- H2PO4-, hier ist das gesamte primäre Phosphat aufgebraucht); 36 mmol Bicarbonat wurden dabei gewonnen (
H2PO4-, hier ist das gesamte primäre Phosphat aufgebraucht); 36 mmol Bicarbonat wurden dabei gewonnen ( vgl. dort).
vgl. dort). Sulfate (aus schwefelhaltigen Aminosäuren),
Sulfate (aus schwefelhaltigen Aminosäuren), Harnsäuren bzw. Urate (aus Purin-Nukleotiden) (pK = 5,8),
Harnsäuren bzw. Urate (aus Purin-Nukleotiden) (pK = 5,8), Oxalsäure bzw. Oxalate (aus Stoffwechsel bzw. Ernährung),
Oxalsäure bzw. Oxalate (aus Stoffwechsel bzw. Ernährung), Milchsäure bzw. Lactate (aus unvollständigem Glucoseabbau),
Milchsäure bzw. Lactate (aus unvollständigem Glucoseabbau),  allenfalls Ketonkörper (aus Fettsäuren).
allenfalls Ketonkörper (aus Fettsäuren). Benötigt man für die Titration des Harns auf pH=7,4 z.B. 50 mmol NaOH,
dann wurden 50 mmol Protonen gepuffert und es sind in der Niere in
dieser Zeit 50 mmol Bicarbonat entstanden.
Benötigt man für die Titration des Harns auf pH=7,4 z.B. 50 mmol NaOH,
dann wurden 50 mmol Protonen gepuffert und es sind in der Niere in
dieser Zeit 50 mmol Bicarbonat entstanden. NH4+). Über die Niere wird H+ u.a. in Form von Ammoniumionen ausgeschieden.
NH4+). Über die Niere wird H+ u.a. in Form von Ammoniumionen ausgeschieden. 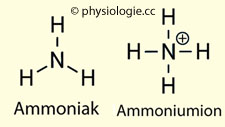
 Die Ausscheidung von Ammoniumionen spart also
Bicarbonat und entlastet indirekt den Pufferverbrauch im Harn.
Die Ausscheidung von Ammoniumionen spart also
Bicarbonat und entlastet indirekt den Pufferverbrauch im Harn. Proximale Tubuluszellen nehmen Glutamin auf (Quelle: Filtrat, Blut / Interstitium) und
verwandeln es in Ammonium und α-Ketoglutarat - aus dem wiederum
Bicarbonat gewonnen wird. Die
renale Ammoniumausscheidung (Entfernung saurer Valenzen) ist daher
direkt mit der Bicarbonatsynthese (Bildung von Pufferbasen) verknüpft
und wirkt einer "Übersäuerung" des Körpers entgegen. Das bezieht sich
auf die relativ wenigen "nichtflüchtigen" Säuren, die über die Niere
ausgeschieden werden müssen - der Hauptteil der Entfernung saurer
Valenzen (in der Form von CO2) übernimmt die Atmung.
Proximale Tubuluszellen nehmen Glutamin auf (Quelle: Filtrat, Blut / Interstitium) und
verwandeln es in Ammonium und α-Ketoglutarat - aus dem wiederum
Bicarbonat gewonnen wird. Die
renale Ammoniumausscheidung (Entfernung saurer Valenzen) ist daher
direkt mit der Bicarbonatsynthese (Bildung von Pufferbasen) verknüpft
und wirkt einer "Übersäuerung" des Körpers entgegen. Das bezieht sich
auf die relativ wenigen "nichtflüchtigen" Säuren, die über die Niere
ausgeschieden werden müssen - der Hauptteil der Entfernung saurer
Valenzen (in der Form von CO2) übernimmt die Atmung.  Die Hauptlast der renalen Ammoniumsynthese tragen die proximalen Tubuli. Die
renale Bildung von Ammonium kann bis auf eine tägliche Ausscheidung von
600-700 mM Säurevalenzen hinaufreguliert werden, das Zehnfache der
normalerweise anfallenden renalen Säureelimination.
Die Hauptlast der renalen Ammoniumsynthese tragen die proximalen Tubuli. Die
renale Bildung von Ammonium kann bis auf eine tägliche Ausscheidung von
600-700 mM Säurevalenzen hinaufreguliert werden, das Zehnfache der
normalerweise anfallenden renalen Säureelimination.
 Abbildung: Molekülmodelle für Ammoniak, Wasser und Harnstoff
Abbildung: Molekülmodelle für Ammoniak, Wasser und Harnstoff
 Abbildung), und seine Bewegung durch Zellmembranen ist spezifisch
reguliert, z.B. durch Aquaporine.
Abbildung), und seine Bewegung durch Zellmembranen ist spezifisch
reguliert, z.B. durch Aquaporine.
 Abbildung: Tubulärer Glutamin- / Ammonium- Metabolismus
Abbildung: Tubulärer Glutamin- / Ammonium- Metabolismus
 Bei
metabolischer Azidose steigt der ausgeschiedene Anteil auf bis zu 80%
an; nur ausgeschiedenes Ammonium entlastet den Pufferstatus, da die Bildung von NH4+ und HCO3- äquimolar erfolgt, d.h. auf ein Ammonium entfällt jeweils ein Bicarbonat.
Bei
metabolischer Azidose steigt der ausgeschiedene Anteil auf bis zu 80%
an; nur ausgeschiedenes Ammonium entlastet den Pufferstatus, da die Bildung von NH4+ und HCO3- äquimolar erfolgt, d.h. auf ein Ammonium entfällt jeweils ein Bicarbonat.  Bei
der Metabolisierung von Glutamin fällt Glucose an (
Bei
der Metabolisierung von Glutamin fällt Glucose an ( Abbildung). Im
postabsorptiven Normalzustand trägt die Niere mit etwa 20% zur Glucoseversorgung des Körpers bei (den größeren Teil übernimmt die Leber), im chronischen Hungerzustand kann dieser Anteil auf 45% ansteigen - die Niere kann zu einem bedeutenden Glucoseproduzenten werden, z.B. auch bei metabolischer Azidose oder Hypokaliämie.
Abbildung). Im
postabsorptiven Normalzustand trägt die Niere mit etwa 20% zur Glucoseversorgung des Körpers bei (den größeren Teil übernimmt die Leber), im chronischen Hungerzustand kann dieser Anteil auf 45% ansteigen - die Niere kann zu einem bedeutenden Glucoseproduzenten werden, z.B. auch bei metabolischer Azidose oder Hypokaliämie.
 Abbildung: Epithelialer Ammoniumtransport in der Niere
Abbildung: Epithelialer Ammoniumtransport in der Niere
 Abbildung). Das fettlösliche NH3 rezirkuliert zwischen Interstitium und Tubuli (NH4+ wird im aufsteigenden Schenkel der Henle-Schleife in das Interstitium resorbiert und verwandelt sich hier wieder in NH3) und seine Konzentration bleibt dadurch relativ hoch.
Abbildung). Das fettlösliche NH3 rezirkuliert zwischen Interstitium und Tubuli (NH4+ wird im aufsteigenden Schenkel der Henle-Schleife in das Interstitium resorbiert und verwandelt sich hier wieder in NH3) und seine Konzentration bleibt dadurch relativ hoch.  Als tubuläres Maximum bezeichnet man die höchste
tubuläre Transportkapazität für einen bestimmten zu transportierenden Stoff - z.B. Glucose oder Aminosäuren:
Als tubuläres Maximum bezeichnet man die höchste
tubuläre Transportkapazität für einen bestimmten zu transportierenden Stoff - z.B. Glucose oder Aminosäuren: Der
normale Nüchtern-Glucosespiegel im Blutplasma (und im glomerulären
Filtrat) beträgt 4-5 mM (70-100 mg/dl). Die proximalen Tubuli nehmen so
gut wie die gesamte filtrierte Menge - transzellulär - wieder auf,
verwenden sie teils für ihren
eigenen Energiestoffwechsel und exportierern den Rest in
Richtung Interstitium und Blutkreislauf.
Der
normale Nüchtern-Glucosespiegel im Blutplasma (und im glomerulären
Filtrat) beträgt 4-5 mM (70-100 mg/dl). Die proximalen Tubuli nehmen so
gut wie die gesamte filtrierte Menge - transzellulär - wieder auf,
verwenden sie teils für ihren
eigenen Energiestoffwechsel und exportierern den Rest in
Richtung Interstitium und Blutkreislauf.
 Abbildung: Wie die Niere mit Glucose umgeht
Abbildung: Wie die Niere mit Glucose umgeht
 Über die apikale Membran resorbieren die Zellen des frühproximalen Tubulus bis zu 98% der glomerulär filtrierten Glucose mittels SGLT2-Transporter
zusammen mit Natriumionen (1:1, sekundär aktiv, hohe
Transportkapazität, geringe Affinität), wobei sie eine Anreicherung bis
zum 70-fachen der Konzentration im Tubuluslumen aufbauen können. SGLT2
wird exklusiv von renalen Zellen exprimiert (SGLT2-Inhibitoren wirken
daher nur an der Niere, sie bleiben ohne Einfluss auf den
Glucosetransport in anderen Organen).
Über die apikale Membran resorbieren die Zellen des frühproximalen Tubulus bis zu 98% der glomerulär filtrierten Glucose mittels SGLT2-Transporter
zusammen mit Natriumionen (1:1, sekundär aktiv, hohe
Transportkapazität, geringe Affinität), wobei sie eine Anreicherung bis
zum 70-fachen der Konzentration im Tubuluslumen aufbauen können. SGLT2
wird exklusiv von renalen Zellen exprimiert (SGLT2-Inhibitoren wirken
daher nur an der Niere, sie bleiben ohne Einfluss auf den
Glucosetransport in anderen Organen). Abbildung). SGLT-1 findet sich auch in
anderen Geweben (Herz, Lunge, Gastrointestinaltrakt).
Abbildung). SGLT-1 findet sich auch in
anderen Geweben (Herz, Lunge, Gastrointestinaltrakt). SGLT (sodium glucose transporter) -2-Hemmer (z.B. Canagliflozin, Dapagliflozin, Empagliflozin) behindern die tubuläre Glucoseresorption und senken - insulinunabhängig - den Blutzuckerspiegel (Diabetes-II-Behandlung), sie führen auch zu Kalorienverlust.
SGLT (sodium glucose transporter) -2-Hemmer (z.B. Canagliflozin, Dapagliflozin, Empagliflozin) behindern die tubuläre Glucoseresorption und senken - insulinunabhängig - den Blutzuckerspiegel (Diabetes-II-Behandlung), sie führen auch zu Kalorienverlust.  In der basolateralen
Membran befindet sich die Na/K-ATPase, welche den für den Betrieb des
sekundär-aktiven Transport nötigen Natriumgradienten garantiert, sowie
die insulinunabhängigen Glucosetransporter GLUT2 (frühproximal, hohe Transportkapazität )
und GLUT1 (pars recta). Anders als die SGLTs, sind diese Transporter
natriumunabhängig; sie erleichtern die Diffusion der Glucose aus den
Epithelzellen in das Interstitium.
In der basolateralen
Membran befindet sich die Na/K-ATPase, welche den für den Betrieb des
sekundär-aktiven Transport nötigen Natriumgradienten garantiert, sowie
die insulinunabhängigen Glucosetransporter GLUT2 (frühproximal, hohe Transportkapazität )
und GLUT1 (pars recta). Anders als die SGLTs, sind diese Transporter
natriumunabhängig; sie erleichtern die Diffusion der Glucose aus den
Epithelzellen in das Interstitium. Abbildung), der Zucker wird nur
teilweise wiederaufgenommen, der Rest tritt im Harn auf (Glukosurie: Glucosekonzentration von ≥0,8 mM oder ≥15 mg/dl Nüchternurin).
Abbildung), der Zucker wird nur
teilweise wiederaufgenommen, der Rest tritt im Harn auf (Glukosurie: Glucosekonzentration von ≥0,8 mM oder ≥15 mg/dl Nüchternurin).
 Abbildung: Glucose-Titrationskurve
Abbildung: Glucose-Titrationskurve
 Aminosäuren (Gesamtkonzentration im Plasma ~2,4 mM) werden glomerulär frei filtriert und im proximalen Tubulus mit Hilfe sekundär-aktiven
Transports transzellulär aus dem Tubulus zum Blut rückresorbiert (98-99%). Zunächst werden sie
apikal teils Na+- und/oder H+-gekoppelt,
teils über erleichterte Diffusion in die Tubuluszelle aufgenommen; dann
verlassen sie die Zellen über deren basolaterale Membran mittels
erleichterter Diffusion oder über (Na-abhängige) Aminosäureaustauscher.
Aminosäuren (Gesamtkonzentration im Plasma ~2,4 mM) werden glomerulär frei filtriert und im proximalen Tubulus mit Hilfe sekundär-aktiven
Transports transzellulär aus dem Tubulus zum Blut rückresorbiert (98-99%). Zunächst werden sie
apikal teils Na+- und/oder H+-gekoppelt,
teils über erleichterte Diffusion in die Tubuluszelle aufgenommen; dann
verlassen sie die Zellen über deren basolaterale Membran mittels
erleichterter Diffusion oder über (Na-abhängige) Aminosäureaustauscher. 
 Abbildung: Wie die Niere mit Oligopeptiden umgeht
Abbildung: Wie die Niere mit Oligopeptiden umgeht
 Peptide im Tubuluslumen - u.a.
Angiotensin und Glutathion - werden teils am apikalen Bürstensaum
(durch Endo-, Di-, Aminopeptidasen u.a.) zu Oligopeptiden und
Aminosäuren abgebaut. Oligopeptide (2-5 Aminosäuren, z.B. das vor allem in Muskeln und Nervensystem vorhandene Dipeptid Carnosin, das als Antioxidans und Puffer wirkt) werden teils erst in der Tubulusepithelzelle zu Aminosäuren abgebaut (zytoplasmazische Peptidasen), nachdem sie über die Oligopeptid-Cotransporter PepT1 und PepT2 zusammen mit H+ aufgenommen wurden (
Peptide im Tubuluslumen - u.a.
Angiotensin und Glutathion - werden teils am apikalen Bürstensaum
(durch Endo-, Di-, Aminopeptidasen u.a.) zu Oligopeptiden und
Aminosäuren abgebaut. Oligopeptide (2-5 Aminosäuren, z.B. das vor allem in Muskeln und Nervensystem vorhandene Dipeptid Carnosin, das als Antioxidans und Puffer wirkt) werden teils erst in der Tubulusepithelzelle zu Aminosäuren abgebaut (zytoplasmazische Peptidasen), nachdem sie über die Oligopeptid-Cotransporter PepT1 und PepT2 zusammen mit H+ aufgenommen wurden ( Abbildung).
Abbildung).
 Abbildung: Wie die Niere mit Proteinen umgeht
Abbildung: Wie die Niere mit Proteinen umgeht
 Abbildung). Dieser
Abbau kann Minuten bis Tage dauern. Einige Proteinmoleküle können dem
Abbau auch entgehen und gelangen transzytotisch direkt in das
Interstitium.
Abbildung). Dieser
Abbau kann Minuten bis Tage dauern. Einige Proteinmoleküle können dem
Abbau auch entgehen und gelangen transzytotisch direkt in das
Interstitium. s. dort).
s. dort). glomerulär filtriert (~0,8
M/d, d.h. 8-mal die tägliche orale Aufnahme),
glomerulär filtriert (~0,8
M/d, d.h. 8-mal die tägliche orale Aufnahme),
 im proximalen Tubulus zu ~80% (davon rund die Hälfte parazellulär durch den elektrischen Gradienten, der durch den Chlorideinstrom entsteht) und
im proximalen Tubulus zu ~80% (davon rund die Hälfte parazellulär durch den elektrischen Gradienten, der durch den Chlorideinstrom entsteht) und  in der aufsteigenden Henle-Schleife
zu ~10% rückresorbiert,
in der aufsteigenden Henle-Schleife
zu ~10% rückresorbiert,  im distalen Tubulus gar nicht (niedriges
Kaliumangebot) oder - abhängig von der
Kaliumbilanz unter
Einfluss von Aldosteron - zu 20-180% (der filtrierten Menge) - vom spätdistalen Tubulussystem (inklusive kortikalen Sammelrohren) sezerniert,
im distalen Tubulus gar nicht (niedriges
Kaliumangebot) oder - abhängig von der
Kaliumbilanz unter
Einfluss von Aldosteron - zu 20-180% (der filtrierten Menge) - vom spätdistalen Tubulussystem (inklusive kortikalen Sammelrohren) sezerniert, im
medulläres Sammelrohrsystem zu 6-40% der filtrierten Menge
rückresorbiert (höhere Werte bei exzessivem Kaliumangebot in der
Nahrung, was starke Sekretion in den distalen Tubulus zur Folge hat, s.
dort).
im
medulläres Sammelrohrsystem zu 6-40% der filtrierten Menge
rückresorbiert (höhere Werte bei exzessivem Kaliumangebot in der
Nahrung, was starke Sekretion in den distalen Tubulus zur Folge hat, s.
dort).
 Abbildung: Wie die Niere mit Kalium umgeht
Abbildung: Wie die Niere mit Kalium umgeht
 Abbildung):
Abbildung):  Die Kaliumresorption erfolgt im proximalen Tubulus
weitgehend passiv und folgt der Rückresorption von Kochsalz. Der
Mechanismus ist im proximalen Abschnitt solvent drag (Mitbewegen in
Filtrat), im distalen zunehmend auch parazelluläre Diffusion (durch das lumen-negative transepitheliale elektrische Potential im frühen distalen Tubulus erleichtert).
Die Kaliumresorption erfolgt im proximalen Tubulus
weitgehend passiv und folgt der Rückresorption von Kochsalz. Der
Mechanismus ist im proximalen Abschnitt solvent drag (Mitbewegen in
Filtrat), im distalen zunehmend auch parazelluläre Diffusion (durch das lumen-negative transepitheliale elektrische Potential im frühen distalen Tubulus erleichtert). Abbildung):
Abbildung):  Basolaterale Na+-K+-Pumpe,
Basolaterale Na+-K+-Pumpe, 
 basolateraler K+-Cl--Kotransport,
basolateraler K+-Cl--Kotransport,
 Diffusion durch K+-Kanäle (apikal - meist inaktiv, basolateral -
Öffnungswahrscheinlichkeit abhängig von Aktivität der Na/K-Pumpe)
Diffusion durch K+-Kanäle (apikal - meist inaktiv, basolateral -
Öffnungswahrscheinlichkeit abhängig von Aktivität der Na/K-Pumpe)
 Solvent drag (parazellulärer Weg)
Solvent drag (parazellulärer Weg)
 Im dicken aufsteigenden Schenkel der Henle-Schleife erfolgt die
Kaliumresorption jeweils zur Hälfte
Im dicken aufsteigenden Schenkel der Henle-Schleife erfolgt die
Kaliumresorption jeweils zur Hälfte  passiv-parazellulär (unterstützt
durch die positive Aufladung des Tubuluslumens) und
passiv-parazellulär (unterstützt
durch die positive Aufladung des Tubuluslumens) und 
 transzellulär, d.h.
über Na+/K+/2Cl--Kotransport (apikal) und K+-Permeasen - die basolaterale
Membran ist sowohl für K+ als auch für Cl- durchgängig.
transzellulär, d.h.
über Na+/K+/2Cl--Kotransport (apikal) und K+-Permeasen - die basolaterale
Membran ist sowohl für K+ als auch für Cl- durchgängig. Die Schaltzellen (intercalated cells) der kortikalen Sammelrohre spielen u.a. eine wesentliche Rolle für die H+-Sekretion. Dabei besteht eine Wechselwirkung mit der Kaliumresorption (
Die Schaltzellen (intercalated cells) der kortikalen Sammelrohre spielen u.a. eine wesentliche Rolle für die H+-Sekretion. Dabei besteht eine Wechselwirkung mit der Kaliumresorption ( Abbildung). K+
wird von der apikalen Membran aktiv in die Tubuluszelle transportiert
und verlässt sie basolateral über einen Kaliumkanal. Man unterscheidet
Schaltzellen vom Typ A (sezernieren H+ in das Tubuluslumen, z.T. im Austausch gegen Kalium,
Abbildung). K+
wird von der apikalen Membran aktiv in die Tubuluszelle transportiert
und verlässt sie basolateral über einen Kaliumkanal. Man unterscheidet
Schaltzellen vom Typ A (sezernieren H+ in das Tubuluslumen, z.T. im Austausch gegen Kalium,  Abbildung) und Typ B (sezernieren Bicarbonat im Austausch gegen Chlorid).
Abbildung) und Typ B (sezernieren Bicarbonat im Austausch gegen Chlorid).  Die Hauptzellen (principal cells) der
späten distalen Tubuli und kortikalen Sammelrohre können Kalium über Kotransport mit Chlorid oder über Kaliumkanäle sezernieren. Hier wie
auch überall sonst spielt die Na+-K+-Pumpe der basolateralen Membran eine aktive Rolle (
Die Hauptzellen (principal cells) der
späten distalen Tubuli und kortikalen Sammelrohre können Kalium über Kotransport mit Chlorid oder über Kaliumkanäle sezernieren. Hier wie
auch überall sonst spielt die Na+-K+-Pumpe der basolateralen Membran eine aktive Rolle ( Abbildung). Die apikale Membran verfügt über epitheliale Natriumkanäle (ENaCs), durch die Natriumionen in die Zelle gelangen können; steigt der Na+-Einstrom, lässt dieser ein stärker lumen-negatives Potential zurück, was wiederum den Ausstrom von Kalium fördert, d.h. kaliuretisch wirkt.
Abbildung). Die apikale Membran verfügt über epitheliale Natriumkanäle (ENaCs), durch die Natriumionen in die Zelle gelangen können; steigt der Na+-Einstrom, lässt dieser ein stärker lumen-negatives Potential zurück, was wiederum den Ausstrom von Kalium fördert, d.h. kaliuretisch wirkt. 
 Abbildung: Tubuläre Transportvorgänge und die Wirkung ausgewählter Pharmaka
Abbildung: Tubuläre Transportvorgänge und die Wirkung ausgewählter Pharmaka  Diuretika
steigern die Harnmenge durch Erhöhung der Salzausscheidung. Sie hemmen
die Natriumresorption und steigern dadurch die Natriummenge im
Tubulussystem. Durch
die Verknüpfung von Natriumresorption und Kaliumsekretion in den
Sammelrohren kommt es hier bei Erhöhung der Natriumresorption zu einem Kaliumverlust in den Harn.
Diuretika
steigern die Harnmenge durch Erhöhung der Salzausscheidung. Sie hemmen
die Natriumresorption und steigern dadurch die Natriummenge im
Tubulussystem. Durch
die Verknüpfung von Natriumresorption und Kaliumsekretion in den
Sammelrohren kommt es hier bei Erhöhung der Natriumresorption zu einem Kaliumverlust in den Harn. Abbildung), senken die Natriumresorption
im Sammelrohr und steigern (in Kombination mit anderen Diuretika, die an weiter proximal gelegenen Tubulusabschnitten - proximaler Tubulus, Henle-Schleife, frühdistaler Tubulus - angreifen) die Natriurese
bis auf 5% der glomerulär filtrierten Menge (normalerweise <1%). Sie werden also zur Verstärkung der
natriuretischen Wirkung anderer Diuretika verwendet; durch die Blockade apikaler Natriumkanäle reduzieren sie dabei das lumen-negative Potential der Sammelrohre und haben einen indirekt kaliumsparenden Effekt.
Abbildung), senken die Natriumresorption
im Sammelrohr und steigern (in Kombination mit anderen Diuretika, die an weiter proximal gelegenen Tubulusabschnitten - proximaler Tubulus, Henle-Schleife, frühdistaler Tubulus - angreifen) die Natriurese
bis auf 5% der glomerulär filtrierten Menge (normalerweise <1%). Sie werden also zur Verstärkung der
natriuretischen Wirkung anderer Diuretika verwendet; durch die Blockade apikaler Natriumkanäle reduzieren sie dabei das lumen-negative Potential der Sammelrohre und haben einen indirekt kaliumsparenden Effekt.
 Ein wesentlicher Faktor für die Kaliumausscheidung im distalen Nephron ist die Strömung
durch die Sammelrohre - je höher der Durchfluss (bei gegebener
Kaliumlast), desto mehr Kalium wird sezerniert. Aus diesem Grund wirkt
z.B. Volumenexpansion (Infusionen), osmotische Diurese (exzessives
Trinken) oder die Gabe bestimmter Diuretika (z.B. Furosemid)
kaliuretisch.
Ein wesentlicher Faktor für die Kaliumausscheidung im distalen Nephron ist die Strömung
durch die Sammelrohre - je höher der Durchfluss (bei gegebener
Kaliumlast), desto mehr Kalium wird sezerniert. Aus diesem Grund wirkt
z.B. Volumenexpansion (Infusionen), osmotische Diurese (exzessives
Trinken) oder die Gabe bestimmter Diuretika (z.B. Furosemid)
kaliuretisch. Eine weiterer Faktor ist das lumen-negative Potential im Sammelrohrsystem. Wird das Lumen stärker negativ - wie durch Zunahme des Eintritts von Na+ durch epitheliale Natriumkanäle (ENaCs) -, strömt mehr K+ durch apikale Kaliumkanäle aus der Epithelzelle (steigender elektrischer Gradient), die Kaliumausscheidung nimmt zu.
Eine weiterer Faktor ist das lumen-negative Potential im Sammelrohrsystem. Wird das Lumen stärker negativ - wie durch Zunahme des Eintritts von Na+ durch epitheliale Natriumkanäle (ENaCs) -, strömt mehr K+ durch apikale Kaliumkanäle aus der Epithelzelle (steigender elektrischer Gradient), die Kaliumausscheidung nimmt zu. Die luminale Chloridkonzentration
wirkt sich ebenfalls auf die Kaliumsekretion aus: Nimmt sie ab (z.B.
durch Substitution durch ein anderes Anion, wie Sulfat oder Bicarbonat), steigt die K+-Ausscheidung. Wahrscheinlich
wirkt dieser Effekt über den apikalen K/Cl-Cotransport (
Die luminale Chloridkonzentration
wirkt sich ebenfalls auf die Kaliumsekretion aus: Nimmt sie ab (z.B.
durch Substitution durch ein anderes Anion, wie Sulfat oder Bicarbonat), steigt die K+-Ausscheidung. Wahrscheinlich
wirkt dieser Effekt über den apikalen K/Cl-Cotransport ( Abbildung
oben), der durch niedriges luminales [Cl-] angeregt wird.
Abbildung
oben), der durch niedriges luminales [Cl-] angeregt wird.  Zu den Kalium-Austauschmengen in den Nierenabschnitten s. dort
Zu den Kalium-Austauschmengen in den Nierenabschnitten s. dort Zur hormonellen Steuerung der Kaliumbilanz s. dort
Zur hormonellen Steuerung der Kaliumbilanz s. dort
 Abbildung: Resorption von Ca++ im Nephron
Abbildung: Resorption von Ca++ im Nephron
 Abbildung)
Abbildung) zu ~65% vom proximalen Tubulus
(via parazelluläre Diffusion: Durch die Rückresorption von Flüssigkeit
steigt die Calciumkonzentration, es entsteht ein entsprechender
Konzentrationsgradient)
zu ~65% vom proximalen Tubulus
(via parazelluläre Diffusion: Durch die Rückresorption von Flüssigkeit
steigt die Calciumkonzentration, es entsteht ein entsprechender
Konzentrationsgradient) zu ~25% im aufsteigenden (dicken) Teil der Henle-Schleife - teils parazellulär,
angetrieben durch das lumen-positive Potential (Antrieb: Na/K/2Cl- Cotransporter und K+-Rückdiffusion in das Lumen), teils
aktiv-transzellulär unter Beteiligung des Calcium-sensing receptor CaSR in der basolateralen Membran der Tubuluszellen. Bindung von Ca++ an den CaSR reduziert die Ca++-Rückresorption
zu ~25% im aufsteigenden (dicken) Teil der Henle-Schleife - teils parazellulär,
angetrieben durch das lumen-positive Potential (Antrieb: Na/K/2Cl- Cotransporter und K+-Rückdiffusion in das Lumen), teils
aktiv-transzellulär unter Beteiligung des Calcium-sensing receptor CaSR in der basolateralen Membran der Tubuluszellen. Bindung von Ca++ an den CaSR reduziert die Ca++-Rückresorption Der Rest auf etwa 99% wird im distalen Tubulus (~8%) und Sammelrohr (~1%) resorbiert - apikal dem elektrochemischen Gradienten folgend über Calciumkanäle (transient receptor potential cation family subfamily V member 5 / 6, TRPV5 und TRPV6), basolateral über Na/Ca-Antiport (sodium-calcium exchanger NCX1) und eine Ca++-ATPase (PMCA1b, plasma membrane Clcium ATPase). Parathormon stimuliert in der basolateralen Membran des distalen Tubulus Ca++-Exportpumpen (PMCA) und einen Na+-Ca++-Austauscher (NCX), Calcium gelangt über die basolaterale Membran in Interstitium und Blut.
Der Rest auf etwa 99% wird im distalen Tubulus (~8%) und Sammelrohr (~1%) resorbiert - apikal dem elektrochemischen Gradienten folgend über Calciumkanäle (transient receptor potential cation family subfamily V member 5 / 6, TRPV5 und TRPV6), basolateral über Na/Ca-Antiport (sodium-calcium exchanger NCX1) und eine Ca++-ATPase (PMCA1b, plasma membrane Clcium ATPase). Parathormon stimuliert in der basolateralen Membran des distalen Tubulus Ca++-Exportpumpen (PMCA) und einen Na+-Ca++-Austauscher (NCX), Calcium gelangt über die basolaterale Membran in Interstitium und Blut. s. auch dort).
s. auch dort).  Dickwandiger Teil des aufsteigenden Schenkels der Henle-Schleife: Sogenannte Schleifendiuretika - z.B. Furosemid - hemmen den luminalen Na/K/2Cl-Symport (
Dickwandiger Teil des aufsteigenden Schenkels der Henle-Schleife: Sogenannte Schleifendiuretika - z.B. Furosemid - hemmen den luminalen Na/K/2Cl-Symport ( Abbildung oben).
Dadurch steigern sie die Natriumzufuhr an den distalen Tubulus und
können bis zu 25% des glomerulär filtrierten Natriums zur Ausscheidung
bringen (intensive Diurese / Natriurese). Furosemid verringert
das lumen-positive Potential und reduziert dadurch die Ca++-Resorption (Anwendung bei Hypercalcämie).
Abbildung oben).
Dadurch steigern sie die Natriumzufuhr an den distalen Tubulus und
können bis zu 25% des glomerulär filtrierten Natriums zur Ausscheidung
bringen (intensive Diurese / Natriurese). Furosemid verringert
das lumen-positive Potential und reduziert dadurch die Ca++-Resorption (Anwendung bei Hypercalcämie). Abbildung), der größte Teil im dicken Teil des aufsteigenden Schenkels der Henle-Schleife (nicht, wie bei den meisten anderen Stoffen, im proximalen Tubulus, der nur etwa 15% der Rückresorption von Mg++ übernimmt):
Abbildung), der größte Teil im dicken Teil des aufsteigenden Schenkels der Henle-Schleife (nicht, wie bei den meisten anderen Stoffen, im proximalen Tubulus, der nur etwa 15% der Rückresorption von Mg++ übernimmt):
 Abbildung: Magnesium- Rückresorption in der Niere
Abbildung: Magnesium- Rückresorption in der Niere ~15% im proximalen Tubulus im Gefolge der Natrium- und Wasserresorption, welche Magnesium im Tubuluslumen anreichert, sowie durch solvent drag (mit Wasser)
~15% im proximalen Tubulus im Gefolge der Natrium- und Wasserresorption, welche Magnesium im Tubuluslumen anreichert, sowie durch solvent drag (mit Wasser) ~70% im dicken aufsteigenden Schenkel der Henle-Schleife - parazellulär, abhängig von der Natrium- und Kaliumresorption mittels NKCC2 (Na+-K+-2Cl−- cotransporter). Die Claudine 16 und 19 ermöglichen die Magnesium-Permeabilität.
~70% im dicken aufsteigenden Schenkel der Henle-Schleife - parazellulär, abhängig von der Natrium- und Kaliumresorption mittels NKCC2 (Na+-K+-2Cl−- cotransporter). Die Claudine 16 und 19 ermöglichen die Magnesium-Permeabilität. 10% des filtrierten Magnesiums werden im distalen Tubulus rückresorbiert - reguliert durch hormonelle Einflüsse.
10% des filtrierten Magnesiums werden im distalen Tubulus rückresorbiert - reguliert durch hormonelle Einflüsse. 

 10-25% des filtrierten Magnesiums werden im proximalen Tubulus resorbiert - parazellulär via tight junctions -, erleichtert durch die Konzentrieriung von Mg++ durch die Resorption von Natrium (durch NHE3) und Wasser (durch Aquaporin 1).
10-25% des filtrierten Magnesiums werden im proximalen Tubulus resorbiert - parazellulär via tight junctions -, erleichtert durch die Konzentrieriung von Mg++ durch die Resorption von Natrium (durch NHE3) und Wasser (durch Aquaporin 1). Der
größte Teil (50-70%) des filtrierten Magnesiums wird vom dicken Teil des aufsteigenden
Schenkels der Henle-Schleife rückresorbiert (hauptsächlich
parazellulär: Claudin
16
Der
größte Teil (50-70%) des filtrierten Magnesiums wird vom dicken Teil des aufsteigenden
Schenkels der Henle-Schleife rückresorbiert (hauptsächlich
parazellulär: Claudin
16  , auch Paracellin genannt, ist ein Bestandteil von tight junctions und kontrolliert die parazelluläre Diffusion - Mutationen dieses Moleküls können zu Magnesiumverlust führen. Das lumen-positive Potential - bestimmt durch die Aktivität des Na/K/Cl-Cotransporters NKCC2 und die Sekretion von K+ an der apikalen Membran - treibt die Magnesiumionen blutwärts.
, auch Paracellin genannt, ist ein Bestandteil von tight junctions und kontrolliert die parazelluläre Diffusion - Mutationen dieses Moleküls können zu Magnesiumverlust führen. Das lumen-positive Potential - bestimmt durch die Aktivität des Na/K/Cl-Cotransporters NKCC2 und die Sekretion von K+ an der apikalen Membran - treibt die Magnesiumionen blutwärts. 10% resorbiert das Sammelrohrsystem; diese komplexen Mechanismen werden durch
Insulin, Östrogene und Wachstumsfaktoren (Endothelialer Wachstumsfaktor EGF) rezeptorvermittelt (über Phosphoinositol-3-Kinase) positiv beeinflusst: Sie fördern die Expression von TRPM6 (transient receptor potential melastatin type 6), das die Mg++-Aufnahme
verstärkt.
10% resorbiert das Sammelrohrsystem; diese komplexen Mechanismen werden durch
Insulin, Östrogene und Wachstumsfaktoren (Endothelialer Wachstumsfaktor EGF) rezeptorvermittelt (über Phosphoinositol-3-Kinase) positiv beeinflusst: Sie fördern die Expression von TRPM6 (transient receptor potential melastatin type 6), das die Mg++-Aufnahme
verstärkt.  Etwa
5% des
glomerulär filtrierten Magnesiums werden im Harn ausgeschieden, abgestimmt auf die Netto-Resorption im Darm (ca. 100 mg/d).
Etwa
5% des
glomerulär filtrierten Magnesiums werden im Harn ausgeschieden, abgestimmt auf die Netto-Resorption im Darm (ca. 100 mg/d).



 Abbildung unten).
Abbildung unten).
 Abbildung: Wie die Niere mit Phosphat umgeht
Abbildung: Wie die Niere mit Phosphat umgeht
 Abbildung): NaPi-IIa, NaPi-IIc und PiT-2 (Pi = inorganic phosphate, "anorganisches" Phosphat). Basolateral verlässt Phosphat die Zelle über einen noch unklaren Mechanismus. Das distale Tubulussystem trägt kaum zum Phosphataustausch bei.
Abbildung): NaPi-IIa, NaPi-IIc und PiT-2 (Pi = inorganic phosphate, "anorganisches" Phosphat). Basolateral verlässt Phosphat die Zelle über einen noch unklaren Mechanismus. Das distale Tubulussystem trägt kaum zum Phosphataustausch bei. Abbildung).
Abbildung).
 Abbildung: Phosphat-"Titrationskurven"
Abbildung: Phosphat-"Titrationskurven"
 Abbildung sind um den Betrag des tubulären Maximums für Phosphat
parallel zueinander verschoben).
Abbildung sind um den Betrag des tubulären Maximums für Phosphat
parallel zueinander verschoben). Der wichtigste Einfluss auf die Phosphatbilanz der Niere ist das Phosphatangebot: Erhöhter
Plasma-Phosphatspiegel steigert
die renale Ausscheidung von Phosphat, während Phosphatmangel die tubulären
Phosphattransporter hinaufreguliert und die Ausscheidung minimiert.
Der wichtigste Einfluss auf die Phosphatbilanz der Niere ist das Phosphatangebot: Erhöhter
Plasma-Phosphatspiegel steigert
die renale Ausscheidung von Phosphat, während Phosphatmangel die tubulären
Phosphattransporter hinaufreguliert und die Ausscheidung minimiert.
 Abbildung: Wirkungen des Parathormons
Abbildung: Wirkungen des Parathormons
 Abbildung) - und vom Säure-Basen-Gleichgewicht ab.
Abbildung) - und vom Säure-Basen-Gleichgewicht ab. Die Phosphatausscheidung steigt durch
Die Phosphatausscheidung steigt durch  Parathormon: PTH bindet an PTH1-Rezeptoren (rasche Wirkung: G-Protein-gekoppelter Rezeptor; Gαs aktiviert Adenylatzyklase: cAMP → Proteinkinase A; Gαq aktiviert Phospholipase C → Proteinkinase C). PKA und PKC bewirken Endozytose und lysosomalen Abbau - und damit Herunterregulierung - des Na/P-Cotransporters an der apikalen Membran
der Tubuluszellen. Damit wird weniger Phosphat resorbiert (und mehr ausgeschieden)
Parathormon: PTH bindet an PTH1-Rezeptoren (rasche Wirkung: G-Protein-gekoppelter Rezeptor; Gαs aktiviert Adenylatzyklase: cAMP → Proteinkinase A; Gαq aktiviert Phospholipase C → Proteinkinase C). PKA und PKC bewirken Endozytose und lysosomalen Abbau - und damit Herunterregulierung - des Na/P-Cotransporters an der apikalen Membran
der Tubuluszellen. Damit wird weniger Phosphat resorbiert (und mehr ausgeschieden) hohes Angebot mit der Nahrung (über steigenden
Phosphatspiegel)
hohes Angebot mit der Nahrung (über steigenden
Phosphatspiegel) Calcitonin
Calcitonin Azidose (Phosphatpuffer reduzieren den pH-Abfall im Harn)
Azidose (Phosphatpuffer reduzieren den pH-Abfall im Harn) Parathormon erhöht die Phosphatresorption
in Darm und Knochen und senkt sie gleichzeitig in den Nieren (die Ausscheidung in den Harn steigt an). Diese beiden Effekte balancieren sich normalerweise aus, sodass Parathormon den Phosphatspiegel im Blut kaum beeinflusst.
Parathormon erhöht die Phosphatresorption
in Darm und Knochen und senkt sie gleichzeitig in den Nieren (die Ausscheidung in den Harn steigt an). Diese beiden Effekte balancieren sich normalerweise aus, sodass Parathormon den Phosphatspiegel im Blut kaum beeinflusst. Harnstoff (urea) stammt aus dem Eiweißabbau in der Leber; es stellt das führende stickstoffhältige Ausscheidungsprodukt aus dem Proteinstoffwechsel dar. Harnstoff wird glomerulär frei filtriert, etwa die Hälfte davon
wird im proximalen Tubulus (passiv) rückresorbiert (
Harnstoff (urea) stammt aus dem Eiweißabbau in der Leber; es stellt das führende stickstoffhältige Ausscheidungsprodukt aus dem Proteinstoffwechsel dar. Harnstoff wird glomerulär frei filtriert, etwa die Hälfte davon
wird im proximalen Tubulus (passiv) rückresorbiert ( Abbildung).
Abbildung). 
 Abbildung: Wie die Niere mit Harnstoff umgeht
Abbildung: Wie die Niere mit Harnstoff umgeht
 Die oberen (rindennahen) Teile der Sammelrohre sind für Harnstoff undurchlässig, daher wird Harnstoff im Sammelrohr konzentriert,
wenn Wasser in das Mark diffundiert (ermöglicht durch Aquaporine, die
durch Vasopressinwirkung in die Epithelzellen eingelagert werden).
Die oberen (rindennahen) Teile der Sammelrohre sind für Harnstoff undurchlässig, daher wird Harnstoff im Sammelrohr konzentriert,
wenn Wasser in das Mark diffundiert (ermöglicht durch Aquaporine, die
durch Vasopressinwirkung in die Epithelzellen eingelagert werden). UT-A1 in der apikalen Membran von Sammelrohrzellen wird durch
Vasopressin aktiviert und resorbiert ~70% der filtrierten
Harnstoffmenge
UT-A1 in der apikalen Membran von Sammelrohrzellen wird durch
Vasopressin aktiviert und resorbiert ~70% der filtrierten
Harnstoffmenge UT-A2 transportiert Harnstoff über die apikale Membran
in das Lumen der absteigenden Henle-Schleife
UT-A2 transportiert Harnstoff über die apikale Membran
in das Lumen der absteigenden Henle-Schleife UT-A3 bringt Harnstoff
aus dem inneren Sammelrohr in das Interstitium. Es wird durch
Vasopressin aktiviert
UT-A3 bringt Harnstoff
aus dem inneren Sammelrohr in das Interstitium. Es wird durch
Vasopressin aktiviert 
 Abbildung: Harnstofftransport über Abschnitte des Nephron
Abbildung: Harnstofftransport über Abschnitte des Nephron
 Harnstoff wird über die Wand proximaler
Tubuli sowohl para- (z.T. via solvent drag) als auch transzellulär
(Transporter unklar) etwa zur Hälfte der glomerulär filtrierten Menge
in das Blut rückresorbiert.
Harnstoff wird über die Wand proximaler
Tubuli sowohl para- (z.T. via solvent drag) als auch transzellulär
(Transporter unklar) etwa zur Hälfte der glomerulär filtrierten Menge
in das Blut rückresorbiert. Im absteigenden Schenkel der Henle-Schleife juxtamedullärer Nephrone
ist die interstitielle Harnstoffkonzentration größer als die luminale;
daher diffundiert Harnstoff in den Tubulus (apikal und basolateral via UT-A2).
Auch der dünne aufsteigende Schenkel nimmt Harnstoff aus dem
Interstitium auf (wahrscheinlich ebenfalls via erleichterte Diffusion) -
Harnstoff wird also in den Tubulus befördert.
Im absteigenden Schenkel der Henle-Schleife juxtamedullärer Nephrone
ist die interstitielle Harnstoffkonzentration größer als die luminale;
daher diffundiert Harnstoff in den Tubulus (apikal und basolateral via UT-A2).
Auch der dünne aufsteigende Schenkel nimmt Harnstoff aus dem
Interstitium auf (wahrscheinlich ebenfalls via erleichterte Diffusion) -
Harnstoff wird also in den Tubulus befördert.  Die Henle-Schleife oberflächlicher
(rindennaher) Nephrone erstreckt sich nur bis in die äußere
Markschicht. Auch diese Nephrone bringen Harnstoff in den Tubulus der
Henle-Schleife (die vermutlich auf voller Länge über UT-A2 verfügt),
den die Blutgefäße aus dem inneren Mark konzentriert antransportieren.
Die Henle-Schleife oberflächlicher
(rindennaher) Nephrone erstreckt sich nur bis in die äußere
Markschicht. Auch diese Nephrone bringen Harnstoff in den Tubulus der
Henle-Schleife (die vermutlich auf voller Länge über UT-A2 verfügt),
den die Blutgefäße aus dem inneren Mark konzentriert antransportieren.  Zusammen bringen die Nephrone mehr (~110%) als die glomerulär filtrierte Menge zum distalen Tubulussystem. ~30%
werden hier wieder rückresorbiert, der Rest kommt in die
Sammelrohre und nimmt an der Nachlieferung von Harnstoff ins Mark teil
('closed-loop-System').
Zusammen bringen die Nephrone mehr (~110%) als die glomerulär filtrierte Menge zum distalen Tubulussystem. ~30%
werden hier wieder rückresorbiert, der Rest kommt in die
Sammelrohre und nimmt an der Nachlieferung von Harnstoff ins Mark teil
('closed-loop-System').  Auch die Epithelzellen der unteren Sammelrohre (inneres Mark) verfügen über Harnstofftransporter (apikal UT-A1, basolateral vermutlich UT-A3).
Auch die Epithelzellen der unteren Sammelrohre (inneres Mark) verfügen über Harnstofftransporter (apikal UT-A1, basolateral vermutlich UT-A3). Durch die Kapillarwände gelangt Harnstoff mittels UT3-Transporter.
Durch die Kapillarwände gelangt Harnstoff mittels UT3-Transporter. Im unteren Sammelrohr
diffundiert Harnstoff aus dem Tubulus
in das Intertstitium - seinem Konzentrationsgradienten folgend -, wenn
unter dem Einfluss von Vasopressin (ADH) Harnstofftransporter in die
Wand der unteren Sammelrohre eingelagert werden.
Im unteren Sammelrohr
diffundiert Harnstoff aus dem Tubulus
in das Intertstitium - seinem Konzentrationsgradienten folgend -, wenn
unter dem Einfluss von Vasopressin (ADH) Harnstofftransporter in die
Wand der unteren Sammelrohre eingelagert werden.  Abbildung). Mit anderen Worten:
Abbildung). Mit anderen Worten:  Knapp die Hälfte des filtrierten Harnstoffs wird mit dem Harn ausgeschieden
Knapp die Hälfte des filtrierten Harnstoffs wird mit dem Harn ausgeschieden
 Harnsäure bzw. ihre Salze (Urate) sind Abbauprodukte von Purinen. Ihre Konzentration im Blutplasma beträgt 0,2-0,4, im glomeruläre Filtrat ≤0,25 mM/l. Urat wird
Harnsäure bzw. ihre Salze (Urate) sind Abbauprodukte von Purinen. Ihre Konzentration im Blutplasma beträgt 0,2-0,4, im glomeruläre Filtrat ≤0,25 mM/l. Urat wird zu 99% rückresorbiert, dann
zu 99% rückresorbiert, dann
 zu ~50% (der filtrierten Menge) sezerniert und
zu ~50% (der filtrierten Menge) sezerniert und  wieder zu ~40%
resorbiert (alles im proximalen Tubulus).
wieder zu ~40%
resorbiert (alles im proximalen Tubulus).
 Abbildung: Wie die Niere mit Harnsäure umgeht
Abbildung: Wie die Niere mit Harnsäure umgeht
 Abbildung). Im frühen proximalen Tubulus überwiegt der
transzelluläre Mechanismus (Aufnahme über die luminale Membran, s. oben). Der
parazelluläre Weg folgt dem Urat-Konzentrationsgradienten.
Abbildung). Im frühen proximalen Tubulus überwiegt der
transzelluläre Mechanismus (Aufnahme über die luminale Membran, s. oben). Der
parazelluläre Weg folgt dem Urat-Konzentrationsgradienten. Harnsäure (uric acid)
Harnsäure (uric acid) Viele Medikamente
werden aus dem Blut direkt in die Tubuli sezerniert - z.B. Penizillin.
(Antibiotika werden auch über den Schweiß ausgeschieden - dieser
Umstand kann zur Bildung von Resistenzen beitragen.)
Viele Medikamente
werden aus dem Blut direkt in die Tubuli sezerniert - z.B. Penizillin.
(Antibiotika werden auch über den Schweiß ausgeschieden - dieser
Umstand kann zur Bildung von Resistenzen beitragen.) Stoffe wie
Jod- oder Aminohippuran,
Para-Amino-Hippursäure (PAH -
Stoffe wie
Jod- oder Aminohippuran,
Para-Amino-Hippursäure (PAH -  Abbildung) werden aus fast der
gesamten
Plasmamenge, das durch die Niere strömt, entfernt - filtriert (zu
>80%) und vom proximalen Tubulus sezerniert (~90%, falls die
Konzentration nicht zu hoch und das tubuläre Maximum nicht
überschritten ist).
Abbildung) werden aus fast der
gesamten
Plasmamenge, das durch die Niere strömt, entfernt - filtriert (zu
>80%) und vom proximalen Tubulus sezerniert (~90%, falls die
Konzentration nicht zu hoch und das tubuläre Maximum nicht
überschritten ist). 
 Der proximale Tubulus ist aufgrund seiner Enzymausstattung voll auf oxidative Energiegewinnung
ausgelegt - der glykolytische Weg ist ihm verschlossen. Das bedeutet,
dass ausreichende Blut- und Sauerstoffzufuhr gegeben sein
muss, sonst besteht die Gefahr eines akuten Nierenversagens.
Der proximale Tubulus ist aufgrund seiner Enzymausstattung voll auf oxidative Energiegewinnung
ausgelegt - der glykolytische Weg ist ihm verschlossen. Das bedeutet,
dass ausreichende Blut- und Sauerstoffzufuhr gegeben sein
muss, sonst besteht die Gefahr eines akuten Nierenversagens. ) kann durch vererbte Stoffwechseldefekte,
Sauerstoffmangel oder Vergiftungen auftreten (erniedrigtes ATP in den
Tubuluszellen .. blockierte Na-K-Pumpe).
) kann durch vererbte Stoffwechseldefekte,
Sauerstoffmangel oder Vergiftungen auftreten (erniedrigtes ATP in den
Tubuluszellen .. blockierte Na-K-Pumpe). Anstieg der extrazellulären Harnsäurekonzentration kann zur Präzipitation z.B. in Gelenken führen (Gicht). Urikosurika erhöhen
den ausgeschiedenen Uratanteil, der
sogar über der filtrierten Menge liegen kann (hohe Sekretion). Sie
wirken im Allgemeinen, indem sie den URAT1-Transporter hemmen.
Anstieg der extrazellulären Harnsäurekonzentration kann zur Präzipitation z.B. in Gelenken führen (Gicht). Urikosurika erhöhen
den ausgeschiedenen Uratanteil, der
sogar über der filtrierten Menge liegen kann (hohe Sekretion). Sie
wirken im Allgemeinen, indem sie den URAT1-Transporter hemmen.
 Der proximale Tubulus resorbiert 60-80% der glomerulär filtrierten Flüssigkeitsmenge; er ist reich an Mitochondrien.
20-40% des filtrierten Volumens betritt die Henle-Schleife,
bestehend aus einem dünnwandigen absteigenden (wasserdurchlässigen) und einem dickwandigen
aufsteigenden Schenkel (Resorption von 5-10% der filtrierten
Flüssigkeitsmenge, Aufbau eines osmotischen Gradienten). Im distalen Tubulus / Sammelrohr
erfolgt eine Feineinstellung von Stoffmengen und Osmolarität (Vasopressin: Wasserresorption,
Aldosteron: Natriumresorption, natriuretische Peptide: Natriumausscheidung).
Tubuluszellen bauen auch Peptidhormone (Angiotensine, Glukagon,
Bradykinin) ab
Der proximale Tubulus resorbiert 60-80% der glomerulär filtrierten Flüssigkeitsmenge; er ist reich an Mitochondrien.
20-40% des filtrierten Volumens betritt die Henle-Schleife,
bestehend aus einem dünnwandigen absteigenden (wasserdurchlässigen) und einem dickwandigen
aufsteigenden Schenkel (Resorption von 5-10% der filtrierten
Flüssigkeitsmenge, Aufbau eines osmotischen Gradienten). Im distalen Tubulus / Sammelrohr
erfolgt eine Feineinstellung von Stoffmengen und Osmolarität (Vasopressin: Wasserresorption,
Aldosteron: Natriumresorption, natriuretische Peptide: Natriumausscheidung).
Tubuluszellen bauen auch Peptidhormone (Angiotensine, Glukagon,
Bradykinin) ab Tubulusepithelzellen sind reichlich mit
Mikrovilli ausgestattet (große Resorptionsoberfläche), auch die basolaterale Membran verfügt
über zahlreiche Einstülpungen. Der Natriumgradient treibt im proximalen Tubulus den Symport
von Glucose und Aminosäuren an, auch die Sekretion von H+. Basolaterale Na+-Anreicherung saugt Wasser
osmotisch aus dem Tubulus, sowohl trans- (Aquaporin)
als auch parazellulär (tight junctions). Diese Strömung nimmt gelöste
Teilchen mit (solvent drag), erhöht den hydrostatischen Druck.
Die Rückresorption erfolgt isoosmotisch, die proximalen Tubuli sind mit Aquaporinen
ausgestattet
Tubulusepithelzellen sind reichlich mit
Mikrovilli ausgestattet (große Resorptionsoberfläche), auch die basolaterale Membran verfügt
über zahlreiche Einstülpungen. Der Natriumgradient treibt im proximalen Tubulus den Symport
von Glucose und Aminosäuren an, auch die Sekretion von H+. Basolaterale Na+-Anreicherung saugt Wasser
osmotisch aus dem Tubulus, sowohl trans- (Aquaporin)
als auch parazellulär (tight junctions). Diese Strömung nimmt gelöste
Teilchen mit (solvent drag), erhöht den hydrostatischen Druck.
Die Rückresorption erfolgt isoosmotisch, die proximalen Tubuli sind mit Aquaporinen
ausgestattet Der absteigende Schenkel der Henle-Schleife ist für Wasser
und Harnstoff durchgängig - sowohl parazellulär als auch transzellulär (Aquaporin 1). Der dicke aufsteigende Schenkel ist nicht wasserdurchlässig, aber intensiv mit Ionenpumpen ausgestattet (hohe Zahl an Na/K-ATPasen, viele Mitochondrien).
Etwa 75% der gelösten Stoffe (Natrium, Chlorid, Bicarbonat u.a.) werden
in das Nierenmark befördert (Erhaltung hoher Osmolarität), der Inhalt des Tubulus gelangt
hypoosmotisch (~50 mOsm) in die Rindenzone
Der absteigende Schenkel der Henle-Schleife ist für Wasser
und Harnstoff durchgängig - sowohl parazellulär als auch transzellulär (Aquaporin 1). Der dicke aufsteigende Schenkel ist nicht wasserdurchlässig, aber intensiv mit Ionenpumpen ausgestattet (hohe Zahl an Na/K-ATPasen, viele Mitochondrien).
Etwa 75% der gelösten Stoffe (Natrium, Chlorid, Bicarbonat u.a.) werden
in das Nierenmark befördert (Erhaltung hoher Osmolarität), der Inhalt des Tubulus gelangt
hypoosmotisch (~50 mOsm) in die Rindenzone Distaler
Tubulus und Sammelrohr übernehmen die - teils hormongesteuerte -
"Feinabstimmung" des renalen Stoffmanagements. Hauptzellen resorbieren
Kochsalz und sezernieren Kalium (lumen-negatives Potential),
Zwischenzellen sezernieren Protonen und resorbieren Kalium und
Bicarbonat. Die Wand der Sammelrohre ist genuin wasserundurchlässig,
Einlagerung von Aquaporinen (über Wirkung von Vasopressin) ermöglicht
die Resorption von Wasser (bis zu ~20 l/d)
Distaler
Tubulus und Sammelrohr übernehmen die - teils hormongesteuerte -
"Feinabstimmung" des renalen Stoffmanagements. Hauptzellen resorbieren
Kochsalz und sezernieren Kalium (lumen-negatives Potential),
Zwischenzellen sezernieren Protonen und resorbieren Kalium und
Bicarbonat. Die Wand der Sammelrohre ist genuin wasserundurchlässig,
Einlagerung von Aquaporinen (über Wirkung von Vasopressin) ermöglicht
die Resorption von Wasser (bis zu ~20 l/d)  Nichtflüchtige pH-wirksame Substanzen werden über die Nieren ausgeschieden - bei üblicher Ernährung 50-100 mM/d saure Valenzen (titrierbare"
Säure im Harn: Phosphate aus Nukleinsäuren, Sulfate aus
schwefelhaltigen Aminosäuren, Urate aus Nukleotiden, Oxalate aus
Stoffwechsel / Ernährung, Lactate aus Glucoseabbau, Ketonkörper aus
Fettsäuren), bei vegetarischer Kost oder metabolischer Alkalose basische Valenzen. Das Phosphatsystem puffert den Harn, Bicarbonat ist im Harn meist nicht vorhanden. Der proximale Tubulus gewinnt mittels Na/H-Antiport ~90% des filtrierten Bicarbonats zurück, der Rest wird distal resorbiert. Die Nieren bilden üblicherweise ~70 mM/d Bicarbonatpuffer neu, ohne Carboanhydrasewirkung sinkt die H+-Ausscheidung (Azidose). Werden Säuren abgepuffert, entsteht aus Bicarbonat CO2 (wird abgeatmet)
Nichtflüchtige pH-wirksame Substanzen werden über die Nieren ausgeschieden - bei üblicher Ernährung 50-100 mM/d saure Valenzen (titrierbare"
Säure im Harn: Phosphate aus Nukleinsäuren, Sulfate aus
schwefelhaltigen Aminosäuren, Urate aus Nukleotiden, Oxalate aus
Stoffwechsel / Ernährung, Lactate aus Glucoseabbau, Ketonkörper aus
Fettsäuren), bei vegetarischer Kost oder metabolischer Alkalose basische Valenzen. Das Phosphatsystem puffert den Harn, Bicarbonat ist im Harn meist nicht vorhanden. Der proximale Tubulus gewinnt mittels Na/H-Antiport ~90% des filtrierten Bicarbonats zurück, der Rest wird distal resorbiert. Die Nieren bilden üblicherweise ~70 mM/d Bicarbonatpuffer neu, ohne Carboanhydrasewirkung sinkt die H+-Ausscheidung (Azidose). Werden Säuren abgepuffert, entsteht aus Bicarbonat CO2 (wird abgeatmet) Durch Ausscheidung von Ammoniumionen können saure Valenzen aus dem Körper entfernt werden (NH3
ist fettlöslich, Ammonium bleibt im Tubulus). Quelle des dazu
benötigten Stickstoffs ist Glutamin (1/5 des extrazellulären
Aminosäurepools). Der proximale Tubulus gewinnt Glutamin aus Filtrat
und Blut und verwandelt es in Ammonium und α-Ketoglutarat (aus dem
Bicarbonat gewonnen wird: nur ausgeschiedenes Ammonium entlastet den
Pufferstatus). Die Ammoniumsynthese kann fallweise 10-fach
gesteigert werden. Bei der
Metabolisierung von Glutamin fällt Glucose an (die Nieren bestreiten ~20%, im Hungerzustand, bei metabolischer Azidose oder Hypokaliämie bis zu 45% der Glucoseversorgung des Körpers)
Durch Ausscheidung von Ammoniumionen können saure Valenzen aus dem Körper entfernt werden (NH3
ist fettlöslich, Ammonium bleibt im Tubulus). Quelle des dazu
benötigten Stickstoffs ist Glutamin (1/5 des extrazellulären
Aminosäurepools). Der proximale Tubulus gewinnt Glutamin aus Filtrat
und Blut und verwandelt es in Ammonium und α-Ketoglutarat (aus dem
Bicarbonat gewonnen wird: nur ausgeschiedenes Ammonium entlastet den
Pufferstatus). Die Ammoniumsynthese kann fallweise 10-fach
gesteigert werden. Bei der
Metabolisierung von Glutamin fällt Glucose an (die Nieren bestreiten ~20%, im Hungerzustand, bei metabolischer Azidose oder Hypokaliämie bis zu 45% der Glucoseversorgung des Körpers)  Transporter haben eine begrenzte Förderkapazität (tubuläres Maximum) - wird diese überschritten, wird ein Teil der betreffenden Substanz mit dem Harn ausgeschieden. Der Nüchtern-Blutzuckerspiegel beträgt ~90 mg/dl, die Schwellenkonzentration ~200 mg/dl (~240 mg/min Glucose filtriert,
ab diesen Werten gelangt Glucose in den Harn: Glukosurie),
bei 300-400 mg/dl sind sämtliche Tubuli am Transportmaximum für Glucose
angelangt, bei weiterer Steigerung nimmt die Glucoseausscheidung linear
mit dem Blutzuckerspiegel zu. Aminosäuren haben niedrige tubuläre Transportmaxima, bei erhöhten Blutwerten kommt es zu partieller
Ausscheidung (Stabilisierung der Plasmawerte)
Transporter haben eine begrenzte Förderkapazität (tubuläres Maximum) - wird diese überschritten, wird ein Teil der betreffenden Substanz mit dem Harn ausgeschieden. Der Nüchtern-Blutzuckerspiegel beträgt ~90 mg/dl, die Schwellenkonzentration ~200 mg/dl (~240 mg/min Glucose filtriert,
ab diesen Werten gelangt Glucose in den Harn: Glukosurie),
bei 300-400 mg/dl sind sämtliche Tubuli am Transportmaximum für Glucose
angelangt, bei weiterer Steigerung nimmt die Glucoseausscheidung linear
mit dem Blutzuckerspiegel zu. Aminosäuren haben niedrige tubuläre Transportmaxima, bei erhöhten Blutwerten kommt es zu partieller
Ausscheidung (Stabilisierung der Plasmawerte) Ca++
wird zu 65-70% im proximalen Tubulus (parazellulär) resorbiert, zu 25%
im aufsteigenden Teil der Henle-Schleife (parazellulär und
transzellulär unter Kontrolle von Parathormon), der Rest auf 99,5% im
distalen Tubulus und Sammelrohr. Ca++-Ionen
dringen über epitheliale Calciumkanäle leicht in Tubuluszellen
ein (Konzentrationsdifferenz plus Membranpotential), binden an
Calmodulin (Aufrechterhaltung des Konzentrationsgradienten) und werden aktiv über die basolaterale Membran der Tubuluszelle
transportiert (Na/Ca-Antiport und Ca-ATPase). ~200 mg/d werden im Harn ausgeschieden, bei Immobilität (→ Knochenabbau) nimmt die Ca++-Ausscheidung zu
Ca++
wird zu 65-70% im proximalen Tubulus (parazellulär) resorbiert, zu 25%
im aufsteigenden Teil der Henle-Schleife (parazellulär und
transzellulär unter Kontrolle von Parathormon), der Rest auf 99,5% im
distalen Tubulus und Sammelrohr. Ca++-Ionen
dringen über epitheliale Calciumkanäle leicht in Tubuluszellen
ein (Konzentrationsdifferenz plus Membranpotential), binden an
Calmodulin (Aufrechterhaltung des Konzentrationsgradienten) und werden aktiv über die basolaterale Membran der Tubuluszelle
transportiert (Na/Ca-Antiport und Ca-ATPase). ~200 mg/d werden im Harn ausgeschieden, bei Immobilität (→ Knochenabbau) nimmt die Ca++-Ausscheidung zu  Filtriertes Mg++
wird zu 50-70% vom dicken Teil des aufsteigenden Schenkels der
Henle-Schleife rückresorbiert (Claudin kontrolliert die parazelluläre
Diffusion), 10-25% im proximalen Tubulus, 10% im Sammelrohr, angeregt
durch Insulin, Östrogene, Wachstumsfaktoren.
~5% werden im Harn ausgeschieden
Filtriertes Mg++
wird zu 50-70% vom dicken Teil des aufsteigenden Schenkels der
Henle-Schleife rückresorbiert (Claudin kontrolliert die parazelluläre
Diffusion), 10-25% im proximalen Tubulus, 10% im Sammelrohr, angeregt
durch Insulin, Östrogene, Wachstumsfaktoren.
~5% werden im Harn ausgeschieden  Täglich werden ~7g Phosphat filtriert, das Filtrat enthält ~1 mM/l. Der proximale Tubulus resorbiert ~80%
über einen apikalen Na/P-Symporter (durch Parathormon hemmbar), der
distale Tubulus ~10%; ~10% werden ausgeschieden. Erhöhter
Phosphatspiegel steigert, Phosphatmangel reduziert die renale
Ausscheidung. Die Phosphatresorption wird unterstützt durch Wachstum,
Phosphatmangel, Vit. D, Alkalose; die Ausscheidung durch Parathormon, Calcitonin, Azidose
Täglich werden ~7g Phosphat filtriert, das Filtrat enthält ~1 mM/l. Der proximale Tubulus resorbiert ~80%
über einen apikalen Na/P-Symporter (durch Parathormon hemmbar), der
distale Tubulus ~10%; ~10% werden ausgeschieden. Erhöhter
Phosphatspiegel steigert, Phosphatmangel reduziert die renale
Ausscheidung. Die Phosphatresorption wird unterstützt durch Wachstum,
Phosphatmangel, Vit. D, Alkalose; die Ausscheidung durch Parathormon, Calcitonin, Azidose Harnstoff (wichtigster N-Träger) wird glomerulär filtriert, etwa die Hälfte davon wird im proximalen Tubulus rückresorbiert, der Rest wird im Nierenmark als osmotischer
Verstärkungsfaktor genutzt und zirkuliert zwischen Tubulus und
Intertstitium, 15-70% (Mittelwert ~40%)
werden mit dem Harn ausgeschieden. Aus dem unteren Sammelrohr
diffundiert Harnstoff seinem Konzentrationsgradienten folgend in das
Interstitium - vorausgesetzt, Vasopressin bewirkt die Einlagerung von
Harnstofftransportern (UT1, UT4) in die Sammelrohre. Der Harnstoffmechanismus
bewirkt die Hälfte der osmotischen Konzentration des
Nierenmarks. Harnstoff diffundiert anschließend zu ≥50% der glomerulär
filtrierten Menge in den dünnen Schenkel des aufsteigenden Teils der
Henle-Schleife juxtamedullärer Nephrone. Im
distalen Tubulussystem kommen so 100-110% der filtrierten Menge an
Harnstoff an; ~30% werden im distalen Tubulus wieder rückresorbiert,
der Rest kommt wieder in das Sammelrohr. Durch Kapillarwände gelangt Harnstoff mittels
UT3-Transporter
Harnstoff (wichtigster N-Träger) wird glomerulär filtriert, etwa die Hälfte davon wird im proximalen Tubulus rückresorbiert, der Rest wird im Nierenmark als osmotischer
Verstärkungsfaktor genutzt und zirkuliert zwischen Tubulus und
Intertstitium, 15-70% (Mittelwert ~40%)
werden mit dem Harn ausgeschieden. Aus dem unteren Sammelrohr
diffundiert Harnstoff seinem Konzentrationsgradienten folgend in das
Interstitium - vorausgesetzt, Vasopressin bewirkt die Einlagerung von
Harnstofftransportern (UT1, UT4) in die Sammelrohre. Der Harnstoffmechanismus
bewirkt die Hälfte der osmotischen Konzentration des
Nierenmarks. Harnstoff diffundiert anschließend zu ≥50% der glomerulär
filtrierten Menge in den dünnen Schenkel des aufsteigenden Teils der
Henle-Schleife juxtamedullärer Nephrone. Im
distalen Tubulussystem kommen so 100-110% der filtrierten Menge an
Harnstoff an; ~30% werden im distalen Tubulus wieder rückresorbiert,
der Rest kommt wieder in das Sammelrohr. Durch Kapillarwände gelangt Harnstoff mittels
UT3-Transporter Harnsäure bzw. Urat ist ein Abbauprodukt von Purinen (Konzentration im
Filtrat ≤0,25 mM). Urat wird im proximalen Tubulus zu 99%
rückresorbiert, dann zu ~50% (der filtrierten Menge) sezerniert, und
wieder zu ~40% resorbiert - frühproximal über mehrere Carrier, die
gegen andere Anionen und schwache Säuren austauschen, dann
parazellulär. Ausgeschieden werden ≤10% der filtrierten Menge. Der
Uratpool beträgt
~1200 mg, der Tagesumsatz ~700 mg/d, die Harnsäureclearance 6–12
ml/min. Hohe Calciumoxalatausscheidung bedingt Harnsteinanfälligkeit
Harnsäure bzw. Urat ist ein Abbauprodukt von Purinen (Konzentration im
Filtrat ≤0,25 mM). Urat wird im proximalen Tubulus zu 99%
rückresorbiert, dann zu ~50% (der filtrierten Menge) sezerniert, und
wieder zu ~40% resorbiert - frühproximal über mehrere Carrier, die
gegen andere Anionen und schwache Säuren austauschen, dann
parazellulär. Ausgeschieden werden ≤10% der filtrierten Menge. Der
Uratpool beträgt
~1200 mg, der Tagesumsatz ~700 mg/d, die Harnsäureclearance 6–12
ml/min. Hohe Calciumoxalatausscheidung bedingt Harnsteinanfälligkeit