

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Blutdruck, Wasserhaushalt, Säure-Basen-Status

 Integrierte Kreislaufregulation
Integrierte Kreislaufregulation
© H. Hinghofer-Szalkay
 Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel
Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel
Barorezeptor: βαρύς = schwer, recipere = behalten, erlangen, aufnehmen
Elektrolyt: ἤλεκτρον = Bernstein (elektrische Aufladung beim Reiben mit Seide oder Baumwolle), λύσις = (Auf)Lösung
Karotissinus: καρόω = in tiefen Schlaf versetzen (Druck auf Halsschlagader kann bewusstlos machen), sinus = Bucht (Ausbuchtung)
Orthostase: ὀρθός = (auf)recht, richtig; stare = (aufrecht) stehen
Volumen: volvere = wälzen, rollen; volumen = Krümmung, Windung
Das Herz reagiert unmittelbar
auf Änderungen seiner Vor- und Nachlast. Der Frank-Starling-Mechanismus
gleicht die Förderleistung der Ventrikel auf deren diastolische
Vorfüllung (enddiastolisches Volumen) an; ändert sich die Nachlast
(Blutdruck), gelingt die Anpassung ebenfalls über den Einfluß auf das
enddiastolische Volumen - dieses wird durch Verringerung des vorangehenden Schlagvolumens automatisch erhöht (und umgekehrt).
Der Baroreflex wird von Dehnungsrezeptoren in der Wand von Aortenbogen und innerer Halsschlagader (Karotissinus) angeregt. Das Reflexzentrum liegt im Hirnstamm (nucl. tractus solitarii),
die Reflexantwort erfolgt über Herztätigkeit und Gefäßtonus (vor allem
im Splanchnikusgebiet).
Der Karotissinus liegt etwa auf halber Strecke zwischen Herz und
Gehirn: So reagiert der Baroreflex vor allem auf
hydrostatische Störeinflüsse auf die zerebrale Perfusion,
wie sie durch Änderungen der Körperlage (Liegen <=> Stehen)
auftreten, und stabilisiert den Blutdruck in Kopfhöhe. Die Barozeptoren
des Aortenbogens liegen hingegen auf Höhe der
arteriellen hydrostatischen Indifferenz und reagieren kaum auf
orthostatische Änderungen; sie ermitteln den "Systemblutdruck".
Im Hirnstamm wirken u.a. ein kardioakzeleratorisches und ein kardioinhibitorisches Areal regelnd auf die Herztätigkeit ein. Ersteres stimuliert - wie auch das vasomotorische Areal - den Sympathikus, letzteres den Parasympathikus.
Kurz- bis mittelfristig blutdruckregulierend wirken Hormone
wie Aldosteron ("Salzsparhormon"), Vasopressin ("Wassersparhormon"),
atriale natriuretische Peptide (herzschonend) und der
Renin-Angiotensin-Mechanismus (kreislaufstützend). Dazu kommt die
Wirkung lokaler Mediatoren wie Kinine und Prostaglandine.
Längerfristig kommen Vorgänge ins
Spiel, die Faktoren wie
Größe, Wanddicke und Dehnbarkeit der Gefäße sowie Ausdehnung und
Wandstärke des Herzens beeinflussen. Solche feinregulatorischen
Anpassungen sind u.a. während der Wachstumsperiode mit ihren
morphologisch-mechanischen Änderungen (Körpermasse, Länge,
Kräftemuster) von Bedeutung.
|
Übersicht  Einfluss des autonom-nervösen Systems
Einfluss des autonom-nervösen Systems  Blutvolumen
Blutvolumen  Kurzfristige Regulation
Kurzfristige Regulation  Längerfristige Regulation
Längerfristige Regulation  Kardiale Faktoren, Vor- und Nachlast
Kardiale Faktoren, Vor- und Nachlast  Orthostase
Orthostase  Chemorezeptoren und pH-Wert
Chemorezeptoren und pH-Wert  Körperliche Belastung
Körperliche Belastung  Integrierte Regulation, Reaktion auf Blutverlust
Integrierte Regulation, Reaktion auf Blutverlust
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Der
Flüssigkeitsgehalt des Körpers wird durch neurale (autonom-nervöse) und
humorale Mechanismen stabilisiert. Dazu versorgen verschiedene
Rezeptoren über autonom-nervöse Afferenzen Kontrollstellen (Kreislaufzentrum, Hypothalamus u.a.) mit Information über aktuelle Istwerte einschlägiger Zustandsgrößen. Flüssigkeitsvolumina
 (z.B.
Blutvolumen, Ganzkörperwasser) werden nicht direkt detektiert, sondern
über Druckwerte im Kreislauf und andere Größen, der mit dem
Flüssigkeitshaushalt in mehr oder weniger direkter
Verbindung stehen:
(z.B.
Blutvolumen, Ganzkörperwasser) werden nicht direkt detektiert, sondern
über Druckwerte im Kreislauf und andere Größen, der mit dem
Flüssigkeitshaushalt in mehr oder weniger direkter
Verbindung stehen:
 Druckrezeptoren im Herzen und Arteriensystem (Barorezeptoren
Druckrezeptoren im Herzen und Arteriensystem (Barorezeptoren
 in Aorta und sinus caroticus) beeinflussen über den Sympathikus den
Zustand der Blutgefäße (Tonus) und des Herzens (Herzqualitäten) - so
wird der Blutdruck stabilisiert.
in Aorta und sinus caroticus) beeinflussen über den Sympathikus den
Zustand der Blutgefäße (Tonus) und des Herzens (Herzqualitäten) - so
wird der Blutdruck stabilisiert.
 Druckrezeptoren in der Niere (vas afferens) steuern die Freisetzung von Renin
aus umliegenden granulären Zellen - je geringer der Druck, desto
mehr Renin wird aktiviert, dieses aktiviert Angiotensin und regt (via Aldosteron) die Rückresorption von Natrium an.
Druckrezeptoren in der Niere (vas afferens) steuern die Freisetzung von Renin
aus umliegenden granulären Zellen - je geringer der Druck, desto
mehr Renin wird aktiviert, dieses aktiviert Angiotensin und regt (via Aldosteron) die Rückresorption von Natrium an.
 Nimmt die glomeruläre Filtration ab, gelangt weniger Kochsalz zur macula densa. Ein tubulo-glomerulärer Rückkopplungsmechanismus wirkt stabilisierend auf die Salzbilanz: Reduzierte Strömung an der macula densa senkt den Tonus der vasa afferentia, dadurch nehmen glomerulärer Druck und Filtration wieder zu (negative Rückkopplung).
Nimmt die glomeruläre Filtration ab, gelangt weniger Kochsalz zur macula densa. Ein tubulo-glomerulärer Rückkopplungsmechanismus wirkt stabilisierend auf die Salzbilanz: Reduzierte Strömung an der macula densa senkt den Tonus der vasa afferentia, dadurch nehmen glomerulärer Druck und Filtration wieder zu (negative Rückkopplung).
 Natriuretische Peptide aus dem Herzen fördern bei dessen Überdehnung die Natriumausscheidung in der Niere, das Blutvolumen nimmt ab. Das Flüssigkeitsvolumen wird über die Menge an freiem Natrium sowie die Osmoregulation eingestellt.
Natriuretische Peptide aus dem Herzen fördern bei dessen Überdehnung die Natriumausscheidung in der Niere, das Blutvolumen nimmt ab. Das Flüssigkeitsvolumen wird über die Menge an freiem Natrium sowie die Osmoregulation eingestellt.
Einfluss des autonom-nervösen Systems
Die
Kreislaufregulation muss verschiedene, zum Teil
entgegengesetzte Anforderungen erfüllen. So steigt in einer
Belastungssituation die Aktivität des Sympathikus (der hauptsächlich
Noradrenalin freisetzt), und die Nebenniere wird aktiviert (das Mark
produziert Adrenalin).
Das Wirkungsmuster dieser beiden Katecholamine
ist aber unterschiedlich. Der Sympathikus spielt die tragende Rolle bei
der autonom-nervösen Steuerung des Gefäßtonus; seine Fasern finden sich
überall in der Wand der Blutgefäße.
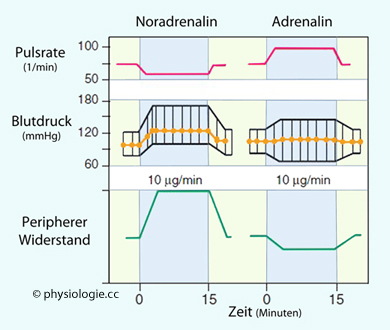
 Abbildung: Auswirkung einer i.v.-Infusion (jeweils 10 µg/min) von Noradrenalin bzw. Adrenalin
Abbildung: Auswirkung einer i.v.-Infusion (jeweils 10 µg/min) von Noradrenalin bzw. Adrenalin
Nach Allwood MJ, Cobbold AF, Ginsberg J. Peripheral
vascular effects of noradrenaline, isopropylnoradrenaline, and
dopamine. Br Med Bull 1963; 19: 132-6
Noradrenalin
kontrahiert α-adrenerg die arterioläre Muskulatur und erhöht so den
peripheren Widerstand, Adrenalin hingegen wirkt ß2-adrenerg vasodilatatorisch (unten). Beide Katecholamine regen das Herz ß1-adrenerg an. Noradrenalin erhöht den Blutdruck so stark, dass der Barorezeptorreflex die Pulsfrequenz senkt.
Die hellblauen Felder geben die Zeit der gleichmäßigen Infusion
(jeweils 15 Minuten Dauer) an. Der systolische Druck steigt in beiden
Fällen, der diastolische nur bei Noradrenalin; Adrenalin senkt den
diastolischen Druck wegen der vasodilatatorischen ß2-Rezeptor-Wirkung. Der arterielle Mitteldruck ist orange dargestellt.
Das Herzminutenvolumen (nicht gezeigt) nimmt während der Gabe von Noradrenalin ab
(der Barorezeptorreflex steigert bei Blutdruckerhöhung den
parasympathischen, und senkt den sympathischen, Einfluss auf das Herz),
während der Infusion von Adrenalin zu, da es zu keinem Blutdruckanstieg kommt, der die Adrenalinwirkung konterkarieren würde

Die  Abbildung gibt einen klassichen
Versuch wieder: Die Effekte einer Noradrenalin- vs. Adrenalininfusion.
Abbildung gibt einen klassichen
Versuch wieder: Die Effekte einer Noradrenalin- vs. Adrenalininfusion.
Versuchspersonen
wurde - unter sonst gleichbleibenden Bedingungen (Körperlage etc) -
jeweils eine mäßige Dosis (10 µg/min) Noradrenalin oder Adrenalin
intravenös infundiert. Das Wirkungsspektrum dieser Katecholamine
erklärt die Unterschiede in der Kreislaufreaktion:
Arterien / Arteriolen sind sowohl mit α1- als auch mit ß2-Rezeptoren
(vor allem in Skelettmuskeln) ausgestattet. Auf erstere wirkt
Noradrenalin besonders stark vasokonstriktorisch; letztere vermitteln
Vasodilatation und reagieren vor allem auf Adrenalin. Deshalb steigert
Noradrenalin den diastolischen Blutdruck (erhöhter peripherer
Widerstand), der bei Adrenalininfusion sinkt.
Sowohl Adrenalin als auch Noradrenalin wirken auf ß1-Rezeptoren im Herzen, u.a. frequenzsteigernd (positiv chronotrop). Dennoch sinkt
bei Noradrenalininfusion die Pulsfrequenz. Der Grund: Der starke
Blutdruckanstieg engagiert den Barorezeptorreflex (s. unten) so
intensiv, dass der negativ chronotrope Reflexeffekt auf den Sinusknoten
stärker ist als die direkte Wirkung des infundierten Noradrenalins.
Der primäre Einfluss sympathischer Fasern auf Gefäße ist adrenerg und bewirkt meist
 Vasokonstriktion, vermittelt über α1-Rezeptoren → Gq-Protein → IP3, PLC → intrazellulärer [Ca++]-Anstieg → Kontraktion der Gefäßwand.
Vasokonstriktion, vermittelt über α1-Rezeptoren → Gq-Protein → IP3, PLC → intrazellulärer [Ca++]-Anstieg → Kontraktion der Gefäßwand.
 Anregung von ß2-Rezeptoren hingegen bewirkt Vasodilatation über den cAMP-PKA-Weg → Phosphorylierung der Myosin-Leichtkettenkinase (MLCK), die dabei gegenüber dem Ca++-Calmodulin- Komplex weniger empfindlich wird → Relaxation.
Anregung von ß2-Rezeptoren hingegen bewirkt Vasodilatation über den cAMP-PKA-Weg → Phosphorylierung der Myosin-Leichtkettenkinase (MLCK), die dabei gegenüber dem Ca++-Calmodulin- Komplex weniger empfindlich wird → Relaxation.
Zahlreiche Blutgefäße sind mit einer Kombination verschiedener Adrenozeptoren (α, ß) bestückt,
so fällt die Wirkung von Noradrenalin und Adrenalin jeweils -
quantitativ und qualitativ - unterschiedlich aus (je nach
physiologischem Anforderungsprofil). Beispielsweise verfügen Blutgefäße
in der Haut ausschließlich über α-Rezeptoren, ihre Reaktion auf Katecholamine ist immer Kontraktion; in den Koronargefäßen hingegen überwiegen ß2- vor α1-Rezeptoren,
sie reagieren auf Adrenalin mit Vasodilatation (was etwa bei Stress
sinnvoll ist: Vermehrte myokardiale Durchblutung in
Gefahrensituationen).
 Über α- und ß-Adrenozeptoren s. dort
Über α- und ß-Adrenozeptoren s. dort
Einige sympathische Fassern funktionierern cholinerg und wirken vasodilatatorisch, und zwar in der Skelettmuskulatur.
Sie werden nicht vom Kreislaufzentrum in der medulla oblongata, sondern
von Neuronen in der Großhirnrinde gesteuert, die im Hypothalamus oder
Mittelhirn auf Folgeneuronen projizieren. Deren Axone laufen direkt in
das Rückenmark, wo sie auf präganglionäre sympathische Neurone
schalten. Die verknüpften postganglionären Zellen setzen an ihren
Varikositäten Acetylcholin (möglicherweise auch weitere Transmitter)
frei. Diese erfolgt im Rahmen von Stressreaktionen (fight or flight), vielleicht auch als Vorbereitung auf intendierte körperliche Aktivität (antizipatorische Durchblutungssteigerung).
Die vasodilatatorische (durchblutungsfördernde) Wirkung des Acetylcholins
(das bei direkter Applikation glatte Muskelzellen kontrahiert) erfolgt nicht unmittelbar auf glatte Gefäßmuskelzellen, sondern ist eine indirekte: Über muskarinische Rezeptoren auf Nachbarzellen,
z.B. auf der präsynaptischen Membran postganglionärer sympathischer
Fasern, die darauf hin ihr [cAMP] senken und weniger Noradrenalin
freisetzen (Inhibition vasokonstriktorischer Einflüsse).
Vasodilatatorische parasympathische Einflüsse gibt es ebenfalls, allerdings nur an wenigen Orten: In den Speicheldrüsen
(deren Sekretionstätigkeit sie zusammen mit sympathischen Neuronen
anregen), einige im gastrointestinalen System; eine tragende Rolle
spielen sie im erektilen Gewebe der Geschlechtsorgane. Postganglionäre parasympathische Fasern setzen neben Acetylcholin auch Cotransmitter frei, wie NO, VIP oder CGRP.
Blutvolumen
 Zum Blutvolumen s. auch dort
Zum Blutvolumen s. auch dort
Ein adäquates Blutvolumen ist eine Grundvoraussetzung für intakte Kreislaufregulation. Die Steuerung
des kardiovaskulären Systems ist auf bestimmte Füllungsbereiche von
Herz und Blutgefäßen eingestellt: Ohne ein
adäquates Blutvolumen können die Kreislaufreflexe nicht funktionieren
(deshalb ist z.B. ein zu starker Blutverlust nicht mit dem Leben
vereinbar).
Mit dem Blutvolumen steigt (ceteris paribus) der Blutdruck - dieser wird von arteriellen Baro(re)zeptoren gemessen.
Die Kreislaufregulation stabilisiert primär den systemisch-arteriellen Blutdruck.
Ohne ausreichenden Blutdruck ist die Perfusion (und damit
Funktionsfähigkeit) der Gewebe beeinträchtigt (die glomeruläre Filtration
in den Nieren nimmt ab, was sich wiederum auf die Volumenregulation
auswirkt, etc).
Der Blutdruck beeinflusst den Flüssigkeitshaushalt: Erhöhung
des Blutdrucks führt zu vermehrter Harnausscheidung (“Druckdiurese”),
dies senkt extrazelluläres Volumen und Blutdruck (negative Rückkopplung
→ Stabilisierung des zirkulierenden Volumens). In einem Bereich von
10-25 kPa stabilisieren die Nieren ihre Durchblutung durch
Autoregulation  an den Arteriolen.
an den Arteriolen.
Blutdruck und Blutvolumen / Osmolarität: Die Regulation der Körperflüssigkeiten
(osmotische Wirkung: Wasser, Salze  → Osmo-, Elektrolyt-,
Volumenregulation) ist eng mit der von Blutdruck (treibende Kraft für
Blutnachschub) und Durchblutung (Perfusion: Ernährung der Organe und
Gewebe) verknüpft.
→ Osmo-, Elektrolyt-,
Volumenregulation) ist eng mit der von Blutdruck (treibende Kraft für
Blutnachschub) und Durchblutung (Perfusion: Ernährung der Organe und
Gewebe) verknüpft.
Dehnung von Typ-B-Dehnungsrezeptoren in den Hohlvenen im Einstromgebiet zum rechten Vorhof signalisiert erhöhtes (zentrales) Blutvolumen und
 senkt reflektorisch den Sympathikustonus (verringerte Vasokonstriktion, erhöhte Volumendehnbarkeit),
senkt reflektorisch den Sympathikustonus (verringerte Vasokonstriktion, erhöhte Volumendehnbarkeit),
 hemmt die Freisetzung von Renin aus juxtraglomerulären Zellen in den Nieren (Wasserausscheidung, Volumensenkung),
hemmt die Freisetzung von Renin aus juxtraglomerulären Zellen in den Nieren (Wasserausscheidung, Volumensenkung),
 reduziert die Sekretion von Vasopressin aus dem Hypophysenhinterlappen (vermehrte Wasserausscheidung).
reduziert die Sekretion von Vasopressin aus dem Hypophysenhinterlappen (vermehrte Wasserausscheidung).
Verstärkte Dehnung der Hohlvenen und Vorhöfe des Herzens senkt die Sekretion von Vasopressin (ADH) und Renin
|
Starke
Dehnung der Vorhöfe führt außerdem zu Freisetzung von Atriopeptin (ANP,
atriale natriuretische Peptide), was zu vermehrter Natriurese und damit
Senkung des Blutvolumens führt.
Physiologisch ausschlaggebend ist nicht die Größe des Blutvolumens an sich, sondern seine funktionelle Bedeutung. Daher wurde der Begriff des effektiven Blutvolumens (effective circulating volume) geprägt:
Derjenige Anteil des Volumens, der sich hämodynamisch und regulatorisch
auswirkt, etwa als Messgröße verschiedener Rezeptoren und / oder als
Stellgröße für verschiedene Effektoren (im Sinne einer kybernetischen Betrachtung).
Rasche Blutdruckregulation
Die Zentren für die kardiovaskulären Reflexe liegen im Kreislaufzentrum der medulla oblongata des Hirnstamms, übergeordnet sind der Hypothalamus und die Großhirnrinde. Effektoren sind vor allem Herz (Schrittmacherzellen, Arbeitsmyokard), Blutgefäße (glatte Muskelzellen) und Nebennierenmark (Adrenalinausschüttung).


Abbildung: Autonom-nervöse Steuerung des kardiovaskulären Systems
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Die bedeutendsten Effektoren der Steuerung des Blutdrucks sind Herz, Arterien, Venen und Nebennierenmark.
Dargestellt sind die Steuerzentren in Kortex, Hypothalamus, Mesencephalon, medulla oblongata und Thorakalmark.
Sympathische Einflüsse steigern Blutdruck und Adrenalinspiegel, parasympathische führen zu Vasodilatation, teils via Bradykinin

Zum vasomotorischen
Kreislaufzentrum im Hirnstamm (C1, A1) s. auch
dort
Das Kreislaufzentrum der medulla oblongata regt (in den meisten Fällen, und unter der Kontrolle übergeordneter Neuronensysteme) präganglionäre sympathische Fasern an und hat so eine tonisch blutdrucksteigernde Wirkung (insbesondere durch arterioläre Vasokonstriktion: Steigerung des peripheren Widerstandes).
Barorezeptoren: Primäre Regulation  Chemorezeptoren: Sekundäre Regulation
Chemorezeptoren: Sekundäre Regulation
Der
arterielle (systemische) Blutdruck wird fortlaufend durch ein zweifaches System von
Rezeptoren und Reflexen überwacht: Ein primäres, das den Blutdruck steuert (Barorezeptoren versorgen das Zentrum mit Information über aktuelle Messwerte), und ein sekundäres, das sich über das Atemzentrum um die Stabilisierung der Blutgaswerte (pO2, pCO2, pH - Chemorezeptoren) kümmert, aber auch auf den Kreislauf wirkt.
Primäre Regulation: Barorezeptorreflexe
Der Baro(rezeptor)reflex geht von "reflexogenen Zonen" in der Wand der Sinus in der Carotis  und im Aortenbogen
(Barorezeptoren) aus, deren Aktivität vom Grad der Wanddehnung abhängt. Strukturelles Substrat sind dehnungssensitive Nervenzellen.
und im Aortenbogen
(Barorezeptoren) aus, deren Aktivität vom Grad der Wanddehnung abhängt. Strukturelles Substrat sind dehnungssensitive Nervenzellen.
Barorezeptoren zeigen PD-Charakteristik: Sie reagieren einerseits proportional (P) zum Dehnungsreiz (zum Blutdruck), andererseits besonders empfindlich auf zeitliche Änderungen dieses Reizes (D, differentialempfindlich). Sie adaptieren rasch, d.h. sie reduzieren bei anhaltend verändertem Innendruck die statische Komponente ihrer Empfindlichkeit.
Der Carotissinus
(sinus caroticus,  Abbildung) ist ein dünnwandiger, gut
dehnbarer Abschnitt der a. carotis interna. Seine Wand oszilliert
deutlich mit dem arteriellen Puls (um ~15%
des Durchmessers). Die Dehnung der Wand ist der adäquate Reiz für die
Reizung. Die einzelnen afferenten Fasern sammeln sich im Sinusnerv, der
dann in den N. glossopharyngeus
mündet, der zum Hirnstamm zieht. Auch die Wand des Aortenbogens ist im Bereich des sinus aorticus
gut dehnbar (relativ hohe Compliance: ∂V/∂p) und reagiert insbesondere
auf die vom linken Ventrikel erzeugten Druckwellen. Die Fasern vom
Aortenbogen ziehen mit dem N. vagus zum Hirnstamm.
Abbildung) ist ein dünnwandiger, gut
dehnbarer Abschnitt der a. carotis interna. Seine Wand oszilliert
deutlich mit dem arteriellen Puls (um ~15%
des Durchmessers). Die Dehnung der Wand ist der adäquate Reiz für die
Reizung. Die einzelnen afferenten Fasern sammeln sich im Sinusnerv, der
dann in den N. glossopharyngeus
mündet, der zum Hirnstamm zieht. Auch die Wand des Aortenbogens ist im Bereich des sinus aorticus
gut dehnbar (relativ hohe Compliance: ∂V/∂p) und reagiert insbesondere
auf die vom linken Ventrikel erzeugten Druckwellen. Die Fasern vom
Aortenbogen ziehen mit dem N. vagus zum Hirnstamm.
Am Baroreflex beteiligte afferente Nervenfasern haben ihren Zellkörper in Ganglien des N. glossopharyngeus (IX) und vagus (X)
|
Modifiziert nach Vorlagen bei interactive-biology.com / Cranial Nerves in Health and Disease (Wilson-Paiwels, Akesson, Stewart, Spacey), BC Dekker Inc. 2002
Links: Vereinfachte Darstellung des Reflexbogens von Barozeptoren in
der Aorta (Afferenz: N. IX) zu parasympathischen Efferenzen zum Herzen
(N. X). Drucksteigerung senkt, Druckabfall erhöht die Herzfrequenz.
Rechts: Der
Blutdruck dehnt tangential die Wand des sinus caroticus, in der tunica
adventitia werden mechanosensible freie Nervenendigungen gereizt
(Barorezeptoren) und erhöhen ihre Aktionspotentialfrequenz. Impulse
werden über den N. glossopharyngeus zum nucl. tractus solitarii der
medulla oblongata geleitet (s. weiter unten). Das chemosensible glomus caroticum (Größe 3 x 6 mm) ist extrem gut durchblutet ( s. dort)
s. dort)
 Strukturell sind die arteriellen Barorezeptoren Endverzweigungen myelinierter und unmyelinierter sensorischer Nervenfasern, die sich zwischen elastische Fasern der Gefäßwand schmiegen. Steigt der Innendruck, werden sie gestreckt, und die Aktionspotentialfrequenz nimmt zu - die Fasern sind dehnungsempfindlich.
Strukturell sind die arteriellen Barorezeptoren Endverzweigungen myelinierter und unmyelinierter sensorischer Nervenfasern, die sich zwischen elastische Fasern der Gefäßwand schmiegen. Steigt der Innendruck, werden sie gestreckt, und die Aktionspotentialfrequenz nimmt zu - die Fasern sind dehnungsempfindlich.
Ansprechverhalten der Nervenfasern:
Mit steigendem Innendruck im Carotissinus (beginnend mit einem
Minimaldruck von etwa 40-60 mmHg, unterhalb dessen die Fasern stumm
sind) nimmt nicht nur die Frequenz der Aktionspotentiale pro afferenter Faser zu, sondern auch die Zahl der aktiv gewordenen Fasern (recruitment).
Der Sättigungsdruck liegt bei etwa 200 mmHg, darüber gibt es keine
Steigerung der Aktivität mehr. Die einzelnen Nervenfasern zeigen darüber
hinaus unterschiedliche Empfindlichkeit:
Als Sensitivität bezeichnet man
ihr Ansprechverhalten (je steiler der druckabhängige Frequenzanstieg,
umso sensitiver die Faser). Zusätzlich reagieren die Fasern auf
statische Reize anders (sinusoidal: besonders empfindlich im
physiologischen Mittelbereich des Drucks) als auf sich ändernde
(oszillierender Blutdruck: etwa lineare Steigerung der
Entladungsfrequenz mit dem Blutdruck) ( Abbildung).
Abbildung).

 Abbildung: Aktivität (Aktionspotentialfrequenz) des Sinusnerven in Abhängigkeit vom Blutdruck
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Aktivität (Aktionspotentialfrequenz) des Sinusnerven in Abhängigkeit vom Blutdruck
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Rote Kurve: Die Aktivität nimmt stetig mit dem mittleren Blutdruck zu,
wenn dieser pulsiert (physiologischer Normalfall).
Grüne Kurve: Bei
stationärem
Blutdruck ("statisch": experimentelle Situation) ist das
Ansprechverhalten sigmoidal (besonders starke Zunahme im
physiologischen Blutdruckbereich).
Man kann auch beobachten, dass Barorezeptoren
auf statische Reizung weniger stark reagieren als auf pulsatile, wie dies typisch für PD-empfindliche Rezeptoren ist (hier nicht gezeigt)
 Orthostatische Regulation:
Während der Aortensinus etwa auf der Höhe der arteriellen
hydrostatischen Indifferenz liegt und daher durch Lagewechsel zwischen
liegend und aufrecht weitgehend unbeeinflusst ist, reagiert der
Carotissinus - der deutlich über der arteriellen hydrostatischen Indifferenzzone
liegt - auf solche Lagewechsel mit veränderter Aktivität, löst also
entsprechende orthostatische Regulation aus (z.B. Anstieg der
Herzfrequenz und Vasokonstriktion beim Aufstehen).
Orthostatische Regulation:
Während der Aortensinus etwa auf der Höhe der arteriellen
hydrostatischen Indifferenz liegt und daher durch Lagewechsel zwischen
liegend und aufrecht weitgehend unbeeinflusst ist, reagiert der
Carotissinus - der deutlich über der arteriellen hydrostatischen Indifferenzzone
liegt - auf solche Lagewechsel mit veränderter Aktivität, löst also
entsprechende orthostatische Regulation aus (z.B. Anstieg der
Herzfrequenz und Vasokonstriktion beim Aufstehen).
 Nicht nur die
Intensität der Dehnung an sich (statisch: Proportionalempfindlichkeit),
sondern auch deren zeitliche Änderung (pulsatil:
Differentialempfindlichkeit) bestimmt die Aktionspotentialfrequenz
an den Nervenfasern, die vom Sinus zum Gehirn führen.
Nicht nur die
Intensität der Dehnung an sich (statisch: Proportionalempfindlichkeit),
sondern auch deren zeitliche Änderung (pulsatil:
Differentialempfindlichkeit) bestimmt die Aktionspotentialfrequenz
an den Nervenfasern, die vom Sinus zum Gehirn führen.
Damit reagieren Barorezeptoren auf verschiedene Kriterien des Druckverlaufes im Karitossinus und im Aortenbogen:
 Arterieller Mitteldruck: Je höher der Druck, desto höher die Aktionspotentialfrequenz (P-Anteil)
Arterieller Mitteldruck: Je höher der Druck, desto höher die Aktionspotentialfrequenz (P-Anteil)
 Steilheit der Druckschwankungen: Je steiler der Druckanstieg, desto höher der Frequenzanstieg (D-Anteil)
Steilheit der Druckschwankungen: Je steiler der Druckanstieg, desto höher der Frequenzanstieg (D-Anteil)
 Blutdruckamplitude: Zusätzliche C-Fasern sprechen an. Besonders wichtig bei Orthostase oder Blutverlust
Blutdruckamplitude: Zusätzliche C-Fasern sprechen an. Besonders wichtig bei Orthostase oder Blutverlust
Die Dehnungsempfindlichkeit entspricht der Öffnungswahrscheinlichkeit
mechanosensibler Kationenkanäle in der Membran der barosensitiven Neurone.
Mechanosensible Kationenkanäle verleihen den Barozeptoren ihre Empfindlichkeit gegenüber Änderungen der Wandspannung
|


Abbildung: Barorezeptorreflex
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
In diesem Beispiel wird ein systemischer Blutdruckanstieg als primärer Stimulus angenommen, der das Regelsystem aktiviert.
Änderung des arteriellen Blutdrucks beeinflusst sympathische Aktivität und damit peripheren Widerstand
(Gefäßtonus) sowie Herzleistung im Sinne korrigierender negativer Rückkopplung.
Diese findet am vasomotorischen Areal der medulla
oblongata statt (inhibitorische Interneuronen vom nucl. tractus
solitarii) und dadurch, dass Blutdruckanstieg die parasympathische
Aktivität zum Herzen anregt.
Der Regelkreis
beantwortet Blutdruckabfall mit Vasokonstriktion und Tachykardie,
Blutdruckanstieg mit Vasodilatation und Bradykardie

Man unterscheidet nach ihrer
Leitungsgeschwindigkeit zwei Arten barosensitiver Neuronen:
 A-Fasern
sind gut myelinisiert, leiten schnell und haben eine niedrige
Reizschwelle (zwischen 30 und 90 mmHg). Sie feuern pulsatil im normalen
Blutdruckbereich.
A-Fasern
sind gut myelinisiert, leiten schnell und haben eine niedrige
Reizschwelle (zwischen 30 und 90 mmHg). Sie feuern pulsatil im normalen
Blutdruckbereich.
 Die zahlreicheren C-Fasern sind nicht myelinisiert, leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg).
Die zahlreicheren C-Fasern sind nicht myelinisiert, leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg).
Bei normalem Blutdruck ist nur etwa jede vierte C-Faser aktiv, in Phase
mit den Druckspitzen; C-Fasern erfassen vor allem erhöhte
Blutdruckbereiche (>150 mmHg), wo sie noch sensitiv reagieren,
A-Fasern nicht mehr (deren Ansprechverhalten ist in hohen
Druckbereichen saturiert). Außerdem nimmt die Zahl der C-Fasern, die auf erhöhte Dehnungsreize reagieren, mit steigendem Blutdruck zu (recruitment).
Die Afferenz Barosensoren → Gehirn erfolgt zum nucleus tractus solitarii der medulla oblongata (NTS,  s. auch unten)
s. auch unten).
Information von Barorezeptoren wird zum nucl. tractus solitarii geleitet
|
Den gesamten Komplex der Neuronengruppen, sie sich an der Kreislaufregulation beteiligen, nennt man das medulläre kardiovaskuläre Zentrum
(Kreislaufzentrum). Es erhält alle relevanten Informationen über das
Druckgeschehen in der Peripherie und ist die Koordinationsstelle für
die Stabilität von Blutdruck und Kreislauf.
Das Kreislaufzentrum lässt mehrere Unterabschnitte erkennen, insbesondere ein Vasomotoren- (vasomotor area) und ein kardioinhibitorisches Zentrum (cardioinhibitory area) (Abbildung  s. dort):
s. dort):
 Die nuclei tractus solitarii
(NTS - rechts und links jeweils in der dorsalen medulla oblongata)
erhalten den Großteil der Impulse von Barorezeptoren. Sie wirken auf
mehrere Abschnitte des Kreislaufzentrums:
Die nuclei tractus solitarii
(NTS - rechts und links jeweils in der dorsalen medulla oblongata)
erhalten den Großteil der Impulse von Barorezeptoren. Sie wirken auf
mehrere Abschnitte des Kreislaufzentrums:
 Einerseits regen sie den dorsal gelegenen nucleus ambiguus und den dorsalen motorischen Vaguskern an (der vor allem Bradykardie bewirkt),
Einerseits regen sie den dorsal gelegenen nucleus ambiguus und den dorsalen motorischen Vaguskern an (der vor allem Bradykardie bewirkt),
 andererseits hemmen sie das ventromedial gelegene vasomotorische Areal.
andererseits hemmen sie das ventromedial gelegene vasomotorische Areal.
 Auf das kardioinhibitorische Zentrum projizieren exzitatorische Interneuronen von den NTS. Diese Neuronengruppe wirkt parasympathisch auf das Herz, vor allem senkt sie seine Schlagfrequenz.
Auf das kardioinhibitorische Zentrum projizieren exzitatorische Interneuronen von den NTS. Diese Neuronengruppe wirkt parasympathisch auf das Herz, vor allem senkt sie seine Schlagfrequenz.
 Auf das vasomotorische Areal projizieren inhibitorische
Interneuronen von den NTS. Es inkludiert u.a. die rostral gelegenen
areae A1 und C1 und die unteren Olivenkerne. Die Neuronen in C1 zeigen
herzschlagsynchrone Aktivität, bedingt durch pulsabhängige
Aktionspotentialsalven von den Barorezeptoren. Reizung der C1-Region
bewirkt Vasokonstriktion, und diese Region unterhält einen Dauertonus
der Widerstandsgefäße, soferne sie nicht von NTS-Interneuronen
inhibiert wird (letztere bewirken Vasodilatation). Die tonische Aktivität der C1-Neuronen regt präganglionäre sympathische Zellen an und erhält den arteriellen Blutdruck aufrecht.
Auf das vasomotorische Areal projizieren inhibitorische
Interneuronen von den NTS. Es inkludiert u.a. die rostral gelegenen
areae A1 und C1 und die unteren Olivenkerne. Die Neuronen in C1 zeigen
herzschlagsynchrone Aktivität, bedingt durch pulsabhängige
Aktionspotentialsalven von den Barorezeptoren. Reizung der C1-Region
bewirkt Vasokonstriktion, und diese Region unterhält einen Dauertonus
der Widerstandsgefäße, soferne sie nicht von NTS-Interneuronen
inhibiert wird (letztere bewirken Vasodilatation). Die tonische Aktivität der C1-Neuronen regt präganglionäre sympathische Zellen an und erhält den arteriellen Blutdruck aufrecht.
Unterbrechung der sympathischen Efferenzen zu den Blutgefäßen führt zu Vasodilatation und Blutdruckabfall.
Einige inhibitorische Interneurone erreichen vermutlich auch ein kardioakzeleratorisches Areal in der dorsalen medulla oblongata; dieses wirkt positiv chrono- und inotrop, regt also die Herztätigkeit an.
Die Efferenzen aus dem Kreislaufzentrum können adrenerg (C1-Neurone), peptiderg (z.B. NPY) oder glutamaterg sein (NMDA- und Nicht-NMDA-Rezeptoren auf präganglionären sympathischen Neuronen). Sie wirken sich über sympathische und parasympathische Projektionen vor allem auf Herz (Sympathikus: Beschleunigung und Kräftigung, Parasympathikus: Verlangsamung), Blutgefäße (Sympathikus: Vasomotorentonus) und Nebennieren (Sympathikus: Adrenalinausschüttung) aus ( Abbildung).
Abbildung).
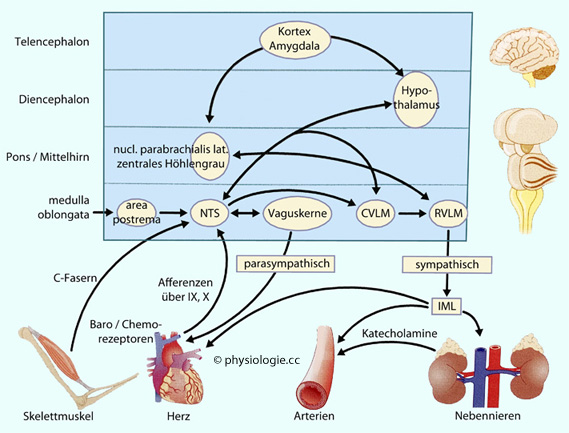
 Abbildung: Neuronale Kreislaufsteuerung
Abbildung: Neuronale Kreislaufsteuerung
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Afferenzen
von Barorezeptoren in Herz und Gefäßen (über glossopharyngeus & vagus) sowie von der Skelettmuskulatur (C-Fasern) gelangen zum nucl. tractus
solitarii (NTS). Dieser erhält auch chemorezeptive Meldungen von der area postrema (zirkumventrikuläres Organ posterior vom NTS).
Vom nucl. tractus
solitarii
gibt es anregende Projektionen auf den dorsalen
Vaguskern und nucl. ambiguus des Hirnstammes ("Vaguskerne",
parasympathische Bremsung der Herzaktion) und hemmende zum
vasomotorischen Areal (geringere sympathische Anregung, Dilatation von
Widerstandsgefäßen, weniger Adrenalinfreisetzung aus den Nebennieren).
Die
Abbildung zeigt auch subkortikale Strukturen, die auf die
Kreislaufregulation Einfluss nehmen. Das Frontalhirn kann auf diese im
Rahmen von Belastungen durch körperliche Belastung bzw. Stress
(fight-or-flight-Situationen) zugreifen
IML = nucl. intermediolateralis (Wurzelzellen im Seitenhorn des
Rückenmarks); VLM = ventrolaterale medulla (C: caudal, R: rostral)

Mit
der Druck / Dehnungsbelastung an den Barorezeptoren steigt die afferente
Aktionspotentialfrequenz und damit die gegenregulatorische Antwort auf
Herz
und Blutgefäße:
 Nimmt der arterielle Druck zu, sinkt die anregende
Wirkung des Sympathikus (Gefäßerweiterung, sinkende suprarenale Adrenalinfreisetzung) und nimmt die bremsende
Wirkung des Parasympathikus zu (Abnahme der Herzfrequenz) - all das innerhalb etwa einer Sekunde.
Nimmt der arterielle Druck zu, sinkt die anregende
Wirkung des Sympathikus (Gefäßerweiterung, sinkende suprarenale Adrenalinfreisetzung) und nimmt die bremsende
Wirkung des Parasympathikus zu (Abnahme der Herzfrequenz) - all das innerhalb etwa einer Sekunde.
 Umgekehrt liegen die Dinge bei Blutdruckabfall (→ Vasokonstriktion, Tachykardie).
Umgekehrt liegen die Dinge bei Blutdruckabfall (→ Vasokonstriktion, Tachykardie).
Plötzliche Zunahme des arteriellen Blutdrucks
führt an kardiopetalen Fasern reflektorisch zu
 gesteigerter parasympathischer Aktivität → vermehrter Freisetzung von Acetylcholin am Sinusknoten gesteigerter parasympathischer Aktivität → vermehrter Freisetzung von Acetylcholin am Sinusknoten
 herabgesetzter sympathischer Aktivität → verringerter Freisetzung an Noradrenalin am Sinusknoten herabgesetzter sympathischer Aktivität → verringerter Freisetzung an Noradrenalin am Sinusknoten
 Senkung der
Herzfrequenz (Bradykardie) Senkung der
Herzfrequenz (Bradykardie)
 Reduktion des Venentonus, die venöse Volumendehnbarkeit (Kapazität) nimmt zu (sinkende Vorlast für das Herz) Reduktion des Venentonus, die venöse Volumendehnbarkeit (Kapazität) nimmt zu (sinkende Vorlast für das Herz)
|
Der Verstärkungsfaktor (gain) des Barorezeptorreflexes lässt sich verändern (resetting):
 Zentral (insbesondere durch Beteiligung der Insel:
Durch körperliche Belastung oder schon die Aussicht darauf: Der
Sollwert für den arteriellen Blutdruck erhöht sich proportional zur
Muskelarbeit, ohne dass der erhöhte Druck durch den Reflex wieder
reduziert wird) oder im Rahmen der Sinusarrhythmie;
Zentral (insbesondere durch Beteiligung der Insel:
Durch körperliche Belastung oder schon die Aussicht darauf: Der
Sollwert für den arteriellen Blutdruck erhöht sich proportional zur
Muskelarbeit, ohne dass der erhöhte Druck durch den Reflex wieder
reduziert wird) oder im Rahmen der Sinusarrhythmie;
 peripher
(verändert sich der Blutdruck über längere Zeiträume - Stunden und Tage
-, adaptiert das Rezeptorsystem, und der Blutdruck wird auf einem
veränderten Niveau reguliert. Der Vorteil besteht darin, dass die
Präzision der Regulation in den optimalen (steilsten) Ansprechbereich
des Systems "nachzieht"; der Nachteil darin, dass sich der mittlere
Blutdruck verändert.
peripher
(verändert sich der Blutdruck über längere Zeiträume - Stunden und Tage
-, adaptiert das Rezeptorsystem, und der Blutdruck wird auf einem
veränderten Niveau reguliert. Der Vorteil besteht darin, dass die
Präzision der Regulation in den optimalen (steilsten) Ansprechbereich
des Systems "nachzieht"; der Nachteil darin, dass sich der mittlere
Blutdruck verändert.
Sympathische Fasern sind besonders zahlreich in Gefäßen der Haut und in den Nieren
(in beiden Gebieten bedeutet hohe Sympathikusaktivität eine starke
Einschränkung der Durchblutung, z.B. im Kreislaufschock). In zerebralen und Koronargefäßen
findet man hingegen relativ wenige sympathische Fasern, diese
unmittelbar überlebenswichtigen Organe werden auch bei hohem
Sympathikustonus gut durchblutet (Schockzustand!). Die Gefäße der Plazenta enthalten überhaupt keine sympathischen Fasern, sie werden anders reguliert.
Die sympathische vasomotorische Aktivität kommt bei einem
plötzlichen Blutdruckanstieg auf >150/90 mmHg vollständig zum
Erliegen. Das Herz wird gebremst, der periphere Widerstand nimmt ab - beides senkt den Blutdruck (negative Rückkopplung;  Abbildung).
Abbildung).

 Abbildung: Barorezeptoraktivität und Blutdruck
Kombinirt nach Vorlagen in Thies
R, Physiology, 3rd ed. Springer 1992; und (modifiziert) nach Sved AF,
Blood Pressure: Baroreceptors, in: Squire RL (ed), Encyclopedia of
Neurocsience 2009
Abbildung: Barorezeptoraktivität und Blutdruck
Kombinirt nach Vorlagen in Thies
R, Physiology, 3rd ed. Springer 1992; und (modifiziert) nach Sved AF,
Blood Pressure: Baroreceptors, in: Squire RL (ed), Encyclopedia of
Neurocsience 2009
Unten: Kennkurve
der Druckantwort der Barorezeptoren ("Antwortgröße" =
Aktionspotentialfrequenz): Mit steigender Dehnung (arteriellem Druck)
nimmt die Frequenz der Aktionspotentiale zu, die...
...über den IX.
(Glossopharyngeus; von Carotissinus) und X. Hirnnerv (Vagus; von Aortembogen) zum
nucl. tractus solitarii und Kreislaufzentrum im unteren Hirnstamm geleitet
werden (oben)

Der Barorezeptorreflex ist ein klassisches Beispiel eines Regelkreises
mit negativer Rückkopplung. Der arterielle Baroreflex adaptiert
rasch (Stunden bis Tage) und ist daher nur für momentane Korrekturen akuter Blutdruckschwankungen ausgelegt (z.B. bei Änderungen der Körperlage).
 Die
Adaptation des Baroreflexes ermöglicht optimale Kompensationswirkung
gegenüber akuten Störungen auch bei verändertem Druckniveau.
Die
Adaptation des Baroreflexes ermöglicht optimale Kompensationswirkung
gegenüber akuten Störungen auch bei verändertem Druckniveau.
Der Reflex passt sich längerfristigen Veränderungen des arteriellen Drucks an,
sodass er z.B. auch bei chronischer Hypertonie kurzfristige
Störungen (wie z.B. bei Veränderung der Körperlage) mit hoher Präzision
(steile Portion der Regulationskurve) korrigieren kann -
wenn auch auf verändertem Absolutniveau.
Wirkungen der Barorezeptoren auf das Gehirn:
Zunehmende Erregung der Barorezeptoren hat nicht nur Wirkungen auf das
Kreislaufzentrum in der medulla oblongata (abnehmender Sympathikustonus
→ Vasodilatation, Anregung parasympathischer Neurone → Absinken der
Herzfrequenz), sondern auch auf
 die Atmung (diese wird gedämpft),
die Atmung (diese wird gedämpft),
 den Muskeltonus (dieser sinkt ab) und
den Muskeltonus (dieser sinkt ab) und
 die elektrische Aktivität des Großhirns (Tendenz zur Synchronisation, im EEG erkennbar).
die elektrische Aktivität des Großhirns (Tendenz zur Synchronisation, im EEG erkennbar).

Sekundäre Regulation: Chemorezeptorreflexe
Der primäre Fokus der Barorezeptoren ist die Kreislaufregulation, derjenige der Chemorezeptoren die Regulation der Atmung. Baro-
und periphere Chemorezeptoren liegen nahe beieinander (Carotis,
Aortenbogen), haben ähnliche neuronale Verschaltungen, und wirken sich
beide auf den Kreislauf aus.

Zur
Steuerung der Atmung über Chemorezeptoren s.
dort
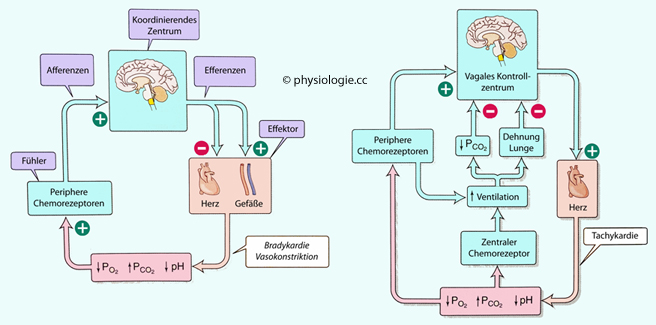

Abbildung: Einfluss der Chemorezeptoren auf die Kreislaufregulation
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
In diesem Beispiel wird ein Sinken des pO2, Anstieg des pCO2, und/oder Reduktion des pH (hypoxischer, Hyperkapnie-, Azidosereiz) als primärer Stimulus angenommen, der das System anregt.
Links: Das Grundschema der Regelung (intrinsische Kreislaufantwort auf chemorezeptive Reize); die Reaktion auf periphere Chemorezeptorreize alleine bewirkt Bradykardie und Vasokonstriktion.
Rechts: Integrierte Regulation mit Beteiligung der Atmung. Zentrale Chemorezeptoren regen bei hypoxischer, Hyperkapnie- und/oder Azidosereizung die Ventilation an; der pCO2, nimmt ab, was - zusammen
mit mechanozeptiven Reizen aus der Lunge - den parasympathischen Ast
des Kreislaufzentrums hemmt, die Herzfrequenz nimmt zu

I
m Gegensatz zu Barorezeptoren, deren Anregung das vasomotorische Zentrum im Hirnstamm hemmt (negative Rückkopplung, Vasodilatation, Senkung des Blutdrucks), regt gesteigerte Aktivität peripherer Chemorezeptoren - bedingt vor allem durch Hypoxie, auch Hyperkapnie und Azidose - das vasomotorische Zentrum an und bewirkt Vasokonstriktion. Was das Herz betrifft, regen beide Rezeptorgruppen (Baro- und periphere Chemorezeptoren) das kardioinhibitorische Zentrum an und senken die Herzfrequenz (Bradykardie) ( Abbildung, links). Anstieg des pO2, auch Absinken des pCO2 und Anstieg des pH, haben entgegengesetzte Wirkung (Vasodilatation, Tachykardie).
Welche physiologische Rolle
spielen diese Projektionen peripherer Chemorezeptoren auf das
Kreislaufzentrum? Unter normalen Bedingungen ändert sich der arterielle
pO2 nur geringfügig, das wirkt sich auf Blutdruck oder Herzfrequenz kaum aus. Hypoxie
Abbildung, links). Anstieg des pO2, auch Absinken des pCO2 und Anstieg des pH, haben entgegengesetzte Wirkung (Vasodilatation, Tachykardie).
Welche physiologische Rolle
spielen diese Projektionen peripherer Chemorezeptoren auf das
Kreislaufzentrum? Unter normalen Bedingungen ändert sich der arterielle
pO2 nur geringfügig, das wirkt sich auf Blutdruck oder Herzfrequenz kaum aus. Hypoxie hingegen (z.B. bei starkem Blutverlust) steigert reflektorisch die
Atmung, senkt dadurch den arteriellen pCO2 und verursacht so über zentrale Chemorezeptoren Tachykardie.
Die Tachykardie ist sinnvoll, da ein reduziertes Blutangebot
in ausgedehnten Gewebebereichen - wie durch sinkendes
Herzminutenvolumen (dessen Betrag an sich nicht von Rezeptoren im
Körper erfasst wird) verursacht - typischerweise Hypoxie, Hyperkapnie und Azidose
hervorruft. Eine Anregung des Herzens durch erhöhte Schlagfrequenz
steigert das Herzminutenvolumen und damit auch das Blutangebot an die
Peripherie. (Außerdem würde ein erhöhter arterieller pCO2 durch intrazellulären pH-Abfall die Schlagkraft der Herzmuskelzellen reduzieren.)
Die Meldung der peripheren Chemorezeptoren bleibt nicht alleine
wirksam, sondern wird durch weitere Faktoren ergänzt - wie den Effekt zentraler Chemorezeptoren, die vor allem die Wasserstoffionenkonzentration im Bereich des Hirnstamms messen. Sie werden durch steigenden pCO2 (und Absinken des pH) stimuliert, was das vasomotorische Zentrum anregt (disinhibiert, d.h. den bremsenden Einfluss der Barorezeptoren zurückdrängt) und zu einem Anstieg der Herzfrequenz (Tachykardie) führt. Das Atemzentrum
der medulla oblongata übt so einen intensiven Einfluss auf das Kreislaufzentrum
aus.
Der tonische Einfluss der Barorezeptoren auf den nucleus tractus solitarii
regt inhibitorische Interneuronen an, die auf das vasomotorische
Zentrum projizieren. Das bewirkt eine Unterdrückung sympathischer
Aktivität und reduziert den peripheren Widerstand. Zunehmende Aktivität
zentraler Chemorezeptoren unterbricht diese Wirkung und führt damit
zu Disinhibition der Vasomotoren.
Insgesamt stimuliert sowohl
Sauerstoffmangel (über den peripheren Weg) als auch Hyperkapnie (über
den zentralen Mechanismus) das Vasomotorenzentrum; die beiden Reize
wirken synergistisch und bewirken über den Sympathikus systemische Vasokonstriktion.
Einfluss pulmonaler Dehnungs- und nozizeptiver Reize
Verschiedene weitere sensorische Afferenzen wirken sich auf Herzfrequenz und Blutdruck aus, insbesondere:
 Reizung von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch Inhibition vagaler Efferenzen im Hirnstamm. Das trägt zur atmungssynchronen Sinusarrhythmie bei. Plötzliche tiefe Einatmung löst auch Vasokonstriktion in der Haut aus (inspiratory gasp reflex)
Reizung von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch Inhibition vagaler Efferenzen im Hirnstamm. Das trägt zur atmungssynchronen Sinusarrhythmie bei. Plötzliche tiefe Einatmung löst auch Vasokonstriktion in der Haut aus (inspiratory gasp reflex)
 Somatische Schmerzreize
können ebenfalls den Herzschlag beschleunigen und den Blutdruck
steigern. Umgekehrt kann starke Reizung viszeraler Schmerzfasern
Bradykardie und Blutdruckabfall auslösen. Kältereize können hypertensiv wirken, andere Stressoren (plötzlicher Lärm, Bedrohung) Tachykardie auslösen. Sexuelle Erregung steigert ebenfalls Pulsfrequenz und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus (Bradykardie).
Somatische Schmerzreize
können ebenfalls den Herzschlag beschleunigen und den Blutdruck
steigern. Umgekehrt kann starke Reizung viszeraler Schmerzfasern
Bradykardie und Blutdruckabfall auslösen. Kältereize können hypertensiv wirken, andere Stressoren (plötzlicher Lärm, Bedrohung) Tachykardie auslösen. Sexuelle Erregung steigert ebenfalls Pulsfrequenz und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus (Bradykardie).
Über längere Zeiträume wirken Regelkreise, die weniger stark adaptieren
Der
Barorezeptorreflex stabilisiert die Höhe des arteriellen Blutdrucks nur
für kurze Zeiträume; Denervierung führt dazu, dass Störungen des
Systems (z.B. Lagewechsel) zu stärkeren Abweichungen vom
Blutdruck-Sollwert führen ( Abbildung).
Abbildung).

 Abbildung: Beitrag der Barorezeptoren zur Stabilität des Blutdrucks
Abbildung: Beitrag der Barorezeptoren zur Stabilität des Blutdrucks
Nach
Cowley AW Jr, Liard JF, Guyton AC: Circ Res 1973; 32: 546-76; und
Persson PB, Ehmke H, Kirchheim HR, News Physiol Sci 1989; 4: 56-9
Oben:
Mit intakter Verbindung der Barorezeptoren mit dem nucleus tractus
solitarii im Hirnstamm (grüne Kurve: Kontrolle) ist der Blutdruck (hier
um ~100 mmHg) präziser reguliert als ohne Anbindung der Rezeptoren an das Gehirn (rote Kurve).
Unten: Sind auch die Afferenzen
von den kardiopulmonären (Niederdruck-, "Volumen"-Rezeptoren)
blockiert, streut nicht nur der Blutdruck breiter, sondern er ist auch
zu höheren Werten hin (um ~140 mmHg) verschoben.
Das bedeutet, dass die Afferenz von den kardiopulmonären Rezeptoren für die zentrale Einstellung der richtigen Höhe des Blutdruck-Sollwertes unverzichtbar sind; die Afferenz von den arteriellen Barorezeptoren ermöglicht hingegen eine präzisere Kontrolle des Blutdrucks um den korrekten Sollwert

 Abbildung). Das bedeutet, dass der arterielle Barorezeptorreflex
die Abweichungen vom Sollwert gering hält, während der
Niederdruckanteil des Systems den Sollwert des Mitteldruckes
einstellt.
Abbildung). Das bedeutet, dass der arterielle Barorezeptorreflex
die Abweichungen vom Sollwert gering hält, während der
Niederdruckanteil des Systems den Sollwert des Mitteldruckes
einstellt.
Zur Langzeitregulierung des
arteriellen Drucks eignet sich der Barorezeptorreflex nicht; hier
spielen Mechanismen
eine Rolle, die mit der Einstellung des Blutvolumens (z.B.
Renin-Angiotensin-Aldosteronsystem, Vasopressin) und der
Aufnahmefähigkeit der Gefäßbäume (Compliance-Anpassung) zu tun haben.
Aufrechtes
Stehen führt schon wenige Minuten nach einem Wechsel aus der liegenden
(oder sitzenden) Position zu deutlichem Aldosteronanstieg im Blut;
dadurch kommt es zu kreislaufunterstützenden Effekten, die bis zu
Stunden nach dem Orthostasereiz nachwirken können.
Sympathische
Nervenfasern beeinflussen Gefäße und
Tubuli in der Niere, afferente Fasern senden von hier Information über
mechanische (Druck, Volumen) und chemische Veränderungen (pH, Atemgase)
zum Rückenmark.
Eine besonders wichtige Rolle für die Blutdruck- und Kreislaufregulation spielen die nuclei tractus solitarii
(NTS) in der medulla oblongata, auf welche die meisten Afferenzen von
den Blutdruckrezeptoren projizieren (Glutamat oder Substanz P dürften hier als Neurotransmitter wirken).
Von den
NTS ziehen inhibitorische Interneurone zu einem vasomotorischen Areal
in ventromedialen Teilen der medulla oblongata. Hier finden sich
A1- und C1-Zellen (adrenerg, catecholaminerg); das C1-Areal hat tonisch vasokonstriktorische Wirkung, Hemmung durch den NTS hebt diesen Tonus auf und bewirkt Vasodilatation.
Steigt z.B. der Blutdruck, werden die
Barorezeptoren stärker
gereizt, die Aktionspotentialfrequenz der afferenten Fasern nimmt zu.
Hemmende Interneurone aus dem nucleus tractus solitarii
wirken auf C1-Neurone, es kommt zu Vasodilatation und Blutdruckabfall
(negative Rückkopplung). Dieser Weg dominiert die Gefäßkomponente des Baroreflexes. (Das Aktivitätsmuster der C1-Fasern ist mit dem Herzzyklus gekoppelt.)
Andere exzitatorische Interneurone ziehen vom nucleus tractus solitarii zu einem kardioinhibitorischen Areal ( Abbildung oben), das den dorsalen motorischen Vaguskern und den nucleus ambiguus einschließt. Neuronen aus dem dorsalen motorischen Vaguskern stellen die Herzkomponente des Barozeptorreflexes im Sinne einer Frequenzsenkung (Bradykardie).
Abbildung oben), das den dorsalen motorischen Vaguskern und den nucleus ambiguus einschließt. Neuronen aus dem dorsalen motorischen Vaguskern stellen die Herzkomponente des Barozeptorreflexes im Sinne einer Frequenzsenkung (Bradykardie).
Auch ein kardioakzeleratorisches Areal
befindet sich in der (dorsalen) medulla oblongata, wahrscheinlich wird
dieses von inhibitorischen Interneuronen aus dem NTS beeinflusst.
Der efferente Schenkel des Baroreflexes schließt sowohl sympathische als auch parasympathische Leitungen ein:
 Sympathische
Efferenzen fußen sowohl im vasomotorischen als auch im
kardioakzeleratorischen Areal der medulla oblongata. "Bulbospinale"
Neuronen ziehen von hier direkt zu präganglionären Zellen im
Rückenmark, was Umschaltung auf postganglionäre Zellen in vegetativen
Ganglien und noradrenergen Einfluss auf Herz und Gefäße zur Folge hat:
Sympathische
Efferenzen fußen sowohl im vasomotorischen als auch im
kardioakzeleratorischen Areal der medulla oblongata. "Bulbospinale"
Neuronen ziehen von hier direkt zu präganglionären Zellen im
Rückenmark, was Umschaltung auf postganglionäre Zellen in vegetativen
Ganglien und noradrenergen Einfluss auf Herz und Gefäße zur Folge hat:
 Herzanregung
(positiv inotrop, chronotrop etc) und
Herzanregung
(positiv inotrop, chronotrop etc) und

 Vasokonstriktion, resultierend in
Vasokonstriktion, resultierend in

 erhöhtem Herzzeitvolumen, Blutdruckanstieg, Perfusionssteigerung in
betreffenden Geweben / Organen.
erhöhtem Herzzeitvolumen, Blutdruckanstieg, Perfusionssteigerung in
betreffenden Geweben / Organen.
Anregung des Baroreflexes regt den nucleus tractus solitarii an, hemmt so die tonische
Aktivität der C1-Neurone (s. oben) und dämpft damit Herztätigkeit und
Gefäßtonus.
 Parasympathische Efferenzen werden über Anregung des nucleus tractus solitarii, nucleus ambiguus und des dorsalen
motorischen Vaguskerns aktiviert: Es wird also das kardioinhibitorische
Areal aktiv. Fasern des N. vagus (X) bringen die Information zum
Herzen, wo die Umschaltung auf postganglionäre Fasern erfolgt und die
Herzqualitäten negativ beeinflusst werden, vor allem die Chronotropie
(Frequenzsenkung).
Parasympathische Efferenzen werden über Anregung des nucleus tractus solitarii, nucleus ambiguus und des dorsalen
motorischen Vaguskerns aktiviert: Es wird also das kardioinhibitorische
Areal aktiv. Fasern des N. vagus (X) bringen die Information zum
Herzen, wo die Umschaltung auf postganglionäre Fasern erfolgt und die
Herzqualitäten negativ beeinflusst werden, vor allem die Chronotropie
(Frequenzsenkung).
Recht kurzfristig beteiligen sich auch hormonelle Komponenten an der Blutdruckregulation:
 Aldosteron ist das "Salzsparhormon" des Körpers, ohne seine
Wirkung kommt es zu
lebensbedrohlichem Salzverlust (und Hypovolämie). Aldosteron wird immer
dann vermehrt freigesetzt, wenn es zu zentralem Druckabfall kommt (z.B.
beim Aufrichten / Aufstehen aus liegender Ruhelage) - es steigert den
Blutdruck, indem es Kochsalz im Körper zurückhält und das
extrazelluläre Volumen erhöht.
Aldosteron ist das "Salzsparhormon" des Körpers, ohne seine
Wirkung kommt es zu
lebensbedrohlichem Salzverlust (und Hypovolämie). Aldosteron wird immer
dann vermehrt freigesetzt, wenn es zu zentralem Druckabfall kommt (z.B.
beim Aufrichten / Aufstehen aus liegender Ruhelage) - es steigert den
Blutdruck, indem es Kochsalz im Körper zurückhält und das
extrazelluläre Volumen erhöht.

 Abbildung: Vasopressinkonzentration im Blutplasma als Funktion eines Blutdruckabfalls
Abbildung: Vasopressinkonzentration im Blutplasma als Funktion eines Blutdruckabfalls
Nach Daten in Baylis PH: Osmoregulation and control of vasopressin secretion in healthy humans. Am J Physiol 1987; 253: R671
Bei
mehreren Probanden wurde der arterielle Blutdruck durch Infusion eines
Ganglienblockers bis um ~35% abgesenkt. Mit zunehmendem Hypotoniegrad
steigt die Vasopressinausschüttung exponentiell an (Kurve)

 Vasopressin bewirkt
u.a. eine Erhöhung der im Körper verbleibenden Wassermenge
("Wassersparhormon"). Es wird aber auch bei Volumenproblemen intensiv
ausgeschüttet, die im zentralen Kreislaufbereich auftreten - umso
stärker, je größer das Problem für die Blutdruckregulation wird
(
Vasopressin bewirkt
u.a. eine Erhöhung der im Körper verbleibenden Wassermenge
("Wassersparhormon"). Es wird aber auch bei Volumenproblemen intensiv
ausgeschüttet, die im zentralen Kreislaufbereich auftreten - umso
stärker, je größer das Problem für die Blutdruckregulation wird
( Abbildung).
Abbildung).
Der Mechanismus ist eine reflektorische Aktivierung
des Hypothalamus durch sinkende Dehnung der arteriellen Baro-, aber
auch der kardiopulmonalen Volumenrezeptoren. Die Wirkung erfolgt über V1-Vasopressinrezeptoren an den Blutgefäßen.
 Der Sympathikus wird bei Kreislaufbelastung, Blutverlust, Stress, Lärm u.a.
stimuliert. Er regt direkt die tubuläre Rückgewinnung von Salz und Wasser an, aktiviert den Reninmechanismus (
Der Sympathikus wird bei Kreislaufbelastung, Blutverlust, Stress, Lärm u.a.
stimuliert. Er regt direkt die tubuläre Rückgewinnung von Salz und Wasser an, aktiviert den Reninmechanismus ( Abbildung) - und damit wiederum Aldosteron.
In der Niere wirken sympathische Fasern bei höherer Aktivität
vasokonstriktorisch, das senkt die Nierendurchblutung (entgegen der
Autoregulation, welche ein
Gleichbleiben der renalen Durchblutung zum Ziel hat).
Abbildung) - und damit wiederum Aldosteron.
In der Niere wirken sympathische Fasern bei höherer Aktivität
vasokonstriktorisch, das senkt die Nierendurchblutung (entgegen der
Autoregulation, welche ein
Gleichbleiben der renalen Durchblutung zum Ziel hat).
 Atriale natriuretische Peptide wirken schließlich salz-und wasserausscheidend, sind also Gegenspieler, die den Blutdruck wieder senken können.
Atriale natriuretische Peptide wirken schließlich salz-und wasserausscheidend, sind also Gegenspieler, die den Blutdruck wieder senken können.
 Lokale Wirkstoffe beeinflussen
Gefäßtonus, Widerstand und damit Perfusion / Blutdruck ebenfalls.
Lokale Wirkstoffe beeinflussen
Gefäßtonus, Widerstand und damit Perfusion / Blutdruck ebenfalls.

 Abbildung: Blutdrucksenkung durch Prostaglandine
Abbildung: Blutdrucksenkung durch Prostaglandine
Modifiziert nach Chi Y, Jasmin JF, Yoshinori Seki Y, Lisanti MP,
Charron MJ, Lefer DJ, Schuster VL. Inhibition of the Prostaglandin
Transporter PGT Lowers Blood Pressure in Hypertensive Rats and Mice.
PLOS One 2015; 10: e.0131735
Wahrscheinlicher
Mechanismus: Prostaglandine wirken vasodilatierend und regen die
Natriumausscheidung an, beides senkt den Blutdruck


TXA
2, PGG
2 und PGH
2 bewirken TP-Rezeptorvermittelte
Vasokonstriktion und wirken blutdrucksteigernd; dieser Effekt kann aber durch
 vasodilatative
vasodilatative Effekte von PGI
2,
PGD und PGE überlagert sein. Diese erweitern über IP-, DP- und
EP-Rezeptoren die meisten Gefäßgebiete und wirken dadurch
blutdrucksenkend. Gesteigerte Natriumexkretion könnte den hypotensiven Effekt verstärken (

Abbildung)
E-Prostaglandine wirken auf vasokonstringierende EP1- und EP3-Rezeptoren; bei intravenöser Gabe von PGE1
überwiegt aber der dilatierende Effekt, der Blutdruck nimmt auch im
Herzen ab (enddiastolisch und endsystolisch), was wiederum
reflektorische Frequenzsteigerung bewirkt und das Herzminutenvolumen
steigert.
Zu den Langzeitwirkungen von Prostaglandinen zählen vermutlich Einflüsse auf Gefäßwanddifferenzierung und Genregulation.
 Abbildung: Einflüsse auf peripheren Widerstand und Herzzeitvolumen bestimmen den arteriellen Blutdruck
Abbildung: Einflüsse auf peripheren Widerstand und Herzzeitvolumen bestimmen den arteriellen Blutdruck
Nach Allen W. Cowley, Jr. The genetic dissection of essential hypertension. Nature Reviews Genetics 2006; 7: 829-40
Integrierte Blutdruckregulation, kurz- und langzeitige Veränderungen.
Der arterielle
Blutdruck steigt mit Herzzeitvolumen und peripherem Widerstand.
Durchgezogene Linien: direkte Wirkung;
strichlierte Linien: Negative Rückkopplungsschleifen
NO, Stickstoffmonoxid; ROS, reaktive Sauerstoffspezies (Radikale)

 Über längere Zeiträume treten Mechanismen in den Vordergrund,
die nicht mehr einen einfachen hydromechanischen Kreislauf mit
konstanten physikalischen Eigenschaften repräsentieren, sondern
Anpassungen von Volumina, deren Verteilung, ferner von Eigenschaften
der Gefäßwände (Dehnbarkeit, Tonus) und der Herzfunktion.
Über längere Zeiträume treten Mechanismen in den Vordergrund,
die nicht mehr einen einfachen hydromechanischen Kreislauf mit
konstanten physikalischen Eigenschaften repräsentieren, sondern
Anpassungen von Volumina, deren Verteilung, ferner von Eigenschaften
der Gefäßwände (Dehnbarkeit, Tonus) und der Herzfunktion.
Über noch längere Zeiträume machen solche adaptiven Vorgänge letztlich auch die Anpassung
an veränderte Dimensionen nicht nur einzelner Organe (z.B. Muskulatur),
sondern auch des ganzen Körpers möglich (Wachstum!).
Der Organismus ist
in der Lage, seine Kreislaufregulation an veränderte
Randbedingungen anzupassen. Ziel der Regelungen ist in erster Linie die Stabilität des arteriellen Blutdrucks und das Erreichen
optimaler Durchblutungswerte.
Dies
implementiert morphologische Veränderungen, wie Änderungen der
Gefäßwandstrukturen und allenfalls auch des Herzmuskels (Hypertrophie?)
sowie die Bildung neuer Mikrogefäße (Kapillarisierung,  Abbildung).
Abbildung).
Eine wichtige Rolle spielt auch das Kalium:
Insbesondere bei Hypertonikern schützt erhöhte Kaliumaufnahme vor
Bluthochdruck. Der antihypertensive Effekt wird auf mehrere Faktoren
zurückgeführt, wie erhöhte Natriurese, modifizierender Einfluss auf den
Baroreflex, direkte Vasodilatation, sowie abgeschwächte Wirkung von
Vasokonstriktoren (wie Noradrenalin, Angiotensin II).
Antworten auf Änderungen von Volumen, Blutdruck, Osmolalität

Nach Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
|
Reiz
|
Involviertes Organ / Gewebe
|
Reaktion
|
Blutdruckabfall
|
Direkte Effekte
|
|
Juxtaglomeruläre Zellen
|
Reninbildung
|
|
Glomerula
|
Sinkende glomeruläre Filtration
|
Reflexwirkungen
|
Barorezeptoren
(Carotis, Aorta)
|
Kreislaufzentrum
|
Steigender Sympathikustonus, sinkender Parasympathikustonus
|
Barorezeptoren
(Carotis, Aorta) |
Hypothalamus
|
Durstempfinden
|
Barorezeptoren
(Carotis, Aorta) |
Hypothalamus
|
Vasopressinsekretion
|
| Barorezeptoren in Herzvorhöfen |
Hypothalamus |
Durstempfinden |
| Barorezeptoren in Herzvorhöfen |
Hypothalamus |
Vasopressinsekretion |
Blutdruckanstieg
|
| Direkte Effekte |
|
Glomerula |
Vorübergehende Erhöhung der glomerulären Filtration
|
|
Myokardzellen
|
Sekretion natriuretischer Peptide
|
| Reflexwirkungen |
Barorezeptoren
(Carotis, Aorta) |
Kreislaufzentrum |
Sinkender Sympathikustonus, steigender Parasympathikustonus |
Barorezeptoren
(Carotis, Aorta) |
Hypothalamus |
Senkung des Durstempfindens |
Barorezeptoren
(Carotis, Aorta) |
Hypothalamus |
Senkung der Vasopressinsekretion |
| Barorezeptoren in Herzvorhöfen |
Hypothalamus |
Senkung des Durstempfindens |
| Barorezeptoren in Herzvorhöfen |
Hypothalamus |
Senkung der Vasopressinsekretion |
Osmolaritätsanstieg
|
| Direkte Effekte |
Starke Dehydrierung
|
Nebennierenrinde
|
Reduzierte Aldosteronsekretion
|
| Reflexwirkungen |
Osmorezeptoren
|
Hypothalamus
|
Durstempfinden
|
| Osmorezeptoren |
Hypothalamus |
Vasopressinsekretion
|
Osmolaritätsabfall
|
| Direkte Effekte |
Starke Hyponatriämie
|
Nebennierenrinde |
Erhöhte Aldosteronsekretion
|
| Reflexwirkungen |
| Osmorezeptoren |
Hypothalamus |
Erniedrigte Vasopressinsekretion |
Körperliche Belastung aktiviert ein gewichtetes Programm der Blutdruckstabilisierung
Bei
Muskelarbeit treten die stärksten Herausforderungen an die
Kreislaufregulation zutage ( Abbildung). Die Pumpleistung des
Herzens kann bis zum 4- bis 5-fachen des Ruhewertes ansteigen, hauptsächlich
bedingt durch Frequenzerhöhung (Faktor ~3) und auch durch
gesteigertes Schlagvolumen (Faktor ~1,5).
Abbildung). Die Pumpleistung des
Herzens kann bis zum 4- bis 5-fachen des Ruhewertes ansteigen, hauptsächlich
bedingt durch Frequenzerhöhung (Faktor ~3) und auch durch
gesteigertes Schlagvolumen (Faktor ~1,5).


Höhere Zentren (Hypothalamus, Großhirn) werden bei Beginn willkürlicher Muskelaktivität aktiv.
Das ermöglicht "
frühe" Kreislaufeinstellung (Motorik → Aktivierung des Sympathikus → Vasokonstriktion in Geweben wie
Haut, Baucheingeweiden, Nieren, inaktiver Muskulatur, nicht aber in
aktiver Muskulatur, wo es zu Gefäßerweiterung kommt) und kann
als
Vorwärtskoppelung
gesehen werden.
Die frühe Kreislaufantwort erzielt erhöhtes
Herzminutenvolumen und Vasokonstriktion, beides Faktoren, die den
Blutdruck in einer Situation aufrechterhält (und meist steigert), wo
ein Teil der Peripherie (=Widerstandsgefäße in der aktiven Muskulatur)
den Strömungswiderstand senkt.
Dieser Effekt ist durch Autoregulation
erklärbar (lokaler Bedarf → lokale Vasodilatation); er ist (beim
Menschen) nicht zentral gesteuert.
 Verzögerte
Verzögerte Reaktionen stammen aus dem Bewegungsapparat selbst und von anderen reflektorischen Komponenten. Hierher gehören
Histaminfreisetzung,
Adrenalinwirkung,
Temperaturregulation (Wirkung von
Kallikrein).
Durch das Zusammenspiel dieser Komponenten werden einerseits die
gesteigerten Kreislaufanforderungen erfüllt, andererseits bleibt der
Blutdruck stabil.
Körperliche Belastung wirkt sich auf den systolischen Blutdruck
aus: Dieser nimmt mit Dauer und Intensität körperlicher Belastung zu
( Abbildung). Das Ausmaß dieser Steigerung hat prädiktiven Wert für
spätere Probleme wie Hypertonie oder Erkrankung der Herzkranzgefäße.
(Der diastolische Wert ändert sich nicht wesentlich, die
Blutdruckamplitude steigt unter Belastung an.)
Abbildung). Das Ausmaß dieser Steigerung hat prädiktiven Wert für
spätere Probleme wie Hypertonie oder Erkrankung der Herzkranzgefäße.
(Der diastolische Wert ändert sich nicht wesentlich, die
Blutdruckamplitude steigt unter Belastung an.)

 Abbildung: Systolischer Blutdruck als Funktion der Dauer maximaler körperlicher Ausbelastung
Abbildung: Systolischer Blutdruck als Funktion der Dauer maximaler körperlicher Ausbelastung
Nach Kurl S, Laukkanen JA, Rauramaa R, Lakka TA,
Sivenius J, Salonen JT. Systolic Blood Pressure Response to Exercise
Stress Test and Risk of Stroke. Stroke. 2001; 32: 2036-41
Mittelwerte und einfacher Standardabweichungsbereich (SD)
bei einem großen Kollektiv an gesunden, unmedizierten Männern, die am
Ergometer bis zur Belastungsgrenze gingen (stufenweiser Anstieg um 20
W/min).
Der systolische Mitelwert stieg innerhalb von 10 Minuten von
etwa 150 auf über 200 mmHg
 Zur Regulation der Muskeldurchblutung s. auch dort
Zur Regulation der Muskeldurchblutung s. auch dort
Beeinflussung der Herztätigkeit
Die Pumpleistung des Herzens ist bestimmt durch Vorlast (preload;
früher: "vis a tergo"), Nachlast (afterload;
früher: "vis a fronte") und den Zustand des Myokards (Inotropie):
 Als Maß für die Vorlast gilt der Füllungsdruck in den Vorhöfen - im
Bereich des rechten Vorhofs der Zentralvenendruck, links im Vorhof bzw.
den Pulmonalvenen.
Als Maß für die Vorlast gilt der Füllungsdruck in den Vorhöfen - im
Bereich des rechten Vorhofs der Zentralvenendruck, links im Vorhof bzw.
den Pulmonalvenen.
 Steigt die Vorlast, nimmt die Ventrikelfüllung zu - und umgekehrt.
Steigt die Vorlast, nimmt die Ventrikelfüllung zu - und umgekehrt.
Ein wesentlicher Faktor für
die Vorlast ist die Körperlage (Füllungsdruck steigt beim Hinlegen, sinkt beim
Aufstehen), das Blutvolumen und der Zustand der Blutgefäße (venöse
Füllung, Sympathikustonus, Complianceveränderungen u.a.).

 Abbildung: Einflüsse, welche die Vorlast (preload) des Herzens bestimmen
Abbildung: Einflüsse, welche die Vorlast (preload) des Herzens bestimmen
Die Qualität der diastolischen Entspannung des Herzmuskels wird durch die Lusitropie angegeben

 Der Zustand des Herzmuskels wird durch Faktoren wie Muskelmasse, Dehnungszustand, Durchblutung der Herzkranzgefäße bestimmt.
Einflüsse auf die "Fitness" des Herzmuskels als Förderpumpe nennt man inotrop.
Positiv inotrop wirkt z.B. ein verbessertes Angebot an Substraten für
den Energiehaushalt des Myokards, bessere Durchblutung, hohe
Sauerstoffsättigung des arteriellen Hämoglobins.
Der Zustand des Herzmuskels wird durch Faktoren wie Muskelmasse, Dehnungszustand, Durchblutung der Herzkranzgefäße bestimmt.
Einflüsse auf die "Fitness" des Herzmuskels als Förderpumpe nennt man inotrop.
Positiv inotrop wirkt z.B. ein verbessertes Angebot an Substraten für
den Energiehaushalt des Myokards, bessere Durchblutung, hohe
Sauerstoffsättigung des arteriellen Hämoglobins.
 Die Nachlast wird repräsentiert durch den arteriellen Druck in
Pulmonalarterie bzw. Aorta (eigentlich die Impedanz, also der dynamische Widerstand, gegen den der Ventrikel Blut fördert). Je höher der arterielle Druck und je
geringer die Dehnbarkeit der arteriellen Gefäße (insbesondere der
Aortenwurzel), desto höher ist der Arbeitsaufwand des Myokards während
der Austreibungszeit.
Die Nachlast wird repräsentiert durch den arteriellen Druck in
Pulmonalarterie bzw. Aorta (eigentlich die Impedanz, also der dynamische Widerstand, gegen den der Ventrikel Blut fördert). Je höher der arterielle Druck und je
geringer die Dehnbarkeit der arteriellen Gefäße (insbesondere der
Aortenwurzel), desto höher ist der Arbeitsaufwand des Myokards während
der Austreibungszeit.
Steigt die Nachlast, nimmt das Schlagvolumen ab - und umgekehrt.
Medikamentöse Vasodilatation senkt den peripheren Widerstand und die Nachlast - ein Effekt, der therapeutisch zur Schonung eines überlasteten Herzens eingesetzt wird.
Beeinflussung des Säure-Basen-Haushalts
Die
Kreislaufregulation kann den Säure-Basen-Haushalt beeinflussen:

Abnahme des
(effektiv zirkulierenden) Blutvolumens steigert die
Sympathikusaktivität und regt die Bildung von Angiotensin an


Dadurch
wird der Na-H-Austausch im proximalen Tubulus und damit die H
+-Sekretion in der Niere angeregt


Bei längerer Dauer steigt auch die Aldosteronwirkung (H
+-Sekretion im distalen Tubulus).
Volumenerhöhung hat den gegenteiligen Effekt (verringerte Säureausscheidung).
Signale von Chemorezeptoren beeinflussen die Kreislaufsteuerung: "Alarmsignale", wie sinkender pH (Azidose), steigender pCO2 (Hyperkapnie) oder sinkender pO2
(Hypoxie) regen über periphere (glomera aortica & carotica) und
zentrale Chemorezeptoren (Rautengrube) das medulläre Kreislaufzentrum
an und bewirken Vasokonstriktion (→ Blutdruckanstieg) und eventuell
(bei fixierter Atmung) Senkung der Herzfrequenz (Bradykardie).
Einfluss von Körperposition, Venenfüllung, Atemtätigkeit
 Orthostase
Orthostase  (=aufrechte Körperlage):
Nimmt der Rückstrom von Blut aus dem Venensystem zum Herzen ab (wie beim Aufrichten
des Körpers), wirkt der
Lungenkreislauf als kurzzeitige Füllungsreserve für das linke Herz und
stabilisiert den arteriellen Druck. Sinkt der venöse Rückstrom zum
Herzen, nimmt auch das Herzminutenvolumen ab (bei Orthostase um ~30%), in den Beinvenen werden ~10% des Blutvolumens zusätzlich
eingelagert.
(=aufrechte Körperlage):
Nimmt der Rückstrom von Blut aus dem Venensystem zum Herzen ab (wie beim Aufrichten
des Körpers), wirkt der
Lungenkreislauf als kurzzeitige Füllungsreserve für das linke Herz und
stabilisiert den arteriellen Druck. Sinkt der venöse Rückstrom zum
Herzen, nimmt auch das Herzminutenvolumen ab (bei Orthostase um ~30%), in den Beinvenen werden ~10% des Blutvolumens zusätzlich
eingelagert.
Wechsel
vom Liegen zum Stehen (Orthostase) senkt den Blutrückstrom zum Herzen
(Zwischenspeicherung in Beinvenen) und bewirkt eine Abnahme des
Herzzeitvolumens um ~30%
Orthostase erhöht reflektorisch den peripheren Widerstand und die Pulsfrequenz (Blutdruckstabilisierung)
Es kommt zu Reduktion der Durchblutung
* des Gehirns (wegen des sinkenden hydrostatischen Drucks)
* der Nieren (wegen des reflektorisch erhöhten Sympathikustonus)
|
Dennoch
bleibt normalerweise der systolische Blutdruck unverändert, der
Mitteldruck steigt sogar etwas an. Grund dafür ist die orthostatische Reaktion (orthostatic response): Reflexe, die von
kardiopulmonalen Rezeptoren (Dehnungsmessfühler in der Wand der
herznahen Lungengefäße sowie der Vorhöfe) und arteriellen
Barorezeptoren (Carotis, juxtaglomerulärer Apparat der Nieren) ausgehen.
 Zahlreiche Faktoren beeinflussen das Ausmaß einer orthostatischen Reaktion, insbesondere: Blutvolumen und seine Verteilung, systemischer Füllungsdruck; Dehnbarkeit der Gefäße, insbesondere der Venen in unteren Körperpartien; Lage der hydrostatischen Indifferenz; Grad der Kippung (Kipptisch); Muskeltonus; Funktion von Hoch- und Niederdruckrezeptoren; Temperatur; Herzfrequenz zu Beginn des Reizes; Sympathikustonus; Kontraktilität des Herzmuskels; Empfindlichkeit der Gefäße gegenüber konstriktorischen Impulsen.
Zahlreiche Faktoren beeinflussen das Ausmaß einer orthostatischen Reaktion, insbesondere: Blutvolumen und seine Verteilung, systemischer Füllungsdruck; Dehnbarkeit der Gefäße, insbesondere der Venen in unteren Körperpartien; Lage der hydrostatischen Indifferenz; Grad der Kippung (Kipptisch); Muskeltonus; Funktion von Hoch- und Niederdruckrezeptoren; Temperatur; Herzfrequenz zu Beginn des Reizes; Sympathikustonus; Kontraktilität des Herzmuskels; Empfindlichkeit der Gefäße gegenüber konstriktorischen Impulsen.
Um den Blutdruck aufrechtzuerhalten, steigt bei Orthostase der
periphere Widerstand - das heißt, die Arteriolen kontrahieren. Dies geschieht auf Kosten der Durchblutung von
Eingeweiden, Muskulatur und Haut. Die Herzfrequenz nimmt deutlich zu
(Pulsanstieg beim Aufstehen). Bei ungenügender Erhöhung des
peripheren Widerstands nimmt der Blutdruck hingegen ab; hochgradige
Mangeldurchblutung des Gehirns kann zu Bewusstlosigkeit führen, man
spricht von einem orthostatischen Kollaps.
Auch die Beinvenen (z.B. v.
saphena) beteiligen sich an der Gegenregulation: Sie sind zu
anhaltender Kontraktion fähig und senken dadurch die orthostatische
Blutspeicherung in den unteren Körperpartien, die sich aus
hydrostatischen Gründen bei aufrechter Körperhaltung ergibt. Das ist wesentlich, da das Venensystem eine relativ hohe Compliance aufweist.
Insgesamt wird Kreislaufstabilität bei orthostatischer Belastung
mehrfach erzielt: Einerseits sinkt in den abhängigen Körperpartien
(untere Extremitäten) der arterielle Zustrom durch arterioläre
Konstriktion (verringerte Perfusion minimiert Venenfüllung),
andererseits nimmt der Venentonus zu (verringerte Compliance), beides
wirkt dem "Versacken" von Blut im Niederdrucksystem und ungenügender
Herzfüllung
entgegen.
Trotzdem nimmt das Herzzeitvolumen in Orthostase deutlich ab
- es sei denn, es kommt gleichzeitig zu Muskelaktivierung (sportliche
Belastung); dann kommt der Effekt der "Muskelpumpe" zum Tragen, die
Kreislaufregulation wird insgesamt umgestellt und die Herztätigkeit
zusätzlich angeregt.

 Auch die Atmung wirkt sich auf die venöse Blutfüllung aus ("Atempumpe"):
Auch die Atmung wirkt sich auf die venöse Blutfüllung aus ("Atempumpe"):
 Zunehmender transmuraler Druck bei der Einatmung weitet die rechte
Herzkammer und erhöht Vorlast und Schlagvolumen. Der sinkende
Vorhofdruck vergrößert den Druckgradienten Peripherie - Herz, der
venöse Rückstrom steigt an. Die umgekehrten Effekte während der Ausatmung sind weniger wirksam.
Zunehmender transmuraler Druck bei der Einatmung weitet die rechte
Herzkammer und erhöht Vorlast und Schlagvolumen. Der sinkende
Vorhofdruck vergrößert den Druckgradienten Peripherie - Herz, der
venöse Rückstrom steigt an. Die umgekehrten Effekte während der Ausatmung sind weniger wirksam.
 Die Einatmung erhöht das Blutvolumen in der Lunge und senkt vorübergehend den Bluteinstrom in den linken Vorhof - die Auswurfleistung des linken Ventrikels nimmt während der Inspiration ab.
Die Einatmung erhöht das Blutvolumen in der Lunge und senkt vorübergehend den Bluteinstrom in den linken Vorhof - die Auswurfleistung des linken Ventrikels nimmt während der Inspiration ab.
Insgesamt verstärkt rasche und/oder vertiefte Atmung das Herzzeitvolumen.
Integrierte Kreislaufregulation, Reaktion auf Blutverlust
Die Größe des
Herzzeitvolumens ist abhängig von einem komplexen Zusammenspiel von
extrazellulärem Volumen, Blutvolumen, arteriellen und venösen
Compliance- und Widerstandswerten.

 Abbildung: Experimentelle Untersuchung der Kreislauffunktionen
Abbildung: Experimentelle Untersuchung der Kreislauffunktionen
Photo © H. Hinghofer-Szalkay
Die
Testperson liegt auf einem Kipptisch. Wird sie in aufrechte Position
gebracht, ändern sich physiologoischerweise zahlreiche Zustandsgrößen,
z.B. sinkt das Herzzeitvolumen (Blutmenge, die das Herz pro Zeiteinheit
auswirft) um ca. 30%

So kann in einer kritischen Kreislaufsituation (etwa bei Blutverlust)
eine Erniedrigung der venösen Compliance (durch Erhöhung des
Sympathikustonus, Gefäßkontraktion und damit Drucksteigerung im
Niederdrucksystem) zu gesteigertem Blutrückstrom zum Herzen
(verbessertes Blutangebot) und - z.T. über den
Frank-Starling-Mechanismus - zu erhöhtem Herzzeitvolumen und damit
Stabilisierung des Blutdrucks führen, ohne dass eine Bluttransfusion
durchgeführt worden wäre.
Ein
Beispiel für das Ineinandergreifen verschiedener regulativer Wege ist
die kurzfristige Reaktion auf Blutverlust (Hämorrhagie → Hypovolämie,  Abbildung):
Abbildung):

 Abbildung: Kurzfristige Reaktionen auf Blutverlust
Abbildung: Kurzfristige Reaktionen auf Blutverlust
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Abnehmender
venöser Rückstrom senkt Blutdruck und Gewebedurchblutung. Das aktiviert
Baro- und Chemoreflexe (gelbe Felder). Das Kreislaufzentrum reagiert
mit Anregung des Herzens, der Gefäße, und des
Renin-Angiotensin- Mechanismus.
Die
gezeigten Mechanismen stellen nur die ersten
Schritte zur Kreislaufstabilisierung dar; mittel- bis langfristig
schließen hormonelle, später allenfalls auch strukturelle
Veränderungen an.
All diese Veränderungen steigern direkt oder indirekt den arteriellen Blutdruck.
Ziel der Mechanismen ist die
Verhinderung ungenügender Durchblutungsmuster, die in einem
Kreislaufschock münden können

Die  Abbildung zeigt die wichtigsten Reflexwege zur initialen Kompensation des Blutdruckabfalls und Stabilisierung des Kreislaufs:
Abbildung zeigt die wichtigsten Reflexwege zur initialen Kompensation des Blutdruckabfalls und Stabilisierung des Kreislaufs:
 (1) Arterielle Barorezeptoren:
Als Reaktion auf sinkende afferente Aktionspotentialfrequenz sinkt der
Parasympathikus- und steigt der Sympathikustonus, das Herz wird
angeregt, vor allem im Splanchnikusgebiet und renal kommt es zu
Vasokonstriktion.
(1) Arterielle Barorezeptoren:
Als Reaktion auf sinkende afferente Aktionspotentialfrequenz sinkt der
Parasympathikus- und steigt der Sympathikustonus, das Herz wird
angeregt, vor allem im Splanchnikusgebiet und renal kommt es zu
Vasokonstriktion.
 (2) Rezeptoren im Niederdrucksystem
(kardiopulmonal) werden infolge des geringeren zentralen Blutvolumens
weniger stark stimuliert, reflektorisch steigt der Sympathikustonus vor
allem im Gebiet der Nieren (was glomeruläre Filtration und
Harnproduktion reduziert). Außerdem steigert der Hypothalamus die
Freisetzung von Vasopressin, das den Blutdruck steigert; und ANP wird
von den wenig gefüllten Atrien kaum noch produziert, die renale
Natriumausscheidung sinkt (Volumenkonservierung).
(2) Rezeptoren im Niederdrucksystem
(kardiopulmonal) werden infolge des geringeren zentralen Blutvolumens
weniger stark stimuliert, reflektorisch steigt der Sympathikustonus vor
allem im Gebiet der Nieren (was glomeruläre Filtration und
Harnproduktion reduziert). Außerdem steigert der Hypothalamus die
Freisetzung von Vasopressin, das den Blutdruck steigert; und ANP wird
von den wenig gefüllten Atrien kaum noch produziert, die renale
Natriumausscheidung sinkt (Volumenkonservierung).
 (3) Die sinkende Durchblutung peripherer Chemorezeptoren (glomera carotica und aortica) senkt hier den pO2 und steigert die afferente Aktionspotentialfrequenz. Das steigert indirekt die Herzfrequenz (s. dort).
(3) Die sinkende Durchblutung peripherer Chemorezeptoren (glomera carotica und aortica) senkt hier den pO2 und steigert die afferente Aktionspotentialfrequenz. Das steigert indirekt die Herzfrequenz (s. dort).
 (4) Hypotoniebedingte zerebrale Ischämie senkt den pO2 und hebt den pCO2 im Gehirn. Die resultierende Azidose steigert den Sympathikustonus wesentlich stärker, als dies der Barorezeptorreflex tut.
(4) Hypotoniebedingte zerebrale Ischämie senkt den pO2 und hebt den pCO2 im Gehirn. Die resultierende Azidose steigert den Sympathikustonus wesentlich stärker, als dies der Barorezeptorreflex tut.
Der hohe Sympathikustonus stimuliert auch die Freisetzung von Adrenalin
aus dem Nebennierenmark. Die Katecholamine wirken positiv ino- und
chronotrop auf das Herz (erhöhte Schlagkraft und Schlagfrequenz),
führen zu arteriolärer (Extremitäten, Haut, Nieren, Splanchnikusgebiet)
und venöser Vasokonstriktion (Compliancesenkung). Erhöhte
Angiotensinspiegel unterstützen den vasokonstriktorischen Effekt. Die Durchblutung des Gehirns und des Herzmuskels bleibt weitgehend erhalten.

 Abbildung: Herzleistung nach zwei Blutverlusten unterschiedlicher Intensität
Abbildung: Herzleistung nach zwei Blutverlusten unterschiedlicher Intensität
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Das
Bild zeigt den sehr unterschiedlichen Zeitverlauf nach Verlust von ca.
20% des Blutvolumens (gefolgt von Korrekturen im Sinne negativer
Rückkopplung im System der Kreislaufregulation) bzw. 40% des Blutvolumens (gefolgt von positiver Rückkopplung mit fatalem Ausgang).
Ist der Blutverlust nicht so hoch, dass er die physiologischen
Regulationsmechanismen überfordert, kann das System durch (in diesem
Kapitel geschilderte) Maßnahmen (wie selektive Vasokonstriktion,
stärkere Einwärtsfiltration in der Mikrozirkulation, Sekretion
volumensparender Hormone) die normale Herzleistung wieder herstellen
(strichlierte Kurve).
Ist das System
hingegen überfordert, verstärkt sich die Misere (positive Rückkopplung
im regeltechnischen Sinne) und das System ist von sich aus (ohne
medizinische Intervention) nicht in der Lage, den Kreislauf zun
stabilisieren (rote Kurve)

Die Nieren sind über einen längeren
Zeitraum das primäre Kontrollorgan für Flüssigkeitsvolumina und
Blutdruck - insbesondere mit dem Mechanismus der Druckdiurese (Flüssigkeitsausscheidung steigt mit Volumenbelastung). Neuroendokrine Faktoren wirken auf
das renale Gewebe, z.B. bei erhöhtem Bedarf (wie
Ausfall eines Teils des Nierenparenchyms oder unilateraler
Nephrektomie) im Sinne kompensatorischer Anpassung.
Verzögerte Kompensation:
Nach diesen initialen Kompensationsvorgängen kommt es allmählich zu
Umverlagerung von Gewebeflüssigkeit in die Blutbahn. Der hohe
Gefäßwiderstand (präkapilläre Vasokonstriktion) senkt die kapillären
Blutdruckwerte ("Starling-Gleichgewicht"). Diese transkapilläre "Einwärtsfiltration" (fluid shift) wirkt
wie eine Autotransfusion in den Kreislauf - etwa 75% des verlorenen
Volumens werden so innerhalb einer Stunde wieder ersetzt.
Dieses Einströmen von Ultrafiltrat führt zu einer Hämodilution: Eiweißkonzentration, Hämatokrit und Hämoglobinwert sinken nach einem starken Blutverlust deutlich ab.
 Allmählich
rücken vermehrt Proteine in die Blutbahn nach, vermutlich über das
fenestrierte Endothel intestinaler und hepatischer Kapillaren (in
diesen Gebieten ist die Proteinkonzentration der interstitiellen
Flüssigkeit verhältnismäßig hoch); und die Albuminsynthese der Leber steigt an, sodass die Proteinwerte im Plasma nach mehreren Tagen normalisiert werden.
Allmählich
rücken vermehrt Proteine in die Blutbahn nach, vermutlich über das
fenestrierte Endothel intestinaler und hepatischer Kapillaren (in
diesen Gebieten ist die Proteinkonzentration der interstitiellen
Flüssigkeit verhältnismäßig hoch); und die Albuminsynthese der Leber steigt an, sodass die Proteinwerte im Plasma nach mehreren Tagen normalisiert werden.
 Gesteigerte Erythropoese
führt schließlich (über Wochen) auch zur Wiederherstellung der
Ausgangswerte des Hämatokrit und der Hämoglobinkonzentration im Blut.
Gesteigerte Erythropoese
führt schließlich (über Wochen) auch zur Wiederherstellung der
Ausgangswerte des Hämatokrit und der Hämoglobinkonzentration im Blut.
Zeitverlauf der Regelmechanismen:
Der arterielle Blutdruck beeinflusst kurzfristig die Druckregulation
im Sinne des Baroreflexes, mittelfristig
den Flüssigkeits- und
Elektrolythaushalt, und über längere Zeit auch die Morphologie von
Herz, Gefäßen und Nieren (Einflüsse "auf Herz und Nieren"). Die
beschriebenen Vorgänge laufen nicht synchron ab, sondern zeitlich
gestaffelt, wobei sie ineinander greifen und gegenseitig ergänzen.
Nach
einer Störung im Bereich des arteriellen Blutdrucks treten
nacheinander kurz-, mittel- und langfristige Mechanismen auf den Plan
( Abbildung).
Abbildung).


Abbildung: Einfluss verschiedener Regelsysteme auf die Blutdruckregulation
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Das Bild stellt
die Zeitabhängigkeit der Beteiligung verschiedener Regelmechanismen
nach einer plötzlichen Änderung (Zeitpunkt 0: gestrichelte Linie) des
arteriellen Drucks (hier: Hypotonie) dar. Ziel der Korrekturmaßnahmen
ist
die Wiederherstellung des physiologischen Blutdruckbereichs.
Kurz- bis mittelfristige Mechanismen:
 a: ZNS-Ischämiereflex
a: ZNS-Ischämiereflex
 b: Barorezeptorreflexe
b: Barorezeptorreflexe
 c: Chemorezeptorreflexe
c: Chemorezeptorreflexe
 d: Stressrelaxation der Gefäße
d: Stressrelaxation der Gefäße
 e: Kapilläre Flüssigkeitsverschiebungen
e: Kapilläre Flüssigkeitsverschiebungen
 f: Renin-Angiotensin Vasokonstriktion
Langfristige Mechanismen:
f: Renin-Angiotensin Vasokonstriktion
Langfristige Mechanismen:
 g: Aldosteron
g: Aldosteron
 h: Renale Steuerung von Blutdruck und Blutvolumen
Baro- und Chemoreflexe reagieren in
Sekundenschnelle, der zentralnervöse Ischämiereflex innerhalb einer Minute und besonders intensiv; transkapilläre Flüssigkeitsverschiebungen
treten innerhalb von Minuten auf.
Relaxation der Blutgefäße als Antwort auf Blutdrucksteigerung erfolgt
im Minutenbereich, erreicht innerhalb weniger Stunden ihren
Höchstbetrag und kann lange andauern. Einige hormonelle Antworten
benötigen Minuten (Renin-Angiotensin) bis Stunden (Aldosteron), um
wirksam zu werden. Umstellungen der Nierenfunktionen treten nach
mehreren Tagen auf, haben dann aber den stärksten und langanhaltenden
Effekt.
Verzögerte Reaktionen der Proteinsynthese und Erythropoese sind nicht gezeigt
h: Renale Steuerung von Blutdruck und Blutvolumen
Baro- und Chemoreflexe reagieren in
Sekundenschnelle, der zentralnervöse Ischämiereflex innerhalb einer Minute und besonders intensiv; transkapilläre Flüssigkeitsverschiebungen
treten innerhalb von Minuten auf.
Relaxation der Blutgefäße als Antwort auf Blutdrucksteigerung erfolgt
im Minutenbereich, erreicht innerhalb weniger Stunden ihren
Höchstbetrag und kann lange andauern. Einige hormonelle Antworten
benötigen Minuten (Renin-Angiotensin) bis Stunden (Aldosteron), um
wirksam zu werden. Umstellungen der Nierenfunktionen treten nach
mehreren Tagen auf, haben dann aber den stärksten und langanhaltenden
Effekt.
Verzögerte Reaktionen der Proteinsynthese und Erythropoese sind nicht gezeigt

Am raschesten reagieren der Baro- und Chemoreflexe auf Störeinflüsse auf
den arteriellen Blutdruck. Flüssigkeitsverschiebungen (sowohl innerhalb des Kreislaufs -
Veränderung von Blutvolumen, Blutumverteilung - als auch transvaskuläre
Filtration) treten im Minutenbereich auf.
Dann erfolgt die
reflektorische Antwort von weiteren Hormonen (Aldosteron, eventuell
Vasopressin etc.).
Bleibt der Blutdruck verändert, treibt das langfristige Mechanismen an,
wie das Renin-Angiotensin-Aldosteron-System, aber auch adaptive
Gewebeanpassungen (Complianceveränderungen, Wachstumsvorgänge etc).

Durch Veränderung des, oder Druck auf den, Pressorezeptor(s) im Halsbereich kann es zu einem Karotissinussyndrom
kommen. Schon eine Kopfdrehung oder leichte Berührung des Halses (z.B.
beim Rasieren) löst den Barorezeptorreflex aus: Der Sympathikustonus
sinkt, das Herz wird bradykard und es kann durch den resultierenden
Blutdruckabfall zu einer Synkope kommen.
Erhöhten Zentralvenendruck findet man u.a. bei Stenose der
Trikuspidalklappen oder Rechtsherzinsuffizienz (Stau vor dem rechten
Herzen) oder ausgeprägter Anämie. Der Zentralvenendruck steigt auch z.B. bei
Hochlagerung der Beine (vermehrtes Blutangebot).


 Dehnungssensitive Nervenzellen in
der Wand des Carotissinus und Aortenbogens (Barorezeptoren) reagieren
auf Blutdruckänderungen, besonders deren zeitliche Änderung
(PD-Rezeptor) - am empfindlichsten im physiologischen Blutdruckbereich
(der Durchmesser des sinus coronarius oszilliert mit dem arteriellen
Puls um ~15%). Die
Dehnungsempfindlichkeit entspricht der Öffnungswahrscheinlichkeit
mechanosensibler Kationenkanäle in der Membran der barosensitiven
Neurone. Die Afferenzen erfolgen über den IX. (Carotis) und X. Hirnnerven (Aorta) zum nucl. tractus solitarii der medulla oblongata.
A-Fasern sind gut myelinisiert, leiten schnell, haben eine niedrige
Reizschwelle (<90 mmHg), feuern pulsatil im normalen
Blutdruckbereich. Die zahlreicheren C-Fasern sind nicht myelinisiert,
leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg). Bei
normalem Blutdruck sind
~25% der C-Fasern aktiv (Druckspitzen); C-Fasern erfassen vor allem erhöhte Blutdruckbereiche (>150 mmHg). Der
Baroreflex adaptiert rasch (Stunden bis Tage), er ist für Korrekturen
akuter Blutdruckschwankungen ausgelegt (z.B. Änderung der Körperlage) - er
passt sich längerfristigen Druckänderungen an und bleibt so in seinem
optimalen Empfindlichkeitsbereich Dehnungssensitive Nervenzellen in
der Wand des Carotissinus und Aortenbogens (Barorezeptoren) reagieren
auf Blutdruckänderungen, besonders deren zeitliche Änderung
(PD-Rezeptor) - am empfindlichsten im physiologischen Blutdruckbereich
(der Durchmesser des sinus coronarius oszilliert mit dem arteriellen
Puls um ~15%). Die
Dehnungsempfindlichkeit entspricht der Öffnungswahrscheinlichkeit
mechanosensibler Kationenkanäle in der Membran der barosensitiven
Neurone. Die Afferenzen erfolgen über den IX. (Carotis) und X. Hirnnerven (Aorta) zum nucl. tractus solitarii der medulla oblongata.
A-Fasern sind gut myelinisiert, leiten schnell, haben eine niedrige
Reizschwelle (<90 mmHg), feuern pulsatil im normalen
Blutdruckbereich. Die zahlreicheren C-Fasern sind nicht myelinisiert,
leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg). Bei
normalem Blutdruck sind
~25% der C-Fasern aktiv (Druckspitzen); C-Fasern erfassen vor allem erhöhte Blutdruckbereiche (>150 mmHg). Der
Baroreflex adaptiert rasch (Stunden bis Tage), er ist für Korrekturen
akuter Blutdruckschwankungen ausgelegt (z.B. Änderung der Körperlage) - er
passt sich längerfristigen Druckänderungen an und bleibt so in seinem
optimalen Empfindlichkeitsbereich
 Der nucl. tractus solitarii projiziert anregend auf den nucleus ambiguus, der parasympathische Aktivität beeinflust ("Vaguskerne", parasympathische Bremsung der Herzaktion), und hemmt das ventromedial gelegene vasomotorische Areal, das auf sympathische Efferenzen wirkt (Dilatation von Widerstandsgefäßen, weniger Adrenalinfreisetzung aus den Nebennieren). Das ergibt mehrfache Rückkopplung auf Herz und Blutgefäße, die den Blutdruck stabilisiert. Plötzliche
Zunahme des arteriellen Drucks erhöht die parasympathische (vermehrte
Freisetzung von Acetylcholin) und senkt die
sympathische Aktivität (verringerte Freisetzung von Noradrenalin). Gleichzeitig sinkt
der Venentonus, die venöse Volumendehnbarkeit nimmt zu (sinkende
Vorlast für das Herz). Erregung der Barorezeptoren dämpft auch die Atmung und senkt den Muskeltonus Der nucl. tractus solitarii projiziert anregend auf den nucleus ambiguus, der parasympathische Aktivität beeinflust ("Vaguskerne", parasympathische Bremsung der Herzaktion), und hemmt das ventromedial gelegene vasomotorische Areal, das auf sympathische Efferenzen wirkt (Dilatation von Widerstandsgefäßen, weniger Adrenalinfreisetzung aus den Nebennieren). Das ergibt mehrfache Rückkopplung auf Herz und Blutgefäße, die den Blutdruck stabilisiert. Plötzliche
Zunahme des arteriellen Drucks erhöht die parasympathische (vermehrte
Freisetzung von Acetylcholin) und senkt die
sympathische Aktivität (verringerte Freisetzung von Noradrenalin). Gleichzeitig sinkt
der Venentonus, die venöse Volumendehnbarkeit nimmt zu (sinkende
Vorlast für das Herz). Erregung der Barorezeptoren dämpft auch die Atmung und senkt den Muskeltonus
 Sensorische Afferenzen wirken auf Herzfrequenz und Blutdruck: Reizung
von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch
Inhibition vagaler Efferenzen im Hirnstamm (Beitrag zur
atmungssynchronen Sinusarrhythmie). Plötzliche tiefe Einatmung löst
auch Vasokonstriktion in der Haut aus. Somatische Schmerzreize können
den Herzschlag beschleunigen und den Blutdruck steigern, umgekehrt kann viszeraler Schmerz Bradykardie und Blutdruckabfall
auslösen. Kältereize wirken hypertensiv, plötzlicher Lärm und Bedrohung
können Tachykardie auslösen. Sexuelle Erregung steigert Pulsfrequenz
und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus
(Bradykardie) Sensorische Afferenzen wirken auf Herzfrequenz und Blutdruck: Reizung
von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch
Inhibition vagaler Efferenzen im Hirnstamm (Beitrag zur
atmungssynchronen Sinusarrhythmie). Plötzliche tiefe Einatmung löst
auch Vasokonstriktion in der Haut aus. Somatische Schmerzreize können
den Herzschlag beschleunigen und den Blutdruck steigern, umgekehrt kann viszeraler Schmerz Bradykardie und Blutdruckabfall
auslösen. Kältereize wirken hypertensiv, plötzlicher Lärm und Bedrohung
können Tachykardie auslösen. Sexuelle Erregung steigert Pulsfrequenz
und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus
(Bradykardie)
 Die Langzeitregulierung des arteriellen Drucks erfolgt über Anpassung des Blutvolumens, der Compliance der Gefäße und allenfalls des Herzmuskels. Aldosteron hält Kochsalz im Körper zurück ("Salzsparhormon") und erhöht das
extrazelluläre Volumen; Vasopressin verringert die Wasserdiurese
("Wassersparhormon"). Der Sympathikus regt die tubuläre Rückgewinnung
von Salz und Wasser an, aktiviert den Reninmechanismus und damit
wiederum Aldosteron. Atriale natriuretische Peptide wirken umgekehrt
natriuretisch. Der Organismus passt die Kreislaufregulation an
veränderte Randbedingungen an, mit dem Ziel optimaler Durchblutungswerte Die Langzeitregulierung des arteriellen Drucks erfolgt über Anpassung des Blutvolumens, der Compliance der Gefäße und allenfalls des Herzmuskels. Aldosteron hält Kochsalz im Körper zurück ("Salzsparhormon") und erhöht das
extrazelluläre Volumen; Vasopressin verringert die Wasserdiurese
("Wassersparhormon"). Der Sympathikus regt die tubuläre Rückgewinnung
von Salz und Wasser an, aktiviert den Reninmechanismus und damit
wiederum Aldosteron. Atriale natriuretische Peptide wirken umgekehrt
natriuretisch. Der Organismus passt die Kreislaufregulation an
veränderte Randbedingungen an, mit dem Ziel optimaler Durchblutungswerte
 Mit Dauer und
Intensität körperlicher Belastung steigt der systolische Druck, der
diastolische Wert ändert sich kaum, die Blutdruckamplitude steigt unter
Belastung an. Die "Atempumpe" steigert das Herzzeitvolumen zusätzlich zu den Effekten neurohumoraler Kreislaufanregung Mit Dauer und
Intensität körperlicher Belastung steigt der systolische Druck, der
diastolische Wert ändert sich kaum, die Blutdruckamplitude steigt unter
Belastung an. Die "Atempumpe" steigert das Herzzeitvolumen zusätzlich zu den Effekten neurohumoraler Kreislaufanregung
 Die Körperlage
beeinflusst die Vorlast des Herzens: Der Füllungsdruck steigt beim
Hinlegen, sinkt beim Aufstehen. Bei Wechsel zu Orthostase nimmt das Herzminutenvolumen um ~30% ab, in den Beinvenen werden ~10% des Blutvolumens
zusätzlich eingelagert. Reflexe
stabilisieren den Blutdruck (Vasokonstriktion reduziert Perfusion und
venöse Speicherung), die Durchblutung des Gehirns (sinkender
hydrostatischer Druck) und der Nieren (reflektorisch erhöhter
Sympathikustonus) nimmt ab Die Körperlage
beeinflusst die Vorlast des Herzens: Der Füllungsdruck steigt beim
Hinlegen, sinkt beim Aufstehen. Bei Wechsel zu Orthostase nimmt das Herzminutenvolumen um ~30% ab, in den Beinvenen werden ~10% des Blutvolumens
zusätzlich eingelagert. Reflexe
stabilisieren den Blutdruck (Vasokonstriktion reduziert Perfusion und
venöse Speicherung), die Durchblutung des Gehirns (sinkender
hydrostatischer Druck) und der Nieren (reflektorisch erhöhter
Sympathikustonus) nimmt ab
 Hypovolämie steigert die Sympathikusaktivität und regt die Bildung von Angiotensin an (H+-Sekretion im proximalen Tubulus). Bei längerer Dauer steigt auch die Aldosteronwirkung (H+-Sekretion im distalen Tubulus). Volumenerhöhung hat den gegenteiligen Effekt (verringerte Säureausscheidung) Hypovolämie steigert die Sympathikusaktivität und regt die Bildung von Angiotensin an (H+-Sekretion im proximalen Tubulus). Bei längerer Dauer steigt auch die Aldosteronwirkung (H+-Sekretion im distalen Tubulus). Volumenerhöhung hat den gegenteiligen Effekt (verringerte Säureausscheidung)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Integrierte Kreislaufregulation
Integrierte Kreislaufregulation
 Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel
Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel Einfluss des autonom-nervösen Systems
Einfluss des autonom-nervösen Systems  Blutvolumen
Blutvolumen  Kurzfristige Regulation
Kurzfristige Regulation  Längerfristige Regulation
Längerfristige Regulation  Kardiale Faktoren, Vor- und Nachlast
Kardiale Faktoren, Vor- und Nachlast  Orthostase
Orthostase  Chemorezeptoren und pH-Wert
Chemorezeptoren und pH-Wert  Körperliche Belastung
Körperliche Belastung  Integrierte Regulation, Reaktion auf Blutverlust
Integrierte Regulation, Reaktion auf Blutverlust
 Core messages
Core messages (z.B.
Blutvolumen, Ganzkörperwasser) werden nicht direkt detektiert, sondern
über Druckwerte im Kreislauf und andere Größen, der mit dem
Flüssigkeitshaushalt in mehr oder weniger direkter
Verbindung stehen:
(z.B.
Blutvolumen, Ganzkörperwasser) werden nicht direkt detektiert, sondern
über Druckwerte im Kreislauf und andere Größen, der mit dem
Flüssigkeitshaushalt in mehr oder weniger direkter
Verbindung stehen: Druckrezeptoren im Herzen und Arteriensystem (Barorezeptoren
Druckrezeptoren im Herzen und Arteriensystem (Barorezeptoren
 in Aorta und sinus caroticus) beeinflussen über den Sympathikus den
Zustand der Blutgefäße (Tonus) und des Herzens (Herzqualitäten) - so
wird der Blutdruck stabilisiert.
in Aorta und sinus caroticus) beeinflussen über den Sympathikus den
Zustand der Blutgefäße (Tonus) und des Herzens (Herzqualitäten) - so
wird der Blutdruck stabilisiert. Druckrezeptoren in der Niere (vas afferens) steuern die Freisetzung von Renin
aus umliegenden granulären Zellen - je geringer der Druck, desto
mehr Renin wird aktiviert, dieses aktiviert Angiotensin und regt (via Aldosteron) die Rückresorption von Natrium an.
Druckrezeptoren in der Niere (vas afferens) steuern die Freisetzung von Renin
aus umliegenden granulären Zellen - je geringer der Druck, desto
mehr Renin wird aktiviert, dieses aktiviert Angiotensin und regt (via Aldosteron) die Rückresorption von Natrium an.  Nimmt die glomeruläre Filtration ab, gelangt weniger Kochsalz zur macula densa. Ein tubulo-glomerulärer Rückkopplungsmechanismus wirkt stabilisierend auf die Salzbilanz: Reduzierte Strömung an der macula densa senkt den Tonus der vasa afferentia, dadurch nehmen glomerulärer Druck und Filtration wieder zu (negative Rückkopplung).
Nimmt die glomeruläre Filtration ab, gelangt weniger Kochsalz zur macula densa. Ein tubulo-glomerulärer Rückkopplungsmechanismus wirkt stabilisierend auf die Salzbilanz: Reduzierte Strömung an der macula densa senkt den Tonus der vasa afferentia, dadurch nehmen glomerulärer Druck und Filtration wieder zu (negative Rückkopplung). Natriuretische Peptide aus dem Herzen fördern bei dessen Überdehnung die Natriumausscheidung in der Niere, das Blutvolumen nimmt ab. Das Flüssigkeitsvolumen wird über die Menge an freiem Natrium sowie die Osmoregulation eingestellt.
Natriuretische Peptide aus dem Herzen fördern bei dessen Überdehnung die Natriumausscheidung in der Niere, das Blutvolumen nimmt ab. Das Flüssigkeitsvolumen wird über die Menge an freiem Natrium sowie die Osmoregulation eingestellt. 
 Abbildung: Auswirkung einer i.v.-Infusion (jeweils 10 µg/min) von Noradrenalin bzw. Adrenalin
Abbildung: Auswirkung einer i.v.-Infusion (jeweils 10 µg/min) von Noradrenalin bzw. Adrenalin
 Abbildung gibt einen klassichen
Versuch wieder: Die Effekte einer Noradrenalin- vs. Adrenalininfusion.
Abbildung gibt einen klassichen
Versuch wieder: Die Effekte einer Noradrenalin- vs. Adrenalininfusion. Vasokonstriktion, vermittelt über α1-Rezeptoren → Gq-Protein → IP3, PLC → intrazellulärer [Ca++]-Anstieg → Kontraktion der Gefäßwand.
Vasokonstriktion, vermittelt über α1-Rezeptoren → Gq-Protein → IP3, PLC → intrazellulärer [Ca++]-Anstieg → Kontraktion der Gefäßwand.  Anregung von ß2-Rezeptoren hingegen bewirkt Vasodilatation über den cAMP-PKA-Weg → Phosphorylierung der Myosin-Leichtkettenkinase (MLCK), die dabei gegenüber dem Ca++-Calmodulin- Komplex weniger empfindlich wird → Relaxation.
Anregung von ß2-Rezeptoren hingegen bewirkt Vasodilatation über den cAMP-PKA-Weg → Phosphorylierung der Myosin-Leichtkettenkinase (MLCK), die dabei gegenüber dem Ca++-Calmodulin- Komplex weniger empfindlich wird → Relaxation. Über α- und ß-Adrenozeptoren s. dort
Über α- und ß-Adrenozeptoren s. dort
 an den Arteriolen.
an den Arteriolen. → Osmo-, Elektrolyt-,
Volumenregulation) ist eng mit der von Blutdruck (treibende Kraft für
Blutnachschub) und Durchblutung (Perfusion: Ernährung der Organe und
Gewebe) verknüpft.
→ Osmo-, Elektrolyt-,
Volumenregulation) ist eng mit der von Blutdruck (treibende Kraft für
Blutnachschub) und Durchblutung (Perfusion: Ernährung der Organe und
Gewebe) verknüpft.  senkt reflektorisch den Sympathikustonus (verringerte Vasokonstriktion, erhöhte Volumendehnbarkeit),
senkt reflektorisch den Sympathikustonus (verringerte Vasokonstriktion, erhöhte Volumendehnbarkeit), hemmt die Freisetzung von Renin aus juxtraglomerulären Zellen in den Nieren (Wasserausscheidung, Volumensenkung),
hemmt die Freisetzung von Renin aus juxtraglomerulären Zellen in den Nieren (Wasserausscheidung, Volumensenkung), reduziert die Sekretion von Vasopressin aus dem Hypophysenhinterlappen (vermehrte Wasserausscheidung).
reduziert die Sekretion von Vasopressin aus dem Hypophysenhinterlappen (vermehrte Wasserausscheidung).
 Abbildung: Autonom-nervöse Steuerung des kardiovaskulären Systems
Abbildung: Autonom-nervöse Steuerung des kardiovaskulären Systems Chemorezeptoren: Sekundäre Regulation
Chemorezeptoren: Sekundäre Regulation und im Aortenbogen
(Barorezeptoren) aus, deren Aktivität vom Grad der Wanddehnung abhängt. Strukturelles Substrat sind dehnungssensitive Nervenzellen.
und im Aortenbogen
(Barorezeptoren) aus, deren Aktivität vom Grad der Wanddehnung abhängt. Strukturelles Substrat sind dehnungssensitive Nervenzellen.  Abbildung) ist ein dünnwandiger, gut
dehnbarer Abschnitt der a. carotis interna. Seine Wand oszilliert
deutlich mit dem arteriellen Puls (um ~15%
des Durchmessers). Die Dehnung der Wand ist der adäquate Reiz für die
Reizung. Die einzelnen afferenten Fasern sammeln sich im Sinusnerv, der
dann in den N. glossopharyngeus
mündet, der zum Hirnstamm zieht. Auch die Wand des Aortenbogens ist im Bereich des sinus aorticus
gut dehnbar (relativ hohe Compliance: ∂V/∂p) und reagiert insbesondere
auf die vom linken Ventrikel erzeugten Druckwellen. Die Fasern vom
Aortenbogen ziehen mit dem N. vagus zum Hirnstamm.
Abbildung) ist ein dünnwandiger, gut
dehnbarer Abschnitt der a. carotis interna. Seine Wand oszilliert
deutlich mit dem arteriellen Puls (um ~15%
des Durchmessers). Die Dehnung der Wand ist der adäquate Reiz für die
Reizung. Die einzelnen afferenten Fasern sammeln sich im Sinusnerv, der
dann in den N. glossopharyngeus
mündet, der zum Hirnstamm zieht. Auch die Wand des Aortenbogens ist im Bereich des sinus aorticus
gut dehnbar (relativ hohe Compliance: ∂V/∂p) und reagiert insbesondere
auf die vom linken Ventrikel erzeugten Druckwellen. Die Fasern vom
Aortenbogen ziehen mit dem N. vagus zum Hirnstamm.

 Abbildung: Baroreflex, Carotisrezeptoren
Abbildung: Baroreflex, Carotisrezeptoren
 s. dort)
s. dort)
 Abbildung).
Abbildung).
 Abbildung: Aktivität (Aktionspotentialfrequenz) des Sinusnerven in Abhängigkeit vom Blutdruck
Abbildung: Aktivität (Aktionspotentialfrequenz) des Sinusnerven in Abhängigkeit vom Blutdruck
 Nicht nur die
Intensität der Dehnung an sich (statisch: Proportionalempfindlichkeit),
sondern auch deren zeitliche Änderung (pulsatil:
Differentialempfindlichkeit) bestimmt die Aktionspotentialfrequenz
an den Nervenfasern, die vom Sinus zum Gehirn führen.
Nicht nur die
Intensität der Dehnung an sich (statisch: Proportionalempfindlichkeit),
sondern auch deren zeitliche Änderung (pulsatil:
Differentialempfindlichkeit) bestimmt die Aktionspotentialfrequenz
an den Nervenfasern, die vom Sinus zum Gehirn führen. Arterieller Mitteldruck: Je höher der Druck, desto höher die Aktionspotentialfrequenz (P-Anteil)
Arterieller Mitteldruck: Je höher der Druck, desto höher die Aktionspotentialfrequenz (P-Anteil) Steilheit der Druckschwankungen: Je steiler der Druckanstieg, desto höher der Frequenzanstieg (D-Anteil)
Steilheit der Druckschwankungen: Je steiler der Druckanstieg, desto höher der Frequenzanstieg (D-Anteil) Blutdruckamplitude: Zusätzliche C-Fasern sprechen an. Besonders wichtig bei Orthostase oder Blutverlust
Blutdruckamplitude: Zusätzliche C-Fasern sprechen an. Besonders wichtig bei Orthostase oder Blutverlust
 Abbildung: Barorezeptorreflex
Abbildung: Barorezeptorreflex
 A-Fasern
sind gut myelinisiert, leiten schnell und haben eine niedrige
Reizschwelle (zwischen 30 und 90 mmHg). Sie feuern pulsatil im normalen
Blutdruckbereich.
A-Fasern
sind gut myelinisiert, leiten schnell und haben eine niedrige
Reizschwelle (zwischen 30 und 90 mmHg). Sie feuern pulsatil im normalen
Blutdruckbereich.  Die zahlreicheren C-Fasern sind nicht myelinisiert, leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg).
Die zahlreicheren C-Fasern sind nicht myelinisiert, leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg).  s. auch unten).
s. auch unten). s. dort):
s. dort): Die nuclei tractus solitarii
(NTS - rechts und links jeweils in der dorsalen medulla oblongata)
erhalten den Großteil der Impulse von Barorezeptoren. Sie wirken auf
mehrere Abschnitte des Kreislaufzentrums:
Die nuclei tractus solitarii
(NTS - rechts und links jeweils in der dorsalen medulla oblongata)
erhalten den Großteil der Impulse von Barorezeptoren. Sie wirken auf
mehrere Abschnitte des Kreislaufzentrums: Einerseits regen sie den dorsal gelegenen nucleus ambiguus und den dorsalen motorischen Vaguskern an (der vor allem Bradykardie bewirkt),
Einerseits regen sie den dorsal gelegenen nucleus ambiguus und den dorsalen motorischen Vaguskern an (der vor allem Bradykardie bewirkt),  andererseits hemmen sie das ventromedial gelegene vasomotorische Areal.
andererseits hemmen sie das ventromedial gelegene vasomotorische Areal. Auf das kardioinhibitorische Zentrum projizieren exzitatorische Interneuronen von den NTS. Diese Neuronengruppe wirkt parasympathisch auf das Herz, vor allem senkt sie seine Schlagfrequenz.
Auf das kardioinhibitorische Zentrum projizieren exzitatorische Interneuronen von den NTS. Diese Neuronengruppe wirkt parasympathisch auf das Herz, vor allem senkt sie seine Schlagfrequenz. Auf das vasomotorische Areal projizieren inhibitorische
Interneuronen von den NTS. Es inkludiert u.a. die rostral gelegenen
areae A1 und C1 und die unteren Olivenkerne. Die Neuronen in C1 zeigen
herzschlagsynchrone Aktivität, bedingt durch pulsabhängige
Aktionspotentialsalven von den Barorezeptoren. Reizung der C1-Region
bewirkt Vasokonstriktion, und diese Region unterhält einen Dauertonus
der Widerstandsgefäße, soferne sie nicht von NTS-Interneuronen
inhibiert wird (letztere bewirken Vasodilatation). Die tonische Aktivität der C1-Neuronen regt präganglionäre sympathische Zellen an und erhält den arteriellen Blutdruck aufrecht.
Auf das vasomotorische Areal projizieren inhibitorische
Interneuronen von den NTS. Es inkludiert u.a. die rostral gelegenen
areae A1 und C1 und die unteren Olivenkerne. Die Neuronen in C1 zeigen
herzschlagsynchrone Aktivität, bedingt durch pulsabhängige
Aktionspotentialsalven von den Barorezeptoren. Reizung der C1-Region
bewirkt Vasokonstriktion, und diese Region unterhält einen Dauertonus
der Widerstandsgefäße, soferne sie nicht von NTS-Interneuronen
inhibiert wird (letztere bewirken Vasodilatation). Die tonische Aktivität der C1-Neuronen regt präganglionäre sympathische Zellen an und erhält den arteriellen Blutdruck aufrecht.  Abbildung).
Abbildung). 
 Abbildung: Neuronale Kreislaufsteuerung
Abbildung: Neuronale Kreislaufsteuerung
 Nimmt der arterielle Druck zu, sinkt die anregende
Wirkung des Sympathikus (Gefäßerweiterung, sinkende suprarenale Adrenalinfreisetzung) und nimmt die bremsende
Wirkung des Parasympathikus zu (Abnahme der Herzfrequenz) - all das innerhalb etwa einer Sekunde.
Nimmt der arterielle Druck zu, sinkt die anregende
Wirkung des Sympathikus (Gefäßerweiterung, sinkende suprarenale Adrenalinfreisetzung) und nimmt die bremsende
Wirkung des Parasympathikus zu (Abnahme der Herzfrequenz) - all das innerhalb etwa einer Sekunde. Umgekehrt liegen die Dinge bei Blutdruckabfall (→ Vasokonstriktion, Tachykardie).
Umgekehrt liegen die Dinge bei Blutdruckabfall (→ Vasokonstriktion, Tachykardie). gesteigerter parasympathischer Aktivität → vermehrter Freisetzung von Acetylcholin am Sinusknoten
gesteigerter parasympathischer Aktivität → vermehrter Freisetzung von Acetylcholin am Sinusknoten herabgesetzter sympathischer Aktivität → verringerter Freisetzung an Noradrenalin am Sinusknoten
herabgesetzter sympathischer Aktivität → verringerter Freisetzung an Noradrenalin am Sinusknoten Senkung der
Herzfrequenz (Bradykardie)
Senkung der
Herzfrequenz (Bradykardie) Reduktion des Venentonus, die venöse Volumendehnbarkeit (Kapazität) nimmt zu (sinkende Vorlast für das Herz)
Reduktion des Venentonus, die venöse Volumendehnbarkeit (Kapazität) nimmt zu (sinkende Vorlast für das Herz) Zentral (insbesondere durch Beteiligung der Insel:
Durch körperliche Belastung oder schon die Aussicht darauf: Der
Sollwert für den arteriellen Blutdruck erhöht sich proportional zur
Muskelarbeit, ohne dass der erhöhte Druck durch den Reflex wieder
reduziert wird) oder im Rahmen der Sinusarrhythmie;
Zentral (insbesondere durch Beteiligung der Insel:
Durch körperliche Belastung oder schon die Aussicht darauf: Der
Sollwert für den arteriellen Blutdruck erhöht sich proportional zur
Muskelarbeit, ohne dass der erhöhte Druck durch den Reflex wieder
reduziert wird) oder im Rahmen der Sinusarrhythmie;  peripher
(verändert sich der Blutdruck über längere Zeiträume - Stunden und Tage
-, adaptiert das Rezeptorsystem, und der Blutdruck wird auf einem
veränderten Niveau reguliert. Der Vorteil besteht darin, dass die
Präzision der Regulation in den optimalen (steilsten) Ansprechbereich
des Systems "nachzieht"; der Nachteil darin, dass sich der mittlere
Blutdruck verändert.
peripher
(verändert sich der Blutdruck über längere Zeiträume - Stunden und Tage
-, adaptiert das Rezeptorsystem, und der Blutdruck wird auf einem
veränderten Niveau reguliert. Der Vorteil besteht darin, dass die
Präzision der Regulation in den optimalen (steilsten) Ansprechbereich
des Systems "nachzieht"; der Nachteil darin, dass sich der mittlere
Blutdruck verändert. Abbildung).
Abbildung).
 Abbildung: Barorezeptoraktivität und Blutdruck
Abbildung: Barorezeptoraktivität und Blutdruck
 Die
Adaptation des Baroreflexes ermöglicht optimale Kompensationswirkung
gegenüber akuten Störungen auch bei verändertem Druckniveau.
Die
Adaptation des Baroreflexes ermöglicht optimale Kompensationswirkung
gegenüber akuten Störungen auch bei verändertem Druckniveau.  die Atmung (diese wird gedämpft),
die Atmung (diese wird gedämpft),  den Muskeltonus (dieser sinkt ab) und
den Muskeltonus (dieser sinkt ab) und  die elektrische Aktivität des Großhirns (Tendenz zur Synchronisation, im EEG erkennbar).
die elektrische Aktivität des Großhirns (Tendenz zur Synchronisation, im EEG erkennbar).
 Abbildung: Einfluss der Chemorezeptoren auf die Kreislaufregulation
Abbildung: Einfluss der Chemorezeptoren auf die Kreislaufregulation
 Abbildung, links). Anstieg des pO2, auch Absinken des pCO2 und Anstieg des pH, haben entgegengesetzte Wirkung (Vasodilatation, Tachykardie).
Abbildung, links). Anstieg des pO2, auch Absinken des pCO2 und Anstieg des pH, haben entgegengesetzte Wirkung (Vasodilatation, Tachykardie).  Reizung von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch Inhibition vagaler Efferenzen im Hirnstamm. Das trägt zur atmungssynchronen Sinusarrhythmie bei. Plötzliche tiefe Einatmung löst auch Vasokonstriktion in der Haut aus (inspiratory gasp reflex)
Reizung von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch Inhibition vagaler Efferenzen im Hirnstamm. Das trägt zur atmungssynchronen Sinusarrhythmie bei. Plötzliche tiefe Einatmung löst auch Vasokonstriktion in der Haut aus (inspiratory gasp reflex) Somatische Schmerzreize
können ebenfalls den Herzschlag beschleunigen und den Blutdruck
steigern. Umgekehrt kann starke Reizung viszeraler Schmerzfasern
Bradykardie und Blutdruckabfall auslösen. Kältereize können hypertensiv wirken, andere Stressoren (plötzlicher Lärm, Bedrohung) Tachykardie auslösen. Sexuelle Erregung steigert ebenfalls Pulsfrequenz und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus (Bradykardie).
Somatische Schmerzreize
können ebenfalls den Herzschlag beschleunigen und den Blutdruck
steigern. Umgekehrt kann starke Reizung viszeraler Schmerzfasern
Bradykardie und Blutdruckabfall auslösen. Kältereize können hypertensiv wirken, andere Stressoren (plötzlicher Lärm, Bedrohung) Tachykardie auslösen. Sexuelle Erregung steigert ebenfalls Pulsfrequenz und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus (Bradykardie). Abbildung).
Abbildung). 
 Abbildung: Beitrag der Barorezeptoren zur Stabilität des Blutdrucks
Abbildung: Beitrag der Barorezeptoren zur Stabilität des Blutdrucks
 Abbildung). Das bedeutet, dass der arterielle Barorezeptorreflex
die Abweichungen vom Sollwert gering hält, während der
Niederdruckanteil des Systems den Sollwert des Mitteldruckes
einstellt.
Abbildung). Das bedeutet, dass der arterielle Barorezeptorreflex
die Abweichungen vom Sollwert gering hält, während der
Niederdruckanteil des Systems den Sollwert des Mitteldruckes
einstellt.
 Abbildung oben), das den dorsalen motorischen Vaguskern und den nucleus ambiguus einschließt. Neuronen aus dem dorsalen motorischen Vaguskern stellen die Herzkomponente des Barozeptorreflexes im Sinne einer Frequenzsenkung (Bradykardie).
Abbildung oben), das den dorsalen motorischen Vaguskern und den nucleus ambiguus einschließt. Neuronen aus dem dorsalen motorischen Vaguskern stellen die Herzkomponente des Barozeptorreflexes im Sinne einer Frequenzsenkung (Bradykardie).  Sympathische
Efferenzen fußen sowohl im vasomotorischen als auch im
kardioakzeleratorischen Areal der medulla oblongata. "Bulbospinale"
Neuronen ziehen von hier direkt zu präganglionären Zellen im
Rückenmark, was Umschaltung auf postganglionäre Zellen in vegetativen
Ganglien und noradrenergen Einfluss auf Herz und Gefäße zur Folge hat:
Sympathische
Efferenzen fußen sowohl im vasomotorischen als auch im
kardioakzeleratorischen Areal der medulla oblongata. "Bulbospinale"
Neuronen ziehen von hier direkt zu präganglionären Zellen im
Rückenmark, was Umschaltung auf postganglionäre Zellen in vegetativen
Ganglien und noradrenergen Einfluss auf Herz und Gefäße zur Folge hat:  Herzanregung
(positiv inotrop, chronotrop etc) und
Herzanregung
(positiv inotrop, chronotrop etc) und
 Vasokonstriktion, resultierend in
Vasokonstriktion, resultierend in

 erhöhtem Herzzeitvolumen, Blutdruckanstieg, Perfusionssteigerung in
betreffenden Geweben / Organen.
erhöhtem Herzzeitvolumen, Blutdruckanstieg, Perfusionssteigerung in
betreffenden Geweben / Organen. Parasympathische Efferenzen werden über Anregung des nucleus tractus solitarii, nucleus ambiguus und des dorsalen
motorischen Vaguskerns aktiviert: Es wird also das kardioinhibitorische
Areal aktiv. Fasern des N. vagus (X) bringen die Information zum
Herzen, wo die Umschaltung auf postganglionäre Fasern erfolgt und die
Herzqualitäten negativ beeinflusst werden, vor allem die Chronotropie
(Frequenzsenkung).
Parasympathische Efferenzen werden über Anregung des nucleus tractus solitarii, nucleus ambiguus und des dorsalen
motorischen Vaguskerns aktiviert: Es wird also das kardioinhibitorische
Areal aktiv. Fasern des N. vagus (X) bringen die Information zum
Herzen, wo die Umschaltung auf postganglionäre Fasern erfolgt und die
Herzqualitäten negativ beeinflusst werden, vor allem die Chronotropie
(Frequenzsenkung).  Aldosteron ist das "Salzsparhormon" des Körpers, ohne seine
Wirkung kommt es zu
lebensbedrohlichem Salzverlust (und Hypovolämie). Aldosteron wird immer
dann vermehrt freigesetzt, wenn es zu zentralem Druckabfall kommt (z.B.
beim Aufrichten / Aufstehen aus liegender Ruhelage) - es steigert den
Blutdruck, indem es Kochsalz im Körper zurückhält und das
extrazelluläre Volumen erhöht.
Aldosteron ist das "Salzsparhormon" des Körpers, ohne seine
Wirkung kommt es zu
lebensbedrohlichem Salzverlust (und Hypovolämie). Aldosteron wird immer
dann vermehrt freigesetzt, wenn es zu zentralem Druckabfall kommt (z.B.
beim Aufrichten / Aufstehen aus liegender Ruhelage) - es steigert den
Blutdruck, indem es Kochsalz im Körper zurückhält und das
extrazelluläre Volumen erhöht.
 Abbildung: Vasopressinkonzentration im Blutplasma als Funktion eines Blutdruckabfalls
Abbildung: Vasopressinkonzentration im Blutplasma als Funktion eines Blutdruckabfalls
 Vasopressin bewirkt
u.a. eine Erhöhung der im Körper verbleibenden Wassermenge
("Wassersparhormon"). Es wird aber auch bei Volumenproblemen intensiv
ausgeschüttet, die im zentralen Kreislaufbereich auftreten - umso
stärker, je größer das Problem für die Blutdruckregulation wird
(
Vasopressin bewirkt
u.a. eine Erhöhung der im Körper verbleibenden Wassermenge
("Wassersparhormon"). Es wird aber auch bei Volumenproblemen intensiv
ausgeschüttet, die im zentralen Kreislaufbereich auftreten - umso
stärker, je größer das Problem für die Blutdruckregulation wird
( Abbildung).
Abbildung).  Der Sympathikus wird bei Kreislaufbelastung, Blutverlust, Stress, Lärm u.a.
stimuliert. Er regt direkt die tubuläre Rückgewinnung von Salz und Wasser an, aktiviert den Reninmechanismus (
Der Sympathikus wird bei Kreislaufbelastung, Blutverlust, Stress, Lärm u.a.
stimuliert. Er regt direkt die tubuläre Rückgewinnung von Salz und Wasser an, aktiviert den Reninmechanismus ( Abbildung) - und damit wiederum Aldosteron.
In der Niere wirken sympathische Fasern bei höherer Aktivität
vasokonstriktorisch, das senkt die Nierendurchblutung (entgegen der
Autoregulation, welche ein
Gleichbleiben der renalen Durchblutung zum Ziel hat).
Abbildung) - und damit wiederum Aldosteron.
In der Niere wirken sympathische Fasern bei höherer Aktivität
vasokonstriktorisch, das senkt die Nierendurchblutung (entgegen der
Autoregulation, welche ein
Gleichbleiben der renalen Durchblutung zum Ziel hat). Atriale natriuretische Peptide wirken schließlich salz-und wasserausscheidend, sind also Gegenspieler, die den Blutdruck wieder senken können.
Atriale natriuretische Peptide wirken schließlich salz-und wasserausscheidend, sind also Gegenspieler, die den Blutdruck wieder senken können. Lokale Wirkstoffe beeinflussen
Gefäßtonus, Widerstand und damit Perfusion / Blutdruck ebenfalls.
Lokale Wirkstoffe beeinflussen
Gefäßtonus, Widerstand und damit Perfusion / Blutdruck ebenfalls.
 Abbildung: Blutdrucksenkung durch Prostaglandine
Abbildung: Blutdrucksenkung durch Prostaglandine
 TXA2, PGG2 und PGH2 bewirken TP-Rezeptorvermittelte Vasokonstriktion und wirken blutdrucksteigernd; dieser Effekt kann aber durch
TXA2, PGG2 und PGH2 bewirken TP-Rezeptorvermittelte Vasokonstriktion und wirken blutdrucksteigernd; dieser Effekt kann aber durch  vasodilatative Effekte von PGI2,
PGD und PGE überlagert sein. Diese erweitern über IP-, DP- und
EP-Rezeptoren die meisten Gefäßgebiete und wirken dadurch
blutdrucksenkend. Gesteigerte Natriumexkretion könnte den hypotensiven Effekt verstärken (
vasodilatative Effekte von PGI2,
PGD und PGE überlagert sein. Diese erweitern über IP-, DP- und
EP-Rezeptoren die meisten Gefäßgebiete und wirken dadurch
blutdrucksenkend. Gesteigerte Natriumexkretion könnte den hypotensiven Effekt verstärken ( Abbildung)
Abbildung)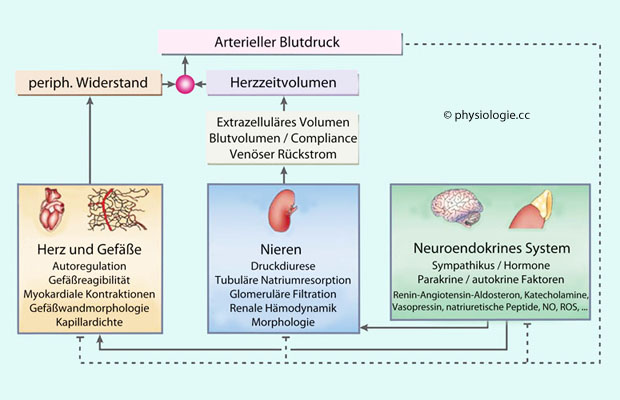
 Abbildung: Einflüsse auf peripheren Widerstand und Herzzeitvolumen bestimmen den arteriellen Blutdruck
Abbildung: Einflüsse auf peripheren Widerstand und Herzzeitvolumen bestimmen den arteriellen Blutdruck
 Über längere Zeiträume treten Mechanismen in den Vordergrund,
die nicht mehr einen einfachen hydromechanischen Kreislauf mit
konstanten physikalischen Eigenschaften repräsentieren, sondern
Anpassungen von Volumina, deren Verteilung, ferner von Eigenschaften
der Gefäßwände (Dehnbarkeit, Tonus) und der Herzfunktion.
Über längere Zeiträume treten Mechanismen in den Vordergrund,
die nicht mehr einen einfachen hydromechanischen Kreislauf mit
konstanten physikalischen Eigenschaften repräsentieren, sondern
Anpassungen von Volumina, deren Verteilung, ferner von Eigenschaften
der Gefäßwände (Dehnbarkeit, Tonus) und der Herzfunktion.  Abbildung).
Abbildung). 
 Abbildung). Die Pumpleistung des
Herzens kann bis zum 4- bis 5-fachen des Ruhewertes ansteigen, hauptsächlich
bedingt durch Frequenzerhöhung (Faktor ~3) und auch durch
gesteigertes Schlagvolumen (Faktor ~1,5).
Abbildung). Die Pumpleistung des
Herzens kann bis zum 4- bis 5-fachen des Ruhewertes ansteigen, hauptsächlich
bedingt durch Frequenzerhöhung (Faktor ~3) und auch durch
gesteigertes Schlagvolumen (Faktor ~1,5). 
 Abbildung: Integrierte Kreislaufreaktion auf körperliche Belastung (Muskelaktivität)
Abbildung: Integrierte Kreislaufreaktion auf körperliche Belastung (Muskelaktivität) Histamin, Adrenalin, Acetylcholin (ACh), Noradrenalin (NA)
Histamin, Adrenalin, Acetylcholin (ACh), Noradrenalin (NA)

 Höhere Zentren (Hypothalamus, Großhirn) werden bei Beginn willkürlicher Muskelaktivität aktiv.
Höhere Zentren (Hypothalamus, Großhirn) werden bei Beginn willkürlicher Muskelaktivität aktiv. Verzögerte Reaktionen stammen aus dem Bewegungsapparat selbst und von anderen reflektorischen Komponenten. Hierher gehören Histaminfreisetzung, Adrenalinwirkung, Temperaturregulation (Wirkung von Kallikrein).
Verzögerte Reaktionen stammen aus dem Bewegungsapparat selbst und von anderen reflektorischen Komponenten. Hierher gehören Histaminfreisetzung, Adrenalinwirkung, Temperaturregulation (Wirkung von Kallikrein).
 Abbildung). Das Ausmaß dieser Steigerung hat prädiktiven Wert für
spätere Probleme wie Hypertonie oder Erkrankung der Herzkranzgefäße.
(Der diastolische Wert ändert sich nicht wesentlich, die
Blutdruckamplitude steigt unter Belastung an.)
Abbildung). Das Ausmaß dieser Steigerung hat prädiktiven Wert für
spätere Probleme wie Hypertonie oder Erkrankung der Herzkranzgefäße.
(Der diastolische Wert ändert sich nicht wesentlich, die
Blutdruckamplitude steigt unter Belastung an.)
 Abbildung: Systolischer Blutdruck als Funktion der Dauer maximaler körperlicher Ausbelastung
Abbildung: Systolischer Blutdruck als Funktion der Dauer maximaler körperlicher Ausbelastung Zur Regulation der Muskeldurchblutung s. auch dort
Zur Regulation der Muskeldurchblutung s. auch dort Als Maß für die Vorlast gilt der Füllungsdruck in den Vorhöfen - im
Bereich des rechten Vorhofs der Zentralvenendruck, links im Vorhof bzw.
den Pulmonalvenen.
Als Maß für die Vorlast gilt der Füllungsdruck in den Vorhöfen - im
Bereich des rechten Vorhofs der Zentralvenendruck, links im Vorhof bzw.
den Pulmonalvenen.  Steigt die Vorlast, nimmt die Ventrikelfüllung zu - und umgekehrt.
Steigt die Vorlast, nimmt die Ventrikelfüllung zu - und umgekehrt.
 Abbildung: Einflüsse, welche die Vorlast (preload) des Herzens bestimmen
Abbildung: Einflüsse, welche die Vorlast (preload) des Herzens bestimmen
 Der Zustand des Herzmuskels wird durch Faktoren wie Muskelmasse, Dehnungszustand, Durchblutung der Herzkranzgefäße bestimmt.
Einflüsse auf die "Fitness" des Herzmuskels als Förderpumpe nennt man inotrop.
Positiv inotrop wirkt z.B. ein verbessertes Angebot an Substraten für
den Energiehaushalt des Myokards, bessere Durchblutung, hohe
Sauerstoffsättigung des arteriellen Hämoglobins.
Der Zustand des Herzmuskels wird durch Faktoren wie Muskelmasse, Dehnungszustand, Durchblutung der Herzkranzgefäße bestimmt.
Einflüsse auf die "Fitness" des Herzmuskels als Förderpumpe nennt man inotrop.
Positiv inotrop wirkt z.B. ein verbessertes Angebot an Substraten für
den Energiehaushalt des Myokards, bessere Durchblutung, hohe
Sauerstoffsättigung des arteriellen Hämoglobins. Die Nachlast wird repräsentiert durch den arteriellen Druck in
Pulmonalarterie bzw. Aorta (eigentlich die Impedanz, also der dynamische Widerstand, gegen den der Ventrikel Blut fördert). Je höher der arterielle Druck und je
geringer die Dehnbarkeit der arteriellen Gefäße (insbesondere der
Aortenwurzel), desto höher ist der Arbeitsaufwand des Myokards während
der Austreibungszeit.
Die Nachlast wird repräsentiert durch den arteriellen Druck in
Pulmonalarterie bzw. Aorta (eigentlich die Impedanz, also der dynamische Widerstand, gegen den der Ventrikel Blut fördert). Je höher der arterielle Druck und je
geringer die Dehnbarkeit der arteriellen Gefäße (insbesondere der
Aortenwurzel), desto höher ist der Arbeitsaufwand des Myokards während
der Austreibungszeit.  Abnahme des
(effektiv zirkulierenden) Blutvolumens steigert die
Sympathikusaktivität und regt die Bildung von Angiotensin an
Abnahme des
(effektiv zirkulierenden) Blutvolumens steigert die
Sympathikusaktivität und regt die Bildung von Angiotensin an
 Dadurch
wird der Na-H-Austausch im proximalen Tubulus und damit die H+-Sekretion in der Niere angeregt
Dadurch
wird der Na-H-Austausch im proximalen Tubulus und damit die H+-Sekretion in der Niere angeregt
 Bei längerer Dauer steigt auch die Aldosteronwirkung (H+-Sekretion im distalen Tubulus).
Bei längerer Dauer steigt auch die Aldosteronwirkung (H+-Sekretion im distalen Tubulus).  Orthostase
Orthostase  (=aufrechte Körperlage):
Nimmt der Rückstrom von Blut aus dem Venensystem zum Herzen ab (wie beim Aufrichten
des Körpers), wirkt der
Lungenkreislauf als kurzzeitige Füllungsreserve für das linke Herz und
stabilisiert den arteriellen Druck. Sinkt der venöse Rückstrom zum
Herzen, nimmt auch das Herzminutenvolumen ab (bei Orthostase um ~30%), in den Beinvenen werden ~10% des Blutvolumens zusätzlich
eingelagert.
(=aufrechte Körperlage):
Nimmt der Rückstrom von Blut aus dem Venensystem zum Herzen ab (wie beim Aufrichten
des Körpers), wirkt der
Lungenkreislauf als kurzzeitige Füllungsreserve für das linke Herz und
stabilisiert den arteriellen Druck. Sinkt der venöse Rückstrom zum
Herzen, nimmt auch das Herzminutenvolumen ab (bei Orthostase um ~30%), in den Beinvenen werden ~10% des Blutvolumens zusätzlich
eingelagert.
 Zahlreiche Faktoren beeinflussen das Ausmaß einer orthostatischen Reaktion, insbesondere: Blutvolumen und seine Verteilung, systemischer Füllungsdruck; Dehnbarkeit der Gefäße, insbesondere der Venen in unteren Körperpartien; Lage der hydrostatischen Indifferenz; Grad der Kippung (Kipptisch); Muskeltonus; Funktion von Hoch- und Niederdruckrezeptoren; Temperatur; Herzfrequenz zu Beginn des Reizes; Sympathikustonus; Kontraktilität des Herzmuskels; Empfindlichkeit der Gefäße gegenüber konstriktorischen Impulsen.
Zahlreiche Faktoren beeinflussen das Ausmaß einer orthostatischen Reaktion, insbesondere: Blutvolumen und seine Verteilung, systemischer Füllungsdruck; Dehnbarkeit der Gefäße, insbesondere der Venen in unteren Körperpartien; Lage der hydrostatischen Indifferenz; Grad der Kippung (Kipptisch); Muskeltonus; Funktion von Hoch- und Niederdruckrezeptoren; Temperatur; Herzfrequenz zu Beginn des Reizes; Sympathikustonus; Kontraktilität des Herzmuskels; Empfindlichkeit der Gefäße gegenüber konstriktorischen Impulsen. Auch die Atmung wirkt sich auf die venöse Blutfüllung aus ("Atempumpe"):
Auch die Atmung wirkt sich auf die venöse Blutfüllung aus ("Atempumpe"): Zunehmender transmuraler Druck bei der Einatmung weitet die rechte
Herzkammer und erhöht Vorlast und Schlagvolumen. Der sinkende
Vorhofdruck vergrößert den Druckgradienten Peripherie - Herz, der
venöse Rückstrom steigt an. Die umgekehrten Effekte während der Ausatmung sind weniger wirksam.
Zunehmender transmuraler Druck bei der Einatmung weitet die rechte
Herzkammer und erhöht Vorlast und Schlagvolumen. Der sinkende
Vorhofdruck vergrößert den Druckgradienten Peripherie - Herz, der
venöse Rückstrom steigt an. Die umgekehrten Effekte während der Ausatmung sind weniger wirksam. Die Einatmung erhöht das Blutvolumen in der Lunge und senkt vorübergehend den Bluteinstrom in den linken Vorhof - die Auswurfleistung des linken Ventrikels nimmt während der Inspiration ab.
Die Einatmung erhöht das Blutvolumen in der Lunge und senkt vorübergehend den Bluteinstrom in den linken Vorhof - die Auswurfleistung des linken Ventrikels nimmt während der Inspiration ab. 
 Abbildung: Experimentelle Untersuchung der Kreislauffunktionen
Abbildung: Experimentelle Untersuchung der Kreislauffunktionen
 Abbildung):
Abbildung):
 Abbildung: Kurzfristige Reaktionen auf Blutverlust
Abbildung: Kurzfristige Reaktionen auf Blutverlust
 Abbildung zeigt die wichtigsten Reflexwege zur initialen Kompensation des Blutdruckabfalls und Stabilisierung des Kreislaufs:
Abbildung zeigt die wichtigsten Reflexwege zur initialen Kompensation des Blutdruckabfalls und Stabilisierung des Kreislaufs: (1) Arterielle Barorezeptoren:
Als Reaktion auf sinkende afferente Aktionspotentialfrequenz sinkt der
Parasympathikus- und steigt der Sympathikustonus, das Herz wird
angeregt, vor allem im Splanchnikusgebiet und renal kommt es zu
Vasokonstriktion.
(1) Arterielle Barorezeptoren:
Als Reaktion auf sinkende afferente Aktionspotentialfrequenz sinkt der
Parasympathikus- und steigt der Sympathikustonus, das Herz wird
angeregt, vor allem im Splanchnikusgebiet und renal kommt es zu
Vasokonstriktion. (2) Rezeptoren im Niederdrucksystem
(kardiopulmonal) werden infolge des geringeren zentralen Blutvolumens
weniger stark stimuliert, reflektorisch steigt der Sympathikustonus vor
allem im Gebiet der Nieren (was glomeruläre Filtration und
Harnproduktion reduziert). Außerdem steigert der Hypothalamus die
Freisetzung von Vasopressin, das den Blutdruck steigert; und ANP wird
von den wenig gefüllten Atrien kaum noch produziert, die renale
Natriumausscheidung sinkt (Volumenkonservierung).
(2) Rezeptoren im Niederdrucksystem
(kardiopulmonal) werden infolge des geringeren zentralen Blutvolumens
weniger stark stimuliert, reflektorisch steigt der Sympathikustonus vor
allem im Gebiet der Nieren (was glomeruläre Filtration und
Harnproduktion reduziert). Außerdem steigert der Hypothalamus die
Freisetzung von Vasopressin, das den Blutdruck steigert; und ANP wird
von den wenig gefüllten Atrien kaum noch produziert, die renale
Natriumausscheidung sinkt (Volumenkonservierung). (3) Die sinkende Durchblutung peripherer Chemorezeptoren (glomera carotica und aortica) senkt hier den pO2 und steigert die afferente Aktionspotentialfrequenz. Das steigert indirekt die Herzfrequenz (s. dort).
(3) Die sinkende Durchblutung peripherer Chemorezeptoren (glomera carotica und aortica) senkt hier den pO2 und steigert die afferente Aktionspotentialfrequenz. Das steigert indirekt die Herzfrequenz (s. dort). (4) Hypotoniebedingte zerebrale Ischämie senkt den pO2 und hebt den pCO2 im Gehirn. Die resultierende Azidose steigert den Sympathikustonus wesentlich stärker, als dies der Barorezeptorreflex tut.
(4) Hypotoniebedingte zerebrale Ischämie senkt den pO2 und hebt den pCO2 im Gehirn. Die resultierende Azidose steigert den Sympathikustonus wesentlich stärker, als dies der Barorezeptorreflex tut.
 Abbildung: Herzleistung nach zwei Blutverlusten unterschiedlicher Intensität
Abbildung: Herzleistung nach zwei Blutverlusten unterschiedlicher Intensität
 Allmählich
rücken vermehrt Proteine in die Blutbahn nach, vermutlich über das
fenestrierte Endothel intestinaler und hepatischer Kapillaren (in
diesen Gebieten ist die Proteinkonzentration der interstitiellen
Flüssigkeit verhältnismäßig hoch); und die Albuminsynthese der Leber steigt an, sodass die Proteinwerte im Plasma nach mehreren Tagen normalisiert werden.
Allmählich
rücken vermehrt Proteine in die Blutbahn nach, vermutlich über das
fenestrierte Endothel intestinaler und hepatischer Kapillaren (in
diesen Gebieten ist die Proteinkonzentration der interstitiellen
Flüssigkeit verhältnismäßig hoch); und die Albuminsynthese der Leber steigt an, sodass die Proteinwerte im Plasma nach mehreren Tagen normalisiert werden. Gesteigerte Erythropoese
führt schließlich (über Wochen) auch zur Wiederherstellung der
Ausgangswerte des Hämatokrit und der Hämoglobinkonzentration im Blut.
Gesteigerte Erythropoese
führt schließlich (über Wochen) auch zur Wiederherstellung der
Ausgangswerte des Hämatokrit und der Hämoglobinkonzentration im Blut. Abbildung).
Abbildung). 
 Abbildung: Einfluss verschiedener Regelsysteme auf die Blutdruckregulation
Abbildung: Einfluss verschiedener Regelsysteme auf die Blutdruckregulation









 Dehnungssensitive Nervenzellen in
der Wand des Carotissinus und Aortenbogens (Barorezeptoren) reagieren
auf Blutdruckänderungen, besonders deren zeitliche Änderung
(PD-Rezeptor) - am empfindlichsten im physiologischen Blutdruckbereich
(der Durchmesser des sinus coronarius oszilliert mit dem arteriellen
Puls um ~15%). Die
Dehnungsempfindlichkeit entspricht der Öffnungswahrscheinlichkeit
mechanosensibler Kationenkanäle in der Membran der barosensitiven
Neurone. Die Afferenzen erfolgen über den IX. (Carotis) und X. Hirnnerven (Aorta) zum nucl. tractus solitarii der medulla oblongata.
A-Fasern sind gut myelinisiert, leiten schnell, haben eine niedrige
Reizschwelle (<90 mmHg), feuern pulsatil im normalen
Blutdruckbereich. Die zahlreicheren C-Fasern sind nicht myelinisiert,
leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg). Bei
normalem Blutdruck sind
~25% der C-Fasern aktiv (Druckspitzen); C-Fasern erfassen vor allem erhöhte Blutdruckbereiche (>150 mmHg). Der
Baroreflex adaptiert rasch (Stunden bis Tage), er ist für Korrekturen
akuter Blutdruckschwankungen ausgelegt (z.B. Änderung der Körperlage) - er
passt sich längerfristigen Druckänderungen an und bleibt so in seinem
optimalen Empfindlichkeitsbereich
Dehnungssensitive Nervenzellen in
der Wand des Carotissinus und Aortenbogens (Barorezeptoren) reagieren
auf Blutdruckänderungen, besonders deren zeitliche Änderung
(PD-Rezeptor) - am empfindlichsten im physiologischen Blutdruckbereich
(der Durchmesser des sinus coronarius oszilliert mit dem arteriellen
Puls um ~15%). Die
Dehnungsempfindlichkeit entspricht der Öffnungswahrscheinlichkeit
mechanosensibler Kationenkanäle in der Membran der barosensitiven
Neurone. Die Afferenzen erfolgen über den IX. (Carotis) und X. Hirnnerven (Aorta) zum nucl. tractus solitarii der medulla oblongata.
A-Fasern sind gut myelinisiert, leiten schnell, haben eine niedrige
Reizschwelle (<90 mmHg), feuern pulsatil im normalen
Blutdruckbereich. Die zahlreicheren C-Fasern sind nicht myelinisiert,
leiten langsam und haben eine hohe Reizschwelle (70-140 mmHg). Bei
normalem Blutdruck sind
~25% der C-Fasern aktiv (Druckspitzen); C-Fasern erfassen vor allem erhöhte Blutdruckbereiche (>150 mmHg). Der
Baroreflex adaptiert rasch (Stunden bis Tage), er ist für Korrekturen
akuter Blutdruckschwankungen ausgelegt (z.B. Änderung der Körperlage) - er
passt sich längerfristigen Druckänderungen an und bleibt so in seinem
optimalen Empfindlichkeitsbereich Der nucl. tractus solitarii projiziert anregend auf den nucleus ambiguus, der parasympathische Aktivität beeinflust ("Vaguskerne", parasympathische Bremsung der Herzaktion), und hemmt das ventromedial gelegene vasomotorische Areal, das auf sympathische Efferenzen wirkt (Dilatation von Widerstandsgefäßen, weniger Adrenalinfreisetzung aus den Nebennieren). Das ergibt mehrfache Rückkopplung auf Herz und Blutgefäße, die den Blutdruck stabilisiert. Plötzliche
Zunahme des arteriellen Drucks erhöht die parasympathische (vermehrte
Freisetzung von Acetylcholin) und senkt die
sympathische Aktivität (verringerte Freisetzung von Noradrenalin). Gleichzeitig sinkt
der Venentonus, die venöse Volumendehnbarkeit nimmt zu (sinkende
Vorlast für das Herz). Erregung der Barorezeptoren dämpft auch die Atmung und senkt den Muskeltonus
Der nucl. tractus solitarii projiziert anregend auf den nucleus ambiguus, der parasympathische Aktivität beeinflust ("Vaguskerne", parasympathische Bremsung der Herzaktion), und hemmt das ventromedial gelegene vasomotorische Areal, das auf sympathische Efferenzen wirkt (Dilatation von Widerstandsgefäßen, weniger Adrenalinfreisetzung aus den Nebennieren). Das ergibt mehrfache Rückkopplung auf Herz und Blutgefäße, die den Blutdruck stabilisiert. Plötzliche
Zunahme des arteriellen Drucks erhöht die parasympathische (vermehrte
Freisetzung von Acetylcholin) und senkt die
sympathische Aktivität (verringerte Freisetzung von Noradrenalin). Gleichzeitig sinkt
der Venentonus, die venöse Volumendehnbarkeit nimmt zu (sinkende
Vorlast für das Herz). Erregung der Barorezeptoren dämpft auch die Atmung und senkt den Muskeltonus Sensorische Afferenzen wirken auf Herzfrequenz und Blutdruck: Reizung
von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch
Inhibition vagaler Efferenzen im Hirnstamm (Beitrag zur
atmungssynchronen Sinusarrhythmie). Plötzliche tiefe Einatmung löst
auch Vasokonstriktion in der Haut aus. Somatische Schmerzreize können
den Herzschlag beschleunigen und den Blutdruck steigern, umgekehrt kann viszeraler Schmerz Bradykardie und Blutdruckabfall
auslösen. Kältereize wirken hypertensiv, plötzlicher Lärm und Bedrohung
können Tachykardie auslösen. Sexuelle Erregung steigert Pulsfrequenz
und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus
(Bradykardie)
Sensorische Afferenzen wirken auf Herzfrequenz und Blutdruck: Reizung
von Dehnungsrezeptoren in der Lunge bewirkt Reflextachykardie durch
Inhibition vagaler Efferenzen im Hirnstamm (Beitrag zur
atmungssynchronen Sinusarrhythmie). Plötzliche tiefe Einatmung löst
auch Vasokonstriktion in der Haut aus. Somatische Schmerzreize können
den Herzschlag beschleunigen und den Blutdruck steigern, umgekehrt kann viszeraler Schmerz Bradykardie und Blutdruckabfall
auslösen. Kältereize wirken hypertensiv, plötzlicher Lärm und Bedrohung
können Tachykardie auslösen. Sexuelle Erregung steigert Pulsfrequenz
und Blutdruck. Benetzung des Gesichts löst den Tauchreflex aus
(Bradykardie) Die Langzeitregulierung des arteriellen Drucks erfolgt über Anpassung des Blutvolumens, der Compliance der Gefäße und allenfalls des Herzmuskels. Aldosteron hält Kochsalz im Körper zurück ("Salzsparhormon") und erhöht das
extrazelluläre Volumen; Vasopressin verringert die Wasserdiurese
("Wassersparhormon"). Der Sympathikus regt die tubuläre Rückgewinnung
von Salz und Wasser an, aktiviert den Reninmechanismus und damit
wiederum Aldosteron. Atriale natriuretische Peptide wirken umgekehrt
natriuretisch. Der Organismus passt die Kreislaufregulation an
veränderte Randbedingungen an, mit dem Ziel optimaler Durchblutungswerte
Die Langzeitregulierung des arteriellen Drucks erfolgt über Anpassung des Blutvolumens, der Compliance der Gefäße und allenfalls des Herzmuskels. Aldosteron hält Kochsalz im Körper zurück ("Salzsparhormon") und erhöht das
extrazelluläre Volumen; Vasopressin verringert die Wasserdiurese
("Wassersparhormon"). Der Sympathikus regt die tubuläre Rückgewinnung
von Salz und Wasser an, aktiviert den Reninmechanismus und damit
wiederum Aldosteron. Atriale natriuretische Peptide wirken umgekehrt
natriuretisch. Der Organismus passt die Kreislaufregulation an
veränderte Randbedingungen an, mit dem Ziel optimaler Durchblutungswerte Mit Dauer und
Intensität körperlicher Belastung steigt der systolische Druck, der
diastolische Wert ändert sich kaum, die Blutdruckamplitude steigt unter
Belastung an. Die "Atempumpe" steigert das Herzzeitvolumen zusätzlich zu den Effekten neurohumoraler Kreislaufanregung
Mit Dauer und
Intensität körperlicher Belastung steigt der systolische Druck, der
diastolische Wert ändert sich kaum, die Blutdruckamplitude steigt unter
Belastung an. Die "Atempumpe" steigert das Herzzeitvolumen zusätzlich zu den Effekten neurohumoraler Kreislaufanregung Die Körperlage
beeinflusst die Vorlast des Herzens: Der Füllungsdruck steigt beim
Hinlegen, sinkt beim Aufstehen. Bei Wechsel zu Orthostase nimmt das Herzminutenvolumen um ~30% ab, in den Beinvenen werden ~10% des Blutvolumens
zusätzlich eingelagert. Reflexe
stabilisieren den Blutdruck (Vasokonstriktion reduziert Perfusion und
venöse Speicherung), die Durchblutung des Gehirns (sinkender
hydrostatischer Druck) und der Nieren (reflektorisch erhöhter
Sympathikustonus) nimmt ab
Die Körperlage
beeinflusst die Vorlast des Herzens: Der Füllungsdruck steigt beim
Hinlegen, sinkt beim Aufstehen. Bei Wechsel zu Orthostase nimmt das Herzminutenvolumen um ~30% ab, in den Beinvenen werden ~10% des Blutvolumens
zusätzlich eingelagert. Reflexe
stabilisieren den Blutdruck (Vasokonstriktion reduziert Perfusion und
venöse Speicherung), die Durchblutung des Gehirns (sinkender
hydrostatischer Druck) und der Nieren (reflektorisch erhöhter
Sympathikustonus) nimmt ab Hypovolämie steigert die Sympathikusaktivität und regt die Bildung von Angiotensin an (H+-Sekretion im proximalen Tubulus). Bei längerer Dauer steigt auch die Aldosteronwirkung (H+-Sekretion im distalen Tubulus). Volumenerhöhung hat den gegenteiligen Effekt (verringerte Säureausscheidung)
Hypovolämie steigert die Sympathikusaktivität und regt die Bildung von Angiotensin an (H+-Sekretion im proximalen Tubulus). Bei längerer Dauer steigt auch die Aldosteronwirkung (H+-Sekretion im distalen Tubulus). Volumenerhöhung hat den gegenteiligen Effekt (verringerte Säureausscheidung) 