




 Perfusion von Organen und Geweben
Perfusion von Organen und Geweben
 Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel
Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel| Teilkreisläufe konkurrieren um Durchblutung. So benötigt bei sportlicher Aktivität einerseits die
Muskulatur viel Blut (bis zum Mehrfachen des Ruhe-Herzzeitvolumens), andererseits die Haut
eine für ihre Kühlungsaufgabe ausreichende Perfusion. Gewebe wie Herzmuskel oder Gehirn tolerieren keine Einbuße ihrer
Blutversorgung, ihre Perfusion muss unter allen Umständen gesichert sein. In kritischen Situationen haben (über)lebenswichtige Gewebe Vorrang vor anderen, die vorübergehend auch mit wenig Sauerstoff auskommen. Der Sympathikustonus ist dann meist hoch, inaktive Muskulatur und Splanchnicusgebiet (Darm, Pankreas, Nieren..) werden kaum durchblutet (gut für das Herz). In aktiven Teilen des Bewegungssystems wird sympathisch bedingte Vasokonstriktion über Autoregulation überspielt und ihre Perfusion durch "kollaterale Vasokonstriktion" gesichert. 100 ml Blut können ~20 ml Sauerstoff transportieren (1,34 ml/g Hämoblobin: Hüfner'sche Zahl). Davon schöpft das Gewebe je nach Bedarf einen gewissen Anteil (Sauerstoffextraktion), der Rest wird zur Lunge retourniert. Der Unterschied zwischen arterieller und venöser O2-Menge heisst arteriovenöse Sauerstoffdifferenz (AVDO2). Sie ist z.B. hoch im Herzmuskel (der viel O2 für seine Energieproduktion braucht) und gering in der Niere (die im Dienst der durchblutungsintensiven Harnproduktion steht). Die spezifische Durchblutung ist auf 100g Gewebemasse normiert (z.B. kühle Haut 10, Gehirn 55, Myokard 80, Niere 400 ml/100 g/min). Stoffwechselintensive Organe haben hohen spezifischen Sauerstoffverbrauch. Sehr rasch (Sekunden) wirken z.B. Autoregulation, die dehnungsgetriggerte Gefäßkontraktion (Bayliss-Effekt) oder der Baroreflex; langsamer (Minuten bis Stunden) durch Hormone gesteuerte Adaptationen; Stunden bis Tage brauchen z.B. Veränderungen der Gefäß- und Gewebsdehnbarkeit (Compliance), des Flüssigkeitshaushaltes und der Nierenfunktion. |
 Sauerstoffextraktion AVDO2
Sauerstoffextraktion AVDO2  Spezifische Durchblutung
Spezifische Durchblutung  Regulationsmechanismen
Regulationsmechanismen  Organdurchblutung
Organdurchblutung  Reaktive Hyperämie
Reaktive Hyperämie

 Autoregulation
Autoregulation  Euler-Liljestrand-Mechanismus
Euler-Liljestrand-Mechanismus
 Core messages
Core messages
 CI-Wert bei einer Person mit 2 m2 Hautoberfläche und einem HZV von 6 l/min? (3 l/min)
CI-Wert bei einer Person mit 2 m2 Hautoberfläche und einem HZV von 6 l/min? (3 l/min)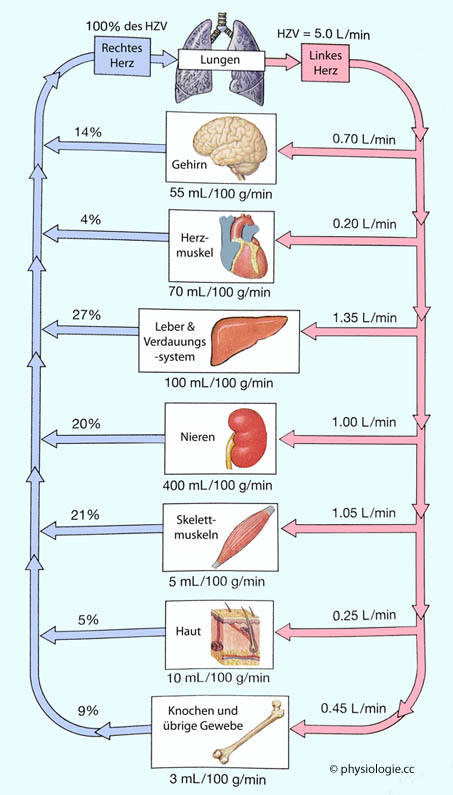
 Abbildung: Perfusion der Körperregionen in Ruhe
Abbildung: Perfusion der Körperregionen in Ruhe
 Abbildung - die das Fettgewebe nicht, wohl aber die Haut mit eigenen Werten berücksichtigt - gezeigten etwas ab):
Abbildung - die das Fettgewebe nicht, wohl aber die Haut mit eigenen Werten berücksichtigt - gezeigten etwas ab): ~30% für das Verdauungssystem - der größte "Verbraucher" von Durchblutung im Zustand körperlicher Ruhe
~30% für das Verdauungssystem - der größte "Verbraucher" von Durchblutung im Zustand körperlicher Ruhe ~20% für die Nieren
- notwendig für die "Blutwäsche"
~20% für die Nieren
- notwendig für die "Blutwäsche" ~15% für das Gehirn - die Gehirndurchblutung ist insgesamt weitgehend konstant (0,55 ml/min/g)
~15% für das Gehirn - die Gehirndurchblutung ist insgesamt weitgehend konstant (0,55 ml/min/g) ~15% für die Muskulatur
- das steigt bei körperlicher Belastung um bis zum Zigfachen des Ruhewertes
~15% für die Muskulatur
- das steigt bei körperlicher Belastung um bis zum Zigfachen des Ruhewertes ~10% für das Fettgewebe
- die Durchblutung entspricht hier etwa dem Anteil am Körpergewicht
~10% für das Fettgewebe
- die Durchblutung entspricht hier etwa dem Anteil am Körpergewicht ~5% für den Herzmuskel - das Myokard hat dabei weniger als ein halbes Prozent der Körpermasse
~5% für den Herzmuskel - das Myokard hat dabei weniger als ein halbes Prozent der Körpermasse ~5% für andere Gewebe (dieser Anteil kann stark steigen, z.B. nimmt die Haut bei extremer Wärmebelastung bis zur Hälfte des - dann erhöhten - Herzminutenvolumens in Anspruch).
~5% für andere Gewebe (dieser Anteil kann stark steigen, z.B. nimmt die Haut bei extremer Wärmebelastung bis zur Hälfte des - dann erhöhten - Herzminutenvolumens in Anspruch). Je nach Aufschlüsselung in eigene Systeme divergieren die in der Literatur angegebenen Werte. So beansprucht das Immunsystem alleine insgesamt etwa 10%des
gesamten Herzzeitvolumens. Dieser Anteil verbirgt sich bei den oben
gezeigten Zahlen in den jeweiligen Gewebewerten, er wurde nicht eigens
berücksichtigt.
Je nach Aufschlüsselung in eigene Systeme divergieren die in der Literatur angegebenen Werte. So beansprucht das Immunsystem alleine insgesamt etwa 10%des
gesamten Herzzeitvolumens. Dieser Anteil verbirgt sich bei den oben
gezeigten Zahlen in den jeweiligen Gewebewerten, er wurde nicht eigens
berücksichtigt.
 bei körperlicher Arbeit: Die Perfusion der arbeitenden Muskulatur nimmt bis zigfach zu, das Herzminutenvolumen steigt bis zum Vier- bis Fünffachen des Ruhewertes an.
bei körperlicher Arbeit: Die Perfusion der arbeitenden Muskulatur nimmt bis zigfach zu, das Herzminutenvolumen steigt bis zum Vier- bis Fünffachen des Ruhewertes an. 
 bei Hitzeeinwirkung: Die Durchblutung der Haut nimmt enorm zu, das Herzminutenvolumen kann sich verdoppeln.
bei Hitzeeinwirkung: Die Durchblutung der Haut nimmt enorm zu, das Herzminutenvolumen kann sich verdoppeln. 
 s. auch dort
s. auch dort bei erhöhter Beanspruchung des Immunsystems
(z.B. Sepsis), in solchen Fällen nimmt der Stoff- und Energiebedarf und
damit die Perfusion der Immungewebe anteilsmäßig deutlich zu.
bei erhöhter Beanspruchung des Immunsystems
(z.B. Sepsis), in solchen Fällen nimmt der Stoff- und Energiebedarf und
damit die Perfusion der Immungewebe anteilsmäßig deutlich zu.  ); 100 ml Blut
enthalten etwa 15 Gramm Hämoglobin. Daher können in 100ml Blut ~20 ml O2 transportiert (und dem Gewebe angeboten) werden (15 mal 1,34 = 20). Kennt man die Durchblutung eines Organs und die AVDO2, errechnet sich daraus der Sauerstoffverbrauch.
); 100 ml Blut
enthalten etwa 15 Gramm Hämoglobin. Daher können in 100ml Blut ~20 ml O2 transportiert (und dem Gewebe angeboten) werden (15 mal 1,34 = 20). Kennt man die Durchblutung eines Organs und die AVDO2, errechnet sich daraus der Sauerstoffverbrauch. Beispiel: Gehirndurchblutung 800 ml/min, AVDO2 = 6 ml/100 ml. Der Sauerstoffverbrauch errechnet sich als 6 mal 8 = 48 ml/min (1/5-1/6 des gesamten Sauerstoffbedarfs des Körpers, der in Ruhe 250-300 ml/min beträgt).
Beispiel: Gehirndurchblutung 800 ml/min, AVDO2 = 6 ml/100 ml. Der Sauerstoffverbrauch errechnet sich als 6 mal 8 = 48 ml/min (1/5-1/6 des gesamten Sauerstoffbedarfs des Körpers, der in Ruhe 250-300 ml/min beträgt). ), sie hängt weiters ab von Herzfrequenz, Aortendruck und Sympathikustonus. Bei körperlicher Belastung nimmt die Durchblutung des
Herzmuskels bis auf das Fünffache des Ruhewertes zu, nimmt aber immer
etwa 5% des HZV in Anspruch: Das heißt, die Koronarperfusion ändert sich proportional zum Herzzeitvolumen.
), sie hängt weiters ab von Herzfrequenz, Aortendruck und Sympathikustonus. Bei körperlicher Belastung nimmt die Durchblutung des
Herzmuskels bis auf das Fünffache des Ruhewertes zu, nimmt aber immer
etwa 5% des HZV in Anspruch: Das heißt, die Koronarperfusion ändert sich proportional zum Herzzeitvolumen. vgl. dort).
vgl. dort).Sauerstoffbedarf (µM/min/g) |
Durchblutung (ml/min/g) |
Sauerstoffausschöpfung (% der arteriell angebotenen Menge) |
|
| Herz (Ruhe) |
4,0 |
0,8 |
57 (AVDO2 12 Vol-%) |
| Nieren |
2,4 |
4,0 |
7 (AVDO2 1,5 Vol-%) |
| Leber |
2,5 |
1,0 |
28 (AVDO2 ~6 Vol-%) |
| Gehirn |
1,5 |
0,5 |
34 (AVDO2 ~7 Vol-%) |
| Skelettmuskel (Ruhe) |
0,1 |
0,04 |
28 (AVDO2 ~6 Vol-%) |
| Skelettmuskel (Arbeit) |
bis 8 |
bis 1,6 |
bis 90 (AVDO2 19 Vol-%) |
| Haut |
0,04 |
0,1 |
4 (AVDO2 1 Vol-%) |
 von nur wenigen % der arteriell angebotenen Menge (Haut - AVDO2 etwa 1 Volumsprozent, von z.B. arteriell 21 Vol-% - bei einer Hämoglobinkonzentration von ~150 g/l - zu venös 20 Vol-%)
von nur wenigen % der arteriell angebotenen Menge (Haut - AVDO2 etwa 1 Volumsprozent, von z.B. arteriell 21 Vol-% - bei einer Hämoglobinkonzentration von ~150 g/l - zu venös 20 Vol-%) bis zu etwa 90% der arteriell angebotenen Menge (maximal aktive Skelettmuskulatur - AVDO2 etwa 19 Volumsprozent)
bis zu etwa 90% der arteriell angebotenen Menge (maximal aktive Skelettmuskulatur - AVDO2 etwa 19 Volumsprozent) Als spezifische Durchblutung bezeichnet man die auf eine bestimmte Organ- bzw. Zellmasse normierte Perfusionsgröße (z.B. ml Blut pro Minute pro 100 Gramm Organ). Ihr Wert ist ein Ausdruck für den Blutbedarf des jeweiligen Gewebes.
Als spezifische Durchblutung bezeichnet man die auf eine bestimmte Organ- bzw. Zellmasse normierte Perfusionsgröße (z.B. ml Blut pro Minute pro 100 Gramm Organ). Ihr Wert ist ein Ausdruck für den Blutbedarf des jeweiligen Gewebes.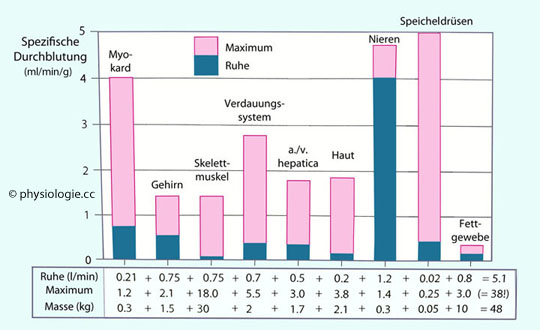
 Abbildung: Spezifische Durchblutung verschiedener Gewebe (ml/min pro Gramm)
Abbildung: Spezifische Durchblutung verschiedener Gewebe (ml/min pro Gramm)
 für
die Haut (Gesamtdurchblutung ≤0,4 l/min) ~10 ml/min/100g, wenn sie
"kühl" ist und nicht für die Wärmeabgabe genutzt wird (dann steigt
diese Zahl auf das Zehnfache und mehr - bis auf ~5 l/min)
für
die Haut (Gesamtdurchblutung ≤0,4 l/min) ~10 ml/min/100g, wenn sie
"kühl" ist und nicht für die Wärmeabgabe genutzt wird (dann steigt
diese Zahl auf das Zehnfache und mehr - bis auf ~5 l/min) für das Gehirn global 55 ml/min/100g - wesentlich weniger in der weißen
Substanz (~20) und fast das Doppelte in der Hirnrinde (~100
ml/min/100g)
für das Gehirn global 55 ml/min/100g - wesentlich weniger in der weißen
Substanz (~20) und fast das Doppelte in der Hirnrinde (~100
ml/min/100g) für den Herzmuskel ~80 ml/min/100g, allerdings kann diese Zahl bis auf
das 4-5fache steigen (320-400 ml/100g/min), wenn der Körper maximal ausbelastet wird
für den Herzmuskel ~80 ml/min/100g, allerdings kann diese Zahl bis auf
das 4-5fache steigen (320-400 ml/100g/min), wenn der Körper maximal ausbelastet wird Leber und Milz haben einen spezifischen Blutbedarf wie die Hirnrinde (~100 ml/min/100g)
Leber und Milz haben einen spezifischen Blutbedarf wie die Hirnrinde (~100 ml/min/100g) Spitzenreiter ist die Niere, die global ~400 ml/min/100g benötigt, noch mehr die Rinde mit ~530 ml/min/100g (
Spitzenreiter ist die Niere, die global ~400 ml/min/100g benötigt, noch mehr die Rinde mit ~530 ml/min/100g ( Abbildung).
Abbildung). Blutdruck - Durchblutung des ganzen Körpers
Blutdruck - Durchblutung des ganzen Körpers Perfusion einzelner Organe (Eigenbedarf)
Perfusion einzelner Organe (Eigenbedarf) Blutvolumen - Voraussetzung für das Funktionieren des Kreislaufs
Blutvolumen - Voraussetzung für das Funktionieren des Kreislaufs Zustand der Gefäße und des Herzens (Anregung, Herzinsuffizienz usw.).
Zustand der Gefäße und des Herzens (Anregung, Herzinsuffizienz usw.).  Vasodilatatorische Einflüsse steigern die Durchblutung
Vasodilatatorische Einflüsse steigern die Durchblutung Metabolisch (lokal): Purine (Adenosin, ADP, ATP), pCO2-Anstieg, pO2-Abfall, pH-Senkung, Anstieg extrazellulären [K+]
Metabolisch (lokal): Purine (Adenosin, ADP, ATP), pCO2-Anstieg, pO2-Abfall, pH-Senkung, Anstieg extrazellulären [K+] Endothelial: Prostazyklin, NO
Endothelial: Prostazyklin, NO Humoral: Kinine, Histamin
Humoral: Kinine, Histamin Nerval: ß-adrenerg
Nerval: ß-adrenerg Vasokonstriktorische Einflüsse senken die Durchblutung
Vasokonstriktorische Einflüsse senken die Durchblutung Endothelial: Endotheline
Endothelial: Endotheline Humoral: Vasopressin, Angiotensin u.a.
Humoral: Vasopressin, Angiotensin u.a. Nerval: α-adrenerg
Nerval: α-adrenerg Myogen: Bayliss-Effekt (Druckanstieg → Dehnung → Konstriktion: Barinogene
Myogen: Bayliss-Effekt (Druckanstieg → Dehnung → Konstriktion: Barinogene Kontraktion)
Kontraktion) Die Faktoren, die auf den Gefäßtonus einwirken, unterscheiden sich je nach Gefäßhierarchie: Der Kontraktionsgrad von Arterien - bis zu großen Areriolen - wird weitgehend durch den sympathischen Tonus kontrolliert. An kleinen Arteriolen wirken vorwiegend myogene Mechanismen (auch NO). Im Bereich der terminalen und Metarteriolen dominiert der Einfluss von humoralen (inklusive Gewebshormone) und metabolischen Faktoren (s. oben).
Die Faktoren, die auf den Gefäßtonus einwirken, unterscheiden sich je nach Gefäßhierarchie: Der Kontraktionsgrad von Arterien - bis zu großen Areriolen - wird weitgehend durch den sympathischen Tonus kontrolliert. An kleinen Arteriolen wirken vorwiegend myogene Mechanismen (auch NO). Im Bereich der terminalen und Metarteriolen dominiert der Einfluss von humoralen (inklusive Gewebshormone) und metabolischen Faktoren (s. oben).
 Abbildung: Doppelter Rückkopplungskreis für die Blutdruckregulation
Abbildung: Doppelter Rückkopplungskreis für die Blutdruckregulation
 Lungengefäße lassen sich durch
erhöhten Blutdruck widerstandslos weiten, sodass die Nachlast für den rechten Ventrikel bei zunehmender Förderleistung abnimmt.
Lungengefäße lassen sich durch
erhöhten Blutdruck widerstandslos weiten, sodass die Nachlast für den rechten Ventrikel bei zunehmender Förderleistung abnimmt.| Nimmt die Durchblutung der Lunge zu (erhöhtes Herzminutenvolumen), sinkt automatisch der pulmonale Gefäßwiderstand (druckpassiv) |
 Im Sekundenbereich wirkende Mechanismen (
Im Sekundenbereich wirkende Mechanismen ( Abbildung oben), wie Autoregulation: Auf lokaler Ebene (ohne Einfluss des Nervensystems) gibt es bedarfabhängige und durchblutungsstabilisierende Effekte.
Abbildung oben), wie Autoregulation: Auf lokaler Ebene (ohne Einfluss des Nervensystems) gibt es bedarfabhängige und durchblutungsstabilisierende Effekte.  Autoregulation
ist besonders bedeutsam für Organe, die sehr empfindlich gegenüber
Ischämie (Unterdurchblutung) oder Hyperämie (Überdurchblutung) sind -
insbesondere Gehirn, Herzmuskel und Nieren.
Autoregulation
ist besonders bedeutsam für Organe, die sehr empfindlich gegenüber
Ischämie (Unterdurchblutung) oder Hyperämie (Überdurchblutung) sind -
insbesondere Gehirn, Herzmuskel und Nieren. Unter Autoregulation versteht
man die Fähigkeit von Blutgefäßen, ihren Widerstand selbst zu
regulieren - meist durch Anstieg des Gefäßtonus in Reaktion auf
erhöhten Innendruck (und vice versa).
Unter Autoregulation versteht
man die Fähigkeit von Blutgefäßen, ihren Widerstand selbst zu
regulieren - meist durch Anstieg des Gefäßtonus in Reaktion auf
erhöhten Innendruck (und vice versa).| Myogene (autoregulatorische) Vasokonstriktion wirkt über Aktivierung mechanosensitiver Ionenkanäle |
 (
( Abbildung s. dort)
beruht auf so einem myogenen Gefäßmechanismus: Er beschreibt den
Zeitverlauf der myogenen Reaktion nach einem Blutdruckanstieg in
arteriolär-präkapillären Gefäßen. Dehnung führt zu Kontraktion und
Widerstandserhöhung - trotz zunehmendem Druck behält das Gefäß einen etwa
konstanten Durchmesser oder wird sogar enger. Zweck ist
die Stabilisierung der
Durchblutung.
Abbildung s. dort)
beruht auf so einem myogenen Gefäßmechanismus: Er beschreibt den
Zeitverlauf der myogenen Reaktion nach einem Blutdruckanstieg in
arteriolär-präkapillären Gefäßen. Dehnung führt zu Kontraktion und
Widerstandserhöhung - trotz zunehmendem Druck behält das Gefäß einen etwa
konstanten Durchmesser oder wird sogar enger. Zweck ist
die Stabilisierung der
Durchblutung.
 Abbildung: Steuerung des Kreislaufsystems
Abbildung: Steuerung des Kreislaufsystems Der Barorezeptorreflex wirkt kurzfristig; bei längerdauernder
Abweichung (Stunden bis Tage) des arteriellen Ruheblutdrucks (Hypotonie: zu niedriger Blutdruck, Grenzwerte definitionsabhängig, etwa <100 mmHg systolisch und <60 mmHg diastolisch;
Hypertonie: zu hoher Blutdruck, systolisch >140 mmHg, diastolisch >90 mmHg) nimmt seine Wirksamkeit stark ab (Adaptation)
Der Barorezeptorreflex wirkt kurzfristig; bei längerdauernder
Abweichung (Stunden bis Tage) des arteriellen Ruheblutdrucks (Hypotonie: zu niedriger Blutdruck, Grenzwerte definitionsabhängig, etwa <100 mmHg systolisch und <60 mmHg diastolisch;
Hypertonie: zu hoher Blutdruck, systolisch >140 mmHg, diastolisch >90 mmHg) nimmt seine Wirksamkeit stark ab (Adaptation) 
 Kardio-pulmonale Reflexe, ausgelöst von Dehnungsrezeptoren in oder nahe den Herzvorhöfen.
Kardio-pulmonale Reflexe, ausgelöst von Dehnungsrezeptoren in oder nahe den Herzvorhöfen. Im Minutenbereich wirkende Mechanismen. Hierher zählen kurzfristige hormonelle Einstellungen (
Im Minutenbereich wirkende Mechanismen. Hierher zählen kurzfristige hormonelle Einstellungen ( Abbildung unten), z.B. über Katecholamine, Aldosteron und Vasopressin (ADH). Vasopressin erhöht die Rückgewinnung von Wasser in der Niere; es wirkt in
höherer Konzentration vasokonstriktorisch und damit blutdrucksteigernd.
Abbildung unten), z.B. über Katecholamine, Aldosteron und Vasopressin (ADH). Vasopressin erhöht die Rückgewinnung von Wasser in der Niere; es wirkt in
höherer Konzentration vasokonstriktorisch und damit blutdrucksteigernd.

 Im längerfristigen Zeitbereich (Stunden, Tage und länger)
wirkende Mechanismen, welche
- lokal, neural und humoral gesteuert - Nierenfunktion und
Flüssigkeitshaushalt sowie schließlich morphologische Anpassungen
(Gefäßwand, Muskelstärke..) betreffen. Sie beeinflussen das
Blutvolumen in Relation zur Aufnahmefähigkeit (Compliance) von Gefäßen
und Interstitium.
Im längerfristigen Zeitbereich (Stunden, Tage und länger)
wirkende Mechanismen, welche
- lokal, neural und humoral gesteuert - Nierenfunktion und
Flüssigkeitshaushalt sowie schließlich morphologische Anpassungen
(Gefäßwand, Muskelstärke..) betreffen. Sie beeinflussen das
Blutvolumen in Relation zur Aufnahmefähigkeit (Compliance) von Gefäßen
und Interstitium.  Kleines Molekül, große Ehren: 1998 erhielten Robert Furchgott, Louis Ignarro und Ferid Murad
"für ihre Arbeiten über die Rolle von Stickstoffmonoxid als Botenstoff
im Herz-Kreislauf-System" den Nobelpreis für Physiologie oder Medizin.
Murad wies nach, dass die Wirkung vieler gefäßerweiternder Medikamente
durch Guanylatzyklase vermittelt wird (Freisetzung von
Stickstoffmonoxid). Furchgott stellte unabhängig davon fest, dass
Blutgefäße selbst einen "endothelium-derived relaxing factor" bilden
können. Murad und Ignarro zeigten unabhängig voneinander, dass dieser
Faktor Stickstoffmonoxid ist. Murad's Arbeitsgruppe gelang es später
auch, die NO-Synthase zu isolieren.
Kleines Molekül, große Ehren: 1998 erhielten Robert Furchgott, Louis Ignarro und Ferid Murad
"für ihre Arbeiten über die Rolle von Stickstoffmonoxid als Botenstoff
im Herz-Kreislauf-System" den Nobelpreis für Physiologie oder Medizin.
Murad wies nach, dass die Wirkung vieler gefäßerweiternder Medikamente
durch Guanylatzyklase vermittelt wird (Freisetzung von
Stickstoffmonoxid). Furchgott stellte unabhängig davon fest, dass
Blutgefäße selbst einen "endothelium-derived relaxing factor" bilden
können. Murad und Ignarro zeigten unabhängig voneinander, dass dieser
Faktor Stickstoffmonoxid ist. Murad's Arbeitsgruppe gelang es später
auch, die NO-Synthase zu isolieren.| HZV = (pA - ZVD) / TPR |

 Abbildung: Mechanismen der Vasokonstriktion (VC) und Vasodilatation (VD)
Abbildung: Mechanismen der Vasokonstriktion (VC) und Vasodilatation (VD)
 Abbildung):
Abbildung): Neuronale Mechanismen, insbesondere durch sympathische Fasern
Neuronale Mechanismen, insbesondere durch sympathische Fasern Myogene
Mechanismen, d.h. die autonome Antwort auf (durch den transmuralen
Druck bedingte) Dehnung der Arterien- und Venenwände. Die Folge ist Autoregulation - insbesondere in Skelettmuskulatur, Myokard, Gehirn, Nieren
Myogene
Mechanismen, d.h. die autonome Antwort auf (durch den transmuralen
Druck bedingte) Dehnung der Arterien- und Venenwände. Die Folge ist Autoregulation - insbesondere in Skelettmuskulatur, Myokard, Gehirn, Nieren Metabolische
Mechanismen, welche das Ausmaß lokalen Stoffwechselbedarfs
signalisieren - wie Veränderung des pH-Wertes, der Blutgaswerte, der
extrazellulären [K+] usw.
Metabolische
Mechanismen, welche das Ausmaß lokalen Stoffwechselbedarfs
signalisieren - wie Veränderung des pH-Wertes, der Blutgaswerte, der
extrazellulären [K+] usw. Endotheliale Mechanismen, wie z.B. die Freisetzung von NO
(das die Gefäßwand relaxiert und der Anlagerung von Leukozyten
vorbeugt) in Reaktion auf das Einwirken von (strömungsabhängigen) Scherkräften.
Endotheliale Mechanismen, wie z.B. die Freisetzung von NO
(das die Gefäßwand relaxiert und der Anlagerung von Leukozyten
vorbeugt) in Reaktion auf das Einwirken von (strömungsabhängigen) Scherkräften.
 Der Lungenkreislauf weist Besonderheiten auf:
Der Lungenkreislauf weist Besonderheiten auf:  Seine Blutgefäße
haben einen niedrigen Ruhetonus, sie verhalten sich dehnungs- bzw.
druckpassiv.
Seine Blutgefäße
haben einen niedrigen Ruhetonus, sie verhalten sich dehnungs- bzw.
druckpassiv. Die Strömung ist wegen des geringen Fließwiderstandes der (besonders kurzen
und dünnwandigen) Arterien und Arteriolen hoch
(Herzminutenvolumen!).
Die Strömung ist wegen des geringen Fließwiderstandes der (besonders kurzen
und dünnwandigen) Arterien und Arteriolen hoch
(Herzminutenvolumen!).  Wegen der im Verhältnis zur
Gewebemasse enorm hohen Perfusion gibt es weder
metabolische noch Autoregulation, aber:
Wegen der im Verhältnis zur
Gewebemasse enorm hohen Perfusion gibt es weder
metabolische noch Autoregulation, aber: Bei
Sauerstoffmangel erfolgt hypoxische Vasokonstriktion (um Blut in
besser belüftete Lungenabschnitte umzuleiten).
Bei
Sauerstoffmangel erfolgt hypoxische Vasokonstriktion (um Blut in
besser belüftete Lungenabschnitte umzuleiten).  Sympathische Fasern haben kaum
Einfluss auf den Gefäßtonus.
Sympathische Fasern haben kaum
Einfluss auf den Gefäßtonus. 
 Abbildung: Blutversorgung der Luftwege und Alveolen
Abbildung: Blutversorgung der Luftwege und Alveolen
 Das
System der Bronchialarterien versorgt das Lungengewebe mit arteriellem
Blut. Zwischen Pulmonal- und Bronchialkreislauf gibt es geringgradige
Querverbindungen.
Das
System der Bronchialarterien versorgt das Lungengewebe mit arteriellem
Blut. Zwischen Pulmonal- und Bronchialkreislauf gibt es geringgradige
Querverbindungen. Das Blut aus dem rechten Herzen gelangt in die
Pulmonalarterien (Lungenschlagadern) und von hier in die
Alveolarkapillaren, wo der Gasaustausch stattfindet und das Hämoglobin auf ~97% mit Sauerstoff gesättigt wird. Durch diese Gefäße
fließt das gesamte Herzminutenvolumen.
Das Blut aus dem rechten Herzen gelangt in die
Pulmonalarterien (Lungenschlagadern) und von hier in die
Alveolarkapillaren, wo der Gasaustausch stattfindet und das Hämoglobin auf ~97% mit Sauerstoff gesättigt wird. Durch diese Gefäße
fließt das gesamte Herzminutenvolumen.  Faktoren, welche den pulmonalen Gefäßwiderstand beeinflussen  Nach Boron / Boulpaep, Concise Medical Physiology, Elsevier 2021 |
|
| Vasodilatatorisch |
Vasokonstriktorisch |
| ↑ alveolärer pO2 |
↓alveolärer pO2 |
| ↓alveolärer pCO2 | ↑ alveolärer pCO2 |
| ↑pH | ↓pH |
| H2-histaminerge Agonisten |
H1-histaminerge Agonisten |
| PGI2, PGE1 |
Thromboxan, PGF2, PGE2 |
| ß-adrenerge Agonisten |
α-adrenerge Agonisten |
| Bradykinin |
Serotonin |
| Acetylcholin |
Angiotensin II |
| NO |
|
 Abbildung).
Abbildung).
 Abbildung: Gefäßsystem der Lunge mit thorakalen Anastomosen und Kurzschlüssen
Abbildung: Gefäßsystem der Lunge mit thorakalen Anastomosen und Kurzschlüssen
Typische Druckwerte im Lungenkreislauf (Herzhöhe) Nach Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018 |
|||||
| a. pulmonalis (mm Hg) |
Kapillare |
v. pulmonalis |
|||
| systolisch |
diastolisch |
Mittelwert |
mm Hg |
mm Hg |
|
| Ruhe, liegend |
25 |
12 |
17 |
13 |
9 |
| Ruhe, aufrecht |
22 |
9 |
14 |
9 |
5 |
| Schwere Arbeit (aufrecht) |
40 |
24 |
30 |
18 |
6 |
| In der Pulmonalarterie herrscht ein mittlerer Druck von 12-16 mmHg (~2 kPa) Die Blutdruckamplitude beträgt 10-15 mmHg (diastolisch ~10, systolisch 20-25 mmHg) |
 Die Atemtiefe bestimmt den Strömungswiderstand im Lungenkreislauf (
Die Atemtiefe bestimmt den Strömungswiderstand im Lungenkreislauf ( Abbildung):
Abbildung):  Bei tiefer Ausatmung sind die Blutgefäße im Lungengewebe ("extraalveoläre"
Gefäße im Schnittpunkt mehrerer Alveolarsepten) nur gering aufgespannt
(kleiner Innenradius) und bieten einen relativ hohen
Strömungswiderstand (blaue Kurve).
Bei tiefer Ausatmung sind die Blutgefäße im Lungengewebe ("extraalveoläre"
Gefäße im Schnittpunkt mehrerer Alveolarsepten) nur gering aufgespannt
(kleiner Innenradius) und bieten einen relativ hohen
Strömungswiderstand (blaue Kurve).  Bei tiefer Einatmung andererseits
sind die Alveolarkapillaren abgeflacht und komprimiert und bieten nun ihrerseits einen hohen Strömungswiderstand (grüne Kurve).
Bei tiefer Einatmung andererseits
sind die Alveolarkapillaren abgeflacht und komprimiert und bieten nun ihrerseits einen hohen Strömungswiderstand (grüne Kurve). 
 Abbildung: Pulmonaler Gefäßwiderstand als Funktion des Lungenvolumens
Abbildung: Pulmonaler Gefäßwiderstand als Funktion des Lungenvolumens

 Abbildung: Pulmonale Vasokonstriktion infolge Hypoxie (hypoxic pulmonary vasoconstriction HPV)
Abbildung: Pulmonale Vasokonstriktion infolge Hypoxie (hypoxic pulmonary vasoconstriction HPV) 
 Abbildung):
Abbildung): Bei Anstieg des Drucks in den Pulmonalgefäßen reagieren diese dehnungspassiv
(nicht mit einem Bayliss-Effekt), was zur Folge hat, dass es zu
Erweiterung und vermehrter Blutaufnahme kommt. Dadurch sinkt der
Strömungswiderstand, die Perfusion steigt, wie in unten gelegenen
Lungenabschnitten bei aufrechter Körperlage (hydrostatische Druckschichtung im Gefäßsystem
Bei Anstieg des Drucks in den Pulmonalgefäßen reagieren diese dehnungspassiv
(nicht mit einem Bayliss-Effekt), was zur Folge hat, dass es zu
Erweiterung und vermehrter Blutaufnahme kommt. Dadurch sinkt der
Strömungswiderstand, die Perfusion steigt, wie in unten gelegenen
Lungenabschnitten bei aufrechter Körperlage (hydrostatische Druckschichtung im Gefäßsystem  s. dort). So werden gut
belüftete Lungenpartien auch gut durchblutet
(Venilations-Perfusions-Abgleich).
s. dort). So werden gut
belüftete Lungenpartien auch gut durchblutet
(Venilations-Perfusions-Abgleich).| Der pulmonale Gefäßwiderstand beträgt ~10% des systemischen (peripheren) Gefäßwiderstandes |
 Die glatte Muskulatur der Pulmonalgefäße reagiert jedoch aktiv auf niedrigen Sauerstoffpartialdruck (Hypoxie) mit Konstriktion: Man nennt dieses Phänomen hypoxic pulmonary vasoconstriction (HPV). Die Pulmonalarterien sind vom Typ P
- "P" für pulmonal -; ihr Verhalten ist deswegen sinnvoll, weil
schlecht belüftete Lungenabschnitte nur gering durchblutet werden (Euler-Liljestrand-Mechanismus
Die glatte Muskulatur der Pulmonalgefäße reagiert jedoch aktiv auf niedrigen Sauerstoffpartialdruck (Hypoxie) mit Konstriktion: Man nennt dieses Phänomen hypoxic pulmonary vasoconstriction (HPV). Die Pulmonalarterien sind vom Typ P
- "P" für pulmonal -; ihr Verhalten ist deswegen sinnvoll, weil
schlecht belüftete Lungenabschnitte nur gering durchblutet werden (Euler-Liljestrand-Mechanismus  ).
Dafür werden gut belüftete Lungenabschnitte (mit hohem [pO2]) stärker durchblutet. An anderen Stellen im Körper bewirkt Hypoxämie an Arteriolen Vasodilatation, um auf diese Weise die Perfusion zu steigern und mehr Sauerstoff an das
Gewebe zu bringen. Das Verhalten der pulmonalen Gefäße ist eine Besonderheit.
).
Dafür werden gut belüftete Lungenabschnitte (mit hohem [pO2]) stärker durchblutet. An anderen Stellen im Körper bewirkt Hypoxämie an Arteriolen Vasodilatation, um auf diese Weise die Perfusion zu steigern und mehr Sauerstoff an das
Gewebe zu bringen. Das Verhalten der pulmonalen Gefäße ist eine Besonderheit. Hypoxische pulmonale Vasokonstriktion wird als Euler-Liljestrand-Mechanismus bezeichnet. Kleine arterielle Gefäße in der Lunge kontrahieren bei alveolärer Hypoxie im betreffenden Lungenabschnitt.
Hypoxische pulmonale Vasokonstriktion wird als Euler-Liljestrand-Mechanismus bezeichnet. Kleine arterielle Gefäße in der Lunge kontrahieren bei alveolärer Hypoxie im betreffenden Lungenabschnitt. 
 Atemgasaustausch, Arterialisierung des Blutes
Atemgasaustausch, Arterialisierung des Blutes Füllungsreserve für den linken Ventrikel
Füllungsreserve für den linken Ventrikel Aktivierung / Abbau hormoneller Substanzen. Die Lungengefäße inaktivieren Acetylcholin, Noradrenalin, Serotonin, Bradykinin; sie aktivieren Angiotensin I (mittels ACE - Angiotensin II passiert die Lunge unverändert, so wie auch Adrenalin oder Vasopressin)
Aktivierung / Abbau hormoneller Substanzen. Die Lungengefäße inaktivieren Acetylcholin, Noradrenalin, Serotonin, Bradykinin; sie aktivieren Angiotensin I (mittels ACE - Angiotensin II passiert die Lunge unverändert, so wie auch Adrenalin oder Vasopressin) Synthese von NO, Heparinen, Surfactant
Synthese von NO, Heparinen, Surfactant Bildung, Speicherung und Freisetzung proinflammatorischer Stoffe
(Histamin, Endothelin, Eikosanoide, PAF, Adenosin)
Bildung, Speicherung und Freisetzung proinflammatorischer Stoffe
(Histamin, Endothelin, Eikosanoide, PAF, Adenosin)  evt. Filterung von Emboli im Pulmonalblut - Gerinnseln (Thromben),
Fett-Tröpfchen nach Knochenbrüchen (Fettemboli), Gasbläschen (Gasemboli). Emboli bleiben in der
Mikrozirkulation der Lunge stecken und werden anschließend resorbiert bzw. abgebaut.
evt. Filterung von Emboli im Pulmonalblut - Gerinnseln (Thromben),
Fett-Tröpfchen nach Knochenbrüchen (Fettemboli), Gasbläschen (Gasemboli). Emboli bleiben in der
Mikrozirkulation der Lunge stecken und werden anschließend resorbiert bzw. abgebaut. Die Perfusion des Herzmuskels - die Koronardurchblutung - beträgt in Ruhe 70-80 ml/100 g Myokardgewebe (4-5% des Herzzeitvolumens; das Herz einer mäßig trainierten erwachsenen Person wiegt ~300 Gramm). Der Sauerstoffbedarf des Myokards beträgt etwa 25 ml/min (ca. ein Zehntel des Gesamt-O2-Verbrauchs von ~250 ml/min) bei körperlicher Ruhe. Herzmuskelzellen enthalten ~3,4 g/l Myoglobin, das bei einem pO2 von 5 mmHg noch zur Hälfte oxygeniert ist und so einen kleinen Sauerstoffvorrat für die oxidative Phosphorylierung bereithält sowie die rasche Diffusion von Sauerstoff durch das Sarkoplasma begünstigt.
Die Perfusion des Herzmuskels - die Koronardurchblutung - beträgt in Ruhe 70-80 ml/100 g Myokardgewebe (4-5% des Herzzeitvolumens; das Herz einer mäßig trainierten erwachsenen Person wiegt ~300 Gramm). Der Sauerstoffbedarf des Myokards beträgt etwa 25 ml/min (ca. ein Zehntel des Gesamt-O2-Verbrauchs von ~250 ml/min) bei körperlicher Ruhe. Herzmuskelzellen enthalten ~3,4 g/l Myoglobin, das bei einem pO2 von 5 mmHg noch zur Hälfte oxygeniert ist und so einen kleinen Sauerstoffvorrat für die oxidative Phosphorylierung bereithält sowie die rasche Diffusion von Sauerstoff durch das Sarkoplasma begünstigt.| Die O2-Extraktionsrate des Myokards beträgt bereits bei körperlicher Ruhe 60-70% des arteriellen Angebots. Der pO2 im sinus coronarius liegt unter 40 mmHg |
| Der Sauerstoffverbrauch des Herzmuskels kann bei schwerer körperlicher Belastung auf das Vierfache des Ruhewertes ansteigen |
 Der Sauerstoffbedarf des Myokards steuert seine Durchblutung. Die Koronardurchblutung wird durch lokale metabolische Mechanismen reguliert: Adenosin, K+, H+ häufen sich mit zunehmender Muskelaktivität im Myokard an und bewirken Vasodilatation und bessere Blutversorgung; Abnahme von [ATP] und eine Ansammlung von AMP spielt wahrscheinlich ebenfalls eine Rolle. Auch endotheliale Wirkstoffe wie Prostazykline, NO wirken gefäßerweiternd.
Der Sauerstoffbedarf des Myokards steuert seine Durchblutung. Die Koronardurchblutung wird durch lokale metabolische Mechanismen reguliert: Adenosin, K+, H+ häufen sich mit zunehmender Muskelaktivität im Myokard an und bewirken Vasodilatation und bessere Blutversorgung; Abnahme von [ATP] und eine Ansammlung von AMP spielt wahrscheinlich ebenfalls eine Rolle. Auch endotheliale Wirkstoffe wie Prostazykline, NO wirken gefäßerweiternd.| Adenosin steigert die Myokarddurchblutung |
 Zwischen einem Perfusionsdruck (Aortendruck minus enddiastolischer
Ventrikeldruck) von 60 bis 180 mmHg wirken Mechanismen der Autoregulation;
dadurch wird die Durchblutung des Herzmuskels gegenüber
Blutdruckschwankungen stabilisiert. Bei 60 mmHg sind die Arteriolen
maximal dilatiert, weitere Drucksenkung führt zu entsprechend
verringerter Perfusion.
Zwischen einem Perfusionsdruck (Aortendruck minus enddiastolischer
Ventrikeldruck) von 60 bis 180 mmHg wirken Mechanismen der Autoregulation;
dadurch wird die Durchblutung des Herzmuskels gegenüber
Blutdruckschwankungen stabilisiert. Bei 60 mmHg sind die Arteriolen
maximal dilatiert, weitere Drucksenkung führt zu entsprechend
verringerter Perfusion.  Autonom-nervöse Einflüsse auf die Koronargefäße: Koronararterien sind dicht mit sympathischen Fasern versorgt, und Noradrenalin wirkt über α1-Adrenozeptoren auch an deren Arteriolen vasokonstriktorisch.
Autonom-nervöse Einflüsse auf die Koronargefäße: Koronararterien sind dicht mit sympathischen Fasern versorgt, und Noradrenalin wirkt über α1-Adrenozeptoren auch an deren Arteriolen vasokonstriktorisch.| Auch in der Wand von Koronargefäßen wirkt Noradrenalin durch Aktivierung von α1-Adrenozeptoren vasokonstriktorisch |
 s. dort). Man sagt, die Koronargefäße werden bei Belastung des Körpers druckpassiv gedehnt.
s. dort). Man sagt, die Koronargefäße werden bei Belastung des Körpers druckpassiv gedehnt.| Bei
körperlicher Belastung sinkt der Strömungswiderstand in den
Koronargefäßen. Die Durchblutung des Myokards nimmt im Ausmaß der
Steigerung der Herzleistung zu |
 Der linke Ventrikel komprimiert während der Systole seine eigenen Versorgungsgefäße, insbesondere die subendokardialen; die linksmyokardiale Perfusion konzentriert sich auf die Diastole,
wo der arterielle Druck über dem im Muskelgewebe liegt. Die Herzfrequenz
beeinflusst die Durchblutung des linken Ventrikels entsprechend dem
Zeitanteil, den die Systole in Anspruch nimmt. Bei Tachykardie sind die
Äste der a. coronaria sinistra insgesamt länger komprimiert, was die
Durchblutung erschwert. (Die Perfusion des rechten Ventrikels ist durch die Schlagfrequenz ziemlich unbeeinflusst.)
Der linke Ventrikel komprimiert während der Systole seine eigenen Versorgungsgefäße, insbesondere die subendokardialen; die linksmyokardiale Perfusion konzentriert sich auf die Diastole,
wo der arterielle Druck über dem im Muskelgewebe liegt. Die Herzfrequenz
beeinflusst die Durchblutung des linken Ventrikels entsprechend dem
Zeitanteil, den die Systole in Anspruch nimmt. Bei Tachykardie sind die
Äste der a. coronaria sinistra insgesamt länger komprimiert, was die
Durchblutung erschwert. (Die Perfusion des rechten Ventrikels ist durch die Schlagfrequenz ziemlich unbeeinflusst.) ß-Blocker senken die Herzfrequenz und erhöhen dadurch Diastolendauer und linksventrikuläre Perfusion.
ß-Blocker senken die Herzfrequenz und erhöhen dadurch Diastolendauer und linksventrikuläre Perfusion.  Das Gehirn hat etwa 2% der Masse des gesamten Körpers, beansprucht aber ~15% des Ruhe-Herzzeitvolumens. Gleichzeitig hat es von allen Geweben die geringste Ischämietoleranz: Vollständige
Unterbrechung der Gehirndurchblutung für nur einige Sekunden führt zu
Bewusstlosigkeit, für einige Minuten (bei Körpertemperatur) zu
bleibenden Schäden (bei Abkühlung des Kopfes erweitert sich diese
Zeitspanne). Außerdem ist das Gehirn für seinen Energiestoffwechsel
vollständig abhängig vom Blutzucker: Der Glucoseverbrauch beträgt etwa
100 Gramm pro Tag (der Glykogenvorrat der Leber beträgt maximal ~150 g).
Das Gehirn hat etwa 2% der Masse des gesamten Körpers, beansprucht aber ~15% des Ruhe-Herzzeitvolumens. Gleichzeitig hat es von allen Geweben die geringste Ischämietoleranz: Vollständige
Unterbrechung der Gehirndurchblutung für nur einige Sekunden führt zu
Bewusstlosigkeit, für einige Minuten (bei Körpertemperatur) zu
bleibenden Schäden (bei Abkühlung des Kopfes erweitert sich diese
Zeitspanne). Außerdem ist das Gehirn für seinen Energiestoffwechsel
vollständig abhängig vom Blutzucker: Der Glucoseverbrauch beträgt etwa
100 Gramm pro Tag (der Glykogenvorrat der Leber beträgt maximal ~150 g). 
 Abbildung: Gehirndurchblutung in Abhängigkeit von arteriellen O2- und CO2- Partialdrucken sowie arteriellem Blutdruck
Abbildung: Gehirndurchblutung in Abhängigkeit von arteriellen O2- und CO2- Partialdrucken sowie arteriellem Blutdruck Mit steigendem Kohlendioxidwert (normal ~40 mmHg) nimmt die Gehirndurchblutung zu
Mit steigendem Kohlendioxidwert (normal ~40 mmHg) nimmt die Gehirndurchblutung zu Sauerstoffpartialdruckwerte unter ~50 mmHg steigern die Gehirndurchblutung
Sauerstoffpartialdruckwerte unter ~50 mmHg steigern die Gehirndurchblutung  Zwischen ~50 und ~150 mmHg arteriellem Blutdruck bleibt die zerebrale Perfusion weitgehend konstant (Autoregulation)
Zwischen ~50 und ~150 mmHg arteriellem Blutdruck bleibt die zerebrale Perfusion weitgehend konstant (Autoregulation)

 Abbildung) ist insgesamt recht konstant (~55 ml/min/100g), regional aber unterschiedlich
(graue
Hirnsubstanz ist stoffwechselintensiver und daher stärker durchblutet
als weiße) und
je nach aktuellem Energieumsatz wechselnd (gesteigert bei hohem
Aktivitätslevel neuronaler Schaltkreise, stark erhöht bei epileptischen
Massenentladungen).
Abbildung) ist insgesamt recht konstant (~55 ml/min/100g), regional aber unterschiedlich
(graue
Hirnsubstanz ist stoffwechselintensiver und daher stärker durchblutet
als weiße) und
je nach aktuellem Energieumsatz wechselnd (gesteigert bei hohem
Aktivitätslevel neuronaler Schaltkreise, stark erhöht bei epileptischen
Massenentladungen). | 15% des Ruhe-Herzzeitvolumens beansprucht das Gehirn (zerebrale Perfusion) |
 Die Gesamtlänge sämtlicher Blutgefäße im Gehirn des Menschen entspricht ungefähr dem halben Abstand der Erde zum Mond.
Die Gesamtlänge sämtlicher Blutgefäße im Gehirn des Menschen entspricht ungefähr dem halben Abstand der Erde zum Mond. Neuronal: Die Versorgung der Gehirngefäße durch sympathische postganglionäre Fasern aus dem ggl. cervicale superius
erfolgt über a. carotis interna und aa. vertebrales, circulus
arteriosus Willisii und deren Gefäßäste; sie wirken
vasokonstriktorisch. Es gibt auch parasympathische Versorgung über den N. facialis, diese Fasern bewirken moderate Vasodilatation. Schließlich verfügen die Gehirngefäße über sensorische Fasern mit Zellkörpern in den Ganglien des N. trigeminus, die CGRP
freisetzen können (der auf molarer Basis am stärksten wirksame
Vasodilatator) und auf diese Weise gefäßerweiternd wirken (und Migraine
auslösen können).
Neuronal: Die Versorgung der Gehirngefäße durch sympathische postganglionäre Fasern aus dem ggl. cervicale superius
erfolgt über a. carotis interna und aa. vertebrales, circulus
arteriosus Willisii und deren Gefäßäste; sie wirken
vasokonstriktorisch. Es gibt auch parasympathische Versorgung über den N. facialis, diese Fasern bewirken moderate Vasodilatation. Schließlich verfügen die Gehirngefäße über sensorische Fasern mit Zellkörpern in den Ganglien des N. trigeminus, die CGRP
freisetzen können (der auf molarer Basis am stärksten wirksame
Vasodilatator) und auf diese Weise gefäßerweiternd wirken (und Migraine
auslösen können). Myogen: Die richtige Adjustierung der Gehirndurchblutung ist in erster Linie durch lokale Mechanismen gewährleistet; myogene Autoregulation durch den Bayliss-Effekt sorgt für weitgehend konstante Gesamtdurchblutung über einen Bereich etwa zwischen 50 und 150 mmHg arteriellem Druck (auf Kopfhöhe).
Myogen: Die richtige Adjustierung der Gehirndurchblutung ist in erster Linie durch lokale Mechanismen gewährleistet; myogene Autoregulation durch den Bayliss-Effekt sorgt für weitgehend konstante Gesamtdurchblutung über einen Bereich etwa zwischen 50 und 150 mmHg arteriellem Druck (auf Kopfhöhe).| Die Gehirndurchblutung unterliegt myogener Autoregulation - steigt der Druck in einer kleinen Arterie, kontrahiert ihre Wand |
 Metabolisch:
Durch den Abbau von ATP ensteht Adenosin, das gefäßerweiternd wirkt. Abnahme des pH und des pO2 wirken ebenfalls durchblutungssteigernd. Hyperkapnie (arterieller pCO2>45 mmHg) führt zu Erweiterung der Widerstandsgefäße und Durchblutungssteigerung im Gehirn; umgekehrt führt Hypokapnie (arterieller pCO2<35 mmHg) zu Vasokonstriktion und Absinken der zerebralen Perfusion (übertriebene
Atemtätigkeit kann zu CO2-Mangel und Bewusstlosigkeit führen).
Metabolisch:
Durch den Abbau von ATP ensteht Adenosin, das gefäßerweiternd wirkt. Abnahme des pH und des pO2 wirken ebenfalls durchblutungssteigernd. Hyperkapnie (arterieller pCO2>45 mmHg) führt zu Erweiterung der Widerstandsgefäße und Durchblutungssteigerung im Gehirn; umgekehrt führt Hypokapnie (arterieller pCO2<35 mmHg) zu Vasokonstriktion und Absinken der zerebralen Perfusion (übertriebene
Atemtätigkeit kann zu CO2-Mangel und Bewusstlosigkeit führen). | Hypokapnie (sinkender pCO2) oder hoher pO2 bewirken zerebrale Vasokonstriktion und senken die Gehirndurchblutung Intensive Hyperventilation kann zu Schwindel und Bewusstlosigkeit führen |
 Weiters nimmt der Gefäßwiderstand mit steigendem Liquordruck
zu, die Gehirndurchblutung ab: Der erhöhte intrakranielle Druck verengt die Gefäße. Das Gehirn reagiert mit systemischer Steigerung des Blutdrucks (Cushing-Reflex
Weiters nimmt der Gefäßwiderstand mit steigendem Liquordruck
zu, die Gehirndurchblutung ab: Der erhöhte intrakranielle Druck verengt die Gefäße. Das Gehirn reagiert mit systemischer Steigerung des Blutdrucks (Cushing-Reflex , Ischämiereflex, Cushing effect, C. response, C. phenomenon, C. reaction, C's Law). Vermutlich wird das Vasomotorenzentrum der medulla oblongata durch den erhöhten Hirndruck stimuliert.
, Ischämiereflex, Cushing effect, C. response, C. phenomenon, C. reaction, C's Law). Vermutlich wird das Vasomotorenzentrum der medulla oblongata durch den erhöhten Hirndruck stimuliert. Im Liegen ist die Hirndurchblutung höher als im Sitzen oder Stehen. Außerhalb des Autoregulationsbereichs ist der Effekt des Lagewechsels auf die Hirndurchblutung intensiver: So kann es bei starker Hypotonie beim Aufstehen zu orthostatisch bedingter Synkope kommen.
Im Liegen ist die Hirndurchblutung höher als im Sitzen oder Stehen. Außerhalb des Autoregulationsbereichs ist der Effekt des Lagewechsels auf die Hirndurchblutung intensiver: So kann es bei starker Hypotonie beim Aufstehen zu orthostatisch bedingter Synkope kommen. Die Nieren
erhalten pro Minute etwa einen Liter Blut (20% des Ruhe-HZV). Beide
Nieren wiegen etwa 300 g, ihre spezifische Durchblutung beträgt damit
ca. 330 ml/min/100g, einer der höchsten Werte im Organismus (hohe
funktionelle Perfusion).
Die Nieren
erhalten pro Minute etwa einen Liter Blut (20% des Ruhe-HZV). Beide
Nieren wiegen etwa 300 g, ihre spezifische Durchblutung beträgt damit
ca. 330 ml/min/100g, einer der höchsten Werte im Organismus (hohe
funktionelle Perfusion).| Die Nieren beanspruchen etwa 20% des Ruhe-Herzzeitvolumens bei Indifferenztemperatur Innere Blutungen aus renalen Arterien können leicht unbemerkt bleiben und rasch zu lebensbedrohlichem Kreislaufschock führen |
 Zur Struktur der Nierengefäße s. dort
Zur Struktur der Nierengefäße s. dort Über die Steuerung der Nierendurchblutung s. dort
Über die Steuerung der Nierendurchblutung s. dort Über die Messung der Nierendurchblutung (renale Perfusion) s. dort
Über die Messung der Nierendurchblutung (renale Perfusion) s. dort Zur Steuerung der Muskeldurchblutung s. auch dort
Zur Steuerung der Muskeldurchblutung s. auch dort Der Sauerstoffbedarf des Organismus ist im Wesentlichen von der Muskelaktivität
bestimmt: Er beträgt bei einer erwachsenen Person im Ruhezustand etwa
0,3 l/min. Mit zunehmender physischer Belastung nimmt der
Sauerstoffbedarf zu; steigt er um 1 l/min, erhöht sich das
Herzzeitvolumen um ~6 l/min, also etwa um den Betrag des Ruhe-Herzzeitvolumens.
Der Sauerstoffbedarf des Organismus ist im Wesentlichen von der Muskelaktivität
bestimmt: Er beträgt bei einer erwachsenen Person im Ruhezustand etwa
0,3 l/min. Mit zunehmender physischer Belastung nimmt der
Sauerstoffbedarf zu; steigt er um 1 l/min, erhöht sich das
Herzzeitvolumen um ~6 l/min, also etwa um den Betrag des Ruhe-Herzzeitvolumens. 
 Abbildung:
Aufteilung des Herzminutenvolumens bei Ruhe und maximaler Ausbelastung
- bei untrainierten und maximal trainierten Personen
Abbildung:
Aufteilung des Herzminutenvolumens bei Ruhe und maximaler Ausbelastung
- bei untrainierten und maximal trainierten Personen
| Die Vasokonstriktion von Haut- und Splanchnicusgefäßen erfolgt über α1-Rezeptoren |
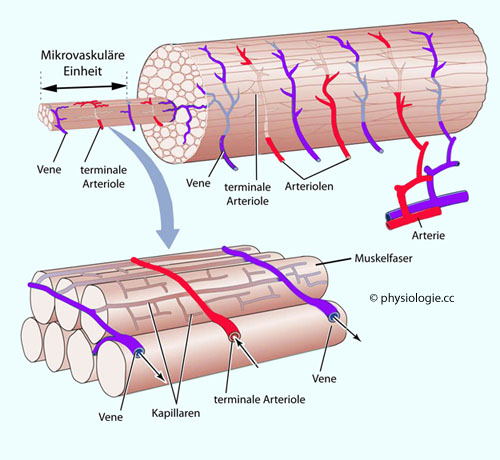
 Abbildung: Mikrovaskuläre Einheit
Abbildung: Mikrovaskuläre Einheit
 Abbildung). Mikrovaskuläre Einheiten im Skelettmuskel sind höchstens einen Millimeter lang und liegen jeweils zwischen zwei Venenästen.
Abbildung). Mikrovaskuläre Einheiten im Skelettmuskel sind höchstens einen Millimeter lang und liegen jeweils zwischen zwei Venenästen.| Bei der Skelettmuskulatur ist das Verhältnis von maximal möglicher zu Ruhedurchblutung am höchsten (vgl. dort) Maximal belastete Muskeln verbrauchen ~20-mal mehr Sauerstoff als unbelastete |
 Abbildung oben); hochtrainierte Sportler
kommen auf wesentlich höhere Maximalbeträge, und ihr Sauerstoffkonsum
kann dementsprechend auf mehr als das Zwanzigfache des Ruhewertes
ansteigen.
Abbildung oben); hochtrainierte Sportler
kommen auf wesentlich höhere Maximalbeträge, und ihr Sauerstoffkonsum
kann dementsprechend auf mehr als das Zwanzigfache des Ruhewertes
ansteigen.| Steigt die Sauerstoffaufnahme um 1 l/min, bewirkt das eine eine Steigerung des Herzzeitvolumens um ~6 l/min. |
| Bei Sauerstoffmangel (plötzliche Mehrdurchblutung, Ischämie bei Stenose) kann das Muskelgewebe die Sauerstoffausschöpfung aus dem Blut bis auf ~90% steigern |
 Sympathische Kontrolle:
Die Arteriolen in der ruhenden Muskulatur (40-45% des Körpergewichts - der größte "Verbraucher" im Kreislauf)
stehen unter starkem Einfluss des sympathischen Tonus. Dieser ist im Ruhezustand niedrig, fällt er aber
weg (experimentell), nimmt die Durchblutung (ohne Muskelarbeit!) auf das Doppelte zu (Ausfall der Noradrenalinwirkung an α-Rezeptoren → arterioläre Vasodilatation).
Sympathische Kontrolle:
Die Arteriolen in der ruhenden Muskulatur (40-45% des Körpergewichts - der größte "Verbraucher" im Kreislauf)
stehen unter starkem Einfluss des sympathischen Tonus. Dieser ist im Ruhezustand niedrig, fällt er aber
weg (experimentell), nimmt die Durchblutung (ohne Muskelarbeit!) auf das Doppelte zu (Ausfall der Noradrenalinwirkung an α-Rezeptoren → arterioläre Vasodilatation). | Die Sauerstoffsättigung des gemischt-venösen Blutes sinkt bei körperlicher Belastung, die arteriovenöse Sauerstoffdifferenz (AVDO2) nimmt zu Die AVDO2 ist auch nach Belastung über der Dauerleistungsgrenze einige Minuten lang erhöht (Abdecken der "Sauerstoffschuld") |
 Muskelarbeit: Das Herzzeitvolumen steigt bei Ausbelastung und mäßigem Trainingszustand bis zum 4-5fachen des Ruhewertes an,
vorwiegend durch Steigerung der Herzfrequenz (die Kreislaufantwort auf beginnende Muskelbelastung wird von der hinteren Insel koordiniert). Die Muskelpumpe
gewährleistet effizienten Rückstrom zum Herzen; die Durchblutung von
Nieren und Gastrointestinalsystem wird gedrosselt (und, wenn möglich,
auch die der Haut).
Muskelarbeit: Das Herzzeitvolumen steigt bei Ausbelastung und mäßigem Trainingszustand bis zum 4-5fachen des Ruhewertes an,
vorwiegend durch Steigerung der Herzfrequenz (die Kreislaufantwort auf beginnende Muskelbelastung wird von der hinteren Insel koordiniert). Die Muskelpumpe
gewährleistet effizienten Rückstrom zum Herzen; die Durchblutung von
Nieren und Gastrointestinalsystem wird gedrosselt (und, wenn möglich,
auch die der Haut).| Das Herzzeitvolumen steigt bei körperlicher Belastung vor allem durch Steigerung der Herzfrequenz, das Schlagvolumen nimmt nur geringgradig zu |
 Abbildung oben).
Abbildung oben).| Bei Erreichen der Dauerleistungsgrenze verbraucht aktive Muskulatur ~20-mal mehr Sauerstoff als im Ruhezustand |
 Über die Muskeldurchblutung im Zusammenhang mit dem Herzminutenvolumen s. dort
Über die Muskeldurchblutung im Zusammenhang mit dem Herzminutenvolumen s. dort Über die Steuerung des Kreislaufs bei körperlicher Belastung s. dort
Über die Steuerung des Kreislaufs bei körperlicher Belastung s. dort Über Muskelarbeit und venösen Rückstrom ("Muskelpumpe") s. dort
Über Muskelarbeit und venösen Rückstrom ("Muskelpumpe") s. dort Über die Steuerung der Atmung bei körperlicher Belastung s. dort
Über die Steuerung der Atmung bei körperlicher Belastung s. dort Die Haut (Gewicht 2-3 kg, Dicke 1-2 mm, Oberfläche 1,6-2,0 m2 - Werte für erwachsene Personen) hat bei Thermoneutralität (~27°C) eine spezifische Durchblutung von 10-20 ml/min/100g (Mindestwert ~1,
Maximalwert 150-200 ml/min/100g). Die 0,1 mm dicke Epidermis hat keine
Gefäße, sie wird über Diffusion mit Sauerstoff versorgt.
Die Haut (Gewicht 2-3 kg, Dicke 1-2 mm, Oberfläche 1,6-2,0 m2 - Werte für erwachsene Personen) hat bei Thermoneutralität (~27°C) eine spezifische Durchblutung von 10-20 ml/min/100g (Mindestwert ~1,
Maximalwert 150-200 ml/min/100g). Die 0,1 mm dicke Epidermis hat keine
Gefäße, sie wird über Diffusion mit Sauerstoff versorgt.| Die Hautdurchblutung kann sich bei Hitzeeinfluss auf den Betrag des Ruhe-Herzzeitvolumens erhöhen (dabei verdoppelt sich das Herzzeitvolumen) |
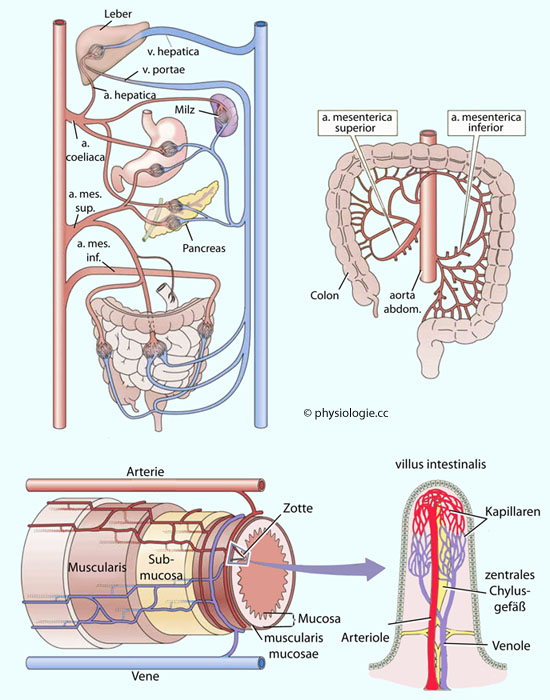
 Abbildung: Gefäßversorgung des intestinalen Systems
Abbildung: Gefäßversorgung des intestinalen Systems
| Der Gastrointestinaltrakt (inklusive Leber) beansprucht etwa 30% (24-35) des Ruhe-Herzzeitvolumens bei Indifferenztemperatur |
| Bei körperlicher Belastung steigt der Sympathikustonus und verengt über adrenerge (α1-) Rezeptoren Arteriolen im Splanchnicusgebiet und der Haut |

 Abbildung: Zeitverlauf hämodynamischer Änderungen nach Einnahme einer Mahlzeit
Abbildung: Zeitverlauf hämodynamischer Änderungen nach Einnahme einer Mahlzeit Die Regulationsbreite der gastrointestinalen Perfusion ist sehr hoch:
Die Regulationsbreite der gastrointestinalen Perfusion ist sehr hoch:
 Die spezifische Perfusion des Darms beträgt im Nüchternzustand etwa 30 ml/100g/min. Postprandiale Vasodilatation bewirkt eine erhebliche Perfusionssteigerung (vgl. dazu spezifisch-dynamische Wirkung): Eine umfangreiche Mahlzeit kann die Durchblutung je nach Umfang und Zusammensetzung der aufgenommenen Nahrung auf bis zu ~250 ml/100g/min steigern - das entspricht einer Erhöhung bis auf das Achtfache (in der
Die spezifische Perfusion des Darms beträgt im Nüchternzustand etwa 30 ml/100g/min. Postprandiale Vasodilatation bewirkt eine erhebliche Perfusionssteigerung (vgl. dazu spezifisch-dynamische Wirkung): Eine umfangreiche Mahlzeit kann die Durchblutung je nach Umfang und Zusammensetzung der aufgenommenen Nahrung auf bis zu ~250 ml/100g/min steigern - das entspricht einer Erhöhung bis auf das Achtfache (in der  Abbildung auf das 2-3fache).
Abbildung auf das 2-3fache).  Im Rahmen der "zephalen Phase" der Verdauung erfolgt die entsprechende Vasodilatation antizipatorisch (bevor überhaupt Nahrung in das Intestinum gelangt).
Im Rahmen der "zephalen Phase" der Verdauung erfolgt die entsprechende Vasodilatation antizipatorisch (bevor überhaupt Nahrung in das Intestinum gelangt).  Die Resorptionsaktivität der Schleimhaut führt zur Freisetzung von Vasodilatantien wie Adenosin und CO2
(der Parasympathikus wirkt indirekt durchblutungsfördernd, indem er
Transport und Sekretion - und damit die Resorption - anregt)
Die Resorptionsaktivität der Schleimhaut führt zur Freisetzung von Vasodilatantien wie Adenosin und CO2
(der Parasympathikus wirkt indirekt durchblutungsfördernd, indem er
Transport und Sekretion - und damit die Resorption - anregt) Die Resorption erhöht die Osmolalität in den Gefäßen der Darmzotten, dies alleine wirkt schon perfusionssteigernd.
Die Resorption erhöht die Osmolalität in den Gefäßen der Darmzotten, dies alleine wirkt schon perfusionssteigernd.  Einige Verdauungshormone (CCK) sowie Kinine wirken lokal vasodilatatorisch.
Einige Verdauungshormone (CCK) sowie Kinine wirken lokal vasodilatatorisch. Gallensäuren und partiell verdaute Fette steigern ebenfalls die Durchblutung.
Gallensäuren und partiell verdaute Fette steigern ebenfalls die Durchblutung. Vasokonstriktion und Ischämie: Umgekehrt kann erhöhter Sympathikustonus (Stress, Muskelarbeit) die Durchblutung des Darms von ~30 auf etwa 10 ml/100g/min - im Extremfall sogar bis auf ein Fünftel
des Ausgangswertes - reduzieren. Die Vasokonstriktion ist α-adrenerg
bedingt und erstreckt sich auf die Muscularis wie die Mucosa
gleichermaßen (keine Umverteilung von Blut zwischen diesen beiden
Schichten).
Vasokonstriktion und Ischämie: Umgekehrt kann erhöhter Sympathikustonus (Stress, Muskelarbeit) die Durchblutung des Darms von ~30 auf etwa 10 ml/100g/min - im Extremfall sogar bis auf ein Fünftel
des Ausgangswertes - reduzieren. Die Vasokonstriktion ist α-adrenerg
bedingt und erstreckt sich auf die Muscularis wie die Mucosa
gleichermaßen (keine Umverteilung von Blut zwischen diesen beiden
Schichten).  Abbildung): Gewebe, die schwächer durchblutet werden als dies ihrem Stoffwechselbedarf entspricht, reagieren mit Erweiterung ihrer Widerstandsgefäße
und erleichtern dadurch ihre Perfusion. Zeitlich gesehen bedeutet dies,
dass auf eine Minderperfusion eine entsprechende Korrektur
(Perfusionssteigerung) folgt. Da diese Hyperämie als Reaktion auf eine Störung (mangelnde Perfusion) erfolgt, spricht man von reaktiver Hyperämie.
Abbildung): Gewebe, die schwächer durchblutet werden als dies ihrem Stoffwechselbedarf entspricht, reagieren mit Erweiterung ihrer Widerstandsgefäße
und erleichtern dadurch ihre Perfusion. Zeitlich gesehen bedeutet dies,
dass auf eine Minderperfusion eine entsprechende Korrektur
(Perfusionssteigerung) folgt. Da diese Hyperämie als Reaktion auf eine Störung (mangelnde Perfusion) erfolgt, spricht man von reaktiver Hyperämie. 
 Abbildung: Reaktive Hyperämie
Abbildung: Reaktive Hyperämie
 Abbildung).
Abbildung).

 Die Sofortreaktion erfolgt in Sekundenschnelle. Ihr Ziel ist die Stabilisierung der Perfusion lebenswichiger Organe.
Druckrezeptoren (venös und arteriell) regen eine sympathische Reaktion
an: Das Herz schlagt rascher und kräftiger (Tachykardie, positive
Inotropie), die Widerstandsgefäße kontrahieren (zunächst generell,
Autoregulation stellt aber rasch die Perfusion von Hirn, Herz und
Nieren sicher, während Haut, Darm und Muskeln hypoperfundiert werden),
und die Kapazitätsgefäße (Venen) kontrahieren, was den venösen
Rückstrom unterstützt.
Die Sofortreaktion erfolgt in Sekundenschnelle. Ihr Ziel ist die Stabilisierung der Perfusion lebenswichiger Organe.
Druckrezeptoren (venös und arteriell) regen eine sympathische Reaktion
an: Das Herz schlagt rascher und kräftiger (Tachykardie, positive
Inotropie), die Widerstandsgefäße kontrahieren (zunächst generell,
Autoregulation stellt aber rasch die Perfusion von Hirn, Herz und
Nieren sicher, während Haut, Darm und Muskeln hypoperfundiert werden),
und die Kapazitätsgefäße (Venen) kontrahieren, was den venösen
Rückstrom unterstützt.  Die frühe Antwort erfolgt Minuten bis Stunden nach dem Blutverlust. Ihr Ziel ist die interne Restitution des Blutvolumens.
Dies erfolgt durch kapilläre Resorption (Autotransfusion - bis zu 500
ml in 30 Minuten), Steigerung des Blutzuckerspiegels (sympathisch
angeregte hepatische Glykogenolyse und Glukoneogenese mit
entsprechendem osmotischem Effekt), Konservierung von Salz und Wasser
(aktiviertes Reninsystem, inhibierte natriuretische Peptide,
Vasopressinfreisetzung, Cortisolsekretion).
Die frühe Antwort erfolgt Minuten bis Stunden nach dem Blutverlust. Ihr Ziel ist die interne Restitution des Blutvolumens.
Dies erfolgt durch kapilläre Resorption (Autotransfusion - bis zu 500
ml in 30 Minuten), Steigerung des Blutzuckerspiegels (sympathisch
angeregte hepatische Glykogenolyse und Glukoneogenese mit
entsprechendem osmotischem Effekt), Konservierung von Salz und Wasser
(aktiviertes Reninsystem, inhibierte natriuretische Peptide,
Vasopressinfreisetzung, Cortisolsekretion). Im Rahmen der späten Reaktion - weitere Restitution des Blutvolumens - steigt das Plasmavolumen in den folgenden zwei Tagen durch vermehrte Aufnahme von Wasser und Elektrolyten. Innerhalb von 4-6 Tagen wird verlorengegangenes Albumin von der Leber nachgebildet. Die Hämoglobinkonzentration normalisiert sich im Zuge einige Wochen gesteigerter Hämatopoese (vorausgesetzt, es ist genügend Eisen verfügbar).
Im Rahmen der späten Reaktion - weitere Restitution des Blutvolumens - steigt das Plasmavolumen in den folgenden zwei Tagen durch vermehrte Aufnahme von Wasser und Elektrolyten. Innerhalb von 4-6 Tagen wird verlorengegangenes Albumin von der Leber nachgebildet. Die Hämoglobinkonzentration normalisiert sich im Zuge einige Wochen gesteigerter Hämatopoese (vorausgesetzt, es ist genügend Eisen verfügbar). Bei den meisten
Schockformen ist das Herzminutenvolumen herabgesetzt, entweder
weil das Herz selbst geschädigt ist (kardiogener Schock), oder weil
zu wenig Blut aus der Kreislaufperipherie zuströmt.
Bei den meisten
Schockformen ist das Herzminutenvolumen herabgesetzt, entweder
weil das Herz selbst geschädigt ist (kardiogener Schock), oder weil
zu wenig Blut aus der Kreislaufperipherie zuströmt. | Im Schockzustand wird reflektorisch der periphere Widerstand erhöht - die Durchblutung der Haut (Blässe) und des Splanchnicusgebietes ist reduziert |
 Volumenverlustschock:
Blutverlust (Unfall; Blutung nach außen oder nach
innen) führt zu ungenügendem Rückstrom zum Herzen und herabgesetztem
Herzzeitvolumen. Volumenverlustschock behandelt man durch Auffüllen des
fehlenden
Volumens. Man verwendet u.a. Plasmaersatzstoffe, Infusionslösungen mit
kolloidosmotischer Wirkung: Sie bleiben im Kreislauf und “saugen”
interstitielle Flüssigkeit an.
Volumenverlustschock:
Blutverlust (Unfall; Blutung nach außen oder nach
innen) führt zu ungenügendem Rückstrom zum Herzen und herabgesetztem
Herzzeitvolumen. Volumenverlustschock behandelt man durch Auffüllen des
fehlenden
Volumens. Man verwendet u.a. Plasmaersatzstoffe, Infusionslösungen mit
kolloidosmotischer Wirkung: Sie bleiben im Kreislauf und “saugen”
interstitielle Flüssigkeit an. Kardiogener
Schock: Schädigung des Herzens (meistens Herzinfarkt) bedingt
ungenügendes Herzzeitvolumen. Kardiogenen Schock behandelt man
durch Entlastung und Stärkung der Herzfunktion, notfalls
Herzmassage, Kardioversion (Defibrillation).
Kardiogener
Schock: Schädigung des Herzens (meistens Herzinfarkt) bedingt
ungenügendes Herzzeitvolumen. Kardiogenen Schock behandelt man
durch Entlastung und Stärkung der Herzfunktion, notfalls
Herzmassage, Kardioversion (Defibrillation). Schock durch
Fehlregulation des Gefäßtonus (z.B. infolge einer Verletzung von Hirnstamm oder Rückenmark: neurogener Schock) mit niedrigem peripherem Widerstand ("Fehlverteilungsschock", “Widerstandsverlustschock”)
geht mit funktionell ungünstiger Verteilung des Blutvolumens
(peripheres Pooling), Blutdruckabfall und Absinken des Herzzeitvolumens
einher.
Fehlverteilungsschock kann durch kreislaufwirksame Mittel und (auch)
horizontale Lagerung behandelt werden.
Schock durch
Fehlregulation des Gefäßtonus (z.B. infolge einer Verletzung von Hirnstamm oder Rückenmark: neurogener Schock) mit niedrigem peripherem Widerstand ("Fehlverteilungsschock", “Widerstandsverlustschock”)
geht mit funktionell ungünstiger Verteilung des Blutvolumens
(peripheres Pooling), Blutdruckabfall und Absinken des Herzzeitvolumens
einher.
Fehlverteilungsschock kann durch kreislaufwirksame Mittel und (auch)
horizontale Lagerung behandelt werden.
 Das Herzzeitvolumen (HZV) beträgt bei körperlicher Ruhe und Indifferenztemperatur
~3 l/min/m2 Hautoberfläche (cardiac index) und wird
auf die Körpergebiete bedarfsgemäß aufgeteilt. Der periphere
Widerstand wird so eingestellt, dass einerseits die Durchblutung ausreichend
ist, andererseits der arterielle Blutdruck stabil bleibt. Die größte
Blutmenge (>80%) enthält das Niederdrucksystem, besonders
speicherfähig sind die Venen der Bauchorgane (N. splanchnicus) und die
Venengeflechte der Haut (Thermoregulation). Unter Basisbedingungen
erhalten das Verdauungssystem ~30%, die Nieren ~20%, das ZNS ~15%, die Skelettmuskulatur ~15%, das Fettgewebe ~10%, das Myokard ~5% und andere Gewebe ~5% des HZV.
Diese Verteilung ist veränderbar, insbesondere bei körperlicher Arbeit.
Im Schockzustand steigt der periphere Widerstand, die Durchblutung der
Haut (Blässe) und des Splanchnicusgebietes (Verdauungssystem) ist
erniedrigt, beide Gebiete entspeichern ihre Venen Das Herzzeitvolumen (HZV) beträgt bei körperlicher Ruhe und Indifferenztemperatur
~3 l/min/m2 Hautoberfläche (cardiac index) und wird
auf die Körpergebiete bedarfsgemäß aufgeteilt. Der periphere
Widerstand wird so eingestellt, dass einerseits die Durchblutung ausreichend
ist, andererseits der arterielle Blutdruck stabil bleibt. Die größte
Blutmenge (>80%) enthält das Niederdrucksystem, besonders
speicherfähig sind die Venen der Bauchorgane (N. splanchnicus) und die
Venengeflechte der Haut (Thermoregulation). Unter Basisbedingungen
erhalten das Verdauungssystem ~30%, die Nieren ~20%, das ZNS ~15%, die Skelettmuskulatur ~15%, das Fettgewebe ~10%, das Myokard ~5% und andere Gewebe ~5% des HZV.
Diese Verteilung ist veränderbar, insbesondere bei körperlicher Arbeit.
Im Schockzustand steigt der periphere Widerstand, die Durchblutung der
Haut (Blässe) und des Splanchnicusgebietes (Verdauungssystem) ist
erniedrigt, beide Gebiete entspeichern ihre Venen Die Sauerstoffextraktion (arterio-venöse Sauerstoffdifferenz AVDO2) gibt an, wieviel der mit dem Blut angebotenen O2-Menge ein Gewebe ausschöpft (arteriell angeboten minus venös abtransportiert). Die O2-Ausschöpfung liegt zwischen wenigen % (gut durchblutete Haut, Niere) bis >90% (hochaktive
Muskeln) der arteriell angebotenen Menge. Die hohe (~75%) O2-Sättigung
des gemischt-venösen Blutes bei Körperruhe bedeutet eine funktionelle
Reserve für körperliche Belastung. 100 ml Blut können ~20 ml O2 transportieren (Hämoglobingehalt 15 g/100 ml, Hüfner'sche Zahl 1,34 ml O2/g Hb). Aus Durchblutung und [AVDO2] errechnet sich der O2-Verbrauch Die Sauerstoffextraktion (arterio-venöse Sauerstoffdifferenz AVDO2) gibt an, wieviel der mit dem Blut angebotenen O2-Menge ein Gewebe ausschöpft (arteriell angeboten minus venös abtransportiert). Die O2-Ausschöpfung liegt zwischen wenigen % (gut durchblutete Haut, Niere) bis >90% (hochaktive
Muskeln) der arteriell angebotenen Menge. Die hohe (~75%) O2-Sättigung
des gemischt-venösen Blutes bei Körperruhe bedeutet eine funktionelle
Reserve für körperliche Belastung. 100 ml Blut können ~20 ml O2 transportieren (Hämoglobingehalt 15 g/100 ml, Hüfner'sche Zahl 1,34 ml O2/g Hb). Aus Durchblutung und [AVDO2] errechnet sich der O2-Verbrauch Die Perfusion der Gewebe hängt von ihrem metabolischem Aufwand ab. Die spezifische Durchblutung
(ml/min/100g Gewebe) ist im angeregten / aktiven
Zustand am höchsten in Speicheldrüsen und der Nierenrinde
(Salztransport), gefolgt vom Myokard (die
spezifische Durchblutung des Myokards ist generell höher als die des
Skelettmuskels) und
Verdauungssystem (postprandial). Starke Erhöhungen finden sich auch in Haut und
Skelettmuskel. Die höchste spezifische
Durchblutung im Basiszustand haben Nieren, Myokard und Gehirn Die Perfusion der Gewebe hängt von ihrem metabolischem Aufwand ab. Die spezifische Durchblutung
(ml/min/100g Gewebe) ist im angeregten / aktiven
Zustand am höchsten in Speicheldrüsen und der Nierenrinde
(Salztransport), gefolgt vom Myokard (die
spezifische Durchblutung des Myokards ist generell höher als die des
Skelettmuskels) und
Verdauungssystem (postprandial). Starke Erhöhungen finden sich auch in Haut und
Skelettmuskel. Die höchste spezifische
Durchblutung im Basiszustand haben Nieren, Myokard und Gehirn Blutgefäße haben einen aktiven Gefäßtonus, bedingt durch myogene (lokale vasoaktive Substanzen, Ca++)
und neurogene (sympathisch-adrenerge) Faktoren. Resultat ist ein
bestimmter Gefäßquerschnitt und damit Strömungswiderstand
(Leitfähigkeit nimmt mit der 4. Potenz des Innenradius zu). Vasodilatation steigert, Vasokonstriktion senkt die Perfusion. Vasodilatation kann erfolgen durch Purine, pCO2-Anstieg, pO2-Abfall, pH-Senkung (metabolisch); Prostazyklin, NO (endothelial); Kinine, Histamin (humoral); ß-adrenerg (nerval). Vasokonstriktion erfolgt durch Endotheline (endothelial), Vasopressin, Angiotensin u.a. (humoral), α-adrenerg (nerval), Gefäßwanddehnung (myogen - Bayliss-Effekt). Der
Kontraktionsgrad größerer arterieller Gefäße unterliegt dem
sympathischen Tonus, der von Arteriolen weitgehend myogenen Mechanismen. Im Sekundenbereich wirken Autoregulation (Aktivierung mechanosensitiver Ionenkanäle),
Stickstoffmonoxid (bei gesteigerter Schubspannung am Endothel
freigesetzt) und andere lokale Mechanismen; weiters der
Barorezeptorreflex (Druckstabilisierung) und kardio-pulmonale Reflexe
(Volumensteuerung). Im Minutenbereich wirken Katecholamine, Aldosteron, Vasopressin. Längerfristig wirken Umstellungen des
Flüssigkeitshaushalts sowie morphologische Anpassungen (Gefäßwände:
Compliance) Blutgefäße haben einen aktiven Gefäßtonus, bedingt durch myogene (lokale vasoaktive Substanzen, Ca++)
und neurogene (sympathisch-adrenerge) Faktoren. Resultat ist ein
bestimmter Gefäßquerschnitt und damit Strömungswiderstand
(Leitfähigkeit nimmt mit der 4. Potenz des Innenradius zu). Vasodilatation steigert, Vasokonstriktion senkt die Perfusion. Vasodilatation kann erfolgen durch Purine, pCO2-Anstieg, pO2-Abfall, pH-Senkung (metabolisch); Prostazyklin, NO (endothelial); Kinine, Histamin (humoral); ß-adrenerg (nerval). Vasokonstriktion erfolgt durch Endotheline (endothelial), Vasopressin, Angiotensin u.a. (humoral), α-adrenerg (nerval), Gefäßwanddehnung (myogen - Bayliss-Effekt). Der
Kontraktionsgrad größerer arterieller Gefäße unterliegt dem
sympathischen Tonus, der von Arteriolen weitgehend myogenen Mechanismen. Im Sekundenbereich wirken Autoregulation (Aktivierung mechanosensitiver Ionenkanäle),
Stickstoffmonoxid (bei gesteigerter Schubspannung am Endothel
freigesetzt) und andere lokale Mechanismen; weiters der
Barorezeptorreflex (Druckstabilisierung) und kardio-pulmonale Reflexe
(Volumensteuerung). Im Minutenbereich wirken Katecholamine, Aldosteron, Vasopressin. Längerfristig wirken Umstellungen des
Flüssigkeitshaushalts sowie morphologische Anpassungen (Gefäßwände:
Compliance) Der Pulmonalkreislauf (alveolärkapilläre Passagezeit ~0,3-1 s) liefert eine Füllungsreserve für den linken Ventrikel (~600 ml, atmungsabhängig), bearbeitet Hormone und filtert Thromben (allenfalls Fett- und Gasemboli). Seine dünnwandigen Gefäße haben einen niedrigen Ruhetonus (kaum sympathischer Einfluss) und sind dehnungspassiv. Bei Sauerstoffmangel kontrahieren sie (K+-Ausstrom↓→ Depolarisierung → Ca++-Einstrom), um das Blut in besser belüftete Regionen umzuleiten. ~100 m2 Endothel aktivieren Angiotensin über ACE, inaktivieren Serotonin und Eikosanoide. Prä- und postkapillärer Widerstand sind gleich groß, der Kapillardruck liegt in der Mitte zwischen dem arteriellen (~2 kPa) und venösen. Das
Interstitium ist eiweißreich (hoher extravasaler kolloidosmotischer
Druck), der Filtrationsdruck bleibt positiv und die Alveolaroberfläche
feucht. Flüssigkeit sammelt sich aber nicht in der Alveole an: Alveolarepithel resorbiert Natrium, Wasser folgt nach. Gut belüftete Lungenpartien sind gut durchblutet (Euler-Liljestrand- Mechanismus: Venilations-Perfusions- Abgleich). Luftröhre, Bronchien, pleura visceralis und Teile des Ösophagus haben mit dem Bronchialkreislauf eine eigene Blutversorgung Der Pulmonalkreislauf (alveolärkapilläre Passagezeit ~0,3-1 s) liefert eine Füllungsreserve für den linken Ventrikel (~600 ml, atmungsabhängig), bearbeitet Hormone und filtert Thromben (allenfalls Fett- und Gasemboli). Seine dünnwandigen Gefäße haben einen niedrigen Ruhetonus (kaum sympathischer Einfluss) und sind dehnungspassiv. Bei Sauerstoffmangel kontrahieren sie (K+-Ausstrom↓→ Depolarisierung → Ca++-Einstrom), um das Blut in besser belüftete Regionen umzuleiten. ~100 m2 Endothel aktivieren Angiotensin über ACE, inaktivieren Serotonin und Eikosanoide. Prä- und postkapillärer Widerstand sind gleich groß, der Kapillardruck liegt in der Mitte zwischen dem arteriellen (~2 kPa) und venösen. Das
Interstitium ist eiweißreich (hoher extravasaler kolloidosmotischer
Druck), der Filtrationsdruck bleibt positiv und die Alveolaroberfläche
feucht. Flüssigkeit sammelt sich aber nicht in der Alveole an: Alveolarepithel resorbiert Natrium, Wasser folgt nach. Gut belüftete Lungenpartien sind gut durchblutet (Euler-Liljestrand- Mechanismus: Venilations-Perfusions- Abgleich). Luftröhre, Bronchien, pleura visceralis und Teile des Ösophagus haben mit dem Bronchialkreislauf eine eigene Blutversorgung Die Koronardurchblutung (in Ruhe 70-80 ml/100 g, Sauerstoffextraktion
~70%) ist in erster Linie durch lokale metabolische Mechanismen (auto-) reguliert, sie steigt durch Adenosin, K+, H+, Prostazykline, NO (Vasodilatation).
Bei Belastung steigt die Extraktion bis auf 90%, die Mehrversorgung mit
Sauerstoff erfolgt in erster Linie über erhöhte Perfusion (bis ~400
ml/100g). Die Differenz zwischen basaler und maximaler Perfusion ist
die koronare Reserve, sie sollte >3,5 betragen (um diesen Faktor kann die Durchblutung ansteigen). Koronararterien reagieren auf
sympathische Aktivität meist mit Vasodilatation: Erhöhte
Kontraktionskraft und Herzfrequenz steigern den myokardialen
Sauerstoffverbrauch und damit autoregulativ die Durchblutung. Der linke
Ventrikel komprimiert während der Systole seine Versorgungsgefäße
(insbesondere subendokardial), die Perfusion erfolgt vor allem
diastolisch Die Koronardurchblutung (in Ruhe 70-80 ml/100 g, Sauerstoffextraktion
~70%) ist in erster Linie durch lokale metabolische Mechanismen (auto-) reguliert, sie steigt durch Adenosin, K+, H+, Prostazykline, NO (Vasodilatation).
Bei Belastung steigt die Extraktion bis auf 90%, die Mehrversorgung mit
Sauerstoff erfolgt in erster Linie über erhöhte Perfusion (bis ~400
ml/100g). Die Differenz zwischen basaler und maximaler Perfusion ist
die koronare Reserve, sie sollte >3,5 betragen (um diesen Faktor kann die Durchblutung ansteigen). Koronararterien reagieren auf
sympathische Aktivität meist mit Vasodilatation: Erhöhte
Kontraktionskraft und Herzfrequenz steigern den myokardialen
Sauerstoffverbrauch und damit autoregulativ die Durchblutung. Der linke
Ventrikel komprimiert während der Systole seine Versorgungsgefäße
(insbesondere subendokardial), die Perfusion erfolgt vor allem
diastolisch  Zwischen ~50 und ~150 mmHg arteriellem Druck wird die zerebrale Perfusion (~15% des Ruhe-HZV) myogen autoreguliert (~55 ml/min/100g), steigt aber mit steigendem pCO2 (normal ~40 mmHg; Hypokapnie
bewirkt zerebrale Vasokonstriktion und sinkende Gehirndurchblutung,
intensive Hyperventilation kann zu Schwindel und bis zu
Bewusstlosigkeit führen) oder pO2-Werten <50 mmHg. Orthostase senkt die zerebrale Perfusion (bis ~20%, bei Regulationsschwäche auch stärker). Graue Hirnsubstanz ist stärker durchblutet als weiße, je nach aktuellem Energieumsatz Zwischen ~50 und ~150 mmHg arteriellem Druck wird die zerebrale Perfusion (~15% des Ruhe-HZV) myogen autoreguliert (~55 ml/min/100g), steigt aber mit steigendem pCO2 (normal ~40 mmHg; Hypokapnie
bewirkt zerebrale Vasokonstriktion und sinkende Gehirndurchblutung,
intensive Hyperventilation kann zu Schwindel und bis zu
Bewusstlosigkeit führen) oder pO2-Werten <50 mmHg. Orthostase senkt die zerebrale Perfusion (bis ~20%, bei Regulationsschwäche auch stärker). Graue Hirnsubstanz ist stärker durchblutet als weiße, je nach aktuellem Energieumsatz  Die adrenerge
Steuerung der Skelettmuskelgefäße ist unterschiedlich: Diese verfügen
sowohl über α- (Kontraktion) als auch ß2-Rezeptoren (Dilatation). Der Sympathikustonus zur Muskulatur ist meist niedrig; maximale Aktivität, wie bei starkem Blutdruckabfall (Baroreflex),
reduziert die Durchblutung auf ~25% des normalen Ruhewertes. Bei
Muskelarbeit steigt der Anteil der Durchblutung der gesamten
Skelettmuskulatur von ~15% (Ruhe) auf bis
>80% des (erhöhten) HZV. Steigt der O2-Bedarf um 1 l/min (Ruhe
~0,3 l/min), erhöht sich das HZV um ~6 l/min (Ruhe
~6 l/min). Hochtrainierte Sportler können ihren O2-Konsum verzwanzigfachen, die Muskeldurchblutung kann lokal bis zu ~40fach ansteigen (aktive Muskeln werden hauptsächlich durch autoregulatíve Mehrdurchblutung versorgt). Die O2-Sättigung
des gemischt-venösen Blutes sinkt bei körperlicher Belastung, die Sauerstoffextraktion nimmt zu. Verstärkte kapilläre
Filtration bewirkt ein Anschwellen des arbeitenden Muskels, das
Plasmavolumen kann um 10-15% abnehmen (der Hämatokrit steigt an) Die adrenerge
Steuerung der Skelettmuskelgefäße ist unterschiedlich: Diese verfügen
sowohl über α- (Kontraktion) als auch ß2-Rezeptoren (Dilatation). Der Sympathikustonus zur Muskulatur ist meist niedrig; maximale Aktivität, wie bei starkem Blutdruckabfall (Baroreflex),
reduziert die Durchblutung auf ~25% des normalen Ruhewertes. Bei
Muskelarbeit steigt der Anteil der Durchblutung der gesamten
Skelettmuskulatur von ~15% (Ruhe) auf bis
>80% des (erhöhten) HZV. Steigt der O2-Bedarf um 1 l/min (Ruhe
~0,3 l/min), erhöht sich das HZV um ~6 l/min (Ruhe
~6 l/min). Hochtrainierte Sportler können ihren O2-Konsum verzwanzigfachen, die Muskeldurchblutung kann lokal bis zu ~40fach ansteigen (aktive Muskeln werden hauptsächlich durch autoregulatíve Mehrdurchblutung versorgt). Die O2-Sättigung
des gemischt-venösen Blutes sinkt bei körperlicher Belastung, die Sauerstoffextraktion nimmt zu. Verstärkte kapilläre
Filtration bewirkt ein Anschwellen des arbeitenden Muskels, das
Plasmavolumen kann um 10-15% abnehmen (der Hämatokrit steigt an)  In thermoneutraler Umgebung beträgt die spezifische Durchblutung der Haut ~10 ml/min/100g (insgesamt
~0,3 l/min). Die Perfusion dient auch der Durchblutung der Schweißdrüsen und kann zwischen
~1 und
~100% des Ruhe-HZV liegen. Je mehr Blut arteriell zuströmt, desto mehr speichern die Venennetze In thermoneutraler Umgebung beträgt die spezifische Durchblutung der Haut ~10 ml/min/100g (insgesamt
~0,3 l/min). Die Perfusion dient auch der Durchblutung der Schweißdrüsen und kann zwischen
~1 und
~100% des Ruhe-HZV liegen. Je mehr Blut arteriell zuströmt, desto mehr speichern die Venennetze  Das Verdauungssystem erhält ≥30% des Ruhe-HZV (~1,5
l/min). Erhöhter Sympathikustonus
reduziert die Perfusion, führt zu Entspeicherung und Verbesserung des
venösen Rückstroms zum Herzen. Körperliche Belastung steigert den
Sympathikustonus und reduziert die intestinale Perfusion
(α1-Rezeptoren). Eine umfangreiche Mahlzeit kann die Durchblutung des
Darms verdoppeln (vasodilatatorische Autoregulation), maximaler
Sympathikustonus (Stress, Muskelarbeit) bis auf ~20% des Normalwertes
reduzieren Das Verdauungssystem erhält ≥30% des Ruhe-HZV (~1,5
l/min). Erhöhter Sympathikustonus
reduziert die Perfusion, führt zu Entspeicherung und Verbesserung des
venösen Rückstroms zum Herzen. Körperliche Belastung steigert den
Sympathikustonus und reduziert die intestinale Perfusion
(α1-Rezeptoren). Eine umfangreiche Mahlzeit kann die Durchblutung des
Darms verdoppeln (vasodilatatorische Autoregulation), maximaler
Sympathikustonus (Stress, Muskelarbeit) bis auf ~20% des Normalwertes
reduzieren Reaktive (postischämische, postokklusive) Hyperämie tritt nach Unterdurchblutung auf. Sie dauert einige Sekunden bis Minuten an, bedingt durch
Metabolite, die während Hypoxie in das Interstitium
freigesetzt werden. Für die Vasodilatation spielt Stickstoffmonoxid eine Rolle Reaktive (postischämische, postokklusive) Hyperämie tritt nach Unterdurchblutung auf. Sie dauert einige Sekunden bis Minuten an, bedingt durch
Metabolite, die während Hypoxie in das Interstitium
freigesetzt werden. Für die Vasodilatation spielt Stickstoffmonoxid eine Rolle |
