Höhe, Tiefe, Druck und Sauerstofftransport  Hypobarie / Höhenaufstieg
Hypobarie / Höhenaufstieg  Hyperbarie / Tauchen
Hyperbarie / Tauchen  Dekompression
Dekompression  Sauerstofftoxizität
Sauerstofftoxizität 
Tauchreflex
 Begleitgase
Begleitgase
 CO2
CO2  CO
CO  Core messages
Core messages
Der
menschliche Organismus ist auf Umweltbedingungen angepasst, die dem
Aufenthalt an Land und einem relativ engen Höhenbereich - 0
(Meeresspiegel) bis etwa 5000 Meter - entspricht. Verlässt man diesen
Bereich (größere Höhen einerseits, Aufenthalt unter Wasser
andererseits), reicht physiologische Anpassung für das Aufrechterhalten
von Gesundheit und Überleben nur für kurze Zeit, nicht auf Dauer. Bei
der Anwendung künstlicher life support systems
ist das Verständnis für, und die Interpretation und Anwendung von,
physikalische(n) und physiologische(n) Rahmendaten von entscheidender
Bedeutung.
Höhe, Tiefe, Druck und Sauerstofftransport
Die Erdatmosphäre besteht zu 21% aus Sauerstoff. Das bedeutet, der Sauerstoffpartialdruck
beträgt 21% des atmosphärischen Druckes - das gilt auch für
die Partialdrucke in Flüssigkeiten, die mit Luft äquilibriert sind (Henry-Gesetz). Bei 1 bar (~100 kPa) Gesamtdruck
auf Meereshöhe beträgt der pO2 ~21 kPa.
 Abbildung:
Druck und Höhe / Tiefe
Kombiniert nach Vorlagen in dreamstime.com, exploringnature.org
Abbildung:
Druck und Höhe / Tiefe
Kombiniert nach Vorlagen in dreamstime.com, exploringnature.org
Der Luftdruck nimmt mit der Höhe nichtlinear
ab; mit etwas mehr als 5 km Aufstieg ist
er um die Hälfte reduziert, bei weiteren ~5 km nochmals um die Hälfte,
d.h. etwa 1/4 Atmosphäre.
Im Wasser nimmt der Druck linear mit der
Tiefe zu: Um 100 kPa (=Luftdruck auf Meereshöhe) pro 10 Meter. In 50
Meter Tiefe beträgt der Druck 6 (5+1) Atmosphären (bar)

In den Lungenalveolen ergibt sich aufgrund der Mischung im Totraum ein pO2 von ~13 kPa (~100 mmHg). Bei diesem Partialdruck ist das Hämoglobin praktisch zur Gänze mit Sauerstoff gesättigt (Bindungskurve des Hämoglobins). Mit abnehmendem pO2 sinkt auch die Sauerstoffsättigung - entsprechend der Bindungskurve (z.B. 50% bei ~3,5 kPa pO2).
Ein Hauptproblem bei der Wahl von Atemgasgemischen bei hypobaren  (Höhenaufenthalt: Fliegen, Bergsteigen) oder hyperbaren
(Höhenaufenthalt: Fliegen, Bergsteigen) oder hyperbaren  Umständen (Tauchen, Tunnelbau, Druckkammer) ist
der richtige Sauerstoffanteil. Ist er zu hoch, wirkt Sauerstoff toxisch
(er ist sehr reaktionsfreudig); ist er zu niedrig, treten
Hypoxiesymptome und Gefahr des Erstickens auf.
Umständen (Tauchen, Tunnelbau, Druckkammer) ist
der richtige Sauerstoffanteil. Ist er zu hoch, wirkt Sauerstoff toxisch
(er ist sehr reaktionsfreudig); ist er zu niedrig, treten
Hypoxiesymptome und Gefahr des Erstickens auf.
Auch Wasserdampf ist in
Atemgasen vorhanden - der Anteil hängt stark von Temperatur und
Luftdruck ab. Der Wasserdampfdruck über einer freien Wasserfläche -
also bei vollständiger Sättigung der Luft mit H2O - beträgt bei 0°C 0,6 kPa (4,8 mg H2O pro Liter Luft), bei 100°C 101,3 kPa (598 mg H2O pro Liter Luft), nimmt also nichtlinear mit der Wärmebewegung zu. Bei Körpertemperatur (37°C) lauten die Zahlen 6,3 kPa (47 mmHg), ein Liter Luft (z.B. in der Lunge) enthält dann 44 mg H2O (das großteils kondensiert, wenn man in kalte Umgebung ausatmet).
Die Druckabhängigkeit des Siedepunkts ist ebenfalls beträchtlich: Wenn
der atmosphärische Druck 760 mmHg beträgt, kocht Wasser bekanntlich bei
100°C. Sinkt der Druck, nimmt auch der Siedepunkt ab; Wasser kocht z.B.
bei einem Druck von 2,34 kPa (etwas mehr als 1/50 des Drucks auf
Meereshöhe) bereits bei 20°C. Bei einem völlig ungeschützten Körper
würden Körperflüssigkeiten (bei 37°C) ab einer Höhe von ca. 19 km - hier herrscht ein Luftdruck von nur noch 47 mmHg, also entsprechend dem pH2O - zu kochen beginnen: Die Lungen wären mit Wasserdampf gefüllt, für Stickstoff oder Sauerstoff bliebe kein Platz.
 Zur Anpassung an veränderte Atemgaspartialdrucke s. dort
Zur Anpassung an veränderte Atemgaspartialdrucke s. dort
Höhenanpassung / abnehmender Umgebungsdruck (Hypoxie)
Mit
zunehmender Höhe nimmt der Luftdruck ab. Dementsprechend sinken auch
der alveoläre Sauerstoffpartialdruck und die
Sauerstoffsättigung des Hämoglobins.
Die
Sauerstoffbindung an Hämoglobin nimmt ab - unakklimatisiert auf
~70% in 5 km Höhe und auf <40% in 8,8 km Höhe. Unakklimatisierte
Personen können schon ab Höhen von wenigen tausend Meter über dem
Meeresspiegel deutliche Symptome der Höhenkrankheit entwickeln.
In Passagierflugzeugen wird der Kabinendruck so eingestellt, dass er
dem Druck auf ~2 km Meereshöhe entspricht ("Kabinenhöhe"). Je höher das
Flugzeug steigt, umso größer wird der Druckunterschied zwischen innen
(z.B. 80 kPa) und außen (z.B. 20 kPa in ~11 km Höhe).
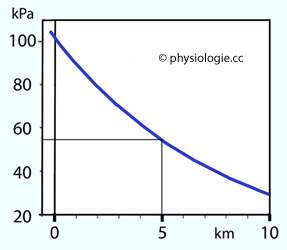
 Abbildung: Luftdruck als Funktion der Meereshöhe
Abbildung: Luftdruck als Funktion der Meereshöhe
Nach verschiedenen Quellen kompiliert
Mittlerer Luftdruck in kPa (Ordinate) als Funktion der Höhe in Relation zum mittleren Meeresspiegel in km (Abszisse).
Ganz links: Orte mit einer Lage unter "Normalnull" (rotes Meer:
428 m unter dem Meeresspiegel) haben mittlere Luftdruckwerte, welche
denjenigen auf Meereshöhe (101 kPa) übertreffen (totes Meer etwa 105 kPa).
Rechts:
Etwa in 5500 m Höhe beträgt der Luftdruck (und damit die Partialdrucke
von Sauerstoff, Stickstoff, Argon etc) nur mehr die Hälfte der Werte,
die auf Meereshöhe bestehen.
Auf 8.849 m (Spitze des Mt. Everest) beträgt der mittlere Luftdruck nur noch ca. 31 kPa

 Abbildung), am Gipfel des Mount
Everest (8849 m) ein Drittel (33-34 kPa, je nach Wetterlage). Der Sauerstoffmangel bedingt Hyperventilation
mit den damit verbundenen metabolischen Komplikationen (respiratorische
Alkalose, Bremsung des Atemantriebs durch die Hypokapnie). Daher hielt
man es
lange für ausgeschlossen, ohne Atemgerät (zusätzlicher Sauerstoff) auf
den höchsten Berg der Welt zu steigen (Mount Everest: Mittlerer pO2 der Atemluft etwa 6,6 kPa oder knapp über 50 mmHg).
Abbildung), am Gipfel des Mount
Everest (8849 m) ein Drittel (33-34 kPa, je nach Wetterlage). Der Sauerstoffmangel bedingt Hyperventilation
mit den damit verbundenen metabolischen Komplikationen (respiratorische
Alkalose, Bremsung des Atemantriebs durch die Hypokapnie). Daher hielt
man es
lange für ausgeschlossen, ohne Atemgerät (zusätzlicher Sauerstoff) auf
den höchsten Berg der Welt zu steigen (Mount Everest: Mittlerer pO2 der Atemluft etwa 6,6 kPa oder knapp über 50 mmHg).
Durchgehend bewohnte Orte finden sich generell unter etwa 5000 m Höhe
(Luftdruck und Partialdrucke betragen auf 5500 m nur mehr die Hälfte
der Werte auf Meereshöhe).

Ab ~3000 m Höhenaufenthalt ist der alveoläre pO2 merklich reduziert
Die hypoxiebedingte Mehratmung verursacht Hypokapnie und respiratorische (Höhen-) Alkalose
Kompensatorisch sinkt nach einiger Zeit die Pufferbasenkonzentration, der Base excess wird negativ
|
Sauerstoffpartialdruck in verschiedenen Höhen

Nach Dejours: Principles of Comparative Physiology 2nd ed. Elsevier 1981
|
Höhe üb. Meeresspiegel (m)
|
Fraktion Standard- atm. Druck
|
O2-Partialdruck (kPa)
|
0
|
1,00
|
21,2
|
1.000
|
0,89
|
18,8
|
2.000
|
0,78 |
16,7
|
3.000
|
0,69
|
14,7
|
4.000
|
0,61
|
12,9
|
5.000
|
0,53
|
11,3
|
5.500
|
0,5
|
10,6
|
6.000
|
0,47
|
9,9
|
7.000
|
0,40
|
8,6
|
8.000
|
0,35
|
7,5
|
9.000
|
0,30
|
6,4
|
10.000
|
0,26
|
5,5
|
 pO2 in der Inspirationsluft am Gipfel des Mt. Everest (8.849 m ü.M.): In dieser Höhe herrscht ein mittlerer Luftdruck von ca. 250 mmHg. 21% der Luft besteht aus Sauerstoff, der pO2 beträgt 52-53 mmHg. In der Lunge ist die Luft wasserdampfgesättigt (pH2O = 47 mmHg), für die übrigen Gase bleibt ein Druck von 250-47 - also 203 mmHg. Davon sind 21% (O2-Anteil in der Luft) knapp 43 mmHg. Bei diesem pO2
ist das Hämoglobin im arterialisierten Blut nur noch zu drei Viertel
gesättigt und der Sauerstofftransport zum Gewebe entsprechend reduziert
(normalerweise enthält das gemischt-venöse Blut - das in die Lungen
einströmt - bei körperlicher Ruhe ebenfalls zu drei Viertel mit
Sauerstoff gesättigtes Hämoglobin).
pO2 in der Inspirationsluft am Gipfel des Mt. Everest (8.849 m ü.M.): In dieser Höhe herrscht ein mittlerer Luftdruck von ca. 250 mmHg. 21% der Luft besteht aus Sauerstoff, der pO2 beträgt 52-53 mmHg. In der Lunge ist die Luft wasserdampfgesättigt (pH2O = 47 mmHg), für die übrigen Gase bleibt ein Druck von 250-47 - also 203 mmHg. Davon sind 21% (O2-Anteil in der Luft) knapp 43 mmHg. Bei diesem pO2
ist das Hämoglobin im arterialisierten Blut nur noch zu drei Viertel
gesättigt und der Sauerstofftransport zum Gewebe entsprechend reduziert
(normalerweise enthält das gemischt-venöse Blut - das in die Lungen
einströmt - bei körperlicher Ruhe ebenfalls zu drei Viertel mit
Sauerstoff gesättigtes Hämoglobin).

 Abbildung: Zusammensetzung der Alveolarluft als Funktion von Höhe und Atemgas
Modifiziert nach einer Vorlage in Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Abbildung: Zusammensetzung der Alveolarluft als Funktion von Höhe und Atemgas
Modifiziert nach einer Vorlage in Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Mit
zunehmender Höhe sinkt der Luftdruck und damit auch der
Sauerstoffpartialdruck. Bei plötzlicher Exposition an 6000 Meter Höhe
tritt - bei fehlender Anpassung - Bewusstlosigkeit auf (bei
sorgfältiger Anpassung und ausgezeichneter Konstitution sind Aufstiege
bis 8848 m möglich).
Atmet man reinen Sauerstoff, verschiebt sich die obere Toleranzgrenze auf knapp 14 km, der alveoläre pO2
sinkt dabei auf ~40 mmHg. Spätestens ab dieser Höhe muss die Kabine
druckstabilisiert werden oder es müssen Druckanzüge getragen werden.
Ungeschützt nähert sich in noch größeren Höhen (ab ~19 km) der
Gesamtdruck dem Wasserdampfpartialdruck an (47 mmHg bei
Körpertemperatur), es besteht die Gefahr des Verdampfens ("Kochen") von
Körperflüssigkeiten

Die Effekte extremer Hypoxie sind dramatisch: Wird man z.B. in 10 km
Höhe dem Außendruck ausgesetzt, bleibt etwa eine Minute - average effective performance time -, innerhalb
der man ohne Einschränkung der mentalen Leistung handeln kann.
(Innerhalb dieser Zeit sollte man eine Sauerstoffmaske angelegt haben.)
Steigt man - ohne Druckkapsel / Druckanzug - in größere Höhen auf
(Stratosphärenballon, militärisches Flugzeug ohne Druckkabine), muss
Sauerstoff obligat (zu)geatmet werden. ~20 kPa (1/5 Atmosphäre) - das
ist der Gesamtdruck in etwa 11 km Höhe - entspricht dem normalen
Sauerstoffpartialdruck.
Atmet man in dieser Höhe reinen Sauerstoff, kann das Hämoglobin die
Versorgung des Gewebes gleich gut übernehmen wie bei Atmung von Luft
auf Meereshöhe.
Tolerierbar ist auf diese Weise der Aufstieg in eine
Höhe von ~13 km, bei noch geringeren Druckwerten nimmt die
Sauerstoffsättigung des Hämoglobins merklich ab (
 Abbildung
Abbildung) und
das Tragen eines luftdichten "Astronautenanzugs" wird (bei längerer
Exponierung an die hier herrschenden hypobaren Druckwerte) notwendig.
Durch Steigerung des Sauerstoffanteils in der geatmeten Luft (über 21%
hinaus), nimmt die Zone der tolerierbaren Hypobarie entsprechend zu (
 Abbildung:
Abbildung:):
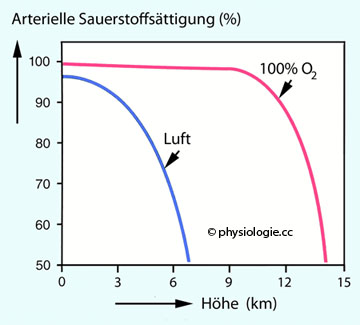
 Abbildung: Sauerstoffsättigung vs. Höhe
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Abbildung: Sauerstoffsättigung vs. Höhe
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Mit zunehmender Höhe (hier in tausend Meter über dem Meeresspiegel, Abszisse) nimmt der Luftdruck und damit auch der pO2
ab. Ist man dem Außendruck ausgesetzt (keine Druckkammer wie in einem
Raumschiff, sondern Außendruck wie in einem offenen Stratosphärenballon
oder Kampfjet), sinkt damit der Anteil des sauerstoffbeladenen Hämoglobins im arteriellen Blut entsprechend seinem O2-Bindungsverhalten.
Atmet man unter diesen Bedingungen normale Außenluft, liegt der Anteil
des sauerstoffgesättigten arteriellen Hämoglobins in ca. 7 km Höhe nur
noch bei 50% (blaue Kurve).
Atmet man reinen Sauerstoff, nimmt der Luftdruck und damit der pO2
zwar ebenfalls mit der Höhe kontinuierlich ab, liegt aber bis zu ca. 9
km Höhe immer noch über dem für die so gut wie vollständige
Sauerstoffsättigung des Hämoglobins notwendigen Wert. Erst dann sinkt
auch hier der Anteil des HbO2 - Halbsättigung wird erst bei ~14 km Höhe erreicht (
rote Kurve)

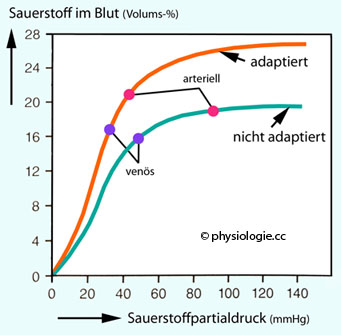 <Abbildung: Partialdruckabhängige Sauerstofftransportkapazität bei höhenadaptierten und nicht-adaptierten Personen
<Abbildung: Partialdruckabhängige Sauerstofftransportkapazität bei höhenadaptierten und nicht-adaptierten Personen
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Menschen, die dauerhaft in Höhen bis zu
~5000 m Meereshöhe leben, haben sich in mehrfacher Weise an den niedrigen Sauerstoffgehalt der Luft adaptiert. So nimmt ihr O
2-Bindungsvermögen an Hämoglobin deutlich zu und erreicht ihr Maximum bei bis zu
~27 Volums-% (
orange Kurve).
Bei Menschen, die in Gegenden leben, die auf oder nur unwesentlich über
dem Meeresspiegel liegen, zeigt sich die übliche Bindungskurve, die bei
~20 Volums-% endet (grüne Kurve)

Dank sorgfältiger Höhenakklimatisierung sowie Anpassung des Stoffwechsels an hypoxische Bedingungen ist ein Aufstieg zum Gipfel des Mt. Everest auch ohne O2-Zusatz möglich:

Die Höhenanpassung beruht auf verschiedenen Komponenten - vor allem
 Normalisierung der zunächst auftretenden respiratorischen Alkalose (vermehrter CO2-Verlust, dadurch hypokapniebedingte Atemdrosselung) durch vermehrte Bicarbonatausscheidung
der Nieren ("metabolische Kompensation"). Dadurch wird die
Atemdrosselung wieder aufgehoben, es kann mehr Sauerstoff geatmet
werden. Dieser Mechanismus tritt innerhalb einiger Tage in Kraft
Normalisierung der zunächst auftretenden respiratorischen Alkalose (vermehrter CO2-Verlust, dadurch hypokapniebedingte Atemdrosselung) durch vermehrte Bicarbonatausscheidung
der Nieren ("metabolische Kompensation"). Dadurch wird die
Atemdrosselung wieder aufgehoben, es kann mehr Sauerstoff geatmet
werden. Dieser Mechanismus tritt innerhalb einiger Tage in Kraft
 Über längere Zeiträume steigt die Ausschüttung von Erythropoetin, dadurch steigt die Sauerstofftransportkapazität des Blutes (erhöhtes Hämoglobin, gesteigerter Hämatokrit)
Über längere Zeiträume steigt die Ausschüttung von Erythropoetin, dadurch steigt die Sauerstofftransportkapazität des Blutes (erhöhtes Hämoglobin, gesteigerter Hämatokrit)
 Einen wesentlichen Beitrag zur Höhenakklimatisierung liefert der Eisenstoffwechsel. Transferrin
versorgt die Erythropoese mit Eisen; es ist normalerweise zu 15-45%
eisengesättigt (d.h. mehr als die Hälfte der verfügbaren
Bindungsstellen ist unbesetzt). Dieser Prozentsatz wird durch das Hepcidin / Ferroportin-System
reguliert: Das aus der Leber stammende Hepcidin kontrolliert
Eisenaufnahme und die Eisenfreisetzung aus Makrophagen.
Zielmolekül des Hepcidins ist der Eisenexporter Ferroportin,
dessen Endozytose und Abbau es befördert. Auf diese Weise sorgt
Hepcidin dafür, dass Eisen in der Zelle (Enterozyt, Makrophage)
verbleibt, und senkt den extrazellulären Eisenspiegel.
Der Hepcidinspiegel selbst unterliegt mehreren Steuerungsfaktoren (wie die Eisenverfügbarkeit). Einer dieser Faktoren ist Hypoxie:
Aufstieg in größere Höhen senkt den Hepcidinspiegel und steigert
dadurch die Eisenverfügbarkeit. Wie das funktioniert? Offenbar spielt Erythropoetin
eine (indirekte) Rolle, womit dieses nicht nur für die Anregung der
Blutbildung, sondern - über Senkung der hepatischen Hepcidinbildung -
auch für bessere Verfügbarkeit des dazu benötigten Eisens
verantwortlich wäre.
Einen wesentlichen Beitrag zur Höhenakklimatisierung liefert der Eisenstoffwechsel. Transferrin
versorgt die Erythropoese mit Eisen; es ist normalerweise zu 15-45%
eisengesättigt (d.h. mehr als die Hälfte der verfügbaren
Bindungsstellen ist unbesetzt). Dieser Prozentsatz wird durch das Hepcidin / Ferroportin-System
reguliert: Das aus der Leber stammende Hepcidin kontrolliert
Eisenaufnahme und die Eisenfreisetzung aus Makrophagen.
Zielmolekül des Hepcidins ist der Eisenexporter Ferroportin,
dessen Endozytose und Abbau es befördert. Auf diese Weise sorgt
Hepcidin dafür, dass Eisen in der Zelle (Enterozyt, Makrophage)
verbleibt, und senkt den extrazellulären Eisenspiegel.
Der Hepcidinspiegel selbst unterliegt mehreren Steuerungsfaktoren (wie die Eisenverfügbarkeit). Einer dieser Faktoren ist Hypoxie:
Aufstieg in größere Höhen senkt den Hepcidinspiegel und steigert
dadurch die Eisenverfügbarkeit. Wie das funktioniert? Offenbar spielt Erythropoetin
eine (indirekte) Rolle, womit dieses nicht nur für die Anregung der
Blutbildung, sondern - über Senkung der hepatischen Hepcidinbildung -
auch für bessere Verfügbarkeit des dazu benötigten Eisens
verantwortlich wäre.

 Abbildung: Rolle des Eisens für die Sauerstoff- Homöostase
Nach Gassmann M, Muckenthaler MU. Adaptation of iron requirement to
hypoxic conditions at high altitude. J Appl Physiol 2015; 119: 1432-40
Abbildung: Rolle des Eisens für die Sauerstoff- Homöostase
Nach Gassmann M, Muckenthaler MU. Adaptation of iron requirement to
hypoxic conditions at high altitude. J Appl Physiol 2015; 119: 1432-40
Niere: Mit dem Aufstieg in große Höhe bedingt der niedrige Umgebungsdruck arterielle Hypoxämie (über den Mechanismus s. dort): Prolylhydroxylasen PHD,
hypoxie-induzierbarer Faktor HIF-2α, Aryl hydrocarbon receptor nuclear translocator ARNT, Erythropoetin (Epo). Ein zweiter eisenabhängiger Mechanismus knüpft die Erythropoetinsynthese an die Eisenverfügbarkeit: HIF-2α enthält eine IRE (iron-responsive element) genannte RNS-Sequenz. Bei Eisenmangel - und reduzierter Hämoglobinsynthese - bindet diese an ein iron regulatory protein-1 (IRP1), was die Translation von HIF-2α hemmt.
Knochenmark: Erreicht Epo das rote Knochenmark, regt es dort die
Hämatopoese an - Eisen wird verbraucht. Um die Fe-Versorgung zu
sichern, wirken hypoxie-induzierte Faktoren wie das Epo-kontrollierte Erythroferron (ErFe) - das die Hepcidinsynthese in der Leber blockiert - oder der growth differentiation factor 15 (GDF15) - beide werden in Erythroblasten synthetisiert, wie auch der platelet-derived growth factor BB (PDGF-BB) u.a.
Leber: Diese
Faktoren erreichen die Leber und vermindern die Expression von
Hepcidin, das Ferroportin (Fpn) bindet und zu seiner Internalisierung
(und Inaktivierung) führt (s. dort).
Makrophagen / Darm:
Reduziertes Hepcidin erhöht die Verfügbarkeit
und Aktivität von Ferroportin, Eisen wird vermehrt aus internen
Speichern (z.B. Makrophagen, die Erythrozyten abbauen) und aus der
Nahrung gewonnen (Duodenum). Zusätzlich fördern Hypoxie und Eisenmangel
die intestinale Eisenresorption: Ähnlich wie in der Niere stabilisiert
Sauerstoff- oder Eisenverfügbarkeit HIF-2α, das die Transkription von
Faktoren anregt, welche die Eisenresorption kontrollieren:
Ferrireduktase (dcytb), den apikalen divalenten Metalltransporter DMT-1 und den Eisenexporter Ferroportin.
Blut: Das aus Makrophagen und Darm gewonnene Eisen wird dann an Transferrin (Tf) gebunden zum Knochenmark gebracht
CFU-E, colony-forming unit-erythroid; HRE, hypoxia response element

"Stress-Erythropoese": Bei Eisenmangel triggert Erythropoetin in (Pro)Erythroblasten die Expression von Erythroferron (ERFE). Dieses Protein (es wird auch in Muskelzellen synthetisiert) hemmt die Hepcidinbildung und erhöht damit die Aktivität des Eisenexportkanals Ferroportin - und dadurch die Eisenmobilisierung
aus Darm und körpereigenen Speichern. Vermutlich spielen auch noch
weitere Faktoren eine Rolle bei der hypoxiebedingten Reduktion der
Hepcidinsynthese in der Leber.
Der Blutdruck
ist durch mäßige
Hypoxie bzw. Höhe unbeeinträchtigt, steigt jedoch (systolisch und
diastolisch) bei starker Hypoxie bzw. extremer Höhe als Folge der
Anregung des Sympathikus und damit einhergehenden erhöhten
Katecholaminwerten (periphere Vasokonstriktion) - trotz
hypoxiebedingter Gefäßerweiterung vor allem in der Skelettmuskulatur,
die aber durch Noradrenalinwirkung übertrumpft wird. Körperliche
Belastung steigert den systolischen Druck weiter, der diastolische
Druck sinkt leicht ab (das normale Reaktionsmuster).
Die Herzfrequenz ist ebenfalls höhenabhängig:
 Einerseits nimmt die Ruhefrequenz von etwa 60/min auf Meereshöhe hypoxiebedingt auf ~90/min auf 8000 m Höhe zu (das Schlagvolumen nimmt leicht ab);
Einerseits nimmt die Ruhefrequenz von etwa 60/min auf Meereshöhe hypoxiebedingt auf ~90/min auf 8000 m Höhe zu (das Schlagvolumen nimmt leicht ab);
 andererseits sinkt die maximale Herzfrequenz
bei längerem Höhenaufenthalt (nicht bei akuter Hypoxie!) von etwa
190/min auf Meereshöhe auf ~130/min auf 8000 m Höhe ab. Der Vorteil ist
eine kardioprotektive Wirkung, vermutlich bedingt durch
Herunterregulierung der ß-Rezeptoren in Folge chronisch erhöhter
Katecholaminwerte im Extrazellulärraum.
andererseits sinkt die maximale Herzfrequenz
bei längerem Höhenaufenthalt (nicht bei akuter Hypoxie!) von etwa
190/min auf Meereshöhe auf ~130/min auf 8000 m Höhe ab. Der Vorteil ist
eine kardioprotektive Wirkung, vermutlich bedingt durch
Herunterregulierung der ß-Rezeptoren in Folge chronisch erhöhter
Katecholaminwerte im Extrazellulärraum.
Hypoxie und Lungengefäße
Sauerstoffmangel in großer Höhe reduziert das arterielle O2-Angebot (Kritische Sättigung 12 Vol-%, Normalwert 19-20 Vol-%) und erhöht über
pulmonale Vasokonstriktion (Pumonalgefäße - Typ P - kontrahieren bei sinkendem pO2: Euler-Liljestrand-Mechanismus) und Widerstandsteigerung den Blutdruck
in der Lunge.
Es kann dazu kommen, dass der Kapillardruck so
stark ansteigt, dass Flüssigkeit ins
zuerst in das Interstitium, dann - bei noch höherem Druck
- in
die Alveolen austritt ("Höhenödem").
Niedriger Luftdruck (große Höhe) bedingt niedrigen pO2 (Hypoxie) und pulmonale Vasokonstriktion
Dadurch steigt der Blutdruck im Lungenkreislauf, es kann zu
Flüssigkeitsaustritt aus den Alveolarkapillaren ("Höhenödem") kommen
|
Kleine arterielle Lungengefäße (<0,8 mm) reagieren auf Hypoxie mit Vasokonstriktion (Euler-Liljestrand-Mechanismus), was den pulmonalen Fließwiderstand erhöht und zu Lungenödem führen kann.
Rascher Aufstieg führt zu einer generellen Gefäßreaktion in der Lunge; Gefäße des P-Typs reagieren auf Hypoxie mit Konstriktion, der Druck im Pulmonalkreislauf nimmt zu, und der steigende Filtrationsdruck kann zu Höhenödem
führen. Dieses lebensbedrohliche Zustandbild kann durch Erhöhung des
Sauerstoffpartialdrucks in der Atemluft (Druck- bzw.
Sauerstoffbeatmung) rückgängig gemacht werden.

Abbildung: Neurokognitive Beeinträchtigungen mit akut zunehmender Höhe
Nach WilsonMH, NewmanS, ImrayCH. The cerebral effects of ascent to high altitudes. Lancet Neurol 2009; 8:175-91
Ab 4000 m können psychomotorische Störungen, ab 6000 m kann Bewusstlosigkeit auftreten
 Zahlreiche Mechanismen sind an der hypoxisch bedingten Erhöhung des intrakraniellen Drucks
bei Höhenaufenthalt verantwortlich. Mechanische Faktoren erhöhen den
intravasalen Druck und können so
Flüssigkeitsaustritt (Ödeme) und Gefäßwandschäden verursachen.
Zahlreiche Mechanismen sind an der hypoxisch bedingten Erhöhung des intrakraniellen Drucks
bei Höhenaufenthalt verantwortlich. Mechanische Faktoren erhöhen den
intravasalen Druck und können so
Flüssigkeitsaustritt (Ödeme) und Gefäßwandschäden verursachen.
Atemgas-Partialdrucke wirken wahrscheinlich unmittelbar vasoaktiv:
Hypoxämie wirkt gefäßerweiternd, Hypokapnie gefäßverengend; die
Atemregulation beeinflusst wiederum die Partialdruckwerte.
Hypoxämie
belastet die Na-K-Pumpe, freie Radikale beschädigen die Basalmembran;
diese leidet vermutlich zusätzlich unter der Wirkung von VEGF, das
durch Akkumulierung von HIF-1α - einem hypoxiebedingt auftretenden
Steuerungsprotein, dessen Bildung von zahlreichen Faktoren beeinflusst wird - hinaufreguliert wird.
Höhenanpassung führt zu Erhöhung des 2,3-DPG-Gehalts in den roten Blutkörperchen und dadurch zu Rechtsveschiebung der O2-Bindungskurve des Hämoglobins und verbesserter Sauerstoffversorgung des Gewebes.
Längerer Aufenbthalt in großer Höhe führt zu vermehrter Bildung von 2,3-DPG
|
Schließlich könnte lokaler Kaliumrückstau die
Freisetzung von Stickstoffmonoxid anregen, was vasodilatierend wirkt, ebenso wie unter
neuronaler Wirkung freigesetztes Adenosin (
Abbildung
).
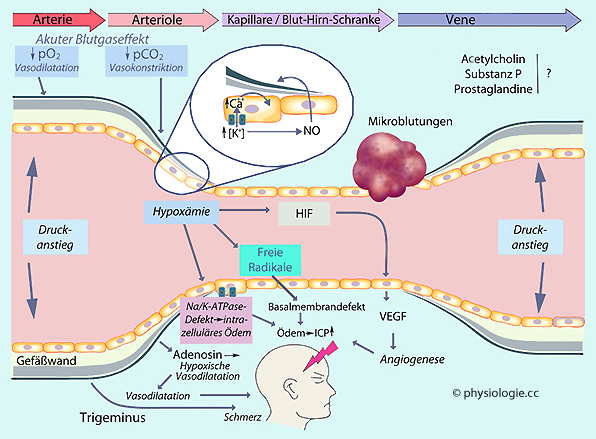

Abbildung: Mechanismen, die an der Erhöhung des intrakraniellen Drucks bei Hypoxie beteiligt sind / sein dürften
Verlauf
vom arteriellen zum venösen Ast. Vasodilatation erfolgt durch Adenosin
und Stickstoffmonoxid (NO). Ödeme steigern den intrakraniellen Druck,
sie entstehen infolge Membrandefekten (freie Radikale!) und
hypoxiebedingter Schädigung der Natrium-Kalium-Pumpe
HIF, Hypoxia-Inducible Factor  ICP, Intrakranieller Druck (=Hirndruck)
ICP, Intrakranieller Druck (=Hirndruck)  VEGF, Vascular Endothelial Growth Factor
VEGF, Vascular Endothelial Growth Factor
 Vasodilatation liegt wahrscheinlich auftretenden Kopfschmerzen
zugrunde. Mikrohämatome entstehen teils druckbedingt, teils unter
Wirkung zusätzlicher Wirkstoffe.
Vasodilatation liegt wahrscheinlich auftretenden Kopfschmerzen
zugrunde. Mikrohämatome entstehen teils druckbedingt, teils unter
Wirkung zusätzlicher Wirkstoffe.
Kommt es zu
einer Verletzung der Druckhülle (Dekompression), nimmt der Luftdruck
entsprechend ab und damit auch die Sauerstoffsättigung des Hämoglobins;
die
Sauerstoffversorgung des Gehirns sinkt und damit auch seine
Leistungsfähigkeit.
Nimmt der Umgebungsdruck rasch ab (
Dekompression),
kann Stickstoff, der zuvor in den Körperflüssigkeiten gelöst war, in
Form von Gasblasen austreten. Dies kann Jucken, Schmerzen (
decompression sickness DCS,
'bends',
weil die betroffene Person sich vor Schmerzen krümmt) und Gasembolien
im Kreislauf (
arterial gas embolization AGE) verursachen. Der Überbegriff (DCS, AGE) lautet
decompression illness (DCI).
Dekompressionsprobleme entstehen

bei
rascher Zunahme der Höhe und entsprechender Abnahme des Umgebungsdrucks
(oder rascher Abnahme des Drucks in einer entsprechenden Druckkammer)

beim
Auftauchen nach einem längeren hyperbaren Aufenthalt (Druckkammer,
Sättigungstauchen)

bei
Personen, die kurz nach
Sättigungstauchgängen einen Flug antreten (die "Kabinenhöhe" im
Flugzeug wird auf ~1800 m eingestellt, die arterielle
Sauerstoffsätigung beträgt hierbei übrigens nur noch knapp 80%)

beim
"Umsteigen" in einen "Soft suit"- Raumanzug (hier herrscht aus
technischen / praktischen Gründen ein geringerer Druck als im
Raumschiff).
Um Komplikationen zu verhindern, müssen
Dekompressionszeiten
eingehalten werden, die empirisch ermittelt wurden (Deko-Tabellen,
Computerprogramme). Treten Symptome auf, wird der Umgebungsdruck erhöht, um das
Gas wieder in Lösung zu bringen.
Voratmen von reinem Sauerstoff trägt zur Verhinderung dieser Probleme
bei, da Sauerstoff im Stoffwechsel verbraucht wird und folglich sich nicht in dem
Maße im Gewebe ansammelt, wie der inerte Stickstoff dies tut.

Schorcheltauchen: Schwimmt man mit dem Kopf unter Wasser, kann man mit einem kurzen Atemrohr Außenluft atmen. Der Schnorchel hat 2 cm Durchmesser und maximal 35 cm Länge, was rund 100 ml Totraum ergibt - das dabei unvermeidliche Wiedereinatmen der Totraumluft nennt man Pendelatmung, sie reduziert die alveoläre Ventilation. Weiters tritt ein hydrostatischer
Druckunterschied auf (z.B. in 30 cm Wassertiefe um 3 kPa oder 22,5
mmHg). Das Wasser komprimiert den Thorax, das erschwert die
Inspiration.
 Wasserimmersion und ihre Konsequenzen für den Kreislauf s. dort
Wasserimmersion und ihre Konsequenzen für den Kreislauf s. dort
Freitauchen: Taucht man ohne Schnorchel oder Geräte (SCUBA-Ausrüstung), muss man den Atem unter Wasser anhalten (Apnoe: Apnoetauchen).
Das Ein- und Untertauchen des Körpers in Wasser ändert (abgesehen vom Problem der Atmung) zahlreiche physikalische Kenngrößen des den Organismus umgebenden Mediums:
Vergleich Luft - Wasser als Atemmedium

Nach Schmidt-Nielsen, Physiologie der Tiere (Spektrum 1997)

D = Diffusionskoeffizient, K = Diffusionskonstante |
|
Wasser
|
Luft
|
Verhältnis
|
O2-Konzentration (l/l)
|
0,0007
|
0,209
|
~1:30
|
Dichte (kg/l)
|
1,000
|
0,0013
|
~800:1 |
Viskosität (cP)
|
1
|
0,02
|
50:1
|
Wärmekapazität (cal/l.°C)
|
1000
|
0,31
|
~3000:1 |
Wärmeleitfähigkeit (cal/s.cm.°C)
|
0,0014
|
0,000057
|
~25:1 |
| DO2 (cm2/s) |
0,000025
|
0,198
|
~1:8000 |
| DCO2 (cm2/s) |
0,000018
|
0,155
|
~1:9000 |
| KO2 (bar.min/s) |
34.10-6
|
11
|
~1:300000 |
KCO2 (bar.min/s)
|
850.10-6 |
9,4
|
~1:11000 |
l Medium / l O2
|
143
|
4,8
|
~30:1 |
| kg Medium / l O2 |
143
|
0,0062
|
~23000:1 |
So enthält z.B. Luft pro Liter dreißig mal so viel Sauerstoff wie Wasser (bei gleichem pO2) - dazu kommt das Massenverhältnis von etwa 800 zu 1. Das bedeutet, dass 1kg Luft 105-mal
so viel Sauerstoff enthält wie 1 kg Wasser (das mit Luft äquilibriert
ist). Weiters ist Wasser etwa 50-mal visköser als Luft; die
Sauerstoff- Diffusionsgeschwindigkeit ist in Luft 104-mal
größer als in Wasser. (Diese Unterschiede sind vor allem im Rahmen der
vergleichenden Physiologie der Respiration bedeutsam - Kiemenatmung vs.
Lungenatmung.)
Von direkter Relevanz für den Aufenthalt in und unter Wasser ist die unterschiedliche Wärmeleitfähigkeit: Sie ist in Wasser 25-mal höher als in Luft. Daher kühlt man (ohne Schutzanzug) in Wasser, dessen Temperatur unter der Indifferenztemperatur
(für den Menschen etwa 35°C) liegt, viel rascher aus als bei
vergleichbarem Temperaturgefälle in der Luft (Indifferenztemperatur
zwischen 27 und 31°C).
 Viele
Menschen nehmen vor einem Freitauchgang mehrfach tief Luft, um
sich "mit Sauerstoff vollzupumpen". Dieses Verhalten ist nicht
zielführend, denn:
Viele
Menschen nehmen vor einem Freitauchgang mehrfach tief Luft, um
sich "mit Sauerstoff vollzupumpen". Dieses Verhalten ist nicht
zielführend, denn:
 Es gibt im Körper keinen nennenswerten Sauerstoffspeicher - das
Hämoglobin des arteriellen Blutes ist ohnehin vollständig
sauerstoffgesättigt, physikalisch gelöst lasst sich durch Erhöhung des
pO2 nur wenig zusätzlicher Sauerstoff in den Körperflüssigkeiten "zwischenspeichern". Auf Meereshöhe kann man bei einer erwachsenen Person etwa von folgenden Werten ausgehen:
Es gibt im Körper keinen nennenswerten Sauerstoffspeicher - das
Hämoglobin des arteriellen Blutes ist ohnehin vollständig
sauerstoffgesättigt, physikalisch gelöst lasst sich durch Erhöhung des
pO2 nur wenig zusätzlicher Sauerstoff in den Körperflüssigkeiten "zwischenspeichern". Auf Meereshöhe kann man bei einer erwachsenen Person etwa von folgenden Werten ausgehen:
 5 l Blut (arteriell 20 Vol-%, venös ≤15 Vol-%) enthalten etwa 850 ml O2
5 l Blut (arteriell 20 Vol-%, venös ≤15 Vol-%) enthalten etwa 850 ml O2
 An das Myoglobin in der Muskulatur sind ca. 250 ml O2 gebunden
An das Myoglobin in der Muskulatur sind ca. 250 ml O2 gebunden
 In der Lunge befinden sich ungefähr 400-500 ml O2
In der Lunge befinden sich ungefähr 400-500 ml O2
Damit enthält der Körper unter Normbedingungen insgesamt ~1,5
Liter Sauerstoff (der Ruhebedarf für knapp 6 Minuten), davon kann ohne
Nachschub natürlich nur ein Bruchteil verwendet werden. Nur wenige
Minuten Apnoe bringen schon die Gefahr hypoxischer Gewebeschäden mit
sich.
Dazu ein Rechenbeispiel:
 Unter normalen Umgebungsbedingungen (100 kPa Gesamtdruck) sind 98,6 %
des Sauerstoffs (etwa 20 Vol-%) im arteriellen Blut an Hämoglobin
angelagert; nur 1,4% (<0,3 Vol-%) liegen physikalisch gelöst vor (
Unter normalen Umgebungsbedingungen (100 kPa Gesamtdruck) sind 98,6 %
des Sauerstoffs (etwa 20 Vol-%) im arteriellen Blut an Hämoglobin
angelagert; nur 1,4% (<0,3 Vol-%) liegen physikalisch gelöst vor ( s. dort). Dieser gelöste O2-Anteil
nimmt mit zunehmendem Umgebungsdruck zu: Bei einer Verdoppelung des
Drucks (10 m Tiefe bei Freitauchen oder SCUBA-Tauchen) auf knapp 0,6
Vol-%; bei einer Verzehnfachung des Drucks (90 m Tiefe) steigt der
Sauerstoffgehalt des Blutes um ~4 Vol-% an (von ~20 auf ~24 Vol-%).
s. dort). Dieser gelöste O2-Anteil
nimmt mit zunehmendem Umgebungsdruck zu: Bei einer Verdoppelung des
Drucks (10 m Tiefe bei Freitauchen oder SCUBA-Tauchen) auf knapp 0,6
Vol-%; bei einer Verzehnfachung des Drucks (90 m Tiefe) steigt der
Sauerstoffgehalt des Blutes um ~4 Vol-% an (von ~20 auf ~24 Vol-%).
 Vertiefte / beschleunigte Atmung (bei körperlicher Ruhe) bedeutet Hyperventilation, also vermehrte Abatmung von CO2
und Hypokapnie. Die Folge ist eine Bremsung des Atemantriebs während
der Tauchphase - man bemerkt erst sehr spät (wenn sich wieder genügend
CO2 rückstaut, um die Atmung anzuregen) den "Lufthunger", der zum Auftauchen zwingt, manchmal zu spät (Bewusstlosigkeit unter Wasser).
Vertiefte / beschleunigte Atmung (bei körperlicher Ruhe) bedeutet Hyperventilation, also vermehrte Abatmung von CO2
und Hypokapnie. Die Folge ist eine Bremsung des Atemantriebs während
der Tauchphase - man bemerkt erst sehr spät (wenn sich wieder genügend
CO2 rückstaut, um die Atmung anzuregen) den "Lufthunger", der zum Auftauchen zwingt, manchmal zu spät (Bewusstlosigkeit unter Wasser).
Hyperventilation vor dem Tauchgang reduziert den Atemantrieb
|
Beim
Freitauchen (kurzes Abtauchen unter Wasser) oder Sättigungstauchen (längere Tauchphasen mit Tauchgerät) setzt man sich steigendem
Umgebungsdruck
aus. Das heißt, der hydrostatische Druck in 1 m Wassertiefe beträgt
bereits 10 kPa - mehr, als die Inspirationsmuskulatur überwinden
könnte. (Die Schwankungen des intrapulmonalen Drucks bei normaler
Atmung sind geringer als 1 kPa.)

 Abbildung: Sauerstoffanreicherung des Blutes als Funktion von Umgebungsdruck bzw. Sauerstoffpartialdruck
Abbildung: Sauerstoffanreicherung des Blutes als Funktion von Umgebungsdruck bzw. Sauerstoffpartialdruck
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Die physikalische Lösung des Sauerstoffs in Wasser (grüne Linie) steigt linear mit dem Partialdruck (Henry-Gesetz).
Die Bindung an das Hämoglobin (unter physiologischen Bedingungen ~70mal so stark, rote
Kurve) erfolgt entsprechend der Sauerstoffbindungskurve, ist also
bereits bei 1 atm Außendruck praktisch komplett.
Jede weitere
Drucksteigerung erhöht lediglich den physikalisch gelösten Anteil
(Gesamtmenge Sauerstoff im Blut: blaue Kurve).
Die Grenze zum toxischen Bereich gilt nur für kurze Aufenthaltsdauer;
bei längerem Verweilen in der Tiefe rückt sie nach links ( nächste
Abbildung)
nächste
Abbildung)

Aktives Einatmen ist ab ~1 Meter Wassertiefe nicht mehr möglich (Überlastung der Inspirationsmuskulatur)
|
Das
würde auch für Atmen über Luftschläuche gelten, die einfach eine
Verbindung zur Luft über Wasser herstellen (ohne Kompression); ein Schnorchel
ist so kurz (maximal 35 cm), dass der Thorax nur knapp unter die
Wasseroberfläche taucht und aktives Atmen druckmäßig noch gelingt.
Atmung während eines Tauchganges in tiefere Zonen erfolgt mittels Lungenautomat (regulator): Ein unter Druck stehendes Atemgas (Druckflaschen) wird über einen Atemregler auf den Umgebungsdruck gebracht und kann durch das Mundstück geatmet werden. Dieses Drucklufttauchgerät (SCUBA, self-contained underwater breathing apparatus)
ermöglicht das Atmen in verschiedenen Tiefen, indem es den Gasdruck
automatisch an den Umgebungsdruck angleicht. Die Atemmuskeln müssen nur
die Druckschwankungen generieren, die auch die normale Atmung antreiben.
Pro 10 Meter Tiefenzunahme steigt der Druck um eine
Atmosphäre (1 bar ~ 100 kPa). Dementsprechend nehmen auch die Gaspartialdrucke
in der (aus dem SCUBA-System geatmeten) Luft zu.
Beispielsweise beträgt der pO2 beim Atmen von Druckluft in 40 Meter Wassertiefe (Druckanstieg um 4 bar, Gesamtdruck 5 bar) 1 bar (Sauerstoffanteil 20%, 5 x 20 = 100%). Diesen Wert kann man für kurze Zeit ohne Schaden tolerieren (spätestens nach 4 Stunden beginnt bei pO2 = 100 kPa die Toxizität des Sauerstoffs zu wirken).
Das Problem der Dekompression ergibt sich - gewissermaßen umgekehrt wie beim Höhenaufstieg - nicht beim Abtauchen (zunehmende Tiefe), sondern beim Auftauchen.
Das Problem ist analog: Abnehmender Druck führt zur Gefahr der
Gasbläschenbildung in Gewebe und Körperflüssigkeiten (s. oben) und zur
"Caissonkrankheit".
Dabei spielt das Produkt aus Höhenunterschied und
Aufenthaltsdauer die entscheidende Rolle, denn je länger man dem
höheren Druck ausgesetzt war, desto intensiver ist die Sättigung der
Körperflüssigkeiten mit Gasen und umso stärker ist die Tendenz zur
Ausgasung bei Druckreduktion.
Eine entsprechende Linie im
Tiefen-Dauer-Diagramm zeigt die Grenze an, ab der beim Auftauchen
Zwischenstopps eingelegt werden müssen (schrittweise Dekompression,  Abbildung).
Abbildung).

 Abbildung: Toleranzzeit und Tauchtiefe
Abbildung: Toleranzzeit und Tauchtiefe
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Der "sichere" Bereich ist blau
dargestellt: Bis zu ~10 m Tauchtiefe bewirkt auch längerer Aufenthalt
keine kritische Anreicherung mit Gasen, Auftauchen ist ohne
Zwischenstopps gefahrlos möglich. Bei kurzer Aufenthaltsdauer (<30
min) gilt das auch für Tiefen bis zu 40 Meter.
Tauchmanöver in mehr als
10 Meter Tiefe für längere Dauer (hellrot)
bedürfen beim Wiederauftauchen definierter Zwischenstopps
(Dekompressionstabellen, computerassistiertes Zeitmanagement), um das
Auftreten von Gasblasen im Körper (Gasembolie, bends) zu vermeiden

Atmet man normale Luft auf Meereshöhe, beträgt der pO
2 der Inspirationsluft 21 kPa. Ein Sauerstoffanteil in der Atemluft von bis zu 50% (entsprechend einem pO
2
von 50 kPa auf Meereshöhe) gilt - bei erwachsenen Personen - als sicher
und hat auch bei längerer Anwendung keine schädliche Wirkung. Ein pO
2
von 100 kPa (Atmung von reinem Sauerstoff auf Meereshöhe) reduziert die
Lungenfunktionen innerhalb von etwa 24 Stunden; nach 48 Stunden können
Zeichen eines ARDS
(acute respiratory distress syndrome) auftreten. Je länger die Hyperoxie andauert, desto gravierender werden die Schäden.
Erhöhte pO
2-Werte können toxische Effekte auf den Körper haben (vgl.
dort), zunehmend mit der Einwirkungsdauer. Das kann alle Gewebe betreffen, insbesondere aber
 das ZNS: Atmen von hyperbarem Sauerstoff kann zu Krämpfen und Bewusstlosigkeit führen (Paul Bert-Effekt
das ZNS: Atmen von hyperbarem Sauerstoff kann zu Krämpfen und Bewusstlosigkeit führen (Paul Bert-Effekt  )
)
 die Lungen:
Hyperbarer Sauerstoff wirkt toxisch auf die Lungen - ausgehend von den
großen Luftwegen, breitet sich eine Entzündung in die Lunge hinein aus
(Lorraine Smith-Effekt)
die Lungen:
Hyperbarer Sauerstoff wirkt toxisch auf die Lungen - ausgehend von den
großen Luftwegen, breitet sich eine Entzündung in die Lunge hinein aus
(Lorraine Smith-Effekt)
 die Netzhaut:
Behandlung Frühgeborener mit Anreicherung von Sauerstoff in der
Atemluft (Brutkästen) führte früher zu bindegewebigen Veränderungen im
Auge (retrolentale Fibroplasie)
die Netzhaut:
Behandlung Frühgeborener mit Anreicherung von Sauerstoff in der
Atemluft (Brutkästen) führte früher zu bindegewebigen Veränderungen im
Auge (retrolentale Fibroplasie)
Mit zunehmendem pO
2
werden die
Toleranzzeiten wegen der Reaktionsfreudigkeit
des Sauerstoffs (Sauerstoffradikale, Lungenentzündung) immer kürzer (Überforderung
der Entgiftungsmechanismen).
Bei tage- oder wochenlangem Aufenthalt in Unterwasserlabors
mit Druckausgleich (freie Ausstiegsmöglichkeit) muss der
Sauerstoffanteil im Atemgasgemisch gesenkt werden: Z.B. in 40 m Tiefe
auf ein Fünftel
des in der Luft herrschenden Wertes (4 Vol-%), um einen normalen
Sauerstoffpartialdruck der Atemluft (~20 kPa) einzustellen.
Veränderter Atemgasdruck (Tauchmedizin, hyperbare Chirurgie, Flug- und
Raumfahrtphysiologie) erfordert also - zumindest über längere Zeit - eine
Anpassung des verwendeten Gasgemisches. Sauerstoff muss in einem
physiologisch verträglichen Partialdruckbereich angeboten werden.
Tauchreflex
Beim Tauchen (Kopf unter Wasser) tritt reflektorisch ein Reflexmuster auf, das als Tauchreflex (diving response)
bezeichnet wird. Es besteht aus drei Komponenten:
 Apnoe,
Apnoe,
 starke
Bradykardie (bei Robben bis <10 bpm,
starke
Bradykardie (bei Robben bis <10 bpm,  Abbildung) und
Abbildung) und
 periphere Vasokonstriktion (starke Reduktion der Durchblutung mit Ausnahme des Gehirns).
periphere Vasokonstriktion (starke Reduktion der Durchblutung mit Ausnahme des Gehirns).

 Abbildung: Tauchreflex bei Weddellrobben
Abbildung: Tauchreflex bei Weddellrobben
Nach einer Vorlage in
Butler / Brown / Stephenson / Speakman, Animal Physiology - An
Environmental Perspective, Oxford University Press 2021, basierend auf
Daten bei Butler PJ, Jones DR: Physiology of diving birds and mammals. Physiol Rev 1997; 77: 837-99
Oben:
Durchschnittliche Reaktionsmuster der Herzfrequenz bei vier Tieren.
Ausgehend von etwa 60 Schlägen pro Minute sinkt die Schlagfrequenz
während Minuten 10-20 auf Werte unter 10 bpm ab.
Unten: Laktatwerte (Blutplasma)
bei 6 Tieren. Während dieser in der Submersionsphase im Schnitt nicht
über 2 mM betragen (geringe Durchblutung aller Organs mit Ausnahme des
Gehirns), nehmen sie anschließend auf Werte über 6 mM zu (starke
postischämische Perfusion mit Ausschwemmung des angesammelten Laktats
aus den Geweben).
Die Submersionsphase dauert jeweils 20 Minuten.
Beim Menschen sind die hämodynamischen und metabolischen Veränderungen
weniger stark ausgeprägt als bei Robben (die routinemäßig tauchen) -
aber das Reaktionsmuster entspricht dem bei den Tieren beobachteten

Der Zweck dieses
Reaktionsmusters ist offensichtlich: Der Atemantrieb wird unterdrückt,
das Herz geht auf Schongang (ausgeprägte Bradykardie), der Blutdruck wird durch Verengung der
Widerstandgefäße stabilisiert. Der Sauerstoffverbrauch wird zugunsten
des Gehirns reduziert (während alle anderen Organe / Gewebe eine deutliche Reduktion ihrer Durchblutung erfahren, bleibt die zerebrale Perfusion praktisch unbeeinträchtigt).
Der Laktatspiegel steigt in der Apnoephase nur langsam, nach Ende der
Submersion stark an und kann dann mehr als eine Stunde lang erhöht
bleiben.
Ausgelöst wird der Reflex durch Kontakt der Gesichtshaut mit (insbesondere kaltem) Wasser, insbesondere in der Periorbital- und Nasenregion (Trigeminusäste).
Reflexbradykardie kann auch durch Benetzung des Gesichts - ohne
Untertauchen des Körpers - ausgelöst werden. Dabei kontrahieren
Widerstandgefäße in Haut und Muskulatur. Der Blutdruck bleibt wegen der
intensiven Vasokonstriktion trotz der Bradykardie stabil.
Mit zunehmender Dauer eines Tauchganges
sammeln sich im Kreislauf Laktat und andere saure Valenzen an;
arterielle Chemorezeptoren intensivieren die Komponenten des
Tauchreflexes, bis Sauerstoffmangel dann normalerweise das Auftauchen erzwingt.

Begleitgase
Begleitgase müssen bestimmte Eigenschaften haben: Nicht entflammbar
(inert), geringe Toxizität (der narkotische Faktor ist ein
Vergleichsmaß zu den Auswirkungen von Stickstoff, dessen NF als 1,0
angesetzt wird), geringe Dichte, akzeptable Diffusions- und
Schwingungseigenschaften (und leistbarer Preis).

 Abbildung:
Atemgasmischungen und inerte Begleitgase (Tauchsport) -
Vor- und Nachteile
Abbildung:
Atemgasmischungen und inerte Begleitgase (Tauchsport) -
Vor- und Nachteile
Stickstoff dient bezüglich der zentralnervösen Wirkung als Referenz
(narkotischer Faktor NF = 1). Je niedriger der NF eines Begleitgases ist,
desto höhere Partialdrucke dieses Gases sind tolerierbar. So hat Helium
einen NF von 0,23 - deshalb beträgt die maximale Tauchtiefe (Heliox = O2-He-Gemisch)
etwa 200 Meter, während man mit Pressluft (1/5 O2, 4/5 N2) nur ≤50 Meter tief tauchen
kann. Nachteile anderer Begleitgase schränken deren Verwendbarkeit ein
Argon  , Krypton
, Krypton  , Xenon
, Xenon 

Warum ein Begleitgas? Weil reiner Sauerstoff explosionsartig verbrennen kann (Apollo-1-Katastrophe).
Außerdem muss mit zunehmendem Gesamtdruck (Tauchtiefe) ein steigender
Prozentsatz Begleitgas zugemischt werden, um bei physiologischem
Sauerstoff-Partialdruck (~20
kPa) einen ausreichenden Gesamtdruck zu erzielen. Beträgt der
Gesamtdruck z.B. 10 atm (1000 kPa), muss das Atemgas zu 98% aus Begleitgas bestehen (980 kPa), um einen physiologischen Sauerstoff-Partialdruck von 20 kPa zu erzielen.
Der Wasserdruck steigt pro m Tiefe um 10 kPa. Beispiel: Längerer
Aufenthalt in 200 m ... Gesamtdruck ("Sättigungstauchen") 2100 kPa (21
atm) ... Gasmischung (Heliox) ca. 1% Sauerstoff und 99% Helium  .
Atmung von reinem Sauerstoff ist sinnvoll, wenn
.
Atmung von reinem Sauerstoff ist sinnvoll, wenn
 der Gesamtdruck niedrig ist (z.B. Flug ohne Druckausgleich in größerer Höhe)
der Gesamtdruck niedrig ist (z.B. Flug ohne Druckausgleich in größerer Höhe)
 ein Diffusionshindernis (Alveolarödem, Fibrose,..) in der Lunge vorliegt und das Hämoglobin sonst nicht ausreichend O2-gesättigt werden kann.
ein Diffusionshindernis (Alveolarödem, Fibrose,..) in der Lunge vorliegt und das Hämoglobin sonst nicht ausreichend O2-gesättigt werden kann.

 Abbildung: Wirkungen des CO2-Anteils (Vol-% bei 1 bar Luftdruck) der Einatemluft
Abbildung: Wirkungen des CO2-Anteils (Vol-% bei 1 bar Luftdruck) der Einatemluft
Beträgt z.B. der Druck 5 bar (wie in 40 m Wassertiefe), treten die
entsprechenden Symptome bei 1/5 des angegebenen Vol-%-Wertes für CO2 auf.
Ausatemluft enthält etwa 5 Vol-% CO2 (gelbes Feld). Hyperkapnie = arterieller pCO2>45 mmHg
 Kohlendioxid (CO2) darf sich im Atemsystem nicht anreichern; es hat stark atemantreibende Wirkung (bis ~70 mmHg pCO2), bei höheren Werten kommt es zu neurotoxischen Wirkungen, die zu
Verringerung des Atemantriebs führen (Symptome als Funktion des
Kohlendioxidanteils in der Atemluft s. >Tabelle).
Kohlendioxid (CO2) darf sich im Atemsystem nicht anreichern; es hat stark atemantreibende Wirkung (bis ~70 mmHg pCO2), bei höheren Werten kommt es zu neurotoxischen Wirkungen, die zu
Verringerung des Atemantriebs führen (Symptome als Funktion des
Kohlendioxidanteils in der Atemluft s. >Tabelle).
Daher wird CO2 durch chemische Bindung aus dem Atemgaskreislauf entfernt (carbon dioxide scrubber: z.B. Atemkalk, Lithiumhydroxid).
Kohlenmonoxid
Kohlenmonoxid (CO)
bindet ~240-mal
stärker (~240-fache Affinität) an Hämoglobin (normales HbA) als O2
(unterschiedliche Affinitätswerte abhängig von Hämoglobinvariante,
Spezies, allfälligen Mutationen) und blockiert damit den
Sauerstofftransport. Es entsteht Carboxyhämoglobin
(HbCO), wobei ein Anteil von unter 3% HbCO am gesamten
Hämoglobinbestand des Körpers als ungiftig gewertet wird. Die
Erdatmosphäre enthält 0,1 ppm CO, die Luft in geschlossenen Räumen
(Wohnung) typischerweise bis zu 5 ppm. In städtischen Ballungsräumen
kann der Anteil 100 ppm deutlich übersteigen. Bei diesem Wert liegen
z.B. bei Exposition für 10 Minuten knappe 1,5% des Hämoglobins als HbCO
vor, nach 100 Minuten etwa 5%, nach 5 Stunden über 10%.
 Bei der
Befüllung von Druckluftflaschen mit Umgebungsluft kann es vorkommen,
dass Kohlenmonoxid (z.B. aus Abgasen) unbemerkt mit angesaugt wird und
dann bei Atmung der komprimierten Luft zu CO-Vergiftung führt.
Bei der
Befüllung von Druckluftflaschen mit Umgebungsluft kann es vorkommen,
dass Kohlenmonoxid (z.B. aus Abgasen) unbemerkt mit angesaugt wird und
dann bei Atmung der komprimierten Luft zu CO-Vergiftung führt.

 Abbildung:
Symptome der Kohlenmonoxidvergiftung in Abhängigkeit von Konzentration
(bei 1 bar Gesamtdruck) und Hämoglobinbindung (% der
Häm-Bindungsstellen)
Abbildung:
Symptome der Kohlenmonoxidvergiftung in Abhängigkeit von Konzentration
(bei 1 bar Gesamtdruck) und Hämoglobinbindung (% der
Häm-Bindungsstellen)
ppm
= parts per million (10.000 ppm = 1 Volumenprozent). Bewußtlosigkeit
tritt bereits auf, wenn das Atemgas ~0,3 Vol-% CO enthält
 Kohlenmonoxidvergiftung
verursacht Kopfschmerz, Schwächegefühl, Schmerz in der Brust und
Verwirrung, bei höherer Dosierung Herzrhythmusstörungen,
Bewusstlosigkeit, Krämpfe, und kann schließlich zum Tod führen. Je
länger eine Person einer Atemluft mit hohem pCO ausgesetzt ist, desto
höher wird der Anteil an HbCO im Blut. Ein Gleichgewicht mit konstanter
Sättigung tritt erst nach mehreren Stunden auf.
Kohlenmonoxidvergiftung
verursacht Kopfschmerz, Schwächegefühl, Schmerz in der Brust und
Verwirrung, bei höherer Dosierung Herzrhythmusstörungen,
Bewusstlosigkeit, Krämpfe, und kann schließlich zum Tod führen. Je
länger eine Person einer Atemluft mit hohem pCO ausgesetzt ist, desto
höher wird der Anteil an HbCO im Blut. Ein Gleichgewicht mit konstanter
Sättigung tritt erst nach mehreren Stunden auf.
Als gesundheitsgefährdend gelten generell CO-Werte ab 100 ppm (0,01 Vol-%); bei Atmung entsprechender Luft kann der Anteil HbCO bis über 10% des Hämoglonbinbestandes im Blut ansteigen. Ein pCO von 0,3 mm
Hg, entsprechend einem Atemluftanteil von nur 0,04 % (~400 ppm), kann bereits die Hälfte des Hämoglobins für den Sauerstofftransport (50% HbCO) blockieren.
Mechanismus der CO-Vergiftung: Kohlenmonoxid bindet an die reduzierte Form von Eisen (Fe2+) in der Cytochrom-a3-Komponente des Kompolex IV der Atmungskette ( s. dort). So verhindert CO die Reduktion von Sauerstoff (den finalen Schritt in der Atmungskette) und reduziert sowohl den O2-Verbrauch als auch die Produktion von ATP (oxidative Phosphorylierung).
s. dort). So verhindert CO die Reduktion von Sauerstoff (den finalen Schritt in der Atmungskette) und reduziert sowohl den O2-Verbrauch als auch die Produktion von ATP (oxidative Phosphorylierung).
Als Therapie einer CO-Vergiftung bietet sich Sauerstoffbeatmung an, wenn mögich unter erhöhtem Druck (hyperbare Oxygenierung in einer Überdruckkammer).
Durch den erhöhten Sauerstoffpartialdruck verändert sich die
Bindungskonkurrenz am Hämoglobin zuungunsten des CO, und es kann wieder
mehr Sauerstoff an das Gewebe antransportiert werden. Für kurze Zeit
sind hohe Sauerstoffpartialdruckwerte ungefährlich, O2-Toxizität
tritt erst nach Stunden auf (je höher der Partialdruck, desto eher - 1
atm (100 kPa) reiner Sauerstoff kann für mindestens 12 Stunden
gefahrlos toleriert werden).


 Die Bindungskurve des Hämoglobins entscheidet über die Kapazität des
Blutes, Sauerstoff zu transportieren. Unter Bedingungen auf Meereshöhe
(und bei normalem Hämatokrit) ist der Anteil des an Hämoglobin
gebundenen 70-mal höher als der des physikalisch gelösten Sauerstoffs
im Kreislauf
Die Bindungskurve des Hämoglobins entscheidet über die Kapazität des
Blutes, Sauerstoff zu transportieren. Unter Bedingungen auf Meereshöhe
(und bei normalem Hämatokrit) ist der Anteil des an Hämoglobin
gebundenen 70-mal höher als der des physikalisch gelösten Sauerstoffs
im Kreislauf
 Der Luftdruck halbiert sich in ~5500 m Meereshöhe. Bei optimaler
Anpassung und Fitness ist ein vorübergehender Aufenthalt in Höhen bis
zu ~8800 m möglich (Mount Everest: 8848 m). Bei Atmen von reinem
Sauerstoff liegt die Obergrenze ohne Druckanzug bzw. Kapsel bei 13-14
km. In etwa 19 km Seehöhe liegt der barometrische Druck auf der Höhe
des Wasserdampfpartialdruckes (47 mmHg bei Körpertemperatur)
Der Luftdruck halbiert sich in ~5500 m Meereshöhe. Bei optimaler
Anpassung und Fitness ist ein vorübergehender Aufenthalt in Höhen bis
zu ~8800 m möglich (Mount Everest: 8848 m). Bei Atmen von reinem
Sauerstoff liegt die Obergrenze ohne Druckanzug bzw. Kapsel bei 13-14
km. In etwa 19 km Seehöhe liegt der barometrische Druck auf der Höhe
des Wasserdampfpartialdruckes (47 mmHg bei Körpertemperatur)
 Ab ~3000 m Höhenaufenthalt ist der alveoläre pO2 merklich reduziert. Hypoxiebedingt kommt es zu Hyperpnoe, diese verursacht Hypokapnie und respiratorische Alkalose. Als Kompensation sinkt die Pufferbasenkonzentration (negativer Base excess). In den Erythrozyten steigt [2,3-DPG] und verschiebt die O2-Bindungskurve des Hämoglobins nach rechts, was die Sauerstoffversorgung des Gewebes verbessert Ab ~3000 m Höhenaufenthalt ist der alveoläre pO2 merklich reduziert. Hypoxiebedingt kommt es zu Hyperpnoe, diese verursacht Hypokapnie und respiratorische Alkalose. Als Kompensation sinkt die Pufferbasenkonzentration (negativer Base excess). In den Erythrozyten steigt [2,3-DPG] und verschiebt die O2-Bindungskurve des Hämoglobins nach rechts, was die Sauerstoffversorgung des Gewebes verbessert
 Höhenanpassung ist längerfristig: Die initiale respiratorische Alkalose - vermehrte Abatmung von CO2 - wird innerhalb von einigen Tagen durch verstärkte renale Bicarbonatausscheidung kompensiert. Der pCO2
normalisiert sich, Atmung und Sauerstoffaufnahme sind nicht weiter
reprimiert. Auch steigt die Bildung von Erythropoetin, Hämoglobinmenge
und Sauerstofftransportkapazität des Blutes nehmen innerhalb einiger
Wochen deutlich zu Höhenanpassung ist längerfristig: Die initiale respiratorische Alkalose - vermehrte Abatmung von CO2 - wird innerhalb von einigen Tagen durch verstärkte renale Bicarbonatausscheidung kompensiert. Der pCO2
normalisiert sich, Atmung und Sauerstoffaufnahme sind nicht weiter
reprimiert. Auch steigt die Bildung von Erythropoetin, Hämoglobinmenge
und Sauerstofftransportkapazität des Blutes nehmen innerhalb einiger
Wochen deutlich zu
 Hypoxie senkt den Hepcidinspiegel und steigert dadurch die
Eisenverfügbarkeit (Hepcidin reduziert die Menge des Eisenexporters
Ferroportin, sodass mehr Eisen in Enterozyten und Makrophagen verbleibt
und der extrazelluläre Eisenspiegel sinkt)
Hypoxie senkt den Hepcidinspiegel und steigert dadurch die
Eisenverfügbarkeit (Hepcidin reduziert die Menge des Eisenexporters
Ferroportin, sodass mehr Eisen in Enterozyten und Makrophagen verbleibt
und der extrazelluläre Eisenspiegel sinkt)
 Reduziertes Sauerstoffangebot bewirkt Vasokonstriktion in der Lunge und
erhöht den pulmonalen Widerstand und Blutdruck. Flüssigkeitsaustritt
aus den Alveolarkapillaren ("Höhenödem") kann die Folge sein. Hypoxie
wirkt im Gehirn gefäßerweiternd steigert den intrakraniellen Druck,
Ödeme und Gefäßwandschäden
sind die Folge
Reduziertes Sauerstoffangebot bewirkt Vasokonstriktion in der Lunge und
erhöht den pulmonalen Widerstand und Blutdruck. Flüssigkeitsaustritt
aus den Alveolarkapillaren ("Höhenödem") kann die Folge sein. Hypoxie
wirkt im Gehirn gefäßerweiternd steigert den intrakraniellen Druck,
Ödeme und Gefäßwandschäden
sind die Folge
 Der hydrostatische Druck nimmt pro Meter Wassertiefe um 10 kPa zu.
Schnorchel sind kurz (≤35 cm), die Atmung kann die entsprechende
Druckbelastung von maximal 3,5 kPa überwinden. Ab etwa 1 m Wassertiefe
ist aktives Einatmen nicht mehr möglich
Der hydrostatische Druck nimmt pro Meter Wassertiefe um 10 kPa zu.
Schnorchel sind kurz (≤35 cm), die Atmung kann die entsprechende
Druckbelastung von maximal 3,5 kPa überwinden. Ab etwa 1 m Wassertiefe
ist aktives Einatmen nicht mehr möglich
 Drucklufttauchgeräte (SCUBA) gleichen den Gasdruck automatisch an den
Umgebungsdruck an und ermöglichen so das Atmen in unterschiedlichen
Tiefen. Limitierend sind die Partialdruckwerte der beteiligten Atemgase
(Sauerstoff und Begleitgase), z.B. beträgt bei Verwendung von Pressluft
der pN2 in 40 Meter Tiefe (5 bar Gesamtdruck) 4 bar oder 400
kPa (~80% der Luft besteht aus Stickstoff). Begleitgase wirken bei
hohem Partialdruck neurotoxisch
Drucklufttauchgeräte (SCUBA) gleichen den Gasdruck automatisch an den
Umgebungsdruck an und ermöglichen so das Atmen in unterschiedlichen
Tiefen. Limitierend sind die Partialdruckwerte der beteiligten Atemgase
(Sauerstoff und Begleitgase), z.B. beträgt bei Verwendung von Pressluft
der pN2 in 40 Meter Tiefe (5 bar Gesamtdruck) 4 bar oder 400
kPa (~80% der Luft besteht aus Stickstoff). Begleitgase wirken bei
hohem Partialdruck neurotoxisch
 Sauerstoff wirkt bei erhöhtem Partialdruck toxisch (Grenzwert z.B. 4 Stunden bei pO2 = 100 kPa) Sauerstoff wirkt bei erhöhtem Partialdruck toxisch (Grenzwert z.B. 4 Stunden bei pO2 = 100 kPa)
 Kohlendioxid (arteriell ~40 mmHg pCO2) wirkt atemantreibend (bis ~70 mmHg pCO2),
bei höheren Werten neurotoxisch; Bewusstlosigkeit tritt ab 15 Vol-% in
der Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend
früher Kohlendioxid (arteriell ~40 mmHg pCO2) wirkt atemantreibend (bis ~70 mmHg pCO2),
bei höheren Werten neurotoxisch; Bewusstlosigkeit tritt ab 15 Vol-% in
der Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend
früher
 Kohlenmonoxid bindet stark an Hämoglobin und blockiert dadurch den
Sauerstofftransport; Bewusstlosigkeit tritt ab 0,3 Vol-% in der
Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend früher
Kohlenmonoxid bindet stark an Hämoglobin und blockiert dadurch den
Sauerstofftransport; Bewusstlosigkeit tritt ab 0,3 Vol-% in der
Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend früher
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Argon: αργον = faul, untätig (reagiert nicht)
Argon: αργον = faul, untätig (reagiert nicht)




 Hypobarie / Höhenaufstieg
Hypobarie / Höhenaufstieg  Hyperbarie / Tauchen
Hyperbarie / Tauchen  Dekompression
Dekompression  Sauerstofftoxizität
Sauerstofftoxizität 

 CO2
CO2  CO
CO  Core messages
Core messages
 Abbildung:
Druck und Höhe / Tiefe
Abbildung:
Druck und Höhe / Tiefe
 (Höhenaufenthalt: Fliegen, Bergsteigen) oder hyperbaren
(Höhenaufenthalt: Fliegen, Bergsteigen) oder hyperbaren  Umständen (Tauchen, Tunnelbau, Druckkammer) ist
der richtige Sauerstoffanteil. Ist er zu hoch, wirkt Sauerstoff toxisch
(er ist sehr reaktionsfreudig); ist er zu niedrig, treten
Hypoxiesymptome und Gefahr des Erstickens auf.
Umständen (Tauchen, Tunnelbau, Druckkammer) ist
der richtige Sauerstoffanteil. Ist er zu hoch, wirkt Sauerstoff toxisch
(er ist sehr reaktionsfreudig); ist er zu niedrig, treten
Hypoxiesymptome und Gefahr des Erstickens auf.  Zur Anpassung an veränderte Atemgaspartialdrucke s. dort
Zur Anpassung an veränderte Atemgaspartialdrucke s. dort
 Abbildung: Luftdruck als Funktion der Meereshöhe
Abbildung: Luftdruck als Funktion der Meereshöhe
 Abbildung), am Gipfel des Mount
Everest (8849 m) ein Drittel (33-34 kPa, je nach Wetterlage). Der Sauerstoffmangel bedingt Hyperventilation
mit den damit verbundenen metabolischen Komplikationen (respiratorische
Alkalose, Bremsung des Atemantriebs durch die Hypokapnie). Daher hielt
man es
lange für ausgeschlossen, ohne Atemgerät (zusätzlicher Sauerstoff) auf
den höchsten Berg der Welt zu steigen (Mount Everest: Mittlerer pO2 der Atemluft etwa 6,6 kPa oder knapp über 50 mmHg).
Abbildung), am Gipfel des Mount
Everest (8849 m) ein Drittel (33-34 kPa, je nach Wetterlage). Der Sauerstoffmangel bedingt Hyperventilation
mit den damit verbundenen metabolischen Komplikationen (respiratorische
Alkalose, Bremsung des Atemantriebs durch die Hypokapnie). Daher hielt
man es
lange für ausgeschlossen, ohne Atemgerät (zusätzlicher Sauerstoff) auf
den höchsten Berg der Welt zu steigen (Mount Everest: Mittlerer pO2 der Atemluft etwa 6,6 kPa oder knapp über 50 mmHg).

 pO2 in der Inspirationsluft am Gipfel des Mt. Everest (8.849 m ü.M.): In dieser Höhe herrscht ein mittlerer Luftdruck von ca. 250 mmHg. 21% der Luft besteht aus Sauerstoff, der pO2 beträgt 52-53 mmHg. In der Lunge ist die Luft wasserdampfgesättigt (pH2O = 47 mmHg), für die übrigen Gase bleibt ein Druck von 250-47 - also 203 mmHg. Davon sind 21% (O2-Anteil in der Luft) knapp 43 mmHg. Bei diesem pO2
ist das Hämoglobin im arterialisierten Blut nur noch zu drei Viertel
gesättigt und der Sauerstofftransport zum Gewebe entsprechend reduziert
(normalerweise enthält das gemischt-venöse Blut - das in die Lungen
einströmt - bei körperlicher Ruhe ebenfalls zu drei Viertel mit
Sauerstoff gesättigtes Hämoglobin).
pO2 in der Inspirationsluft am Gipfel des Mt. Everest (8.849 m ü.M.): In dieser Höhe herrscht ein mittlerer Luftdruck von ca. 250 mmHg. 21% der Luft besteht aus Sauerstoff, der pO2 beträgt 52-53 mmHg. In der Lunge ist die Luft wasserdampfgesättigt (pH2O = 47 mmHg), für die übrigen Gase bleibt ein Druck von 250-47 - also 203 mmHg. Davon sind 21% (O2-Anteil in der Luft) knapp 43 mmHg. Bei diesem pO2
ist das Hämoglobin im arterialisierten Blut nur noch zu drei Viertel
gesättigt und der Sauerstofftransport zum Gewebe entsprechend reduziert
(normalerweise enthält das gemischt-venöse Blut - das in die Lungen
einströmt - bei körperlicher Ruhe ebenfalls zu drei Viertel mit
Sauerstoff gesättigtes Hämoglobin). 
 Abbildung: Zusammensetzung der Alveolarluft als Funktion von Höhe und Atemgas
Abbildung: Zusammensetzung der Alveolarluft als Funktion von Höhe und Atemgas
 Abbildung) und
das Tragen eines luftdichten "Astronautenanzugs" wird (bei längerer
Exponierung an die hier herrschenden hypobaren Druckwerte) notwendig.
Abbildung) und
das Tragen eines luftdichten "Astronautenanzugs" wird (bei längerer
Exponierung an die hier herrschenden hypobaren Druckwerte) notwendig. Abbildung:):
Abbildung:): 
 Abbildung: Sauerstoffsättigung vs. Höhe
Abbildung: Sauerstoffsättigung vs. Höhe



 Normalisierung der zunächst auftretenden respiratorischen Alkalose (vermehrter CO2-Verlust, dadurch hypokapniebedingte Atemdrosselung) durch vermehrte Bicarbonatausscheidung
der Nieren ("metabolische Kompensation"). Dadurch wird die
Atemdrosselung wieder aufgehoben, es kann mehr Sauerstoff geatmet
werden. Dieser Mechanismus tritt innerhalb einiger Tage in Kraft
Normalisierung der zunächst auftretenden respiratorischen Alkalose (vermehrter CO2-Verlust, dadurch hypokapniebedingte Atemdrosselung) durch vermehrte Bicarbonatausscheidung
der Nieren ("metabolische Kompensation"). Dadurch wird die
Atemdrosselung wieder aufgehoben, es kann mehr Sauerstoff geatmet
werden. Dieser Mechanismus tritt innerhalb einiger Tage in Kraft Über längere Zeiträume steigt die Ausschüttung von Erythropoetin, dadurch steigt die Sauerstofftransportkapazität des Blutes (erhöhtes Hämoglobin, gesteigerter Hämatokrit)
Über längere Zeiträume steigt die Ausschüttung von Erythropoetin, dadurch steigt die Sauerstofftransportkapazität des Blutes (erhöhtes Hämoglobin, gesteigerter Hämatokrit) Einen wesentlichen Beitrag zur Höhenakklimatisierung liefert der Eisenstoffwechsel. Transferrin
versorgt die Erythropoese mit Eisen; es ist normalerweise zu 15-45%
eisengesättigt (d.h. mehr als die Hälfte der verfügbaren
Bindungsstellen ist unbesetzt). Dieser Prozentsatz wird durch das Hepcidin / Ferroportin-System
reguliert: Das aus der Leber stammende Hepcidin kontrolliert
Eisenaufnahme und die Eisenfreisetzung aus Makrophagen.
Zielmolekül des Hepcidins ist der Eisenexporter Ferroportin,
dessen Endozytose und Abbau es befördert. Auf diese Weise sorgt
Hepcidin dafür, dass Eisen in der Zelle (Enterozyt, Makrophage)
verbleibt, und senkt den extrazellulären Eisenspiegel.
Einen wesentlichen Beitrag zur Höhenakklimatisierung liefert der Eisenstoffwechsel. Transferrin
versorgt die Erythropoese mit Eisen; es ist normalerweise zu 15-45%
eisengesättigt (d.h. mehr als die Hälfte der verfügbaren
Bindungsstellen ist unbesetzt). Dieser Prozentsatz wird durch das Hepcidin / Ferroportin-System
reguliert: Das aus der Leber stammende Hepcidin kontrolliert
Eisenaufnahme und die Eisenfreisetzung aus Makrophagen.
Zielmolekül des Hepcidins ist der Eisenexporter Ferroportin,
dessen Endozytose und Abbau es befördert. Auf diese Weise sorgt
Hepcidin dafür, dass Eisen in der Zelle (Enterozyt, Makrophage)
verbleibt, und senkt den extrazellulären Eisenspiegel. 
 Abbildung: Rolle des Eisens für die Sauerstoff- Homöostase
Abbildung: Rolle des Eisens für die Sauerstoff- Homöostase
 Einerseits nimmt die Ruhefrequenz von etwa 60/min auf Meereshöhe hypoxiebedingt auf ~90/min auf 8000 m Höhe zu (das Schlagvolumen nimmt leicht ab);
Einerseits nimmt die Ruhefrequenz von etwa 60/min auf Meereshöhe hypoxiebedingt auf ~90/min auf 8000 m Höhe zu (das Schlagvolumen nimmt leicht ab); andererseits sinkt die maximale Herzfrequenz
bei längerem Höhenaufenthalt (nicht bei akuter Hypoxie!) von etwa
190/min auf Meereshöhe auf ~130/min auf 8000 m Höhe ab. Der Vorteil ist
eine kardioprotektive Wirkung, vermutlich bedingt durch
Herunterregulierung der ß-Rezeptoren in Folge chronisch erhöhter
Katecholaminwerte im Extrazellulärraum.
andererseits sinkt die maximale Herzfrequenz
bei längerem Höhenaufenthalt (nicht bei akuter Hypoxie!) von etwa
190/min auf Meereshöhe auf ~130/min auf 8000 m Höhe ab. Der Vorteil ist
eine kardioprotektive Wirkung, vermutlich bedingt durch
Herunterregulierung der ß-Rezeptoren in Folge chronisch erhöhter
Katecholaminwerte im Extrazellulärraum. 
 Abbildung: Neurokognitive Beeinträchtigungen mit akut zunehmender Höhe
Abbildung: Neurokognitive Beeinträchtigungen mit akut zunehmender Höhe 

 Abbildung).
Abbildung).
 Abbildung: Mechanismen, die an der Erhöhung des intrakraniellen Drucks bei Hypoxie beteiligt sind / sein dürften
Abbildung: Mechanismen, die an der Erhöhung des intrakraniellen Drucks bei Hypoxie beteiligt sind / sein dürften ICP, Intrakranieller Druck (=Hirndruck)
ICP, Intrakranieller Druck (=Hirndruck)  VEGF, Vascular Endothelial Growth Factor
VEGF, Vascular Endothelial Growth Factor
 bei
rascher Zunahme der Höhe und entsprechender Abnahme des Umgebungsdrucks
(oder rascher Abnahme des Drucks in einer entsprechenden Druckkammer)
bei
rascher Zunahme der Höhe und entsprechender Abnahme des Umgebungsdrucks
(oder rascher Abnahme des Drucks in einer entsprechenden Druckkammer) beim
Auftauchen nach einem längeren hyperbaren Aufenthalt (Druckkammer,
Sättigungstauchen)
beim
Auftauchen nach einem längeren hyperbaren Aufenthalt (Druckkammer,
Sättigungstauchen) bei
Personen, die kurz nach
Sättigungstauchgängen einen Flug antreten (die "Kabinenhöhe" im
Flugzeug wird auf ~1800 m eingestellt, die arterielle
Sauerstoffsätigung beträgt hierbei übrigens nur noch knapp 80%)
bei
Personen, die kurz nach
Sättigungstauchgängen einen Flug antreten (die "Kabinenhöhe" im
Flugzeug wird auf ~1800 m eingestellt, die arterielle
Sauerstoffsätigung beträgt hierbei übrigens nur noch knapp 80%) beim
"Umsteigen" in einen "Soft suit"- Raumanzug (hier herrscht aus
technischen / praktischen Gründen ein geringerer Druck als im
Raumschiff).
beim
"Umsteigen" in einen "Soft suit"- Raumanzug (hier herrscht aus
technischen / praktischen Gründen ein geringerer Druck als im
Raumschiff).


 Viele
Menschen nehmen vor einem Freitauchgang mehrfach tief Luft, um
sich "mit Sauerstoff vollzupumpen". Dieses Verhalten ist nicht
zielführend, denn:
Viele
Menschen nehmen vor einem Freitauchgang mehrfach tief Luft, um
sich "mit Sauerstoff vollzupumpen". Dieses Verhalten ist nicht
zielführend, denn: Es gibt im Körper keinen nennenswerten Sauerstoffspeicher - das
Hämoglobin des arteriellen Blutes ist ohnehin vollständig
sauerstoffgesättigt, physikalisch gelöst lasst sich durch Erhöhung des
pO2 nur wenig zusätzlicher Sauerstoff in den Körperflüssigkeiten "zwischenspeichern". Auf Meereshöhe kann man bei einer erwachsenen Person etwa von folgenden Werten ausgehen:
Es gibt im Körper keinen nennenswerten Sauerstoffspeicher - das
Hämoglobin des arteriellen Blutes ist ohnehin vollständig
sauerstoffgesättigt, physikalisch gelöst lasst sich durch Erhöhung des
pO2 nur wenig zusätzlicher Sauerstoff in den Körperflüssigkeiten "zwischenspeichern". Auf Meereshöhe kann man bei einer erwachsenen Person etwa von folgenden Werten ausgehen: 5 l Blut (arteriell 20 Vol-%, venös ≤15 Vol-%) enthalten etwa 850 ml O2
5 l Blut (arteriell 20 Vol-%, venös ≤15 Vol-%) enthalten etwa 850 ml O2 An das Myoglobin in der Muskulatur sind ca. 250 ml O2 gebunden
An das Myoglobin in der Muskulatur sind ca. 250 ml O2 gebunden In der Lunge befinden sich ungefähr 400-500 ml O2
In der Lunge befinden sich ungefähr 400-500 ml O2 Unter normalen Umgebungsbedingungen (100 kPa Gesamtdruck) sind 98,6 %
des Sauerstoffs (etwa 20 Vol-%) im arteriellen Blut an Hämoglobin
angelagert; nur 1,4% (<0,3 Vol-%) liegen physikalisch gelöst vor (
Unter normalen Umgebungsbedingungen (100 kPa Gesamtdruck) sind 98,6 %
des Sauerstoffs (etwa 20 Vol-%) im arteriellen Blut an Hämoglobin
angelagert; nur 1,4% (<0,3 Vol-%) liegen physikalisch gelöst vor ( s. dort). Dieser gelöste O2-Anteil
nimmt mit zunehmendem Umgebungsdruck zu: Bei einer Verdoppelung des
Drucks (10 m Tiefe bei Freitauchen oder SCUBA-Tauchen) auf knapp 0,6
Vol-%; bei einer Verzehnfachung des Drucks (90 m Tiefe) steigt der
Sauerstoffgehalt des Blutes um ~4 Vol-% an (von ~20 auf ~24 Vol-%).
s. dort). Dieser gelöste O2-Anteil
nimmt mit zunehmendem Umgebungsdruck zu: Bei einer Verdoppelung des
Drucks (10 m Tiefe bei Freitauchen oder SCUBA-Tauchen) auf knapp 0,6
Vol-%; bei einer Verzehnfachung des Drucks (90 m Tiefe) steigt der
Sauerstoffgehalt des Blutes um ~4 Vol-% an (von ~20 auf ~24 Vol-%).  Vertiefte / beschleunigte Atmung (bei körperlicher Ruhe) bedeutet Hyperventilation, also vermehrte Abatmung von CO2
und Hypokapnie. Die Folge ist eine Bremsung des Atemantriebs während
der Tauchphase - man bemerkt erst sehr spät (wenn sich wieder genügend
CO2 rückstaut, um die Atmung anzuregen) den "Lufthunger", der zum Auftauchen zwingt, manchmal zu spät (Bewusstlosigkeit unter Wasser).
Vertiefte / beschleunigte Atmung (bei körperlicher Ruhe) bedeutet Hyperventilation, also vermehrte Abatmung von CO2
und Hypokapnie. Die Folge ist eine Bremsung des Atemantriebs während
der Tauchphase - man bemerkt erst sehr spät (wenn sich wieder genügend
CO2 rückstaut, um die Atmung anzuregen) den "Lufthunger", der zum Auftauchen zwingt, manchmal zu spät (Bewusstlosigkeit unter Wasser).
 Abbildung: Sauerstoffanreicherung des Blutes als Funktion von Umgebungsdruck bzw. Sauerstoffpartialdruck
Abbildung: Sauerstoffanreicherung des Blutes als Funktion von Umgebungsdruck bzw. Sauerstoffpartialdruck nächste
Abbildung)
nächste
Abbildung)

 Abbildung).
Abbildung).
 Abbildung: Toleranzzeit und Tauchtiefe
Abbildung: Toleranzzeit und Tauchtiefe
 das ZNS: Atmen von hyperbarem Sauerstoff kann zu Krämpfen und Bewusstlosigkeit führen (Paul Bert-Effekt
das ZNS: Atmen von hyperbarem Sauerstoff kann zu Krämpfen und Bewusstlosigkeit führen (Paul Bert-Effekt  )
) die Lungen:
Hyperbarer Sauerstoff wirkt toxisch auf die Lungen - ausgehend von den
großen Luftwegen, breitet sich eine Entzündung in die Lunge hinein aus
(Lorraine Smith-Effekt)
die Lungen:
Hyperbarer Sauerstoff wirkt toxisch auf die Lungen - ausgehend von den
großen Luftwegen, breitet sich eine Entzündung in die Lunge hinein aus
(Lorraine Smith-Effekt) die Netzhaut:
Behandlung Frühgeborener mit Anreicherung von Sauerstoff in der
Atemluft (Brutkästen) führte früher zu bindegewebigen Veränderungen im
Auge (retrolentale Fibroplasie)
die Netzhaut:
Behandlung Frühgeborener mit Anreicherung von Sauerstoff in der
Atemluft (Brutkästen) führte früher zu bindegewebigen Veränderungen im
Auge (retrolentale Fibroplasie) Apnoe,
Apnoe,  starke
Bradykardie (bei Robben bis <10 bpm,
starke
Bradykardie (bei Robben bis <10 bpm,  Abbildung) und
Abbildung) und  periphere Vasokonstriktion (starke Reduktion der Durchblutung mit Ausnahme des Gehirns).
periphere Vasokonstriktion (starke Reduktion der Durchblutung mit Ausnahme des Gehirns). 
 Abbildung: Tauchreflex bei Weddellrobben
Abbildung: Tauchreflex bei Weddellrobben


 Abbildung:
Atemgasmischungen und inerte Begleitgase (Tauchsport) -
Vor- und Nachteile
Abbildung:
Atemgasmischungen und inerte Begleitgase (Tauchsport) -
Vor- und Nachteile , Krypton
, Krypton  , Xenon
, Xenon 

 .
. der Gesamtdruck niedrig ist (z.B. Flug ohne Druckausgleich in größerer Höhe)
der Gesamtdruck niedrig ist (z.B. Flug ohne Druckausgleich in größerer Höhe) ein Diffusionshindernis (Alveolarödem, Fibrose,..) in der Lunge vorliegt und das Hämoglobin sonst nicht ausreichend O2-gesättigt werden kann.
ein Diffusionshindernis (Alveolarödem, Fibrose,..) in der Lunge vorliegt und das Hämoglobin sonst nicht ausreichend O2-gesättigt werden kann. 
 Abbildung: Wirkungen des CO2-Anteils (Vol-% bei 1 bar Luftdruck) der Einatemluft
Abbildung: Wirkungen des CO2-Anteils (Vol-% bei 1 bar Luftdruck) der Einatemluft Kohlendioxid (CO2) darf sich im Atemsystem nicht anreichern; es hat stark atemantreibende Wirkung (bis ~70 mmHg pCO2), bei höheren Werten kommt es zu neurotoxischen Wirkungen, die zu
Verringerung des Atemantriebs führen (Symptome als Funktion des
Kohlendioxidanteils in der Atemluft s. >Tabelle).
Kohlendioxid (CO2) darf sich im Atemsystem nicht anreichern; es hat stark atemantreibende Wirkung (bis ~70 mmHg pCO2), bei höheren Werten kommt es zu neurotoxischen Wirkungen, die zu
Verringerung des Atemantriebs führen (Symptome als Funktion des
Kohlendioxidanteils in der Atemluft s. >Tabelle).  Bei der
Befüllung von Druckluftflaschen mit Umgebungsluft kann es vorkommen,
dass Kohlenmonoxid (z.B. aus Abgasen) unbemerkt mit angesaugt wird und
dann bei Atmung der komprimierten Luft zu CO-Vergiftung führt.
Bei der
Befüllung von Druckluftflaschen mit Umgebungsluft kann es vorkommen,
dass Kohlenmonoxid (z.B. aus Abgasen) unbemerkt mit angesaugt wird und
dann bei Atmung der komprimierten Luft zu CO-Vergiftung führt.
 Abbildung:
Symptome der Kohlenmonoxidvergiftung in Abhängigkeit von Konzentration
(bei 1 bar Gesamtdruck) und Hämoglobinbindung (% der
Häm-Bindungsstellen)
Abbildung:
Symptome der Kohlenmonoxidvergiftung in Abhängigkeit von Konzentration
(bei 1 bar Gesamtdruck) und Hämoglobinbindung (% der
Häm-Bindungsstellen)
 s. dort). So verhindert CO die Reduktion von Sauerstoff (den finalen Schritt in der Atmungskette) und reduziert sowohl den O2-Verbrauch als auch die Produktion von ATP (oxidative Phosphorylierung).
s. dort). So verhindert CO die Reduktion von Sauerstoff (den finalen Schritt in der Atmungskette) und reduziert sowohl den O2-Verbrauch als auch die Produktion von ATP (oxidative Phosphorylierung).
 Die Bindungskurve des Hämoglobins entscheidet über die Kapazität des
Blutes, Sauerstoff zu transportieren. Unter Bedingungen auf Meereshöhe
(und bei normalem Hämatokrit) ist der Anteil des an Hämoglobin
gebundenen 70-mal höher als der des physikalisch gelösten Sauerstoffs
im Kreislauf
Die Bindungskurve des Hämoglobins entscheidet über die Kapazität des
Blutes, Sauerstoff zu transportieren. Unter Bedingungen auf Meereshöhe
(und bei normalem Hämatokrit) ist der Anteil des an Hämoglobin
gebundenen 70-mal höher als der des physikalisch gelösten Sauerstoffs
im Kreislauf Der Luftdruck halbiert sich in ~5500 m Meereshöhe. Bei optimaler
Anpassung und Fitness ist ein vorübergehender Aufenthalt in Höhen bis
zu ~8800 m möglich (Mount Everest: 8848 m). Bei Atmen von reinem
Sauerstoff liegt die Obergrenze ohne Druckanzug bzw. Kapsel bei 13-14
km. In etwa 19 km Seehöhe liegt der barometrische Druck auf der Höhe
des Wasserdampfpartialdruckes (47 mmHg bei Körpertemperatur)
Der Luftdruck halbiert sich in ~5500 m Meereshöhe. Bei optimaler
Anpassung und Fitness ist ein vorübergehender Aufenthalt in Höhen bis
zu ~8800 m möglich (Mount Everest: 8848 m). Bei Atmen von reinem
Sauerstoff liegt die Obergrenze ohne Druckanzug bzw. Kapsel bei 13-14
km. In etwa 19 km Seehöhe liegt der barometrische Druck auf der Höhe
des Wasserdampfpartialdruckes (47 mmHg bei Körpertemperatur) Ab ~3000 m Höhenaufenthalt ist der alveoläre pO2 merklich reduziert. Hypoxiebedingt kommt es zu Hyperpnoe, diese verursacht Hypokapnie und respiratorische Alkalose. Als Kompensation sinkt die Pufferbasenkonzentration (negativer Base excess). In den Erythrozyten steigt [2,3-DPG] und verschiebt die O2-Bindungskurve des Hämoglobins nach rechts, was die Sauerstoffversorgung des Gewebes verbessert
Ab ~3000 m Höhenaufenthalt ist der alveoläre pO2 merklich reduziert. Hypoxiebedingt kommt es zu Hyperpnoe, diese verursacht Hypokapnie und respiratorische Alkalose. Als Kompensation sinkt die Pufferbasenkonzentration (negativer Base excess). In den Erythrozyten steigt [2,3-DPG] und verschiebt die O2-Bindungskurve des Hämoglobins nach rechts, was die Sauerstoffversorgung des Gewebes verbessert Höhenanpassung ist längerfristig: Die initiale respiratorische Alkalose - vermehrte Abatmung von CO2 - wird innerhalb von einigen Tagen durch verstärkte renale Bicarbonatausscheidung kompensiert. Der pCO2
normalisiert sich, Atmung und Sauerstoffaufnahme sind nicht weiter
reprimiert. Auch steigt die Bildung von Erythropoetin, Hämoglobinmenge
und Sauerstofftransportkapazität des Blutes nehmen innerhalb einiger
Wochen deutlich zu
Höhenanpassung ist längerfristig: Die initiale respiratorische Alkalose - vermehrte Abatmung von CO2 - wird innerhalb von einigen Tagen durch verstärkte renale Bicarbonatausscheidung kompensiert. Der pCO2
normalisiert sich, Atmung und Sauerstoffaufnahme sind nicht weiter
reprimiert. Auch steigt die Bildung von Erythropoetin, Hämoglobinmenge
und Sauerstofftransportkapazität des Blutes nehmen innerhalb einiger
Wochen deutlich zu Hypoxie senkt den Hepcidinspiegel und steigert dadurch die
Eisenverfügbarkeit (Hepcidin reduziert die Menge des Eisenexporters
Ferroportin, sodass mehr Eisen in Enterozyten und Makrophagen verbleibt
und der extrazelluläre Eisenspiegel sinkt)
Hypoxie senkt den Hepcidinspiegel und steigert dadurch die
Eisenverfügbarkeit (Hepcidin reduziert die Menge des Eisenexporters
Ferroportin, sodass mehr Eisen in Enterozyten und Makrophagen verbleibt
und der extrazelluläre Eisenspiegel sinkt) Reduziertes Sauerstoffangebot bewirkt Vasokonstriktion in der Lunge und
erhöht den pulmonalen Widerstand und Blutdruck. Flüssigkeitsaustritt
aus den Alveolarkapillaren ("Höhenödem") kann die Folge sein. Hypoxie
wirkt im Gehirn gefäßerweiternd steigert den intrakraniellen Druck,
Ödeme und Gefäßwandschäden
sind die Folge
Reduziertes Sauerstoffangebot bewirkt Vasokonstriktion in der Lunge und
erhöht den pulmonalen Widerstand und Blutdruck. Flüssigkeitsaustritt
aus den Alveolarkapillaren ("Höhenödem") kann die Folge sein. Hypoxie
wirkt im Gehirn gefäßerweiternd steigert den intrakraniellen Druck,
Ödeme und Gefäßwandschäden
sind die Folge Der hydrostatische Druck nimmt pro Meter Wassertiefe um 10 kPa zu.
Schnorchel sind kurz (≤35 cm), die Atmung kann die entsprechende
Druckbelastung von maximal 3,5 kPa überwinden. Ab etwa 1 m Wassertiefe
ist aktives Einatmen nicht mehr möglich
Der hydrostatische Druck nimmt pro Meter Wassertiefe um 10 kPa zu.
Schnorchel sind kurz (≤35 cm), die Atmung kann die entsprechende
Druckbelastung von maximal 3,5 kPa überwinden. Ab etwa 1 m Wassertiefe
ist aktives Einatmen nicht mehr möglich Drucklufttauchgeräte (SCUBA) gleichen den Gasdruck automatisch an den
Umgebungsdruck an und ermöglichen so das Atmen in unterschiedlichen
Tiefen. Limitierend sind die Partialdruckwerte der beteiligten Atemgase
(Sauerstoff und Begleitgase), z.B. beträgt bei Verwendung von Pressluft
der pN2 in 40 Meter Tiefe (5 bar Gesamtdruck) 4 bar oder 400
kPa (~80% der Luft besteht aus Stickstoff). Begleitgase wirken bei
hohem Partialdruck neurotoxisch
Drucklufttauchgeräte (SCUBA) gleichen den Gasdruck automatisch an den
Umgebungsdruck an und ermöglichen so das Atmen in unterschiedlichen
Tiefen. Limitierend sind die Partialdruckwerte der beteiligten Atemgase
(Sauerstoff und Begleitgase), z.B. beträgt bei Verwendung von Pressluft
der pN2 in 40 Meter Tiefe (5 bar Gesamtdruck) 4 bar oder 400
kPa (~80% der Luft besteht aus Stickstoff). Begleitgase wirken bei
hohem Partialdruck neurotoxisch Sauerstoff wirkt bei erhöhtem Partialdruck toxisch (Grenzwert z.B. 4 Stunden bei pO2 = 100 kPa)
Sauerstoff wirkt bei erhöhtem Partialdruck toxisch (Grenzwert z.B. 4 Stunden bei pO2 = 100 kPa) Kohlendioxid (arteriell ~40 mmHg pCO2) wirkt atemantreibend (bis ~70 mmHg pCO2),
bei höheren Werten neurotoxisch; Bewusstlosigkeit tritt ab 15 Vol-% in
der Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend
früher
Kohlendioxid (arteriell ~40 mmHg pCO2) wirkt atemantreibend (bis ~70 mmHg pCO2),
bei höheren Werten neurotoxisch; Bewusstlosigkeit tritt ab 15 Vol-% in
der Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend
früher Kohlenmonoxid bindet stark an Hämoglobin und blockiert dadurch den
Sauerstofftransport; Bewusstlosigkeit tritt ab 0,3 Vol-% in der
Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend früher
Kohlenmonoxid bindet stark an Hämoglobin und blockiert dadurch den
Sauerstofftransport; Bewusstlosigkeit tritt ab 0,3 Vol-% in der
Atemluft unter 1 bar Druck ein, bei höheren Drucken entsprechend früher
