




 Energiestoffwechsel
des Nervengewebes (Hirnstoffwechsel)
Energiestoffwechsel
des Nervengewebes (Hirnstoffwechsel)
 Bayliss-Effekt: William Bayliss
Bayliss-Effekt: William Bayliss| Das Gehirn ist energieintensiv: Aus ~120 g Glucose täglich (fast
30% des Zuckerumsatzes des Körpers) bezieht es etwa 20% des
Ruhe-Energieumsatzes des gesamten Organismus. Dazu empfängt es mit rund
750 ml/min etwa 15% des Ruhe-Herzminutenvolumens und schöpft das
arterielle Sauerstoffangebot (~20 Volums%) zu einem Drittel aus
(arterio-venöse O2-Differenz 6-7 ml/100 ml Blut), sodass der Sauerstoffpartialdruck im Nervengewebe relativ hoch bleibt. Der Glucosetransporter GLUT3 ermöglicht den Übertritt des Blutzuckers durch die Blut-Hirn-Schranke zum Gewebe. In Hungerphasen kann das Gehirn auf Ketonkörper zurückgreifen, welche die Leber aus Fettsäuren synthetisiert. Im Durchschnitt beträgt der spezifische Sauerstoffverbrauch des Gehirns rund 4 ml/100 g/min, die spezifische Durchblutung rund 50 ml/100g/min. Die Perfusionswerte für graue Substanz (~100 ml/100g/min) liegen viermal höher als die der weißen Substanz (~25 ml/100g/min): In ersterer (substantia grisea) erfolgen Synthese- und Umbauprozesse der Nervenzellen; die Aufrechterhaltung des Ionenmilieus für die Leitung von Aktionspotentialen (substantia alba) ist weniger energieaufwendig. Insgesamt ist die zerebrale Perfusion ziemlich konstant, regional unterliegt sie funktionsabhängiger Umverteilung - je nach Belastungsmustern. Schwankungen der lokalen Glucoseverwertung können mittels PET nachgewiesen und mit spezifischen Mustern der Denkaktivität korreliert werden. Dass die Gehirndurchblutung trotz unterschiedlicher Blutdruckwerte (in einem Bereich zwischen etwa 50 und 150 mmHg) stabil bleibt, liegt an der zerebralen Autoregulation (bedingt durch den Bayliss-Effekt): Je stärker der Blutdruck Arteriolen dehnt, desto stärker kontrahieren sie - der Widerstand steigt, die Strömung bleibt nahezu unverändert. Erst bei sehr hohen Blutdruckwerten ist die Regulationsbreite ausgeschöpft, und die Durchblutung nimmt mit weiterer arterieller Drucksteigerung entsprechend zu. Auf Kohlendioxid reagieren die Hirngefäße intensiv: Steigender pCO2 dilatiert die zerebralen Arteriolen, die Durchblutung der entsprechenden Region steigt; sinkender pCO2 senkt sie (die Produktion von Energie und CO2 geht Hand in Hand). Er erklärt auch, warum Hyperventilation schwindlig macht (Hypokapnie → Vasokonstriktion → Perfusionsdrosselung). Absinken der Hirndurchblutung um mehr als 50% unter den Normalwert bringt Symptome der Unterversorgung (Schwindelgefühl). Das kann in eine Synkope münden: Plötzliche Bewusstlosigkeit - meist im Stehen, wegen der ungünstigen Druckverhältnisse im Kopf bei aufrechter Körperlage (hydrostatischer Druck nach oben abnehmend). Dieses Phänomen ist selbstlimitierend: Der Kollaps behebt das Problem (hydrostatischer Druck steigt, die Gehirndurchblutung normalisiert sich innerhalb von Sekunden). |
 Gehirndurchblutung
Gehirndurchblutung  Energieverbrauch
Energieverbrauch  Substratnutzung, Selfish-Brain-Theorie
Substratnutzung, Selfish-Brain-Theorie  Synkope, Belastung
Synkope, Belastung  Einflüsse auf zerebrale Perfusion und Substratutilisation
Einflüsse auf zerebrale Perfusion und Substratutilisation
 Gehirn und Hungerzustand
Gehirn und Hungerzustand
 Core messages
Core messages Glucose kann über GLUT3 in den Geweberaum übertreten, es ist der wichtigste Energiebringer für das ZNS;
Glucose kann über GLUT3 in den Geweberaum übertreten, es ist der wichtigste Energiebringer für das ZNS; Ketonkörper
Ketonkörper  spielen im Hungerstoffwechsel eine bedeutende Rolle.
spielen im Hungerstoffwechsel eine bedeutende Rolle. 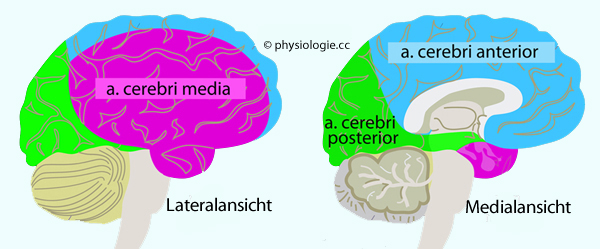
 Abbildung: Versorgungsgebiete der großen Hirnarterien
Abbildung: Versorgungsgebiete der großen Hirnarterien
 Sauerstoffbedarf (graue Substanz: ~7 ml O2/min/100g) und Durchblutung (graue Substanz: ~100 ml/min/100g, gesamtes Gehirn ~55 ml/min/100g) des Gehirns sind hoch - auf relativer
Basis vergleichbar dem Herzmuskel bei körperlicher Ruhe. Das erklärt auch das Aufwärmen des Blutes in der Jugularvene um ~0,3°C
durch das Gehirn. Die Durchblutung einzelner Gehirnregionen passt sich
sehr rasch dem jeweils aktuellen Bedarf an, was mittels Neuroimaging-Methoden nachweisbar ist.
Sauerstoffbedarf (graue Substanz: ~7 ml O2/min/100g) und Durchblutung (graue Substanz: ~100 ml/min/100g, gesamtes Gehirn ~55 ml/min/100g) des Gehirns sind hoch - auf relativer
Basis vergleichbar dem Herzmuskel bei körperlicher Ruhe. Das erklärt auch das Aufwärmen des Blutes in der Jugularvene um ~0,3°C
durch das Gehirn. Die Durchblutung einzelner Gehirnregionen passt sich
sehr rasch dem jeweils aktuellen Bedarf an, was mittels Neuroimaging-Methoden nachweisbar ist.  ) beginnt sich das Bewusstsein einzutrüben (Mangeldurchblutung in der Netzhaut führt zu "Röhrensehen" und Black-out - z.B. bei orthostatischer Synkope),
und nach einer Minute ist der Sauerstoff in der grauen Substanz
vollständig verbraucht. Bei Bestehen der Blutleere für ~5 Minuten ist
(bei normaler Körpertemperatur) mit dem
Auftreten irreversibler Gewebeschäden zu rechnen, obwohl zu diesem
Zeitpunkt im Gehirngewebe noch etwas Glucose verfügbar ist.
) beginnt sich das Bewusstsein einzutrüben (Mangeldurchblutung in der Netzhaut führt zu "Röhrensehen" und Black-out - z.B. bei orthostatischer Synkope),
und nach einer Minute ist der Sauerstoff in der grauen Substanz
vollständig verbraucht. Bei Bestehen der Blutleere für ~5 Minuten ist
(bei normaler Körpertemperatur) mit dem
Auftreten irreversibler Gewebeschäden zu rechnen, obwohl zu diesem
Zeitpunkt im Gehirngewebe noch etwas Glucose verfügbar ist. vgl. dort
vgl. dort Abbildung). Die Kapillardichte der grauen Substanz ist mit ~3000-4000 pro mm2
sehr hoch (ähnlich wie im Herzmuskel), dadurch sind die
Diffusionsstrecken im Gewebe mit <10 µm gering. Die sehr dichte
Ausstattung mit tight junctions verleiht den Gehirnkreislauf die Eigenschaft einer extrem gut ausgebildeten Diffusionsschranke. Auch die Sauerstoffextraktion der grauen Substanz ist mit ~35% höher als der Körperdurchschnitt in Ruhe (~25%).
Abbildung). Die Kapillardichte der grauen Substanz ist mit ~3000-4000 pro mm2
sehr hoch (ähnlich wie im Herzmuskel), dadurch sind die
Diffusionsstrecken im Gewebe mit <10 µm gering. Die sehr dichte
Ausstattung mit tight junctions verleiht den Gehirnkreislauf die Eigenschaft einer extrem gut ausgebildeten Diffusionsschranke. Auch die Sauerstoffextraktion der grauen Substanz ist mit ~35% höher als der Körperdurchschnitt in Ruhe (~25%).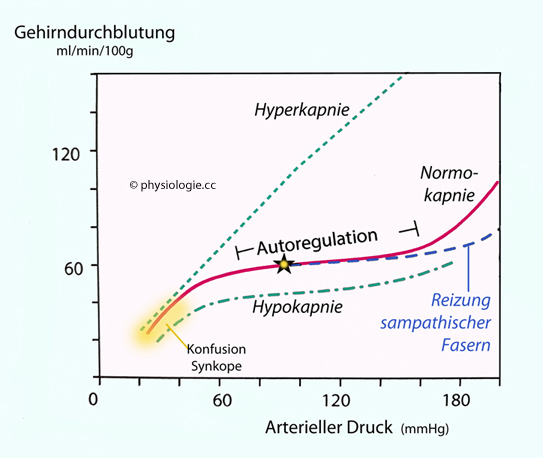
 Abbildung: Autoregulation der Gehirndurchblutung
Abbildung: Autoregulation der Gehirndurchblutung
 Abbildung).
Abbildung).  Abbildung).
Erhöhter lokaler Sympathikuseinfluss schließlich verlängert (ausgehend
von der normalen Autoregulationskurve) den Bereich stabilisierter
Perfusion zu höheren Blutdruckwerten hin.
Abbildung).
Erhöhter lokaler Sympathikuseinfluss schließlich verlängert (ausgehend
von der normalen Autoregulationskurve) den Bereich stabilisierter
Perfusion zu höheren Blutdruckwerten hin.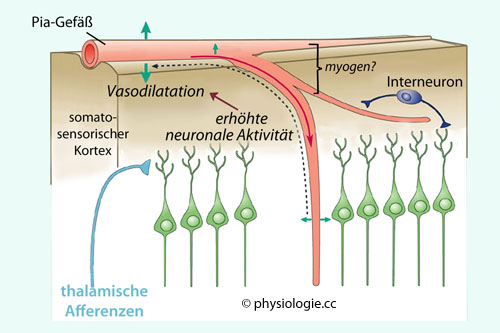
 Abbildung: Durchblutungsregulation in der Hirnrinde
Abbildung: Durchblutungsregulation in der Hirnrinde

 Adenosin: Steigt die Aktivität einer Hirnregion, wird hier vermeht Adenosin gebildet, das über Adenosintransporter
aus den Zellen in das Interstitium gelangt. An glatten Muskelzellen der
umliegenden Blutgefäße bindet es an G-Protein-gekoppelte Adenosinrezeptoren. Dadurch steigt in den Gefäßmuskelzellen cAMP, es erfolgt Vasodilatation.
Adenosin: Steigt die Aktivität einer Hirnregion, wird hier vermeht Adenosin gebildet, das über Adenosintransporter
aus den Zellen in das Interstitium gelangt. An glatten Muskelzellen der
umliegenden Blutgefäße bindet es an G-Protein-gekoppelte Adenosinrezeptoren. Dadurch steigt in den Gefäßmuskelzellen cAMP, es erfolgt Vasodilatation. Kalium- und Wasserstoffionen: Auch diese werden von aktivem Hirnareal vermehrt in das zerebrale Interstitium freigesetzt; erhöhtes [K+] bewirkt direkt, pH-Abfall über verminderte Aktivität spannungsgesteuerter Calciumkanäle indirekt Dilatation der Gefäße und damit Durchblutungssteigerung.
Kalium- und Wasserstoffionen: Auch diese werden von aktivem Hirnareal vermehrt in das zerebrale Interstitium freigesetzt; erhöhtes [K+] bewirkt direkt, pH-Abfall über verminderte Aktivität spannungsgesteuerter Calciumkanäle indirekt Dilatation der Gefäße und damit Durchblutungssteigerung. Steigender pCO2
(Normwert in arteriellem Blut: 40 mmHg) führt - über Wasserstoffionen:
Steigender pCO2
(Normwert in arteriellem Blut: 40 mmHg) führt - über Wasserstoffionen:  H2CO3
H2CO3  H+ + HCO3-
H+ + HCO3- Stickstoffmonoxid (NO) wird in Abhängigkeit von der Aktivität von Neuronen ebenfalls freigesetzt und wirkt vasodilatatorisch.
Stickstoffmonoxid (NO) wird in Abhängigkeit von der Aktivität von Neuronen ebenfalls freigesetzt und wirkt vasodilatatorisch. Myogene Komponenten stabilisieren die zerebrale Perfusion in einem Blutdruckbereich zwischen ~50 und ~150 mmHg (Autoregulation,
Myogene Komponenten stabilisieren die zerebrale Perfusion in einem Blutdruckbereich zwischen ~50 und ~150 mmHg (Autoregulation,  Abbildung oben) und beruhen auf dem Bayliss-Effekt.
Abbildung oben) und beruhen auf dem Bayliss-Effekt. Bei <50 ml/100g/min werden die Hirnzellen azidotisch
Bei <50 ml/100g/min werden die Hirnzellen azidotisch Bei <40 ml/100g/min leidet die Proteinsynthese
Bei <40 ml/100g/min leidet die Proteinsynthese Bei <30 ml/100g/min kommt es zu Zellschwellung (zelluläres Ödem)
Bei <30 ml/100g/min kommt es zu Zellschwellung (zelluläres Ödem) Bei <20 ml/100g/min kommt es zu einem Funktionsverlust der Ionenpumpen (Zusammenbruch des Membranpotentials)
Bei <20 ml/100g/min kommt es zu einem Funktionsverlust der Ionenpumpen (Zusammenbruch des Membranpotentials)| Das Gehirn beteiligt sich zu mindestens 20% am Ruhe-Energieumsatz des Körpers |
 Der spezifische Sauerstoffverbrauch
des Gehirns beträgt im Schnitt ~4 ml/100 g/min. Durchblutungswerte
unter 1
ml/100 g/min können schon in kurzer Zeit (~10 Minuten) irreversible
Zellschäden
verursachen. Allerdings kann auch eine länger dauernde
durchblutungsleere Phase ohne bleibende Folgen für die zerebrale
Intaktheit bleiben, soferne der Kreislauf ausreichend rasch wieder
restituiert und die Gewebetemperatur niedrig gehalten wird.
Der spezifische Sauerstoffverbrauch
des Gehirns beträgt im Schnitt ~4 ml/100 g/min. Durchblutungswerte
unter 1
ml/100 g/min können schon in kurzer Zeit (~10 Minuten) irreversible
Zellschäden
verursachen. Allerdings kann auch eine länger dauernde
durchblutungsleere Phase ohne bleibende Folgen für die zerebrale
Intaktheit bleiben, soferne der Kreislauf ausreichend rasch wieder
restituiert und die Gewebetemperatur niedrig gehalten wird. Beispiel: Gehirndurchblutung 800 ml/min, arterio-venöse Sauerstoffdifferenz (AVDO2) 6 ml O2/100 ml Blut; der Sauerstoffverbrauch errechnet sich als 6 (AVDO2) mal 8 (8 mal 100 ml) = 48 ml/min.
Beispiel: Gehirndurchblutung 800 ml/min, arterio-venöse Sauerstoffdifferenz (AVDO2) 6 ml O2/100 ml Blut; der Sauerstoffverbrauch errechnet sich als 6 (AVDO2) mal 8 (8 mal 100 ml) = 48 ml/min.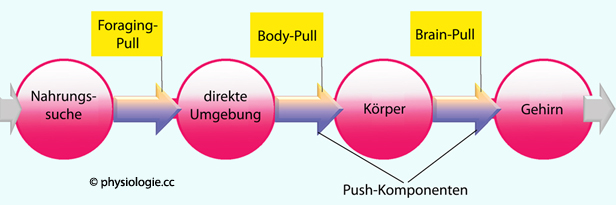
 Abbildung: Informations- und Transportketten
Abbildung: Informations- und Transportketten 
 Tatsächlich verhindert Hypoglycämie die Sekretion von Insulin, und Zielgewebe des Insulins (Adipozyten, Myozyten) lagern
weniger GLUT4 in ihre Membranen ein. Dadurch wird hier weniger Glucose
utilisiert, und es bleibt mehr für das Gehirn übrig (dessen
GLUT3-Transporter insulinunabhängig sind).
Tatsächlich verhindert Hypoglycämie die Sekretion von Insulin, und Zielgewebe des Insulins (Adipozyten, Myozyten) lagern
weniger GLUT4 in ihre Membranen ein. Dadurch wird hier weniger Glucose
utilisiert, und es bleibt mehr für das Gehirn übrig (dessen
GLUT3-Transporter insulinunabhängig sind).
 Abbildung: Physiologische Mechanismen der zerebralen Substratversorgung
Abbildung: Physiologische Mechanismen der zerebralen Substratversorgung

 Abbildung) und fördern gleichzeitig ß-adrenerg die Glykolyse u.a.
in der Muskulatur.
Abbildung) und fördern gleichzeitig ß-adrenerg die Glykolyse u.a.
in der Muskulatur.  Abbildung oben). Der Körper bezieht wiederum Ressourcen
aus seiner Umgebung und bewirkt einen "body pull".
Abbildung oben). Der Körper bezieht wiederum Ressourcen
aus seiner Umgebung und bewirkt einen "body pull". ) bedingt sein.
) bedingt sein.  Bei einem kalorischen Äquivalent von 20 kJ/l O2 ergibt ein O2-Verbrauch von 60
ml/min einen Energiebedarf von ~1,2 kJ/min. Dem entspricht ein Glucosebedarf von ~70 mg/min (physiologischer Brennwert 17 kJ/g Glucose) oder 100-120 g/d. Das Gehirn beansprucht damit 25-30% des Ganzkörper-Glucoseverbrauchs (bei körperlicher Ruhe).
Bei einem kalorischen Äquivalent von 20 kJ/l O2 ergibt ein O2-Verbrauch von 60
ml/min einen Energiebedarf von ~1,2 kJ/min. Dem entspricht ein Glucosebedarf von ~70 mg/min (physiologischer Brennwert 17 kJ/g Glucose) oder 100-120 g/d. Das Gehirn beansprucht damit 25-30% des Ganzkörper-Glucoseverbrauchs (bei körperlicher Ruhe).  Bei Neugeborenen beträgt der Anteil des zephalen Energieverbrauchs mehr als 60% des gesamten Ruheumsatzes.
Bei Neugeborenen beträgt der Anteil des zephalen Energieverbrauchs mehr als 60% des gesamten Ruheumsatzes.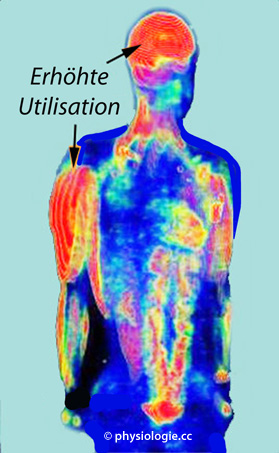
 Abbildung: Veränderte Glucoseaufnahme als Effekt von Muskelaktivierung durch Langlaufen
Abbildung: Veränderte Glucoseaufnahme als Effekt von Muskelaktivierung durch Langlaufen
 Abbildung).
Abbildung). Langzeiteffekte körperlichen Trainings auf das Gehirn schließen höheres
Gehirngewicht und gesteigerte Funktion ein - ein gesunder, körperlich
aktiver Lebensstil trägt wesentlich zur Beibehaltung guter zerebraler
Leistungsfähigkeit bei. Vermutlich sind Faktoren wie der brain-derived neurotrophic factor (BDNF) in die dahinterliegenden Mechanismen involviert.
Langzeiteffekte körperlichen Trainings auf das Gehirn schließen höheres
Gehirngewicht und gesteigerte Funktion ein - ein gesunder, körperlich
aktiver Lebensstil trägt wesentlich zur Beibehaltung guter zerebraler
Leistungsfähigkeit bei. Vermutlich sind Faktoren wie der brain-derived neurotrophic factor (BDNF) in die dahinterliegenden Mechanismen involviert. In ähnlicher Weise ist der Säugling
in der Lage, Ketonkörper zu verwerten und damit den hohen Fettanteil
der Muttermilch optimal zu nutzen (Säuglinge können Blutglucose-Spiegel
bis herunter auf ~1,5 mM ohne neurologische Ausfälle tolerieren - Toleranzschwelle bei Erwachsenen <3,0 mM).
In ähnlicher Weise ist der Säugling
in der Lage, Ketonkörper zu verwerten und damit den hohen Fettanteil
der Muttermilch optimal zu nutzen (Säuglinge können Blutglucose-Spiegel
bis herunter auf ~1,5 mM ohne neurologische Ausfälle tolerieren - Toleranzschwelle bei Erwachsenen <3,0 mM). Abbildung), der Sympathikus hat vergleichsweise geringeren
Einfluss.
Abbildung), der Sympathikus hat vergleichsweise geringeren
Einfluss. 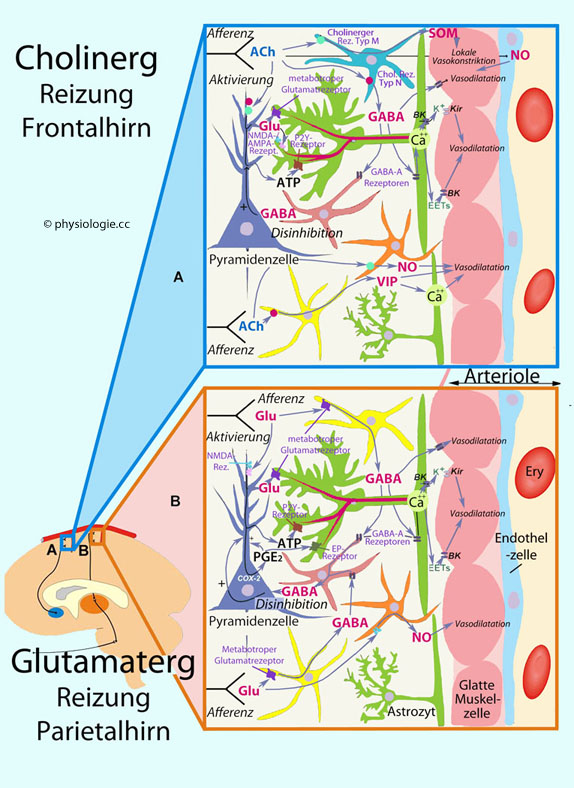
 Abbildung: Details neurovaskulärer Steuerung von Gefäßweite und Hirndurchblutung
Abbildung: Details neurovaskulärer Steuerung von Gefäßweite und Hirndurchblutung
 BK, Ca++-aktivierter Kaliumkanal
BK, Ca++-aktivierter Kaliumkanal  COX, Cyclooxygenase
COX, Cyclooxygenase  EET, Epoxyeikosatetraensäure
EET, Epoxyeikosatetraensäure  EP, PGE2 -Rezeptor
EP, PGE2 -Rezeptor  Kir, inward rectifier
Kir, inward rectifier  muskarinischer Ach-Rezeptor
muskarinischer Ach-Rezeptor  metabotroper Glutamat (Glu)-Rezeptor
metabotroper Glutamat (Glu)-Rezeptor  nikotinischer ACh receptor
nikotinischer ACh receptor  NMDA, N-Methyl-d-Aspartat
NMDA, N-Methyl-d-Aspartat  NO, Stickstoffmonoxid
NO, Stickstoffmonoxid  NPY, Neuropeptid Y
NPY, Neuropeptid Y  P2YR, P2Y-Rezeptor
P2YR, P2Y-Rezeptor  SOM, Somatostatin
SOM, Somatostatin  VIP, vasoactive intestinal peptide
VIP, vasoactive intestinal peptide
 Glatte Muskelzellen s. auch dort
Glatte Muskelzellen s. auch dort  Endothelzellen s. auch dort
Endothelzellen s. auch dort 
 Hyperventilation (→ Hypokapnie) senkt die Hirndurchblutung (Vasokonstriktion infolge übertriebener Atmung kann Ohnmacht verursachen)
Hyperventilation (→ Hypokapnie) senkt die Hirndurchblutung (Vasokonstriktion infolge übertriebener Atmung kann Ohnmacht verursachen) Hypoventilation (→ Hyperkapnie) steigert die Hirndurchblutung (Vasodilatation - z.B. bei Anwendung eines Totraumvergrößerers)
Hypoventilation (→ Hyperkapnie) steigert die Hirndurchblutung (Vasodilatation - z.B. bei Anwendung eines Totraumvergrößerers) Sauerstoffmangel (Hypoxie)
hat (wie Hyperkapnie) einen vasodilatierenden (und damit
durchblutungssteigernden) Effekt. Umgekehrt wirkt sich ein Anstieg des
Sauerstoffpartialdrucks (z.B. bei Atmung von reinem Sauerstoff) kaum
auf die zerebrale Durchblutung aus.
Sauerstoffmangel (Hypoxie)
hat (wie Hyperkapnie) einen vasodilatierenden (und damit
durchblutungssteigernden) Effekt. Umgekehrt wirkt sich ein Anstieg des
Sauerstoffpartialdrucks (z.B. bei Atmung von reinem Sauerstoff) kaum
auf die zerebrale Durchblutung aus.
 Vermehrte Aktionspotentialtätigkeit in aktiven Gehirnteilen bedingt Kaliumfreisetzung in den Extrazellulärraum, was lokal Dilatation der Hirngefäße auslöst.
Vermehrte Aktionspotentialtätigkeit in aktiven Gehirnteilen bedingt Kaliumfreisetzung in den Extrazellulärraum, was lokal Dilatation der Hirngefäße auslöst. Auch Adenosin, das bei erhöhtem Energieverbrauch von Nervenzellen freigesetzt wird, bewirkt Vasodilatation und Durchblutungssteigerung.
Auch Adenosin, das bei erhöhtem Energieverbrauch von Nervenzellen freigesetzt wird, bewirkt Vasodilatation und Durchblutungssteigerung. Ebenfalls produzieren aktivierte Nervenzellen NO,
was die Gefäße weiter stellt (in der
Ebenfalls produzieren aktivierte Nervenzellen NO,
was die Gefäße weiter stellt (in der  Abbildung oben orange gezeigte
Nervenzellen mit metabotropen Acetylcholin- sowie NMDA-Rezeptoren).
Abbildung oben orange gezeigte
Nervenzellen mit metabotropen Acetylcholin- sowie NMDA-Rezeptoren). Der Bayliss-Effekt
Der Bayliss-Effekt  stabilisiert die Gehirndurchblutung in einem Druckbereich zwischen ~50 und ~120 mmHg (zerebrale Autoregulation
stabilisiert die Gehirndurchblutung in einem Druckbereich zwischen ~50 und ~120 mmHg (zerebrale Autoregulation  Abbildung oben). Die Autoregulation ermöglicht die Stabilisierung des Blutflusses zum Gehirn bei wechselndem Blutdruck.
Abbildung oben). Die Autoregulation ermöglicht die Stabilisierung des Blutflusses zum Gehirn bei wechselndem Blutdruck.  Zur Messung der Hirndurchblutung werden verschiedene Methoden
verwendet. Nichtinvasive Möglichkeiten bestehen in transkraniellem
Doppler (Ausnützung des Doppler-Effekts), NIRS
(Nah-Infrarotspektroskopie) und MRI (Magnetresonanz-Angiographie).
Zur Messung der Hirndurchblutung werden verschiedene Methoden
verwendet. Nichtinvasive Möglichkeiten bestehen in transkraniellem
Doppler (Ausnützung des Doppler-Effekts), NIRS
(Nah-Infrarotspektroskopie) und MRI (Magnetresonanz-Angiographie). Abnahme des pCO2
(Hypokapnie) - bedingt durch übertriebene Atmung (Hyperventilation),
wie sie z.B. bei Panikanfällen auftreten kann - führt zu Konstriktion
der zerebralen Gefäße und damit zu Minderdurchblutung des Gehirns bis
hin zur Bewußtlosigkeit (bei Reduktion der zerebralen Perfusion auf
unter ~50% des Normalwerts). Zumischung von CO2 zur Atemluft (z.B. Rückatmung ausgeatmeter Luft) mindert die Symptomatik.
Abnahme des pCO2
(Hypokapnie) - bedingt durch übertriebene Atmung (Hyperventilation),
wie sie z.B. bei Panikanfällen auftreten kann - führt zu Konstriktion
der zerebralen Gefäße und damit zu Minderdurchblutung des Gehirns bis
hin zur Bewußtlosigkeit (bei Reduktion der zerebralen Perfusion auf
unter ~50% des Normalwerts). Zumischung von CO2 zur Atemluft (z.B. Rückatmung ausgeatmeter Luft) mindert die Symptomatik. Akute
Gefäßverschlüsse im Versorgungsbereich des Gehirns führen zu einem
ischämischen Schlaganfall (Hirninfarkt), was zu neurologischen
Ausfällen (Sprachstörungen, Bewußtseinsausfälle,
Sensibilitätsstörungen, Paresen
Akute
Gefäßverschlüsse im Versorgungsbereich des Gehirns führen zu einem
ischämischen Schlaganfall (Hirninfarkt), was zu neurologischen
Ausfällen (Sprachstörungen, Bewußtseinsausfälle,
Sensibilitätsstörungen, Paresen  ) und im schlimmsten Fall zum Tod führen
kann.
) und im schlimmsten Fall zum Tod führen
kann. Hoher Druck in den Hirngefäßen führt zur Filtration von Flüssigkeit in das Gewebe (Hirnödem).
Dadurch steigt der intrakranielle Druck (wegen des Schädelknochens sehr
geringe Dehnbarkeit) und dies komprimiert die Hirngefäße, sodass es zu
sinkender Durchblutung und damit Sauerstoffmangel kommt, was die
Nervenzellen schädigt und über längere Zeit unbehandelt zum Tod führen
kann.
Hoher Druck in den Hirngefäßen führt zur Filtration von Flüssigkeit in das Gewebe (Hirnödem).
Dadurch steigt der intrakranielle Druck (wegen des Schädelknochens sehr
geringe Dehnbarkeit) und dies komprimiert die Hirngefäße, sodass es zu
sinkender Durchblutung und damit Sauerstoffmangel kommt, was die
Nervenzellen schädigt und über längere Zeit unbehandelt zum Tod führen
kann.

 Das Gehirn (2% der Körpermasse) verbraucht 15% des Herzzeitvolumens (~0,75 l/min) und 20% des Energieumsatzes (5-6 g Glucose / h); es hat geringe Hypoxietoleranz, die relative Durchblutung beträgt global ~50 ml/100g/min (graue Substanz ~100, weiße ~25 ml/100 g/min). Die a. cerebri media
(größte Hirnarterie) versorgt die seitlichen Gehirnregionen,
Perfusionsstörungen können Lähmung, Neglect, Gesichtsfeldausfall,
Sprachstörungen und Apraxien bewirken. Die a. cerebri anterior
versorgt Basalganglien, vorderen Hypothalamus und mediale Teile des
Frontal- und Parietallappens, Ausfälle bewirken motorische Defizite.
Die a. cerebri posterior
versorgt Okzipitallappen, Hippokampus, posteriore Teile des Thalamus
und Hypothalamus, Ausfälle äußern sich u.a. als "Rindenblindheit". Das
Gehirn ist glucoseabhängig, über GLUT3 tritt Glucose aus dem Blut in das Hirngewebe über Das Gehirn (2% der Körpermasse) verbraucht 15% des Herzzeitvolumens (~0,75 l/min) und 20% des Energieumsatzes (5-6 g Glucose / h); es hat geringe Hypoxietoleranz, die relative Durchblutung beträgt global ~50 ml/100g/min (graue Substanz ~100, weiße ~25 ml/100 g/min). Die a. cerebri media
(größte Hirnarterie) versorgt die seitlichen Gehirnregionen,
Perfusionsstörungen können Lähmung, Neglect, Gesichtsfeldausfall,
Sprachstörungen und Apraxien bewirken. Die a. cerebri anterior
versorgt Basalganglien, vorderen Hypothalamus und mediale Teile des
Frontal- und Parietallappens, Ausfälle bewirken motorische Defizite.
Die a. cerebri posterior
versorgt Okzipitallappen, Hippokampus, posteriore Teile des Thalamus
und Hypothalamus, Ausfälle äußern sich u.a. als "Rindenblindheit". Das
Gehirn ist glucoseabhängig, über GLUT3 tritt Glucose aus dem Blut in das Hirngewebe über Arterielle zerebrale Gefäße verhalten sich <50 mmHg druckpassiv; im Autoregulationsbereich (~50-150 mmHg) kontrahieren sie mit
steigendem Innendruck und stabilisieren die Durchblutung; über ~150 mmHg werden sie (maximal kontrahiert)
durch weiter steigenden Druck aufgedehnt. Die Regulation der
Hirndurchblutung erfolgt vorwiegend metabolisch, beruhend auf Adenosin, Kalium- und Wasserstoffionen, Stickstoffmonoxid (Vasodilatation bei erhöhter neuronaler Aktivität). Das Gehirn
schöpft 1/3 des arteriellen Sauerstoffs aus (arterio-venöse
Sauerstoffdifferenz 6-7 ml/100 ml). Der spezifische
Sauerstoffverbrauch des Gehirns beträgt im Schnitt ~4 ml/100 g/min
(graue Substanz / aktives Gewebe ~10, weiße Substanz ~1 ml/100g/min).
Für das gesamte Gehirn ergibt sich 50-60 ml/min (~20% des Ruhe-
Sauerstoffverbrauchs des Körpers). Arterielle zerebrale Gefäße verhalten sich <50 mmHg druckpassiv; im Autoregulationsbereich (~50-150 mmHg) kontrahieren sie mit
steigendem Innendruck und stabilisieren die Durchblutung; über ~150 mmHg werden sie (maximal kontrahiert)
durch weiter steigenden Druck aufgedehnt. Die Regulation der
Hirndurchblutung erfolgt vorwiegend metabolisch, beruhend auf Adenosin, Kalium- und Wasserstoffionen, Stickstoffmonoxid (Vasodilatation bei erhöhter neuronaler Aktivität). Das Gehirn
schöpft 1/3 des arteriellen Sauerstoffs aus (arterio-venöse
Sauerstoffdifferenz 6-7 ml/100 ml). Der spezifische
Sauerstoffverbrauch des Gehirns beträgt im Schnitt ~4 ml/100 g/min
(graue Substanz / aktives Gewebe ~10, weiße Substanz ~1 ml/100g/min).
Für das gesamte Gehirn ergibt sich 50-60 ml/min (~20% des Ruhe-
Sauerstoffverbrauchs des Körpers).  Das Gehirn beansprucht 25-30% des Ganzkörper-Glucoseverbrauchs (körperliche Ruhe). Bei begrenzten
Ressourcen erzwingt es seine Glucoseversorgung ("selfish
brain"): Es kann mittels GLUT 1 weiter Glucose verbrauchen, während
insulinabhängige (GLUT 4) periphere Gewebe von der Glucoseversorgung
wegen niedriger Insulinwirkung abgeschnitten werden. Auch kann das
Gehirn über die CRH - ACTH - Cortisol - Achse Glucose mobilisieren;
Ketonkörper stabilisieren im Hungerzustand seine Energieversorgung
(sympathikusbedingte Abgabe freier Fettsäuren
in viszeralem Fettgewebe, Ketogenese in der Leber). Das Gehirn übt
einen "brain pull" auf den Körper aus, während es von diesem mit
Energieträgern versorgt wird; der Körper bezieht wiederum Ressourcen
aus seiner Umgebung und bewirkt einen "body pull" Das Gehirn beansprucht 25-30% des Ganzkörper-Glucoseverbrauchs (körperliche Ruhe). Bei begrenzten
Ressourcen erzwingt es seine Glucoseversorgung ("selfish
brain"): Es kann mittels GLUT 1 weiter Glucose verbrauchen, während
insulinabhängige (GLUT 4) periphere Gewebe von der Glucoseversorgung
wegen niedriger Insulinwirkung abgeschnitten werden. Auch kann das
Gehirn über die CRH - ACTH - Cortisol - Achse Glucose mobilisieren;
Ketonkörper stabilisieren im Hungerzustand seine Energieversorgung
(sympathikusbedingte Abgabe freier Fettsäuren
in viszeralem Fettgewebe, Ketogenese in der Leber). Das Gehirn übt
einen "brain pull" auf den Körper aus, während es von diesem mit
Energieträgern versorgt wird; der Körper bezieht wiederum Ressourcen
aus seiner Umgebung und bewirkt einen "body pull"  Bei Absinken
der Hirndurchblutung auf unter die Hälfte des Normwertes beginnen
Symptome der Präsynkope. Diese geht einer Synkope (plötzliche
Bewusstlosigkeit) unmittelbar voraus und kann u.a. durch plötzliches
Überwiegen der parasympathischen Aktivität (vasovagal) bedingt sein.
Oft ist die Ursache orthostatische Überforderung, ein Schockerlebnis, oder auch starker Blutverlust, Funktionsversagen
des Herzens (z.B. Infarkt). Muskelaktivität steigert die zerebrale
Utilisation von Glucose; körperliches Training erhöht Masse und Leistungsfähigkeit des Gehirns (BDNF?) Bei Absinken
der Hirndurchblutung auf unter die Hälfte des Normwertes beginnen
Symptome der Präsynkope. Diese geht einer Synkope (plötzliche
Bewusstlosigkeit) unmittelbar voraus und kann u.a. durch plötzliches
Überwiegen der parasympathischen Aktivität (vasovagal) bedingt sein.
Oft ist die Ursache orthostatische Überforderung, ein Schockerlebnis, oder auch starker Blutverlust, Funktionsversagen
des Herzens (z.B. Infarkt). Muskelaktivität steigert die zerebrale
Utilisation von Glucose; körperliches Training erhöht Masse und Leistungsfähigkeit des Gehirns (BDNF?) |
