




| Aldosteron, Cortisol und Adrenalin sind die wichtigsten Hormone der Nebennieren, wobei Aldosteron
das einzige Hormon ist, dessen Fehlen unmittelbar lebensbedrohlich ist (unbehandelter Mb. Addison: Kreislaufzusammenbruch wegen Salzmangel und Hypovolämie). Das Nebennierenmark produziert dank einer speziellen Methyltransferase (PNMT) Katecholamine bis zur Endstufe Adrenalin. Dieses macht fit für Kampfsituationen, es regt Atmung und Kreisauf an, mobilisiert Glucose. In der Nebennierenrinde werden aus Cholesterin diverse Steroidhormone gebildet. Die Außenzone (zona glomerulosa) erzeugt das Mineralcorticoid Aldosteron, dessen Produktion vor allem durch Angiotensin II angeregt wird. Als "Salzsparhormon" fördert es die Rückresorption von Natrium in der Niere, damit stabilisiert es extrazelluläres und Blutvolumen. Die Mittelzone (zona fasciculata) synthetisiert Glucocorticoide, insbesondere Cortisol; der wichtigste Anreiz dazu ist ACTH. Cortisol wirkt einerseits energiemobilisierend (Glucosesteigerung), andererseits anabol auf den Bewegungsapparat. Bei akuter Herausforderung durch die Umwelt ziehen höhere Cortisolspiegel Ressourcen vom Immunsystem ab, Abwehrvorgänge sind eher gedämpft; dazu kommt Steigerung des Glucosespiegels (Alarmreaktion) sowie - als Mineralcorticoid-Nebenwirkung - Salzretention und Volumenkonservierung (Kreislaufstabilisierung). |
 Mark: Adrenalin
Mark: Adrenalin  Rinde: Zona glomerulosa / Aldosteron
Rinde: Zona glomerulosa / Aldosteron  Zona fasciculata / Cortisol
Zona fasciculata / Cortisol
 Zona reticularis / Androgene
Zona reticularis / Androgene
 Typ I-, Typ II-Corticosteroidrezeptoren
Typ I-, Typ II-Corticosteroidrezeptoren
 Core messages
Core messages
 Abbildung: Nebenniere
Abbildung: Nebenniere Zur Stellung der Nebenniere im Immunsystem s. auch dort
Zur Stellung der Nebenniere im Immunsystem s. auch dort
 Abbildung),
wo es die Enzyme der Katecholaminsynthese anregt - insbesondere PNMT (Phenylethanolamin-N-Methyl-Transferase), das Noradrenalin zu Adrenalin methyliert.
Abbildung),
wo es die Enzyme der Katecholaminsynthese anregt - insbesondere PNMT (Phenylethanolamin-N-Methyl-Transferase), das Noradrenalin zu Adrenalin methyliert.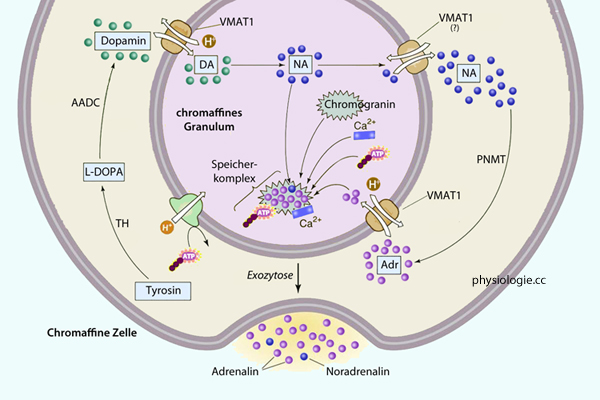
 Abbildung: Katecholaminsynthese in chromaffiner Zelle
Abbildung: Katecholaminsynthese in chromaffiner Zelle Adr, Adrenalin
Adr, Adrenalin  DA, Dopamin
DA, Dopamin  NA, Noradrenalin
NA, Noradrenalin  PNMT, Phenylethanomalin-N-Methyltransferase
PNMT, Phenylethanomalin-N-Methyltransferase  TH, Tyrosinhydroxylase
TH, Tyrosinhydroxylase  VMAT, vesicular monoamine transporter
VMAT, vesicular monoamine transporter Chromaffine Zellen
Chromaffine Zellen  sind postganglionäre sympathische Zellen, die sich vorwiegend in der
Nebenniere finden und hier von Neuronen des Splanchnicusnerven
innerviert sind. Angeregt werden sie durch Stresseinfluss (fight / flight / fright-Reaktionen).
Ihre Acetylcholinrezeptoren sind nikotinisch (wie die von
postganglionären Neuronen allgemein), und sie sezernieren aus
chromaffinen Granula Katecholamine - Adrenalin und Noradrenalin im Verhältnis 4:1, auch etwas Dopamin, ferner Enkephaline - parakrin sowie in den Kreislauf (sie sind neuroendokrin).
sind postganglionäre sympathische Zellen, die sich vorwiegend in der
Nebenniere finden und hier von Neuronen des Splanchnicusnerven
innerviert sind. Angeregt werden sie durch Stresseinfluss (fight / flight / fright-Reaktionen).
Ihre Acetylcholinrezeptoren sind nikotinisch (wie die von
postganglionären Neuronen allgemein), und sie sezernieren aus
chromaffinen Granula Katecholamine - Adrenalin und Noradrenalin im Verhältnis 4:1, auch etwas Dopamin, ferner Enkephaline - parakrin sowie in den Kreislauf (sie sind neuroendokrin).  <Adrenalin
<Adrenalin Zum Sympathikus und über adrenerge Wirkungsspektren sowie Rezeptoren s. dort
Zum Sympathikus und über adrenerge Wirkungsspektren sowie Rezeptoren s. dort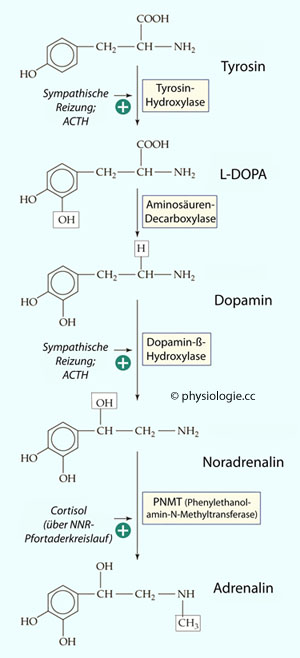
 Abbildung: Katecholaminsynthese und ihre Steuerung
Abbildung: Katecholaminsynthese und ihre Steuerung Synthese und Speicherung: Adrenalin entsteht im chromaffinen
Synthese und Speicherung: Adrenalin entsteht im chromaffinen  Gewebe von Nebennierenmark und (extraadrenalen) Paraganglien
(
Gewebe von Nebennierenmark und (extraadrenalen) Paraganglien
( Abbildung unten). Je nach Enzymausstattung der Zellen geht die
Synthese über DOPA und Dopamin bis zu Noradrenalin, oder weiter bis
Adrenalin (
Abbildung unten). Je nach Enzymausstattung der Zellen geht die
Synthese über DOPA und Dopamin bis zu Noradrenalin, oder weiter bis
Adrenalin ( Abbildung).
Abbildung). Solche, deren Enzyme
bis zur Synthesestufe des Noradrenalins reichen (N-Zellen, 20% ), und
Solche, deren Enzyme
bis zur Synthesestufe des Noradrenalins reichen (N-Zellen, 20% ), und  solche, die über
Phenylethanolamin-N-Methyltransferase (PNMT -
solche, die über
Phenylethanolamin-N-Methyltransferase (PNMT -  s. dort
und
s. dort
und  Abbildung) verfügen (sie treten erst nach der Geburt auf) und Adrenalin
bilden (A-Zellen, 80%). Die Produktion von PNMT wird durch Steroide angeregt, die in der Nebennierenrinde produziert werden.
Abbildung) verfügen (sie treten erst nach der Geburt auf) und Adrenalin
bilden (A-Zellen, 80%). Die Produktion von PNMT wird durch Steroide angeregt, die in der Nebennierenrinde produziert werden. Abbildung oben) und wird im
Zytoplasma durch PNMT zu Adrenalin methyliert, das dann in den
vesikulären Speicher zurückkehrt. Die PNMT-Synthese (und auch die von Tyrosinhydroxylase und
Dopamin-ß-Hydroxylase) wird durch Glucocorticoide (Cortisol) angeregt,
die über den intraadrenalen - also innerhalb der Nebenniere verlaufenden - Pfortaderkreislauf (Abbildung) aus der Rinde in das Nebennierenmark gelangen.
Abbildung oben) und wird im
Zytoplasma durch PNMT zu Adrenalin methyliert, das dann in den
vesikulären Speicher zurückkehrt. Die PNMT-Synthese (und auch die von Tyrosinhydroxylase und
Dopamin-ß-Hydroxylase) wird durch Glucocorticoide (Cortisol) angeregt,
die über den intraadrenalen - also innerhalb der Nebenniere verlaufenden - Pfortaderkreislauf (Abbildung) aus der Rinde in das Nebennierenmark gelangen. 
 Abbildung: Paraganglien
Abbildung: Paraganglien
 Zu den
Paraganglien (
Zu den
Paraganglien ( Abbildung) gehören
Abbildung) gehören  das Zuckerkandl'sche Organ
das Zuckerkandl'sche Organ  (paraganglion
aorticum abdominale am Abgang der a. mesenterica inferior),
(paraganglion
aorticum abdominale am Abgang der a. mesenterica inferior),  das Glomus caroticum und die Glomera
aortica (Chemorezeptoren),
das Glomus caroticum und die Glomera
aortica (Chemorezeptoren),  das Paraganglion jugulare (glomus jugulare)
in der Wand der vena jugularis interna,
das Paraganglion jugulare (glomus jugulare)
in der Wand der vena jugularis interna,  peritoneale Paraganglien sowie
peritoneale Paraganglien sowie
 Paraganglien in den Geschlechtsorganen.
Paraganglien in den Geschlechtsorganen.  bildet aus der Aminosäure Tyrosin die
Dopaminvorstufe DOPA - sie ist das geschwindigkeitsbegrenzende Emzym).
bildet aus der Aminosäure Tyrosin die
Dopaminvorstufe DOPA - sie ist das geschwindigkeitsbegrenzende Emzym). | Acetylcholin bewirkt die Freisetzung von Katecholaminen aus dem Nebennierenmark |


 Acetylcholin - der universelle präganglionäre Transmitter - depolarisiert die chromaffinen Zellen,
Acetylcholin - der universelle präganglionäre Transmitter - depolarisiert die chromaffinen Zellen,  spannungsabhängige Ca++-Kanäle öffnen (
spannungsabhängige Ca++-Kanäle öffnen ( Abbildung),
Abbildung),  der Ca++-Einstrom führt zu Exozytose gespeicherten (Nor-)Adrenalins.
der Ca++-Einstrom führt zu Exozytose gespeicherten (Nor-)Adrenalins.
 Abbildung: Stimulierung chromaffiner Zellen
Abbildung: Stimulierung chromaffiner Zellen
 Spannunsabhängige Calciumkanäle (VOCC: voltage-operated calcium channels),
Spannunsabhängige Calciumkanäle (VOCC: voltage-operated calcium channels),
 mitochondriale Calcium-Uniporter (U),
mitochondriale Calcium-Uniporter (U),
 Ryanodinrezeptoren des endoplasmatischen Retikulums (RyR)
und
Ryanodinrezeptoren des endoplasmatischen Retikulums (RyR)
und 
 sekretorische Vesikel
sekretorische Vesikel

 Die Sekretion der Katecholamine im Nebennierenmark erfolgt im Verhältnis Adrenalin / Noradrenalin = 4/1. Durch Stimulierung der PNMT (Phenylethanolamin-N-Methyltransferase) erhöhen Glucocorticoide diesen Quotienten zugunsten von Adrenalin. Bei Neugeborenen
ist der Adrenalin/Noradrenalin-Quotient wesentlich niedriger, erst nach
der Geburt nimmt er zu - durch Cortisoleinfluss auf das Enzym PNMT.
Die Sekretion der Katecholamine im Nebennierenmark erfolgt im Verhältnis Adrenalin / Noradrenalin = 4/1. Durch Stimulierung der PNMT (Phenylethanolamin-N-Methyltransferase) erhöhen Glucocorticoide diesen Quotienten zugunsten von Adrenalin. Bei Neugeborenen
ist der Adrenalin/Noradrenalin-Quotient wesentlich niedriger, erst nach
der Geburt nimmt er zu - durch Cortisoleinfluss auf das Enzym PNMT. Adrenalin und Noradrenalin werden methyliert und (anschließend) oxidiert (
Adrenalin und Noradrenalin werden methyliert und (anschließend) oxidiert ( Abbildung). Aus dem Extrazellulärraum nicht in die Zellen wiederaufgenommenes
Noradrenalin (10-15%) wird hauptsächlich nichtneuronal (Leber,
Nieren..) aus dem Kreislauf entfernt.
Abbildung). Aus dem Extrazellulärraum nicht in die Zellen wiederaufgenommenes
Noradrenalin (10-15%) wird hauptsächlich nichtneuronal (Leber,
Nieren..) aus dem Kreislauf entfernt.
 Abbildung: Katecholaminabbau
Abbildung: Katecholaminabbau
 s. auch dort.
s. auch dort.  entsteht durch die Wirkung einer Aldehyd-Dehydrogenase. Abbauprodukte
werden - sulfatiert oder glucuronierrt - mit dem Harn ausgeschieden;
ihre Konzentration erlaubt einen Rückschluss auf die
Katecholaminsynthese in Sympathikus und Nebennieren (je höher die Belastung, desto mehr VMS im
Harn).
entsteht durch die Wirkung einer Aldehyd-Dehydrogenase. Abbauprodukte
werden - sulfatiert oder glucuronierrt - mit dem Harn ausgeschieden;
ihre Konzentration erlaubt einen Rückschluss auf die
Katecholaminsynthese in Sympathikus und Nebennieren (je höher die Belastung, desto mehr VMS im
Harn).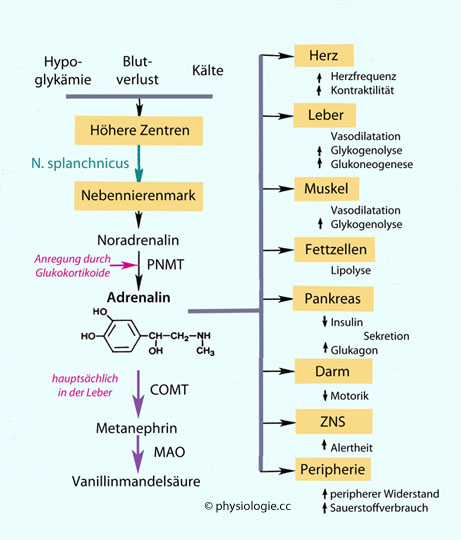
 Abbildung: Physiologische Adrenalinwirkungen
Abbildung: Physiologische Adrenalinwirkungen
 Adrenalin hat zu α-Rezeptoren (Vasokonstriktion) eine etwas geringere, zu β1-Rezeptoren (Herz, Nieren) etwa gleich starke, und zu β2-Rezeptoren (Bronchien, Stoffwechsel) eine wesentlich höhere Affinität als Noradrenalin. (Zu den molekularen Wirkmechanismen der Rezeptoren
Adrenalin hat zu α-Rezeptoren (Vasokonstriktion) eine etwas geringere, zu β1-Rezeptoren (Herz, Nieren) etwa gleich starke, und zu β2-Rezeptoren (Bronchien, Stoffwechsel) eine wesentlich höhere Affinität als Noradrenalin. (Zu den molekularen Wirkmechanismen der Rezeptoren  s. dort.)
s. dort.) Steigerung der Lipolyse im Fettgewebe (Aktivierung der hormonsensitiven Lipase)
Steigerung der Lipolyse im Fettgewebe (Aktivierung der hormonsensitiven Lipase) Steigerung der Gluconeogenese und Glykogenolyse (Steigerung des Blutzucker- und Laktatspiegels) in der Leber (gleichzeitig Hemmung der Glykolyse), Steigerung des Sauerstoffbedarfs
Steigerung der Gluconeogenese und Glykogenolyse (Steigerung des Blutzucker- und Laktatspiegels) in der Leber (gleichzeitig Hemmung der Glykolyse), Steigerung des Sauerstoffbedarfs Im Skelettmuskel Steigerung von Glykogenolyse, Proteinsynthese, Na/K-ATPasetätigkeit (dadurch Senkung des Kaliumspiegels)
Im Skelettmuskel Steigerung von Glykogenolyse, Proteinsynthese, Na/K-ATPasetätigkeit (dadurch Senkung des Kaliumspiegels)  Am Gastrointestinaltrakt hemmt Adrenalin die Peristaltik und relaxiert den Darm (ß1, ß2); Sphinkteren werden angeregt, wenn ihr Tonus niedrig ist
Am Gastrointestinaltrakt hemmt Adrenalin die Peristaltik und relaxiert den Darm (ß1, ß2); Sphinkteren werden angeregt, wenn ihr Tonus niedrig ist Am Herzen wirkt Adrenalin - über ß1-Rezeptoren - positiv auf alle Herzqualitäten
Am Herzen wirkt Adrenalin - über ß1-Rezeptoren - positiv auf alle Herzqualitäten Gefäßsystem: Adrenalin wirkt vor allem an kleinen Arteriolen und
präkapillären Sphinkteren, aber auch an Venen und großen Arterien.
Verschiedene Gefäßbette reagieren - entsprechend ihrer Ausstattung mit Adrenozeptoren - unterschiedlich, was zu Umverteilungen von Blut und Perfusion im Kreislauf führt (Verringerung der Hautdurchblutung, insbesondere im Bereich der Hände und Füße).
Gefäßsystem: Adrenalin wirkt vor allem an kleinen Arteriolen und
präkapillären Sphinkteren, aber auch an Venen und großen Arterien.
Verschiedene Gefäßbette reagieren - entsprechend ihrer Ausstattung mit Adrenozeptoren - unterschiedlich, was zu Umverteilungen von Blut und Perfusion im Kreislauf führt (Verringerung der Hautdurchblutung, insbesondere im Bereich der Hände und Füße).  Die Gefäße der Haut und der Eingeweide sind reich an α-Rezeptoren und reagieren auf Adrenalin mit Vasokonstriktion.
Die Gefäße der Haut und der Eingeweide sind reich an α-Rezeptoren und reagieren auf Adrenalin mit Vasokonstriktion. Adrenalin erweitert Koronar- und Skelettmuskelarteriolen sowie Gefäße der Leber (diese enthalten zahlreiche ß2-Rezeptoren) - zumindest bei mäßiger Adrenalinkonzentration, bei
hohen Dosen überwiegt die α-Rezeptor-vermittelte Vasokonstriktion und
Blutdrucksteigerung.
Adrenalin erweitert Koronar- und Skelettmuskelarteriolen sowie Gefäße der Leber (diese enthalten zahlreiche ß2-Rezeptoren) - zumindest bei mäßiger Adrenalinkonzentration, bei
hohen Dosen überwiegt die α-Rezeptor-vermittelte Vasokonstriktion und
Blutdrucksteigerung.  Bronchien werden relaxiert, die Sekretion steigt, der Zilienschlag wird beschleunigt, die Histaminfreisetzung gehemmt (vorwiegend ß2).
Die Ausstattung der Luftwege mit ß-Rezeptoren ist allerdings schütter,
der Einfluss von Katecholaminen (vor allem zirkulierenden Adrenalins)
auf den Bronchientonus relativ klein.
Bronchien werden relaxiert, die Sekretion steigt, der Zilienschlag wird beschleunigt, die Histaminfreisetzung gehemmt (vorwiegend ß2).
Die Ausstattung der Luftwege mit ß-Rezeptoren ist allerdings schütter,
der Einfluss von Katecholaminen (vor allem zirkulierenden Adrenalins)
auf den Bronchientonus relativ klein. Regulation:
Die Freisetzung von Katecholaminen aus der Nebenniere unterliegt
(ungleich anderen endokrinen Systemen) keinem Feedback durch die
peripheren Hormone (Adrenalin, Noradrenalin); vielmehr steuert das
Gehirn die Katecholaminsekretion (via Sympathikus und ACTH) nach
Maßgabe der integrierten Belastungslage.
Regulation:
Die Freisetzung von Katecholaminen aus der Nebenniere unterliegt
(ungleich anderen endokrinen Systemen) keinem Feedback durch die
peripheren Hormone (Adrenalin, Noradrenalin); vielmehr steuert das
Gehirn die Katecholaminsekretion (via Sympathikus und ACTH) nach
Maßgabe der integrierten Belastungslage. Zur Physiologie des Adrenalins s. weiters bei:
Zur Physiologie des Adrenalins s. weiters bei:  Stress
Stress  Katecholamine
Katecholamine
 Blutzuckerregulation
Blutzuckerregulation  Autonomes Nervensystem
Autonomes Nervensystem Abbildung ganz oben).
Abbildung ganz oben).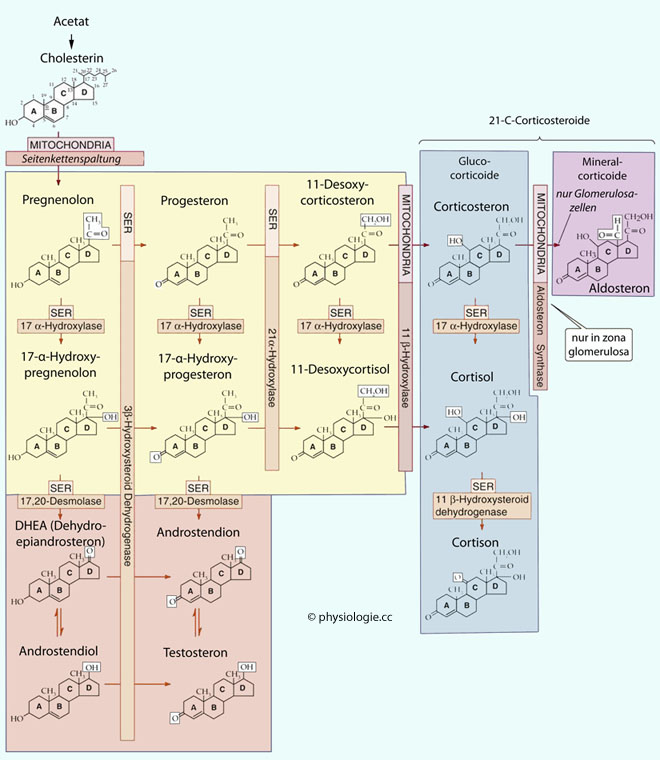
 Abbildung: Synthesewege adrenaler Steroide
Abbildung: Synthesewege adrenaler Steroide Zur Synthese von Steroidhormonen s. auch dort
Zur Synthese von Steroidhormonen s. auch dort
 Abbildung). Alle hier erforderlichen Enzyme befinden sich im
glatten endoplasmatischen Retikulum bzw. in den Mitochondrien und
gehören zur Gruppe der Cytochrom P-450-Oxidasen.
Abbildung). Alle hier erforderlichen Enzyme befinden sich im
glatten endoplasmatischen Retikulum bzw. in den Mitochondrien und
gehören zur Gruppe der Cytochrom P-450-Oxidasen.  Zona fasciculata
Zona fasciculata  Zona reticularis
Zona reticularis Die Außenschicht
(zona glomerulosa) das Mineralcorticoid Aldosteron;
Die Außenschicht
(zona glomerulosa) das Mineralcorticoid Aldosteron;  die Mittelschicht
(zona fasciculata) Glucocorticoide (Cortisol, Cortison, Corticosteron);
die Mittelschicht
(zona fasciculata) Glucocorticoide (Cortisol, Cortison, Corticosteron);  die
Innenschicht (zona reticularis) Hormon-Vorstufen mit androgener Wirkung (Dehydroepiandrosteron, Androstendion).
die
Innenschicht (zona reticularis) Hormon-Vorstufen mit androgener Wirkung (Dehydroepiandrosteron, Androstendion). Abbildung oben) über Seitenkettenabspaltung (side-chain cleavage enzymes) sowie die Produktion weiterer Enzyme an, die für die Cortisolsynthese benötigt werden. Ohne ACTH-Einfluss atrophieren die zona
fasciculata und reticularis; nicht die zona glomerulosa, deren
Aktivität auch durch Angiotensin II sowie hohen Serum-Kaliumspiegel
angeregt wird.
Abbildung oben) über Seitenkettenabspaltung (side-chain cleavage enzymes) sowie die Produktion weiterer Enzyme an, die für die Cortisolsynthese benötigt werden. Ohne ACTH-Einfluss atrophieren die zona
fasciculata und reticularis; nicht die zona glomerulosa, deren
Aktivität auch durch Angiotensin II sowie hohen Serum-Kaliumspiegel
angeregt wird.
 Abbildung: Nebennierenrinde mit ihren drei Zonen
Abbildung: Nebennierenrinde mit ihren drei Zonen
 Mineralcorticoide / Aldosteron: Zona glomerulosa
Mineralcorticoide / Aldosteron: Zona glomerulosa Die
Zellen der äußersten Rindenschicht (zona glomerulosa) exprimieren kein
CYP17 (Steroid-17α-Hydroxylase) und können daher weder Cortisol noch
Androgene synthetisieren. Ihr Produkt ist Aldosteron, das sie via P-450 Enzymen in fünf Schritten herstellen (
Die
Zellen der äußersten Rindenschicht (zona glomerulosa) exprimieren kein
CYP17 (Steroid-17α-Hydroxylase) und können daher weder Cortisol noch
Androgene synthetisieren. Ihr Produkt ist Aldosteron, das sie via P-450 Enzymen in fünf Schritten herstellen ( Abbildung oben):
Abbildung oben): Im endoplasmatischen Retikulum über
Pregnenolon, (Hydroxysteroiddehydrogenase 3ß-HSD) → Progesteron, (21-Hydroxylase CYP21B) → zu 11-Deoxycorticosteron
(DOC), und weiter
Im endoplasmatischen Retikulum über
Pregnenolon, (Hydroxysteroiddehydrogenase 3ß-HSD) → Progesteron, (21-Hydroxylase CYP21B) → zu 11-Deoxycorticosteron
(DOC), und weiter in den Mitochondrien (11-Hydroxylase CYP11B2) → Corticosteron, (18-Hydroxylase CYP11B2) → 18(OH) Corticosteron und
(18-Oxidase CYP11B2) → zu Aldosteron (die letzten drei Schritte werden durch
dasselbe Enzym - CYP11B2 - angeregt).
in den Mitochondrien (11-Hydroxylase CYP11B2) → Corticosteron, (18-Hydroxylase CYP11B2) → 18(OH) Corticosteron und
(18-Oxidase CYP11B2) → zu Aldosteron (die letzten drei Schritte werden durch
dasselbe Enzym - CYP11B2 - angeregt). Die Leber inaktiviert (glukuroniert) so gut wie das gesamte ihr
zuströmende Hormon in einem Durchlauf, und die Niere scheidet es aus;
daher seine kurze Halbwertszeit. Die
Leber macht Aldosteron durch Glukuronierung und Sulfatierung löslich,
dabei wird es auch inaktiviert. Die Ausscheidung erfolgt über die
Niere, etwas auch über die Galle. Aldosteron zählt zu den Hormonen, die
recht rasch eliminiert werden: Die biologische Halbwertszeit beträgt
etwa 20 Minuten.
Die Leber inaktiviert (glukuroniert) so gut wie das gesamte ihr
zuströmende Hormon in einem Durchlauf, und die Niere scheidet es aus;
daher seine kurze Halbwertszeit. Die
Leber macht Aldosteron durch Glukuronierung und Sulfatierung löslich,
dabei wird es auch inaktiviert. Die Ausscheidung erfolgt über die
Niere, etwas auch über die Galle. Aldosteron zählt zu den Hormonen, die
recht rasch eliminiert werden: Die biologische Halbwertszeit beträgt
etwa 20 Minuten.  Aldosteron (Serum, Plasma)
Aldosteron (Serum, Plasma) Starke Abhängigkeit vom Natriumangebot (Kochsalz)
Starke Abhängigkeit vom Natriumangebot (Kochsalz)

 Abbildung)
Abbildung)
 Abbildung), deren Transkription aldosteroninduzierte Proteine (aldosterone-induced proteins, AIPs) entstehen lässt:
Abbildung), deren Transkription aldosteroninduzierte Proteine (aldosterone-induced proteins, AIPs) entstehen lässt: Aldosteron bewirkt vermehrte Einlagerung präformierter epithelialer Natriumkanäle (ENaC) in die - und ihre verzögerte Entfernung (limitiertes Recycling) aus der - apikale(n) (lumenwärts gerichteten) Membran von Hauptzellen im Sammelrohr (
Aldosteron bewirkt vermehrte Einlagerung präformierter epithelialer Natriumkanäle (ENaC) in die - und ihre verzögerte Entfernung (limitiertes Recycling) aus der - apikale(n) (lumenwärts gerichteten) Membran von Hauptzellen im Sammelrohr ( Abbildung). Diese Gleichgewichtsverschiebung vermehrt prompt die Zahl der ENaCs und unterstützt die Na+-Resorption. Mit einer Verzögerung von 30-60 Minuten
verstärkt Aldosteron darüber hinaus die ENaC-Neusynthese.
Abbildung). Diese Gleichgewichtsverschiebung vermehrt prompt die Zahl der ENaCs und unterstützt die Na+-Resorption. Mit einer Verzögerung von 30-60 Minuten
verstärkt Aldosteron darüber hinaus die ENaC-Neusynthese.| Aldosteron wirkt anregend auf die Aktivität der H+-ATPase im Sammelrohr |

 Abbildung: Aldosteronrezeptor und -wirkung
Abbildung: Aldosteronrezeptor und -wirkung IL6, Interleukin 6
IL6, Interleukin 6
 MCP, monocyte chemoattractant protein, auch CCL2 (CC-chemokine ligand), ein Chemokin
MCP, monocyte chemoattractant protein, auch CCL2 (CC-chemokine ligand), ein Chemokin
 Weiters steigert Aldosteron in Hauptzellen des Sammelrohrs die Aktivität der basolateralen Na+/K+-ATPase - diese wird vom Zellinneren in die Membran verlagert
und erleichtert durch Erhöhung des Natriumgradienten die Natriumresorption aus dem Tubuluslumen.
Weiters steigert Aldosteron in Hauptzellen des Sammelrohrs die Aktivität der basolateralen Na+/K+-ATPase - diese wird vom Zellinneren in die Membran verlagert
und erleichtert durch Erhöhung des Natriumgradienten die Natriumresorption aus dem Tubuluslumen.| Hyperaldosteronismus erhöht die Ausscheidung von K+ und H+, senkt das Serum-[K+] und bewirkt nicht-respiratorische Alkalose Aldosteronmangel steigert den Serum- Kaliumspiegel (Hyperkaliämie) und kann - über vermehrten Verlust an Kochsalz - hypotone Dehydration verursachen Auch Hemmung der Mineralcorticoidrezeptoren führt zu Hyperkaliämie |

 Wird die 11-ß-Hydroxy-Steroiddehydrogenase
blockiert, funktioniert das nicht mehr, und die potentiell
mineralcorticoiden Wirkungen des Cortisols machen sich bemerkbar
(Natriumanreicherung, Kaliumverlust, vermehrte H+-Ausscheidung:
Hypokaliämische Hypertonie, Herzrhythmusstörungen, Tetanie,
metabolische Alkalose). Inhaltsstoffe der Lakritze hemmen die 11-ß-Hydroxy-Steroiddehydrogenase, sodass es bei exzessivem Lakritzengenuss zu solchen Symptomen kommen kann.
Wird die 11-ß-Hydroxy-Steroiddehydrogenase
blockiert, funktioniert das nicht mehr, und die potentiell
mineralcorticoiden Wirkungen des Cortisols machen sich bemerkbar
(Natriumanreicherung, Kaliumverlust, vermehrte H+-Ausscheidung:
Hypokaliämische Hypertonie, Herzrhythmusstörungen, Tetanie,
metabolische Alkalose). Inhaltsstoffe der Lakritze hemmen die 11-ß-Hydroxy-Steroiddehydrogenase, sodass es bei exzessivem Lakritzengenuss zu solchen Symptomen kommen kann.
 Abbildung: Die Aldosteronproduktion ist umgekehrt proportional zum Salzdurchsatz
Abbildung: Die Aldosteronproduktion ist umgekehrt proportional zum Salzdurchsatz
 Zwischen Aldosteronspiegel und
NaCl-Ausscheidung besteht eine umgekehrt proportionale Relation (
Zwischen Aldosteronspiegel und
NaCl-Ausscheidung besteht eine umgekehrt proportionale Relation ( Abbildung):
Abbildung):  Je weniger Salz aufgenommen wird, desto mehr Aldosteron wird gebildet - bis zu ~250 µg pro Tag ("normales" NaCl-Angebot) und mehr (>1000 µg/d), wenn die Kochsalzzufuhr ungewöhnlich niedrig ist.
Je weniger Salz aufgenommen wird, desto mehr Aldosteron wird gebildet - bis zu ~250 µg pro Tag ("normales" NaCl-Angebot) und mehr (>1000 µg/d), wenn die Kochsalzzufuhr ungewöhnlich niedrig ist.  Je
mehr Kochsalz dem Körper zugeführt wird, desto geringer fällt die
Aldosteronsynthese aus (biologisch gesehen ist Salzüberschuss - wie in
der westlichen Ernährung üblich - eine Ausnahmesituation, normalerweise
braucht der Körper Aldosteron, um Kochsalz im Körper zu
halten).
Je
mehr Kochsalz dem Körper zugeführt wird, desto geringer fällt die
Aldosteronsynthese aus (biologisch gesehen ist Salzüberschuss - wie in
der westlichen Ernährung üblich - eine Ausnahmesituation, normalerweise
braucht der Körper Aldosteron, um Kochsalz im Körper zu
halten).  Angiotensin II regt die Aldosteronsynthese am intensivsten an, indem es den Transport von freiem Cholesterin über die äußere Mitochondrienmembran mittels StAR (steroidogenic acute regulatory protein) sowie die Aldosteronsynthase CYP11B2 fördert. Das Renin-Angiotensin-System wird durch verringertes Blutvolumen (Hypovolämie),
Blutdruckabfall (Hypotonie), Hyponatriämie und Hyperkaliämie aktiviert.
Angiotensin II regt die Aldosteronsynthese am intensivsten an, indem es den Transport von freiem Cholesterin über die äußere Mitochondrienmembran mittels StAR (steroidogenic acute regulatory protein) sowie die Aldosteronsynthase CYP11B2 fördert. Das Renin-Angiotensin-System wird durch verringertes Blutvolumen (Hypovolämie),
Blutdruckabfall (Hypotonie), Hyponatriämie und Hyperkaliämie aktiviert. Erhöhter Kaliumspiegel depolarisiert die Zellen der zona glomerulosa, das öffnet spannungsabhängige Ca++-Kanäle und stimuliert die Aldosteronsynthese.
Erhöhter Kaliumspiegel depolarisiert die Zellen der zona glomerulosa, das öffnet spannungsabhängige Ca++-Kanäle und stimuliert die Aldosteronsynthese.  ACTH spielt bei der Steuerung der Aldosteronproduktion eine geringere Rolle; akute ACTH-Spitzen haben anregende Wirkung, und zwar über MC2-Rezeptoren der Glomerulosazellen (G-Protein → Adenylatcyclase → cAMP → PKA →
phosphorylierte Proteine). Ein zweiter (indirekter) Wirkmechanismus
funktioniert über gesteigerte Synthese von Cortisol, Corticosteron und
Desoxycorticosteron (s. Abbildung) in der zona fasciculata, die schwache Mineralcorticoidwirkung ausüben.
ACTH spielt bei der Steuerung der Aldosteronproduktion eine geringere Rolle; akute ACTH-Spitzen haben anregende Wirkung, und zwar über MC2-Rezeptoren der Glomerulosazellen (G-Protein → Adenylatcyclase → cAMP → PKA →
phosphorylierte Proteine). Ein zweiter (indirekter) Wirkmechanismus
funktioniert über gesteigerte Synthese von Cortisol, Corticosteron und
Desoxycorticosteron (s. Abbildung) in der zona fasciculata, die schwache Mineralcorticoidwirkung ausüben. | Hyperkaliämie stimuliert die Aldosteronausschüttung |
 Die aus dem Herzen bei zunehmender Dehnung freigesetzten atrialen natriuretischen Peptide hemmen die Aldosteronsynthese in der zona glomerulosa und bewirken verstärkte Ausscheidung von Salz und Wasser in der Niere.
Die aus dem Herzen bei zunehmender Dehnung freigesetzten atrialen natriuretischen Peptide hemmen die Aldosteronsynthese in der zona glomerulosa und bewirken verstärkte Ausscheidung von Salz und Wasser in der Niere. 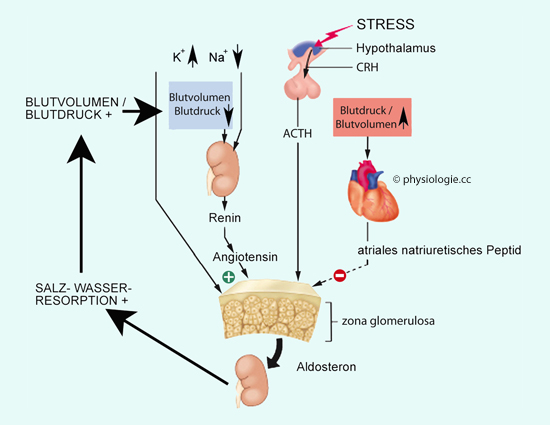
 Abbildung:
Die Nebenniere im Brennpunkt der mittelfristigen Kreislaufregulation
Abbildung:
Die Nebenniere im Brennpunkt der mittelfristigen Kreislaufregulation
 Abbildung), und neben autonom-nervösen Reaktionen auf z.B.
Barorezeptorreizung wirken sich auf diesem Wege Änderungen von
Blutvolumen und Blutdruck auf Nebennierenrinde und Salz-Wasserhaushalt
aus.
Abbildung), und neben autonom-nervösen Reaktionen auf z.B.
Barorezeptorreizung wirken sich auf diesem Wege Änderungen von
Blutvolumen und Blutdruck auf Nebennierenrinde und Salz-Wasserhaushalt
aus.  Der
Aldosteronantagonist Spironolacton blockiert Aldosteronrezeptoren und wird therapeutisch eingesetzt.
Der
Aldosteronantagonist Spironolacton blockiert Aldosteronrezeptoren und wird therapeutisch eingesetzt.  Systemische Wirkungen
Systemische Wirkungen  Regulation
Regulation s. dort),
beeinflusst aber darüber hinaus viele weitere Körperfunktionen, indem
es in Transkriptionsvorgänge eingreift und auf Nerven-, Immun-,
Bewegungs-, kardiovaskuläres und andere Systeme einwirkt.
s. dort),
beeinflusst aber darüber hinaus viele weitere Körperfunktionen, indem
es in Transkriptionsvorgänge eingreift und auf Nerven-, Immun-,
Bewegungs-, kardiovaskuläres und andere Systeme einwirkt.
 Abbildung: Achse Stress - Hypothalamus - Hypophyse - Nebenniere
Abbildung: Achse Stress - Hypothalamus - Hypophyse - Nebenniere PKA, Proteinkinase
A
PKA, Proteinkinase
A < Cortisol
< Cortisol

 Enzyme in der zona fasciculata der NNR bilden aus
Pregnenolon über mehrere Zwischenstufen (die meisten im
endoplasmatischen Rertikulum) auf zwei verschiedenen Wegen Glucocorticoide (s. Abbildung oben):
Enzyme in der zona fasciculata der NNR bilden aus
Pregnenolon über mehrere Zwischenstufen (die meisten im
endoplasmatischen Rertikulum) auf zwei verschiedenen Wegen Glucocorticoide (s. Abbildung oben): Pregnenolon
(CYP17) → 17(OH)Pregnenolon, (3ß-HSD) → 17(OH)Progesteron, (CYP21A2) →
11-DesoxyCortisol, (mitochondriales CYP11B1) → Cortisol
Pregnenolon
(CYP17) → 17(OH)Pregnenolon, (3ß-HSD) → 17(OH)Progesteron, (CYP21A2) →
11-DesoxyCortisol, (mitochondriales CYP11B1) → Cortisol  Pregnenolon (3ß-HSD) → Progesteron, (CYP21A2) → DOC, (CYP11B1) → Corticosteron
Pregnenolon (3ß-HSD) → Progesteron, (CYP21A2) → DOC, (CYP11B1) → Corticosteron Glucocorticoide werden in der Leber
enzymatisch über mehrere Schritte inaktiviert, konjugiert (sulfatiert / glukuroniert) und vor allem über den Harn entfernt.
In die Galle gelangte Konjugate gelangen in den enterohepatischen
Kreislauf und werden dort weiter modifiziert.
Glucocorticoide werden in der Leber
enzymatisch über mehrere Schritte inaktiviert, konjugiert (sulfatiert / glukuroniert) und vor allem über den Harn entfernt.
In die Galle gelangte Konjugate gelangen in den enterohepatischen
Kreislauf und werden dort weiter modifiziert. Glycyrrhizinsäure, ein
Inhaltsstoff der aus Süßholzwurzeln gewonnenen Lakritze (black licorice), hemmt 11ß-HSD2. Dies blockiert bei übermäßigem Lakritzgenuss den Umbau Cortisol → Cortison, verstärkt die Mineralcorticoidwirkung des (nicht abgebauten) Cortisols und führt u.a. zu Bluthochdruck (s. oben).
Glycyrrhizinsäure, ein
Inhaltsstoff der aus Süßholzwurzeln gewonnenen Lakritze (black licorice), hemmt 11ß-HSD2. Dies blockiert bei übermäßigem Lakritzgenuss den Umbau Cortisol → Cortison, verstärkt die Mineralcorticoidwirkung des (nicht abgebauten) Cortisols und führt u.a. zu Bluthochdruck (s. oben). Cortisol (Serum)
Cortisol (Serum)


 Abbildung).
Abbildung). 
 Abbildung: Zelluläre Wirkung von Glucocorticoiden
Abbildung: Zelluläre Wirkung von Glucocorticoiden Der Glucocorticoidrezeptor (Cortisolrezeptor) wird auch als Typ II- Corticosteroidrezeptor bezeichnet. Unter Typ I- Corticosteroidrezeptor versteht man den Mineralcorticoidrezeptor (Aldosteronrezeptor).
Der Glucocorticoidrezeptor (Cortisolrezeptor) wird auch als Typ II- Corticosteroidrezeptor bezeichnet. Unter Typ I- Corticosteroidrezeptor versteht man den Mineralcorticoidrezeptor (Aldosteronrezeptor). Abbildung) bzw. mit Proteinkinasen / Phosphatasen. Dazu kommt,
dass vom Rezeptor zahlreiche Isoformen / Splice-Varianten existieren.
Abbildung) bzw. mit Proteinkinasen / Phosphatasen. Dazu kommt,
dass vom Rezeptor zahlreiche Isoformen / Splice-Varianten existieren. 
 Abbildung: Physiologische Systemwirkungen von Glucocorticoiden
Abbildung: Physiologische Systemwirkungen von Glucocorticoiden
 Im postdigestiven (bzw. Hungerzustand - niedriger Insulin / Glukagon-Quotient) stellt Cortisol die
Energieversorgung des Körpers sicher und optimiert das Wirkungsspektrum
der ebenfalls erhöhten Katecholamin- und Glukagonspiegel. Lipolyse und
Gluconeogenese werden angeregt. Die meisten Immunreaktionen werden in
ihrer Intensität gedämpft.
Im postdigestiven (bzw. Hungerzustand - niedriger Insulin / Glukagon-Quotient) stellt Cortisol die
Energieversorgung des Körpers sicher und optimiert das Wirkungsspektrum
der ebenfalls erhöhten Katecholamin- und Glukagonspiegel. Lipolyse und
Gluconeogenese werden angeregt. Die meisten Immunreaktionen werden in
ihrer Intensität gedämpft. In der digestiven Phase hingegen
(hoher Insulin / Glukagon-Quotient) ist der Cortisolspiegel
normalerweise niedrig. Ist er dennoch erhöht (wie bei Mb. Cushing), hat
Cortisol diabetogene Wirkung (erhöhte Glykogensynthese in der Leber,
verminderte Glucoseaufnahme im Muskel etc) und erhöht den Appetit.
In der digestiven Phase hingegen
(hoher Insulin / Glukagon-Quotient) ist der Cortisolspiegel
normalerweise niedrig. Ist er dennoch erhöht (wie bei Mb. Cushing), hat
Cortisol diabetogene Wirkung (erhöhte Glykogensynthese in der Leber,
verminderte Glucoseaufnahme im Muskel etc) und erhöht den Appetit. Im Hungerzustand fördern Glucocorticoide die Resorption von Glucose im Dünndarm (wo sie auch mit der Calciumresorption interferieren, daher bewirkt Langzeittherapie mit Glucocorticoiden Osteoporose) und reduzieren die Glucoseaufnahme in der Peripherie (Skelettmuskel: Abbau von Protein, Fettgewebe: Lipolyse) durch Aktivitätsreduktion von GLUT4 (diabetogene Wirkung). Der
Blutzuckerspiegel wird stabilisiert, Glucosetoleranz und Insulinempfindlichkeit
sind reduziert (Cortisol ist ein Insulinantagonist an Muskel- und Fettzellen). In erhöhter Konzentration kann Cortisol zusammen mit Insulin die hepatische Glykogensynthese anregen und zu Muskelschwund durch exzessive Proteolyse führen
Im Hungerzustand fördern Glucocorticoide die Resorption von Glucose im Dünndarm (wo sie auch mit der Calciumresorption interferieren, daher bewirkt Langzeittherapie mit Glucocorticoiden Osteoporose) und reduzieren die Glucoseaufnahme in der Peripherie (Skelettmuskel: Abbau von Protein, Fettgewebe: Lipolyse) durch Aktivitätsreduktion von GLUT4 (diabetogene Wirkung). Der
Blutzuckerspiegel wird stabilisiert, Glucosetoleranz und Insulinempfindlichkeit
sind reduziert (Cortisol ist ein Insulinantagonist an Muskel- und Fettzellen). In erhöhter Konzentration kann Cortisol zusammen mit Insulin die hepatische Glykogensynthese anregen und zu Muskelschwund durch exzessive Proteolyse führen Cortisol mobilisiert Glykogen- und
Proteinspeicher, veranlasst den Umbau von Aminosäuren zu Glucose (Gluconeogenese in der Leber: Gesteigerte Expression von PEPCK - Phosphoenolpyruvat-Karboxylase - und Glucose-6-Phosphatase). Die Mobilisierung von Aminosäuren (Proteolyse in Muskel, Bindegewebe, Haut u.a.) für die Gluconeogenese bedingt eine negative Stickstoffbilanz
Cortisol mobilisiert Glykogen- und
Proteinspeicher, veranlasst den Umbau von Aminosäuren zu Glucose (Gluconeogenese in der Leber: Gesteigerte Expression von PEPCK - Phosphoenolpyruvat-Karboxylase - und Glucose-6-Phosphatase). Die Mobilisierung von Aminosäuren (Proteolyse in Muskel, Bindegewebe, Haut u.a.) für die Gluconeogenese bedingt eine negative Stickstoffbilanz Die Lipolyse wird im Hungerzustand durch Glucocorticoide begünstigt, die Spaltung von
Triglyzeriden steigert den Fettsäurespiegel im Blut; die Lipoproteinlipase wird aktiviert, die Expression von
Fettsäuresynthase gehemmt. Ist Cortisol in der digestiven Phase
erhöht, regt es die Masse an abdominellem (viszeralem) und
subkapsulärem Fettgewebe sowie die Reifung von Präadipozyten zu
Adipozyten an (Mb. Cushing)
Die Lipolyse wird im Hungerzustand durch Glucocorticoide begünstigt, die Spaltung von
Triglyzeriden steigert den Fettsäurespiegel im Blut; die Lipoproteinlipase wird aktiviert, die Expression von
Fettsäuresynthase gehemmt. Ist Cortisol in der digestiven Phase
erhöht, regt es die Masse an abdominellem (viszeralem) und
subkapsulärem Fettgewebe sowie die Reifung von Präadipozyten zu
Adipozyten an (Mb. Cushing) Glucocorticoide steigern die Empfindlichkeit von Adrenozeptoren (permissive Wirkung), die Katecholaminwirkung steigt dadurch an (Lipolyse, positive Wirkung auf Herzqualitäten, Vasokonstriktion → Blutdruckanstieg); auch regen sie die Synthese von Katecholaminen im Nebennierenmark an. So werden Kreislauf (Herzstärkung, Blutdruckerhöhung) und Hirnfunktionen unterstützt. Cortisol fördert auch die Erythropoese und steigert dadurch die Sauerstoff-Transportkapazität
Glucocorticoide steigern die Empfindlichkeit von Adrenozeptoren (permissive Wirkung), die Katecholaminwirkung steigt dadurch an (Lipolyse, positive Wirkung auf Herzqualitäten, Vasokonstriktion → Blutdruckanstieg); auch regen sie die Synthese von Katecholaminen im Nebennierenmark an. So werden Kreislauf (Herzstärkung, Blutdruckerhöhung) und Hirnfunktionen unterstützt. Cortisol fördert auch die Erythropoese und steigert dadurch die Sauerstoff-Transportkapazität Cortisol hemmt die Neubildung von Knochensubstanz und fördert deren Resorption, indem es Osteoblasten hemmt, andererseits die Calciumresorption im Darm und die tubuläre Rückresortion in der Niere reduziert. [Ca++] sinkt im Blut, das regt die Sekretion von Parathormon an, und dieses mobilisiert Calcium aus dem Knochen (osteoporotische Wirkung)
Cortisol hemmt die Neubildung von Knochensubstanz und fördert deren Resorption, indem es Osteoblasten hemmt, andererseits die Calciumresorption im Darm und die tubuläre Rückresortion in der Niere reduziert. [Ca++] sinkt im Blut, das regt die Sekretion von Parathormon an, und dieses mobilisiert Calcium aus dem Knochen (osteoporotische Wirkung)| Cortisol wirkt katabol (aufbauhemmend) auf den Knochenstoffwechsel |

 Auf den Darm übt Cortisol einen trophischen Effekt aus; bei Cortisolmangel degeneriert die Mukosa, die Peristaltik nimmt ab, die Sekretion ebenfalls. Cortisol fördert die Salzsäurebildung in der Magenschleimhaut und hemmt
die Muzinsekretion (ulzerogene Wirkung)
Auf den Darm übt Cortisol einen trophischen Effekt aus; bei Cortisolmangel degeneriert die Mukosa, die Peristaltik nimmt ab, die Sekretion ebenfalls. Cortisol fördert die Salzsäurebildung in der Magenschleimhaut und hemmt
die Muzinsekretion (ulzerogene Wirkung) Cortisol hemmt die Freisetzung und Wirkung von Vasopressin (=Adiuretin). Abwesenheit von Cortisol führt zu Erniedrigung der Freiwasserclearance
Cortisol hemmt die Freisetzung und Wirkung von Vasopressin (=Adiuretin). Abwesenheit von Cortisol führt zu Erniedrigung der Freiwasserclearance Cortisol beteiligt sich bei körperlicher Belastung an der "Umleitung" der Perfusion zur
Arbeitsmuskulatur
Cortisol beteiligt sich bei körperlicher Belastung an der "Umleitung" der Perfusion zur
Arbeitsmuskulatur Cortisol
hemmt reproduktives Verhalten sowie die hormonelle Achse Hypothalamus -
Hypophyse - Gonaden, sodass in Stresssituationen der Energieverbrauch
des Fortpflanzungssystems heruntergefahren wird. Dauerstress kann zu
Atrophie der Gonaden führen
Cortisol
hemmt reproduktives Verhalten sowie die hormonelle Achse Hypothalamus -
Hypophyse - Gonaden, sodass in Stresssituationen der Energieverbrauch
des Fortpflanzungssystems heruntergefahren wird. Dauerstress kann zu
Atrophie der Gonaden führen Die anti-inflammatorische (entzündungshemmende) Wirkung der
Glucocorticoide ist komplex und hängt vom jeweiligen Gewebe, seinem
Zustand sowie von Zeitfaktoren ab. Cortisol reduziert die
Bildung von Immunzellen (Eosinophilen, Helfer-T-Zellen), die Aktivität
von Phagozyten (Stabilisierung lysosomaler Membranen) und die
Extravasation von Leukozyten (s. unten); die Antikörperproduktion ist
nicht verändert. Sie hemmen die Aktivität von Feribroblasten und die
Bildung von Grundsubstanz, können so auch Heilungsprozesse verzögern.
Glucocorticoide tragen insgesamt zu einer niedrigen Entzündungsbereitschaft des Immunsystems bei. Entzündungen erhöhen die Bildung von Glucocorticoiden, wie auch Belastungen allgemein (auch schon die bloße Erwartung einer Stress-Situation).
Die anti-inflammatorische (entzündungshemmende) Wirkung der
Glucocorticoide ist komplex und hängt vom jeweiligen Gewebe, seinem
Zustand sowie von Zeitfaktoren ab. Cortisol reduziert die
Bildung von Immunzellen (Eosinophilen, Helfer-T-Zellen), die Aktivität
von Phagozyten (Stabilisierung lysosomaler Membranen) und die
Extravasation von Leukozyten (s. unten); die Antikörperproduktion ist
nicht verändert. Sie hemmen die Aktivität von Feribroblasten und die
Bildung von Grundsubstanz, können so auch Heilungsprozesse verzögern.
Glucocorticoide tragen insgesamt zu einer niedrigen Entzündungsbereitschaft des Immunsystems bei. Entzündungen erhöhen die Bildung von Glucocorticoiden, wie auch Belastungen allgemein (auch schon die bloße Erwartung einer Stress-Situation).| Cortisol hemmt die Bildung von Lymphozyten |
 Da Glucocorticoide auch an Mineralcorticoidrezeptoren binden, regen sie in der Niere die Natriumresorption und Kaliumsekretion an.
Da Glucocorticoide auch an Mineralcorticoidrezeptoren binden, regen sie in der Niere die Natriumresorption und Kaliumsekretion an. Eine normale Konzentration und Tagesrhythmik der Glucocorticoide stabilisiert Hirnfunktion und psychische Stabilität. Sowohl Mangel als auch Überschuss von Cortisol
hat psychologische Auswirkungen (Verhaltensstörungen, Irritierbarkeit, Schlaflosigkeit, Depression,
Apathie).
Eine normale Konzentration und Tagesrhythmik der Glucocorticoide stabilisiert Hirnfunktion und psychische Stabilität. Sowohl Mangel als auch Überschuss von Cortisol
hat psychologische Auswirkungen (Verhaltensstörungen, Irritierbarkeit, Schlaflosigkeit, Depression,
Apathie). Glucocorticoide werden für die normale Entwicklung des Feten benötigt.
Das gilt insbesondere für die Entwicklung von Gehirn, Sinnesorganen,
Gastrointestinaltrakt, Haut und Lunge (Reifung von Typ-2-Zellen: Bildung von Surfactant).
Glucocorticoide werden für die normale Entwicklung des Feten benötigt.
Das gilt insbesondere für die Entwicklung von Gehirn, Sinnesorganen,
Gastrointestinaltrakt, Haut und Lunge (Reifung von Typ-2-Zellen: Bildung von Surfactant).| Cortisol hat Mineralcorticoidwirkung und kann den arteriellen Blutdruck steigern |

 Abbildung: Glucocorticoidwirkungen an Zellen des Immunsystems
Abbildung: Glucocorticoidwirkungen an Zellen des Immunsystems Apoptose s. dort
Apoptose s. dort
 B-Zellen und Antikörper s. dort
B-Zellen und Antikörper s. dort
 Dendritische Zellen s. dort
Dendritische Zellen s. dort
 Granulozyten und Makrophagen s. dort
Granulozyten und Makrophagen s. dort
 Mastzellen s. dort
Mastzellen s. dort
 Th1-, Th2-, Th17-, Treg-Zellen s. dort
Th1-, Th2-, Th17-, Treg-Zellen s. dort
 Zytokine (Interleukin etc) s. dort
Zytokine (Interleukin etc) s. dort 
 Abbildung): Cortisol schützt den Organismus vor allzu starker Aktivierung von Entzündungsmechanismen, es wirkt entzündungshemmend (anti-inflammatorisch
Abbildung): Cortisol schützt den Organismus vor allzu starker Aktivierung von Entzündungsmechanismen, es wirkt entzündungshemmend (anti-inflammatorisch  , antiphlogistisch
, antiphlogistisch  ) und immunsuppressiv.
Immunantworten und entzündliche Geschehen sind oft Begleiterscheinungen
von Stress, und diese sind potentiell gewebeschädigend. Cortisol stellt
in dieser Situation ein homöostatisches Gegengewicht dar - zusammen mit
Katecholaminen hemmt es die Bildung proinflammatorischer, und fördert
die Sekretion antiinflammatorischer Zytokine. Cortisol tut dies z.T.
durch Hemmung der Phospholipase 2, einem Schlüsselenzym der Synthese von Eikosanoiden (Prostaglandin, Thromboxan, Leukotriene).
) und immunsuppressiv.
Immunantworten und entzündliche Geschehen sind oft Begleiterscheinungen
von Stress, und diese sind potentiell gewebeschädigend. Cortisol stellt
in dieser Situation ein homöostatisches Gegengewicht dar - zusammen mit
Katecholaminen hemmt es die Bildung proinflammatorischer, und fördert
die Sekretion antiinflammatorischer Zytokine. Cortisol tut dies z.T.
durch Hemmung der Phospholipase 2, einem Schlüsselenzym der Synthese von Eikosanoiden (Prostaglandin, Thromboxan, Leukotriene).

 Abbildung: Pulsatil-zirkadiane Sekretion von ACTH und Cortisol beim Menschen
Abbildung: Pulsatil-zirkadiane Sekretion von ACTH und Cortisol beim Menschen
 Abbildung). Der Cortisolspiegel im Blut ist zwischen Mitternacht und 3 Uhr morgens am niedrigsten, etwa
80% der täglichen Produktion (10-30 mg/d)
entstehen zwischen 4 und 8 Uhr morgens.
Abbildung). Der Cortisolspiegel im Blut ist zwischen Mitternacht und 3 Uhr morgens am niedrigsten, etwa
80% der täglichen Produktion (10-30 mg/d)
entstehen zwischen 4 und 8 Uhr morgens.  Glucocorticoidpräparate sollten
in diesem Zeitfenster verabfolgt werden, um den physiologischen
Rhythmus zu wahren.
Glucocorticoidpräparate sollten
in diesem Zeitfenster verabfolgt werden, um den physiologischen
Rhythmus zu wahren. 
 Abbildung: Biosynthese von Steroidhormonen
Abbildung: Biosynthese von Steroidhormonen Die Umwandlung von Cholesterin zu Pregnenolon ist der geschwindigkeitsbestimmende Schritt und wird durch ACTH reguliert. Aminoglutethimid hemmt diesen ersten Schritt der Biosynthese und wirkt ähnlich wie Metapyron, das die Synthese von Corticosteron und Cortisol blockiert. Trilostan
(fast nur noch veterinärmedizinisch eingesetzt) inhibiert
3ß-Hydroxylase - und damit die Synthese von Progesteronen und
Androstendion. Carbenoxolon greift an der Umsetzung von Cortisol zu Cortison an
Die Umwandlung von Cholesterin zu Pregnenolon ist der geschwindigkeitsbestimmende Schritt und wird durch ACTH reguliert. Aminoglutethimid hemmt diesen ersten Schritt der Biosynthese und wirkt ähnlich wie Metapyron, das die Synthese von Corticosteron und Cortisol blockiert. Trilostan
(fast nur noch veterinärmedizinisch eingesetzt) inhibiert
3ß-Hydroxylase - und damit die Synthese von Progesteronen und
Androstendion. Carbenoxolon greift an der Umsetzung von Cortisol zu Cortison an
 In
ACTH-bildenden Vorderlappenzellen bindet Cortisol an zytoplasmatische
Rezeptoren, der Komplex wandert zum Zellkern und moduliert die
Genexpression - was sowohl die Synthese von ACTH als auch von
CRH-Rezeptoren reduziert. Außerdem wird die Freisetzung ACTH-hältiger
Vesikel gehemmt.
In
ACTH-bildenden Vorderlappenzellen bindet Cortisol an zytoplasmatische
Rezeptoren, der Komplex wandert zum Zellkern und moduliert die
Genexpression - was sowohl die Synthese von ACTH als auch von
CRH-Rezeptoren reduziert. Außerdem wird die Freisetzung ACTH-hältiger
Vesikel gehemmt. Weniger
bedeutsam ist die Rückkopplung auf hypothalamische Zellen: Cortisol
reduziert hier die Transkription von CRH sowie die (pulsatile)
Freisetzung gespeicherten CRH.
Weniger
bedeutsam ist die Rückkopplung auf hypothalamische Zellen: Cortisol
reduziert hier die Transkription von CRH sowie die (pulsatile)
Freisetzung gespeicherten CRH. 
 Weder
adrenale Androgene noch ihre Metabolite (Testosteron,
Dihydrotestosteron, Östradiol) haben negative Rückkopplungswirkung auf
CRH (Hypothalamus) oder ACTH (Hypophyse).
Diese Rückkopplung kann nur durch Cortisol selbst erfolgen;
Enzymdefekte, die dessen Bildung verhindern (z.B. CYP21-Mangel), sind
daher durch sehr hohe ACTH-Spiegel gekennzeichnet, was wiederum die
Synthese der Androgene in die Höhe treibt (kongenitale adrenale Hyperplasie).
Weder
adrenale Androgene noch ihre Metabolite (Testosteron,
Dihydrotestosteron, Östradiol) haben negative Rückkopplungswirkung auf
CRH (Hypothalamus) oder ACTH (Hypophyse).
Diese Rückkopplung kann nur durch Cortisol selbst erfolgen;
Enzymdefekte, die dessen Bildung verhindern (z.B. CYP21-Mangel), sind
daher durch sehr hohe ACTH-Spiegel gekennzeichnet, was wiederum die
Synthese der Androgene in die Höhe treibt (kongenitale adrenale Hyperplasie). 1950 erhielten Edward Kendall, Tadeus Reichstein und Philip Hensch
den Nobelpreis für Physiologie oder Medizin "für ihre Entdeckungen bei
den Hormonen der Nebennierenrinde, ihrer Struktur und ihrer
biologischen Wirkungen". Hench verabreichte 1948 erstmals einer
Patientin mit schwerem Rheuma Cortison; dieses war - wie auch andere
Hormone - von Kendall erstmals isoliert worden. Reichstein hatte
die therapeutische Wirkung des Cortisons postuliert und klärte u.a. die
Struktur des Aldosterons.
1950 erhielten Edward Kendall, Tadeus Reichstein und Philip Hensch
den Nobelpreis für Physiologie oder Medizin "für ihre Entdeckungen bei
den Hormonen der Nebennierenrinde, ihrer Struktur und ihrer
biologischen Wirkungen". Hench verabreichte 1948 erstmals einer
Patientin mit schwerem Rheuma Cortison; dieses war - wie auch andere
Hormone - von Kendall erstmals isoliert worden. Reichstein hatte
die therapeutische Wirkung des Cortisons postuliert und klärte u.a. die
Struktur des Aldosterons.|
Erkrankung |
Cortisolspiegel |
ACTH-Spiegel |
Grund / Mechanismus |
| ACTH- produzierender HVL-Tumor (Cushing's disease) |
erhöht |
erhöht / normal |
Anregung durch ACTH, negatives feedback durch Cortisol an responsiblem Gewebe |
| NNR- Tumor (Cushings's syndrome) |
erhöht | erniedrigt |
Cortisol bremst ACTH-Produktion |
| Ektopischer ACTH- produzierender Tumor |
erhöht | erhöht | Anregung durch ACTH |
| Primäre Nebennieren- insuffizienz |
erniedrigt | erhöht | Niedriger Cortisolspiegel regt ACTH-Produktion an |
| Sekundäre / tertiäre Nebennieren- insuffizienz |
erniedrigt | erniedrigt | NNR ungenügend angeregt |

 Abbildung: Symptome bei Cushing-Syndrom
Abbildung: Symptome bei Cushing-Syndrom Glucocorticoide
in großer Menge über längere Zeit (Glucocorticoid-Langzeittherapie,
ACTH-produzierender Tumor der Hypophyse oder in den Bronchien, Cortisolproduzierender NNR-Tumor) haben ausgeprägte anti-anabole
(aufbauhemmende)
Wirkung, es kommt zum
Cushing-Syndrom
Glucocorticoide
in großer Menge über längere Zeit (Glucocorticoid-Langzeittherapie,
ACTH-produzierender Tumor der Hypophyse oder in den Bronchien, Cortisolproduzierender NNR-Tumor) haben ausgeprägte anti-anabole
(aufbauhemmende)
Wirkung, es kommt zum
Cushing-Syndrom  , das neben
Wirkungen auf Stoffwechsel (Hyperglykämie, Gewichtszunahme)
und Kreislauf (Bluthochdruck) u.a. durch Wassereinlagerungen in Gesicht
und Körper
(Ödeme), Osteoporose (Hemmung der Osteoblasten) und Muskelschwäche
(verstärkter Proteinabbau) gekennzeichnet ist (
, das neben
Wirkungen auf Stoffwechsel (Hyperglykämie, Gewichtszunahme)
und Kreislauf (Bluthochdruck) u.a. durch Wassereinlagerungen in Gesicht
und Körper
(Ödeme), Osteoporose (Hemmung der Osteoblasten) und Muskelschwäche
(verstärkter Proteinabbau) gekennzeichnet ist ( Abbildung).
Abbildung). | Zu
den Symptomen des Cushing-Syndroms zählen Hyperglykämie,
Stammfettsucht, weniger Muskelmasse (Extremitäten), Bluthochdruck,
Abnahme der Lymphozytenzahl |
 Die
abwehrhemmende Wirkung der Glucocorticoide wird therapeutisch
eingesetzt, hochdosiert u.a. zur Dämpfung überschießender
postoperativer Entzündungen, zur Behandlung von Autoimmunkrankheiten,
und in der Transplantationsmedizin.
Die
abwehrhemmende Wirkung der Glucocorticoide wird therapeutisch
eingesetzt, hochdosiert u.a. zur Dämpfung überschießender
postoperativer Entzündungen, zur Behandlung von Autoimmunkrankheiten,
und in der Transplantationsmedizin. Ein hormonproduzierendes Adenom in der zona glomerulosa bedingt das Conn-Syndrom
Ein hormonproduzierendes Adenom in der zona glomerulosa bedingt das Conn-Syndrom  (primärer Hyperaldosteronismus,
gekennzeichnet durch Natriumretention, manchmal kombiniert mit
Kaliumverlust, Alkalose und arterieller Hypertonie). Aufgrund der negativen Rückkopplung ist der Reninspiegel niedrig, der Aldosteron / Renin-Quotient erhöht.
(primärer Hyperaldosteronismus,
gekennzeichnet durch Natriumretention, manchmal kombiniert mit
Kaliumverlust, Alkalose und arterieller Hypertonie). Aufgrund der negativen Rückkopplung ist der Reninspiegel niedrig, der Aldosteron / Renin-Quotient erhöht.  Komplette Nebenniereninsuffizienz führt zu Morbus Addison:
Komplette Nebenniereninsuffizienz führt zu Morbus Addison:  Unbehandelt kommt es zu intensivem Kochsalzverlust, Hyperkaliämie, Muskelschwäche und
Blutdruckabfall, Kreislaufschwäche und lebensgefährlichem Kreislaufversagen. Ursache ist Zerstörung der NNR (primärer Mb.
Addison, ~80%; ACTH-Spiegel wegen der negativen Rückkopplung erhöht) oder ungenügende Stimulation durch das hypothalamisch-hypophysäre System (~20%; ACTH-Spiegel niedrig). Auch nimmt die kutane Pigmentierung zu.
Unbehandelt kommt es zu intensivem Kochsalzverlust, Hyperkaliämie, Muskelschwäche und
Blutdruckabfall, Kreislaufschwäche und lebensgefährlichem Kreislaufversagen. Ursache ist Zerstörung der NNR (primärer Mb.
Addison, ~80%; ACTH-Spiegel wegen der negativen Rückkopplung erhöht) oder ungenügende Stimulation durch das hypothalamisch-hypophysäre System (~20%; ACTH-Spiegel niedrig). Auch nimmt die kutane Pigmentierung zu.| Hyperpigmentierung der Haut ist eines der Symptome eines Morbus Addison |
 Symptome eines Hypoaldosteronismus (Natriummangel, niedriger Blutdruck, Hyperkaliämie, metabolische Azidose) können auch durch Mutation und Funktionsverlust der epithelialen Natriumkanäle (ENaC) bedingt sein.
Symptome eines Hypoaldosteronismus (Natriummangel, niedriger Blutdruck, Hyperkaliämie, metabolische Azidose) können auch durch Mutation und Funktionsverlust der epithelialen Natriumkanäle (ENaC) bedingt sein.| Nebenniereninsuffizienz bedingt Hyponatriämie |


 Die Nebennieren beeinflussen Elektrolythaushalt, Kreislauffunktion, Zucker-, Fett- und Proteinstoffwechsel. Die
Rinde erzeugt Aldosteron (zona glomerulosa), Cortisol (zona
fasciculata), Androgene (zona reticularis); das Mark Adrenalin und
etwas Noradrenalin. ACTH wirkt auf
die gesamte Nebennierenrinde, Angiotensin II regt die Aldosteronbildung
an, Stress stimuliert die Sekretion von Cortisol und Katecholaminen. Bei
Belastungen des Elektrolythaushaltes, Hypoglykämie, Infektionen und
Traumen sind die NN-Funktionen von entscheidender Bedeutung.
Steroide werden nicht gespeichert, sondern nach Bedarf synthetisiert,
dazu verfügen die Rindenzellen über Hydroxylasen, Lyasen, Dehydrogenasen Die Nebennieren beeinflussen Elektrolythaushalt, Kreislauffunktion, Zucker-, Fett- und Proteinstoffwechsel. Die
Rinde erzeugt Aldosteron (zona glomerulosa), Cortisol (zona
fasciculata), Androgene (zona reticularis); das Mark Adrenalin und
etwas Noradrenalin. ACTH wirkt auf
die gesamte Nebennierenrinde, Angiotensin II regt die Aldosteronbildung
an, Stress stimuliert die Sekretion von Cortisol und Katecholaminen. Bei
Belastungen des Elektrolythaushaltes, Hypoglykämie, Infektionen und
Traumen sind die NN-Funktionen von entscheidender Bedeutung.
Steroide werden nicht gespeichert, sondern nach Bedarf synthetisiert,
dazu verfügen die Rindenzellen über Hydroxylasen, Lyasen, Dehydrogenasen Das
Nebennierenmark wird über T5-T11 sympathisch gesteuert.
Einige Reize wirken vorwiegend auf das NN-Mark (z.B. Hypoglykämie),
andere auf den Sympathikus (z.B. Hypovolämie). 20% der Markzellen
bilden Noradrenalin (30% des im Blut kreisenden Noradrenalins stammt aus der Nebenniere; Halbwertzeit im Sekundenbereich, Schwerpunkt Kreislaufanregung), 80% verfügen über PNMT (Cortisol steigert seine Synthese) und bilden Adrenalin (Halbwertzeit
~3 min, Schwerpunkt Lipolyse, Blutzuckerstabilisierung). Präganglionäre (cholinerge) Impulse depolarisieren die Zellen, Ca++
regt die Exozytose der Speichergranula an, gleichzeitig steigt die
Synthese der Katecholamine (stabiler intrazellulärer
Speicherbestand). Adrenalin relaxiert über ß-Rezeptoren Bronchien, Koronar- und Skelettmuskelarteriolen, und triggert in der Niere die Reninfreisetzung Das
Nebennierenmark wird über T5-T11 sympathisch gesteuert.
Einige Reize wirken vorwiegend auf das NN-Mark (z.B. Hypoglykämie),
andere auf den Sympathikus (z.B. Hypovolämie). 20% der Markzellen
bilden Noradrenalin (30% des im Blut kreisenden Noradrenalins stammt aus der Nebenniere; Halbwertzeit im Sekundenbereich, Schwerpunkt Kreislaufanregung), 80% verfügen über PNMT (Cortisol steigert seine Synthese) und bilden Adrenalin (Halbwertzeit
~3 min, Schwerpunkt Lipolyse, Blutzuckerstabilisierung). Präganglionäre (cholinerge) Impulse depolarisieren die Zellen, Ca++
regt die Exozytose der Speichergranula an, gleichzeitig steigt die
Synthese der Katecholamine (stabiler intrazellulärer
Speicherbestand). Adrenalin relaxiert über ß-Rezeptoren Bronchien, Koronar- und Skelettmuskelarteriolen, und triggert in der Niere die Reninfreisetzung  Aldosteron ist das führende Mineralcorticoid, sein Fehlen bewirkt Kochsalz- und Wasserverlust, Dehydration, Kreislaufversagen und ist potentiell tödlich. Aldosteron stammt aus der zona glomerulosa, wird von der Leber rasch glukuroniert / sulfatiert und so inaktiviert (Halbwertszeit
~20 min), die Niere scheidet es aus - zwischen einigen wenigen und >100 mg/d: Je geringer das Salzangebot, desto höher die Aldosteronbildung. In der Zelle bindet Aldosteron an den Mineralcorticoidrezeptor und das Dimer an ein mineralcorticoid response element
der DNA. Die Transkription der Zielgene erzeugt aldosteroninduzierte
Proteine (AIPs). Erhöhte Einlagerung epithelialer Natriumkanäle in die
apikale Membran von Hauptzellen im Sammelrohr verstärkt die Na+-Resorption. Auch steigert Aldosteron die Aktivität der basolateralen Na/K-ATPase und wirkt anregend auf die Aktivität der H+-ATPase (H+-Ausscheidung). Aldosteron
fördert die Rückgewinnung von Kochsalz in Niere, Schweiß- und
Speicheldrüsen, Dickdarm und Lunge, und erhält das extrazelluläre
Volumen aufrecht (Stabilisierung von Blutvolumen und Kreislauf). Es ist
das einzige kaliumwirksame Hormon (Aldosteron fördert die K+-Ausscheidung). Hypovolämie, Hypotonie, Hyponatriämie und Hyperkaliämie aktivieren das Renin-Angiotensin-System, Angiotensin II regt die Aldosteronsynthese an (Cholesterintransport über die äußere Mitochondrienmembran, Aldosteronsynthase CYP11B2) Aldosteron ist das führende Mineralcorticoid, sein Fehlen bewirkt Kochsalz- und Wasserverlust, Dehydration, Kreislaufversagen und ist potentiell tödlich. Aldosteron stammt aus der zona glomerulosa, wird von der Leber rasch glukuroniert / sulfatiert und so inaktiviert (Halbwertszeit
~20 min), die Niere scheidet es aus - zwischen einigen wenigen und >100 mg/d: Je geringer das Salzangebot, desto höher die Aldosteronbildung. In der Zelle bindet Aldosteron an den Mineralcorticoidrezeptor und das Dimer an ein mineralcorticoid response element
der DNA. Die Transkription der Zielgene erzeugt aldosteroninduzierte
Proteine (AIPs). Erhöhte Einlagerung epithelialer Natriumkanäle in die
apikale Membran von Hauptzellen im Sammelrohr verstärkt die Na+-Resorption. Auch steigert Aldosteron die Aktivität der basolateralen Na/K-ATPase und wirkt anregend auf die Aktivität der H+-ATPase (H+-Ausscheidung). Aldosteron
fördert die Rückgewinnung von Kochsalz in Niere, Schweiß- und
Speicheldrüsen, Dickdarm und Lunge, und erhält das extrazelluläre
Volumen aufrecht (Stabilisierung von Blutvolumen und Kreislauf). Es ist
das einzige kaliumwirksame Hormon (Aldosteron fördert die K+-Ausscheidung). Hypovolämie, Hypotonie, Hyponatriämie und Hyperkaliämie aktivieren das Renin-Angiotensin-System, Angiotensin II regt die Aldosteronsynthese an (Cholesterintransport über die äußere Mitochondrienmembran, Aldosteronsynthase CYP11B2) Cortisol ist das wichtigste Glucocorticoid; der Cortisolspiegel ist zwischen Mitternacht und 3 Uhr morgens am
niedrigsten, etwa 80% der am Tag gebildeten 10-30 mg entstehen zwischen 4
und 8 Uhr morgens. Stress regt die Bildung von CRH und ACTH an, Enzyme in der zona fasciculata bilden aus Pregnenolon über mehrere Zwischenstufen Glucocorticoide (Cortisol, Corticosteron). Transcortin (CBG) transportiert ~90% des Cortisols im Blut. Cortisol bindet in der Zelle an den Cortisolrezeptor (Dimerisierung, Bindung an glucocorticoid response elements
in der Nähe von Promotersequenzen Cortisol-regulierter Gene,
Mobilisierung von Koaktivatoren und Korepressoren, Interaktion mit
anderen Transkriptionsfaktoren). Glucocorticoide stellen Energieträger
bereit; sie helfen bei der Anpassung an Belastungssituationen
(Muskelarbeit, Nahrungsmangel, "Stresshormon"). Die metabolischen
Wirkungen hängen von der Stoffwechsellage ab: Im Hungerzustand
(niedriger Insulin / Glukagon-Quotient) Energieversorgung (Lipolyse, Gluconeogenese), in der digestiven Phase (hoher Insulin /
Glukagon-Quotient) diabetogene Wirkung. Cortisol wirkt katabol auf den
Knochenstoffwechsel, hemmt reproduktives Verhalten sowie die hormonelle
Achse Hypothalamus - Hypophyse - Gonaden, reduziert die Bildung von
Immunzellen und die Extravasation von Leukozyten. Normale Konzentration
und Tagesrhythmik der Glucocorticoide stabilisiert Hirnfunktion und
psychische Stabilität (sowohl Mangel als auch Überschuss von Cortisol
hat Auswirkungen auf die Psyche). Cortisol hat Mineralcorticoidwirkung
und kann den arteriellen Blutdruck steigern Cortisol ist das wichtigste Glucocorticoid; der Cortisolspiegel ist zwischen Mitternacht und 3 Uhr morgens am
niedrigsten, etwa 80% der am Tag gebildeten 10-30 mg entstehen zwischen 4
und 8 Uhr morgens. Stress regt die Bildung von CRH und ACTH an, Enzyme in der zona fasciculata bilden aus Pregnenolon über mehrere Zwischenstufen Glucocorticoide (Cortisol, Corticosteron). Transcortin (CBG) transportiert ~90% des Cortisols im Blut. Cortisol bindet in der Zelle an den Cortisolrezeptor (Dimerisierung, Bindung an glucocorticoid response elements
in der Nähe von Promotersequenzen Cortisol-regulierter Gene,
Mobilisierung von Koaktivatoren und Korepressoren, Interaktion mit
anderen Transkriptionsfaktoren). Glucocorticoide stellen Energieträger
bereit; sie helfen bei der Anpassung an Belastungssituationen
(Muskelarbeit, Nahrungsmangel, "Stresshormon"). Die metabolischen
Wirkungen hängen von der Stoffwechsellage ab: Im Hungerzustand
(niedriger Insulin / Glukagon-Quotient) Energieversorgung (Lipolyse, Gluconeogenese), in der digestiven Phase (hoher Insulin /
Glukagon-Quotient) diabetogene Wirkung. Cortisol wirkt katabol auf den
Knochenstoffwechsel, hemmt reproduktives Verhalten sowie die hormonelle
Achse Hypothalamus - Hypophyse - Gonaden, reduziert die Bildung von
Immunzellen und die Extravasation von Leukozyten. Normale Konzentration
und Tagesrhythmik der Glucocorticoide stabilisiert Hirnfunktion und
psychische Stabilität (sowohl Mangel als auch Überschuss von Cortisol
hat Auswirkungen auf die Psyche). Cortisol hat Mineralcorticoidwirkung
und kann den arteriellen Blutdruck steigern Die zona reticularis bildet - angeregt durch ACTH - Androstendion sowie die Vorläufer DHEA und DHEAS. Bei Männern verstärken sie
die Ausprägung männlicher sekundärer Geschlechtsmerkmale, nicht
das Wachstum der Gonaden (Testosteron);
die periphere Umwandlung adrenaler zu aktiven Androgenen spielt hier
eine geringe Rolle, bei Frauen hingegen tragen adrenale Androgene zu
50% der zirkulierenden aktiven Androgene bei (Achsel- und
Schambehaarung, Libido). Androstendion und DHEA zeigen zirkadiane
Rhythmik (DHEAS wegen der langen Halbwertszeit nicht). Weder adrenale
Androgene noch ihre Metabolite (Testosteron, Dihydrotestosteron,
Östradiol) haben negative Rückkopplungswirkung auf CRH (Hypothalamus)
oder ACTH (Hypophyse), die Rückkopplung erfolgt nur durch Cortisol Die zona reticularis bildet - angeregt durch ACTH - Androstendion sowie die Vorläufer DHEA und DHEAS. Bei Männern verstärken sie
die Ausprägung männlicher sekundärer Geschlechtsmerkmale, nicht
das Wachstum der Gonaden (Testosteron);
die periphere Umwandlung adrenaler zu aktiven Androgenen spielt hier
eine geringe Rolle, bei Frauen hingegen tragen adrenale Androgene zu
50% der zirkulierenden aktiven Androgene bei (Achsel- und
Schambehaarung, Libido). Androstendion und DHEA zeigen zirkadiane
Rhythmik (DHEAS wegen der langen Halbwertszeit nicht). Weder adrenale
Androgene noch ihre Metabolite (Testosteron, Dihydrotestosteron,
Östradiol) haben negative Rückkopplungswirkung auf CRH (Hypothalamus)
oder ACTH (Hypophyse), die Rückkopplung erfolgt nur durch Cortisol |
