

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


Sexualität, Reproduktion, Entwicklung und Wachstum
Reproduktionssystem des Mannes
Reproduktionssystem des Mannes
© H. Hinghofer-Szalkay



 Adrenarche: ad = an, ren = Niere (Nebenniere), ρχή = Anfang
Adrenarche: ad = an, ren = Niere (Nebenniere), ρχή = Anfang| SRY (sex-determining region Y, auch testis determining factor TDF) ist ein Y-chromosomal codierter Transkriptionsfaktor. Unter seiner Wirkung entwickeln sich die (zunächst neutralen) Gonadenanlagen zu Hoden, fehlt er, entwickeln sie sich zu Ovarien. MIF (Müllerian inhibiting factor) wird nur in Sertoli-Zellen gebildet und bewirkt die Rückbildung der Müller-Gänge. Testosteron bringt die Wolff-Gänge dazu, sich zu Nebenhoden, Samenleiter und Samenblase zu entwickeln. Testosteron sowie seine Metaboliten Dihydrotestosteron und Östradiol (das in vielen Geweben aus Testosteron entsteht) bewirken androgene Effekte. Der Androgenrezeptor ist ein Transkriptionsfaktor, der von fast allen Zellen exprimiert wird; seine zahlreichen Wirkungen werden durch Koaktivatoren und Korepressoren angeregt / unterdrückt. Die Testosteronsynthese wird durch Gonadotropine stimuliert, und Testosteron bremst - zusammen mit Inhibin aus Sertoli-Zellen - die Gonadotropinausschüttung im hypothalamisch-hypophysären System (negative Rückkopplung). Die Spermatogenese wird von Sertoli-Zellen unterstützt; diese bilden androgenbindendes Protein, bauen ein spezielles micro-environment auf - unterstützt durch die Blut-Hoden-Schranke zwischen Spermatogonien und Spermatozyten - und regen mitotische Teilungen an. |
 Pubertät
Pubertät  Geschlechtsrelevante Hormone
Geschlechtsrelevante Hormone  Funktionen der Sertoli-Zellen
Funktionen der Sertoli-Zellen  Spermatogenese
Spermatogenese  Ejakulat
Ejakulat  Regelkreise
Regelkreise

 Abbildung: Männliches Reproduktionssystem
Abbildung: Männliches Reproduktionssystem Zur Spermatogenese s. unten
Zur Spermatogenese s. unten
 Einem intratubulären mit samenbildendem Epithel - Samenzellen in verschiedenen Entwicklungsstadien, und Sertoli-Zellen; und
Einem intratubulären mit samenbildendem Epithel - Samenzellen in verschiedenen Entwicklungsstadien, und Sertoli-Zellen; und  einem peritubulären mit Bindewegebe, Gefäßen, Nerven, Immunzellen und Leydig'schen Zwischenzellen.
einem peritubulären mit Bindewegebe, Gefäßen, Nerven, Immunzellen und Leydig'schen Zwischenzellen. Eine endokrine: Bildung männlicher Geschlechtshormone (Androgene: Testosteron, Androstendion, DHEA) in den Leydig'schen Zwischenzellen (Leydig cells)
im Interstitium des Hodengewebes. Die hormonelle Achse (Gehirn -
Testes) steuert zwei grundlegende Funktionen des männlichen
reproduktiven Systems: Bildung von Gameten (Spermatogenese) und
Testosteronsynthese.
Eine endokrine: Bildung männlicher Geschlechtshormone (Androgene: Testosteron, Androstendion, DHEA) in den Leydig'schen Zwischenzellen (Leydig cells)
im Interstitium des Hodengewebes. Die hormonelle Achse (Gehirn -
Testes) steuert zwei grundlegende Funktionen des männlichen
reproduktiven Systems: Bildung von Gameten (Spermatogenese) und
Testosteronsynthese. Eine exokrine:
Bildung (Spermatogenese) und Freisetzung der Spermien. Die Spermien entstehen und reifen in den tubuli seminiferi; diese münden in das rete testis (Hodennetz: Misch- und Transportfunktion), das sich wiederum in etwa 20 ductuli efferentes (Resorption von ~95% der Flüssigkeit) fortsetzt. Diese konfluieren in einen zum Nebenhoden (Epididymis
Eine exokrine:
Bildung (Spermatogenese) und Freisetzung der Spermien. Die Spermien entstehen und reifen in den tubuli seminiferi; diese münden in das rete testis (Hodennetz: Misch- und Transportfunktion), das sich wiederum in etwa 20 ductuli efferentes (Resorption von ~95% der Flüssigkeit) fortsetzt. Diese konfluieren in einen zum Nebenhoden (Epididymis  ) führenden Gang; im Nebenhoden reifen die Spermatozoen im (gerade ausgestreckt mehrere Meter langen, durch vielfache Faltung nur ca. 6 cm beanspruchenden) ductus epididymis
(Nebenhodengang) weiter. Das dicht mit Stereozilien ausgestattete
Epithel dieses Ganges resorbiert weiter Flüssigkeit und stellt (mittels Protonenpumpen) einen
niedrigen pH-Wert sicher, sodass die Spermien nicht vorzeitig aktiviert
werden ("Säurestarre"). Um den Nebenhodengang positionierte
Myofibroblasten befördern die Spermien innerhalb von ca. 12 Tagen vom
Hoden bis zum Samenleiter.
) führenden Gang; im Nebenhoden reifen die Spermatozoen im (gerade ausgestreckt mehrere Meter langen, durch vielfache Faltung nur ca. 6 cm beanspruchenden) ductus epididymis
(Nebenhodengang) weiter. Das dicht mit Stereozilien ausgestattete
Epithel dieses Ganges resorbiert weiter Flüssigkeit und stellt (mittels Protonenpumpen) einen
niedrigen pH-Wert sicher, sodass die Spermien nicht vorzeitig aktiviert
werden ("Säurestarre"). Um den Nebenhodengang positionierte
Myofibroblasten befördern die Spermien innerhalb von ca. 12 Tagen vom
Hoden bis zum Samenleiter. ) liefern bei der Ejakulation etwa 4 ml mukoproteinreiche (Lubrikation des Samens),
puffernde
(Neutralisation sauren Harns), klare Flüssigkeit. Das
"Präejakulat" dieser Drüsen kann Spermien enthalten, die - aus dem
Hoden kommend - retrograd in den Ausführungsgang gelangt sind. Zum
Sekret der Bulbourethraldrüsen gesellt sich eine geringere Menge aus paraurethralen Drüsen (Genaueres s. weiter unten).
) liefern bei der Ejakulation etwa 4 ml mukoproteinreiche (Lubrikation des Samens),
puffernde
(Neutralisation sauren Harns), klare Flüssigkeit. Das
"Präejakulat" dieser Drüsen kann Spermien enthalten, die - aus dem
Hoden kommend - retrograd in den Ausführungsgang gelangt sind. Zum
Sekret der Bulbourethraldrüsen gesellt sich eine geringere Menge aus paraurethralen Drüsen (Genaueres s. weiter unten). Adrenarche ist die vermehrte Produktion von Androgenen durch die Nebennierenrinde (DHEA: Dehydroepiandrosteron, DHEAS: Dehydroepiandrosteronsulfat, A4: Androstendion;
Adrenarche ist die vermehrte Produktion von Androgenen durch die Nebennierenrinde (DHEA: Dehydroepiandrosteron, DHEAS: Dehydroepiandrosteronsulfat, A4: Androstendion;  vgl. dort),
die bei beiden Geschlechtern in der Präpubertät (mit 6-8 Jahren)
auftritt. Die Adrenarche stößt das Wachstum der Schambehaarung (Pubarche) an.
vgl. dort),
die bei beiden Geschlechtern in der Präpubertät (mit 6-8 Jahren)
auftritt. Die Adrenarche stößt das Wachstum der Schambehaarung (Pubarche) an. Gonadarche ist
die vermehrte Produktion der Gonadotropine FSH und LH durch die
Hypophyse. Das steigert die Bildung von Östrogenen (f) und Testosteron
(m), Wachstum und Reifung der sekundären Geschlechtsorgane, die
Entwicklung von sekundären Geschlechtsmerkmalen und beteiligt sich am
Wachstumsschub. Ausgelöst wird diese Kaskade durch pulsatile
Freisetzung von GnRH im Hypothalamus.
Dieses frühpubertäre Ereignis hängt mit herabgesetzter Empfindlichkeit
des hypothalamisch-hypophäysären Systems gegenüber dem negativen
Rückkopplungseffekt durch zirkulierende Sexualhormone zusammen. Das
pulsatile Muster der GnRH-Sekretion setzt sich dann bis zur Menopause
fort.
Gonadarche ist
die vermehrte Produktion der Gonadotropine FSH und LH durch die
Hypophyse. Das steigert die Bildung von Östrogenen (f) und Testosteron
(m), Wachstum und Reifung der sekundären Geschlechtsorgane, die
Entwicklung von sekundären Geschlechtsmerkmalen und beteiligt sich am
Wachstumsschub. Ausgelöst wird diese Kaskade durch pulsatile
Freisetzung von GnRH im Hypothalamus.
Dieses frühpubertäre Ereignis hängt mit herabgesetzter Empfindlichkeit
des hypothalamisch-hypophäysären Systems gegenüber dem negativen
Rückkopplungseffekt durch zirkulierende Sexualhormone zusammen. Das
pulsatile Muster der GnRH-Sekretion setzt sich dann bis zur Menopause
fort. Als Spermarche bezeichnet man das Alter, in dem erste Samenergüsse auftreten.
Als Spermarche bezeichnet man das Alter, in dem erste Samenergüsse auftreten. Zum Tanner-Schema s. dort.
Zum Tanner-Schema s. dort. Abbildung).
Abbildung). 
 Abbildung: SRY und Gonadenentwicklung
Abbildung: SRY und Gonadenentwicklung
 AMH gehört zur TGF-ß-Genfamilie und bindet an AMH-Rezeptoren vom Typ II (diese aktivieren einen Smad-abhängigen Signalweg: Smads
sind regulatorische Proteine für die Transduktion von TGF-ß-Signalen
und beteiligen sich an der Regulierung von Entwicklung und Wachstum
betreffender Zellen).
AMH gehört zur TGF-ß-Genfamilie und bindet an AMH-Rezeptoren vom Typ II (diese aktivieren einen Smad-abhängigen Signalweg: Smads
sind regulatorische Proteine für die Transduktion von TGF-ß-Signalen
und beteiligen sich an der Regulierung von Entwicklung und Wachstum
betreffender Zellen). Über AMH als Marker für die ovarielle Reserve bei der geschlechtsreifen Frau s. dort
Über AMH als Marker für die ovarielle Reserve bei der geschlechtsreifen Frau s. dort (männliche Sexualhormone): Testosteron
(männliche Sexualhormone): Testosteron  und vor allem sein Reduktionsprodukt 5-α-Dihydrotestosteron (DHT) haben starke, Dehydroepiandrosteron (DHEA) mäßige, Androstendion
schwache androgene Wirkung. DHT wird vom Androgenrezeptor mit höherer Affinität gebunden als Testosteron und wirkt 30- bis 50-mal stärker
als eine äquimolare Menge Testosteron. Einige
Zielzellen wandeln Testosteron (via 5α-Reduktase) in DHT um, auch im Hoden; der
Großteil des DHT wird so außerhalb der Testes gebildet.
und vor allem sein Reduktionsprodukt 5-α-Dihydrotestosteron (DHT) haben starke, Dehydroepiandrosteron (DHEA) mäßige, Androstendion
schwache androgene Wirkung. DHT wird vom Androgenrezeptor mit höherer Affinität gebunden als Testosteron und wirkt 30- bis 50-mal stärker
als eine äquimolare Menge Testosteron. Einige
Zielzellen wandeln Testosteron (via 5α-Reduktase) in DHT um, auch im Hoden; der
Großteil des DHT wird so außerhalb der Testes gebildet.
 Abbildung: Testosteronspiegel im Blutplasma bei männlichen Organismen als Funktion der Lebensperiode
Abbildung: Testosteronspiegel im Blutplasma bei männlichen Organismen als Funktion der Lebensperiode
 in die nicht-urethralen Segmente des männlichen Reproduktionstrakts und
damit die
Ausbildung von Nebenhoden, ductus deferens, ductus ejaculatorius und Samenblasen, und DHT diejenige von Prostata,
in die nicht-urethralen Segmente des männlichen Reproduktionstrakts und
damit die
Ausbildung von Nebenhoden, ductus deferens, ductus ejaculatorius und Samenblasen, und DHT diejenige von Prostata, Penis und Skrotum (9.-11. Woche, erfordert 5-α-Reduktase 2, die Testosteron in DHT verwandelt - dieses ist für die Entwicklung von Prostata und externen Genitalien unverzichtbar).
Penis und Skrotum (9.-11. Woche, erfordert 5-α-Reduktase 2, die Testosteron in DHT verwandelt - dieses ist für die Entwicklung von Prostata und externen Genitalien unverzichtbar). Testosteron wird zu ~95% im
Hoden von den Leydig-Zwischenzellen (und zu ~5% im Rahmen der Steroidsynthese der Nebennierenrinde)
gebildet - vor allem in den Morgenstunden (zirkadiane Rhythmik).
Die Bildung steht unter dem Einfluss der Gonadotropine LH und FSH, die
wiederum vom Hypothalamus über GnRH gesteuert werden; dieses wird
pulsatil freigesetzt.
Testosteron wird zu ~95% im
Hoden von den Leydig-Zwischenzellen (und zu ~5% im Rahmen der Steroidsynthese der Nebennierenrinde)
gebildet - vor allem in den Morgenstunden (zirkadiane Rhythmik).
Die Bildung steht unter dem Einfluss der Gonadotropine LH und FSH, die
wiederum vom Hypothalamus über GnRH gesteuert werden; dieses wird
pulsatil freigesetzt. | LH (=ICSH) fördert die Testosteronsynthese im Hoden (interstitielle Leydig-Zellen) |
 Direkt als Testosteron an Androgenrezeptoren. Hauptwirkungen: Entwicklung der Wolff-schen Gänge (intrauterin), Kräftigung der Muskulatur (Pubertät), Knochenwachstum, Erythropoese
Direkt als Testosteron an Androgenrezeptoren. Hauptwirkungen: Entwicklung der Wolff-schen Gänge (intrauterin), Kräftigung der Muskulatur (Pubertät), Knochenwachstum, Erythropoese Als Dihydrotestosteron (DHT - s. unten) mit höherer Effizienz an Androgenrezeptoren. Hauptwirkungen: Äußere Geschlechtsmerkmale - Differenzierung (intrauterin), Reifung (Pubertät); Haarfollilel (Wachstum während Pubertät)
Als Dihydrotestosteron (DHT - s. unten) mit höherer Effizienz an Androgenrezeptoren. Hauptwirkungen: Äußere Geschlechtsmerkmale - Differenzierung (intrauterin), Reifung (Pubertät); Haarfollilel (Wachstum während Pubertät) Als Östradiol an Östrogenrezeptoren. Hauptwirkungen: Epiphysenfugenschluss (bleibt bei Defekten von CYP19 oder Östrogenrezeptor aus) und Dichtesteigerung der Knochensubstanz (Osteoporose bei Defekten von CYP19 oder Östrogenrezeptor); Steigerung der Libido.
Als Östradiol an Östrogenrezeptoren. Hauptwirkungen: Epiphysenfugenschluss (bleibt bei Defekten von CYP19 oder Östrogenrezeptor aus) und Dichtesteigerung der Knochensubstanz (Osteoporose bei Defekten von CYP19 oder Östrogenrezeptor); Steigerung der Libido.
 Abbildung: Umwandlung von Testosteron zu Dihydrotestosteron (DHT), Östradiol, und inaktive Metabolite
Abbildung: Umwandlung von Testosteron zu Dihydrotestosteron (DHT), Östradiol, und inaktive Metabolite Zur Synthese von Steroidhormonen s. auch dort
Zur Synthese von Steroidhormonen s. auch dort
 Abbildung) aus Testosteron das wesentlich stärker wirksame Dihydrotestosteron (DHT). DHT bindet stärker an den Androgenrezeptor (s. unten) und führt zu effizienterer Genexpression.
Abbildung) aus Testosteron das wesentlich stärker wirksame Dihydrotestosteron (DHT). DHT bindet stärker an den Androgenrezeptor (s. unten) und führt zu effizienterer Genexpression. 
 Steigender SHBG-Spiegel erhöht die Proteinfixierung, senkt die Verfügbarkeit freien Hormons und damit die Hormonwirkung.
Steigender SHBG-Spiegel erhöht die Proteinfixierung, senkt die Verfügbarkeit freien Hormons und damit die Hormonwirkung.  Testosteron und andere Androgene werden zum Großteil (~98%) umgebaut
(zu 17-Ketosteroiden in der Leber, zu DHT in der Prostata), sulfatiert
/ glukuroniert und in dieser Form mit Harn und Stuhl
ausgeschieden. Die Leber macht Testosteron (wie alle Steroide) durch Glukuronierung /
Sulfatierung wasserlöslich und damit renal ausscheidbar. Der Abbau
erfolgt zu Androstendion, Androsteron und anderen Metaboliten
(17-Keto-Steroide). Ein wenig
wird zu Östrogenen aromatisiert.
Testosteron und andere Androgene werden zum Großteil (~98%) umgebaut
(zu 17-Ketosteroiden in der Leber, zu DHT in der Prostata), sulfatiert
/ glukuroniert und in dieser Form mit Harn und Stuhl
ausgeschieden. Die Leber macht Testosteron (wie alle Steroide) durch Glukuronierung /
Sulfatierung wasserlöslich und damit renal ausscheidbar. Der Abbau
erfolgt zu Androstendion, Androsteron und anderen Metaboliten
(17-Keto-Steroide). Ein wenig
wird zu Östrogenen aromatisiert.  Oral aufgenommenes Testosteron wird
durch den First-pass-Effekt der
Leber zur Gänze metabolisiert; biologisch aktiv können Testosteron oder
Androgen-Analoga i.m., transdermal (Pflaster) oder subdermal (slow release pellets) appliziert werden.
Oral aufgenommenes Testosteron wird
durch den First-pass-Effekt der
Leber zur Gänze metabolisiert; biologisch aktiv können Testosteron oder
Androgen-Analoga i.m., transdermal (Pflaster) oder subdermal (slow release pellets) appliziert werden.
 Testosteron (Serum, Plasma)
Testosteron (Serum, Plasma)
 Abbildung: Androgenrezeptor- Mechanismus
Abbildung: Androgenrezeptor- Mechanismus
 Abbildung).
Abbildung). diese
können die Vorstufe Cholesterin selbst bilden (Ac-CoA) oder über LDL
endozytieren.
diese
können die Vorstufe Cholesterin selbst bilden (Ac-CoA) oder über LDL
endozytieren. 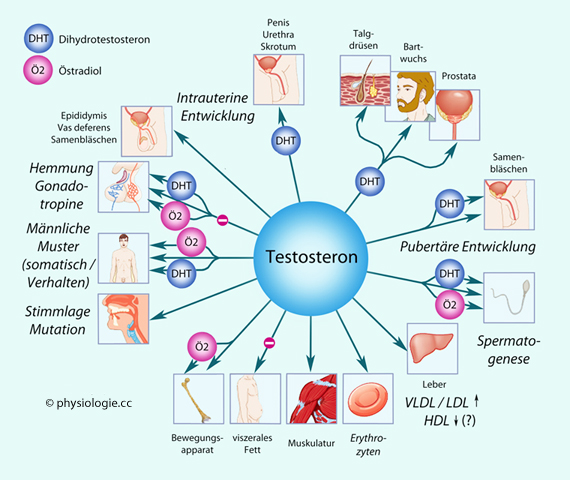
 Abbildung: Testosteronwirkungen beim Mann
Abbildung: Testosteronwirkungen beim Mann HDL, LDL, VLDL s. dort
HDL, LDL, VLDL s. dort 
 Abbildung). Aromatase in zahlreichen Geweben verwandelt Testosteron (das hier eigentlich ein Prohormon ist) in Östradiol, welches dann an Östradiolrezeptoren bindet und biologische Wirkung entfaltet.
Abbildung). Aromatase in zahlreichen Geweben verwandelt Testosteron (das hier eigentlich ein Prohormon ist) in Östradiol, welches dann an Östradiolrezeptoren bindet und biologische Wirkung entfaltet. Aromatase (Östrogensynthase, CYP19A1, ein Mitglied der P450-Superfamilie) aromatisiert Androgene - insbesondere transformiert es Testosteron zu Östradiol.
Aromatase (Östrogensynthase, CYP19A1, ein Mitglied der P450-Superfamilie) aromatisiert Androgene - insbesondere transformiert es Testosteron zu Östradiol. Abbildung):
Abbildung): Differenzierung der Wolff-schen Gänge in Epididymis (Nebenhoden),
ductus deferens (Samenleiter) und vesicula seminalis (Samenblase)
Differenzierung der Wolff-schen Gänge in Epididymis (Nebenhoden),
ductus deferens (Samenleiter) und vesicula seminalis (Samenblase) Regulation
von Gonadotropinsynthese im Hypothalamus (negatives Feedback zusammen
mit DHT, Senkung der GnRH-Pulsfrequenz) und Spermatogenese
Regulation
von Gonadotropinsynthese im Hypothalamus (negatives Feedback zusammen
mit DHT, Senkung der GnRH-Pulsfrequenz) und Spermatogenese Ausbildung der sekundären Geschlechtsmerkmale (Kehlkopf → Stimmbruch, Behaarungstyp u.a.)
Ausbildung der sekundären Geschlechtsmerkmale (Kehlkopf → Stimmbruch, Behaarungstyp u.a.) Spermiogenese, Sekretionsanregung in Prostata und Samenbläschen (postpubertär)
Spermiogenese, Sekretionsanregung in Prostata und Samenbläschen (postpubertär) Libidosteigerung
Libidosteigerung Anregung des Muskel- und Knochenwachstums (anabol)
Anregung des Muskel- und Knochenwachstums (anabol) Anregung der Bildung roter Blutkörperchen (Erythropoese,
Anregung der Bildung roter Blutkörperchen (Erythropoese,  s. rotes Blutbild)
s. rotes Blutbild) Salz- und Wasser-Retention (Niere)
Salz- und Wasser-Retention (Niere) Wirkung auf das Nervensystem (Appetit, Aggressivität, psychosexuell männliche Verhaltensmuster, Förderung der Libido)
Wirkung auf das Nervensystem (Appetit, Aggressivität, psychosexuell männliche Verhaltensmuster, Förderung der Libido)

 Zusammen mit Testosteron bewirkt 5α-Dihydrotestosteron (DHT)
die
peripubertäre Virilisierung, hält die Funktion der sekundären
Geschlechtsmerkmale aufrecht und wirkt anabol. Während der
Embryonalentwicklung trägt es zur Entwicklung des sinus urogenitalis
(Prostata) und der äußeren Genitalien bei. DHT ist hauptverantwortlich
für die Neigung zu stärkerem Ausfall von Haupthaar bei (älteren)
Männern (Glatzenbildung).
Zusammen mit Testosteron bewirkt 5α-Dihydrotestosteron (DHT)
die
peripubertäre Virilisierung, hält die Funktion der sekundären
Geschlechtsmerkmale aufrecht und wirkt anabol. Während der
Embryonalentwicklung trägt es zur Entwicklung des sinus urogenitalis
(Prostata) und der äußeren Genitalien bei. DHT ist hauptverantwortlich
für die Neigung zu stärkerem Ausfall von Haupthaar bei (älteren)
Männern (Glatzenbildung). 
 5α-Reduktase Typ 1: In Gehirn, Leber, Haut
5α-Reduktase Typ 1: In Gehirn, Leber, Haut 5α-Reduktase Typ 2: In Prostata und Nebenhoden
5α-Reduktase Typ 2: In Prostata und Nebenhoden und Progesteron werden nicht nur vom weiblichen, sondern auch vom männlichen Organismus gebildet und haben dort wichtige Funktionen (
und Progesteron werden nicht nur vom weiblichen, sondern auch vom männlichen Organismus gebildet und haben dort wichtige Funktionen ( Abbildung). Östradiol
ist dabei das bestimmende Östrogen.
Abbildung). Östradiol
ist dabei das bestimmende Östrogen. 
 Abbildung: Bildung und Angriffspunkte von Östrogenen beim Mann
Abbildung: Bildung und Angriffspunkte von Östrogenen beim Mann
 im Gangsystem (1 - Leydig-Zellen - der ergiebigere Weg), und
im Gangsystem (1 - Leydig-Zellen - der ergiebigere Weg), und 
 durch Spermatozoen (2).
durch Spermatozoen (2). 
 CFTR, Cystic Fibrosis Transmembrane Conductance Regulator, ein Chloridkanal
CFTR, Cystic Fibrosis Transmembrane Conductance Regulator, ein Chloridkanal  CYP, Zytochrom-P450-Enzym
CYP, Zytochrom-P450-Enzym  SLC, Solute Carrier, ein Transportprotein
SLC, Solute Carrier, ein Transportprotein
 Zu ~85% entsteht beim Mann Östradiol in
peripherem Gewebe (z.B. Fettgewebe) durch Einwirkung einer Aromatase auf Testosteron, ~15% werden in den Leydig'schen Zwischenzellen des Hodens
synthetisiert. Der Großteil (~98%) wird - wie bei der Frau - an Eiweiß
(SBG, Albumin) gebunden (biologisch nicht aktiv) transportiert.
Zu ~85% entsteht beim Mann Östradiol in
peripherem Gewebe (z.B. Fettgewebe) durch Einwirkung einer Aromatase auf Testosteron, ~15% werden in den Leydig'schen Zwischenzellen des Hodens
synthetisiert. Der Großteil (~98%) wird - wie bei der Frau - an Eiweiß
(SBG, Albumin) gebunden (biologisch nicht aktiv) transportiert.  Östrogene beim Mann
Östrogene beim Mann Progesteron beim Mann
Progesteron beim Mann Abbildung). Östradiol bindet an beide, Östron vor allem an ERα und Östriol an ERβ.
Abbildung). Östradiol bindet an beide, Östron vor allem an ERα und Östriol an ERβ.  Testosteron bedarf zur Entfaltung seiner Wirkungen des Zusammenspiels mit Östradiol und DHT.
Testosteron bedarf zur Entfaltung seiner Wirkungen des Zusammenspiels mit Östradiol und DHT. Abbildung) stimulieren. Seinerseits hemmt Inhibin die FSH-Freisetzung aus der Hypophyse (daher der
Name: negative Rückkopplung).
Abbildung) stimulieren. Seinerseits hemmt Inhibin die FSH-Freisetzung aus der Hypophyse (daher der
Name: negative Rückkopplung).
 Abbildung: Regelkreise beim Mann
Abbildung: Regelkreise beim Mann Testosteron hemmt die pulsatile Freisetzung von GnRH im Hypothalamus sowie die LH-Sekretion im Vorderlappen;
Testosteron hemmt die pulsatile Freisetzung von GnRH im Hypothalamus sowie die LH-Sekretion im Vorderlappen; Inhibin unterdrückt die Freisetzung von FSH im Hypophysenvorderlappen.
Inhibin unterdrückt die Freisetzung von FSH im Hypophysenvorderlappen.
| Inhibin wird beim Mann von Sertoli-Zellen des Hodens gebildet |
 Zellen: Leydig-Zellen und Sertoli-Zellen
Zellen: Leydig-Zellen und Sertoli-Zellen Gonadotropine: LH und FSH
Gonadotropine: LH und FSH Androgen: Testosteron
Androgen: Testosteron (sustentacular cells) sind epitheliale Zellen in der Wand der Hodenkanälchen (tubuli seminiferi) und machen hier ~30% des Gewebes aus. Ihre basolaterale Membran liegt auf der Basalmembran an der Außenseite des tubulus seminiferus, ihre apikale grenzt an den inneren Hohlraum (das Lumen), in das reife Samenzellen entlassen werden. Sie spielen eine mehrfache Rolle - exokrine, endokrine und die
Spermatogenese unterstützende. Jeder Sertoli-Zelle kümmert sich um das Heranreifen von bis zu 50 Samenzellen (bzw. ihrer Vorstufen).
(sustentacular cells) sind epitheliale Zellen in der Wand der Hodenkanälchen (tubuli seminiferi) und machen hier ~30% des Gewebes aus. Ihre basolaterale Membran liegt auf der Basalmembran an der Außenseite des tubulus seminiferus, ihre apikale grenzt an den inneren Hohlraum (das Lumen), in das reife Samenzellen entlassen werden. Sie spielen eine mehrfache Rolle - exokrine, endokrine und die
Spermatogenese unterstützende. Jeder Sertoli-Zelle kümmert sich um das Heranreifen von bis zu 50 Samenzellen (bzw. ihrer Vorstufen). Sertoli-Zellen unterstützen Samenzellen strukturell (Stütze und
Kompartimentierung), nutritiv und regulierend (Chemokine,
Wachstumsfaktoren) während aller Phasen ihres
Werdegangs (Spermatogenese). Sie senden molekulare Signale aus, die darüber entscheiden, ob ein Typ A-Spermatogonium (
Sertoli-Zellen unterstützen Samenzellen strukturell (Stütze und
Kompartimentierung), nutritiv und regulierend (Chemokine,
Wachstumsfaktoren) während aller Phasen ihres
Werdegangs (Spermatogenese). Sie senden molekulare Signale aus, die darüber entscheiden, ob ein Typ A-Spermatogonium ( Abbildung) den Pfad der Bildung neuer Spermien beschreitet, als
Stammzelle in der basalen Zone verbleibt oder apoptotisch abgebaut
wird.
Abbildung) den Pfad der Bildung neuer Spermien beschreitet, als
Stammzelle in der basalen Zone verbleibt oder apoptotisch abgebaut
wird.  Das basale Kompartiment an der Außenseite der Tubuli seminiferi steht
mit Blutkreislauf und Immunsystem in engem Kontakt (wie der Rest des
Organismus auch). In diesem Kompartiment befinden sich Spermatogonien
(die keine Abweichung von den immunologischen Kennzeichen haben, die
auch andere Körperzellen aufweisen).
Das basale Kompartiment an der Außenseite der Tubuli seminiferi steht
mit Blutkreislauf und Immunsystem in engem Kontakt (wie der Rest des
Organismus auch). In diesem Kompartiment befinden sich Spermatogonien
(die keine Abweichung von den immunologischen Kennzeichen haben, die
auch andere Körperzellen aufweisen). Das adluminale Kompartiment an der Innenseite der Tubuli ist über Verschlusssysteme zwischen Leydig-Zellen (Blut-Hoden-Schranke
bzw. Sertoli-Zellschranke) von Blut- und Lymphkreislauf weitgehend
isoliert und bietet den immunologisch veränderten post-meiotischen
Spermatozyten und Spermatiden Schutz vor möglichen Angriffen durch das Immunsystem.
Das adluminale Kompartiment an der Innenseite der Tubuli ist über Verschlusssysteme zwischen Leydig-Zellen (Blut-Hoden-Schranke
bzw. Sertoli-Zellschranke) von Blut- und Lymphkreislauf weitgehend
isoliert und bietet den immunologisch veränderten post-meiotischen
Spermatozyten und Spermatiden Schutz vor möglichen Angriffen durch das Immunsystem.  Abbildung).
Abbildung). 
 Abbildung: Dynamik der Blut-Hoden-Schranke, Interaktion zwischen Sertoli- und Samenzellen
Abbildung: Dynamik der Blut-Hoden-Schranke, Interaktion zwischen Sertoli- und Samenzellen S-B: Typ B-Spermatogonium
S-B: Typ B-Spermatogonium  EI°S: früher (early) primärer Spermatozyt
EI°S: früher (early) primärer Spermatozyt  LI°S: später (late) primärer Spermatozyt
LI°S: später (late) primärer Spermatozyt  ESt: früher Spermatid
ESt: früher Spermatid  LSt: später Spermatid
LSt: später Spermatid

 Schutz vor immunologischen Angriffen. Zellen, die in die meiotische
Reifeteilung eingetreten sind (sich differenzierende Spermatozyten),
verändern ihre immunologischen Eigenschaften und würden vom Immunsystem
als verändert erkannt. Sie werden durch die Sertoli-Zellschranke vom
Blutkompartiment funktionell separiert und deshalb vom Immunsystem
nicht angegriffen. Bei
einem Zusammenbruch der BHS kann es zu Autoimmun-Infertilität kommen
Schutz vor immunologischen Angriffen. Zellen, die in die meiotische
Reifeteilung eingetreten sind (sich differenzierende Spermatozyten),
verändern ihre immunologischen Eigenschaften und würden vom Immunsystem
als verändert erkannt. Sie werden durch die Sertoli-Zellschranke vom
Blutkompartiment funktionell separiert und deshalb vom Immunsystem
nicht angegriffen. Bei
einem Zusammenbruch der BHS kann es zu Autoimmun-Infertilität kommen  Testosteronanreicherung durch Anwesenheit von androgenbindendem Globulin
Testosteronanreicherung durch Anwesenheit von androgenbindendem Globulin Einschränkung parazellulären Stoffaustauschs und Kontrolle der Versorgung der sich entwickelnden Spermien mit Nährstoffen (z.B. Eisen / Transferrin, oder Laktat, das Sertoli-Zellen aus Glucose bilden, die sie über GLUT1 aufnehmen)
Einschränkung parazellulären Stoffaustauschs und Kontrolle der Versorgung der sich entwickelnden Spermien mit Nährstoffen (z.B. Eisen / Transferrin, oder Laktat, das Sertoli-Zellen aus Glucose bilden, die sie über GLUT1 aufnehmen) Schutz der Spermatozyten / Spermatiden vor toxischen Substanzen.
Schutz der Spermatozyten / Spermatiden vor toxischen Substanzen.
 Abbildung: Stammzellnische (Sertoli-Zellschranke)
Abbildung: Stammzellnische (Sertoli-Zellschranke)

 Sertoli-Zellen verleihen den Spermatiden immunologischen Schutz (Blut-Hoden-Schranke).
Sertoli-Zellen verleihen den Spermatiden immunologischen Schutz (Blut-Hoden-Schranke). Sertoli-Zellen phagozytieren
Zellbestandteile, die bei der Spermiogenese anfallen (Restkörperchen:
Zytoplasmareste; tote Spermien).
Sertoli-Zellen phagozytieren
Zellbestandteile, die bei der Spermiogenese anfallen (Restkörperchen:
Zytoplasmareste; tote Spermien). Sertoli-Zellen exprimieren parakrine Faktoren sowie Rezeptoren für parakrine Faktoren aus den Spermien.
Sertoli-Zellen exprimieren parakrine Faktoren sowie Rezeptoren für parakrine Faktoren aus den Spermien. Sertoli-Zellen sezernieren (10-20 µl/g Hoden) testikuläre
Flüssigkeit (enthält Salze, Glykogen, Laktat, Glucose, Protein, Lipide,
Enzyme und transportiert die immobilen Spermien in Richtung Nebenhoden).
Sertoli-Zellen sezernieren (10-20 µl/g Hoden) testikuläre
Flüssigkeit (enthält Salze, Glykogen, Laktat, Glucose, Protein, Lipide,
Enzyme und transportiert die immobilen Spermien in Richtung Nebenhoden). Sertoli-Zellen bilden androgenbindendes Protein (ABP), das Testosteron, Dihydrotestosteron und 17-ß-Östradiol in den
Hodenkanälchen bindet. Dies bewirkt testikuläre Androgenanreicherung, die für die Spermatogenese entscheidend ist (Testosterons liegt im Tubulus seminiferus in 50-100-fach höherer Konzentration vor als im Blut). ABP hat dieselbe Aminosäuresequenz wie das Sexualhormonbindende Globulin SHBG, der Unterschied liegt in Bildungsort (SHBG: Leber) und gebundenen Zuckermolekülen.
Sertoli-Zellen bilden androgenbindendes Protein (ABP), das Testosteron, Dihydrotestosteron und 17-ß-Östradiol in den
Hodenkanälchen bindet. Dies bewirkt testikuläre Androgenanreicherung, die für die Spermatogenese entscheidend ist (Testosterons liegt im Tubulus seminiferus in 50-100-fach höherer Konzentration vor als im Blut). ABP hat dieselbe Aminosäuresequenz wie das Sexualhormonbindende Globulin SHBG, der Unterschied liegt in Bildungsort (SHBG: Leber) und gebundenen Zuckermolekülen. Sertoli-Zellen bilden zwahlreiche weitere Proteine, wie Transferrin oder metallbindende Proteine.
Sertoli-Zellen bilden zwahlreiche weitere Proteine, wie Transferrin oder metallbindende Proteine. Sertoli-Zellen bestimmen den Zeitpunkt der Spermiation (Freigabe der Spermien aus dem tubulus seminiferus).
Sertoli-Zellen bestimmen den Zeitpunkt der Spermiation (Freigabe der Spermien aus dem tubulus seminiferus). Sertoli-Zellen bilden Hormone (Anti-Müller-Hormon, Inhibin)
Sertoli-Zellen bilden Hormone (Anti-Müller-Hormon, Inhibin) Sertoli-Zellen exprimieren Rezeptoren
für Androgene und FSH (beide für die volle
Spermatogenese unverzichtbar), Aromatisierung von Testosteron zu
17ß-Östradiol mittels CYP19 (unterstützt lokal wahrscheinlich ebenfalls
die Spermatogenese; Spermien exprimieren Östrogenrezeptoren)
Sertoli-Zellen exprimieren Rezeptoren
für Androgene und FSH (beide für die volle
Spermatogenese unverzichtbar), Aromatisierung von Testosteron zu
17ß-Östradiol mittels CYP19 (unterstützt lokal wahrscheinlich ebenfalls
die Spermatogenese; Spermien exprimieren Östrogenrezeptoren) Sertoli-Zellen bilden Wachstumsfaktoren, diese stimulieren die Spermatogenese.
Sertoli-Zellen bilden Wachstumsfaktoren, diese stimulieren die Spermatogenese. In der frühen Embryogenese bauen Sertoli-Zellen lokal gebildete Retinsäure ab und verhindern dadurch fortschreitende Meiose bei Spermatogonien.
In der frühen Embryogenese bauen Sertoli-Zellen lokal gebildete Retinsäure ab und verhindern dadurch fortschreitende Meiose bei Spermatogonien. Zum hormonellen Wechselspiel zwischen Sertoli- und Leydig-Zellen s. dort
Zum hormonellen Wechselspiel zwischen Sertoli- und Leydig-Zellen s. dort
 Abbildung: Physiologie der Leydig- und Sertoli-Zellen
Abbildung: Physiologie der Leydig- und Sertoli-Zellen Merkhilfe: "L" → Leydig, LH; "S" → Sertoli, FSH
Merkhilfe: "L" → Leydig, LH; "S" → Sertoli, FSH
 Abbildung). Diese lokale negative Rückkopplung
trägt zur Stabilisierung des Testosteronspiegels bei.
Abbildung). Diese lokale negative Rückkopplung
trägt zur Stabilisierung des Testosteronspiegels bei.
Funktionen der Sertoli-Zellen Nach Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 |
| Erhaltung der Blut-Hoden-Schranke Sekretion tubulärer Flüssigkeit (10-20 µl/g Hodengewebe) Sekretion von ABP (androgenbindendem Protein) Sekretion von Inhibin und Östrogenen Sekretion zahlreicher weiterer Proteine (z.B. Wachstumsfaktoren, Transferrin, RBP (retinalbindendem Protein), Metall-bindenden Proteinen) Aufrechterhaltung und Koordination der Spermatogenese Phagozytose von Residualkörperchen (Spermatozyten) |
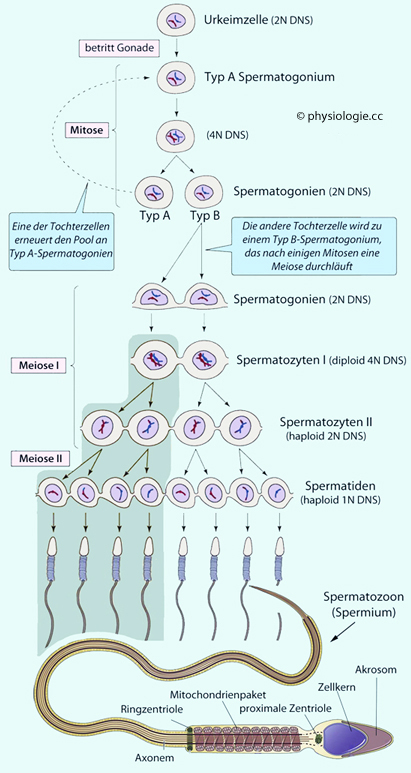
 Abbildung: Spermatogenese (schematisch)
Abbildung: Spermatogenese (schematisch) Abbildung
Abbildung
 Mitotische Vermehrung der Spermatogonien (Ursamenzellen) zur Erhaltung des Keimzellenbestandes (Spermatozytogenese). Mitotische Vermehrung von Typ A- Spermatogonien beginnt mit der Pubertät. Diese Zellen sind das Stammzellreservoir für die kontinuierliche Samenbildung, es entstehen weitere Typ A-Zellen (zur
Erhaltung des Spermatogonienpools) sowie Typ B- Spermatogonien (
Mitotische Vermehrung der Spermatogonien (Ursamenzellen) zur Erhaltung des Keimzellenbestandes (Spermatozytogenese). Mitotische Vermehrung von Typ A- Spermatogonien beginnt mit der Pubertät. Diese Zellen sind das Stammzellreservoir für die kontinuierliche Samenbildung, es entstehen weitere Typ A-Zellen (zur
Erhaltung des Spermatogonienpools) sowie Typ B- Spermatogonien (  Abbildung), die sich mehrmals weiter teilen und dann den mitotischen Zyklus verlassen, um durch meiotische Teilung zu
primären Spermatozyten (Spermatozyten 1. Ordnung) zu werden. Diese sind doppelt diploid: 4N DNA
- 22 Paare duplizierter Autosomen, ein dupliziertes X- und ein
dupliziertes Y-Chromosom. Diese Zellen bilden über interzelluläre Zytoplasmabrücken Zellgruppen, die gemeinsam durch die folgenden Schritte gehen.
Abbildung), die sich mehrmals weiter teilen und dann den mitotischen Zyklus verlassen, um durch meiotische Teilung zu
primären Spermatozyten (Spermatozyten 1. Ordnung) zu werden. Diese sind doppelt diploid: 4N DNA
- 22 Paare duplizierter Autosomen, ein dupliziertes X- und ein
dupliziertes Y-Chromosom. Diese Zellen bilden über interzelluläre Zytoplasmabrücken Zellgruppen, die gemeinsam durch die folgenden Schritte gehen. Meiotische Reifung
- In der ersten Reifeteilung (Meiose I) reduzieren primäre
Spermatozyten ihren DNA-Bestand auf einen haploiden Satz
(Haploidisierung auf 2N DNA). Sie
benötigen ca. 24 Stunden für die Meiose I; dabei bilden sie
Ribonukleinsäuren, ein Vorrat für spätere - rasch ablaufende - Vorgänge
(preparatory mRNA synthesis), ähnlich wie auch bei Eizellen. So wird z.B. mRNA für Protamine vorfabriziert (Protamine
sind Proteine, die Histone im Zellkern verdrängen und dadurch eine -
für die endgültige Formierung des Spermiums notwendige - besonders
intensive Verdichtung des Chromatins ermöglichen. Die Produktion der
Protamine erfolgt erst im Spermatidstadium - geschieht das früher,
kommt es zu vorzeitiger Kondensierung des Chromatins, mit der Folge von
Sterilität).
Meiotische Reifung
- In der ersten Reifeteilung (Meiose I) reduzieren primäre
Spermatozyten ihren DNA-Bestand auf einen haploiden Satz
(Haploidisierung auf 2N DNA). Sie
benötigen ca. 24 Stunden für die Meiose I; dabei bilden sie
Ribonukleinsäuren, ein Vorrat für spätere - rasch ablaufende - Vorgänge
(preparatory mRNA synthesis), ähnlich wie auch bei Eizellen. So wird z.B. mRNA für Protamine vorfabriziert (Protamine
sind Proteine, die Histone im Zellkern verdrängen und dadurch eine -
für die endgültige Formierung des Spermiums notwendige - besonders
intensive Verdichtung des Chromatins ermöglichen. Die Produktion der
Protamine erfolgt erst im Spermatidstadium - geschieht das früher,
kommt es zu vorzeitiger Kondensierung des Chromatins, mit der Folge von
Sterilität). Spermiogenese (spermatid metamorphosis) - in dieser Phase reifen Spermatiden zu fertigen Spermien. Die (etwas kleineren) Spermatiden (1N DNA
- haploider Satz einfacher Chromosomen) sind immer noch synzytial miteinander
verbunden und bilden Zellgruppen in der inneren Schichte des Epithels (bis zu ca. 100 Zellen), die synchron zu Spermatozoen (Spermien) heranreifen (je 4 aus einem Spermatozyten
- 2 X- und 2 Y-chromosomale). Dabei nimmt die Masse des Zytoplasmas ab
und die endgültige Gestalt der Spermien entwickelt sich. Die Zellkerne
verdichten (Protamine s. oben), der mit Enzymen angereicherte
Golgi-Apparat geht im Akrosom auf (Rolle bei der Befruchtung), das
Zytoplasma zieht sich aus der Kernregion zurück, eine Geißel
(Flagellum) bildet sich im Schwanzbereich, mit einer proximalen
mitochondrienreichen Zone (Energieversorgung des Bewegungsapparates) (folgende
Spermiogenese (spermatid metamorphosis) - in dieser Phase reifen Spermatiden zu fertigen Spermien. Die (etwas kleineren) Spermatiden (1N DNA
- haploider Satz einfacher Chromosomen) sind immer noch synzytial miteinander
verbunden und bilden Zellgruppen in der inneren Schichte des Epithels (bis zu ca. 100 Zellen), die synchron zu Spermatozoen (Spermien) heranreifen (je 4 aus einem Spermatozyten
- 2 X- und 2 Y-chromosomale). Dabei nimmt die Masse des Zytoplasmas ab
und die endgültige Gestalt der Spermien entwickelt sich. Die Zellkerne
verdichten (Protamine s. oben), der mit Enzymen angereicherte
Golgi-Apparat geht im Akrosom auf (Rolle bei der Befruchtung), das
Zytoplasma zieht sich aus der Kernregion zurück, eine Geißel
(Flagellum) bildet sich im Schwanzbereich, mit einer proximalen
mitochondrienreichen Zone (Energieversorgung des Bewegungsapparates) (folgende  Abbildung).
Abbildung).
 Abbildung: Stadien der Spermiogenese
Abbildung: Stadien der Spermiogenese Der (zytoplasmafreie, 4-5 µm lange und 2-3 µm breite) Kopfteil
(head) enthält einen kondensierten Zellkern mit seinem einfach haploiden Chromosomensatz mit heterochromatischem - besonders dicht gepacktem - Chromatin, in dem die nukleosomalen Histone durch Protamine (eine besondere Klasse "verpackender" Proteine) ersetzt sind und wo keine Transkription stattfindet. Das am vorderen Pol kappenartig aufgelagerte Akrosom
ist ein Vesikel, das aus dem Golgi-Apparat antransportierte, zur
Penetration des Ovum erforderliche
hydrolytische Enzyme enthält. Diese sind für die Befruchtung
wichtig,
außerdem zur Verhinderung einer Polyspermie (Befruchtung durch mehrere
Spermien). Das Akrosom besteht aus einer äußeren und einer inneren
Membran, über dem Akrosom liegt die Zellmembran des Spermiums
(Akrosomenkappe). Bei der akrosomalen Reaktion
verschmelzen Teile der Zellmembran mit Teilen der äußeren akrosomalen
Membran, spalten sich als kleine Vesikel ab und geben lytische Enzyme
frei.
Der (zytoplasmafreie, 4-5 µm lange und 2-3 µm breite) Kopfteil
(head) enthält einen kondensierten Zellkern mit seinem einfach haploiden Chromosomensatz mit heterochromatischem - besonders dicht gepacktem - Chromatin, in dem die nukleosomalen Histone durch Protamine (eine besondere Klasse "verpackender" Proteine) ersetzt sind und wo keine Transkription stattfindet. Das am vorderen Pol kappenartig aufgelagerte Akrosom
ist ein Vesikel, das aus dem Golgi-Apparat antransportierte, zur
Penetration des Ovum erforderliche
hydrolytische Enzyme enthält. Diese sind für die Befruchtung
wichtig,
außerdem zur Verhinderung einer Polyspermie (Befruchtung durch mehrere
Spermien). Das Akrosom besteht aus einer äußeren und einer inneren
Membran, über dem Akrosom liegt die Zellmembran des Spermiums
(Akrosomenkappe). Bei der akrosomalen Reaktion
verschmelzen Teile der Zellmembran mit Teilen der äußeren akrosomalen
Membran, spalten sich als kleine Vesikel ab und geben lytische Enzyme
frei. Das - ebenfalls 5 µm lange - Mittelstück
(connecting piece) enthält eine proximale (an den Kern befestigte) und eine distale
Zentriole; letztere (Rindzentriole) bildet Mikrotubuli in einer
9+2-Konfiguration. Das Mittelstück
ist der "Maschinenraum" mit spiralig angeordneten Mitochondrien, hier
wird Fructose (die in der Samenflüssigkeit enthalten ist) zur
Energiegewinnung
umgesetzt. Fructose scheint die primäre Energiequelle der Spermatozyten
zu sein; die Motilität der Spermien korreliert mit dem Fructosespiegel
der Samenflüssigkeit.
Das - ebenfalls 5 µm lange - Mittelstück
(connecting piece) enthält eine proximale (an den Kern befestigte) und eine distale
Zentriole; letztere (Rindzentriole) bildet Mikrotubuli in einer
9+2-Konfiguration. Das Mittelstück
ist der "Maschinenraum" mit spiralig angeordneten Mitochondrien, hier
wird Fructose (die in der Samenflüssigkeit enthalten ist) zur
Energiegewinnung
umgesetzt. Fructose scheint die primäre Energiequelle der Spermatozyten
zu sein; die Motilität der Spermien korreliert mit dem Fructosespiegel
der Samenflüssigkeit. Der etwa 50 µm lange Schwanzteil (Flagellum, Geißel - tail) mit einem Axonem ist aus einem mit Mitochondrien umwickelten Mittelstück, einem Haupt- und einem Endstück
aufgebaut. Dieser Teil
des Spermiums verleiht ihm Motilität: Spiralig um das aus 11 Mikrotubuli aufgebaute Axonem angeordnete Mitochondrien versorgen es mit der für den Antrieb der rhythmischen Bewegungen nötige Energie (ATP).
Der etwa 50 µm lange Schwanzteil (Flagellum, Geißel - tail) mit einem Axonem ist aus einem mit Mitochondrien umwickelten Mittelstück, einem Haupt- und einem Endstück
aufgebaut. Dieser Teil
des Spermiums verleiht ihm Motilität: Spiralig um das aus 11 Mikrotubuli aufgebaute Axonem angeordnete Mitochondrien versorgen es mit der für den Antrieb der rhythmischen Bewegungen nötige Energie (ATP). 
 Cremasterreflex
Cremasterreflex Plexus pampiniformis: Gegenstrom-Wärmeaustausch
Plexus pampiniformis: Gegenstrom-Wärmeaustausch Faltung der Skrotalhaut (vergrößerte Oberfläche)
Faltung der Skrotalhaut (vergrößerte Oberfläche) Schweißproduktion der Skrotalhaut
Schweißproduktion der Skrotalhaut
 Abbildung: Hoden, Nebenhoden, Gang- und Drüsensystem
Abbildung: Hoden, Nebenhoden, Gang- und Drüsensystem  vgl. Abbildung oben
vgl. Abbildung oben 
 ) sowie Paraurethralen (Littré'schen
) sowie Paraurethralen (Littré'schen ) Drüsen ihren Inhalt in die Harnröhre. Dieses Sekret dient der Pufferung, Reinigung und Lubrikation. Die Nebenhoden steuern bis zu 20% des Volumens des Samenplasmas bei.
) Drüsen ihren Inhalt in die Harnröhre. Dieses Sekret dient der Pufferung, Reinigung und Lubrikation. Die Nebenhoden steuern bis zu 20% des Volumens des Samenplasmas bei.| Ejakulat sollte zwischen 15 und 200 Millionen Spermien / ml enthalten |
Samenflüssigkeit Befunde / Referenzwerte (nach verschiedenen Quellen) |
|
| Volumen |
2-6 (>1,4) ml (10% Samen, 90% Plasma) |
| pH |
7-8 (saurer pH tötet Spermien ab) |
| Spermienkonzentration |
≥20 Mio/ml |
| Spermiengesamtzahl |
150-600 Mio (>39 Mio) pro Ejakulat |
| Motilität |
≥32% mit Vorwärtsprogression |
| Anteil lebender Spermien | ≥50% |
| Morphologie |
60% (≥30%) normalgestaltig |
| Vitalität |
≥75% lebensfähig |
| Leukozyten |
<1,0 Mio/ml |
| α-Glukosidase |
≥20 mU/Ejakulat |
| Zink |
≥2,4 µmol/Ejakulat |
| Citrat |
≥52 µmol/Ejakulat |
| Saure Phosphatase |
≥200 U/Ejakulat |
| Fructose |
≥13 µmol/Ejakulat |
 Salze: Hohe Werte an Zink (~16 mg/dl - zum Vergleich: Blutplasma 0,1 mg/dl), Calcium (~28 mg/dl - Blutplasma ~9 mg/dl), Magnesium (~11 mg/dl - Blutplasma ~2,3 mg/dl)
Salze: Hohe Werte an Zink (~16 mg/dl - zum Vergleich: Blutplasma 0,1 mg/dl), Calcium (~28 mg/dl - Blutplasma ~9 mg/dl), Magnesium (~11 mg/dl - Blutplasma ~2,3 mg/dl)
 Fructose (~270 mg/dl), Citrat (~530 mg/dl)
Fructose (~270 mg/dl), Citrat (~530 mg/dl)
 Vitamine
Vitamine
 Enzyme, z.B. saure (prostataspezifische) Phosphatase, Glucosidase
Enzyme, z.B. saure (prostataspezifische) Phosphatase, Glucosidase
 weitere Stoffe, deren Funktion nur teilweise verstanden ist: Prostaglandine, Cholin, Spermin (Geruch), Aminosäuren u.a.
weitere Stoffe, deren Funktion nur teilweise verstanden ist: Prostaglandine, Cholin, Spermin (Geruch), Aminosäuren u.a.| Konzentrationswerte im Sperma (Durchschnittswerte)  Nach Owen DH, Katz DF: A Review of the Physical and Chemical Properties of Human Semen and the Formulation of a Semen Simulant. J Androl 2005; 26: 459-69 |
|||
| Na+ | 3 mg/ml |
pH |
7,7 (7,2-8,0) |
| K+ | 1,1 mg/ml |
Fruktose |
2,7 mg/ml |
| Cl- |
1,4 mg/ml |
Glucose |
1 mg/ml |
| Ca++ | 0,28 mg/ml |
Citrat |
5,3 mg/ml |
| Mg++ |
0,11 mg/ml |
Laktat |
0,62 mg/ml |
| Zn++ | 0,16 mg/ml |
Harnstoff |
0,45 mg/ml |
| Osmolalität |
~350 mOsm |
Protein |
50 mg/ml |
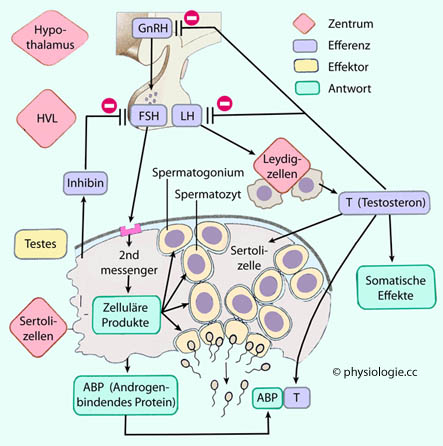

 GnRH steuert die Freisetzung der Gonadotropine (LH,
FSH) aus dem Hypophysen-Vorderlappen. Dabei wirkt nur pulsatile
GnRH-Freisetzung anregend; Dauerinfusion unterdrückt die LH- und
FSH-Ausschüttung ("chemische Kastrierung" z.B. zur Behandlung von
Prostatakrebs, Ziel: Senkung des Testosteronspiegels).
GnRH steuert die Freisetzung der Gonadotropine (LH,
FSH) aus dem Hypophysen-Vorderlappen. Dabei wirkt nur pulsatile
GnRH-Freisetzung anregend; Dauerinfusion unterdrückt die LH- und
FSH-Ausschüttung ("chemische Kastrierung" z.B. zur Behandlung von
Prostatakrebs, Ziel: Senkung des Testosteronspiegels).  FSH stützt über Wirkung von G-Protein-gekoppelten FSH-Rezeptoren
(cAMP → Proteinkinase A) die Integrität
der tubuli seminiferi im Hoden und wirkt (nach der Pubertät) über die
Sertoli-Zellen fördernd auf die Gametogenese, wahrscheinlich mittels
Wachstumsfaktoren. Inhibin aus den Sertoli-Zellen hat endokrine
(hypothalamisch-hypophysäre Hemmung) und parakrine Wirkungen (anregend
auf Leydig-Zellen).
FSH stützt über Wirkung von G-Protein-gekoppelten FSH-Rezeptoren
(cAMP → Proteinkinase A) die Integrität
der tubuli seminiferi im Hoden und wirkt (nach der Pubertät) über die
Sertoli-Zellen fördernd auf die Gametogenese, wahrscheinlich mittels
Wachstumsfaktoren. Inhibin aus den Sertoli-Zellen hat endokrine
(hypothalamisch-hypophysäre Hemmung) und parakrine Wirkungen (anregend
auf Leydig-Zellen).  LH (ICSH: interstitial cell stimulating hormone) stimuliert die
Testosteronbildung in den interstitiellen (Leydig-) Zellen über LH-Rezeptoren (→ Gs, cAMP, PKA, Proteinsynthese, Testosteronsynthese), die auch durch hCG
stimuliert werden können (therapeutische Anwendung bei Oligospermie). LH wirkt teils rasch (Hydrolyse von Cholesterinestern, Expression des StAR-Cholesterintransporters), teils langsamer (Enzym- und Rezeptorexpression), teils stark verzögert (Wachstum / Proliferation von Leydig-Zellen).
LH (ICSH: interstitial cell stimulating hormone) stimuliert die
Testosteronbildung in den interstitiellen (Leydig-) Zellen über LH-Rezeptoren (→ Gs, cAMP, PKA, Proteinsynthese, Testosteronsynthese), die auch durch hCG
stimuliert werden können (therapeutische Anwendung bei Oligospermie). LH wirkt teils rasch (Hydrolyse von Cholesterinestern, Expression des StAR-Cholesterintransporters), teils langsamer (Enzym- und Rezeptorexpression), teils stark verzögert (Wachstum / Proliferation von Leydig-Zellen). Regelkreise (
Regelkreise ( Abbildung oben): Inhibin aus den Sertoli-Zellen der tubuli seminiferi, und Testosteron aus den Leydig-Zellen wirken inhibierend auf Hypothalamus (nucl. arcuatus: GnRH) und Hypophysenvorderlappen (Testosteron
über LH-, Inhibin über FSH-Freisetzung).
Abbildung oben): Inhibin aus den Sertoli-Zellen der tubuli seminiferi, und Testosteron aus den Leydig-Zellen wirken inhibierend auf Hypothalamus (nucl. arcuatus: GnRH) und Hypophysenvorderlappen (Testosteron
über LH-, Inhibin über FSH-Freisetzung). 
 Der Transkriptionsfaktor testis determining factor (TDF), auch sex-determining region Y (SRY) protein,
wird durch das Y-chromosomale SRY-Gen kodiert. Ohne ihn entwickeln sich
die Gonadenanlagen zu Ovarien. Sertoli-Zellen bilden das
'Anti-Müller-Hormon' AMH, das die Rückbildung der Müller-Gänge bewirkt.
HCG regt die Produktion von Testosteron an; die
Testosteronkonzentration hat prä- und postpartal einen mehrgipfligen
Zeitverlauf Der Transkriptionsfaktor testis determining factor (TDF), auch sex-determining region Y (SRY) protein,
wird durch das Y-chromosomale SRY-Gen kodiert. Ohne ihn entwickeln sich
die Gonadenanlagen zu Ovarien. Sertoli-Zellen bilden das
'Anti-Müller-Hormon' AMH, das die Rückbildung der Müller-Gänge bewirkt.
HCG regt die Produktion von Testosteron an; die
Testosteronkonzentration hat prä- und postpartal einen mehrgipfligen
Zeitverlauf Testosteron und 5-α-Dihydrotestosteron (DHT) haben starke,
Dehydroepiandrosteron (DHEA) mäßige, Androstendion schwache androgene
Wirkung. DHT entsteht aus Testosteron durch Wirkung von 5α-Reduktase
(Typ 1 in Gehirn, Leber, Haut; Typ 2 in Prostata und Nebenhoden).
Leydig-sche Zwischenzellen bilden Androgene aus Cholesterin,
zunächst angeregt durch HCG, dann durch LH / FSH (LH fördert die
Testosteronsynthese im Hoden)
Testosteron und 5-α-Dihydrotestosteron (DHT) haben starke,
Dehydroepiandrosteron (DHEA) mäßige, Androstendion schwache androgene
Wirkung. DHT entsteht aus Testosteron durch Wirkung von 5α-Reduktase
(Typ 1 in Gehirn, Leber, Haut; Typ 2 in Prostata und Nebenhoden).
Leydig-sche Zwischenzellen bilden Androgene aus Cholesterin,
zunächst angeregt durch HCG, dann durch LH / FSH (LH fördert die
Testosteronsynthese im Hoden) Testosteron fördert
die Differenzierung der Wolff-Gänge zu Nebenhoden, ductus deferens,
ductus ejaculatorius und Samenblasen; später Muskel- und
Knochenwachstum, Erythropoese. Die Spermatogenese ist völlig abhängig
von Testosteron. Prostata, vesiculae seminales und Haut bilden mittels
5-α-Reduktase aus Testosteron DHT; dieses beeinflusst das Verhalten,
stärkt Muskeln und Knochen und
kann Ausfall des Kopfhaares bewirken. Androgene bewirken den Schluss
der Epiphysenfugen,
verminderte Bildung viszeralen Fettes, Reifung der Spermatozoen,
Stimmbruch; androgene Effekte üben
z.T. DHT und Östradiol (durch Aromatase aus Testosteron
entstanden) aus
Testosteron fördert
die Differenzierung der Wolff-Gänge zu Nebenhoden, ductus deferens,
ductus ejaculatorius und Samenblasen; später Muskel- und
Knochenwachstum, Erythropoese. Die Spermatogenese ist völlig abhängig
von Testosteron. Prostata, vesiculae seminales und Haut bilden mittels
5-α-Reduktase aus Testosteron DHT; dieses beeinflusst das Verhalten,
stärkt Muskeln und Knochen und
kann Ausfall des Kopfhaares bewirken. Androgene bewirken den Schluss
der Epiphysenfugen,
verminderte Bildung viszeralen Fettes, Reifung der Spermatozoen,
Stimmbruch; androgene Effekte üben
z.T. DHT und Östradiol (durch Aromatase aus Testosteron
entstanden) aus Sex hormone-binding globulin
(SHBG) bindet mit hoher Affinität etwa die Hälfte des Testosterons im
Blut, das zu 98% proteingebunden ist (Rest an Albumin). Steigender
SHBG-Spiegel (wie mit zunehmendem Alter) senkt die Verfügbarkeit freien
Hormons und damit die Hormonwirkung. Freies Hormon diffundiert in die
Zelle, bindet an zytoplasmatische Androgenrezeptoren (die dabei
Hitzeschockprotein abkoppeln). Die Rezeptoren dimerisieren, werden
phosphoryliert, gelangen durch die Kernmembran und binden an DNA-androgen response elements.
Androgenrezeptoren sind Transkriptionsfaktoren, deren Wirkung von
gewebespezifischen Koaktivatoren und Korepressoren beeinflusst wird Sex hormone-binding globulin
(SHBG) bindet mit hoher Affinität etwa die Hälfte des Testosterons im
Blut, das zu 98% proteingebunden ist (Rest an Albumin). Steigender
SHBG-Spiegel (wie mit zunehmendem Alter) senkt die Verfügbarkeit freien
Hormons und damit die Hormonwirkung. Freies Hormon diffundiert in die
Zelle, bindet an zytoplasmatische Androgenrezeptoren (die dabei
Hitzeschockprotein abkoppeln). Die Rezeptoren dimerisieren, werden
phosphoryliert, gelangen durch die Kernmembran und binden an DNA-androgen response elements.
Androgenrezeptoren sind Transkriptionsfaktoren, deren Wirkung von
gewebespezifischen Koaktivatoren und Korepressoren beeinflusst wird Testosteron braucht das Zusammenspiel mit Östrogenen. Aromatase macht
aus Testosteron Östradiol, ~98% wird im Kreislauf an SBG und Albumin
gebunden. Östrogene regen das Knochen- und Muskelwachstum an, bewirken
den
Schluss der Epiphysenfugen, hemmen die Testosteronbildung und seine
Umwandlung in DHT, und senken die Gonadotropinfreisetzung aus der
Hypophyse
Testosteron braucht das Zusammenspiel mit Östrogenen. Aromatase macht
aus Testosteron Östradiol, ~98% wird im Kreislauf an SBG und Albumin
gebunden. Östrogene regen das Knochen- und Muskelwachstum an, bewirken
den
Schluss der Epiphysenfugen, hemmen die Testosteronbildung und seine
Umwandlung in DHT, und senken die Gonadotropinfreisetzung aus der
Hypophyse Sertoli-Zellen unterstützen die gesamte Spermatogenese, bestimmen den
Zeitpunkt der Freigabe der Spermien aus dem tubulus seminiferus, bauen
die Blut-Hoden-Schranke auf, sezernieren testikuläre Flüssigkeit,
bilden androgenbindendes Protein (ABP), Anti-Müller-Hormon, Inhibin
(hemmt die FSH-Freisetzung aus der Hypophyse und damit die
Spermatogenese) und
Wachstumsfaktoren (für die Spermatogenese), aromatisieren Testosteron zu Östradiol. Sie
kooperieren mit Leydig-Zellen bei der Steroidhormonsynthese Sertoli-Zellen unterstützen die gesamte Spermatogenese, bestimmen den
Zeitpunkt der Freigabe der Spermien aus dem tubulus seminiferus, bauen
die Blut-Hoden-Schranke auf, sezernieren testikuläre Flüssigkeit,
bilden androgenbindendes Protein (ABP), Anti-Müller-Hormon, Inhibin
(hemmt die FSH-Freisetzung aus der Hypophyse und damit die
Spermatogenese) und
Wachstumsfaktoren (für die Spermatogenese), aromatisieren Testosteron zu Östradiol. Sie
kooperieren mit Leydig-Zellen bei der Steroidhormonsynthese Die Spermatogenese dauert ~70 Tage, anschließend verbleiben die
Spermien mindestens einen Monat in rete testis, ductuli efferentes und
Nebenhoden (Blut-Nebenhoden-Schranke), wo sie weiter reifen (Proteine,
Glykolipide). Danach gelangt der Samen in den Samenleiter (ductus
deferens). Bei der Emission steuern die
Samenblasen (vesiculae seminales) 60-70% des Sekretvolumens bei
(alkalisch, reich an Fruktose, Semenogelin), die Prostata ~30% (Phosphat, Bicarbonat, Citrat, Zink,
saure Phosphatase, PSA, Spermin). Ein erwachsener Mann produziert ~90
Millionen Spermien pro Tag. Die Spermien benötigen eine Temperatur von
höchstens 35°C, eingestellt u.a. durch Gegenstrom-Wärmeaustausch im
plexus pampiniformis und Kühlung über die Skrotalhaut (große
Oberfläche, Evaporation von Schweiß) Die Spermatogenese dauert ~70 Tage, anschließend verbleiben die
Spermien mindestens einen Monat in rete testis, ductuli efferentes und
Nebenhoden (Blut-Nebenhoden-Schranke), wo sie weiter reifen (Proteine,
Glykolipide). Danach gelangt der Samen in den Samenleiter (ductus
deferens). Bei der Emission steuern die
Samenblasen (vesiculae seminales) 60-70% des Sekretvolumens bei
(alkalisch, reich an Fruktose, Semenogelin), die Prostata ~30% (Phosphat, Bicarbonat, Citrat, Zink,
saure Phosphatase, PSA, Spermin). Ein erwachsener Mann produziert ~90
Millionen Spermien pro Tag. Die Spermien benötigen eine Temperatur von
höchstens 35°C, eingestellt u.a. durch Gegenstrom-Wärmeaustausch im
plexus pampiniformis und Kühlung über die Skrotalhaut (große
Oberfläche, Evaporation von Schweiß) GnRH muss pulsatil freigesetzt werden, um zu wirken (Dauerinfusion
senkt den Testosteronspiegel). FSH schützt die Integrität der tubuli
seminiferi und fördert die Gametogenese. LH (ICSH: interstitial cell stimulating hormone)
stimuliert die Testosteronbildung in den Leydig-Zellen. Inhibin bremst
die Gonadotropinfreisetzung. GnRH-Neurone werden von Nachbarneuronen
durch Kisspeptin beeinflusst
GnRH muss pulsatil freigesetzt werden, um zu wirken (Dauerinfusion
senkt den Testosteronspiegel). FSH schützt die Integrität der tubuli
seminiferi und fördert die Gametogenese. LH (ICSH: interstitial cell stimulating hormone)
stimuliert die Testosteronbildung in den Leydig-Zellen. Inhibin bremst
die Gonadotropinfreisetzung. GnRH-Neurone werden von Nachbarneuronen
durch Kisspeptin beeinflusst |
