




 Metabolische
Kontrolle, hypothalamisches System
Metabolische
Kontrolle, hypothalamisches System
 agouti-related: agouti ist eine Fellfarbe, der verantwortliche Genlokus ist nach einem südamerikanischen Nagetier benannt
agouti-related: agouti ist eine Fellfarbe, der verantwortliche Genlokus ist nach einem südamerikanischen Nagetier benannt| Der Energiehaushalt des Körpers wird zentral reguliert: Nervenzellen im Hypothalamus regulieren die Abstimmung von Nahrungsaufnahme, Energieabgabe und körpereigenen Energiereserven. Periphere Signale - aus
Sinnesorganen, Darm, Pankreas, Muskel- und Fettgewebe - informieren
über den Istzustand (Nahrung in Sicht? postprandial? postresorptiv?),
und appetitsteigernde / appetithemmende Zentren steuern die Peripherie
über neuronale (somatomotorische, autonome) sowie hormonelle
Komponenten. Diese beeinflussen Aufnahme,
Digestion, Absorption, Verteilung, Verwertung und Speicherung von Nährstoffen. Orexigene Faktoren / Substanzen regen die Nahrungsaufnahme an, anorexigene bewirken Sattheitsgefühl und hemmen die Nahrungsaufnahme. Die Wirkung des jeweiligen Faktors kann vorübergehend (episodisch) oder fortdauernd (tonisch) sein. Dadurch ergibt sich unterschiedliche zeitliche Dynamik der Hunger-Sattheits-Regulation. Die hypothalamischen Kerne steuern u.a. den nucleus tractus solitarii (dieser empfängt gleichzeitig Signale aus der Peripherie und meldet an hypothalamische und andere Kerne zurück) und den dorsalen motorischen Vaguskern, der wiederum die Darmtätigkeit fördert. Über stoffwechselwirksame Hormonsysteme (z.B. ACTH, hGH, TSH) mischt sich der Hypothalamus in das metabolische Geschehen ein. Über das vegetative Nervensystem wirkt er direkt auf Verdauung, Kreislauf, Stoffwechsel, Substratverwertung und Wärmeregulation. All dies ist eng mit Funktionen des limbischen Systems verknüpft: Dadurch steht die Motivationslage und emotionale Situation des Menschen unter dem Einfluss der Steuerung von Aufnahme, Verwertung und Speicherung der Nahrung (Belohnungseffekt des Essens). |

 Abbildung: Glucose- und Lipidrezeptoren
Abbildung: Glucose- und Lipidrezeptoren
 Leptin
Leptin  ist ein Peptidhormon, das von Adipozyten (also im Fettgewebe) synthetisiert wird. Je größer ein Adipozyt, desto mehr Leptin
kann er sezernieren. Der Leptinspiegel im Blut wird von Neuronen im
Hypothalamus registriert, die über Leptinrezeptoren verfügen.
Steigender Leptinspiegel reduziert den Appetit (negative Rückkopplung).
ist ein Peptidhormon, das von Adipozyten (also im Fettgewebe) synthetisiert wird. Je größer ein Adipozyt, desto mehr Leptin
kann er sezernieren. Der Leptinspiegel im Blut wird von Neuronen im
Hypothalamus registriert, die über Leptinrezeptoren verfügen.
Steigender Leptinspiegel reduziert den Appetit (negative Rückkopplung). Abbildung). Dieses steuert das Essverhalten und vermittelt auch das Gefühl dert Sättigung, wenn die metabolischen Speicher wieder adäquat gefüll sind. Die Sättigungssignale können kurzfristig wirksam sein (von Sinnesorganen, aus dem Gastrointestinaltrakt - z.B. PYY -, aus der Leber und dem Gehirn selbst) oder länger anhalten (Signale aus dem Fettgewebe).
Abbildung). Dieses steuert das Essverhalten und vermittelt auch das Gefühl dert Sättigung, wenn die metabolischen Speicher wieder adäquat gefüll sind. Die Sättigungssignale können kurzfristig wirksam sein (von Sinnesorganen, aus dem Gastrointestinaltrakt - z.B. PYY -, aus der Leber und dem Gehirn selbst) oder länger anhalten (Signale aus dem Fettgewebe).  Der nucleus arcuatus
Der nucleus arcuatus  (nucl. infundibularis)
ist eine zentrale Schaltstelle für die langfristige Regulation des
Energiehaushaltes im Körper. Er ist ein Kern des Hypothalamus und liegt am Boden
des 3. Gehirnventrikels (anschließend an die nuclei paraventriculares, die einen
Teil des 3. Ventrikels seitlich auskleiden). Der nucl. arcuatus spielt eine zentrale Rolle für die Steuerung des Appetits und ist ein Zentrum der Steuerung der Energiebilanz des Körpers. Er reagiert auf periphere Signale, die den Ernährungszustand widerspiegeln,
empfängt Impulse aus dem nucl. tractus solitarii und
ist reziprok mit anderen Kernen des Hypothalamus verbunden.
(nucl. infundibularis)
ist eine zentrale Schaltstelle für die langfristige Regulation des
Energiehaushaltes im Körper. Er ist ein Kern des Hypothalamus und liegt am Boden
des 3. Gehirnventrikels (anschließend an die nuclei paraventriculares, die einen
Teil des 3. Ventrikels seitlich auskleiden). Der nucl. arcuatus spielt eine zentrale Rolle für die Steuerung des Appetits und ist ein Zentrum der Steuerung der Energiebilanz des Körpers. Er reagiert auf periphere Signale, die den Ernährungszustand widerspiegeln,
empfängt Impulse aus dem nucl. tractus solitarii und
ist reziprok mit anderen Kernen des Hypothalamus verbunden.  Abbildung).
Abbildung). AgRP (agouti-related peptide) ist
ein aus 112 Aminosäuren bestehendes Neuropeptid, das hauptsächlich von
NPY-produzierenden Nervenzellen des hypothalamischen nucleus arcuatus
produziert wird (aber auch von Nebennieren, nucl. subthalamicus, Lunge,
Nieren etc). AgRP steigert den Appetit intensiv und über längere Zeit,
senkt gleichzeitig den metabolischen Aufwand und den Energieumsatz des
Körpers. AgRP entfaltet seine Effekte parakrin als kompetitiver
Antagonist an Melanocortinrezeptoren (spezifisch MCR3-R und MCR4-R). AgRP regt auch die Freisetzung von ACTH und Prolactin an, hemmt hingegen die TRH-TSH-Achse.
AgRP (agouti-related peptide) ist
ein aus 112 Aminosäuren bestehendes Neuropeptid, das hauptsächlich von
NPY-produzierenden Nervenzellen des hypothalamischen nucleus arcuatus
produziert wird (aber auch von Nebennieren, nucl. subthalamicus, Lunge,
Nieren etc). AgRP steigert den Appetit intensiv und über längere Zeit,
senkt gleichzeitig den metabolischen Aufwand und den Energieumsatz des
Körpers. AgRP entfaltet seine Effekte parakrin als kompetitiver
Antagonist an Melanocortinrezeptoren (spezifisch MCR3-R und MCR4-R). AgRP regt auch die Freisetzung von ACTH und Prolactin an, hemmt hingegen die TRH-TSH-Achse. CART (cocaine and amphetamine related transcript)
ist die Bezeichnung für eine Gruppe von Neuropeptiden, die von
zahlreichen Zellarten exprimiert wird (Hypothalamus, Hypophyse,
Mandelkerne, Nebennierenmark etc). Sie wirken appetithemmend (wie
Leptin und NPY) und scheinen auch für andere neuronale Prozesse
(Kognition, Belohnungsempfinden) eine wichtige Rolle zu spielen.
CART (cocaine and amphetamine related transcript)
ist die Bezeichnung für eine Gruppe von Neuropeptiden, die von
zahlreichen Zellarten exprimiert wird (Hypothalamus, Hypophyse,
Mandelkerne, Nebennierenmark etc). Sie wirken appetithemmend (wie
Leptin und NPY) und scheinen auch für andere neuronale Prozesse
(Kognition, Belohnungsempfinden) eine wichtige Rolle zu spielen.

 Abbildung: Leptinwirkung auf den nucleus arcuatus
Abbildung: Leptinwirkung auf den nucleus arcuatus
 POMC wird zu mehreren Neuropeptiden abgebaut, einschließlich α-MSH
(alpha-Melanotropin), das Melanocortin-4-Rezeptoren (MC4R) anregt und so die Nahrungsaufnahme hemmt. Mutationen des MC4R-Gens können Übergewicht bewirken. α-MSH ist das wichtigste Melanozyten-stimulierende Peptid,
das u.a. Nahrungsaufnahme und Energiehaushalt beeinflusst.
POMC wird zu mehreren Neuropeptiden abgebaut, einschließlich α-MSH
(alpha-Melanotropin), das Melanocortin-4-Rezeptoren (MC4R) anregt und so die Nahrungsaufnahme hemmt. Mutationen des MC4R-Gens können Übergewicht bewirken. α-MSH ist das wichtigste Melanozyten-stimulierende Peptid,
das u.a. Nahrungsaufnahme und Energiehaushalt beeinflusst.  AgPR-Neurone setzen (neben GABA) zwei orexigene Faktoren frei, AgRP und NPY.
AgPR-Neurone setzen (neben GABA) zwei orexigene Faktoren frei, AgRP und NPY. Abbildung).
Abbildung). Die nuclei parabrachiales sind ein Kernkomplex (parabrachial complex)
im Bereich der dorsolateralen Brücke des Hirnstamms, benannt nach ihrer
Lage (die Kerne sind um den oberen Kleinhirnstiel - brachium
conjunctivum - angeordnet). Die größten sind der mediale (erhält Geschmacksinformation vom nucl. tractus solitarii und leitet sie an den Thalamus weiter), der laterale (ähnliche Aufgaben, projiziert auch in den Hypothalamus) sowie der subparabrachiale
Kern (auch Kölliker-Fuse- bzw. diffuser retikulärer Kern, er
beeinflusst die Atemfrequenz). Insgesamt bearbeiten die
Parabrachialkerne viszerale Afferenzen (auch Schmerz betreffend) und
projizieren diese in das Zwischenhirn (thalamische und hypothalamische
Kerne), das limbische System sowie die Großhirnrinde (z.B. Insel). Sie
beteiligen sich u.a. an der Stabilisierung des Blutzuckerspiegels, der
Thermoregulation, dem Geschmacksempfinden, aber auch an der Steuerung
der Atmung sowie dem Grad der Aufmerksamkeit (arousal).
Die nuclei parabrachiales sind ein Kernkomplex (parabrachial complex)
im Bereich der dorsolateralen Brücke des Hirnstamms, benannt nach ihrer
Lage (die Kerne sind um den oberen Kleinhirnstiel - brachium
conjunctivum - angeordnet). Die größten sind der mediale (erhält Geschmacksinformation vom nucl. tractus solitarii und leitet sie an den Thalamus weiter), der laterale (ähnliche Aufgaben, projiziert auch in den Hypothalamus) sowie der subparabrachiale
Kern (auch Kölliker-Fuse- bzw. diffuser retikulärer Kern, er
beeinflusst die Atemfrequenz). Insgesamt bearbeiten die
Parabrachialkerne viszerale Afferenzen (auch Schmerz betreffend) und
projizieren diese in das Zwischenhirn (thalamische und hypothalamische
Kerne), das limbische System sowie die Großhirnrinde (z.B. Insel). Sie
beteiligen sich u.a. an der Stabilisierung des Blutzuckerspiegels, der
Thermoregulation, dem Geschmacksempfinden, aber auch an der Steuerung
der Atmung sowie dem Grad der Aufmerksamkeit (arousal). Abbildung) - es
speichert nicht nur Neutralfette, es ist auch ein endokrines Organ, das
Adipokine freisetzt - zu diesen gehören Leptin, Resistin, Adiponektin und Visfatin; ferner bildet es auch Zytokine.
Abbildung) - es
speichert nicht nur Neutralfette, es ist auch ein endokrines Organ, das
Adipokine freisetzt - zu diesen gehören Leptin, Resistin, Adiponektin und Visfatin; ferner bildet es auch Zytokine. 
 Abbildung: Metabolische Homöostase des Fettgewebes
Abbildung: Metabolische Homöostase des Fettgewebes
 Abbildung unten).
Abbildung unten). 
 Appetitsteigerung,
Appetitsteigerung, 
 Motivation und Lernen (synaptische Plastizität) und
Motivation und Lernen (synaptische Plastizität) und
 Nozizeption (Schmerzhemmung).
Nozizeption (Schmerzhemmung). Komponenten eine wichtige Rolle (Genuss des Essens). Mit seinen
Sensoren wirkt das ZNS auch als metabolisches Sinnesorgan, indem es die
Verfügbarkeit verschiedener Nährstoffe überprüft und auf hormonelle
Signale aus der Peripherie reagiert.
Komponenten eine wichtige Rolle (Genuss des Essens). Mit seinen
Sensoren wirkt das ZNS auch als metabolisches Sinnesorgan, indem es die
Verfügbarkeit verschiedener Nährstoffe überprüft und auf hormonelle
Signale aus der Peripherie reagiert.
 Abbildung: Kurzzeit-Kontrollsystem der Nahrungsaufnahme
Abbildung: Kurzzeit-Kontrollsystem der Nahrungsaufnahme GLP-1, glucagonähnliches Peptid
GLP-1, glucagonähnliches Peptid  PYY, Peptid YY
PYY, Peptid YY  VIP, vasoaktives intestinales Peptid
VIP, vasoaktives intestinales Peptid
 Sinnesorgane
(Sehen, Riechen, Schmecken, Hören): Sie vermitteln Information, die
relevant für Appetit (Werbung!), Anwesenheit (Angebot) und Aufnahme von
Nahrung ist (äußere Reize)
Sinnesorgane
(Sehen, Riechen, Schmecken, Hören): Sie vermitteln Information, die
relevant für Appetit (Werbung!), Anwesenheit (Angebot) und Aufnahme von
Nahrung ist (äußere Reize) Das Verdauungssystem generiert neuronale (von
Dehnungs-, Chemo- und Osmorezeptoren)
sowie humorale Signale ("Verdauungshormone" - bis auf Ghrelin, das
appetitanregend wirkt, sind dies verschiedene auf Hirnstamm und
Hypothalamus auf Sättigungsgefühl abzielende Faktoren) auf den Zustand
des
Gastointestinalsystems und die Anwesenheit verschiedenster Stoffe in
Darm und Blut (innere Reize)
Das Verdauungssystem generiert neuronale (von
Dehnungs-, Chemo- und Osmorezeptoren)
sowie humorale Signale ("Verdauungshormone" - bis auf Ghrelin, das
appetitanregend wirkt, sind dies verschiedene auf Hirnstamm und
Hypothalamus auf Sättigungsgefühl abzielende Faktoren) auf den Zustand
des
Gastointestinalsystems und die Anwesenheit verschiedenster Stoffe in
Darm und Blut (innere Reize) Im Gehirn
laufen die Information von den Sinnesorganen und aus dem
Verdauungssystem neuronal, sowie auf dem Blutweg (Glucose- und andere
Substrat- sowie Hormonkonzentrationen: Die Blut-Hirn-Schranke
muss dabei überschritten werden) aus Gastrointestinalsystem, Fettgewebe
u.a. zusammen. Hier finden "übergeordnete", gesamtheitliche Aspekte
Berücksichtigung (innere: persönliche Absichten und Befindlichkeit; äußere: Situation, in der sich die Person befindet - mentale Ebene).
Im Gehirn
laufen die Information von den Sinnesorganen und aus dem
Verdauungssystem neuronal, sowie auf dem Blutweg (Glucose- und andere
Substrat- sowie Hormonkonzentrationen: Die Blut-Hirn-Schranke
muss dabei überschritten werden) aus Gastrointestinalsystem, Fettgewebe
u.a. zusammen. Hier finden "übergeordnete", gesamtheitliche Aspekte
Berücksichtigung (innere: persönliche Absichten und Befindlichkeit; äußere: Situation, in der sich die Person befindet - mentale Ebene).  Aktivität des lateralen Hypothalamus regt die Nahrungsaufnahme an (Läsionen dieser Kernregion führen zu Appetitverlust und Anorexie),
Aktivität des lateralen Hypothalamus regt die Nahrungsaufnahme an (Läsionen dieser Kernregion führen zu Appetitverlust und Anorexie), 
 während der ventromediale
Hypothalamus die Nahrungsaufnahme drosselt (Läsionen führen zu
unkontrollierter Kalorienzufuhr und Gewichtszunahme).
während der ventromediale
Hypothalamus die Nahrungsaufnahme drosselt (Läsionen führen zu
unkontrollierter Kalorienzufuhr und Gewichtszunahme).  Peptide) und wirken so längerfristig gewichtssteigernd.
Peptide) und wirken so längerfristig gewichtssteigernd. Hormone, die das Essverhalten regulieren  Nach Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020 |
||||
| Hormone |
Quelle |
Freigesetzt |
Ziel |
Wirkung |
| CCK |
GI-Trakt |
vor / während Mahlzeit |
vagale Afferenzen |
beschränkt Nahrungs- aufnahme |
| Amylin, Insulin, Glucagon |
Pankreas |
vor / während Mahlzeit | vagale Afferenzen | beschränkt Nahrungs- aufnahme |
| PYY3-36 |
Ileum, Colon |
postprandial |
Hirnstamm, Hypothalamus |
verzögert nächste Nahrungs- aufnahme |
| GLP-1 |
Magen |
postprandial | Hirnstamm, Hypothalamus | verzögert nächste Nahrungs- aufnahme |
| Oxynto- modulin |
Magen |
postprandial | Hirnstamm, Hypothalamus | verzögert nächste Nahrungs- aufnahme |
| Leptin |
Fettgewebe |
entsprechend Fettspeichern |
Hirnstamm, nucl. arcuatus |
Langzeit- redulierung der Nahrungs- aufnahme |
| Ghrelin |
Magen |
bei Hunger |
N. vagus, Hypothalamus |
steigert Portion und Zahl der Mahlzeiten |
| Nesfatin-1 |
Hypothalamus, Pankreas, Fettgewebe, GI-Trakt |
Nahrungs- aufnahme |
orexigene NPY-Neurone |
reduziert den Appetit |
 Abbildung); entsprechend beeinflusst er den Hypothalamus (der wiederum auf den nucl. accumbens zurückprojiziert).
Abbildung); entsprechend beeinflusst er den Hypothalamus (der wiederum auf den nucl. accumbens zurückprojiziert).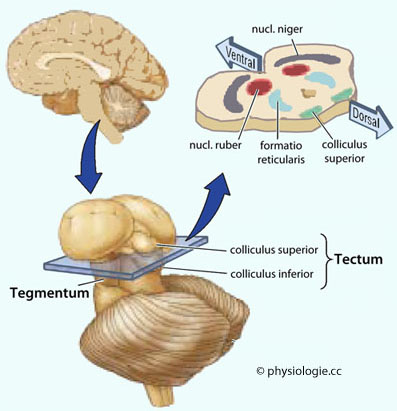
 Abbildung: Hirnstammkerne
Abbildung: Hirnstammkerne
 der Hypothalamus (nucleus dorsomedialis der mittleren Kerngruppe),
der Hypothalamus (nucleus dorsomedialis der mittleren Kerngruppe),  die area postrema (ein chemorezeptives zirkumventrikuläres Organ am Boden
der Rautengrube, in der Nähe des nucleus tractus solitarii),
die area postrema (ein chemorezeptives zirkumventrikuläres Organ am Boden
der Rautengrube, in der Nähe des nucleus tractus solitarii),  die nuclei parabrachiales
(ein Kernkomplex in der dorsalen Brücke, benannt nach ihrer Nähe zum
pedunculus cerebellaris superior, mit zahlreichen Funktionen (nucl.
tractus solitarii → Thalamus, Hypothalamus; Atemsteuerung, Geschmacksleitung etc),
die nuclei parabrachiales
(ein Kernkomplex in der dorsalen Brücke, benannt nach ihrer Nähe zum
pedunculus cerebellaris superior, mit zahlreichen Funktionen (nucl.
tractus solitarii → Thalamus, Hypothalamus; Atemsteuerung, Geschmacksleitung etc),  das ventrale tegmentale Areal,
sowie
das ventrale tegmentale Areal,
sowie  Teile des limbischen Systems.
Teile des limbischen Systems. 
 Der hypothalamische nucleus paraventricularis
dient als Integrationsstelle für zahlreiche ernährungsrelevante Inputs
und beteiligt sich an der Kontrolle des Essverhaltens
Der hypothalamische nucleus paraventricularis
dient als Integrationsstelle für zahlreiche ernährungsrelevante Inputs
und beteiligt sich an der Kontrolle des Essverhaltens
 Abbildung: Hypothalamische Kerne
Abbildung: Hypothalamische Kerne Zum Hypothalamus s. dort
Zum Hypothalamus s. dort
 Die Mandelkerne (nucll. amygdalae) im limbischen System kümmern sich zusammen mit dem nucl. accumbens um Motivation ("Belohnung") beim Essen.
Die Mandelkerne - vor allem der laterale Kern - erhalten Projektionen
aus dem Neokortex und aus spezifischen thalamischen Kernen; und
Efferenzen aus den Mandelkernen projizieren wiederum auf den
Hypothalamus. Auf diese Weise werden emotional geladene Reaktionen
gesteuert, zu diesen gehören die Nahrungsaufnahme betreffende
Vorgänge.
Die Mandelkerne (nucll. amygdalae) im limbischen System kümmern sich zusammen mit dem nucl. accumbens um Motivation ("Belohnung") beim Essen.
Die Mandelkerne - vor allem der laterale Kern - erhalten Projektionen
aus dem Neokortex und aus spezifischen thalamischen Kernen; und
Efferenzen aus den Mandelkernen projizieren wiederum auf den
Hypothalamus. Auf diese Weise werden emotional geladene Reaktionen
gesteuert, zu diesen gehören die Nahrungsaufnahme betreffende
Vorgänge. Abbildung oben).
Abbildung oben). Beschädigung des nucl. tractus solitarii führt zu unkontrollierter Nahrungsaufnahme.
Beschädigung des nucl. tractus solitarii führt zu unkontrollierter Nahrungsaufnahme. Abbildung) und
dem nucleus tractus solitarii, der über das vegetative System mit der
Peripherie kommuniziert. Rezeptoren im gastrointestinalen System
informieren über die Anwesenheit diverser Stoffe im Chymus, Änderungen
der Muskelspannung, und Peptide aus endokrinen und Nervenzellen in der Darmwand. Afferente (vagale) Fasern
melden diese Information an das Gehirn - insbesondere Vaguskerne und
nucleus tractus solitarii. So ergeben sich mehrere Rückkopplungskreise,
von vago-vagalen Reflexen bis zur Steuerung von Energiebilanz, Hunger
und Sattheit..
Abbildung) und
dem nucleus tractus solitarii, der über das vegetative System mit der
Peripherie kommuniziert. Rezeptoren im gastrointestinalen System
informieren über die Anwesenheit diverser Stoffe im Chymus, Änderungen
der Muskelspannung, und Peptide aus endokrinen und Nervenzellen in der Darmwand. Afferente (vagale) Fasern
melden diese Information an das Gehirn - insbesondere Vaguskerne und
nucleus tractus solitarii. So ergeben sich mehrere Rückkopplungskreise,
von vago-vagalen Reflexen bis zur Steuerung von Energiebilanz, Hunger
und Sattheit..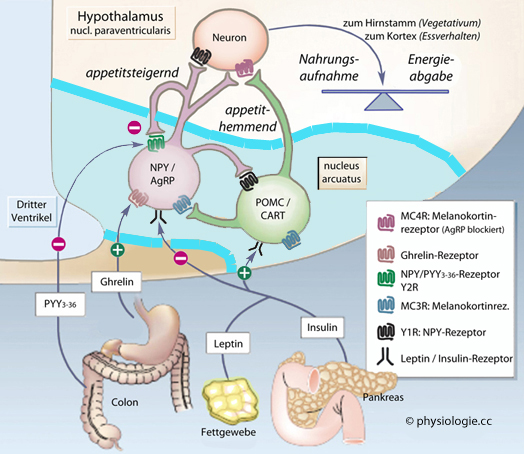
 Abbildung: Hypothalamische Steuerung des Energie-Gleichgewichts
Abbildung: Hypothalamische Steuerung des Energie-Gleichgewichts vgl. dort
vgl. dort
 ) und
vermehrter Substrateinlagerung (insbesondere ins Fettgewebe),
Adipositas und Übergewicht.
) und
vermehrter Substrateinlagerung (insbesondere ins Fettgewebe),
Adipositas und Übergewicht. Kurzfristig wirken die Plasmaspiegel von Substraten wie Glucose, Fettsäuren sowie Hormone (wie Cholezystokinin)
Kurzfristig wirken die Plasmaspiegel von Substraten wie Glucose, Fettsäuren sowie Hormone (wie Cholezystokinin) Langfristig
wirken Signale, die dem Bestand an Speicherfett entsprechen (wie Leptin).
Langfristig
wirken Signale, die dem Bestand an Speicherfett entsprechen (wie Leptin). 
 Abbildung: Wirkungen orexin- und MCH-bildender Neurone im lateralen Hypothalamus
Abbildung: Wirkungen orexin- und MCH-bildender Neurone im lateralen Hypothalamus
 Abbildung). Es wirkt auf eigene Rezeptoren (MCH-R1 und MCH-R2 - Antagonisten können gegen Übergewicht wirksam sein) und hat u.a.
appetitanregende Wirkung. MCH-Rezeptoren finden sich vor allem im
limbischen System.
Abbildung). Es wirkt auf eigene Rezeptoren (MCH-R1 und MCH-R2 - Antagonisten können gegen Übergewicht wirksam sein) und hat u.a.
appetitanregende Wirkung. MCH-Rezeptoren finden sich vor allem im
limbischen System. Orexin
Orexin  - das Gen und seine Transkripte werden Hypocretin
- das Gen und seine Transkripte werden Hypocretin  oder HCRT (hypocretin neuropeptide procursor) genannt -
ist ein vorwiegend vom lateralen Hypothalamus gebildetes Neuropeptid (
oder HCRT (hypocretin neuropeptide procursor) genannt -
ist ein vorwiegend vom lateralen Hypothalamus gebildetes Neuropeptid ( Abbildung),
das in der Form Orexin-A und Orexin-B vorkommt (Gene: Hypocretin-1,
Hypocretin-2). Die (im menschlichen Gehirn ~104)
orexinproduzierenden Neurone (vorwiegend im lateralen Hypothalamus) projizieren großflächig in das ZNS und
regulieren verschiedene Verhaltensweisen, u.a. Schlaf und Essverhalten
(daher der Name). Orexin wirkt anregend auf die Gehirnfunktion und gilt als aufmerksamkeitssteigernder Faktor.
Abbildung),
das in der Form Orexin-A und Orexin-B vorkommt (Gene: Hypocretin-1,
Hypocretin-2). Die (im menschlichen Gehirn ~104)
orexinproduzierenden Neurone (vorwiegend im lateralen Hypothalamus) projizieren großflächig in das ZNS und
regulieren verschiedene Verhaltensweisen, u.a. Schlaf und Essverhalten
(daher der Name). Orexin wirkt anregend auf die Gehirnfunktion und gilt als aufmerksamkeitssteigernder Faktor.
| Für die Regulation der Nahrungsaufnahme bedeutsame Transmitter / endokrine Signale | |||
| episodisch |
tonisch |
sonstige |
|
| orexigen |
Ghrelin, Orexin |
Progesteron |
NPY, AgRP, Galanin, ß-Endorphin, Endocannabinoide u.a. |
| anorexigen |
CCK, PYY, Amylin, GLP-1, Pankreatisches Polypeptid u.a. |
Leptin, Östrogene |
CART, Melanocortine (POMC), Serotonin, Noradrenalin, Dopamin |
 "Orexigene"
Substanzen werden von "hungersensitiven" Nervenzellen freigesetzt,
regen das Hungerzentrum an, hemmen das Sattheitszentrum und erhöhen die Energieaufnahme.
"Orexigene"
Substanzen werden von "hungersensitiven" Nervenzellen freigesetzt,
regen das Hungerzentrum an, hemmen das Sattheitszentrum und erhöhen die Energieaufnahme.  aus NPY-produzierenden Nervenzellen des nucleus arcuatus. Diese AgRP / NPY-Nervenzellen werden
aus NPY-produzierenden Nervenzellen des nucleus arcuatus. Diese AgRP / NPY-Nervenzellen werden  durch Ghrelin angeregt,
durch Ghrelin angeregt, 
 durch Leptin, Insulin, Cholezystokinin gehemmt (s. weiter unten).
durch Leptin, Insulin, Cholezystokinin gehemmt (s. weiter unten).  "Anorexigene" Substanzen wirken umgekehrt - vor allem Pro-opio-melanocortin (POMC) und das Cocaine and amphetamine related transcript (CART). POMC / Cart-Nervenzellen im nucl. arcuatus werden durch Leptin, Insulin, CCK angeregt. Anorexigene Faktoren unterstützen das Sättigungsgefühl. POMC-Neurone und
"Anorexigene" Substanzen wirken umgekehrt - vor allem Pro-opio-melanocortin (POMC) und das Cocaine and amphetamine related transcript (CART). POMC / Cart-Nervenzellen im nucl. arcuatus werden durch Leptin, Insulin, CCK angeregt. Anorexigene Faktoren unterstützen das Sättigungsgefühl. POMC-Neurone und  Episodische Faktoren sind von kurzzeitiger Wirkungsdauer; ihr Auftreten korreliert mit der aktuellen Situation der Nahrungsaufnahme.
Episodische Faktoren sind von kurzzeitiger Wirkungsdauer; ihr Auftreten korreliert mit der aktuellen Situation der Nahrungsaufnahme.  In
der zephalen Phase der Nahrungsaufnahme wirken sich antizipatorische
Signale (Geruch, Geschmack etc) schon auf das Essverhalten aus. Ein
wesentlicher Trigger ist die Nahrungsaufnahme an sich; so beteiligt
sich die Dehnung der Magenwand an der präabsorptiven Appetitkontrolle (diese tritt schon auf, bevor noch Nahrungsbestandteile vom Darm resorbiert werden).
In
der zephalen Phase der Nahrungsaufnahme wirken sich antizipatorische
Signale (Geruch, Geschmack etc) schon auf das Essverhalten aus. Ein
wesentlicher Trigger ist die Nahrungsaufnahme an sich; so beteiligt
sich die Dehnung der Magenwand an der präabsorptiven Appetitkontrolle (diese tritt schon auf, bevor noch Nahrungsbestandteile vom Darm resorbiert werden).  Anschließend bewirken resorbierte
Stoffe, die im Blut auftreten - insbesondere Glucose und Fettsäuren -
ein Sättigungsgefühl, das die Nahrunsaufnahme bremst. Umgekehrt wirkt
sich ein Absinken des Blutzuckerspiegels unmittelbar appetitauslösend
aus (zentrale Glucosesensoren).
Anschließend bewirken resorbierte
Stoffe, die im Blut auftreten - insbesondere Glucose und Fettsäuren -
ein Sättigungsgefühl, das die Nahrunsaufnahme bremst. Umgekehrt wirkt
sich ein Absinken des Blutzuckerspiegels unmittelbar appetitauslösend
aus (zentrale Glucosesensoren). Episodische Faktoren: Weiters werden im Rahmen der resorptiven Vorgänge Hormone in die
Blutbahn abgegeben, welche Appetit / Hunger und Nahrungsaufnahme
hemmen. CCK, Glucagon-like peptide 1, Peptid YY, Amylin, Insulin, Ghrelin gehören zu den Faktoren, welche die Nahrungsaufnahme kurzfristig beeinflussen:
Episodische Faktoren: Weiters werden im Rahmen der resorptiven Vorgänge Hormone in die
Blutbahn abgegeben, welche Appetit / Hunger und Nahrungsaufnahme
hemmen. CCK, Glucagon-like peptide 1, Peptid YY, Amylin, Insulin, Ghrelin gehören zu den Faktoren, welche die Nahrungsaufnahme kurzfristig beeinflussen: Abbildung):
Abbildung):
 Abbildung: Stellung von Präproglucagon-bildenden Neuronen
Abbildung: Stellung von Präproglucagon-bildenden Neuronen
 s. dort).
s. dort). wird
(hauptsächlich) vom Magen im Hungerzustand freigesetzt und regt Nahrungsaufnahme an. Sein orexigener
Effekt beruht z.T. auf einer Stimulierung von NPY-Neuronen im nucleus
arcuatus. Es ist an der Regulation von (mesolimbischen dopaminergen)
Belohnungseffekten beim Essen beteiligt.
wird
(hauptsächlich) vom Magen im Hungerzustand freigesetzt und regt Nahrungsaufnahme an. Sein orexigener
Effekt beruht z.T. auf einer Stimulierung von NPY-Neuronen im nucleus
arcuatus. Es ist an der Regulation von (mesolimbischen dopaminergen)
Belohnungseffekten beim Essen beteiligt.  Tonische Faktoren wirken im Gegensatz zu episodischen
längerfristig und korrelieren mit dem Zustand der Energiespeicher des
Körpers (auf dieser Vorstellung beruht die "lipostatische" Theorie der Regulation des Fettgewebes).
Deren Abnahme regt über tonische Faktoren die Nahrungsaufnahme an; sie
unterliegen u.a. zirkadianer Periodik. Betroffene Organe sind
Fettgewebe, Leber und Bauchspeicheldrüse: Sie produzieren Signale wie
Leptin, Insulin und Glucagon.
Tonische Faktoren wirken im Gegensatz zu episodischen
längerfristig und korrelieren mit dem Zustand der Energiespeicher des
Körpers (auf dieser Vorstellung beruht die "lipostatische" Theorie der Regulation des Fettgewebes).
Deren Abnahme regt über tonische Faktoren die Nahrungsaufnahme an; sie
unterliegen u.a. zirkadianer Periodik. Betroffene Organe sind
Fettgewebe, Leber und Bauchspeicheldrüse: Sie produzieren Signale wie
Leptin, Insulin und Glucagon.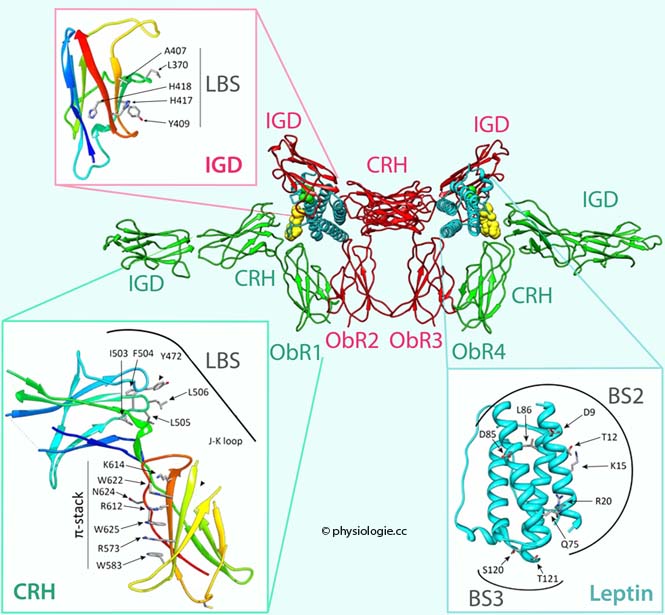
 Abbildung: Leptinmolekül-Leptinrezeptor-Komplex
Abbildung: Leptinmolekül-Leptinrezeptor-Komplex (
( Abbildung) stammt
hauptsächlich aus dem Fettgewebe, weiters aus Magen, Skelettmuskeln, Plazenta und Brüsten.
Abbildung) stammt
hauptsächlich aus dem Fettgewebe, weiters aus Magen, Skelettmuskeln, Plazenta und Brüsten.  Der Leptin-Blutspiegel korreliert
mit der Menge des Fettgewebes im Körper.
Der Leptin-Blutspiegel korreliert
mit der Menge des Fettgewebes im Körper.  Leptin hemmt orexigene Zellen (NPY / AgRP) im Hypothalamus - NPY wirkt besonders stark orexigen
Leptin hemmt orexigene Zellen (NPY / AgRP) im Hypothalamus - NPY wirkt besonders stark orexigen  Leptin vermittelt die Freisetzung des POMC-Abkömmlings α-MSH, das die Nahrungsaufnahme inhibiert, und fördert die Expression des (anorexigenen) CART
Leptin vermittelt die Freisetzung des POMC-Abkömmlings α-MSH, das die Nahrungsaufnahme inhibiert, und fördert die Expression des (anorexigenen) CART| Leptin fördert die hypothalamische Freisetzung von α-MSH und hemmt diejenige von NPY |
 Die (pulsatile) Synthese von Leptin wird gefördert durch Glucocorticoide, Insulin und Östrogene, und gehemmt durch ß-adrenerge Agonisten. Die Freisetzung erfolgt pulsatil und in Abhängigkeit von Fettspeichern bzw. dem body mass index.
Die (pulsatile) Synthese von Leptin wird gefördert durch Glucocorticoide, Insulin und Östrogene, und gehemmt durch ß-adrenerge Agonisten. Die Freisetzung erfolgt pulsatil und in Abhängigkeit von Fettspeichern bzw. dem body mass index.
| Hormon / Zytokin |
Herkunft |
subkutan (SC) / intra- abdominell (IA) |
Reiz für Freisetzung |
primäres Ziel |
Wirkungen |
| Leptin |
Adipozyten |
SC > IA |
erhöhte Fettmasse |
Hypothalamus ↓NPY, AgRP ↑POMC |
Appetit↓ Energieumsatz↑ Insulin- empfindlichkeit↑ Ghrelin↓ |
| Adiponektin |
Adipozyten |
SC > IA | Gewichtsverlust |
Muskel Leber Blutgefäße Herz Makrophagen |
Oxidation freier Fettsäuren↑ entzündungs- hemmend, antioxidativ Insulin- empfindlichkeit↑ kardiovaskuläre Fitness↑ |
| Tumornekrose- faktor |
weißes Fettgewebe Makrophagen |
IA > SC |
Vergrößerung der Adipozyten (Fettansammlung) |
Leber Muskel Adipozyten weitere Organe |
Fettmasse↓ entzündungs- fördernd Insulin- empfindlichkeit↓ |
| Interleukin 6 |
weißes Fettgewebe Makrophagen |
IA > SC | andere entzündungs- fördernde Zytokine |
Leber Muskel Adipozyten weitere Organe |
Insulin- empfindlichkeit↓ Akutphasen- proteine↑ entzündungs- fördernd |
| Ghrelin |
Magen (P/D1-Zellen) Inselzellen (ε) Hypothalamus |
- |
leerer Magen |
Hypothalamus Hypophyse vagale Afferenzen |
Appetit↑ Wachstums- hormon↑ Insulin- empfindlichkeit↓ Metabolismus↓ Leptinfreisetzung↓ |
| Insulin |
Pankreas (ß-Zellen) |
- |
Blutzucker- spiegel↑ Arginin. Leuzin, Fettsäuren↑ GIP, GLP1 |
Hypothalamus |
Appetit↓ Energieumsatz↑ |
| CCK |
Duodenum (I-Zellen) |
- |
Peptide, Aminosäuren↑ Fette, Fettsäuren↑ |
vagale Afferenzen |
Appetit↓ Magenentleerung↓ |

 Fettgewebe bildet Adipokine, die trophisch wirken: Leptin,
Resistin, Adiponektin, Visfatin; auch Zytokine.
Endokrine Sättigungssignale vermitteln CCK, Peptid YY und
Endocannabinoide; Ghrelin regt die Nahrungsaufnahme an, Nahrungsaufnahme unterdrückt die Ghrelinausschüttung. Insulinanregend wirken GLP-1 und GIP (mit Gastrin und Sekretin); Adiponektin
fördert die Insulinsensitivität. Das Gehirn überprüft die Verfügbarkeit von Nährstoffen und reagiert auf hormonelle Signale aus der Peripherie Fettgewebe bildet Adipokine, die trophisch wirken: Leptin,
Resistin, Adiponektin, Visfatin; auch Zytokine.
Endokrine Sättigungssignale vermitteln CCK, Peptid YY und
Endocannabinoide; Ghrelin regt die Nahrungsaufnahme an, Nahrungsaufnahme unterdrückt die Ghrelinausschüttung. Insulinanregend wirken GLP-1 und GIP (mit Gastrin und Sekretin); Adiponektin
fördert die Insulinsensitivität. Das Gehirn überprüft die Verfügbarkeit von Nährstoffen und reagiert auf hormonelle Signale aus der Peripherie Der laterale Hypothalamus regt die Nahrungsaufnahme an ("Hungerzentrum": Läsionen führen zu Appetitverlust und Anorexie), der ventromediale drosselt die Nahrungsaufnahme ("Sattheitszentrum": Läsionen führen zu Gewichtszunahme). α-MSH / CART-Neurone hemmen das Hungerzentrum, regen sympathische
Neurone und den Stoffwechsel an, was längerfristig gewichtsreduzierend
bis anorektisch wirkt. NPY /
AgRP-Neurone regen das Hungerzentrum
und den Parasympathikus an, senken den Energieverbrauch, fördern den
Appetit und wirken längerfristig
gewichtssteigernd Der laterale Hypothalamus regt die Nahrungsaufnahme an ("Hungerzentrum": Läsionen führen zu Appetitverlust und Anorexie), der ventromediale drosselt die Nahrungsaufnahme ("Sattheitszentrum": Läsionen führen zu Gewichtszunahme). α-MSH / CART-Neurone hemmen das Hungerzentrum, regen sympathische
Neurone und den Stoffwechsel an, was längerfristig gewichtsreduzierend
bis anorektisch wirkt. NPY /
AgRP-Neurone regen das Hungerzentrum
und den Parasympathikus an, senken den Energieverbrauch, fördern den
Appetit und wirken längerfristig
gewichtssteigernd  Der Nucleus accumbens
im basalen Vorderhirn "belohnt" Nahrungsaufnahme. Er hat dopaminerge
und opioiderge Neurone und beeinflusst Energiestatus, -homöostase,
Motivation und Essverhalten. Beteiligt an Belohnungseffekten der Nahrungsaufnahme sind weite Teile des limbischen Systems (insbesondere die Amygdala), die mit dem Frontalhirn reziprok verknüpft sind. Der nucleus arcuatus hat
sowohl α-MSH- und CART- als auch NPY- und AgRP-Neurone. Signale aus Hunger- und Sattheitszentrum
gelangen zum nucleus paraventricularis und weiter zum nucleus tractus solitarii; dieser erhält Afferenzen aus dem Verdauungssystem und hat parasympathische Efferenzen Der Nucleus accumbens
im basalen Vorderhirn "belohnt" Nahrungsaufnahme. Er hat dopaminerge
und opioiderge Neurone und beeinflusst Energiestatus, -homöostase,
Motivation und Essverhalten. Beteiligt an Belohnungseffekten der Nahrungsaufnahme sind weite Teile des limbischen Systems (insbesondere die Amygdala), die mit dem Frontalhirn reziprok verknüpft sind. Der nucleus arcuatus hat
sowohl α-MSH- und CART- als auch NPY- und AgRP-Neurone. Signale aus Hunger- und Sattheitszentrum
gelangen zum nucleus paraventricularis und weiter zum nucleus tractus solitarii; dieser erhält Afferenzen aus dem Verdauungssystem und hat parasympathische Efferenzen Endokrine
Signale, die Appetit und Nahrungsaufnahmeverhalten beeinflussen, wirken
orexigen (appetitanregend) oder anorexigen (appetitzügelnd).
Kurzfristig wirken die Plasmaspiegel von Substraten (Glucose,
Fettsäuren) und Hormone (CCK), langfristig Signale, die dem Bestand an
Speicherfett entsprechen (Leptin). Das Melanin concentrating hormone
(MCH) aus dem lateralen Hypothalamus wirkt appetitanregend
(MCH-Rezeptoren im limbischen System). AgRP / NPY-Neuronen
werden durch Ghrelin angeregt, durch Leptin, Insulin, Cholezystokinin
gehemmt. Orexin (Hypocretin) aus dem lateralen und posterioren
Hypothalamus reguliert neben Appetit auch Wachheit und Aufmerksamkeit. - Anorexigene Faktoren unterstützen das Sättigungsgefühl. POMC / CART-Nervenzellen im nucl. arcuatus werden durch Leptin, Insulin, CCK angeregt Endokrine
Signale, die Appetit und Nahrungsaufnahmeverhalten beeinflussen, wirken
orexigen (appetitanregend) oder anorexigen (appetitzügelnd).
Kurzfristig wirken die Plasmaspiegel von Substraten (Glucose,
Fettsäuren) und Hormone (CCK), langfristig Signale, die dem Bestand an
Speicherfett entsprechen (Leptin). Das Melanin concentrating hormone
(MCH) aus dem lateralen Hypothalamus wirkt appetitanregend
(MCH-Rezeptoren im limbischen System). AgRP / NPY-Neuronen
werden durch Ghrelin angeregt, durch Leptin, Insulin, Cholezystokinin
gehemmt. Orexin (Hypocretin) aus dem lateralen und posterioren
Hypothalamus reguliert neben Appetit auch Wachheit und Aufmerksamkeit. - Anorexigene Faktoren unterstützen das Sättigungsgefühl. POMC / CART-Nervenzellen im nucl. arcuatus werden durch Leptin, Insulin, CCK angeregt Episodische Faktoren beeinflussen die Nahrungsaufnahme kurzfristig. Appetithemmend sind CCK (Blutspiegel steigt innerhalb einer halben Stunde nach Beginn der Nahrungsaufnahme und bleibt für
~3 Stunden erhöht), GLP-1 (angeregt durch Kohlenhydrate), PYY (angeregt durch Fette, Fasern, Gallensäuren), Amylin, Insulin, Ghrelin (Spiegel steigt bei Hunger an, meist 1-2 Stunden vor der nächsten Mahlzeit, sinkt postprandial rasch auf Minimalwerte ab) Episodische Faktoren beeinflussen die Nahrungsaufnahme kurzfristig. Appetithemmend sind CCK (Blutspiegel steigt innerhalb einer halben Stunde nach Beginn der Nahrungsaufnahme und bleibt für
~3 Stunden erhöht), GLP-1 (angeregt durch Kohlenhydrate), PYY (angeregt durch Fette, Fasern, Gallensäuren), Amylin, Insulin, Ghrelin (Spiegel steigt bei Hunger an, meist 1-2 Stunden vor der nächsten Mahlzeit, sinkt postprandial rasch auf Minimalwerte ab)  Tonische Faktoren wirken längerfristig und korrelieren mit gespeicherter Energie. Glucocorticoide, Insulin, Östrogene regen die
Freisetzung von Leptin an, der Blutspiegel korreliert mit der Menge des
Fettgewebes im Körper. Leptin hemmt orexigene Zellen (NPY / AgRP) im
Hypothalamus, führt zur Freisetzung von α-MSH und CART, und hemmt
diejenige von NPY Tonische Faktoren wirken längerfristig und korrelieren mit gespeicherter Energie. Glucocorticoide, Insulin, Östrogene regen die
Freisetzung von Leptin an, der Blutspiegel korreliert mit der Menge des
Fettgewebes im Körper. Leptin hemmt orexigene Zellen (NPY / AgRP) im
Hypothalamus, führt zur Freisetzung von α-MSH und CART, und hemmt
diejenige von NPY |
