




| Geschmackszellen sind kurzlebige (10 Tage) sekundäre Sinneszellen. Bindung eines Geschmacksstoffes an Rezeptormoleküle (TR: taste receptors) aktiviert ein spezielles G-Protein (Gustducin),
Phospholipase und Inositolphosphat. Ca++-Ionen strömen ein und erhöhen
daraufhin den Kationeneinstrom durch Kanalproteine (TRP). Geschmacksinformation wird von Zunge, Gaumen und Rachenwand über den VII. (chorda tympani), IX. und X. Hirnnerven zum Hirnstamm (nucl. tractus solitarii) geleitet. Sie trägt zur reflektorischen Steuerung von Motorik (Kau- und Schluckbewegungen), Speichelfluss und Anregung des Verdauungssystems bei; andererseits werden höhergelegene Zentren (Insel, Orbitofrontalcortex, Hypothalamus, Mandelkerne) eingebunden. Geruchszellen sind primäre Sinneszellen, die in die nasale Mukosa (Riechepithel) ragen - diese enthält odorant-binding proteins zur Lösung hydrophober Geruchsstoffe. Auch Geruchs-Sinneszellen sind kurzlebig (4 Wochen). Der - rasch adaptierende - Geruchssinn steht im Dienst von Nahrungsbeurteilung, Orientierung, sozialer und sexueller Kommunikation sowie der Warnung vor Gefahr (brenzliger Geruch). Die Geruchsinformation wird in das phylogenetisch sehr alte (vom Thalamus noch unabhängige) Riechhirn projiziert, das eng mit dem limbischen System - und damit intensiv emotionalen Dimensionen - zusammenhängt: Das allokortikale Rhinencephalon grenzt direkt an den Hippocampus. |
 Geruch (olfaktorisches System)
Geruch (olfaktorisches System)  Zentrale Informationsverarbeitung
Zentrale Informationsverarbeitung  Bulbus olfactorius und Netzhaut: Vergleich der Verschaltungsmuster
Bulbus olfactorius und Netzhaut: Vergleich der Verschaltungsmuster Pheromone
Pheromone
 Core messages
Core messages Abbildung) - auf
attraktive, abstoßende (z.B. Giftstoffe) oder warnende Komponenten
(z.B. Brandgeruch).
Abbildung) - auf
attraktive, abstoßende (z.B. Giftstoffe) oder warnende Komponenten
(z.B. Brandgeruch). 
 Abbildung: Lage der Geruchs- und Geschmacksrezeptoren
Abbildung: Lage der Geruchs- und Geschmacksrezeptoren
 (bulbus und
pedunculus olfactorius) - ohne thalamische Beteiligung -, der
Geschmackssinn im
(neokortikalen) Parietallappen repräsentiert (Insel) - mit Schaltung über den Thalamus (nucl.
ventralis posteromedialis). Beide Sinnesinformationen (olfaktorisch,
gustatorisch) werden dem limbischen System
(Amygdala, Hypothalamus) als zentraler Instanz - mit autonom-nervösen und emotionalen Komponenten - zugeleitet.
(bulbus und
pedunculus olfactorius) - ohne thalamische Beteiligung -, der
Geschmackssinn im
(neokortikalen) Parietallappen repräsentiert (Insel) - mit Schaltung über den Thalamus (nucl.
ventralis posteromedialis). Beide Sinnesinformationen (olfaktorisch,
gustatorisch) werden dem limbischen System
(Amygdala, Hypothalamus) als zentraler Instanz - mit autonom-nervösen und emotionalen Komponenten - zugeleitet. 
 Abbildung: Zunge, Papillen, Geschmacksknospen
Abbildung: Zunge, Papillen, Geschmacksknospen Abbildung unten) - über diese
haben im Speichel gelöste Geschmacksstoffe Zugang zu den
Rezeptormolekülen der Mikrovilli.
Abbildung unten) - über diese
haben im Speichel gelöste Geschmacksstoffe Zugang zu den
Rezeptormolekülen der Mikrovilli.
 Abbildung). Die Sinneszellen haben bis zu 50 Mikrovilli (1-2 µm lang), die zur
Geschmackspore hin ragen und Geschmacksstoffe detektieren
(Oberflächenvergrößerung).
Abbildung). Die Sinneszellen haben bis zu 50 Mikrovilli (1-2 µm lang), die zur
Geschmackspore hin ragen und Geschmacksstoffe detektieren
(Oberflächenvergrößerung). 
 Abbildung: Geschmacksrezeptoren und Geschmacksknospe
Abbildung: Geschmacksrezeptoren und Geschmacksknospe
| Geschmacksrezeptoren adaptieren innerhalb weniger Minuten fast vollständig |
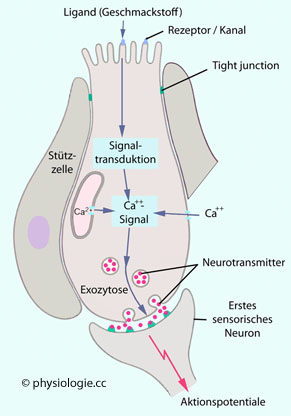
 Abbildung: Geschmackstransduktion in einer Geschmackszelle
Abbildung: Geschmackstransduktion in einer Geschmackszelle
| Süß-, Bitter- und Umami-Rezeptoren aktivieren G-Proteine In die Signalkette sind Adenylylcyclase (→ cAMP), Phospholipase C (→ IP3) und Ca++ involviert. K+-Kanäle schließen, Ca++-Kanäle öffnen, die Zelle wird depolarisiert |
 Abbildung).
Ob die Zunge des Menschen allerdings ENaCs exprimiert, ist fraglich
(das ENaC-blockierende Diuretikum Amilorid scheint die Detektion sauren
Geschmacks nicht zu beeinflussen), andererseits gibt es
Geschmacksrezeptoren, welche keines der bekannten
Geschmacksrezeptor-Moleküle exprimieren. Es kann vermutet werden, dass
es weitere, bisher nicht entdeckte Sensormoleküle gibt.
Abbildung).
Ob die Zunge des Menschen allerdings ENaCs exprimiert, ist fraglich
(das ENaC-blockierende Diuretikum Amilorid scheint die Detektion sauren
Geschmacks nicht zu beeinflussen), andererseits gibt es
Geschmacksrezeptoren, welche keines der bekannten
Geschmacksrezeptor-Moleküle exprimieren. Es kann vermutet werden, dass
es weitere, bisher nicht entdeckte Sensormoleküle gibt. 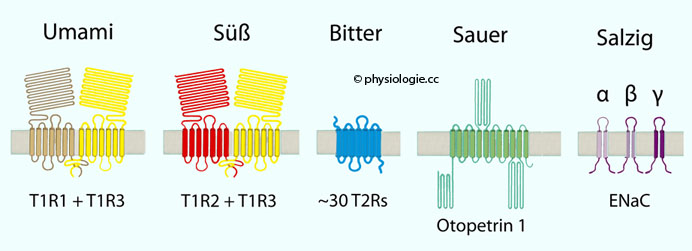
 Abbildung: Geschmacksrezeptoren
Abbildung: Geschmacksrezeptoren
 Salzig: Epitheliale
Natriumkanäle (ENaC) in salzsensitiven Geschmackszellen stehen
normalerweise offen; steigt die extrazelluläre Natriumkonzentration,
dringt Na+
vermehrt in die Zelle ein, die dadurch depolarisiert wird (es entsteht ein Rezeptorpotential). Die physiologische
Reaktion auf "Salzigkeit" ist konzentrationsabhängig: Kochsalz wird in
niedrigerer Konzentration (10-150 mM) als angenehm empfunden, höhere
Konzentrationen meist als unangenehm (diese stimulieren auch Sauer- und
Bitter-Rezeptoren). Das Begleitanion bestimmt die "salzig"-Empfindung
mit (Natriumchlorid schmeckt z.B. anders als Natriumbicarbonat gleicher molarer Konzentration).
Salzig: Epitheliale
Natriumkanäle (ENaC) in salzsensitiven Geschmackszellen stehen
normalerweise offen; steigt die extrazelluläre Natriumkonzentration,
dringt Na+
vermehrt in die Zelle ein, die dadurch depolarisiert wird (es entsteht ein Rezeptorpotential). Die physiologische
Reaktion auf "Salzigkeit" ist konzentrationsabhängig: Kochsalz wird in
niedrigerer Konzentration (10-150 mM) als angenehm empfunden, höhere
Konzentrationen meist als unangenehm (diese stimulieren auch Sauer- und
Bitter-Rezeptoren). Das Begleitanion bestimmt die "salzig"-Empfindung
mit (Natriumchlorid schmeckt z.B. anders als Natriumbicarbonat gleicher molarer Konzentration). Sauer: Protonen gelangen durch Ionenkanäle oder unmittelbar durch die
Membran in die Zelle. Der Einfluss auf verschiedene Ionenkanäle ( TRPP3, ASICs, HCNs) wirkt depolarisierend, öffnet Ca++-Kanäle
und führt zur Freisetzung des Transmitters (Serotonin) aus
Speichervesikeln. Neuerdings wurde ein Mitglied der Otopetrin-Proteine
(das für die Bildung der Otolithen im Innenohr eine Rolle spielt, daher der Name), OTOP-1, als Säurerezeptor identifiziert (
Sauer: Protonen gelangen durch Ionenkanäle oder unmittelbar durch die
Membran in die Zelle. Der Einfluss auf verschiedene Ionenkanäle ( TRPP3, ASICs, HCNs) wirkt depolarisierend, öffnet Ca++-Kanäle
und führt zur Freisetzung des Transmitters (Serotonin) aus
Speichervesikeln. Neuerdings wurde ein Mitglied der Otopetrin-Proteine
(das für die Bildung der Otolithen im Innenohr eine Rolle spielt, daher der Name), OTOP-1, als Säurerezeptor identifiziert ( Abbildung).
Abbildung). Süß stimuliert eine G-Protein-abhängige T1R2/T1R3-Rezeptorkombination (diese Kombinationen gehören zur T1-Rezeptorfamilie).
Diese Rezeptoren haben sehr große extrazelluläre Domänen, welche "süße"
Substanzen (Zucker, Zuckerersatzstoffe, einige Aminosäuren und Peptide)
mit niedriger Affinität im millimolaren Bereich binden (so werden nur
ernährungsphysiologisch relevante Mengen an Zuckern erkannt) und den
Rezeptor aktivieren. Fällt einer dieser Rezeptoren aus, ist kein
Empfinden für "süß" mehr möglich.
Süß stimuliert eine G-Protein-abhängige T1R2/T1R3-Rezeptorkombination (diese Kombinationen gehören zur T1-Rezeptorfamilie).
Diese Rezeptoren haben sehr große extrazelluläre Domänen, welche "süße"
Substanzen (Zucker, Zuckerersatzstoffe, einige Aminosäuren und Peptide)
mit niedriger Affinität im millimolaren Bereich binden (so werden nur
ernährungsphysiologisch relevante Mengen an Zuckern erkannt) und den
Rezeptor aktivieren. Fällt einer dieser Rezeptoren aus, ist kein
Empfinden für "süß" mehr möglich. Umami
(japanisch "schmackhaft", "köstlich") wird über metabotrope Rezeptoren für L-Aminosäuren vermittelt (verkörpert durch L-Glutamat, monosodium glutamate MSG): Einem Komplex aus zwei T1-Subtypen, T1R1 und T1R3. Sie
finden sich in
allen geschmacksempfindlichen Schleimhautzonen, vor allem in papillae
fungiformes. Entwicklungsgeschichtlich dürften diese Rezeptoren die
Präferenz für Proteine in der Nahrung gefördert haben.
Umami
(japanisch "schmackhaft", "köstlich") wird über metabotrope Rezeptoren für L-Aminosäuren vermittelt (verkörpert durch L-Glutamat, monosodium glutamate MSG): Einem Komplex aus zwei T1-Subtypen, T1R1 und T1R3. Sie
finden sich in
allen geschmacksempfindlichen Schleimhautzonen, vor allem in papillae
fungiformes. Entwicklungsgeschichtlich dürften diese Rezeptoren die
Präferenz für Proteine in der Nahrung gefördert haben. Bitter hat Warnfunktion (viele Giftstoffe schmecken bitter), ist aber auch eine Geschmackskomponente in Koffein und Alkaloiden (Nikotin). Die (beim Menschen etwa 25) verschiedenen Bittersensoren
von der Gruppe T2R sind heptahelikale metabotrope Rezeptoren, welche
die verschiedenen Bitterstoffe hochaffin (im mikromolekularen Bereich)
binden. Jede bitterempfindliche Geschmackszelle exprimiert die meisten
oder alle der T2R-Typen, integriert also die Bittersignale. Mutationen in T2R-Genen können individuelle Unterschiede in der Empfindlichkeit gegenüber "bitter" bedingen.
Bitter hat Warnfunktion (viele Giftstoffe schmecken bitter), ist aber auch eine Geschmackskomponente in Koffein und Alkaloiden (Nikotin). Die (beim Menschen etwa 25) verschiedenen Bittersensoren
von der Gruppe T2R sind heptahelikale metabotrope Rezeptoren, welche
die verschiedenen Bitterstoffe hochaffin (im mikromolekularen Bereich)
binden. Jede bitterempfindliche Geschmackszelle exprimiert die meisten
oder alle der T2R-Typen, integriert also die Bittersignale. Mutationen in T2R-Genen können individuelle Unterschiede in der Empfindlichkeit gegenüber "bitter" bedingen.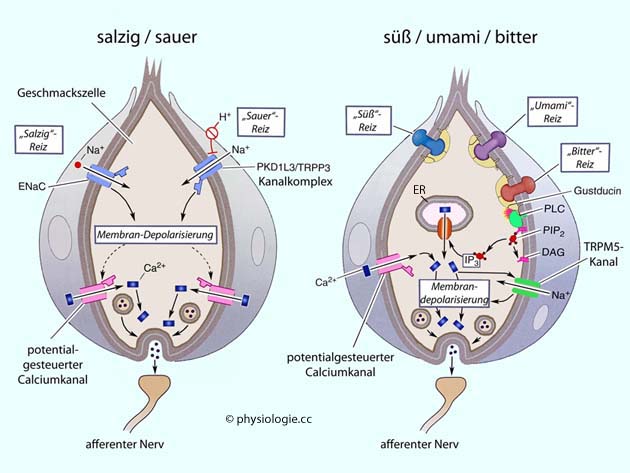
 Abbildung: Geschmackstransduktion
Abbildung: Geschmackstransduktion
 (IX) und vagus (X).
(IX) und vagus (X). | Geschmack |
salzig |
sauer |
süß |
umami |
bitter |
| Rezeptor |
PKD2L1 |
TRPP3 |
T1R2/T1R3 |
T1R1/T1R3 |
T2R |
| Art |
Ionenkanal |
Ionenkanal |
GPCR |
GPCR |
GPCR |
| Effekt in Zelle |
Depolari- sierung ↑[Ca++] Exozytose |
Depolari- sierung ↑[Ca++] Exozytose |
PLC IP3, PIP2 ↑[Ca++], TRPM5 Depolari- sierung, Transmitter- freisetzung |
PLC IP3, PIP2 ↑[Ca++], TRPM5 Depolari- sierung, Transmitter- freisetzung |
PLC IP3, PIP2 ↑[Ca++], TRPM5 Depolari- sierung, Transmitter- freisetzung |
| Transmitter |
Serotonin |
Serotonin |
ATP |
ATP |
ATP |
| Zelltyp |
Bezeichnung |
Funktion / Eigenschaft |
| I |
Stützzelle |
unterstützende Funktion (wie Gliazelle), mehrere Mikrovilli |
| II |
Sinneszelle |
wahrscheinlich Großteil der Geschmacksrezeptoren, exprimiert α-Gustducin, einzelner Mikrovillus am apikalen Pol |
| III |
Typ-III-Zelle |
bilden Synapsen mit afferenten Hirnnervenzellen (VII, IX, X) |
| IV |
Basalzelle |
bilden neue Geschmackssinneszellen |
 Dieses dem Transduzin sehr ähnliche Protein aktiviert Phospholipase (ß2) und den Inositolphosphatweg. IP3 steigert die intrazelluläre Freisetzung von Calciumionen, was wiederum den Kationeneinstrom in die Zelle erhöht (der spezifische Geschmackstransduktionskanal heißt Transient receptor potential cation channel subfamily M member 5, TRPM5).
Dieses dem Transduzin sehr ähnliche Protein aktiviert Phospholipase (ß2) und den Inositolphosphatweg. IP3 steigert die intrazelluläre Freisetzung von Calciumionen, was wiederum den Kationeneinstrom in die Zelle erhöht (der spezifische Geschmackstransduktionskanal heißt Transient receptor potential cation channel subfamily M member 5, TRPM5).  Abbildung):
Abbildung):
 Abbildung: Zentrale Projektionen vom Geschmackssinn
Abbildung: Zentrale Projektionen vom Geschmackssinn
 Der N. facialis (VII - chorda tympani, Zellkörper im ggl. geniculi) versorgt den vorderen Teil der Zunge und des Gaumens,
Der N. facialis (VII - chorda tympani, Zellkörper im ggl. geniculi) versorgt den vorderen Teil der Zunge und des Gaumens, der N.
glossopharyngeus
(IX, Zellkörper im ggl. petrosum) rückwärtige Teile der Zunge (papillae
circumvallatae),
der N.
glossopharyngeus
(IX, Zellkörper im ggl. petrosum) rückwärtige Teile der Zunge (papillae
circumvallatae),  der N. vagus (X, Zellkörper im ggl. nodosum) Rachenwand und Kehldeckel.
der N. vagus (X, Zellkörper im ggl. nodosum) Rachenwand und Kehldeckel.| Alle Geschmacksafferenzen projizieren auf den nucleus tractus solitarii |
 zum
(kontralateralen) Thalamus (nucl. ventralis posteromedialis, nucl. ventrobasalis),
zum
(kontralateralen) Thalamus (nucl. ventralis posteromedialis, nucl. ventrobasalis), | Im nucleus posteromedialis des Thalamus wird vom 2. auf das 3. Neuron umgeschaltet |
 von hier zum Geschmacksareal der vorderen Insel und dem frontalen Operculum (area 36: primäre Geschmacksrinde, primary gustatory cortex) sowie zum unteren gyrus postcentralis; und weiter in die Geschmacksareale des orbitofrontalen Cortex (hier entstehen Aromaeindrücke);
von hier zum Geschmacksareal der vorderen Insel und dem frontalen Operculum (area 36: primäre Geschmacksrinde, primary gustatory cortex) sowie zum unteren gyrus postcentralis; und weiter in die Geschmacksareale des orbitofrontalen Cortex (hier entstehen Aromaeindrücke);  zu Hypothalamus (der vermutlich auch Impulse betreffend süß, leicht salzig sowie Umami verstärkt) und Mandelkernen (autonom-endokrine und emotionale Verarbeitung der Geschmackswahrnehmung);
zu Hypothalamus (der vermutlich auch Impulse betreffend süß, leicht salzig sowie Umami verstärkt) und Mandelkernen (autonom-endokrine und emotionale Verarbeitung der Geschmackswahrnehmung); zum Hirnstamm - hauptsächlich medulla oblongata (Reflexverwaltung: Speichelbildung, Schlucken, Brechreflex..).
zum Hirnstamm - hauptsächlich medulla oblongata (Reflexverwaltung: Speichelbildung, Schlucken, Brechreflex..). Einige Fasern projzieren auf den Vaguskern (Verdauungsreflexe).
Einige Fasern projzieren auf den Vaguskern (Verdauungsreflexe).| Vergleich olfaktorisches / gustatorisches System | ||
| Geruchssinn |
Geschmackssinn |
|
| Sinneszellen |
Primäre Sinneszellen Zilien Riechepithel |
Sekundäre Sinneszellen Mikrovilli Geschmacksknospen |
| Hirnnerven |
I (V) | VII, IX, X |
| 1. Umschaltung im ZNS |
Bulbus olfactorius | Hirnstamm (nucl. tractus solitarii) |
| Cortexareal |
Piriformer und Orbitofrontalcortex |
Insel |
| Adäquate Reize |
Einige 109 Duftstoffe |
5 Grundqualitäten |
| Funktion |
Fern- und Nahsinn Nahrungskontrolle Verdauungsreflexe Kommunikation / Fortpflanzung |
Nahsinn Nahrungskontrolle Steuerung Nahrungsaufnahme Verdauungsreflexe |
 Über Geruchsnerv und Siebbeinplatte als Lymphpfad für das Gehirn s. dort
Über Geruchsnerv und Siebbeinplatte als Lymphpfad für das Gehirn s. dort
 Abbildung: Struktur eines Geruchsrezeptormoleküls
Abbildung: Struktur eines Geruchsrezeptormoleküls
 Abbildung).
Die Geruchsrezeptor-DNA gehören zur umfangreichsten Genfamilie des
Genoms von Säugetieren. Individuelle Unterschiede in der
Empfindlichkeit gegenüber definierten Stoffen ergibt sich aus Polymorphismen in der jeweiligen Genaustattung einer Person.
Abbildung).
Die Geruchsrezeptor-DNA gehören zur umfangreichsten Genfamilie des
Genoms von Säugetieren. Individuelle Unterschiede in der
Empfindlichkeit gegenüber definierten Stoffen ergibt sich aus Polymorphismen in der jeweiligen Genaustattung einer Person.
 Abbildung: Geruchssinn
Abbildung: Geruchssinn
 Abbildung). Dies sind primäre
Sinneszellen mit einem apikalen "Riechköpfchen" - einem singulären
Dendriten mit einigen (8 bis 20)
Zilien, die bündelartig in die Schleimschicht der Mukosa ragen und so
die olfaktorisch aktive Fläche erweitern - und einem Axon, das durch
die lamina cribriformis bis zu einem Glomerulus in bulbus olfactorius
zieht. Die Zilien
enthalten die Geruchsrezeptoren, der Schleim spezielle odorant-binding proteins,
welche die Löslichkeit hydrophober Geruchsstoffe erhöhen. Die Enden der
Zilien sind verdickt und enthalten Vakuolen, welche pinozytotisch aktiv
sind: Sie nehmen Flüssigkeit auf und transportieren diese über den
olfaktorischen Nerven zum Gehirn (die physiologische Bedeutung dieser
Tatsache ist unklar). Die Summe aller Axone (fila olfactoria) macht den
1. Hirnnerven aus.
Abbildung). Dies sind primäre
Sinneszellen mit einem apikalen "Riechköpfchen" - einem singulären
Dendriten mit einigen (8 bis 20)
Zilien, die bündelartig in die Schleimschicht der Mukosa ragen und so
die olfaktorisch aktive Fläche erweitern - und einem Axon, das durch
die lamina cribriformis bis zu einem Glomerulus in bulbus olfactorius
zieht. Die Zilien
enthalten die Geruchsrezeptoren, der Schleim spezielle odorant-binding proteins,
welche die Löslichkeit hydrophober Geruchsstoffe erhöhen. Die Enden der
Zilien sind verdickt und enthalten Vakuolen, welche pinozytotisch aktiv
sind: Sie nehmen Flüssigkeit auf und transportieren diese über den
olfaktorischen Nerven zum Gehirn (die physiologische Bedeutung dieser
Tatsache ist unklar). Die Summe aller Axone (fila olfactoria) macht den
1. Hirnnerven aus.
 Abbildung: Geruchsrezeptoren im Körper
Abbildung: Geruchsrezeptoren im Körper 
 Abbildung); die Expression einiger Rezeptortypen ist streng
zellspezifisch beschränkt, andere finden sich weit über die Gewebe
verstreut. Die Funktion dieser Rezeptoren - wie Beteiligung an
interzellulären Erkennungsprozessen, Zellmigration und -proliferation,
Exozytose oder Apoptose - und das mögliche therapeutische Potential sind
Gegenstand aktueller Forschung.
Abbildung); die Expression einiger Rezeptortypen ist streng
zellspezifisch beschränkt, andere finden sich weit über die Gewebe
verstreut. Die Funktion dieser Rezeptoren - wie Beteiligung an
interzellulären Erkennungsprozessen, Zellmigration und -proliferation,
Exozytose oder Apoptose - und das mögliche therapeutische Potential sind
Gegenstand aktueller Forschung. | Unterschiedliche Geruchsrezeptoren werden von unterschiedlichen Genen codiert |

 Abbildung: Geruchsrezeption
Abbildung: Geruchsrezeption

 Abbildung)
Abbildung) Der Geruchsstoff bindet an spezifische Rezeptorproteine in der Zilienmembran
Der Geruchsstoff bindet an spezifische Rezeptorproteine in der Zilienmembran Die Aktivierung des Rezeptors stimuliert ein heterotrimeres G-Protein, Golf
Die Aktivierung des Rezeptors stimuliert ein heterotrimeres G-Protein, Golf  Golf aktiviert Adenylylcyclase III (ein spezieller Typus der Adenylylcyklase), diese kann zahlreiche cAMP-Moleküle produzieren (Verstärkung)
Golf aktiviert Adenylylcyclase III (ein spezieller Typus der Adenylylcyklase), diese kann zahlreiche cAMP-Moleküle produzieren (Verstärkung) cAMP bindet an einen nichtselektiven Kationenkanal (CNG: Cyclic nucleotide-gated ion channel)
cAMP bindet an einen nichtselektiven Kationenkanal (CNG: Cyclic nucleotide-gated ion channel)  cAMP öffnet den Kationenkanal - das tut auch cGMP -, und die Permeabilität für Kationen (Na+, K+, Ca++) nimmt zu
cAMP öffnet den Kationenkanal - das tut auch cGMP -, und die Permeabilität für Kationen (Na+, K+, Ca++) nimmt zu Der Netto-Einstrom von Kationen depolarisiert die Zelle
Der Netto-Einstrom von Kationen depolarisiert die Zelle Die in das Zytoplasma eingedrungenen Ca++-Ionen öffnen calciumabhängige Chloridkanäle (Anoctamin 2); der Chloridausstrom verstärkt die Depolarisierung
Die in das Zytoplasma eingedrungenen Ca++-Ionen öffnen calciumabhängige Chloridkanäle (Anoctamin 2); der Chloridausstrom verstärkt die Depolarisierung Der Betrag des so entstandenen Rezeptorpotentials
ist der Konzentration des Duftstoffes proportional. Bei Überschreiten
des Schwellenpotentials treten - nicht nur an den Zilien, sondern an der gesamten olfaktorischen Zelle - Aktionspotentiale auf, die dem bulbus
olfactorius zufließen.
Der Betrag des so entstandenen Rezeptorpotentials
ist der Konzentration des Duftstoffes proportional. Bei Überschreiten
des Schwellenpotentials treten - nicht nur an den Zilien, sondern an der gesamten olfaktorischen Zelle - Aktionspotentiale auf, die dem bulbus
olfactorius zufließen.| Geruchsrezeptoren sind metabotrope heptahelikale G-Protein-gekoppelte Rezeptoren Aktivierung der Adenylylcyclase erhöht [cAMP], öffnet Ionenkanäle und führt zu Depolarisation |
 Die Anwesenheit reiner Duftstoffe wird exquisit über den N. olfactorius übermittelt (z.B. Zimt, Vanille).
Die Anwesenheit reiner Duftstoffe wird exquisit über den N. olfactorius übermittelt (z.B. Zimt, Vanille).  Zahlreiche Duftstofe haben eine trigeminale Komponente:
Diese haben eine nozizeptive Warnunktion (z.B. Ammoniak, Salmiak,
Chlor). Für eine Schmerzwahrnehmung sind typischerweise höhere
Konzentrationen notwendig als für die reine Geruchswahrnehmung; sie
bleibt andererseits auch bei völligem Ausfall des Geruchsempfindens
(Anosmie) intakt.
Zahlreiche Duftstofe haben eine trigeminale Komponente:
Diese haben eine nozizeptive Warnunktion (z.B. Ammoniak, Salmiak,
Chlor). Für eine Schmerzwahrnehmung sind typischerweise höhere
Konzentrationen notwendig als für die reine Geruchswahrnehmung; sie
bleibt andererseits auch bei völligem Ausfall des Geruchsempfindens
(Anosmie) intakt.  Duftstoffe mit Geschmackkomponente beteiligen sich an der Auslösung von Geschmacksempfindungen (z.B. Pyridin oder Chloroform).
Duftstoffe mit Geschmackkomponente beteiligen sich an der Auslösung von Geschmacksempfindungen (z.B. Pyridin oder Chloroform). Schweißproduktion (bakterielle Abbauvorgänge)
Schweißproduktion (bakterielle Abbauvorgänge)
 Hygiene (Mundgeruch)
Hygiene (Mundgeruch)
 Alter (Geruchsintensität hängt mit Hormonmuster
und Riechvermögen zusammen)
Alter (Geruchsintensität hängt mit Hormonmuster
und Riechvermögen zusammen)
 Ernährung (z.B. Knoblauchgeruch)
Ernährung (z.B. Knoblauchgeruch)
 Zustand
(z.B. Acetongeruch bei Hunger: Ketose)
Zustand
(z.B. Acetongeruch bei Hunger: Ketose)
 Krankheit (z.B.
Ammoniakgeruch bei Leberschäden).
Krankheit (z.B.
Ammoniakgeruch bei Leberschäden).  (subjektive Skala: ein ruhender Erwachsener emittiert 1 Olf, ein 12jähriges
Kind 2 Olf, ein Sportler nach athletischer Betätigung 30 Olf).
(subjektive Skala: ein ruhender Erwachsener emittiert 1 Olf, ein 12jähriges
Kind 2 Olf, ein Sportler nach athletischer Betätigung 30 Olf).| Geruchsrezeptoren adaptieren rasch und fast vollständig (gilt nicht für Gerüche mit Warncharakter) |

 Ca++-Ionen,
die infolge Reizung der Rezeptoren frei werden, verstärken und
verlängern die Depolarisation nicht nur, sondern binden auch an
Calmodulin. Der Ca++-Calmodulin-Komplex hemmt den CNG-Kanal,
was die Depolarisation verringert
Ca++-Ionen,
die infolge Reizung der Rezeptoren frei werden, verstärken und
verlängern die Depolarisation nicht nur, sondern binden auch an
Calmodulin. Der Ca++-Calmodulin-Komplex hemmt den CNG-Kanal,
was die Depolarisation verringert Ca++-Ionen aktivieren Phosphodiesterasen, was cAMP abbaut und den CNG-Kanal ebenfalls inhibiert
Ca++-Ionen aktivieren Phosphodiesterasen, was cAMP abbaut und den CNG-Kanal ebenfalls inhibiert Die Rezeptoren der Zilien werden nach Bindung des Geruchsstoffs endozytiert (receptor downregulation)
Die Rezeptoren der Zilien werden nach Bindung des Geruchsstoffs endozytiert (receptor downregulation)
 Abbildung: Das Riechsystem
Abbildung: Das Riechsystem
 Die auf einen Glomerulus
konvergierende Information stammt von Sinneszellen, die einen
bestimmten Geruchsrezeptor
exprimieren. Das Gehirn orientiert sich an der Stärke der Erregung der
Glomeruli, das Muster entspricht einer "Geruchslandkarte" der Umgebung.
Die auf einen Glomerulus
konvergierende Information stammt von Sinneszellen, die einen
bestimmten Geruchsrezeptor
exprimieren. Das Gehirn orientiert sich an der Stärke der Erregung der
Glomeruli, das Muster entspricht einer "Geruchslandkarte" der Umgebung. Kontrastierung der afferenten Erregungsmuster durch laterale Hemmung. Projektionen von Mitral- und Büschelzellen regen Interneurone an: Periglomeruläre und Körnerzellen. Diese hemmen benachbarte Mitral- und Büschelzellen (ähnlich wie Horizontalzellen der Netzhaut auf Photorezeptorzellen oder olivo-cochleäre Efferenzen (Neurone aus der oberen Olive) auf Haarzellen im Innenohr inhibierend wirken).
Kontrastierung der afferenten Erregungsmuster durch laterale Hemmung. Projektionen von Mitral- und Büschelzellen regen Interneurone an: Periglomeruläre und Körnerzellen. Diese hemmen benachbarte Mitral- und Büschelzellen (ähnlich wie Horizontalzellen der Netzhaut auf Photorezeptorzellen oder olivo-cochleäre Efferenzen (Neurone aus der oberen Olive) auf Haarzellen im Innenohr inhibierend wirken).  Modifikation afferenter Aktivität durch negative Rückkopplung sowie durch Efferenzen aus dem
limbischen System. Diese regen glutamaterg periglomeruläre und Körnerzellen an und hemmen
die
Weiterleitung von Geruchsinformation über sekundäre Geruchsneuronen.
Die Übertragung von Geruchsinformation wird so eingeschränkt
(Adaptation).
Modifikation afferenter Aktivität durch negative Rückkopplung sowie durch Efferenzen aus dem
limbischen System. Diese regen glutamaterg periglomeruläre und Körnerzellen an und hemmen
die
Weiterleitung von Geruchsinformation über sekundäre Geruchsneuronen.
Die Übertragung von Geruchsinformation wird so eingeschränkt
(Adaptation). 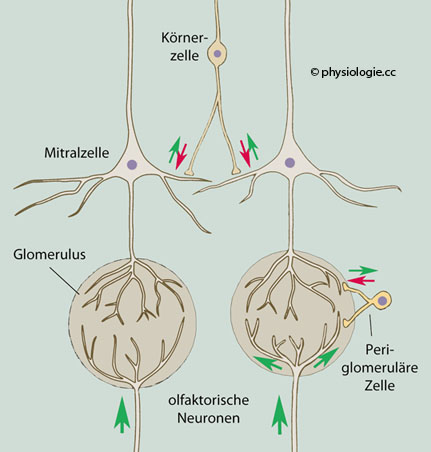
 Abbildung: Interneurone im bulbus olfactorius
Abbildung: Interneurone im bulbus olfactorius
 Dieser
Mechanismus kann seinerseits durch Endocannabinoide
gehemmt werden (die präsynaptischen Endigungen der modifizierenden
efferenten Faserrn verfügen über CB1-Rezeptoren). Das erklärt, warum
Cannabis die Geruchsempfindung steigert (Disinhibition) und so appetitanregend wirkt ("Geschmack" ist zu einem guten Teil Geruch).
Dieser
Mechanismus kann seinerseits durch Endocannabinoide
gehemmt werden (die präsynaptischen Endigungen der modifizierenden
efferenten Faserrn verfügen über CB1-Rezeptoren). Das erklärt, warum
Cannabis die Geruchsempfindung steigert (Disinhibition) und so appetitanregend wirkt ("Geschmack" ist zu einem guten Teil Geruch). Abbildung):
Abbildung):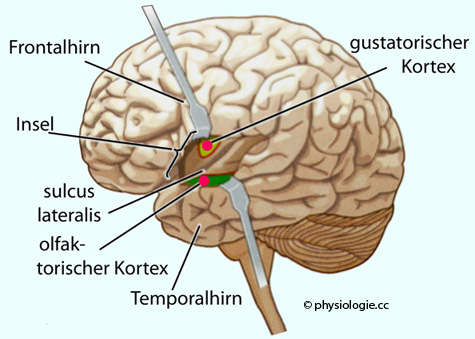
 Abbildung: Zentren für die kortikale Verarbeitung von Geruchs- und Geschmacksinformation
Abbildung: Zentren für die kortikale Verarbeitung von Geruchs- und Geschmacksinformation
 Abbildung) - ohne Umschaltung im Thalamus (als einzige sensorische Afferenz) - u.a. auf
Abbildung) - ohne Umschaltung im Thalamus (als einzige sensorische Afferenz) - u.a. auf  das tuberculum olfactorium - von hier geht es zum bulbus olfactorius der Gegenseite,
das tuberculum olfactorium - von hier geht es zum bulbus olfactorius der Gegenseite,  das limbische System (Lernvorgänge im Hippocampus),
das limbische System (Lernvorgänge im Hippocampus), den piriformen und orbitofrontalen Cortex (Duftdiskriminierung und bewusste Wahrnehmung),
den piriformen und orbitofrontalen Cortex (Duftdiskriminierung und bewusste Wahrnehmung),  den entorhinalen Cortex, von hier zu Hypothalamus und Tegmentum (emotionale Effekte).
den entorhinalen Cortex, von hier zu Hypothalamus und Tegmentum (emotionale Effekte).  Der entorhinale Cortex (EC) ist ein Teil des Allocortex im medialen Temporallappen. Er ist zentral beteiligt an den Mechanismen von Zeitgefühl, Gedächtnis und Körperbewegung und stellt eine funktionelle Brücke zwischen Großhirnrinde und Hippocampusformation dar (EC-hippocampus system).
Dieses System verwaltet vor allem den Aufbau und die Verfestigung des
(deklarativen) Gedächtnisses, räumliches Gedächtnis, sowie
Gedächtnisaufbau im Schlaf.
Der entorhinale Cortex (EC) ist ein Teil des Allocortex im medialen Temporallappen. Er ist zentral beteiligt an den Mechanismen von Zeitgefühl, Gedächtnis und Körperbewegung und stellt eine funktionelle Brücke zwischen Großhirnrinde und Hippocampusformation dar (EC-hippocampus system).
Dieses System verwaltet vor allem den Aufbau und die Verfestigung des
(deklarativen) Gedächtnisses, räumliches Gedächtnis, sowie
Gedächtnisaufbau im Schlaf.

 Abbildung: Neuronale Verrbindungen im olfaktorischen System
Abbildung: Neuronale Verrbindungen im olfaktorischen System
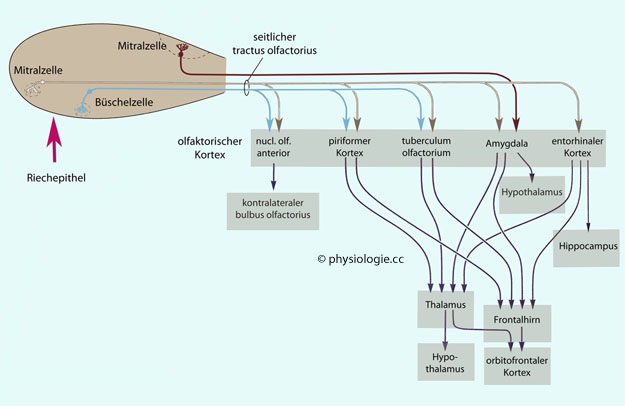
 Abbildung: Afferenzen vom bulbus olfactorius zum olfaktorischen Cortex
Abbildung: Afferenzen vom bulbus olfactorius zum olfaktorischen Cortex
 Pheromone sind geruchlose Stoffe, die (bei Mitgliedern derselben Spezies) auf das sexuelle Verhalten wirken. Sie
werden u.a. von apokrinen Drüsen in Achselhöhlen, Brust und Genitalien an die Umgebung abgegeben. Über olfaktorische Afferenzen werden Neuronengruppen im
limbischen System zu neurohumoralen Reaktionen angeregt.
Pheromone sind geruchlose Stoffe, die (bei Mitgliedern derselben Spezies) auf das sexuelle Verhalten wirken. Sie
werden u.a. von apokrinen Drüsen in Achselhöhlen, Brust und Genitalien an die Umgebung abgegeben. Über olfaktorische Afferenzen werden Neuronengruppen im
limbischen System zu neurohumoralen Reaktionen angeregt. Auch die wissenschaftliche Untersuchung des Geruchssinns kann zur Erlangung hoher Würden führen: Richard Axel und Linda Buck
erhielten 2004 den Nobelpreis für Physiologie oder Medizin "für die
Erforschung der Riechrezeptoren und der Organisation des olfaktorischen
Systems". Beim Studium der Geruchsrezeptorentwicklung stellten sie u.a.
fest, dass die für die Geruchswahrnehmung verantwortlichen Gene (eine
Genfamilie von ~103 Mitgliedern) verschiedene Rezeptoren codieren, von denen jede Sinneszelle jeweils nur einen ausbildet.
Auch die wissenschaftliche Untersuchung des Geruchssinns kann zur Erlangung hoher Würden führen: Richard Axel und Linda Buck
erhielten 2004 den Nobelpreis für Physiologie oder Medizin "für die
Erforschung der Riechrezeptoren und der Organisation des olfaktorischen
Systems". Beim Studium der Geruchsrezeptorentwicklung stellten sie u.a.
fest, dass die für die Geruchswahrnehmung verantwortlichen Gene (eine
Genfamilie von ~103 Mitgliedern) verschiedene Rezeptoren codieren, von denen jede Sinneszelle jeweils nur einen ausbildet. Abbildung):
Abbildung):
 Abbildung: Schema der Verschaltungen in bulbus olfactorius und Netzhaut
Abbildung: Schema der Verschaltungen in bulbus olfactorius und Netzhaut
 ; eine Abschwächung Hyposmie, ein
völliger Ausfall des Riechvermögens Anosmie
; eine Abschwächung Hyposmie, ein
völliger Ausfall des Riechvermögens Anosmie  (z.B. angeboren, als Frühsymptom neurologischer Systemerkrankungen wie Mb. Alzheimer, oder nach
Virusinfektionen). So zeigt sich z.B. bei einem Schnupfen, wie stark der Geruchssinn an
der Entstehung von "Geschmack" beteiligt ist (Speisen erscheinen
geschmacksarm, obwohl die Geschmackszellen normal arbeiten).
(z.B. angeboren, als Frühsymptom neurologischer Systemerkrankungen wie Mb. Alzheimer, oder nach
Virusinfektionen). So zeigt sich z.B. bei einem Schnupfen, wie stark der Geruchssinn an
der Entstehung von "Geschmack" beteiligt ist (Speisen erscheinen
geschmacksarm, obwohl die Geschmackszellen normal arbeiten).  bezeichnet. Geschmacksstörungen heißen Dysgeusien
bezeichnet. Geschmacksstörungen heißen Dysgeusien
 (evt. bedingt durch Medikamente, Bestrahlungen etc); verminderte bzw.
verstärkte Geschmackswahrnehmung Hypo- und Hypergeusie (gr. geusis =
Geschmack).
(evt. bedingt durch Medikamente, Bestrahlungen etc); verminderte bzw.
verstärkte Geschmackswahrnehmung Hypo- und Hypergeusie (gr. geusis =
Geschmack).
 2000 bis 8000 Geschmacksknospen finden sich in Zunge, Gaumen, Rachen,
Kehldeckel, oberem Ösophagus. "Bitter" wird in niedrigeren
Konzentrationen erkannt als andere Geschmäcker (Warnfunktion).
Geschmacksporen bieten eine Öffnung für die Diffusion
von Geschmacksstoffen zu den Sinneszellen. Diese tragen Mikrovilli
(Oberflächenvergrößerung) und detektieren Geschmacksstoffe. Sie
adaptieren rasch (1-2 Minuten); ihre Lebensdauer beträgt ~10 Tage
2000 bis 8000 Geschmacksknospen finden sich in Zunge, Gaumen, Rachen,
Kehldeckel, oberem Ösophagus. "Bitter" wird in niedrigeren
Konzentrationen erkannt als andere Geschmäcker (Warnfunktion).
Geschmacksporen bieten eine Öffnung für die Diffusion
von Geschmacksstoffen zu den Sinneszellen. Diese tragen Mikrovilli
(Oberflächenvergrößerung) und detektieren Geschmacksstoffe. Sie
adaptieren rasch (1-2 Minuten); ihre Lebensdauer beträgt ~10 Tage Geschmackssensible Sinneszellen sind sekundäre Sinneszellen. Ihre
Zellmembran enthält Ionenkanäle (salzig: Epitheliale
Natriumkanäle, sauer: protonenaktivierte Kationenkanäle) oder
G-Protein-gekoppelte Rezeptormoleküle. Bitter, süß und umami werden
über unterschiedlich kombinierte T1- und T2-Rezeptoren detektiert
Geschmackssensible Sinneszellen sind sekundäre Sinneszellen. Ihre
Zellmembran enthält Ionenkanäle (salzig: Epitheliale
Natriumkanäle, sauer: protonenaktivierte Kationenkanäle) oder
G-Protein-gekoppelte Rezeptormoleküle. Bitter, süß und umami werden
über unterschiedlich kombinierte T1- und T2-Rezeptoren detektiert G-Protein-gekoppelte Rezeptoren wirken über Adenylylcyclase (→ cAMP), Phospholipase C (→ IP3) und Ca++. K+-Kanäle schließen, Ca++-Kanäle öffnen, die Zelle wird depolarisiert G-Protein-gekoppelte Rezeptoren wirken über Adenylylcyclase (→ cAMP), Phospholipase C (→ IP3) und Ca++. K+-Kanäle schließen, Ca++-Kanäle öffnen, die Zelle wird depolarisiert Geschmack wird über langsame Fasern (Aδ / C) über die Hirnnerven VII
(chorda tympani: anteriore Zunge, Gaumen), IX (posteriore Zunge) und X
(Rachenwand, Kehldeckel) geleitet - zum nucl. tractus solitarii
(Geschmackskern). Projektionen erfolgen auf Hypothalamus und
Mandelkerne,
medulla oblongata (Speichelbildung, Schlucken),
Vaguskerne (Verdauungsreflexe). Im nucleus posteromedialis thalami
erfolgt eine Umschaltung vom 2. auf das 3. Neuron zu vorderer Insel,
frontalem Operculum (primäre Geschmacksrinde), unterem gyrus
postcentralis, orbitofrontalem Cortex (Aromaeindrücke)
Geschmack wird über langsame Fasern (Aδ / C) über die Hirnnerven VII
(chorda tympani: anteriore Zunge, Gaumen), IX (posteriore Zunge) und X
(Rachenwand, Kehldeckel) geleitet - zum nucl. tractus solitarii
(Geschmackskern). Projektionen erfolgen auf Hypothalamus und
Mandelkerne,
medulla oblongata (Speichelbildung, Schlucken),
Vaguskerne (Verdauungsreflexe). Im nucleus posteromedialis thalami
erfolgt eine Umschaltung vom 2. auf das 3. Neuron zu vorderer Insel,
frontalem Operculum (primäre Geschmacksrinde), unterem gyrus
postcentralis, orbitofrontalem Cortex (Aromaeindrücke) Die ~20 Millionen Geruchssinneszellen (Lebensdauer ~4 Wochen) haben
Zilien mit G-Protein-gekoppelten Geruchsrezeptoren, die im
Nasenschleim gelöste Duftstoffe detektieren - unterstützt durch odorant-binding proteins, welche die Löslichkeit hydrophober Stoffe erhöhen. Jede olfaktorische Sinneszelle exprimiert jeweils nur einen Rezeptortyp
Die ~20 Millionen Geruchssinneszellen (Lebensdauer ~4 Wochen) haben
Zilien mit G-Protein-gekoppelten Geruchsrezeptoren, die im
Nasenschleim gelöste Duftstoffe detektieren - unterstützt durch odorant-binding proteins, welche die Löslichkeit hydrophober Stoffe erhöhen. Jede olfaktorische Sinneszelle exprimiert jeweils nur einen Rezeptortyp G-Protein-gekoppelte Rezeptoren wirken über Adenylylcyclase, cAMP öffnet einen nichtselektiven Kationenkanal (CNG: Cyclic
nucleotide-gated ion channel), der Einstrom von Na+ und Ca++ depolarisiert die Zelle und öffnet calciumabhängige Chloridkanäle G-Protein-gekoppelte Rezeptoren wirken über Adenylylcyclase, cAMP öffnet einen nichtselektiven Kationenkanal (CNG: Cyclic
nucleotide-gated ion channel), der Einstrom von Na+ und Ca++ depolarisiert die Zelle und öffnet calciumabhängige Chloridkanäle Jede olfaktorische Sinneszelle exprimiert jeweils nur einen
Rezeptortyp. Unterschiedliche Gene codieren unterschiedliche
Geruchsrezeptoren; der Mensch verfügt über etwa 400 funktionstüchtige
Geruchsrezeptorgene Jede olfaktorische Sinneszelle exprimiert jeweils nur einen
Rezeptortyp. Unterschiedliche Gene codieren unterschiedliche
Geruchsrezeptoren; der Mensch verfügt über etwa 400 funktionstüchtige
Geruchsrezeptorgene Die Geruchsschwelle liegt bei ~107 Molekülen / ml Luft. Glomeruli sind chemotop organisiert: Etwa 103 Sinneszellen mit
identischen Duftrezeptoren projizieren auf jeweils eine
Mitral- oder Büschelzelle, und diese in den tractus olfactorius. Periglomeruläre und Körnerzellen werden von
efferenten Neuriten glutamaterg angeregt und wirken
inhibitorisch (rasche Adaptation, außer bei Gerüchen mit Warncharakter) Die Geruchsschwelle liegt bei ~107 Molekülen / ml Luft. Glomeruli sind chemotop organisiert: Etwa 103 Sinneszellen mit
identischen Duftrezeptoren projizieren auf jeweils eine
Mitral- oder Büschelzelle, und diese in den tractus olfactorius. Periglomeruläre und Körnerzellen werden von
efferenten Neuriten glutamaterg angeregt und wirken
inhibitorisch (rasche Adaptation, außer bei Gerüchen mit Warncharakter) Die Adaptation beruht auf mehrfachen Mechanismen: Ca++-Ionen binden an Calmodulin, Ca++-Ionen
aktivieren die Phosphodiesterase (beides verringert die
Depolarisation); Rezeptoren werden endozytiert. Zentralnervöse
Mechanismen bedingen Habituation, für diese braucht es aber Wochen,
nicht Minuten Die Adaptation beruht auf mehrfachen Mechanismen: Ca++-Ionen binden an Calmodulin, Ca++-Ionen
aktivieren die Phosphodiesterase (beides verringert die
Depolarisation); Rezeptoren werden endozytiert. Zentralnervöse
Mechanismen bedingen Habituation, für diese braucht es aber Wochen,
nicht Minuten Zentrale Verarbeitung: Aus dem bulbus olfactorius erfolgen Projektionen
auf tuberculum olfactorium und bulbus olfactorius der Gegenseite;
limbisches System (Lernvorgänge im Hippocampus); piriformen und
orbitofrontalen Cortex (Duftdiskriminierung, bewusste Wahrnehmung);
entorhinalen Cortex, Hypothalamus und Tegmentum (emotionale
Komponenten); Thalamus (nucleus mediodorsalis), frontalen Cortex,
Hypothalamus
Zentrale Verarbeitung: Aus dem bulbus olfactorius erfolgen Projektionen
auf tuberculum olfactorium und bulbus olfactorius der Gegenseite;
limbisches System (Lernvorgänge im Hippocampus); piriformen und
orbitofrontalen Cortex (Duftdiskriminierung, bewusste Wahrnehmung);
entorhinalen Cortex, Hypothalamus und Tegmentum (emotionale
Komponenten); Thalamus (nucleus mediodorsalis), frontalen Cortex,
Hypothalamus |
