

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Physiologie
des Hörorgans, Audiometrie
© H. Hinghofer-Szalkay
 Akustik: ἀκούειν = hören
Akustik: ἀκούειν = hören
Bel / dezi-bel: Nach Alexander G. Bell
Cochlea: κοχλίας = Schraube, cochlea (lat) = Schnecke
Corti'sches Organ: Alfonso Corti
Helix: έλιξ = Windung, Spirale
Phon: φωνή = Laut, Ton, Stimme, Sprache
Pascal: Blaise Pascal
Prestin: presto (ital) = schnell
scapha (lat) = Kahn, Boot
Sone: sonus = Klang, Schall
Tragus: τράγος = Ziegenbock (Haarbüschel ähnlich dem einer Ziege geformt)
Das
Gehör hat einen breiten Arbeitsbereich: Zwischen Empfindungs- und
Schmerzschwelle liegt eine 106-fache Zunahme der
Schalldruckintensität. Die Lautheit wird deshalb mit einem logarithmischen Maß angegeben: Dem Schalldruckpegel (SPL, sound pressure level) in Dezibel - dB(A) - bezogen auf einen Referenz-Schalldruck von 2.10-5 Pa. Bei 1000 Hz Schallfrequenz ist die dB-Skala definitionsgemäß mit der Skala des Lautstärkepegels - gemessen in Phon
- identisch.
Die Empfindlichkeit des Ohres ist frequenzabhängig, am
höchsten ist sie bei ~4 kHz. (Der Frequenzbereich der
Sprache umfasst etwa 300-3000 Hz.)
Schall wird auf das Corti'sche Organ
im Innenohr teils über den Schädelknochen ("Knochenleitung"), teils
über die Gehörknöchelchen im Mittelohr ("Luftleitung") übertragen.
Letztere passen den Schallwellenwiderstand
zwischen Luft (Gehörgang)
und Flüssigkeit (Perilymphe) so an, dass der Schalldruck etwa um den
Faktor 20 erhöht wird. Das reduziert die Reflexion des auf das
Trommelfell auftreffenden Schalls von 98% auf ~40%, und verdreißigfacht
damit den Anteil des auf das Innenohr übertragenen Schalldrucks (von 2 auf 60% des auf das Ohr eintreffenden Wertes).
Kontraktion der Mittelohrmuskeln (m. stapedius und m. tensor tympani) versteift die Gehörknöchelchenkette und reduziert so deren Druckübertragung.
Hohe, potentiell schädliche Schallintensität kann dadurch auf dem Weg
zum Innenohr verringert werden und Schäden vermeiden helfen
(Schutzreflex).
Die
Schallwellen werden über das ovale Fenster auf die Perilymphe der
scala vestibuli geleitet und laufen von dort Richtung Schneckenspitze
(Helikotrema). Sie verlangsamen sich dabei, die Druckwellen nähern
sich einander an, bis es an einer frequenzspezifischen Stelle zur Addition der Wellen,
maximaler Auslenkung (Schwingung der Reißner'schen Membran) und
Auslöschung der Wanderwelle kommt (topische Abbildung von
Schallfrequenzanteilen des Schallmusters).
Das
stimuliert Zilienfortsätze des Corti'schen Organs in der scala media und führt zur Reizung innerer Haarzellen; dieses Signal wird über afferente Fasern im N. acusticus an das Gehirn weitergeleitet. Äußere Haarzellen dienen der Verstärkung der Schwingungen und Verbesserung der Frequenzselektivität mittels Prestin, einem kontraktilen Membranprotein.
Je niedriger die Frequenz, desto weiter wandern die Druckwellen in der Schnecke; hohe
Frequenzen werden schon in der Nähe des ovalen Fensters,
niedrige (erst) in der Nähe des Helikotrema abgebildet.
|
Äußeres Ohr  Lautheit und Schalldruck
Lautheit und Schalldruck  Mittelohr
Mittelohr  Innenohr
Innenohr
 Haarzellsystem
Haarzellsystem
 (dezi-) Bel
(dezi-) Bel  Steifigkeit, Wanderwellen
Steifigkeit, Wanderwellen
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Das Ohr ist ein
Vibrationssensor für Schwingungen im hörbaren Bereich. Es ist ein
fundamentaler Bestandteil für die Fähigkeit der Orientierung und der
Kommunikation. Der Aufschlüsselung des Schalls dient das Corti'sche
Organ im Innenohr. Die detektierten Schallmuster werden vom
auditorischen Teil des Nervensystems analysiert und führen zu
entsprechenden Reaktionen (z.B. Hinwendung, Fluchtbewegungen,
sprachliche Reaktion etc). Das System zeichnet sich durch besondere
Schnelligkeit und Präzision der Schallanalyse und allfälliger
motorischer Antworten aus.
Schon die Ohrmuschel leistet einen
Beitrag zur Ortsanalyse einer Schallquelle. Der konkave innere Rand
(scapha ) der Ohrleiste (helix
) der Ohrleiste (helix ) am äußeren Rand der Muschel bis hin zum knorpeligen Tragus
) am äußeren Rand der Muschel bis hin zum knorpeligen Tragus direkt vor dem Eingang zum Gehörgang (meatus acusticus externus) sowie dem gegenüber liegenden Antitragus reflektiert
einen Teil des Schalls, der zum Ohr gelangt (
direkt vor dem Eingang zum Gehörgang (meatus acusticus externus) sowie dem gegenüber liegenden Antitragus reflektiert
einen Teil des Schalls, der zum Ohr gelangt ( Abbildung):
Abbildung):

Abbildung: Schallortung in der Vertikalebene
Modifiziert nach einer Vorlage in in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Das Gehirn empfängt zwei Frontwellen des
Schalls, die nacheinander von der Schallwelle zum äußeren Gehörgang
gelangen: Direkt und nach Reflexion an der Ohrmuschel.
Laufzeitunterschiede treten abhängig von der Lage der Schallquelle - vor allem in
der Vertikalen - auf. Die obere Ohrleiste ist weiter von Gehörgang
entfernt als der (kaudal vom Gehörgang liegende) Antitragus; diese vertikale Differenz ermöglicht es dem
Gehirn, aus den unterschiedlichen Zeitdifferenzen eine entsprechende oben / unten - Information zu extrahieren
 Während die Ortung einer Schallquelle in der Horizontalen vor allem den Vergleich des akustischen Signals von beiden Ohren einbezieht (binaurales Hören), genügt für die Ortung in der Vertikalen schon ein Ohr. Prinzip ist die unterschiedliche Laufzeit am Innenrand der Ohrmuschel reflektierter Schallwellen:
Der Schall dringt teils direkt in den äußeren Gehörgang vor, teils
verzögert nach Reflexion am Außenrand der Ohrmuschel. Töne, die von oben
kommen, haben auf Grund der Form der Ohrmuschel (Reflexion im Bereich
des Antitragus) eine kürzere Laufzeit des reflektierten Schalls (blau
in der
Während die Ortung einer Schallquelle in der Horizontalen vor allem den Vergleich des akustischen Signals von beiden Ohren einbezieht (binaurales Hören), genügt für die Ortung in der Vertikalen schon ein Ohr. Prinzip ist die unterschiedliche Laufzeit am Innenrand der Ohrmuschel reflektierter Schallwellen:
Der Schall dringt teils direkt in den äußeren Gehörgang vor, teils
verzögert nach Reflexion am Außenrand der Ohrmuschel. Töne, die von oben
kommen, haben auf Grund der Form der Ohrmuschel (Reflexion im Bereich
des Antitragus) eine kürzere Laufzeit des reflektierten Schalls (blau
in der  Abbildung) als solche, die von unten
auf das Ohr einwirken (in der
Abbildung) als solche, die von unten
auf das Ohr einwirken (in der  Abbildung rot: Reflexion am Oberrand der
Ohrmuschel, der weiter vom Eingang zum äußeren Gehörgang entfernt ist).
Veränderungen der Position der Schallquelle in der Horizontalebene
ergeben keine solchen Unterschiede. Die Unterstützung der Ortung von
Schallquellen mittels Reflexion durch die Ohrmuschel funktioniert nur
in der Vertikalebene (oben vs. unten).
Abbildung rot: Reflexion am Oberrand der
Ohrmuschel, der weiter vom Eingang zum äußeren Gehörgang entfernt ist).
Veränderungen der Position der Schallquelle in der Horizontalebene
ergeben keine solchen Unterschiede. Die Unterstützung der Ortung von
Schallquellen mittels Reflexion durch die Ohrmuschel funktioniert nur
in der Vertikalebene (oben vs. unten).
Die Formen der Ohrmuscheln weisen beträchtliche individuelle Unterschiede
auf. Dementsprechend sind auch die akustischen Details bei der
"Vorverarbeitung" der Schallmuster individualspezifisch. Aus den
Mustern der akustischen Verzerrungen entsprechende räumliche
Informationen zu errechnen, bedeutet die Berücksichtigung der gegebenen
Geometrie des äußeren Ohres. Die passenden neuronalen Algorithmen sind
nicht genetisch programmiert, sondern beruhen auf Erfahrung und werden individuell erlernt.
Das Gehör vermittelt Information über akustische Vorgänge in der Umgebung und im Körper selbst
Das Ohr vermittelt akustische
 Reize aus Umwelt und Körper (die eigene Stimme klingt anders als von
außen: Schallleitung über das Gewebe von Hals und Kopf zusätzlich zur
"Luftleitung"). Es verfügt über eine erstaunliche akustische
Empfindlichkeit (Schall breitet sich über Longitudinalwellen aus):
Reize aus Umwelt und Körper (die eigene Stimme klingt anders als von
außen: Schallleitung über das Gewebe von Hals und Kopf zusätzlich zur
"Luftleitung"). Es verfügt über eine erstaunliche akustische
Empfindlichkeit (Schall breitet sich über Longitudinalwellen aus):
Seitenunterschiede von ~1 dB SPL
und ~0,00002 Sekunden Ankunftszeit (entspricht einem Winkel von
3°) können
vom menschlichen Ohr wahrgenommen werden (Schallgeschwindigkeit in Luft ~340
m/s, mittlerer Ohrabstand beim Erwachsenen 0,22 m).
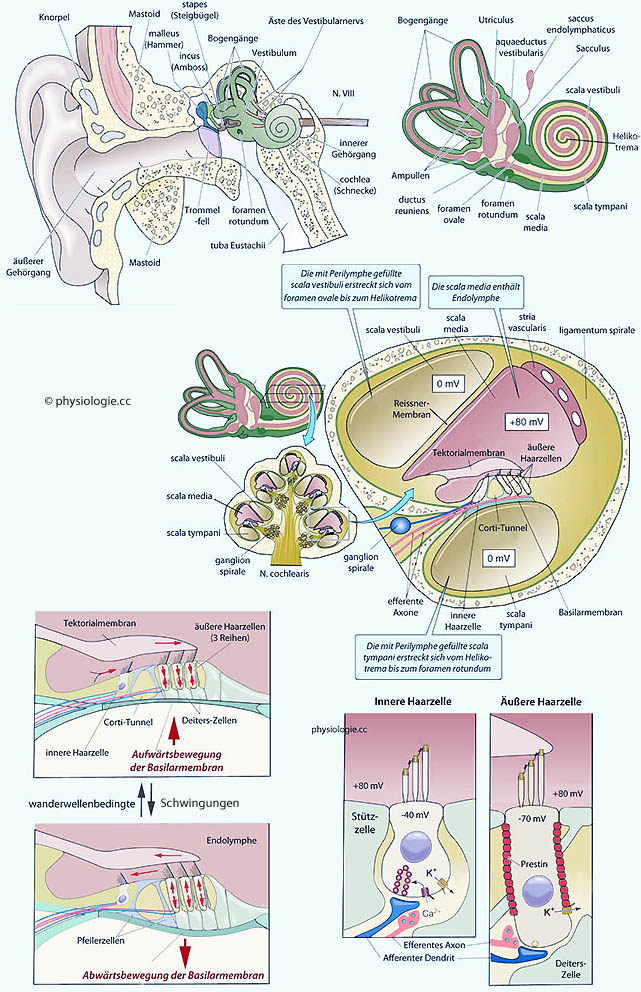
 Abbildung: Gehörsystem und Innenohr
Kombiniert nach Vorlagen in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Gehörsystem und Innenohr
Kombiniert nach Vorlagen in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Oben: Das Labyrinth im Innenohr hat einen auditiven (Gehör) und einen vestibulären Teil (Gleichgewichtssinn).
Mitte: Der Schnitt durch die
Schnecke geht 5-mal durch die Bogengänge. Reissner-Membran und
Basilarmembran untergliedern die insgesamt 9 mm große Innenohrschnecke
(cochlea ) in drei Kompartimente (rechts vergrößert dargestellt):
Scala vestibuli und scala tympani
gehen am Helikotrema ineinander über und enthalten Perilymphe, die eine
für extrazelluläre Flüssigkeit typische Zusammensetzung hat. Von der
scala media ist die scala vestibuli mittels der Reissner'schen Membran,
die scala tympani mittels der Basilarmembran abgegrenzt.
Die scala media
enthält Endolymphe und das Corti-Organ (das auf der Basilarmembran
"reitet"), ist elektrisch geladen (+80 mV relativ zur Perilymphe:
Endocochleäres Potential) und ähnelt in ihrem Elektrolytmuster
(kaliumreich) intrazellulärer Flüssigkeit, bedingt durch die Aktivität der stria vascularis (
) in drei Kompartimente (rechts vergrößert dargestellt):
Scala vestibuli und scala tympani
gehen am Helikotrema ineinander über und enthalten Perilymphe, die eine
für extrazelluläre Flüssigkeit typische Zusammensetzung hat. Von der
scala media ist die scala vestibuli mittels der Reissner'schen Membran,
die scala tympani mittels der Basilarmembran abgegrenzt.
Die scala media
enthält Endolymphe und das Corti-Organ (das auf der Basilarmembran
"reitet"), ist elektrisch geladen (+80 mV relativ zur Perilymphe:
Endocochleäres Potential) und ähnelt in ihrem Elektrolytmuster
(kaliumreich) intrazellulärer Flüssigkeit, bedingt durch die Aktivität der stria vascularis ( s. dort).
Unten links: Akustisch
ausgelöste Wanderwellen durch die Cochlea bewirken Auslenkungen der
Reissner- und Basilarmembran, was zu Relativbewegung zur
Tektorialmembran und damit Abscherung der Haarzellen führt. Am
Überlagerungsort (hier wird der betreffende Frequenzanteil
"abgebildet") sind die Schwingungen am stärksten, weiter
helikotremawärts nehmen sie rasch ab.
Innere Haarzellen liegen innerhalb, äußere Haarzellen außerhalb der Pfeilerzellen (=rods of Corti), die den Corti-Tunnel umrahmen. Rote Pfeile: Kompression / Expansion der äußeren Haarzellen durch Prestin.
Unten rechts: Innere und äußere Haarzelle. Auslenkungen
des Innenohr-Kanalsystems infolge Durchlaufens von Schallwellen führen zu Abwinkelung der Sinneshaare der Haarzellen, was deren
Membranpotential und folglich die Aktionspotentialaktivität der
afferenten Nervenfasern (blau) beeinflusst - diese stammen zum Großteil von den inneren Haarzellen, die das Hören ermöglichen. Äußere Haarzellen verfügen über Prestin,
ein kontraktiles Membranprotein, das seine Länge abhängig vom
Membranpotential verändert: Es ermöglicht ultraschnelle mechanische
Reaktionen der Haarzellen (Elektromotilität), was Schwingungsvorgänge verstärkt (das Innenohr sendet Schallimpulse aus: evoked / spontaneous otoacoustic emissions) und für die Präzision des
Hörprozesses
entscheidend ist (verbesserte Frequenzselektivität).
Rosa sind efferente
Nervenfasern
gezeigt, diese bringen Impulse von der oberen Olive an die Haarzellen -
direkt an äußere, und an afferente Endigungen innerer Haarzellen
(Transmitter: Acetylcholin). Diese olivo-cochleären
Efferenzen können die cochleäre Verstärkung senken, indem sie den
Prestinmechanismus äußerer Haarzellen unterdrücken
s. dort).
Unten links: Akustisch
ausgelöste Wanderwellen durch die Cochlea bewirken Auslenkungen der
Reissner- und Basilarmembran, was zu Relativbewegung zur
Tektorialmembran und damit Abscherung der Haarzellen führt. Am
Überlagerungsort (hier wird der betreffende Frequenzanteil
"abgebildet") sind die Schwingungen am stärksten, weiter
helikotremawärts nehmen sie rasch ab.
Innere Haarzellen liegen innerhalb, äußere Haarzellen außerhalb der Pfeilerzellen (=rods of Corti), die den Corti-Tunnel umrahmen. Rote Pfeile: Kompression / Expansion der äußeren Haarzellen durch Prestin.
Unten rechts: Innere und äußere Haarzelle. Auslenkungen
des Innenohr-Kanalsystems infolge Durchlaufens von Schallwellen führen zu Abwinkelung der Sinneshaare der Haarzellen, was deren
Membranpotential und folglich die Aktionspotentialaktivität der
afferenten Nervenfasern (blau) beeinflusst - diese stammen zum Großteil von den inneren Haarzellen, die das Hören ermöglichen. Äußere Haarzellen verfügen über Prestin,
ein kontraktiles Membranprotein, das seine Länge abhängig vom
Membranpotential verändert: Es ermöglicht ultraschnelle mechanische
Reaktionen der Haarzellen (Elektromotilität), was Schwingungsvorgänge verstärkt (das Innenohr sendet Schallimpulse aus: evoked / spontaneous otoacoustic emissions) und für die Präzision des
Hörprozesses
entscheidend ist (verbesserte Frequenzselektivität).
Rosa sind efferente
Nervenfasern
gezeigt, diese bringen Impulse von der oberen Olive an die Haarzellen -
direkt an äußere, und an afferente Endigungen innerer Haarzellen
(Transmitter: Acetylcholin). Diese olivo-cochleären
Efferenzen können die cochleäre Verstärkung senken, indem sie den
Prestinmechanismus äußerer Haarzellen unterdrücken

Der
Intensitätsbereich ist ebenfalls enorm:
zwischen Empfindungs- und Schmerzschwelle liegt eine millionenfache Zunahme der Schalldruckintensität.
 Lautheit: Um den großen physiologischen Bereich akustischer Druckschwankungen (sechs Zehnerpotenzen) mit handlichen Zahlen
auszudrücken, wird die Stärke der Druckschwankungen (Druckeinheit Pascal
Lautheit: Um den großen physiologischen Bereich akustischer Druckschwankungen (sechs Zehnerpotenzen) mit handlichen Zahlen
auszudrücken, wird die Stärke der Druckschwankungen (Druckeinheit Pascal  : 1 Pa = 1 N/m−2 = 1 kg/m/s) durch ein logarithmisches Maß angegeben: als Schalldruckpegel (SPL = sound pressure level) in dezi-Bel - dB(A).
: 1 Pa = 1 N/m−2 = 1 kg/m/s) durch ein logarithmisches Maß angegeben: als Schalldruckpegel (SPL = sound pressure level) in dezi-Bel - dB(A).
Dieser bezieht sich auf einen Referenzdruck (po) von 2.10-5 Pa (entspricht etwa dem Hörschwellendruck bei 1 kHz, der aber genau genommen bei 4 dB liegt), und es gilt
|
SPL [dB] = 20 . log (p/po) |
 Das Bel
Das Bel
 ist eine nach Alexander Graham Bell benannte logarithmische Einheit (Logarithmus = Hochzahl). Sie wurde eingeführt, um über
mehrere Potenzen reichende Energiepegel handlich zu formulieren (daher
die Hochzahl). Der Schalldruckpegel nach dieser Definition ändert sich
mit dem Quadrat (2!) des Quotienten zweier Leistungsmaße (hier: Schalldruck), d.h. 1 Bel entspricht 2.log(p/po).
ist eine nach Alexander Graham Bell benannte logarithmische Einheit (Logarithmus = Hochzahl). Sie wurde eingeführt, um über
mehrere Potenzen reichende Energiepegel handlich zu formulieren (daher
die Hochzahl). Der Schalldruckpegel nach dieser Definition ändert sich
mit dem Quadrat (2!) des Quotienten zweier Leistungsmaße (hier: Schalldruck), d.h. 1 Bel entspricht 2.log(p/po).
Das Dezibel (Dezi-Bel dB) ist ein Zehntel Bel. So wie ein Meter aus 10 Dezimetern
besteht, kann man statt 1 Bel auch 10 dB schreiben, und aus dem Zweier
wird in der Formel ein "20".
 Die Zunahme des Schalldruckpegels um 20 dB entspricht einer Verzehnfachung des Schalldrucks.
Die Zunahme des Schalldruckpegels um 20 dB entspricht einer Verzehnfachung des Schalldrucks.
 Welcher Zunahme des Schalldrucks entspricht eine Erhöhung
des Schalldruckpegels um 60 dB?
Um auf die Zahl 60 zu kommen, muss
die rechte Seite der oben gegebenen Formel verdreifacht werden (60 = 3
mal 20). Es handelt sich um eine Hochzahl (Basis 10), also ergibt sich
1000 (=103). Die Erhöhung um 60 dB entspricht einer Vertausendfachung des Schalldrucks.
Welcher Zunahme des Schalldrucks entspricht eine Erhöhung
des Schalldruckpegels um 60 dB?
Um auf die Zahl 60 zu kommen, muss
die rechte Seite der oben gegebenen Formel verdreifacht werden (60 = 3
mal 20). Es handelt sich um eine Hochzahl (Basis 10), also ergibt sich
1000 (=103). Die Erhöhung um 60 dB entspricht einer Vertausendfachung des Schalldrucks.
 Abbildung: Isophone
Abbildung: Isophone
Nach einer Vorlage in Blauert J, Räumliches Hören, S. Hirzel Verlag Stuttgart 1974
Isophone verbinden Töne gleicher Lautheit

Die Empfindlichkeit des Ohres ist frequenzabhängig; am höchsten ist sie für Frequenzen zwischen ~1 und ~5 kHz (entspricht etwa dem Bereich gesprochener Sprache). Die subjektiv empfundene Lautheit wird über den Lautstärkepegel quantifiziert (Einheit: Phon  ).
).
Bei 1 kHz stimmen Dezibel- und Phon-Skala definitionsgemäß überein, Isophone (Kurven
gleicher Lautheit) ziehen von hier aus unterschiedlich durch
Schalldruck- Frequenz- Diagramme ( Abbildung).
Abbildung).
Bei 1000 Hz Tonfrequenz stimmen Lautstärke (angegeben in Phon) und Schalldruckpegel (angegeben in dB SPL) überein
Töne, die als gleich laut wahrgenommen werden, haben (unabhängig von der Frequenz) den selben Phonwert
|
Die Frequenz-Untergrenze des menschlichen
Hörvermögens liegt bei 16-20 Hz, die
obere bei 16-20 kHz, mit dem Alter abnehmend (mit 35 Jahren ~15 kHz, 50 Jahre ~12 kHz, im Greisenalter bis auf ~5 kHz - Presbyakusis).
Frequenzoptimum: Das Gehör des Menschen ist zwischen ~1 und ~5 kHz am empfindlichsten
Der Hörbereich liegt zwischen 16 Hz und maximal 20 kHz
Altersschwerhörigkeit (Presbyakusis) geht mit Hörverlust im oberen Frequenzbereich (>5 kHz) einher
|
Der tiefste Ton einer Bassgeige hat 45 Hz, der höchste einer
Sopranistin 2000 Hz. Der Sprechbereich des Menschen liegt zwischen 300 und 3000 Hz.
 Die Lautheit kann in dB SPL oder auch in Sone
Die Lautheit kann in dB SPL oder auch in Sone
 angegeben werden. Dies ist eine subjektive Lautheitsskala: z.B. bewirkt eine Verdreifachung der
empfundenen Lautheit einer Zunahme um 3 Sone. (Die Hörschwelle liegt bei 0 Sone.)
angegeben werden. Dies ist eine subjektive Lautheitsskala: z.B. bewirkt eine Verdreifachung der
empfundenen Lautheit einer Zunahme um 3 Sone. (Die Hörschwelle liegt bei 0 Sone.)
Gehörschäden treten bei längerer Einwirkung von ≥85 dB
SPL (~22 Sone) auf (Gehörschutz notwendig), ab 120 dB genügt dafür
schon eine kurze Beschallung; die
Schmerzgrenze liegt bei >130 dB. (Das lauteste Brüllen, das von
einem Mann registriert wurde, erreichte 128 dB; das lauteste Brüllen
einer Frau 119 dB SPL.)
Die
Empfindlichkeit des Ohres kann wechseln (Stapediusreflex s. unten). So bewirkt eine intensive
Beschallung zunächst eine vorübergehende Erniedrigung der
Empfindlichkeit (TTS: transitory
threshold shift); bei besonders intensiver bzw. länger andauernder Beschallung resultieren permanente Hörschäden (PTS: permanent threshold shift).
Unterschiedsschwellen: Um zwei Töne als verschieden laut zu empfinden, müssen sie sich im Schalldruckpegel um mindestens 1 dB unterscheiden (Intensitäts- Unterschiedsschswelle). Die Frequenz- Unterschiedsschwelle hängt von der Tonhöhe ab: Im Bereich von 1000 Hz mindestens 3 Hz (d.h. 0,3%), bei Tonhöhen darüber oder darunter ist ein größerer Frequenzunterschied notwendig, um zwei Töne als verschieden hoch erkennen zu können.
 Über akustisch evozierte Potentiale (AEP) s. dort
Über akustisch evozierte Potentiale (AEP) s. dort
Schalldruckwellen
gelangen über äußeren Gehörgang (Länge ca. 2,5 cm), Trommelfell (Dicke: 0,1 mm) und Gehörknöchelchen im
Mittelohr - in der 1-2 ml umfassenden Paukenhöhle - zum Innenohr ("Luftleitung"):
 Hammer (hammer) = malleolus, Masse 25 mg;
Hammer (hammer) = malleolus, Masse 25 mg;
 Amboss (anvil) = incus, Masse 30 mg;
Amboss (anvil) = incus, Masse 30 mg;
 Steigbügel (stirrup) = stapes, Masse 3 mg.
Steigbügel (stirrup) = stapes, Masse 3 mg.
Schwingungen einer Schallquelle (auch der eigenen Stimme) werden auch direkt
über den Schädelknochen auf das Innenohr übertragen ("Knochenleitung").

 Abbildung: Bewegung von Trommelfell, Gehörknöchelchen und Flüssigkeit im Innenohr bei Schalleinwirkung
Abbildung: Bewegung von Trommelfell, Gehörknöchelchen und Flüssigkeit im Innenohr bei Schalleinwirkung
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Links:
In der "Kompressionsphase" eines externen Schallereignisses rückt das
Trommelfell nach innen, die Gehörknöchelchenkette überträgt die
Bewegung unter Erhöhung des Drucks (Kraft auf kleinere Fläche) auf die
Perilymphe des Innenohrs.
Rechts: In der
"Unterdruckphase" erfolgt die gegenteilige Bewegung: Die elastische
Membran im runden Fenster rückt zurück, die Perilymphe strömt Richtung
Mittelohr, das Trommelfell wölbt sich in die Ausgangslage zurück.
Pfeile: Druckgradient / Richtung der Bewegung

Flüssigkeit (wie
die Perilymphe im Innenohr) hat einen wesentlich höheren
Schallwellenwiderstand als Luft. (Senkt man den Kopf unter Wasser, hört
man kaum mehr, was sich oben an der Luft akustisch abspielt.) Das Mittelohrsystem dient der Impedanzanpassung: Das ist bedeutsam, weil die (hauptsächlich aus Wasser bestehende) Perilymphe einen
viel höheren Wellenwiderstand hat als Luft.

 Ohne diese Druckverstärkung
würden 98% der über das Mittelohr geleiteten Schallenergie vom Innenohr reflektiert - so sind es nur ~40%.
Ohne diese Druckverstärkung
würden 98% der über das Mittelohr geleiteten Schallenergie vom Innenohr reflektiert - so sind es nur ~40%.
Die Gehörknöchelchenkette dient der Impedanzanpassung Luft - Wasser
|
Schallwellen bewegen Trommelfell →
Trommelfell bewegt Gehörknöchelchen → Gehörknöchelchen bewegen Membran
im foramen ovale → Schwingungen im foramen ovale bewegen Perilymphe →
scala media wird deformiert → Haarzellen im Corti'schen Organ werden
gereizt → Nervenimpulse wandern zum Gehirn
Das Schwingungsverhalten im Mittelohr
kann durch Kontraktion der Mittelohrmuskeln wie mittels Stoßdämpfern
abgeschwächt werden, was einen Schutz vor zu starker Reizung des
Systems bei sehr lauter Beschallung ermöglicht:

Stapediusreflex (stapedial reflex, attenuation reflex): Die Mittelohrmuskeln - m. stapedius, m. tensor tympani ( Abbildung) - kontrahieren sich bei hohen (>90 dB) Schalldrucken und wirken dämpfend auf die Schallübertragung (der m. stapedius reduziert die Kraftübertragung auf das ovale Fenster, der m. tensor tympani versteift das Trommelfell).
Abbildung) - kontrahieren sich bei hohen (>90 dB) Schalldrucken und wirken dämpfend auf die Schallübertragung (der m. stapedius reduziert die Kraftübertragung auf das ovale Fenster, der m. tensor tympani versteift das Trommelfell).
Der Reflexweg läuft üver Cochlearisnerv und formatio reticularis (neben dem Facialiskern) und Motoneuronen zum Stapedius im N. VII.
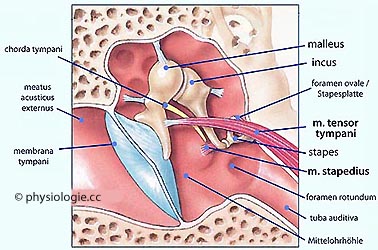
 Abbildung: Mittelohr
Abbildung: Mittelohr
Nach einer Vorlage bei tweetboard.me/anatomy-of-ear-muscles
Der m. tensor tympani tut das, was sein Name besagt: Er versteift das Trommelfell. Er entspringt
am Knorpel der tuba auditiva (Ohrtrompete), zieht durch den canalis
musculotubarius und setzt am manubrium mallei an. Er zieht den Amboss nach medial und spannt so das Trommelfell an. Er wird durch einen Ast des N. mandibularis innerviert.
Der m. stapedius
reduziert ebenfalls die Schallübertragung. Er ist der kleinste
quergestreifte Muskel des menschlichen Organismus. Über die Fußplatte
des Steigbügels versteift er das ligamentum anulare im ovalen Fenster und reduziert so die Schallübertragung auf die Perilymphe. Er ist hier reseziert dargestellt (nur Ansatz sichtbar); er entspringt in der eminentia
pyramidalis der Paukenhöhlenbucht und zieht durch das Mittelohr zum
incus-stapes-Gelenk. Innerviert ist der Stapediusmuskel durch den Stapediusnerv, einen Ast des N. facialis
malleus = Hammer, incus = Amboss, stapes = Steigbügel

Die Ohrtrompete
(tuba auditiva, Eustachi'sche Röhre, Eustachian / auditory / pharyngotympanic tube) sorgt für Belüftung und Druckausgleich mit außen. Auch transportiert die Tube Sekret aus dem Mittelohr zum
Rachen ab (Reinigung, Infektionsschutz).
Tubeninsuffizienz
kann zu Mittelohrentzündung führen. Bei verlegter Tube
wird Luft von der Schleimhaut resorbiert und das Trommelfell nach innen
gedellt, was das Gewebe spannt und Schmerz verursacht.
 Flüssigkeitsansammlung im Mittelohr (z.B. Paukenerguss infolge Belüftungsstörung) beeinträchtigt
das Hörvermögen ("Mittelohrschwerhörigkeit"), weil das Trommelfell
gegen ein Flüssigkeitspolster nicht frei schwingen kann und damit die
Schallübertragung über die Gehörknöchelchen reduziert ist.
Flüssigkeitsansammlung im Mittelohr (z.B. Paukenerguss infolge Belüftungsstörung) beeinträchtigt
das Hörvermögen ("Mittelohrschwerhörigkeit"), weil das Trommelfell
gegen ein Flüssigkeitspolster nicht frei schwingen kann und damit die
Schallübertragung über die Gehörknöchelchen reduziert ist.
 Die Mündung der Tube in den Rachen
ist beim direkten Blick
auf die
Rachenwand durch das Gaumensegel verdeckt und kann mittels Endoskopie ("Spiegelung") untersucht werden.
Die Mündung der Tube in den Rachen
ist beim direkten Blick
auf die
Rachenwand durch das Gaumensegel verdeckt und kann mittels Endoskopie ("Spiegelung") untersucht werden.
Frequenzcodierung: Die Schnecke im
Felsenbein nimmt entlang der ~35 mm langen cochlea eine Frequenzanalyse vor (vergleichbar einer Fourier-Analyse). Der zeitliche
Abstand der Druckwellen, die durch die scala vestibuli zur
Schneckenspitze (Helikotrema) laufen, bestimmt den Ort, an dem sie
aufeinander wie bei einer Brandung auflaufen und die scala media
auslenken.

 Abbildung: Hörorgan, Schallauflösung und Basilarmembran (Cochlea "entrollt")
Abbildung: Hörorgan, Schallauflösung und Basilarmembran (Cochlea "entrollt")
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Am Eingang (foramen ovale) ist die Basilarmembran schmal und dick,
Wanderwellen mit hoher Frequenz (<20 kHz) führen hier zu Überlagerung und Reizung des
Corti-Organs. Helikotremawärts wird die Basilarmembran immer dünner und breiter und bildet
niedrigere Frequenzen (>20 Hz) ab. Radiäre Fasern in der Membran
beeinflussen ihre Elastizität; das System ist am foramen-ovale-Ende um einen Faktor 102 steifer als beim Helikotrema.
Die Frequenzen werden entlang der Cochlea etwa entsprechend ihrem
Logarithmus abgebildet: Das erste Drittel der Cochlea registriert
Frequenzen zwischen 2 und 20 kHz; das zweite Drittel zwischen 200 Hz
und 2 kHz; das dritte zwischen 20 und 200 Hz
 vgl. dort
vgl. dort

 Steifigkeit ist der Widerstand eines Körpers gegen eine elastische Verformung, die durch
äußere Belastung (Kraft) aufgezwungen wird. Im Innenohr ist die
Steifigkeit der Basilarmembran umso größer, je geringer ihre
Schwingungsamplitude bei einem Schallreiz definierter Intensität
ausfällt.
Steifigkeit ist der Widerstand eines Körpers gegen eine elastische Verformung, die durch
äußere Belastung (Kraft) aufgezwungen wird. Im Innenohr ist die
Steifigkeit der Basilarmembran umso größer, je geringer ihre
Schwingungsamplitude bei einem Schallreiz definierter Intensität
ausfällt.
Wanderwellen breiten sich vom ovalen Fenster (hier ist die Basilarmembran etwa hundertmal steifer als apikal) in Richtung Helikotrema mit abnehmender Geschwindigkeit aus - z.B. ein 200 Hz-Ton in Stapesnähe mit ~4 m/s, in Helikotremanähe mit ~2 m/s ( Abbildung unten). Die Amplitude der Wanderwellen erreicht höchstens einige Nanometer (v. Békésy postulierte sogar ein Maximum von nur 0,1 nm, vgl. "Historisches").
Abbildung unten). Die Amplitude der Wanderwellen erreicht höchstens einige Nanometer (v. Békésy postulierte sogar ein Maximum von nur 0,1 nm, vgl. "Historisches").
 Druckwellen mit geringem Abstand (hochfrequenter Schall, hohe Töne)
führen schon bald hinter dem ovalen Fenster zu Überlagerung, maximaler
Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (die Wellen schaukeln sich gegenseitig auf und "versanden" anschließend).
Druckwellen mit geringem Abstand (hochfrequenter Schall, hohe Töne)
führen schon bald hinter dem ovalen Fenster zu Überlagerung, maximaler
Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (die Wellen schaukeln sich gegenseitig auf und "versanden" anschließend).
 Wellen mit größerem Abstand (niedrigfrequenter Schall, tiefe Töne)
gelangen weiter in die Schneckengänge (
Wellen mit größerem Abstand (niedrigfrequenter Schall, tiefe Töne)
gelangen weiter in die Schneckengänge ( Abbildung) und führen erst nahe dem
Helikotrema zu Überlagerung, maximaler Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (Tonotopie, place code: Abbildung der Frequenzen entlang der Strecke Fensterplatte → Schneckenspitze).
Abbildung) und führen erst nahe dem
Helikotrema zu Überlagerung, maximaler Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (Tonotopie, place code: Abbildung der Frequenzen entlang der Strecke Fensterplatte → Schneckenspitze).
Die größte Amplitude der Wanderwellen liegt bei hohen Frequenzen in der Nähe des Mittelohrs (nahe dem foramen ovale), bei tiefen Frequenzen in der Nähe der Schneckenspitze (helikotremanahe)
|
Zur Ortsanalyse kommt das Prinzip der Periodizitätsanalyse:
Die Aktionspotentiale in den afferenten Nervenfasern stehen in fester
Relation zur Phase des Rezeptorpotentials der zugehörigen Haarzellen.
Das Gehirn kann durch Vergleich der Aktionspotentialmuster (an
benachbarten Neuronen) eine präzisere Analyse der Frequenzanteile des
Schalls vornehmen als durch Ortsanalyse alleine.
 "Für
seine Entdeckungen im physikalischen Mechanismus der Erregungen in der
Schnecke des Ohres" erhielt der ungarisch-US-amerikanische Biophysiker
Georg von Békésy
1961 den Nobelpreis für Physiologie oder Medizin.
"Für
seine Entdeckungen im physikalischen Mechanismus der Erregungen in der
Schnecke des Ohres" erhielt der ungarisch-US-amerikanische Biophysiker
Georg von Békésy
1961 den Nobelpreis für Physiologie oder Medizin.

Békésy wandte sich
von der damals gängigen Auffassung der Funktion der Cochlea ähnlich
schwingenden Hörsaiten (Resonanzhypothese) abund postulierte
stattdessen die Wanderwellentheorie. Im Grunde
korrekt, wird diese Vorstellung heute durch den Verstärkungsmechanismus
durch die äußeren Haarzellen (cochlear amplifier) ergänzt (s. unten).
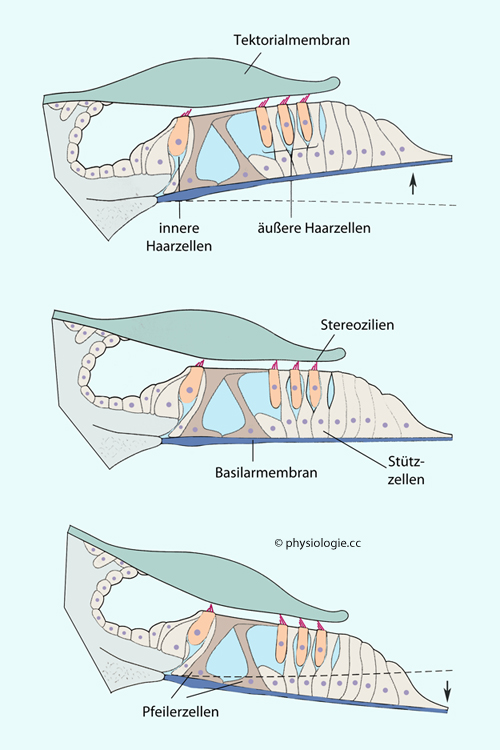
 Abbildung: Abbiegung der Stereozilien durch Bewegung der Basilarmembran
Abbildung: Abbiegung der Stereozilien durch Bewegung der Basilarmembran
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Schneckenachse
(Modiolus) und Spiralganglion (nicht gezeigt) rechts. An der
Projektionsstelle der betreffenden Schwingungsfrequenz entstehen die
größten Druckdifferenzen zwischen scala tympani und scala vestibuli,
was zu Auslenkungen der Basilarmembran führt. Das bedingt wiederum
Scherbewegungen zwischen Tektorialmembran und Corti-Organ.
Die Haarzellen liegen zwischen der Retikularmembran (durch die sie ihre
Mikrovilli, hier Stereozilien genannt, stecken) und der Basilarmembran
(hier blau). Die Spitzen der Stereozilien der äußeren Haarzellen sind
an der Tektorialmembran verankert und werden durch die
Relativbewegungen zwischen Tektorial- und Retikularmembran hin- und
herbewegt. Die Zilien der inneren Haarzellen liegen frei, werden aber
durch das Hin- und Herströmen der Endolymphe abgewinkelt.
Oben:
Bei Aufwärtsbewegung der Basilarmembran (entsprechend Bewegung der
Stapesplatte Richtung Mittelohr) rückt die Retikularmembran nach
außen (in der Abbildung links), die (durch Gerüste der Aktinfilamente
versteiften) Stereozilien (rot) werden in Richtung der längsten
abgebogen, die Haarzellen depolarisiert. Endolymphe fließt nach innen
(hier rechts), auch die Zilien der inneren Haarzellen werden angeregt.
Mitte: In der "Ruheposition" nehmen die Stereozilien ihre Mittelposition ein.
Unten: Bei Abwärtsbewegung der Basilarmembran (entsprechend Bewegung der Stapesplatte Richtung Innenohr) rückt die
Retikularmembran nach innen (in der Abbildung rechts), die Stereozilien
werden hyperpolarisiert

Mechanismus der Auslenkung im Bereich des Corti'schen Organs  (
( Abbildung): Die Haarzellen sind mittels der Retikularmembran
- einer dünnen "perforierten" bindegewebigen Platte - am Übergang
zwischen Zellkörper und Stereozilien fixiert.
Abbildung): Die Haarzellen sind mittels der Retikularmembran
- einer dünnen "perforierten" bindegewebigen Platte - am Übergang
zwischen Zellkörper und Stereozilien fixiert.
Kommt es zu Ausscherungen
der Basilarmembran, "reitet"
das gesamte Corti'sche Organ mit; bei Auslenkungen nach oben gleitet
die Reihe der Haarzellen nach innen (modioluswärts), die Tektorialmembran
bewegt sich relativ dazu nach außen,
und die Stereozilien werden nach außen gebogen (die der äußeren
Haarzellen sind an der Tektorialmembran fixiert, die der inneren werden
von der Endolymphströmung abgewinkelt).
Die Schwingungen der Basilarmembran zwingen dem System eine
Oben-unten-Bewegung auf, und die Stereozilien schwingen zwischen "ein"
und "aus" (s. Druckwellen und Rezeptorpotential unten). Das bedeutet,
es treten Aktionspotentialsalven mit entsprechender Frequenz auf und werden über den Hörnerven an den nucl. cochlearis im Hirnstamm gemeldet.
Das Corti´sche Organ enthält verschiedene Zelltypen (die Funktion einiger davon ist noch
nicht bekannt), darunter Pfeilerzellen (sie festigen den Abstand
zwischen inneren und äußeren Haarzellen), Deiters-Zellen (diese stützen
die äußeren Haarzellen) sowie innere und äußere Haarzellen. An der
Stelle der Wellenüberlagerung senden innere Haarzellen Aktionspotentiale über den Hörnerv (N. vestibulocochlearis, VIII.
Hirnnerv) zum Gehirn (s. unten).
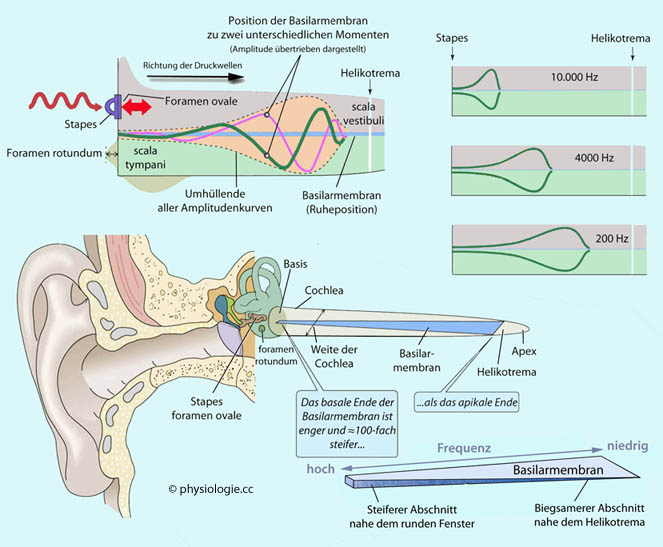
 Abbildung: Wellenpropagation entlang der Innenohrschnecke
Abbildung: Wellenpropagation entlang der Innenohrschnecke
Nach Vorlagen in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016; und Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Links oben: Durch einen Ton konstanter Frequenz ausgelöste Druckwellen wandern durch das Innenohr. Durch den "Brandungseffekt"
verursachte Überhöhungen der Schwingungsamplituden ergeben insgesamt
eine Umhüllende, wie sie durch die strichlierte Linie angedeutet wird.
Die Auslenkungen der Basilarmembran gehen nicht über diese Umhüllende
hinaus; an der Stelle der stärksten Auslenkung wird die entsprechende
Frequenz "abgebildet". Der Effekt ist um einen Faktor von etwa 106 übertrieben dargestellt.
Rechts oben: Abbildung dreier
Frequenzen. Je höher die Frequenz (z.B. 10 kHz), desto rascher kommt es
zur kritischen Überhöhung der Druckwellen - hohe Frequenzen werden stapesnahe abgebildet. Wellen niedriger Frequenz wandern weiter, bevor der Brandungseffekt auftritt - sie werden helikotremanahe abgebildet.
Links unten: Cochlea "entrollt"
dargestellt (Länge etwa 35 mm). Der Cochleagang wird helikotremawärts zusehends enger, die
Basilarmembran hingegen weiter; die Steifigkeit der Membran nimmt von
der Basis der Cochlea (nahe dem foramen ovale) zum Helikotrema hin ab (100:1).
Dies bewirkt, dass hohe Frequenzen stapesnahe, niedrige helikotremanahe
zu maximaler Auslenkung der Basilarmembran (und Reizung der Haarzellen
im Corti'schen Organ) führen - Frequenzanteile des Schalls werden im Innenohr "abgebildet" (Tonotopie).
Rechts unten:
Verlauf der Steifigkeit der Basilarmembran zwischen rundem Fenster
(hart, Abbildung hoher Frequenzen) und Helikotrema (weich, Abbildung
tiefer Frequenzen)

Die Perilymphe ähnelt in ihrer Zusammensetzung extrazellulärer (viel Na+, wenig K+), die Endolymphe hingegen intrazellulärer Flüssigkeit ([Na+] ~2 mM, [K+] ~150 mM).
Die Basilarmembran dient als
mechanische Stütze, nicht als Grenze zwischen Endo- und Perilymphe.
Die Endolymphe des scala media ist durch die Retikularmembran
(diese wird von den endolymphwärts gerichteten Enden der Stützzellen
gebildet) von der Perilymphe der scala tympani, und durch die Reissner-Membran
von der scala vestibuli getrennt.
Im Corti-Organ befinden sich ~3.500 innere und ~12.000 äußere Haarzellen
(dem Ohr steht eine entsprechende Zahl an Frequenzkanälen zur Schallauflösung zur
Verfügung).
Für das Hören benötigt man die (sensorischen) inneren Haarzellen; die äußeren
sind Effektorzellen (mit ihnen alleine ist kein Hören möglich), sie
beeinflussen die mechanischen Charakteristika der Basilarmembran und
wirken sich so auf die Sensorik der inneren Haarzellen aus.
 Abbildung: Ein tip link
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Abbildung: Ein tip link
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Tip links bauen sich aus zwei Vertretern der Cadherin-Familie auf: Cadherin 23 (Cdh23)
und Protocadherin 15 (Pcdh15).
Diese verankern sich in der Zellmembran banachbarter Stereovilli
("Zilien") und übertragen Scherkräfte, die bei mechanischer Reizung von
Haarzellen im Innenohr auftreten.
Blau kolorierte Membranareale deuten (elektronenmikroskopisch dunkel erscheinende) insertional plaques an

Jede Haarzelle verfügt über 10-300 Stereozilien (eigentlich keine Zilien, daher richtiger: Stereovilli) - jeweils ~5
µm lang und 0,1-0,3 µm dick, und
mittels tip links
miteinander verbunden. Tip links
sind elastische Filamente, die von der Seite einer Zilie zur Spitze
einer Nachbarzilie ziehen. An diesen - elektronenmikroskopisch dunkel erscheinenden - insertional plaques
werden bei Reizung Rezeptorpotentiale getriggert.
Tip links bestehen aus Cadherin (Cdh23)
und Protocadherin (Pcdh15), die sich einerseits untereinander zu einem
tip link verbinden, andererseits die Verankerung in jeweils zwei
benachbarten Stereozilien aufbauen (  Abbildung).
Abbildung).
Genetische Veränderungen an den Genen für Cadherin-23 und Protocadherin-15 können zu Taubheit führen.
Dehnung der Membran an Tip-link-Verankerungspunkten führt zur Öffnung von Kationenkanälen (TRPA1, transient receptor potential cation channels type 1). Da die Endolymphe
eine sehr hohe Kaliumkonzentration aufweist (rund 150 mM!), führt dies zu K+-Einstrom in die Zelle.
 Bei
Stereozilien sind es Kaliumionen (nicht Natrium- oder Calciumionen),
deren Einstrom in die Zelle eine Depolarisierung erzeugt.
Bei
Stereozilien sind es Kaliumionen (nicht Natrium- oder Calciumionen),
deren Einstrom in die Zelle eine Depolarisierung erzeugt.
Die resultierende Depolarisierung triggert weiters den Einstrom von Ca++ durch spannungsgesteuerte Calciumkanäle. Dies führt wiederum zur Freisetzung von Glutamat an der Basis der Haarzelle und Depolarisierung der peripheren Endigungen bipolarer Zellen des Spiralganglions. Deren Axone ziehen im Hörnerven zum Gehirn.
Im ersten Abschnitt der Cochlea - wo hohe Frequenzen aufgelöst
werden - sind die Stereozilien 4 µm, zum Helikotrema hin bis 7 µm lang. Jedes
Stereozilium ist mit zentralen
Aktinfilamenten ausgestattet, die durch spezielle Proteine (Plastin,
Fascin, Epsin) fest miteinander verbunden sind und dem Zilium
entsprechende
Steifigkeit verleihen. An ihrer Spitze sind sie in der Kutikularplatte
(einem Maschenwerk von Aktinfilamenten) verankert, was sie zu
gemeinsamen Bewegungen bringt.
Das im Fetalstadium vorhandene Kinozilium
(ein echtes Zilium, mit Axonem und 9 Mikrotubuli) einer Haarzelle in
der Schnecke ist für die mechanoelektrische Transduktion im Corti-Organ
nicht notwendig und verkümmert nach der Geburt.
Die Zilien der inneren
Haarzellen berühren die (über ihnen liegende) Tektorialmembran nicht,
sondern werden von der hin- und herströmenden Endolymphe bewegt (wobei
sie erregt werden). Die Zilien der äußeren Haarzellen hingegen sind an der Tektorialmembran fixiert.
 Abbildung: Haarzellen-Rezeptorpotential
Nach einer Vorlage in Bear / Connors / Paradiso, Neuroscience - Exploring the Brain, 4th ed 2016
Abbildung: Haarzellen-Rezeptorpotential
Nach einer Vorlage in Bear / Connors / Paradiso, Neuroscience - Exploring the Brain, 4th ed 2016
Oben:
Generatorpotential (in Millivolt) einer Haarzelle in Abhängigkeit von
der Zilienauslenkung (in Nanometern) - links vom längsten Zilium weg
(Kaliumkanäle geschlossen → Hyperpolarisierung), rechts zum längsten
Zilium hin (Kaliumkanäle geöffnet → Depolarisierung). Ein Zilium hat
einen Durchmesser von etwa 500 nm, Auslenkungen von 0,3 nm sind bereits
wahrnehmbar.
Unten: Zeitverlauf des Schalldrucks und des Generatorpotentials: Letzteres spiegelt ersteres exakt wider.
Bei Depolarisation kommt es zu Ca++-Einstrom durch spannungsgesteuerte Calciumkanäle, dadurch Freisetzung von Glutamat aus Speichervesikeln
und Erregung afferenter (zum Gehirn führender) Fasern des VIII.
Hirnnerven

Haarzellen sind spezialisierte Epithelzellen (keine Nervenzellen). Sie generieren in Abhängigkeit vom Ausmaß ihrer Abbiegung Rezeptorpotentiale mittels (wenig selektiver) mechanosensitiver Kationenkanäle vom Typ Tmc (transmembrane channel), die mit dem Ausmaß der mechanischen Verformung der scala media
korrelieren und als Generatorpotentiale fungieren ( Abbildung).
Abbildung).
Tmc1- und Tmc2-Proteine sind offenbar funktionelle Komponenten des mechanosensiblen Ionenkanals in der Zilienmembran von Haarzellen im Innenohr. Mutationen von Sequenzen für transmembranale Domänen
im Tmc1-Gen verändern die Ionenpermeabilität des mechanosensitiven
Kanals, und multiple Dissens-Mutationen führen zu rezessiven oder
dominanten Formen von Taubheit.
Auslenkung der Zilien zum "langen" Ende depolarisiert, zum "kurzen" Ende hyperpolarisiert die Zelle (vgl. Abbildung unten). Das Membranpotential beträgt zwischen -30 und -70 mV. In einer
ungereizten Haarzelle sind ≥10% der mechanosensitiven Ionenkanäle
offen.
Ein
Geräusch, dessen Stärke gerade über der Hörschwelle liegt, verursacht
ein Rezeptorpotential von ~0,1 mV Größe. Eine Auslenkung der Zilien um weniger als 1 nm (<10-3 µm) verursacht bereits eine messbare Änderung des Membranpotentials. Bei mäßiger Reizung schwingen die Haarzellbündel um einen Betrag von etwa ±1° hin und her (viel weniger als der ~0,2-µm-Durchmesser eines Stereoziliums). Eine Abbiegung der Zilien um 100 nm (0,1
µm) bewirkt bereits 90% des Maximaleffekts, der bei ~0,5 µm Zilienbewegung erreicht wird.
Depolarisierte Haarzellen setzen Glutamat frei, dieses führt zu Depolarisation afferenter Nervenfaserendigungen und beeinflusst deren Aktionspotentialfrequenz (s. unten). Sowohl
das Aktionspotential als auch die nachfolgende Refraktärzeit afferenter
Cochlea-Neurone dauert jeweils 1 µs; das ermöglicht eine maximale
Aktionspotentialfrequenz an afferenten Cochlearisfasern von etwa 500 Hz.
Haarzellen und die sie umgebenden Stützzellen bilden an ihren apikalen Polen - wo sie durch tight junctions
eng miteinander verbunden sind - die Retikularmembran. Diese separiert
die Endolymphe von der darunterliegenden Perilymphe. Auf diese Weise tauchen die Haarzellen apikal in Endolymphe, basal in
Perilymphe ein.
Mutationen
der Gene für Claudin-Moleküle der tight junctions verändern die
parazelluläre Leitfähigkeit der Retikularmembran und reduzieren den
Betrag des endocochleären Potentials.
 Innere Haarzellen (Abbildung oben) sind nicht
an der Tektorialmembran fixiert, ihre frei beweglichen Zilien werden
von der Endolymphe abgebogen, während diese im Rahmen der
Schalldetektion zwischen Tektorialmembran und Haarzellen hin- und
herströmt (hydrodynamische Kopplung).
Innere Haarzellen (Abbildung oben) sind nicht
an der Tektorialmembran fixiert, ihre frei beweglichen Zilien werden
von der Endolymphe abgebogen, während diese im Rahmen der
Schalldetektion zwischen Tektorialmembran und Haarzellen hin- und
herströmt (hydrodynamische Kopplung).

Abbildung: Transduktion an Haarzellen im Innenohr
Nach Vorlagen in Carlson NR / Birkett MA, Physiology of Behavior, 12th ed. Pearson 2017, und Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Oben links: Positionierung der Zilien einer Haarzelle und ihre Verbindung über tip links
genannte Stereozilien (rot).
Oben rechts: Bewegung der
Zilienbündel in Richtung zum kürzesten Zilium verringert, in Richtung
zum längsten erhöht die Entladungsrate der Neuronen, die an die
Haarzelle angeschlossen sind (N. cochlearis).
Mitte: Mit zunehmendem Zug am tip link
erhöht sich die Öffnungswahrscheinlichkeit verknüpfter TMC-Ionenkanäle
(transmembrane channel-like protein) und damit der Einstrom von Kaliumionen. Dadurch
wird das Membranpotential reduziert (Generatorpotential) und
Aktionspotentiale am angeschlossenen Neuron ausgelöst.
Stehen die Zilien gerade (Ruheposition, hier in der Mitte dargestellt),
beträgt die Öffnungswahrscheinlichkeit für die TMC-Kanäle etwa 10%. Es
besteht also ein mäßiger Kationeneinstrom, was einer geringen
Depolarisierung des Rezeptorpotentials entspricht. Maximale Öffnung der
TMC-Kanäle (rechts) wird bei einer Abbiegung der Zilien zum "langen" Ende um
ca. 0,5 µm erreicht.
Unten: Stereozilien detektieren
mechanische Reize, indem die Durchlässigkeit von Kaliumkanälen in der
Zilienmembran mit ihrer Abwinkelung variiert. Die extrazelluläre
Flüssigkeit hat hier eine außergewöhnlich hohe [K+],
sodass Kaliumionen durch offene Kaliumkanäle in die Zelle einströmen
und die Zelle dadurch depolarisieren. Das führt zu Einstom von
Calciumionen durch spannungssensitive Calciumkanäle in der Membran des
Zellkörpers. In weiterer Folge exozytiert (sezerniert) die Haarzelle eine gesteigerte Menge an Transmitter
(Glutamat), die Aktionspotentialfrequenz am angeschlossenen Neuron nimmt zu


Bewegt sich die Basilarmembran nach oben, fließt Endolymphe nach zentral (Richtung Modiulus), bewegt den Zilienschopf Richtung längster Zilie, die Zelle depolarisiert; das öffnet spannungsabhängige Calciumkanäle, das intrazelluläre [Ca++] steigt, synaptische Vesikel werden exozytiert, Glutamat wird an Synapsen mit afferenten Nervenfasern freigesetzt.
 Innere Haarzellen sind auf -40 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 120 mV. Depolarisierung der Zelle bewirkt Glutamatfreisetzung.
Innere Haarzellen sind auf -40 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 120 mV. Depolarisierung der Zelle bewirkt Glutamatfreisetzung.
Lautstärkencodierung: Fasern
des Hörnerven bilden spontan Aktionspotentiale. Reizung durch Schall
erhöht die Aktionspotentialfrequenz bis auf einige 103/s. Dies würde - auf sich alleine gestellt - die Codierung einer Schalldruckänderung von ~50 dB erlauben. Der tatsächliche dynamische Codierungsbereich beträgt ~120 dB;
das erklärt sich damit, dass jede einzelne Haarzelle mit mehreren
Neuronen (die unterschiedliche Erregungsschwellen haben) Kontakt hat.
Mit der Stärke des Reizes nimmt die Zahl der aktivierten Neuronen zu.
~95% der afferenten Fasern im
Hörnerven beziehen ihre Information von inneren Haarzellen, die also
das eigentliche Hören codieren (vgl.  Abbildung ganz unten).
Abbildung ganz unten).
Die Frequenz, mit der es zum Ein- und Ausstrom von
Kaliumionen durch die Haarzellmembran kommt, entspricht der Frequenz des auslösenden (detektierten) Schalls.
Die inneren Haarzellen haben intensive synaptische Kontakte zu afferenten
Fasern; deren Aktionspotentiale sind zeitlich mit der Phase des Haarzell-Rezeptorpotentials verknüpft (Phasenkopplung).
 Äußere Haarzellen dienen nicht direkt der Schallanalyse, sondern der Verstärkung und Präzisierung des akustischen Signals. Ihre Zilien stehen in direktem Kontakt mit der Tektorialmembran; mechanosensible
Kalium- und Calciumkanäle in der Membran der Zilienspitze (1-2 pro
Zilium) ändern ihren Öffnungszustand entsprechend der Abwinkelung innerhalb von
Bruchteilen einer Millisekunde.
Äußere Haarzellen dienen nicht direkt der Schallanalyse, sondern der Verstärkung und Präzisierung des akustischen Signals. Ihre Zilien stehen in direktem Kontakt mit der Tektorialmembran; mechanosensible
Kalium- und Calciumkanäle in der Membran der Zilienspitze (1-2 pro
Zilium) ändern ihren Öffnungszustand entsprechend der Abwinkelung innerhalb von
Bruchteilen einer Millisekunde.
Schwingt die Basilarmembran nach oben, bewirkt die Abwinkelung
der Zilien eine Depolarisation der Haarzelle, und diese verkürzt sich um einige µm (Hyperpolarisation bewirkt umgekehrt eine Streckung der Haarzelle).
Wie funktioniert diese blitzartige Kontraktion von äußeren Haarzellen? Ihre laterale Membran weist eine Art Stützstrumpf auf, der aus dem kontraktilen Protein Prestin besteht (einige 106 Moleküle pro Zelle - s. Abbildung oben).
Die Verkürzung funktioniert anders als der kontraktile Apparat in
Muskelzellen: Sie benötigt kein ATP, kein Aktinsystem, kein
extrazelluläres Ca++; Prestin gehört zur Familie der
Anionentransporter, es reagiert auf Änderung des Membranpotentials
unmittelbar mit einer eigenen mechanischen Antwort - und zwar um Größenordnungen rascher, als das für andere Motorproteine typisch ist.
besteht (einige 106 Moleküle pro Zelle - s. Abbildung oben).
Die Verkürzung funktioniert anders als der kontraktile Apparat in
Muskelzellen: Sie benötigt kein ATP, kein Aktinsystem, kein
extrazelluläres Ca++; Prestin gehört zur Familie der
Anionentransporter, es reagiert auf Änderung des Membranpotentials
unmittelbar mit einer eigenen mechanischen Antwort - und zwar um Größenordnungen rascher, als das für andere Motorproteine typisch ist.
 Die Kontraktion der Haarzelle unterstützt die Aufwärtsbewegung der Basilarmembran ("cochleärer Verstärker", cochlear amplifier).
Die Kontraktion der Haarzelle unterstützt die Aufwärtsbewegung der Basilarmembran ("cochleärer Verstärker", cochlear amplifier).
Der Prestinmechanismus erhöht die Schwingungsamplitude der Basilarmembran, was insbesondere bei niedrigem Schalldruckpegel einen verstärkenden Effekt hat. Das verbessert die Auflösung von Frequenzanteilen
des
detektierten Schalls - die Verstärkung erfolgt jeweils nur bei einer
charakteristischen Frequenz -, insbesondere bei höheren Frequenzen
(Verschärfung der akustischen Analyse, rote Kurve in der folgenden  Abbildung). So können auch sehr schwache akustische Reize überschwellig wirksam werden.
Abbildung). So können auch sehr schwache akustische Reize überschwellig wirksam werden.
Die Funktion der
wenigen Afferenzen von äußeren Haarzellen zum Hörnerven
ist unklar, vielleicht dienen sie der Schmerzleitung.
 Äußere Haarzellen sind auf -70 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 150 mV. Depolarisierung der Zelle bewirkt Kontraktion des Prestins.
Äußere Haarzellen sind auf -70 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 150 mV. Depolarisierung der Zelle bewirkt Kontraktion des Prestins.

Abbildung: Maximale Auslenkung der Basilarmembran in Relation zur Position in der Cochlea
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Auslöser ist ein reiner Ton (gegebene Frequenz) geringer Intensität.
Die blaue Kurve gibt das passive Antwortmuster der
Basilarmembran wieder (z.B. bei anoxischem Sauerstoffmangel), die rote
Kurve diejenige der "lebendigen" Cochlea, inklusive dem Beitrag des
Prestinmechanismus in den
äußeren Haarzellen (cochlear amplifier).
Die strichlierte Linie zeigt den Schwellenwert, der zu elektrophysiologischen Reaktionen des Innenohrs führt

Mutationen im Prestin-System reduzieren das Hörvermögen um ~40 dB und beeinträchtigen die Fähigkeit der Frequenzunterscheidung.
Olivocochleäre Efferenzen: Das Gehirn beeinflusst die Funktion der Haarzellen über
efferente Fasern aus der oberen Olive ( Abbildung ganz oben).
Diese sind cholinerg; sie wirken direkt auf äußere und indirekt (über
Synapsen an afferenten postsynaptischen Nervenendigungen) auf innere
Haarzellen. Acetylcholin aktiviert über ionotrope Rezeptoren den Einstrom von Ca++ in äußere Haarzellen; dies öffnet calciumaktivierte Kaliumkanäle, was die Zelle hyperpolarisiert und den Prestinmechanismus dämpft.
Abbildung ganz oben).
Diese sind cholinerg; sie wirken direkt auf äußere und indirekt (über
Synapsen an afferenten postsynaptischen Nervenendigungen) auf innere
Haarzellen. Acetylcholin aktiviert über ionotrope Rezeptoren den Einstrom von Ca++ in äußere Haarzellen; dies öffnet calciumaktivierte Kaliumkanäle, was die Zelle hyperpolarisiert und den Prestinmechanismus dämpft.
Durch olicocochleäre Efferenzen übt das Gehirn eine Kontrolle über die Signalverstärkung im Innenohr
aus. Vermutlich dient dieser Mechanismus der auditiven
Fokussierung, d.h. sie reduziert die Empfindlichkeit gegenüber
unerwünschten (Stör-, Begleit-) Geräuschen.
Endocochleäres Potential: Zwischen Endo- und Perilymphe baut sich ein endocochleäres Potential
von ~80 mV Stärke auf. Das Bezugspotential ist das der Perilymphe (0 mV), in der Endolymphe
beträgt das Potential etwa +80 mV.
Die Endolymphe ist gegenüber dem umgebenden Extrazellulärraum auf etwa +80 mV aufgeladen
|
Verlust des endocochleären Potentials ist eine häufige Ursache für Hörverlust.
Das endocochleäre Potential wird von der stria vascularis
aufgebaut: Diese enthält spezialisierte (nicht-sensorische) vestibular dark cells,
das sind Marginalzellen, welche Kaliumionen in die Endolymphe
sezernieren. Die Kaliumionen werden aus dem Kreislauf in das
Interstitium nachgeliefert und wandern über vier Zelllagen: Fibrozyten,
Basalzellen, Intermediär- und Marginalzellen ( Abbildung).
Dabei durchqueren sie gap junctions, welche die ersten drei Zellreihen
verbinden, und dann eine (extrazelluläre) intrastriatale Flüssigkeit
zwischen intermediären und Marginalzellen (
Abbildung).
Dabei durchqueren sie gap junctions, welche die ersten drei Zellreihen
verbinden, und dann eine (extrazelluläre) intrastriatale Flüssigkeit
zwischen intermediären und Marginalzellen ( Abbildung). Das K+ ladet den Endolymphraum der Schnecke positiv auf (80 mV).
Abbildung). Das K+ ladet den Endolymphraum der Schnecke positiv auf (80 mV).
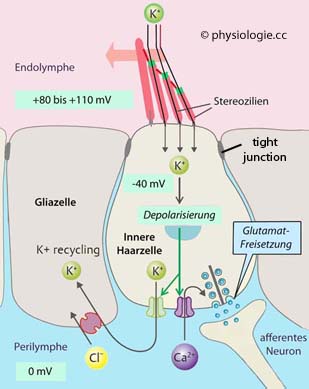

Abbildung: Vorgänge an einer inneren Haarzelle (Spannungswerte entsprechen einer "Momentaufnahme" und sind dynamisch)
Nach einer Vorlage bei R. TannerThies: Physiology - An Illustrated Review. Thieme 2011
Cochleäre
Vibrationen bewirken Relativbewegung der Tektorial- gegen die
Basalmembran, Abwinkelung der Stereozilien,
Depolarisation und Verkürzung. Dies verstärkt den Reiz an den
Stereozilien innerer Haarzellen (rosa Pfeil).
Deren kaliumbedingte
Depolarisierung (hohe Kaliumkonzentration - >140 mM - der positiv aufgeladenen Endolymphe) öffnet Calciumkanäle, was Ca++-Einstrom und dies wiederum Glutamatfreisetzung zur Folge hat - afferente Neuronen (VIII. Hirnnerv) werden dadurch aktiviert.
Schlussleisten (tight junctions) zwischen Haar- und Gliazellen verhindern parazellulären Stromfluss, sie isolieren die Haarzellschicht und trennen den Endolymph- (apikal) vom Perilymphraum (basolateral).
Gliazellen entfernen überschüssige Kaliumionen aus dem Extrazellulärraum via Aufnahme von Chloridionen (K/Cl-Symport)

Das Gesamtpotential
zwischen Haarzelle (intrazellulär -70 mV) und Endolymphe (extrazellulär +80 mV)
beträgt bis zu 150 mV. Das Ruhepotential der Haarzellen addiert sich auf das endocochleäre Potential. Diese hohe Spannung steigert die Empfindlichkeit
der Hördetektion, indem sie den elektrochemischen Gradienten für den K+-Einstrom in die Haarzelle erhöht (Öffnung der Kaliumkanäle an den Haarzell-Stereozilien führt zu Kaliumeinstrom und Depolarisierung).

Werden die
Stereozilien der inneren Haarzellen bei Scherbewegungen gegeneinander verschoben (Durchgang von Wanderwellen), kommt
es zur Öffnung mechanosensibler Ionenkanäle an der Spitze der Zilien, Kaliumeinstrom,
Depolarisation und entsprechende Generatorpotentiale an den
Haarzellen.
Warum depolarisiert Öffnung von Kaliumkanälen die Haarzelle? Üblicherweise führt Öffnung der Kaliumkanäle zu Hyperpolarisierung. Dass die Öffnung von Kaliumkanälen Haarzellen depolarisiert, ist ein Sonderfall und hat zwei Gründe:
 Die Kaliumkonzentration in der Endolymphe ist so hoch, dass das Kalium-Gleichgewichtspotential ~0 mV beträgt.
Die Kaliumkonzentration in der Endolymphe ist so hoch, dass das Kalium-Gleichgewichtspotential ~0 mV beträgt.
 Dazu kommt das endocochleäre Potential - der elektrische Gradient an der Membran beträgt um die 130 mV und treibt K+ durch offene Kaliumkanäle in die Zelle - das verringert das Membranpotential.
Dazu kommt das endocochleäre Potential - der elektrische Gradient an der Membran beträgt um die 130 mV und treibt K+ durch offene Kaliumkanäle in die Zelle - das verringert das Membranpotential.

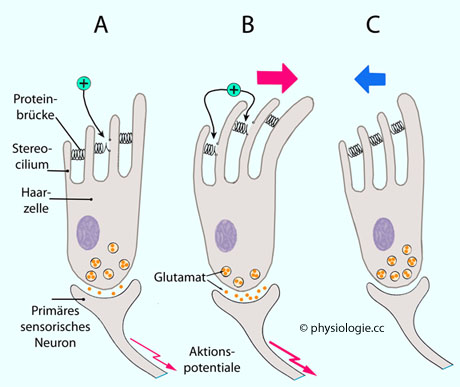
 Abbildung: Signaltransduktion in Haarzellen
Abbildung: Signaltransduktion in Haarzellen
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
A:
Haarzelle in Mittelposition (Ruhezustand, kein externer Reiz). Etwa 10%
der Ionenkanäle in der Membran der Strereozilien sind im geöffneten
Zustand (Proteinbrücken = tip links). Durch diese erfolgt ein mäßiger Ionenstrom (K+), das
Membranpotential der Haarzelle beträgt -30 mV. Eine geringe Menge
Transmitter wird an der Synapse zum primären sensorischen (afferenten) Neuron freigesetzt, es resultiert ein tonisches Signal in Form einer mäßigen Aktionspotentialfrequenz.
B: Die Haarzelle wird in Richtung zum längsten Stereozilium abgebogen, die Zahl offener Kaliumkanäle (+) und damit der Kaliumeinstrom steigen an, die Zelle wird depolarisiert, Glutamatfreisetzung und Aktionspotentialfrequenz nehmen zu (intensiveres Signal an das Gehirn).
C: Die Haarzelle wird in die Gegenrichtung abgebogen, die Zelle wird hyperpolarisiert, die Glutamatfreisetzzung und die Aktionspotentialfrequenz nehmen ab (schwächeres oder ausbleibendes Signal an das Gehirn)
Auslenkung der tip links depolarisiert die Haarzelle
|
Die inneren Haarzellen sind die
eigentlichen Sensoren im Hörapparat; ihre Zerstörung führt zu
kompletter Taubheit.
 Zur Physiologie von Haarzellen s. auch dort
Zur Physiologie von Haarzellen s. auch dort
Bei den äußeren Haarzellen ist ein anderer Mechanismus im Spiel: Sie sind
hauptsächlich efferent innerviert, und bei Depolarisation kontrahieren
sie, bei Hyperpolarisation strecken sie sich. Die Kontraktion ist
ultraschnell und erfolgt durch Wirkung eines speziellen Eiweißes in der
lateralen Wand der äußeren Haarzellen: das Prestin.
Bei Depolarisation verringert es seine Fläche, die Zelle kontrahiert,
dies überträgt sich auf den
Schalldetektionsapparat und bildet einen aktiven Beitrag zur
Empfindlichkeitssteigerung im Innenohr. Dieser "cochleäre Verstärker" (cochlear amplifier) bewirkt eine Verhundertfachung der Auslenkung der Basilarmembran.
Nur so können die inneren Haarzellen auch bei niedrigem Schalldruck erregt werden.
Auch wird durch die lokal eng begrenzte Verstärkung die
Frequenzauflösung erhöht. Wie
wesentlich diese Mechanismen sind, zeigt sich an hochgradiger
Schwerhörigkeit und herabgesetzter Frequenzauflösung (aber nicht
kompletter Taubheit!) bei Verlust der äußeren Haarzellen.
Verschaltung auf afferente Fasern des Hörnerven. Der Hörnerv (N. cochlearis, auditory nerve) ist Teil des VIII. Hirnnerven;
die Somata seiner Nervenzellen - die akustische Sinnesinformation an
das Gehirn melden - liegen im ganglion spirale (das im Zentrum der
Schnecke untergebracht ist und wegen seiner spiraligen Form so genannt wurde).
Einzelne Neurone
des afferenten Systems haben unterschiedliche Frequenzempfindlichkeiten (tuning curves).
Ihre Aktivität
ist ebenfalls unterschiedlich: Die sentitivsten haben ihre Reizschwelle
bei etwa 0 dB SPL, weisen eine hohe Spontanaktivität auf und erreichen
ihre höchste Aktivität bereits bei 30 dB; andere sind
weniger empfindlich und zeigen kaum Spontanaktivität, ihre Reaktion
steigt aber bei höherem Schalldruck (bis über 100 dB) an. Neurone mit
mittlerer Empfindlichkeit liegen zwischen diesen Extremen. Auch feuern
bestimmte Neuronen zu bestimmten Abschnitten der Schallschwingung (phase locking).
Efferente Nervenfasern aus der oberen Olive - etwa eintausend an der Zahl - hemmen die äußeren Haarzellen cholinerg;
d.h. sie werden durch Acetylcholin hyperpolarisiert (Ca++-aktivierbarer
Kaliumkanal). Dies führt zu lokaler Abnahme der Empfindlichkeit der
Cochlea und erlaubt gezielte zentrale Modulation im Sinnesorgan.
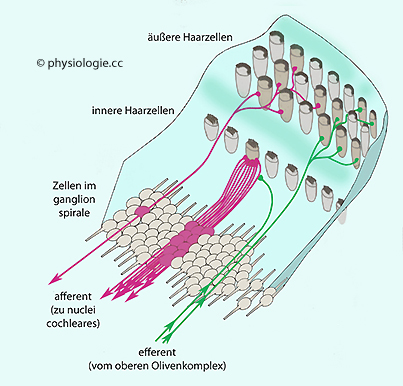

 Abbildung: Innervation der Haarzellen durch Neurone des ganglion spirale
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Abbildung: Innervation der Haarzellen durch Neurone des ganglion spirale
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Das
Spiralganglion (ca. 30.000 Ganglionzellen) innerviert die inneren
Haarzellen besonders dicht: Eine
innere Haarzelle projiziert auf ~10 Neuronen im Spiralganglion, so wird
die Information von jeder Rezeptorzelle unabhängig über mehrere
parallele Kanäle nach zentral gemeldet.
Einige
Neuronen übertragen Signale (konvergent) von jeweils mehreren äußeren Haarzellen
(afferente Fasern rot gezeigt).
Efferente Neurone von den oberen Olivenkernen (grün) innervieren vor
allem äußere Haarzellen. Sie sind cholinerg (ionotrop) und hyperpolarisieren die Haarzellen durch Öffnung Ca++-sensitiver Kaliumkanäle. Einige Fasern enden auch an sensorischen
Terminals innerer Haarzellen

Das Spiralganglion enthält zwischen 35.103
und 50.103 Neurone; die meisten (95%) kommunizieren mit inneren
Haarzellen. Jede der etwa 3.500 davon
sendet Impulse zu etwa 10 verschiedenen afferenten Neuronen ( Abbildung). Diese Anordnung ist nicht redundant: Die
empfindlichsten Neurone haben den synaptischen Kontakt zu ihrer
Haarzelle an der äußeren Seite, die am wenigsten empfindlichen auf der
achsennahen Seite einer inneren Haarzelle. So werden verschieden starke
Reizungen jeder einzelnen inneren Haarzelle über unterschiedliche
Afferenzkanäle codiert.
Abbildung). Diese Anordnung ist nicht redundant: Die
empfindlichsten Neurone haben den synaptischen Kontakt zu ihrer
Haarzelle an der äußeren Seite, die am wenigsten empfindlichen auf der
achsennahen Seite einer inneren Haarzelle. So werden verschieden starke
Reizungen jeder einzelnen inneren Haarzelle über unterschiedliche
Afferenzkanäle codiert.
Von den etwa 12.103 äußeren
Haarzellen werden nur etwa 5% der Spiralganglienneuriten kontaktiert,
und auf jede von diesen konvergiert Information von mehreren äußeren
Haarzellen. Die akustische Information aus der Gehörschnecke stammt von den inneren Haarzellen; die äußeren dienen der Signalverstärkung (Prestin-Mechanismus,
s. oben).
Olivocochleäres System: Efferente cholinerge Nervenfasern, die vom oberen Olivenkomplex der Brücke zur Gehörschnecke ziehen (olivo-cochleäres Bündel, ein Teil des VIII. Hirnnerven)
beeinflussen die
Reiztransformation im Innenohr. Ihre Axone nützen mehrere
Neurotransmitter (vor allem Acetylcholin, auch GABA) / neuroaktive
Peptide; durch rasche Aktivierung von SK-Kaliumkanälen
wirken diese (überraschenderweise) hyperpolarisierend. Solche
inhibitorischen Efferenzen vom Gehirn zum Gehörorgan könnten z.B.
Schutzreflexe auslösen, die einer Schädigung der Haarzellen bei sehr
lauten Schallreizen vorbeugen.

 Nebenwirkung: Schleifendiuretika (z.B. Furosemid) wirken diuretisch, indem sie den Na+-K+-2Cl--Transporter
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife hemmen.
Allerdings blockieren sie auch einen analogen Cotransporter in der
stria vascularis, worauf die Kalium-Konzentration in der Endolymphe und
damit das für die akustische Reiztransduktion notwendige cochleäre
Potential (s. oben) absinkt. Die Folge ist Taubheit, die zuerst reversibel, später bleibend ist. Daher gelten Schleifendiuretika als ototoxisch.
Nebenwirkung: Schleifendiuretika (z.B. Furosemid) wirken diuretisch, indem sie den Na+-K+-2Cl--Transporter
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife hemmen.
Allerdings blockieren sie auch einen analogen Cotransporter in der
stria vascularis, worauf die Kalium-Konzentration in der Endolymphe und
damit das für die akustische Reiztransduktion notwendige cochleäre
Potential (s. oben) absinkt. Die Folge ist Taubheit, die zuerst reversibel, später bleibend ist. Daher gelten Schleifendiuretika als ototoxisch.
Auch Antibiotika (wie
Kanamycin) können den Verstärkungseffekt der äußeren Haarzellen
blockieren (die inneren Haarzellen bleiben unbeschädigt) und zu
Innenohrtaubheit führen. Das zeigt, wie essentiell der Verstärkereffekt
der äußeren Haarzellen für den Hörvorgang ist.


 Die Intensität eines Schalls korreliert mit der Stärke der
Druckschwankungen, die er hervorruft. Der Schalldruckpegel ändert sich
mit dem Quadrat (Hochzahl 2)
des Quotienten zweier Schalldrucke. 1 Bel
entspricht 2.log(p/po), für den Referenzdruck (po) wurde ein Wert von 2.10-5 Pa festgelegt. Der Schalldruckpegel (SPL = sound pressure level) wird in dezi-Bel, dB(A) als 20.log(p/po)
errechnet (ein Dezi-Bel ist ein Zehntel Bel, aus "2" wird in der Formel
"20"). Die Zunahme des Schalldruckpegels um 20 dB entspricht einer
Verzehnfachung des Schalldrucks
Die Intensität eines Schalls korreliert mit der Stärke der
Druckschwankungen, die er hervorruft. Der Schalldruckpegel ändert sich
mit dem Quadrat (Hochzahl 2)
des Quotienten zweier Schalldrucke. 1 Bel
entspricht 2.log(p/po), für den Referenzdruck (po) wurde ein Wert von 2.10-5 Pa festgelegt. Der Schalldruckpegel (SPL = sound pressure level) wird in dezi-Bel, dB(A) als 20.log(p/po)
errechnet (ein Dezi-Bel ist ein Zehntel Bel, aus "2" wird in der Formel
"20"). Die Zunahme des Schalldruckpegels um 20 dB entspricht einer
Verzehnfachung des Schalldrucks
 Die Empfindlichkeit des Ohres ist frequenzabhängig; am höchsten ist sie
zwischen ~1 und ~5 kHz. Die Untergrenze des menschlichen Hörvermögens
liegt bei 16-20
Hz, die obere bei 16-20 kHz, mit dem Alter abnehmend (Presbyakusis: Hörverlust im Frequenzbereich >5 kHz).
Die Empfindlichkeit des Ohres kann wechseln (Stapediusreflex).
Intensive Beschallung reduziert vorübergehend die Empfindlichkeit (TTS:
transitory threshold shift); länger andauernde intensive Beschallung bewirkt
permanente Hörschäden (PTS: permanent threshold shift)
Die Empfindlichkeit des Ohres ist frequenzabhängig; am höchsten ist sie
zwischen ~1 und ~5 kHz. Die Untergrenze des menschlichen Hörvermögens
liegt bei 16-20
Hz, die obere bei 16-20 kHz, mit dem Alter abnehmend (Presbyakusis: Hörverlust im Frequenzbereich >5 kHz).
Die Empfindlichkeit des Ohres kann wechseln (Stapediusreflex).
Intensive Beschallung reduziert vorübergehend die Empfindlichkeit (TTS:
transitory threshold shift); länger andauernde intensive Beschallung bewirkt
permanente Hörschäden (PTS: permanent threshold shift)
 Die subjektiv empfundene
Lautheit wird über den Lautstärkepegel quantifiziert (Einheit: Phon).
Töne, die als gleich laut wahrgenommen werden (Isophone), haben den selben
Phonwert. Bei 1 kHz stimmen
Dezibel- und Phon-Skala definitionsgemäß überein Die subjektiv empfundene
Lautheit wird über den Lautstärkepegel quantifiziert (Einheit: Phon).
Töne, die als gleich laut wahrgenommen werden (Isophone), haben den selben
Phonwert. Bei 1 kHz stimmen
Dezibel- und Phon-Skala definitionsgemäß überein
 Um zwei Töne als verschieden laut zu empfinden,
muss sich ihr Schalldruckpegel um mindestens 1 dB unterscheiden
(Intensitäts- Unterschiedsschswelle). Die Frequenz-
Unterschiedsschwelle hängt von der Tonhöhe ab: Bei 1000 Hz ~3 Hz, darüber oder darunter >3 Hz Um zwei Töne als verschieden laut zu empfinden,
muss sich ihr Schalldruckpegel um mindestens 1 dB unterscheiden
(Intensitäts- Unterschiedsschswelle). Die Frequenz-
Unterschiedsschwelle hängt von der Tonhöhe ab: Bei 1000 Hz ~3 Hz, darüber oder darunter >3 Hz
 Die Gehörknöchelchenkette dient der Impedanzanpassung Luft - Wasser (Erhöhung des Schalldrucks um den Faktor 23).
Die Mittelohrmuskeln dämpfen bei hohen (>90 dB) Schalldrucken die
Schallübertragung: Der m. stapedius reduziert die Kraftübertragung auf
das ovale Fenster (Stapediusreflex), der m. tensor tympani versteift das
Trommelfell. Der Reflex hat eine Latenz von ≤0,1 s und
dämpft wahrscheinlich auch die Wahrnehmung der eigenen Stimme. Die tuba
auditiva (Eustachii) dient dem Druckausgleich und dem Abtransport von
Sekret zum Rachen (Reinigung, Infektionsschutz)
Die Gehörknöchelchenkette dient der Impedanzanpassung Luft - Wasser (Erhöhung des Schalldrucks um den Faktor 23).
Die Mittelohrmuskeln dämpfen bei hohen (>90 dB) Schalldrucken die
Schallübertragung: Der m. stapedius reduziert die Kraftübertragung auf
das ovale Fenster (Stapediusreflex), der m. tensor tympani versteift das
Trommelfell. Der Reflex hat eine Latenz von ≤0,1 s und
dämpft wahrscheinlich auch die Wahrnehmung der eigenen Stimme. Die tuba
auditiva (Eustachii) dient dem Druckausgleich und dem Abtransport von
Sekret zum Rachen (Reinigung, Infektionsschutz)
 In der Innenohrschnecke bestimmt der zeitliche Abstand der Druckwellen
(Wanderwellen, Amplitude höchstens einige Nanometer), die durch die
scala vestibuli laufen, den Ort, an dem sie die scala media maximal
auslenken (Abbildungsort einer Frequenz). Ihre Geschwindigkeit nimmt
ab, bis sie sich überlagern: Hohe Töne werden hahe dem ovalen Fenster
abgebildet, tiefe näher am Helikotrema (Tonotopie
entlang des Corti'schen Organs). Zur Ortsanalyse kommt bei tieferen
Frequenzen Periodizitätsanalyse: Aktionspotentiale in den afferenten
Fasern des Hörnerven stehen in fester Relation zur Phase des
Rezeptorpotentials der zugehörigen Haarzellen
In der Innenohrschnecke bestimmt der zeitliche Abstand der Druckwellen
(Wanderwellen, Amplitude höchstens einige Nanometer), die durch die
scala vestibuli laufen, den Ort, an dem sie die scala media maximal
auslenken (Abbildungsort einer Frequenz). Ihre Geschwindigkeit nimmt
ab, bis sie sich überlagern: Hohe Töne werden hahe dem ovalen Fenster
abgebildet, tiefe näher am Helikotrema (Tonotopie
entlang des Corti'schen Organs). Zur Ortsanalyse kommt bei tieferen
Frequenzen Periodizitätsanalyse: Aktionspotentiale in den afferenten
Fasern des Hörnerven stehen in fester Relation zur Phase des
Rezeptorpotentials der zugehörigen Haarzellen
 Im Corti-Organ sind Haarzellen mittels Retikularmembran fixiert.
Schwingt die Basilarmembran, nimmt sie das Corti'sche Organ mit;
Relativbewegungen zur Tektorialmembran biegen Stereozilien der äußeren,
Endolymphströmungen die der inneren Haarzellen. Letztere bilden in
Abhängigkeit von ihrer Abbiegung Rezeptorpotenziale
(Generatorpotentiale). Öffnung spannungsabhängiger Ca++-Kanäle setzt Glutamat frei, dieses erregt afferente Nervenfasern
Im Corti-Organ sind Haarzellen mittels Retikularmembran fixiert.
Schwingt die Basilarmembran, nimmt sie das Corti'sche Organ mit;
Relativbewegungen zur Tektorialmembran biegen Stereozilien der äußeren,
Endolymphströmungen die der inneren Haarzellen. Letztere bilden in
Abhängigkeit von ihrer Abbiegung Rezeptorpotenziale
(Generatorpotentiale). Öffnung spannungsabhängiger Ca++-Kanäle setzt Glutamat frei, dieses erregt afferente Nervenfasern
 Innere Haarzellen haben
synaptische Kontakte zu afferenten Fasern des Hörnerven, deren
Aktionspotentiale sind mit dem Rezeptorpotential phasengekoppelt. Mit
der Stärke des Reizes nimmt die Zahl der aktivierten Neuronen zu
(Lautstärkencodierung). Kaliumkanäle in den Zilien der Haarzellen sind
miteinander durch molekulare Brücken (tip links)
verbunden. Werden letztere angespannt, öffnen Kaliumkanäle, die folgende
Depolarisation öffnet spannungsabhängige Calciumkanäle,
Glutamat wird freigesetzt. Bei niedrigen Frequenzen folgt das Rezeptorpotential der inneren
Haarzellen den Schwingungen der Basilarmembran, bei höheren ist der
Kaliumeinstrom eher kontinuierlich. ~95% der afferenten Fasern im Hörnerven beziehen ihre Information von inneren Haarzellen Innere Haarzellen haben
synaptische Kontakte zu afferenten Fasern des Hörnerven, deren
Aktionspotentiale sind mit dem Rezeptorpotential phasengekoppelt. Mit
der Stärke des Reizes nimmt die Zahl der aktivierten Neuronen zu
(Lautstärkencodierung). Kaliumkanäle in den Zilien der Haarzellen sind
miteinander durch molekulare Brücken (tip links)
verbunden. Werden letztere angespannt, öffnen Kaliumkanäle, die folgende
Depolarisation öffnet spannungsabhängige Calciumkanäle,
Glutamat wird freigesetzt. Bei niedrigen Frequenzen folgt das Rezeptorpotential der inneren
Haarzellen den Schwingungen der Basilarmembran, bei höheren ist der
Kaliumeinstrom eher kontinuierlich. ~95% der afferenten Fasern im Hörnerven beziehen ihre Information von inneren Haarzellen
 Äußere
Haarzellen verstärken das akustische Signal mittels des kontraktilen Proteins Prestin ("elektromechanische
Transduktion"). Der cochleäre
Verstärker bewirkt eine Verhundertfachung der Auslenkung der
Basilarmembran Äußere
Haarzellen verstärken das akustische Signal mittels des kontraktilen Proteins Prestin ("elektromechanische
Transduktion"). Der cochleäre
Verstärker bewirkt eine Verhundertfachung der Auslenkung der
Basilarmembran
 Endocochleäres Potential: Die
stria vascularis sezerniert Kaliumionen über
vier Zelllagen in die Endolymphe: Gegenüber der Perilymphe bzw. dem
umgebenden Extrazellulärraum ist sie positiv aufgeladen. Das
Gesamtpotential zwischen Haarzelle (intrazellulär -70 mV) und
Endolymphe (extrazellulär +80 mV) beträgt somit ~150 mV. Das
Ruhepotential der Haarzellen addiert sich auf das endocochleäre
Potential; dies steigert die Empfindlichkeit der
Hördetektion (hoher elektrochemischer Gradient für den
K+-Einstrom in die Haarzelle). Schleifendiuretika (Furosemid) blockieren den Na/K/2Cl-Cotransporter
in der stria vascularis, senken die Kalium-Konzentration in der
Endolymphe und damit das cochleäre Potential. Die Folge ist Taubheit, Schleifendiuretika wirken
ototoxisch Endocochleäres Potential: Die
stria vascularis sezerniert Kaliumionen über
vier Zelllagen in die Endolymphe: Gegenüber der Perilymphe bzw. dem
umgebenden Extrazellulärraum ist sie positiv aufgeladen. Das
Gesamtpotential zwischen Haarzelle (intrazellulär -70 mV) und
Endolymphe (extrazellulär +80 mV) beträgt somit ~150 mV. Das
Ruhepotential der Haarzellen addiert sich auf das endocochleäre
Potential; dies steigert die Empfindlichkeit der
Hördetektion (hoher elektrochemischer Gradient für den
K+-Einstrom in die Haarzelle). Schleifendiuretika (Furosemid) blockieren den Na/K/2Cl-Cotransporter
in der stria vascularis, senken die Kalium-Konzentration in der
Endolymphe und damit das cochleäre Potential. Die Folge ist Taubheit, Schleifendiuretika wirken
ototoxisch
 Verschaltung auf afferente Fasern des Hörnerven: Der N. cochlearis ist
Teil des VIII. Hirnnerven; die Somata seiner Nervenzellen liegen im
Spiralganglion. Die meisten (95%) seiner bis zu ~40.000 Neurone
kommunizieren mit ~4000 inneren Haarzellen: Jede von ihnen projiziert
auf etwa 10 afferente Neuronen
Verschaltung auf afferente Fasern des Hörnerven: Der N. cochlearis ist
Teil des VIII. Hirnnerven; die Somata seiner Nervenzellen liegen im
Spiralganglion. Die meisten (95%) seiner bis zu ~40.000 Neurone
kommunizieren mit ~4000 inneren Haarzellen: Jede von ihnen projiziert
auf etwa 10 afferente Neuronen
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Akustik: ἀκούειν = hören
Akustik: ἀκούειν = hören Lautheit und Schalldruck
Lautheit und Schalldruck  Mittelohr
Mittelohr  Innenohr
Innenohr
 Haarzellsystem
Haarzellsystem (dezi-) Bel
(dezi-) Bel  Steifigkeit, Wanderwellen
Steifigkeit, Wanderwellen
 Core messages
Core messages ) der Ohrleiste (helix
) der Ohrleiste (helix ) am äußeren Rand der Muschel bis hin zum knorpeligen Tragus
) am äußeren Rand der Muschel bis hin zum knorpeligen Tragus direkt vor dem Eingang zum Gehörgang (meatus acusticus externus) sowie dem gegenüber liegenden Antitragus reflektiert
einen Teil des Schalls, der zum Ohr gelangt (
direkt vor dem Eingang zum Gehörgang (meatus acusticus externus) sowie dem gegenüber liegenden Antitragus reflektiert
einen Teil des Schalls, der zum Ohr gelangt ( Abbildung):
Abbildung):
 Abbildung: Schallortung in der Vertikalebene
Abbildung: Schallortung in der Vertikalebene
 Abbildung) als solche, die von unten
auf das Ohr einwirken (in der
Abbildung) als solche, die von unten
auf das Ohr einwirken (in der  Abbildung rot: Reflexion am Oberrand der
Ohrmuschel, der weiter vom Eingang zum äußeren Gehörgang entfernt ist).
Abbildung rot: Reflexion am Oberrand der
Ohrmuschel, der weiter vom Eingang zum äußeren Gehörgang entfernt ist).
 Reize aus Umwelt und Körper (die eigene Stimme klingt anders als von
außen: Schallleitung über das Gewebe von Hals und Kopf zusätzlich zur
"Luftleitung"). Es verfügt über eine erstaunliche akustische
Empfindlichkeit (Schall breitet sich über Longitudinalwellen aus):
Reize aus Umwelt und Körper (die eigene Stimme klingt anders als von
außen: Schallleitung über das Gewebe von Hals und Kopf zusätzlich zur
"Luftleitung"). Es verfügt über eine erstaunliche akustische
Empfindlichkeit (Schall breitet sich über Longitudinalwellen aus):
 Abbildung: Gehörsystem und Innenohr
Abbildung: Gehörsystem und Innenohr ) in drei Kompartimente (rechts vergrößert dargestellt):
) in drei Kompartimente (rechts vergrößert dargestellt): s. dort).
s. dort).
 Lautheit: Um den großen physiologischen Bereich akustischer Druckschwankungen (sechs Zehnerpotenzen) mit handlichen Zahlen
auszudrücken, wird die Stärke der Druckschwankungen (Druckeinheit Pascal
Lautheit: Um den großen physiologischen Bereich akustischer Druckschwankungen (sechs Zehnerpotenzen) mit handlichen Zahlen
auszudrücken, wird die Stärke der Druckschwankungen (Druckeinheit Pascal  : 1 Pa = 1 N/m−2 = 1 kg/m/s) durch ein logarithmisches Maß angegeben: als Schalldruckpegel (SPL = sound pressure level) in dezi-Bel - dB(A).
: 1 Pa = 1 N/m−2 = 1 kg/m/s) durch ein logarithmisches Maß angegeben: als Schalldruckpegel (SPL = sound pressure level) in dezi-Bel - dB(A).  Das Bel
Das Bel
 ist eine nach Alexander Graham Bell benannte logarithmische Einheit (Logarithmus = Hochzahl). Sie wurde eingeführt, um über
mehrere Potenzen reichende Energiepegel handlich zu formulieren (daher
die Hochzahl). Der Schalldruckpegel nach dieser Definition ändert sich
mit dem Quadrat (2!) des Quotienten zweier Leistungsmaße (hier: Schalldruck), d.h. 1 Bel entspricht 2.log(p/po).
ist eine nach Alexander Graham Bell benannte logarithmische Einheit (Logarithmus = Hochzahl). Sie wurde eingeführt, um über
mehrere Potenzen reichende Energiepegel handlich zu formulieren (daher
die Hochzahl). Der Schalldruckpegel nach dieser Definition ändert sich
mit dem Quadrat (2!) des Quotienten zweier Leistungsmaße (hier: Schalldruck), d.h. 1 Bel entspricht 2.log(p/po). Die Zunahme des Schalldruckpegels um 20 dB entspricht einer Verzehnfachung des Schalldrucks.
Die Zunahme des Schalldruckpegels um 20 dB entspricht einer Verzehnfachung des Schalldrucks. Welcher Zunahme des Schalldrucks entspricht eine Erhöhung
des Schalldruckpegels um 60 dB?
Welcher Zunahme des Schalldrucks entspricht eine Erhöhung
des Schalldruckpegels um 60 dB? 
 Abbildung: Isophone
Abbildung: Isophone
 ).
).
 Abbildung).
Abbildung).  Die Lautheit kann in dB SPL oder auch in Sone
Die Lautheit kann in dB SPL oder auch in Sone
 angegeben werden. Dies ist eine subjektive Lautheitsskala: z.B. bewirkt eine Verdreifachung der
empfundenen Lautheit einer Zunahme um 3 Sone. (Die Hörschwelle liegt bei 0 Sone.)
angegeben werden. Dies ist eine subjektive Lautheitsskala: z.B. bewirkt eine Verdreifachung der
empfundenen Lautheit einer Zunahme um 3 Sone. (Die Hörschwelle liegt bei 0 Sone.)
 Über akustisch evozierte Potentiale (AEP) s. dort
Über akustisch evozierte Potentiale (AEP) s. dort Hammer (hammer) = malleolus, Masse 25 mg;
Hammer (hammer) = malleolus, Masse 25 mg;  Amboss (anvil) = incus, Masse 30 mg;
Amboss (anvil) = incus, Masse 30 mg;  Steigbügel (stirrup) = stapes, Masse 3 mg.
Steigbügel (stirrup) = stapes, Masse 3 mg. 
 Abbildung: Bewegung von Trommelfell, Gehörknöchelchen und Flüssigkeit im Innenohr bei Schalleinwirkung
Abbildung: Bewegung von Trommelfell, Gehörknöchelchen und Flüssigkeit im Innenohr bei Schalleinwirkung

 Ohne diese Druckverstärkung
würden 98% der über das Mittelohr geleiteten Schallenergie vom Innenohr reflektiert - so sind es nur ~40%.
Ohne diese Druckverstärkung
würden 98% der über das Mittelohr geleiteten Schallenergie vom Innenohr reflektiert - so sind es nur ~40%. 
 Abbildung) - kontrahieren sich bei hohen (>90 dB) Schalldrucken und wirken dämpfend auf die Schallübertragung (der m. stapedius reduziert die Kraftübertragung auf das ovale Fenster, der m. tensor tympani versteift das Trommelfell).
Abbildung) - kontrahieren sich bei hohen (>90 dB) Schalldrucken und wirken dämpfend auf die Schallübertragung (der m. stapedius reduziert die Kraftübertragung auf das ovale Fenster, der m. tensor tympani versteift das Trommelfell). 
 Abbildung: Mittelohr
Abbildung: Mittelohr
 Flüssigkeitsansammlung im Mittelohr (z.B. Paukenerguss infolge Belüftungsstörung) beeinträchtigt
das Hörvermögen ("Mittelohrschwerhörigkeit"), weil das Trommelfell
gegen ein Flüssigkeitspolster nicht frei schwingen kann und damit die
Schallübertragung über die Gehörknöchelchen reduziert ist.
Flüssigkeitsansammlung im Mittelohr (z.B. Paukenerguss infolge Belüftungsstörung) beeinträchtigt
das Hörvermögen ("Mittelohrschwerhörigkeit"), weil das Trommelfell
gegen ein Flüssigkeitspolster nicht frei schwingen kann und damit die
Schallübertragung über die Gehörknöchelchen reduziert ist. Die Mündung der Tube in den Rachen
ist beim direkten Blick
auf die
Rachenwand durch das Gaumensegel verdeckt und kann mittels Endoskopie ("Spiegelung") untersucht werden.
Die Mündung der Tube in den Rachen
ist beim direkten Blick
auf die
Rachenwand durch das Gaumensegel verdeckt und kann mittels Endoskopie ("Spiegelung") untersucht werden.
 Abbildung: Hörorgan, Schallauflösung und Basilarmembran (Cochlea "entrollt")
Abbildung: Hörorgan, Schallauflösung und Basilarmembran (Cochlea "entrollt") vgl. dort
vgl. dort
 Steifigkeit ist der Widerstand eines Körpers gegen eine elastische Verformung, die durch
äußere Belastung (Kraft) aufgezwungen wird. Im Innenohr ist die
Steifigkeit der Basilarmembran umso größer, je geringer ihre
Schwingungsamplitude bei einem Schallreiz definierter Intensität
ausfällt.
Steifigkeit ist der Widerstand eines Körpers gegen eine elastische Verformung, die durch
äußere Belastung (Kraft) aufgezwungen wird. Im Innenohr ist die
Steifigkeit der Basilarmembran umso größer, je geringer ihre
Schwingungsamplitude bei einem Schallreiz definierter Intensität
ausfällt.  Abbildung unten). Die Amplitude der Wanderwellen erreicht höchstens einige Nanometer (v. Békésy postulierte sogar ein Maximum von nur 0,1 nm, vgl. "Historisches").
Abbildung unten). Die Amplitude der Wanderwellen erreicht höchstens einige Nanometer (v. Békésy postulierte sogar ein Maximum von nur 0,1 nm, vgl. "Historisches"). Druckwellen mit geringem Abstand (hochfrequenter Schall, hohe Töne)
führen schon bald hinter dem ovalen Fenster zu Überlagerung, maximaler
Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (die Wellen schaukeln sich gegenseitig auf und "versanden" anschließend).
Druckwellen mit geringem Abstand (hochfrequenter Schall, hohe Töne)
führen schon bald hinter dem ovalen Fenster zu Überlagerung, maximaler
Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (die Wellen schaukeln sich gegenseitig auf und "versanden" anschließend).
 Wellen mit größerem Abstand (niedrigfrequenter Schall, tiefe Töne)
gelangen weiter in die Schneckengänge (
Wellen mit größerem Abstand (niedrigfrequenter Schall, tiefe Töne)
gelangen weiter in die Schneckengänge ( Abbildung) und führen erst nahe dem
Helikotrema zu Überlagerung, maximaler Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (Tonotopie, place code: Abbildung der Frequenzen entlang der Strecke Fensterplatte → Schneckenspitze).
Abbildung) und führen erst nahe dem
Helikotrema zu Überlagerung, maximaler Auslenkung und Reizung des Corti-Organs sowie Auslöschung der Welle (Tonotopie, place code: Abbildung der Frequenzen entlang der Strecke Fensterplatte → Schneckenspitze). "Für
seine Entdeckungen im physikalischen Mechanismus der Erregungen in der
Schnecke des Ohres" erhielt der ungarisch-US-amerikanische Biophysiker
Georg von Békésy
1961 den Nobelpreis für Physiologie oder Medizin.
"Für
seine Entdeckungen im physikalischen Mechanismus der Erregungen in der
Schnecke des Ohres" erhielt der ungarisch-US-amerikanische Biophysiker
Georg von Békésy
1961 den Nobelpreis für Physiologie oder Medizin. 

 Abbildung: Abbiegung der Stereozilien durch Bewegung der Basilarmembran
Abbildung: Abbiegung der Stereozilien durch Bewegung der Basilarmembran
 (
( Abbildung): Die Haarzellen sind mittels der Retikularmembran
- einer dünnen "perforierten" bindegewebigen Platte - am Übergang
zwischen Zellkörper und Stereozilien fixiert.
Abbildung): Die Haarzellen sind mittels der Retikularmembran
- einer dünnen "perforierten" bindegewebigen Platte - am Übergang
zwischen Zellkörper und Stereozilien fixiert. 
 Abbildung: Wellenpropagation entlang der Innenohrschnecke
Abbildung: Wellenpropagation entlang der Innenohrschnecke

 Abbildung: Ein tip link
Abbildung: Ein tip link
 Abbildung).
Abbildung).
 Bei
Stereozilien sind es Kaliumionen (nicht Natrium- oder Calciumionen),
deren Einstrom in die Zelle eine Depolarisierung erzeugt.
Bei
Stereozilien sind es Kaliumionen (nicht Natrium- oder Calciumionen),
deren Einstrom in die Zelle eine Depolarisierung erzeugt.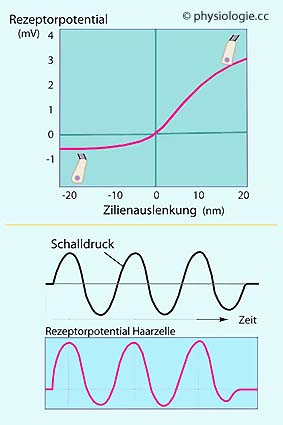
 Abbildung: Haarzellen-Rezeptorpotential
Abbildung: Haarzellen-Rezeptorpotential
 Abbildung).
Abbildung).  Innere Haarzellen (Abbildung oben) sind nicht
an der Tektorialmembran fixiert, ihre frei beweglichen Zilien werden
von der Endolymphe abgebogen, während diese im Rahmen der
Schalldetektion zwischen Tektorialmembran und Haarzellen hin- und
herströmt (hydrodynamische Kopplung).
Innere Haarzellen (Abbildung oben) sind nicht
an der Tektorialmembran fixiert, ihre frei beweglichen Zilien werden
von der Endolymphe abgebogen, während diese im Rahmen der
Schalldetektion zwischen Tektorialmembran und Haarzellen hin- und
herströmt (hydrodynamische Kopplung). 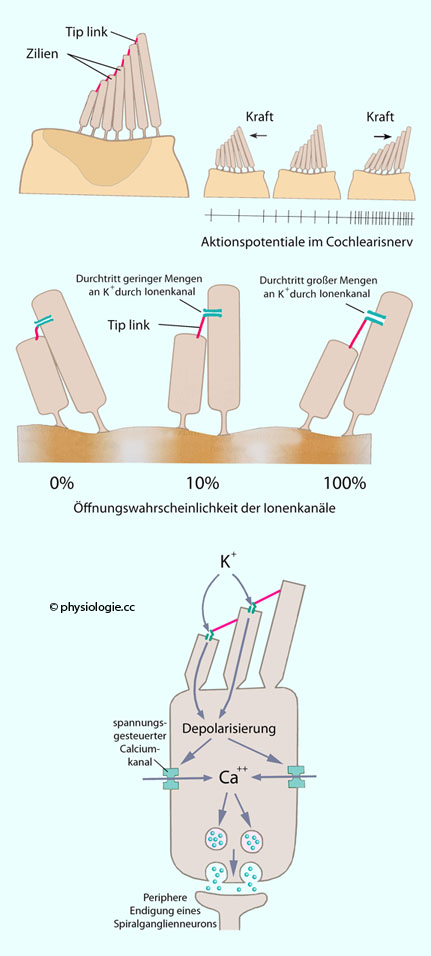
 Abbildung: Transduktion an Haarzellen im Innenohr
Abbildung: Transduktion an Haarzellen im Innenohr

 Innere Haarzellen sind auf -40 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 120 mV. Depolarisierung der Zelle bewirkt Glutamatfreisetzung.
Innere Haarzellen sind auf -40 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 120 mV. Depolarisierung der Zelle bewirkt Glutamatfreisetzung. Abbildung ganz unten).
Abbildung ganz unten). Äußere Haarzellen dienen nicht direkt der Schallanalyse, sondern der Verstärkung und Präzisierung des akustischen Signals. Ihre Zilien stehen in direktem Kontakt mit der Tektorialmembran; mechanosensible
Kalium- und Calciumkanäle in der Membran der Zilienspitze (1-2 pro
Zilium) ändern ihren Öffnungszustand entsprechend der Abwinkelung innerhalb von
Bruchteilen einer Millisekunde.
Äußere Haarzellen dienen nicht direkt der Schallanalyse, sondern der Verstärkung und Präzisierung des akustischen Signals. Ihre Zilien stehen in direktem Kontakt mit der Tektorialmembran; mechanosensible
Kalium- und Calciumkanäle in der Membran der Zilienspitze (1-2 pro
Zilium) ändern ihren Öffnungszustand entsprechend der Abwinkelung innerhalb von
Bruchteilen einer Millisekunde. 
 besteht (einige 106 Moleküle pro Zelle - s. Abbildung oben).
Die Verkürzung funktioniert anders als der kontraktile Apparat in
Muskelzellen: Sie benötigt kein ATP, kein Aktinsystem, kein
extrazelluläres Ca++; Prestin gehört zur Familie der
Anionentransporter, es reagiert auf Änderung des Membranpotentials
unmittelbar mit einer eigenen mechanischen Antwort - und zwar um Größenordnungen rascher, als das für andere Motorproteine typisch ist.
besteht (einige 106 Moleküle pro Zelle - s. Abbildung oben).
Die Verkürzung funktioniert anders als der kontraktile Apparat in
Muskelzellen: Sie benötigt kein ATP, kein Aktinsystem, kein
extrazelluläres Ca++; Prestin gehört zur Familie der
Anionentransporter, es reagiert auf Änderung des Membranpotentials
unmittelbar mit einer eigenen mechanischen Antwort - und zwar um Größenordnungen rascher, als das für andere Motorproteine typisch ist. Die Kontraktion der Haarzelle unterstützt die Aufwärtsbewegung der Basilarmembran ("cochleärer Verstärker", cochlear amplifier).
Die Kontraktion der Haarzelle unterstützt die Aufwärtsbewegung der Basilarmembran ("cochleärer Verstärker", cochlear amplifier).  Abbildung). So können auch sehr schwache akustische Reize überschwellig wirksam werden.
Abbildung). So können auch sehr schwache akustische Reize überschwellig wirksam werden. Äußere Haarzellen sind auf -70 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 150 mV. Depolarisierung der Zelle bewirkt Kontraktion des Prestins.
Äußere Haarzellen sind auf -70 mV aufgeladen; zur Endolymphe (+80 mV) ergibt sich insgesamt eine Potentialdifferenz von 150 mV. Depolarisierung der Zelle bewirkt Kontraktion des Prestins.
 Abbildung: Maximale Auslenkung der Basilarmembran in Relation zur Position in der Cochlea
Abbildung: Maximale Auslenkung der Basilarmembran in Relation zur Position in der Cochlea
 Abbildung ganz oben).
Diese sind cholinerg; sie wirken direkt auf äußere und indirekt (über
Synapsen an afferenten postsynaptischen Nervenendigungen) auf innere
Haarzellen. Acetylcholin aktiviert über ionotrope Rezeptoren den Einstrom von Ca++ in äußere Haarzellen; dies öffnet calciumaktivierte Kaliumkanäle, was die Zelle hyperpolarisiert und den Prestinmechanismus dämpft.
Abbildung ganz oben).
Diese sind cholinerg; sie wirken direkt auf äußere und indirekt (über
Synapsen an afferenten postsynaptischen Nervenendigungen) auf innere
Haarzellen. Acetylcholin aktiviert über ionotrope Rezeptoren den Einstrom von Ca++ in äußere Haarzellen; dies öffnet calciumaktivierte Kaliumkanäle, was die Zelle hyperpolarisiert und den Prestinmechanismus dämpft.  Abbildung).
Dabei durchqueren sie gap junctions, welche die ersten drei Zellreihen
verbinden, und dann eine (extrazelluläre) intrastriatale Flüssigkeit
zwischen intermediären und Marginalzellen (
Abbildung).
Dabei durchqueren sie gap junctions, welche die ersten drei Zellreihen
verbinden, und dann eine (extrazelluläre) intrastriatale Flüssigkeit
zwischen intermediären und Marginalzellen ( Abbildung). Das K+ ladet den Endolymphraum der Schnecke positiv auf (80 mV).
Abbildung). Das K+ ladet den Endolymphraum der Schnecke positiv auf (80 mV). Abbildung: Die stria vascularis sezerniert Kaliumionen in die Endolymphe
Abbildung: Die stria vascularis sezerniert Kaliumionen in die Endolymphe Bindegewebszellen des ligamentum spirale pumpen Kalium - basolateral via Na-K-Pumpe und Na/K/Cl-Symporter, apikal über gap junctions -
Bindegewebszellen des ligamentum spirale pumpen Kalium - basolateral via Na-K-Pumpe und Na/K/Cl-Symporter, apikal über gap junctions - durch Basalzellen hindurch (gap junctions) Richtung
durch Basalzellen hindurch (gap junctions) Richtung intermediäre Zellen,
diese weiter - über Kaliumkanäle - in den interstitiellen Spaltraum
(mit "intrastrialer" Flüssigkeit - diese ist bereits auf ~90 mV
aufgeladen) zu - die scala media auskleidenden -
intermediäre Zellen,
diese weiter - über Kaliumkanäle - in den interstitiellen Spaltraum
(mit "intrastrialer" Flüssigkeit - diese ist bereits auf ~90 mV
aufgeladen) zu - die scala media auskleidenden - spazialisierten Marginalzellen (vestibular dark cells), die basolateral mittels Na-K-Pumpe und Na/K/Cl-Symporter Kalium anreichern und apikal per Kaliumkanälen in die Endolymphe exportieren.
spazialisierten Marginalzellen (vestibular dark cells), die basolateral mittels Na-K-Pumpe und Na/K/Cl-Symporter Kalium anreichern und apikal per Kaliumkanälen in die Endolymphe exportieren.

 Abbildung: Vorgänge an einer inneren Haarzelle (Spannungswerte entsprechen einer "Momentaufnahme" und sind dynamisch)
Abbildung: Vorgänge an einer inneren Haarzelle (Spannungswerte entsprechen einer "Momentaufnahme" und sind dynamisch)

 Die Kaliumkonzentration in der Endolymphe ist so hoch, dass das Kalium-Gleichgewichtspotential ~0 mV beträgt.
Die Kaliumkonzentration in der Endolymphe ist so hoch, dass das Kalium-Gleichgewichtspotential ~0 mV beträgt.  Dazu kommt das endocochleäre Potential - der elektrische Gradient an der Membran beträgt um die 130 mV und treibt K+ durch offene Kaliumkanäle in die Zelle - das verringert das Membranpotential.
Dazu kommt das endocochleäre Potential - der elektrische Gradient an der Membran beträgt um die 130 mV und treibt K+ durch offene Kaliumkanäle in die Zelle - das verringert das Membranpotential.
 Abbildung: Signaltransduktion in Haarzellen
Abbildung: Signaltransduktion in Haarzellen 
 Zur Physiologie von Haarzellen s. auch dort
Zur Physiologie von Haarzellen s. auch dort

 Abbildung: Innervation der Haarzellen durch Neurone des ganglion spirale
Abbildung: Innervation der Haarzellen durch Neurone des ganglion spirale
 Abbildung). Diese Anordnung ist nicht redundant: Die
empfindlichsten Neurone haben den synaptischen Kontakt zu ihrer
Haarzelle an der äußeren Seite, die am wenigsten empfindlichen auf der
achsennahen Seite einer inneren Haarzelle. So werden verschieden starke
Reizungen jeder einzelnen inneren Haarzelle über unterschiedliche
Afferenzkanäle codiert.
Abbildung). Diese Anordnung ist nicht redundant: Die
empfindlichsten Neurone haben den synaptischen Kontakt zu ihrer
Haarzelle an der äußeren Seite, die am wenigsten empfindlichen auf der
achsennahen Seite einer inneren Haarzelle. So werden verschieden starke
Reizungen jeder einzelnen inneren Haarzelle über unterschiedliche
Afferenzkanäle codiert. Nebenwirkung: Schleifendiuretika (z.B. Furosemid) wirken diuretisch, indem sie den Na+-K+-2Cl--Transporter
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife hemmen.
Allerdings blockieren sie auch einen analogen Cotransporter in der
stria vascularis, worauf die Kalium-Konzentration in der Endolymphe und
damit das für die akustische Reiztransduktion notwendige cochleäre
Potential (s. oben) absinkt. Die Folge ist Taubheit, die zuerst reversibel, später bleibend ist. Daher gelten Schleifendiuretika als ototoxisch.
Nebenwirkung: Schleifendiuretika (z.B. Furosemid) wirken diuretisch, indem sie den Na+-K+-2Cl--Transporter
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife hemmen.
Allerdings blockieren sie auch einen analogen Cotransporter in der
stria vascularis, worauf die Kalium-Konzentration in der Endolymphe und
damit das für die akustische Reiztransduktion notwendige cochleäre
Potential (s. oben) absinkt. Die Folge ist Taubheit, die zuerst reversibel, später bleibend ist. Daher gelten Schleifendiuretika als ototoxisch. 
 Die Intensität eines Schalls korreliert mit der Stärke der
Druckschwankungen, die er hervorruft. Der Schalldruckpegel ändert sich
mit dem Quadrat (Hochzahl 2)
des Quotienten zweier Schalldrucke. 1 Bel
entspricht 2.log(p/po), für den Referenzdruck (po) wurde ein Wert von 2.10-5 Pa festgelegt. Der Schalldruckpegel (SPL = sound pressure level) wird in dezi-Bel, dB(A) als 20.log(p/po)
errechnet (ein Dezi-Bel ist ein Zehntel Bel, aus "2" wird in der Formel
"20"). Die Zunahme des Schalldruckpegels um 20 dB entspricht einer
Verzehnfachung des Schalldrucks
Die Intensität eines Schalls korreliert mit der Stärke der
Druckschwankungen, die er hervorruft. Der Schalldruckpegel ändert sich
mit dem Quadrat (Hochzahl 2)
des Quotienten zweier Schalldrucke. 1 Bel
entspricht 2.log(p/po), für den Referenzdruck (po) wurde ein Wert von 2.10-5 Pa festgelegt. Der Schalldruckpegel (SPL = sound pressure level) wird in dezi-Bel, dB(A) als 20.log(p/po)
errechnet (ein Dezi-Bel ist ein Zehntel Bel, aus "2" wird in der Formel
"20"). Die Zunahme des Schalldruckpegels um 20 dB entspricht einer
Verzehnfachung des Schalldrucks Die Empfindlichkeit des Ohres ist frequenzabhängig; am höchsten ist sie
zwischen ~1 und ~5 kHz. Die Untergrenze des menschlichen Hörvermögens
liegt bei 16-20
Hz, die obere bei 16-20 kHz, mit dem Alter abnehmend (Presbyakusis: Hörverlust im Frequenzbereich >5 kHz).
Die Empfindlichkeit des Ohres kann wechseln (Stapediusreflex).
Intensive Beschallung reduziert vorübergehend die Empfindlichkeit (TTS:
transitory threshold shift); länger andauernde intensive Beschallung bewirkt
permanente Hörschäden (PTS: permanent threshold shift)
Die Empfindlichkeit des Ohres ist frequenzabhängig; am höchsten ist sie
zwischen ~1 und ~5 kHz. Die Untergrenze des menschlichen Hörvermögens
liegt bei 16-20
Hz, die obere bei 16-20 kHz, mit dem Alter abnehmend (Presbyakusis: Hörverlust im Frequenzbereich >5 kHz).
Die Empfindlichkeit des Ohres kann wechseln (Stapediusreflex).
Intensive Beschallung reduziert vorübergehend die Empfindlichkeit (TTS:
transitory threshold shift); länger andauernde intensive Beschallung bewirkt
permanente Hörschäden (PTS: permanent threshold shift) Die subjektiv empfundene
Lautheit wird über den Lautstärkepegel quantifiziert (Einheit: Phon).
Töne, die als gleich laut wahrgenommen werden (Isophone), haben den selben
Phonwert. Bei 1 kHz stimmen
Dezibel- und Phon-Skala definitionsgemäß überein
Die subjektiv empfundene
Lautheit wird über den Lautstärkepegel quantifiziert (Einheit: Phon).
Töne, die als gleich laut wahrgenommen werden (Isophone), haben den selben
Phonwert. Bei 1 kHz stimmen
Dezibel- und Phon-Skala definitionsgemäß überein Um zwei Töne als verschieden laut zu empfinden,
muss sich ihr Schalldruckpegel um mindestens 1 dB unterscheiden
(Intensitäts- Unterschiedsschswelle). Die Frequenz-
Unterschiedsschwelle hängt von der Tonhöhe ab: Bei 1000 Hz ~3 Hz, darüber oder darunter >3 Hz
Um zwei Töne als verschieden laut zu empfinden,
muss sich ihr Schalldruckpegel um mindestens 1 dB unterscheiden
(Intensitäts- Unterschiedsschswelle). Die Frequenz-
Unterschiedsschwelle hängt von der Tonhöhe ab: Bei 1000 Hz ~3 Hz, darüber oder darunter >3 Hz  Die Gehörknöchelchenkette dient der Impedanzanpassung Luft - Wasser (Erhöhung des Schalldrucks um den Faktor 23).
Die Mittelohrmuskeln dämpfen bei hohen (>90 dB) Schalldrucken die
Schallübertragung: Der m. stapedius reduziert die Kraftübertragung auf
das ovale Fenster (Stapediusreflex), der m. tensor tympani versteift das
Trommelfell. Der Reflex hat eine Latenz von ≤0,1 s und
dämpft wahrscheinlich auch die Wahrnehmung der eigenen Stimme. Die tuba
auditiva (Eustachii) dient dem Druckausgleich und dem Abtransport von
Sekret zum Rachen (Reinigung, Infektionsschutz)
Die Gehörknöchelchenkette dient der Impedanzanpassung Luft - Wasser (Erhöhung des Schalldrucks um den Faktor 23).
Die Mittelohrmuskeln dämpfen bei hohen (>90 dB) Schalldrucken die
Schallübertragung: Der m. stapedius reduziert die Kraftübertragung auf
das ovale Fenster (Stapediusreflex), der m. tensor tympani versteift das
Trommelfell. Der Reflex hat eine Latenz von ≤0,1 s und
dämpft wahrscheinlich auch die Wahrnehmung der eigenen Stimme. Die tuba
auditiva (Eustachii) dient dem Druckausgleich und dem Abtransport von
Sekret zum Rachen (Reinigung, Infektionsschutz) In der Innenohrschnecke bestimmt der zeitliche Abstand der Druckwellen
(Wanderwellen, Amplitude höchstens einige Nanometer), die durch die
scala vestibuli laufen, den Ort, an dem sie die scala media maximal
auslenken (Abbildungsort einer Frequenz). Ihre Geschwindigkeit nimmt
ab, bis sie sich überlagern: Hohe Töne werden hahe dem ovalen Fenster
abgebildet, tiefe näher am Helikotrema (Tonotopie
entlang des Corti'schen Organs). Zur Ortsanalyse kommt bei tieferen
Frequenzen Periodizitätsanalyse: Aktionspotentiale in den afferenten
Fasern des Hörnerven stehen in fester Relation zur Phase des
Rezeptorpotentials der zugehörigen Haarzellen
In der Innenohrschnecke bestimmt der zeitliche Abstand der Druckwellen
(Wanderwellen, Amplitude höchstens einige Nanometer), die durch die
scala vestibuli laufen, den Ort, an dem sie die scala media maximal
auslenken (Abbildungsort einer Frequenz). Ihre Geschwindigkeit nimmt
ab, bis sie sich überlagern: Hohe Töne werden hahe dem ovalen Fenster
abgebildet, tiefe näher am Helikotrema (Tonotopie
entlang des Corti'schen Organs). Zur Ortsanalyse kommt bei tieferen
Frequenzen Periodizitätsanalyse: Aktionspotentiale in den afferenten
Fasern des Hörnerven stehen in fester Relation zur Phase des
Rezeptorpotentials der zugehörigen Haarzellen Im Corti-Organ sind Haarzellen mittels Retikularmembran fixiert.
Schwingt die Basilarmembran, nimmt sie das Corti'sche Organ mit;
Relativbewegungen zur Tektorialmembran biegen Stereozilien der äußeren,
Endolymphströmungen die der inneren Haarzellen. Letztere bilden in
Abhängigkeit von ihrer Abbiegung Rezeptorpotenziale
(Generatorpotentiale). Öffnung spannungsabhängiger Ca++-Kanäle setzt Glutamat frei, dieses erregt afferente Nervenfasern
Im Corti-Organ sind Haarzellen mittels Retikularmembran fixiert.
Schwingt die Basilarmembran, nimmt sie das Corti'sche Organ mit;
Relativbewegungen zur Tektorialmembran biegen Stereozilien der äußeren,
Endolymphströmungen die der inneren Haarzellen. Letztere bilden in
Abhängigkeit von ihrer Abbiegung Rezeptorpotenziale
(Generatorpotentiale). Öffnung spannungsabhängiger Ca++-Kanäle setzt Glutamat frei, dieses erregt afferente Nervenfasern Innere Haarzellen haben
synaptische Kontakte zu afferenten Fasern des Hörnerven, deren
Aktionspotentiale sind mit dem Rezeptorpotential phasengekoppelt. Mit
der Stärke des Reizes nimmt die Zahl der aktivierten Neuronen zu
(Lautstärkencodierung). Kaliumkanäle in den Zilien der Haarzellen sind
miteinander durch molekulare Brücken (tip links)
verbunden. Werden letztere angespannt, öffnen Kaliumkanäle, die folgende
Depolarisation öffnet spannungsabhängige Calciumkanäle,
Glutamat wird freigesetzt. Bei niedrigen Frequenzen folgt das Rezeptorpotential der inneren
Haarzellen den Schwingungen der Basilarmembran, bei höheren ist der
Kaliumeinstrom eher kontinuierlich. ~95% der afferenten Fasern im Hörnerven beziehen ihre Information von inneren Haarzellen
Innere Haarzellen haben
synaptische Kontakte zu afferenten Fasern des Hörnerven, deren
Aktionspotentiale sind mit dem Rezeptorpotential phasengekoppelt. Mit
der Stärke des Reizes nimmt die Zahl der aktivierten Neuronen zu
(Lautstärkencodierung). Kaliumkanäle in den Zilien der Haarzellen sind
miteinander durch molekulare Brücken (tip links)
verbunden. Werden letztere angespannt, öffnen Kaliumkanäle, die folgende
Depolarisation öffnet spannungsabhängige Calciumkanäle,
Glutamat wird freigesetzt. Bei niedrigen Frequenzen folgt das Rezeptorpotential der inneren
Haarzellen den Schwingungen der Basilarmembran, bei höheren ist der
Kaliumeinstrom eher kontinuierlich. ~95% der afferenten Fasern im Hörnerven beziehen ihre Information von inneren Haarzellen Äußere
Haarzellen verstärken das akustische Signal mittels des kontraktilen Proteins Prestin ("elektromechanische
Transduktion"). Der cochleäre
Verstärker bewirkt eine Verhundertfachung der Auslenkung der
Basilarmembran
Äußere
Haarzellen verstärken das akustische Signal mittels des kontraktilen Proteins Prestin ("elektromechanische
Transduktion"). Der cochleäre
Verstärker bewirkt eine Verhundertfachung der Auslenkung der
Basilarmembran Endocochleäres Potential: Die
stria vascularis sezerniert Kaliumionen über
vier Zelllagen in die Endolymphe: Gegenüber der Perilymphe bzw. dem
umgebenden Extrazellulärraum ist sie positiv aufgeladen. Das
Gesamtpotential zwischen Haarzelle (intrazellulär -70 mV) und
Endolymphe (extrazellulär +80 mV) beträgt somit ~150 mV. Das
Ruhepotential der Haarzellen addiert sich auf das endocochleäre
Potential; dies steigert die Empfindlichkeit der
Hördetektion (hoher elektrochemischer Gradient für den
K+-Einstrom in die Haarzelle). Schleifendiuretika (Furosemid) blockieren den Na/K/2Cl-Cotransporter
in der stria vascularis, senken die Kalium-Konzentration in der
Endolymphe und damit das cochleäre Potential. Die Folge ist Taubheit, Schleifendiuretika wirken
ototoxisch
Endocochleäres Potential: Die
stria vascularis sezerniert Kaliumionen über
vier Zelllagen in die Endolymphe: Gegenüber der Perilymphe bzw. dem
umgebenden Extrazellulärraum ist sie positiv aufgeladen. Das
Gesamtpotential zwischen Haarzelle (intrazellulär -70 mV) und
Endolymphe (extrazellulär +80 mV) beträgt somit ~150 mV. Das
Ruhepotential der Haarzellen addiert sich auf das endocochleäre
Potential; dies steigert die Empfindlichkeit der
Hördetektion (hoher elektrochemischer Gradient für den
K+-Einstrom in die Haarzelle). Schleifendiuretika (Furosemid) blockieren den Na/K/2Cl-Cotransporter
in der stria vascularis, senken die Kalium-Konzentration in der
Endolymphe und damit das cochleäre Potential. Die Folge ist Taubheit, Schleifendiuretika wirken
ototoxisch Verschaltung auf afferente Fasern des Hörnerven: Der N. cochlearis ist
Teil des VIII. Hirnnerven; die Somata seiner Nervenzellen liegen im
Spiralganglion. Die meisten (95%) seiner bis zu ~40.000 Neurone
kommunizieren mit ~4000 inneren Haarzellen: Jede von ihnen projiziert
auf etwa 10 afferente Neuronen
Verschaltung auf afferente Fasern des Hörnerven: Der N. cochlearis ist
Teil des VIII. Hirnnerven; die Somata seiner Nervenzellen liegen im
Spiralganglion. Die meisten (95%) seiner bis zu ~40.000 Neurone
kommunizieren mit ~4000 inneren Haarzellen: Jede von ihnen projiziert
auf etwa 10 afferente Neuronen