Lebenszyklus: Entwicklung, Reifung, Alterung
© H. Hinghofer-Szalkay
 Amadori-Verbindungen: Mario Amadori
Amadori-Verbindungen: Mario Amadori
Gerontologie: γέρων = Greis, λόγος = Lehre
Hayflick-Grenze: Leonard Hayflick
Hormese: ὁρμᾶω = antreiben, bewegen
Maillard-Reaktion: Lous C. Maillard
Presbyakusis: πρέσβυσ = alt, ἀκούειν = hören
Presbyopie: πρέσβυσ = alt, ὤψ = Auge
Progerie: πρό = vor, γέρων = Greis („frühes Alter“)
Telomer, Telomerase: τέλος = Ende, μέρος = Teil
Yamanaka-Faktoren: Shinya Yamanaka
Altersbedingte
Veränderungen treten in jeder Lebensphase auf; vom Embryonalalter an
passen sich Körpersysteme ständig an variable Bedingungen an.
Unmittelbar nach der Geburt kommt es zu massiven
Umstellungen; in der Kindheit
dominieren Wachstum und Entwicklung; im frühen Erwachsenenalter sind
die Körpersysteme maximal belastbar; in
höherem Alter treten Einschränkungen der Leistungsreserven auf, was durch Inaktivität beschleunigt, durch (physisches und mentales) Training verzögert oder aufgehalten werden kann.
Physiologische
Alterungsvorgänge spielen sich auf molekularer, genetischer, chromosomaler,
zellulärer, organismischer und systemischer Ebene ab. Die Wissenschaft von physiologischen Alterungsvorgängen heißt Gerontologie.
Zu den typischen Alterungszeichen gehören z.B. Einschränkung der Akkommodationskraft durch Abnahme der Linsenelastizität (Presbyopie), Verringerung des Hörvermögens durch herabgesetzte Neuronenzahl (Presbyakusis), abnehmende immunologische Kapazität (Infektanfälligkeit) und vieles andere mehr.
Der Alterung liegen unterschiedliche Mechanismen zugrunde, z.B.
-- Abnehmende Belastung senkt Widerstandskraft und Funktionsfähigkeit vieler Systeme (Inaktivitätsatrophie)
-- Die Bandbreite von Reaktionen des Immunsystems auf
mikrobiologische Herausforderungen nimmt ab (Infektanfälligkeit, Krebsneigung)
-- Der Stoffwechsel erzeugt laufend reaktionsfreudige Moleküle (Radikale),
die Nukleinsäuren, Proteine und Lipide verändern (oxidativer Stress).
Der Organismus schützt sich mit Antioxidantien und
Reparaturmechanismen: “Radikalfänger” (Vitamine, Enzyme) machen
freie Radikale unschädlich, DNA-Schäden werden korrigiert (repair) - Fähigkeiten, die in höherem Alter abnehmen. Ob Radikale das Altern tatsächlich beeinflussen, ist strittig
-- Der lebenslange Energieumsatz (Glucoseabbau, Sauerstoffverbrauch) wirkt im Sinne molekularer Veränderungen (Glykosylierung von Proteinen), die mit Alterungsprozessen zusammenhängen (AGEs = advanced glycosylation end-products).
Kalorienarme Ernährung kann den Alterungsprozess bremsen, sofern genügend essentielle Nährstoffe zugeführt werden (Calorie restriction with optimal nutrition).
|
Übersicht  Radikale und Lebenserwartung
Radikale und Lebenserwartung
 Stoffwechsel
Stoffwechsel  Verdauungssystem
Verdauungssystem  Bewegungssystem
Bewegungssystem  Haut
Haut  Kreislauf
Kreislauf  Immunsystem
Immunsystem  Niere
Niere  Atmung
Atmung  Sinne
Sinne  Nervensystem
Nervensystem  Sexualfunktionen
Sexualfunktionen
 Radikal, Nukleophilie
Radikal, Nukleophilie
 Core messages
Core messages
Der
folgende Abschnitt skizziert altersabhängige Veränderungen der menschlichen
Physiologie - von der Geburt über die Wachstums- bzw.
Entwicklungsphase, den Gipfel der Leistungsfähigkeit ("Vitalität") in
der Adoleszenz bis zu Alterung und Seneszenz. Typische Zeitverläufe
machen sich nicht nur in der Körpergröße (Maximum bei Frauen um 16-17, bei Männern um 18-19 Jahre), Körpermasse (meist ab 70 Jahren Alter abnehmend), Körperzusammensetzung
(Zunahme des abdominellen Fettgewebes, meist Abnahme der Muskelmasse in
höherem Alter) bemerkbar, sondern in praktisch allen Körpersystemen
(wie weiter unten beschrieben) - individuell unterschiedlich,
doch klaren Mustern folgend.
Diese Veränderungen spielen sich auf
mehreren Ebenen ab:
 Molekular (z.B. Reaktionen mit freien Radikalen),
Molekular (z.B. Reaktionen mit freien Radikalen),
 zellulär (z.B.
mitochondrielle Schäden, replikative Zellalterung - mit zunehmendem Lebensalter sinkt die zelluläre
Reparations- und Teilungsfähigkeit),
zellulär (z.B.
mitochondrielle Schäden, replikative Zellalterung - mit zunehmendem Lebensalter sinkt die zelluläre
Reparations- und Teilungsfähigkeit),
 systemisch (z.B. Schwächung immunologischer
Mechanismen),
systemisch (z.B. Schwächung immunologischer
Mechanismen),
 umweltbezogen (z.B. Lärm, Luft,
Wasser, Ernährung).
umweltbezogen (z.B. Lärm, Luft,
Wasser, Ernährung).
Zahlreiche Normwerte und Referenzbereiche sind vom
Lebensalter abhängig. Angaben bezüglich physiologischer Zustandsvariablen
beziehen sich meist auf (junge) Erwachsene (was nicht immer dazugesagt wird).
Die meisten Systeme und Funktionen sind im frühen Erwachsenenalter am stärksten belastbar und anpassungsfähig.
Die Funktionsstärke
und Belastbarkeit physiologischer Systeme ist altersabhängig
Neugeborene haben das höchste Entwicklungspotential, ihre Organe
sind allerdings noch nicht vollständig ausgebildet (z.B. Niere, Leber,
s. unten). Wie sich "Alterung"
einer konkreten physiologischen Leistung bzw. in einem bestimmten
System auswirkt und ob dies als vor- oder nachteilig betrachtet werden
kann,
ist im jeweiligen Zusammenhang zu beurteilen.
Aus dem Altern resultieren Veränderungen, die sowohl als Schwächen (Funktions- und
Leistungseinbußen) als auch als Stärken interpretiert werden können (Erfahrung, Wissen, Fähigkeiten, Handlungsstrategien).
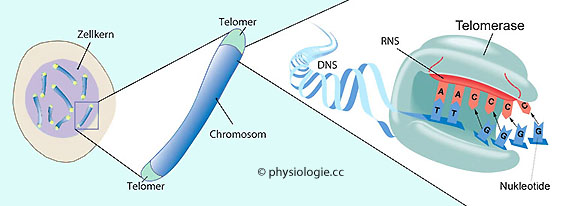
 Abbildung: Telomer und Telomerase
Abbildung: Telomer und Telomerase
Modifiziert nach einer Vorlage in Nature, April 25, 2010 / Watching the Detectives
Telomere bilden eine schützende "Abschlusskappe" an beiden Enden von Chromosomen. Sie bestehen aus mehreren tausend nichtkodierenden, repetitiven, aus 6 Nukleotiden bestehenden DNA-Sequenzen
(beim Menschen TTAGGG, in der Abbildung TTGGGG) und Begleitproteinen.
Sie stellen (sehr vereinfacht dargestellt) sicher, dass Reparaturenzyme
das Chromosomenende (terminale DNA) nicht als Strangbruch
interpretieren.
Bei jeder mitotischen Teilung gehen jeweils 50-100 Basenpaare von den Telomeren verloren, was diese schrittweise verkürzt. Das Ribonukleoprotein Telomerase stellt die Telomerlänge wieder her, indem TTAGGG-Sequenzen "aufgefüllt" werden. Dabei nutzt sie eine
RNA-Matritze (rot dargestellt), die Teil des Enzyms ist.
Telomerase wird nicht von allen Zellen gebildet: Nur Gameten und Stammzellen (insbesondere
in Knochenmark und Darmschleimhaut) exprimieren sie zeitlebens und können sich daher unbegrenzt teilen. (Das trifft auch auf Malignomzellen zu.) Bei den meisten
Zellarten nimmt hingegen die Telomeraseaktivität ab und verschwindet schließlich
ganz, die Zelle teilt sich nicht weiter (z.B. stellen die meisten Nervenzellen ihre Teilungsaktivität ganz ein). Theoretisch würde die "Hayflick-Grenze"  nach ca. 50 Teilungen keine
weitere Mitose mehr zulassen; dieses Limit wird allerdings kaum
erreicht, da die meisten somatischen Zellen innerhalb der erreichbaren
Lebensspanne weniger Mitosen durchlaufen
nach ca. 50 Teilungen keine
weitere Mitose mehr zulassen; dieses Limit wird allerdings kaum
erreicht, da die meisten somatischen Zellen innerhalb der erreichbaren
Lebensspanne weniger Mitosen durchlaufen

Das maximal erreichbare Alter
des Menschen wird mit ~120 Jahren angenommen ( : Jeanne Calment wurde 122,
: Jeanne Calment wurde 122,  : Jiroemon Kimura 116 Jahre alt - mit Stand Ende 2025 sind die ältesten zehn lebenden Menschen Frauen). Die Telomerenlänge
(
: Jiroemon Kimura 116 Jahre alt - mit Stand Ende 2025 sind die ältesten zehn lebenden Menschen Frauen). Die Telomerenlänge
( Abbildung) scheint nicht der limitierende Faktor für die Lebenserwartung zu sein, vielmehr hängt die
Alterung von der Kombination zahlreicher anderer Faktoren ab. Eine wichtige Rolle spielt die Ausgewogenheit:
Abbildung) scheint nicht der limitierende Faktor für die Lebenserwartung zu sein, vielmehr hängt die
Alterung von der Kombination zahlreicher anderer Faktoren ab. Eine wichtige Rolle spielt die Ausgewogenheit:
 Nicht nur langzeitig zu starke Belastung des Körpers senkt die Lebensdauer: Auch die Unterforderung physiologischer Systeme führt zum Nachlassen von Leistungsfähigkeit und
Widerstandskraft (deconditioning). Das Optimum liegt im Mittelbereich, zwischen den Extremen.
Nicht nur langzeitig zu starke Belastung des Körpers senkt die Lebensdauer: Auch die Unterforderung physiologischer Systeme führt zum Nachlassen von Leistungsfähigkeit und
Widerstandskraft (deconditioning). Das Optimum liegt im Mittelbereich, zwischen den Extremen.
 So bewirkt Bettlägrigkeit (oder Schwerelosigkeit) Schwund
der Knochen- und Muskelmasse (geringere mechanische Belastung
verschiebt das Funktionsgleichgewicht in Richtung Abbau) und
So bewirkt Bettlägrigkeit (oder Schwerelosigkeit) Schwund
der Knochen- und Muskelmasse (geringere mechanische Belastung
verschiebt das Funktionsgleichgewicht in Richtung Abbau) und
 Kreislaufprobleme (Ausbleiben orthostatischer Belastung reduziert das
Blutdruckregulationsvermögen);
Kreislaufprobleme (Ausbleiben orthostatischer Belastung reduziert das
Blutdruckregulationsvermögen);
 übertriebene Hygiene kann zu immunologischen Komplikationen führen (mangelnde Herausforderung des
Immunsystems).
übertriebene Hygiene kann zu immunologischen Komplikationen führen (mangelnde Herausforderung des
Immunsystems).
Man kann Faktoren des Alterungsprozesses in Kategorien einteilen:
 So versteht man unter "primärem" Altern (primary aging) intrinsische
Veränderungen, die mit zunehmenden Lebensjahren unabhängig von
Umwelteinflüssen bzw. Krankheiten auftreten, im Gegensatz zu
So versteht man unter "primärem" Altern (primary aging) intrinsische
Veränderungen, die mit zunehmenden Lebensjahren unabhängig von
Umwelteinflüssen bzw. Krankheiten auftreten, im Gegensatz zu
 "sekundärem" Altern (secondary aging), das auf einer Kombination von intrinsischem Altern und Krankheits- bzw. Umwelteinflüssen beruht (z.B. Infektionen).
"sekundärem" Altern (secondary aging), das auf einer Kombination von intrinsischem Altern und Krankheits- bzw. Umwelteinflüssen beruht (z.B. Infektionen).
 Gerontologie
Gerontologie
 beschäftigt sich mit physiologischen Alterungsvorgängen (Geriatrie beschäftigt sich hingegen mit altersbedingten Krankheiten).
beschäftigt sich mit physiologischen Alterungsvorgängen (Geriatrie beschäftigt sich hingegen mit altersbedingten Krankheiten).
Die seltene
Erkrankung Progerie
 zeigt, dass
Altern nicht einfach als “natürlicher Verschleiß” aufgefasst werden
kann: Personen, die an Progerie leiden, haben Defekte der Reparaturmechanismen, die
normalerweise physiologische Verschleißerscheinungen vollkommen beheben können.
zeigt, dass
Altern nicht einfach als “natürlicher Verschleiß” aufgefasst werden
kann: Personen, die an Progerie leiden, haben Defekte der Reparaturmechanismen, die
normalerweise physiologische Verschleißerscheinungen vollkommen beheben können.
Die DNA-Repair-Theorie der Alterung besagt, dass alterungsbedingte Veränderungen mit abnehmender DNA-Reparaturkapazität
verknüpft sind. Dadurch nimmt die Integrität des Genoms mit zunehmender
Lebenszeit ab, mit der Folge fehlerhafter Transkriptionsprodukte. Dazu
kommt, dass die Verweildauer von Proteinen
im Körper zunimmt, d.h. der Umsatz abnimmt, und damit die Zahl
fehlerhafter bzw. "gealterter" Eiweißmoleküle ansteigt - etwa im
Bindegewebe (Kollagen, Elastin oxidieren, lagern Zuckerreste an und
vernetzen sich). Auch nimmt die Kapazität von Lysosomen in den Zellen ab, was den Abbau von Stoffwechselendprodukten verlangsamt.
Verschiedene Maßnahmen (hochwertige Kost, Lebensstil etc) und gesundheitserhaltende Stoffe
(z.B. Sirtuine: "Anti-Aging-Enzyme"?) können Faktoren beeinflussen, die mit zunehmendem Alter bedeutsam werden. Einige Transkriptionsfaktoren ("Yamanaka factors" )
können differenzierte somatische Zellen zu pluripotenten Zellen
reprogrammieren, was Anlass zu Überlegungen über die Möglichkeit eines
lebensverlängernden Einsatzes "verjüngter" stammzellähnlicher (embryonic stem cell-like cells) bzw. induzierter pluripotenter Zellen (iPSCs) gibt.
)
können differenzierte somatische Zellen zu pluripotenten Zellen
reprogrammieren, was Anlass zu Überlegungen über die Möglichkeit eines
lebensverlängernden Einsatzes "verjüngter" stammzellähnlicher (embryonic stem cell-like cells) bzw. induzierter pluripotenter Zellen (iPSCs) gibt.
Ein wichtiger Aspekt ist der Energieumsatz: Versuchstiere, die mit
hochwertigem, aber kalorienarmem Futter ernährt werden, zeigen eine
Lebensverlängerung bis zu ~50% (high / low diet, CRON - Calorie Restriction with Optimal Nutrition
- reich an essentiellen Nahrungsbestandteilen, aber energiearm).
Sauerstoffradikale und Lebenserwartung
 Unter einem Radikal versteht
man ein Molekül oder Atom mit einem oder mehreren freien
Valenzelektronen, die ihm eine hohe Reaktionsfreudigkeit mit anderen
Teilchen verleihen. Radikale haben eine potentiell
gewebeschädigende Wirkung (z.B. im Rahmen der angeborenen Immunität zur
Bekämpfung in das Gewebe gelangter Mikroorganismen).
Unter einem Radikal versteht
man ein Molekül oder Atom mit einem oder mehreren freien
Valenzelektronen, die ihm eine hohe Reaktionsfreudigkeit mit anderen
Teilchen verleihen. Radikale haben eine potentiell
gewebeschädigende Wirkung (z.B. im Rahmen der angeborenen Immunität zur
Bekämpfung in das Gewebe gelangter Mikroorganismen).
Beispiele sind Superoxide (Hyperoxide, z.B. zwei Sauerstoffatome mit einem freien Elektron: O2--Anion), Peroxide (Wasserstoffperoxid H2O2), das Hydroxylradikal (OH-) oder Stickstoffmonoxid (NO mit einem freien Elektron am Stickstoffatom). Diese sind extrem instabil und reagieren (als Supernukleophile:
Nukleophilie ist die Fähigkeit, ein Elektronenpaar für eine Bindung
bereitzustellen) mit umliegenden Reaktionspartnern sofort weiter - oder
sie zerfallen zu Radikalen (R-O-O-R → 2 R-O*).
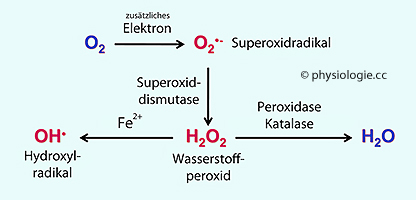
 Abbildung: Sauerstoffradikale (ROS, reactive oxygen species)
Abbildung: Sauerstoffradikale (ROS, reactive oxygen species)
Nach Sullivan LB, Chandel NS. Mitochondrial reactive oxygen species and cancer. Cancer & Metabolism 2014; 2:17-29
Superoxidradikale
entstehen aus Sauerstoff durch Zufügen eines freien Elektrons durch
eine Elektronenlücke in der mitochondrialen Transportkette oder durch
Aktivität der NADHP-Oxidase. Superoxiddismutase (SOD) verwandelt das
Superoxid in Wasserstoffperoxid. Zweiwertiges Eisen kann daraus extrem
reaktionsfreudige Hydroxylradikale machen (Fenton-Reaktion), welche die
Zelle schädigen können.
Peroxidasen, Katalase u.a. lassen aus Wasserstoffperoxid H2O entstehen

Damit
hängt auch die Wirkung von Sauerstoff- und Stickstoffradikalen (ROS reactive oxygen species -  Abbildung; RNA reactive nitrogen species) zusammen (nicht alle "reaktiven Spezies"
sind freie Radikale). Der
(insbesondere mitochondriale) Stoffwechsel erzeugt reaktionsfreudige Moleküle,
die Zellen schädigen können: Nukleinsäuren, Proteine und Lipide nehmen
in erster Linie Schaden (oxidativer Stress).
Abbildung; RNA reactive nitrogen species) zusammen (nicht alle "reaktiven Spezies"
sind freie Radikale). Der
(insbesondere mitochondriale) Stoffwechsel erzeugt reaktionsfreudige Moleküle,
die Zellen schädigen können: Nukleinsäuren, Proteine und Lipide nehmen
in erster Linie Schaden (oxidativer Stress).
Die quantitativ führende ROS-Quelle ist die Elektronentransportkette der Mitochondrien (Superoxiddismutase verwandelt O2--Anionen zu H2O2, das zu hochreaktiven OH-Ionen werden kann). Zwar
gelangt nur <1% des verstoffwechselten Sauerstoffs in diesen Weg,
doch schon diese Menge kann ohne protektive Mechanismen
(Antioxidantien) fatale Wirkung haben. Während genomische DNA durch Histone
geschützt ist, trifft das auf mitochondrielle DNA (mtDNA) nicht zu, und
mtDNA weist mit zunehmendem Alter Veränderungen auf, was zu erhöhter
Radikalwirkung führt (Theorie der mitochondrialen Alterung).
Sauerstoffradikale haben auch physiologische Funktionen:
 So nutzen Makrophagen und neutrophile Granulozyten ROS zur Abtötung von Baktrerien - dabei entsteht ein respiratory burst (oxidativer Burst), hochreaktive Hydroxylradikale (O2-) helfen beim Abbau attackierter Mikroorganismen. ROS sind eine wichtige Komponente der Immunantwort, um Pathogene abzutöten.
So nutzen Makrophagen und neutrophile Granulozyten ROS zur Abtötung von Baktrerien - dabei entsteht ein respiratory burst (oxidativer Burst), hochreaktive Hydroxylradikale (O2-) helfen beim Abbau attackierter Mikroorganismen. ROS sind eine wichtige Komponente der Immunantwort, um Pathogene abzutöten.
 Follikelzellen der Schilddrüse bilden Enzyme (Thyreoperoxidase und duale Oxidase), die via Wasserstoffperoxid Jodid (I-) zu Jod oxidieren, das dann in das Hormonmolekül integriert wird.
Follikelzellen der Schilddrüse bilden Enzyme (Thyreoperoxidase und duale Oxidase), die via Wasserstoffperoxid Jodid (I-) zu Jod oxidieren, das dann in das Hormonmolekül integriert wird.
Antioxidantien wie die
Vitamine A, C, und E und Enzyme wie Superoxiddismutase
(wandelt Superoxid-Anionen O2- zu Wasserstoffperoxid H2O2 um) sowie Glutathionperoxidase
(reduziert Peroxide,  Abbildung) verlangsamen oder verhindern die
Oxidation anderer Substanzen und machen Radikale unschädlich (“Radikalfänger”).
Abbildung) verlangsamen oder verhindern die
Oxidation anderer Substanzen und machen Radikale unschädlich (“Radikalfänger”).
Obst
und Gemüse enthalten reichlich Antioxidantien. Folgende Mineralien /
Spurenelemente sind für die Funktion antioxidativ wirkender Enzyme
notwendig und können (insgesamt in Zeiten erhöhter Belastung)
dementsprechend mit der Nahrung zugeführt werden: Magnesium, Eisen, Zink, Kupfer, Selen, Mangan.
Pflanzliche Wirkstoffe (Polyphenole und andere Phytochemikalien) helfen
die DNA vor Schädigung durch Radikale zu schützen, indem sie die
Produktion antioxidativ wirkender Enzyme anregen.
Glutathion ist ein Tripeptid (Glutamat - Cystein - Glyzin), das aus diesen Aminosäuren (ohne Ribosomen) unter ATP-Verbrauch synthetisiert wird (atypische Peptidbindungen) - vor allem in Erythrozyten, wo es (wie auch sonst im Körper) als Reduktionsmittel für den Oxidationsschutz dient.
Das selenabhängige Enzym Glutathion-Peroxidase verwandelt Wasserstoffperoxid in Wasser und lässt dabei Glutathion-Disulfid (G-S-S-G, oxidierte Form)
entstehen. Dieses wird anschließend wieder zu Glutathion (GSH,
reduzierte Form) zurückverwandelt (regeneriert) - das macht die Glutathion-Reduktase, die dazu wiederum NADPH/H+ benötigt:
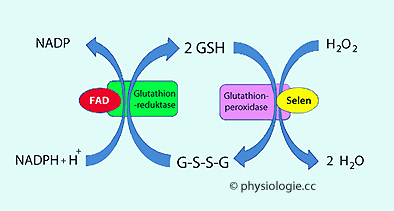
 Abbildung: Glutathionsystem
Abbildung: Glutathionsystem
Glutathion dient als Oxidationsschutz - es macht Wasserstoffperoxid und Sauerstoffradikale unschädlich.
Über die Thiolgruppe (HS-) werden Elektronen abgegeben, der entstehende
Wasserstoff kann dann oxidierte Moleküle reduzieren.
Die Glutathion-Peroxidase
(sie benötigt Selen) verwandelt Wasserstoffperoxid in Wasser und lässt
dabei Glutathion-Disulfid (G-S-S-G) entstehen. Dieses wird anschließend
wieder zu Glutathion (GSH) zurückverwandelt (regeneriert) - das macht
zusammen mit FAD die Glutathion-Reduktase, die dazu NADPH / H+ benötigt

Sauerstoffradikale können überall in der Zelle entstehen, wo O2 im Spiel ist (besonders intensiv an Stellen mit hohem pO2, oder auch in der Netzhaut, wo der oxidative Stress durch Photonen dazukommt).
Besonders aktiv sind Hydroxylradikale; sie können insbesondere in
der Zellmembran Fettsäuren miteinander verbinden und so die
Lipidschichte beschädigen. Auch vernetzen Hydroxylradikale Proteine und stören dadurch deren Funktion.
Glutathionperoxidase enthält Selen, Selenmangel
schwächt Radikalabwehr und Immunfunktion. Man nimmt an,
dass die Fähigkeit zum Abbau von Produkten des Radikalstoffwechsels mit
dem Alter abnimmt und das Gewebe für Schädigungen und Zelluntergang
anfälliger wird, und empfiehlt Ernährung, die
reich an Vitaminen und Spurenelementen ist.
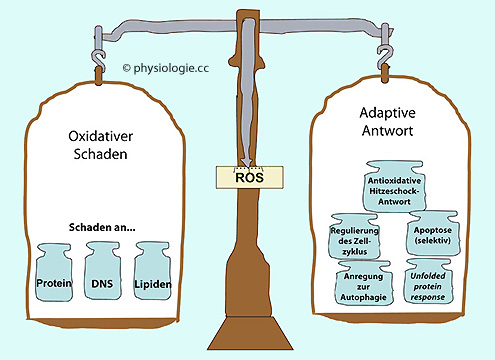
 Abbildung: "ROS-Waage"
Abbildung: "ROS-Waage"
Nach Mao L, Franke J. Hormesis in Aging and Neurodegeneration - A Prodigy Awaiting Dissection. Int J Mol Sci 2013; 14: 13109-28
Einerseits verursachen freie Radikale (ROS)
Schäden an Protein-, DNA- und Lipidmolekülen (linke Waagschale).
Andererseits induzieren sie adaptive Reaktionen des Organismus (rechte
Waagschale) wie z.B. Steuerung des Gefäßtonus, der Erythropoese, Pathogenabwehr.
Mit steigendem
oxidativen Stress nimmt die Intensität antioxidativer Mechanismen zu.
Ist der Gehalt an ROS im Gewebe niedrig, sinkt adaptiv auch die Menge
antioxidativer Enzyme (oxidative balance)

Die Anwesenheit von ROS ruft adaptive Vorgänge auf den Plan, welche die schädlichen Auswirkungen konterkarieren ( Abbildung):
Abbildung):
 Antioxidantien,
Antioxidantien,
 Radikalfänger,
Radikalfänger,
 Hitzeschockproteine,
Hitzeschockproteine,
 Unfolded Protein Response (UPR)
- zelluläre Stressantwort zur Wiederherstellung normaler Funktionen
(Abbau falsch gefalteter Proteine, Synthese von Chaperonen)
Unfolded Protein Response (UPR)
- zelluläre Stressantwort zur Wiederherstellung normaler Funktionen
(Abbau falsch gefalteter Proteine, Synthese von Chaperonen)
 Reparaturmechanismen (DNA repair),
Reparaturmechanismen (DNA repair),
 Zellproliferation oder (bei hoher Belastung)
Zellproliferation oder (bei hoher Belastung)
 Apoptose und Autophagie.
Apoptose und Autophagie.

 Freie Radikale sind Atome / Ionen / Moleküle mit einem unpaaren Elektron in der Außenschale
Freie Radikale sind Atome / Ionen / Moleküle mit einem unpaaren Elektron in der Außenschale
 Sie sind reaktionsfreudig und beschädigen Proteine, Lipide, Nukleinsäuren
Sie sind reaktionsfreudig und beschädigen Proteine, Lipide, Nukleinsäuren
 Antioxidantien blockieren ihre Entstehung, Enzyme können sie eliminieren
Antioxidantien blockieren ihre Entstehung, Enzyme können sie eliminieren
Zucker wirkt im Sinne molekularer Veränderungen, die mit Alterungsprozessen zusammenhängen (Amadori-Verbindungen  entstehen als 2. Stufe der Maillard-Reaktion
entstehen als 2. Stufe der Maillard-Reaktion  ; Advanced Glycosylation End-products: AGEs).
Die Bildung solcher AGEs ist vor allem für Proteine relevant, die eine
lange Lebensdauer haben - ihre strukturellen und funktionellen
Eigenschaften sind beeinträchtigt (Glykierungstheorie der Alterung). Hyperglykämie trägt zur Bildung von AGEs bei.
; Advanced Glycosylation End-products: AGEs).
Die Bildung solcher AGEs ist vor allem für Proteine relevant, die eine
lange Lebensdauer haben - ihre strukturellen und funktionellen
Eigenschaften sind beeinträchtigt (Glykierungstheorie der Alterung). Hyperglykämie trägt zur Bildung von AGEs bei.
Solche nicht-enzymatisch entstandenen Zucker-Eiweiß-Verbindungen (Glykosilierung) beschleunigen degenerative Vorgänge; die Tendenz zu ihrer Bildung nimmt mit erhöhtem Glucosespiegel (Diabetes mellitus!) zu.
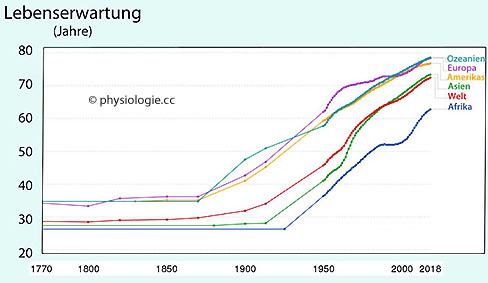
 Abbildung: Weltweite Lebenserwartung
Abbildung: Weltweite Lebenserwartung
Nach Riley 2005, Clio Infra 2015, UN Population Division 2019
Gezeigt ist die statistisch erwartbare durchschnittliche Lebenserwartung für die jeweilige Region jeweils zum Geburtszeitpunkt

Die Lebenserwartung hängt möglicherweise u.a. von diesem Gleichgewicht ab:
 Im
niedrigen ROS-Konzentrationsbereich überwiegt der anregende Effekt auf
adaptive Antworten, ROS verlängern hier die
Dauer der gesunden Lebensspanne;
Im
niedrigen ROS-Konzentrationsbereich überwiegt der anregende Effekt auf
adaptive Antworten, ROS verlängern hier die
Dauer der gesunden Lebensspanne;
 in höherem ROS-Konzentrationsbereich
hingegen überwiegt der schädigende Effekt, Gesundheit und
Lebenserwartung nehmen mit weiter zunehmender ROS-Belastung ab.
in höherem ROS-Konzentrationsbereich
hingegen überwiegt der schädigende Effekt, Gesundheit und
Lebenserwartung nehmen mit weiter zunehmender ROS-Belastung ab.
Das
Optimum liegt vielleicht bei einer ROS-Belastung von <100 µM (korreliert mit der höchsten
Lebenserwartung) - ROS triggern zelluläre Schutzmechanismen. An diesem Beispiel läßt sich das Prinzip der Hormese
 zeigen (Mitochondrien: "Mitohormese"): Geringe Dosen können eine positive Wirkung auf den
Organismus haben, weil sie adaptive
Schutzreaktionen anregen (Prinzip der "Abhärtung").
zeigen (Mitochondrien: "Mitohormese"): Geringe Dosen können eine positive Wirkung auf den
Organismus haben, weil sie adaptive
Schutzreaktionen anregen (Prinzip der "Abhärtung").
Es ist nicht klar, inwieweit Radikale und ihre Beeinflussung durch
verschiedene Maßnahmen (free radical theory) einen ursächlichen Einfluss auf Alterung und Lebenserwartung haben.
 Der
relative
(auf Körpergewicht bzw. Hautoberfläche bezogene) Energieumsatz nimmt
mit zunehmendem Alter ab (maximale Sauerstoffaufnahme von z.B. ~50 auf
~35 ml/kg/min in einer untrainierten männlichen Population). Dies gilt
insbesondere für den Wasseraustausch (Kleinkinder setzen täglich über
50% ihres extrazellulären
Flüssigkeitsvolumens mit der Außenwelt um,
Erwachsene ~15%).
Der
relative
(auf Körpergewicht bzw. Hautoberfläche bezogene) Energieumsatz nimmt
mit zunehmendem Alter ab (maximale Sauerstoffaufnahme von z.B. ~50 auf
~35 ml/kg/min in einer untrainierten männlichen Population). Dies gilt
insbesondere für den Wasseraustausch (Kleinkinder setzen täglich über
50% ihres extrazellulären
Flüssigkeitsvolumens mit der Außenwelt um,
Erwachsene ~15%).
Der Grundumsatz erwachsener Menschen ist weitgehend unabhängig vom Alter - er nimmt im Durchschnitt um lediglich ~0,2% pro Lebensjahr ab.
Die Elimination von Medikamenten ist bei Kleinkindern
und alten Menschen geringer als bei Erwachsenen, die Wirksamkeit
(Verweildauer) daher erhöht.
 Das Verteilungsmuster von Medikamenten im
Körper ist altersabhängig, weil eine Tendenz zur Zunahme des Anteils
von Fettgewebe am Körpergewicht besteht (bis +100%), was die Speicherung lipophiler Stoffe (Hormone, Pharmaka,..) in der
Lipidphase erhöht. Das Volumen des Gesamtkörperwassers (TBW) nimmt im Alter um bis zu 20% ab, ebenfalls der Serumalbuminspiegel.
Das Verteilungsmuster von Medikamenten im
Körper ist altersabhängig, weil eine Tendenz zur Zunahme des Anteils
von Fettgewebe am Körpergewicht besteht (bis +100%), was die Speicherung lipophiler Stoffe (Hormone, Pharmaka,..) in der
Lipidphase erhöht. Das Volumen des Gesamtkörperwassers (TBW) nimmt im Alter um bis zu 20% ab, ebenfalls der Serumalbuminspiegel.

Zur
Bestimmung des Körperwasservolumens s.
dort
 Bei vaginaler Entbindung kommt es zu rascher Übertragung mütterlicher Mikroben auf das Neugeborene,
dessen Darmflora nach etwa einem Monat stabil etabliert ist (bei durch
Kaiserschnitt Entbundenen dauert dieser Prozess länger, auch das
mikrobielle Muster ist anders zusammengesetzt). Zuerst überwiegen
Kolibakterien und Streptokokken; erst nach 1-2 Jahren stellt sich eine Darmflora ein, deren Muster der von Erwachsenen entspricht.
Bei vaginaler Entbindung kommt es zu rascher Übertragung mütterlicher Mikroben auf das Neugeborene,
dessen Darmflora nach etwa einem Monat stabil etabliert ist (bei durch
Kaiserschnitt Entbundenen dauert dieser Prozess länger, auch das
mikrobielle Muster ist anders zusammengesetzt). Zuerst überwiegen
Kolibakterien und Streptokokken; erst nach 1-2 Jahren stellt sich eine Darmflora ein, deren Muster der von Erwachsenen entspricht.
Neugeborene resorbieren eine beträchtliche Menge Protein direkt aus dem Kolostrum - mittels Endozytose,
also ohne vorherigen Abbau zu Aminosäuren, Di- und Tripeptiden. Dieser
Mechanismus erlaubt die Aufnahme von (teils) unveränderten
Immunglobulinen aus der Muttermilch direkt in das Blut des
Neugeborenen.
Darmschleimhautzellen bringen auf diese Weise etwa jedes zehnte, die auf Proteinaufnahme spezialisierten M-Zellen etwa jedes zweite Eiweißmolekül unbeschadet aus dem Darmlumen in das Interstitium des Babys (jeweils 0,2 µg/h/cm2 Mukosaoberfläche - "direkter Pfad"). Der Mechanismus der Protein-Endozytose bleibt etwa während der ersten 6
Monate postpartal bestehen, nachher wird er hormonell weitgehend
"abgestellt" (closure). Im späteren Lebensalter ist die direkte Proteinaufnahme nur noch minimal.
Neugeborene haben im Pankreas ~200,000 Langerhans-Inseln; Erwachsene 1-2 Millionen.
Die Leber
ist während der Fetalzeit (2.-8. Entwicklungsmonat) an der Blutbildung
beteiligt; diese wird graduell in das rote Knochenmark verlagert. Nach der Abtrennung vom Plazentakreislauf muss
die Leber des Neugeborenen die Umbau- und Eliminationsfunktion komplett
übernehmen, an der vorher die Leber der Mutter beteiligt war. Die
eingeschränkte Bilirubinausscheidung äußert sich im icterus neonatorum, die metabolische Kapazität nimmt dann aber innerhalb von Tagen
so zu, dass sich die Bilirubinwerte stabilisieren und anschließend
normalisieren. Die Leberzellen sind äußerst aktiv; das Verhältnis
Lebermasse / Körpermasse ist bei Neugeborenen und Kleinkindern sehr
hoch (mit 6 Monaten 1:10, im Vergleich zu 1:50 beim Erwachsenen).
Der Natrium-Taurocholat Cotransporter NTCP übernimmt
zum großen Teil die Resorption von Gallensalzen in die Leberzellen. Er
ist bei Neugeborenen nur schwach ausgebildet, die Rezirkulation des
Gallensäurepools muss sich erst entwickeln.
Ab
dem 5.
Lebensjahrzehnt reduzieren sich Gewicht und Durchblutung der Leber. Die
Masse der Leber nimmt um bis zu 40% ab, die Durchblutung um bis zu 50%;
die
Aktivität der Leberenzyme sinkt, und viele Medikamente werden langsamer
abgebaut, so dass geringere Dosierungen angebracht sind:
 Beträgt der First-pass-Effekt
für einen bestimmten oral applizierten Arzneistoff beim jungen Menschen
z.B. 90%, bedeutet das, dass 10% des mit dem Darm aufgenommenen
Pharmakons in die Blutbahn gelangen (10% Bioverfügbarkeit). Reduziert
sich der Effekt im Alter z.B. auf 80%, werden nunmehr 20% des
Pharmakons in den systemischen Kreislauf weitergegeben, d.h. die Bioverfügbarkeit dieses Pharmakons hat sich verdoppelt (Reduktion des first-pass-Effekts von 90 auf 80%).
Beträgt der First-pass-Effekt
für einen bestimmten oral applizierten Arzneistoff beim jungen Menschen
z.B. 90%, bedeutet das, dass 10% des mit dem Darm aufgenommenen
Pharmakons in die Blutbahn gelangen (10% Bioverfügbarkeit). Reduziert
sich der Effekt im Alter z.B. auf 80%, werden nunmehr 20% des
Pharmakons in den systemischen Kreislauf weitergegeben, d.h. die Bioverfügbarkeit dieses Pharmakons hat sich verdoppelt (Reduktion des first-pass-Effekts von 90 auf 80%).
Stuhl-pH: Der Stuhl von gestillten
Neugeborenen ist mäßig sauer (pH~5,1), kuhmilchernährte Säuglinge haben
einen Stuhl-pH von ~6,5 (Erwachsene: 6,5-7,3).
Veränderungen mit zunehmendem Lebensalter:
Das Altern hat nur geringe Auswirkungen auf die Funktionen des
Gastrointestinalsystems. Schwächung der Skelettmuskulatur kann Probleme
beim Kauen und Schlucken einerseits, bei der Kontinenz (externer
Schließmuskel) andererseits mit sich bringen. Bei älteren Menschen löst
nicht jeder Schluckvorgang eine peristaltische Welle im Ösophagus aus,
der Cardiasphinkter öffnet nicht immer.
Die Magenschleimhaut
erneuert sich mit zunehmendem Alter langsamer, kann atrophisch
werden und neigt dann zu entzündlichen Veränderungen (atrophische
Gastritis). Ab 40a nimmt die relative Sekretionsleistung (Testmahlzeit)
des Magens ab, die histamininduzierte ab 50a.
Der
Dünndarm nimmt an Masse ab und
büßt an Regenerations- und
Resorptionsfähigkeit ein, die Zotten werden kürzer, die
Resorptionsoberfläche nimmt ab. Die Zahl an Neuronen im intestinalen
Nervensystem sinkt. Die für
die Peristaltik verantwortliche Muskulatur (muscularis propria)
nimmt typischerweise ab, die glatte
Muskulatur in der Schleimhaut (muscularis mucosae) hingegen zu. Die Resorptionskapazität des Darms bleibt bei älteren Menschen im Wesentlichen erhalten (für Aminosäuren und Kohlenhydrate unverändert, die Lipidresorption nimmt etwas ab); Pharmaka werden fast genauso
gut aufgenommen wie bei jüngeren Personen. Die Resorptionsgeschwindigkeit kann wegen der abnehmenden enteralen Perfusion verringert sein.
Im Dickdarm nimmt die
Wandstärke mit dem Alter ab; in Kombination mit hohem intraluminalem
Druck kann dies zur Bildung von Divertikeln beitragen. Die Koorination
der Motorik kann durch Verlust von Neuronen abnehmen;
Konstipation bei betagten Menschen kann mehrere Ursachen haben: Neben
Verlust der motorischen Kapazität und Abnahme des Muskeltonus kann eine
erhöhte Schwelle zur Auslösung des Defäkationsreflexes eine Rolle
spielen, aber auch ballaststoffarme Ernährung.
Ernährung. Kalorienarme Ernährung kann den Alterungsprozess bremsen, sofern genügend essentielle Nährstoffe zugeführt werden. Der relative Eiweißbedarf beträgt im Alter
1.2-1.5 g/kg/Tag, was Umstellung auf
höherwertige Kost erfordern kann. Wenn die insgesamt konsumierte Nahrungsmenge abnimmt,
muss auf die biologische Wertigkeit der Speisen (Vitaminreichtum,
Spurenelemente) besonders geachtet werden, auch in Hinblick auf den
Radikalstoffwechsel.
 Das Erlernen und Anpassen der Motorik ist ein kontinuierlicher Prozess. Zentrale "Mustergeneratoren"
(central pattern generators)
beginnen schon früh in der fetalen Entwicklung, Bewegungsabfolgen
auszulösen - auch ohne sensorischen Input (d.h. die Generierung von
Bewegungsabläufen erfolgt nicht "reflektorisch", sondern spontan
endogen, und ist auch altersspezifisch). Es werden verschiedene
Bewegungsmuster "durchgespielt", deren zeitlicher Ablauf mit Intaktheit
und Reifung der motorischen Zentren korreliert.
Das Erlernen und Anpassen der Motorik ist ein kontinuierlicher Prozess. Zentrale "Mustergeneratoren"
(central pattern generators)
beginnen schon früh in der fetalen Entwicklung, Bewegungsabfolgen
auszulösen - auch ohne sensorischen Input (d.h. die Generierung von
Bewegungsabläufen erfolgt nicht "reflektorisch", sondern spontan
endogen, und ist auch altersspezifisch). Es werden verschiedene
Bewegungsmuster "durchgespielt", deren zeitlicher Ablauf mit Intaktheit
und Reifung der motorischen Zentren korreliert.
Auch nach der Geburt entwickeln sich die motorischen Fähigkeiten
in einer typischen Abfolge (Sitzen mit 6 Monaten, erste Schritte mit
einem Jahr etc). Dies hängt mit der Reifung motorischer Systeme (u.a.
Pyramidenbahn) zusammen, welche erst mit der Pubertät vervollständigt
ist.
 Über Wachstumsmuster des Bewegungsapparats mit dem Alter s. dort
Über Wachstumsmuster des Bewegungsapparats mit dem Alter s. dort
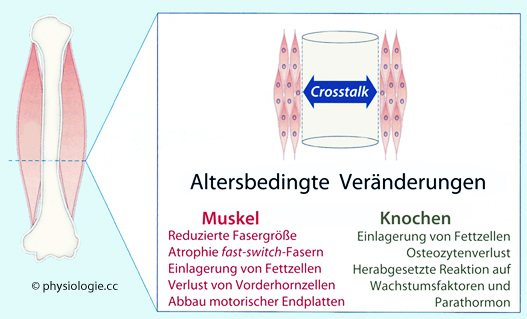
 Abbildung: Altersbedingte Veränderungen im Bewegungssystem
Abbildung: Altersbedingte Veränderungen im Bewegungssystem
Nach: Novotny SA, Warren GL, Hamrick MW. Aging and the Muscle-Bone Relationship. Physiology 2015; 30: 8-16
Die
in der Abbildung erwähnten Veränderungen können die Fähigkeit des
Knochens, auf anabole Signale zu antworten, beeinträchtigen

Für das Verständnis der Alterungsvorgänge im Skelettsystem ist zu berücksichtigen, dass Knochen und Muskulatur wechselseitig interagieren; sowohl direkt mechanisch als auch endokrin und parakrin, also molekular.
So wirken Myokine
nicht nur auf den Muskel, sondern auch auf den Knochen; herabgesetzte
Myokinproduktion im Alter hat daher auch einen atrophisierenden Effekt
auf den Knochen.
Die
altersbedingten Veränderungen, die zur Reduktion der Kraftentfaltung im
Bewegungssystem führen, sind vielfältig ( Abbildung). Insbesondere
jenseits der 50 nimmt die Zahl - etwas auch der Durchmesser - der
Muskelfasern ab (Sarkopenie).
Der durchschnittliche Verlust an Muskelmasse bis zu einem Alter von 80a
beträgt im Schnitt etwa 30%, parallel zum Verlust an Myofibrillen. Das
ist teils auf sinkende Aktivierung, teils auf einen laufenden Verlust
von Typ II- motorischen Vorderhornzellen (fast twitch)
- die mit abnehmender Frequenz rekrutiert werden - zurückzuführen. Auch
der axonale Transport in den Vorderhornzellen nimmt ab. Der
prozentuelle Verlust an Muskelfasern ist höher als der an motorischen
Vorderhornzellen. Das bedeutet, die Größe der motorischen Einheiten
nimmt ab, und die Aktivierung einer definierten Muskelkraft wird als
mühsamer empfunden als in jüngeren Jahren.
Abbildung). Insbesondere
jenseits der 50 nimmt die Zahl - etwas auch der Durchmesser - der
Muskelfasern ab (Sarkopenie).
Der durchschnittliche Verlust an Muskelmasse bis zu einem Alter von 80a
beträgt im Schnitt etwa 30%, parallel zum Verlust an Myofibrillen. Das
ist teils auf sinkende Aktivierung, teils auf einen laufenden Verlust
von Typ II- motorischen Vorderhornzellen (fast twitch)
- die mit abnehmender Frequenz rekrutiert werden - zurückzuführen. Auch
der axonale Transport in den Vorderhornzellen nimmt ab. Der
prozentuelle Verlust an Muskelfasern ist höher als der an motorischen
Vorderhornzellen. Das bedeutet, die Größe der motorischen Einheiten
nimmt ab, und die Aktivierung einer definierten Muskelkraft wird als
mühsamer empfunden als in jüngeren Jahren.
 Krafttraining im Alter erhöht den Durchmesser der betroffenen
Muskelfasern und wirkt so dem zahlenmäßigen Verlust entgegen.
Krafttraining im Alter erhöht den Durchmesser der betroffenen
Muskelfasern und wirkt so dem zahlenmäßigen Verlust entgegen.
Knochen, Knorpel, Gelenke: Die höchste Knochendichte erreicht der Mensch in einem Alter von 25-30 Jahren. Dann nimmt sie im Allgemeinen mit dem Alter zunehmend ab, zusammen mit der mechanischen Belastbarkeit
(Osteoporose). Ursache sind verringerte mechanische Belastung und hormonelle Umstellungen, insbesondere nach dem Klimakterium.
Mit zunehmendem Lebensalter ist die Funktion der Chondrozyten
beeinträchtigt. Kollagenfasern werden intensiver vernetzt,
Proteoglycane nehmen an Masse ab, und es kann weniger Wasser
eingelagert werden, wodurch die Elastizität der Knorpelgrundsubstanz
abnimmt. Die Dicke der Bandscheiben nimmt ab und damit die Körpergröße
(evt. verstärkt durch Osteoporose der Wirbelkörper), weiters die
Beweglichkeit der Gelenke.
Im Bindegewebe findet sich mit
steigendem Alter eine höhere Dichte an Mucopolysacchariden bei
geringerer Flüssigkeitsmenge, und dichter liegende Bindegewebsfasern (Kollagenfasern nehmen an Zahl zu), die dichter miteinander verknüpft sind (cross-linking).
Dieses Gerüst ist stabil, aber es braucht mehr Kraft, um es um einen
definierten Betrag zu strecken; sind die Fasern einmal gedehnt, kehren
sie nur verzögert zu ihrer Anfangslänge zurück. In sehr hohem Alter
nimmt die Konzentration an Kollagenase im Gewebe zu, und seine Stabilität nimmt ab. Auch Elastinfäden verlieren mit dem Alter an Wasser, weisen vermehrt Quervernetzungen auf und beginnen brüchig zu werden.
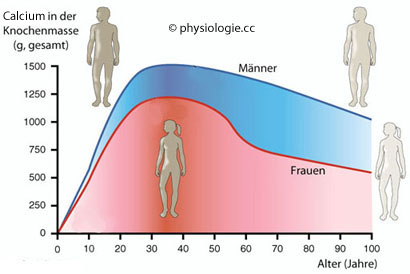
 Abbildung: Knochendichte (gemessen am Calciumgehalt) als Funktion des Lebensalters
Abbildung: Knochendichte (gemessen am Calciumgehalt) als Funktion des Lebensalters
Nach einer Vorlage bei cnx.org
Während der Menopause kommt es bei Frauen zu einem deutlichen Knick in der Verlaufskurve

Auslösend für die Abnahme der Knochenfestigkeit mit zunehmendem Alter ( Abbildung) sind mehrere Faktoren:
Abbildung) sind mehrere Faktoren:

Hormonelle Veränderungen: Die
Abnahme des Östrogenspiegels
führt zu stärkerer Zunahme der Osteoklasten- als der
Osteoblastentätigkeit, was insgesamt die Knochendichte senkt und das
Frakturrisiko steigert
 Bewegungsmangel
Bewegungsmangel (mechanische Belastung übt auf
Knochen und Gelenke einen
trophischen Effekt aus)

Eingeschränkte metabolische Erneuerung
 Fehlernährung
Fehlernährung

Krankheitsbedingte
degenerative Prozesse
Im Alter nimmt die Zahl der Osteozyten im Knochen ab ("leere Lakunen"),
vor allem unter dem Periost. Das hemmt Knochenaufbau und
Regenerierungskapazität. Zudem lagern sich Fettzellen in den Knochen
ein. Schließlich reagieren die Zellen nicht mehr so gut auf endokrine (Parathormon) und parakrine Faktoren (Wachstumsfaktoren).
Skelettmuskulatur: Mit dem Alter nimmt die Masse (-20%) und funktionelle Belastbarkeit der Muskeln ab (Sarkopenie).
Die Ursachen sind vielfältig: Die Zahl der Typ-II- (fast twitch) Fasern nimmt ab, sie werden teilweise durch Typ-I-Fasern ersetzt (wenngleich sich auch deren Kraft infolge mangelnder Belastung
reduziert). Größe und Durchmesser der Muskelfasern nehmen generell ab; motorische Vorderhornzellen
gehen da und dort zugrunde, und Fettzellen treten vermehrt im
Muskelgewebe auf. Schließlich kommt es auch zu degenerativen Vorgängen
an den motorischen Endplatten.
 Regelmäßige Belastung sowie adäquate Ernährung (z.B. ausreichend
Eiweiß) sind wesentliche Faktoren, um dem Altersabbau vorzubeugen. Das
erhöht Gesundheit und Lebensdauer. Studien haben ergeben, dass
bereits regelmäßig durchgeführte tägliche Spaziergänge die Lebenserwartung um mehrere Jahre verlängern können.
Regelmäßige Belastung sowie adäquate Ernährung (z.B. ausreichend
Eiweiß) sind wesentliche Faktoren, um dem Altersabbau vorzubeugen. Das
erhöht Gesundheit und Lebensdauer. Studien haben ergeben, dass
bereits regelmäßig durchgeführte tägliche Spaziergänge die Lebenserwartung um mehrere Jahre verlängern können.
 Größe und Verteilung der Hautoberfläche sind
altersabhängig: Bei
Neugeborenen und Kindern ist der Anteil der Hautfläche von Kopf und
Rumpf in Relation zur Gesamtfläche höher als bei Erwachsenen.
Unmittelbar nach der Geburt sinkt die Körpertemperatur: relativ große
Hautoberfläche, geringe thermische Isolierung, ungenügende
Thermoregulation.
Größe und Verteilung der Hautoberfläche sind
altersabhängig: Bei
Neugeborenen und Kindern ist der Anteil der Hautfläche von Kopf und
Rumpf in Relation zur Gesamtfläche höher als bei Erwachsenen.
Unmittelbar nach der Geburt sinkt die Körpertemperatur: relativ große
Hautoberfläche, geringe thermische Isolierung, ungenügende
Thermoregulation.
Im Alter kann die Versorgung mit Mechanorezeptoren
abnehmen, was
das Tastempfinden reduziert. Die
Haut insgesamt dünnt aus (-20%) und verliert an Elastizität
(extrazelluläre bindegewebige Strukturen). Auch zeigen sich
unregelmäßige
Pigmenteinlagerung, Haarverlust, Verhärtung und Abnahme des
Wassergehalts - die Haut wird trockener. Durch verringerten Abbau immer
auftretender Zucker-Eiweiß-Vernetzungen (Glykosylierungsprodukte) büßt
das Bindegewebe an elastischer Dehnbarkeit ein.
“Orangenhaut” (Cellulite - die Bezeichnung “Zellulitis” ist irreführend) ist eine lokale Vermehrung von bindegewebiger
Grundsubstanz und Flüssigkeit (infolge mangelhaften Lymphabflusses)
sowie Fettzellen.
Empfindlichkeit und Auflösungsvermögen der Haut als Sinnesorgan ist altersabhängig; die Zahl der Mechanosensoren
nimmt mit den Jahren allmählich ab, dementsprechend sinkt die taktile
Qualität. Beispielsweise nimmt die Zahl an Pacini-Rezeptoren
(Vibrationssinn) in der Hand von ~2400 (junge erwachsene Peronen) mit zunehmendem Alter auf ~300 ab.
Die Zahl aktiver Melanozyten in den Haarfollikeln nimmt im Alter ab (die Haare nehmen eine Grau- bis Weißfärbung an).
 Mit der 5. Gestationswoche sind fetale Herzschläge nachweisbar: Sie erfolgen zunächst mit einer Frequenz von ~85 Schlägen pro Minute (bpm: beats per minute);
die Frequenz beschleunigt sich dann etwa 3 Wochen lang linear um ca.
3,3 bpm pro Tag, bis in der 9. Gestationswoche ein Wert von etwa 175
bpm erreicht wird (
Mit der 5. Gestationswoche sind fetale Herzschläge nachweisbar: Sie erfolgen zunächst mit einer Frequenz von ~85 Schlägen pro Minute (bpm: beats per minute);
die Frequenz beschleunigt sich dann etwa 3 Wochen lang linear um ca.
3,3 bpm pro Tag, bis in der 9. Gestationswoche ein Wert von etwa 175
bpm erreicht wird ( Abbildung). Dann sinkt die Frequenz wieder auf
Werte um die 150 bpm (um die 15. Woche) und bleibt dann ziemlich
konstant auf diesem Wert; bis zur Geburt ist er auf ~140 bpm leicht gesunken.
Abbildung). Dann sinkt die Frequenz wieder auf
Werte um die 150 bpm (um die 15. Woche) und bleibt dann ziemlich
konstant auf diesem Wert; bis zur Geburt ist er auf ~140 bpm leicht gesunken.
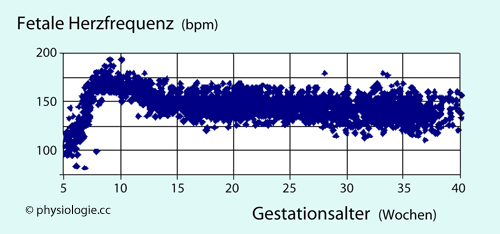
 Abbildung: Herzfrequenz des Feten - vom Beginn der Herzschläge bis zur Geburt
Nach DuBose TJ, Cunyus JA, Johnson L. Embryonic Heart Rate and Age. J Diagn Med Sonography 1990; 6:151-7
Abbildung: Herzfrequenz des Feten - vom Beginn der Herzschläge bis zur Geburt
Nach DuBose TJ, Cunyus JA, Johnson L. Embryonic Heart Rate and Age. J Diagn Med Sonography 1990; 6:151-7
Herzfrequenzwerte von mehreren tausend Feten als Funktion des Lebensalters, ermittelt über M-Mode Sonographie.
Die Zahl der Herzschläge pro Minute nimmt zunächst von Werten unter 100
bpm (Gestationswoche 5) auf etwa das Doppelte zu (Spitzenwerte um
Gestationswoche 8-9). Anschließend Reduktion auf Werte um 140 bpm

 Der Kreislauf ist das erste System, das sich beim Embryo ausbildet (Transport von Atemgasen und Nährstoffen des sich entwickelnden Gewebes). Die Bildung von Blutgefäßen (Vaskulogenese) wird durch Signalmoleküle gesteuert: Mesodermale Vorläuferzellen bilden einen Wachstumsfaktor (VEGF-A: Vascular endothelial growth factor A) und seinen Rezeptor (VEGFR-2);
Fehlen eines dieser Faktoren macht Vaskulogenese unmöglich und ist ein
Letalfaktor. VEGF-A spielt im späteren Leben auch eine tragende Rolle
bei der Wundheilung.
Der Kreislauf ist das erste System, das sich beim Embryo ausbildet (Transport von Atemgasen und Nährstoffen des sich entwickelnden Gewebes). Die Bildung von Blutgefäßen (Vaskulogenese) wird durch Signalmoleküle gesteuert: Mesodermale Vorläuferzellen bilden einen Wachstumsfaktor (VEGF-A: Vascular endothelial growth factor A) und seinen Rezeptor (VEGFR-2);
Fehlen eines dieser Faktoren macht Vaskulogenese unmöglich und ist ein
Letalfaktor. VEGF-A spielt im späteren Leben auch eine tragende Rolle
bei der Wundheilung.
Im Dottersack bilden sich erste Endothelinseln mit Hämangioblasten, die
dann zu einem primären Kapillargeflecht verschmelzen; die
Embryonalanlage bildet endotheliale Röhren, aus denen sich Herz,
dorsale Aorta und primäre Vene entwickeln. Diese bauen anschließend
Verbindungen mit dem Kapillargeflecht auf, und unter genetischer sowie
hämodynamischer Beeinflussung entsteht ein Kreislaufsystem.
Endotheliale Membranproteine (Ephrine) steuern die Entwicklung zu Arterien, Kapillaren und Venen. Ephrinrezeptoren sind die größte Unterfamilie der Rezeptortyrosinkinasen.
Die Ruhepulsfrequenz ist bei
Neugeborenen (~140 Schläge pro Minute) mehr als doppelt so hoch wie
beim Erwachsenen.
Noch bei zehnjährigen Kindern beträgt die Ruhefrequenz ~90/min, erst
beim Erwachsenen stellt sie sich auf 60-70/min ein - je nach
Trainingszustand: Athleten haben Ruhepulswerte um die 50 bpm, völlig
Untrainierte um die 80 bpm - ziemlich unabhängig vom Alter.
Die maximale Herzfrequenz nimmt etwa linear mit dem Alter ab - um 6-8
bpm pro Lebensjahrzehnt. Das hängt mit einer Abnahme der Zahl und
Empfindlichkeit der ß-Rezeptoren am Herzen zusammen.
Mit zunehmendem Alter sinkt die maximal erreichbare Herzfrequenz, die Ruhefrequenz bleibt gleich
|
Das Herzminutenvolumen beträgt beim Neugeborenen ~0,25 l/min/kg KG (knapp 0,9 l/min), beim Erwachsenen ~0,07 l/min/kg KG - im Ruhezustand und bei aufrechter Körperhaltung
~5 l/min (im Liegen ~7 l/min), und nimmt mit dem Alter
(70jährige) bei mangelndem Trainingszustand auf <3 l/min ab. (In
diesem
Alter hat das Herz bereits 150-200 Millionen Liter Blut gefördert und
etwa 3 Milliarden mal geschlagen.) Faustregel: Pro Jahr nimmt zwischen
20 und 80 Jahren Alter das Herzminutenvolumen um jeweils ca. 1% ab; die
maximale Herzfrequenz unter Belastung beträgt 220 minus Alter in Jahren.
Der Lagetyp des EKG ändert sich
mit der Lebensphase: Ist bei Kindern oft ein Steil- bis Rechtstyp
vorzufinden, schwenkt die elektrische Herzachse mit zunehmendem
Lebensalter nach horizontal (Linkstyp).
Die Plateauphyse des myokardialen Aktionspotentials nimmt an Dauer zu,
bedingt durch veränderte Kinetik des Calciumaustauschs (vor allem mit
dem sarkoplasmatischen Retikulum); die Herzmuskelzellen sprechen nicht
mehr so rasch auf Noradrenalin an. Im Sinusknoten nimmt die Zahl von
Zellen ab, in das Erregungsleitungssystem lagern sich bindegewebige
Elemente ein.
Blutdruck:
Der mittlere Ruheblutdruck des Neugeborenen beträgt ~9 kPa (~70 mmHg),
des Erwachsenen ~13 kPa (~100 mmHg -  Näheres s. dort). Funktionsbedingte
Blutdruckschwankungen (Aufregung, Belastung) sind in
der Jugend besonders stark ausgeprägt.
Näheres s. dort). Funktionsbedingte
Blutdruckschwankungen (Aufregung, Belastung) sind in
der Jugend besonders stark ausgeprägt.
Zunehmendes Lebensalter: Die Dehnbarkeit der Gefäßwände nimmt mit zunehmendem Alter ab, was zu Arteriosklerose führen kann (aber nicht muss). Das reduziert den Windkesseleffekt
(Erhöhung des systolischen Drucks), steigert die Pulswellengeschwindigkeit
und belastet das Herz, weil es zusätzlich zur
Druck-Volumen-Komponente dann auch eine erhöhte Beschleunigungsarbeit
leisten muss. Der periphere Widerstand nimmt ab 40a um ~1%
pro Jahr zu, was die Perfusion der Gewebe insgesamt reduziert
(Gehirndurchblutung -20% zwischen 40 und 80a, Nierendurchblutung -50%).
Altern bedingt (bei gesunder Lebensweise) nicht notwendigerweise einen Anstieg
des Ruheblutdrucks; tritt dies auf, dann durch Abnahme der Dehnbarkeit
der Arterienwände (erhöhte Nachlast wirkt sich vor
allem auf den systolischen Druck aus). Die Blutdruckregulation kann sich mit dem Alter verändern. Die
Empfindlichkeit des Barorezeptorreflexes nimmt ab, die
Autoregulationsmechanismen können eingeschränkt sein; dies wirkt sich
u.a. auf die Gehirndurchblutung aus.
Die
Kapillarwände (Basalmembran)
nehmen mit dem Alter oft an Dicke zu,
eine Senkung der Diffusionskapazität macht sich bemerkbar, der Stoffaustausch zu
den Geweben ist erschwert.
Die Venen büßen an Elastizität ein, die Neigung zur Varizenbildung (und damit verbundenen Komplikationen, wie Thromboseneigung) nimmt zu.
 Der Hämatokrit
beträgt bei Neugeborenen >50% (gibt hohe
Sauerstofftransportkapazität), bei Einjährigen ~35%, bei Erwachsenen ~40% (Männer 40-50, Frauen 37-47%). Daraus ergeben sich unterschiedliche Hämoglobinwerte (Hb-Konzentration in den Erythrozyten ~340 g/l). Bei
Veränderungen im Blutbild mit dem Alter ist zu berücksichtigen, dass Abnahme der
körperlichen Aktivität zu verringerter Blutbildung führt.
Der Hämatokrit
beträgt bei Neugeborenen >50% (gibt hohe
Sauerstofftransportkapazität), bei Einjährigen ~35%, bei Erwachsenen ~40% (Männer 40-50, Frauen 37-47%). Daraus ergeben sich unterschiedliche Hämoglobinwerte (Hb-Konzentration in den Erythrozyten ~340 g/l). Bei
Veränderungen im Blutbild mit dem Alter ist zu berücksichtigen, dass Abnahme der
körperlichen Aktivität zu verringerter Blutbildung führt.
Die Leukozytenzahl
beträgt bei Neugeborenen 15-40 Tausend pro µl Blut, bei Einjährigen um die 10 Tausend, bei Erwachsenen 4-11 Tausend/µl.
Die Zahl der
Blutplättchen im Blut ist mit dem Alter leicht rückgängig (16-30 Jahre ~0,21-0,40 x 106/µl, >60 Jahre ~0,18-0,37 x 106/µl).
Die Albuminmenge im Blutplasma sinkt im Alter um etwa 20%, was eine
Verringerung entsprechender Transportkapazitäten bedeutet. (Auch das
Körperwasser ist um ~20% reduziert.)
Das
rote
Knochenmark weicht mit Beginn des 5. Lebensjahrzehnts allmählich
bindegewebigen Strukturen und Fettzellen; mit 70 Jahren hat das
Knochenmarkpunktat etwa die Hälfte der Zelldichte des Jugendlichen. Die
Lymphozytenzahl im Blut nimmt um 20-30% ab, bedingt durch die
Involution der Thymusdrüse und verknüpft mit einer verringerten
Leistungsfähigkeit des spezifischen und unspezifischen
Immunsystems.
Immunsystem
 Während der
Entwicklung des Fetus bilden sich verschiedenste Lymphozyten, auch
solche, deren Rezeptoren auf normale, körperspezifische Molekülmuster
passen. Sie werden durch einen speziellen Ausleseprozess vernichtet,
so dass beim routinemäßigen “Check” normaler Körperzellen dann zeitlebens
keine Reaktion der Lymphozyten auftritt - die potentiell gefährlichen
sind ausgeschaltet worden.
Während der
Entwicklung des Fetus bilden sich verschiedenste Lymphozyten, auch
solche, deren Rezeptoren auf normale, körperspezifische Molekülmuster
passen. Sie werden durch einen speziellen Ausleseprozess vernichtet,
so dass beim routinemäßigen “Check” normaler Körperzellen dann zeitlebens
keine Reaktion der Lymphozyten auftritt - die potentiell gefährlichen
sind ausgeschaltet worden.
Neugeborene weisen im Blut zunächst fast ausschließlich naive
T-Zellen auf (das sind solche, die schon über epitopspezifische
T-Zell-Rezeptoren verfügen, aber noch keinen Antigenkontakt hatten und
daher noch nicht zu Effektorzellen herangereift sind). Gedächtnis-T-Zellen
sind mangels immunologischer "Erfahrung" noch kaum vorhanden (<5% aller peripheren T-Zellen bei Neugeborenen). Erst mit
etwa 30 Lebensjahren ist das Verhältnis ausgeglichen (jeweils ~50% naive und Gedächtnis-T-Zellen im Blutkreislauf),
und im höheren Alter (~80 a) ist nur mehr jede fünfte T-Zelle "naiv", ~80% der T-Lymphozyten im Blut sind Gedächtniszellen.
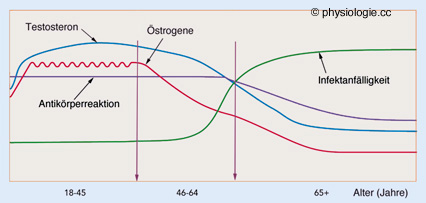
 Abbildung: Infektionsanfälligkeit von Männern und Frauen mit zunehmendem Alter
Nach Fink AL, Klein SL. Sex and Gender Impact Immune Responses to Vaccines Among the Elderly. Physiology 2015; 30: 408-16
Abbildung: Infektionsanfälligkeit von Männern und Frauen mit zunehmendem Alter
Nach Fink AL, Klein SL. Sex and Gender Impact Immune Responses to Vaccines Among the Elderly. Physiology 2015; 30: 408-16
Der
Abfall der Geschlechtshormonspiegel (sowohl Östrogene als auch
Testosteron) trägt wahrscheinlich zu erhöhter Infektanfälligkeit und
nachlassendem Impfschutz mit zunehmendem Alter bei.
Mit der Antikörperreaktion auf immunologische Stimuli nimmt die Effektivität von Schutzimpfungen
in zunehmendem Lebensalter ab - bei Männern möglicherweise stärker als bei Frauen

Die Bildung von Antikörpern in
B-bzw. Plasmazellen funktioniert normalerweise lebenslang effizient -
allerdings nimmt sie mit dem Lebensalter nach Eintritt in die
Postreproduktionsphase allmählich ab ( Abbildung). Die Neubildung
von T-Zellen im Thymus nimmt mit
zunehmendem Alter deutlich ab, sodass man insbesondere gegen
Virusinfektionen
(zytotoxische T-Zellen!) anfälliger wird. Deshalb wird empfohlen,
Impfungen
entsprechend vorausschauend zu planen, z.B. schon im 5. Lebensjahrzehnt
in Hinblick auf Reisen, die man für 60+ plant.
Abbildung). Die Neubildung
von T-Zellen im Thymus nimmt mit
zunehmendem Alter deutlich ab, sodass man insbesondere gegen
Virusinfektionen
(zytotoxische T-Zellen!) anfälliger wird. Deshalb wird empfohlen,
Impfungen
entsprechend vorausschauend zu planen, z.B. schon im 5. Lebensjahrzehnt
in Hinblick auf Reisen, die man für 60+ plant.
Auffallend ist die starke Altersabhängigkeit der Produktion von Thymosinen.
Diese von der Thymusdrüse gebildeten Steuerpeptide zeigen in den ersten
beiden Lebensjahrzehnten die höchste Sekretionsrate, dann nimmt diese
laufend ab und erreicht schon jenseits der 4. Lebensdekade sehr
niedrige Werte. Die thymusabhängige Immunität
steigt bis zur Adoleszenz an und nimmt dann - allerdings weniger steil
- wieder ab; altersassoziierte Erkrankungen (Infektionen,
Autoimmunerkrankungen, Krebs) nehmen an Häufigkeit jenseits der 50
deutlich zu.
 Die
Nieren sind etwa 6 Wochen nach der Geburt voll funktionsfähig. Auf die
Körperoberfläche normierte glomeruläre Filtration und Tubulusfunktion
sind beim Neugeborenen wesentlich geringer
als beim Erwachsenen, daher ist die Verweildauer von Medikamenten, die
renal ausgeschieden werden, etwa 5-fach höher.
Die
Nieren sind etwa 6 Wochen nach der Geburt voll funktionsfähig. Auf die
Körperoberfläche normierte glomeruläre Filtration und Tubulusfunktion
sind beim Neugeborenen wesentlich geringer
als beim Erwachsenen, daher ist die Verweildauer von Medikamenten, die
renal ausgeschieden werden, etwa 5-fach höher.
Die Filtrationsleistung
nimmt innerhalb weniger Monate um einen
Faktor von ~10
zu, um mit 6 Monaten doppelt so hoch zu liegen wie bei Erwachsenen. Mit
2 Jahren werden für Erwachsene typische Referenzwerte erreicht ( Abbildung).
Abbildung).
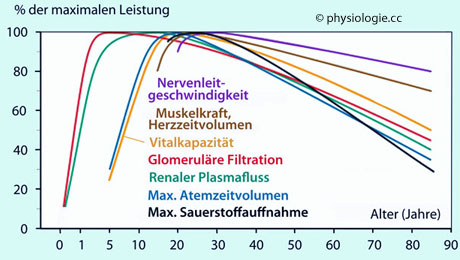
 Abbildung: Performance physiologischer Systeme als Funktion des Lebensalters
Abbildung: Performance physiologischer Systeme als Funktion des Lebensalters
Nach verschiedenen Quellen interpoliert
Der Plafond ist die jeweilige maximale
Systemleistung (100%). Stark vereinfachte gemittelte Verläufe über die
gesamte Lebensspanne.
Die Höchstleistungen werden bei unterschiedlichem Lebensalter erreicht - die glomeruläre Filtration der Nieren schon in der frühen Kindheit, die Nervenleitgeschwindigkeit erst nach Erreichen der Adoleszenz

Die glomeruläre Filtration reduziert sich im Durchschnitt der Bevölkerung um ~1% pro Jahr, z.T.
bedingt durch reduzierte Kapillarpermeabilität. Bei einigen - aber
nicht bei allen - Menschen kommt es mit zunehmendem Alter zu einer
Abnahme der glomerulären Filtrationsleistung.
Die Zahl der Nephrone nimmt bis zum 8. Lebensjahrzehnt um ~30% ab.
Zwar wird dies durch Vergrößerung der restlichen Nephrone
kompensiert, aber die glomeruläre Filtrationsrate nimmt
dennoch ab:
 Bis zum 30. Lebensjahr Männer >110 ml/min, Frauen >95 ml/min
Bis zum 30. Lebensjahr Männer >110 ml/min, Frauen >95 ml/min
 Dann pro Dekade um <10% Abnahme der GFR-Werte
Dann pro Dekade um <10% Abnahme der GFR-Werte
Im Erwachsenenalter hält sich der Betrag der GFR bis in die 4. Dekade im Schnitt bei etwa 100 ml/min/1,73m2 Hautoberfläche. Dann kommt es zu einem linearen Abfall und erreicht in der 8. Dekade einen Durchschnittswert von etwa 70 ml/min/1,73m2 - entsprechend einer Reduktion um ~30%.
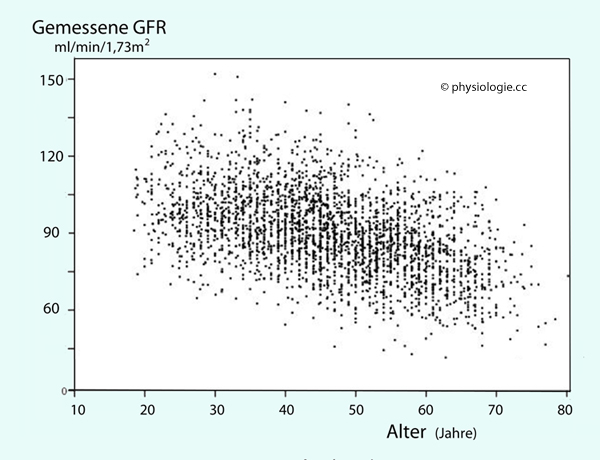
 Abbildung: Scatterplot der ermittelten glomerulären Filtrationsrate bei knapp 3000 Personen
Abbildung: Scatterplot der ermittelten glomerulären Filtrationsrate bei knapp 3000 Personen
Nach Fenton A et al, Glomerular filtration rate: new
age- and gender- specific reference ranges and thresholds for living
kidney donation. BMC Nephrol 2018; 19, 336
Die GFR nimmt mit dem Alter ab. Bis 35 Jahre Lebensalter beträgt sie ~100 ml/min/1,73m2, dann nimmt der Betrag linear ab - bei Frauen rascher (7,7 ml/min/1,73m2 pro Dekade) als bei Männern (6,6). Der Mittelwert dieser Studie betrug bei Männern insgesamt 92, bei Frauen 88 ml/min/1,73m2

 Zur GFR als Funktion des Lebensalters s. dort
Zur GFR als Funktion des Lebensalters s. dort
Durchblutung, renaler Plasmafluss und glomeruläre
Filtration sinken mit Alter 75 auf etwa die Hälfte der Erwachsenen-Referenzwerte.
Die renale Konzentrierfähigkeit nimmt mit dem Alter ab. Bei osmotischer
Belastung nimmt der entsprechende Anstieg der Vasopressinsekretion zu,
aber bei Volumenmangel ist die regulatorische Kapazität eingeschränkt.
Der Kreatininspiegel
bleibt im Wesentlichen unverändert, da im Allgemeinen auch die
Muskelmasse abnimmt. Die Säure-Basen-Regulation bleibt intakt, auch
wenn Kompensationsmechanismen langsamer sind als in jüngeren Jahren.
 Auch bei Kreatininwerten im Normbereich muss die
Dosierung entsprechender Medikamente mit zunehmendem Alter reduziert
werden.
Auch bei Kreatininwerten im Normbereich muss die
Dosierung entsprechender Medikamente mit zunehmendem Alter reduziert
werden.
Autoregulationsbereich: Bei jüngeren Menschen beginnt der Autoregulationsbereich
für die renale Perfusion bei einem arteriellen Mitteldruck von etwa 90
mmHg. Während niedrigerer Blutdruck zu reduzierter Nierendurchblutung
führt, bleibt sie bei höheren Werten weitgehend stabil. Mit zunehmendem
Alter verschiebt sich die Regulationsgrenze (wegen geringerer
Gefäßdehnbarkeit) zu höheren Werten (etwa 100 mmHg). Das bedeutet, dass
eine Reduktion der renalen Durchblutung bereits bei mittleren Blutdruckwerten <100 mmHg auftritt.
Flüssigkeitsumsatz: Ein gesunder Säugling mit 7 kg KG setzt täglich etwa 10% seines Körpergewichts an Wasser
um (Aufnahme per os 620 ml/d, Oxidationswasser 80 l/d; Abgabe mit Urin
500 ml/d, über Atmung und Haut 170, als Stuhl 30 ml/d). Bei einem
Erwachsenen ist die Umsatzzahl nur ein Drittel davon (etwa 3,5% des
Körpergewichts pro Tag).
Die Füllungskapazität und Dehnbarkeit der Harnblase sowie eine Schwäche des Detrusormuskels nimmt mit zunehmendem Alter ab, was oft zu Kontinenzproblemen, Nokturie und höherer Detrusionsfrequenz führt.
 Die
Ruhe-Atemfrequenz des Neugeborenen beträgt ~50 Atemzüge / Minute, bei
Kindern im Volksschulalter ~20/min, bei Erwachsenen ~12/min.
Die
Ruhe-Atemfrequenz des Neugeborenen beträgt ~50 Atemzüge / Minute, bei
Kindern im Volksschulalter ~20/min, bei Erwachsenen ~12/min.
Die embryonale Luftröhre teilt sich zunächst in zwei Lungenknospen, diese rechts in drei, links in zwei Äste -
die Anlagen der Lappenbronchien. Die Bronchien teilen sich dichotomisch
weiter, bis zum Ende des 2. Trimenons etwa 17 Aufzweigungen gebildet
sind. Weitere 6 Teilungen erfolgen nach der Geburt.
Im Laufe des Lebens auftretende Auseinandersetzungen mit Mikroorganismen bzw. Infektionen verändern die immunologische Beschaffenheit der Lunge ( Abbildung). Während im Lungengewebe von Neugeborenen regulatorische T-Lymphozyten (Treg) überwiegen, findet man bei erwachsenen Personen vor allem Gedächtniszellen (TRM, resident memory T cells). Das Gewebe enthält lymphoide Inseln (BALT, bronchus-associated lymphoid tissue) und (nicht MHC-restringierte) γδ-T-Zellen. Darüber hinaus haben Alveolarmakrophagen und einige Epithelzellen Veränderungen erfahren, die auf frühere Infektionen zurückzuführen sind.
Abbildung). Während im Lungengewebe von Neugeborenen regulatorische T-Lymphozyten (Treg) überwiegen, findet man bei erwachsenen Personen vor allem Gedächtniszellen (TRM, resident memory T cells). Das Gewebe enthält lymphoide Inseln (BALT, bronchus-associated lymphoid tissue) und (nicht MHC-restringierte) γδ-T-Zellen. Darüber hinaus haben Alveolarmakrophagen und einige Epithelzellen Veränderungen erfahren, die auf frühere Infektionen zurückzuführen sind.
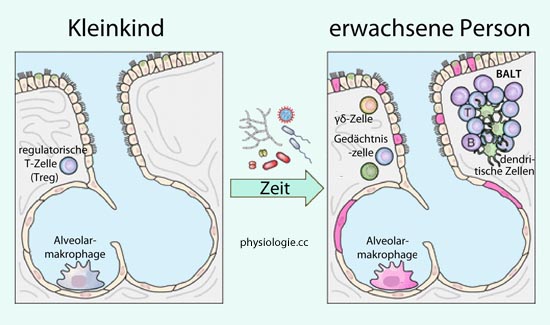
 Abbildung: Immunologische "Reifung" der Lunge
Nach Quinton LJ, Walkey AJ, Mizgerd JP, Integrative Physiology of Pneumonia. Physiol Rev 2018; 98: 1417-64
Abbildung: Immunologische "Reifung" der Lunge
Nach Quinton LJ, Walkey AJ, Mizgerd JP, Integrative Physiology of Pneumonia. Physiol Rev 2018; 98: 1417-64
Durch Kontakt mit, bzw. Infektionen durch Mikroben verändert sich der Immunapparat der Lunge:
 Neugeborene verfügen über Treg-Lymphozyten, Alveolarmakrophagen sind immunologisch unerfahren;
Neugeborene verfügen über Treg-Lymphozyten, Alveolarmakrophagen sind immunologisch unerfahren;
 in der Lunge erwachsener
Personen finden sich hingegen zahlreiche Gedächtniszellen sowie Anteile
von bronchusassoziiertem lymphoidem Gewebe (BALT), dendritische Zellen,
innate lymphoid cells (ILCs), und γδ-T-Zellen; die Alveolarmakrophagen sind immunologisch "trainiert"
in der Lunge erwachsener
Personen finden sich hingegen zahlreiche Gedächtniszellen sowie Anteile
von bronchusassoziiertem lymphoidem Gewebe (BALT), dendritische Zellen,
innate lymphoid cells (ILCs), und γδ-T-Zellen; die Alveolarmakrophagen sind immunologisch "trainiert"

Lungenvolumina: Postpartal
wächst die Lunge und mit ihr nehmen die Volumenkennwerte zu, bis sie im
3. Lebensjahrzehnt ihre Maximalwerte erreichen. Mit
fortschreitendem Alter nimmt die
Vitalkapazität dann bis auf etwa die Hälfte dieser Werte ab
(Abbildung oben); mit steigendem Residualvolumen bleibt die funktionelle Residualkapazität
etwa gleich groß oder kann sogar leicht zunehmen. Der Thorax büßt an
Compliance ein, was auf das gesamte System zutrifft (trotz Steigerung
der Dehnbarkeit der Lunge).
Die Zahl der Alveolen ändert sich mit dem Alter kaum, diejenige der elastischen Fasern und
Lungenkapillaren nimmt aber mit zunehmendem Lebensalter ab, auch die Leistungsfähigkeit der
respiratorischen Muskulatur, insbesondere vis-a-vis abnehmender Dehnbarkeit der Brustwand (reduzierter
Sekundenstoßwert). Degenerative Veränderungen in der Wand der Luftwege
(Elastin, Kollagen) erhöhen deren Kollapsneigung (Atelektasen). Mit zunehmendem Alter sinkt der Betrag des Ventilations / Perfusions- Quotienten.
Durch die Veränderungen des
Lungengewebes nimmt die Wahrscheinlichkeit zu, dass terminale
Abschnitte der Luftwege obstruiert sind, und zu den Effekten der
abnehmenden Dehnbarkeit des Gewebes (Atemlage) kommt so die "gefangene"
Luft distal der Engstellen (trapped air). Die Abstimmung zwischen Ventilation und Perfusion verliert an Optimierung, was sich in reduzierten arteriellen pO2-Werten manifestiert.
Mit zunehmendem Alter nimmt das pulmonale Residualvolumen zu und die Vitalkapazität ab
|
Bei gesunden älteren Menschen führen diese Veränderungen nicht zu einer merklichen Einbuße der Ventilation oder des Gasaustausches. Residualvolumen, inspiratorische Kapazität und Vitalkapazität nehmen mit dem Alter wegen der sinkenden Dehnbarkeit der Thoraxwand ab. Bei chronischen Rauchern kann die Vitalkapazität auf ein Viertel (!) des für das 3. Lebensjahrzehnt typischen Wertes absinken.
Die elastischen Fasern wirken
bronchodilatierend, daher steigt im Alter der Atemwegwiderstand (resistance), und
die Sekundenkapazität (Tiffeneau-Test) ist entsprechend reduziert.
Was die Sauerstoffdiffusion über die Alveolarschranke betrifft, steigt die maximal als physiologisch tolerierbare alveolo-arterielle Sauerstoffdruckdifferenz (A-aO2)
vom 30. Lebensjahr (mit <10 mmHg) pro Jahr um 0,3 mmHg an (Tabelle).
Das reicht für die Versorgung der Gewebe: Bei einem alveolären pO2 von z.B. 100 mmHg wäre dann das Hämoglobin einer 60-jährigen Person bei pO2von ~80 mmHg zu über 90% - und damit ausreichend - sauerstoffgesättigt.
Alter
Jahre
|
A-aO2
mmHg
|
1-30
|
≤ 10
|
40
|
≤ 12
|
50
|
≤ 15
|
70
|
≤ 25
|
Nach Schwartzstein / Parker: Respiratory Physiology - A Clinical Approach. Lippincott Williams & Wilkins 2006
Die Diffusionskapazität der
Alveolarwände nimmt linear mit dem Alter ab, parallel zur sinkenden
Oberfläche (und möglicherweise zum alveolarkapillären Blutvolumen). Der
alveoläre pO2 ist unabhängig vom Lebensalter, die A-aO2 nimmt zu (Tabelle).
 Tastsinn. Der Tastsinn tritt beim Embryo schon ab der 5. Schwangerschaftswoche in Aktion - früher
als jedes andere Sinnessystem. Verstärkt durch die
Berührungsempfindlichkeit der Lanugobehaarung, exploriert der Fetus
bereits intrauterin sich selbst (Eigenberührungen) und seine
unmittelbare Umwelt. Die Mechanosensibilität ist im jugendlichen Alter
(10-19 Jahre) am höchsten.
Tastsinn. Der Tastsinn tritt beim Embryo schon ab der 5. Schwangerschaftswoche in Aktion - früher
als jedes andere Sinnessystem. Verstärkt durch die
Berührungsempfindlichkeit der Lanugobehaarung, exploriert der Fetus
bereits intrauterin sich selbst (Eigenberührungen) und seine
unmittelbare Umwelt. Die Mechanosensibilität ist im jugendlichen Alter
(10-19 Jahre) am höchsten.
Ab einem Alter von ~30 Jahren nimmt sie ab,
ab 70 sehr
deutlich (an den Fingerkuppem von ~0,01 auf ~0,3 g, an der Fußsohle von
~0,3 auf ~4 g Druckschwelle), der Besatz mit Meissner-Körperchen
reduziert sich auf weniger als die Hälfte. Ähnliches gilt für den
Vibrationssinn, dessen Funktion mit dem Alter stark abnimmt. Meldungen
von Gelenksrezeptoren nehmen mit dem Alter ab, vor allem in den Beinen.
 Durch Training der taktilen / haptischen Wahrnehmung
(z.B. physiotherapeutische Berufsausübung) kann der altersbedingten
Abnahme von Druck- und Berührungsempfindlichkeit entgegengewirkt werden.
Durch Training der taktilen / haptischen Wahrnehmung
(z.B. physiotherapeutische Berufsausübung) kann der altersbedingten
Abnahme von Druck- und Berührungsempfindlichkeit entgegengewirkt werden.
 Sehen. Kinder haben eine höhere Produktionsrate an Tränenflüssigkeit (~80 µl/h) als Erwachsene (~40 µl/h).
Sehen. Kinder haben eine höhere Produktionsrate an Tränenflüssigkeit (~80 µl/h) als Erwachsene (~40 µl/h).
Die
Akkommodationsfähigkeit des Auges - bei Kindern bis zu 15 Dioptrien - nimmt mit dem Lebensalter ab (Presbyopie,  Abbildung), bedingt durch die
Verringerung der Linsen-Elastizität: Beim Versuch der Akkommodation
(Naheinstellung) verbleibt die Linse in der (durch den Zug der
Zonulafasern bedingten) abgeflachten Form ("Ferneinstellung") und ist
nicht mehr in der Lage, sich stärker abzurunden und die Brechkraft zu
erhöhen (reduzierte Akkommodationsbreite).
Abbildung), bedingt durch die
Verringerung der Linsen-Elastizität: Beim Versuch der Akkommodation
(Naheinstellung) verbleibt die Linse in der (durch den Zug der
Zonulafasern bedingten) abgeflachten Form ("Ferneinstellung") und ist
nicht mehr in der Lage, sich stärker abzurunden und die Brechkraft zu
erhöhen (reduzierte Akkommodationsbreite).
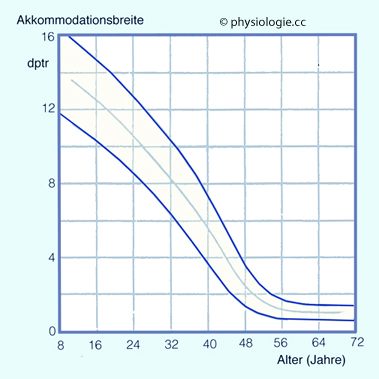
 Abbildung: Die Akkommodationsbreite nimmt mit zunehmendem Alter ab
Abbildung: Die Akkommodationsbreite nimmt mit zunehmendem Alter ab
Nach einer Vorlage bei p.jean2.pagesperso-orange.fr
Die Akkommodationsbreite - angegeben in Dioptrien (dptr) Unterschied zwischen Fern- und Nahpunkt - quantifiziert die verfügbare
Dynamik (Anpassungsfähigkeit) des Akkommodationsapparates
(Ziliarkörper, Linse), unabhängig von allfälliger Kurz- oder
Weitsichtigkeit. Sie nimmt mit zunehmendem Alter ab (Alterssichtigkeit, Presbyopie). Die blauen Kurven ummanteln den Referenzbereich.
Normalerweise
liegt der Fernpunkt im Unendlichen (keine Akkommodation), der Nahpunkt
bei jungen Menschen <1 dm vor dem Auge (Akkommodation um ca. 10 dptr
oder mehr, s. Kurven). Mit zunehmendem Lebensalter rückt der Nahpunkt
weiter vom Auge weg.
Der Akkommodationsbereich
wird ausgedrückt in einer Entfernungsangabe (Fernpunkt minus Nahpunkt),
üblicherseise Metern - und beträgt bei nicht kurzsichtigen Personen
[unendlich]. Das gilt auch für einen presbyopen Menschen, bei dem der
Nahpunkt z.B. auf 1 m Entfernung von Auge wegrückt (Problem:
verringertes Akkommodationsvermögen) sowie für weitsichtige
(hypermetrope) Personen, die beim Blick auf ferne Gegenstände
akkommodieren müssen ("Fernpunkt außerhalb des Unendlichen"), um ein
scharfes Netzhautbild zu erzielen (Problem: Verlust eines Teils des
Anpassungsvermögens). Bei beiden ist der Nahpunkt von Auge weggerückt,
beide brauchen ein Plus-Glas zur Korrektur ("Lesebrille"), ihr
Akkommodationsbereich beträgt aber immer noch [unendlich].
Liegt
der Fernpunkt nicht im Unendlichen, sondern rückt er in die Nähe - dies
ist bei kurzsichtigen (myopen) Personen der Fall -, schrumpft
der Akkommodationsbereich auf einen niedrigen Meter- oder
Dezimeterbereich (manchmal noch stärker), und Korrekturen mit
Minusgläsern ist erforderlich, um eine scharfe Netzhautabbildung
distanter Gegenstände zu ermöglichen. Die Akkommodationsbreite kann
dabei völlig normal sein
Die Akkommodationsbreite beträgt mit 20 Jahren ~10 Dioptrien, mit 40
~6, nimmt im 5. Lebensjahrzehnt stark ab und pendelt sich in
fortgeschrittenem Alter bei ~1 Dioptrie ein. Bei einer altersbedingten
Abnahme auf weniger als 3 dptr Akkommodationsbreite spricht man von Presbyopie  (Alterssichtigkeit).
(Alterssichtigkeit).
Das
bedeutet, dass man nur mehr bis zu ~1m Abstand scharf
sehen kann und eine “Lesebrille” benötigt ( Abbildung) - "die Arme
werden zu kurz zum Lesen". Presbyopie wird mit Sammellinsen zwischen
+0,5 und +3 Dioptrien ausgeglichen.
Abbildung) - "die Arme
werden zu kurz zum Lesen". Presbyopie wird mit Sammellinsen zwischen
+0,5 und +3 Dioptrien ausgeglichen.
Da auch der Weitsichtige
Plus-Gläser braucht, hat sich der falsche Name “Altersweitsichtigkeit”
eingebürgert.
Die Transparenz
der Linse leidet mit zunehmendem Alter; vor allem bei Diabetikern kann
sich eine Linsentrübung (Katarakt) entwickeln, die operativ behoben
werden kann.
 Zu Katarakt und Presbyopie s. auch dort
Zu Katarakt und Presbyopie s. auch dort
 Abbildung: Alterssichtigkeit (Presbyopie)
Abbildung: Alterssichtigkeit (Presbyopie)
Die
Linse verliert ihre Elastizität, trotz Kontraktion des Ziliarmuskels
erfolgt keine Abrundung. Bei Blick auf nahe Gegenstände (divergente
Lichtstrahlen) wandert der Fokus hinter die Netzhaut.
Abhilfe schafft
ein Plus-Glas, das die Lichtstrahlen in eine weniger divergente Bahn
bringt
 Der Augeninnendruck nimmt mit zunehmendem Lebensalter meist ab.
Der Augeninnendruck nimmt mit zunehmendem Lebensalter meist ab.
Im 8.
Lebensjahrzehnt beginnen Strukturen der Netzhaut zu degenerieren, so dass
die Sehfähigkeit geringer wird (Abnahme des Fernvisus).
 Hören. Physiologischerweise bleibt das
Hörvermögen im Frequenzbereich der Sprache (bis 3 kHz) bis ins hohe Alter
erhalten. War man nur selten wesentlichen Lärmbelastungen
ausgesetzt, zeigt sich die Schallempfindlichkeit in niedrigen und mittleren Frequenzbereichen im Wesentlichen
unbeeinflusst von Alterungsprozessen. Veränderungen im Hörnerv können jedoch das
Sprachverständnis reduzieren, insbesondere bei Einwirken gemischter Schallmuster (auditory masking).
Hören. Physiologischerweise bleibt das
Hörvermögen im Frequenzbereich der Sprache (bis 3 kHz) bis ins hohe Alter
erhalten. War man nur selten wesentlichen Lärmbelastungen
ausgesetzt, zeigt sich die Schallempfindlichkeit in niedrigen und mittleren Frequenzbereichen im Wesentlichen
unbeeinflusst von Alterungsprozessen. Veränderungen im Hörnerv können jedoch das
Sprachverständnis reduzieren, insbesondere bei Einwirken gemischter Schallmuster (auditory masking).
Die Schallwahrnehmung in höheren
Frequenzen nimmt mit dem Alter ab (z.B. bei 50-jährigen auf ~12 kHz, im Greisenalter bis auf 5 kHz), wahrscheinlich wegen
Abnutzung der
besonders belasteten vestibulumnahen Teile des Corti´schen Organs
("Fußabstreifereffekt"):
Presbyakusis  (Altersschwerhörigkeit). Bei 60-jährigen kann man mit einem Hörverlust von ~30 dB bei 4 kHz und ~40 dB bei 8 kHz rechnen.
(Altersschwerhörigkeit). Bei 60-jährigen kann man mit einem Hörverlust von ~30 dB bei 4 kHz und ~40 dB bei 8 kHz rechnen.
Verschiedenste
Faktoren beeinflussen die Abnahme des Hörvermögens mit zunehmendem
Alter: Genetische, Ernährung, Schädigung durch Lärm, Stoffwechselerkrankungen (Diabetes), Gifte (ototoxische
Medikamente), Kreislaufbelastungen (Bluthochdruck,
Durchblutungsstörungen).
 Geschmackssinn.
Während junge Erwachsene über ~9000 Geschmacksknospen verfügen, sinkt
diese Zahl bei älteren Menschen auf weniger als die Hälfte. Eine
Abnahme der Intensität des Geschmacksempfindens kann die Folge sein - vor allem der Sinn für Süßes ist reduziert.
Geschmackssinn.
Während junge Erwachsene über ~9000 Geschmacksknospen verfügen, sinkt
diese Zahl bei älteren Menschen auf weniger als die Hälfte. Eine
Abnahme der Intensität des Geschmacksempfindens kann die Folge sein - vor allem der Sinn für Süßes ist reduziert.
Hirnentwicklung und -funktion
 Fetale Entwicklung: Der
Großteil der neokortikalen Zellen entwickelt sich zwischen der 5. Woche
und dem 5. Monat der Schwangerschaft - die Teilungsrate ist in diesem
Zeitraum besonders hoch (in Woche 10 eine Viertelmillion
Neurone
pro Minute). Nervenzellen, die einmal als solche differenziert sind,
teilen sich dann nicht mehr; was sich im Laufe des Lebens ändert, ist
die interneuronale Kommunikation, sowohl in der Zahl der Schaltstellen
und deren synaptischer Effizienz als auch die Verschaltungsmuster
betreffend (Lernprozesse, Erinnerung, Vergessen).
Fetale Entwicklung: Der
Großteil der neokortikalen Zellen entwickelt sich zwischen der 5. Woche
und dem 5. Monat der Schwangerschaft - die Teilungsrate ist in diesem
Zeitraum besonders hoch (in Woche 10 eine Viertelmillion
Neurone
pro Minute). Nervenzellen, die einmal als solche differenziert sind,
teilen sich dann nicht mehr; was sich im Laufe des Lebens ändert, ist
die interneuronale Kommunikation, sowohl in der Zahl der Schaltstellen
und deren synaptischer Effizienz als auch die Verschaltungsmuster
betreffend (Lernprozesse, Erinnerung, Vergessen).
Eine Ausnahme bilden die Nervenzellen im Hippocampus;
der jährliche Verlust von ~2% des Bestandes wird hier durch eine etwa
gleich große Neubildungsrate kompensiert - der hippocampale
Neuronenpool ist dynamisch.
 Abbildung: Neurogenese, Morphogenese, Synaptogenese
Abbildung: Neurogenese, Morphogenese, Synaptogenese
Nach Hur EM, Zhou FQ. GSK3 signalling in neural development. Nature Rev Neurosci 2010; 11: 539-51
Der Großteil der Neuronen entsteht durch Teilung von Gliazellen. In der frühen proliferativen Phase ergibt symmetrische
Teilung in der ventrikulären Zone jeweils zwei radiale Gliazellen, in der späteren neurogenen
Phase teilen sich Gliazellen meist asymmetrisch, d.h. es entsteht
jeweils eine (Vorläufer-) Gliazelle
und ein (postmitotisches) Neuron. Am Ende der Neurogenesephase
durchlaufen einige Gliazellen eine terminale symmetrische Teilung, es
entstehen zwei Neuronen.
Die Wand des Ventrikelbläschens enthält zuerst nur die
Marginal- und ventrikuläre Zone, im Zug der Neuro- und Synaptogenese
entstehen zusätzliche Schichten (subventrikuläre Zone, kortikale Platte
- letztere wächst schließlich zur 2-4 mm dicken Gehirnrinde aus). Die
ventrikuläre Zone ist etwa 10 Zellkörper dick (50-100 µm).
Die Entwicklung neuronaler Verschaltungen kann in mehrere Stadien eingeteilt werden:
 Neurogenese: Vorläuferzellen durchlaufen regulierte Proliferation und Differenzierung;
Neurogenese: Vorläuferzellen durchlaufen regulierte Proliferation und Differenzierung;
 Neuronale Morphogenese: Differenzierte Neuronen wandern unter Anleitung
zahlreicher Faktoren zum Ort ihrer endgültigen Position. Dabei
entwickeln sie Axone und Dendriten;
Neuronale Morphogenese: Differenzierte Neuronen wandern unter Anleitung
zahlreicher Faktoren zum Ort ihrer endgültigen Position. Dabei
entwickeln sie Axone und Dendriten;
 Synaptogenese: Die Neurone stellen ihr Wachstum ein und bilden synaptische Verknüpfungen mit ihren Zielzellen
Synaptogenese: Die Neurone stellen ihr Wachstum ein und bilden synaptische Verknüpfungen mit ihren Zielzellen

Die frühe
Gehirnanlage besteht aus Ventrikelbläschen, die mit einer äußeren
Marginalzone und einer inneren ventrikulären Zone zweischichtig
angelegt sind. Radiär orientierte Gliazellen
strecken ihre Fortsätze durch diese Zonen hindurch. Nachdem ihre
Zellkerne zur Marginalzone aufgestiegen und zur Ventrikelzone wieder
zurückgekehrt sind, retrahieren die radialen Gliazellen ihre Fortsätze
und ihr Zellkern teilt sich - entweder symmetrisch, woraus zwei Gliazellen resultieren (und sich das Spiel wiederholt), oder asymmetrisch, dann entsteht eine Glia- und eine Neuriten-Vorläuferzelle ( Abbildung).
Abbildung).
Nervenzellen (bzw. deren Vorläufer) müssen zu einem definierten Ziel vorwachsen (Auswahl des
Wachstumspfades - pathway selection, des Zielorts - target selection - und der korrekten Zellpopulation - address selection). Dies erfolgt über direkten Zellkontakt (Zelladhäsionsmoleküle CAMs: cell adhesion moloecules) oder über extrazellulär diffundierende Signalstoffe bzw. deren Konzentrationsgradienten: Molekulare Signale wie Netrine, Semaphorine oder Reelin.
Chemoaffinität: Dabei gibt es vom Effekt her sowohl anziehende (chemoattractants) als auch abstoßende Substanzen (chemorepellents). Wirken können diese durch Interaktion mit entsprechenden Rezeptoren
am vorwachsenden Neuriten, die je nach Situation hinauf- oder
herunterreguliert werden. Die Anwesenheit des Signalstoffs alleine
reicht nicht für einen Effekt aus, die Neurit muss auch für die
Botschaft "bereit" (=mit Rezeptoren ausgestattet) sein.
Beispielsweise entscheiden sich Axone, die aus Ganglienzellen der Netzhautanlage vorwachsen, am chiasma opticum
für eine Seite (Fasern von der temporalen Retina kreuzen die Seite
nicht, solche aus der nasalen schon), was zeigt, dass die Axone - je
nach Netzhauthälfte - unterschiedliche Rezeptoren exprimiert haben. Im
corpus geniculatum laterale müssen die Axone anschließend zu bestimmten
Neuronen in der Anlage des corpus geniculatum laterale
finden: Entsprechende Kombinationen von Signalstoffen und Rezeptoren
(z.B. Ephrin-Rezeptoren) steuern die Kontaktnahme der "richtigen" Nervenzellen, um eine korrekte
synaptische Topographie aufzubauen (Chemoaffinitätshypothese).
 Abbildung: Faszikulation
Nach einer Vorlage bei Bear / Connors / Paradiso, Neuroscience - Exploring the Brain, 4th Ed 2016
Abbildung: Faszikulation
Nach einer Vorlage bei Bear / Connors / Paradiso, Neuroscience - Exploring the Brain, 4th Ed 2016
Das
unten dargestellte Axon wächst an einer extrazellulären Leitstruktur
entlang (Migration) - vermittelt durch Integrin-Laminin-Interaktion.
Andere Neuriten "reiten" auf dem Leitaxon, vermittelt über cell adhesion molecules (CAMs). Ergebnis ist das gerichtete Auswachsen eines Faserbündels (Faszikulation)

So bilden sich Dendriten einer Pyramiden-Vorläuferzelle in Richtung
steigender Semaphorinkonzentration aus (zur Marginalzone), Neuriten in
die Gegenrichtung. Leitneurite wachsen entlang extrazellulären Matrixstrukturen (Proteinfasern), an deren Lamininmoleküle sie sich mittels Integrin
binden. Integrine sind auch Rezeptoren für Semaphorine
(s. Tabelle unten) - diese beeinflussen u.a. die Richtung des
Axonwachstums (ihre wichtigsten Bindungspartner sind Plexine - die
Wechselwirkung zwischen Ligand und Rezeptor führt zu einer Ablenkung
des Axonwachstums weg von der Position der Semaphorin-"Quelle").
An Leitneurite können sich mittels CAMs (welche
vorwachsende Axone untereinander verknüpfen) Begleitneurite anschließen, zusammen wachsen diese an extrazellulären
Strukturen entlang und bilden zusammen junge Bahnen aus (Faszikulation,  Abbildung).
Abbildung).
Die folgende Tabelle gibt einige Beispiele für Ligand-Rezeptor-Paare, die für das gesteuerte Aussprossen von Axonen (axon guidance) bedeutsam sind (nach Liqun Luo, Principles of Neurobiology, 2nd ed. 2021):
Ligand
|
Rezeptor
|
Ephrin-A
|
EphA
|
Ephrin-B
|
EphB
|
| EphA |
Ephrin-A |
| EphB |
Ephrin-B |
Semaphorin
|
Plexin; Integrin; Neuropilin
|
Cadherin
|
Cadherin
|
Ig CAM
|
Ig CAM
|
Die Hirnrinde hat sich währenddessen weiterentwickelt: Unter der Marginalzone bilden sich "Platten" aus (cortical plate, subplate),
zwischen denen sich durch Neuronenwanderung Schichten ausbilden -
zuerst VI, dann V etc -, bis sie schließlich verschwinden und die
endgültige Kortexstruktur übrigbleibt. Die "Platten" scheinen die
Information zur richtigen Verschaltung mit extrakortikalen Neuronen zu
beinhalten (z.B. Axone aus dem lateralen Kniehöcker zur primären
Sehrinde, etc).
Bei der Ausbildung von interneuronalen Schaltstellen (Synaptogenese) - die noch in Abwesenheit elektrischer Impulse erfolgt - induzieren zunächst vorwachsende dendritische Filopodien
(die ständig auf der Suche nach Kontakten sind) die Bildung von
Aussprossungen an benachbarten vorwachsenden Axonen. Diese erzeugen
daraufhin synaptische Vesikel und präsynaptische aktive Zonen; und dies induziert wiederum die Ausbildung postsynaptischer Rezeptorcluster
an den betreffenden Dendriten. Dabei kommen verschiedene
Adhäsionsmoleküle ins Spiel, welche die Partnerzellen fester aneinander
knüpfen (viele solcher Kontaktaufnahmen gehen auch ins Leere, wenn sie
sich als "Irrtum" erweisen). Die komplette Ausreifung einer jungen
Synapse kann mehrere Wochen in Anspruch nehmen.
Man unterscheidet insgesamt folgende Stadien der Hirnentwicklung:
 Neurogenese (mitotische Teilung nicht-neuronaler Zellen zur Bildung von Nervenzellen),
Neurogenese (mitotische Teilung nicht-neuronaler Zellen zur Bildung von Nervenzellen),
Zellmigration zu Zielstellen wie Hirnrinde oder Kerne,
Differenzierung von Vorläuferzellen zu speziellen Nerven- und Gliazellen,
Synaptogenese.
Viele Neurone erweisen sich in der Frühentwicklung als entbehrlich und aktivieren ihre eigene Apoptose.
So nimmt beim Fetus die Zahl der spinalen Motoneurone von der 10. bis
zur 30. Gestationswoche um etwa 30% ab, in anderen Regionen kann diese
Reduktion mehr als 50% betragen. Neurotrophe Faktoren wie z.B. NGF oder BDNF (Neurotrophine) erhalten Nervenzellen am Leben.
 Abbildung: Entwicklung der Großhirnrinde
Abbildung: Entwicklung der Großhirnrinde
Nach Poduri A, Evrony GD, Cai X, Walsh CA. Somatic Mutation, Genomic Variation, and Neurological Disease. Science 2013; 341: Issue 6141, 1237758
Das Bild zeigt den Ursprung von Pyramidenzellen und Astrozyten in der Großhirnrinde.
A: Neuroepitheliale Zellen (rot) sind Vorläufer von Neuronen und radiären Gliazellen.
B: Frisch differenzierte Neuronen (blau) migrieren entlang von Gliazellfortsätzen.
C: Neuronen migrieren weiter, es bilden sich intermediäre Vorläuferzellen (gelb).
D: Vorläuferzellen bilden Neuronen (blau).
E: Vorläuferzellen in der ventrikulären Zone bilden Astrozyten (grün). Interneurone (violett) aus anderen Zonen wandern tangential

Die Expression orientierender Moleküle erfolgt in dynamischer Weise nach räumlich-zeitlichen Mustern. Leitsignale wirken attrahierend (Neurit bewegt sich in Richtung zunehmender Konzentration des Signalstoffes) oder repulsiv (Neurit bewegt sich in Richtung abnehmeder Konzentration), und die Expression der Rezeptormoleküle wechselt je nach Lage bzw. Entwicklungsstadium.
Erkennbare anatomische Strukturen des Gehirns treten zu
verschiedenem Gestationsaltern auf. (Über Sexualdimorphismen des
menschlichen Gehirns, die sich bei der geschlechtlichen Entwicklung
herausbilden,  s. dort.)
s. dort.)
Bei
der Geburt ist bereits der vollständige Satz an Nervenzellen des
Neugeborenen gegeben (~100 Milliarden - während der frühen Entwicklung
unterliegen
zahlreiche Neuronen apoptotischem Abbau), die Vernetzung untereinander
wird über mehrere
Jahre entwickelt und verfeinert ("Hirnreifung"). Der Anteil des zephalen Energieverbrauchs beträgt bei Neugeborenen mehr als 60% des gesamten Ruheumsatzes, was auf den enormen Sauerstoff- und Ressourcenbedarf des sich entwickelnden Gehirns hinweist.
Das Gehirngewicht
beträgt beim
Neugeborenen 300-400g (~11% des Körpergewichts!), die höchste Synapsendichte hat
die Großhirnrinde des Menschen mit 1-3 Jahren (50-60 Synapsen / µm3 Kortexmasse). Im Alter von einem Jahr wiegt das Gehirn ~800g, mit vier Jahren ~1200 g;
Erwachsene haben im Durchschnitt 1300 g Hirnmasse (Kleinhirn und
Hirnstamm jeweils mitgerechnet).
Spätere Entwicklung: Bis zum Erwachsenenalter
sinkt die Synapsendichte um rund ein Drittel ab (von 50-60 auf 30-40 Synapsen / µm3). Auch die Zahl der synaptischen spines
nimmt ab, etwa im Frontalhirn von ~50 (Vorschulalter) auf ~20 Spines /
50 µm (Pensionsalter). Parallel dazu nimmt die Ausprägung der grauen
Substanz mit dem Alter ab. Die Myelinisierung
der Nervenzellen erreicht mit etwa 40 Lebensjahren ihren Höhepunkt und
nimmt später langsam wieder ab (damit auch die Leitungsgeschwindigkeit
für Aktionspotentiale).
Das Gehirn beansprucht einen enorm großen Anteil am Stoffwechsel: Der Energieumsatz des Gehirns eines Neugeborenen beansprucht mehr als 60% seines gesamten Ruheumsatzes (bei Erwachsenen
sind es ~25%, auch dies eine hohe Zahl mit Rücksicht auf die Tatsache,
dass das Gehirn erwachsener Personen ~2% zur gesamten Körpermasse
beiträgt).
Hirn-Rückenmarks-Flüssigkeit: Das Liquorvolumen ist individuell sehr unterschiedlich. Säuglinge haben ~50 ml, Kinder ~120 ml, Erwachsene 120-180 ml.
Schlafdauer: Ein
Neugeborenes schläft ~16 Stunden pro Tag, ein einjähriges Kind ~13, ein
vierjähriges ~11, ein Jugendlicher 8-9, ein Erwachsener 6-8 Stunden.
Der Prozentsatz
des REM-Schlafs an der Gesamtschlafdauer ist beim Säugling (50%) und
Kleinkind höher als beim Erwachsenen (20%). Das EEG zeigt bei Kindern
niedrigere Frequenzen als bei Erwachsenen.
Gehirndurchblutung: Die Perfusion nimmt im Alter nur geringgradig ab (bis zu -20% zwischen 30 und 70a), die Gefäßreaktion auf CO2-Schwankungen
bleibt völlig erhalten. Die
Regulationsbreite (Autoregulation) ist im
Alter oft eingeschränkt - niedrigerer Blutdruck führt dann zu
Bewusstseinseinengung, hoher Blutdruck bedingt andererseits die Gefahr
von Hirnblutungen.
Veränderungen in höherem Alter:
Die Nervenleitgeschwindigkeit nimmt in höherem Alter um ~20% der Werte
ab, die mit bis zu 30 Jahren beobachtet werden. Eine Verlagsamung
zentraler Verarbeitungsvorgänge (central processing)
ist nachweisbar, ältere Menschen führen Bewegungen langsamer aus als
junge. Die Kontrolle der Haltung und Körperbalance nimmt an Qualität
ab, Gangunsicherheiten (Sturzgefahr) sind möglich - wozu auch
reduzierte Muskelkraft und sinkende Güte der Propriozeption bzw. des
Sehens beitragen kann.
 Kognitive Leistungen und intellektuelle
Funktionen können vollständig erhalten bleiben; regelmäßige mentale
Beschäftigung stimuliert die Gehirnfunktionen ("brain jogging"),
dies
gilt natürlich für jedes Lebensalter. Das Lernvermögen nimmt im Allgemeinen ab (es
verlangsamt sich), und das Kurzzeitgedächtnis kann beeinträchtigt sein.
Kognitive Leistungen und intellektuelle
Funktionen können vollständig erhalten bleiben; regelmäßige mentale
Beschäftigung stimuliert die Gehirnfunktionen ("brain jogging"),
dies
gilt natürlich für jedes Lebensalter. Das Lernvermögen nimmt im Allgemeinen ab (es
verlangsamt sich), und das Kurzzeitgedächtnis kann beeinträchtigt sein.
Der DNA-Gehalt der Nervenzellen ist
unverändert. Der physiologische Verlust an Nervenzellen im Gehirn wird beim Erwachsenen auf 5-10.104pro
Tag geschätzt, d.h. pro Jahrzehnt <1% des gesamten
Neuronenbestandes (das ergibt hochgerechnet für 100 Jahre weniger als
ein Zehntel des initialen Bestandes). Altersspezifisch ist die
Einlagerung von Lipofuszin ("Alterspigment"). Die
Nervenleitgeschwindigkeit nimmt ab, sehr stark der axonale Transport
von Soma in die Peripherie; Synapsen gehen verloren.
Einige Stellen - insbesondere der Hippokampus - sind zur Neubildung von Neuronen fähig.
Iatrogene Verwirrtheitszustände:
Viele
ältere Patienten haben im Alltag normale Blutdruckwerte, sind aber bei
der
ärztlichen Blutdruckmessung aufgeregt (der Ruheblutdruck stellt sich
erst unter echten Ruhebedingungen ein - mindestens 15 Minuten in einem
ruhigen, abgeschirmten, wohltemperierten Raum, alleine, im Liegen - ein
Szenario, das in der Praxis aus Zeit- und Kostengründen kaum befolgt
wird), erhalten unnötig
blutdrucksenkende Mittel,
welche die Gehirndurchblutung dann zu stark senken -
Müdigkeit und Verwirrtheitszustände können die Folge sein.
Die Menopause erfolgt meist am Ende des 5. Dezenniums; aus Gründen der
Rückkopplung im Hypothalamus steigt der Gonadotropinspiegel stark an.
Der Östrogenspiegel
sinkt mit Beginn der Menopause
aufgrund stark reduzierter Produktion, der Hypothalamus antwortet mit
gesteigerter Gonadotropinausschüttung.
Die vorangehende Prämenopause ist
durch Dysmenorrhoen (unregelmäßige, beschwerliche Regelblutungen)
gekennzeichnet. In der Postmenopause treten oft psychische Probleme
(Depressionen, Stimmungslabilität) auf. Die Ovarien hören auf, Hormone
zu bilden; die hypothalamische Rückkoppelung steigert daraufhin die
Bildung von Gonadotropinen.
Die menopausale Abnahme der Östradiolkonzentration geht mit reduziertem
Energieumsatz einher (Östradiolgabe kann diesen Trend dämpfen).
 Abbildung: Hormonspiegel bei Knaben / jungen Männern als Funktion von Tanner-Stadium bzw. Knochenalter
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Hormonspiegel bei Knaben / jungen Männern als Funktion von Tanner-Stadium bzw. Knochenalter
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Mit der steigenden Gonadotropinproduktion nimmt auch der Testosteronspiegel kontinuierlich zu
Beim Mann
sind die altersabhängigen Veränderungen weniger stark ausgeprägt. SHBG
(Sexhormonbindendes Globulin) ist ein Glykoprotein, das Testosteron
bindet und seine Aktivität
supprimiert. Nur "freies" Testosteron ist biologisch aktiv; sein
Blutspiegel sinkt noch stärker (~1,2% pro Jahr) als der des
Gesamt-Testosterons, mit ~80 Jahren auf etwa die Hälfte des
Spitzenwertes, der sich bei 20jährigen findet.
Die Testosteronsynthese
beträgt im hohen Alter noch etwa 50% des Wertes 20-Jähriger.
 Zu Testosteron und Lebensalter s. dort
Zu Testosteron und Lebensalter s. dort
Die Bildungs- und Transfergeschwindigkeit der Samenzellen ist kaum altersabhängig. Die
Samenbildung geht ab dem 5. Lebensjahrzehnt - mit individuellen Unterschieden und abhängig von der sexuellen Aktivität -
etwas zurück, kann aber bis ins hohe Alter erhalten bleiben.
Allerdings nehmen - insbesondere ab 55 Jahren - viele Kennwerte deutlich ab: ~6,5 Millionen Spermien pro Gramm Hodenparenchym finden sich bei 20-Jährigen, ≤4 Millionen/g bei 60-Jährigen; im Ejakulat ~100 Millionen Spermien/ml bei ~30-jährigen, ~45 Millionen bei ~60-jährigen Männern (u.a. populationsabhängig).
Das Ejakulatvolumen beträgt bei 30-Jährigen im Mittel etwa 3,5 ml, bei 60-Jährigen etwa 2,2 ml (Ursache: Alterung der Samenbläschen); auch die Vorwärtsbeweglichkeit
der Spermien sinkt mit zunehmendem Alter, der Prozentsatz mit maximaler
Motilität um ~0,7% pro Jahr - von >40% um die 30 auf >20% um die
60. Und: Die Zahl der DNA-Schäden in den Spermien steigt mit dem Alter des Mannes).
Die Testosteron-Bildungsrate
nimmt in der Pubertät stark zu, bis Spitzenwerte um ~7 mg/d im 3.
Lebensjahrzehnt erreicht sind; und dann allmählich wieder ab (ziemlich
linear um ~10% pro Jahrzehnt). Der Testosteronspiegel nimmt ab dem 30. Lebensjahr allmählich ab (~1% pro Jahr), dazu nimmt ab dem 35. LJ der
Blutspiegel an Sexualhormonbindendem Globulin SHBG zu.
Im 6. Lebensjahrzehnt tritt etwa bei jedem 3. Mann eine Andropause auf. Häufig
findet sich in diesem Alter eine Vergrößerung der Prostata,
deren Ursache nicht vollständig geklärt und die nur selten bösartig
ist. Die damit verbundene Einengung der
Harnröhre kann eine Operation (Prostatektomie) notwendig machen (ob
dieser Eingriff gerechtfertigt ist, muß individuell vorsichtig
abgewogen werden, insbesondere in Hinblick auf mögliche Folgewirkungen).
Der Testosteronspiegel der Männer sinkt zwar im Mittel mit zunehmendem Lebensalter ab, die entsprechenden Häufigkeitsverteilungen sind allerdings breit und überschneiden sich stark (Tabelle):
Testosteronspiegel und Lebensalter

Werte nach netdoctor.at
|
Alter des Mannes
| Testosteronspiegel
(ng/ml)
|
20-29
|
3,1 - 8,3
|
30-39
|
3,0 - 8,3
|
40-49
|
2,8 - 7,0
|
50-59
|
2,4 - 6,3
|
60-69
|
2,1 - 5,4
|
70 und darüber
|
1,7 - 4,9
|
Niedrige Sexualhormonspiegel verändern u.a. auch die Fettverteilung
(Zunahme viszeralen / abdominellen Fetts). Das kann wiederum einem
metabolischen Syndrom Vorschub leisten und zur Entwicklung von
Erkrankungen wie Bluthochdruck, Koronarsyndrom und Diabetes mellitus
beitragen.

 Der Lebensstil wirkt sich auf die Gesundheit im Alter aus.
Vermeidung dauerhafter belastender Stressfaktoren einerseits,
Ertüchtigung von Geist und Körper andererseits, sowie mäßige
Kalorienzufuhr bei ausreichender Versorgung mit essentiellen
Nährstoffen stärkt die Fitness und erhöht die
Lebenserwartung. Die
Summe an chronischen Erkrankungen und Leiden ist linear mit dem
Lebensalter korreliert; Rüstige und Zuversichtliche leben im
Durchschnitt länger als
Gebrechliche und Verzweifelte - die Psyche hat
direkten Einfluss auf vegetative, hormonelle und immunologische Funktionen.
Der Lebensstil wirkt sich auf die Gesundheit im Alter aus.
Vermeidung dauerhafter belastender Stressfaktoren einerseits,
Ertüchtigung von Geist und Körper andererseits, sowie mäßige
Kalorienzufuhr bei ausreichender Versorgung mit essentiellen
Nährstoffen stärkt die Fitness und erhöht die
Lebenserwartung. Die
Summe an chronischen Erkrankungen und Leiden ist linear mit dem
Lebensalter korreliert; Rüstige und Zuversichtliche leben im
Durchschnitt länger als
Gebrechliche und Verzweifelte - die Psyche hat
direkten Einfluss auf vegetative, hormonelle und immunologische Funktionen.


  Gerontologie beschäftigt sich mit der Physiologie der Alterung Gerontologie beschäftigt sich mit der Physiologie der Alterung
 Sauerstoffradikale (ROS: reactive oxygen species)
regen bis ~100 µM/l Konzentration zelluläre Schutzmechanismen an, bei
steigenden Werten nehmen Gesundheit und Lebenserwartung ab.
Superoxiddismutase, Glutathionperoxidase, Vitamine A / C / E reduzieren
[ROS] ("Radikalfänger") Sauerstoffradikale (ROS: reactive oxygen species)
regen bis ~100 µM/l Konzentration zelluläre Schutzmechanismen an, bei
steigenden Werten nehmen Gesundheit und Lebenserwartung ab.
Superoxiddismutase, Glutathionperoxidase, Vitamine A / C / E reduzieren
[ROS] ("Radikalfänger")
 Bei der Entbindung gelangen Mikroben der Mutter auf das Neugeborene,
dessen Darmflora (zuerst vorwiegend Kolibakterien und Streptokokken)
nach etwa einem Monat stabil etabliert ist; nach 1-2 Jahren bildet sich
eine normale Darmflora aus
Bei der Entbindung gelangen Mikroben der Mutter auf das Neugeborene,
dessen Darmflora (zuerst vorwiegend Kolibakterien und Streptokokken)
nach etwa einem Monat stabil etabliert ist; nach 1-2 Jahren bildet sich
eine normale Darmflora aus
 Die Belastbarkeit von Muskeln, Knochen und Gelenken nimmt mit dem Alter
ab, bedingt durch hormonelle Veränderungen (Abnahme von
Geschlechtshormonen), Bewegungsmangel (Abnahme trophischer Reize),
geringere Regenerationskapazität
Die Belastbarkeit von Muskeln, Knochen und Gelenken nimmt mit dem Alter
ab, bedingt durch hormonelle Veränderungen (Abnahme von
Geschlechtshormonen), Bewegungsmangel (Abnahme trophischer Reize),
geringere Regenerationskapazität
 Das Immunsystem zeigt im Alter eingeschränkte Funktions- und
Anpassungsfähigkeit, der Prozentsatz an Gedächtniszellen im Blut steigt
an
Das Immunsystem zeigt im Alter eingeschränkte Funktions- und
Anpassungsfähigkeit, der Prozentsatz an Gedächtniszellen im Blut steigt
an
 Die Funktionskapazität der Nieren nimmt ab dem 30. Lebensjahr langsam
ab (Durchblutung und glomeruläre Filtration sinken pro Jahr um ca. 1%),
der Autoregulationsbereich steigt leicht an (von ~90 auf ~100 mmHg
arteriellem Blutdruck)
Die Funktionskapazität der Nieren nimmt ab dem 30. Lebensjahr langsam
ab (Durchblutung und glomeruläre Filtration sinken pro Jahr um ca. 1%),
der Autoregulationsbereich steigt leicht an (von ~90 auf ~100 mmHg
arteriellem Blutdruck)
 Die Atmung verändert sich: Die Volumenkennwerte erreichen im 3.
Lebensjahrzehnt maximale Werte. Später nimmt die Vitalkapazität um ~50%
ab, das Residualvolumen steigt, die funktionelle Residualkapazität
bleibt etwa gleich groß. Die Zahl der elastischen Fasern und
Lungenkapillaren sinkt, die Alveolen werden größer, Alveolarsepten
schwinden
Die Atmung verändert sich: Die Volumenkennwerte erreichen im 3.
Lebensjahrzehnt maximale Werte. Später nimmt die Vitalkapazität um ~50%
ab, das Residualvolumen steigt, die funktionelle Residualkapazität
bleibt etwa gleich groß. Die Zahl der elastischen Fasern und
Lungenkapillaren sinkt, die Alveolen werden größer, Alveolarsepten
schwinden
 Aspekte der Leistungsfähigkeit der Sinnesorgane hängen vom
Lebensalter ab (Presbyakusis: Altersschwerhörigkeit, hohe Frequenzen
werden nicht mehr wahrgenommen; Presbyopie: Akkommodationsschwäche,
mangelnde Elastizität der Linse)
Aspekte der Leistungsfähigkeit der Sinnesorgane hängen vom
Lebensalter ab (Presbyakusis: Altersschwerhörigkeit, hohe Frequenzen
werden nicht mehr wahrgenommen; Presbyopie: Akkommodationsschwäche,
mangelnde Elastizität der Linse)
 Hirnfunktionen: Die Großhirnrinde hat ihre höchste Synapsendichte mit
1-3 Jahren Lebensalter und nimmt dann ab (von 50-60 auf 30-40 Synapsen
/ µm3). Die Zahl der synaptischen spines nimmt im Frontalhirn von ~50 (Vorschulalter) auf ~20 Spines / 50 µm (Pensionsalter) ab
Hirnfunktionen: Die Großhirnrinde hat ihre höchste Synapsendichte mit
1-3 Jahren Lebensalter und nimmt dann ab (von 50-60 auf 30-40 Synapsen
/ µm3). Die Zahl der synaptischen spines nimmt im Frontalhirn von ~50 (Vorschulalter) auf ~20 Spines / 50 µm (Pensionsalter) ab
 Das EEG zeigt bei Kindern niedrigere Frequenzen als bei Erwachsenen.
Die Schlafdauer sinkt von ~16 Stunden (Neugeborenes) auf 6-8 Stunden
pro Tag (erwachsene Person). Der Prozentsatz des REM-Schlafs an der
Gesamtschlafdauer ist beim Säugling (50%) und Kleinkind höher als beim
Erwachsenen (20%)
Das EEG zeigt bei Kindern niedrigere Frequenzen als bei Erwachsenen.
Die Schlafdauer sinkt von ~16 Stunden (Neugeborenes) auf 6-8 Stunden
pro Tag (erwachsene Person). Der Prozentsatz des REM-Schlafs an der
Gesamtschlafdauer ist beim Säugling (50%) und Kleinkind höher als beim
Erwachsenen (20%)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.






 Amadori-Verbindungen: Mario Amadori
Amadori-Verbindungen: Mario Amadori Radikale und Lebenserwartung
Radikale und Lebenserwartung
 Stoffwechsel
Stoffwechsel  Verdauungssystem
Verdauungssystem  Bewegungssystem
Bewegungssystem  Haut
Haut  Kreislauf
Kreislauf  Immunsystem
Immunsystem  Niere
Niere  Atmung
Atmung  Sinne
Sinne  Nervensystem
Nervensystem  Sexualfunktionen
Sexualfunktionen
 Radikal, Nukleophilie
Radikal, Nukleophilie
 Molekular (z.B. Reaktionen mit freien Radikalen),
Molekular (z.B. Reaktionen mit freien Radikalen),  zellulär (z.B.
mitochondrielle Schäden, replikative Zellalterung - mit zunehmendem Lebensalter sinkt die zelluläre
Reparations- und Teilungsfähigkeit),
zellulär (z.B.
mitochondrielle Schäden, replikative Zellalterung - mit zunehmendem Lebensalter sinkt die zelluläre
Reparations- und Teilungsfähigkeit),  systemisch (z.B. Schwächung immunologischer
Mechanismen),
systemisch (z.B. Schwächung immunologischer
Mechanismen), umweltbezogen (z.B. Lärm, Luft,
Wasser, Ernährung).
umweltbezogen (z.B. Lärm, Luft,
Wasser, Ernährung). 
 Abbildung: Telomer und Telomerase
Abbildung: Telomer und Telomerase nach ca. 50 Teilungen keine
weitere Mitose mehr zulassen; dieses Limit wird allerdings kaum
erreicht, da die meisten somatischen Zellen innerhalb der erreichbaren
Lebensspanne weniger Mitosen durchlaufen
nach ca. 50 Teilungen keine
weitere Mitose mehr zulassen; dieses Limit wird allerdings kaum
erreicht, da die meisten somatischen Zellen innerhalb der erreichbaren
Lebensspanne weniger Mitosen durchlaufen
 : Jeanne Calment wurde 122,
: Jeanne Calment wurde 122,  : Jiroemon Kimura 116 Jahre alt - mit Stand Ende 2025 sind die ältesten zehn lebenden Menschen Frauen). Die Telomerenlänge
(
: Jiroemon Kimura 116 Jahre alt - mit Stand Ende 2025 sind die ältesten zehn lebenden Menschen Frauen). Die Telomerenlänge
( Abbildung) scheint nicht der limitierende Faktor für die Lebenserwartung zu sein, vielmehr hängt die
Alterung von der Kombination zahlreicher anderer Faktoren ab. Eine wichtige Rolle spielt die Ausgewogenheit:
Abbildung) scheint nicht der limitierende Faktor für die Lebenserwartung zu sein, vielmehr hängt die
Alterung von der Kombination zahlreicher anderer Faktoren ab. Eine wichtige Rolle spielt die Ausgewogenheit: Nicht nur langzeitig zu starke Belastung des Körpers senkt die Lebensdauer: Auch die Unterforderung physiologischer Systeme führt zum Nachlassen von Leistungsfähigkeit und
Widerstandskraft (deconditioning). Das Optimum liegt im Mittelbereich, zwischen den Extremen.
Nicht nur langzeitig zu starke Belastung des Körpers senkt die Lebensdauer: Auch die Unterforderung physiologischer Systeme führt zum Nachlassen von Leistungsfähigkeit und
Widerstandskraft (deconditioning). Das Optimum liegt im Mittelbereich, zwischen den Extremen. So bewirkt Bettlägrigkeit (oder Schwerelosigkeit) Schwund
der Knochen- und Muskelmasse (geringere mechanische Belastung
verschiebt das Funktionsgleichgewicht in Richtung Abbau) und
So bewirkt Bettlägrigkeit (oder Schwerelosigkeit) Schwund
der Knochen- und Muskelmasse (geringere mechanische Belastung
verschiebt das Funktionsgleichgewicht in Richtung Abbau) und
 Kreislaufprobleme (Ausbleiben orthostatischer Belastung reduziert das
Blutdruckregulationsvermögen);
Kreislaufprobleme (Ausbleiben orthostatischer Belastung reduziert das
Blutdruckregulationsvermögen);  übertriebene Hygiene kann zu immunologischen Komplikationen führen (mangelnde Herausforderung des
Immunsystems).
übertriebene Hygiene kann zu immunologischen Komplikationen führen (mangelnde Herausforderung des
Immunsystems). So versteht man unter "primärem" Altern (primary aging) intrinsische
Veränderungen, die mit zunehmenden Lebensjahren unabhängig von
Umwelteinflüssen bzw. Krankheiten auftreten, im Gegensatz zu
So versteht man unter "primärem" Altern (primary aging) intrinsische
Veränderungen, die mit zunehmenden Lebensjahren unabhängig von
Umwelteinflüssen bzw. Krankheiten auftreten, im Gegensatz zu
 "sekundärem" Altern (secondary aging), das auf einer Kombination von intrinsischem Altern und Krankheits- bzw. Umwelteinflüssen beruht (z.B. Infektionen).
"sekundärem" Altern (secondary aging), das auf einer Kombination von intrinsischem Altern und Krankheits- bzw. Umwelteinflüssen beruht (z.B. Infektionen). Gerontologie
Gerontologie
 beschäftigt sich mit physiologischen Alterungsvorgängen (Geriatrie beschäftigt sich hingegen mit altersbedingten Krankheiten).
beschäftigt sich mit physiologischen Alterungsvorgängen (Geriatrie beschäftigt sich hingegen mit altersbedingten Krankheiten). zeigt, dass
Altern nicht einfach als “natürlicher Verschleiß” aufgefasst werden
kann: Personen, die an Progerie leiden, haben Defekte der Reparaturmechanismen, die
normalerweise physiologische Verschleißerscheinungen vollkommen beheben können.
zeigt, dass
Altern nicht einfach als “natürlicher Verschleiß” aufgefasst werden
kann: Personen, die an Progerie leiden, haben Defekte der Reparaturmechanismen, die
normalerweise physiologische Verschleißerscheinungen vollkommen beheben können. )
können differenzierte somatische Zellen zu pluripotenten Zellen
reprogrammieren, was Anlass zu Überlegungen über die Möglichkeit eines
lebensverlängernden Einsatzes "verjüngter" stammzellähnlicher (embryonic stem cell-like cells) bzw. induzierter pluripotenter Zellen (iPSCs) gibt.
)
können differenzierte somatische Zellen zu pluripotenten Zellen
reprogrammieren, was Anlass zu Überlegungen über die Möglichkeit eines
lebensverlängernden Einsatzes "verjüngter" stammzellähnlicher (embryonic stem cell-like cells) bzw. induzierter pluripotenter Zellen (iPSCs) gibt. Unter einem Radikal versteht
man ein Molekül oder Atom mit einem oder mehreren freien
Valenzelektronen, die ihm eine hohe Reaktionsfreudigkeit mit anderen
Teilchen verleihen. Radikale haben eine potentiell
gewebeschädigende Wirkung (z.B. im Rahmen der angeborenen Immunität zur
Bekämpfung in das Gewebe gelangter Mikroorganismen).
Unter einem Radikal versteht
man ein Molekül oder Atom mit einem oder mehreren freien
Valenzelektronen, die ihm eine hohe Reaktionsfreudigkeit mit anderen
Teilchen verleihen. Radikale haben eine potentiell
gewebeschädigende Wirkung (z.B. im Rahmen der angeborenen Immunität zur
Bekämpfung in das Gewebe gelangter Mikroorganismen).
 Abbildung: Sauerstoffradikale (ROS, reactive oxygen species)
Abbildung: Sauerstoffradikale (ROS, reactive oxygen species)
 Abbildung; RNA reactive nitrogen species) zusammen (nicht alle "reaktiven Spezies"
sind freie Radikale). Der
(insbesondere mitochondriale) Stoffwechsel erzeugt reaktionsfreudige Moleküle,
die Zellen schädigen können: Nukleinsäuren, Proteine und Lipide nehmen
in erster Linie Schaden (oxidativer Stress).
Abbildung; RNA reactive nitrogen species) zusammen (nicht alle "reaktiven Spezies"
sind freie Radikale). Der
(insbesondere mitochondriale) Stoffwechsel erzeugt reaktionsfreudige Moleküle,
die Zellen schädigen können: Nukleinsäuren, Proteine und Lipide nehmen
in erster Linie Schaden (oxidativer Stress).  So nutzen Makrophagen und neutrophile Granulozyten ROS zur Abtötung von Baktrerien - dabei entsteht ein respiratory burst (oxidativer Burst), hochreaktive Hydroxylradikale (O2-) helfen beim Abbau attackierter Mikroorganismen. ROS sind eine wichtige Komponente der Immunantwort, um Pathogene abzutöten.
So nutzen Makrophagen und neutrophile Granulozyten ROS zur Abtötung von Baktrerien - dabei entsteht ein respiratory burst (oxidativer Burst), hochreaktive Hydroxylradikale (O2-) helfen beim Abbau attackierter Mikroorganismen. ROS sind eine wichtige Komponente der Immunantwort, um Pathogene abzutöten. Follikelzellen der Schilddrüse bilden Enzyme (Thyreoperoxidase und duale Oxidase), die via Wasserstoffperoxid Jodid (I-) zu Jod oxidieren, das dann in das Hormonmolekül integriert wird.
Follikelzellen der Schilddrüse bilden Enzyme (Thyreoperoxidase und duale Oxidase), die via Wasserstoffperoxid Jodid (I-) zu Jod oxidieren, das dann in das Hormonmolekül integriert wird. Abbildung) verlangsamen oder verhindern die
Oxidation anderer Substanzen und machen Radikale unschädlich (“Radikalfänger”).
Abbildung) verlangsamen oder verhindern die
Oxidation anderer Substanzen und machen Radikale unschädlich (“Radikalfänger”). 
 Abbildung: Glutathionsystem
Abbildung: Glutathionsystem

 Abbildung: "ROS-Waage"
Abbildung: "ROS-Waage"
 Abbildung):
Abbildung):  Antioxidantien,
Antioxidantien,  Radikalfänger,
Radikalfänger,  Hitzeschockproteine,
Hitzeschockproteine,  Unfolded Protein Response (UPR)
- zelluläre Stressantwort zur Wiederherstellung normaler Funktionen
(Abbau falsch gefalteter Proteine, Synthese von Chaperonen)
Unfolded Protein Response (UPR)
- zelluläre Stressantwort zur Wiederherstellung normaler Funktionen
(Abbau falsch gefalteter Proteine, Synthese von Chaperonen) Reparaturmechanismen (DNA repair),
Reparaturmechanismen (DNA repair),  Zellproliferation oder (bei hoher Belastung)
Zellproliferation oder (bei hoher Belastung) Apoptose und Autophagie.
Apoptose und Autophagie.
 Freie Radikale sind Atome / Ionen / Moleküle mit einem unpaaren Elektron in der Außenschale
Freie Radikale sind Atome / Ionen / Moleküle mit einem unpaaren Elektron in der Außenschale Sie sind reaktionsfreudig und beschädigen Proteine, Lipide, Nukleinsäuren
Sie sind reaktionsfreudig und beschädigen Proteine, Lipide, Nukleinsäuren Antioxidantien blockieren ihre Entstehung, Enzyme können sie eliminieren
Antioxidantien blockieren ihre Entstehung, Enzyme können sie eliminieren entstehen als 2. Stufe der Maillard-Reaktion
entstehen als 2. Stufe der Maillard-Reaktion  ; Advanced Glycosylation End-products: AGEs).
Die Bildung solcher AGEs ist vor allem für Proteine relevant, die eine
lange Lebensdauer haben - ihre strukturellen und funktionellen
Eigenschaften sind beeinträchtigt (Glykierungstheorie der Alterung). Hyperglykämie trägt zur Bildung von AGEs bei.
; Advanced Glycosylation End-products: AGEs).
Die Bildung solcher AGEs ist vor allem für Proteine relevant, die eine
lange Lebensdauer haben - ihre strukturellen und funktionellen
Eigenschaften sind beeinträchtigt (Glykierungstheorie der Alterung). Hyperglykämie trägt zur Bildung von AGEs bei.
 Abbildung: Weltweite Lebenserwartung
Abbildung: Weltweite Lebenserwartung
 Im
niedrigen ROS-Konzentrationsbereich überwiegt der anregende Effekt auf
adaptive Antworten, ROS verlängern hier die
Dauer der gesunden Lebensspanne;
Im
niedrigen ROS-Konzentrationsbereich überwiegt der anregende Effekt auf
adaptive Antworten, ROS verlängern hier die
Dauer der gesunden Lebensspanne;  in höherem ROS-Konzentrationsbereich
hingegen überwiegt der schädigende Effekt, Gesundheit und
Lebenserwartung nehmen mit weiter zunehmender ROS-Belastung ab.
in höherem ROS-Konzentrationsbereich
hingegen überwiegt der schädigende Effekt, Gesundheit und
Lebenserwartung nehmen mit weiter zunehmender ROS-Belastung ab.  zeigen (Mitochondrien: "Mitohormese"): Geringe Dosen können eine positive Wirkung auf den
Organismus haben, weil sie adaptive
Schutzreaktionen anregen (Prinzip der "Abhärtung").
zeigen (Mitochondrien: "Mitohormese"): Geringe Dosen können eine positive Wirkung auf den
Organismus haben, weil sie adaptive
Schutzreaktionen anregen (Prinzip der "Abhärtung"). Der
relative
(auf Körpergewicht bzw. Hautoberfläche bezogene) Energieumsatz nimmt
mit zunehmendem Alter ab (maximale Sauerstoffaufnahme von z.B. ~50 auf
~35 ml/kg/min in einer untrainierten männlichen Population). Dies gilt
insbesondere für den Wasseraustausch (Kleinkinder setzen täglich über
50% ihres extrazellulären
Flüssigkeitsvolumens mit der Außenwelt um,
Erwachsene ~15%).
Der
relative
(auf Körpergewicht bzw. Hautoberfläche bezogene) Energieumsatz nimmt
mit zunehmendem Alter ab (maximale Sauerstoffaufnahme von z.B. ~50 auf
~35 ml/kg/min in einer untrainierten männlichen Population). Dies gilt
insbesondere für den Wasseraustausch (Kleinkinder setzen täglich über
50% ihres extrazellulären
Flüssigkeitsvolumens mit der Außenwelt um,
Erwachsene ~15%).  Das Verteilungsmuster von Medikamenten im
Körper ist altersabhängig, weil eine Tendenz zur Zunahme des Anteils
von Fettgewebe am Körpergewicht besteht (bis +100%), was die Speicherung lipophiler Stoffe (Hormone, Pharmaka,..) in der
Lipidphase erhöht. Das Volumen des Gesamtkörperwassers (TBW) nimmt im Alter um bis zu 20% ab, ebenfalls der Serumalbuminspiegel.
Das Verteilungsmuster von Medikamenten im
Körper ist altersabhängig, weil eine Tendenz zur Zunahme des Anteils
von Fettgewebe am Körpergewicht besteht (bis +100%), was die Speicherung lipophiler Stoffe (Hormone, Pharmaka,..) in der
Lipidphase erhöht. Das Volumen des Gesamtkörperwassers (TBW) nimmt im Alter um bis zu 20% ab, ebenfalls der Serumalbuminspiegel. Bei vaginaler Entbindung kommt es zu rascher Übertragung mütterlicher Mikroben auf das Neugeborene,
dessen Darmflora nach etwa einem Monat stabil etabliert ist (bei durch
Kaiserschnitt Entbundenen dauert dieser Prozess länger, auch das
mikrobielle Muster ist anders zusammengesetzt). Zuerst überwiegen
Kolibakterien und Streptokokken; erst nach 1-2 Jahren stellt sich eine Darmflora ein, deren Muster der von Erwachsenen entspricht.
Bei vaginaler Entbindung kommt es zu rascher Übertragung mütterlicher Mikroben auf das Neugeborene,
dessen Darmflora nach etwa einem Monat stabil etabliert ist (bei durch
Kaiserschnitt Entbundenen dauert dieser Prozess länger, auch das
mikrobielle Muster ist anders zusammengesetzt). Zuerst überwiegen
Kolibakterien und Streptokokken; erst nach 1-2 Jahren stellt sich eine Darmflora ein, deren Muster der von Erwachsenen entspricht. Beträgt der First-pass-Effekt
für einen bestimmten oral applizierten Arzneistoff beim jungen Menschen
z.B. 90%, bedeutet das, dass 10% des mit dem Darm aufgenommenen
Pharmakons in die Blutbahn gelangen (10% Bioverfügbarkeit). Reduziert
sich der Effekt im Alter z.B. auf 80%, werden nunmehr 20% des
Pharmakons in den systemischen Kreislauf weitergegeben, d.h. die Bioverfügbarkeit dieses Pharmakons hat sich verdoppelt (Reduktion des first-pass-Effekts von 90 auf 80%).
Beträgt der First-pass-Effekt
für einen bestimmten oral applizierten Arzneistoff beim jungen Menschen
z.B. 90%, bedeutet das, dass 10% des mit dem Darm aufgenommenen
Pharmakons in die Blutbahn gelangen (10% Bioverfügbarkeit). Reduziert
sich der Effekt im Alter z.B. auf 80%, werden nunmehr 20% des
Pharmakons in den systemischen Kreislauf weitergegeben, d.h. die Bioverfügbarkeit dieses Pharmakons hat sich verdoppelt (Reduktion des first-pass-Effekts von 90 auf 80%). Das Erlernen und Anpassen der Motorik ist ein kontinuierlicher Prozess. Zentrale "Mustergeneratoren"
(central pattern generators)
beginnen schon früh in der fetalen Entwicklung, Bewegungsabfolgen
auszulösen - auch ohne sensorischen Input (d.h. die Generierung von
Bewegungsabläufen erfolgt nicht "reflektorisch", sondern spontan
endogen, und ist auch altersspezifisch). Es werden verschiedene
Bewegungsmuster "durchgespielt", deren zeitlicher Ablauf mit Intaktheit
und Reifung der motorischen Zentren korreliert.
Das Erlernen und Anpassen der Motorik ist ein kontinuierlicher Prozess. Zentrale "Mustergeneratoren"
(central pattern generators)
beginnen schon früh in der fetalen Entwicklung, Bewegungsabfolgen
auszulösen - auch ohne sensorischen Input (d.h. die Generierung von
Bewegungsabläufen erfolgt nicht "reflektorisch", sondern spontan
endogen, und ist auch altersspezifisch). Es werden verschiedene
Bewegungsmuster "durchgespielt", deren zeitlicher Ablauf mit Intaktheit
und Reifung der motorischen Zentren korreliert. 
 Abbildung: Altersbedingte Veränderungen im Bewegungssystem
Abbildung: Altersbedingte Veränderungen im Bewegungssystem
 Abbildung). Insbesondere
jenseits der 50 nimmt die Zahl - etwas auch der Durchmesser - der
Muskelfasern ab (Sarkopenie).
Der durchschnittliche Verlust an Muskelmasse bis zu einem Alter von 80a
beträgt im Schnitt etwa 30%, parallel zum Verlust an Myofibrillen. Das
ist teils auf sinkende Aktivierung, teils auf einen laufenden Verlust
von Typ II- motorischen Vorderhornzellen (fast twitch)
- die mit abnehmender Frequenz rekrutiert werden - zurückzuführen. Auch
der axonale Transport in den Vorderhornzellen nimmt ab. Der
prozentuelle Verlust an Muskelfasern ist höher als der an motorischen
Vorderhornzellen. Das bedeutet, die Größe der motorischen Einheiten
nimmt ab, und die Aktivierung einer definierten Muskelkraft wird als
mühsamer empfunden als in jüngeren Jahren.
Abbildung). Insbesondere
jenseits der 50 nimmt die Zahl - etwas auch der Durchmesser - der
Muskelfasern ab (Sarkopenie).
Der durchschnittliche Verlust an Muskelmasse bis zu einem Alter von 80a
beträgt im Schnitt etwa 30%, parallel zum Verlust an Myofibrillen. Das
ist teils auf sinkende Aktivierung, teils auf einen laufenden Verlust
von Typ II- motorischen Vorderhornzellen (fast twitch)
- die mit abnehmender Frequenz rekrutiert werden - zurückzuführen. Auch
der axonale Transport in den Vorderhornzellen nimmt ab. Der
prozentuelle Verlust an Muskelfasern ist höher als der an motorischen
Vorderhornzellen. Das bedeutet, die Größe der motorischen Einheiten
nimmt ab, und die Aktivierung einer definierten Muskelkraft wird als
mühsamer empfunden als in jüngeren Jahren.  Krafttraining im Alter erhöht den Durchmesser der betroffenen
Muskelfasern und wirkt so dem zahlenmäßigen Verlust entgegen.
Krafttraining im Alter erhöht den Durchmesser der betroffenen
Muskelfasern und wirkt so dem zahlenmäßigen Verlust entgegen.
 Abbildung: Knochendichte (gemessen am Calciumgehalt) als Funktion des Lebensalters
Abbildung: Knochendichte (gemessen am Calciumgehalt) als Funktion des Lebensalters
 Abbildung) sind mehrere Faktoren:
Abbildung) sind mehrere Faktoren: Hormonelle Veränderungen: Die Abnahme des Östrogenspiegels
führt zu stärkerer Zunahme der Osteoklasten- als der
Osteoblastentätigkeit, was insgesamt die Knochendichte senkt und das
Frakturrisiko steigert
Hormonelle Veränderungen: Die Abnahme des Östrogenspiegels
führt zu stärkerer Zunahme der Osteoklasten- als der
Osteoblastentätigkeit, was insgesamt die Knochendichte senkt und das
Frakturrisiko steigert Bewegungsmangel (mechanische Belastung übt auf Knochen und Gelenke einen
trophischen Effekt aus)
Bewegungsmangel (mechanische Belastung übt auf Knochen und Gelenke einen
trophischen Effekt aus)  Eingeschränkte metabolische Erneuerung
Eingeschränkte metabolische Erneuerung Fehlernährung
Fehlernährung  Krankheitsbedingte
degenerative Prozesse
Krankheitsbedingte
degenerative Prozesse Regelmäßige Belastung sowie adäquate Ernährung (z.B. ausreichend
Eiweiß) sind wesentliche Faktoren, um dem Altersabbau vorzubeugen. Das
erhöht Gesundheit und Lebensdauer. Studien haben ergeben, dass
bereits regelmäßig durchgeführte tägliche Spaziergänge die Lebenserwartung um mehrere Jahre verlängern können.
Regelmäßige Belastung sowie adäquate Ernährung (z.B. ausreichend
Eiweiß) sind wesentliche Faktoren, um dem Altersabbau vorzubeugen. Das
erhöht Gesundheit und Lebensdauer. Studien haben ergeben, dass
bereits regelmäßig durchgeführte tägliche Spaziergänge die Lebenserwartung um mehrere Jahre verlängern können. Größe und Verteilung der Hautoberfläche sind
altersabhängig: Bei
Neugeborenen und Kindern ist der Anteil der Hautfläche von Kopf und
Rumpf in Relation zur Gesamtfläche höher als bei Erwachsenen.
Unmittelbar nach der Geburt sinkt die Körpertemperatur: relativ große
Hautoberfläche, geringe thermische Isolierung, ungenügende
Thermoregulation.
Größe und Verteilung der Hautoberfläche sind
altersabhängig: Bei
Neugeborenen und Kindern ist der Anteil der Hautfläche von Kopf und
Rumpf in Relation zur Gesamtfläche höher als bei Erwachsenen.
Unmittelbar nach der Geburt sinkt die Körpertemperatur: relativ große
Hautoberfläche, geringe thermische Isolierung, ungenügende
Thermoregulation.  Mit der 5. Gestationswoche sind fetale Herzschläge nachweisbar: Sie erfolgen zunächst mit einer Frequenz von ~85 Schlägen pro Minute (bpm: beats per minute);
die Frequenz beschleunigt sich dann etwa 3 Wochen lang linear um ca.
3,3 bpm pro Tag, bis in der 9. Gestationswoche ein Wert von etwa 175
bpm erreicht wird (
Mit der 5. Gestationswoche sind fetale Herzschläge nachweisbar: Sie erfolgen zunächst mit einer Frequenz von ~85 Schlägen pro Minute (bpm: beats per minute);
die Frequenz beschleunigt sich dann etwa 3 Wochen lang linear um ca.
3,3 bpm pro Tag, bis in der 9. Gestationswoche ein Wert von etwa 175
bpm erreicht wird ( Abbildung). Dann sinkt die Frequenz wieder auf
Werte um die 150 bpm (um die 15. Woche) und bleibt dann ziemlich
konstant auf diesem Wert; bis zur Geburt ist er auf ~140 bpm leicht gesunken.
Abbildung). Dann sinkt die Frequenz wieder auf
Werte um die 150 bpm (um die 15. Woche) und bleibt dann ziemlich
konstant auf diesem Wert; bis zur Geburt ist er auf ~140 bpm leicht gesunken.
 Abbildung: Herzfrequenz des Feten - vom Beginn der Herzschläge bis zur Geburt
Abbildung: Herzfrequenz des Feten - vom Beginn der Herzschläge bis zur Geburt
 Der Kreislauf ist das erste System, das sich beim Embryo ausbildet (Transport von Atemgasen und Nährstoffen des sich entwickelnden Gewebes). Die Bildung von Blutgefäßen (Vaskulogenese) wird durch Signalmoleküle gesteuert: Mesodermale Vorläuferzellen bilden einen Wachstumsfaktor (VEGF-A: Vascular endothelial growth factor A) und seinen Rezeptor (VEGFR-2);
Fehlen eines dieser Faktoren macht Vaskulogenese unmöglich und ist ein
Letalfaktor. VEGF-A spielt im späteren Leben auch eine tragende Rolle
bei der Wundheilung.
Der Kreislauf ist das erste System, das sich beim Embryo ausbildet (Transport von Atemgasen und Nährstoffen des sich entwickelnden Gewebes). Die Bildung von Blutgefäßen (Vaskulogenese) wird durch Signalmoleküle gesteuert: Mesodermale Vorläuferzellen bilden einen Wachstumsfaktor (VEGF-A: Vascular endothelial growth factor A) und seinen Rezeptor (VEGFR-2);
Fehlen eines dieser Faktoren macht Vaskulogenese unmöglich und ist ein
Letalfaktor. VEGF-A spielt im späteren Leben auch eine tragende Rolle
bei der Wundheilung. Näheres s. dort). Funktionsbedingte
Blutdruckschwankungen (Aufregung, Belastung) sind in
der Jugend besonders stark ausgeprägt.
Näheres s. dort). Funktionsbedingte
Blutdruckschwankungen (Aufregung, Belastung) sind in
der Jugend besonders stark ausgeprägt.  Der Hämatokrit
beträgt bei Neugeborenen >50% (gibt hohe
Sauerstofftransportkapazität), bei Einjährigen ~35%, bei Erwachsenen ~40% (Männer 40-50, Frauen 37-47%). Daraus ergeben sich unterschiedliche Hämoglobinwerte (Hb-Konzentration in den Erythrozyten ~340 g/l). Bei
Veränderungen im Blutbild mit dem Alter ist zu berücksichtigen, dass Abnahme der
körperlichen Aktivität zu verringerter Blutbildung führt.
Der Hämatokrit
beträgt bei Neugeborenen >50% (gibt hohe
Sauerstofftransportkapazität), bei Einjährigen ~35%, bei Erwachsenen ~40% (Männer 40-50, Frauen 37-47%). Daraus ergeben sich unterschiedliche Hämoglobinwerte (Hb-Konzentration in den Erythrozyten ~340 g/l). Bei
Veränderungen im Blutbild mit dem Alter ist zu berücksichtigen, dass Abnahme der
körperlichen Aktivität zu verringerter Blutbildung führt. Während der
Entwicklung des Fetus bilden sich verschiedenste Lymphozyten, auch
solche, deren Rezeptoren auf normale, körperspezifische Molekülmuster
passen. Sie werden durch einen speziellen Ausleseprozess vernichtet,
so dass beim routinemäßigen “Check” normaler Körperzellen dann zeitlebens
keine Reaktion der Lymphozyten auftritt - die potentiell gefährlichen
sind ausgeschaltet worden.
Während der
Entwicklung des Fetus bilden sich verschiedenste Lymphozyten, auch
solche, deren Rezeptoren auf normale, körperspezifische Molekülmuster
passen. Sie werden durch einen speziellen Ausleseprozess vernichtet,
so dass beim routinemäßigen “Check” normaler Körperzellen dann zeitlebens
keine Reaktion der Lymphozyten auftritt - die potentiell gefährlichen
sind ausgeschaltet worden.
 Abbildung: Infektionsanfälligkeit von Männern und Frauen mit zunehmendem Alter
Abbildung: Infektionsanfälligkeit von Männern und Frauen mit zunehmendem Alter
 Abbildung). Die Neubildung
von T-Zellen im Thymus nimmt mit
zunehmendem Alter deutlich ab, sodass man insbesondere gegen
Virusinfektionen
(zytotoxische T-Zellen!) anfälliger wird. Deshalb wird empfohlen,
Impfungen
entsprechend vorausschauend zu planen, z.B. schon im 5. Lebensjahrzehnt
in Hinblick auf Reisen, die man für 60+ plant.
Abbildung). Die Neubildung
von T-Zellen im Thymus nimmt mit
zunehmendem Alter deutlich ab, sodass man insbesondere gegen
Virusinfektionen
(zytotoxische T-Zellen!) anfälliger wird. Deshalb wird empfohlen,
Impfungen
entsprechend vorausschauend zu planen, z.B. schon im 5. Lebensjahrzehnt
in Hinblick auf Reisen, die man für 60+ plant. Die
Nieren sind etwa 6 Wochen nach der Geburt voll funktionsfähig. Auf die
Körperoberfläche normierte glomeruläre Filtration und Tubulusfunktion
sind beim Neugeborenen wesentlich geringer
als beim Erwachsenen, daher ist die Verweildauer von Medikamenten, die
renal ausgeschieden werden, etwa 5-fach höher.
Die
Nieren sind etwa 6 Wochen nach der Geburt voll funktionsfähig. Auf die
Körperoberfläche normierte glomeruläre Filtration und Tubulusfunktion
sind beim Neugeborenen wesentlich geringer
als beim Erwachsenen, daher ist die Verweildauer von Medikamenten, die
renal ausgeschieden werden, etwa 5-fach höher. Abbildung).
Abbildung).
 Abbildung: Performance physiologischer Systeme als Funktion des Lebensalters
Abbildung: Performance physiologischer Systeme als Funktion des Lebensalters
 Bis zum 30. Lebensjahr Männer >110 ml/min, Frauen >95 ml/min
Bis zum 30. Lebensjahr Männer >110 ml/min, Frauen >95 ml/min Dann pro Dekade um <10% Abnahme der GFR-Werte
Dann pro Dekade um <10% Abnahme der GFR-Werte
 Abbildung: Scatterplot der ermittelten glomerulären Filtrationsrate bei knapp 3000 Personen
Abbildung: Scatterplot der ermittelten glomerulären Filtrationsrate bei knapp 3000 Personen
 Zur GFR als Funktion des Lebensalters s. dort
Zur GFR als Funktion des Lebensalters s. dort Auch bei Kreatininwerten im Normbereich muss die
Dosierung entsprechender Medikamente mit zunehmendem Alter reduziert
werden.
Auch bei Kreatininwerten im Normbereich muss die
Dosierung entsprechender Medikamente mit zunehmendem Alter reduziert
werden.  Die
Ruhe-Atemfrequenz des Neugeborenen beträgt ~50 Atemzüge / Minute, bei
Kindern im Volksschulalter ~20/min, bei Erwachsenen ~12/min.
Die
Ruhe-Atemfrequenz des Neugeborenen beträgt ~50 Atemzüge / Minute, bei
Kindern im Volksschulalter ~20/min, bei Erwachsenen ~12/min. Abbildung). Während im Lungengewebe von Neugeborenen regulatorische T-Lymphozyten (Treg) überwiegen, findet man bei erwachsenen Personen vor allem Gedächtniszellen (TRM, resident memory T cells). Das Gewebe enthält lymphoide Inseln (BALT, bronchus-associated lymphoid tissue) und (nicht MHC-restringierte) γδ-T-Zellen. Darüber hinaus haben Alveolarmakrophagen und einige Epithelzellen Veränderungen erfahren, die auf frühere Infektionen zurückzuführen sind.
Abbildung). Während im Lungengewebe von Neugeborenen regulatorische T-Lymphozyten (Treg) überwiegen, findet man bei erwachsenen Personen vor allem Gedächtniszellen (TRM, resident memory T cells). Das Gewebe enthält lymphoide Inseln (BALT, bronchus-associated lymphoid tissue) und (nicht MHC-restringierte) γδ-T-Zellen. Darüber hinaus haben Alveolarmakrophagen und einige Epithelzellen Veränderungen erfahren, die auf frühere Infektionen zurückzuführen sind.
 Abbildung: Immunologische "Reifung" der Lunge
Abbildung: Immunologische "Reifung" der Lunge Neugeborene verfügen über Treg-Lymphozyten, Alveolarmakrophagen sind immunologisch unerfahren;
Neugeborene verfügen über Treg-Lymphozyten, Alveolarmakrophagen sind immunologisch unerfahren; in der Lunge erwachsener
Personen finden sich hingegen zahlreiche Gedächtniszellen sowie Anteile
von bronchusassoziiertem lymphoidem Gewebe (BALT), dendritische Zellen,
innate lymphoid cells (ILCs), und γδ-T-Zellen; die Alveolarmakrophagen sind immunologisch "trainiert"
in der Lunge erwachsener
Personen finden sich hingegen zahlreiche Gedächtniszellen sowie Anteile
von bronchusassoziiertem lymphoidem Gewebe (BALT), dendritische Zellen,
innate lymphoid cells (ILCs), und γδ-T-Zellen; die Alveolarmakrophagen sind immunologisch "trainiert"
 Tastsinn. Der Tastsinn tritt beim Embryo schon ab der 5. Schwangerschaftswoche in Aktion - früher
als jedes andere Sinnessystem. Verstärkt durch die
Berührungsempfindlichkeit der Lanugobehaarung, exploriert der Fetus
bereits intrauterin sich selbst (Eigenberührungen) und seine
unmittelbare Umwelt. Die Mechanosensibilität ist im jugendlichen Alter
(10-19 Jahre) am höchsten.
Tastsinn. Der Tastsinn tritt beim Embryo schon ab der 5. Schwangerschaftswoche in Aktion - früher
als jedes andere Sinnessystem. Verstärkt durch die
Berührungsempfindlichkeit der Lanugobehaarung, exploriert der Fetus
bereits intrauterin sich selbst (Eigenberührungen) und seine
unmittelbare Umwelt. Die Mechanosensibilität ist im jugendlichen Alter
(10-19 Jahre) am höchsten.  Durch Training der taktilen / haptischen Wahrnehmung
(z.B. physiotherapeutische Berufsausübung) kann der altersbedingten
Abnahme von Druck- und Berührungsempfindlichkeit entgegengewirkt werden.
Durch Training der taktilen / haptischen Wahrnehmung
(z.B. physiotherapeutische Berufsausübung) kann der altersbedingten
Abnahme von Druck- und Berührungsempfindlichkeit entgegengewirkt werden. Sehen. Kinder haben eine höhere Produktionsrate an Tränenflüssigkeit (~80 µl/h) als Erwachsene (~40 µl/h).
Sehen. Kinder haben eine höhere Produktionsrate an Tränenflüssigkeit (~80 µl/h) als Erwachsene (~40 µl/h). Abbildung), bedingt durch die
Verringerung der Linsen-Elastizität: Beim Versuch der Akkommodation
(Naheinstellung) verbleibt die Linse in der (durch den Zug der
Zonulafasern bedingten) abgeflachten Form ("Ferneinstellung") und ist
nicht mehr in der Lage, sich stärker abzurunden und die Brechkraft zu
erhöhen (reduzierte Akkommodationsbreite).
Abbildung), bedingt durch die
Verringerung der Linsen-Elastizität: Beim Versuch der Akkommodation
(Naheinstellung) verbleibt die Linse in der (durch den Zug der
Zonulafasern bedingten) abgeflachten Form ("Ferneinstellung") und ist
nicht mehr in der Lage, sich stärker abzurunden und die Brechkraft zu
erhöhen (reduzierte Akkommodationsbreite).
 Abbildung: Die Akkommodationsbreite nimmt mit zunehmendem Alter ab
Abbildung: Die Akkommodationsbreite nimmt mit zunehmendem Alter ab (Alterssichtigkeit).
(Alterssichtigkeit).  Abbildung) - "die Arme
werden zu kurz zum Lesen". Presbyopie wird mit Sammellinsen zwischen
+0,5 und +3 Dioptrien ausgeglichen.
Abbildung) - "die Arme
werden zu kurz zum Lesen". Presbyopie wird mit Sammellinsen zwischen
+0,5 und +3 Dioptrien ausgeglichen. 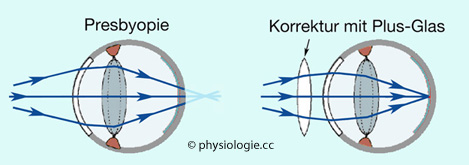
 Abbildung: Alterssichtigkeit (Presbyopie)
Abbildung: Alterssichtigkeit (Presbyopie)
 Hören. Physiologischerweise bleibt das
Hörvermögen im Frequenzbereich der Sprache (bis 3 kHz) bis ins hohe Alter
erhalten. War man nur selten wesentlichen Lärmbelastungen
ausgesetzt, zeigt sich die Schallempfindlichkeit in niedrigen und mittleren Frequenzbereichen im Wesentlichen
unbeeinflusst von Alterungsprozessen. Veränderungen im Hörnerv können jedoch das
Sprachverständnis reduzieren, insbesondere bei Einwirken gemischter Schallmuster (auditory masking).
Hören. Physiologischerweise bleibt das
Hörvermögen im Frequenzbereich der Sprache (bis 3 kHz) bis ins hohe Alter
erhalten. War man nur selten wesentlichen Lärmbelastungen
ausgesetzt, zeigt sich die Schallempfindlichkeit in niedrigen und mittleren Frequenzbereichen im Wesentlichen
unbeeinflusst von Alterungsprozessen. Veränderungen im Hörnerv können jedoch das
Sprachverständnis reduzieren, insbesondere bei Einwirken gemischter Schallmuster (auditory masking).  (Altersschwerhörigkeit). Bei 60-jährigen kann man mit einem Hörverlust von ~30 dB bei 4 kHz und ~40 dB bei 8 kHz rechnen.
(Altersschwerhörigkeit). Bei 60-jährigen kann man mit einem Hörverlust von ~30 dB bei 4 kHz und ~40 dB bei 8 kHz rechnen. Geschmackssinn.
Während junge Erwachsene über ~9000 Geschmacksknospen verfügen, sinkt
diese Zahl bei älteren Menschen auf weniger als die Hälfte. Eine
Abnahme der Intensität des Geschmacksempfindens kann die Folge sein - vor allem der Sinn für Süßes ist reduziert.
Geschmackssinn.
Während junge Erwachsene über ~9000 Geschmacksknospen verfügen, sinkt
diese Zahl bei älteren Menschen auf weniger als die Hälfte. Eine
Abnahme der Intensität des Geschmacksempfindens kann die Folge sein - vor allem der Sinn für Süßes ist reduziert.
 Fetale Entwicklung: Der
Großteil der neokortikalen Zellen entwickelt sich zwischen der 5. Woche
und dem 5. Monat der Schwangerschaft - die Teilungsrate ist in diesem
Zeitraum besonders hoch (in Woche 10 eine Viertelmillion
Neurone
pro Minute). Nervenzellen, die einmal als solche differenziert sind,
teilen sich dann nicht mehr; was sich im Laufe des Lebens ändert, ist
die interneuronale Kommunikation, sowohl in der Zahl der Schaltstellen
und deren synaptischer Effizienz als auch die Verschaltungsmuster
betreffend (Lernprozesse, Erinnerung, Vergessen).
Fetale Entwicklung: Der
Großteil der neokortikalen Zellen entwickelt sich zwischen der 5. Woche
und dem 5. Monat der Schwangerschaft - die Teilungsrate ist in diesem
Zeitraum besonders hoch (in Woche 10 eine Viertelmillion
Neurone
pro Minute). Nervenzellen, die einmal als solche differenziert sind,
teilen sich dann nicht mehr; was sich im Laufe des Lebens ändert, ist
die interneuronale Kommunikation, sowohl in der Zahl der Schaltstellen
und deren synaptischer Effizienz als auch die Verschaltungsmuster
betreffend (Lernprozesse, Erinnerung, Vergessen). 
 Abbildung: Neurogenese, Morphogenese, Synaptogenese
Abbildung: Neurogenese, Morphogenese, Synaptogenese Neurogenese: Vorläuferzellen durchlaufen regulierte Proliferation und Differenzierung;
Neurogenese: Vorläuferzellen durchlaufen regulierte Proliferation und Differenzierung; Neuronale Morphogenese: Differenzierte Neuronen wandern unter Anleitung
zahlreicher Faktoren zum Ort ihrer endgültigen Position. Dabei
entwickeln sie Axone und Dendriten;
Neuronale Morphogenese: Differenzierte Neuronen wandern unter Anleitung
zahlreicher Faktoren zum Ort ihrer endgültigen Position. Dabei
entwickeln sie Axone und Dendriten; Synaptogenese: Die Neurone stellen ihr Wachstum ein und bilden synaptische Verknüpfungen mit ihren Zielzellen
Synaptogenese: Die Neurone stellen ihr Wachstum ein und bilden synaptische Verknüpfungen mit ihren Zielzellen
 Abbildung).
Abbildung).
 Abbildung: Faszikulation
Abbildung: Faszikulation
 Abbildung).
Abbildung).  Neurogenese (mitotische Teilung nicht-neuronaler Zellen zur Bildung von Nervenzellen),
Neurogenese (mitotische Teilung nicht-neuronaler Zellen zur Bildung von Nervenzellen), 
 Abbildung: Entwicklung der Großhirnrinde
Abbildung: Entwicklung der Großhirnrinde
 s. dort.)
s. dort.)  Kognitive Leistungen und intellektuelle
Funktionen können vollständig erhalten bleiben; regelmäßige mentale
Beschäftigung stimuliert die Gehirnfunktionen ("brain jogging"),
dies
gilt natürlich für jedes Lebensalter. Das Lernvermögen nimmt im Allgemeinen ab (es
verlangsamt sich), und das Kurzzeitgedächtnis kann beeinträchtigt sein.
Kognitive Leistungen und intellektuelle
Funktionen können vollständig erhalten bleiben; regelmäßige mentale
Beschäftigung stimuliert die Gehirnfunktionen ("brain jogging"),
dies
gilt natürlich für jedes Lebensalter. Das Lernvermögen nimmt im Allgemeinen ab (es
verlangsamt sich), und das Kurzzeitgedächtnis kann beeinträchtigt sein.
 Abbildung: Meiose bei Mann und Frau (Mitte, rechts) im Vergleich zur Mitose (links)
Abbildung: Meiose bei Mann und Frau (Mitte, rechts) im Vergleich zur Mitose (links) Zu den Phasen der Zellteilung (Prophase bis Telophase) s. dort
Zu den Phasen der Zellteilung (Prophase bis Telophase) s. dort Über die altersabhängige Entwicklung von Gonaden, Gametern, Ei- und Samenzellen s. dort
Über die altersabhängige Entwicklung von Gonaden, Gametern, Ei- und Samenzellen s. dort 
 Abbildung: Hormonspiegel bei Knaben / jungen Männern als Funktion von Tanner-Stadium bzw. Knochenalter
Abbildung: Hormonspiegel bei Knaben / jungen Männern als Funktion von Tanner-Stadium bzw. Knochenalter


 Der Lebensstil wirkt sich auf die Gesundheit im Alter aus.
Vermeidung dauerhafter belastender Stressfaktoren einerseits,
Ertüchtigung von Geist und Körper andererseits, sowie mäßige
Kalorienzufuhr bei ausreichender Versorgung mit essentiellen
Nährstoffen stärkt die Fitness und erhöht die
Lebenserwartung. Die
Summe an chronischen Erkrankungen und Leiden ist linear mit dem
Lebensalter korreliert; Rüstige und Zuversichtliche leben im
Durchschnitt länger als
Gebrechliche und Verzweifelte - die Psyche hat
direkten Einfluss auf vegetative, hormonelle und immunologische Funktionen.
Der Lebensstil wirkt sich auf die Gesundheit im Alter aus.
Vermeidung dauerhafter belastender Stressfaktoren einerseits,
Ertüchtigung von Geist und Körper andererseits, sowie mäßige
Kalorienzufuhr bei ausreichender Versorgung mit essentiellen
Nährstoffen stärkt die Fitness und erhöht die
Lebenserwartung. Die
Summe an chronischen Erkrankungen und Leiden ist linear mit dem
Lebensalter korreliert; Rüstige und Zuversichtliche leben im
Durchschnitt länger als
Gebrechliche und Verzweifelte - die Psyche hat
direkten Einfluss auf vegetative, hormonelle und immunologische Funktionen.


 Gerontologie beschäftigt sich mit der Physiologie der Alterung
Gerontologie beschäftigt sich mit der Physiologie der Alterung Sauerstoffradikale (ROS: reactive oxygen species)
regen bis ~100 µM/l Konzentration zelluläre Schutzmechanismen an, bei
steigenden Werten nehmen Gesundheit und Lebenserwartung ab.
Superoxiddismutase, Glutathionperoxidase, Vitamine A / C / E reduzieren
[ROS] ("Radikalfänger")
Sauerstoffradikale (ROS: reactive oxygen species)
regen bis ~100 µM/l Konzentration zelluläre Schutzmechanismen an, bei
steigenden Werten nehmen Gesundheit und Lebenserwartung ab.
Superoxiddismutase, Glutathionperoxidase, Vitamine A / C / E reduzieren
[ROS] ("Radikalfänger") Bei der Entbindung gelangen Mikroben der Mutter auf das Neugeborene,
dessen Darmflora (zuerst vorwiegend Kolibakterien und Streptokokken)
nach etwa einem Monat stabil etabliert ist; nach 1-2 Jahren bildet sich
eine normale Darmflora aus
Bei der Entbindung gelangen Mikroben der Mutter auf das Neugeborene,
dessen Darmflora (zuerst vorwiegend Kolibakterien und Streptokokken)
nach etwa einem Monat stabil etabliert ist; nach 1-2 Jahren bildet sich
eine normale Darmflora aus Die Belastbarkeit von Muskeln, Knochen und Gelenken nimmt mit dem Alter
ab, bedingt durch hormonelle Veränderungen (Abnahme von
Geschlechtshormonen), Bewegungsmangel (Abnahme trophischer Reize),
geringere Regenerationskapazität
Die Belastbarkeit von Muskeln, Knochen und Gelenken nimmt mit dem Alter
ab, bedingt durch hormonelle Veränderungen (Abnahme von
Geschlechtshormonen), Bewegungsmangel (Abnahme trophischer Reize),
geringere Regenerationskapazität Das Immunsystem zeigt im Alter eingeschränkte Funktions- und
Anpassungsfähigkeit, der Prozentsatz an Gedächtniszellen im Blut steigt
an
Das Immunsystem zeigt im Alter eingeschränkte Funktions- und
Anpassungsfähigkeit, der Prozentsatz an Gedächtniszellen im Blut steigt
an Die Funktionskapazität der Nieren nimmt ab dem 30. Lebensjahr langsam
ab (Durchblutung und glomeruläre Filtration sinken pro Jahr um ca. 1%),
der Autoregulationsbereich steigt leicht an (von ~90 auf ~100 mmHg
arteriellem Blutdruck)
Die Funktionskapazität der Nieren nimmt ab dem 30. Lebensjahr langsam
ab (Durchblutung und glomeruläre Filtration sinken pro Jahr um ca. 1%),
der Autoregulationsbereich steigt leicht an (von ~90 auf ~100 mmHg
arteriellem Blutdruck) Die Atmung verändert sich: Die Volumenkennwerte erreichen im 3.
Lebensjahrzehnt maximale Werte. Später nimmt die Vitalkapazität um ~50%
ab, das Residualvolumen steigt, die funktionelle Residualkapazität
bleibt etwa gleich groß. Die Zahl der elastischen Fasern und
Lungenkapillaren sinkt, die Alveolen werden größer, Alveolarsepten
schwinden
Die Atmung verändert sich: Die Volumenkennwerte erreichen im 3.
Lebensjahrzehnt maximale Werte. Später nimmt die Vitalkapazität um ~50%
ab, das Residualvolumen steigt, die funktionelle Residualkapazität
bleibt etwa gleich groß. Die Zahl der elastischen Fasern und
Lungenkapillaren sinkt, die Alveolen werden größer, Alveolarsepten
schwinden Aspekte der Leistungsfähigkeit der Sinnesorgane hängen vom
Lebensalter ab (Presbyakusis: Altersschwerhörigkeit, hohe Frequenzen
werden nicht mehr wahrgenommen; Presbyopie: Akkommodationsschwäche,
mangelnde Elastizität der Linse)
Aspekte der Leistungsfähigkeit der Sinnesorgane hängen vom
Lebensalter ab (Presbyakusis: Altersschwerhörigkeit, hohe Frequenzen
werden nicht mehr wahrgenommen; Presbyopie: Akkommodationsschwäche,
mangelnde Elastizität der Linse) Hirnfunktionen: Die Großhirnrinde hat ihre höchste Synapsendichte mit
1-3 Jahren Lebensalter und nimmt dann ab (von 50-60 auf 30-40 Synapsen
/ µm3). Die Zahl der synaptischen spines nimmt im Frontalhirn von ~50 (Vorschulalter) auf ~20 Spines / 50 µm (Pensionsalter) ab
Hirnfunktionen: Die Großhirnrinde hat ihre höchste Synapsendichte mit
1-3 Jahren Lebensalter und nimmt dann ab (von 50-60 auf 30-40 Synapsen
/ µm3). Die Zahl der synaptischen spines nimmt im Frontalhirn von ~50 (Vorschulalter) auf ~20 Spines / 50 µm (Pensionsalter) ab Das EEG zeigt bei Kindern niedrigere Frequenzen als bei Erwachsenen.
Die Schlafdauer sinkt von ~16 Stunden (Neugeborenes) auf 6-8 Stunden
pro Tag (erwachsene Person). Der Prozentsatz des REM-Schlafs an der
Gesamtschlafdauer ist beim Säugling (50%) und Kleinkind höher als beim
Erwachsenen (20%)
Das EEG zeigt bei Kindern niedrigere Frequenzen als bei Erwachsenen.
Die Schlafdauer sinkt von ~16 Stunden (Neugeborenes) auf 6-8 Stunden
pro Tag (erwachsene Person). Der Prozentsatz des REM-Schlafs an der
Gesamtschlafdauer ist beim Säugling (50%) und Kleinkind höher als beim
Erwachsenen (20%)