

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Hepatozyten
Hepatozyten
 Cholesterin: χολή = Galle, στερεός = fest (Gallenstein!)
Cholesterin: χολή = Galle, στερεός = fest (Gallenstein!)| Lebergewebe
ist regenerationsfähig: Hepatozyten (Leberzellen) teilen und erneuern sich stetig,
angeregt durch endokrine Faktoren. Die Entfernung von bis zu 75% des Lebergewebes kann durch kompensatorische
Hyperplasie wettgemacht werden. Mittels gap
junctions sind Hepatozyten miteinander verknüpft (interzellulärer Signal- und Stoffaustausch). Leberzellen sind polar organisiert, ihre Ausstattung mit Transportern unterscheidet sich basolateral-perisinusoidal (blutseitig) von der apikal-kanalikulären Seite (Gallenkapillaren) - das ermöglicht spezifischen Austausch mit Interstitium einerseits, biliärem System andererseits. Mikrovilli vergrößern hier die Membranflächen, die gesamte Oberfläche der Gallenkapillaren wird auf 10 m2 geschätzt; tight junctions und Desmosomen dichten die Gallenkanäle ab. Basolaterale Membrantransporter lassen die Aufnahme von Stoffen aus dem Pfortaderblut zu, z.B. rückresorbierte Gallensalze über NTCP (Natrium-taurocholate cotransporting peptide). Organische Anionen betreten die Hepatozyten über OATP (organic anion transport proteins), Kationen über OCT (organic cation transporters); die basolaterale Membran exozytiert Stoffe mittels MRP (multidrug resistance-associated proteins). An der apikalen Membran transportieren MRP Bilirubinglukuronid, BSEP (bile salt export pump) Gallensalze, BCRP (breast cancer resistance protein) sulfatierte Steroid- und Gallensäurekonjugate aus der Zelle in die Gallenflüssigkeit. |
 Speicherung, Transformation, Aktivierung
Speicherung, Transformation, Aktivierung  Polare Organisation
Polare Organisation  Gallenbildung
Gallenbildung
 Core messages
Core messages
 Abbildung: Transportsysteme in Hepatozyten
Abbildung: Transportsysteme in Hepatozyten GLUT2 s. dort
GLUT2 s. dort 
 Regenerierung:
Hepatozyten
werden ständig neu gebildet, alte Zellen werden ersetzt; zu ihrer
mittleren Lebensdauer gibt es unterschiedliche Angaben (1-8 Monate).
Regenerierung:
Hepatozyten
werden ständig neu gebildet, alte Zellen werden ersetzt; zu ihrer
mittleren Lebensdauer gibt es unterschiedliche Angaben (1-8 Monate). 
 ~25% hepatische Organmasse reichen für das kompensatorische Wachstum zum
Volumen einer vollständigen
Leber aus; die ursprüngliche Organisation (Form) des
Organs stellt sich dabei allerdings nicht wieder her:
Nicht die Anatomie, sondern die funktionelle Masse wird restauriert (kompensatorische Hyperplasie).
~25% hepatische Organmasse reichen für das kompensatorische Wachstum zum
Volumen einer vollständigen
Leber aus; die ursprüngliche Organisation (Form) des
Organs stellt sich dabei allerdings nicht wieder her:
Nicht die Anatomie, sondern die funktionelle Masse wird restauriert (kompensatorische Hyperplasie).
 Entfernung von Teilen der Leber kann zu mehr als 20-fachem HGF-Anstieg im Blut führen.
Entfernung von Teilen der Leber kann zu mehr als 20-fachem HGF-Anstieg im Blut führen.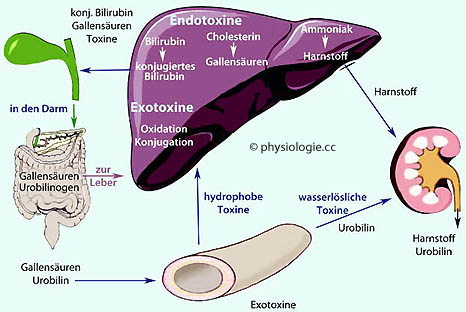
 Abbildung:
Ausscheidung von Bilirubin, Gallensäuren, Harnstoff, Toxinen
Abbildung:
Ausscheidung von Bilirubin, Gallensäuren, Harnstoff, Toxinen
 Speicherfunktion:
Je nach Situation kann die Leber Kohlenhydrate speichern (postprandial:
Glykogenbildung) oder im Bedarfsfall bereitstellen (Glykogenolyse, Gluconeogenese); sie stellt also einen wichtigen metabolischen Puffer
dar.
Speicherfunktion:
Je nach Situation kann die Leber Kohlenhydrate speichern (postprandial:
Glykogenbildung) oder im Bedarfsfall bereitstellen (Glykogenolyse, Gluconeogenese); sie stellt also einen wichtigen metabolischen Puffer
dar.  Endokrine Aktivität: Leberzellen aktivieren Hormone:
Endokrine Aktivität: Leberzellen aktivieren Hormone: Flüssigkeitsspeicher: Die Leber wirkt an der Regulierung des osmotischen Gleichgewichts mit. Sie dient als
“osmotischer
Puffer” (über 1 Liter Flüssigkeit - intrazellulär und interstitiell -
plus ~0,5 Liter Blut) und enthält Osmorezeptoren, die osmotische Schwankungen an das Gehirn melden, was
osmoregulatorische Kompensationsmaßnahmen zur Folge hat.
Flüssigkeitsspeicher: Die Leber wirkt an der Regulierung des osmotischen Gleichgewichts mit. Sie dient als
“osmotischer
Puffer” (über 1 Liter Flüssigkeit - intrazellulär und interstitiell -
plus ~0,5 Liter Blut) und enthält Osmorezeptoren, die osmotische Schwankungen an das Gehirn melden, was
osmoregulatorische Kompensationsmaßnahmen zur Folge hat. Biotransformation: Einige
Medikamente und Signalstoffe werden erst in der Leber aktiviert:
Biotransformation: Einige
Medikamente und Signalstoffe werden erst in der Leber aktiviert:  Thyroxin wird zu T3 umgewandelt;
Thyroxin wird zu T3 umgewandelt;  das
Wachstumshormon regt die Bildung der Somatomedine an.
das
Wachstumshormon regt die Bildung der Somatomedine an.  Andere Stoffe
werden abgebaut (Insulin, Glukagon, Steroide, Eikosanoide)
Andere Stoffe
werden abgebaut (Insulin, Glukagon, Steroide, Eikosanoide)  oder durch
Konjugation (Wasserlöslichkeit durch Verknüpfung mit Begleitstoffen)
für die Entfernung durch Galle und Niere vorbereitet (Entgiftung,
Ausscheidung).
oder durch
Konjugation (Wasserlöslichkeit durch Verknüpfung mit Begleitstoffen)
für die Entfernung durch Galle und Niere vorbereitet (Entgiftung,
Ausscheidung).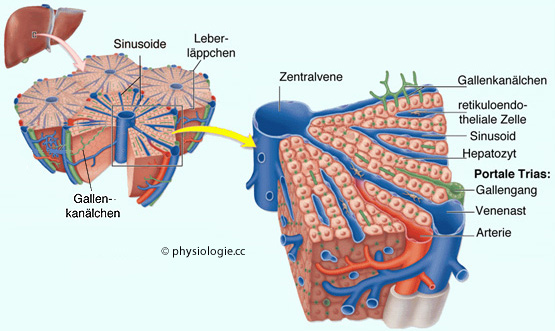
 Abbildung: Aufbau von Leberläppchen
Abbildung: Aufbau von Leberläppchen
 Die apikale Membran (15% der Membranfläche) liegt am kanalikulären Lumen (Gallebildung),
Die apikale Membran (15% der Membranfläche) liegt am kanalikulären Lumen (Gallebildung),  die
basolaterale Membran (85% der Membranfläche des Hepatozyten) grenzt an
den perizellulären Raum zwischen Leberzellen und Sinusoiden
(Blutseite).
die
basolaterale Membran (85% der Membranfläche des Hepatozyten) grenzt an
den perizellulären Raum zwischen Leberzellen und Sinusoiden
(Blutseite).  Die Membranfläche der Hepatozyten ist zwecks besserer
Austauschkapazität durch Mikrovilli
Die Membranfläche der Hepatozyten ist zwecks besserer
Austauschkapazität durch Mikrovilli  wesentlich erhöht (allein die
Oberfläche der Gallenkapillaren beträgt ~10 m2). Die Gallenkapillaren sind durch tight junctions und Desmosomen
wesentlich erhöht (allein die
Oberfläche der Gallenkapillaren beträgt ~10 m2). Die Gallenkapillaren sind durch tight junctions und Desmosomen  abgedichtet; gap junctions erlauben die Kommunikation zwischen Hepatozyten.
abgedichtet; gap junctions erlauben die Kommunikation zwischen Hepatozyten. Über Desmosomen s. auch dort
Über Desmosomen s. auch dort
 Abbildung: Zusammenarbeit von Leber und Niere bei der Säure- und Stickstoffausscheidung
Abbildung: Zusammenarbeit von Leber und Niere bei der Säure- und Stickstoffausscheidung
 Säure-Basen-Haushalt (> X.9): Es existiert ein enger Zusammenhang der Funktionen von Leber und Niere bei der Säure- und Stickstoffausscheidung (
Säure-Basen-Haushalt (> X.9): Es existiert ein enger Zusammenhang der Funktionen von Leber und Niere bei der Säure- und Stickstoffausscheidung ( Abbildung).
Abbildung).  Sinkt der pH-Wert im Blut (Azidose), verlagert sich die
Stickstoffausscheidung in Richtung Ammonium;
Sinkt der pH-Wert im Blut (Azidose), verlagert sich die
Stickstoffausscheidung in Richtung Ammonium;  steigt der pH-Wert
(Alkalose), rückt die Bildung von Harnstoff in den Vordergrund.
steigt der pH-Wert
(Alkalose), rückt die Bildung von Harnstoff in den Vordergrund. Die hepatische Gallebildung wird angeregt durch Sekretin, CCK, steigende Gallensäurekonzentration im Pfortaderblut, sowie Insulin und Glukagon;
Die hepatische Gallebildung wird angeregt durch Sekretin, CCK, steigende Gallensäurekonzentration im Pfortaderblut, sowie Insulin und Glukagon; Gallenblasenkontraktionen werden angeregt durch CCK und Aktivität parasympathischer Fasern (Acetylcholin).
Gallenblasenkontraktionen werden angeregt durch CCK und Aktivität parasympathischer Fasern (Acetylcholin). Zur Zusammensetzung der Gallenflüssigkeit s. dort
Zur Zusammensetzung der Gallenflüssigkeit s. dort An der basolateralen Membran befinden sich Transporter, die Stoffe aus dem Pfortaderblut in die Leberzelle befördern.
Zur Aufnahme von rückresorbierten Gallensalzen
(entero-hepatischer Kreislauf) steht das Natrium-taurocholate
cotransporting peptide (NTCP) zur Verfügung. OATP-Transporter (organic anion transport protein)
haben ein breites Substratspektrum für organische Anionen,
unkonjugierte Gallensäuren und lipophile Substanzen. Kationen passieren
via organic cation transporters (OCTs). OATPs und OCTs sind SLC-Transporter.
An der basolateralen Membran befinden sich Transporter, die Stoffe aus dem Pfortaderblut in die Leberzelle befördern.
Zur Aufnahme von rückresorbierten Gallensalzen
(entero-hepatischer Kreislauf) steht das Natrium-taurocholate
cotransporting peptide (NTCP) zur Verfügung. OATP-Transporter (organic anion transport protein)
haben ein breites Substratspektrum für organische Anionen,
unkonjugierte Gallensäuren und lipophile Substanzen. Kationen passieren
via organic cation transporters (OCTs). OATPs und OCTs sind SLC-Transporter. An der kanalikulären Membran finden sich ebenfalls MRPs;
sie befördern ein breites Spektrum an Substanzen, u.a.
Bilirubinglukuronid, das in die Gallenflüssigkeit sezerniert wird.
(MRP-Gendefekte sind die Ursache des Dubin-Johnson-Syndroms, s. unten).
MRP2 bringt (unter ATP-Verbrauch) konjugiertes (glucuronidiertes) Bilirubin in die Gallenkanälchen.
An der kanalikulären Membran finden sich ebenfalls MRPs;
sie befördern ein breites Spektrum an Substanzen, u.a.
Bilirubinglukuronid, das in die Gallenflüssigkeit sezerniert wird.
(MRP-Gendefekte sind die Ursache des Dubin-Johnson-Syndroms, s. unten).
MRP2 bringt (unter ATP-Verbrauch) konjugiertes (glucuronidiertes) Bilirubin in die Gallenkanälchen.  Zu Phase-1- und Phase-2-Reaktionen s. dort
Zu Phase-1- und Phase-2-Reaktionen s. dort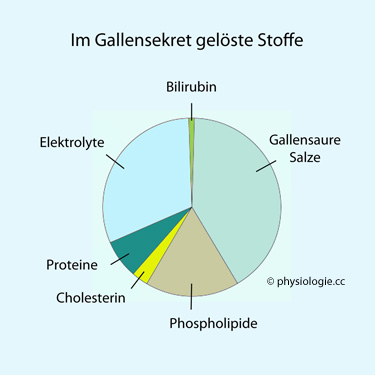
 Abbildung: Zusammensetzung der Galle (gelöste Feststoffe)
Abbildung: Zusammensetzung der Galle (gelöste Feststoffe) Abbildung):
Abbildung): Gallensaure Salze (41% der Masse an gelösten Feststoffen)
Gallensaure Salze (41% der Masse an gelösten Feststoffen) Elektrolyte (31%), inklusive Bicarbonat für Pufferung
Elektrolyte (31%), inklusive Bicarbonat für Pufferung Phospholipide (17%)
Phospholipide (17%) Proteine (7%)
Proteine (7%) Cholesterin
Cholesterin  (3%)
(3%) Bilirubin ~1%
Bilirubin ~1%
 Mit der Galle in den Darm ausgeschiedene Stoffe können resorbiert werden und über
den enterohepatischen Kreislauf wieder ins Blut (und in die Leber)
zurückgelangen.
Mit der Galle in den Darm ausgeschiedene Stoffe können resorbiert werden und über
den enterohepatischen Kreislauf wieder ins Blut (und in die Leber)
zurückgelangen.
 (Hyperbilirubinämie, Ikterus - eine seltene Hepatopathie mit gestörter
Ausscheidung konjugierten Bilirubins in die Galle) ist durch einen
Defekt des MRP2 bedingt.
(Hyperbilirubinämie, Ikterus - eine seltene Hepatopathie mit gestörter
Ausscheidung konjugierten Bilirubins in die Galle) ist durch einen
Defekt des MRP2 bedingt.

 Die Leber erneuert ihre Zellen innerhalb eines Jahres mehrmals vollständig. Unterstützt durch hepatocyte growth factor (HGF), EGF, TGF, IL-6, Wachstumshormon, Insulin, Noradrenalin, Serotonin, T3/T4 treten Hepatozyten bei Bedarf in
einen Vermehrungszyklus ein (G0 → G1; 1 oder 2 Mitosen), danach wieder
in die G0-Phase. Nicht-parenchymatöse Zellen (Endothel-, Kupffer-, Stellatumzellen) werden ebenfalls laufend erneuert.
Kompensatorisches Wachstum ersetzt entferntes oder untergegangenes Lebergewebe - ~25% der normalen Organmasse reichen für vollständigen Ersatz aus. Die Regeneration hängt auch ab von der extrazellulären Matrix
(Leitstrukturen, mechanische Stützung, Freisetzung regulatorischer
Stoffe). Entfernung von Teilen der Leber kann zu
~20-fachem HGF-Anstieg im Blut führen Die Leber erneuert ihre Zellen innerhalb eines Jahres mehrmals vollständig. Unterstützt durch hepatocyte growth factor (HGF), EGF, TGF, IL-6, Wachstumshormon, Insulin, Noradrenalin, Serotonin, T3/T4 treten Hepatozyten bei Bedarf in
einen Vermehrungszyklus ein (G0 → G1; 1 oder 2 Mitosen), danach wieder
in die G0-Phase. Nicht-parenchymatöse Zellen (Endothel-, Kupffer-, Stellatumzellen) werden ebenfalls laufend erneuert.
Kompensatorisches Wachstum ersetzt entferntes oder untergegangenes Lebergewebe - ~25% der normalen Organmasse reichen für vollständigen Ersatz aus. Die Regeneration hängt auch ab von der extrazellulären Matrix
(Leitstrukturen, mechanische Stützung, Freisetzung regulatorischer
Stoffe). Entfernung von Teilen der Leber kann zu
~20-fachem HGF-Anstieg im Blut führen Die Leber
speichert Vitamine und Spurenelemente. Kupfer wird an
Metalloproteine gebunden, bei Bedarf abgegeben,
überschüssiges Kupfer mit der Galle (proteingebunden) ausgeschieden. Durch Somatotropin angeregte Hepatozyten bilden IGF (Somatomedin). Die Leber aktiviert Hormonvorstufen (Dejodinierung von T4 zu T3, 25-Hydroxylierung von D3-Hormon) und Pharmaka, andere baut sie ab (Insulin, Glukagon, Steroide, Eikosanoide). Sie
wirkt an der Regulierung des osmotischen Gleichgewichts mit
(osmotischer Puffer) und enthält Osmorezeptoren. Mikrovilli vergrößern die Oberfläche für den Stoffaustausch (Gallenkapillaren ~10 m2). Gap junctions erlauben Kommunikation zwischen Hepatozyten. Die apikale Membran
der Hepatozyten (15% der Membranfläche) liegt am kanalikulären Lumen
(Gallebildung), die basolaterale (85%) grenzt an die Blutseite; die
beiden sind unterschiedlich mit Permeasen und Transportern bestückt
(polare Organisation). Zwischen den beiden Membranen liegt ein
Schlussleistensystem (limitierter parazellulärer Austausch) Die Leber
speichert Vitamine und Spurenelemente. Kupfer wird an
Metalloproteine gebunden, bei Bedarf abgegeben,
überschüssiges Kupfer mit der Galle (proteingebunden) ausgeschieden. Durch Somatotropin angeregte Hepatozyten bilden IGF (Somatomedin). Die Leber aktiviert Hormonvorstufen (Dejodinierung von T4 zu T3, 25-Hydroxylierung von D3-Hormon) und Pharmaka, andere baut sie ab (Insulin, Glukagon, Steroide, Eikosanoide). Sie
wirkt an der Regulierung des osmotischen Gleichgewichts mit
(osmotischer Puffer) und enthält Osmorezeptoren. Mikrovilli vergrößern die Oberfläche für den Stoffaustausch (Gallenkapillaren ~10 m2). Gap junctions erlauben Kommunikation zwischen Hepatozyten. Die apikale Membran
der Hepatozyten (15% der Membranfläche) liegt am kanalikulären Lumen
(Gallebildung), die basolaterale (85%) grenzt an die Blutseite; die
beiden sind unterschiedlich mit Permeasen und Transportern bestückt
(polare Organisation). Zwischen den beiden Membranen liegt ein
Schlussleistensystem (limitierter parazellulärer Austausch) Die Galle dient der Emulgierung (Fettverdauung) und Eliminierung
(Abbauprodukte, Toxine). Sie enthält gallensaure Salze (~40%), Elektrolyte (~30%), Phospholipide, Proteine, Cholesterin, Bilirubin. Die Gallebildung wird angeregt durch Sekretin,
CCK, steigende Gallensäurekonzentration im Pfortaderblut, Insulin und
Glukagon; zur Kontraktion wird die Gallenblase angeregt durch CCK und
Acetylcholin (parasympathische Aktivität). Gallensäuren werden im Ileum zu ~95%
rückresorbiert, im enterohepatischen
Kreislauf zirkulieren 2-4 Gramm (Gallensäurepool), ~0,6 g/d werden ausgeschieden und
nachsynthetisiert
Die Galle dient der Emulgierung (Fettverdauung) und Eliminierung
(Abbauprodukte, Toxine). Sie enthält gallensaure Salze (~40%), Elektrolyte (~30%), Phospholipide, Proteine, Cholesterin, Bilirubin. Die Gallebildung wird angeregt durch Sekretin,
CCK, steigende Gallensäurekonzentration im Pfortaderblut, Insulin und
Glukagon; zur Kontraktion wird die Gallenblase angeregt durch CCK und
Acetylcholin (parasympathische Aktivität). Gallensäuren werden im Ileum zu ~95%
rückresorbiert, im enterohepatischen
Kreislauf zirkulieren 2-4 Gramm (Gallensäurepool), ~0,6 g/d werden ausgeschieden und
nachsynthetisiert  NTCP
(Natrium-Taurocholat Cotransporter) benötigt man für die Resorption von
Gallensalzen in die Leberzellen, MRP2 (multidrug resistance-associated
protein) für den Transport von Bilirubin und anderen organischen Anionen in die Gallencanaliculi - bei einem MRP2-Defekt tritt Hyperbilirubinämie auf NTCP
(Natrium-Taurocholat Cotransporter) benötigt man für die Resorption von
Gallensalzen in die Leberzellen, MRP2 (multidrug resistance-associated
protein) für den Transport von Bilirubin und anderen organischen Anionen in die Gallencanaliculi - bei einem MRP2-Defekt tritt Hyperbilirubinämie auf |
