

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Biotransformation, Abbauwege, Steuerung
der Leberfunktion
Biotransformation, Abbauwege, Steuerung
der Leberfunktion
 Biotransformation: βίος = Leben, trans = (hin)über, formare = bilden
Biotransformation: βίος = Leben, trans = (hin)über, formare = bilden| Die Leber funktioniert wie eine äußerst effiziente "Chemiefabrik", die -- in Moleküle (körpereigen oder körperfremd) funktionelle Gruppen einfügt (Oxidation, Reduktion, Hydrolyse, Dealkylierung, Dehalogenierung - Phase-I-Reaktionen) und -- Moleküle mit zusätzlichen (meist gut wasserlöslichen) Gruppen versieht (konjugiert: Glukuronierung, Sulfatierung, Methylierung, Acetylierung, Konjugation mit Aminosäuren und Glutathion - Phase-II-Reaktionen). So macht sie Stoffe besser löslich und - über Harn, Stuhl, Atemluft, Schweiß - ausscheidbar. Die Anpassungsfähigkeit der Leberzellen ist enorm - so kann die Aktivität der HMG-CoA-Reduktase (das limitierende Enzym der Cholesterinsynthese) bei steigendem Bedarf (abnehmender Konzentration von Cholesterin oder Mevalonat) enorm erhöhen - durch Bereitstellung der bis zu 200-fachen Menge (oder durch Aktivierung sonst inaktiver) HMG-CoA-Reduktase. Hormone (Insulin, Glukagon, Adrenalin, Kortisol, hGH) und Zytokine (IL-6, TNF) wirken auf Hepatozyten steuernd ein, andererseits bildet die Leber IGF und Vorstufen von Mediatoren und Hormonen (Kininogen, Angiotensinogen). Stickstoffausscheidung und der Einfluss auf die pH-Regulation sind über den Glutamin-Harnstoff-Mechanismus miteinander verknüpft. |
 Steuerung der Leberfunktion
Steuerung der Leberfunktion  Harnstoff, Ammonium, Säure-Basen-Haushalt
Harnstoff, Ammonium, Säure-Basen-Haushalt P-450 Cytochrome
P-450 Cytochrome

 Abbildung: Detoxifizierung durch Phase-1- und Phase-2-Reaktionen
Abbildung: Detoxifizierung durch Phase-1- und Phase-2-Reaktionen
 werden verschiedene
körpereigene Stoffe (z.B. Steroidhormone, Bilirubin, Ammoniak) sowie Medikamente oder Gifte z.T.
aktiviert,
z.T. inaktiviert, bzw. in ausscheidbare Form gebracht. Die Erlangung
besserer Wasserlöslichkeit ist dabei ein entscheidender Faktor.
Enzyminduktion, z.B. von Cytochrom
werden verschiedene
körpereigene Stoffe (z.B. Steroidhormone, Bilirubin, Ammoniak) sowie Medikamente oder Gifte z.T.
aktiviert,
z.T. inaktiviert, bzw. in ausscheidbare Form gebracht. Die Erlangung
besserer Wasserlöslichkeit ist dabei ein entscheidender Faktor.
Enzyminduktion, z.B. von Cytochrom  P450 (Phase-1-Reaktion, s. unten), beschleunigt die Vorgänge.
P450 (Phase-1-Reaktion, s. unten), beschleunigt die Vorgänge. Als First-pass-Effekt
bezeichnet man den Anteil der Eliminierung einer Substanz (eines
Medikaments), der bei der ersten Leberpassage (nach der Sekretion bzw.
"Injektion" der Substanz in die Blutbahn) eliminiert wird.
Als First-pass-Effekt
bezeichnet man den Anteil der Eliminierung einer Substanz (eines
Medikaments), der bei der ersten Leberpassage (nach der Sekretion bzw.
"Injektion" der Substanz in die Blutbahn) eliminiert wird. Zuerst
kommt es am betreffenden Molekül zu Abänderung funktioneller Gruppen (Phase-1-Reaktion); in den meisten Fällen wird eine polare Gruppe an das Molekül angefügt und es schon dadurch biologisch inaktiviert.
Zuerst
kommt es am betreffenden Molekül zu Abänderung funktioneller Gruppen (Phase-1-Reaktion); in den meisten Fällen wird eine polare Gruppe an das Molekül angefügt und es schon dadurch biologisch inaktiviert.  In einer Phase-2-Reaktion
kommt es zwecks besserer Ausscheidbarkeit zum
Hinzufügen (Konjugation) von (endogenen) polaren (und damit wasserlöslichen) Gruppen wie Methyl, Glucuronat,
Glutathion, Acetat, Sulfat oder Aminosäuren.
In einer Phase-2-Reaktion
kommt es zwecks besserer Ausscheidbarkeit zum
Hinzufügen (Konjugation) von (endogenen) polaren (und damit wasserlöslichen) Gruppen wie Methyl, Glucuronat,
Glutathion, Acetat, Sulfat oder Aminosäuren. Als Phase 3 schließlich bezeichnet man den Transport und die Sekretion der Produkte aus Phase 1 und 2 in den Darm (über die Galle: canaliculäre Entfernung) oder in den Kreislauf (via Disse-Raum; sinusoidale Entfernung).
Als Phase 3 schließlich bezeichnet man den Transport und die Sekretion der Produkte aus Phase 1 und 2 in den Darm (über die Galle: canaliculäre Entfernung) oder in den Kreislauf (via Disse-Raum; sinusoidale Entfernung). Erhöhung der Wasserlöslichkeit (durch Vorbereitung auf Anfügen stark polarer Gruppen in Phase II)
Erhöhung der Wasserlöslichkeit (durch Vorbereitung auf Anfügen stark polarer Gruppen in Phase II) Veränderungen an funktionellen Gruppen (was meist die biologische Aktivität des Moleküls reduziert).
Veränderungen an funktionellen Gruppen (was meist die biologische Aktivität des Moleküls reduziert). P-450 Cytochrome (cytochrome P450 enzymes,
CYPs)
sind eine Enzym-Superfamilie, deren Mitglieder Häm als Cofaktor haben
und als mischfunktionelle Oxygenasen (-OH-einsetzende Enzyme) wirken.
Die mehr als 100 Mitglieder dieser Familie unterscheiden sich in ihrer
Aminosäuresequenz, jedes ist mit "CYP" und einem Zahlen-Buchstaben-Code
bezeichnet. Ihre Substratspezifität überschneidet sich teilweise.
Hepatozyten exprimieren drei CYPs (CYP1, CYP2 und CYP3, mehrere
Isoformen), diese sitzen in der Membran des glatten endoplasmatischen
Retikulums. CYPs oxidieren u.a. Fettsäuren, Steroide, auch Medikamente
(letztere werden dadurch aktiviert oder inaktiviert). P-450 ist
das vielseitigste Enzymsystem im Körper, das insgesamt mehr als 106 Substrate umsetzen kann.
P-450 Cytochrome (cytochrome P450 enzymes,
CYPs)
sind eine Enzym-Superfamilie, deren Mitglieder Häm als Cofaktor haben
und als mischfunktionelle Oxygenasen (-OH-einsetzende Enzyme) wirken.
Die mehr als 100 Mitglieder dieser Familie unterscheiden sich in ihrer
Aminosäuresequenz, jedes ist mit "CYP" und einem Zahlen-Buchstaben-Code
bezeichnet. Ihre Substratspezifität überschneidet sich teilweise.
Hepatozyten exprimieren drei CYPs (CYP1, CYP2 und CYP3, mehrere
Isoformen), diese sitzen in der Membran des glatten endoplasmatischen
Retikulums. CYPs oxidieren u.a. Fettsäuren, Steroide, auch Medikamente
(letztere werden dadurch aktiviert oder inaktiviert). P-450 ist
das vielseitigste Enzymsystem im Körper, das insgesamt mehr als 106 Substrate umsetzen kann. Zum P-450-System gehörende mischfunktionelle Monooxygenasen sind die führenden Enzyme des Phase-I-Metabolismus - sie übernehmen Hydroxylierungen (R-H zu R-OH).
Mehrere hundert Gene sind für die im endoplasmatischen Retikulum
lokalisierten Cytochrom-P450-Enzyme (CYP) zuständig. Fast jedes zweite
P-450-Enzym weist genetische Polymorphismen auf, und vom mehr als 1000
Substanzen weiß man, dass sie P-450-Enzyme induzieren (ihre Wirksamkeit
erhöhen) können - was u.a. Gewöhnung an Toxine bzw. Pharmaka erklärt. CYP3 A4 ist an etwa 50%, CYP2 D6 an 20-30% aller Biotransformationen beteiligt (Metabolisierung von Medikamenten!).
Zum P-450-System gehörende mischfunktionelle Monooxygenasen sind die führenden Enzyme des Phase-I-Metabolismus - sie übernehmen Hydroxylierungen (R-H zu R-OH).
Mehrere hundert Gene sind für die im endoplasmatischen Retikulum
lokalisierten Cytochrom-P450-Enzyme (CYP) zuständig. Fast jedes zweite
P-450-Enzym weist genetische Polymorphismen auf, und vom mehr als 1000
Substanzen weiß man, dass sie P-450-Enzyme induzieren (ihre Wirksamkeit
erhöhen) können - was u.a. Gewöhnung an Toxine bzw. Pharmaka erklärt. CYP3 A4 ist an etwa 50%, CYP2 D6 an 20-30% aller Biotransformationen beteiligt (Metabolisierung von Medikamenten!). Einerseits in der Leber, wo sie im
endoplasmatischen Retikulum der Hepatozyten zahlreiche Reaktionen
katalysieren (Bildung von Gallensäuren, Aktivierung / Inaktivierung von
Vitaminen, Medikamenten u.a.),
Einerseits in der Leber, wo sie im
endoplasmatischen Retikulum der Hepatozyten zahlreiche Reaktionen
katalysieren (Bildung von Gallensäuren, Aktivierung / Inaktivierung von
Vitaminen, Medikamenten u.a.),  andererseits in Steroide
produzierenden Organen (Ovarien, Plazenta, Hoden, Nebennierenrinde).
andererseits in Steroide
produzierenden Organen (Ovarien, Plazenta, Hoden, Nebennierenrinde).  in der Leber metabolisieren CYP2 R1, CYP3 A4, CYP27 A1 Cholecalciferol (Vitamin D3) zu 25-(OH)D3,
in der Leber metabolisieren CYP2 R1, CYP3 A4, CYP27 A1 Cholecalciferol (Vitamin D3) zu 25-(OH)D3, in der Niere metabolisieren CYP27 B1 25-(OH)D3 zu 1,25-(OH)2D3, CYP24 A1 zu 24,25-(OH)2D3.
in der Niere metabolisieren CYP27 B1 25-(OH)D3 zu 1,25-(OH)2D3, CYP24 A1 zu 24,25-(OH)2D3. Glucuronat via (Uridindiphosphat--) Glucuronyltransferasen (UDP-GT) (
Glucuronat via (Uridindiphosphat--) Glucuronyltransferasen (UDP-GT) ( Abbildung), die sich (ausnahmsweise) im endoplasmatischem Retikulum befinden (so wie die Phase 1-Enzyme).
Abbildung), die sich (ausnahmsweise) im endoplasmatischem Retikulum befinden (so wie die Phase 1-Enzyme). 
 Abbildung: Glucuronidierung
Abbildung: Glucuronidierung Sulfat mittels zytosolischer Sultotransferasen (z.B. Steroide),
Sulfat mittels zytosolischer Sultotransferasen (z.B. Steroide), Methyl (mit S-Adenosyl Methionin - z.B. Thiole) mittels Methyltransferasen,
Methyl (mit S-Adenosyl Methionin - z.B. Thiole) mittels Methyltransferasen, Acetat (via N-Acetyl-Transferasen mit Acetyl-CoA - z.B. Amine, Sulfonamide -, was zu Entgiftung führt),
Acetat (via N-Acetyl-Transferasen mit Acetyl-CoA - z.B. Amine, Sulfonamide -, was zu Entgiftung führt), Glutathion
- der wichtigste Entgiftungsweg für zahlreiche Medikamente und
Karzinogene (via Glutathion-S-Transferase GST, Ausscheidung über Harn oder Galle),
Glutathion
- der wichtigste Entgiftungsweg für zahlreiche Medikamente und
Karzinogene (via Glutathion-S-Transferase GST, Ausscheidung über Harn oder Galle), Aminosäuren wie
Glycin, Taurin, Glutamin (z.B. Gallensäuren).
Aminosäuren wie
Glycin, Taurin, Glutamin (z.B. Gallensäuren). Abbildung):
Abbildung):
 Abbildung: Wie Hepatozyten organische Kationen und Lipide ausscheiden
Abbildung: Wie Hepatozyten organische Kationen und Lipide ausscheiden
 Abbildung).
Abbildung). Gallensaure Salze gelangen ATP-abhängig über BSEP (bile-salt export pump, auch ABCB11 - ATP-binding cassette, subfamily B member 11 genannt) in die Gallenkapillaren (
Gallensaure Salze gelangen ATP-abhängig über BSEP (bile-salt export pump, auch ABCB11 - ATP-binding cassette, subfamily B member 11 genannt) in die Gallenkapillaren ( s. dort),
wobei ein Konzentrationsgefälle bis zu 1 zu 1000 überwunden werden kann
(also Gallensalze auf der kanalikulären Seite konzentriert werden
können).
s. dort),
wobei ein Konzentrationsgefälle bis zu 1 zu 1000 überwunden werden kann
(also Gallensalze auf der kanalikulären Seite konzentriert werden
können).  Zahlreiche organische Anionen
(z.B. glucuronierte oder sulfatierte Gallensäuren,
Bilirubindiglucuronid) nutzen hauptsächlich das ebenfalls
ATP-abhängige, elektrogene MRP2 (Multidrug resistance-associated protein 2, auch ABCC2, ATP-binding cassette, subfamily C member 2 genannt -
Zahlreiche organische Anionen
(z.B. glucuronierte oder sulfatierte Gallensäuren,
Bilirubindiglucuronid) nutzen hauptsächlich das ebenfalls
ATP-abhängige, elektrogene MRP2 (Multidrug resistance-associated protein 2, auch ABCC2, ATP-binding cassette, subfamily C member 2 genannt -  s. dort).
s. dort).  Organische Kationen können über das multidrug resistance protein MDR1 oder über das multidrug and toxin extrusion protein MATE1 zur Ausscheidung kommen (
Organische Kationen können über das multidrug resistance protein MDR1 oder über das multidrug and toxin extrusion protein MATE1 zur Ausscheidung kommen ( Abbildung).
Abbildung).  Lipide - insbesondere Phospholipide - nutzen die Flippase MDR3
(ABCB4) als Transporter - Phosphatidylcholin kann so z.B. von der
inneren in die äußere Schicht der Zellmembran wechseln. Spezielle
Umlagerungen verschiedener Phospholipide (Anreicherung von Cholesterin
und Sphingomyelin in der Außenschicht) üben eine Schutzfunktion aus,
indem sie die apikale Membran der Leberzellen vor oberflächenaktiven
Schädigungen durch die Galle bewahren (Kompartimentierung).
Lipide - insbesondere Phospholipide - nutzen die Flippase MDR3
(ABCB4) als Transporter - Phosphatidylcholin kann so z.B. von der
inneren in die äußere Schicht der Zellmembran wechseln. Spezielle
Umlagerungen verschiedener Phospholipide (Anreicherung von Cholesterin
und Sphingomyelin in der Außenschicht) üben eine Schutzfunktion aus,
indem sie die apikale Membran der Leberzellen vor oberflächenaktiven
Schädigungen durch die Galle bewahren (Kompartimentierung). Abbildung).
Abbildung).
 Abbildung: Input- und Outputwege der Leber
Abbildung: Input- und Outputwege der Leber
 Beispielsweise kann die Leber je nach Bedarf Energie speichern (Glykogenbildung)
oder bereitstellen. Insulin fördert den Speicherungsmechanismus; Adrenalin bewirkt über ß2-Rezeptoren
Energiebereitstellung durch Glykogenolyse und Glukoneogenese. Für den Kohlenhydratmetabolismus ist sie mit Glucosetransportern (GLUT2)
bestückt, die Glucose in Abhängigkeit von der
aktuellen extrazellulären Konzentration (Blutzuckerspiegel) durch die
Membran schleusen.
Beispielsweise kann die Leber je nach Bedarf Energie speichern (Glykogenbildung)
oder bereitstellen. Insulin fördert den Speicherungsmechanismus; Adrenalin bewirkt über ß2-Rezeptoren
Energiebereitstellung durch Glykogenolyse und Glukoneogenese. Für den Kohlenhydratmetabolismus ist sie mit Glucosetransportern (GLUT2)
bestückt, die Glucose in Abhängigkeit von der
aktuellen extrazellulären Konzentration (Blutzuckerspiegel) durch die
Membran schleusen. Die Bildung von Plasmaproteinen und Lipiden ist ebenfalls substrat- und
hormonabhängig (Insulin, "kontrainsulinäre" Hormone).
Die Bildung von Plasmaproteinen und Lipiden ist ebenfalls substrat- und
hormonabhängig (Insulin, "kontrainsulinäre" Hormone).  Das Wachstumshormon wirkt an der Leberzelle anabol (vermehrte Aminosäureaufnahme und -verwertung) und bewirkt die Freisetzung von IGF1 (s. unten).
Das Wachstumshormon wirkt an der Leberzelle anabol (vermehrte Aminosäureaufnahme und -verwertung) und bewirkt die Freisetzung von IGF1 (s. unten).  Bei Energiemangel werden Fettsäuren zu Ketonkörpern
umgebaut, die zum Teil für mangelnde Glucose im Energiestoffwechsel
einspringen können. Dazu müssen sich die Zellen in Gehirn und
Muskulatur umstellen: Sie erhöhen die Exprimierung der Enzyme, die für
die Überführung von Ketonkörpern in AcCo-A notwendig sind.
Bei Energiemangel werden Fettsäuren zu Ketonkörpern
umgebaut, die zum Teil für mangelnde Glucose im Energiestoffwechsel
einspringen können. Dazu müssen sich die Zellen in Gehirn und
Muskulatur umstellen: Sie erhöhen die Exprimierung der Enzyme, die für
die Überführung von Ketonkörpern in AcCo-A notwendig sind. Regulation der Cholesterinsynthese: Das limitierende Enzym ist die HMG-CoA-Reduktase - sie reduziert HMG-CoA zu Mevalonat.
Ihre Aktivität kann (durch erhöhte Transkription / Translation /
Enzymstabilität) um das 200-fache steigen, wenn der Bedarf für
Mevalonsäure-Abkömmlinge im Stoffwechsel erhöht ist.
Regulation der Cholesterinsynthese: Das limitierende Enzym ist die HMG-CoA-Reduktase - sie reduziert HMG-CoA zu Mevalonat.
Ihre Aktivität kann (durch erhöhte Transkription / Translation /
Enzymstabilität) um das 200-fache steigen, wenn der Bedarf für
Mevalonsäure-Abkömmlinge im Stoffwechsel erhöht ist.  Bei steigender Cholesterin- oder Mevalonatkonzentration in der Zelle
nimmt die Bildung der HMG-CoA-Reduktase ab, und umgekehrt.
Bei steigender Cholesterin- oder Mevalonatkonzentration in der Zelle
nimmt die Bildung der HMG-CoA-Reduktase ab, und umgekehrt. 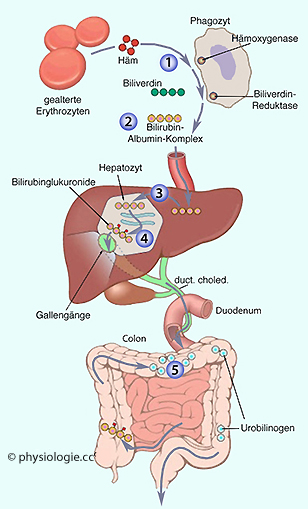
 Abbildung: Hämoglobinabbau, Urobilinogenausscheidung
Abbildung: Hämoglobinabbau, Urobilinogenausscheidung Interleukin-6 und TNF gehören zu den (stressinduzierbaren)
immunologischen Faktoren, die auf die Leberzelle direkt steuernd
einwirken können (stressinduzierte Serumkinasen: Akutphasenproteine).
Interleukin-6 und TNF gehören zu den (stressinduzierbaren)
immunologischen Faktoren, die auf die Leberzelle direkt steuernd
einwirken können (stressinduzierte Serumkinasen: Akutphasenproteine). Die Leber selbst bildet insulinähnliche Wachstumsfaktoren (IGFs) und Vorstufen von Mediatoren / Hormonen (hochmolekulares Kininogen
Die Leber selbst bildet insulinähnliche Wachstumsfaktoren (IGFs) und Vorstufen von Mediatoren / Hormonen (hochmolekulares Kininogen  , Angiotensinogen).
, Angiotensinogen). ) in Harnstoff
umgewandelt.
) in Harnstoff
umgewandelt.  Der Harnstoffzyklus ist der wichtigste Ausscheidungsweg für
Stickstoff (Ammoniak ist ein Zellgift). Aufgrund der Enzymausstattung kann der Harnstoffzyklus nur
in Leberzellen vollständig ablaufen (2 Reaktionen in Mitochondrien, 3
im Zytosol,
Der Harnstoffzyklus ist der wichtigste Ausscheidungsweg für
Stickstoff (Ammoniak ist ein Zellgift). Aufgrund der Enzymausstattung kann der Harnstoffzyklus nur
in Leberzellen vollständig ablaufen (2 Reaktionen in Mitochondrien, 3
im Zytosol,  Abbildung unten).
Abbildung unten). 
 Bis
ins 19. Jahrhundert galt die Annahme, dass organische Moleküle nur von
lebenden Zellen, nicht aber im Labor ("künstlich") produziert werden
können. 1828 gelang der Gegenbeweis: Der deutsche Chemiker Friedrich Wöhler stellte Harnstoff als erste organische Substanz synthetisch aus einer "unbelebten" Substanz (Ammoniumzyanat) her.
Bis
ins 19. Jahrhundert galt die Annahme, dass organische Moleküle nur von
lebenden Zellen, nicht aber im Labor ("künstlich") produziert werden
können. 1828 gelang der Gegenbeweis: Der deutsche Chemiker Friedrich Wöhler stellte Harnstoff als erste organische Substanz synthetisch aus einer "unbelebten" Substanz (Ammoniumzyanat) her. 
 Abbildung: Harnstoffzyklus
Abbildung: Harnstoffzyklus

 Harnstoff konsumiert bei seiner Bildung sowohl H+ - als auch HCO3-; bei ausgeglichenem Säure-Basen-Haushalt wird
Stickstoff vorwiegend als Harnstoff gebunden (periportale Zone 1 des Leberläppchens).
Harnstoff konsumiert bei seiner Bildung sowohl H+ - als auch HCO3-; bei ausgeglichenem Säure-Basen-Haushalt wird
Stickstoff vorwiegend als Harnstoff gebunden (periportale Zone 1 des Leberläppchens).  Bei Azidose hingegen wird vermehrt Glutamat herangezogen, um Ammonium
zu binden, es entsteht Glutamin (Zone 3 des Azinus). Im
proximalen Tubulus wird es zu alpha-Ketoglutarat und Ammonium gespalten.
Mit Ammoniumchlorid gelangen saure Valenzen zur
Ausscheidung. Alpha-Ketoglutarat wird abgebaut, und es entsteht Bicarbonat.
Bei Azidose hingegen wird vermehrt Glutamat herangezogen, um Ammonium
zu binden, es entsteht Glutamin (Zone 3 des Azinus). Im
proximalen Tubulus wird es zu alpha-Ketoglutarat und Ammonium gespalten.
Mit Ammoniumchlorid gelangen saure Valenzen zur
Ausscheidung. Alpha-Ketoglutarat wird abgebaut, und es entsteht Bicarbonat.
 Ammonium entsteht renal durch Hydrolyse aus Glutamin und durch bakteriellen Abbau im Darm
(~4g - etwa 240 mM - Ammonium entstehen pro Tag im Colon, das
Pfortaderblut hat eine mehrfach höhere Ammoniumkonzentration als das
systemische Blut. Dieses Ammonium gelangt unmittelbar zur Leber).
Ammonium entsteht renal durch Hydrolyse aus Glutamin und durch bakteriellen Abbau im Darm
(~4g - etwa 240 mM - Ammonium entstehen pro Tag im Colon, das
Pfortaderblut hat eine mehrfach höhere Ammoniumkonzentration als das
systemische Blut. Dieses Ammonium gelangt unmittelbar zur Leber).  Die Leber "entgiftet" Ammonium (neurotoxische Wirkung höherer
Serumkonzentrationen - hepatische Enzephalopathie): Der
Harnstoffzyklus ist normalerweise nur zu einem Viertel seiner maximalen
Kapazität ausgenützt (funktionelle Reserve). Dabei entsteht Harnstoff
(~20g/d), der (wie auch Glutamin) renal ausgeschieden wird. Erhöhung
des Ammoniumspiegels beruht fast immer auf gestörter hepatischer
Elimination.
Die Leber "entgiftet" Ammonium (neurotoxische Wirkung höherer
Serumkonzentrationen - hepatische Enzephalopathie): Der
Harnstoffzyklus ist normalerweise nur zu einem Viertel seiner maximalen
Kapazität ausgenützt (funktionelle Reserve). Dabei entsteht Harnstoff
(~20g/d), der (wie auch Glutamin) renal ausgeschieden wird. Erhöhung
des Ammoniumspiegels beruht fast immer auf gestörter hepatischer
Elimination.
 Hepatische
Biotransformation aktiviert oder inaktiviert körpereigene Stoffe,
Medikamente oder Gifte, und bringt diese in ausscheidbare (wasserlösliche) Form.
First-pass-Effekt bedeutet, dass ein Anteil
resorbierter Substanz bei der ersten Leberpassage umgewandelt oder
eliminiert wird. Meist erfolgt die Biotransformation zweiphasig -
Abänderung funktioneller Gruppen (Phase-1-Reaktion), Hinzufügen polarer
Gruppen (Phase-2-Reaktion) Hepatische
Biotransformation aktiviert oder inaktiviert körpereigene Stoffe,
Medikamente oder Gifte, und bringt diese in ausscheidbare (wasserlösliche) Form.
First-pass-Effekt bedeutet, dass ein Anteil
resorbierter Substanz bei der ersten Leberpassage umgewandelt oder
eliminiert wird. Meist erfolgt die Biotransformation zweiphasig -
Abänderung funktioneller Gruppen (Phase-1-Reaktion), Hinzufügen polarer
Gruppen (Phase-2-Reaktion)  In Phase-1-Reaktionen wirken Oxidation, Reduktion, Hydrolyse, Dealkylierung, Dehalogenierung - z.B. durch mischfunktionelle Monooxygenasen (insbesondere das Häm-Protein Cytochrom-P450-Enzym (CYP) im endoplasmatischen Retikulum), zytosolische
Alkoholdehydrogenasen (ADH), Aldehyddehydrogenasen, Xanthinoxidase,
Reduktasen, Esterasen. Dies betrifft viele wasserunlösliche Stoffe wie
Steroide, Prostaglandine, Medikamente. Toxische Stoffe durchlaufen die
Phase 1, werden meist neutralisiert, manchmal in kleinere Moleküle
zerteilt (die Bruchstücke werden in der Phase 2 wasserlöslich und
ausscheidbar gemacht) In Phase-1-Reaktionen wirken Oxidation, Reduktion, Hydrolyse, Dealkylierung, Dehalogenierung - z.B. durch mischfunktionelle Monooxygenasen (insbesondere das Häm-Protein Cytochrom-P450-Enzym (CYP) im endoplasmatischen Retikulum), zytosolische
Alkoholdehydrogenasen (ADH), Aldehyddehydrogenasen, Xanthinoxidase,
Reduktasen, Esterasen. Dies betrifft viele wasserunlösliche Stoffe wie
Steroide, Prostaglandine, Medikamente. Toxische Stoffe durchlaufen die
Phase 1, werden meist neutralisiert, manchmal in kleinere Moleküle
zerteilt (die Bruchstücke werden in der Phase 2 wasserlöslich und
ausscheidbar gemacht)  In Phase-2-Reaktionen
werden die Stoffe konjugiert (Glukuronierung, Sulfatierung,
Methylierung, Acetylierung, Konjugation mit Aminosäuren und Glutathion)
und besser löslich bzw. ausscheidbar gemacht. Glukuronierung erfolgt
durch Glukuronyl-, Glutathion-S-, N-Acetyl-, Sulfo-,
Methyltransferasen. Gifte können so entschärft, gelegentlich auch
harmlose Stoffe toxisch werden. Alkohol wird zu Acetaldehyd
oxydiert (ADH, Cytochrom P-450, Katalase in Peroxisomen), Acetaldehyd durch Aldehyd-Dehydrogenase zu Acetat abgebaut In Phase-2-Reaktionen
werden die Stoffe konjugiert (Glukuronierung, Sulfatierung,
Methylierung, Acetylierung, Konjugation mit Aminosäuren und Glutathion)
und besser löslich bzw. ausscheidbar gemacht. Glukuronierung erfolgt
durch Glukuronyl-, Glutathion-S-, N-Acetyl-, Sulfo-,
Methyltransferasen. Gifte können so entschärft, gelegentlich auch
harmlose Stoffe toxisch werden. Alkohol wird zu Acetaldehyd
oxydiert (ADH, Cytochrom P-450, Katalase in Peroxisomen), Acetaldehyd durch Aldehyd-Dehydrogenase zu Acetat abgebaut Die Leber steht unter dem Einfluss verschiedener Substrate, Transmitter, Hormone, Mediatoren (wie IL-6 und TNF)
und speichert (gefördert durch Insulin) oder liefert (z.B. durch
Adrenalin) so je nach Bedarf Energie. GLUT2 ermöglicht die Aufnahme von
Glucose in Abhängigkeit vom Blutzuckerspiegel. Auch die Bildung von
Plasmaproteinen und Lipiden ist substrat- und hormonabhängig (Insulin,
"kontrainsulinäre" Hormone). Wachstumshormon bewirkt die Freisetzung
von IGF1. Bei Energiemangel werden Fettsäuren zu Ketonkörpern umgebaut.
Die Cholesterinsynthese ist durch die Verfügbarkeit von HMG-CoA-Reduktase - deren Aktivität bis
~200-fach ansteigen kann - gesteuert (steigende Cholesterinkonzentration in der Zelle senkt die Bildung der HMG-CoA-Reduktase, und umgekehrt).
Hepatozyten nehmen Bilirubin auf, indem sie dieses von der Bindung an
Albumin lösen, glukuronieren es (machen es wasserlöslich) und
scheiden es mit der Galle in den Darm aus (dort erfolgt die Umwandlung
zu Urobilinogen) Die Leber steht unter dem Einfluss verschiedener Substrate, Transmitter, Hormone, Mediatoren (wie IL-6 und TNF)
und speichert (gefördert durch Insulin) oder liefert (z.B. durch
Adrenalin) so je nach Bedarf Energie. GLUT2 ermöglicht die Aufnahme von
Glucose in Abhängigkeit vom Blutzuckerspiegel. Auch die Bildung von
Plasmaproteinen und Lipiden ist substrat- und hormonabhängig (Insulin,
"kontrainsulinäre" Hormone). Wachstumshormon bewirkt die Freisetzung
von IGF1. Bei Energiemangel werden Fettsäuren zu Ketonkörpern umgebaut.
Die Cholesterinsynthese ist durch die Verfügbarkeit von HMG-CoA-Reduktase - deren Aktivität bis
~200-fach ansteigen kann - gesteuert (steigende Cholesterinkonzentration in der Zelle senkt die Bildung der HMG-CoA-Reduktase, und umgekehrt).
Hepatozyten nehmen Bilirubin auf, indem sie dieses von der Bindung an
Albumin lösen, glukuronieren es (machen es wasserlöslich) und
scheiden es mit der Galle in den Darm aus (dort erfolgt die Umwandlung
zu Urobilinogen) Das stark
toxisch wirkende Ammoniak wird im Rahmen des Harnstoffzyklus
(Krebs-Henseleit-Zyklus) unter ATP-Verbrauch in Harnstoff umgewandelt. Der Harnstoffzyklus läuft nur in
Leberzellen vollständig ab (Enzymausstattung). Der Harnstoffzyklus dient auch der
Biosynthese von NO, Kreatin, biogenen Aminen. Hohe Proteinzufuhr
induziert Enzyme des Harnstoffzyklus (steigende Kapazität zur
Stickstoffausscheidung). Wieviel Stickstoff in Harnstoff (~20g/d) und
wieviel in Ammoniak (~4g/d) zur Ausscheidung kommt, hängt vom
Säure-Basen-Status ab: Die Harnstoffsynthese ist pH-neutral, bei
Azidose wird vermehrt Glutamat genutzt, um Ammonium zu binden (Leber,
Muskeln, Gehirn) - es entsteht Glutamin, die Niere spaltet dieses zu
alpha-Ketoglutarat (dieses wird zu Bicarbonat abgebaut) und Ammonium,
mit Ammoniumchlorid werden saure Valenzen ausgeschieden. Glutamin und
Aspartat sind wichtige Aminogruppenspender; Transaminierungsreaktionen
(AST, ALT) führen Aminosäuren ineinander über Das stark
toxisch wirkende Ammoniak wird im Rahmen des Harnstoffzyklus
(Krebs-Henseleit-Zyklus) unter ATP-Verbrauch in Harnstoff umgewandelt. Der Harnstoffzyklus läuft nur in
Leberzellen vollständig ab (Enzymausstattung). Der Harnstoffzyklus dient auch der
Biosynthese von NO, Kreatin, biogenen Aminen. Hohe Proteinzufuhr
induziert Enzyme des Harnstoffzyklus (steigende Kapazität zur
Stickstoffausscheidung). Wieviel Stickstoff in Harnstoff (~20g/d) und
wieviel in Ammoniak (~4g/d) zur Ausscheidung kommt, hängt vom
Säure-Basen-Status ab: Die Harnstoffsynthese ist pH-neutral, bei
Azidose wird vermehrt Glutamat genutzt, um Ammonium zu binden (Leber,
Muskeln, Gehirn) - es entsteht Glutamin, die Niere spaltet dieses zu
alpha-Ketoglutarat (dieses wird zu Bicarbonat abgebaut) und Ammonium,
mit Ammoniumchlorid werden saure Valenzen ausgeschieden. Glutamin und
Aspartat sind wichtige Aminogruppenspender; Transaminierungsreaktionen
(AST, ALT) führen Aminosäuren ineinander über |
