




| Der
erste postpartale Atemzug verlangt dem Neugerorenen beträchtliche Anstrengung ab - eine Druckexkursion
von etwa 10 kPa
bewegt knapp 40 ml Luft (später reicht ein Druckaufwand von ~0,2 kPa). Schon mit den folgenden Atemzügen wird die
Ventilation leichter; die volle
Entfaltung der Alveolen nimmt mehrere Tage in Anspruch. Unmittelbar postpartal treten Sauerstoffmangel (die Partialdruckwerte müssen auf neue Niveaus ansteigen), geringes Blutzuckerniveau (das hebt den Adrenalinspiegel, Leberglykogen und Fettsäuren werden genutzt) und Abkühlung auf (die extrauterine Wärmeregulierung muss erst trainiert werden). Nach wenigen Tagen sind Hypoxie, Hypoglykämie und Hypothermie verschwunden, aber der Bilirubinspiegel hat sich stark erhöht: Die Leber muss erst lernen, mit Gallenfarbstoffen (aus dem Hämoglobinabbau) umzugehen. Die Haut färbt sich gelblich (icterus neonatorum), erst nach etwa einer Wochen beginnen die Bilirubinwerte wieder zu sinken. Die (auf das Gewicht normierte) Nierenfunktion ist zunächst eingeschränkt (~5fach erhöhte Verweildauer nierengängiger Medikamente); ein halbes Jahr später hat sich die normierte Funktionskapazität etwa verzehnfacht (auf das Doppelte der Referenzwerte für Erwachsene), ein Zeichen enorm gesteigerter Funktionsfähigkeit. Das körperliche Wachstum steht unter dem Einfluss mehrerer Hormone, führend sind das Wachstumshormon (Somatotropin) und das von ihm abhängige IGF1. Steuernd wirkt das hypothalamische GHRH, das unter dem Einfluss einer Fülle neuroendokriner Faktoren steht. Die Vorgänge im wachsenden Knochen sind ebenfalls vielfältig gesteuert - mechanisch, parakrin und endokrin. |
 Weitere postnatale Anpassungen
Weitere postnatale Anpassungen  Physiologische Besonderheiten im Kindesalter
Physiologische Besonderheiten im Kindesalter  Entwicklung und Wachstum
Entwicklung und Wachstum
 Adrenarche und Pubertät
Adrenarche und Pubertät
 Core messages
Core messages postpartal 4-5 Tage lang stark an.
postpartal 4-5 Tage lang stark an. Hypoxie:
Konstriktion der Umbilikalarterien
Hypoxie:
Konstriktion der Umbilikalarterien  beendet die Versorgung mit
arterialisiertem Blut aus der Plazenta, der Sauerstoffpartialdruck
sinkt, das Atemzentrum wird angeregt.
beendet die Versorgung mit
arterialisiertem Blut aus der Plazenta, der Sauerstoffpartialdruck
sinkt, das Atemzentrum wird angeregt. 
 Abbildung: Zielwerte für postpartale Sauerstoffsättigung des Hämoglobins bei Neugeborenen
Abbildung: Zielwerte für postpartale Sauerstoffsättigung des Hämoglobins bei Neugeborenen
 Der Betrag der arteriovenösen Sauerstoffdifferenz (zwischen Nabelvene und Nabelarterie ~30%) und der O2-Anlieferung an das Gewebe sind trotz des niedrigen pO2 sehr ähnlich wie beim Erwachsenen.
Der Betrag der arteriovenösen Sauerstoffdifferenz (zwischen Nabelvene und Nabelarterie ~30%) und der O2-Anlieferung an das Gewebe sind trotz des niedrigen pO2 sehr ähnlich wie beim Erwachsenen. s. dort). Ein hoher Hämatokrit (50-60%) bei ~8 Millionen
Erys/µl Blut verleiht dem Neugeborenen eine hohe
Sauerstofftransportkapazität (~25 ml O2/100 ml Blut, im Vergleich zu ~20 Vol% beim Erwachsenen).
s. dort). Ein hoher Hämatokrit (50-60%) bei ~8 Millionen
Erys/µl Blut verleiht dem Neugeborenen eine hohe
Sauerstofftransportkapazität (~25 ml O2/100 ml Blut, im Vergleich zu ~20 Vol% beim Erwachsenen).  Hypoglykämie:
Am ersten Tag sinkt der Blutzuckerspiegel des (nunmehr von der Mutter
unabhängigen) Neugeborenen auf die
Hälfte des Normalwertes, der Insulin/Glukagon-Quotient sinkt, der
Adrenalinspiegel steigt, die Leber-Glykogenreserven werden
aufgebraucht (s. unten); freie Fettsäuren werden vermehrt verwertet, ab dem 2. Tag
stabilisiert sich die Stoffwechselsituation durch entsprechende
Enzyminduktionen, der Blutzuckerspiegel kehrt in den Normbereich
zurück.
Hypoglykämie:
Am ersten Tag sinkt der Blutzuckerspiegel des (nunmehr von der Mutter
unabhängigen) Neugeborenen auf die
Hälfte des Normalwertes, der Insulin/Glukagon-Quotient sinkt, der
Adrenalinspiegel steigt, die Leber-Glykogenreserven werden
aufgebraucht (s. unten); freie Fettsäuren werden vermehrt verwertet, ab dem 2. Tag
stabilisiert sich die Stoffwechselsituation durch entsprechende
Enzyminduktionen, der Blutzuckerspiegel kehrt in den Normbereich
zurück. Hypothermie
und Thermoregulation:
Unmittelbar nach der Geburt gelangt das Baby - noch von
Amnionflüssigkeit bedeckt, die verdunstet und dadurch evaporartiven
Wärmeverlust bedeutet - in eine um meist ~10°C kühlere Umgebung als in utero. Seine thermoneutrale Zone
liegt zwischen 32 und 36°C (wesentlich höher als bei erwachsenen
Personen), subkutanes Fett ist noch wenig entwickelt, Kältezittern
tritt noch nicht auf, und die Körpertemperatur sinkt für
1-2 Tage um 1-2°C (bei kleinen, insbesondere frühgeborenen Babys ist diese Problematik noch verschärft). In den ersten ~10 Tagen postpartal verdoppeln sich dann Sauerstoffaufnahme und Energieumsatz, insbesondere braunes (mitochondrienreiches) Fettgewebe generiert zusätzlich Wärme, und die Körpertemperatur normalisiert sich wieder.
Hypothermie
und Thermoregulation:
Unmittelbar nach der Geburt gelangt das Baby - noch von
Amnionflüssigkeit bedeckt, die verdunstet und dadurch evaporartiven
Wärmeverlust bedeutet - in eine um meist ~10°C kühlere Umgebung als in utero. Seine thermoneutrale Zone
liegt zwischen 32 und 36°C (wesentlich höher als bei erwachsenen
Personen), subkutanes Fett ist noch wenig entwickelt, Kältezittern
tritt noch nicht auf, und die Körpertemperatur sinkt für
1-2 Tage um 1-2°C (bei kleinen, insbesondere frühgeborenen Babys ist diese Problematik noch verschärft). In den ersten ~10 Tagen postpartal verdoppeln sich dann Sauerstoffaufnahme und Energieumsatz, insbesondere braunes (mitochondrienreiches) Fettgewebe generiert zusätzlich Wärme, und die Körpertemperatur normalisiert sich wieder. Große
Hautoberfläche relativ zur Körpermasse
Große
Hautoberfläche relativ zur Körpermasse Geringe thermische Isolierung
(wenig Fettgewebe)
Geringe thermische Isolierung
(wenig Fettgewebe) Geringe Neigung zu Muskelzittern
Geringe Neigung zu Muskelzittern Ungenügende
Thermoregulation (unverhornte Haut bedingt starke evaporative Kühlung)
Ungenügende
Thermoregulation (unverhornte Haut bedingt starke evaporative Kühlung)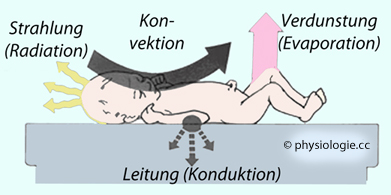
 Abbildung: Quellen des Wärmeverlusts
Abbildung: Quellen des Wärmeverlusts
 Kurz nach der Geburt mobilisiert das Neugeborene seine Kohlenhydrat- und Fettreserven:
Kurz nach der Geburt mobilisiert das Neugeborene seine Kohlenhydrat- und Fettreserven:  Während der ersten 12 Stunden baut es die hepatischen Glykogenvorräte
ab und läuft dann Gefahr, hypoglykämisch zu werden, wenn es nicht
gestillt bzw. gefüttert wird. Niedrige Glucosewerte im Blut steigern
die Glucagon- und senken die Insulinsekretion, was die
Glucosefreisetzung der Leber anregt.
Während der ersten 12 Stunden baut es die hepatischen Glykogenvorräte
ab und läuft dann Gefahr, hypoglykämisch zu werden, wenn es nicht
gestillt bzw. gefüttert wird. Niedrige Glucosewerte im Blut steigern
die Glucagon- und senken die Insulinsekretion, was die
Glucosefreisetzung der Leber anregt. In den letzten zwei Monaten vor der Geburt speichert der Fetus etwa 500
g Fett (ca. 15% des Körpergewichts). Postpartale Hypoglycämie
stimuliert die Sekretion "anti-insulinärer" Hormone, insbesondere
Glucagon und Adrenalin. Diese regen die hormonsensitive Lipase im Fettgewebe (via cAMP) an und führen zum Abbau der Fettdepots,
Glycerin und freie Fettsäuren treten in den Kreislauf über, Fettsäuren
dienen als Energiequelle, Glycerin wird von der Leber zur
Gluconeogenese genutzt.
In den letzten zwei Monaten vor der Geburt speichert der Fetus etwa 500
g Fett (ca. 15% des Körpergewichts). Postpartale Hypoglycämie
stimuliert die Sekretion "anti-insulinärer" Hormone, insbesondere
Glucagon und Adrenalin. Diese regen die hormonsensitive Lipase im Fettgewebe (via cAMP) an und führen zum Abbau der Fettdepots,
Glycerin und freie Fettsäuren treten in den Kreislauf über, Fettsäuren
dienen als Energiequelle, Glycerin wird von der Leber zur
Gluconeogenese genutzt. Die auf das Körpergewicht bezogene tägliche Eiweißzufuhr
ist aufgrund des wachstumsbedingten Mehrbedarfs hoch:
Die auf das Körpergewicht bezogene tägliche Eiweißzufuhr
ist aufgrund des wachstumsbedingten Mehrbedarfs hoch:  Kleinkinder
benötigen mindestens 2 g Protein / kg KG pro Tag (Erwachsene 0,7-1,0 g/d).
Kleinkinder
benötigen mindestens 2 g Protein / kg KG pro Tag (Erwachsene 0,7-1,0 g/d). Eisenhaushalt: Der Hämatokrit
beträgt bei Neugeborenen >50% (gibt hohe
Sauerstofftransportkapazität), bei Einjährigen ~35%, bei Erwachsenen
~40%. Reife Neugeborene haben keinen Eisenmangel; überschüssiges Blut
muss sogar abgebaut werden ("Trimenonreduktion").
Eisenhaushalt: Der Hämatokrit
beträgt bei Neugeborenen >50% (gibt hohe
Sauerstofftransportkapazität), bei Einjährigen ~35%, bei Erwachsenen
~40%. Reife Neugeborene haben keinen Eisenmangel; überschüssiges Blut
muss sogar abgebaut werden ("Trimenonreduktion").  Erst in den Wachstumsphasen
zwischen 7 und 12 Monaten sowie zwischen 12 und 16 Jahren ist der
Eisenbedarf deutlich gesteigert (45-50 mg pro kg Gewichtszunahme) und
es kann zu Eisenmangel kommen, was im Extremfall zu Störungen der
Gehirnentwicklung führen kann.
Erst in den Wachstumsphasen
zwischen 7 und 12 Monaten sowie zwischen 12 und 16 Jahren ist der
Eisenbedarf deutlich gesteigert (45-50 mg pro kg Gewichtszunahme) und
es kann zu Eisenmangel kommen, was im Extremfall zu Störungen der
Gehirnentwicklung führen kann. Abbildung) unter Kontrolle gehalten werden:
Abbildung) unter Kontrolle gehalten werden: 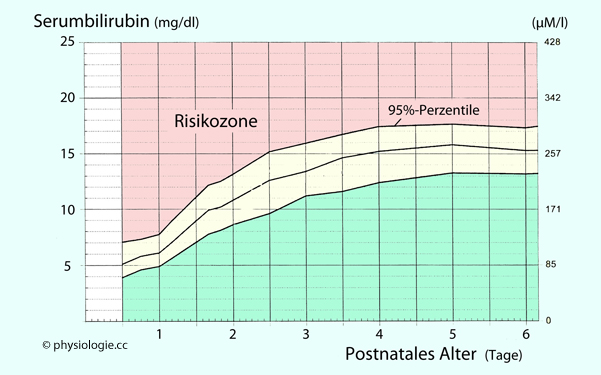
 Abbildung: Nomogramm zu Bilirubinwerten im Blut des Neugeborenen
Abbildung: Nomogramm zu Bilirubinwerten im Blut des Neugeborenen
 Abbildung: Etwa 15 mg/dl, mehr als das Zehnfache des
Normalwertes bei erwachsenen Personen) und sinkt dann allmählich auf
Normalwerte (bei Erwachsenen ≤1,1 mg/dl) ab.
Abbildung: Etwa 15 mg/dl, mehr als das Zehnfache des
Normalwertes bei erwachsenen Personen) und sinkt dann allmählich auf
Normalwerte (bei Erwachsenen ≤1,1 mg/dl) ab. Bilirubin bei Säuglingen (Plasma / Serum)
Bilirubin bei Säuglingen (Plasma / Serum)
 )
manifestiert sich bei etwa jedem zweiten Baby auch an den Skleren und
der Haut des Stammes, gilt aber bis zu den in der Abbildung als grüne
Fläche ausgewiesenen Werten (in Anhängigkeit des postnatalen Alters)
als physiologisch und - da vorübergehend - unbedenklich.
)
manifestiert sich bei etwa jedem zweiten Baby auch an den Skleren und
der Haut des Stammes, gilt aber bis zu den in der Abbildung als grüne
Fläche ausgewiesenen Werten (in Anhängigkeit des postnatalen Alters)
als physiologisch und - da vorübergehend - unbedenklich.| Bei einem offen gebliebenen foramen ovale (Vorhofseptumdefekt) kann es zu Erhöhung der rechtsventrikulären Vorlast kommen |

 Abbildung:
Verteilung der Hauptkompartimente des Körpers von Erwachsenen (links)
und Neugeborenen (rechts) bezogen auf die Masse
Abbildung:
Verteilung der Hauptkompartimente des Körpers von Erwachsenen (links)
und Neugeborenen (rechts) bezogen auf die Masse
 Das interstitielle Flüssigkeitsvolumen
des Neugeborenen hat einen wesentlich höheren Anteil am Körpergewicht
als beim Erwachsenem (
Das interstitielle Flüssigkeitsvolumen
des Neugeborenen hat einen wesentlich höheren Anteil am Körpergewicht
als beim Erwachsenem ( Abbildung). Auch das Blutvolumen (intravaskuläre Flüssigkeit)
ist relatv hoch (~85 ml/kg, im Vergleich zu ~70 ml/kg bei erwachsenen
Personen). Damit ist die extrazelluläre Flüssigkeitsmenge etwa doppelt
so groß wie beim Erwachsenen, und der Flüssigkeitsaustausch ist bezogen auf die Körpermasse wesentlich intensiver - Babys können rasch austrocknen (Dehydrierung); wenn sie schreien, haben sie oft einfach nur Durst.
Abbildung). Auch das Blutvolumen (intravaskuläre Flüssigkeit)
ist relatv hoch (~85 ml/kg, im Vergleich zu ~70 ml/kg bei erwachsenen
Personen). Damit ist die extrazelluläre Flüssigkeitsmenge etwa doppelt
so groß wie beim Erwachsenen, und der Flüssigkeitsaustausch ist bezogen auf die Körpermasse wesentlich intensiver - Babys können rasch austrocknen (Dehydrierung); wenn sie schreien, haben sie oft einfach nur Durst.
 Abbildung: Synapsendichte als Funktion des Lebensalters
Abbildung: Synapsendichte als Funktion des Lebensalters
 Die
Akkommodationsfähigkeit des Auges beträgt bei Kindern bis zu 15 Dioptrien (hohe Linsen-Elastizität).
Die
Akkommodationsfähigkeit des Auges beträgt bei Kindern bis zu 15 Dioptrien (hohe Linsen-Elastizität). Als Kindheit (childhood) bezeichnet man die Spanne zwischen Geburt und Pubertät. Sie wird in folgende Altersgruppen eingeteilt: Neugeborenes (neonate - Geburt bis 28 Tage nach der Geburt, Säugling (infant - Tag 28 bis 1 Jahr postnatal), Kind (child - 1-12 Jahre), Adoleszenz (adolescent - 13-17 Jahre).
Als Kindheit (childhood) bezeichnet man die Spanne zwischen Geburt und Pubertät. Sie wird in folgende Altersgruppen eingeteilt: Neugeborenes (neonate - Geburt bis 28 Tage nach der Geburt, Säugling (infant - Tag 28 bis 1 Jahr postnatal), Kind (child - 1-12 Jahre), Adoleszenz (adolescent - 13-17 Jahre). Zum embryonalen / fetalen Wachstum s. dort
Zum embryonalen / fetalen Wachstum s. dort Für normales Wachstum und Knochenentwicklung essentielle Hormone sind GH, Schilddrüsenhormone, Insulin und IGFs.
Für normales Wachstum und Knochenentwicklung essentielle Hormone sind GH, Schilddrüsenhormone, Insulin und IGFs.
 Abbildung: Wachstumshormon-IGF-System
Abbildung: Wachstumshormon-IGF-System
 GH-Referenzwerte s. dort
GH-Referenzwerte s. dort Als Pubertät
Als Pubertät  bezeichnet
man die physiologischen Veränderungen, welche den Körper eines Kindes
zu dem einer erwachsenen, fortpflanzungsfähigen Person reifen lassen.
Sie wird von Gehirn über hormonelle Signale auf die Gonaden (Ovarien,
Testes) ausgelöst und von diesen mit der Produktion von Sexualhormonen
beantwortet. Das regt Wachstum, Transformation und Funktion
verschiedener Organe und Gewebe an (Gehirn, Knochen, Muskeln, Haut,
Haare, Blut, Sexualorgane) und steigert die Libido. Das auslösende
hormonelle Signal ist das Auftreten von GnRH-Pulsationen, diese regen die Bildung von Gonadotropinen (FSH und LH) an.
bezeichnet
man die physiologischen Veränderungen, welche den Körper eines Kindes
zu dem einer erwachsenen, fortpflanzungsfähigen Person reifen lassen.
Sie wird von Gehirn über hormonelle Signale auf die Gonaden (Ovarien,
Testes) ausgelöst und von diesen mit der Produktion von Sexualhormonen
beantwortet. Das regt Wachstum, Transformation und Funktion
verschiedener Organe und Gewebe an (Gehirn, Knochen, Muskeln, Haut,
Haare, Blut, Sexualorgane) und steigert die Libido. Das auslösende
hormonelle Signal ist das Auftreten von GnRH-Pulsationen, diese regen die Bildung von Gonadotropinen (FSH und LH) an.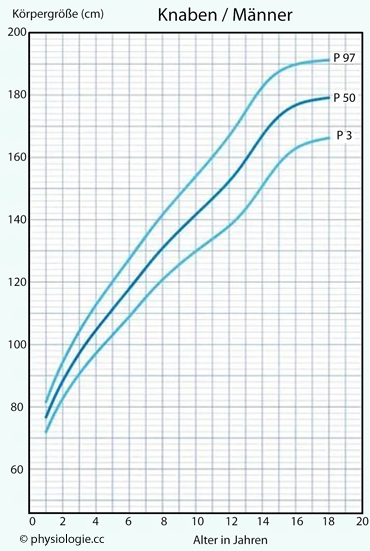
 Abbildung: Wachstumskurven (m)
Abbildung: Wachstumskurven (m) Zu Perzentilen s. dort
Zu Perzentilen s. dort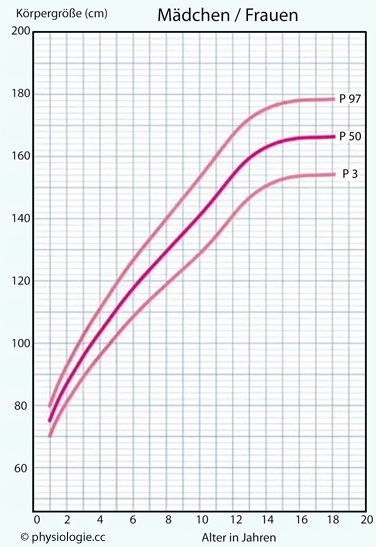
 Abbildung: Wachstumskurven (f)
Abbildung: Wachstumskurven (f)
 (Zunahme von Knochen-, Muskel-, Haut-, Darm-, Lebergewebe, Herzmuskel).
(Zunahme von Knochen-, Muskel-, Haut-, Darm-, Lebergewebe, Herzmuskel).  Zu GH- und IGF-Rezeptoren s. dort
Zu GH- und IGF-Rezeptoren s. dort Sie regen die Lipolyse im Fettgewebe an und steigern dadurch die Konzentration freier Fettsäuren im Blut (diese hemmen ihrerseits die GH-Freisetzung aus der Hypophyse)
Sie regen die Lipolyse im Fettgewebe an und steigern dadurch die Konzentration freier Fettsäuren im Blut (diese hemmen ihrerseits die GH-Freisetzung aus der Hypophyse)  sie fördern den Abbau von Glykogen bei gleichzeitiger Bremsung der Glykolyse, und steigern so den Blutzuckerspiegel (mögliche diabetogene Wirkung längerfristig erhöhter GH-Spiegel)
sie fördern den Abbau von Glykogen bei gleichzeitiger Bremsung der Glykolyse, und steigern so den Blutzuckerspiegel (mögliche diabetogene Wirkung längerfristig erhöhter GH-Spiegel) sie senken die Konzentration an Aminosäuren im Blutplasma durch Förderung der Proteinsynthese
in Bindegewebs-, Muskel- und Knochenzellen; periostales und
perichondrales Knochenwachstum werden angeregt. Vor dem
Epiphysenfugenschluss stimulieren sie das Längenwachstum (IGF-1 ist der
stärkste Förderer), nachher appositionelles (Dicken-) Wachstum.
sie senken die Konzentration an Aminosäuren im Blutplasma durch Förderung der Proteinsynthese
in Bindegewebs-, Muskel- und Knochenzellen; periostales und
perichondrales Knochenwachstum werden angeregt. Vor dem
Epiphysenfugenschluss stimulieren sie das Längenwachstum (IGF-1 ist der
stärkste Förderer), nachher appositionelles (Dicken-) Wachstum. Schilddrüsenhormone
regen das Wachstum an, bei Minderproduktion (Hypothyreose) droht -
neben zahlreichen weiteren Symptomen - Kleinwuchs. Rechtzeitige
Substitution mit T3/T4 kann das Wachstum wieder beschleunigen (catch-up growth).
Schilddrüsenhormone
regen das Wachstum an, bei Minderproduktion (Hypothyreose) droht -
neben zahlreichen weiteren Symptomen - Kleinwuchs. Rechtzeitige
Substitution mit T3/T4 kann das Wachstum wieder beschleunigen (catch-up growth). Geschlechtshormone (Testosteron, Östradiol) beschleunigen das Längenwachstum, sie stimulieren wohl auch die GH-Sekretion.
Geschlechtshormone (Testosteron, Östradiol) beschleunigen das Längenwachstum, sie stimulieren wohl auch die GH-Sekretion. Insulin
ist ein anabol wirkendes und auch wachstumsförderndes Hormon (vor allem
pränatal). Babies diabetischer Mütter entwickeln oft fetale Makrosomie
(der erhöhte Blutzuckerspiegel provoziert vermehrte Insulinproduktion).
Umgekehrt bewirkt schwere Insulinresistenz oder ein Fehlen der
Insulinproduktion (pankreatische Agenese) geringes Geburtsgewicht.
Insulin
ist ein anabol wirkendes und auch wachstumsförderndes Hormon (vor allem
pränatal). Babies diabetischer Mütter entwickeln oft fetale Makrosomie
(der erhöhte Blutzuckerspiegel provoziert vermehrte Insulinproduktion).
Umgekehrt bewirkt schwere Insulinresistenz oder ein Fehlen der
Insulinproduktion (pankreatische Agenese) geringes Geburtsgewicht. Übertriebene
Cortisolproduktion (Hypophyse, Nebenniere) oder therapeutische
Glucocorticoidgaben wirken wachstumshemmend. Cortisolmangel wirkt sich
nicht auf das Wachstum aus.
Übertriebene
Cortisolproduktion (Hypophyse, Nebenniere) oder therapeutische
Glucocorticoidgaben wirken wachstumshemmend. Cortisolmangel wirkt sich
nicht auf das Wachstum aus.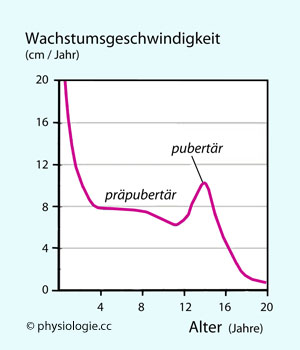
 Abbildung: Gemittelte Wachstumskurve
Abbildung: Gemittelte Wachstumskurve
 Abbildung).
Abbildung).  angegeben. Die Typisierung orientiert sich nach der Ausbildung von
Genitalien, Brust und Behaarung:
angegeben. Die Typisierung orientiert sich nach der Ausbildung von
Genitalien, Brust und Behaarung:| Stadium |
Schamhaar |
Genitalien  |
Brust  |
| Tanner I vorpubertär |
Flaumhaar |
Hodenvolumen < 1,5 ml Penis klein |
Keine fühlbare Brustdrüse Warzenhof folgt den Hautkonturen der umgebenden Brust |
| Tanner II |
 Flaumige Haare an der Basis von Penis und Hodensack, gering pigmentiert Flaumige Haare an der Basis von Penis und Hodensack, gering pigmentiert Auf äußeren Schamlippen Auf äußeren Schamlippen |
Hodenvolumen → 1,6 bis 6 ml Haut des Hodensackes verdünnt, rötlicher erweitert Penislänge unverändert |
Brustknospe entwickelt sich Brustdrüsengewebe wird tastbar Warzenhof leicht vergrößert |
| Tanner III |
Kräftiger, gekräuselt, dunkler |
Hodenvolumen 6-12 ml Penislänge nimmt zu |
Brust beginnt sich zu wölben Drüsengewebe größer als die Grenzen des Warzenhofes Warzenhof wächst, bleibt in einer Ebene mit umgebendem Gewebe |
| Tanner IV |
Ausbreitung über Schamhügel, noch nicht Oberschenkel |
Hodenvolumen 12-20 ml Hodensack wird größer und dunkler Penisumfang und -Länge nehmen zu |
Brustgröße und Erhebung nehmen zu Brustwarze und Warzenhof heben sich von der Brustkontur ab |
| Tanner V (erwachsen) |
Erwachsen, über Schenkel bis linea alba |
Hodenvolumen >20 ml Hodensack und Penis ausgewachsen |
Brust erreicht ihre Endgröße Warzenhof bildet wieder eine Ebene mit der Brustkontur, aus der nur die Brustwarze hervorsteht |
 Zu Somatomedinen (IGFs) s. dort
Zu Somatomedinen (IGFs) s. dort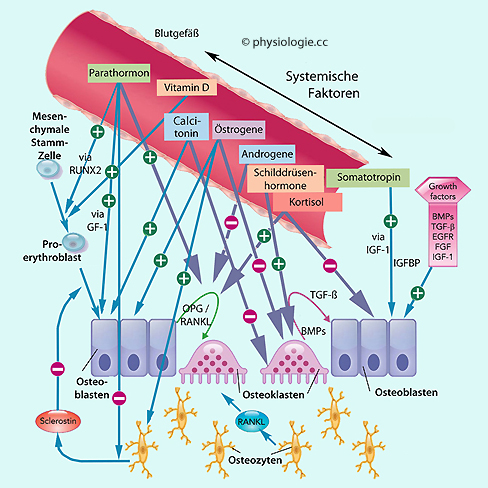
 Abbildung: Einfluss systemischer (endokriner) und Wachstumsfaktoren auf den Knochenstoffwechsel
Abbildung: Einfluss systemischer (endokriner) und Wachstumsfaktoren auf den Knochenstoffwechsel RANK, receptor activator of nuclear factor kappa B ist ein Protein der Osteoklasten, Mutationen führen zu Knochenerkrankungen
RANK, receptor activator of nuclear factor kappa B ist ein Protein der Osteoklasten, Mutationen führen zu Knochenerkrankungen  RANKL, RANK ligand u.a. auf Osteoblasten, die Bindung an RANK führt zur Differenzierung von Klasten (
RANKL, RANK ligand u.a. auf Osteoblasten, die Bindung an RANK führt zur Differenzierung von Klasten ( s. auch dort)
s. auch dort)

 Abbildung). So hemmt Östradiol über Wirkung auf Osteoklasten die
Knochenresorption (sie regt diese zur Apoptose an) und wirkt damit kräftigend auf das Skelettsystem.
Abbildung). So hemmt Östradiol über Wirkung auf Osteoklasten die
Knochenresorption (sie regt diese zur Apoptose an) und wirkt damit kräftigend auf das Skelettsystem.
 Abbildung unten) an.
Abbildung unten) an.  Unter dem Einfluss
der spezifischen Hormonmuster entwickeln Mädchen
Röhrenknochen mit geringerem Umfang, aber stärkerer Mineralisation
(Knochendichte) der Compacta;
Unter dem Einfluss
der spezifischen Hormonmuster entwickeln Mädchen
Röhrenknochen mit geringerem Umfang, aber stärkerer Mineralisation
(Knochendichte) der Compacta;  Knaben haben stärkere Knochen mit
größerem Durchmesser (und voluminösere Spongiosa), aber geringerer
Compactadichte.
Knaben haben stärkere Knochen mit
größerem Durchmesser (und voluminösere Spongiosa), aber geringerer
Compactadichte. 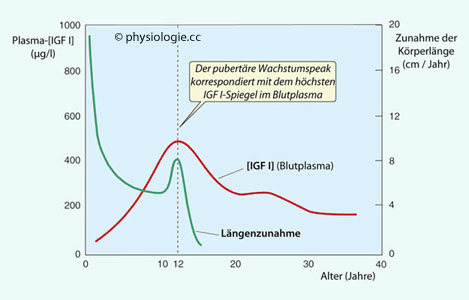
 Abbildung: Durchschnittliche Wachstumskurve (grün) und IGF-I (rot)
Abbildung: Durchschnittliche Wachstumskurve (grün) und IGF-I (rot)


 Abbildung: Wachstum verschiedener Gewebe / Organe als Funktion des Lebensalters
Abbildung: Wachstum verschiedener Gewebe / Organe als Funktion des Lebensalters
 Abbildung).
Abbildung).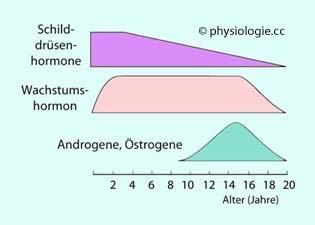
 Abbildung: Bedeutung von Hormonsystemen für den Wachstumsprozess
Abbildung: Bedeutung von Hormonsystemen für den Wachstumsprozess

 Wird die
Bindungskapazität des Albumins für (nach der Geburt gesteigerte)
Gallenfarbstoffe überfordert, tritt Bilirubin vermehrt in das
Gewebe ein. Das kann u.a. im Nervensystem geschehen (unreife
Blut-Hirn-Schranke), insbesondere die Basalganglien betreffen und eine Bilirubinenzephalopathie ("Kernikterus") mit neurologischen Schädigungen bewirken.
Wird die
Bindungskapazität des Albumins für (nach der Geburt gesteigerte)
Gallenfarbstoffe überfordert, tritt Bilirubin vermehrt in das
Gewebe ein. Das kann u.a. im Nervensystem geschehen (unreife
Blut-Hirn-Schranke), insbesondere die Basalganglien betreffen und eine Bilirubinenzephalopathie ("Kernikterus") mit neurologischen Schädigungen bewirken. Starker Stress unter der Geburt kann beim Feten zu vorzeitigem Anstieg des Motilinspiegels
und damit Darmentleerung führen; Mekonium gelangt ins Fruchtwasser und
wird aspiriert, was zu konnataler Pneumonie führen kann.
Starker Stress unter der Geburt kann beim Feten zu vorzeitigem Anstieg des Motilinspiegels
und damit Darmentleerung führen; Mekonium gelangt ins Fruchtwasser und
wird aspiriert, was zu konnataler Pneumonie führen kann. Hormonmangel oder fehlende Hormonwirkung:
GH-Mangel kann durch Störungen im Hypothalamus (mangelnde
GHRH-Freisetzung) oder in der Hypophyse bedingt sein (mangelnde
Expression von GHRH-Rezeptoren). In der Peripherie kann sich ein Defekt
der GH-Rezeptoren oder gestörte Wirkung von IGF-1 (Signaltransduktion) bemerkbar machen. Mangelnde GH-Wirkung ab der
Kindheit führt zu hypophysärem Minderwuchs (proportioniert), GH-Mangel
bei Erwachsenen hat metabolische Folgen. Defekte am GH-Rezeptor können
dysproportionierten Zwergwuchs bedingen.
Hormonmangel oder fehlende Hormonwirkung:
GH-Mangel kann durch Störungen im Hypothalamus (mangelnde
GHRH-Freisetzung) oder in der Hypophyse bedingt sein (mangelnde
Expression von GHRH-Rezeptoren). In der Peripherie kann sich ein Defekt
der GH-Rezeptoren oder gestörte Wirkung von IGF-1 (Signaltransduktion) bemerkbar machen. Mangelnde GH-Wirkung ab der
Kindheit führt zu hypophysärem Minderwuchs (proportioniert), GH-Mangel
bei Erwachsenen hat metabolische Folgen. Defekte am GH-Rezeptor können
dysproportionierten Zwergwuchs bedingen. GH-Überschuss
(hormonbildendes Hypophysenvorderlappen-Adenom) ab der Kindheit führt
zu Riesenwuchs (Gigantismus) oder (nur) zu Akromegalie, wenn das Adenom
erst im Erwachsenenalter auftritt. Metabolische Störungen (Diabetes
mellitus) und Aktivierung von Prolaktinrezeptoren durch hohe
GH-Konzentration (Galaktorrhoe) sowie Organvergrößerungen
(Kardiomegalie) können zusätzlich auftreten.
GH-Überschuss
(hormonbildendes Hypophysenvorderlappen-Adenom) ab der Kindheit führt
zu Riesenwuchs (Gigantismus) oder (nur) zu Akromegalie, wenn das Adenom
erst im Erwachsenenalter auftritt. Metabolische Störungen (Diabetes
mellitus) und Aktivierung von Prolaktinrezeptoren durch hohe
GH-Konzentration (Galaktorrhoe) sowie Organvergrößerungen
(Kardiomegalie) können zusätzlich auftreten.
 Das Neugeborene ist mit Stoffwechselproblemen konfrontiert: Hypoxie, Hypoglykämie (Glucosespiegel sinkt auf die Hälfte des Normalwertes,
die hepatische Glykogenreserve wird aufgebraucht, freie Fettsäuren
werden vermehrt verwertet), Hypothermie (Stabilisierung innerhalb einer Woche durch Adrenalin und Thyroxin - braunes Fettgewebe, Thermogenin), erhöhter Bilirubinspiegel (icterus neonatorum). Kleinkinder benötigen mindestens 2 g Protein / kg KG pro Tag Das Neugeborene ist mit Stoffwechselproblemen konfrontiert: Hypoxie, Hypoglykämie (Glucosespiegel sinkt auf die Hälfte des Normalwertes,
die hepatische Glykogenreserve wird aufgebraucht, freie Fettsäuren
werden vermehrt verwertet), Hypothermie (Stabilisierung innerhalb einer Woche durch Adrenalin und Thyroxin - braunes Fettgewebe, Thermogenin), erhöhter Bilirubinspiegel (icterus neonatorum). Kleinkinder benötigen mindestens 2 g Protein / kg KG pro Tag Eigenständige Antikörperbildung setzt postnatal nur verzögert ein. Die Leukozytenzahl beträgt bei Neugeborenen 15-40 tausend pro
µl Blut (bei Erwachsenen 4-11.103/µl). Die Darmflora ist nach ca. einem Monat stabil etabliert (Colibakterien, Streptokokken), nach 1-2 Jahren entspricht die Darmflora der von erwachsenen Personen Eigenständige Antikörperbildung setzt postnatal nur verzögert ein. Die Leukozytenzahl beträgt bei Neugeborenen 15-40 tausend pro
µl Blut (bei Erwachsenen 4-11.103/µl). Die Darmflora ist nach ca. einem Monat stabil etabliert (Colibakterien, Streptokokken), nach 1-2 Jahren entspricht die Darmflora der von erwachsenen Personen  Das
relative Herzminutenvolumen ist beim Neugeborenen dreimal so hoch wie beim Erwachsenen (~0,25 vs. ~0,07 l/ l/min/kg KG), die Ruhepulsfrequenz mehr als doppelt so hoch
(70-170 bpm), der Ruheblutdruck beträgt ~70 mmHg. Erhöht sind auch relatives interstitielles,
extrazelluläres und Blutvolumen sowie der
Flüssigkeitsaustausch (Dehydrierungsgefahr bei
Babys). Glomeruläre Filtration und Tubulusfunktion sind hingegen viel
geringer als bei Erwachsenen, die Verweildauer von renal
auszuscheidenden Medikamenten etwa 5-fach länger Das
relative Herzminutenvolumen ist beim Neugeborenen dreimal so hoch wie beim Erwachsenen (~0,25 vs. ~0,07 l/ l/min/kg KG), die Ruhepulsfrequenz mehr als doppelt so hoch
(70-170 bpm), der Ruheblutdruck beträgt ~70 mmHg. Erhöht sind auch relatives interstitielles,
extrazelluläres und Blutvolumen sowie der
Flüssigkeitsaustausch (Dehydrierungsgefahr bei
Babys). Glomeruläre Filtration und Tubulusfunktion sind hingegen viel
geringer als bei Erwachsenen, die Verweildauer von renal
auszuscheidenden Medikamenten etwa 5-fach länger Bei der Geburt
liegen ~100 Milliarden Nervenzellen vor, deren Vernetzung über mehrere
Jahre aufgebaut wird ("Hirnreifung"). Motorische Fähigkeiten entwickeln
sich in einer typischen Abfolge (Sitzen mit 6 Monaten, erste Schritte
mit einem Jahr) parallel zur Reifung motorischer Systeme (u.a.
Pyramidenbahn). Das EEG zeigt bei Kindern niedrigere Frequenzen als beim Erwachsenen. Der REM-Schlaf ist ausgeprägter (50% der Gesamtschlafdauer) als bei Erwachsenen (20%) Bei der Geburt
liegen ~100 Milliarden Nervenzellen vor, deren Vernetzung über mehrere
Jahre aufgebaut wird ("Hirnreifung"). Motorische Fähigkeiten entwickeln
sich in einer typischen Abfolge (Sitzen mit 6 Monaten, erste Schritte
mit einem Jahr) parallel zur Reifung motorischer Systeme (u.a.
Pyramidenbahn). Das EEG zeigt bei Kindern niedrigere Frequenzen als beim Erwachsenen. Der REM-Schlaf ist ausgeprägter (50% der Gesamtschlafdauer) als bei Erwachsenen (20%) Die körperliche Entwicklung von Kindheit über Pubertät bis Adoleszenz wird über das Tanner-Schema angegeben. An
Entwicklung, Wachstum und Reifung sind GH und IGFs sowie
Schilddrüsenhormone, Testosteron, Östrogene, Wachstumsfaktoren, Zytokine und Prostaglandine beteiligt. IGFs steigern den
Spiegel an freien Fettsäuren (Lipolyse) und Glucose (Glykogenabbau), und senken die Aminosäurespiegel (Einbau in
den Bewegungsapparat). Somatotropin (GH) wird in 3-4 Pulsen pro Tag
freigesetzt, am stärksten peripubertär; es wirkt auf Muskeln, Gehirn,
Herz, Fettgewebe. In der Leber entstehen
Somatomedine, das wichtigste ist IGF-I. GH und IGF-1 fördern das
Wachsrum von Haut, Herz, Leber, Milz. TNF und exogene Glucocorticoide
hemmen den wachstumsfördernden IGF-Effekt und beschleunigen den
Eiweißabbau im Muskel Die körperliche Entwicklung von Kindheit über Pubertät bis Adoleszenz wird über das Tanner-Schema angegeben. An
Entwicklung, Wachstum und Reifung sind GH und IGFs sowie
Schilddrüsenhormone, Testosteron, Östrogene, Wachstumsfaktoren, Zytokine und Prostaglandine beteiligt. IGFs steigern den
Spiegel an freien Fettsäuren (Lipolyse) und Glucose (Glykogenabbau), und senken die Aminosäurespiegel (Einbau in
den Bewegungsapparat). Somatotropin (GH) wird in 3-4 Pulsen pro Tag
freigesetzt, am stärksten peripubertär; es wirkt auf Muskeln, Gehirn,
Herz, Fettgewebe. In der Leber entstehen
Somatomedine, das wichtigste ist IGF-I. GH und IGF-1 fördern das
Wachsrum von Haut, Herz, Leber, Milz. TNF und exogene Glucocorticoide
hemmen den wachstumsfördernden IGF-Effekt und beschleunigen den
Eiweißabbau im Muskel  Postnatal steigen die Gonadotropinspiegel (FSH, LH), präpubertär
sind sie niedrig; mit der Pubertät steigen sie wieder an, Oszillationen werden
intensiver, bei der Frau bestehen zyklische Schwankungen. In der
Menopause sind die Gonadotropinwerte stark erhöht (mangelnde
Rückkopplung durch Steroidhormone). Der pubertäre Wachstumsgipfel erfolgt bei Knaben um etwa 2 Jahre später als bei Mädchen, resultierend in größerer Körperlänge. Östradiol bringt Osteoklasten zur Apoptose und wirkt so knochenaufbauend. Mädchen haben Röhrenknochen mit geringerem Umfang, aber stärkerer Mineralisation der Compacta, Knaben stärkere Knochen mit größerem Durchmesser (voluminösere Spongiosa), aber geringerer Compactadichte. Der Schluss der
Epiphysenfugen wird bei beiden Geschlechtern (Adrogene werden zu Östrogenen
aromatisiert) durch hohe Östrogenspiegel
bewirkt (Einfluss auf Chondrozyten) Postnatal steigen die Gonadotropinspiegel (FSH, LH), präpubertär
sind sie niedrig; mit der Pubertät steigen sie wieder an, Oszillationen werden
intensiver, bei der Frau bestehen zyklische Schwankungen. In der
Menopause sind die Gonadotropinwerte stark erhöht (mangelnde
Rückkopplung durch Steroidhormone). Der pubertäre Wachstumsgipfel erfolgt bei Knaben um etwa 2 Jahre später als bei Mädchen, resultierend in größerer Körperlänge. Östradiol bringt Osteoklasten zur Apoptose und wirkt so knochenaufbauend. Mädchen haben Röhrenknochen mit geringerem Umfang, aber stärkerer Mineralisation der Compacta, Knaben stärkere Knochen mit größerem Durchmesser (voluminösere Spongiosa), aber geringerer Compactadichte. Der Schluss der
Epiphysenfugen wird bei beiden Geschlechtern (Adrogene werden zu Östrogenen
aromatisiert) durch hohe Östrogenspiegel
bewirkt (Einfluss auf Chondrozyten) |
