

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Physiologie
des Knochens
Physiologie
des Knochens
© H. Hinghofer-Szalkay
 Cathepsine: καθεψειν = verdauen (Proteasen!)
Cathepsine: καθεψειν = verdauen (Proteasen!)
Compacta: pangere = befestigen, dichten
Osteoblast: ὀστέον = Knochen, βλάστος = Spross, Keim
Osteoklast: κλάστειν = (zer)brechen
Osteonectin: nectere = anbinden, verknüpfen
Osteoprotegerin: protegere = beschützen (hier: vor Abbau)
Sclerostin: σκληρός = hart (Knochen)
Spongiosa: spongia = Schwamm, weicher Panzer
WNT: Nach Wingless und Int-1 benannter Signaltransduktionsmechanismus (Mutation bedingt Flügelverlust bei Taufliegen)
Mechanische. metabolische und hormonelle Einflüsse steuern den Knochenstoffwechsel: Belastungen steigern, Inaktivität senkt die Knochenmasse; Azidose kann den Knochenabbau fördern; osteoblastenstimulierende Faktoren (z.B. Calcitonin) fördern die Knochenbildung, osteoklastenanregende (z.B. Parathormon) den Abbau (dabei wird Ca++ frei, das hebt den Calciumspiegel im Blut).
Es gibt drei knochenspezifische Zelltypen: Osteoblasten bauen frische Knochensubstanz ein; Osteoklasten lösen an Resorptionslakunen Knochensubstanz auf; Osteozyten detektieren im Knochen auftretende Kräfte (Mechanosensoren).
Diese Zellen kooperieren: So aktivieren Osteoblasten Osteoklasten - das erfolgt über den RANK-RANKL-Mechanismus. RANK ist ein Membranprotein auf Osteoklasten, das durch Bindung von Liganden (RANKL) auf Osteoblasten oder Stromazellen aktiviert wird. RANK aktiviert einen für Bildung und Überleben der Osteoklasten unverzichtbaren Transkriptionsfaktor.
Ein weiterer RANKL-Rezeptor konkurriert um die Bindung: Das Osteoprotegerin.
Das Gleichgewicht Osteoprotegerin / RANKL (beide werden von
Osteoblasten exprimiert) steuert die Balance zwischen Neubildung und
Abbau des Knochens.
Dieses Gleichgewicht wird zusätzlich beeinflusst durch lokale Einflüsse einerseits (cross-talk zwischen Osteoblasten und Osteoklasten), systemische Faktoren andererseits (Parathormon, Geschlechtshormone,
Glucocorticoide, Vitamin-D-Hormon, Zytokine, Wachstumsfaktoren).
|
Der
wichtigste stärkende (trophische) Einfluss auf den Knochenstoffwechsel
ist mechanische Belastung. Nimmt diese zu, baut der Knochen zusätzliche
tragende Struktur auf; nimmt sie ab, atrophiert die Knochensubstanz
(Osteoporose). Aufenthalt im schwerelosen Zustand oder prolongierte
Bettlägrigkeit kostet mehr als 1% der Knochensubstanz pro Monat.
Das Einwirken von Kräften beeinflusst das Gleichgewicht von Auf- und Abbau im Knochen
Etwa 75% der Knochensubstanz besteht aus Compacta
(cortical / compact / lamellar bone) in den Außenzonen der Röhren- und flachen Knochen, der die Hauptlast
der Kräfte trägt, die auf das Skelett einwirken; innen finden sich die
maschenartig angeordneten Bälkchen des trabekulären Knochens (Spongiosa) (trabecular / cancellous / medullary bone),
dessen Struktur ebenfalls von einwirkenden Kräften bestimmt wird (~25%
der Knochenmasse). Hier steht eine wesentlich größere Oberfläche für
dynamischen Austausch zur Verfügung, und die Spongiosa ist besonders
anfällig für osteoporotische Schwächung (z.B. in Wirbelknochen).
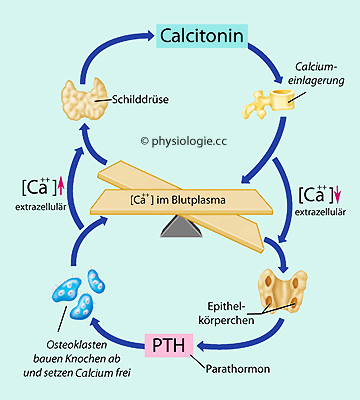

Abbildung: Regelkreise der Calciumhomöostase
Nach einer Vorlage bei Pearson Education / Benjamin Cummings 2001
"Calcium-Schaukel":
Das Gleichgewicht von Einbau in den Knochen, und Mobilisierung aus dem
Knochen wird durch das Zusammenwirken hormoneller Faktoren -
insbesondere Calcitonin aus parafollikulären Zellen und Parathormon aus
den Epithelkörperchen - geregelt.
Dies zeigt die zentrale Bedeutung der
Schilddrüse für die Calciumhomöostase in extrazellulären
Flüssigkeiten
 Jedes Knochenbälkchen und jedes Modul kompakten
Knochens (basic multicellular unit, BMU) passt die
Tragfähigkeit seiner
Strukturelemente laufend an mechanische
Belastungen an. Man schätzt die Zahl der jeweils aktuell aktiven BMUs im Skelett eines Menschen auf insgesamt 2 Millionen.
Jedes Knochenbälkchen und jedes Modul kompakten
Knochens (basic multicellular unit, BMU) passt die
Tragfähigkeit seiner
Strukturelemente laufend an mechanische
Belastungen an. Man schätzt die Zahl der jeweils aktuell aktiven BMUs im Skelett eines Menschen auf insgesamt 2 Millionen.

 ) und Neubildung (Osteoblasten
) und Neubildung (Osteoblasten  ). An jeder betreffenden Stelle besteht dadurch gerade das richtige Maß an Knochensubstanz; Neubildung erfolgt an Orten der Materialermüdung bzw. -beschädigung (microdamages).
). An jeder betreffenden Stelle besteht dadurch gerade das richtige Maß an Knochensubstanz; Neubildung erfolgt an Orten der Materialermüdung bzw. -beschädigung (microdamages).
Calciumphosphate sind relativ schwer löslich und bilden bei Überschreitung des Löslichkeitsproduktes Kristalle (Apatit u.ä.).
 Unter Löslichkeitsprodukt versteht man das Produkt der Konzentrationen der Kationen und der Anionen eines Salzes - in diesem Fall Ca++ und HPO42-
-,
das gerade noch volle Löslichkeit erlaubt, also ohne dass ein Teil des
Salzes unlöslich wird (ausfällt). Das Löslichkeitsprodukt ist ein Maß
für die
Löslichkeit,
d.h. die Fähigkeit des gelösten Stoffes, sich unter homogener
Verteilung seiner Komponenten im Lösungsmittel zu vermischen (lösen).
Der Betrag des Löslichkeitsproduktes ist groß bei leicht löslichen,
klein bei schwer löslichen
Salzen.
Unter Löslichkeitsprodukt versteht man das Produkt der Konzentrationen der Kationen und der Anionen eines Salzes - in diesem Fall Ca++ und HPO42-
-,
das gerade noch volle Löslichkeit erlaubt, also ohne dass ein Teil des
Salzes unlöslich wird (ausfällt). Das Löslichkeitsprodukt ist ein Maß
für die
Löslichkeit,
d.h. die Fähigkeit des gelösten Stoffes, sich unter homogener
Verteilung seiner Komponenten im Lösungsmittel zu vermischen (lösen).
Der Betrag des Löslichkeitsproduktes ist groß bei leicht löslichen,
klein bei schwer löslichen
Salzen.
 Im Knochen ist diese Überschreitung notwendig, um neue Knochensubvstanz bilden zu können. Für extrazelluläre Flüssigkeiten gilt ansonsten, dass der Phosphatspiegel bei Erhöhung des Ca++-Spiegels gesenkt werden muß (und vice versa), um ein Ausfallen von Kristallen (Verkalkung, Steinbildung) zu verhindern.
Im Knochen ist diese Überschreitung notwendig, um neue Knochensubvstanz bilden zu können. Für extrazelluläre Flüssigkeiten gilt ansonsten, dass der Phosphatspiegel bei Erhöhung des Ca++-Spiegels gesenkt werden muß (und vice versa), um ein Ausfallen von Kristallen (Verkalkung, Steinbildung) zu verhindern.
Das Knochenzellsystem reagiert auf physikalische und biochemische Zustandsvariable:
 Mechanische
Mechanische
Kräfte in der unmittelbaren Umgebung (Röhren- und Trabekelknochen: Zu-
oder Abbau je nach Belastungsmuster). Stärker
belastete Elemente nehmen an Masse zu (z.B. auch nach einer Fraktur), während andere,
weniger belastete abnehmen. Der Knochen kann so auch seine Form modifizieren (Callusbildung nach Knochenbrüchen).
 Schon Galileo Galilei hat erkannt, dass zur Erhaltung der
Knochensubstanz mechanische Belastung erforderlich ist. Die moderne
wissenschaftliche Analyse der kraftabhängigen Knochenphysiologie hat
erst vor wenigen Jahrzehnten begonnen (z.B. durch Harold M. Frost, der
den Begriff des "Mechanostaten" für die Funktion der Osteozyten
eingeführt hat).
Schon Galileo Galilei hat erkannt, dass zur Erhaltung der
Knochensubstanz mechanische Belastung erforderlich ist. Die moderne
wissenschaftliche Analyse der kraftabhängigen Knochenphysiologie hat
erst vor wenigen Jahrzehnten begonnen (z.B. durch Harold M. Frost, der
den Begriff des "Mechanostaten" für die Funktion der Osteozyten
eingeführt hat).
 Hormonelle
Hormonelle Einflüsse. Der Knochen ist ein
Calcium- und Phosphatspeicher (70 kg schwerer Mensch: ~1000 g Calcium - über 99% der Menge im Körper - und ~600 Gramm Phosphor - 85%);
calciumsensitive Rezeptoren (
CaSR) an verschiedenen Zellen messen Veränderungen des extrazellulären Ca
++-Spiegels.
Dies führt zur Ausschüttung entsprechender Hormone, welche wiederum die
Knochenzellen zur Korrektur des Calciumspiegels veranlassen, indem sie
Calcium mobilisieren oder die Speicherung im Knochen zu erhöhen
trachten:
 Parathormon
Parathormon
 Vit-D3-Hormon
Vit-D3-Hormon
 Calcitonin
Calcitonin
 FGF23
FGF23
Spezialisierte Zellen bewirken Homöostase im Knochen
Der Knochen ist
eine Struktur von hoher Druck- und Zugfestigkeit und unterliegt einer
intensiven biologischen Dynamik. Der Auf-, Um- und Abbau - entsprechend
mechanischen und anderen Anforderungen - wird vom Zusammenspiel
verschiedener Zellarten bewerkstelligt: Osteoblasten bauen Knochen auf,
Osteozyten sind in den Knochen "einzementierte" Kraftsensoren,
Osteoklasten lösen Knochensubstanz auf; dazu kommen phagozytierende
Zellen aus dem Kreislauf (Makrophagen / Monozyten) sowie Zellen, die Zytokine und andere Mediatoren produzieren (Endothelzellen, Lymphozyten).
Osteoblasten  Osteozyten
Osteozyten  Osteoklasten
Osteoklasten
Der
Knochen dient als Calciumpuffer für den gesamten
Organismus. Die An- und Abbauvorgänge wirken sich einerseits auf den
Calcium- und Phosphatspiegel in der extrazellulären Flüssigkeit aus
(kurzfristig), andererseits (langfristig) auf die Festigkeit der
Knochenstruktur. Knochen wird durch drei hauptsächliche Zelltypen geformt und remodelliert: Osteoblasten (Neubildung von Knochensubsztanz, Expression von RANKL und Osteoprotegerin), Osteozyten (Mechanosensoren, Produktion von Sclerostin) und Osteoklasten (Resorption, Expression von RANK).
Osteoblasten
Osteoblasten entwickeln sich aus
mesodermalen Stromazellen, aus denen auch Muskel-, Fett- oder
Knorpelzellen werden können. Verschiedene parakrine und endokrine
Faktoren steuern diese Entwicklung. Beispielsweise spielt der
knochenspezifische Transkriptionsfaktor Runx2 (Runt-related transcription factor 2) eine Schlüsselrolle für die Differenzierung der Osteoblasten (dieser Faktor ist bei Patienten mit kleidokranialer Dysplasie - einer seltenen Unterentwicklung des Schlüsselbeins - mutiert).

 Abbildung: Knochenzellen und Sclerostin
Abbildung: Knochenzellen und Sclerostin
Nach Holdsworth G, Roberts SJ, Ke HZ. Novel actions of sclerostin on bone. JME 2019; 62: R167-85
Osteoklasten bauen Knochensubstanz ab, sie stammen aus Prä-Osteoklasten, die wiederum von Monozyten abstammen.
Das aus Osteozyten stammende
Sclerostin wirkt (bei sinkender mechanischer Belastung von
Knochengewebe) im Sinne des Knochenabbaus: Es fördert die Differenzierung von Prä- zu aktiven Osteoklasten und hemmt diejenige von Stammzellen (deren Entwicklung zu Adipozyten es fördert)
zu Prä-Osteoblasten sowie von diesen zu aktiven Osteoblasten, indem es
den Wnt-Signalweg (WNT) inhibiert. Auch fördert es die
Apoptose von Osteoblasten
 Wnt
Wnt  ist ein Signalprotein im Rahmen von Signaltransduktionswegen, die durch para- oder autokrine Signale auf Rezeptoren in der Zellmembran reagieren und an denen mehrere Proteine beteiligt sind.
Sie spielen für Wachstum, Differenzierung und Migration
von Zellen eine Schlüsselrolle, u.a. in der Embryogenese und zeitlebens im
Knochen. Die Abkürzung "Wnt" steht für Wingless (mutierte wingless-Gene
bei Taufliegen produzieren eine flügellose Variante) und Int-1 (das
Int-Gen spielt
bei genetischen Manipulationen im Mausmodell eine Rolle). Wnt ist nur
einer von zahlreichen Signalwegen, über die Zellen auf äußere Reize
reagieren (vgl. dort).
ist ein Signalprotein im Rahmen von Signaltransduktionswegen, die durch para- oder autokrine Signale auf Rezeptoren in der Zellmembran reagieren und an denen mehrere Proteine beteiligt sind.
Sie spielen für Wachstum, Differenzierung und Migration
von Zellen eine Schlüsselrolle, u.a. in der Embryogenese und zeitlebens im
Knochen. Die Abkürzung "Wnt" steht für Wingless (mutierte wingless-Gene
bei Taufliegen produzieren eine flügellose Variante) und Int-1 (das
Int-Gen spielt
bei genetischen Manipulationen im Mausmodell eine Rolle). Wnt ist nur
einer von zahlreichen Signalwegen, über die Zellen auf äußere Reize
reagieren (vgl. dort).
 Das Glycoprotein Sclerostin
Das Glycoprotein Sclerostin  (SOST) wird von Osteozyten exprimiert - nach Maßgabe der mechanischen Belastung
des Knochens: Je geringer diese ist, desto mehr Sclerostin entsteht.
Sclerostin bindet an Rezeptoren in der Membran von Osteoblasten, und
über den WNT-Signalweg hemmt es den Aufbau frischer Knochensubstanz (
(SOST) wird von Osteozyten exprimiert - nach Maßgabe der mechanischen Belastung
des Knochens: Je geringer diese ist, desto mehr Sclerostin entsteht.
Sclerostin bindet an Rezeptoren in der Membran von Osteoblasten, und
über den WNT-Signalweg hemmt es den Aufbau frischer Knochensubstanz ( Abbildung), z.B. in chronisch unterbelasteten Knochen (Bettlägrigkeit, Astronauten).
Abbildung), z.B. in chronisch unterbelasteten Knochen (Bettlägrigkeit, Astronauten).
 Bei erhöhter mechanischer Belastung führt die Repression von SOST zu vermehrter Differenzierung von Osteoblasten, Bildung neuer Osteozyten und Aufbau neuer Knochensubstanz.
Bei erhöhter mechanischer Belastung führt die Repression von SOST zu vermehrter Differenzierung von Osteoblasten, Bildung neuer Osteozyten und Aufbau neuer Knochensubstanz.
Mutationen des SOST-Gens mit Funktionsverlust führen zu exzessivem Knochenwachstum (Sklerostose).
Osteoblasten stammen von Vorläuferzellen ab, die sich im Periost und im Knochenmark befinden. Sie sind in Gruppen angeordnet, diese funktionellen Einheiten werden als Osteone bezeichnet. Osteoblasten bewerkstelligen die Knochenbildung, vor allem durch die Synthese von Kollagen. Auch beteiligen sie sich an der Aktivierung von Osteoklasten.
Zu den Komponenten, welche der Knochenstruktur (ähnlich wie bei Stahlbeton) mechanische Belastbarkeit sowohl im Sinne von Druck als auch von Zug ermöglichen, gehören:

Die Bildung einer
organischen Matrix - des zunächst nicht-mineralisierten
Osteoids -, einer Gerüststruktur, die vorwiegend aus
Typ-I-Kollagen besteht. Die organische Matrix verleiht dem Knochen
Zugfestigkeit und Elastizität.

Die Herstellung einer lokalen Umgebung
(micro-environment), welche die Kristallisation von Calciumphosphat reguliert.

Bestimmte Eiweiße - z.B. das
Vit-K-abhängige, Calciumionen mit hoher Affinität bindende
Matrix Gla-Protein (MGP, nach
seiner Gamma-Carboxyglutamin Domäne benannt) - verhindern das Ausfällen von Calciumphosphat, die
Ionenkonzentrationen liegen im Bereich des Löslichkeitsprodukts.
 Alkalische Phosphatase
Alkalische Phosphatase
an der Oberfläche von Knochenzellen begünstigt hingegen die Bildung und
Ablagerung von Hydroxylapatit.

Synthese des Calciumphosphat-regulierenden
FGF 23.
Osteoblasten synthetisieren weiters
 das Zytokin M-CSF (monocyte colony-stimulating factor), das über Bindung an seinen Rezeptor an Vorläuferzellen von Osteoklasten deren Expression von RANK und damit die Reifung zu aktiven Osteoklasten anregt
das Zytokin M-CSF (monocyte colony-stimulating factor), das über Bindung an seinen Rezeptor an Vorläuferzellen von Osteoklasten deren Expression von RANK und damit die Reifung zu aktiven Osteoklasten anregt
 Proteoglykane, stark glykosylierte Proteine der extrazellulären Matrix, die Zellverbände stabilisieren
Proteoglykane, stark glykosylierte Proteine der extrazellulären Matrix, die Zellverbände stabilisieren
 Osteocalcin:
Osteocalcin:
 Osteocalcin
(auch: bone gamma-carboxyglutamic acid-containing protein BGLAP) ist ein - exklusiv - von Knochen (Osteoblasten) und Zähnen (Odontoblasten) gebildetes
6-kDa Peptid, das an Stellen der Knochenneubildung entsteht. Es bindet intensiv Calciumionen, abhängig von Vitamin K (die Knochenmatrix
enthält ca. 2% Osteocalcin) und gilt als Knochenaufbaumarker. Calcitriol (Vit. D) regt seine Synthese an.
Osteocalcin
(auch: bone gamma-carboxyglutamic acid-containing protein BGLAP) ist ein - exklusiv - von Knochen (Osteoblasten) und Zähnen (Odontoblasten) gebildetes
6-kDa Peptid, das an Stellen der Knochenneubildung entsteht. Es bindet intensiv Calciumionen, abhängig von Vitamin K (die Knochenmatrix
enthält ca. 2% Osteocalcin) und gilt als Knochenaufbaumarker. Calcitriol (Vit. D) regt seine Synthese an.
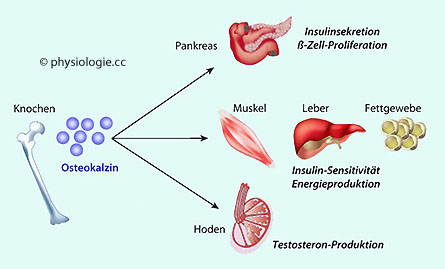

Abbildung: Osteocalcin als multifunktionales Hormon
Nach Karsenty G, Ferron M, The contribution of bone to whole-organism physiology. Nature 2012; 481: 314-20
Osteocalcin
aus Osteoblasten bindet Calcium
im Knochen, es gilt als Aufbaumarker.
Es wirkt aber auch endokrin auf zahlreiche weitere Gewebe (z.B.
ß-Zellen im Pankreas, die zur Freisetzung des anabol wirkenden Insulin
angeregt werden): der Knochen
ist ein Hormonproduzent

Osteocalcin regt darüber hinaus den Stoffwechsel im Sinne vermehrter
Energiefreisetzung an (verbesserte Insulinempfindlichkeit) und
stimuliert beim Mann Testosteronproduktion, Spermienbildung und
Fertilität
( Abbildung).
Abbildung).
Osteocalcin wirkt über Osteocalcinrezeptoren, die zur Gruppe der G-Protein-assoziierten Rezeptoren gehören. Man findet sie u.a. in
 Myozyten des Skelettmuskels (wo Osteocalcin die Energieverfügbarkeit steigert),
Myozyten des Skelettmuskels (wo Osteocalcin die Energieverfügbarkeit steigert),
 Adipozyten (Osteocalcin triggert hier die Freisetzung von Adiponektin, das die Insulinempfindlichkeit erhöht),
Adipozyten (Osteocalcin triggert hier die Freisetzung von Adiponektin, das die Insulinempfindlichkeit erhöht),
 Leydig-Zwischenzellen (wo Osteocalcin die Testosteronproduktion anregt),
Leydig-Zwischenzellen (wo Osteocalcin die Testosteronproduktion anregt),
 ß-Zellen im Pankreas (deren Insulinsekretion gesteigert wird),
ß-Zellen im Pankreas (deren Insulinsekretion gesteigert wird),
 Nervenzellen (Osteocalcin fördert Lernen und Gedächtnis).
Nervenzellen (Osteocalcin fördert Lernen und Gedächtnis).
 Osteocalcin (Plasma / Serum)
Osteocalcin (Plasma / Serum)
Frauen: 21-30 Jahre 4-20 µg/l, ≥31 Jahre 4-12 µg/l
Männer: 21-30 Jahre 6-20 µg/l, ≥31 Jahre 4-12 µg/l
Kinder: 1-10 Jahre 10-50 µg/l, 11-15 Jahre 10-100 µg/l, 16-20 Jahre 10-50 µg/l
Biologische Halbwertszeit 4 Minuten
 Osteonectin
Osteonectin  ist
ein 35-kDa Glycoprotein, das sowohl an Calcium als auch an Kollagen
bindet und so anorganische und organische Komponenten miteinander
verknüpft (daher die Bezeichnung). Osteonectin wird im Zuge des
Knochenaufbaus von Osteoblasten sezerniert (auch von Fibroblasten, z.B.
im Periodontium der Zähne). Es bindet auch an andere extrazelluläre
Matrixmoleküle, vermittelt Wechselwirkungen zwischen Matrix und Zellen (es hat anti-adhäsive Wirkung), beeinflusst Zellmigration und Angiogenese, beteiligt sich an
Knochenstoffwechsel (es erhöht die Produktion und Aktivität von Matrix-Metalloproteinasen) und Wundheilung (es wird auch von Makrophagen synthetisiert).
ist
ein 35-kDa Glycoprotein, das sowohl an Calcium als auch an Kollagen
bindet und so anorganische und organische Komponenten miteinander
verknüpft (daher die Bezeichnung). Osteonectin wird im Zuge des
Knochenaufbaus von Osteoblasten sezerniert (auch von Fibroblasten, z.B.
im Periodontium der Zähne). Es bindet auch an andere extrazelluläre
Matrixmoleküle, vermittelt Wechselwirkungen zwischen Matrix und Zellen (es hat anti-adhäsive Wirkung), beeinflusst Zellmigration und Angiogenese, beteiligt sich an
Knochenstoffwechsel (es erhöht die Produktion und Aktivität von Matrix-Metalloproteinasen) und Wundheilung (es wird auch von Makrophagen synthetisiert).
Osteonectin wird auch als SPARC (secreted protein, acidic and rich in cysteine) bezeichnet.
 Ein verknüpfendes Glycoprotein ist auch Osteopontin (300
AS; auch: Sialoprotein I), das sich an der Synthese der Knochenmatrix
beteiligt und einerseits Integrine, andererseits Hydroxylapatit binden
kann (es ist negativ geladen und regt die Phosphorylierung in Knochen,
Otolithen u.a. an). Es wird von Osteoblasten und Osteozyten (Vit. D3 regt seine Bildung an), aber auch zahlreichen anderen Zellen exprimiert (dendritische
Zellen, Endothel, Gehirn, Nieren, Muskulatur, Knorpel u.a.).
Osteopontin ist wesentlich am fortwährenden Vorgang des Knochenumbaus (bone remodeling) beteiligt, indem es Osteoklasten an der Resorptionsoberfläche fixieren hilft.
Ein verknüpfendes Glycoprotein ist auch Osteopontin (300
AS; auch: Sialoprotein I), das sich an der Synthese der Knochenmatrix
beteiligt und einerseits Integrine, andererseits Hydroxylapatit binden
kann (es ist negativ geladen und regt die Phosphorylierung in Knochen,
Otolithen u.a. an). Es wird von Osteoblasten und Osteozyten (Vit. D3 regt seine Bildung an), aber auch zahlreichen anderen Zellen exprimiert (dendritische
Zellen, Endothel, Gehirn, Nieren, Muskulatur, Knorpel u.a.).
Osteopontin ist wesentlich am fortwährenden Vorgang des Knochenumbaus (bone remodeling) beteiligt, indem es Osteoklasten an der Resorptionsoberfläche fixieren hilft.

 Abbildung: Knochenbildung und -resorption
Abbildung: Knochenbildung und -resorption
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Parakrine Mechanismen regulieren Bildung und Aktivität von Osteoklasten. Die Kristallisationszone (Bildung von Apatit) ist rot angedeutet (links)
Osteoklasten - und ihre Vorläufer - verfügen über einen Rezeptor, der den nukleären Faktor κB aktivieren kann und als RANK (receptor activator of nuclear factor κB) bezeichnet wird. Das heisst, Osteoklastenvorläufer werden über Bindung eines Liganden (RANK-L)
auf Osteoblasten aktiviert und differenzieren sich zu reifen
Osteoklasten.
Osteoprotegerin (OPG) ist ebenfalls ein Produkt von Osteoblasten. Es interagiert mit dieser Bindung - bindet ebenfalls RANKL - und läßt
die Osteoklasten "ausgeschaltet"

Osteoblasten steuern Osteoklasten über den RANK-RANKL-Osteoprotegerin- Mechanismus ( Abbildung). Dieser sorgt für ein Gleichgewicht von Auf- und Abbau im Knochen (s. auch
Abbildung). Dieser sorgt für ein Gleichgewicht von Auf- und Abbau im Knochen (s. auch  Abbildung unten):
Abbildung unten):
 NF-κB (Nuclear factor κB) ist ein weit verbreiteter Transkriptionsfaktor, er ist für Bildung und Überleben der Osteoklasten essentiell.
NF-κB (Nuclear factor κB) ist ein weit verbreiteter Transkriptionsfaktor, er ist für Bildung und Überleben der Osteoklasten essentiell.
RANK (Receptor activator of nuclear factor κB) ist ein membranständiges Rezeptorprotein auf zahlreichen Zellen, u.a. Osteoklasten, das entsprechende Liganden (RANKL) binden kann. Aktivierung von RANK auf Osteoklasten führt (über nukleären Faktor κB) zu vermehrtem Um- und Abbau von Knochensubstanz.
RANKL (RANK-L, L für Ligand) ist ein Membranprotein, das ebenfalls von zahlreichen Geweben - auch Osteoblasten - exprimiert wird und an mehrere Bindungspartner koppeln kann: Beispielsweise an RANK auf Osteoklasten, was diese anregt. RANKL kann aber auch Osteoprotegerin binden:
Osteoprotegerin  (OPG) ist ein von zahlreichen Zellarten - auch Osteoblasten - exprimiertes, lösliches Glycoprotein, das - wie RANK - an RANKL bindet, dadurch die Bindung an (auf Osteoklasten-.Vorläuferzellen sitzendes) RANK kompetitiv verhindern kann ("decoy receptor") und die Differenzierung zu aktiven Osteoklasten hemmt (den Knochen dadurch vor Abbau schützt, daher der Name).
(OPG) ist ein von zahlreichen Zellarten - auch Osteoblasten - exprimiertes, lösliches Glycoprotein, das - wie RANK - an RANKL bindet, dadurch die Bindung an (auf Osteoklasten-.Vorläuferzellen sitzendes) RANK kompetitiv verhindern kann ("decoy receptor") und die Differenzierung zu aktiven Osteoklasten hemmt (den Knochen dadurch vor Abbau schützt, daher der Name).
 Auf diese Weise dämpfen Osteoblasten durch Produktion von
Osteoprotegerin selbst die Differenzierung von Osteoklasten, die sie
andererseits durch RANKL anregen.
Auf diese Weise dämpfen Osteoblasten durch Produktion von
Osteoprotegerin selbst die Differenzierung von Osteoklasten, die sie
andererseits durch RANKL anregen.
Aktives Vitamin D3 fördert die
Bildung von RANKL und inhibiert die von Osteoprotegerin - mit der Folge
angeregten Knochenumbaus.
Sowohl bei Östrogenmangel als auch bei erhöhtem Glucocorticoidspiegel scheint das Gleichgewicht zwischen der OPG- und RANKL- Bildung durch Stroma- bzw. Osteoblastenzellen ein wichtiger Faktor für das Osteoporoserisiko zu sein: In beiden Fällen sinkt die Produktion von OPG und steigt diejenige von RANKL.
Ein weiterer essentieller Faktor für die Aktivierung von Osteoklasten ist
der Makrophagen-Wachstumsfaktor M-CSF, exprimiert von Stromazellen im roten
Knochenmark.
Endokrine Achse Muskel - Knochen - Muskel: Osteoblasten reagieren (mittels ihres IL-6-Rezeptors) auf Interleukin 6.
IL-6 stammt u.a. aus Myozyten in aktiven Skelettmuskeln. Sie geben es
in den Kreislauf ab, und Osteoblasten bilden RANKL. Osteoklasten
steigern darauf die Freisetzung von Osteocalcin (s. oben), und Osteocalcin regt wiederum den Stoffwechsel der Skelettmuskulatur an.
Der Knochen ist demnach Teil eines hormonellen Regelkreises, der den Bewegungsapparat stärkt ( Abbildung).
Abbildung).
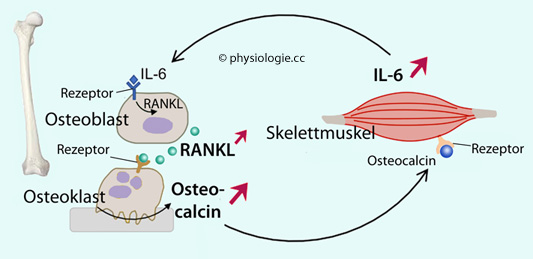
 Abbildung: Interleukin 6 erhöht die Leistungsfähigkeit der Muskulatur via Osteocalcin
Abbildung: Interleukin 6 erhöht die Leistungsfähigkeit der Muskulatur via Osteocalcin
Nach Chowdhury S et al, Muscle-derived interleukin 6 increases exercise capacity by signaling in osteoblasts. J Clin Invest. 2020; 130: 2888-902
Mehrere
Zytokine unterstützen die Muskelfunktion und steigern die
Arbeitskapazität. Der Interleukin-6- (IL-6) Spiegel steigt bei
körperlicher Belastung deutlich an.
Auch Hormone können die Muskelfunktion steigern; Osteocalcin regt die
Expression von IL-6 im Muskel an. Möglicherweise steigert IL-6 die
Expression von RANKL

NF-κB ist für Bildung und Überleben der Osteoklasten essentiell - wie auch M-SCF (Macrophage colony-stimulating factor) und der WNT-Signalweg (s. oben).
 Parathormon stimuliert die Expression von M-SCF und RANKL durch Osteoblasten (diese tragen Parathormonrezeptoren), und fördert so die Osteoklastentätigkeit. Parathormon steigert den Ca++-Spiegel indirekt, indem es (via Osteoklasten) Calcium aus dem Knochen mobilisiert.
Parathormon stimuliert die Expression von M-SCF und RANKL durch Osteoblasten (diese tragen Parathormonrezeptoren), und fördert so die Osteoklastentätigkeit. Parathormon steigert den Ca++-Spiegel indirekt, indem es (via Osteoklasten) Calcium aus dem Knochen mobilisiert.
 Intermittierende Parathormongabe (eine Injektion / Tag) fördert die
Osteoblastenaktivität, steigert die Knochendichte und reduziert die
Frakturgefahr. Dieser Effekt beruht auf multiplen Mechanismen, wie vermehrter Bildung von IGF-1, verringerter Apoptose der Osteoblasten, sowie verringerter Produktion von Sclerostin:
Intermittierende Parathormongabe (eine Injektion / Tag) fördert die
Osteoblastenaktivität, steigert die Knochendichte und reduziert die
Frakturgefahr. Dieser Effekt beruht auf multiplen Mechanismen, wie vermehrter Bildung von IGF-1, verringerter Apoptose der Osteoblasten, sowie verringerter Produktion von Sclerostin:

Neben
RANK gibt es einen zweiten RANKL-Rezeptor: Das Osteoprotegerin (s. oben).
Es konkurriert um die Bindungsstelle und kann RANKL so "abfangen". Über
das Gleichgewicht Osteoprotegerin / RANKL
(beide werden von Osteoblasten exprimiert) wird die Balance Neubildung
/ Abbau gesteuert. Dieses Gleichgewicht wird zusätzlich beeinflusst
 durch lokale parakrine Einflüsse (cross-talk zwischen Osteoblasten, Osteoklasten, wahrscheinlich auch Osteozyten)
durch lokale parakrine Einflüsse (cross-talk zwischen Osteoblasten, Osteoklasten, wahrscheinlich auch Osteozyten)
 durch
zahlreiche systemische Faktoren (Parathormon, Geschlechtshormone,
Glucocorticoide; Vitamin D; Zytokine, z.B. IL-1; Wachstumsfaktoren).
durch
zahlreiche systemische Faktoren (Parathormon, Geschlechtshormone,
Glucocorticoide; Vitamin D; Zytokine, z.B. IL-1; Wachstumsfaktoren).
Osteozyten
sind die langlebigsten und häufigsten (90-95%, etwa das Zehnfache der
Anzahl von Osteoblasten) aller Knochenzellen im Skelett erwachsener
Personen. Sie haben sich in die Knochensubstanz in Lakunen "eingemauert" und strecken etwa 40-100 dendritische Fortsätze in lakunokanalikuläre "Mikrotunnel" im Knochen aus, wo sie über gap junctions untereinander kommunizieren und - zusammen mit Osteoblasten - mechanorezeptiv tätig sind.


Abbildung: Osteozyten im lakuno- kanalikulären System
Nach Qin L, Liu W, Cao H, Xiao G. Molecular mechanoreceptors in osteocytes. Bone Res 2020; 8: 3
Oben links: Raster- Elmi- Aufnahme von Osteozyten (vergrößerter Ausschnitt oben rechts, man erkennt zahlreiche kanalikuläre Verbindungen).
Unten: Skizze zweier Osteozyten mit Darstellung vom Fokalkontakten (focal adhesions, verankern das Zytoskelett an der extrazellulären Matrix), gap junctions, primären Zilien, Zytoskelett, Ionenkanälen (Piezo = mechanosensibles Piezo-Protein, VSC = spannungssensitiver Calciumkanal), perizellulärer Matrix der Lakune.
In den Canaliculi finden sich im Abstand von etwa 0,1 µm an der knöchernen Wand befestigte "Kollagenhügel" (collagen hillocks) zur Fixierung extrazellulärer Matrix und der Zellmembran der dendritischen Fortsätze

Osteozyten regulieren die ossäre Homöostase
durch direkten Einfluss auf die Mineralisierung (Calciumeinbau) und
indirekten Einfluss über Kontrolle von Osteoblasten und Osteoklasten
durch Sekretion regulatorischer Faktoren (NO, ATP, Prostaglandin E2 fördern die Differenzierung von Osteoblasten, Sclerostin u.a. hemmen diese) und Einfluss auf Signalsysteme (WNT, s. oben). Osteozyten sind auch endokrin
tätig: Über FGF23 senken die die Parathormonbildung in den
Epithelkörperchen der Schilddrüse, erhöhen die renale
Phosphatausscheidung, beeinflussen allfällige Calcifikation in Blutgefäßen.
Auch verfügen sie über Hormonrezeptoren (z.B. für Parathormon).
Die wohl
wichtigste Aufgabe der Osteozyten ist die Detektion mechanischer
Belastung im Knochen und ihre regulatorischen Reaktionen darauf.
Dies involviert Genexpression, Proteinsynthese, sowie Differenzierung
und Wachstum von Knochenzellen.

In das lakuno-kanalikuläre System (Knochenkanälchen) ragen Zilien der Osteozyten (Lakunen) sowie Integrinbrücken der dendritischen Zellfortsätze (Canaliculi), und extrazelluläre
(interstitielle) Flüssigkeit bewegt sich an diesen mechanosensiblen Strukturen vorbei - entsprechend den Verformungen
des Knochens, die bei Belastung auftreten. Die Scherung (shear stress) - hervorgerufen durch die Lateralbewegung extrazellulärer
Flüssigkeit, ähnlich wie die Bewegung von Endolymphe in den Bogengängen
des Innenohrs - ist der wichtigste Reiz, der dabei Osteozyten zu
Reaktionen veranlasst. Der Ducrhmesser der Canaliculi beträgt
lediglich 210-260 nm, also etwa ein Viertel eines Mikrometers. Hier
müssen der dendritische Zellfortsatz, extrazelluläre Matrix und
Flüssigkeit Platz finden.
Vibration kann Hin-
und Herbewegung kanalikulärer Flüssigkeit bewirken und
könnte auf diese Weise ebenfalls einen anabolen Effekt auf den Knochen
ausüben. Das eröffnet die Möglichkeit einer Osteoporoseprophylaxe z.B.
durch Vibrationsplatten, die Resultate einschlägiger Studien sind
allerdings widersprüchlich.
Mechanosensible Membranrezeptoren
setzen die auftretenden Kräfte im Osteozyten so um, dass dieser Knochensubstanz anbaut (Osteozyten verfügen über spannungsgesteuerte Calciumkanäle vom T-Typ,  Abbildung). Das Osteozyten-Netzwerk funktioniert
insgesamt wie ein mechanosensibler Computer: Knochenmasse
wird dort gebildet, wo die Belastungen zunehmen. Wie die einzelnen
Stufen der Funktionskette - die Übertragung von Kräftemustern auf
Osteozyten und deren konsekutive Reaktionsmechanismen - im Einzelnen
funktionieren, ist Gegenstand aktueller Forschung.
Abbildung). Das Osteozyten-Netzwerk funktioniert
insgesamt wie ein mechanosensibler Computer: Knochenmasse
wird dort gebildet, wo die Belastungen zunehmen. Wie die einzelnen
Stufen der Funktionskette - die Übertragung von Kräftemustern auf
Osteozyten und deren konsekutive Reaktionsmechanismen - im Einzelnen
funktionieren, ist Gegenstand aktueller Forschung.
Aktinfilamente
spielen eine tragende Rolle für die Erhaltung der Gestalt und Funktion
der Osteozyten. Sie werden dabei unterstützt von Mikrotubuli, die auch
die Calciumdynamik (Ca-Kanäle) sowie Sclerostinbildung (Genexpression)
beeinflussen, sowie von intermediären Filamenten. Eine besondere
Aufgabe übernehmen (primäre) Zilien, die aus dem Zellkörper der Osteozyten in den Lakunenraum ragen (  Abbildung oben) und mechanische Reizung (Strömung extrazellulärer Flüssigkeit, shear stress) in regulatorische Reaktionen der Zelle umzumünzen erlauben. Dabei spielen auch (mechanosensitive) Ionenkanäle eine Rolle (z.B. Piezo 1,
Abbildung oben) und mechanische Reizung (Strömung extrazellulärer Flüssigkeit, shear stress) in regulatorische Reaktionen der Zelle umzumünzen erlauben. Dabei spielen auch (mechanosensitive) Ionenkanäle eine Rolle (z.B. Piezo 1,  Abbildung oben);
innerhalb einer Minute nach mechanischer Reizung steigt die
Ca++-Konzentration in Osteozyten. (Je mehr dieser Kanäle in menschlichen
Knochen exprimiert werden, desto geringer ist die Anfälligkeit für
Osteoporose.) Schließlich beteiligen sich Komponenten der zwischen Wand
der Canaliculi und Dendritenfortsätzen gelegenen Glykokalyx aktiv an der Mechanotransduktion der Osteozyten - insbesondere Catenine (Wnt-Signalweg) und Integrine (fokale Adhäsionspunkte).
Abbildung oben);
innerhalb einer Minute nach mechanischer Reizung steigt die
Ca++-Konzentration in Osteozyten. (Je mehr dieser Kanäle in menschlichen
Knochen exprimiert werden, desto geringer ist die Anfälligkeit für
Osteoporose.) Schließlich beteiligen sich Komponenten der zwischen Wand
der Canaliculi und Dendritenfortsätzen gelegenen Glykokalyx aktiv an der Mechanotransduktion der Osteozyten - insbesondere Catenine (Wnt-Signalweg) und Integrine (fokale Adhäsionspunkte).
Parakrine Faktoren: Osteozyten bilden RANKL sowie Sclerostin (einen Inhibitor des WNT-Signalweges,  Abbildung oben), das die Neubildung von Knochen hemmt (anti-anaboler Effekt).
Abbildung oben), das die Neubildung von Knochen hemmt (anti-anaboler Effekt).
 Die Sclerostinbildung der Osteozyten wird gehemmt durch mechanische Belastung, Parathormon und mehrere Zytokine.
Die Sclerostinbildung der Osteozyten wird gehemmt durch mechanische Belastung, Parathormon und mehrere Zytokine.

 Die Sclerostinbildung der Osteozyten wird angeregt durch Calcitonin.
Die Sclerostinbildung der Osteozyten wird angeregt durch Calcitonin.
Auf diese Weise ist die Aktivität der Osteozyten durch endokrine Feedback-Schleifen reguliert.
Osteoklasten entwickeln
sich aus Vorläuferzellen (angeregt durch Zytokine, Parathormon) und
fusionieren zu vielkernigen Riesenzellen. Diese streifen über die
Oberfläche der Knochenstrukturen und bauen diese ab, wobei sie
ringförmige Abdichtungszonen aufbauen - mittels
Integrin-Vitronectin-Brücken ( Abbildung unten).
Durch den Abbau von Knochensubstanz entstehen auf ihrer Oberfläche
kreisförmige Lakunen bzw. (wenn die Osteoklasten weiterwandern)
streifenförmige Vertiefungen.
Abbildung unten).
Durch den Abbau von Knochensubstanz entstehen auf ihrer Oberfläche
kreisförmige Lakunen bzw. (wenn die Osteoklasten weiterwandern)
streifenförmige Vertiefungen.
Aktive Osteoklasten sezernieren
 hydrolytische Enzyme
hydrolytische Enzyme, wie Cathepsine

, zum Abbau der
organischen Matrix. Dabei werden im Osteoid "gefangene" Zytokine - wie
IGF-1
- frei, die wiederum Osteoblasten aktivieren, bevor an den betroffenen Stellen
neues Osteoid deponiert wird,
 H+
H+ zur Auflösung der
Apatitkristalle.
Cathepsine (CTSA bis CTSZ) sind Endoproteasen, die in Lysosomen (manchmal auch Endosomen) gespeichert werden
und an verschiedenen proteolytischen Vorgängen beteiligt sind (z.B.
intrazellulär: Abbau von Zellorganellen, extrazellulär: Abbau
extrazellulärer Matrix, von Basalmembranen oder Knochensubstanz,
Angriffe durch Lymphozyten oder Granulozyten) und auch an
Gefäßneubildung und Wundheilung mitwirken.
 Osteoid nennt man die organische Proteinmatrix des Knochens - bestehend aus Kollagen (Typ-I-Kollagen:
~90% der Proteinmasse des Osteoids) und anderen extrazellulären
Matrixproteinen. Die Bestandteile des Osteoids stammen zum größten Teil
aus Osteoblasten. Die Kollagenfasern sind hochorganisiert angeordnet
und bilden Startpunkte für die Mineralisierung des Knochens:
Hydroxyapatitkristalle formieren sich mit ihrer Längsachse parallel zu
den Kollagenfasern.
Osteoid nennt man die organische Proteinmatrix des Knochens - bestehend aus Kollagen (Typ-I-Kollagen:
~90% der Proteinmasse des Osteoids) und anderen extrazellulären
Matrixproteinen. Die Bestandteile des Osteoids stammen zum größten Teil
aus Osteoblasten. Die Kollagenfasern sind hochorganisiert angeordnet
und bilden Startpunkte für die Mineralisierung des Knochens:
Hydroxyapatitkristalle formieren sich mit ihrer Längsachse parallel zu
den Kollagenfasern.
Zu Osteocalcin und Osteonectin (anderen Proteinen des Osteoids)  s. oben.
s. oben.
"Auffüllen" von Lakunen (remodeling): Nach Resorption einer Lakune durch Osteoklasten (Abbildungen) lagern sich in diese Präosteoblasten
ein, entwickeln sich zu Osteoblasten und bilden frische Knochenmatrix.
Hat das neue Osteoid ein Ausmaß von ~20 µm Durchmesser erreicht,
beginnt die Calcifizierung. Ein kompletter Erneuerungszyklus nimmt etwa 6 Monate
in Anspruch. Dabei entstehen kleine strukturelle Defizite, die sich im
Laufe des Lebens addieren und - beginnend mit dem Abschluss der
Wachstumsphase - altersabhängige Knochenschwächung (age-related bone loss) bedingen.
 Abbildung: Osteoklast und Knochenresorption
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Osteoklast und Knochenresorption
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Der
Osteoklast bewegt sich über die Oberfläche der Knochenmatrix, an
"reparaturbedürftigen" Stellen bleibt er stehen und bildet eine
kreisförmige Integrin-Vitronektin- Abdichtungszone
. Innerhalb dieser Zone (Resorptionslakune) sezerniert er Salzsäure (Protonenpumpe: H+, Chloridkanal: Cl-) und Proteasen, z.B. Kathepsin (Lysosomen). Das löst sowohl die Mineralphase als auch Kollagen auf. Die Funktion der tartratresistenten sauren Phosphatase (TRAP) wird noch untersucht.
Karboanhydrase (CA) im Osteoklasten sorgt für den Nachschub an Wasserstoffionen, die sezerniert werden, um Calciumcarbonat (CaCO3) aufzulösen. Bicarbonat wird mittels HCO3--Cl--Austauscher
in das Interstitium befördert. Der gesamte Vorgang wird durch weitere
Systeme am Bürstensaum, wie Natrium-Calcium-Austauscher oder
Natrium-Protonen-Austauscher (nicht gezeigt) unterstützt.
ClC7, Chloridkanal-Isoform; IL-6, Interleukin
 Zu diversen Transportern s. dort
Zu diversen Transportern s. dort

Osteoklasten sind über
Parathormon (Anregung) / Calcitonin (Hemmung) in die Ca++-Homöostase eingebunden: Sie lagern Calcium in frischen Knochen ein, entziehen es dem Plasma und senken dadurch den Ca++-Spiegel im Blut. Dazu kommen Monozyten / Makrophagen, Lymphozyten und Endothelzellen, welche vor Ort Zytokine und andere Mediatoren freisetzen.
Östrogene und Knochen:
Östrogene hemmen die Bildung und Reifung von Osteoklasten und senken
(mit TGF-ß) ihre Anzahl, indem sie auf aktive Osteoklasten
apoptosefördernd wirken. Auf diese Weise wirken sie osteoanabol und
antiosteoporotisch, sie erhalten die Integrität des Knochens. Östrogene
sind weiters für den Schluss der Epiphysenfugen verantwortlich
(peripubertärer Konzentrationsanstieg sowohl bei Frauen als auch bei
Männern). Östrogenrezeptoren wirken hauptsächlich transkriptionsfördernd.
Regulation des Knochenstoffwechsels
Geregelt wird die Aktivität dieser Zellen durch mechanische Belastung und Zytokine / Wachstumsfaktoren wie Osteocalcin, alkalische Knochenphosphatase, TGF-ß. Faktoren wie Osteocalcin und alkalische Phosphatase sind für den Mineralisierungsprozess im Knochen besonders
bedeutsam, gelangen auch in das Blut und können als Marker für
veränderten Knochenstoffwechsel herangezogen werden.
 Über Sclerostin, Osteocalcin, Osteonectin, Osteopontin, RANK-RANKL-Osteoprotegerin s. oben
Über Sclerostin, Osteocalcin, Osteonectin, Osteopontin, RANK-RANKL-Osteoprotegerin s. oben
Das Zusammenspiel von Osteoblasten und Osteoklasten bestimmt den
Knochenumbau und ist Angriffspunkt für pharmakologische Einflussnahmen:
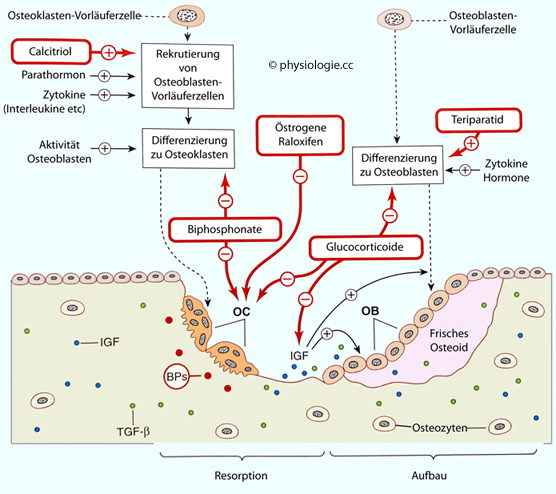

Abbildung: Einflüsse auf die Knochenmodellierung
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Links: In die Knochensubstanz sind Zytokine wie IGF (insulin-like growth factor) und TGF-ß (transforming growth factor)
eingebettet (grüne Punkte). Wurden Biphosphonate (BPs) verabreicht,
werden diese ebenfalls in der Matrix gespeichert (rote Punkte).
Mitte und rechts: Eingebettete Biphosphonate werden von Osteoklasten resorbiert. Eingebettete
Zytokine werden bei der Resorption von Knochenmatrix freigesetzt und
regen Osteoblasten in der benachbarten Wachstumszone an. Osteoblasten
produzieren wiederum frische Zytokine, die in das frische Osteoid
eingebaut werden. Über die Aktivitäten von Calcitriol (Vit.D), Parathormon, Östrogenen und Glucocorticoiden s. dort
 Biphosphonate hemmen die Ausdifferenzierung sowie die Aktivität von Osteoblasten und verkürzen ihre Lebensdauer - was die Reduktion des Knochenabbaus (gewünschter Effekt der Biphosphonate) erklärt. Raloxifen ist ein selektiver Östrogenrezeptor-Modulator (SERM), er bindet (obwohl kein Steroid) an Östrogenrezeptoren im Knochen und wirkt so antiresorptiv, also knochenanabol. Teriparatid
ist ein rekombinantes Parathormon-Fragment (1-34), es fördert (bei
niedriger Dosierung) die Ausdifferenzierung von Osteoblasten, wirkt
damit ebenfalls knochenaufbauend und wird zur Osteoporosetherapie
angewendet
Biphosphonate hemmen die Ausdifferenzierung sowie die Aktivität von Osteoblasten und verkürzen ihre Lebensdauer - was die Reduktion des Knochenabbaus (gewünschter Effekt der Biphosphonate) erklärt. Raloxifen ist ein selektiver Östrogenrezeptor-Modulator (SERM), er bindet (obwohl kein Steroid) an Östrogenrezeptoren im Knochen und wirkt so antiresorptiv, also knochenanabol. Teriparatid
ist ein rekombinantes Parathormon-Fragment (1-34), es fördert (bei
niedriger Dosierung) die Ausdifferenzierung von Osteoblasten, wirkt
damit ebenfalls knochenaufbauend und wird zur Osteoporosetherapie
angewendet

 Die Bildung von Osteoklasten wird von Osteoblasten und Osteozyten über osteoklasten-induzierende Faktoren gesteuert, vor allem
Die Bildung von Osteoklasten wird von Osteoblasten und Osteozyten über osteoklasten-induzierende Faktoren gesteuert, vor allem
 M-CSF (macrophage colony-stimulating factor)
M-CSF (macrophage colony-stimulating factor) und
 RANKL (receptor activator of NF-κB ligand)
RANKL (receptor activator of NF-κB ligand) - früher auch
osteoclast differentiation factor.
Über das RANKL - RANK - OPG- System ergeben
sich ebenfalls mehrere Möglichkeiten therapeutischer Beeinflussung des
Knochenstoffwechsels:
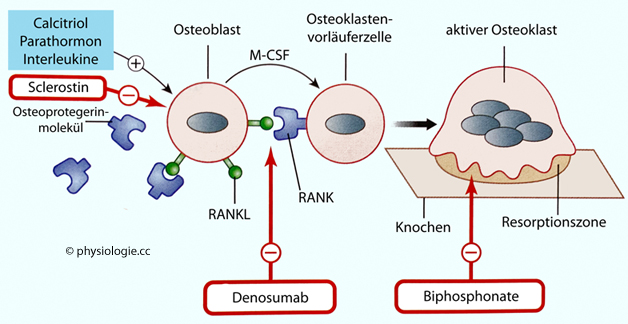
 Abbildung: Einflüsse auf das RANK-RANKL- Osteoprotegerin- System
Abbildung: Einflüsse auf das RANK-RANKL- Osteoprotegerin- System
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Osteoblasten exprimieren (angeregt durch Parathormon) das Membranprotein RANKL.
Koppelt dieses an RANK auf Vorläuferzellen von Osteoklasten, woraufhin
diese zu aktiven Osteoklasten werden und Knochensubstanz resorbieren.
Osteoblasten sezernieren auch das lösliche Glycoprotein Osteoprotegerin,
das um die Bindung mit RANKL auf Osteoblasten konkurriert und so die
Aktivierung von Osteoklasten-Vorläuferzellen (und damit die Reifung zu
aktiven Osteoklasten) verhindern kann.
 Denosumab ist
ein humaner monoklonaler Antikörper, der an RANK bindet und damit RANKL
die Bindung streitig macht. Der Knochenabbau wird dadurch reduziert
(Osteoporosetherapie). Über Sclerostin und Biphosphonate s. oben
Denosumab ist
ein humaner monoklonaler Antikörper, der an RANK bindet und damit RANKL
die Bindung streitig macht. Der Knochenabbau wird dadurch reduziert
(Osteoporosetherapie). Über Sclerostin und Biphosphonate s. oben

Knochengewebe als Calcium-Speicher des Körpers (>99%) ist Angriffsort
zahlreicher Hormone / Signalmoleküle. Insgesamt sind an der Steuerung des Knochenstoffwechsels zahlreiche Faktoren beteiligt:
 Parathormon
Parathormon
 Calcitonin
Calcitonin
 D-Vitamine
D-Vitamine
 Östrogene, Testosteron, andere Steroide
Östrogene, Testosteron, andere Steroide
 GH / IGFs. Wachstumshormon wird für das Knochenwachstum benötigt; Chondrozyten gehen nach Proliferations- und Hypertrophiezyklen zugrunde (Apoptose), an ihre Stelle treten Osteoblasten. Insulinähnliche Wachstumsfaktoren (IGFs) werden zu ~3/4 unter Wirkung des Wachstumshormons (GH)
hepatisch synthetisiert. GH stimuliert teils selbst, teils über IGFs
die Entwicklung und Reifung der Knorpelzellen in wachsendem
Röhrenknochen. Das Osteoklasten / Osteoblastensystem wird durch GH und
IGFs aktiviert.
GH / IGFs. Wachstumshormon wird für das Knochenwachstum benötigt; Chondrozyten gehen nach Proliferations- und Hypertrophiezyklen zugrunde (Apoptose), an ihre Stelle treten Osteoblasten. Insulinähnliche Wachstumsfaktoren (IGFs) werden zu ~3/4 unter Wirkung des Wachstumshormons (GH)
hepatisch synthetisiert. GH stimuliert teils selbst, teils über IGFs
die Entwicklung und Reifung der Knorpelzellen in wachsendem
Röhrenknochen. Das Osteoklasten / Osteoblastensystem wird durch GH und
IGFs aktiviert.
 Neben GH / IGF und anderen Hormonen (s. oben) müssen Wachstumsfaktoren wie FGF, PTHrP (parathormone-related peptide), Ihh (Indian hedgehog), Faktoren der TNF-Familie, Interleuine sowie weitere Mediatoren (wie BMPs) wirksam werden, um die Abfolge der für geordnetes Knochenwachstum nötigen Differenzierungsschritte zu gewährleisten.
Neben GH / IGF und anderen Hormonen (s. oben) müssen Wachstumsfaktoren wie FGF, PTHrP (parathormone-related peptide), Ihh (Indian hedgehog), Faktoren der TNF-Familie, Interleuine sowie weitere Mediatoren (wie BMPs) wirksam werden, um die Abfolge der für geordnetes Knochenwachstum nötigen Differenzierungsschritte zu gewährleisten.
 Knochenmorphogenetische Proteine (bone morphogenic proteins, BMPs) sind parakrin
wirkende Zytokine, welche zur Kommunikation zwischen Zellen (die
TGF-Rezeptoren exprimieren) grundlegend beitragen. Das ist insbesondere
für die Entwicklung (auch apoptotische Rückentwicklung) und Funktion
von Zellverbänden entscheidend. Ihr Mechanismus der
Informationsübertragung ist derjenige der TGFß-Gruppe von Signalmolekülen, zu denen die BMPs gezählt werden.
Knochenmorphogenetische Proteine (bone morphogenic proteins, BMPs) sind parakrin
wirkende Zytokine, welche zur Kommunikation zwischen Zellen (die
TGF-Rezeptoren exprimieren) grundlegend beitragen. Das ist insbesondere
für die Entwicklung (auch apoptotische Rückentwicklung) und Funktion
von Zellverbänden entscheidend. Ihr Mechanismus der
Informationsübertragung ist derjenige der TGFß-Gruppe von Signalmolekülen, zu denen die BMPs gezählt werden.
Inaktivität führt zu Knochenabbau
Knochenabbau kann die Folge geringer Belastung (Inaktivitätsatrophie) oder hormoneller Fehlversorgung sein:
 Mangelnde mechanische Reizung (Immobilisierung),
Mangelnde mechanische Reizung (Immobilisierung),
 Calciummangel (Fehlernährung, Schwangerschaft),
Calciummangel (Fehlernährung, Schwangerschaft),
 Vitamin-D-Mangel (Mangelernährung oder intensiver
Knochenaufbau, UV-Mangel),
Vitamin-D-Mangel (Mangelernährung oder intensiver
Knochenaufbau, UV-Mangel),
 Östrogenmangel (Postmenopause: Östrogene sind RANKL-Suppressoren, die
Osteoklastendifferenzierung wird daher in der Postmenopause weniger
gehemmt) oder
Östrogenmangel (Postmenopause: Östrogene sind RANKL-Suppressoren, die
Osteoklastendifferenzierung wird daher in der Postmenopause weniger
gehemmt) oder
 hohe Dosen an Glucocorticoiden (anti-anabole Wirkung; Cushing-Syndrom)
hohe Dosen an Glucocorticoiden (anti-anabole Wirkung; Cushing-Syndrom)
gefährden Festigkeit und Wachstum des
Knochens.
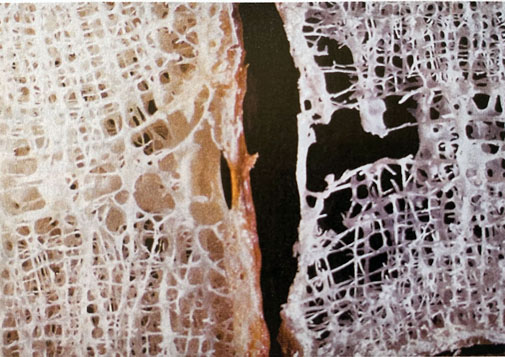
 Abbildung: Spongiosa
Abbildung: Spongiosa 
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Links: Normale Spongiosa. Die Struktur der Knochenbälkchen spiegelt den Verlauf der räumlichen Kräfteverteilung im Knochen wider.
Rechts: Durch längere körperliche Inaktivität bzw. fehlende mechanische Belastung rarefizierte Spongiosa.
Die Ausdünnung an kraftübertragenden Knochenbälkchen führt zu
Osteoporose. Dieser Zustand kann u.a. durch längere Bettlägrigkeit oder
schwerelosen Zustand hervorgerufen werden und betrifft vor allem
Knochen, die normalerweise stark an der Aufrechterhaltung des Körpers
in einem Schwerkraftfeld beteiligt sind (Wirbel, Beckenknochen etc).
Über die Rolle des den Knochenanbau hemmenden Sclerostin s. oben

Die Regulation der Knochendichte bleibt lebenslang
erhalten, auch nach Abschluss des Längenwachstums.
Knochenabbau und Lebensalter: Der Verlust von Knochensubstanz
 beginnt im 4. Lebensjahrzehnt
(~0,5-1% p/a) unasbhängig vom Geschlecht,
beginnt im 4. Lebensjahrzehnt
(~0,5-1% p/a) unasbhängig vom Geschlecht,
 beschleunigt sich bei Frauen in der Menopause / Postmenopause infolge erhöhter Aktivität der Osteoklasten,
hauptsächlich in der Spongiosa (
beschleunigt sich bei Frauen in der Menopause / Postmenopause infolge erhöhter Aktivität der Osteoklasten,
hauptsächlich in der Spongiosa ( Abbildung) bis auf das ~10fache (bei Männern nach einer Kastration), und
Abbildung) bis auf das ~10fache (bei Männern nach einer Kastration), und
 stabilisiert sich schließlich bei 1-3% p/a
(verringerte Zahl an Osteoblasten, betrifft hauptsächlich Compacta
stabilisiert sich schließlich bei 1-3% p/a
(verringerte Zahl an Osteoblasten, betrifft hauptsächlich Compacta  ).
).
Inaktivität (Bettlägerigkeit, Raumflug) kann den Calciumverlust
tragender Strukturen (Oberschenkelhals, Wirbelkörper..) auf über 1% per
Monat steigern.
Langdauernde Inaktivität (Jahre, Jahrzehnte) kann im Extremfall zum
weitgehenden Verlust des Knochens führen, wie Einzelbeispiele gezeigt
haben. Betroffene sind in solchen (seltenen) Fällen nicht mehr in der Lage, unter
1G-Bedingungen in aufrechter Körperlage Kraft zu entfalten bzw. sich
fortzubewegen, ohne Knochenbrüche zu riskieren.


 Knochensubstanz besteht zu 3/4 aus Compacta, 1/4 Spongiosa
(besonders anfällig für osteoporotische Schwächung - z.B.
Wirbelknochen). Mechanische (Belastung), nutritive und hormonelle
Komponenten (D3-Hormon,
Parathormon, Somatotropin, Schilddrüsenhormone u.a.) bestimmen die
Knochengesundheit. Jedes Knochenelement (basic multicellular unit,
BMU) passt seine Tragfähigkeit an die aktuelle Belastungssituation an.
Neubildung erfolgt bei Materialermüdung bzw. -schädigung (microdamages). Insgesamt sind jeweils ~2 Millionen BMUs aktiv
Knochensubstanz besteht zu 3/4 aus Compacta, 1/4 Spongiosa
(besonders anfällig für osteoporotische Schwächung - z.B.
Wirbelknochen). Mechanische (Belastung), nutritive und hormonelle
Komponenten (D3-Hormon,
Parathormon, Somatotropin, Schilddrüsenhormone u.a.) bestimmen die
Knochengesundheit. Jedes Knochenelement (basic multicellular unit,
BMU) passt seine Tragfähigkeit an die aktuelle Belastungssituation an.
Neubildung erfolgt bei Materialermüdung bzw. -schädigung (microdamages). Insgesamt sind jeweils ~2 Millionen BMUs aktiv
 Calciumphosphate sind schwer löslich und bilden bei Überschreitung
des Löslichkeitsproduktes Kristalle. Im Knochen ermöglicht dies die
Bildung neuer Knochensubstanz, ansonsten wird ein Ausfällen von
Kristallen (Verkalkung,
Steinbildung) durch Steuerung des Ca++- bzw. Phosphatspiegels verhindert Calciumphosphate sind schwer löslich und bilden bei Überschreitung
des Löslichkeitsproduktes Kristalle. Im Knochen ermöglicht dies die
Bildung neuer Knochensubstanz, ansonsten wird ein Ausfällen von
Kristallen (Verkalkung,
Steinbildung) durch Steuerung des Ca++- bzw. Phosphatspiegels verhindert
 Osteoblasten bilden neue Knochensubstanz: Organische
Matrix (das zunächst nicht-mineralisierte Osteoid) vorwiegend aus
Typ-I-Kollagen verleiht dem Knochen Zugfestigkeit und Elastizität. Spezielle Proteine (wie GLA) verhindern, alkalische
Phosphatase begünstigt das Ausfällen von Calciumphosphat
(Hydroxylapatit); dieses macht den Knochen druckbelastbar. Osteocalcin
aus Osteoblasten bindet Calcium im Knochen, es gilt als Aufbaumarker
(die Knochenmatrix enthält ~2% Osteocalcin). Osteoblasten bilden
ferner M-CSF, das über Bindung an Osteoklasten-Vorläufer deren
Expression von RANK und damit die Reifung zu aktiven Osteoklasten
anregt Osteoblasten bilden neue Knochensubstanz: Organische
Matrix (das zunächst nicht-mineralisierte Osteoid) vorwiegend aus
Typ-I-Kollagen verleiht dem Knochen Zugfestigkeit und Elastizität. Spezielle Proteine (wie GLA) verhindern, alkalische
Phosphatase begünstigt das Ausfällen von Calciumphosphat
(Hydroxylapatit); dieses macht den Knochen druckbelastbar. Osteocalcin
aus Osteoblasten bindet Calcium im Knochen, es gilt als Aufbaumarker
(die Knochenmatrix enthält ~2% Osteocalcin). Osteoblasten bilden
ferner M-CSF, das über Bindung an Osteoklasten-Vorläufer deren
Expression von RANK und damit die Reifung zu aktiven Osteoklasten
anregt
 Osteoprotegerin ist ein Rezeptorprotein, das durch Koppelung an RANKL dessen Bindung an RANK verhindert ("decoy receptor").
Das hemmt die Differenzierung zu aktiven
Osteoklasten und schützt den Knochen vor Abbau (daher "protegerin"). Osteonectin bindet anorganische (Apatit) und organische Komponenten (Kollagen) und fördert die Mineralisierung des Knochens Osteoprotegerin ist ein Rezeptorprotein, das durch Koppelung an RANKL dessen Bindung an RANK verhindert ("decoy receptor").
Das hemmt die Differenzierung zu aktiven
Osteoklasten und schützt den Knochen vor Abbau (daher "protegerin"). Osteonectin bindet anorganische (Apatit) und organische Komponenten (Kollagen) und fördert die Mineralisierung des Knochens
 Osteoklasten verfügen über RANK, einen membranständigen Rezeptor,
dessen Aktivierung - über Bindung eines Liganden auf Osteoblasten,
RANKL - Osteoklastenvorläufer zu aktiven Osteoklasten reifen lässt.
Osteoprotegerin interagiert mit dieser Bindung und hält
Osteoklasten inaktiv. RANK bedeutet receptor activator of nuclear factor κB; letzterer ist ein Transkriptionsfaktor, der für das Überleben von Osteoklasten essentiell ist. Parathormon steigert den Ca++-Spiegel,
indem es die Expression von RANKL durch Osteoblasten anregt und so
Osteoklasten dazu bringt, Calcium aus dem Knochen zu mobilisieren Osteoklasten verfügen über RANK, einen membranständigen Rezeptor,
dessen Aktivierung - über Bindung eines Liganden auf Osteoblasten,
RANKL - Osteoklastenvorläufer zu aktiven Osteoklasten reifen lässt.
Osteoprotegerin interagiert mit dieser Bindung und hält
Osteoklasten inaktiv. RANK bedeutet receptor activator of nuclear factor κB; letzterer ist ein Transkriptionsfaktor, der für das Überleben von Osteoklasten essentiell ist. Parathormon steigert den Ca++-Spiegel,
indem es die Expression von RANKL durch Osteoblasten anregt und so
Osteoklasten dazu bringt, Calcium aus dem Knochen zu mobilisieren
 Osteozyten
kommunizieren
mittels gap junctions untereinander, das Netzwerk funktioniert wie ein
mechanosensibler Computer: Mittels Filamenten mit der
Wand der canaliculi verankert, reagieren Osteozyten auf Scherkräfte,
die bei belastungssynchroner Strömung kanalikulärer Flüssigkeit
auftreten. Über Mechanorezeptoren und spannungsgesteuerte Calciumkanäle werden intrazelluläre Signalwege aktiviert und der
Knochenaufbau entsprechend angeregt Osteozyten
kommunizieren
mittels gap junctions untereinander, das Netzwerk funktioniert wie ein
mechanosensibler Computer: Mittels Filamenten mit der
Wand der canaliculi verankert, reagieren Osteozyten auf Scherkräfte,
die bei belastungssynchroner Strömung kanalikulärer Flüssigkeit
auftreten. Über Mechanorezeptoren und spannungsgesteuerte Calciumkanäle werden intrazelluläre Signalwege aktiviert und der
Knochenaufbau entsprechend angeregt
 Osteoklasten bauen Knochensubstanz ab. Sie bilden Integrin-Vitronektin- Abdichtungszonen, lösen Calciumphosphat auf (H+)
und bauen organische Matrix hydrolytisch ab (Resorptionslakunen) -
dabei werden im Osteoid gespeicherte Zytokine freigesetzt, die
Osteoblasten aktivieren. Die Lakunen werden dann durch Osteoblasten
wieder aufgefüllt, frische Knochenmatrix calcifiziert.
Der komplette Erneuerungszyklus (remodeling) dauert etwa 6 Monate. Osteoklasten
werden durch Parathormon angeregt, durch Calcitonin gehemmt. Östrogene
hemmen Osteoklasten und
wirken damit antiosteoporotisch; sie triggern (auch beim Mann) den Schluss der
Epiphysenfugen Osteoklasten bauen Knochensubstanz ab. Sie bilden Integrin-Vitronektin- Abdichtungszonen, lösen Calciumphosphat auf (H+)
und bauen organische Matrix hydrolytisch ab (Resorptionslakunen) -
dabei werden im Osteoid gespeicherte Zytokine freigesetzt, die
Osteoblasten aktivieren. Die Lakunen werden dann durch Osteoblasten
wieder aufgefüllt, frische Knochenmatrix calcifiziert.
Der komplette Erneuerungszyklus (remodeling) dauert etwa 6 Monate. Osteoklasten
werden durch Parathormon angeregt, durch Calcitonin gehemmt. Östrogene
hemmen Osteoklasten und
wirken damit antiosteoporotisch; sie triggern (auch beim Mann) den Schluss der
Epiphysenfugen
 Osteocalcin, alkalische Phosphatase und andere für den
Mineralisierungsprozess im Knochen bedeutsame Faktoren gelangen in das
Blut und sind Marker für veränderten Knochenstoffwechsel Osteocalcin, alkalische Phosphatase und andere für den
Mineralisierungsprozess im Knochen bedeutsame Faktoren gelangen in das
Blut und sind Marker für veränderten Knochenstoffwechsel
 Somatotropin (GH) fördert das Knochenwachstum. Die Leber bildet
unter GH-Wirkung insulinähnliche Wachstumsfaktoren (IGFs), diese
fördern die Entwicklung und Reifung von Knorpel- und Knochenzellen in wachsenden
Röhrenknochen. Zusätzlich regen Wachstumsfaktoren (FGF, PTHrP, Ihh,
TNF, bone morphogenic proteins) für das Knochenwachstum
nötige Differenzierungsschritte an Somatotropin (GH) fördert das Knochenwachstum. Die Leber bildet
unter GH-Wirkung insulinähnliche Wachstumsfaktoren (IGFs), diese
fördern die Entwicklung und Reifung von Knorpel- und Knochenzellen in wachsenden
Röhrenknochen. Zusätzlich regen Wachstumsfaktoren (FGF, PTHrP, Ihh,
TNF, bone morphogenic proteins) für das Knochenwachstum
nötige Differenzierungsschritte an
 Mangelnde mechanische Reizung (Inaktivität,
Immobilisierung), Calciummangel (Schwangerschaft), Vitamin-D-Mangel,
Östrogenmangel, hochdosierte Glucocorticoide (Cushing-Syndrom) bedingen Knochenabbau Mangelnde mechanische Reizung (Inaktivität,
Immobilisierung), Calciummangel (Schwangerschaft), Vitamin-D-Mangel,
Östrogenmangel, hochdosierte Glucocorticoide (Cushing-Syndrom) bedingen Knochenabbau
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Cathepsine: καθεψειν = verdauen (Proteasen!)
Cathepsine: καθεψειν = verdauen (Proteasen!) Zellen der Knochenmodellierung
Zellen der Knochenmodellierung  Endokrine Achse Knochen-Muskel
Endokrine Achse Knochen-Muskel  Regulation des Knochenstoffwechsels
Regulation des Knochenstoffwechsels
 WNT
WNT  Sclerostin
Sclerostin  Osteocalcin
Osteocalcin  Osteonectin
Osteonectin  Osteopontin
Osteopontin  NFκB, RANK, RANKL, Osteoprotegerin
NFκB, RANK, RANKL, Osteoprotegerin  Osteoid
Osteoid  BMPs
BMPs
 Core messages
Core messages
 Abbildung: Regelkreise der Calciumhomöostase
Abbildung: Regelkreise der Calciumhomöostase

 ) und Neubildung (Osteoblasten
) und Neubildung (Osteoblasten  ). An jeder betreffenden Stelle besteht dadurch gerade das richtige Maß an Knochensubstanz; Neubildung erfolgt an Orten der Materialermüdung bzw. -beschädigung (microdamages).
). An jeder betreffenden Stelle besteht dadurch gerade das richtige Maß an Knochensubstanz; Neubildung erfolgt an Orten der Materialermüdung bzw. -beschädigung (microdamages). Unter Löslichkeitsprodukt versteht man das Produkt der Konzentrationen der Kationen und der Anionen eines Salzes - in diesem Fall Ca++ und HPO42-
-,
das gerade noch volle Löslichkeit erlaubt, also ohne dass ein Teil des
Salzes unlöslich wird (ausfällt). Das Löslichkeitsprodukt ist ein Maß
für die
Löslichkeit,
d.h. die Fähigkeit des gelösten Stoffes, sich unter homogener
Verteilung seiner Komponenten im Lösungsmittel zu vermischen (lösen).
Der Betrag des Löslichkeitsproduktes ist groß bei leicht löslichen,
klein bei schwer löslichen
Salzen.
Unter Löslichkeitsprodukt versteht man das Produkt der Konzentrationen der Kationen und der Anionen eines Salzes - in diesem Fall Ca++ und HPO42-
-,
das gerade noch volle Löslichkeit erlaubt, also ohne dass ein Teil des
Salzes unlöslich wird (ausfällt). Das Löslichkeitsprodukt ist ein Maß
für die
Löslichkeit,
d.h. die Fähigkeit des gelösten Stoffes, sich unter homogener
Verteilung seiner Komponenten im Lösungsmittel zu vermischen (lösen).
Der Betrag des Löslichkeitsproduktes ist groß bei leicht löslichen,
klein bei schwer löslichen
Salzen. Im Knochen ist diese Überschreitung notwendig, um neue Knochensubvstanz bilden zu können. Für extrazelluläre Flüssigkeiten gilt ansonsten, dass der Phosphatspiegel bei Erhöhung des Ca++-Spiegels gesenkt werden muß (und vice versa), um ein Ausfallen von Kristallen (Verkalkung, Steinbildung) zu verhindern.
Im Knochen ist diese Überschreitung notwendig, um neue Knochensubvstanz bilden zu können. Für extrazelluläre Flüssigkeiten gilt ansonsten, dass der Phosphatspiegel bei Erhöhung des Ca++-Spiegels gesenkt werden muß (und vice versa), um ein Ausfallen von Kristallen (Verkalkung, Steinbildung) zu verhindern. Mechanische
Kräfte in der unmittelbaren Umgebung (Röhren- und Trabekelknochen: Zu-
oder Abbau je nach Belastungsmuster). Stärker
belastete Elemente nehmen an Masse zu (z.B. auch nach einer Fraktur), während andere,
weniger belastete abnehmen. Der Knochen kann so auch seine Form modifizieren (Callusbildung nach Knochenbrüchen).
Mechanische
Kräfte in der unmittelbaren Umgebung (Röhren- und Trabekelknochen: Zu-
oder Abbau je nach Belastungsmuster). Stärker
belastete Elemente nehmen an Masse zu (z.B. auch nach einer Fraktur), während andere,
weniger belastete abnehmen. Der Knochen kann so auch seine Form modifizieren (Callusbildung nach Knochenbrüchen). Schon Galileo Galilei hat erkannt, dass zur Erhaltung der
Knochensubstanz mechanische Belastung erforderlich ist. Die moderne
wissenschaftliche Analyse der kraftabhängigen Knochenphysiologie hat
erst vor wenigen Jahrzehnten begonnen (z.B. durch Harold M. Frost, der
den Begriff des "Mechanostaten" für die Funktion der Osteozyten
eingeführt hat).
Schon Galileo Galilei hat erkannt, dass zur Erhaltung der
Knochensubstanz mechanische Belastung erforderlich ist. Die moderne
wissenschaftliche Analyse der kraftabhängigen Knochenphysiologie hat
erst vor wenigen Jahrzehnten begonnen (z.B. durch Harold M. Frost, der
den Begriff des "Mechanostaten" für die Funktion der Osteozyten
eingeführt hat). Hormonelle Einflüsse. Der Knochen ist ein Calcium- und Phosphatspeicher (70 kg schwerer Mensch: ~1000 g Calcium - über 99% der Menge im Körper - und ~600 Gramm Phosphor - 85%); calciumsensitive Rezeptoren (CaSR) an verschiedenen Zellen messen Veränderungen des extrazellulären Ca++-Spiegels.
Dies führt zur Ausschüttung entsprechender Hormone, welche wiederum die
Knochenzellen zur Korrektur des Calciumspiegels veranlassen, indem sie
Calcium mobilisieren oder die Speicherung im Knochen zu erhöhen
trachten:
Hormonelle Einflüsse. Der Knochen ist ein Calcium- und Phosphatspeicher (70 kg schwerer Mensch: ~1000 g Calcium - über 99% der Menge im Körper - und ~600 Gramm Phosphor - 85%); calciumsensitive Rezeptoren (CaSR) an verschiedenen Zellen messen Veränderungen des extrazellulären Ca++-Spiegels.
Dies führt zur Ausschüttung entsprechender Hormone, welche wiederum die
Knochenzellen zur Korrektur des Calciumspiegels veranlassen, indem sie
Calcium mobilisieren oder die Speicherung im Knochen zu erhöhen
trachten: Parathormon
Parathormon Vit-D3-Hormon
Vit-D3-Hormon Calcitonin
Calcitonin FGF23
FGF23 Osteozyten
Osteozyten  Osteoklasten
Osteoklasten
 Abbildung: Knochenzellen und Sclerostin
Abbildung: Knochenzellen und Sclerostin Wnt
Wnt  ist ein Signalprotein im Rahmen von Signaltransduktionswegen, die durch para- oder autokrine Signale auf Rezeptoren in der Zellmembran reagieren und an denen mehrere Proteine beteiligt sind.
Sie spielen für Wachstum, Differenzierung und Migration
von Zellen eine Schlüsselrolle, u.a. in der Embryogenese und zeitlebens im
Knochen. Die Abkürzung "Wnt" steht für Wingless (mutierte wingless-Gene
bei Taufliegen produzieren eine flügellose Variante) und Int-1 (das
Int-Gen spielt
bei genetischen Manipulationen im Mausmodell eine Rolle). Wnt ist nur
einer von zahlreichen Signalwegen, über die Zellen auf äußere Reize
reagieren (vgl. dort).
ist ein Signalprotein im Rahmen von Signaltransduktionswegen, die durch para- oder autokrine Signale auf Rezeptoren in der Zellmembran reagieren und an denen mehrere Proteine beteiligt sind.
Sie spielen für Wachstum, Differenzierung und Migration
von Zellen eine Schlüsselrolle, u.a. in der Embryogenese und zeitlebens im
Knochen. Die Abkürzung "Wnt" steht für Wingless (mutierte wingless-Gene
bei Taufliegen produzieren eine flügellose Variante) und Int-1 (das
Int-Gen spielt
bei genetischen Manipulationen im Mausmodell eine Rolle). Wnt ist nur
einer von zahlreichen Signalwegen, über die Zellen auf äußere Reize
reagieren (vgl. dort). Das Glycoprotein Sclerostin
Das Glycoprotein Sclerostin  (SOST) wird von Osteozyten exprimiert - nach Maßgabe der mechanischen Belastung
des Knochens: Je geringer diese ist, desto mehr Sclerostin entsteht.
Sclerostin bindet an Rezeptoren in der Membran von Osteoblasten, und
über den WNT-Signalweg hemmt es den Aufbau frischer Knochensubstanz (
(SOST) wird von Osteozyten exprimiert - nach Maßgabe der mechanischen Belastung
des Knochens: Je geringer diese ist, desto mehr Sclerostin entsteht.
Sclerostin bindet an Rezeptoren in der Membran von Osteoblasten, und
über den WNT-Signalweg hemmt es den Aufbau frischer Knochensubstanz ( Abbildung), z.B. in chronisch unterbelasteten Knochen (Bettlägrigkeit, Astronauten).
Abbildung), z.B. in chronisch unterbelasteten Knochen (Bettlägrigkeit, Astronauten).  Bei erhöhter mechanischer Belastung führt die Repression von SOST zu vermehrter Differenzierung von Osteoblasten, Bildung neuer Osteozyten und Aufbau neuer Knochensubstanz.
Bei erhöhter mechanischer Belastung führt die Repression von SOST zu vermehrter Differenzierung von Osteoblasten, Bildung neuer Osteozyten und Aufbau neuer Knochensubstanz. Die Bildung einer organischen Matrix - des zunächst nicht-mineralisierten Osteoids -, einer Gerüststruktur, die vorwiegend aus Typ-I-Kollagen besteht. Die organische Matrix verleiht dem Knochen Zugfestigkeit und Elastizität.
Die Bildung einer organischen Matrix - des zunächst nicht-mineralisierten Osteoids -, einer Gerüststruktur, die vorwiegend aus Typ-I-Kollagen besteht. Die organische Matrix verleiht dem Knochen Zugfestigkeit und Elastizität. Die Herstellung einer lokalen Umgebung (micro-environment), welche die Kristallisation von Calciumphosphat reguliert.
Die Herstellung einer lokalen Umgebung (micro-environment), welche die Kristallisation von Calciumphosphat reguliert.  Bestimmte Eiweiße - z.B. das
Vit-K-abhängige, Calciumionen mit hoher Affinität bindende Matrix Gla-Protein (MGP, nach seiner Gamma-Carboxyglutamin Domäne benannt) - verhindern das Ausfällen von Calciumphosphat, die
Ionenkonzentrationen liegen im Bereich des Löslichkeitsprodukts.
Bestimmte Eiweiße - z.B. das
Vit-K-abhängige, Calciumionen mit hoher Affinität bindende Matrix Gla-Protein (MGP, nach seiner Gamma-Carboxyglutamin Domäne benannt) - verhindern das Ausfällen von Calciumphosphat, die
Ionenkonzentrationen liegen im Bereich des Löslichkeitsprodukts.  Alkalische Phosphatase
an der Oberfläche von Knochenzellen begünstigt hingegen die Bildung und
Ablagerung von Hydroxylapatit.
Alkalische Phosphatase
an der Oberfläche von Knochenzellen begünstigt hingegen die Bildung und
Ablagerung von Hydroxylapatit.  Synthese des Calciumphosphat-regulierenden FGF 23.
Synthese des Calciumphosphat-regulierenden FGF 23. das Zytokin M-CSF (monocyte colony-stimulating factor), das über Bindung an seinen Rezeptor an Vorläuferzellen von Osteoklasten deren Expression von RANK und damit die Reifung zu aktiven Osteoklasten anregt
das Zytokin M-CSF (monocyte colony-stimulating factor), das über Bindung an seinen Rezeptor an Vorläuferzellen von Osteoklasten deren Expression von RANK und damit die Reifung zu aktiven Osteoklasten anregt Proteoglykane, stark glykosylierte Proteine der extrazellulären Matrix, die Zellverbände stabilisieren
Proteoglykane, stark glykosylierte Proteine der extrazellulären Matrix, die Zellverbände stabilisieren Osteocalcin:
Osteocalcin: Osteocalcin
(auch: bone gamma-carboxyglutamic acid-containing protein BGLAP) ist ein - exklusiv - von Knochen (Osteoblasten) und Zähnen (Odontoblasten) gebildetes
6-kDa Peptid, das an Stellen der Knochenneubildung entsteht. Es bindet intensiv Calciumionen, abhängig von Vitamin K (die Knochenmatrix
enthält ca. 2% Osteocalcin) und gilt als Knochenaufbaumarker. Calcitriol (Vit. D) regt seine Synthese an.
Osteocalcin
(auch: bone gamma-carboxyglutamic acid-containing protein BGLAP) ist ein - exklusiv - von Knochen (Osteoblasten) und Zähnen (Odontoblasten) gebildetes
6-kDa Peptid, das an Stellen der Knochenneubildung entsteht. Es bindet intensiv Calciumionen, abhängig von Vitamin K (die Knochenmatrix
enthält ca. 2% Osteocalcin) und gilt als Knochenaufbaumarker. Calcitriol (Vit. D) regt seine Synthese an.
 Abbildung: Osteocalcin als multifunktionales Hormon
Abbildung: Osteocalcin als multifunktionales Hormon
 Abbildung).
Abbildung).  Myozyten des Skelettmuskels (wo Osteocalcin die Energieverfügbarkeit steigert),
Myozyten des Skelettmuskels (wo Osteocalcin die Energieverfügbarkeit steigert),  Adipozyten (Osteocalcin triggert hier die Freisetzung von Adiponektin, das die Insulinempfindlichkeit erhöht),
Adipozyten (Osteocalcin triggert hier die Freisetzung von Adiponektin, das die Insulinempfindlichkeit erhöht), Leydig-Zwischenzellen (wo Osteocalcin die Testosteronproduktion anregt),
Leydig-Zwischenzellen (wo Osteocalcin die Testosteronproduktion anregt),  ß-Zellen im Pankreas (deren Insulinsekretion gesteigert wird),
ß-Zellen im Pankreas (deren Insulinsekretion gesteigert wird), Nervenzellen (Osteocalcin fördert Lernen und Gedächtnis).
Nervenzellen (Osteocalcin fördert Lernen und Gedächtnis). Osteocalcin (Plasma / Serum)
Osteocalcin (Plasma / Serum) Osteonectin
Osteonectin  ist
ein 35-kDa Glycoprotein, das sowohl an Calcium als auch an Kollagen
bindet und so anorganische und organische Komponenten miteinander
verknüpft (daher die Bezeichnung). Osteonectin wird im Zuge des
Knochenaufbaus von Osteoblasten sezerniert (auch von Fibroblasten, z.B.
im Periodontium der Zähne). Es bindet auch an andere extrazelluläre
Matrixmoleküle, vermittelt Wechselwirkungen zwischen Matrix und Zellen (es hat anti-adhäsive Wirkung), beeinflusst Zellmigration und Angiogenese, beteiligt sich an
Knochenstoffwechsel (es erhöht die Produktion und Aktivität von Matrix-Metalloproteinasen) und Wundheilung (es wird auch von Makrophagen synthetisiert).
ist
ein 35-kDa Glycoprotein, das sowohl an Calcium als auch an Kollagen
bindet und so anorganische und organische Komponenten miteinander
verknüpft (daher die Bezeichnung). Osteonectin wird im Zuge des
Knochenaufbaus von Osteoblasten sezerniert (auch von Fibroblasten, z.B.
im Periodontium der Zähne). Es bindet auch an andere extrazelluläre
Matrixmoleküle, vermittelt Wechselwirkungen zwischen Matrix und Zellen (es hat anti-adhäsive Wirkung), beeinflusst Zellmigration und Angiogenese, beteiligt sich an
Knochenstoffwechsel (es erhöht die Produktion und Aktivität von Matrix-Metalloproteinasen) und Wundheilung (es wird auch von Makrophagen synthetisiert). Ein verknüpfendes Glycoprotein ist auch Osteopontin (300
AS; auch: Sialoprotein I), das sich an der Synthese der Knochenmatrix
beteiligt und einerseits Integrine, andererseits Hydroxylapatit binden
kann (es ist negativ geladen und regt die Phosphorylierung in Knochen,
Otolithen u.a. an). Es wird von Osteoblasten und Osteozyten (Vit. D3 regt seine Bildung an), aber auch zahlreichen anderen Zellen exprimiert (dendritische
Zellen, Endothel, Gehirn, Nieren, Muskulatur, Knorpel u.a.).
Osteopontin ist wesentlich am fortwährenden Vorgang des Knochenumbaus (bone remodeling) beteiligt, indem es Osteoklasten an der Resorptionsoberfläche fixieren hilft.
Ein verknüpfendes Glycoprotein ist auch Osteopontin (300
AS; auch: Sialoprotein I), das sich an der Synthese der Knochenmatrix
beteiligt und einerseits Integrine, andererseits Hydroxylapatit binden
kann (es ist negativ geladen und regt die Phosphorylierung in Knochen,
Otolithen u.a. an). Es wird von Osteoblasten und Osteozyten (Vit. D3 regt seine Bildung an), aber auch zahlreichen anderen Zellen exprimiert (dendritische
Zellen, Endothel, Gehirn, Nieren, Muskulatur, Knorpel u.a.).
Osteopontin ist wesentlich am fortwährenden Vorgang des Knochenumbaus (bone remodeling) beteiligt, indem es Osteoklasten an der Resorptionsoberfläche fixieren hilft.
 Abbildung: Knochenbildung und -resorption
Abbildung: Knochenbildung und -resorption
 Abbildung). Dieser sorgt für ein Gleichgewicht von Auf- und Abbau im Knochen (s. auch
Abbildung). Dieser sorgt für ein Gleichgewicht von Auf- und Abbau im Knochen (s. auch  Abbildung unten):
Abbildung unten): NF-κB (Nuclear factor κB) ist ein weit verbreiteter Transkriptionsfaktor, er ist für Bildung und Überleben der Osteoklasten essentiell.
NF-κB (Nuclear factor κB) ist ein weit verbreiteter Transkriptionsfaktor, er ist für Bildung und Überleben der Osteoklasten essentiell. (OPG) ist ein von zahlreichen Zellarten - auch Osteoblasten - exprimiertes, lösliches Glycoprotein, das - wie RANK - an RANKL bindet, dadurch die Bindung an (auf Osteoklasten-.Vorläuferzellen sitzendes) RANK kompetitiv verhindern kann ("decoy receptor") und die Differenzierung zu aktiven Osteoklasten hemmt (den Knochen dadurch vor Abbau schützt, daher der Name).
(OPG) ist ein von zahlreichen Zellarten - auch Osteoblasten - exprimiertes, lösliches Glycoprotein, das - wie RANK - an RANKL bindet, dadurch die Bindung an (auf Osteoklasten-.Vorläuferzellen sitzendes) RANK kompetitiv verhindern kann ("decoy receptor") und die Differenzierung zu aktiven Osteoklasten hemmt (den Knochen dadurch vor Abbau schützt, daher der Name).  Auf diese Weise dämpfen Osteoblasten durch Produktion von
Osteoprotegerin selbst die Differenzierung von Osteoklasten, die sie
andererseits durch RANKL anregen.
Auf diese Weise dämpfen Osteoblasten durch Produktion von
Osteoprotegerin selbst die Differenzierung von Osteoklasten, die sie
andererseits durch RANKL anregen. 
 Abbildung).
Abbildung).
 Abbildung: Interleukin 6 erhöht die Leistungsfähigkeit der Muskulatur via Osteocalcin
Abbildung: Interleukin 6 erhöht die Leistungsfähigkeit der Muskulatur via Osteocalcin
 Parathormon stimuliert die Expression von M-SCF und RANKL durch Osteoblasten (diese tragen Parathormonrezeptoren), und fördert so die Osteoklastentätigkeit. Parathormon steigert den Ca++-Spiegel indirekt, indem es (via Osteoklasten) Calcium aus dem Knochen mobilisiert.
Parathormon stimuliert die Expression von M-SCF und RANKL durch Osteoblasten (diese tragen Parathormonrezeptoren), und fördert so die Osteoklastentätigkeit. Parathormon steigert den Ca++-Spiegel indirekt, indem es (via Osteoklasten) Calcium aus dem Knochen mobilisiert. Intermittierende Parathormongabe (eine Injektion / Tag) fördert die
Osteoblastenaktivität, steigert die Knochendichte und reduziert die
Frakturgefahr. Dieser Effekt beruht auf multiplen Mechanismen, wie vermehrter Bildung von IGF-1, verringerter Apoptose der Osteoblasten, sowie verringerter Produktion von Sclerostin:
Intermittierende Parathormongabe (eine Injektion / Tag) fördert die
Osteoblastenaktivität, steigert die Knochendichte und reduziert die
Frakturgefahr. Dieser Effekt beruht auf multiplen Mechanismen, wie vermehrter Bildung von IGF-1, verringerter Apoptose der Osteoblasten, sowie verringerter Produktion von Sclerostin:
 durch lokale parakrine Einflüsse (cross-talk zwischen Osteoblasten, Osteoklasten, wahrscheinlich auch Osteozyten)
durch lokale parakrine Einflüsse (cross-talk zwischen Osteoblasten, Osteoklasten, wahrscheinlich auch Osteozyten) durch
zahlreiche systemische Faktoren (Parathormon, Geschlechtshormone,
Glucocorticoide; Vitamin D; Zytokine, z.B. IL-1; Wachstumsfaktoren).
durch
zahlreiche systemische Faktoren (Parathormon, Geschlechtshormone,
Glucocorticoide; Vitamin D; Zytokine, z.B. IL-1; Wachstumsfaktoren). 
 Abbildung: Osteozyten im lakuno- kanalikulären System
Abbildung: Osteozyten im lakuno- kanalikulären System

 Abbildung). Das Osteozyten-Netzwerk funktioniert
insgesamt wie ein mechanosensibler Computer: Knochenmasse
wird dort gebildet, wo die Belastungen zunehmen. Wie die einzelnen
Stufen der Funktionskette - die Übertragung von Kräftemustern auf
Osteozyten und deren konsekutive Reaktionsmechanismen - im Einzelnen
funktionieren, ist Gegenstand aktueller Forschung.
Abbildung). Das Osteozyten-Netzwerk funktioniert
insgesamt wie ein mechanosensibler Computer: Knochenmasse
wird dort gebildet, wo die Belastungen zunehmen. Wie die einzelnen
Stufen der Funktionskette - die Übertragung von Kräftemustern auf
Osteozyten und deren konsekutive Reaktionsmechanismen - im Einzelnen
funktionieren, ist Gegenstand aktueller Forschung.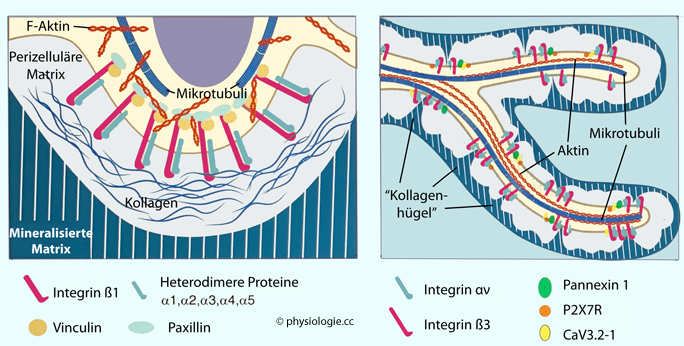
 Abbildung: Fokale Adhäsionen an Zellkörper (links) und Dendriten (rechts) von Osteozyten
Abbildung: Fokale Adhäsionen an Zellkörper (links) und Dendriten (rechts) von Osteozyten
 Abbildung oben) und mechanische Reizung (Strömung extrazellulärer Flüssigkeit, shear stress) in regulatorische Reaktionen der Zelle umzumünzen erlauben. Dabei spielen auch (mechanosensitive) Ionenkanäle eine Rolle (z.B. Piezo 1,
Abbildung oben) und mechanische Reizung (Strömung extrazellulärer Flüssigkeit, shear stress) in regulatorische Reaktionen der Zelle umzumünzen erlauben. Dabei spielen auch (mechanosensitive) Ionenkanäle eine Rolle (z.B. Piezo 1,  Abbildung oben);
innerhalb einer Minute nach mechanischer Reizung steigt die
Ca++-Konzentration in Osteozyten. (Je mehr dieser Kanäle in menschlichen
Knochen exprimiert werden, desto geringer ist die Anfälligkeit für
Osteoporose.) Schließlich beteiligen sich Komponenten der zwischen Wand
der Canaliculi und Dendritenfortsätzen gelegenen Glykokalyx aktiv an der Mechanotransduktion der Osteozyten - insbesondere Catenine (Wnt-Signalweg) und Integrine (fokale Adhäsionspunkte).
Abbildung oben);
innerhalb einer Minute nach mechanischer Reizung steigt die
Ca++-Konzentration in Osteozyten. (Je mehr dieser Kanäle in menschlichen
Knochen exprimiert werden, desto geringer ist die Anfälligkeit für
Osteoporose.) Schließlich beteiligen sich Komponenten der zwischen Wand
der Canaliculi und Dendritenfortsätzen gelegenen Glykokalyx aktiv an der Mechanotransduktion der Osteozyten - insbesondere Catenine (Wnt-Signalweg) und Integrine (fokale Adhäsionspunkte). Abbildung oben), das die Neubildung von Knochen hemmt (anti-anaboler Effekt).
Abbildung oben), das die Neubildung von Knochen hemmt (anti-anaboler Effekt).  Die Sclerostinbildung der Osteozyten wird gehemmt durch mechanische Belastung, Parathormon und mehrere Zytokine.
Die Sclerostinbildung der Osteozyten wird gehemmt durch mechanische Belastung, Parathormon und mehrere Zytokine. 
 Die Sclerostinbildung der Osteozyten wird angeregt durch Calcitonin.
Die Sclerostinbildung der Osteozyten wird angeregt durch Calcitonin. Abbildung unten).
Durch den Abbau von Knochensubstanz entstehen auf ihrer Oberfläche
kreisförmige Lakunen bzw. (wenn die Osteoklasten weiterwandern)
streifenförmige Vertiefungen.
Abbildung unten).
Durch den Abbau von Knochensubstanz entstehen auf ihrer Oberfläche
kreisförmige Lakunen bzw. (wenn die Osteoklasten weiterwandern)
streifenförmige Vertiefungen.  hydrolytische Enzyme, wie Cathepsine
hydrolytische Enzyme, wie Cathepsine  , zum Abbau der organischen Matrix. Dabei werden im Osteoid "gefangene" Zytokine - wie IGF-1
- frei, die wiederum Osteoblasten aktivieren, bevor an den betroffenen Stellen
neues Osteoid deponiert wird,
, zum Abbau der organischen Matrix. Dabei werden im Osteoid "gefangene" Zytokine - wie IGF-1
- frei, die wiederum Osteoblasten aktivieren, bevor an den betroffenen Stellen
neues Osteoid deponiert wird, H+ zur Auflösung der Apatitkristalle.
H+ zur Auflösung der Apatitkristalle. Osteoid nennt man die organische Proteinmatrix des Knochens - bestehend aus Kollagen (Typ-I-Kollagen:
~90% der Proteinmasse des Osteoids) und anderen extrazellulären
Matrixproteinen. Die Bestandteile des Osteoids stammen zum größten Teil
aus Osteoblasten. Die Kollagenfasern sind hochorganisiert angeordnet
und bilden Startpunkte für die Mineralisierung des Knochens:
Hydroxyapatitkristalle formieren sich mit ihrer Längsachse parallel zu
den Kollagenfasern.
Osteoid nennt man die organische Proteinmatrix des Knochens - bestehend aus Kollagen (Typ-I-Kollagen:
~90% der Proteinmasse des Osteoids) und anderen extrazellulären
Matrixproteinen. Die Bestandteile des Osteoids stammen zum größten Teil
aus Osteoblasten. Die Kollagenfasern sind hochorganisiert angeordnet
und bilden Startpunkte für die Mineralisierung des Knochens:
Hydroxyapatitkristalle formieren sich mit ihrer Längsachse parallel zu
den Kollagenfasern.  s. oben.
s. oben.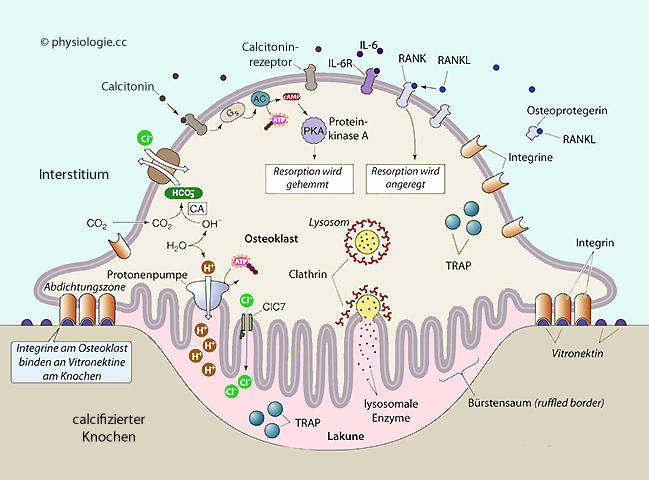
 Abbildung: Osteoklast und Knochenresorption
Abbildung: Osteoklast und Knochenresorption

 Abbildung: Einflüsse auf die Knochenmodellierung
Abbildung: Einflüsse auf die Knochenmodellierung Biphosphonate hemmen die Ausdifferenzierung sowie die Aktivität von Osteoblasten und verkürzen ihre Lebensdauer - was die Reduktion des Knochenabbaus (gewünschter Effekt der Biphosphonate) erklärt. Raloxifen ist ein selektiver Östrogenrezeptor-Modulator (SERM), er bindet (obwohl kein Steroid) an Östrogenrezeptoren im Knochen und wirkt so antiresorptiv, also knochenanabol. Teriparatid
ist ein rekombinantes Parathormon-Fragment (1-34), es fördert (bei
niedriger Dosierung) die Ausdifferenzierung von Osteoblasten, wirkt
damit ebenfalls knochenaufbauend und wird zur Osteoporosetherapie
angewendet
Biphosphonate hemmen die Ausdifferenzierung sowie die Aktivität von Osteoblasten und verkürzen ihre Lebensdauer - was die Reduktion des Knochenabbaus (gewünschter Effekt der Biphosphonate) erklärt. Raloxifen ist ein selektiver Östrogenrezeptor-Modulator (SERM), er bindet (obwohl kein Steroid) an Östrogenrezeptoren im Knochen und wirkt so antiresorptiv, also knochenanabol. Teriparatid
ist ein rekombinantes Parathormon-Fragment (1-34), es fördert (bei
niedriger Dosierung) die Ausdifferenzierung von Osteoblasten, wirkt
damit ebenfalls knochenaufbauend und wird zur Osteoporosetherapie
angewendet

 Die Bildung von Osteoklasten wird von Osteoblasten und Osteozyten über osteoklasten-induzierende Faktoren gesteuert, vor allem
Die Bildung von Osteoklasten wird von Osteoblasten und Osteozyten über osteoklasten-induzierende Faktoren gesteuert, vor allem  M-CSF (macrophage colony-stimulating factor) und
M-CSF (macrophage colony-stimulating factor) und RANKL (receptor activator of NF-κB ligand) - früher auch osteoclast differentiation factor.
RANKL (receptor activator of NF-κB ligand) - früher auch osteoclast differentiation factor.
 Abbildung: Einflüsse auf das RANK-RANKL- Osteoprotegerin- System
Abbildung: Einflüsse auf das RANK-RANKL- Osteoprotegerin- System Denosumab ist
ein humaner monoklonaler Antikörper, der an RANK bindet und damit RANKL
die Bindung streitig macht. Der Knochenabbau wird dadurch reduziert
(Osteoporosetherapie). Über Sclerostin und Biphosphonate s. oben
Denosumab ist
ein humaner monoklonaler Antikörper, der an RANK bindet und damit RANKL
die Bindung streitig macht. Der Knochenabbau wird dadurch reduziert
(Osteoporosetherapie). Über Sclerostin und Biphosphonate s. oben

 Parathormon
Parathormon Calcitonin
Calcitonin D-Vitamine
D-Vitamine Östrogene, Testosteron, andere Steroide
Östrogene, Testosteron, andere Steroide GH / IGFs. Wachstumshormon wird für das Knochenwachstum benötigt; Chondrozyten gehen nach Proliferations- und Hypertrophiezyklen zugrunde (Apoptose), an ihre Stelle treten Osteoblasten. Insulinähnliche Wachstumsfaktoren (IGFs) werden zu ~3/4 unter Wirkung des Wachstumshormons (GH)
hepatisch synthetisiert. GH stimuliert teils selbst, teils über IGFs
die Entwicklung und Reifung der Knorpelzellen in wachsendem
Röhrenknochen. Das Osteoklasten / Osteoblastensystem wird durch GH und
IGFs aktiviert.
GH / IGFs. Wachstumshormon wird für das Knochenwachstum benötigt; Chondrozyten gehen nach Proliferations- und Hypertrophiezyklen zugrunde (Apoptose), an ihre Stelle treten Osteoblasten. Insulinähnliche Wachstumsfaktoren (IGFs) werden zu ~3/4 unter Wirkung des Wachstumshormons (GH)
hepatisch synthetisiert. GH stimuliert teils selbst, teils über IGFs
die Entwicklung und Reifung der Knorpelzellen in wachsendem
Röhrenknochen. Das Osteoklasten / Osteoblastensystem wird durch GH und
IGFs aktiviert.  Neben GH / IGF und anderen Hormonen (s. oben) müssen Wachstumsfaktoren wie FGF, PTHrP (parathormone-related peptide), Ihh (Indian hedgehog), Faktoren der TNF-Familie, Interleuine sowie weitere Mediatoren (wie BMPs) wirksam werden, um die Abfolge der für geordnetes Knochenwachstum nötigen Differenzierungsschritte zu gewährleisten.
Neben GH / IGF und anderen Hormonen (s. oben) müssen Wachstumsfaktoren wie FGF, PTHrP (parathormone-related peptide), Ihh (Indian hedgehog), Faktoren der TNF-Familie, Interleuine sowie weitere Mediatoren (wie BMPs) wirksam werden, um die Abfolge der für geordnetes Knochenwachstum nötigen Differenzierungsschritte zu gewährleisten. Knochenmorphogenetische Proteine (bone morphogenic proteins, BMPs) sind parakrin
wirkende Zytokine, welche zur Kommunikation zwischen Zellen (die
TGF-Rezeptoren exprimieren) grundlegend beitragen. Das ist insbesondere
für die Entwicklung (auch apoptotische Rückentwicklung) und Funktion
von Zellverbänden entscheidend. Ihr Mechanismus der
Informationsübertragung ist derjenige der TGFß-Gruppe von Signalmolekülen, zu denen die BMPs gezählt werden.
Knochenmorphogenetische Proteine (bone morphogenic proteins, BMPs) sind parakrin
wirkende Zytokine, welche zur Kommunikation zwischen Zellen (die
TGF-Rezeptoren exprimieren) grundlegend beitragen. Das ist insbesondere
für die Entwicklung (auch apoptotische Rückentwicklung) und Funktion
von Zellverbänden entscheidend. Ihr Mechanismus der
Informationsübertragung ist derjenige der TGFß-Gruppe von Signalmolekülen, zu denen die BMPs gezählt werden.  Mangelnde mechanische Reizung (Immobilisierung),
Mangelnde mechanische Reizung (Immobilisierung), Calciummangel (Fehlernährung, Schwangerschaft),
Calciummangel (Fehlernährung, Schwangerschaft), Vitamin-D-Mangel (Mangelernährung oder intensiver
Knochenaufbau, UV-Mangel),
Vitamin-D-Mangel (Mangelernährung oder intensiver
Knochenaufbau, UV-Mangel),
 Östrogenmangel (Postmenopause: Östrogene sind RANKL-Suppressoren, die
Osteoklastendifferenzierung wird daher in der Postmenopause weniger
gehemmt) oder
Östrogenmangel (Postmenopause: Östrogene sind RANKL-Suppressoren, die
Osteoklastendifferenzierung wird daher in der Postmenopause weniger
gehemmt) oder  hohe Dosen an Glucocorticoiden (anti-anabole Wirkung; Cushing-Syndrom)
hohe Dosen an Glucocorticoiden (anti-anabole Wirkung; Cushing-Syndrom)

 Abbildung: Spongiosa
Abbildung: Spongiosa 

 beginnt im 4. Lebensjahrzehnt
(~0,5-1% p/a) unasbhängig vom Geschlecht,
beginnt im 4. Lebensjahrzehnt
(~0,5-1% p/a) unasbhängig vom Geschlecht,  beschleunigt sich bei Frauen in der Menopause / Postmenopause infolge erhöhter Aktivität der Osteoklasten,
hauptsächlich in der Spongiosa (
beschleunigt sich bei Frauen in der Menopause / Postmenopause infolge erhöhter Aktivität der Osteoklasten,
hauptsächlich in der Spongiosa ( Abbildung) bis auf das ~10fache (bei Männern nach einer Kastration), und
Abbildung) bis auf das ~10fache (bei Männern nach einer Kastration), und  stabilisiert sich schließlich bei 1-3% p/a
(verringerte Zahl an Osteoblasten, betrifft hauptsächlich Compacta
stabilisiert sich schließlich bei 1-3% p/a
(verringerte Zahl an Osteoblasten, betrifft hauptsächlich Compacta  ).
).

 Knochensubstanz besteht zu 3/4 aus Compacta, 1/4 Spongiosa
(besonders anfällig für osteoporotische Schwächung - z.B.
Wirbelknochen). Mechanische (Belastung), nutritive und hormonelle
Komponenten (D3-Hormon,
Parathormon, Somatotropin, Schilddrüsenhormone u.a.) bestimmen die
Knochengesundheit. Jedes Knochenelement (basic multicellular unit,
BMU) passt seine Tragfähigkeit an die aktuelle Belastungssituation an.
Neubildung erfolgt bei Materialermüdung bzw. -schädigung (microdamages). Insgesamt sind jeweils ~2 Millionen BMUs aktiv
Knochensubstanz besteht zu 3/4 aus Compacta, 1/4 Spongiosa
(besonders anfällig für osteoporotische Schwächung - z.B.
Wirbelknochen). Mechanische (Belastung), nutritive und hormonelle
Komponenten (D3-Hormon,
Parathormon, Somatotropin, Schilddrüsenhormone u.a.) bestimmen die
Knochengesundheit. Jedes Knochenelement (basic multicellular unit,
BMU) passt seine Tragfähigkeit an die aktuelle Belastungssituation an.
Neubildung erfolgt bei Materialermüdung bzw. -schädigung (microdamages). Insgesamt sind jeweils ~2 Millionen BMUs aktiv  Calciumphosphate sind schwer löslich und bilden bei Überschreitung
des Löslichkeitsproduktes Kristalle. Im Knochen ermöglicht dies die
Bildung neuer Knochensubstanz, ansonsten wird ein Ausfällen von
Kristallen (Verkalkung,
Steinbildung) durch Steuerung des Ca++- bzw. Phosphatspiegels verhindert
Calciumphosphate sind schwer löslich und bilden bei Überschreitung
des Löslichkeitsproduktes Kristalle. Im Knochen ermöglicht dies die
Bildung neuer Knochensubstanz, ansonsten wird ein Ausfällen von
Kristallen (Verkalkung,
Steinbildung) durch Steuerung des Ca++- bzw. Phosphatspiegels verhindert Osteoblasten bilden neue Knochensubstanz: Organische
Matrix (das zunächst nicht-mineralisierte Osteoid) vorwiegend aus
Typ-I-Kollagen verleiht dem Knochen Zugfestigkeit und Elastizität. Spezielle Proteine (wie GLA) verhindern, alkalische
Phosphatase begünstigt das Ausfällen von Calciumphosphat
(Hydroxylapatit); dieses macht den Knochen druckbelastbar. Osteocalcin
aus Osteoblasten bindet Calcium im Knochen, es gilt als Aufbaumarker
(die Knochenmatrix enthält ~2% Osteocalcin). Osteoblasten bilden
ferner M-CSF, das über Bindung an Osteoklasten-Vorläufer deren
Expression von RANK und damit die Reifung zu aktiven Osteoklasten
anregt
Osteoblasten bilden neue Knochensubstanz: Organische
Matrix (das zunächst nicht-mineralisierte Osteoid) vorwiegend aus
Typ-I-Kollagen verleiht dem Knochen Zugfestigkeit und Elastizität. Spezielle Proteine (wie GLA) verhindern, alkalische
Phosphatase begünstigt das Ausfällen von Calciumphosphat
(Hydroxylapatit); dieses macht den Knochen druckbelastbar. Osteocalcin
aus Osteoblasten bindet Calcium im Knochen, es gilt als Aufbaumarker
(die Knochenmatrix enthält ~2% Osteocalcin). Osteoblasten bilden
ferner M-CSF, das über Bindung an Osteoklasten-Vorläufer deren
Expression von RANK und damit die Reifung zu aktiven Osteoklasten
anregt  Osteoprotegerin ist ein Rezeptorprotein, das durch Koppelung an RANKL dessen Bindung an RANK verhindert ("decoy receptor").
Das hemmt die Differenzierung zu aktiven
Osteoklasten und schützt den Knochen vor Abbau (daher "protegerin"). Osteonectin bindet anorganische (Apatit) und organische Komponenten (Kollagen) und fördert die Mineralisierung des Knochens
Osteoprotegerin ist ein Rezeptorprotein, das durch Koppelung an RANKL dessen Bindung an RANK verhindert ("decoy receptor").
Das hemmt die Differenzierung zu aktiven
Osteoklasten und schützt den Knochen vor Abbau (daher "protegerin"). Osteonectin bindet anorganische (Apatit) und organische Komponenten (Kollagen) und fördert die Mineralisierung des Knochens Osteoklasten verfügen über RANK, einen membranständigen Rezeptor,
dessen Aktivierung - über Bindung eines Liganden auf Osteoblasten,
RANKL - Osteoklastenvorläufer zu aktiven Osteoklasten reifen lässt.
Osteoprotegerin interagiert mit dieser Bindung und hält
Osteoklasten inaktiv. RANK bedeutet receptor activator of nuclear factor κB; letzterer ist ein Transkriptionsfaktor, der für das Überleben von Osteoklasten essentiell ist. Parathormon steigert den Ca++-Spiegel,
indem es die Expression von RANKL durch Osteoblasten anregt und so
Osteoklasten dazu bringt, Calcium aus dem Knochen zu mobilisieren
Osteoklasten verfügen über RANK, einen membranständigen Rezeptor,
dessen Aktivierung - über Bindung eines Liganden auf Osteoblasten,
RANKL - Osteoklastenvorläufer zu aktiven Osteoklasten reifen lässt.
Osteoprotegerin interagiert mit dieser Bindung und hält
Osteoklasten inaktiv. RANK bedeutet receptor activator of nuclear factor κB; letzterer ist ein Transkriptionsfaktor, der für das Überleben von Osteoklasten essentiell ist. Parathormon steigert den Ca++-Spiegel,
indem es die Expression von RANKL durch Osteoblasten anregt und so
Osteoklasten dazu bringt, Calcium aus dem Knochen zu mobilisieren Osteozyten
kommunizieren
mittels gap junctions untereinander, das Netzwerk funktioniert wie ein
mechanosensibler Computer: Mittels Filamenten mit der
Wand der canaliculi verankert, reagieren Osteozyten auf Scherkräfte,
die bei belastungssynchroner Strömung kanalikulärer Flüssigkeit
auftreten. Über Mechanorezeptoren und spannungsgesteuerte Calciumkanäle werden intrazelluläre Signalwege aktiviert und der
Knochenaufbau entsprechend angeregt
Osteozyten
kommunizieren
mittels gap junctions untereinander, das Netzwerk funktioniert wie ein
mechanosensibler Computer: Mittels Filamenten mit der
Wand der canaliculi verankert, reagieren Osteozyten auf Scherkräfte,
die bei belastungssynchroner Strömung kanalikulärer Flüssigkeit
auftreten. Über Mechanorezeptoren und spannungsgesteuerte Calciumkanäle werden intrazelluläre Signalwege aktiviert und der
Knochenaufbau entsprechend angeregt Osteoklasten bauen Knochensubstanz ab. Sie bilden Integrin-Vitronektin- Abdichtungszonen, lösen Calciumphosphat auf (H+)
und bauen organische Matrix hydrolytisch ab (Resorptionslakunen) -
dabei werden im Osteoid gespeicherte Zytokine freigesetzt, die
Osteoblasten aktivieren. Die Lakunen werden dann durch Osteoblasten
wieder aufgefüllt, frische Knochenmatrix calcifiziert.
Der komplette Erneuerungszyklus (remodeling) dauert etwa 6 Monate. Osteoklasten
werden durch Parathormon angeregt, durch Calcitonin gehemmt. Östrogene
hemmen Osteoklasten und
wirken damit antiosteoporotisch; sie triggern (auch beim Mann) den Schluss der
Epiphysenfugen
Osteoklasten bauen Knochensubstanz ab. Sie bilden Integrin-Vitronektin- Abdichtungszonen, lösen Calciumphosphat auf (H+)
und bauen organische Matrix hydrolytisch ab (Resorptionslakunen) -
dabei werden im Osteoid gespeicherte Zytokine freigesetzt, die
Osteoblasten aktivieren. Die Lakunen werden dann durch Osteoblasten
wieder aufgefüllt, frische Knochenmatrix calcifiziert.
Der komplette Erneuerungszyklus (remodeling) dauert etwa 6 Monate. Osteoklasten
werden durch Parathormon angeregt, durch Calcitonin gehemmt. Östrogene
hemmen Osteoklasten und
wirken damit antiosteoporotisch; sie triggern (auch beim Mann) den Schluss der
Epiphysenfugen  Osteocalcin, alkalische Phosphatase und andere für den
Mineralisierungsprozess im Knochen bedeutsame Faktoren gelangen in das
Blut und sind Marker für veränderten Knochenstoffwechsel
Osteocalcin, alkalische Phosphatase und andere für den
Mineralisierungsprozess im Knochen bedeutsame Faktoren gelangen in das
Blut und sind Marker für veränderten Knochenstoffwechsel  Somatotropin (GH) fördert das Knochenwachstum. Die Leber bildet
unter GH-Wirkung insulinähnliche Wachstumsfaktoren (IGFs), diese
fördern die Entwicklung und Reifung von Knorpel- und Knochenzellen in wachsenden
Röhrenknochen. Zusätzlich regen Wachstumsfaktoren (FGF, PTHrP, Ihh,
TNF, bone morphogenic proteins) für das Knochenwachstum
nötige Differenzierungsschritte an
Somatotropin (GH) fördert das Knochenwachstum. Die Leber bildet
unter GH-Wirkung insulinähnliche Wachstumsfaktoren (IGFs), diese
fördern die Entwicklung und Reifung von Knorpel- und Knochenzellen in wachsenden
Röhrenknochen. Zusätzlich regen Wachstumsfaktoren (FGF, PTHrP, Ihh,
TNF, bone morphogenic proteins) für das Knochenwachstum
nötige Differenzierungsschritte an Mangelnde mechanische Reizung (Inaktivität,
Immobilisierung), Calciummangel (Schwangerschaft), Vitamin-D-Mangel,
Östrogenmangel, hochdosierte Glucocorticoide (Cushing-Syndrom) bedingen Knochenabbau
Mangelnde mechanische Reizung (Inaktivität,
Immobilisierung), Calciummangel (Schwangerschaft), Vitamin-D-Mangel,
Östrogenmangel, hochdosierte Glucocorticoide (Cushing-Syndrom) bedingen Knochenabbau
