




 Signaltransduktion
Signaltransduktion
 Kalium: القلية "al-qalya", Pflanzenasche
Kalium: القلية "al-qalya", Pflanzenasche| Die Folgewirkung der Bindung eines Hormons an seinen Rezeptor kann verschiedene Mechanismen auslösen: -- Rezeptoren triggern enzymatische Wirkung, Proteine werden phosphoryliert; mehrere Enzyme sind hintereinandergeschaltet und verstärken das Signal (Phosphorylierungskaskade) -- Rezeptoren verändern die Ionendurchgängigkeit der Membran (ligandengesteuerte Permeasen) und bewirken erhöhte Diffusion von Natrium-, Kalium-, Calcium-, Chloridionen (und entsprechende Veränderungen des Membranpotentials, also De- oder Hyperpolarisierung) -- Rezeptoren aktivieren nachgeschaltete Membranproteine (G-Proteine), man nennt sie metabotrop. Sie aktivieren Phospholipase C und setzen damit IP3 (Inositoltriphosphat) und DAG (Diacylglycerin) frei, oder sie aktivieren Adenylylcyclase (Adenylatzyklase), was zur Bildung von zyklischem Adenosinmonophosphat (cAMP) führt. cAMP aktiviert Proteinkinase A und Ionenkanäle; auch Transkriptionsfaktoren, z.B. CREB: cAMP response element-binding protein, dieses koppelt an bestimmte DNA-Abschnitte und regt die Bildung von mRNA an, wie auch -- Nukleäre Rezeptoren beeinflussen Transkription und Translation (Proteinsynthese). Manche dieser Signalwege interagieren im Stoffwechsel der Zelle (Crosstalk). |
 Der Weg über zyklische Nukleotide
Der Weg über zyklische Nukleotide  Der Phospholipase-DAG-IP3-Weg
Der Phospholipase-DAG-IP3-Weg  Dynamik der Signaltransduktion: Crosstalk und Desensitierung
Dynamik der Signaltransduktion: Crosstalk und Desensitierung  Verfügbare Rezeptorzahl
Verfügbare Rezeptorzahl

 GTPasen
GTPasen  Ras
Ras  MAP-Kinase
MAP-Kinase  G-Protein
G-Protein  Rho
Rho  PKA / Phosphatasen
PKA / Phosphatasen  Response element
Response element
 Zinkfingerdomäne
Zinkfingerdomäne  Arrestine
Arrestine
 (Hormone, Transmitter. Mediatoren, Zytokine).
Diese Signalmoleküle binden an Rezeptoren (in der Zellmembran oder intrazellulär - vgl. Rezeptortypen)
und bewirken dort Folgereaktionen (Signaltransduktion):
(Hormone, Transmitter. Mediatoren, Zytokine).
Diese Signalmoleküle binden an Rezeptoren (in der Zellmembran oder intrazellulär - vgl. Rezeptortypen)
und bewirken dort Folgereaktionen (Signaltransduktion): einer großen (extrazellulären) Rezeptordomäne,
einer großen (extrazellulären) Rezeptordomäne,  einer transmembranalen α-Helix
sowie
einer transmembranalen α-Helix
sowie  einer intrazellulären Domäne, mit je nach Rezeptor
unterschiedlicher Größe, Form und Funktion.
einer intrazellulären Domäne, mit je nach Rezeptor
unterschiedlicher Größe, Form und Funktion.  findet sich z.B. bei Wachstumsfaktor-Rezeptoren (wie für EGF, PDGF, NGF, FGF, VEGF), Immunrezeptoren, Zytokinrezeptoren, Leptinrezeptoren.
Sie bestehen aus einer, der Insulinrezeptor aus zwei Aminosäureketten
(α und β). Bindung des Liganden an den Rezeptor (extrazellulär) führt
zu dessen Dimerisierung und Aktivierung der Tyrosinkinase (intrazellulär).
findet sich z.B. bei Wachstumsfaktor-Rezeptoren (wie für EGF, PDGF, NGF, FGF, VEGF), Immunrezeptoren, Zytokinrezeptoren, Leptinrezeptoren.
Sie bestehen aus einer, der Insulinrezeptor aus zwei Aminosäureketten
(α und β). Bindung des Liganden an den Rezeptor (extrazellulär) führt
zu dessen Dimerisierung und Aktivierung der Tyrosinkinase (intrazellulär).  Unter Ephrinen versteht man membrangebundene Proteine, die an Ephrinrezeptoren (Eph receptors, Klasse IX-Tyrosinkinasen) binden. Beides sind membrangebundene Proteine, daher erfordert diese Rezeptorwirkung einen direkten (juxtakrinen) Kontakt von Zelle zu Zelle, u.a.
Unter Ephrinen versteht man membrangebundene Proteine, die an Ephrinrezeptoren (Eph receptors, Klasse IX-Tyrosinkinasen) binden. Beides sind membrangebundene Proteine, daher erfordert diese Rezeptorwirkung einen direkten (juxtakrinen) Kontakt von Zelle zu Zelle, u.a.  im Rahmen der embryonalen Entwicklung (Steuerung vorwachsender Wachstumsendigungen von Axonen - s. Abbildung: Synaptische Molekülnetze -, Migration embryonaler Zellen, Bildung
von Gewebsgrenzen, Zellmigration, Stammzelldifferenzierung, Gefäßneubildung),
im Rahmen der embryonalen Entwicklung (Steuerung vorwachsender Wachstumsendigungen von Axonen - s. Abbildung: Synaptische Molekülnetze -, Migration embryonaler Zellen, Bildung
von Gewebsgrenzen, Zellmigration, Stammzelldifferenzierung, Gefäßneubildung), beim Aufbau von Langzeitgedächtnis.
beim Aufbau von Langzeitgedächtnis. Bindung des Signalmoleküls (Liganden) an den Rezeptor, der eine Konformationsänderung durchläuft
Bindung des Signalmoleküls (Liganden) an den Rezeptor, der eine Konformationsänderung durchläuft Rezeptor-Dimerisierung durch Autophosphorylierung
Rezeptor-Dimerisierung durch Autophosphorylierung Phosphotyrosinreste binden an Adapter- und Dockingproteine, die Kinasen aktivieren
Phosphotyrosinreste binden an Adapter- und Dockingproteine, die Kinasen aktivieren Phosphorylierung von Zielproteinen (in Zellkern, Zytoplasma, Zellmembran)
Phosphorylierung von Zielproteinen (in Zellkern, Zytoplasma, Zellmembran) Veränderte Gentranskription und Proteinaktivitäten
Veränderte Gentranskription und Proteinaktivitäten über Ras/Raf-Mitogen-aktiviertes Protein (MAP) Kinase oder
über Ras/Raf-Mitogen-aktiviertes Protein (MAP) Kinase oder  über den Jak/Stat-Pfad:
über den Jak/Stat-Pfad: Der Pfad über MAP-Kinase (MAP: mitogen-activated protein) wird durch die GTPase Ras
Der Pfad über MAP-Kinase (MAP: mitogen-activated protein) wird durch die GTPase Ras  aktiviert (
aktiviert ( Abbildung).
Abbildung).  Unter GTPasen versteht
man eine große Familie von Enzymen (Hydrolasen), die
Guanosintriphosphat (GTP) binden und zu Guanosindiphosphat (GDP)
hydrolysieren. GTPasen sind an GTP gebunden aktiv, an GDP gebunden
inaktiv und können die Aktivität von Zielproteinen steuern. Sie wirken
auf zahlreiche Stoffwechselprozesse (Signaltransduktion nach
Aktivierung von Rezeptoren in der Zellmembran; Translation an
Ribosomen; transmembranaler Proteintransport; Vesikeltransport durch
die Zelle; Differenzierung, Wachstum, Bewegung, Teilung von Zellen).
Unter GTPasen versteht
man eine große Familie von Enzymen (Hydrolasen), die
Guanosintriphosphat (GTP) binden und zu Guanosindiphosphat (GDP)
hydrolysieren. GTPasen sind an GTP gebunden aktiv, an GDP gebunden
inaktiv und können die Aktivität von Zielproteinen steuern. Sie wirken
auf zahlreiche Stoffwechselprozesse (Signaltransduktion nach
Aktivierung von Rezeptoren in der Zellmembran; Translation an
Ribosomen; transmembranaler Proteintransport; Vesikeltransport durch
die Zelle; Differenzierung, Wachstum, Bewegung, Teilung von Zellen).
 Abbildung: Transkriptionssteuerung durch den Ras-Signalweg
Abbildung: Transkriptionssteuerung durch den Ras-Signalweg Ras ist
eine kleine GTPase (ein Mitglied der Ras Superfamilie), die in
zahlreiche zelluläre Signalwege eingebunden ist und Zellen zur
Proliferation anregt. Ras ist Produkt eines Proto-Onkogens (Proto-Onkogene
sind physiologische Gene für Zellwachstum und Apoprosesteuerung, die
bei Fehlsteuerung durch Mutation krebsartiges Wachstum begünstigen
können).
Ras ist
eine kleine GTPase (ein Mitglied der Ras Superfamilie), die in
zahlreiche zelluläre Signalwege eingebunden ist und Zellen zur
Proliferation anregt. Ras ist Produkt eines Proto-Onkogens (Proto-Onkogene
sind physiologische Gene für Zellwachstum und Apoprosesteuerung, die
bei Fehlsteuerung durch Mutation krebsartiges Wachstum begünstigen
können).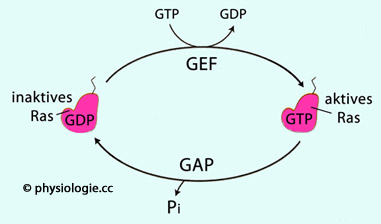
 Abbildung: Aktivierungs- / Inaktivierungszyklus von Ras G-Protein
Abbildung: Aktivierungs- / Inaktivierungszyklus von Ras G-Protein
 MAP-Kinase (MAPK, mitogen-activated protein kinase) ist
eine Serin / Threonin-spezifische Proteinkinase. Sie ist an
verschiedenen Reaktionen der Zelle auf Reize wie Hitzeeinfluss,
osmotische Belastung, Mitogene, Wachstumsfaktoren, Zytokine, GPCR-Liganden (solche GPCRs können an MAP-Kinasen koppeln). Das MAP-Kinase-System reguliert eine
breite Palette zellphysiologischer Schlüsselmechanismen, z.B. Überleben
oder Apoptose, Genexpression, Wachstum, Teilung, Differenzierung der
Zelle und Regeneration. MAP-Kinase beteiligt sich auch an der Regulation der Embryogenese.
MAP-Kinase (MAPK, mitogen-activated protein kinase) ist
eine Serin / Threonin-spezifische Proteinkinase. Sie ist an
verschiedenen Reaktionen der Zelle auf Reize wie Hitzeeinfluss,
osmotische Belastung, Mitogene, Wachstumsfaktoren, Zytokine, GPCR-Liganden (solche GPCRs können an MAP-Kinasen koppeln). Das MAP-Kinase-System reguliert eine
breite Palette zellphysiologischer Schlüsselmechanismen, z.B. Überleben
oder Apoptose, Genexpression, Wachstum, Teilung, Differenzierung der
Zelle und Regeneration. MAP-Kinase beteiligt sich auch an der Regulation der Embryogenese. Eine andere Gruppe von Rezeptoren mit Enzymaktivität (wie Prolaktin und viele Zytokine, z.B. γ-Interferon) nutzen den JAK-STAT- Mechanismus (
Eine andere Gruppe von Rezeptoren mit Enzymaktivität (wie Prolaktin und viele Zytokine, z.B. γ-Interferon) nutzen den JAK-STAT- Mechanismus ( s. dort).
s. dort). Abbau des Signalproteins (extrazelluläre Proteasen),
Abbau des Signalproteins (extrazelluläre Proteasen),  ligandeninduzierte Rezeptorendozytose gefolgt von lysosomalem Abbau,
ligandeninduzierte Rezeptorendozytose gefolgt von lysosomalem Abbau,  beschleunigte Inaktivierung von Ras,
beschleunigte Inaktivierung von Ras, Dephosphorylierung von Zielproteinen durch Phosphoprotein-Phosphatasen.
Dephosphorylierung von Zielproteinen durch Phosphoprotein-Phosphatasen. ) oder
Hyperpolarisation (Kaliumausstrom), Ca++-Einstrom und entsprechende sekundäre Vorgänge.
) oder
Hyperpolarisation (Kaliumausstrom), Ca++-Einstrom und entsprechende sekundäre Vorgänge.  steht eine große Gruppe von Genen, und sie werden durch unterschiedliche Faktoren beeinflusst:
steht eine große Gruppe von Genen, und sie werden durch unterschiedliche Faktoren beeinflusst:  Intrazelluläre Ca++-Konzentration ([Ca++]-Anstieg öffnet calciumabhängige K+-Kanäle),
Intrazelluläre Ca++-Konzentration ([Ca++]-Anstieg öffnet calciumabhängige K+-Kanäle), 
 Membranpotential (Depolarisation - insbesondere durch Natriumeinstrom - öffnet spannungsgesteuerte K+-Kanäle),
Membranpotential (Depolarisation - insbesondere durch Natriumeinstrom - öffnet spannungsgesteuerte K+-Kanäle), 
 Gβγ-Untereinheit (s. unten - öffnet K+-Kanäle; offene Kaliumkanäle bewirken Hyperpolarisation),
Gβγ-Untereinheit (s. unten - öffnet K+-Kanäle; offene Kaliumkanäle bewirken Hyperpolarisation), 
 Verhältnis ATP/ADP, oder
Verhältnis ATP/ADP, oder 
 mehrere davon kombiniert.
mehrere davon kombiniert. 
 Abbildung: Intrazelluläre Calciumkonzentration und Ca++-Speicher
Abbildung: Intrazelluläre Calciumkonzentration und Ca++-Speicher
 Abbildung) erfolgt generell pulsatil, die Calciumionen
Abbildung) erfolgt generell pulsatil, die Calciumionen  haben in der Zelle vielfache Ziele:
haben in der Zelle vielfache Ziele: Proteine des Zytoskeletts - u.a. kontraktile, was zu Verformung / Bewegung / Verkürzung führt
Proteine des Zytoskeletts - u.a. kontraktile, was zu Verformung / Bewegung / Verkürzung führt Chlorid- und Kalium-aktivierte Membranpumpen
Chlorid- und Kalium-aktivierte Membranpumpen Enzyme, z.B. die ubiquitären Calpaine (1 bis 17), Cysteinproteasen, die u.a. Gefäßtonus und Hirnfunktionen beeinflussen
Enzyme, z.B. die ubiquitären Calpaine (1 bis 17), Cysteinproteasen, die u.a. Gefäßtonus und Hirnfunktionen beeinflussen Ca++-bindende
Proteine wie Calmodulin, das an Vorgängen wie intrazellulärem
Transport, Kontraktion glatter Muskelzellen, Kurz- und
Langzeitgedächtnis oder Immunantworten beteiligt ist.
Ca++-bindende
Proteine wie Calmodulin, das an Vorgängen wie intrazellulärem
Transport, Kontraktion glatter Muskelzellen, Kurz- und
Langzeitgedächtnis oder Immunantworten beteiligt ist. Zur Dynamik freier Calciumionen im Zytoplasma s. auch dort
Zur Dynamik freier Calciumionen im Zytoplasma s. auch dort Abbildung).
Faktoren, welche den Phosphorylierungsgrad des G-Proteins beeinflussen,
können so die Signalkette in die Zelle ein- oder ausschalten.
Abbildung).
Faktoren, welche den Phosphorylierungsgrad des G-Proteins beeinflussen,
können so die Signalkette in die Zelle ein- oder ausschalten.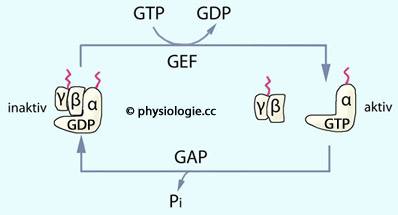
 Abbildung: Zyklus der Aktivierung / Inaktivierung trimerer G-Proteine
Abbildung: Zyklus der Aktivierung / Inaktivierung trimerer G-Proteine
 Gs (stimulieren die Adenylylcyclase, steigern den cAMP-Spiegel in der Zelle),
Gs (stimulieren die Adenylylcyclase, steigern den cAMP-Spiegel in der Zelle),  Gi (inhibieren die Adenylylcyclase, senken den cAMP-Spiegel in der Zelle),
Gi (inhibieren die Adenylylcyclase, senken den cAMP-Spiegel in der Zelle),  Gq (aktivieren Phospholipase C, erhöhen die Konzentration an DAG, IP3 und Ca++),
Gq (aktivieren Phospholipase C, erhöhen die Konzentration an DAG, IP3 und Ca++), Gt (Transducine, aktivieren die cGMP-Phosphodiesterase, senken den cGMP-Spiegel in der Zelle).
Gt (Transducine, aktivieren die cGMP-Phosphodiesterase, senken den cGMP-Spiegel in der Zelle).  Weitere Unterformen und Wirkungen sind bekannt.
Weitere Unterformen und Wirkungen sind bekannt. Einige Toxine können Gα-Untereinheiten
durch ADP-Ribosylierung (Anfügen von ADP-Ribosen an ein Protein)
modifizieren. Die Produktion des second messenger kann direkt oder
indirekt angeheizt werden: So verhindert Choleratoxin die Inaktivierung von Gsα
- die Folge ist Überproduktion von cAMP und Öffnung von Chloridkanälen
in Darmschleimhautzellen, mit der Folge großen Wasser- und
Elektrolytverlusts (Diarrhoe). Pertussistoxin andererseits verhindert die Aktivierung von Giα
- die Hemmung der Adenylylcyclase entfällt, es wird ebenfalls mehr cAMP
produziert; in diesem Fall steigt die Sekretion in den Luftwegen, was
Keuchhusten verursacht.
Einige Toxine können Gα-Untereinheiten
durch ADP-Ribosylierung (Anfügen von ADP-Ribosen an ein Protein)
modifizieren. Die Produktion des second messenger kann direkt oder
indirekt angeheizt werden: So verhindert Choleratoxin die Inaktivierung von Gsα
- die Folge ist Überproduktion von cAMP und Öffnung von Chloridkanälen
in Darmschleimhautzellen, mit der Folge großen Wasser- und
Elektrolytverlusts (Diarrhoe). Pertussistoxin andererseits verhindert die Aktivierung von Giα
- die Hemmung der Adenylylcyclase entfällt, es wird ebenfalls mehr cAMP
produziert; in diesem Fall steigt die Sekretion in den Luftwegen, was
Keuchhusten verursacht. s. dort),
weiters die Rho, Rab, Arf und Ran-Proteinfamilioen. Sie hydrolysieren
GTP und wechseln zwischen aktivem (GTP gebunden) und inaktivem Zustand
(GDP gebunden). Kleine GTP-bindende Proteine beteiligen sich an einer
Fülle zellulärer Vorgänge; einige bleiben membranassoziiert (z.B. Ras),
andere diffundieren in das Zytoplasma.
s. dort),
weiters die Rho, Rab, Arf und Ran-Proteinfamilioen. Sie hydrolysieren
GTP und wechseln zwischen aktivem (GTP gebunden) und inaktivem Zustand
(GDP gebunden). Kleine GTP-bindende Proteine beteiligen sich an einer
Fülle zellulärer Vorgänge; einige bleiben membranassoziiert (z.B. Ras),
andere diffundieren in das Zytoplasma. G-Proteine sind
molekulare Schalter, die inaktiv sind, wenn sie GDP
gebunden haben, und aktiv, wenn sie GTP binden (Anlagerung an ein
Zielmolekül verstärkt ihre GTPase-Aktivität). Werden sie durch
Guaninnukleotid- Austauschfaktoren (GEFs, guanine nucleotide exchange factors)
aktiviert, binden sie GTP.
G-Proteine sind
molekulare Schalter, die inaktiv sind, wenn sie GDP
gebunden haben, und aktiv, wenn sie GTP binden (Anlagerung an ein
Zielmolekül verstärkt ihre GTPase-Aktivität). Werden sie durch
Guaninnukleotid- Austauschfaktoren (GEFs, guanine nucleotide exchange factors)
aktiviert, binden sie GTP. Die Aktivierung
von G-Proteinen ist ein wichiger Verstärkungsfaktor in der Signalkette:
Ein einziger aktivierter Rezeptor kann mehrere G-Proteine
"einschalten", und diese wiederum erreichen jeweils mehrere
Zielmoleküle.
Die Aktivierung
von G-Proteinen ist ein wichiger Verstärkungsfaktor in der Signalkette:
Ein einziger aktivierter Rezeptor kann mehrere G-Proteine
"einschalten", und diese wiederum erreichen jeweils mehrere
Zielmoleküle.  Abbildung):
Abbildung):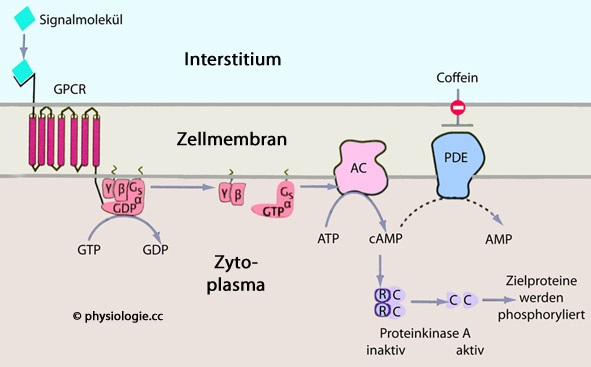

 Abbildung: Anlagerung eines Signalstoffes, der die cAMP-Konzentration in der Zelle steigert
Abbildung: Anlagerung eines Signalstoffes, der die cAMP-Konzentration in der Zelle steigert
 Rho ist eine Gruppe von GTPasen (Rho-Kinasen).
Sind sie - durch
Austausch von GDP gegen GTP - "eingeschaltet", aktivieren sie eine
Vielzahl von Zielproteinen. Dadurch sind sie in die Steuerung mehrerer
zellulärer Aktivitäten involviert (Zellmigration, Bewegung,
Kontraktion, Umbau von Synapsen, Gefäßneubildung..).
Rho ist eine Gruppe von GTPasen (Rho-Kinasen).
Sind sie - durch
Austausch von GDP gegen GTP - "eingeschaltet", aktivieren sie eine
Vielzahl von Zielproteinen. Dadurch sind sie in die Steuerung mehrerer
zellulärer Aktivitäten involviert (Zellmigration, Bewegung,
Kontraktion, Umbau von Synapsen, Gefäßneubildung..). Abbildung):
Abbildung): Abbildung: Anlagerung eines Signalstoffes, der die cAMP-Konzentration in der Zelle senkt
Abbildung: Anlagerung eines Signalstoffes, der die cAMP-Konzentration in der Zelle senkt
 cAMP (zyklisches Adenosinmonophosphat) - durch Aktivität der Adenylylcyclase, die aus ATP cAMP abspaltet.
cAMP aktiviert Proteinkinase A (und damit zahlreiche Sekundärreaktionen
der Zelle) sowie cAMP-abhängige Ionenkanäle, die u.a. bei Riech- und
Sehvorgängen eine Rolle spielen;
cAMP (zyklisches Adenosinmonophosphat) - durch Aktivität der Adenylylcyclase, die aus ATP cAMP abspaltet.
cAMP aktiviert Proteinkinase A (und damit zahlreiche Sekundärreaktionen
der Zelle) sowie cAMP-abhängige Ionenkanäle, die u.a. bei Riech- und
Sehvorgängen eine Rolle spielen; IP3 (Inositoltriphosphat) und DAG (Diacylglycerin) - durch Aktivität der Phospholipase C
(Phosphoinositid-Phospholipase C), die
Phosphatidylinositol-4,5-bisphosphat (PIP2) zu Inositoltrisphosphat
(IP3) und Diacylglycerol (DAG) hydrolysiert.
IP3 (Inositoltriphosphat) und DAG (Diacylglycerin) - durch Aktivität der Phospholipase C
(Phosphoinositid-Phospholipase C), die
Phosphatidylinositol-4,5-bisphosphat (PIP2) zu Inositoltrisphosphat
(IP3) und Diacylglycerol (DAG) hydrolysiert.
 Abbildung: Desensitierung, Internalisierung, Recycling von GPC-Rezeptoren
Abbildung: Desensitierung, Internalisierung, Recycling von GPC-Rezeptoren
 vgl. dort).
Anschließend koppelt Arrestin vom Rezeptor wieder ab, dieser wird
dephosphoryliert, gelangt in die Außenmembran zurück (Recycling) und
ist wieder für neue Bindung eines Signalstoffs (z.B. Hormon,
Transmitter) verfügbar (
vgl. dort).
Anschließend koppelt Arrestin vom Rezeptor wieder ab, dieser wird
dephosphoryliert, gelangt in die Außenmembran zurück (Recycling) und
ist wieder für neue Bindung eines Signalstoffs (z.B. Hormon,
Transmitter) verfügbar ( Abbildung).
Abbildung). Die wichtigsten GPCR-Signalwege
stimulieren (Gs) oder hemmen (Gi) die Aktivität der Adenylylcyclase und
damit die Produktion von cAMP, oder sie aktivieren (Gt) die
cGMP-Phosphodiesterase und senken damit die Konzentration von cGMP in
der Zelle.
Die wichtigsten GPCR-Signalwege
stimulieren (Gs) oder hemmen (Gi) die Aktivität der Adenylylcyclase und
damit die Produktion von cAMP, oder sie aktivieren (Gt) die
cGMP-Phosphodiesterase und senken damit die Konzentration von cGMP in
der Zelle. Enzyme, welche zyklische Nukleotide aufspalten (z.B. cAMP- oder cGMP-
Phosphodiesterasen), reduzieren die Konzentration des entsprechenden
"zweiten Botenstoffs" (cAMP, cGMP). Solche Enzyme werden durch
zahlreiche - natürlich vorkommende oder pharmazeutische - Substanzen
gehemmt, was die Wirkung des second messenger verstärkt (er wird
weniger stark abgebaut). Beispiele: Coffein hemmt Phosphodiesterasen und steigert [cAMP] (Abbildung); das erektionsfördernde Sildenafil hemmt Typ 5-cGMP Phosphodiesterase und erhöht [cGMP].
Enzyme, welche zyklische Nukleotide aufspalten (z.B. cAMP- oder cGMP-
Phosphodiesterasen), reduzieren die Konzentration des entsprechenden
"zweiten Botenstoffs" (cAMP, cGMP). Solche Enzyme werden durch
zahlreiche - natürlich vorkommende oder pharmazeutische - Substanzen
gehemmt, was die Wirkung des second messenger verstärkt (er wird
weniger stark abgebaut). Beispiele: Coffein hemmt Phosphodiesterasen und steigert [cAMP] (Abbildung); das erektionsfördernde Sildenafil hemmt Typ 5-cGMP Phosphodiesterase und erhöht [cGMP]. cGMP
cGMP Abbildung):
Abbildung):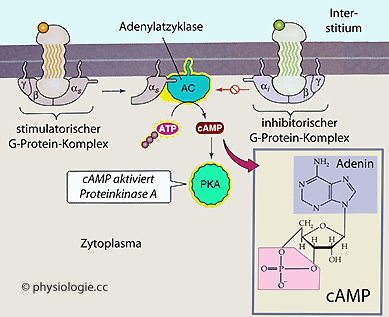
 Abbildung: Adenylylcyclase-cAMP-Weg
Abbildung: Adenylylcyclase-cAMP-Weg
 Signalstoff (Hormon, der "first messenger") bindet an extrazelluläre Bindungsdomäne des Rezeptormoleküls, dieses ändert daraufhin seine Konformation
Signalstoff (Hormon, der "first messenger") bindet an extrazelluläre Bindungsdomäne des Rezeptormoleküls, dieses ändert daraufhin seine Konformation Dies aktiviert anliegendes G-Protein, GDP wird durch GTP ersetzt
Dies aktiviert anliegendes G-Protein, GDP wird durch GTP ersetzt Das aktivierte G-Protein reagiert mit der intrazellulär liegenden Adenylylcyclase (AC), die aus ATP cAMP bildet - Gs stimuliert, Gi hemmt die AC
Das aktivierte G-Protein reagiert mit der intrazellulär liegenden Adenylylcyclase (AC), die aus ATP cAMP bildet - Gs stimuliert, Gi hemmt die AC cAMP (der second messenger) aktiviert eine Proteinkinase A (PKA) im Zytosol
cAMP (der second messenger) aktiviert eine Proteinkinase A (PKA) im Zytosol Die PKA phosphorlyiert Zielproteine, die dann die Hormonwirkungen vermitteln.
Die PKA phosphorlyiert Zielproteine, die dann die Hormonwirkungen vermitteln. Die Proteinkinase A (PKA) phosphoryliert
Zielproteine in der Zelle, vor allem Enzyme ("molekularer Schalter",
der eine rasche Aktivierung / Inaktivierung von Stoffwechselschritten
erlaubt). Manche Enzyme sind in dephosphorylierter Form aktiv (z.B.
solche der Glykolyse), andere in phosphorylierter Form (z.B. Enzyme der
Gluconeogenese). Gegenspieler der PKA sind Phosphatasen, diese entfernen Phorphat von ihren Zielproteinen.
Die Proteinkinase A (PKA) phosphoryliert
Zielproteine in der Zelle, vor allem Enzyme ("molekularer Schalter",
der eine rasche Aktivierung / Inaktivierung von Stoffwechselschritten
erlaubt). Manche Enzyme sind in dephosphorylierter Form aktiv (z.B.
solche der Glykolyse), andere in phosphorylierter Form (z.B. Enzyme der
Gluconeogenese). Gegenspieler der PKA sind Phosphatasen, diese entfernen Phorphat von ihren Zielproteinen.  Abbildung) erleichtert die
Phosphorylierung (Übertragung eines Phosphats von ATP) auf Serin- oder
Threoningruppen von Zielproteinen (z.B. Rezeptoren, Ionenkanälen,
Signalproteinen, Enzymen) und wirkt sich so auf deren Aktivität oder
Lokalisierung aus. Ihre Konzentration wird von der Zelle über cAMP sehr genau reguliert.
Abbildung) erleichtert die
Phosphorylierung (Übertragung eines Phosphats von ATP) auf Serin- oder
Threoningruppen von Zielproteinen (z.B. Rezeptoren, Ionenkanälen,
Signalproteinen, Enzymen) und wirkt sich so auf deren Aktivität oder
Lokalisierung aus. Ihre Konzentration wird von der Zelle über cAMP sehr genau reguliert. 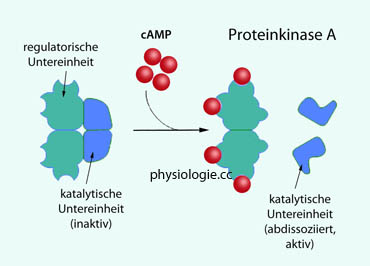
 Abbildung: cAMP-abhängige Proteinkinase A
Abbildung: cAMP-abhängige Proteinkinase A
 Das dynamische Gleichgewicht der Aktivitäten von Kinasen (bilden z.B. cAMP) und Phosphatasen
(dephosphorylieren und inaktivieren damit PKA-aktivierte Proteine) hat
einen wichtigen Einfluss auf die Konzentration aktiver Signalstoffe in
der Zelle. Phosphatasen können ihrerseits durch Phosphatase-Inhibitoren
ausgeschaltet werden.
Das dynamische Gleichgewicht der Aktivitäten von Kinasen (bilden z.B. cAMP) und Phosphatasen
(dephosphorylieren und inaktivieren damit PKA-aktivierte Proteine) hat
einen wichtigen Einfluss auf die Konzentration aktiver Signalstoffe in
der Zelle. Phosphatasen können ihrerseits durch Phosphatase-Inhibitoren
ausgeschaltet werden. Adenylylcyclase kann die [cAMP] in der Zelle innerhalb weniger Sekunden um ein Mehrfaches erhöhen.
Adenylylcyclase kann die [cAMP] in der Zelle innerhalb weniger Sekunden um ein Mehrfaches erhöhen.  cAMP wird durch Phosphodiesterase
abgebaut; diese kann z.B. durch Koffein oder Theophyllin gehemmt werden
(dadurch verlängert sich die Anwesenheit des cAMP und die
Hormonwirkung).
cAMP wird durch Phosphodiesterase
abgebaut; diese kann z.B. durch Koffein oder Theophyllin gehemmt werden
(dadurch verlängert sich die Anwesenheit des cAMP und die
Hormonwirkung).  cAMP wirkt sehr oft durch Erhöhung der PKA-Aktivität (cAMP-abhängige PKA wird auch als PKAc bezeichnet). PKAc phosphoryliert zahlreiche Proteine an ihren Serin- oder Threoninresten, unter anderem Transkriptionsfaktoren wie CREB (cAMP response element-binding proteins).
cAMP wirkt sehr oft durch Erhöhung der PKA-Aktivität (cAMP-abhängige PKA wird auch als PKAc bezeichnet). PKAc phosphoryliert zahlreiche Proteine an ihren Serin- oder Threoninresten, unter anderem Transkriptionsfaktoren wie CREB (cAMP response element-binding proteins).  Ein response element ist eine kurze DNA-Strecke, die in zahlreichen Promotern (DNA-Abschnitten, an die Proteine binden, um eine Transkription zu starten) und Enhancern (DNA-Abschnitten, an die Aktivatorproteine binden, um die Wahrscheinlichkeit eines Transkription zu erhöhen) enthalten ist. Die Kopplung von response elements regt dann Transkription der entsprechenden DNA-Sequenz (mRNA-Synthese) an. Bei CREB wirkt der Mechanismus über einen Koaktivator (CREB-binding protein).
Ein response element ist eine kurze DNA-Strecke, die in zahlreichen Promotern (DNA-Abschnitten, an die Proteine binden, um eine Transkription zu starten) und Enhancern (DNA-Abschnitten, an die Aktivatorproteine binden, um die Wahrscheinlichkeit eines Transkription zu erhöhen) enthalten ist. Die Kopplung von response elements regt dann Transkription der entsprechenden DNA-Sequenz (mRNA-Synthese) an. Bei CREB wirkt der Mechanismus über einen Koaktivator (CREB-binding protein). cAMP wirkt weiters an Epac-Proteinen (exchange protein activated by cAMP); diese wirken als Guaninnukleotid-Austauschfaktoren (GEFs, s. oben) und beeinflussen u.a. Adhäsion der Zelle an extrazellulärer Matrix, Calciumfreisetzuung aus intrazellulären Speichern (vor allem im Herzmuskel), oder die Verstärkung der Insulinfreisetzung durch GLP im Pankreas.
cAMP wirkt weiters an Epac-Proteinen (exchange protein activated by cAMP); diese wirken als Guaninnukleotid-Austauschfaktoren (GEFs, s. oben) und beeinflussen u.a. Adhäsion der Zelle an extrazellulärer Matrix, Calciumfreisetzuung aus intrazellulären Speichern (vor allem im Herzmuskel), oder die Verstärkung der Insulinfreisetzung durch GLP im Pankreas. cAMP (auch cGMP) bindet schließlich an, und aktiviert, Ionenkanäle; Ionenkanäle verfügen oft über Phosphorylierungsstellen für PKA, wie auch Rezeptoren, Enzyme und Signalproteine.
cAMP (auch cGMP) bindet schließlich an, und aktiviert, Ionenkanäle; Ionenkanäle verfügen oft über Phosphorylierungsstellen für PKA, wie auch Rezeptoren, Enzyme und Signalproteine. ACTH (Hormon des Hypophysenlappens, das die Nebennierenrinde steuert - daher adreno-cortico-tropes Hormon)
ACTH (Hormon des Hypophysenlappens, das die Nebennierenrinde steuert - daher adreno-cortico-tropes Hormon) Angiotensin II
an Epithelzellen - im Gegensatz zum vaskulären Angriffspunkt, dessen
Transformation über den Inositolphosphatweg funktioniert (s. unten)
Angiotensin II
an Epithelzellen - im Gegensatz zum vaskulären Angriffspunkt, dessen
Transformation über den Inositolphosphatweg funktioniert (s. unten) CRH (Kortikoliberin, ein Liberin, d.h. hypothalamisches Hormon, das die ACTH-Freisetzung beeinflusst - corticotropin releasing hormone)
CRH (Kortikoliberin, ein Liberin, d.h. hypothalamisches Hormon, das die ACTH-Freisetzung beeinflusst - corticotropin releasing hormone) FSH ("Follikel-stimulierendes Hormon", Follitropin), ein Gonadotropin des Hypophysenvorderlappens)
FSH ("Follikel-stimulierendes Hormon", Follitropin), ein Gonadotropin des Hypophysenvorderlappens) Glukagon, ein Peptid, das u.a. in der Bauchspeicheldrüse gebildet wird
Glukagon, ein Peptid, das u.a. in der Bauchspeicheldrüse gebildet wird HCG: Chorion-Gonadotropin (Human chorionic gonadotropin), ein Peptidkormon aus dem Syncytiotrophoblasten, das ähnliche Wirkung wie LH hat und auf den LHCG-Rezeptor wirkt
HCG: Chorion-Gonadotropin (Human chorionic gonadotropin), ein Peptidkormon aus dem Syncytiotrophoblasten, das ähnliche Wirkung wie LH hat und auf den LHCG-Rezeptor wirkt Calcitonin senkt den Calciumspiegel. Es ist ein aus den Epithelkörperchen stammendes Peptidhormon
Calcitonin senkt den Calciumspiegel. Es ist ein aus den Epithelkörperchen stammendes Peptidhormon Katecholamine (α2-, ß-Rezeptoren) stehen im Zentrum der sympathischen Übertragung im peripheren Nervensystem und spielen auch im Gehirn eine zentrale Rolle
Katecholamine (α2-, ß-Rezeptoren) stehen im Zentrum der sympathischen Übertragung im peripheren Nervensystem und spielen auch im Gehirn eine zentrale Rolle LH
(luteinisierendes Hormon, Lutropin) ist ein Glykoprotein, das an der Steuerung der Fortpflanzung beteiligt
ist; bei der Frau fördert es Eisprung und Gelbkörperbildung, beim Mann
wird es Interstitial cell stimulating hormone (ICSH) genannt
LH
(luteinisierendes Hormon, Lutropin) ist ein Glykoprotein, das an der Steuerung der Fortpflanzung beteiligt
ist; bei der Frau fördert es Eisprung und Gelbkörperbildung, beim Mann
wird es Interstitial cell stimulating hormone (ICSH) genannt Parathormon
wird bei Absinken des Calciumspiegels rasch von Epithelkörperchenzellen
in die Blutbahn freigesetzt und verhindert so Hypocalcämie
Parathormon
wird bei Absinken des Calciumspiegels rasch von Epithelkörperchenzellen
in die Blutbahn freigesetzt und verhindert so Hypocalcämie Sekretin
ist ein Mitglied der Gukagon-Hormonfamilie, es regt die
Bauchspeicheldrüse zur Sekretion bicarbonathaltigen (basischen) Sekrets
an und hemmt die Produktion der Magensäure
Sekretin
ist ein Mitglied der Gukagon-Hormonfamilie, es regt die
Bauchspeicheldrüse zur Sekretion bicarbonathaltigen (basischen) Sekrets
an und hemmt die Produktion der Magensäure Somatoliberin
(GHRH: Growth hormone releasing hormone) besteht aus 40 Aminosäuren und
regt die Bildung und Freisetzung des Wachstumshormons an
Somatoliberin
(GHRH: Growth hormone releasing hormone) besteht aus 40 Aminosäuren und
regt die Bildung und Freisetzung des Wachstumshormons an Somatostatin (GHIH: Growth hormone inhibiting hormone) hat sowohl im endokrinen wie auch im
Nervensystem regulierende Aufgaben; gebildet wird es von δ-Zellen des
Pankreas, einzelnen Zellen des Gastrointestinaltrakts sowie des Hypothalamus
Somatostatin (GHIH: Growth hormone inhibiting hormone) hat sowohl im endokrinen wie auch im
Nervensystem regulierende Aufgaben; gebildet wird es von δ-Zellen des
Pankreas, einzelnen Zellen des Gastrointestinaltrakts sowie des Hypothalamus  TSH
(Thyreoidea-stimulierendes Hormon, Thyreotropin) regt in der Schilddrüse
die Sekretion von Thyroxin (T4) und Triiodthyronin (T3) an
TSH
(Thyreoidea-stimulierendes Hormon, Thyreotropin) regt in der Schilddrüse
die Sekretion von Thyroxin (T4) und Triiodthyronin (T3) an Vasopressin bewirkt an Nierentubuli über V2-Rezeptoren die Rückresorption von Wasser aus dem extratubulären Kompartiment. Dieser Mechanismus benützt cAMP
Vasopressin bewirkt an Nierentubuli über V2-Rezeptoren die Rückresorption von Wasser aus dem extratubulären Kompartiment. Dieser Mechanismus benützt cAMP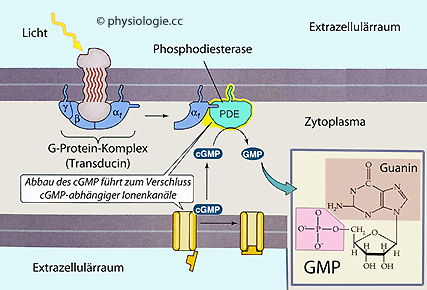
 Abbildung: Das retinale G-Protein Transducin aktiviert eine Phosphodiesterase
Abbildung: Das retinale G-Protein Transducin aktiviert eine Phosphodiesterase
 Abbildung).
Abbildung).  Mehr dazu s. dort
Mehr dazu s. dort Abbildung: ).
Abbildung: ).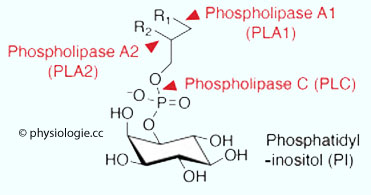
 Abbildung: Wirkung von Phospholipasen auf Phosphatidylinositol (PI)
Abbildung: Wirkung von Phospholipasen auf Phosphatidylinositol (PI)
 Diacylglycerol (DAG),
das stark lipophil ist, membranassoziiert bleibt und Proteinkinase C
(PKC) - die an zahlreichen Zielproteinen wirkt (Transkriptionsfaktoren,
Enzyme, Rezeptoren, Ionenkanäle, Zytoskelett) - aktiviert (der DAG-PKC-Mechanismus kommandiert eine ganze Armada von Kontrollmolekülen); und
Diacylglycerol (DAG),
das stark lipophil ist, membranassoziiert bleibt und Proteinkinase C
(PKC) - die an zahlreichen Zielproteinen wirkt (Transkriptionsfaktoren,
Enzyme, Rezeptoren, Ionenkanäle, Zytoskelett) - aktiviert (der DAG-PKC-Mechanismus kommandiert eine ganze Armada von Kontrollmolekülen); und  Inositol-1,4,5-Triphosphat (IP3), das wasserlöslich ist und in das Zytoplasma diffundiert und an spezifischen IP3-Rezeptoren - das sind (wie Ryanodinrezeptoren) ligandengesteuerte Calciumkanäle in der Membran des endoplasmatischen Retikulums - wirkt.
Inositol-1,4,5-Triphosphat (IP3), das wasserlöslich ist und in das Zytoplasma diffundiert und an spezifischen IP3-Rezeptoren - das sind (wie Ryanodinrezeptoren) ligandengesteuerte Calciumkanäle in der Membran des endoplasmatischen Retikulums - wirkt.  Abbildung):
Abbildung):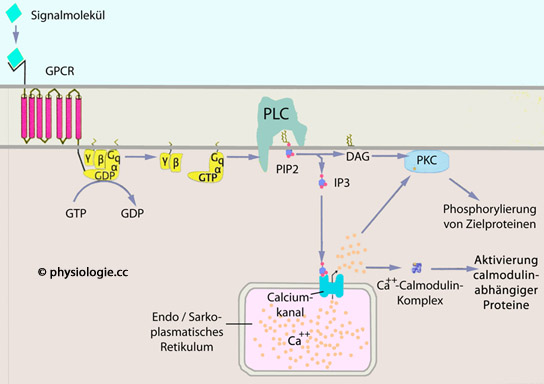
 Abbildung: DAG-IP3-Weg
Abbildung: DAG-IP3-Weg
 Ein Signalstoff koppelt an die extrazelluläre Bindungsdomäne des Rezeptormoleküls, dieses ändert seine Konformation
Ein Signalstoff koppelt an die extrazelluläre Bindungsdomäne des Rezeptormoleküls, dieses ändert seine Konformation GDP wird gegen GTP getauscht, das G-Protein aktiviert, die abdissoziierte qα-Untereinheit schaltet Phospholipase C (PLC) in der Zellmembran ein
GDP wird gegen GTP getauscht, das G-Protein aktiviert, die abdissoziierte qα-Untereinheit schaltet Phospholipase C (PLC) in der Zellmembran ein  PLC spaltet - aus in der Zellmembran vorhandenem Phosphatidylinositol-Biphosphat (PIP2) - die second messenger Diacylglycerin (DAG) und Inositoltriphosphat (IP3) ab
PLC spaltet - aus in der Zellmembran vorhandenem Phosphatidylinositol-Biphosphat (PIP2) - die second messenger Diacylglycerin (DAG) und Inositoltriphosphat (IP3) ab DAG aktiviert die Proteinkinase C (PKC) an der Innenseite der Zellmembran
DAG aktiviert die Proteinkinase C (PKC) an der Innenseite der Zellmembran IP3 bewirkt - über einen IP3-Rezeptor (ITPR - inositol triphosphate receptor) - die Freisetzung von Ca++ aus dem endoplasmatischen Retikulum. Diese führen zur Translokation von PKC in die Zellmembran, wo sie durch DAG aktiviert wird. In Muskelzellen aktiviert Ca++ eine Calmodulin-abhängige Kinase (CAMK): Bindet das zytoplasmatische Calmodulin Ca++-Ionen, ändert es seine Konfiguration, lagert inaktive Kinase an und aktiviert sie dadurch
IP3 bewirkt - über einen IP3-Rezeptor (ITPR - inositol triphosphate receptor) - die Freisetzung von Ca++ aus dem endoplasmatischen Retikulum. Diese führen zur Translokation von PKC in die Zellmembran, wo sie durch DAG aktiviert wird. In Muskelzellen aktiviert Ca++ eine Calmodulin-abhängige Kinase (CAMK): Bindet das zytoplasmatische Calmodulin Ca++-Ionen, ändert es seine Konfiguration, lagert inaktive Kinase an und aktiviert sie dadurch Beide - PKC und CAMK - phosphorylieren Zielproteine, was die
Hormonwirkung (teilweise über veränderte Genexpressionen) mediiert.
Beide - PKC und CAMK - phosphorylieren Zielproteine, was die
Hormonwirkung (teilweise über veränderte Genexpressionen) mediiert. Angiotensin II an Gefäßen nützt diesen Weg zur Auslösung einer Vasokonstriktion
Angiotensin II an Gefäßen nützt diesen Weg zur Auslösung einer Vasokonstriktion GnRH
(Gonadoliberin) wird wie die meisten Vorderlappenhormone pulsatil ins
Blut freigesetzt. Es stimuliert über GnRH-Rezeptoren die LH- und
FSH-Freisetzung in der Adenohypophyse
GnRH
(Gonadoliberin) wird wie die meisten Vorderlappenhormone pulsatil ins
Blut freigesetzt. Es stimuliert über GnRH-Rezeptoren die LH- und
FSH-Freisetzung in der Adenohypophyse Katecholamine nutzen außer dem cAMP- (s.oben) auch den PL-DAG-IP3-Weg
Katecholamine nutzen außer dem cAMP- (s.oben) auch den PL-DAG-IP3-Weg Oxytozin
steuert Verhalten und Gefühle, und unterstützt im Rahmen des
Geburtsvorganges über Anregung der Uterus-Myometriumzellen die
Wehentätigkeit
Oxytozin
steuert Verhalten und Gefühle, und unterstützt im Rahmen des
Geburtsvorganges über Anregung der Uterus-Myometriumzellen die
Wehentätigkeit  TRH (Thyreoliberin) besteht aus nur 3 Aminosäuren; es wirkt über einen speziellen Rezeptor anregend auf die TSH-Ausschüttung in der Adenohypophyse
TRH (Thyreoliberin) besteht aus nur 3 Aminosäuren; es wirkt über einen speziellen Rezeptor anregend auf die TSH-Ausschüttung in der Adenohypophyse Vasopressin (antidiuretisches Hormon, ADH, Adiuretin) wirkt an Gefäßen über den V1-Rezeptor
vasokonstriktorisch; dieser Mechanismus nützt den PC-IP3-Weg (im
Gegensatz zur cAMP-vermittelten Wasserrückresorption in den Niere)
Vasopressin (antidiuretisches Hormon, ADH, Adiuretin) wirkt an Gefäßen über den V1-Rezeptor
vasokonstriktorisch; dieser Mechanismus nützt den PC-IP3-Weg (im
Gegensatz zur cAMP-vermittelten Wasserrückresorption in den Niere) Hormone der Gastrin-Familie
Hormone der Gastrin-Familie Abbildung fasst Wirkungen von G-Proteinen und second messengers auf zelluläre Funktionen zusammen:
Abbildung fasst Wirkungen von G-Proteinen und second messengers auf zelluläre Funktionen zusammen: 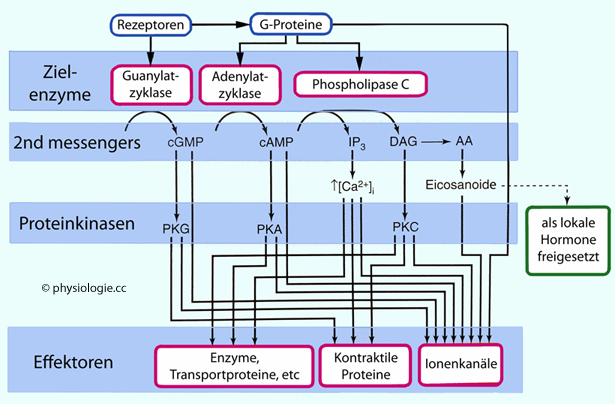
 Abbildung: Kontrolle zellulärer Effektorsysteme
Abbildung: Kontrolle zellulärer Effektorsysteme
 vgl. dort
vgl. dort Abbildung) sind modulär aufgebaute Moleküle, die aus mehreren Teilen bestehen:
Abbildung) sind modulär aufgebaute Moleküle, die aus mehreren Teilen bestehen: Einem
Teil (ligand binding region), der Signalstoff (Hormon,
sekundären Botenstoff, Cofaktoren) bindet
Einem
Teil (ligand binding region), der Signalstoff (Hormon,
sekundären Botenstoff, Cofaktoren) bindet Eine Zinkfingerdomäne (DNA binding domain), die
kurze DNA-Sequenzen (hormone resoponse elements) erkennt, an sie bindet und die Ablesung
des regulierten Gens beeinflusst
Eine Zinkfingerdomäne (DNA binding domain), die
kurze DNA-Sequenzen (hormone resoponse elements) erkennt, an sie bindet und die Ablesung
des regulierten Gens beeinflusst  Zinkfingerproteine enthalten "Zinkfingerdomänen" mit
einem oder mehreren Zinkatomen, welche die besondere räumliche
Anordnung dieser Peptidstrukturen stabilisieren. Es gibt zahlreiche
Zinkfingermotive mit unterschiedlicher räumlicher Struktur, was sie
befähigt, bestimmte molekulare Muster (an DNA, RNA, Proteinen u.a.) zu
erkennen und zu binden.
Zinkfingerproteine enthalten "Zinkfingerdomänen" mit
einem oder mehreren Zinkatomen, welche die besondere räumliche
Anordnung dieser Peptidstrukturen stabilisieren. Es gibt zahlreiche
Zinkfingermotive mit unterschiedlicher räumlicher Struktur, was sie
befähigt, bestimmte molekulare Muster (an DNA, RNA, Proteinen u.a.) zu
erkennen und zu binden. Einem
Teil, der die Transkription reguliert.
Einem
Teil, der die Transkription reguliert.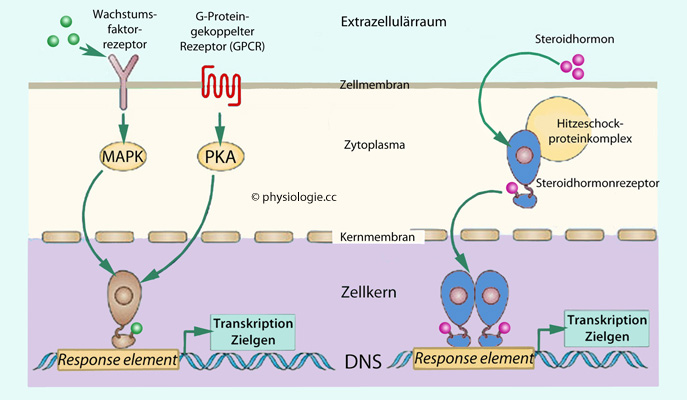
 Abbildung: Beispiele für die Wirkungsweise nukleärer Rezeptoren
Abbildung: Beispiele für die Wirkungsweise nukleärer Rezeptoren
 im Zytoplasma
auf ihr Hormon "warten" (typischerweise: Glucocorticoid-,
Mineralcorticoidrezeptoren) - und hier mit Chaperonen
kombiniert vorliegen,
im Zytoplasma
auf ihr Hormon "warten" (typischerweise: Glucocorticoid-,
Mineralcorticoidrezeptoren) - und hier mit Chaperonen
kombiniert vorliegen,  im Plasma des Zellkerns (Östrogen-, Progesteronrezeptoren) oder
im Plasma des Zellkerns (Östrogen-, Progesteronrezeptoren) oder  an DNA gebunden (Thyroidhormon-, Retinsäurerezeptoren).
an DNA gebunden (Thyroidhormon-, Retinsäurerezeptoren).  Im Sekunden- bis Minutenbereich
greifen Modifikationen am Rezeptormolekül, welche seine Affinität für
den jeweiligen Signalstoff ändern (Phosphorylierung, Bindung von
Arrestin, intrazelluläre Sequestrierung)
Im Sekunden- bis Minutenbereich
greifen Modifikationen am Rezeptormolekül, welche seine Affinität für
den jeweiligen Signalstoff ändern (Phosphorylierung, Bindung von
Arrestin, intrazelluläre Sequestrierung) Herunterregulierung der Rezeptorzahl und Beeinflussung der
Proteinsynthese (Transkription, Translation) beansprucht Stunden bis Tage.
Herunterregulierung der Rezeptorzahl und Beeinflussung der
Proteinsynthese (Transkription, Translation) beansprucht Stunden bis Tage.  Abbildung):
Abbildung):
 Abbildung: Empfindlichkeitsanpassung der Zelle durch Herunter- bzw. Hinaufregulierung von Rezeptoren
Abbildung: Empfindlichkeitsanpassung der Zelle durch Herunter- bzw. Hinaufregulierung von Rezeptoren Arrestine (blau) schwächen die Signalwirkung an Rezeptoren ab
Arrestine (blau) schwächen die Signalwirkung an Rezeptoren ab
 Clathrin bewirkt die endozytotische Einstülpung der Zellmembran
Clathrin bewirkt die endozytotische Einstülpung der Zellmembran
 Dynamine sind für die Endozytose benötigte GTPasen
Dynamine sind für die Endozytose benötigte GTPasen
 GRK, G-Protein-gekoppelte Rezeptor-Kinase
GRK, G-Protein-gekoppelte Rezeptor-Kinase Als Arrestine (Arr) bezeichnet man Proteine, welche sich an Desensitierung, Sequestrierung und intrazellulärem Transport von GPCRs beteiligen. Man unterscheidet mehrere Subtypen, die als Arr-1, Arr-2 (auch ß-Arrestin,
Als Arrestine (Arr) bezeichnet man Proteine, welche sich an Desensitierung, Sequestrierung und intrazellulärem Transport von GPCRs beteiligen. Man unterscheidet mehrere Subtypen, die als Arr-1, Arr-2 (auch ß-Arrestin,  Abbildung), Arr-3 und Arr-4 bezeichnet werden. Sie werden in Geweben unterschiedlich exprimiert.
Abbildung), Arr-3 und Arr-4 bezeichnet werden. Sie werden in Geweben unterschiedlich exprimiert. Zahl verfügbarer
Rezeptormoleküle (upregulation: Erhöhung durch Verlagerung in die Außenmembran; downregulation:
Erniedrigung durch Endozytose, s. Abbildung)
Zahl verfügbarer
Rezeptormoleküle (upregulation: Erhöhung durch Verlagerung in die Außenmembran; downregulation:
Erniedrigung durch Endozytose, s. Abbildung) Interaktion mit anderen Molekülen
(Agonisten - Verstärkung, Antagonisten - kompetitive Hemmung)
Interaktion mit anderen Molekülen
(Agonisten - Verstärkung, Antagonisten - kompetitive Hemmung) Veränderte Signalverstärkung
Veränderte Signalverstärkung 
 Enzymrezeptoren phosphorylieren Effektorproteine, z.B. die MAP-Kinase
(Embryogenese, Zelldifferenzierung, Zellwachstum, Mitose, Apoptose).
Mindestens drei Kinasen wirken in Serie (Phosphorylierungskaskade),
aktivierte MAP-Kinase aktiviert Genexpression. Die Aktivierungsdauer
hängt u.a. von den Rezeptoren ab; einige nutzen den JAK-STAT-Mechanismus
(Zugriff auf Transkription) Enzymrezeptoren phosphorylieren Effektorproteine, z.B. die MAP-Kinase
(Embryogenese, Zelldifferenzierung, Zellwachstum, Mitose, Apoptose).
Mindestens drei Kinasen wirken in Serie (Phosphorylierungskaskade),
aktivierte MAP-Kinase aktiviert Genexpression. Die Aktivierungsdauer
hängt u.a. von den Rezeptoren ab; einige nutzen den JAK-STAT-Mechanismus
(Zugriff auf Transkription)  Ionotrope Rezeptoren verändern die Durchlässigkeit von Membrankanälen. So bewirkt höhere Öffnungswahrscheinlichkeit von Kaliumkanälen Re- und Hyperpolarisierung der Zelle; Ca++-Einstrom hat vielfache Wirkung (Verformung, Bewegung, intrazellulärer Transport, Gedächtnis, Immunantworten) Ionotrope Rezeptoren verändern die Durchlässigkeit von Membrankanälen. So bewirkt höhere Öffnungswahrscheinlichkeit von Kaliumkanälen Re- und Hyperpolarisierung der Zelle; Ca++-Einstrom hat vielfache Wirkung (Verformung, Bewegung, intrazellulärer Transport, Gedächtnis, Immunantworten)  Metabotrope Rezeptoren sind heptahelikal aufgebaut und wirken über G-Proteine (GPCRs): Gs (stimulierend), Gi (inhibierend), Gq und andere. Ihre Untereinheiten (α, β, γ) sind am nicht aktivierten Rezeptor angelagert. Wird dieser aktiviert, bindet die
α-Untereinheit GTP, die β- und γ-Untereinheit dissoziieren und
aktivieren membranständige Effektoren. Solange die Dissoziation anhält,
ist der Signalweg eingeschaltet (Multiplikation des molekularen
Effekts).
Gsα stimuliert Adenylylcyclase (→ cAMP → Proteinkinase A), Giα
hemmt sie, Gqα aktiviert Phospholipase C → IP3, DAG. Proteinkinase A besteht aus regulatorischen und katalytischen (PKAc) Untereinheiten. PKAc phosphoryliert u.a. Transkriptionsfaktoren wie CREB, dieses bindet an eine DNA-Strecke (cAMP response element), die in zahlreichen Promotern enthalten ist, das regt die Transkription an. Typ III- Rezeptoren werden nach längerer Aktivierung unempfindlich. Einige Rezeptoren nutzen cGMP als second messenger (ANP) Metabotrope Rezeptoren sind heptahelikal aufgebaut und wirken über G-Proteine (GPCRs): Gs (stimulierend), Gi (inhibierend), Gq und andere. Ihre Untereinheiten (α, β, γ) sind am nicht aktivierten Rezeptor angelagert. Wird dieser aktiviert, bindet die
α-Untereinheit GTP, die β- und γ-Untereinheit dissoziieren und
aktivieren membranständige Effektoren. Solange die Dissoziation anhält,
ist der Signalweg eingeschaltet (Multiplikation des molekularen
Effekts).
Gsα stimuliert Adenylylcyclase (→ cAMP → Proteinkinase A), Giα
hemmt sie, Gqα aktiviert Phospholipase C → IP3, DAG. Proteinkinase A besteht aus regulatorischen und katalytischen (PKAc) Untereinheiten. PKAc phosphoryliert u.a. Transkriptionsfaktoren wie CREB, dieses bindet an eine DNA-Strecke (cAMP response element), die in zahlreichen Promotern enthalten ist, das regt die Transkription an. Typ III- Rezeptoren werden nach längerer Aktivierung unempfindlich. Einige Rezeptoren nutzen cGMP als second messenger (ANP) Nukleäre Rezeptoren bestehen aus mehreren Teilen: Einer
bindet den Signalstoff, ein "Zink-Finger" erkennt kurze DNA-Sequenzen,
um ihre Zielgene zu erreichen. Koaktivatoren rekrutieren Enzyme an den
Transkriptionskomplex, Histon-Acetylasen machen das Chromatin ablesbar. Korepressoren
hemmen die Transkription. Nukleäre Rezeptoren können eine
Vielzahl verschiedener Gene beeinflussen; so können sie metabolische Programme steuern Nukleäre Rezeptoren bestehen aus mehreren Teilen: Einer
bindet den Signalstoff, ein "Zink-Finger" erkennt kurze DNA-Sequenzen,
um ihre Zielgene zu erreichen. Koaktivatoren rekrutieren Enzyme an den
Transkriptionskomplex, Histon-Acetylasen machen das Chromatin ablesbar. Korepressoren
hemmen die Transkription. Nukleäre Rezeptoren können eine
Vielzahl verschiedener Gene beeinflussen; so können sie metabolische Programme steuern Hormonwirkungen
schwächen sich oft bei längerdauernder Stimulation von Zielgewebe ab
(Desensitivierung). Dabei kommt es zu einer Verlagerung von
Rezeptormolekülen von der Zellmembran in die Zelle, wo sie vom
Transmitter nicht erreicht werden (receptor downregulation).
Die Empfindlichkeit einer Zelle gegenüber extrazellulären Signalmolekülen kann z.B. durch folgende Faktoren variieren: Zahl
verfügbarer Rezeptormoleküle, Interaktion mit Agonisten / Antagonisten, veränderte Signalverstärkung Hormonwirkungen
schwächen sich oft bei längerdauernder Stimulation von Zielgewebe ab
(Desensitivierung). Dabei kommt es zu einer Verlagerung von
Rezeptormolekülen von der Zellmembran in die Zelle, wo sie vom
Transmitter nicht erreicht werden (receptor downregulation).
Die Empfindlichkeit einer Zelle gegenüber extrazellulären Signalmolekülen kann z.B. durch folgende Faktoren variieren: Zahl
verfügbarer Rezeptormoleküle, Interaktion mit Agonisten / Antagonisten, veränderte Signalverstärkung |
