

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Hirnstamm und Zwischenhirn
© H. Hinghofer-Szalkay
 Herring-Körperchen: Percy T. Herring
Herring-Körperchen: Percy T. Herring
locus coeruleus: himmelblauer Ort
Meynert-Kern: Theodor Meynert
nucleus ambiguus: ambiguus = doppelgestaltig, ungewiss, zweifelhaft
Okulomotorik: oculus = Auge, motor = Beweger (movere = bewegen)
Orexin: ὄρεξις, = Verlangen, Appetit
Pallidum: globus pallidus = weiße Kugel
Putamen: putamen = Schale (putare = beschneiden)
Raphekerne: ραφή = Naht (liegen an der Naht zwischen den beiden Hirnstammhälften)
Thalamus: θάλαμος = Kammer
Der
Hirnstamm hat zahlreiche lebenswichtige Aufgaben; beispielsweise
aktiviert sein retikuläres System das Großhirn so, dass Bewusstsein und
Aufmerksamkeit entstehen, und erzeugt Motivation oder Aversion;
Reflexzentren steuern viele automatisierte motorische Abläufe, u.a. die
Augenmuskulatur (Blickmotorik). Atmungsapparat, Herz, Blutgefäße und
Eingeweide stehen unter der Kontrolle des Hirnstamms.
Die Medulla oblongata (verlängertes Mark) enthält
Reflexzentren für Atmung und Säure-Basen-Haushalt, Blutdruckregulation, Niesen, Husten, Schlucken etc. Der nucleus tractus solitarii erhält viszerale Afferenzen von kardiovaskulären Rezeptoren, dem Respirationssystem, Geschmacksrezeptoren (Speichelsekretion) und dem gastrointestinalen System; der Schluckvorgang wird durch den nucl. ambiguus koordiniert.
Die Pons (Brücke) beinhaltet
Brückenkerne und Teile der formatio reticularis; sie kommuniziert
insbesondere mit dem Kleinhirn und beteiligt sich auch an der Steuerung
der Harnblase.
Das Mesencephalon (Mittelhirn) steuert die Augenbewegungen und ist an der Extrapyramidalmotorik beteiligt. Die Mittelhirnhaube (tegmentum) enthält den nucl. ruber, Teile des nucl. niger (Basalganglien) und zahlreiche Hirnnervenkerne; das Mittelhirndach (tectum, Vierhügelplatte) steuert optische und akustische Reflexe und unterstützt die Zielmotorik.
Das Zwischenhirn (Diencephalon) beeinflusst Muskeltonus und Bewegungsabläufe über noradrenerge, serotoninerge, dopaminerge und cholinerge Projektionen in das Vorderhirn;
zu ihm gehören Thalamus, Hypothalamus
(vegetativ-endokrines Regulationszentrum), globus pallidus (Motorik), Zirbeldrüse (Biorhythmen), Raphekerne und
nucl. coeruleus (Konzentration, Schlafsteuerung u.a.).
|
Als Hirnstamm bezeichnet man die neuronale Zwischenzone, die vom oberen Rückenmark (Spinalmark) bis
zum Zwischenhirn (Diencephalon) reicht. Das Diencephalon wird manchmal
dem Hirnstamm zugerechnet; jedenfalls enthält der Hirnstamm das
Mittelhirn, die Brücke und das verlängerte Mark. Gemeinsam ist diesen
Teilen die Verwaltung lebenswichtiger Grundfunktionen wie Atmung und
Kreislauf, zahlreicher Reflexe, die Erhaltung von Gleichgewicht,
Vorbearbeitung von Sinnesinformation (Hören, Sehen), Anregung des
Großhirns etc. Bewusste Interaktion mit der Umwelt ist dem Hirnstamm
alleine nicht möglich.
Man kann den Hirnstamm stark vereinfacht als das "Rückenmark für Kopf und Hals" bezeichnen: So wie das Rückenmark von Körperstamm und Extremitäten sensorische Informationen erhält und an diese motorische Impulse sendet, tut dies der Hirnstamm mit somatosensorischer Informationen aus dem Kopf-Hals-Bereich (dazu kommen auditorische, vestibuläre, Geschmacks- und viszerale Afferenzen)
und sendet efferente Impulse zu Augen, Tränen- und Speicheldrüsen, der
Muskulatur im Kopf-Hals-Bereich (inklusive Pharynx und Larynx) sowie an Organe in Thorax und Abdomen.
Folgende Strukturen bauen den Hirnstamm (verlängertes Mark bis Mittelhirn) auf:

 Absteigende motorische Bahnen für Stamm und Extremitäten (tr. corticospinalis)
Absteigende motorische Bahnen für Stamm und Extremitäten (tr. corticospinalis)

 Aufsteigende sensorische Bahnen aus Stamm und Extremitäten (tr. spinothalamicus, Hintersäulen)
Aufsteigende sensorische Bahnen aus Stamm und Extremitäten (tr. spinothalamicus, Hintersäulen)

 Hirnnervenkerne und -faszikel (=Verbindung Kern-Nerv) im dorsalen Hirnstamm (motorische eher medial, sensorische lateral)
Hirnnervenkerne und -faszikel (=Verbindung Kern-Nerv) im dorsalen Hirnstamm (motorische eher medial, sensorische lateral)

 Pedunculi cerebellares (Verbindungen mit dem Kleinhirn) im dorsalen Hirnstamm
Pedunculi cerebellares (Verbindungen mit dem Kleinhirn) im dorsalen Hirnstamm

 Retikuläres System und aufsteigende Projektionssysteme
Retikuläres System und aufsteigende Projektionssysteme
Der Hirnstamm stabilisiert basale Körperfunktionen
Der Hirnstamm besteht aus verlängertem Mark (medulla oblongata), Brücke (pons) und Mittelhirn
(mesencephalon). Er enthält den nucleus ruber (im Mittelhirn), die
formatio reticularis (pontiner und medullärer Teil), sowie die
Vestibulariskerne.
 Abbildung: Vegetative Zentren im Hirnstamm
Nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Abbildung: Vegetative Zentren im Hirnstamm
Nach einer Vorlage in Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Der
Hirnstamm steuert das kardiovaskuläre System, die Atmung, Elemente der
posturalen Motorik und der Fortbewegung, sowie zahlreiche Schutzreflexe

Der Hirnstamm enthält lebenswichtige Zentren (Atem- und
Kreislaufzentrum) und steuert komplexe Reflexe mit
unterschiedlichen Aufgaben, z.B. der Erhaltung des Gleichgewichts.
Auch das Zwischenhirn (Diencephalon, bestehend aus Thalamus, Hypo-, Sub-, Epithalamus) wird oft dem Hirnstamm zugerechnet. Dieses enthält umfangreiche Kerngebiete, die sensorische,
motorische, vegetative, hormonelle, emotionale sowie stimmungs- und
aufmerksamkeitssteuernde Funktionen haben.
 Zu motorischen Aufgaben des Hirnstamms s. dort.
Zu motorischen Aufgaben des Hirnstamms s. dort.
Dazu gehört

die Stabilisierung des Körpers gegen die Wirkung der Schwerkraft (posturale Motorik:
Halte- und Stellreflexe)
 Schutzreflexe
Schutzreflexe, wie Corneal-, Husten-, Nies- und Würgereflex

die Modulation des
Lokomotionsgenerators im Rückenmark, wie die Anpassung der Gehbewegungen an die Geschwindigkeit der Fortbewegung (Schreiten bis Laufen).
In der medulla oblongata befinden sich Reflexzentren für Herzfunktion, Kreislauf, Atmung,
sowie Neuronengruppen für die Kontrolle des Nies-, Husten-, Schluck-,
Saug- und Brechreflexes untergebracht. Weiters befinden sich hier
Chemorezeptoren für den Säure-Basen-Haushalt.
 Einer
der zentralen Kerne der medulla oblongata ist der nucleus tractus
solitarii (
Einer
der zentralen Kerne der medulla oblongata ist der nucleus tractus
solitarii ( Abbildungen unten). Er besteht aus einer Gruppe von Kernen, die viszerale
Afferenzen aus dem N. facialis (VII), glossopharyngeus (IX) und vagus
(X) über den Zustand folgender Systeme erhalten:
Abbildungen unten). Er besteht aus einer Gruppe von Kernen, die viszerale
Afferenzen aus dem N. facialis (VII), glossopharyngeus (IX) und vagus
(X) über den Zustand folgender Systeme erhalten:

 Abbildung: Kerngebiete im Hirnstamm des Menschen
Abbildung: Kerngebiete im Hirnstamm des Menschen
Nach einer Vorlage in Berkowitz AL, Clinical Neurology & Neuroanatomy: A Localization-Based Approach, 2nd ed. Mc Graw Hill 2022
Links: Dorsalansicht des Hirnstamms (Kleinhirn entfernt).
Rechts: Schnitte durch Mittelhirn, Brücke und verlängertes Mark. Die Lage der Hirnnervenkerne und Faseraustritte ist dargestellt.
Nucl. solitarius (solitary nucleus) = nucleus tractus solitarii. Dieser Komplex liegt in der medulla oblongata und besteht aus
mehreren sensorischen Kernen. Diese erhalten und bearbeiten Information
von Geschmacksrezeptoren, Eingeweiden (Thorax, Abdomen) und dem
Mittelohr über den VII, IX. und X. Hirnnerven und projizieren
ihrerseits auf mehrere Kerne des Hirnstamms (locus coeruleus, nuclei
raphe) und Zwischenhirns (Hypothalamus, Thalamus) sowie in das
limbische System

Efferenzen von den Solitariuskernen projizieren
einerseits auf weite Teile des Gehirns (Hirnstammkerne - Raphekerne,
locus coeruleus -, Hypothalamus, Mandelkerne), andererseits zum dorsalen motorischen Vaguskern
und von hier über parasympathische Fasern in die Peripherie (Herz,
Gefäße, Speicheldrüsen, Pharynx, Oesophagus, Magen-Darm-Trakt).
 Über Hirnnerven und ihre Funktionen s. dort
Über Hirnnerven und ihre Funktionen s. dort
 Im Tegmentum der medulla oblongata befindet sich der nucleus ambiguus
Im Tegmentum der medulla oblongata befindet sich der nucleus ambiguus  (
( Abbildung rechts unten), ein viszeromotorischer Kern, der Afferenzen aus der Großhirnrinde sowie
dem Spinalkern des Trigeminus (V.) erhält. Seine Efferenzen ziehen über den
IX., X. und XI. Hirnnerven zu Muskeln des Rachens,
Gaumens und Kehlkopfs; dadurch beeinflusst er u.a. den Schluckvorgang sowie für das Sprechen benötigte motorische Systeme.
Abbildung rechts unten), ein viszeromotorischer Kern, der Afferenzen aus der Großhirnrinde sowie
dem Spinalkern des Trigeminus (V.) erhält. Seine Efferenzen ziehen über den
IX., X. und XI. Hirnnerven zu Muskeln des Rachens,
Gaumens und Kehlkopfs; dadurch beeinflusst er u.a. den Schluckvorgang sowie für das Sprechen benötigte motorische Systeme.
Läsionen des nucl. ambiguus äußern sich in nasaler Sprache, Schluckstörung
(Dysphagie), Stimmstörung (Dysphonie); die Uvula ist auf die Gegenseite
verzogen.
 Die Brücke
(pons) stellt sozusagen ein Verbindungsstück zwischen Rückenmark, Kleinhirn und Mittelhirn dar.
Die Brücke
(pons) stellt sozusagen ein Verbindungsstück zwischen Rückenmark, Kleinhirn und Mittelhirn dar.
 Sie beinhaltet zahlreiche Nervenbahnen, Teile der formatio
reticularis und Brückenkerne für die Kommunikation zwischen Groß- und Kleinhirn.
Sie beinhaltet zahlreiche Nervenbahnen, Teile der formatio
reticularis und Brückenkerne für die Kommunikation zwischen Groß- und Kleinhirn.
 Die Brücke ist ein wichtiges Zentrum für die Kontrolle eines Teils der Blickbewegungen - sie enthält die Abducenskerne (VI. Hirnnerv), welche Abduktionsbewegungen der Augen steuern (Blick nach lateral).
Die Brücke ist ein wichtiges Zentrum für die Kontrolle eines Teils der Blickbewegungen - sie enthält die Abducenskerne (VI. Hirnnerv), welche Abduktionsbewegungen der Augen steuern (Blick nach lateral).
 Sie beteiligt sich an der Verwaltung vestibulärer Funktionen (z.B. Erhaltung des Gleichgewichts).
Sie beteiligt sich an der Verwaltung vestibulärer Funktionen (z.B. Erhaltung des Gleichgewichts).
 Die Brücke enthält die obere Olive, eine zentrale Schaltstelle der Hörbahn.
Die Brücke enthält die obere Olive, eine zentrale Schaltstelle der Hörbahn.
 Der obere Anteil der Brücke beteiligt sich an der Steuerung der Harnblase (Kontrolle des sakralen Detrusionsreflexes).
Der obere Anteil der Brücke beteiligt sich an der Steuerung der Harnblase (Kontrolle des sakralen Detrusionsreflexes).
 Das Mittelhirn
(mesencephalon, midbrain) beinhaltet ebenfalls massive Nervenstränge (crura cerebri), ist an der
Extrapyramidalmotorik beteiligt.
Das Mittelhirn ist an der Bildung komplexer motorischer Muster
beteiligt, so generiert es bei Reizung einer als mesencephalic locomotor region
(MLR) bezeichneten Neuronengruppe Schreitbewegungen (Zunahme der
Reizstärke kann z.B. bei Versuchstieren den Übergang von Trab- auf
Galopp-Motorik bewirken). Langsame und rasche lokomotorische
Bewegungsmuster scheinen dabei von unterschiedlichen glutamatergen
Neuronengruppen angeregt zu werden (langsame von Zellen des
pedunculopontinen Kerns, rasche von Zellen des nucleus cuneiformis).
Neben der Lokomotion kontrolliert der Hirnstamm (z.B. über die formatio
reticularis) eine Fülle weiterer Bewegungsmuster, inklusive die Okulomotorik
Das Mittelhirn
(mesencephalon, midbrain) beinhaltet ebenfalls massive Nervenstränge (crura cerebri), ist an der
Extrapyramidalmotorik beteiligt.
Das Mittelhirn ist an der Bildung komplexer motorischer Muster
beteiligt, so generiert es bei Reizung einer als mesencephalic locomotor region
(MLR) bezeichneten Neuronengruppe Schreitbewegungen (Zunahme der
Reizstärke kann z.B. bei Versuchstieren den Übergang von Trab- auf
Galopp-Motorik bewirken). Langsame und rasche lokomotorische
Bewegungsmuster scheinen dabei von unterschiedlichen glutamatergen
Neuronengruppen angeregt zu werden (langsame von Zellen des
pedunculopontinen Kerns, rasche von Zellen des nucleus cuneiformis).
Neben der Lokomotion kontrolliert der Hirnstamm (z.B. über die formatio
reticularis) eine Fülle weiterer Bewegungsmuster, inklusive die Okulomotorik
 .
.
Eingänge von verschiedenen Sinnessystemen spielen für mesenzephale
Aktivitätsmuster eine modifizierende Rolle; das Mittelhirn vermittelt Orientierung nach akustischen und optischen Hinweisen.


Abbildung: Hirnstamm - Kerne und Bahnen
Nach einer Vorlage bei what-when-now.com
Der fascululus longitudinalis medialis
verbindet die Kerne der Augenmuskeln (N. oculomotorius, trochlearias,
abducens) mit den Vestibulariskernen sowie der formatio
reticularis, was der Koordination von Kopfstellung und Augenbewegungen
dient.
Der lemniscus medialis
ist Teil der somatischen Afferenzen und leitet Informationen der
Oberflächensensibilität (außer Schmerz und Temperatur) und
Tiefensensibilität; der nucl. gracilis bekommt Impulse von unteren,
der nucl. cuneatus von oberen Rumpfabschnitten.
Der lemniscus lateralis ist Teil der Hörbahn, der die obere Olive mit dem nucl. cochlearis der Gegenseite verbindet.
Der tractus corticobulbaris leitet motorische Impulse vom cortex cerebri zu motorischen Kernen des Hirnstamms, der tractus corticospinalis weiter zu motorischen Vorderhornzellen im Rückenmark

Als Tegmentum (lat. für "Abdeckung") bezeichnet man die ventral an den inneren Liquorraum angrenzende Schicht im Bereich des Hirnstamms
(dorsal liegt im Mittelhirnbereich das Tectum). Das Tegmentum enthält u.a. die
formatio reticularis, okulomotorische Kerne, zentrales Höhlengrau, nucleus ruber und substantia nigra.
Der größte Anteil des Mesencephalon ist die Mittelhirnhaube (Tegmentum). Diese hat vorwiegend motorische Funktionen und enthält u.a. folgende Teile:
 Nucleus ruber
Nucleus ruber und Teile der substantia nigra (Extrapyramidalmotorik)

Hirnnervenkerne
- nucl. N. oculomotorii (III), nucl. N. trochlearis (IV), nucl.
accessorius N. oculomotorii (Edinger-Westphal-Kern), nucl.
mesencephalicus N. trigemini (V)

Teile der
formatio reticularis (vegetative, sensorische und motorische Aufgaben)
 Fasciculus longitudinalis medialis
Fasciculus longitudinalis medialis
(grün in der

Abbildung; Koordination der Blickbewegungen, auch mit
Rücksicht auf den Gleichgewichtssinn: Verknüpfung der vestibularis- mit
den okulomotorischen Hirnnervenkernen)

Der
fasciculus longitudinalis dorsalis
(Schütz'sches Bündel) ist eine lange Projektionsbahn des Hypothalamus.
Er zieht vom Mamillarkörper zur medulla oblongata und verbindet den Edinger-Westphal-Kern
(nucl. accessorius N. oculomotorii), die Salivatoriuskerne und den
nucl. dorsalis N. vagi miteinander. Er leitet sensorische und
motorische Information im vegetativen System und wirkt sich auf die
meisten autonom-nervösen Funktionen des Körpers aus.
Aufsteigende Fasern leiten viszerale Afferenzen von der formatio reticularis zum Hypothalamus,
absteigende
Efferenzen vom Hypothalamus an präganglionäre autonome Neuronen - diese
beeinflussen z.B. Herzfrequenz, Blutdruck, Atmung und andere sympathische / parasympathische Aktivitäten

Tractus tegmentalis centralis ("zentrale Haubenbahn", leitet extrapyramidalmotorische Fasern)
 Das dorsal gelegene Mittelhirndach (Tectum) wird wegen seiner anatomischen Struktur als Vierhügelplatte
bezeichnet. Ursprünglich nahm man an, dass die oberen Vierhügel rein
visuelle, die unteren nur auditive Information verarbeiten; tatsächlich
überlappen sich diese Bereiche. Einige Neuronen reagieren auf beide sensorischen Eingänge, es besteht funktionelle Synergie.
Das dorsal gelegene Mittelhirndach (Tectum) wird wegen seiner anatomischen Struktur als Vierhügelplatte
bezeichnet. Ursprünglich nahm man an, dass die oberen Vierhügel rein
visuelle, die unteren nur auditive Information verarbeiten; tatsächlich
überlappen sich diese Bereiche. Einige Neuronen reagieren auf beide sensorischen Eingänge, es besteht funktionelle Synergie.

Die
oberen Vierhügel (colliculi superiores) dienen
visuellen Reflexen. Zusätzlich spielen sie eine Rolle für
motorische Zielauswahl,
insbesondere wenn sensorische Reize (visuelle, somatosensorische,
auditive) diese Funktion (insbesondere die Auslösung und Steuerung von
Sakkaden) anregen. Sie
empfangen auch Impulse von Großhirnrinde (supplementäres
Augenfeld, dorsolateraler
Präfrontalcortex,
parietale Systeme) und
substantia nigra
(pars reticulata).
Auf diese Weise können sie die Blickmotorik in einen umfassenden
Gesamtzusammenhang integrieren. Die colliculi superiores sind eine
Integrationsstelle für multisensorische, kontextuelle Information, die
bei der Steuerung zielgerichteter, explorativ-orientierender Bewegungen
berücksichtigt und an prämotorische Neuronen weitergeleitet wird.
Das
tectopulvinäre System (tectopulvinar pathway)
dient der raschen Reaktion auf plötzlich auftauchende visuelle Reize.
Es geht von den oberen Vierhügeln aus, projiziert auf das Pulvinar
thalami und spricht vor allem auf Bewegung in der Netzhautperipherie an
(insbesondere via
M-Ganglienzellen, die
auf hohe zeitliche Auflösung spezialisiert sind). So wird die
Aufmerksamkeit (und Motorik) auf überraschende, unerwartete Reize
fokussiert, bevor noch visuelle Information bewusst verarbeitet werden
kann.
Auch spezielle Regionen des Frontallappens (frontale Augenfelder)
beeinflussen die Okulomotorik und sind im Fall widersprüchlicher
Intentionen in der Lage, reflektorische Impulse aus den oberen
Vierhügeln zu unterdrücken.
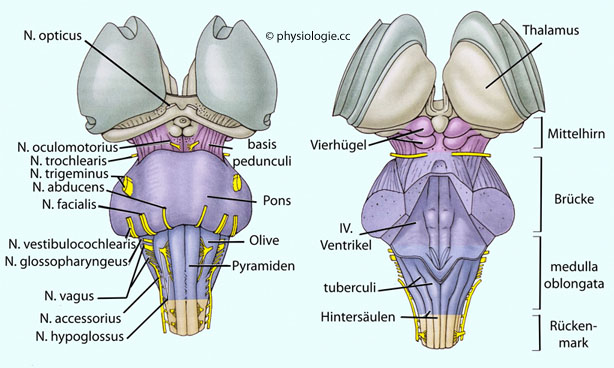

Abbildung: Lage der Vierhügelplatte im Hirnstamm
Nach einer Vorlage in Martin JH: Neuroanatomy and Atlas, 5th ed. McGrawHill 2021
Links Blick auf den Hirnstamm von ventral,
rechts von dorsal. Die Vierhügelplatte (corpora quadrigemina) ist der Hauptteil des Mittelhirndachs.
Die Colliculi
superiores (obere Vierhügel) - auch colliculi optici - verarbeiten
visuelle
Information, die ihnen sowohl von der Netzhaut (Sehnerven), vom
Rückenmark (tractus spinotectalis), von den (direkt benachbarten)
unteren Vierhügeln sowie rückläufig vom Großhirn (tractus
corticotectalis) zufließt. Sie projizieren auf Rückenmark, formatio
reticularis und Hirnnervenkerne. Sie vermitteln optische Reflexe,
insbesondere beteiligen sie sich an der Generierung ruckartiger
Stellbewegungen der Augen (Sakkaden).
Die Colliculi
inferiores (untere Vierhügel) verarbeiten
auditorische
Information, die ihnen über exzitatorische und inhibitorische Impulse
aus Kernen der Hörbahn (insbesondere aus den nuclei cochlearis und
olivaris superior) zufließen; rückläufige Impulse kommen vom
auditorischen Cortex. Die colliculi verfügen über einen zentralen Kern
sowie laterale und dorsale Rindenzonen. Hohe Tonfrequenzen werden in
ventralen, tiefe in dorsalen Anteilen der colliculi inferiores - die
eine multisensorische Integrationsfunktion ausüben - verarbeitet.

Zu Hirnnerven s.
dort, zur Epiphyse s.
dort


Die
unteren Vierhügel (colliculi inferiores) dienen Umschaltungen und Informationsmodifikation in der
Hörbahn.
Sie beteiligen sich an der Lokalisation von Schallquellen, sowie an
Reflexen für entsprechende Zuwendungsmotorik der Augen und des Kopfes
(Orientierung hin zur Schallquelle). Hier konvergiert Information über
die Charakteristika und die Entstehungsorte von Schallmustern. Die
Regionen sind entsprechend der Tonhöhe der Reize angeordnet (Tonotopie).
 Das Prätectum
(area praetectalis) besteht aus mehreren Kernen und ist Teil des
visuellen Mittelhirns. Es erhält sensorische Information aus der
Netzhaut und sendet Impulse an beide Edinger-Westphal-Kerne. Es ermöglicht so den konsensuellen Pupillenreflex (symmetrische Reaktion beider Pupillen auch bei Beleuchtung nur eines Auges). Weiters ist es in die Steuerung optikonetischer Reflexe
involviert, welche der Stabilisierung des Netzhautbildes dienen. Auch
beteiligt es sich an der Bearbeitung somatosensorischer Informationen
(inklusive Schmerz).
Das Prätectum
(area praetectalis) besteht aus mehreren Kernen und ist Teil des
visuellen Mittelhirns. Es erhält sensorische Information aus der
Netzhaut und sendet Impulse an beide Edinger-Westphal-Kerne. Es ermöglicht so den konsensuellen Pupillenreflex (symmetrische Reaktion beider Pupillen auch bei Beleuchtung nur eines Auges). Weiters ist es in die Steuerung optikonetischer Reflexe
involviert, welche der Stabilisierung des Netzhautbildes dienen. Auch
beteiligt es sich an der Bearbeitung somatosensorischer Informationen
(inklusive Schmerz).
 Das zentrale Höhlengrau dient u.a. der Verwaltung somatischer und viszeraler Stereotypen, beeinflusst das 'fight or flight'-Verhalten, kann starke Gefühlsregungen (Panik) auslösen, und dient der opioidergen Schmerzunterdrückung.
Das zentrale Höhlengrau dient u.a. der Verwaltung somatischer und viszeraler Stereotypen, beeinflusst das 'fight or flight'-Verhalten, kann starke Gefühlsregungen (Panik) auslösen, und dient der opioidergen Schmerzunterdrückung.
Projektionen aus dem Hirnstamm
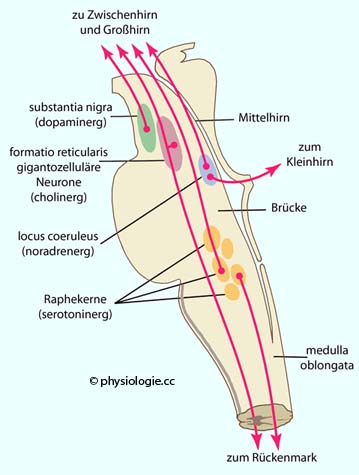
 Abbildung: Projektionen aus dem Hirnstamm
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Abbildung: Projektionen aus dem Hirnstamm
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Die in der Abbildung gezeigten Kerngebiete aktivieren neurohumorale Systeme:
 Die substantia nigra
(nucleus niger) wirkt dopaminerg. Sie liegt im oberen / anterioren Teil
des Mesencephalon und wird vor allem von anderen Neuronen des Striatum
beeinflusst. Sie projiziert hauptsächlich in das Putamen und den
nucleus caudatus (nigrostriatales System), den Hypothalamus sowie
andere Teile des limbischen Systems. Die substantia nigra ist ein
Zentrum der motorischen Steuerung (s. dort).
Die substantia nigra
(nucleus niger) wirkt dopaminerg. Sie liegt im oberen / anterioren Teil
des Mesencephalon und wird vor allem von anderen Neuronen des Striatum
beeinflusst. Sie projiziert hauptsächlich in das Putamen und den
nucleus caudatus (nigrostriatales System), den Hypothalamus sowie
andere Teile des limbischen Systems. Die substantia nigra ist ein
Zentrum der motorischen Steuerung (s. dort).
 Die formatio reticularis
enthält gigantozelluläre cholinerge Neurone, die sich in der Zone von
Mittelhirn bis medulla oblongata befinden und Fasern zu Großhirn und
Rückenmark entsenden. Diese Zellen stehen unter dem Einfluss des
zentralen Höhlengraus, des Hypothalamus und des zentralen Amagdalakerns
und korrespondieren mit kleineren Neuronen der formatio reticularis.
Sie koordinieren Kopf- und Augenbewegungen, modifizieren den Tonus der
Stamm- und Extremitätenmuskulatur, können Herzfrequenz und Blutdruck
senken und beteiligen sich an zentraler Schmerzhemmung.
Die formatio reticularis
enthält gigantozelluläre cholinerge Neurone, die sich in der Zone von
Mittelhirn bis medulla oblongata befinden und Fasern zu Großhirn und
Rückenmark entsenden. Diese Zellen stehen unter dem Einfluss des
zentralen Höhlengraus, des Hypothalamus und des zentralen Amagdalakerns
und korrespondieren mit kleineren Neuronen der formatio reticularis.
Sie koordinieren Kopf- und Augenbewegungen, modifizieren den Tonus der
Stamm- und Extremitätenmuskulatur, können Herzfrequenz und Blutdruck
senken und beteiligen sich an zentraler Schmerzhemmung.
 Der locus coeruleus
an der Grenze zwischen Mittelhirn und Brücke steht unter dem Einfluss
von Präfrontalcortex (dessen anregende Wirkung mit der Aktivität der
Person zunimmt), Hypothalamus und anderen Hirnstammkernen. Er entsendet
noradrenerge Fasern zum Gehirn (sowohl anregende als auch hemmende
Wirkungen) und zum Kleinhirn.
Der locus coeruleus
an der Grenze zwischen Mittelhirn und Brücke steht unter dem Einfluss
von Präfrontalcortex (dessen anregende Wirkung mit der Aktivität der
Person zunimmt), Hypothalamus und anderen Hirnstammkernen. Er entsendet
noradrenerge Fasern zum Gehirn (sowohl anregende als auch hemmende
Wirkungen) und zum Kleinhirn.
 Die Raphekerne
im medianen Bereich von Pons und medulla oblongata enthalten zahlreiche
serotoninerge Neurone. Diese haben Efferenzen zu anderen
Teilen des Zentralnervensystems, stehen mit diesen in wechselseitiger
Beziehung und wirken schmerzhemmend, auf den Wachheitszustand,
beeinflussen die Mororik u.a.
Die Raphekerne
im medianen Bereich von Pons und medulla oblongata enthalten zahlreiche
serotoninerge Neurone. Diese haben Efferenzen zu anderen
Teilen des Zentralnervensystems, stehen mit diesen in wechselseitiger
Beziehung und wirken schmerzhemmend, auf den Wachheitszustand,
beeinflussen die Mororik u.a.

Aminerge (noradrenerge, serotoninerge, dopaminerge,
cholinerge, histaminerge) Projektionen aus dem Hirnstamm haben elektrophysiologische Ähnlichkeiten: Sie zeigen hohe
Spontanaktivität, mit jeweils einer Depolarisationsphase vor dem
nächsten Aktionspotential, reguliert durch Schrittmacherschaltungen. Die Freisetzung
der Monoamine erfolgt teilweise synaptisch, teilweise breitflächiger
(parakrin); zahlreiche monoaminerge Neurone setzen auch Cotransmitter frei.
Monoaminerge Projektionen üben modulierende Wirkung auf das Vorderhirn aus, wo sie kortikale und subkortikale Funktionskreise beeinflussen.
Beispielsweise ist die
 Funktion der Basalganglien von kontinuierlicher
dopaminerger Anregung (nigrostriatal: Projektionen der substantia nigra auf das Striatum) abhängig
Funktion der Basalganglien von kontinuierlicher
dopaminerger Anregung (nigrostriatal: Projektionen der substantia nigra auf das Striatum) abhängig
 serotoninerge Projektionen modulieren motorische Programme
serotoninerge Projektionen modulieren motorische Programme
 noradrenerge unterstützen die Aufmerksamkeit und stimulieren motorische
Vorderhornzellen.
noradrenerge unterstützen die Aufmerksamkeit und stimulieren motorische
Vorderhornzellen.
 Insgesamt erleichtert monoaminerge Anregung die
motorische Aktivität und spielt für Motivation und
Belohnungsmechanismen eine wichtige Rolle.
Insgesamt erleichtert monoaminerge Anregung die
motorische Aktivität und spielt für Motivation und
Belohnungsmechanismen eine wichtige Rolle.
Unter den Kerngebieten des Hirnstamms, die breitflächig auf andere Teile des ZNS wirken, ist die formatio reticularis (Retikulärformation, reticular formation) besonders vielfältig. Sie durchzieht den Hirnstamm (Mittelhirn bis medulla oblongata)
als eine unscharf begrenzte Gruppe miteinander vernetzter
Neuronenansammlungen (Kerne), die
 einerseits das sensorische Gating (sensory gating, Unterdrückung jeweils irrelevanter Reize) von Afferenzen zum Thalamus steuern,
einerseits das sensorische Gating (sensory gating, Unterdrückung jeweils irrelevanter Reize) von Afferenzen zum Thalamus steuern,
 andererseits die generelle kortikale Aktivität
über Projektionen aus dem Hirnstamm regulieren.
andererseits die generelle kortikale Aktivität
über Projektionen aus dem Hirnstamm regulieren.
Die formatio reticularis enthält u.a. das aszendierende
aktivierende System (ARAS) und ist Ursprung des tractus reticulospinalis. Sie besteht aus einer medianen (Raphekerne),
einer medialen gigantozellulären sowie einer lateral gelegenen
parvozellulären Zone. Zu ihren Funktionen gehören Beiträge zur
Steuerung von Bewusstsein und Schlaf, motorischer Kontrolle, Kreislaufregulation sowie endogene Schmerzmodulation.
 Der Hirnstamm enthält Kerngebiete, die monoaminerg (noradrenerg, serotoninerg, dopaminerg,
histaminerg) sowie cholinerg auf andere Teile des Gehirns projizieren und eine Fülle von
Effekten auf Motorik, Wachheit, Aufmerksamkeit, Schmerzempfinden und
Gemütslage ausüben. Der Hypothalamus enthält weiters Neuronen, die
orexinerg auf Wachheit, Aufmerksamkeit und Nahrungsaufnahme wirken.
Der Hirnstamm enthält Kerngebiete, die monoaminerg (noradrenerg, serotoninerg, dopaminerg,
histaminerg) sowie cholinerg auf andere Teile des Gehirns projizieren und eine Fülle von
Effekten auf Motorik, Wachheit, Aufmerksamkeit, Schmerzempfinden und
Gemütslage ausüben. Der Hypothalamus enthält weiters Neuronen, die
orexinerg auf Wachheit, Aufmerksamkeit und Nahrungsaufnahme wirken.
Noradrenerge Projektionen
Noradrenalin
ist ein im Gehirn weit verbreiteter Neurotransmitter und wirkt u.a. auf
Aufmerksamkeit, Stimmung, Sexualverhalten und andere
Verhaltenskomponenten. Die Aktivität noradrenerger Neurone ist im Wachzustand wesentlich höher als im Schlaf (im REM-Schlaf feuern sie so gut wie überhaupt nicht) oder in Narkose.
Die Somata noradrenerger Neuronen finden sich im unteren Hirnstamm, hauptsächlich im pontinen (aus ~12.000 Neuronen bestehenden) nucleus (locus) coeruleus
sowie in der formatio reticularis
(laterale Kerne). Aufsteigende Fasern projizieren auf so gut wie das
gesamte Zentralnervensystem: Groß- und Kleinhirnrinde, Bulbus olfactorius, Riechhirn, Hippocampus, Mandelkerne, Basalganglien, Thalamus, Hypothalamus, Rückenmark ( Abbildung). Nordarenerge Nervenendigungen finden sich vorwiegend in lamina IV des cortex cerebri, auf die thalamische Afferenzen projizieren. Keine kortikale Zelle ist weiter als 30 µm von einer solchen entfernt.
Abbildung). Nordarenerge Nervenendigungen finden sich vorwiegend in lamina IV des cortex cerebri, auf die thalamische Afferenzen projizieren. Keine kortikale Zelle ist weiter als 30 µm von einer solchen entfernt.
 Abbildung: Noradrenerge Projektionen aus dem Hirnstamm
Nach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Abbildung: Noradrenerge Projektionen aus dem Hirnstamm
Nach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Ansammlungen
noradrenerger Neurone / Fasern dunkelrot, Projektionsgebiete hellrot.
Noradrenerge Projektionen bestehen vom locus coeruleus in das gesamte
Groß- und Kleinhirn sowie in das Rückenmark.
Am = Mandelkerne  C = Kleinhirn, Hip = Hippocampus
C = Kleinhirn, Hip = Hippocampus  Hyp = Hypothalamus
Hyp = Hypothalamus  LC = locus (nucleus) coeruleus
LC = locus (nucleus) coeruleus  LTA = laterales tegmentales Areal (Teil der
formatio reticularis)
LTA = laterales tegmentales Areal (Teil der
formatio reticularis)  MBF = mediales Vorderhirnbündel
MBF = mediales Vorderhirnbündel  NTS = nucleus
tractus solitarii (sensorischer Vaguskern)
NTS = nucleus
tractus solitarii (sensorischer Vaguskern)  Sep = Septum
Sep = Septum  Str =
Striatum
Str =
Striatum  Th = Thalamus
Th = Thalamus

Diese
noradrenerge Neuronengruppe wird durch neue, insbesondere bedrohliche Reize
aktiviert. Das System erhöht die kortikale „signal to noise ratio“. Diese noradrenergen Systeme wirken auf
 Aufmerksamkeit (Arousal) und
Interesse - u.a. über Rezeptoren im Thalamus und im Cortex,
Aufmerksamkeit (Arousal) und
Interesse - u.a. über Rezeptoren im Thalamus und im Cortex,
 Lernfähigkeit und Gedächtnis,
Lernfähigkeit und Gedächtnis,
 Wachheit (Schlafzyklus) - noradrenerge Projektionen fördern den Wachzustand und sind im REM-Schlaf inaktiv,
Wachheit (Schlafzyklus) - noradrenerge Projektionen fördern den Wachzustand und sind im REM-Schlaf inaktiv, 
 Angst-, Schmerz- und Stressantworten,
Angst-, Schmerz- und Stressantworten,
 Ausschüttung hypophysärer Hormone wie GH, LH, Prolaktin,
Ausschüttung hypophysärer Hormone wie GH, LH, Prolaktin,
 Stimmungsbeeinflussung
(Unterfunktion dieses Systems kann depressive Verstimmung, Überfunktion schizophrene Psychose zur Folge haben).
Stimmungsbeeinflussung
(Unterfunktion dieses Systems kann depressive Verstimmung, Überfunktion schizophrene Psychose zur Folge haben).
Die Axone von locis-coeruleus-Neuronen - organisiert als ein aufsteigendes dorsales und ein ventrales Vorderhirnbündel sowie ein absteigendes
Bündel - erreichen das gesamte ZNS (Großhirnrinde,
Riechhirn, Hippocampus, Thalamus, Hypothalamus, Hirnstamm, Kleinhirn,
Rückenmark). Jedes einzelne Neuron bildet bis zu 250.000 Synapsen in
verschiedenen Teilen des Gehirns aus (z.B. sowohl in der Großhirn- als
auch in der Kleinhirnrinde - extreme Divergenz). Diese Synapsen wirken meist inhibitorisch über ß-Rezeptoren.
 Abbildung: Noradrenerge Synapse (vgl. dort)
Nach einer Vorlage bei Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Abbildung: Noradrenerge Synapse (vgl. dort)
Nach einer Vorlage bei Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Tyrosin
wird über einen Natrium-abhängigen Cotransport in das Axon geschleust.
Anschließend erfolgt die enzymatische Verwandlung (hemmbar durch Metyrosin) zu Dopamin. Dopamin wird mittels Monoaminotransporters in Vesikel aufgenommen (VMAT); dieser Vorgang ist durch Reserpin blockierbar. Im Vesikel wird Dopamin zu Noradrenalin umgewandelt.
Aktionspotentiale öffnen Calciumkanäle; Ca++
bewirkt Vesikelfusion mit der präsynaptischen Membran, Noradrenalin
wird freigesetzt (zusammen mit Peptiden (P) und ATP. Dieser Vorgang
involviert SNAPs und VAMPs und kann u.a. durch Guanethidin blockiert werden.
Freigesetztes Noradrenalin wirkt nicht nur auf postsynaptische
Adrenozeptoren, sondern auch an präsynaptischen Autorezeptoren sowie
anderen Neuroeffektoren, z.B. Blutgefäßen. Auch kann Noradrenalin
präsynaptisch wieder aufgenommen und wiederverwertet werden
(Noradrenalintransporter, hemmbar u.a. durch Kokain oder trizyklische Antidepressiva)

 Noradrenerge Übertragung im Gehirn kann an verschiedenen Stellen
pharmakologisch beeinflusst werden, z.B. durch Blockade der
Wiederaufnahme von Noradrenalin an der präsynaptischen Membran.
Dadurch bleibt Noradrenalin länger an der Synapse verfügbar. Solche
Substanzen können eine pathologisch eingetrübte Stimmung heben (trizyklische Antidepressiva,
Noradrenerge Übertragung im Gehirn kann an verschiedenen Stellen
pharmakologisch beeinflusst werden, z.B. durch Blockade der
Wiederaufnahme von Noradrenalin an der präsynaptischen Membran.
Dadurch bleibt Noradrenalin länger an der Synapse verfügbar. Solche
Substanzen können eine pathologisch eingetrübte Stimmung heben (trizyklische Antidepressiva,  Abbildung). Monoamin- bzw. Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs: Serotonin-norepinephrine reuptake inhibitors)
blockieren das präsynaptische Recycling von Monoaminen und erhöhen dadurch die Verfügbarkeit dieser
Neurotransmitter an den postsynaptischen Rezeptoren. Sie werden als
Antidepressiva eingesetzt.
Abbildung). Monoamin- bzw. Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs: Serotonin-norepinephrine reuptake inhibitors)
blockieren das präsynaptische Recycling von Monoaminen und erhöhen dadurch die Verfügbarkeit dieser
Neurotransmitter an den postsynaptischen Rezeptoren. Sie werden als
Antidepressiva eingesetzt.
 In den synaptischen Spalt freigesetztes Noradrenalin wird entweder präsynaptisch wiederaufgenommen (reuptake)
oder es diffundiert in die Umgebung, gelangt mit dem Blutkreislauf in
die Peripherie und wird dort (hauptächlich in der Leber) durch MAO und COMT abgebaut.
In den synaptischen Spalt freigesetztes Noradrenalin wird entweder präsynaptisch wiederaufgenommen (reuptake)
oder es diffundiert in die Umgebung, gelangt mit dem Blutkreislauf in
die Peripherie und wird dort (hauptächlich in der Leber) durch MAO und COMT abgebaut.
Im Gehirn werden alle Subtypen adrenerger Rezeptoren exprimiert, allerdings an unterschiedlichen Orten, was pharmakologisch bedeutsam sein kann:
Rezeptortyp
|
Lokalisierung |
Rezeptortyp |
Lokalisierung
|
| α1A |
Großhirnrinde
Hippocampus |
α2B |
Zwischenhirn |
| α1B |
Großhirnrinde
Hirnstamm |
α2C |
weit verbreitet |
| α1D |
Großhirnrinde |
ß1 |
Großhirnrinde
Hypothalamus |
| α2A |
Locus coeruleus
Hippocampus |
ß2 |
Kleinhirn
Hippocampus
Großhirnrinde |
 Über den anregenden Einfluss von Orexin auf den nucleus coeruleus s. dort.
Über den anregenden Einfluss von Orexin auf den nucleus coeruleus s. dort.
 Mehrere
Forschergruppen entdeckten in den 60er-Jahren des 20. Jahrhunderts
Wesen und Verschaltungsmuster der Zellen im locus coeruleus. Ein
noradrenerges Transmittersystem im Gehirn war so neu und
unerwartet, dass es Jahre weiterer Forschung brauchte, bis dieses von
der etablierten Wissenschaft allgemein akzeptiert wurde.
Mehrere
Forschergruppen entdeckten in den 60er-Jahren des 20. Jahrhunderts
Wesen und Verschaltungsmuster der Zellen im locus coeruleus. Ein
noradrenerges Transmittersystem im Gehirn war so neu und
unerwartet, dass es Jahre weiterer Forschung brauchte, bis dieses von
der etablierten Wissenschaft allgemein akzeptiert wurde.
 Serotoninerge Projektionen
Serotoninerge Projektionen
Serotonin
ist in zahlreiche autonome Funktionen involviert, wie gastrointestinale
Motorik, Thermoregulation, Kreislaufregulation (Steigerung von
Herzfrequenz und Blutdruck), Atmung (pCO2-sensitive serotoninerge Neuronen), Sexualverhalten, Schlaf, Schmerzempfinden (Blockade auf Hinterhornebene). Serotoninerge
Neuronen finden sich (in mehreren Gruppen) in einer medianen Zone des Hirnstamms.
Serotoninerge mediane / rostrale Raphekerne
in medulla oblongata, pons und mesencephalon projizieren auf
verschiedenste Hirnteile mit ähnlicher Ausdehnung wie das noradrenerge
des locus coeruleus - beide beteiligen sich am Aufbau des aktivierenden retikulären Systems ( Abbildung):
Abbildung):

 Abbildung: Serotoninerge Projektionen aus dem Hirnstamm
Nach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Abbildung: Serotoninerge Projektionen aus dem Hirnstamm
Nach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Ansammlungen
noradrenerger Neurone / Fasern dunkelrot, Projektionsgebiete hellrot.
Serotoninerge Projektionen kommen von den Raphekernen in das gesamte Groß- und Kleinhirn sowie in das Rückenmark.
Am =
Mandelkerne  C = Kleinhirn
C = Kleinhirn  Hip = Hippocampus
Hip = Hippocampus  Hyp = Hypothalamus
Hyp = Hypothalamus  Sep = Septum
Sep = Septum  Str = Striatum
Str = Striatum  Th =
Thalamus
Th =
Thalamus

 Rostrale Zellgruppen projizieren in Großhirnrinde sowie das limbische System (nucleus suprachiasmaticus des Hypothalamus, Hippocampus, Mandelkerne) sowie ventrolaterale corpora geniculata,
Rostrale Zellgruppen projizieren in Großhirnrinde sowie das limbische System (nucleus suprachiasmaticus des Hypothalamus, Hippocampus, Mandelkerne) sowie ventrolaterale corpora geniculata,
 Kaudale
Zellgruppen projizieren in das Rückenmark (vor allem zu motorischen
Vorderhornzellen, aber auch zu Seiten- und Hinterhorn) und zum Kleinhirn.
Kaudale
Zellgruppen projizieren in das Rückenmark (vor allem zu motorischen
Vorderhornzellen, aber auch zu Seiten- und Hinterhorn) und zum Kleinhirn.
Serotoninerge Projektionen in das Frontalhirn
regen dessen Aktivität an - u.a. eine Dämpfung der Aktivität der
Amygdalae -, und eine Abnahme dieser Funktion (also reduzierte
serotoninerge Anregung) kann zu aggressivem und antisozialem Verhalten
führen.
 Selektive Serotonin-Aufnahmehemmer (SSRIs: Selective serotonin reuptake inhibitors - z.B. Fluoxetin) hemmen gezielt die präsynaptische Wiederverwertung des Serotonins durch den Serotonin-Transporter (SERT). Sie senken u.a. die Bereitschaft zu aggressivem Verhalten und erhöhen die Aktivität des präfrontalen Cortex.
Selektive Serotonin-Aufnahmehemmer (SSRIs: Selective serotonin reuptake inhibitors - z.B. Fluoxetin) hemmen gezielt die präsynaptische Wiederverwertung des Serotonins durch den Serotonin-Transporter (SERT). Sie senken u.a. die Bereitschaft zu aggressivem Verhalten und erhöhen die Aktivität des präfrontalen Cortex.
Die Raphekerne
übernehmen „sensory processing“, sie helfen, unwesentliche Reize zu
ignorieren, und modulieren neurovegetative Stressantworten (Blutdruck).
Sie regen die Lokomotion an, beeinflussen Sinnes- (auch Schmerz-) Afferenzen
und haben Einfluss auf Appetit, Körpertemperatur
und Stimmungslage.
Die Nervenfasern projizieren vor allem in die lamina V, wo sich
Pyramidenzellen befinden, und wirken damit auf kortikale Efferenzen.
Beeinträchtigung der Raphe-Region bewirkt Schlafstörungen (insbesondere im
REM-Schlaf).
Verschiedene Rezeptortypen
(16 bekannt) sind unterschiedlich verteilt auf Groß- und Kleinhirnrinde, Thalamus,
Basalganglien, Hippocampus, Hypothalamus, Rückenmark.
Serotonin wirkt postsynaptisch auf
 Typ 5-HT2A, 2C (über Gq, PLC, IP3, DAG)
Typ 5-HT2A, 2C (über Gq, PLC, IP3, DAG)
 Typ 5-HT1A (über Gi, Hemmung von AC, cAMP)
Typ 5-HT1A (über Gi, Hemmung von AC, cAMP)
 Typ 5-HT4 (über Gs, AC, cAMP)
Typ 5-HT4 (über Gs, AC, cAMP)
 Typ 5-HT3 (über Natriumeinstrom). Dies sind pentamere Ionenkanäle, ähnlich dem nikotinischen Acetylcholinrezeptor. Ähnlich dem AMPA-Rezeptorkanal sind sie im offenen Zustand für Na+ und K+ durchgängig; das Umkehrpotential liegt bei ~0 mV.
Typ 5-HT3 (über Natriumeinstrom). Dies sind pentamere Ionenkanäle, ähnlich dem nikotinischen Acetylcholinrezeptor. Ähnlich dem AMPA-Rezeptorkanal sind sie im offenen Zustand für Na+ und K+ durchgängig; das Umkehrpotential liegt bei ~0 mV.
 Abbildung: Serotoninerges Neuron
Nach einer Vorlage bei Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Abbildung: Serotoninerges Neuron
Nach einer Vorlage bei Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Tryptophan
wird über einen Natrium-abhängigen Cotransport (Aminosäuretransporter)
in das Axon geschleust und enzymatisch zu Serotonin
(5-Hydroxy-Tryptamin, 5HT) umgewandelt. (Tryptophanhydroxylase im
Gehirn unterscheidet sich von derjeniger in der Peripherie.) 5HT
gelangt über einen Monoaminotransporter (VMAT) in Speichervesikel.
Öffnet ein Aktionspotential Calciumkanäle, bewirkt eingeströmtes Ca++
die Exozytose von Serotonin aus Vesikeln - 5HT gelangt in den
synaptischen Spaltraum. Dort wirkt es auf postsynaptische
Serotoninrezeptoren (nicht gezeigt), diffundiert aus der Synapse, oder
wird über Serotonintransporter präsynaptisch (Na+-abhängig) wieder aufgenommen (blockierbar durch Rückaufnahme-Inhibitoren).
In der Zelle wird Serotonin durch Monoaminooxydase (MAO) abgebaut. (Dieser Vorgang lässt sich durch MAO-Hemmer blockieren)

 Pharmaka, welche die Aktivität der Monoaminooxidase blockieren, werden als MAO-Hemmer
bezeichnet. Damit reduzieren solche Medikamente den Abbau von
Katecholaminen (Dopamin, Noradrenalin) sowie von Serotonin. Damit haben
sie u.a. stimmungsaufhellende Wirkung und werden in bestimmten Fällen
als Antidepressiva eingesetzt.
Pharmaka, welche die Aktivität der Monoaminooxidase blockieren, werden als MAO-Hemmer
bezeichnet. Damit reduzieren solche Medikamente den Abbau von
Katecholaminen (Dopamin, Noradrenalin) sowie von Serotonin. Damit haben
sie u.a. stimmungsaufhellende Wirkung und werden in bestimmten Fällen
als Antidepressiva eingesetzt.
Serotonin scheint über 1A-Serotoninrezeptoren für die 'innere Entspannung' im Sinne der Aktivierung eines default mode network
notwendig zu sein.
 Selektive Serotonin-Wiederaufnahmehemmer steigern die
Serotoninkonzentration an der Synapse und wirken antidepressiv.
Selektive Serotonin-Wiederaufnahmehemmer steigern die
Serotoninkonzentration an der Synapse und wirken antidepressiv.
 Über den anregenden Einfluss von Orexinen s. dort.
Über den anregenden Einfluss von Orexinen s. dort.
(Depressive) Personen mit schwach ausgeprägter
1A-Rezeptorwirkung leiden unter Unruhe und Problemen, sich zu
entspannen. (LSD beeinträchtigt die Aktivität serotoninerger Nervenzellen).
 Zahlreiche halluzinogene Drogen (z.B. LSD) wirken offenbar durch Interaktion mit dem serotoninergen System.
Zahlreiche halluzinogene Drogen (z.B. LSD) wirken offenbar durch Interaktion mit dem serotoninergen System.
 Zu Dopamin und Basalganglien s. dort
Zu Dopamin und Basalganglien s. dort
Im Hirnstamm (Mesencephalon, Diencephalon) befindet sich etwa
eine Million dopaminerge
Nervenzellen, die in weite Teile des Gehirns projizieren. Dieses dopaminerge System beeinflusst Motorik, Kognition, Motivation, neuroendokrine Steuerung. Es besteht aus mehreren Teilen ( Abbildung):
Abbildung):
 Einem mesolimbischen Weg (auch als Belohnungssystem bezeichnet) aus dem Mittelhirn (ventrales Tegmentum)
Einem mesolimbischen Weg (auch als Belohnungssystem bezeichnet) aus dem Mittelhirn (ventrales Tegmentum) zum limbischen System (
Hippocampus,
Amydgala) sowie zu ventalen Anteilen des
Striatums, insbesondere
nucleus accumbens und
tuberculum olfactorium.
Freudige Überraschungen stimulieren die Dopaminausschüttung im Gehirn
|
Dieses System ist in
belohnungsabhängiges Verhalten involviert (es weckt das Belohnungsbedürfnis und motiviert zur Verstärkung von Anregungen verschiedener Art) und
regt die Motivation an, wirkt verstärkend auf motorisches Lernen und trägt zu positiven Empfindungen bei - es beteiligt sich an
Arbeitsgedächtnis, Planung und Problemlösung, emotionaler Verarbeitung.
Funktionsstörungen im mesolimbischen System können vermutlich attention deficit hyperactivity disorder (ADHD) und Drogenabhängigkeit bedingen.
In das
Auftreten eines ADHD können neben dopaminergen auch noradrenerge
Projektionssysteme involviert sein, eines von mehreren Beispielen für
die Interaktion zwischen Transmittersystemen.
 Einem mesokortikalen Weg vom ventralen Tegmentum zum präfrontalen Cortex, der Einfluss auf die Kognition hat.
Einem mesokortikalen Weg vom ventralen Tegmentum zum präfrontalen Cortex, der Einfluss auf die Kognition hat.
Fehlfunktion des mesokortikalen Systems wird mit der Entstehung von Psychosen (wie Schizophrenie) in Zusammenhang gebracht.
 Einem nigrostriatalen Weg vom nucleus niger (pars compacta) zum dorsalen Striatum (~75% der dopaminergen Fasern), wichtig für Auslösung und flüssigen Ablauf von Willkürbewegungen (gestört bei Mb. Parkinson).
Einem nigrostriatalen Weg vom nucleus niger (pars compacta) zum dorsalen Striatum (~75% der dopaminergen Fasern), wichtig für Auslösung und flüssigen Ablauf von Willkürbewegungen (gestört bei Mb. Parkinson).
 Einem tuberoinfundibularen Weg vom nucleus arcuatus des Hypothalamus zu dessen eminentia mediana bzw. zur Hypophyse. Diese kurze Verbindung dient der Kontrolle der Prolactinfreisetzung.
Einem tuberoinfundibularen Weg vom nucleus arcuatus des Hypothalamus zu dessen eminentia mediana bzw. zur Hypophyse. Diese kurze Verbindung dient der Kontrolle der Prolactinfreisetzung.
Weitere dopaminerge Neuronengruppen befinden sich an anderen Stellen des Gehirns und in der Netzhaut.
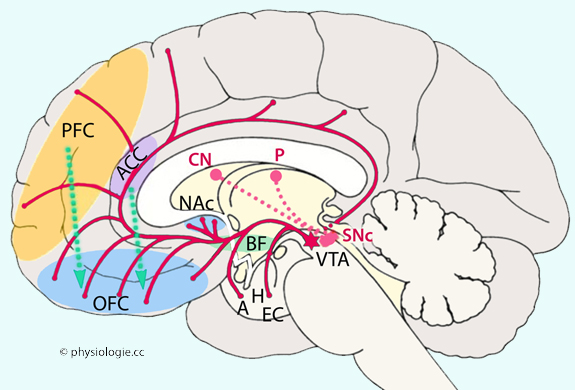
 Abbildung: Dopaminerge Projektionen aus dem Hirnstamm
Nach
Simic G, Tkalcic M, Vukic V, Mulc D, Spanic E, Sagud M,
Olucha-Bordoneau FE, Vuksic M, Hof PR. Understanding Emotions: Origins
and Roles of the Amygdala. Biomolecules 2021; 11: 823
Abbildung: Dopaminerge Projektionen aus dem Hirnstamm
Nach
Simic G, Tkalcic M, Vukic V, Mulc D, Spanic E, Sagud M,
Olucha-Bordoneau FE, Vuksic M, Hof PR. Understanding Emotions: Origins
and Roles of the Amygdala. Biomolecules 2021; 11: 823
Dopaminerge
Projektionen vom ventralen Tegmentum (VTA) und der substantia nigra in
das
limbische System (Mandelkerne, Hippocampus), das Striatum (ventrales
Pallidum), das Septum (nucl. accumbens), das Frontalhirn
(mesokortikaler Pfad), das vordere Cingulum und den entorhinalen Cortex.
Die Freisetzung von Dopamin über dieses System geht einher mit der
Erinnerung an bestimmte Objekte, Reize oder Begebenheiten, die in einen
Zusammenhang mit einem Belohnungserlebnis gebracht werden. Das macht
sie für Motivation bedeutsam. Auch vermittelt der jeweilige
"Dopamintonus" den Antrieb zu bewussten motorischen Abfolgen und ebnet
den Impetus für kommende ähnliche Muster.
Grün
strichlierte Linien deuten Projektionen aus dem Präfrontalhirn und
gyrus cinguli in den Orbitofrontalcortex an. Diese vermitteln
vermutlich bewusste Kontrolle über emotional gefärbte Ja-nein- (go/no-go) Entscheidungen
A =
Amygdala  ACC = anteriorer gyrus cinguli
ACC = anteriorer gyrus cinguli  BF = basales Vorderhirn
BF = basales Vorderhirn  CN = nucleus caudatus
CN = nucleus caudatus  EC = entorhinaler Cortex
EC = entorhinaler Cortex  H = Hippocampus
H = Hippocampus  NAc
= nucleus accumbens
NAc
= nucleus accumbens  OFC = orbitofrontaler Cortex
OFC = orbitofrontaler Cortex  P = Putamen
P = Putamen  PFC = Präfrontalcortex
PFC = Präfrontalcortex  SNc = substantia nigra - pars compacta
SNc = substantia nigra - pars compacta  VTA = ventrales tegmentales Areal
VTA = ventrales tegmentales Areal

Dopaminerge Neurone werden intensiv von glutamatergen
(exzitatorischen) und GABAergen (inhibitorischen) Axonen beeinflusst. Solche Verschaltungen können u.a. an Langzeiteffekten wie synaptischer Potenzierung oder Hemmung beteiligt sein (Neuroplastizität). Dazu zählen Belohnung, Motivation, Erinnerung (Lernen) oder
auch Gewöhnung und Löschung (Vergessen).
Das Wirkungsspektrum des Dopamins ist vielfältig und z.T. widersprüchlich erscheinend. Angesichts der Tatsache, dass es ein modulatorisch
(nicht direkt inhibitorisch oder exzitatorisch) wirksamer
Neurotransmitter ist, der teils eher parakrin als synaptisch, und auf
zahlreiche verschiedene Rezeptoren wirkt (Vertreter der D1-Gruppe steigern, solche der D2-Gruppe reduzieren die cAMP-Konzentration), ist dieser Umstand erklärlich.
 Abbildung: Dopaminrezeptoren im Gehirn
Nach einer Vorlage bei Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
Abbildung: Dopaminrezeptoren im Gehirn
Nach einer Vorlage bei Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
Das Gehirn exprimiert alle Arten von Dopaminrezeptoren ( s. dort)
s. dort)

Wo befinden sich welche Dopaminrezeptoren? D1-Rezeptoren finden sich ausschließlich auf postsynaptischen Membranen, D2-Rezeptoren
sind sowohl prä- (wo sie als Autorezeptoren wirken) als auch
postsynaptisch positioniert (zahlreiche antipsychotisch wirkenden
Medikamente sind D2-Rezeptorantagonisten).
Dopaminmangel wirkt sich - auch entsprechend den betroffenen Neuronengruppen - vielfältig aus: Motorische (Mb. Parkinson,
Tourette-Syndrom), psychische Störungen (Depression,
Schizophrenie, ADHD, Suchtverhalten) sowie solche in hormonellen Regelkreisen
(Dopamin hemmt die Freisetzung von Prolaktin).
Die Wirkung erfolgt über verschiedene Dopaminrezeptoren
(D1 bis D5) und umfasst drei Aufgabengebiete: Motorische Kontrolle,
Verhaltensbeeinflussung und endokrine Steuerung. Dopaminerge Neurone
spielen auch eine Rolle bei Übelkeit und Erbrechen.
 Dopaminantagonisten
wirken antiemetisch.
Dopaminantagonisten
wirken antiemetisch.
 Der nucleus accumbens wirkt als "Belohnungszentrum", das
dopaminerg angeregt werden kann; das mediale Vorderhirnbündel verbindet
beteiligte Zentren, verstärkt "belohnende" Aktivitäten und wird daher
als "pleasure reward bundle" bezeichnet. Insgesamt
stehen zerebrale Vorgänge wie Emotion, Kognition, Gedächtnis, Belohnung
sowie motorische Aktivität unter dopaminergem Einfluss.
Der nucleus accumbens wirkt als "Belohnungszentrum", das
dopaminerg angeregt werden kann; das mediale Vorderhirnbündel verbindet
beteiligte Zentren, verstärkt "belohnende" Aktivitäten und wird daher
als "pleasure reward bundle" bezeichnet. Insgesamt
stehen zerebrale Vorgänge wie Emotion, Kognition, Gedächtnis, Belohnung
sowie motorische Aktivität unter dopaminergem Einfluss.
Dopaminerge Neurone spielen eine Rolle bei Übelkeit (Reizung von D2-Rezeptoren in der area postrema löst Erbrechen aus).
Der nucleus arcuatus entsendet weiters Fasern zur eminentia mediana (tubero-infundibuläres System). Dopamin ist der wichtigste Inhibitor der Prolactinsekretion (prolactin inhibiting factor).
 Antipsychotika (Neuroleptika) wirken als selektive D2-Rezeptor-Antagonisten
und werden eingesetzt, um sogenannte positive Symptome der
Schizophrenie (Halluzinationen, Wahnvorstellungen) zu mildern.
Kokain und Amphetamine hemmen die Wiederaufnahme von Katecholaminen
- Noradrenalin und Dopamin - in präsynaptische Neurone. Dadurch
verlängern sie die Aufenthaltsdauer dieser Transmitter im synaptischen
Spalt und intensivieren deren Wirkung, was anregende (exzitierende)
Effekte hat (Wachheit, Alertheit) und ähnlich wirkt wie erhöhter
Sympathikustonus (Herzfrequenzsteigerung, Pupillenerweiterung usw).
Antipsychotika (Neuroleptika) wirken als selektive D2-Rezeptor-Antagonisten
und werden eingesetzt, um sogenannte positive Symptome der
Schizophrenie (Halluzinationen, Wahnvorstellungen) zu mildern.
Kokain und Amphetamine hemmen die Wiederaufnahme von Katecholaminen
- Noradrenalin und Dopamin - in präsynaptische Neurone. Dadurch
verlängern sie die Aufenthaltsdauer dieser Transmitter im synaptischen
Spalt und intensivieren deren Wirkung, was anregende (exzitierende)
Effekte hat (Wachheit, Alertheit) und ähnlich wirkt wie erhöhter
Sympathikustonus (Herzfrequenzsteigerung, Pupillenerweiterung usw).
Acetylcholin war der erste indentifizierte Neurotransmitter (Nobelpreis für Physiologie oder Medizin 1936 an Otto Loewi und Henry Dale "für ihre Entdeckungen bei der chemischen Übertragung der Nervenimpulse"), und er
findet sich in praktisch allen Teilen des menschlichen Gehirns.
Cholinerge Übertragung beteiligt sich z.B. an Lern- und
Gedächtnisprozessen und anderen Funktionen des limbischen Systems.
Neurone des modulatorischen cholinergen Systems des Hirnstamms finden
sich in der pons (pedunculopontine Kerne), projizieren auf breite
Hirngebiete
und üben starken Einfluss auf das Verhalten aus.
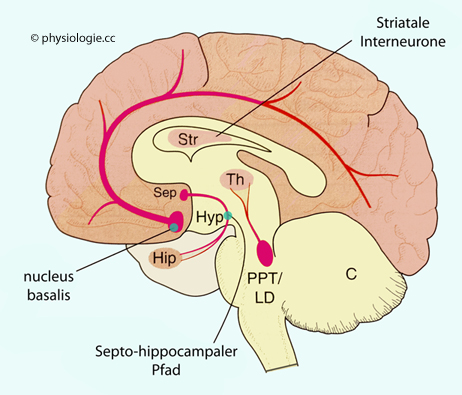
 Abbildung: Cholinerge Projektionen aus Hirnstamm und Vorderhirn
Abbildung: Cholinerge Projektionen aus Hirnstamm und Vorderhirn
Nach einer Vorlage in Rang & Dale's Pharmacology, 9th ed. 2020 (Elsevier)
Ansammlungen
noradrenerger Neurone / Fasern dunkelrot, Projektionsgebiete hellrot.
Cholinerge Projektionen erfolgen aus Septumkernen (Sep) zum Hippocampus, aus dem nucl. basalis (Meynert-Kern, Teil des basalen Vorderhirns) sehr diffus zu großen Teilen des Cortex, aus dem ponto- mesencephal- tegmentalem Komplex PPT/LD (pedunculopontinen und laterodorsalen tegmentalen Kernen) zum Thalamus (Th).
C =
Kleinhirn  Hip = Hippocampus
Hip = Hippocampus  Hyp = Hypothalamus
Hyp = Hypothalamus  Str
= Striatum
Str
= Striatum

Mb.
Alzheimer ist durch breitflächigen Verlust cholinerger Neurone
im Gehirn gekennzeichnet.
Cholinerge Systeme bilden ein diffuses modulierendes System, das aus mehreren Teilen besteht ( Abbildung), nämlich dem basalen Vorderhirnsystem, dem ponto-mesenzephalo-tegmentalen Komplex sowie Interneuronen im Basalgangliensystem:
Abbildung), nämlich dem basalen Vorderhirnsystem, dem ponto-mesenzephalo-tegmentalen Komplex sowie Interneuronen im Basalgangliensystem:
 Der basale Vorderhirnkomplex innerviert folgende Strukturen:
Der basale Vorderhirnkomplex innerviert folgende Strukturen:
 Den Hippocampus aus den (unter dem Rostrum des Balkens gelegenen) medialen Septumkernen (septum pellucidum) - sie beeinflussen Belohnung, Lernprozesse, Kurzzeitgedächtnis
Den Hippocampus aus den (unter dem Rostrum des Balkens gelegenen) medialen Septumkernen (septum pellucidum) - sie beeinflussen Belohnung, Lernprozesse, Kurzzeitgedächtnis
 Den Neocortex (breit gestreut) sowie das limbische System aus dem (zwischen Mandelkern und globus pallidus gelegenen) nucleus basalis (magnocellularis) Meynert
Den Neocortex (breit gestreut) sowie das limbische System aus dem (zwischen Mandelkern und globus pallidus gelegenen) nucleus basalis (magnocellularis) Meynert  (
( Abbildung), einem Teil des basalen Vorderhirns. Die Fasern aus dem Meynert'schen Kern nutzen Galanin als Cotransmitter. Dieses System ist einer der
bedeutendsten Acetylcholinproduzenten des Gehirns und dient u.a. der Aufmerksamkeitssteuerung.
Abbildung), einem Teil des basalen Vorderhirns. Die Fasern aus dem Meynert'schen Kern nutzen Galanin als Cotransmitter. Dieses System ist einer der
bedeutendsten Acetylcholinproduzenten des Gehirns und dient u.a. der Aufmerksamkeitssteuerung.
Dieses Fasersystem degeneriert bei Personen, die an Mb. Alzheimer leiden.
 Als basales Vorderhirn (basal forebrain)
bezeichnet man einen Teil des Großhirns, der direkt vor und unter dem
Striatum liegt. Das basale Vorderhirn beinhaltet außer dem nucl.
basalis Meynert u.a. den nucleus accumbens, Teile des Pallidum und der
Septumkerne. Experimentelle Reizung führt zur Freisetzung von
Acetylcholin und regt Wachheit bzw. REM-Phasen an; Hemmung der
Acetylcholinwirkung fördert Tiefschlaf (slow-wave sleep).
Als basales Vorderhirn (basal forebrain)
bezeichnet man einen Teil des Großhirns, der direkt vor und unter dem
Striatum liegt. Das basale Vorderhirn beinhaltet außer dem nucl.
basalis Meynert u.a. den nucleus accumbens, Teile des Pallidum und der
Septumkerne. Experimentelle Reizung führt zur Freisetzung von
Acetylcholin und regt Wachheit bzw. REM-Phasen an; Hemmung der
Acetylcholinwirkung fördert Tiefschlaf (slow-wave sleep).
 Der ponto-mesenzephalo-tegmentale Komplex des Mittelhirns und der Brücke (
Der ponto-mesenzephalo-tegmentale Komplex des Mittelhirns und der Brücke ( Abbildung) innerviert den dorsalen Thalamus sowie motorische Vorderhornzellen im Rückenmark. Zusammen mit noradrenergen und serotoninergen Bahnen aktiviert dieses System sensorische Relaiskerne und Teile des Vorderhirns.
Abbildung) innerviert den dorsalen Thalamus sowie motorische Vorderhornzellen im Rückenmark. Zusammen mit noradrenergen und serotoninergen Bahnen aktiviert dieses System sensorische Relaiskerne und Teile des Vorderhirns.
 Kurze cholinerge Verbindungen (Interneurone) im Striatum dienen der motorischen Kontrolle, solche im nucl. accumbens dem zerebralen Belohnungssystem.
Kurze cholinerge Verbindungen (Interneurone) im Striatum dienen der motorischen Kontrolle, solche im nucl. accumbens dem zerebralen Belohnungssystem.

 Abbildung: Cholinerge Synapse
Nach einer Vorlage bei Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Abbildung: Cholinerge Synapse
Nach einer Vorlage bei Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Cholin wird über einen Natrium-abhängigen Cholintransporter in das Axon befördert (blockierbar durch
Hemicholinium).
Acetylcholin wird mittels der zytoplasmatischen
Cholin-Acetyltransferase aus Cholin und Essigsäure gebildet. Dann
erfolgt die Einlagerung in Speichervesikel mittels vesikel-assoziierten
Transporters (VAT), zusammen mit Peptiden (P) und ATP. (Dieser Schritt
ist durch
Vesamicol blockierbar.)
Erregung des präsynaptischen Axons öffnet spannungssensitive
Calciumkanäle, eingeströmtes Ca
++
bewirkt Vesikelfusion und Freigabe von Acetylcholin und seinen
Ko-Transmittern in den synaptischen Spalt. Dieser Vorgang involviert SNAPs und VAMPs und kann (in der Peripherie) durch
Botulinumtoxin blockiert werden. Die Aktivierung präsynaptischer Auto- und Heterorezeptoren modifiziert die Freisetzung der Transmitter.
Die neuromodulatorische Wirkung des Acetylcholins
erfolgt über muskarinische (metabotrope, d.h. über G-Proteine relativ
langsam wirkende) Rezeptoren. Über
M-Acetylcholinrezeptoren s.
dort.
Damit
sich die postsynaptische Membran rasch erholen (repolarisieren) kann,
muss das freigesetzte Acetylcholin rasch aus dem synaptischen
Extrazellulärraum entfernt werden. Neben der präsynaptischen
Wiederaufnahme sowie Abdiffusion in die Umgebung dient dazu die
Aktivität von Acetylcholinesterase

 Cholinerge
Projektionen in den Hypothalamus beeinflussen die Freisetzung von GnRH,
ACTH, TSH und GH, sowie Oxytozin und Vasopressin.
Cholinerge
Projektionen in den Hypothalamus beeinflussen die Freisetzung von GnRH,
ACTH, TSH und GH, sowie Oxytozin und Vasopressin.
 Das
cholinerge System scheint weiters in die Kontrolle der Aufmerksamkeit
und
in die Schlaf-Wach-Steuerung involviert zu sein. Seine Aktivität ist für die Vigilanz bedeutsam (Nikotin ist ein Acetylcholin-Agonist) und fördert die selektive (zielgerichtete) Aufmerksamkeit.
Das
cholinerge System scheint weiters in die Kontrolle der Aufmerksamkeit
und
in die Schlaf-Wach-Steuerung involviert zu sein. Seine Aktivität ist für die Vigilanz bedeutsam (Nikotin ist ein Acetylcholin-Agonist) und fördert die selektive (zielgerichtete) Aufmerksamkeit.
Cholinerge Neurone sind im
Rahmen einiger neurodegenerativer Erkrankungen (Demenz, Mb. Parkinson)
betroffen. In der Narkose ist die zerebrale Aktivität reduziert und die
Acetylcholinproduktion reduziert.
 Cholinerg sind folgende Neuronen:
Cholinerg sind folgende Neuronen:
 Projektionen aus dem basalen Vorderhirnkomplex und dem ponto-mesenzephalo-tegmentalen Komplex des Hirnstamms (s. oben)
Projektionen aus dem basalen Vorderhirnkomplex und dem ponto-mesenzephalo-tegmentalen Komplex des Hirnstamms (s. oben)
 Interneurone im Striatum, die durch nigro-striatale dopaminerge
Neuronen gehemmt werden (deren Degeneration enthemmt die cholinergen
Interneurone, was bei Mb. Parkisnon der Fall ist)
Interneurone im Striatum, die durch nigro-striatale dopaminerge
Neuronen gehemmt werden (deren Degeneration enthemmt die cholinergen
Interneurone, was bei Mb. Parkisnon der Fall ist)
 Alle Motoneurone zu quergestreifter Muskulatur
Alle Motoneurone zu quergestreifter Muskulatur
 Präganglionäre autonome Nervenfasern (nikotinerg)
Präganglionäre autonome Nervenfasern (nikotinerg)
 Postganglionäre parasympathische Neurone (muskarinerg)
Postganglionäre parasympathische Neurone (muskarinerg)
 Postganglionär-sympathische Fasern zu Schweißdrüsen
Postganglionär-sympathische Fasern zu Schweißdrüsen
 Zahlreiche Neurone im Darmnervensystem
Zahlreiche Neurone im Darmnervensystem
 Über den anregenden Einfluss von Orexinen s. dort.
Über den anregenden Einfluss von Orexinen s. dort.
Histaminerge Projektionen
Auch Histamin beteiligt sich an der Regulierung von Wachheit und Aufmerksamkeit.

 Abbildung: Histaminerge Projektionen
Abbildung: Histaminerge Projektionen
Nach Schneider E, Neumann D, Seifert R. Modulation of
behavior by the histaminergic system: Lessons from H1R- and H2R-
deficient mice. Neurosci Biobehav Rev 2014; 42: 252-66
Histaminerge
Projektionen aus dem Hirnstamm haben ihren Ursprung im hypothalamischen
nucleus tuberomamillaris und steigern die kortikale Aktivität und
Wachheit. Diese Neurone sind vor allem im Wachzustand aktiv

Histamin entsteht aus der Aminosäure Histidin und wirkt über H2-Rezeptoren zerebral anregend (hirngängige Antihistaminika machen müde und benommen). Histaminerge Neuronen finden sich im knapp rostral der Mamillarkörper gelegenen nucleus tuberomamillaris (TMN: tuberomamillary nucleus) des Hypothalamus ( Abbildung).
Abbildung).
Von hier projizieren die Axone vor allem in die Großhirnrinde, in den
Thalamus, zu den Basalganglien, das (vorwiegend cholinerge, ebenfalls
auf das Gehirn anregend wirkende sowie auch in den REM-Schlaf
involvierte) basale Vorderhirn sowie in andere hypothalamische Kerne.
Die Wirkung ist eine direkte (erhöhte Aufmerksamkeit und zerebrale
Anregung) sowie indirekte (Stimulierung des basalen Vorderhirns und der
dorsalen Brückenregion).
Die Aktivität histaminerger Neurone ist im Wachzustand hoch und im Schlaf (sowohl slow-wave als auch REM) niedrig.
Anregenden Einfluss u.a. auf die tuberomamillären Kerne haben auch Orexine:
Orexine 
Die beiden Isoformen Orexin A und B (auch: Hypocretin 1 und 2, weil im Hypothalamus gebildet und Ähnlichkeiten zu Sekretin bestehen) sind Neuropeptide (Orexin A: 33 Aminosäuren mit 2 Disulfidbrücken, Orexin B: 28
Aminosäuren; durch Spaltung von Präproorexin - 130 Aminosäuren), die im lateralen Hypothalamus
(5-8.104 orexinbildende Neurone) gebildet werden. Diese Neurone projizieren auf das gesamte Gehirn. Die Wirkung erfolgt über zwei Typen G-Protein-gekoppelter Orexinrezeptoren (OX1 und OX2). An diese bindet Orexin A mit etwa gleicher Affinität, Orexin B vor allem an OX2.
 Hypocretine / Orexine steigern Wachheit und Aufmerksamkeit, indem sie
die Großhirnrinde über aufmerksamkeitssteigernde Gehirngebiete des Hirnstamms (Raphekerne, locus coeruleus, nucl.
tuberomamillaris, cholinerge Hirnstamineurone) anregen (
Hypocretine / Orexine steigern Wachheit und Aufmerksamkeit, indem sie
die Großhirnrinde über aufmerksamkeitssteigernde Gehirngebiete des Hirnstamms (Raphekerne, locus coeruleus, nucl.
tuberomamillaris, cholinerge Hirnstamineurone) anregen ( vgl. dort). Ihre Aktivität ist im Wachzustand hoch, im Schlaf (sowohl REM als auch non-REM) niedrig.
vgl. dort). Ihre Aktivität ist im Wachzustand hoch, im Schlaf (sowohl REM als auch non-REM) niedrig.
 Hypocretine / Orexine stimulieren wahrscheinlich auch die Nahrungsaufnahme.
Hypocretine / Orexine stimulieren wahrscheinlich auch die Nahrungsaufnahme.
Weitere mögliche Orexinwirkungen beim Menschen (z.B. Gemütsaufhellung) sind Gegenstand der Forschung.
Mit "Hypocretin" (HCRT) bezeichnet man nunmehr die Gene und Transkripte
(Ribonukleinsäuren), mit "Orexin" die Peptide dieses Systems.
Aufmerksamkeit und aktivierendes retikuläres System

Zur
formatio reticularis s. auch
dort
 Zu Aufmerkasmkeit und Bewusstsein s. auch dort
Zu Aufmerkasmkeit und Bewusstsein s. auch dort
Wachheit / Erregung (arousal) und Aufmerksamkeit (attention / vigilance) treten nur auf, wenn das Großhirn von subkortikalen Systemen in Hinstamm und Zwischenhirn aus stimuliert wird ( Abbildung). Reduziert dieses System seine Tätigkeit, tritt ein Zustand von mangelnder Aufmerksamkeit und Vigilanz oder Schlaf auf.
Abbildung). Reduziert dieses System seine Tätigkeit, tritt ein Zustand von mangelnder Aufmerksamkeit und Vigilanz oder Schlaf auf.
Beschädigung oder mangelnde
Versorgung subkortikaler Wecksysteme kann Bewusstlosigkeit oder Koma
bewirken. Dabei sind die Augen geschlossen, Reize aus der Umgebung
werden nicht wahrgenommen; in schweren Fällen bewirken auch
schmerzhafte Reize keine Abwehrreaktionen mehr. Allgemeinnarkose führt
ebenfalls zu einem Funktionsausfall der zerebralen Wecksysteme.
 Bewusstsein erfordert (unter anderem) eine aktivierte Großhirnrinde.
Bewusstsein erfordert (unter anderem) eine aktivierte Großhirnrinde.
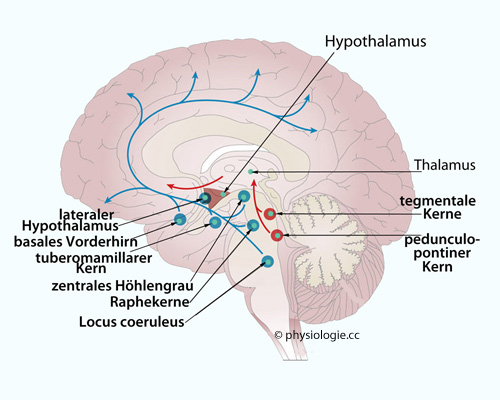
 Abbildung: Aszendierendes retikuläres aktivierendes System (ARAS)
Nach Morin CM, Drake CL, Harvey AG, Krystal AD, Manber R, Riemann D, Spiegelhalder K. Insomnia disorder. Nat Rev Dis Primers. 2015; 1: 15026
Abbildung: Aszendierendes retikuläres aktivierendes System (ARAS)
Nach Morin CM, Drake CL, Harvey AG, Krystal AD, Manber R, Riemann D, Spiegelhalder K. Insomnia disorder. Nat Rev Dis Primers. 2015; 1: 15026
Das blau gezeigte aufsteigende Anregungssystem beinhaltet noradrenerge Fasern aus dem locus coeruleus, serotoninerge aus den Raphekernen, histaminerge aus dem tuberomamillären Kern, dopaminerge aus dem ventralen Tegmentum und zentralen Höhlengrau. Dieses System erhält auch Zuflüsse aus dem lateralen Hypothalamus (Orexin, MCH) und aus dem basalen Vorderhirn (Acetylcholin, GABA).
Ein zweites anregendes System (rot) projiziert cholinerg-anregend aus dem pedunculopontinen Kern (Brücke) und laterodorsalen Tegmentum (Mittelhirn) auf Ralaisneurone im
Thalamus, was ebenfalls den Cortex aktiviert

Das subkortikale Wecksystem ist aus Komponenten des Hirnstamms (extrathalamisches Kontrollsystem) und Anteilen des Thalamus aufgebaut:
 Das extrathalamische (modulatorische) Kontrollsystem besteht aus mehreren miteinander verbundenen Anteilen. In seinem Zentrum steht die
Das extrathalamische (modulatorische) Kontrollsystem besteht aus mehreren miteinander verbundenen Anteilen. In seinem Zentrum steht die
 Formatio reticularis des Hirnstamms (von medulla oblongata bis Mittelhirn). Aktivität dessen "aufsteigenden" Teils - des (aszendierenden) aktivierenden retikulären Systems - reticular activating system, ascending arousal system
(A)RAS - ist für die Aufrechterhaltung des Bewusstseinszustandes
essentiell, es steuert Wachheit, Aufmerksamkeit, Bewusstsein und regt dafür notwendige Funktionen an. So steigert seine Aktivität den Blutdruck über Erhöhung des sympathischen Tonus.
Formatio reticularis des Hirnstamms (von medulla oblongata bis Mittelhirn). Aktivität dessen "aufsteigenden" Teils - des (aszendierenden) aktivierenden retikulären Systems - reticular activating system, ascending arousal system
(A)RAS - ist für die Aufrechterhaltung des Bewusstseinszustandes
essentiell, es steuert Wachheit, Aufmerksamkeit, Bewusstsein und regt dafür notwendige Funktionen an. So steigert seine Aktivität den Blutdruck über Erhöhung des sympathischen Tonus.
Bei einem Ausfall des
aktivierenden retikulären Systems (oder im Zuge einer Vollnarkose)
kommt es zu Bewusstlosigkeit bzw. komatösen Zuständen.
Das ARAS hat mehrere Stränge mit unterschiedlichen Neurotransmittern,
und projiziert über mehrere Routen auf die Großhirnrinde, darunter
 Eine ventrale Route - hauptsächlich noradrenerg (locus coeruleus) und serotoninerg (Raphekerne), aber auch dopaminerg (zentrales Höhlengrau) und histaminerg (Hypothalamus, nucl. tuberomamillaris) - via das basale Vorderhirn. Diese Systeme sind im Wachzustand aktiv und reduzieren ihre Aktivität im Schlaf (REM und non-REM).
Eine ventrale Route - hauptsächlich noradrenerg (locus coeruleus) und serotoninerg (Raphekerne), aber auch dopaminerg (zentrales Höhlengrau) und histaminerg (Hypothalamus, nucl. tuberomamillaris) - via das basale Vorderhirn. Diese Systeme sind im Wachzustand aktiv und reduzieren ihre Aktivität im Schlaf (REM und non-REM).
 Eine dorsale Route - hauptsächlich cholinerg - zum Thalamus (
Eine dorsale Route - hauptsächlich cholinerg - zum Thalamus ( Abbildung)
und basalen Vorderhirn, der in weiterer Folge glutamaterg den Cortex
anregt. Diese Route ist am aktivsten bei Wachheit und im REM-Schlaf und
beeinflusst die Aktivität thalamischer und kortikaler Neurone.
Abbildung)
und basalen Vorderhirn, der in weiterer Folge glutamaterg den Cortex
anregt. Diese Route ist am aktivsten bei Wachheit und im REM-Schlaf und
beeinflusst die Aktivität thalamischer und kortikaler Neurone.
Das cholinerge und das noradrenerge System sind zusammen bedeutsam für die
Aufrechterhaltung längerdauernder Aufmerksamkeit und Wachsamkeit (Vigilanz). Diese Fähigkeit wird auch von der Großhirnrinde unterstützt, vor allem von der rechten
Hemisphäre (das gilt für visuelle genauso wie für auditive Reize),
insbesondere in den Gebieten des Frontal- und des unteren
Parietallappens.
 Zusätzlich wirkt ein Sytem GABAerger Neurone des Hypothalamus (präoptisches Areal POA), das vor allem im Schlafzustand
aktiv ist. Läsionen dieser Neurone lädiert sowohl den Ablauf des REM-
als auch des non-REM-Schlafs. Andererseits regt ein System von Neuronen
des lateralen Hypothalamus, die Hypocretin (=Orexin) als
Neurotransmitter verwenden, den Wachzustand an, wohl über Reizung des ARAS (
Zusätzlich wirkt ein Sytem GABAerger Neurone des Hypothalamus (präoptisches Areal POA), das vor allem im Schlafzustand
aktiv ist. Läsionen dieser Neurone lädiert sowohl den Ablauf des REM-
als auch des non-REM-Schlafs. Andererseits regt ein System von Neuronen
des lateralen Hypothalamus, die Hypocretin (=Orexin) als
Neurotransmitter verwenden, den Wachzustand an, wohl über Reizung des ARAS ( vgl. dort).
vgl. dort).

Weitere Komponenten des subkortikalen Wecksystems sind
 Mittelhirn
Mittelhirn / Tectum: Die
oberen Vierhügel haben eine zentrale Funktion bei der Nachjustierung der Aufmerksamkeit, in deren Rahmen z.B. sakkadische
Blickeinstellungen erfolgen

Dorsaler
Hypothalamus, dieser verwaltet neurohumorale und einige motorische Begleitreaktionen
 Das thalamische Wecksystem umfasst mehrere Thalamuskerne
Das thalamische Wecksystem umfasst mehrere Thalamuskerne (
 Abbildung
Abbildung).

 Abbildung: Thalamuskerne
Abbildung: Thalamuskerne
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience, 4th ed. 2018, Cambridge Univ. Press
Grün / hellblau gezeigt sind Kerne,
die vermutlich an der Aufrechterhaltung von Wachheit und Aufmerksamkeit
beteiligt sind.
Wachheit und Vigilanz werden wahrscheinlich vor allem durch Aktivität der nuclei
reticulares, intralaminares (grün) sowie mediales dorsales (hellblau)
angeregt, selektive Aufmerksamkeit durch Aktivität des Pulvinar sowie
der corpora geniculata lateralia

An der Aufrechterhaltung von Wachheit
sind außer intralaminaren (zentromedianen) auch retikuläre und
mediodorsale Thalamuskerne beteiligt, an gerichteter Aufmerksamkeit
(Vigilanz, Konzentration) Pulvinar und lateraler Kniehöcker. Der Thalamus kanalisiert sensorische Information (gating) und lenkt so die Aufmerksamkeit auf jeweils prioritäre Information.
Im Zentrum des subkortikalen Wecksystems stehen aufsteigende Bahnen aus dem mesenzephalen Tegmentum (diese entspringen in parabrachialen / pedunculopontinen Kernen und sind glutamaterg) sowie dem basalen Vorderhirn (cholinerg und GABAerg). Dazu kommen dopaminerge Neurone aus ventralem Tegmentum und zentralen Höhlengrau, weiters glutamaterge und GABAerge aus dem nucl. supramamillaris. Diese Systeme sind zur Erhaltung des Wachzustandes beim Menschen notwendig; ihr Ausfall führt zu komatösen Zuständen.
Serotoninerge (Raphekerne), noradrenerge (locus coeruleus), histaminerge (nucl. tuberomamillaris), orexinerge (lateraler Hypothalamus)
Bahnen spielen eine weniger ausgeprägte Rolle in der Funktion des ARAS.
Sie unterstützen die Funktion des "Hauptsystems", sind dafür aber nicht
essentiell - Abnahme oder Ausfall ihrer Aktivität wirkt sich auf das
"Arousal" nur geringgradig aus.
Läsionen orexigener Neurone im lateralen Hypothalamus führen zu Narkolepsie.
 Die Neurone ziehen durch Hypothalamus und basales Vorderhirn und
projizieren direkt auf die Großhirnrinde, deren Aktivität sie anregen.
Modulierende Axone ziehen auch zum Thalamus und fördern das
"Durchschalten" sensorischer Impulse zum Cortex.
Die Neurone ziehen durch Hypothalamus und basales Vorderhirn und
projizieren direkt auf die Großhirnrinde, deren Aktivität sie anregen.
Modulierende Axone ziehen auch zum Thalamus und fördern das
"Durchschalten" sensorischer Impulse zum Cortex.
Der neuronale Schaltplan des ARAS beinhaltet hemmende Elemente, sodass sich im aktiven ARAS oszillierende Exzitationen ergeben, die sich im EEG als Rhythmen darstellen ( s. auch Schlafstadien).
Auf diese Weise wird die Aktivität auf bestimmte Inhalte gebündelt,
ohne dass es zu ungehemmter Ausbreitung von Exzitationen im Gehirn
kommt - immerhin sind wahrscheinlich mehr als 10% der Nervenzellen im
ARAS elektrisch gekoppelt (mittels gap junctions).
s. auch Schlafstadien).
Auf diese Weise wird die Aktivität auf bestimmte Inhalte gebündelt,
ohne dass es zu ungehemmter Ausbreitung von Exzitationen im Gehirn
kommt - immerhin sind wahrscheinlich mehr als 10% der Nervenzellen im
ARAS elektrisch gekoppelt (mittels gap junctions).
Aufmerksamkeit
 s. auch dort
s. auch dort
Aufmerksamkeit kann das Antwortverhalten einzelner Neurone verändern, z.B. kann das maximale Ansprechverhalten auf adäquate Reizmuster im rezeptiven Feld
zu- oder abnehmen, das Ansprechverhalten sich um den optimalen Reiz
herum verschärfen (fokussieren), oder auch verändern (verlagern).
Man unterscheidet zwei Formen der Aufmerksamkeit, die meist interagieren:
 Exogene Aufmerksamkeit (bottom-up oder reflexive oder exogenously controlled attention): Ein äußerer Stimulus triggert sie ohne kognitive Anstrengung. Diese
Form der Aufmerksamkeit wird offenbar über das untere Parietalhirn (lobus parietalis inferior) vermittelt (der sulcus intraparietalis trennt den oberen vom unteren Parietallappen). Sie erreicht ihr Maximum innerhalb einer
Zehntelsekunde nach Reizbeginn und flacht rasch wieder ab, falls dem
Reiz keine weitere Bedeutung zukommt.
Exogene Aufmerksamkeit (bottom-up oder reflexive oder exogenously controlled attention): Ein äußerer Stimulus triggert sie ohne kognitive Anstrengung. Diese
Form der Aufmerksamkeit wird offenbar über das untere Parietalhirn (lobus parietalis inferior) vermittelt (der sulcus intraparietalis trennt den oberen vom unteren Parietallappen). Sie erreicht ihr Maximum innerhalb einer
Zehntelsekunde nach Reizbeginn und flacht rasch wieder ab, falls dem
Reiz keine weitere Bedeutung zukommt.
 Im Gegensatz dazu unterstützt endogene ("willentliche") Aufmerksamkeit (top-down oder voluntary oder consciously controlled attention) die bewußte Suche nach einem Zielobjekt oder die Konzentration
auf ein bestimmtes Verhalten. Diese Art der Aufmerksamkeit wird vermutlich vor allem über das obere Parietalhirn (lobus parietalis superior) vermittelt. Endogene Aufmerksamkeit ist unter der
Kontrolle des Bewußtseins, und es dauert etwa 0,3 Sekunden (dreimal so
lang wie bei der exogenen Aufmerksamkeit), bis ihr Maximum erreicht
ist; sie bleibt im Allgemeinen auch länger bestehen.
Im Gegensatz dazu unterstützt endogene ("willentliche") Aufmerksamkeit (top-down oder voluntary oder consciously controlled attention) die bewußte Suche nach einem Zielobjekt oder die Konzentration
auf ein bestimmtes Verhalten. Diese Art der Aufmerksamkeit wird vermutlich vor allem über das obere Parietalhirn (lobus parietalis superior) vermittelt. Endogene Aufmerksamkeit ist unter der
Kontrolle des Bewußtseins, und es dauert etwa 0,3 Sekunden (dreimal so
lang wie bei der exogenen Aufmerksamkeit), bis ihr Maximum erreicht
ist; sie bleibt im Allgemeinen auch länger bestehen.
"Top-down" Aufmerksamkeit wird wahrscheinlich auch durch die vordere
Insel mit dem Operculum, dorsal-anteriore Anteile des gyrus cinguli,
sowie den (direkt darüber liegenden) medialen Abschnitt des oberen
Frontalcortex vermittelt. Beginn und Fortsetzung zielgerichteter Aufmerksamkeit aktiviert diese Rindenregionen, ihre Aktivität nimmt bei Fehlern weiter zu.
Der Bereich des sulcus intraparietalis (er trennt den lobus parietalis superior vom lobus parietalis inferior) scheint an der Selektion von Prioritäten
wesentlich beteiligt zu sein. Er beteiligt sich weiters an der Selektion unter mehreren konkurrierenden visuellen Reizen.
An der Selektion zwischen mehreren
Möglichkeiten der Antwort auf Inhalte, welche die Aufmerksamkeit
erregen, nehmen weiters der vordere gyrus cinguli sowie der supplementär-motorische Cortex
teil. Der vordere gyrus cinguli ist besonders an der Selektion
korrekter motorischer Antworten bei schwierigen Problemlösungen
beteiligt. In solchen Situationen sind mehrere medial gelegene präfrontale Cortexregionen gefordert.
Das thalamokortikale System ist Teil einer rückläufigen Aktivierungsschaltung und bringt
Pyramidenzellen der Hirnrinde zu höherer Aktivität (starke
Stimuli können "aufwecken" - oder im Wachzustand die Aufmerksamkeit auf
die betreffende Reizquelle bündeln).
Gesteigerte Aufmerksamkeit hat mehrere Wirkungen - unter anderem
steigt (unabhängig von der auslösenden Sinnesmodalität) die visuelle Empfindlichkeit (pulvinar thalami) und sinken die
Reaktionszeiten. Die zielgerichtete Leistungsfähigkeit des Gehirns
nimmt also zu. Cholinerge und adrenerge Anteile sind die wichtigsten
Anteile in diesem System; beide
sind im Wachzustand aktiv (die cholinergen auch im REM-Schlaf, die
adrenergen auch im non-REM-Schlaf). NO (an Dendriten) scheint eine Rolle als
Transmitter im ARAS zu spielen.
Da man die Aufmerksamkeit auf Dinge richtet, die man gleichzeitig mit
den Augen fixiert (Projektion auf die fovea centralis), besteht eine
enge Verbindung mit der Steuerung der Blickmotorik (frontales Augenfeld, Augenmuskelkerne). Zielgerichtete Augenbewegungen gehen insbesondere von den oberen Vierhügeln (colliculi superiores) des Mittelhirndachs aus. Veränderungen der Aufmerksamkeit gehen hingegen vom pulvinar thalami aus.
Die "oberste Kontrolle" über die Aufmerksamkeitssteuerung hat die Großhirnrinde - insbesondere der sulcus intraparietalis, das temporoparietale Übergangsgebiet, und das frontale Augenfeld. Die verschiedenen kortikalen Gebiete kooperieren bei der Steuerung der Aufmerksamkeit.
 Abbildung: Bereich des Zwischenhirns
Abbildung: Bereich des Zwischenhirns
Nach einer Vorlage bei toppr.com
Zum
Zwischenhirn gehört der Thalamus, der u.a. fast alle afferenten
(Sinnes-)Meldungen bearbeitet und wichtige motorische Funktionen hat,
und der Hypothalamus, das vegetativ-endokrine Regulationszentrum

Das Zwischenhirn
(Diencephalon) - wesentliche Teile davon dienen der Steuerung von Muskeltonus und
Bewegungsabläufen (motorische Kontrolle) - besteht aus
 Thalamus
Thalamus
 Subthalamus (=thalamus ventralis) - zu ihm gehören das Pallidum (globus pallidus
Subthalamus (=thalamus ventralis) - zu ihm gehören das Pallidum (globus pallidus  ) und der nucleus subthalamicus (Luysi), das sind Teile der Basalganglien
) und der nucleus subthalamicus (Luysi), das sind Teile der Basalganglien
 Hypothalamus
Hypothalamus
 Epithalamus:
Epithalamus:
 Als Epithalamus bezeichnet man den dorsalen Abschnitt des Zwischenhirns. Zu ihm gehören
Als Epithalamus bezeichnet man den dorsalen Abschnitt des Zwischenhirns. Zu ihm gehören

Der
~3 cm lange Thalamus
ist aus zwei gleich strukturierten (median durch die aus Gliazellen
bestehende adhaesio bzw. massa interthalamica miteinander verbundenen)
Hälften (linker und rechter Thalamus), zwischen denen kaum neuronale Verbindungen bestehen, aufgebaut. Er liegt beidseits des 3. Ventrikels (lateral liegen absteigende Fasern der capsula interna) und macht ~80% des dienzephalen Volumens aus (knapp 20% der Masse des Zwischenhirns entfallen auf den Hypothalamus). Er besteht aus ~50 Kernen, die mit allen
Teilen der Großhirnrinde reziprok (bidirektional) verbunden sind.
Der
Thalamus dient u.a. als Schaltstelle für fast alle sensorischen
Informationen (Ausnahme: Geruchssinn) sowie für den Großteil der aus
dem Cortex kommenden motorischen Signale. Hier werden durchlaufende
Impulse bewertet, angeglichen, neu gewichtet und modifiziert
weitergeleitet. Dabei wird ein hohes Maß an Spezifität bewahrt
(Sinnesmodalität, motorisches Ziel). Der Thalamus kann Informationsflüsse abschwächen, verstärken und/oder umorganisieren.
Die Kontakte des Thalamus mit dem umliegenden Gehirn sind
zum Teil spezifischer Natur und sehr komplex aufgebaut. Die Thalamuskerne teilt man in Gruppen ein, z.B. als
 anteriore (Lernen, Gedächtnis)
anteriore (Lernen, Gedächtnis)
 mediale (kortikale Anregung, kognitives Lernen)
mediale (kortikale Anregung, kognitives Lernen)
 laterale (sensorische und motorische Aufgaben, Interpretation)
laterale (sensorische und motorische Aufgaben, Interpretation)
 posteriore Kerne (auditive und visuelle Funktionen, Sprachkontrolle, Integration)
posteriore Kerne (auditive und visuelle Funktionen, Sprachkontrolle, Integration)
Diese Kerngebiete sind durch Schichten weißer Substanz (laminae medullaris
internae) voneinander abgegrenzt, die kleine
Neuronengruppen (intralaminare Kerne) enthalten und kortikaler Aktivierung sowie sensomotorischer Integration dienen.
 Thalamuskerne haben koordinative
und 'Relaisfunktion' (betreffende Neuronen arbeiten sensorische Information modalitätsspezifisch auf). Der Mittelteil der medialen Gruppe und die
intralaminären Kerne wirken als diffuse Projektionskerne.
Durch Verbindungen mit Frontalhirn und Hippocampus beteiligt sich der
Thalamus wahrscheinlich auch an der Kognition (z.B. Gedächtnis).
Thalamuskerne haben koordinative
und 'Relaisfunktion' (betreffende Neuronen arbeiten sensorische Information modalitätsspezifisch auf). Der Mittelteil der medialen Gruppe und die
intralaminären Kerne wirken als diffuse Projektionskerne.
Durch Verbindungen mit Frontalhirn und Hippocampus beteiligt sich der
Thalamus wahrscheinlich auch an der Kognition (z.B. Gedächtnis).
Oszillationen: Spontanaktive Zellen (Schaltneuronen) im Thalamus verfügen über HCN2-Ionenkanäle
und üben über diese Schrittmacherfunktion aus (Spontandepolarisierung).
Die graue Substanz des Thalamus ist durch vertikale Schichten weißer
Substanz (laminae) aus Nervenfasern untergliedert, welche die Kerne untereinander sowie den Thalamus mit der Großhirnrinde verbinden (thalamokortikale, kortikothalamische, thalamothalamische Projektionen).
Der Thalamus hat vier grundsätzliche Funktionsbereiche:
 sensorisch - alle Sinnesinformation (außer dem Riechsinn) wird über den Thalamus an die Großhirnrinde übermittelt
sensorisch - alle Sinnesinformation (außer dem Riechsinn) wird über den Thalamus an die Großhirnrinde übermittelt

 motorisch - Basalganglien und Kleinhirn senden motorische Impulsmuster über den Thalamus an die Großhirnrinde
motorisch - Basalganglien und Kleinhirn senden motorische Impulsmuster über den Thalamus an die Großhirnrinde

 autonom-nervös (vegetativ) - der Thalamus beteiligt sich an Aufmerksamkeitssteuerung und Bewusstseinsbildung
autonom-nervös (vegetativ) - der Thalamus beteiligt sich an Aufmerksamkeitssteuerung und Bewusstseinsbildung

 Emotion und Gedächtnis - der Thalamus ist Teil des Papez-Kreises und kontrolliert zum gyrus cinguli projizierte emotionale und Gedächtnisinformationen
Emotion und Gedächtnis - der Thalamus ist Teil des Papez-Kreises und kontrolliert zum gyrus cinguli projizierte emotionale und Gedächtnisinformationen

Abbildung: Thalamuskerne, ihre Eingänge und Projektionen auf die Großhirnrinde
Nach einer Vorlage bei Massey / Cunniffe / Noorani, Carpenter's Neurophysiology - A Conceptual Approach, 6th ed. CRC Press Taylor & Francis Group 2022
Oben: Die Neuronenmasse des Thalamus wird durch die thalamischen laminae medullares Y-förmig in
anteriore, mediale und laterale Areale unterteilt. Unten: Die
zugeordneten Cortexareale (unten) sind entsprechend farbcodiert dargestellt.
Der mediale und laterale Kniehöcker
(MG, LG) erhalten akustische (über CN 8) und visuelle Information (über CN 2). VPM (nucleus ventroposteromedialis) erhält sensorische Impulse aus dem Kopf- / Gesichtsbereich (CN 5), VPL (nucleus ventroposterolateralis) somatosensorische Information aus dem restlichen Körper.
LP und LD sind der lateral-posteriore
und lateral-dorsale, DM ist der dorsomediale, CM der zentromediane
Kern, Ant die anteriore
Gruppe. Letztere korrespondiert mit
dem limbischen System, VA mit den Basalganglien, VL mit dem Kleinhirn,
LD mit dem Parietallappen und gyrus cinguli, die mediale Kerngruppe mit
dem Frontallappen, die posteriore mit Assoziationscortices

 Unspezifisch
Unspezifisch /
viszerosensibel
sind
intralaminäre und
zentromediane Kerne. Sie
erhalten Afferenzen aus der retikulären Formation des Mittelhirns und
aus dem Vorderseitenstrang (
tractus spinothalamicus) und projizieren in die gesamte
Großhirnrinde.
 Spezifisch sensorisch
Spezifisch sensorisch sind
die Kniehöcker (
corpora geniculata) für Sehen und Hören sowie die
ventrobasalen Kerne für die somatische Sensibilität. Diese Kerne sind
entwicklungsgeschichtlich jünger (Entwicklung mit Neocortex), arbeiten
modalitätsspezifisch und räumlich sehr präzise.
 Sensomotorisch: Nucleus ventralis anterior
Sensomotorisch: Nucleus ventralis anterior (verlangsamt Willkürbewegungen) und
lateralis (beschleunigt Willkürbewegungen).

Zu den
Assoziationskernen
gehören das
Pulvinar und der
Nucl. lateralis posterior
(parieto-okzipito-temporale Verbindungen) sowie die mit dem gyrus
cinguli verbundenen
Nucll. anterior und
lateralis dorsalis.
Funktionen, Ein- und Ausgangsverbindungen der Thalamuskerne
Anteriore Kerngruppe
Der
anteriore Thalamus beschäftigt sich mit Aspekten von
Lernen,
Gedächtnis und Emotionen
Eingang:
Hypothalamus (
Mamillarkörper - Bahn: tractus mamillothalamicus), Hippocampus
Ausgang: Vorderes limbisches Gebiet -
Gyrus cinguli (limbischer Paläocortex), gyrus parahippocampalis
Intralaminare Kerne
Intralaminare Kerne beteiligen sich an
kortikaler Aktivierung und
sensomotorischer Integration
Eingang: Tractus spinothalamicus, formatio reticularis, Kleinhirnkerne, Pallidum
Ausgang: Striatum, Frontal- und Parietallappen
Mediale
Gruppe
Der Mittelteil der medialen Gruppe (midline group) reguliert die Erregbarkeit des
Vorderhirns
Eingang: Formatio reticularis,
Hypothalamus
Ausgang: Cortex cerebri inkl. Gyrus cinguli,
Amygdala
Der
Dorsomedialkern (medial dorsal nucleus) ist befasst mit
Emotionen,
kognitivem Lernen, Gedächtnis und Beurteilung
Laterale Gruppe
Nucleus ventralis anterior:
Beteiligung an der Bewegungsplanung
Nucleus ventralis lateralis: Bewegungsplanung
und -kontrolle
 Nucleus ventralis posterior (lateralis und medialis): Somatosensorik
Nucleus ventralis posterior (lateralis und medialis): Somatosensorik
Nucleus lateralis dorsalis:
Gedächtnis und Interpretation visueller Reize
Unsicher (Hippocampus, colliculi superiores?)
Ausgang:
Gyrus
cinguli, visueller Assoziationscortex
Nucleus lateralis posterior: Sensorische Interpretation
Posteriore Gruppe
Pulvinar: Sensorische
Integration, Augenbewegungskontrolle, Sprachkontrolle, Wechsel der Aufmerksamkeit auf die Gegenseite
Corpus geniculatum laterale: Verarbeitung visueller Information
Corpus geniculatum mediale: Verarbeitung auditiver Information
Der Hypothalamus ist
die Zentralstelle für die Erhaltung physiologischer Gleichgewichte
(neuro-humorale Homöostase, Integration verschiedener Regelsysteme,
z.B. Körpertemperatur, Nahrungs- und Flüssigkeitsbilanz, Hormonstatus,
metabolischer Status, Exekution emotionaler Antworten, Verhaltenssteuerung, zirkadiane Rhythmen). Er kann
als Teil des limbischen Systems gesehen werden. Der Hypothalamus erhält Information
über innere und äußere Reize und hat Zugriff auf die Hypophyse,
vegetative Zentren, sowie motorische Neuronengruppen des Hirnstamms.
Man teilt den Hypothalamus in rostrokaudal angeordnete Regionen ein:

 Abbildung: Hypothalamische Kerngebiete (Sagittalschnitt)
Abbildung: Hypothalamische Kerngebiete (Sagittalschnitt)
Nach einer Vorlage bei Tortora / Grabowski, Principles
of Anatomy and Physiology, 7th ed. 1993. Biological Sciences Textbooks
Inc. HarperCollins College Publishers, New York
Links posteriorer, rechts anteriorer Hypothalamus.
Die Abbildung zeigt die Gruppierung in mamilläre (posteriore), tuberale, supraoptische und präoptische Kerngruppen.
Der anteriore Hypothalamus steuert den Wasserhaushalt; er
kann Durstempfinden erzeugen und die Wasseraussscheidung der Nieren
(via Vasopressin) anregen. Angiotensin regt das Subfornikalorgan
und dieses das hypothalamische Durstzentrum an. Der anteriore
Hypothalamus stabilisiert die Körpertemperatur und erzeugt die
Hypophyse steuernde Hormone (Liberine, Statine).
Der mittlere (tuberale) Hypothalamus steuert u.a. Kreislauf, Verdauungssystem, Hunger und Sattheit.
Der posteriore Hypothalamus
regt u.a. das sympathische System an, sezerniert Vasopressin und
Oxytocin, kümmert sich um Schlaf, Wachheit, Lernen, Gedächtnis, auch
Appetit und Sattheit.
 Der präoptische Hypothalamus (in der
Der präoptische Hypothalamus (in der  Abbildung dunkelviolett markiert) liegt über dem chiasma opticum
und enthält Neurone zur Steuerung von Durst, Wasserbilanz, Körpertemperatur,
Schlaf, Sexualverhalten und zirkadiane Rhythmen.
Neurone der präoptischen Region projizieren inhibitorisch auf Neuronen,
die Weck- bzw. anregernde Wirkung haben; man kann sie als
"Schlafneurone" bezeichnen. Die Mehrzahl dieser schlafinduzierenden
Neurone liegt in der ventrolateralen präoptischen Region (ventromedial preoptic area vlPOA).
Abbildung dunkelviolett markiert) liegt über dem chiasma opticum
und enthält Neurone zur Steuerung von Durst, Wasserbilanz, Körpertemperatur,
Schlaf, Sexualverhalten und zirkadiane Rhythmen.
Neurone der präoptischen Region projizieren inhibitorisch auf Neuronen,
die Weck- bzw. anregernde Wirkung haben; man kann sie als
"Schlafneurone" bezeichnen. Die Mehrzahl dieser schlafinduzierenden
Neurone liegt in der ventrolateralen präoptischen Region (ventromedial preoptic area vlPOA).
Der mediane nucleus praeopticus (median preoptic nucleus
MnPO) hat eine herausragende Bedeutung als Zentrum für die Regulation
der Körpertemperatur und des Flüssigkeitshaushaltes (Einfluss auf
Hitze- und Kälteschutzverhalten sowie Trinkverhalten) und beeinflusst
das Schlafverhalten. Seine Efferenzen ziehen zu hypothalamischen
Nachbarkernen, in tiefere Hirnstammbereiche und von hier zu autonomen
(mediolateralen) Rückenmarkszonen, um Durchblutung, Schweißsekretion und
Piloerektion zu beeinflussen.
 Der supraoptische Hypothalamus liegt über dem Infundubulum und enthält den supraoptischen, anterioren und paraventrikulären Kern.
Der supraoptische Hypothalamus liegt über dem Infundubulum und enthält den supraoptischen, anterioren und paraventrikulären Kern.
 Der tuberale Hypothalamus liegt direkt dahinter über der Hypophyse
und kontrolliert deren hormonelle Steuerung (Liberine, Statine), das
autonome Nervensystem, Aggression, Hunger und Sexualverhalten.
Der tuberale Hypothalamus liegt direkt dahinter über der Hypophyse
und kontrolliert deren hormonelle Steuerung (Liberine, Statine), das
autonome Nervensystem, Aggression, Hunger und Sexualverhalten.
 Der posteriore
Hypothalamus enthält die posterioren und mamillären Kerne sowie
histaminerge Neuronen im nucl. tuberomamillaris (seine Aktivität weckt
die Aufmerksamkeit).
Der posteriore
Hypothalamus enthält die posterioren und mamillären Kerne sowie
histaminerge Neuronen im nucl. tuberomamillaris (seine Aktivität weckt
die Aufmerksamkeit).
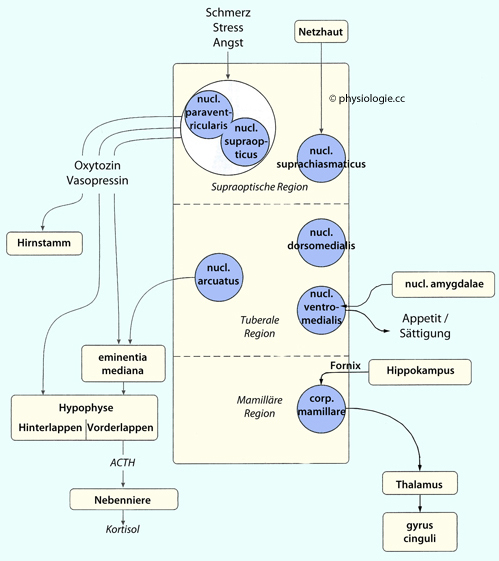
 Abbildung: Kerne des medialen Hypothalamus (Rechteck) und Projektionen
Abbildung: Kerne des medialen Hypothalamus (Rechteck) und Projektionen
Modifiziert nach einer Vorlage in Clark / Boutros: The Brain and Behavior, Blackwell Science 1999
Oben: Supraoptische Region. Die
Freisetzung der Hinterlappenhormone aus den nucll. supraopticus und
paraventricularis hängt nicht nur von Faktoren wie Blutvolumen und
Osmolalität ab, sondern kann auch durch Stressfaktoren wie Schmerz oder
Angst gesteigert sein.
Der nucl. supraopticus verwaltet lichtabhängig
zirkadiane Rhythmen.
Mitte: Tuberale Region. Diese Mamiolläre Region. steuert die Hypophyse und ist mit dem limbischen System verbunden.
Unten: Mamilläre Region. Dieser Teil ist in den
Papez-Kreis eingebunden

Der mediale Hypothalamus wird auch unterteilt in
 die supraoptische Region direkt über der Sehnervenkreuzung hinter der präoptischen Region (diese enthält die präoptischen Kerne - medial den sexually dimorphic nucleus
SDN).
die supraoptische Region direkt über der Sehnervenkreuzung hinter der präoptischen Region (diese enthält die präoptischen Kerne - medial den sexually dimorphic nucleus
SDN).
Die supraoptische Region beinhaltet die Kerne,
welche die Hinterlappenhormone Oxytozin und Vasopressin produzieren
(magnozelluläre Neurone im nucl. supraopticus und paraventricularis) und die u.a. auf Stressfaktoren reagieren.
 Die (paarigen) nuclei suprachiasmatici haben ein Volumen von jeweils nur 0,25 mm3 (0,00025 ml), sind aber von großer Bedeutung. Sie vollführen eine Zeitgeberaktivität (central master-clock), die sie zum primären Schrittmacher zirkadianer (~24-Stunden-) Rhythmen machen - eine Aufgabe, die sie über neuroendokrine Einflüsse auf zahlreiche physiologische Systeme wahrnehmen (
Die (paarigen) nuclei suprachiasmatici haben ein Volumen von jeweils nur 0,25 mm3 (0,00025 ml), sind aber von großer Bedeutung. Sie vollführen eine Zeitgeberaktivität (central master-clock), die sie zum primären Schrittmacher zirkadianer (~24-Stunden-) Rhythmen machen - eine Aufgabe, die sie über neuroendokrine Einflüsse auf zahlreiche physiologische Systeme wahrnehmen ( vgl. dort). Grundlage ist dabei ein Schwingungssystem miteinander verknüpfter molekularer
Rückkopplungsschleifen, die sich auf die Genexpression der beteiligten
Neurone auswirken. Sie liegen direkt über der Sehnervenkreuzung (daher der Name); zur Synchronisierung mit Rhythmen in der Umwelt empfangen sie Signale aus der Netzhaut.
vgl. dort). Grundlage ist dabei ein Schwingungssystem miteinander verknüpfter molekularer
Rückkopplungsschleifen, die sich auf die Genexpression der beteiligten
Neurone auswirken. Sie liegen direkt über der Sehnervenkreuzung (daher der Name); zur Synchronisierung mit Rhythmen in der Umwelt empfangen sie Signale aus der Netzhaut.
 Die tuberale Region (s. oben) - der nucl. arcuatus ist in die Kontrolle des Körpergewichts involviert und produziert auch ß-Endorphin.
Die tuberale Region (s. oben) - der nucl. arcuatus ist in die Kontrolle des Körpergewichts involviert und produziert auch ß-Endorphin.
Der nucl. dorsomedialis vermittelt aggressives Verhalten, der nucl. ventromedialis
erhält Impulse vom Mandelkern und projiziert auf den Meynert'schen
Basalkern; auch er reguliert Nahrungsaufnahme und Körpergewicht. Der
mediale Hypothalamus wirkt als Sattheitszentrum
 Die mamilläre Region erhält vor
allem Impulse aus dem Hippocampus; ihre Funktion ist mit Emotionen und
Gedächtnisbildung verknüpft. Projektionen in den vorderen Thalamuskern
sind Teil limbischer Rückkopplung.
Die mamilläre Region erhält vor
allem Impulse aus dem Hippocampus; ihre Funktion ist mit Emotionen und
Gedächtnisbildung verknüpft. Projektionen in den vorderen Thalamuskern
sind Teil limbischer Rückkopplung.
Seitlich vom medialen Hypothalamus liegt der laterale Hypothalamus; diese Zone gilt als Hungerzentrum.
Der laterale Hypothalamus ist intensiv mit dem nucleus accumbens und dem ventralen Tegmentum verschaltet, und ist vor allem in Vorgänge im Zusammenhang mit Aufmerksamkeit und Belohnung involviert.
Blutversorgung der Hypophyse: Über den Pfortaderkreislauf der oberen Hypophysenarterie gelangen hypothalamische Liberine / Statine von
der eminentia mediana zum Vorderlappen, und Vorderlappenhormone über
den weiteren Venenverlauf - und über das Versorgungsgebiet der unteren Hypophysenarterie aus dem Hinterlappen Oxytozin und Vasopressin - in den systemischen Kreislauf.
Anteriore Kerngruppe grün, mittlere rosa, posteriore grau, nucl.lateralis blau unterlegt

Der Hypothalamus hat zentrale Bedeutung für
 vegetative Anpassungsreaktionen
(Aufrechterhaltung der Homöostase: Kreislauf, Atmung, Körpertemperatur,
Metabolismus / Nahrungsaufnahme, Flüssigkeitsvolumen und Osmolalität /
Flüssigkeitsaufnahme und Nierenfunktion, vegetative Begleitung von Angriffs- oder
Fluchtverhalten - Substratversorgung! -, Immunabwehr, Schlaf-Wach-Rhythmus etc) und
vegetative Anpassungsreaktionen
(Aufrechterhaltung der Homöostase: Kreislauf, Atmung, Körpertemperatur,
Metabolismus / Nahrungsaufnahme, Flüssigkeitsvolumen und Osmolalität /
Flüssigkeitsaufnahme und Nierenfunktion, vegetative Begleitung von Angriffs- oder
Fluchtverhalten - Substratversorgung! -, Immunabwehr, Schlaf-Wach-Rhythmus etc) und
 die
entsprechende Abstimmung mit der Verhaltenssteuerung, wie
die
entsprechende Abstimmung mit der Verhaltenssteuerung, wie
 Essen: Nutritives (die Nahrungsaufnahme betreffendes) Verhalten und
parasympathische Aktivierung des Verdauungssystems (trophotrope,
d.h. auf die Ernährung gerichtete Reaktionslage). Multiple periphere
und zentrale Signale - neuronale wie humorale - werden in die Steuerung
der Energie-Homöostase einbezogen. Ziel ist die Herstellung eines
Gleichgewichts zwischen Nahrungsaufnahme und Energiekonsumption (und
die Erhaltung eines optimalen Körpergewichts).
Essen: Nutritives (die Nahrungsaufnahme betreffendes) Verhalten und
parasympathische Aktivierung des Verdauungssystems (trophotrope,
d.h. auf die Ernährung gerichtete Reaktionslage). Multiple periphere
und zentrale Signale - neuronale wie humorale - werden in die Steuerung
der Energie-Homöostase einbezogen. Ziel ist die Herstellung eines
Gleichgewichts zwischen Nahrungsaufnahme und Energiekonsumption (und
die Erhaltung eines optimalen Körpergewichts).
Periphere Faktoren, die den Energiestatus längerfristig
(über die Zeit gemittelt) anzeigen, sind ( Abbildung) Leptin und Adiponektin aus dem
Fettgewebe und Insulin aus der Bauchspeicheldrüse. Ghrelin aus dem
Magen liefert ein akutes Hungersignal, und zu den Sättigungssignalen (kurzfristige Speicheranzeige) gehören das Peptid YY (PYY3-36), pankreatisches Polypeptid, Amylin und Oxyntomodulin (OXM). Die Inkretinhormone Glukagonähnliches Peptid (GLP-1) und Glukoseabhängiges insulinotropes Peptid (GIP) verstärken die Reaktion der Langerhans-Inseln im Pankreas auf nutritive Reize.
Abbildung) Leptin und Adiponektin aus dem
Fettgewebe und Insulin aus der Bauchspeicheldrüse. Ghrelin aus dem
Magen liefert ein akutes Hungersignal, und zu den Sättigungssignalen (kurzfristige Speicheranzeige) gehören das Peptid YY (PYY3-36), pankreatisches Polypeptid, Amylin und Oxyntomodulin (OXM). Die Inkretinhormone Glukagonähnliches Peptid (GLP-1) und Glukoseabhängiges insulinotropes Peptid (GIP) verstärken die Reaktion der Langerhans-Inseln im Pankreas auf nutritive Reize.

Abbildung: Der Hypothalamus integriert Signale zur Steuerung des Energiehaushalts
Nach Cooke D, Bloom S, The obesity pipeline: current
strategies in the development of anti-obesity drug. Nature Rev Drug
Discov 2006; 5: 919-31
Hypothalamische
Neuronen verfügen über zahlreiche Rezeptorarten für Signalstoffe, die
für den Energiemetabolismus bedeutsam sind, wie Ghrelin, Leptin, Insulin, Melanocortin (MC), GLP und NPY

Zusätzliche Signale kommen von Rezeptoren im Magen (Dehnung) und oberen
Dünndarm (Nährstoffe) und werden über vagale und auch sympathische
Afferenzen an den nucleus tractus solitarii weitergeleitet.
Der nucleus arcuatus
fasst all diese Signale zusammen. So wird das Wechselspiel von
appetitfördernden und -hemmenden Neuronen (orexigen, anorexigen)
gesteuert.
Mehr über die Steuerung von Hunger und Sattheit  s. dort
s. dort
 Trinken: Wasseraufnahme in Reaktion auf Durstempfinden. Das Trinkverhalten ist wesentlich von der osmotischen Konzentration der Körperflüssigkeiten bestimmt, insbesondere im Hypothalamus (Osmorezeptoren im Gebiet des nucleus supraopticus).
Trinken: Wasseraufnahme in Reaktion auf Durstempfinden. Das Trinkverhalten ist wesentlich von der osmotischen Konzentration der Körperflüssigkeiten bestimmt, insbesondere im Hypothalamus (Osmorezeptoren im Gebiet des nucleus supraopticus).
 Wärmehaushalt und Temperaturregulation
- dazu gehören Einflüsse auf Energieutilisation, Wärmeproduktion im
Muskel, Hautdurchblutung, Sudomotorik (Schweißbildung) genauso wie
entsprechendes Verhalten (z.B. Aufsuchen eines wärmeren oder kühleren
Ortes)
Wärmehaushalt und Temperaturregulation
- dazu gehören Einflüsse auf Energieutilisation, Wärmeproduktion im
Muskel, Hautdurchblutung, Sudomotorik (Schweißbildung) genauso wie
entsprechendes Verhalten (z.B. Aufsuchen eines wärmeren oder kühleren
Ortes)
 Abwehr- und Aggressionsverhalten im Zusammenspiel mit dem limbischen
System; hier überwiegt die Aktivität des Sympathikus (ergotrope, d.h. auf die Entfaltung von Muskelkraft gerichtete
Reaktionslage), Hormonausschüttung aus der Nebenniere
eingeschlossen
Abwehr- und Aggressionsverhalten im Zusammenspiel mit dem limbischen
System; hier überwiegt die Aktivität des Sympathikus (ergotrope, d.h. auf die Entfaltung von Muskelkraft gerichtete
Reaktionslage), Hormonausschüttung aus der Nebenniere
eingeschlossen
 Reproduktives Verhalten, das der Fortpflanzung dient: Verarbeitung
sexueller Signale (Formen, Stimme, Bewegungsmuster, Pheromone,
Pupillenweite, Berührung), Koordination hormonell-vegetativer
Reaktionen
Reproduktives Verhalten, das der Fortpflanzung dient: Verarbeitung
sexueller Signale (Formen, Stimme, Bewegungsmuster, Pheromone,
Pupillenweite, Berührung), Koordination hormonell-vegetativer
Reaktionen
 Beteiligung an der Steuerung des Schlaf-Wach-Rhythmus
Beteiligung an der Steuerung des Schlaf-Wach-Rhythmus  s. dort.
s. dort.
Diese Verhaltensmuster bedingen ein enges Zusammenspiel zwischen
 autonomem
autonomem (=vegetativem) Nervensystem - z.B. Koordination von Reflexen,
 limbischem System
limbischem System (Hippocampus, Amygdala, Septumkerne usw) - Kontrolle von Gefühlen und Verhaltensabläufen,

motorischen und sensorischen Systemen.
Hypothalamus
|
Nucleus
|
Funktion / Stimulationseffekt
|
Effekt einer Läsion
|
suprachiasmaticus
|
Einstellen der zirkadianen Rhythmik
|
Wegfall der zirkadianen Periodik
|
supraopticus / paraventricularis
|
Anstieg von Blutvolumen, Blutdruck, Metabolismus
|
Diabetes insipidus
|
lateralis
|
Erhöhte Nahrungsaufnahme
|
Appetitlosigkeit
|
ventromedialis
|
Erniedrigte Nahrungsaufnahme
|
Hungerzustände
|
dorsomedialis
|
sham rage*
|
Abnahme des Aggressionspegels
|
corpus mamillare
|
-
|
Übergang Kurz- zu Langzeitgedächtnis defekt
|
*
Unter sham rage
("vorgetäuschter Wut") versteht man experimentell im Tierversuch
herbeigeführte Verhaltensänderungen (Krümmung des Rückens, Fauchen,
Ausfahren der Krallen, Beißen) bei Stimulation des nucl. dormomedialis
oder Abtragung der Großhirnrinde. Der Begriff wurde von Walter B. Cannon geprägt (von ihm stammt auch der Begriff der Fight-or-flight response und das Konzept der Homöostase, veröffentlicht in seinem 1932 erschienenen Buch "The Wisdom of the Body").
Von hypothalamischen Nervenzellen freigesetzte Signalstoffe
 wirken zum Teil als synaptische Transmitter auf andere Nervenzellen,
wirken zum Teil als synaptische Transmitter auf andere Nervenzellen,
 teils werden sie über neuronalen Transport in den Hypophysenhinterlappen befördert (etwa 105 Neurone mit Zellkörpern in den nucl. supraopticus und paraventricularis), aus dem sie bei Erregung der Neurone freigesetzt werden,
teils werden sie über neuronalen Transport in den Hypophysenhinterlappen befördert (etwa 105 Neurone mit Zellkörpern in den nucl. supraopticus und paraventricularis), aus dem sie bei Erregung der Neurone freigesetzt werden,
 teils (in der eminentia mediana) in das Blut des
hypothalamisch-hypophysären Pfortadersystems freigesetzt und wirken
auf den Vorderlappen ein (Releasing- und Inhibiting-Faktoren = Liberine und Statine).
teils (in der eminentia mediana) in das Blut des
hypothalamisch-hypophysären Pfortadersystems freigesetzt und wirken
auf den Vorderlappen ein (Releasing- und Inhibiting-Faktoren = Liberine und Statine).
 Abbildung: Zentrales autonomes Netzwerk
Abbildung: Zentrales autonomes Netzwerk
Nach
Riganello F, Vatrano M;, Cortese MD, Tonin P, Soddu A: Central
autonomic network and early prognosis in patients with disorders of
consciousness. Sci Rep 2024; 14: 1610
Die
Abbildung zeigt das Konzept eines zentralen Netzwerks des autonomen
Systems. Die Interaktion zwischen autonomem und zentralem Nervensystem
dient dem Abgleich innerer und äußerer Anforderungen an homöostatische
Regelmechanismen.
Im Großhirn beeinflussen Präfrontalkortex, gyrus cinguli, Insel, basales
Vorderhirn, Hypothalamus, nucleus accumbens und der zentrale
Amygdalakern an der Kontrolle von Verhalten, Bewusstsein (Interozeption), Emotionen,
Stressantworten.
Im Tegmentum übernimmt das zentrale Höhlengrau das Zusammenführen von Aspekten des Arousal mit solchen der Schmerzmodulation.
In der Brücke (pons) befassen sich der parabrachiale Kern und der locus coeruleus, in der medulla oblongata (nucleus tractus solitarii, dorsale motorische Kerne des N. vagus, ventrolaterale Neurone) mit tonischer Kontrolle des Blutdrucks, Atemrhythmen und Reflexen (Kreislauf, Respiration, Verdauung, Blasenfunktion).
Über das Rückenmark
wirken autonom-nervöse Bahnen und Ganglien über vegetative Reflexe auf
die jeweiligen Zielorgane (z.B. das Herz). Diese wiederum senden via
sensorische Afferenzen Information über ihren aktuellen Zustand zurück
an das ZNS

Der Hypothalamus ist ein Bindeglied bei der neuro-humoralen Koordination und ein wichtiger Bestandteil eines Gesamtsystems, das als zentrales autonomes Netzwerk (central autonomic network
CAN) bezeichnet wird ( Abbildung). Er erhält Impulse von
Abbildung). Er erhält Impulse von
 übergeordneten Gebieten (Großhirnrinde, limbisches System, Thalamus)
übergeordneten Gebieten (Großhirnrinde, limbisches System, Thalamus)
 Afferenzen aus der Peripherie
Afferenzen aus der Peripherie
 Rezeptoren im Hypothalamus selbst (diese messen Hormonspiegel, Metaboliten wie Glukose und Fettsäuren, Osmolalität, Temperatur). Rezeptoren erlauben Gegensteuerung im
Sinne einer negativen Rückkopplung, z.T. neuronal, z.T. durch Liberine
und Statine.
Rezeptoren im Hypothalamus selbst (diese messen Hormonspiegel, Metaboliten wie Glukose und Fettsäuren, Osmolalität, Temperatur). Rezeptoren erlauben Gegensteuerung im
Sinne einer negativen Rückkopplung, z.T. neuronal, z.T. durch Liberine
und Statine.
 Wärmerezeptoren veranlassen bei Erhöhung der Bluttemperatur über einen
Schwellenwert (z.B. 37,0°C) vermehrte Wärmeabgabe des Körpers über die
Haut
Wärmerezeptoren veranlassen bei Erhöhung der Bluttemperatur über einen
Schwellenwert (z.B. 37,0°C) vermehrte Wärmeabgabe des Körpers über die
Haut
 Osmorezeptoren messen die Osmolalität des Blutes
und regen bei Erhöhung Durstempfinden und Vasopressinfreisetzung an,
hemmen bei Erniedrigung das Vasopressinsystem und fördern die Aldosteronbildung
Osmorezeptoren messen die Osmolalität des Blutes
und regen bei Erhöhung Durstempfinden und Vasopressinfreisetzung an,
hemmen bei Erniedrigung das Vasopressinsystem und fördern die Aldosteronbildung
 Hormonrezeptoren sprechen auf die Konzentration von T3/T4, Cortisol,
Östradiol und Progesteron, Testosteron und Dihydrotestosteron
an und korrigieren dementsprechend die Freisetzung von Liberinen und Statinen.
Hormonrezeptoren sprechen auf die Konzentration von T3/T4, Cortisol,
Östradiol und Progesteron, Testosteron und Dihydrotestosteron
an und korrigieren dementsprechend die Freisetzung von Liberinen und Statinen.
Der
Hypothalamus kontrolliert die meisten autonomen (vegetativen)
Funktionen. Er erhält Impulse aus dem Großhirn und projiziert auf
Hirnstamm und Rückenmark. So steuert er sympathische und
parasympathische Aktivität. Die wichtigsten Verbindungsbahnen sind das
mediale Vorderhirnbündel und der fasciculus longitudinalis dorsalis.
Das mediale Vorderhirnbündel (fasciculus medialis telencephali, medial forebrain bundle) ist Teil eines Belohnungssystems (zu diesem gehört der nucl. accumbens), das auf die Brodmann-Areale 8 bis 11 projiziert und sowohl auf- als auch absteigende Bahnen enthält.
Das hintere Längsbündel
(fasciculus longitudinalis dorsalis, Schütz'sches Bündel) zieht vom
Hypothalamus (corpora mamillaria) zur medulla oblongata und verbindet
parasympathische Hirnnervenkerne (Edinger-Westphal, nucll. salivatorii,
nucl. dorsalis N. vagi). Es enthält ebenfalls sowohl auf- als auch absteigende Fasern und beteiligt sich an den meisten autonom-nervösen Regulationsvorgängen.
Magno- und parvozelluläre Gebiete
Der Hypothalamus trägt intensiv zur Steuerung des autonomen Nervensystems (lateraler Hypothalamus) und neurosekretorischer Zellen (medialer Hypothalamus) bei.

Abbildung: Vasopressinneurone und hypothalamisch-hypophysäres System
Nach
Koshimitsu T et al, Vasopressin V1a and V1b Receptors: From Molecules
to Physiological Systems, Physiol Rev 2012; 92: 1814-64
Vasopressinproduzierende Neuronen bilden das Hormon als Präprohormon und verwandeln es während des Transfers in die Axonperipherie zu Vasopressin (=Adiuretin, antidiuretisches Hormon ADH).
Axone von magnozellulären Nervenzellen - deren Körper im nucl. paraventricularis (PVN) und supraopticus (SON) liegen - speichern das Hormon in Form von Herring-Körperchen
 . Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System").
. Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System").
Parvozelluläre
Vasopressinneurone im PVN hingegen enden an äußeren Kapillarnetzen der
eminentia mediana und setzen hier
Vasopressin frei, das über hypothalamisch-hypophysäre Pfortadergefäße
in den Vorderlappen gelangt und hier die Freisetzung von ACTH anregt

Neurosekretorische Zellen des Hypothalamus:
 Großzellige (magnozelluläre)
Gebiete im vorderen Hypothalamus: Hierzu gehören der nucl. supraopticus
und Teile des nucl. paraventricularis. Diese Zellen bilden Vasopressin
und Oxytozin, die über axonalen Transport in den Hypophysenhinterlappen
gelangen und in Herring-Körperchen zwischengespeichert werden, bis sie
- durch Aktionspotentiale getriggert - in Hinterlappengefäße angegeben
werden (
Großzellige (magnozelluläre)
Gebiete im vorderen Hypothalamus: Hierzu gehören der nucl. supraopticus
und Teile des nucl. paraventricularis. Diese Zellen bilden Vasopressin
und Oxytozin, die über axonalen Transport in den Hypophysenhinterlappen
gelangen und in Herring-Körperchen zwischengespeichert werden, bis sie
- durch Aktionspotentiale getriggert - in Hinterlappengefäße angegeben
werden (  Abbildung).
Abbildung).
 Kleinzellige (parvozelluläre)
Gebiete im medialen Hypothalamus: Sie setzen im Bereich der eminentia
mediana ihre Hormone in den Pfortaderkerislauf frei. Die Hormone
gelangen in den Hypophysenvorderlappen (
Kleinzellige (parvozelluläre)
Gebiete im medialen Hypothalamus: Sie setzen im Bereich der eminentia
mediana ihre Hormone in den Pfortaderkerislauf frei. Die Hormone
gelangen in den Hypophysenvorderlappen (  Abbildung), wo Vasopressin über V1-Rezeptoren die Freisetzung von ACTH anregt. Dadurch wirkt es synergistisch mit CRH und fördert die Freisetzung von Glucocorticoiden.
Abbildung), wo Vasopressin über V1-Rezeptoren die Freisetzung von ACTH anregt. Dadurch wirkt es synergistisch mit CRH und fördert die Freisetzung von Glucocorticoiden.
Gemeinsame Aufgabe des vegetativ-nervösen Systems und der Hormone sind

Stabilisierung und Steuerung des Stoffwechsels

Einstellung des “inneren Milieus” (Temperatur, Kreislauf, Atmung, Wasser- und Elektrolythaushalt)

Steuerung von Wachstum und Reifung

Überwachung der Funktion der Fortpflanzungsorgane.
Der Hypothalamus beeinflusst
somato-motorische Funktionen über eine Kreisschaltung zwischen
limbischem System und formatio reticularis. Emotionell-psychische Impulse und Umweltreize
beeinflussen diese Steuerungstätigkeiten.
 Bereits als Student forschte der Schweizer Walter Rudolf Hess
an physiologischen Fragestellungen. Dann arbeitete er als Augenarzt,
bis er sich wieder der Physiologie zuwandte und ab 1917 als Ordinarius
in Zürich wirkte. Ab 1920 führte er seine bahnbrechenden Versuche mit
"unterbrochener Gleichstromreizung" am Gehirn durch. Seine Elektroden
hatten einen Durchmesser von lediglich 1/4 mm. Mittels punktgenauer
Stimulation im Hypothalamus
konnte er verschiedenste vegetative Reaktionen und Verhaltensänderungen
der Versuchstiere auslösen. 1949 erhielt er den Nobelpreis für
Physiologie oder Medizin "für die Entdeckung der funktionellen
Organisation des Zwischenhirns für die Koordination der Tätigkeit von
inneren Organen".
Bereits als Student forschte der Schweizer Walter Rudolf Hess
an physiologischen Fragestellungen. Dann arbeitete er als Augenarzt,
bis er sich wieder der Physiologie zuwandte und ab 1917 als Ordinarius
in Zürich wirkte. Ab 1920 führte er seine bahnbrechenden Versuche mit
"unterbrochener Gleichstromreizung" am Gehirn durch. Seine Elektroden
hatten einen Durchmesser von lediglich 1/4 mm. Mittels punktgenauer
Stimulation im Hypothalamus
konnte er verschiedenste vegetative Reaktionen und Verhaltensänderungen
der Versuchstiere auslösen. 1949 erhielt er den Nobelpreis für
Physiologie oder Medizin "für die Entdeckung der funktionellen
Organisation des Zwischenhirns für die Koordination der Tätigkeit von
inneren Organen".

Schon im frühen Kindesalter kann es zum Auftreten eines Attention Deficit / Hyperactivity Syndrome (ADHS, Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung)
kommen. Bei diesen Patienten ist die Aktivität im Präfrontalcortex
betroffen, dies hängt offenbar mit Veränderungen in den Dopamin-,
Serotonin- und/oder Noradrenalinsystemen des Hirnstamms zusammen.
 Dementsprechend versucht man, diese Systeme pharmakologisch zu
beeinflussen, z.B. mit Methylphenidat (Ritalin): Dieses hemmt präsynaptische Wiederaufnahme-Transporter (reuptake inhibition)
für Dopamin und Noradrenalin und erhöht dadurch deren synaptische
Verfügbarkeit und Wirkung; und es bindet an Serotoninrezeptoren.
Dementsprechend versucht man, diese Systeme pharmakologisch zu
beeinflussen, z.B. mit Methylphenidat (Ritalin): Dieses hemmt präsynaptische Wiederaufnahme-Transporter (reuptake inhibition)
für Dopamin und Noradrenalin und erhöht dadurch deren synaptische
Verfügbarkeit und Wirkung; und es bindet an Serotoninrezeptoren.

  Der Hirnstamm hat motorische, sensorische, vegetative, endokrine
Funktionen. Zu motorischen Aufgaben des Hirnstamms gehören
Körperstabilisierung (posturale Motorik, Halte- und Stellreflexe),
Schutzmotorik, Modulation von Lokomotionsautomatismen (Schreiten,
Laufen)
Der Hirnstamm hat motorische, sensorische, vegetative, endokrine
Funktionen. Zu motorischen Aufgaben des Hirnstamms gehören
Körperstabilisierung (posturale Motorik, Halte- und Stellreflexe),
Schutzmotorik, Modulation von Lokomotionsautomatismen (Schreiten,
Laufen)
 Die Medulla oblongata hat Chemorezeptoren (Säure-Basen-Haushalt) und
Reflexzentren für Kreislauf, Atmung, Ernährung. Viszerale Afferenzen
der Nn. facialis, glossopharyngeus, vagus informieren den nucleus
tractus solitarii über den Zustand in Carotissinus, Aortenbogen,
Herzräumen, Lunge und gastrointestinalem System. Der viszeromotorische
nucleus ambiguus erhält Afferenzen aus Großhirnrinde und Trigeminuskern
und projiziert auf Muskeln in Gaumen, Rachen und Kehlkopf
(Schluckvorgang, Sprechen)
Die Medulla oblongata hat Chemorezeptoren (Säure-Basen-Haushalt) und
Reflexzentren für Kreislauf, Atmung, Ernährung. Viszerale Afferenzen
der Nn. facialis, glossopharyngeus, vagus informieren den nucleus
tractus solitarii über den Zustand in Carotissinus, Aortenbogen,
Herzräumen, Lunge und gastrointestinalem System. Der viszeromotorische
nucleus ambiguus erhält Afferenzen aus Großhirnrinde und Trigeminuskern
und projiziert auf Muskeln in Gaumen, Rachen und Kehlkopf
(Schluckvorgang, Sprechen)
 Die Pons enthält Kerne für die Kommunikation zwischen Groß- und
Kleinhirn und kontrolliert die Freigabe des Detrusionsreflexes
(Steuerung der Blasenmotorik)
Die Pons enthält Kerne für die Kommunikation zwischen Groß- und
Kleinhirn und kontrolliert die Freigabe des Detrusionsreflexes
(Steuerung der Blasenmotorik)
 Das Mesencephalon beteiligt sich an der Extrapyramidalmotorik und steuert die Okulomotorik. Das Mesencephalon beteiligt sich an der Extrapyramidalmotorik und steuert die Okulomotorik.
-- Das Tegmentum erfüllt vegetative, sensorische und
motorische Aufgaben; es enthält Teile der formatio reticularis (Atem-
und Kreislaufzentrum), den fasciculus longitudinalis medialis
(Koordination der Blickbewegungen und Gleichgewicht), den fasciculus
longitudinalis dorsalis (Projektionsbahn des Hypothalamus) und wirkt
sich auf die meisten autonom-nervösen Funktionen des Körpers aus
-- Das Tectum (Vierhügelplatte): Die colliculi
superiores dienen visuellen Reflexen (Zielauswahl) und dienen als
Integrationsstelle für multisensorische, kontextuelle Information für
die Steuerung von Blickbewegungen; die colliculi inferiores dienen
Umschaltungen der Hörbahn
-- Das Prätektum ermöglicht den konsensuellen Pupillenreflex
-- Das zentrale Höhlengrau dient opioiderger Schmerzunterdrückung, es kann Panik auslösen
 Zum Diencephalon gehören Thalamus, Hypothalamus, Zirbeldrüse und
Subthalamus, Pallidum, Raphekerne und Coeruleuskerne. Es entsendet
noradrenerge (Wachheit, Aufmerksamkeit, Angst, Stress,
Blutdruckregulation), serotoninerge (aktivierendes retikuläres System, sensory processing,
Appetit, Körpertemperatur, Stimmungslage), dopaminerge (Motorik,
Psyche, Prolaktinfreisetzung) und cholinerge (Belohnung, Lernen,
Aufmerksamkeit, Gedächtnis) Projektionen in das Vorderhirn
Zum Diencephalon gehören Thalamus, Hypothalamus, Zirbeldrüse und
Subthalamus, Pallidum, Raphekerne und Coeruleuskerne. Es entsendet
noradrenerge (Wachheit, Aufmerksamkeit, Angst, Stress,
Blutdruckregulation), serotoninerge (aktivierendes retikuläres System, sensory processing,
Appetit, Körpertemperatur, Stimmungslage), dopaminerge (Motorik,
Psyche, Prolaktinfreisetzung) und cholinerge (Belohnung, Lernen,
Aufmerksamkeit, Gedächtnis) Projektionen in das Vorderhirn
 Wachheit und Bewusstsein werden durch Aktivität des aktivierenden
(aszendierenden) retikulären Systems (ARAS, auch extrathalamisches
Kontrollsystem) ermöglicht. Dieses reicht vom Hirnstamm über den
Thalamus bis zur Großhirnrinde, in seinem Zentrum steht die formatio
reticularis des Mittelhirns. Endo- (top down) oder exogen (bottom up) aktiviert, regt es den Cortex an
Wachheit und Bewusstsein werden durch Aktivität des aktivierenden
(aszendierenden) retikulären Systems (ARAS, auch extrathalamisches
Kontrollsystem) ermöglicht. Dieses reicht vom Hirnstamm über den
Thalamus bis zur Großhirnrinde, in seinem Zentrum steht die formatio
reticularis des Mittelhirns. Endo- (top down) oder exogen (bottom up) aktiviert, regt es den Cortex an
 Der Thalamus hat mehrere Funktionsbereiche: Sensorische (alle Sinne
außer olfaktorisch), motorische (von Basalganglien und Kleinhirn zur
Großhirnrinde), vegetative und emotionale (Teil limbischer
Kreisschaltungen). Die Kerne des Thalamus wirken viszerosensibel,
sensorisch, sensomotorisch und assoziativ
Der Thalamus hat mehrere Funktionsbereiche: Sensorische (alle Sinne
außer olfaktorisch), motorische (von Basalganglien und Kleinhirn zur
Großhirnrinde), vegetative und emotionale (Teil limbischer
Kreisschaltungen). Die Kerne des Thalamus wirken viszerosensibel,
sensorisch, sensomotorisch und assoziativ
 Der Hypothalamus konzentriert sich auf die Aufrechterhaltung der
Homöostase (Kreislauf, Atmung, Körpertemperatur, Metabolismus /
Nahrungsaufnahme, Flüssigkeitsbilanz, Osmolalität und Nierenfunktion,
vegetative Begleitung von Angriffs- oder Fluchtverhalten, Immunabwehr,
Schlaf-Wach-Rhythmus) und Verhaltenssteuerung
Der Hypothalamus konzentriert sich auf die Aufrechterhaltung der
Homöostase (Kreislauf, Atmung, Körpertemperatur, Metabolismus /
Nahrungsaufnahme, Flüssigkeitsbilanz, Osmolalität und Nierenfunktion,
vegetative Begleitung von Angriffs- oder Fluchtverhalten, Immunabwehr,
Schlaf-Wach-Rhythmus) und Verhaltenssteuerung
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Herring-Körperchen: Percy T. Herring
Herring-Körperchen: Percy T. Herring Medulla oblongata, nucl. tractus solitarii
Medulla oblongata, nucl. tractus solitarii  Pons, Mesencephalon
Pons, Mesencephalon  Projektionen aus dem Hirnstamm
Projektionen aus dem Hirnstamm  Wachheit, Aufmerksamkeit, Bewusstsein
Wachheit, Aufmerksamkeit, Bewusstsein  Zwischenhirn
Zwischenhirn  Thalamus
Thalamus  Hypothalamus
Hypothalamus
 Magno- und parvozelluläre Gebiete
Magno- und parvozelluläre Gebiete Basales Vorderhirn
Basales Vorderhirn  Epithalamus
Epithalamus
 Core messages
Core messages
 Absteigende motorische Bahnen für Stamm und Extremitäten (tr. corticospinalis)
Absteigende motorische Bahnen für Stamm und Extremitäten (tr. corticospinalis) 
 Aufsteigende sensorische Bahnen aus Stamm und Extremitäten (tr. spinothalamicus, Hintersäulen)
Aufsteigende sensorische Bahnen aus Stamm und Extremitäten (tr. spinothalamicus, Hintersäulen) 
 Hirnnervenkerne und -faszikel (=Verbindung Kern-Nerv) im dorsalen Hirnstamm (motorische eher medial, sensorische lateral)
Hirnnervenkerne und -faszikel (=Verbindung Kern-Nerv) im dorsalen Hirnstamm (motorische eher medial, sensorische lateral)
 Pedunculi cerebellares (Verbindungen mit dem Kleinhirn) im dorsalen Hirnstamm
Pedunculi cerebellares (Verbindungen mit dem Kleinhirn) im dorsalen Hirnstamm
 Retikuläres System und aufsteigende Projektionssysteme
Retikuläres System und aufsteigende Projektionssysteme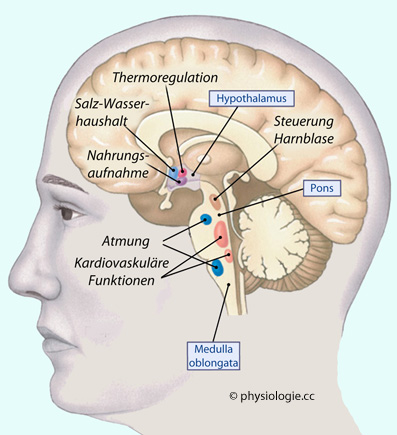
 Abbildung: Vegetative Zentren im Hirnstamm
Abbildung: Vegetative Zentren im Hirnstamm
 Zu motorischen Aufgaben des Hirnstamms s. dort.
Zu motorischen Aufgaben des Hirnstamms s. dort.  die Stabilisierung des Körpers gegen die Wirkung der Schwerkraft (posturale Motorik: Halte- und Stellreflexe)
die Stabilisierung des Körpers gegen die Wirkung der Schwerkraft (posturale Motorik: Halte- und Stellreflexe) Schutzreflexe, wie Corneal-, Husten-, Nies- und Würgereflex
Schutzreflexe, wie Corneal-, Husten-, Nies- und Würgereflex die Modulation des Lokomotionsgenerators im Rückenmark, wie die Anpassung der Gehbewegungen an die Geschwindigkeit der Fortbewegung (Schreiten bis Laufen).
die Modulation des Lokomotionsgenerators im Rückenmark, wie die Anpassung der Gehbewegungen an die Geschwindigkeit der Fortbewegung (Schreiten bis Laufen). Einer
der zentralen Kerne der medulla oblongata ist der nucleus tractus
solitarii (
Einer
der zentralen Kerne der medulla oblongata ist der nucleus tractus
solitarii ( Abbildungen unten). Er besteht aus einer Gruppe von Kernen, die viszerale
Afferenzen aus dem N. facialis (VII), glossopharyngeus (IX) und vagus
(X) über den Zustand folgender Systeme erhalten:
Abbildungen unten). Er besteht aus einer Gruppe von Kernen, die viszerale
Afferenzen aus dem N. facialis (VII), glossopharyngeus (IX) und vagus
(X) über den Zustand folgender Systeme erhalten:  von kardiovaskulären Rezeptoren (Carotissinus, Aortenbogen, Herzräume, Lungengefäße: Kreislaufreflexe)
von kardiovaskulären Rezeptoren (Carotissinus, Aortenbogen, Herzräume, Lungengefäße: Kreislaufreflexe) aus dem Respirationssystem (Chemorezeptoren: Atmungssteuerung)
aus dem Respirationssystem (Chemorezeptoren: Atmungssteuerung) aus dem gastrointestinalen System (Mechano- und Chemorezeptoren, Beeinflussung des Nahrungsaufnahmeverhaltens)
aus dem gastrointestinalen System (Mechano- und Chemorezeptoren, Beeinflussung des Nahrungsaufnahmeverhaltens) von Geschmacksrezeptoren (daher auch "Geschmackskern": Speichelsekretion, Kaubewegungen, Schluckreflex).
von Geschmacksrezeptoren (daher auch "Geschmackskern": Speichelsekretion, Kaubewegungen, Schluckreflex). sensorische Informationen aus dem Mittelohr (plexus tympanicus)
sensorische Informationen aus dem Mittelohr (plexus tympanicus)
 Abbildung: Kerngebiete im Hirnstamm des Menschen
Abbildung: Kerngebiete im Hirnstamm des Menschen
 Über Hirnnerven und ihre Funktionen s. dort
Über Hirnnerven und ihre Funktionen s. dort Im Tegmentum der medulla oblongata befindet sich der nucleus ambiguus
Im Tegmentum der medulla oblongata befindet sich der nucleus ambiguus  (
( Abbildung rechts unten), ein viszeromotorischer Kern, der Afferenzen aus der Großhirnrinde sowie
dem Spinalkern des Trigeminus (V.) erhält. Seine Efferenzen ziehen über den
IX., X. und XI. Hirnnerven zu Muskeln des Rachens,
Gaumens und Kehlkopfs; dadurch beeinflusst er u.a. den Schluckvorgang sowie für das Sprechen benötigte motorische Systeme.
Abbildung rechts unten), ein viszeromotorischer Kern, der Afferenzen aus der Großhirnrinde sowie
dem Spinalkern des Trigeminus (V.) erhält. Seine Efferenzen ziehen über den
IX., X. und XI. Hirnnerven zu Muskeln des Rachens,
Gaumens und Kehlkopfs; dadurch beeinflusst er u.a. den Schluckvorgang sowie für das Sprechen benötigte motorische Systeme.  Die Brücke
(pons) stellt sozusagen ein Verbindungsstück zwischen Rückenmark, Kleinhirn und Mittelhirn dar.
Die Brücke
(pons) stellt sozusagen ein Verbindungsstück zwischen Rückenmark, Kleinhirn und Mittelhirn dar.  Sie beinhaltet zahlreiche Nervenbahnen, Teile der formatio
reticularis und Brückenkerne für die Kommunikation zwischen Groß- und Kleinhirn.
Sie beinhaltet zahlreiche Nervenbahnen, Teile der formatio
reticularis und Brückenkerne für die Kommunikation zwischen Groß- und Kleinhirn.  Die Brücke ist ein wichtiges Zentrum für die Kontrolle eines Teils der Blickbewegungen - sie enthält die Abducenskerne (VI. Hirnnerv), welche Abduktionsbewegungen der Augen steuern (Blick nach lateral).
Die Brücke ist ein wichtiges Zentrum für die Kontrolle eines Teils der Blickbewegungen - sie enthält die Abducenskerne (VI. Hirnnerv), welche Abduktionsbewegungen der Augen steuern (Blick nach lateral).  Sie beteiligt sich an der Verwaltung vestibulärer Funktionen (z.B. Erhaltung des Gleichgewichts).
Sie beteiligt sich an der Verwaltung vestibulärer Funktionen (z.B. Erhaltung des Gleichgewichts). Die Brücke enthält die obere Olive, eine zentrale Schaltstelle der Hörbahn.
Die Brücke enthält die obere Olive, eine zentrale Schaltstelle der Hörbahn. Der obere Anteil der Brücke beteiligt sich an der Steuerung der Harnblase (Kontrolle des sakralen Detrusionsreflexes).
Der obere Anteil der Brücke beteiligt sich an der Steuerung der Harnblase (Kontrolle des sakralen Detrusionsreflexes). Das Mittelhirn
(mesencephalon, midbrain) beinhaltet ebenfalls massive Nervenstränge (crura cerebri), ist an der
Extrapyramidalmotorik beteiligt.
Das Mittelhirn ist an der Bildung komplexer motorischer Muster
beteiligt, so generiert es bei Reizung einer als mesencephalic locomotor region
(MLR) bezeichneten Neuronengruppe Schreitbewegungen (Zunahme der
Reizstärke kann z.B. bei Versuchstieren den Übergang von Trab- auf
Galopp-Motorik bewirken). Langsame und rasche lokomotorische
Bewegungsmuster scheinen dabei von unterschiedlichen glutamatergen
Neuronengruppen angeregt zu werden (langsame von Zellen des
pedunculopontinen Kerns, rasche von Zellen des nucleus cuneiformis).
Neben der Lokomotion kontrolliert der Hirnstamm (z.B. über die formatio
reticularis) eine Fülle weiterer Bewegungsmuster, inklusive die Okulomotorik
Das Mittelhirn
(mesencephalon, midbrain) beinhaltet ebenfalls massive Nervenstränge (crura cerebri), ist an der
Extrapyramidalmotorik beteiligt.
Das Mittelhirn ist an der Bildung komplexer motorischer Muster
beteiligt, so generiert es bei Reizung einer als mesencephalic locomotor region
(MLR) bezeichneten Neuronengruppe Schreitbewegungen (Zunahme der
Reizstärke kann z.B. bei Versuchstieren den Übergang von Trab- auf
Galopp-Motorik bewirken). Langsame und rasche lokomotorische
Bewegungsmuster scheinen dabei von unterschiedlichen glutamatergen
Neuronengruppen angeregt zu werden (langsame von Zellen des
pedunculopontinen Kerns, rasche von Zellen des nucleus cuneiformis).
Neben der Lokomotion kontrolliert der Hirnstamm (z.B. über die formatio
reticularis) eine Fülle weiterer Bewegungsmuster, inklusive die Okulomotorik
 .
.
 Abbildung: Hirnstamm - Kerne und Bahnen
Abbildung: Hirnstamm - Kerne und Bahnen
 Nucleus ruber und Teile der substantia nigra (Extrapyramidalmotorik)
Nucleus ruber und Teile der substantia nigra (Extrapyramidalmotorik) Hirnnervenkerne
- nucl. N. oculomotorii (III), nucl. N. trochlearis (IV), nucl.
accessorius N. oculomotorii (Edinger-Westphal-Kern), nucl.
mesencephalicus N. trigemini (V)
Hirnnervenkerne
- nucl. N. oculomotorii (III), nucl. N. trochlearis (IV), nucl.
accessorius N. oculomotorii (Edinger-Westphal-Kern), nucl.
mesencephalicus N. trigemini (V) Teile der formatio reticularis (vegetative, sensorische und motorische Aufgaben)
Teile der formatio reticularis (vegetative, sensorische und motorische Aufgaben) Fasciculus longitudinalis medialis
(grün in der
Fasciculus longitudinalis medialis
(grün in der  Abbildung; Koordination der Blickbewegungen, auch mit
Rücksicht auf den Gleichgewichtssinn: Verknüpfung der vestibularis- mit
den okulomotorischen Hirnnervenkernen)
Abbildung; Koordination der Blickbewegungen, auch mit
Rücksicht auf den Gleichgewichtssinn: Verknüpfung der vestibularis- mit
den okulomotorischen Hirnnervenkernen) Der fasciculus longitudinalis dorsalis
(Schütz'sches Bündel) ist eine lange Projektionsbahn des Hypothalamus.
Er zieht vom Mamillarkörper zur medulla oblongata und verbindet den Edinger-Westphal-Kern
(nucl. accessorius N. oculomotorii), die Salivatoriuskerne und den
nucl. dorsalis N. vagi miteinander. Er leitet sensorische und
motorische Information im vegetativen System und wirkt sich auf die
meisten autonom-nervösen Funktionen des Körpers aus.
Der fasciculus longitudinalis dorsalis
(Schütz'sches Bündel) ist eine lange Projektionsbahn des Hypothalamus.
Er zieht vom Mamillarkörper zur medulla oblongata und verbindet den Edinger-Westphal-Kern
(nucl. accessorius N. oculomotorii), die Salivatoriuskerne und den
nucl. dorsalis N. vagi miteinander. Er leitet sensorische und
motorische Information im vegetativen System und wirkt sich auf die
meisten autonom-nervösen Funktionen des Körpers aus. Tractus tegmentalis centralis ("zentrale Haubenbahn", leitet extrapyramidalmotorische Fasern)
Tractus tegmentalis centralis ("zentrale Haubenbahn", leitet extrapyramidalmotorische Fasern) Das dorsal gelegene Mittelhirndach (Tectum) wird wegen seiner anatomischen Struktur als Vierhügelplatte
bezeichnet. Ursprünglich nahm man an, dass die oberen Vierhügel rein
visuelle, die unteren nur auditive Information verarbeiten; tatsächlich
überlappen sich diese Bereiche. Einige Neuronen reagieren auf beide sensorischen Eingänge, es besteht funktionelle Synergie.
Das dorsal gelegene Mittelhirndach (Tectum) wird wegen seiner anatomischen Struktur als Vierhügelplatte
bezeichnet. Ursprünglich nahm man an, dass die oberen Vierhügel rein
visuelle, die unteren nur auditive Information verarbeiten; tatsächlich
überlappen sich diese Bereiche. Einige Neuronen reagieren auf beide sensorischen Eingänge, es besteht funktionelle Synergie. Die oberen Vierhügel (colliculi superiores) dienen visuellen Reflexen. Zusätzlich spielen sie eine Rolle für motorische Zielauswahl,
insbesondere wenn sensorische Reize (visuelle, somatosensorische,
auditive) diese Funktion (insbesondere die Auslösung und Steuerung von Sakkaden) anregen. Sie
empfangen auch Impulse von Großhirnrinde (supplementäres Augenfeld, dorsolateraler Präfrontalcortex, parietale Systeme) und substantia nigra
(pars reticulata).
Die oberen Vierhügel (colliculi superiores) dienen visuellen Reflexen. Zusätzlich spielen sie eine Rolle für motorische Zielauswahl,
insbesondere wenn sensorische Reize (visuelle, somatosensorische,
auditive) diese Funktion (insbesondere die Auslösung und Steuerung von Sakkaden) anregen. Sie
empfangen auch Impulse von Großhirnrinde (supplementäres Augenfeld, dorsolateraler Präfrontalcortex, parietale Systeme) und substantia nigra
(pars reticulata). 
 Abbildung: Lage der Vierhügelplatte im Hirnstamm
Abbildung: Lage der Vierhügelplatte im Hirnstamm Zu Hirnnerven s. dort, zur Epiphyse s. dort
Zu Hirnnerven s. dort, zur Epiphyse s. dort
 Die unteren Vierhügel (colliculi inferiores) dienen Umschaltungen und Informationsmodifikation in der Hörbahn.
Sie beteiligen sich an der Lokalisation von Schallquellen, sowie an
Reflexen für entsprechende Zuwendungsmotorik der Augen und des Kopfes
(Orientierung hin zur Schallquelle). Hier konvergiert Information über
die Charakteristika und die Entstehungsorte von Schallmustern. Die
Regionen sind entsprechend der Tonhöhe der Reize angeordnet (Tonotopie).
Die unteren Vierhügel (colliculi inferiores) dienen Umschaltungen und Informationsmodifikation in der Hörbahn.
Sie beteiligen sich an der Lokalisation von Schallquellen, sowie an
Reflexen für entsprechende Zuwendungsmotorik der Augen und des Kopfes
(Orientierung hin zur Schallquelle). Hier konvergiert Information über
die Charakteristika und die Entstehungsorte von Schallmustern. Die
Regionen sind entsprechend der Tonhöhe der Reize angeordnet (Tonotopie). Das Prätectum
(area praetectalis) besteht aus mehreren Kernen und ist Teil des
visuellen Mittelhirns. Es erhält sensorische Information aus der
Netzhaut und sendet Impulse an beide Edinger-Westphal-Kerne. Es ermöglicht so den konsensuellen Pupillenreflex (symmetrische Reaktion beider Pupillen auch bei Beleuchtung nur eines Auges). Weiters ist es in die Steuerung optikonetischer Reflexe
involviert, welche der Stabilisierung des Netzhautbildes dienen. Auch
beteiligt es sich an der Bearbeitung somatosensorischer Informationen
(inklusive Schmerz).
Das Prätectum
(area praetectalis) besteht aus mehreren Kernen und ist Teil des
visuellen Mittelhirns. Es erhält sensorische Information aus der
Netzhaut und sendet Impulse an beide Edinger-Westphal-Kerne. Es ermöglicht so den konsensuellen Pupillenreflex (symmetrische Reaktion beider Pupillen auch bei Beleuchtung nur eines Auges). Weiters ist es in die Steuerung optikonetischer Reflexe
involviert, welche der Stabilisierung des Netzhautbildes dienen. Auch
beteiligt es sich an der Bearbeitung somatosensorischer Informationen
(inklusive Schmerz). Das zentrale Höhlengrau dient u.a. der Verwaltung somatischer und viszeraler Stereotypen, beeinflusst das 'fight or flight'-Verhalten, kann starke Gefühlsregungen (Panik) auslösen, und dient der opioidergen Schmerzunterdrückung.
Das zentrale Höhlengrau dient u.a. der Verwaltung somatischer und viszeraler Stereotypen, beeinflusst das 'fight or flight'-Verhalten, kann starke Gefühlsregungen (Panik) auslösen, und dient der opioidergen Schmerzunterdrückung.
 Abbildung: Projektionen aus dem Hirnstamm
Abbildung: Projektionen aus dem Hirnstamm Die substantia nigra
(nucleus niger) wirkt dopaminerg. Sie liegt im oberen / anterioren Teil
des Mesencephalon und wird vor allem von anderen Neuronen des Striatum
beeinflusst. Sie projiziert hauptsächlich in das Putamen und den
nucleus caudatus (nigrostriatales System), den Hypothalamus sowie
andere Teile des limbischen Systems. Die substantia nigra ist ein
Zentrum der motorischen Steuerung (s. dort).
Die substantia nigra
(nucleus niger) wirkt dopaminerg. Sie liegt im oberen / anterioren Teil
des Mesencephalon und wird vor allem von anderen Neuronen des Striatum
beeinflusst. Sie projiziert hauptsächlich in das Putamen und den
nucleus caudatus (nigrostriatales System), den Hypothalamus sowie
andere Teile des limbischen Systems. Die substantia nigra ist ein
Zentrum der motorischen Steuerung (s. dort). Die formatio reticularis
enthält gigantozelluläre cholinerge Neurone, die sich in der Zone von
Mittelhirn bis medulla oblongata befinden und Fasern zu Großhirn und
Rückenmark entsenden. Diese Zellen stehen unter dem Einfluss des
zentralen Höhlengraus, des Hypothalamus und des zentralen Amagdalakerns
und korrespondieren mit kleineren Neuronen der formatio reticularis.
Sie koordinieren Kopf- und Augenbewegungen, modifizieren den Tonus der
Stamm- und Extremitätenmuskulatur, können Herzfrequenz und Blutdruck
senken und beteiligen sich an zentraler Schmerzhemmung.
Die formatio reticularis
enthält gigantozelluläre cholinerge Neurone, die sich in der Zone von
Mittelhirn bis medulla oblongata befinden und Fasern zu Großhirn und
Rückenmark entsenden. Diese Zellen stehen unter dem Einfluss des
zentralen Höhlengraus, des Hypothalamus und des zentralen Amagdalakerns
und korrespondieren mit kleineren Neuronen der formatio reticularis.
Sie koordinieren Kopf- und Augenbewegungen, modifizieren den Tonus der
Stamm- und Extremitätenmuskulatur, können Herzfrequenz und Blutdruck
senken und beteiligen sich an zentraler Schmerzhemmung.  Der locus coeruleus
an der Grenze zwischen Mittelhirn und Brücke steht unter dem Einfluss
von Präfrontalcortex (dessen anregende Wirkung mit der Aktivität der
Person zunimmt), Hypothalamus und anderen Hirnstammkernen. Er entsendet
noradrenerge Fasern zum Gehirn (sowohl anregende als auch hemmende
Wirkungen) und zum Kleinhirn.
Der locus coeruleus
an der Grenze zwischen Mittelhirn und Brücke steht unter dem Einfluss
von Präfrontalcortex (dessen anregende Wirkung mit der Aktivität der
Person zunimmt), Hypothalamus und anderen Hirnstammkernen. Er entsendet
noradrenerge Fasern zum Gehirn (sowohl anregende als auch hemmende
Wirkungen) und zum Kleinhirn. Die Raphekerne
im medianen Bereich von Pons und medulla oblongata enthalten zahlreiche
serotoninerge Neurone. Diese haben Efferenzen zu anderen
Teilen des Zentralnervensystems, stehen mit diesen in wechselseitiger
Beziehung und wirken schmerzhemmend, auf den Wachheitszustand,
beeinflussen die Mororik u.a.
Die Raphekerne
im medianen Bereich von Pons und medulla oblongata enthalten zahlreiche
serotoninerge Neurone. Diese haben Efferenzen zu anderen
Teilen des Zentralnervensystems, stehen mit diesen in wechselseitiger
Beziehung und wirken schmerzhemmend, auf den Wachheitszustand,
beeinflussen die Mororik u.a.
 Funktion der Basalganglien von kontinuierlicher
dopaminerger Anregung (nigrostriatal: Projektionen der substantia nigra auf das Striatum) abhängig
Funktion der Basalganglien von kontinuierlicher
dopaminerger Anregung (nigrostriatal: Projektionen der substantia nigra auf das Striatum) abhängig serotoninerge Projektionen modulieren motorische Programme
serotoninerge Projektionen modulieren motorische Programme noradrenerge unterstützen die Aufmerksamkeit und stimulieren motorische
Vorderhornzellen.
noradrenerge unterstützen die Aufmerksamkeit und stimulieren motorische
Vorderhornzellen.  Insgesamt erleichtert monoaminerge Anregung die
motorische Aktivität und spielt für Motivation und
Belohnungsmechanismen eine wichtige Rolle.
Insgesamt erleichtert monoaminerge Anregung die
motorische Aktivität und spielt für Motivation und
Belohnungsmechanismen eine wichtige Rolle. einerseits das sensorische Gating (sensory gating, Unterdrückung jeweils irrelevanter Reize) von Afferenzen zum Thalamus steuern,
einerseits das sensorische Gating (sensory gating, Unterdrückung jeweils irrelevanter Reize) von Afferenzen zum Thalamus steuern, andererseits die generelle kortikale Aktivität
über Projektionen aus dem Hirnstamm regulieren.
andererseits die generelle kortikale Aktivität
über Projektionen aus dem Hirnstamm regulieren. Der Hirnstamm enthält Kerngebiete, die monoaminerg (noradrenerg, serotoninerg, dopaminerg,
histaminerg) sowie cholinerg auf andere Teile des Gehirns projizieren und eine Fülle von
Effekten auf Motorik, Wachheit, Aufmerksamkeit, Schmerzempfinden und
Gemütslage ausüben. Der Hypothalamus enthält weiters Neuronen, die
orexinerg auf Wachheit, Aufmerksamkeit und Nahrungsaufnahme wirken.
Der Hirnstamm enthält Kerngebiete, die monoaminerg (noradrenerg, serotoninerg, dopaminerg,
histaminerg) sowie cholinerg auf andere Teile des Gehirns projizieren und eine Fülle von
Effekten auf Motorik, Wachheit, Aufmerksamkeit, Schmerzempfinden und
Gemütslage ausüben. Der Hypothalamus enthält weiters Neuronen, die
orexinerg auf Wachheit, Aufmerksamkeit und Nahrungsaufnahme wirken. Abbildung). Nordarenerge Nervenendigungen finden sich vorwiegend in lamina IV des cortex cerebri, auf die thalamische Afferenzen projizieren. Keine kortikale Zelle ist weiter als 30 µm von einer solchen entfernt.
Abbildung). Nordarenerge Nervenendigungen finden sich vorwiegend in lamina IV des cortex cerebri, auf die thalamische Afferenzen projizieren. Keine kortikale Zelle ist weiter als 30 µm von einer solchen entfernt.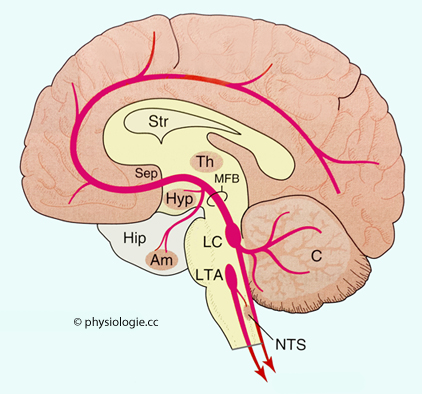
 Abbildung: Noradrenerge Projektionen aus dem Hirnstamm
Abbildung: Noradrenerge Projektionen aus dem Hirnstamm C = Kleinhirn, Hip = Hippocampus
C = Kleinhirn, Hip = Hippocampus  Hyp = Hypothalamus
Hyp = Hypothalamus  LC = locus (nucleus) coeruleus
LC = locus (nucleus) coeruleus  LTA = laterales tegmentales Areal (Teil der
formatio reticularis)
LTA = laterales tegmentales Areal (Teil der
formatio reticularis)  MBF = mediales Vorderhirnbündel
MBF = mediales Vorderhirnbündel  NTS = nucleus
tractus solitarii (sensorischer Vaguskern)
NTS = nucleus
tractus solitarii (sensorischer Vaguskern)  Sep = Septum
Sep = Septum  Str =
Striatum
Str =
Striatum  Th = Thalamus
Th = Thalamus
 Aufmerksamkeit (Arousal) und
Interesse - u.a. über Rezeptoren im Thalamus und im Cortex,
Aufmerksamkeit (Arousal) und
Interesse - u.a. über Rezeptoren im Thalamus und im Cortex,  Lernfähigkeit und Gedächtnis,
Lernfähigkeit und Gedächtnis, Wachheit (Schlafzyklus) - noradrenerge Projektionen fördern den Wachzustand und sind im REM-Schlaf inaktiv,
Wachheit (Schlafzyklus) - noradrenerge Projektionen fördern den Wachzustand und sind im REM-Schlaf inaktiv, 
 Angst-, Schmerz- und Stressantworten,
Angst-, Schmerz- und Stressantworten,  Ausschüttung hypophysärer Hormone wie GH, LH, Prolaktin,
Ausschüttung hypophysärer Hormone wie GH, LH, Prolaktin, Stimmungsbeeinflussung
(Unterfunktion dieses Systems kann depressive Verstimmung, Überfunktion schizophrene Psychose zur Folge haben).
Stimmungsbeeinflussung
(Unterfunktion dieses Systems kann depressive Verstimmung, Überfunktion schizophrene Psychose zur Folge haben).
 Abbildung: Noradrenerge Synapse (vgl. dort)
Abbildung: Noradrenerge Synapse (vgl. dort)
 Noradrenerge Übertragung im Gehirn kann an verschiedenen Stellen
pharmakologisch beeinflusst werden, z.B. durch Blockade der
Wiederaufnahme von Noradrenalin an der präsynaptischen Membran.
Dadurch bleibt Noradrenalin länger an der Synapse verfügbar. Solche
Substanzen können eine pathologisch eingetrübte Stimmung heben (trizyklische Antidepressiva,
Noradrenerge Übertragung im Gehirn kann an verschiedenen Stellen
pharmakologisch beeinflusst werden, z.B. durch Blockade der
Wiederaufnahme von Noradrenalin an der präsynaptischen Membran.
Dadurch bleibt Noradrenalin länger an der Synapse verfügbar. Solche
Substanzen können eine pathologisch eingetrübte Stimmung heben (trizyklische Antidepressiva,  Abbildung). Monoamin- bzw. Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs: Serotonin-norepinephrine reuptake inhibitors)
blockieren das präsynaptische Recycling von Monoaminen und erhöhen dadurch die Verfügbarkeit dieser
Neurotransmitter an den postsynaptischen Rezeptoren. Sie werden als
Antidepressiva eingesetzt.
Abbildung). Monoamin- bzw. Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRIs: Serotonin-norepinephrine reuptake inhibitors)
blockieren das präsynaptische Recycling von Monoaminen und erhöhen dadurch die Verfügbarkeit dieser
Neurotransmitter an den postsynaptischen Rezeptoren. Sie werden als
Antidepressiva eingesetzt. In den synaptischen Spalt freigesetztes Noradrenalin wird entweder präsynaptisch wiederaufgenommen (reuptake)
oder es diffundiert in die Umgebung, gelangt mit dem Blutkreislauf in
die Peripherie und wird dort (hauptächlich in der Leber) durch MAO und COMT abgebaut.
In den synaptischen Spalt freigesetztes Noradrenalin wird entweder präsynaptisch wiederaufgenommen (reuptake)
oder es diffundiert in die Umgebung, gelangt mit dem Blutkreislauf in
die Peripherie und wird dort (hauptächlich in der Leber) durch MAO und COMT abgebaut. Über den anregenden Einfluss von Orexin auf den nucleus coeruleus s. dort.
Über den anregenden Einfluss von Orexin auf den nucleus coeruleus s. dort. Mehrere
Forschergruppen entdeckten in den 60er-Jahren des 20. Jahrhunderts
Wesen und Verschaltungsmuster der Zellen im locus coeruleus. Ein
noradrenerges Transmittersystem im Gehirn war so neu und
unerwartet, dass es Jahre weiterer Forschung brauchte, bis dieses von
der etablierten Wissenschaft allgemein akzeptiert wurde.
Mehrere
Forschergruppen entdeckten in den 60er-Jahren des 20. Jahrhunderts
Wesen und Verschaltungsmuster der Zellen im locus coeruleus. Ein
noradrenerges Transmittersystem im Gehirn war so neu und
unerwartet, dass es Jahre weiterer Forschung brauchte, bis dieses von
der etablierten Wissenschaft allgemein akzeptiert wurde. Abbildung):
Abbildung):
 Abbildung: Serotoninerge Projektionen aus dem Hirnstamm
Abbildung: Serotoninerge Projektionen aus dem Hirnstamm C = Kleinhirn
C = Kleinhirn  Hip = Hippocampus
Hip = Hippocampus  Hyp = Hypothalamus
Hyp = Hypothalamus  Sep = Septum
Sep = Septum  Str = Striatum
Str = Striatum  Th =
Thalamus
Th =
Thalamus
 Rostrale Zellgruppen projizieren in Großhirnrinde sowie das limbische System (nucleus suprachiasmaticus des Hypothalamus, Hippocampus, Mandelkerne) sowie ventrolaterale corpora geniculata,
Rostrale Zellgruppen projizieren in Großhirnrinde sowie das limbische System (nucleus suprachiasmaticus des Hypothalamus, Hippocampus, Mandelkerne) sowie ventrolaterale corpora geniculata, Kaudale
Zellgruppen projizieren in das Rückenmark (vor allem zu motorischen
Vorderhornzellen, aber auch zu Seiten- und Hinterhorn) und zum Kleinhirn.
Kaudale
Zellgruppen projizieren in das Rückenmark (vor allem zu motorischen
Vorderhornzellen, aber auch zu Seiten- und Hinterhorn) und zum Kleinhirn. Selektive Serotonin-Aufnahmehemmer (SSRIs: Selective serotonin reuptake inhibitors - z.B. Fluoxetin) hemmen gezielt die präsynaptische Wiederverwertung des Serotonins durch den Serotonin-Transporter (SERT). Sie senken u.a. die Bereitschaft zu aggressivem Verhalten und erhöhen die Aktivität des präfrontalen Cortex.
Selektive Serotonin-Aufnahmehemmer (SSRIs: Selective serotonin reuptake inhibitors - z.B. Fluoxetin) hemmen gezielt die präsynaptische Wiederverwertung des Serotonins durch den Serotonin-Transporter (SERT). Sie senken u.a. die Bereitschaft zu aggressivem Verhalten und erhöhen die Aktivität des präfrontalen Cortex.  Typ 5-HT2A, 2C (über Gq, PLC, IP3, DAG)
Typ 5-HT2A, 2C (über Gq, PLC, IP3, DAG) Typ 5-HT1A (über Gi, Hemmung von AC, cAMP)
Typ 5-HT1A (über Gi, Hemmung von AC, cAMP) Typ 5-HT4 (über Gs, AC, cAMP)
Typ 5-HT4 (über Gs, AC, cAMP) Typ 5-HT3 (über Natriumeinstrom). Dies sind pentamere Ionenkanäle, ähnlich dem nikotinischen Acetylcholinrezeptor. Ähnlich dem AMPA-Rezeptorkanal sind sie im offenen Zustand für Na+ und K+ durchgängig; das Umkehrpotential liegt bei ~0 mV.
Typ 5-HT3 (über Natriumeinstrom). Dies sind pentamere Ionenkanäle, ähnlich dem nikotinischen Acetylcholinrezeptor. Ähnlich dem AMPA-Rezeptorkanal sind sie im offenen Zustand für Na+ und K+ durchgängig; das Umkehrpotential liegt bei ~0 mV.
 Abbildung: Serotoninerges Neuron
Abbildung: Serotoninerges Neuron
 Pharmaka, welche die Aktivität der Monoaminooxidase blockieren, werden als MAO-Hemmer
bezeichnet. Damit reduzieren solche Medikamente den Abbau von
Katecholaminen (Dopamin, Noradrenalin) sowie von Serotonin. Damit haben
sie u.a. stimmungsaufhellende Wirkung und werden in bestimmten Fällen
als Antidepressiva eingesetzt.
Pharmaka, welche die Aktivität der Monoaminooxidase blockieren, werden als MAO-Hemmer
bezeichnet. Damit reduzieren solche Medikamente den Abbau von
Katecholaminen (Dopamin, Noradrenalin) sowie von Serotonin. Damit haben
sie u.a. stimmungsaufhellende Wirkung und werden in bestimmten Fällen
als Antidepressiva eingesetzt.  Selektive Serotonin-Wiederaufnahmehemmer steigern die
Serotoninkonzentration an der Synapse und wirken antidepressiv.
Selektive Serotonin-Wiederaufnahmehemmer steigern die
Serotoninkonzentration an der Synapse und wirken antidepressiv. Über den anregenden Einfluss von Orexinen s. dort.
Über den anregenden Einfluss von Orexinen s. dort.
 Zahlreiche halluzinogene Drogen (z.B. LSD) wirken offenbar durch Interaktion mit dem serotoninergen System.
Zahlreiche halluzinogene Drogen (z.B. LSD) wirken offenbar durch Interaktion mit dem serotoninergen System. Zu Dopamin und Basalganglien s. dort
Zu Dopamin und Basalganglien s. dort Abbildung):
Abbildung):  Einem mesolimbischen Weg (auch als Belohnungssystem bezeichnet) aus dem Mittelhirn (ventrales Tegmentum) zum limbischen System (Hippocampus, Amydgala) sowie zu ventalen Anteilen des Striatums, insbesondere nucleus accumbens und tuberculum olfactorium.
Einem mesolimbischen Weg (auch als Belohnungssystem bezeichnet) aus dem Mittelhirn (ventrales Tegmentum) zum limbischen System (Hippocampus, Amydgala) sowie zu ventalen Anteilen des Striatums, insbesondere nucleus accumbens und tuberculum olfactorium.  Einem mesokortikalen Weg vom ventralen Tegmentum zum präfrontalen Cortex, der Einfluss auf die Kognition hat.
Einem mesokortikalen Weg vom ventralen Tegmentum zum präfrontalen Cortex, der Einfluss auf die Kognition hat.  Einem nigrostriatalen Weg vom nucleus niger (pars compacta) zum dorsalen Striatum (~75% der dopaminergen Fasern), wichtig für Auslösung und flüssigen Ablauf von Willkürbewegungen (gestört bei Mb. Parkinson).
Einem nigrostriatalen Weg vom nucleus niger (pars compacta) zum dorsalen Striatum (~75% der dopaminergen Fasern), wichtig für Auslösung und flüssigen Ablauf von Willkürbewegungen (gestört bei Mb. Parkinson). Einem tuberoinfundibularen Weg vom nucleus arcuatus des Hypothalamus zu dessen eminentia mediana bzw. zur Hypophyse. Diese kurze Verbindung dient der Kontrolle der Prolactinfreisetzung.
Einem tuberoinfundibularen Weg vom nucleus arcuatus des Hypothalamus zu dessen eminentia mediana bzw. zur Hypophyse. Diese kurze Verbindung dient der Kontrolle der Prolactinfreisetzung.
 Abbildung: Dopaminerge Projektionen aus dem Hirnstamm
Abbildung: Dopaminerge Projektionen aus dem Hirnstamm ACC = anteriorer gyrus cinguli
ACC = anteriorer gyrus cinguli  BF = basales Vorderhirn
BF = basales Vorderhirn  CN = nucleus caudatus
CN = nucleus caudatus  EC = entorhinaler Cortex
EC = entorhinaler Cortex  H = Hippocampus
H = Hippocampus  NAc
= nucleus accumbens
NAc
= nucleus accumbens  OFC = orbitofrontaler Cortex
OFC = orbitofrontaler Cortex  P = Putamen
P = Putamen  PFC = Präfrontalcortex
PFC = Präfrontalcortex  SNc = substantia nigra - pars compacta
SNc = substantia nigra - pars compacta  VTA = ventrales tegmentales Areal
VTA = ventrales tegmentales Areal

 Abbildung: Dopaminrezeptoren im Gehirn
Abbildung: Dopaminrezeptoren im Gehirn
 Dopaminantagonisten
wirken antiemetisch.
Dopaminantagonisten
wirken antiemetisch. Der nucleus accumbens wirkt als "Belohnungszentrum", das
dopaminerg angeregt werden kann; das mediale Vorderhirnbündel verbindet
beteiligte Zentren, verstärkt "belohnende" Aktivitäten und wird daher
als "pleasure reward bundle" bezeichnet. Insgesamt
stehen zerebrale Vorgänge wie Emotion, Kognition, Gedächtnis, Belohnung
sowie motorische Aktivität unter dopaminergem Einfluss.
Der nucleus accumbens wirkt als "Belohnungszentrum", das
dopaminerg angeregt werden kann; das mediale Vorderhirnbündel verbindet
beteiligte Zentren, verstärkt "belohnende" Aktivitäten und wird daher
als "pleasure reward bundle" bezeichnet. Insgesamt
stehen zerebrale Vorgänge wie Emotion, Kognition, Gedächtnis, Belohnung
sowie motorische Aktivität unter dopaminergem Einfluss.  Antipsychotika (Neuroleptika) wirken als selektive D2-Rezeptor-Antagonisten
und werden eingesetzt, um sogenannte positive Symptome der
Schizophrenie (Halluzinationen, Wahnvorstellungen) zu mildern.
Antipsychotika (Neuroleptika) wirken als selektive D2-Rezeptor-Antagonisten
und werden eingesetzt, um sogenannte positive Symptome der
Schizophrenie (Halluzinationen, Wahnvorstellungen) zu mildern.
 Abbildung: Cholinerge Projektionen aus Hirnstamm und Vorderhirn
Abbildung: Cholinerge Projektionen aus Hirnstamm und Vorderhirn Hip = Hippocampus
Hip = Hippocampus  Hyp = Hypothalamus
Hyp = Hypothalamus  Str
= Striatum
Str
= Striatum
 Abbildung), nämlich dem basalen Vorderhirnsystem, dem ponto-mesenzephalo-tegmentalen Komplex sowie Interneuronen im Basalgangliensystem:
Abbildung), nämlich dem basalen Vorderhirnsystem, dem ponto-mesenzephalo-tegmentalen Komplex sowie Interneuronen im Basalgangliensystem: Der basale Vorderhirnkomplex innerviert folgende Strukturen:
Der basale Vorderhirnkomplex innerviert folgende Strukturen: Den Hippocampus aus den (unter dem Rostrum des Balkens gelegenen) medialen Septumkernen (septum pellucidum) - sie beeinflussen Belohnung, Lernprozesse, Kurzzeitgedächtnis
Den Hippocampus aus den (unter dem Rostrum des Balkens gelegenen) medialen Septumkernen (septum pellucidum) - sie beeinflussen Belohnung, Lernprozesse, Kurzzeitgedächtnis Den Neocortex (breit gestreut) sowie das limbische System aus dem (zwischen Mandelkern und globus pallidus gelegenen) nucleus basalis (magnocellularis) Meynert
Den Neocortex (breit gestreut) sowie das limbische System aus dem (zwischen Mandelkern und globus pallidus gelegenen) nucleus basalis (magnocellularis) Meynert  (
( Abbildung), einem Teil des basalen Vorderhirns. Die Fasern aus dem Meynert'schen Kern nutzen Galanin als Cotransmitter. Dieses System ist einer der
bedeutendsten Acetylcholinproduzenten des Gehirns und dient u.a. der Aufmerksamkeitssteuerung.
Abbildung), einem Teil des basalen Vorderhirns. Die Fasern aus dem Meynert'schen Kern nutzen Galanin als Cotransmitter. Dieses System ist einer der
bedeutendsten Acetylcholinproduzenten des Gehirns und dient u.a. der Aufmerksamkeitssteuerung.  Als basales Vorderhirn (basal forebrain)
bezeichnet man einen Teil des Großhirns, der direkt vor und unter dem
Striatum liegt. Das basale Vorderhirn beinhaltet außer dem nucl.
basalis Meynert u.a. den nucleus accumbens, Teile des Pallidum und der
Septumkerne. Experimentelle Reizung führt zur Freisetzung von
Acetylcholin und regt Wachheit bzw. REM-Phasen an; Hemmung der
Acetylcholinwirkung fördert Tiefschlaf (slow-wave sleep).
Als basales Vorderhirn (basal forebrain)
bezeichnet man einen Teil des Großhirns, der direkt vor und unter dem
Striatum liegt. Das basale Vorderhirn beinhaltet außer dem nucl.
basalis Meynert u.a. den nucleus accumbens, Teile des Pallidum und der
Septumkerne. Experimentelle Reizung führt zur Freisetzung von
Acetylcholin und regt Wachheit bzw. REM-Phasen an; Hemmung der
Acetylcholinwirkung fördert Tiefschlaf (slow-wave sleep).  Der ponto-mesenzephalo-tegmentale Komplex des Mittelhirns und der Brücke (
Der ponto-mesenzephalo-tegmentale Komplex des Mittelhirns und der Brücke ( Abbildung) innerviert den dorsalen Thalamus sowie motorische Vorderhornzellen im Rückenmark. Zusammen mit noradrenergen und serotoninergen Bahnen aktiviert dieses System sensorische Relaiskerne und Teile des Vorderhirns.
Abbildung) innerviert den dorsalen Thalamus sowie motorische Vorderhornzellen im Rückenmark. Zusammen mit noradrenergen und serotoninergen Bahnen aktiviert dieses System sensorische Relaiskerne und Teile des Vorderhirns.  Kurze cholinerge Verbindungen (Interneurone) im Striatum dienen der motorischen Kontrolle, solche im nucl. accumbens dem zerebralen Belohnungssystem.
Kurze cholinerge Verbindungen (Interneurone) im Striatum dienen der motorischen Kontrolle, solche im nucl. accumbens dem zerebralen Belohnungssystem.
 Abbildung: Cholinerge Synapse
Abbildung: Cholinerge Synapse
 Cholinerge
Projektionen in den Hypothalamus beeinflussen die Freisetzung von GnRH,
ACTH, TSH und GH, sowie Oxytozin und Vasopressin.
Cholinerge
Projektionen in den Hypothalamus beeinflussen die Freisetzung von GnRH,
ACTH, TSH und GH, sowie Oxytozin und Vasopressin.  Das
cholinerge System scheint weiters in die Kontrolle der Aufmerksamkeit
und
in die Schlaf-Wach-Steuerung involviert zu sein. Seine Aktivität ist für die Vigilanz bedeutsam (Nikotin ist ein Acetylcholin-Agonist) und fördert die selektive (zielgerichtete) Aufmerksamkeit.
Das
cholinerge System scheint weiters in die Kontrolle der Aufmerksamkeit
und
in die Schlaf-Wach-Steuerung involviert zu sein. Seine Aktivität ist für die Vigilanz bedeutsam (Nikotin ist ein Acetylcholin-Agonist) und fördert die selektive (zielgerichtete) Aufmerksamkeit. Cholinerg sind folgende Neuronen:
Cholinerg sind folgende Neuronen: Projektionen aus dem basalen Vorderhirnkomplex und dem ponto-mesenzephalo-tegmentalen Komplex des Hirnstamms (s. oben)
Projektionen aus dem basalen Vorderhirnkomplex und dem ponto-mesenzephalo-tegmentalen Komplex des Hirnstamms (s. oben) Interneurone im Striatum, die durch nigro-striatale dopaminerge
Neuronen gehemmt werden (deren Degeneration enthemmt die cholinergen
Interneurone, was bei Mb. Parkisnon der Fall ist)
Interneurone im Striatum, die durch nigro-striatale dopaminerge
Neuronen gehemmt werden (deren Degeneration enthemmt die cholinergen
Interneurone, was bei Mb. Parkisnon der Fall ist) Alle Motoneurone zu quergestreifter Muskulatur
Alle Motoneurone zu quergestreifter Muskulatur Präganglionäre autonome Nervenfasern (nikotinerg)
Präganglionäre autonome Nervenfasern (nikotinerg) Postganglionäre parasympathische Neurone (muskarinerg)
Postganglionäre parasympathische Neurone (muskarinerg) Postganglionär-sympathische Fasern zu Schweißdrüsen
Postganglionär-sympathische Fasern zu Schweißdrüsen Zahlreiche Neurone im Darmnervensystem
Zahlreiche Neurone im Darmnervensystem Über den anregenden Einfluss von Orexinen s. dort.
Über den anregenden Einfluss von Orexinen s. dort.
 Abbildung: Histaminerge Projektionen
Abbildung: Histaminerge Projektionen
 Abbildung).
Abbildung). 
 Hypocretine / Orexine steigern Wachheit und Aufmerksamkeit, indem sie
die Großhirnrinde über aufmerksamkeitssteigernde Gehirngebiete des Hirnstamms (Raphekerne, locus coeruleus, nucl.
tuberomamillaris, cholinerge Hirnstamineurone) anregen (
Hypocretine / Orexine steigern Wachheit und Aufmerksamkeit, indem sie
die Großhirnrinde über aufmerksamkeitssteigernde Gehirngebiete des Hirnstamms (Raphekerne, locus coeruleus, nucl.
tuberomamillaris, cholinerge Hirnstamineurone) anregen ( vgl. dort). Ihre Aktivität ist im Wachzustand hoch, im Schlaf (sowohl REM als auch non-REM) niedrig.
vgl. dort). Ihre Aktivität ist im Wachzustand hoch, im Schlaf (sowohl REM als auch non-REM) niedrig. Hypocretine / Orexine stimulieren wahrscheinlich auch die Nahrungsaufnahme.
Hypocretine / Orexine stimulieren wahrscheinlich auch die Nahrungsaufnahme.  Abbildung). Reduziert dieses System seine Tätigkeit, tritt ein Zustand von mangelnder Aufmerksamkeit und Vigilanz oder Schlaf auf.
Abbildung). Reduziert dieses System seine Tätigkeit, tritt ein Zustand von mangelnder Aufmerksamkeit und Vigilanz oder Schlaf auf.  Bewusstsein erfordert (unter anderem) eine aktivierte Großhirnrinde.
Bewusstsein erfordert (unter anderem) eine aktivierte Großhirnrinde.
 Abbildung: Aszendierendes retikuläres aktivierendes System (ARAS)
Abbildung: Aszendierendes retikuläres aktivierendes System (ARAS)
 Formatio reticularis des Hirnstamms (von medulla oblongata bis Mittelhirn). Aktivität dessen "aufsteigenden" Teils - des (aszendierenden) aktivierenden retikulären Systems - reticular activating system, ascending arousal system
(A)RAS - ist für die Aufrechterhaltung des Bewusstseinszustandes
essentiell, es steuert Wachheit, Aufmerksamkeit, Bewusstsein und regt dafür notwendige Funktionen an. So steigert seine Aktivität den Blutdruck über Erhöhung des sympathischen Tonus.
Formatio reticularis des Hirnstamms (von medulla oblongata bis Mittelhirn). Aktivität dessen "aufsteigenden" Teils - des (aszendierenden) aktivierenden retikulären Systems - reticular activating system, ascending arousal system
(A)RAS - ist für die Aufrechterhaltung des Bewusstseinszustandes
essentiell, es steuert Wachheit, Aufmerksamkeit, Bewusstsein und regt dafür notwendige Funktionen an. So steigert seine Aktivität den Blutdruck über Erhöhung des sympathischen Tonus. Eine ventrale Route - hauptsächlich noradrenerg (locus coeruleus) und serotoninerg (Raphekerne), aber auch dopaminerg (zentrales Höhlengrau) und histaminerg (Hypothalamus, nucl. tuberomamillaris) - via das basale Vorderhirn. Diese Systeme sind im Wachzustand aktiv und reduzieren ihre Aktivität im Schlaf (REM und non-REM).
Eine ventrale Route - hauptsächlich noradrenerg (locus coeruleus) und serotoninerg (Raphekerne), aber auch dopaminerg (zentrales Höhlengrau) und histaminerg (Hypothalamus, nucl. tuberomamillaris) - via das basale Vorderhirn. Diese Systeme sind im Wachzustand aktiv und reduzieren ihre Aktivität im Schlaf (REM und non-REM). Eine dorsale Route - hauptsächlich cholinerg - zum Thalamus (
Eine dorsale Route - hauptsächlich cholinerg - zum Thalamus ( Abbildung)
und basalen Vorderhirn, der in weiterer Folge glutamaterg den Cortex
anregt. Diese Route ist am aktivsten bei Wachheit und im REM-Schlaf und
beeinflusst die Aktivität thalamischer und kortikaler Neurone.
Abbildung)
und basalen Vorderhirn, der in weiterer Folge glutamaterg den Cortex
anregt. Diese Route ist am aktivsten bei Wachheit und im REM-Schlaf und
beeinflusst die Aktivität thalamischer und kortikaler Neurone. Zusätzlich wirkt ein Sytem GABAerger Neurone des Hypothalamus (präoptisches Areal POA), das vor allem im Schlafzustand
aktiv ist. Läsionen dieser Neurone lädiert sowohl den Ablauf des REM-
als auch des non-REM-Schlafs. Andererseits regt ein System von Neuronen
des lateralen Hypothalamus, die Hypocretin (=Orexin) als
Neurotransmitter verwenden, den Wachzustand an, wohl über Reizung des ARAS (
Zusätzlich wirkt ein Sytem GABAerger Neurone des Hypothalamus (präoptisches Areal POA), das vor allem im Schlafzustand
aktiv ist. Läsionen dieser Neurone lädiert sowohl den Ablauf des REM-
als auch des non-REM-Schlafs. Andererseits regt ein System von Neuronen
des lateralen Hypothalamus, die Hypocretin (=Orexin) als
Neurotransmitter verwenden, den Wachzustand an, wohl über Reizung des ARAS ( vgl. dort).
vgl. dort). Mittelhirn / Tectum: Die oberen Vierhügel haben eine zentrale Funktion bei der Nachjustierung der Aufmerksamkeit, in deren Rahmen z.B. sakkadische Blickeinstellungen erfolgen
Mittelhirn / Tectum: Die oberen Vierhügel haben eine zentrale Funktion bei der Nachjustierung der Aufmerksamkeit, in deren Rahmen z.B. sakkadische Blickeinstellungen erfolgen Dorsaler Hypothalamus, dieser verwaltet neurohumorale und einige motorische Begleitreaktionen
Dorsaler Hypothalamus, dieser verwaltet neurohumorale und einige motorische Begleitreaktionen Abbildung).
Abbildung). 
 Abbildung: Thalamuskerne
Abbildung: Thalamuskerne
 Die Neurone ziehen durch Hypothalamus und basales Vorderhirn und
projizieren direkt auf die Großhirnrinde, deren Aktivität sie anregen.
Modulierende Axone ziehen auch zum Thalamus und fördern das
"Durchschalten" sensorischer Impulse zum Cortex.
Die Neurone ziehen durch Hypothalamus und basales Vorderhirn und
projizieren direkt auf die Großhirnrinde, deren Aktivität sie anregen.
Modulierende Axone ziehen auch zum Thalamus und fördern das
"Durchschalten" sensorischer Impulse zum Cortex. s. auch Schlafstadien).
Auf diese Weise wird die Aktivität auf bestimmte Inhalte gebündelt,
ohne dass es zu ungehemmter Ausbreitung von Exzitationen im Gehirn
kommt - immerhin sind wahrscheinlich mehr als 10% der Nervenzellen im
ARAS elektrisch gekoppelt (mittels gap junctions).
s. auch Schlafstadien).
Auf diese Weise wird die Aktivität auf bestimmte Inhalte gebündelt,
ohne dass es zu ungehemmter Ausbreitung von Exzitationen im Gehirn
kommt - immerhin sind wahrscheinlich mehr als 10% der Nervenzellen im
ARAS elektrisch gekoppelt (mittels gap junctions). Exogene Aufmerksamkeit (bottom-up oder reflexive oder exogenously controlled attention): Ein äußerer Stimulus triggert sie ohne kognitive Anstrengung. Diese
Form der Aufmerksamkeit wird offenbar über das untere Parietalhirn (lobus parietalis inferior) vermittelt (der sulcus intraparietalis trennt den oberen vom unteren Parietallappen). Sie erreicht ihr Maximum innerhalb einer
Zehntelsekunde nach Reizbeginn und flacht rasch wieder ab, falls dem
Reiz keine weitere Bedeutung zukommt.
Exogene Aufmerksamkeit (bottom-up oder reflexive oder exogenously controlled attention): Ein äußerer Stimulus triggert sie ohne kognitive Anstrengung. Diese
Form der Aufmerksamkeit wird offenbar über das untere Parietalhirn (lobus parietalis inferior) vermittelt (der sulcus intraparietalis trennt den oberen vom unteren Parietallappen). Sie erreicht ihr Maximum innerhalb einer
Zehntelsekunde nach Reizbeginn und flacht rasch wieder ab, falls dem
Reiz keine weitere Bedeutung zukommt. Im Gegensatz dazu unterstützt endogene ("willentliche") Aufmerksamkeit (top-down oder voluntary oder consciously controlled attention) die bewußte Suche nach einem Zielobjekt oder die Konzentration
auf ein bestimmtes Verhalten. Diese Art der Aufmerksamkeit wird vermutlich vor allem über das obere Parietalhirn (lobus parietalis superior) vermittelt. Endogene Aufmerksamkeit ist unter der
Kontrolle des Bewußtseins, und es dauert etwa 0,3 Sekunden (dreimal so
lang wie bei der exogenen Aufmerksamkeit), bis ihr Maximum erreicht
ist; sie bleibt im Allgemeinen auch länger bestehen.
Im Gegensatz dazu unterstützt endogene ("willentliche") Aufmerksamkeit (top-down oder voluntary oder consciously controlled attention) die bewußte Suche nach einem Zielobjekt oder die Konzentration
auf ein bestimmtes Verhalten. Diese Art der Aufmerksamkeit wird vermutlich vor allem über das obere Parietalhirn (lobus parietalis superior) vermittelt. Endogene Aufmerksamkeit ist unter der
Kontrolle des Bewußtseins, und es dauert etwa 0,3 Sekunden (dreimal so
lang wie bei der exogenen Aufmerksamkeit), bis ihr Maximum erreicht
ist; sie bleibt im Allgemeinen auch länger bestehen.
 Abbildung: Bereich des Zwischenhirns
Abbildung: Bereich des Zwischenhirns
 Thalamus
Thalamus  Subthalamus (=thalamus ventralis) - zu ihm gehören das Pallidum (globus pallidus
Subthalamus (=thalamus ventralis) - zu ihm gehören das Pallidum (globus pallidus  ) und der nucleus subthalamicus (Luysi), das sind Teile der Basalganglien
) und der nucleus subthalamicus (Luysi), das sind Teile der Basalganglien Hypothalamus
Hypothalamus  Epithalamus:
Epithalamus: Als Epithalamus bezeichnet man den dorsalen Abschnitt des Zwischenhirns. Zu ihm gehören
Als Epithalamus bezeichnet man den dorsalen Abschnitt des Zwischenhirns. Zu ihm gehören  das Prätectum
das Prätectum die nuclei habenulares
(Habenulae - lat. "Zügelchen" -, auch Epiphysenstiele genannt), sie
verbinden den Thalamus mit der Zirbeldrüse (glandula pinealis), sind
Teil des limbischen Systems und involviert in die Verarbeitung von
Sinneseindrücken und Emotionen, Motivation und Lernen, sowie von
Schmerz;
die nuclei habenulares
(Habenulae - lat. "Zügelchen" -, auch Epiphysenstiele genannt), sie
verbinden den Thalamus mit der Zirbeldrüse (glandula pinealis), sind
Teil des limbischen Systems und involviert in die Verarbeitung von
Sinneseindrücken und Emotionen, Motivation und Lernen, sowie von
Schmerz; die stria medullaris,
ein Teil des Trigonum habenulae, das als Teil des dorsalen dienzephalen
Leitungssystems in die Verbindung zwischen limbischem System und
anderen Hirnteilen integriert ist;
die stria medullaris,
ein Teil des Trigonum habenulae, das als Teil des dorsalen dienzephalen
Leitungssystems in die Verbindung zwischen limbischem System und
anderen Hirnteilen integriert ist; der hypothalamische nucleus paraventricularis
(liegt neben dem 3. Hirnventrikel), der Oxytocin und (in geringerem
Maß) Vasopressin produziert und diese Hormone an den
Hypophysenhinterlappen transferiert;
der hypothalamische nucleus paraventricularis
(liegt neben dem 3. Hirnventrikel), der Oxytocin und (in geringerem
Maß) Vasopressin produziert und diese Hormone an den
Hypophysenhinterlappen transferiert; die commissura posterior mit ihren Verbindungsfasern, die u.a. für den konsensuellen Pupillenreflex benötigt werden;
die commissura posterior mit ihren Verbindungsfasern, die u.a. für den konsensuellen Pupillenreflex benötigt werden; die Zirbeldrüse (glandula pinealis).
die Zirbeldrüse (glandula pinealis).
 anteriore (Lernen, Gedächtnis)
anteriore (Lernen, Gedächtnis) mediale (kortikale Anregung, kognitives Lernen)
mediale (kortikale Anregung, kognitives Lernen) laterale (sensorische und motorische Aufgaben, Interpretation)
laterale (sensorische und motorische Aufgaben, Interpretation) posteriore Kerne (auditive und visuelle Funktionen, Sprachkontrolle, Integration)
posteriore Kerne (auditive und visuelle Funktionen, Sprachkontrolle, Integration) Thalamuskerne haben koordinative
und 'Relaisfunktion' (betreffende Neuronen arbeiten sensorische Information modalitätsspezifisch auf). Der Mittelteil der medialen Gruppe und die
intralaminären Kerne wirken als diffuse Projektionskerne.
Durch Verbindungen mit Frontalhirn und Hippocampus beteiligt sich der
Thalamus wahrscheinlich auch an der Kognition (z.B. Gedächtnis).
Thalamuskerne haben koordinative
und 'Relaisfunktion' (betreffende Neuronen arbeiten sensorische Information modalitätsspezifisch auf). Der Mittelteil der medialen Gruppe und die
intralaminären Kerne wirken als diffuse Projektionskerne.
Durch Verbindungen mit Frontalhirn und Hippocampus beteiligt sich der
Thalamus wahrscheinlich auch an der Kognition (z.B. Gedächtnis). sensorisch - alle Sinnesinformation (außer dem Riechsinn) wird über den Thalamus an die Großhirnrinde übermittelt
sensorisch - alle Sinnesinformation (außer dem Riechsinn) wird über den Thalamus an die Großhirnrinde übermittelt
 motorisch - Basalganglien und Kleinhirn senden motorische Impulsmuster über den Thalamus an die Großhirnrinde
motorisch - Basalganglien und Kleinhirn senden motorische Impulsmuster über den Thalamus an die Großhirnrinde
 autonom-nervös (vegetativ) - der Thalamus beteiligt sich an Aufmerksamkeitssteuerung und Bewusstseinsbildung
autonom-nervös (vegetativ) - der Thalamus beteiligt sich an Aufmerksamkeitssteuerung und Bewusstseinsbildung
 Emotion und Gedächtnis - der Thalamus ist Teil des Papez-Kreises und kontrolliert zum gyrus cinguli projizierte emotionale und Gedächtnisinformationen
Emotion und Gedächtnis - der Thalamus ist Teil des Papez-Kreises und kontrolliert zum gyrus cinguli projizierte emotionale und Gedächtnisinformationen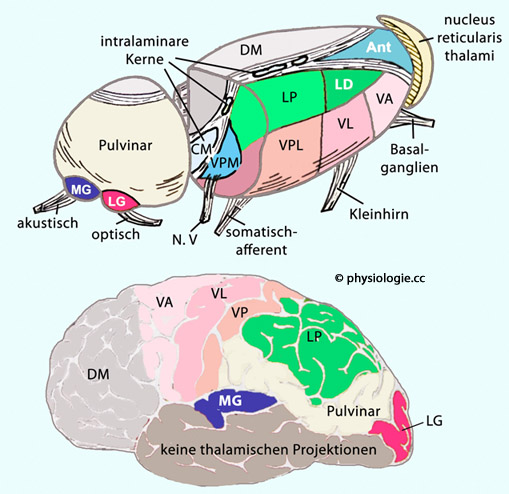
 Abbildung: Thalamuskerne, ihre Eingänge und Projektionen auf die Großhirnrinde
Abbildung: Thalamuskerne, ihre Eingänge und Projektionen auf die Großhirnrinde
 Unspezifisch / viszerosensibel
sind intralaminäre und zentromediane Kerne. Sie
erhalten Afferenzen aus der retikulären Formation des Mittelhirns und
aus dem Vorderseitenstrang (tractus spinothalamicus) und projizieren in die gesamte
Großhirnrinde.
Unspezifisch / viszerosensibel
sind intralaminäre und zentromediane Kerne. Sie
erhalten Afferenzen aus der retikulären Formation des Mittelhirns und
aus dem Vorderseitenstrang (tractus spinothalamicus) und projizieren in die gesamte
Großhirnrinde. Spezifisch sensorisch sind
die Kniehöcker (corpora geniculata) für Sehen und Hören sowie die
ventrobasalen Kerne für die somatische Sensibilität. Diese Kerne sind
entwicklungsgeschichtlich jünger (Entwicklung mit Neocortex), arbeiten
modalitätsspezifisch und räumlich sehr präzise.
Spezifisch sensorisch sind
die Kniehöcker (corpora geniculata) für Sehen und Hören sowie die
ventrobasalen Kerne für die somatische Sensibilität. Diese Kerne sind
entwicklungsgeschichtlich jünger (Entwicklung mit Neocortex), arbeiten
modalitätsspezifisch und räumlich sehr präzise. Sensomotorisch: Nucleus ventralis anterior (verlangsamt Willkürbewegungen) und lateralis (beschleunigt Willkürbewegungen).
Sensomotorisch: Nucleus ventralis anterior (verlangsamt Willkürbewegungen) und lateralis (beschleunigt Willkürbewegungen). Zu den Assoziationskernen
gehören das Pulvinar und der Nucl. lateralis posterior
(parieto-okzipito-temporale Verbindungen) sowie die mit dem gyrus
cinguli verbundenen Nucll. anterior und lateralis dorsalis.
Zu den Assoziationskernen
gehören das Pulvinar und der Nucl. lateralis posterior
(parieto-okzipito-temporale Verbindungen) sowie die mit dem gyrus
cinguli verbundenen Nucll. anterior und lateralis dorsalis. Nucleus ventralis posterior (lateralis und medialis): Somatosensorik
Nucleus ventralis posterior (lateralis und medialis): Somatosensorik
 Abbildung: Hypothalamische Kerngebiete (Sagittalschnitt)
Abbildung: Hypothalamische Kerngebiete (Sagittalschnitt) Der präoptische Hypothalamus (in der
Der präoptische Hypothalamus (in der  Abbildung dunkelviolett markiert) liegt über dem chiasma opticum
und enthält Neurone zur Steuerung von Durst, Wasserbilanz, Körpertemperatur,
Schlaf, Sexualverhalten und zirkadiane Rhythmen.
Neurone der präoptischen Region projizieren inhibitorisch auf Neuronen,
die Weck- bzw. anregernde Wirkung haben; man kann sie als
"Schlafneurone" bezeichnen. Die Mehrzahl dieser schlafinduzierenden
Neurone liegt in der ventrolateralen präoptischen Region (ventromedial preoptic area vlPOA).
Abbildung dunkelviolett markiert) liegt über dem chiasma opticum
und enthält Neurone zur Steuerung von Durst, Wasserbilanz, Körpertemperatur,
Schlaf, Sexualverhalten und zirkadiane Rhythmen.
Neurone der präoptischen Region projizieren inhibitorisch auf Neuronen,
die Weck- bzw. anregernde Wirkung haben; man kann sie als
"Schlafneurone" bezeichnen. Die Mehrzahl dieser schlafinduzierenden
Neurone liegt in der ventrolateralen präoptischen Region (ventromedial preoptic area vlPOA). Der supraoptische Hypothalamus liegt über dem Infundubulum und enthält den supraoptischen, anterioren und paraventrikulären Kern.
Der supraoptische Hypothalamus liegt über dem Infundubulum und enthält den supraoptischen, anterioren und paraventrikulären Kern. Der tuberale Hypothalamus liegt direkt dahinter über der Hypophyse
und kontrolliert deren hormonelle Steuerung (Liberine, Statine), das
autonome Nervensystem, Aggression, Hunger und Sexualverhalten.
Der tuberale Hypothalamus liegt direkt dahinter über der Hypophyse
und kontrolliert deren hormonelle Steuerung (Liberine, Statine), das
autonome Nervensystem, Aggression, Hunger und Sexualverhalten. Der posteriore
Hypothalamus enthält die posterioren und mamillären Kerne sowie
histaminerge Neuronen im nucl. tuberomamillaris (seine Aktivität weckt
die Aufmerksamkeit).
Der posteriore
Hypothalamus enthält die posterioren und mamillären Kerne sowie
histaminerge Neuronen im nucl. tuberomamillaris (seine Aktivität weckt
die Aufmerksamkeit).
 Abbildung: Kerne des medialen Hypothalamus (Rechteck) und Projektionen
Abbildung: Kerne des medialen Hypothalamus (Rechteck) und Projektionen
 die supraoptische Region direkt über der Sehnervenkreuzung hinter der präoptischen Region (diese enthält die präoptischen Kerne - medial den sexually dimorphic nucleus
SDN).
die supraoptische Region direkt über der Sehnervenkreuzung hinter der präoptischen Region (diese enthält die präoptischen Kerne - medial den sexually dimorphic nucleus
SDN).  Die (paarigen) nuclei suprachiasmatici haben ein Volumen von jeweils nur 0,25 mm3 (0,00025 ml), sind aber von großer Bedeutung. Sie vollführen eine Zeitgeberaktivität (central master-clock), die sie zum primären Schrittmacher zirkadianer (~24-Stunden-) Rhythmen machen - eine Aufgabe, die sie über neuroendokrine Einflüsse auf zahlreiche physiologische Systeme wahrnehmen (
Die (paarigen) nuclei suprachiasmatici haben ein Volumen von jeweils nur 0,25 mm3 (0,00025 ml), sind aber von großer Bedeutung. Sie vollführen eine Zeitgeberaktivität (central master-clock), die sie zum primären Schrittmacher zirkadianer (~24-Stunden-) Rhythmen machen - eine Aufgabe, die sie über neuroendokrine Einflüsse auf zahlreiche physiologische Systeme wahrnehmen ( vgl. dort). Grundlage ist dabei ein Schwingungssystem miteinander verknüpfter molekularer
Rückkopplungsschleifen, die sich auf die Genexpression der beteiligten
Neurone auswirken. Sie liegen direkt über der Sehnervenkreuzung (daher der Name); zur Synchronisierung mit Rhythmen in der Umwelt empfangen sie Signale aus der Netzhaut.
vgl. dort). Grundlage ist dabei ein Schwingungssystem miteinander verknüpfter molekularer
Rückkopplungsschleifen, die sich auf die Genexpression der beteiligten
Neurone auswirken. Sie liegen direkt über der Sehnervenkreuzung (daher der Name); zur Synchronisierung mit Rhythmen in der Umwelt empfangen sie Signale aus der Netzhaut.  Die tuberale Region (s. oben) - der nucl. arcuatus ist in die Kontrolle des Körpergewichts involviert und produziert auch ß-Endorphin.
Die tuberale Region (s. oben) - der nucl. arcuatus ist in die Kontrolle des Körpergewichts involviert und produziert auch ß-Endorphin.  Die mamilläre Region erhält vor
allem Impulse aus dem Hippocampus; ihre Funktion ist mit Emotionen und
Gedächtnisbildung verknüpft. Projektionen in den vorderen Thalamuskern
sind Teil limbischer Rückkopplung.
Die mamilläre Region erhält vor
allem Impulse aus dem Hippocampus; ihre Funktion ist mit Emotionen und
Gedächtnisbildung verknüpft. Projektionen in den vorderen Thalamuskern
sind Teil limbischer Rückkopplung.
 Abbildung: Kerne und Verbindungen des Hypothalamus (
Abbildung: Kerne und Verbindungen des Hypothalamus ( s. auch dort)
s. auch dort)
 vegetative Anpassungsreaktionen
(Aufrechterhaltung der Homöostase: Kreislauf, Atmung, Körpertemperatur,
Metabolismus / Nahrungsaufnahme, Flüssigkeitsvolumen und Osmolalität /
Flüssigkeitsaufnahme und Nierenfunktion, vegetative Begleitung von Angriffs- oder
Fluchtverhalten - Substratversorgung! -, Immunabwehr, Schlaf-Wach-Rhythmus etc) und
vegetative Anpassungsreaktionen
(Aufrechterhaltung der Homöostase: Kreislauf, Atmung, Körpertemperatur,
Metabolismus / Nahrungsaufnahme, Flüssigkeitsvolumen und Osmolalität /
Flüssigkeitsaufnahme und Nierenfunktion, vegetative Begleitung von Angriffs- oder
Fluchtverhalten - Substratversorgung! -, Immunabwehr, Schlaf-Wach-Rhythmus etc) und  die
entsprechende Abstimmung mit der Verhaltenssteuerung, wie
die
entsprechende Abstimmung mit der Verhaltenssteuerung, wie Essen: Nutritives (die Nahrungsaufnahme betreffendes) Verhalten und
parasympathische Aktivierung des Verdauungssystems (trophotrope,
d.h. auf die Ernährung gerichtete Reaktionslage). Multiple periphere
und zentrale Signale - neuronale wie humorale - werden in die Steuerung
der Energie-Homöostase einbezogen. Ziel ist die Herstellung eines
Gleichgewichts zwischen Nahrungsaufnahme und Energiekonsumption (und
die Erhaltung eines optimalen Körpergewichts).
Essen: Nutritives (die Nahrungsaufnahme betreffendes) Verhalten und
parasympathische Aktivierung des Verdauungssystems (trophotrope,
d.h. auf die Ernährung gerichtete Reaktionslage). Multiple periphere
und zentrale Signale - neuronale wie humorale - werden in die Steuerung
der Energie-Homöostase einbezogen. Ziel ist die Herstellung eines
Gleichgewichts zwischen Nahrungsaufnahme und Energiekonsumption (und
die Erhaltung eines optimalen Körpergewichts).  Abbildung) Leptin und Adiponektin aus dem
Fettgewebe und Insulin aus der Bauchspeicheldrüse. Ghrelin aus dem
Magen liefert ein akutes Hungersignal, und zu den Sättigungssignalen (kurzfristige Speicheranzeige) gehören das Peptid YY (PYY3-36), pankreatisches Polypeptid, Amylin und Oxyntomodulin (OXM). Die Inkretinhormone Glukagonähnliches Peptid (GLP-1) und Glukoseabhängiges insulinotropes Peptid (GIP) verstärken die Reaktion der Langerhans-Inseln im Pankreas auf nutritive Reize.
Abbildung) Leptin und Adiponektin aus dem
Fettgewebe und Insulin aus der Bauchspeicheldrüse. Ghrelin aus dem
Magen liefert ein akutes Hungersignal, und zu den Sättigungssignalen (kurzfristige Speicheranzeige) gehören das Peptid YY (PYY3-36), pankreatisches Polypeptid, Amylin und Oxyntomodulin (OXM). Die Inkretinhormone Glukagonähnliches Peptid (GLP-1) und Glukoseabhängiges insulinotropes Peptid (GIP) verstärken die Reaktion der Langerhans-Inseln im Pankreas auf nutritive Reize. 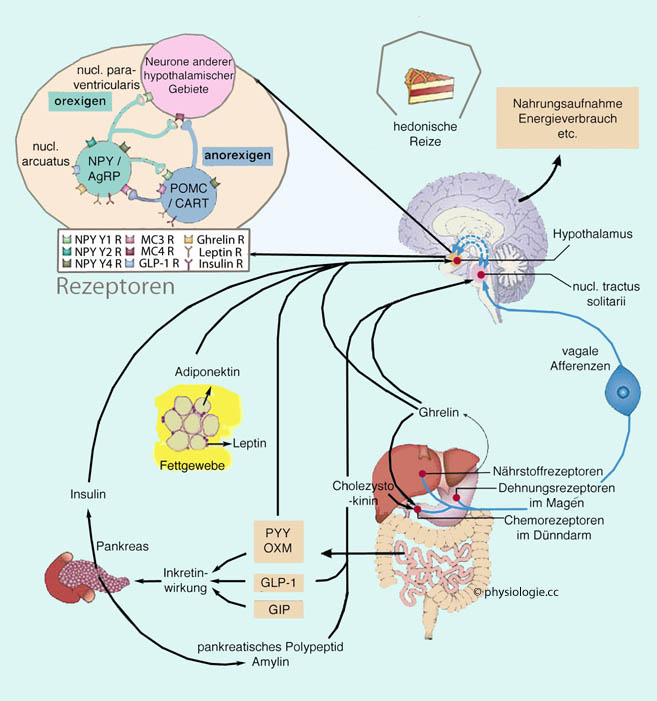
 Abbildung: Der Hypothalamus integriert Signale zur Steuerung des Energiehaushalts
Abbildung: Der Hypothalamus integriert Signale zur Steuerung des Energiehaushalts
 s. dort
s. dort Trinken: Wasseraufnahme in Reaktion auf Durstempfinden. Das Trinkverhalten ist wesentlich von der osmotischen Konzentration der Körperflüssigkeiten bestimmt, insbesondere im Hypothalamus (Osmorezeptoren im Gebiet des nucleus supraopticus).
Trinken: Wasseraufnahme in Reaktion auf Durstempfinden. Das Trinkverhalten ist wesentlich von der osmotischen Konzentration der Körperflüssigkeiten bestimmt, insbesondere im Hypothalamus (Osmorezeptoren im Gebiet des nucleus supraopticus). Wärmehaushalt und Temperaturregulation
- dazu gehören Einflüsse auf Energieutilisation, Wärmeproduktion im
Muskel, Hautdurchblutung, Sudomotorik (Schweißbildung) genauso wie
entsprechendes Verhalten (z.B. Aufsuchen eines wärmeren oder kühleren
Ortes)
Wärmehaushalt und Temperaturregulation
- dazu gehören Einflüsse auf Energieutilisation, Wärmeproduktion im
Muskel, Hautdurchblutung, Sudomotorik (Schweißbildung) genauso wie
entsprechendes Verhalten (z.B. Aufsuchen eines wärmeren oder kühleren
Ortes) Abwehr- und Aggressionsverhalten im Zusammenspiel mit dem limbischen
System; hier überwiegt die Aktivität des Sympathikus (ergotrope, d.h. auf die Entfaltung von Muskelkraft gerichtete
Reaktionslage), Hormonausschüttung aus der Nebenniere
eingeschlossen
Abwehr- und Aggressionsverhalten im Zusammenspiel mit dem limbischen
System; hier überwiegt die Aktivität des Sympathikus (ergotrope, d.h. auf die Entfaltung von Muskelkraft gerichtete
Reaktionslage), Hormonausschüttung aus der Nebenniere
eingeschlossen Reproduktives Verhalten, das der Fortpflanzung dient: Verarbeitung
sexueller Signale (Formen, Stimme, Bewegungsmuster, Pheromone,
Pupillenweite, Berührung), Koordination hormonell-vegetativer
Reaktionen
Reproduktives Verhalten, das der Fortpflanzung dient: Verarbeitung
sexueller Signale (Formen, Stimme, Bewegungsmuster, Pheromone,
Pupillenweite, Berührung), Koordination hormonell-vegetativer
Reaktionen Beteiligung an der Steuerung des Schlaf-Wach-Rhythmus
Beteiligung an der Steuerung des Schlaf-Wach-Rhythmus  s. dort.
s. dort. autonomem (=vegetativem) Nervensystem - z.B. Koordination von Reflexen,
autonomem (=vegetativem) Nervensystem - z.B. Koordination von Reflexen,  limbischem System (Hippocampus, Amygdala, Septumkerne usw) - Kontrolle von Gefühlen und Verhaltensabläufen,
limbischem System (Hippocampus, Amygdala, Septumkerne usw) - Kontrolle von Gefühlen und Verhaltensabläufen,  motorischen und sensorischen Systemen.
motorischen und sensorischen Systemen.  wirken zum Teil als synaptische Transmitter auf andere Nervenzellen,
wirken zum Teil als synaptische Transmitter auf andere Nervenzellen,  teils werden sie über neuronalen Transport in den Hypophysenhinterlappen befördert (etwa 105 Neurone mit Zellkörpern in den nucl. supraopticus und paraventricularis), aus dem sie bei Erregung der Neurone freigesetzt werden,
teils werden sie über neuronalen Transport in den Hypophysenhinterlappen befördert (etwa 105 Neurone mit Zellkörpern in den nucl. supraopticus und paraventricularis), aus dem sie bei Erregung der Neurone freigesetzt werden, teils (in der eminentia mediana) in das Blut des
hypothalamisch-hypophysären Pfortadersystems freigesetzt und wirken
auf den Vorderlappen ein (Releasing- und Inhibiting-Faktoren = Liberine und Statine).
teils (in der eminentia mediana) in das Blut des
hypothalamisch-hypophysären Pfortadersystems freigesetzt und wirken
auf den Vorderlappen ein (Releasing- und Inhibiting-Faktoren = Liberine und Statine). 
 Abbildung: Zentrales autonomes Netzwerk
Abbildung: Zentrales autonomes Netzwerk
 Abbildung). Er erhält Impulse von
Abbildung). Er erhält Impulse von  übergeordneten Gebieten (Großhirnrinde, limbisches System, Thalamus)
übergeordneten Gebieten (Großhirnrinde, limbisches System, Thalamus) Afferenzen aus der Peripherie
Afferenzen aus der Peripherie Rezeptoren im Hypothalamus selbst (diese messen Hormonspiegel, Metaboliten wie Glukose und Fettsäuren, Osmolalität, Temperatur). Rezeptoren erlauben Gegensteuerung im
Sinne einer negativen Rückkopplung, z.T. neuronal, z.T. durch Liberine
und Statine.
Rezeptoren im Hypothalamus selbst (diese messen Hormonspiegel, Metaboliten wie Glukose und Fettsäuren, Osmolalität, Temperatur). Rezeptoren erlauben Gegensteuerung im
Sinne einer negativen Rückkopplung, z.T. neuronal, z.T. durch Liberine
und Statine. Wärmerezeptoren veranlassen bei Erhöhung der Bluttemperatur über einen
Schwellenwert (z.B. 37,0°C) vermehrte Wärmeabgabe des Körpers über die
Haut
Wärmerezeptoren veranlassen bei Erhöhung der Bluttemperatur über einen
Schwellenwert (z.B. 37,0°C) vermehrte Wärmeabgabe des Körpers über die
Haut  Osmorezeptoren messen die Osmolalität des Blutes
und regen bei Erhöhung Durstempfinden und Vasopressinfreisetzung an,
hemmen bei Erniedrigung das Vasopressinsystem und fördern die Aldosteronbildung
Osmorezeptoren messen die Osmolalität des Blutes
und regen bei Erhöhung Durstempfinden und Vasopressinfreisetzung an,
hemmen bei Erniedrigung das Vasopressinsystem und fördern die Aldosteronbildung  Hormonrezeptoren sprechen auf die Konzentration von T3/T4, Cortisol,
Östradiol und Progesteron, Testosteron und Dihydrotestosteron
an und korrigieren dementsprechend die Freisetzung von Liberinen und Statinen.
Hormonrezeptoren sprechen auf die Konzentration von T3/T4, Cortisol,
Östradiol und Progesteron, Testosteron und Dihydrotestosteron
an und korrigieren dementsprechend die Freisetzung von Liberinen und Statinen.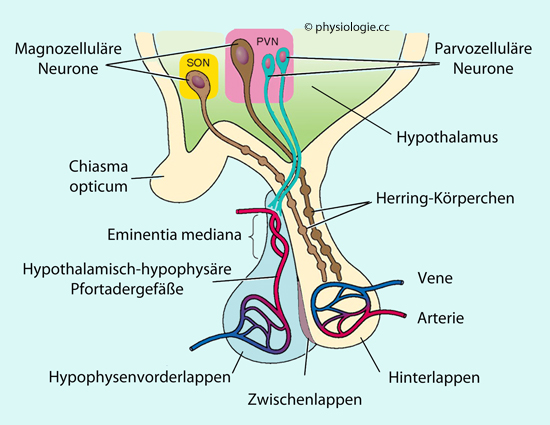
 Abbildung: Vasopressinneurone und hypothalamisch-hypophysäres System
Abbildung: Vasopressinneurone und hypothalamisch-hypophysäres System . Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System").
. Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System").
 Großzellige (magnozelluläre)
Gebiete im vorderen Hypothalamus: Hierzu gehören der nucl. supraopticus
und Teile des nucl. paraventricularis. Diese Zellen bilden Vasopressin
und Oxytozin, die über axonalen Transport in den Hypophysenhinterlappen
gelangen und in Herring-Körperchen zwischengespeichert werden, bis sie
- durch Aktionspotentiale getriggert - in Hinterlappengefäße angegeben
werden (
Großzellige (magnozelluläre)
Gebiete im vorderen Hypothalamus: Hierzu gehören der nucl. supraopticus
und Teile des nucl. paraventricularis. Diese Zellen bilden Vasopressin
und Oxytozin, die über axonalen Transport in den Hypophysenhinterlappen
gelangen und in Herring-Körperchen zwischengespeichert werden, bis sie
- durch Aktionspotentiale getriggert - in Hinterlappengefäße angegeben
werden (  Abbildung).
Abbildung).  Kleinzellige (parvozelluläre)
Gebiete im medialen Hypothalamus: Sie setzen im Bereich der eminentia
mediana ihre Hormone in den Pfortaderkerislauf frei. Die Hormone
gelangen in den Hypophysenvorderlappen (
Kleinzellige (parvozelluläre)
Gebiete im medialen Hypothalamus: Sie setzen im Bereich der eminentia
mediana ihre Hormone in den Pfortaderkerislauf frei. Die Hormone
gelangen in den Hypophysenvorderlappen (  Abbildung), wo Vasopressin über V1-Rezeptoren die Freisetzung von ACTH anregt. Dadurch wirkt es synergistisch mit CRH und fördert die Freisetzung von Glucocorticoiden.
Abbildung), wo Vasopressin über V1-Rezeptoren die Freisetzung von ACTH anregt. Dadurch wirkt es synergistisch mit CRH und fördert die Freisetzung von Glucocorticoiden. Stabilisierung und Steuerung des Stoffwechsels
Stabilisierung und Steuerung des Stoffwechsels Einstellung des “inneren Milieus” (Temperatur, Kreislauf, Atmung, Wasser- und Elektrolythaushalt)
Einstellung des “inneren Milieus” (Temperatur, Kreislauf, Atmung, Wasser- und Elektrolythaushalt) Steuerung von Wachstum und Reifung
Steuerung von Wachstum und Reifung Überwachung der Funktion der Fortpflanzungsorgane.
Überwachung der Funktion der Fortpflanzungsorgane. Bereits als Student forschte der Schweizer Walter Rudolf Hess
an physiologischen Fragestellungen. Dann arbeitete er als Augenarzt,
bis er sich wieder der Physiologie zuwandte und ab 1917 als Ordinarius
in Zürich wirkte. Ab 1920 führte er seine bahnbrechenden Versuche mit
"unterbrochener Gleichstromreizung" am Gehirn durch. Seine Elektroden
hatten einen Durchmesser von lediglich 1/4 mm. Mittels punktgenauer
Stimulation im Hypothalamus
konnte er verschiedenste vegetative Reaktionen und Verhaltensänderungen
der Versuchstiere auslösen. 1949 erhielt er den Nobelpreis für
Physiologie oder Medizin "für die Entdeckung der funktionellen
Organisation des Zwischenhirns für die Koordination der Tätigkeit von
inneren Organen".
Bereits als Student forschte der Schweizer Walter Rudolf Hess
an physiologischen Fragestellungen. Dann arbeitete er als Augenarzt,
bis er sich wieder der Physiologie zuwandte und ab 1917 als Ordinarius
in Zürich wirkte. Ab 1920 führte er seine bahnbrechenden Versuche mit
"unterbrochener Gleichstromreizung" am Gehirn durch. Seine Elektroden
hatten einen Durchmesser von lediglich 1/4 mm. Mittels punktgenauer
Stimulation im Hypothalamus
konnte er verschiedenste vegetative Reaktionen und Verhaltensänderungen
der Versuchstiere auslösen. 1949 erhielt er den Nobelpreis für
Physiologie oder Medizin "für die Entdeckung der funktionellen
Organisation des Zwischenhirns für die Koordination der Tätigkeit von
inneren Organen". Dementsprechend versucht man, diese Systeme pharmakologisch zu
beeinflussen, z.B. mit Methylphenidat (Ritalin): Dieses hemmt präsynaptische Wiederaufnahme-Transporter (reuptake inhibition)
für Dopamin und Noradrenalin und erhöht dadurch deren synaptische
Verfügbarkeit und Wirkung; und es bindet an Serotoninrezeptoren.
Dementsprechend versucht man, diese Systeme pharmakologisch zu
beeinflussen, z.B. mit Methylphenidat (Ritalin): Dieses hemmt präsynaptische Wiederaufnahme-Transporter (reuptake inhibition)
für Dopamin und Noradrenalin und erhöht dadurch deren synaptische
Verfügbarkeit und Wirkung; und es bindet an Serotoninrezeptoren.
 Der Hirnstamm hat motorische, sensorische, vegetative, endokrine
Funktionen. Zu motorischen Aufgaben des Hirnstamms gehören
Körperstabilisierung (posturale Motorik, Halte- und Stellreflexe),
Schutzmotorik, Modulation von Lokomotionsautomatismen (Schreiten,
Laufen)
Der Hirnstamm hat motorische, sensorische, vegetative, endokrine
Funktionen. Zu motorischen Aufgaben des Hirnstamms gehören
Körperstabilisierung (posturale Motorik, Halte- und Stellreflexe),
Schutzmotorik, Modulation von Lokomotionsautomatismen (Schreiten,
Laufen) Die Medulla oblongata hat Chemorezeptoren (Säure-Basen-Haushalt) und
Reflexzentren für Kreislauf, Atmung, Ernährung. Viszerale Afferenzen
der Nn. facialis, glossopharyngeus, vagus informieren den nucleus
tractus solitarii über den Zustand in Carotissinus, Aortenbogen,
Herzräumen, Lunge und gastrointestinalem System. Der viszeromotorische
nucleus ambiguus erhält Afferenzen aus Großhirnrinde und Trigeminuskern
und projiziert auf Muskeln in Gaumen, Rachen und Kehlkopf
(Schluckvorgang, Sprechen)
Die Medulla oblongata hat Chemorezeptoren (Säure-Basen-Haushalt) und
Reflexzentren für Kreislauf, Atmung, Ernährung. Viszerale Afferenzen
der Nn. facialis, glossopharyngeus, vagus informieren den nucleus
tractus solitarii über den Zustand in Carotissinus, Aortenbogen,
Herzräumen, Lunge und gastrointestinalem System. Der viszeromotorische
nucleus ambiguus erhält Afferenzen aus Großhirnrinde und Trigeminuskern
und projiziert auf Muskeln in Gaumen, Rachen und Kehlkopf
(Schluckvorgang, Sprechen) Die Pons enthält Kerne für die Kommunikation zwischen Groß- und
Kleinhirn und kontrolliert die Freigabe des Detrusionsreflexes
(Steuerung der Blasenmotorik)
Die Pons enthält Kerne für die Kommunikation zwischen Groß- und
Kleinhirn und kontrolliert die Freigabe des Detrusionsreflexes
(Steuerung der Blasenmotorik) Das Mesencephalon beteiligt sich an der Extrapyramidalmotorik und steuert die Okulomotorik.
Das Mesencephalon beteiligt sich an der Extrapyramidalmotorik und steuert die Okulomotorik.  Zum Diencephalon gehören Thalamus, Hypothalamus, Zirbeldrüse und
Subthalamus, Pallidum, Raphekerne und Coeruleuskerne. Es entsendet
noradrenerge (Wachheit, Aufmerksamkeit, Angst, Stress,
Blutdruckregulation), serotoninerge (aktivierendes retikuläres System, sensory processing,
Appetit, Körpertemperatur, Stimmungslage), dopaminerge (Motorik,
Psyche, Prolaktinfreisetzung) und cholinerge (Belohnung, Lernen,
Aufmerksamkeit, Gedächtnis) Projektionen in das Vorderhirn
Zum Diencephalon gehören Thalamus, Hypothalamus, Zirbeldrüse und
Subthalamus, Pallidum, Raphekerne und Coeruleuskerne. Es entsendet
noradrenerge (Wachheit, Aufmerksamkeit, Angst, Stress,
Blutdruckregulation), serotoninerge (aktivierendes retikuläres System, sensory processing,
Appetit, Körpertemperatur, Stimmungslage), dopaminerge (Motorik,
Psyche, Prolaktinfreisetzung) und cholinerge (Belohnung, Lernen,
Aufmerksamkeit, Gedächtnis) Projektionen in das Vorderhirn Wachheit und Bewusstsein werden durch Aktivität des aktivierenden
(aszendierenden) retikulären Systems (ARAS, auch extrathalamisches
Kontrollsystem) ermöglicht. Dieses reicht vom Hirnstamm über den
Thalamus bis zur Großhirnrinde, in seinem Zentrum steht die formatio
reticularis des Mittelhirns. Endo- (top down) oder exogen (bottom up) aktiviert, regt es den Cortex an
Wachheit und Bewusstsein werden durch Aktivität des aktivierenden
(aszendierenden) retikulären Systems (ARAS, auch extrathalamisches
Kontrollsystem) ermöglicht. Dieses reicht vom Hirnstamm über den
Thalamus bis zur Großhirnrinde, in seinem Zentrum steht die formatio
reticularis des Mittelhirns. Endo- (top down) oder exogen (bottom up) aktiviert, regt es den Cortex an Der Thalamus hat mehrere Funktionsbereiche: Sensorische (alle Sinne
außer olfaktorisch), motorische (von Basalganglien und Kleinhirn zur
Großhirnrinde), vegetative und emotionale (Teil limbischer
Kreisschaltungen). Die Kerne des Thalamus wirken viszerosensibel,
sensorisch, sensomotorisch und assoziativ
Der Thalamus hat mehrere Funktionsbereiche: Sensorische (alle Sinne
außer olfaktorisch), motorische (von Basalganglien und Kleinhirn zur
Großhirnrinde), vegetative und emotionale (Teil limbischer
Kreisschaltungen). Die Kerne des Thalamus wirken viszerosensibel,
sensorisch, sensomotorisch und assoziativ Der Hypothalamus konzentriert sich auf die Aufrechterhaltung der
Homöostase (Kreislauf, Atmung, Körpertemperatur, Metabolismus /
Nahrungsaufnahme, Flüssigkeitsbilanz, Osmolalität und Nierenfunktion,
vegetative Begleitung von Angriffs- oder Fluchtverhalten, Immunabwehr,
Schlaf-Wach-Rhythmus) und Verhaltenssteuerung
Der Hypothalamus konzentriert sich auf die Aufrechterhaltung der
Homöostase (Kreislauf, Atmung, Körpertemperatur, Metabolismus /
Nahrungsaufnahme, Flüssigkeitsbilanz, Osmolalität und Nierenfunktion,
vegetative Begleitung von Angriffs- oder Fluchtverhalten, Immunabwehr,
Schlaf-Wach-Rhythmus) und Verhaltenssteuerung