



 Ammonshorn (cornu Ammonis): Nach dem ägyptischen Gott Amun, der u.a. in der Form eines Widders verehrt wurde
Ammonshorn (cornu Ammonis): Nach dem ägyptischen Gott Amun, der u.a. in der Form eines Widders verehrt wurde| Sinnesmeldungen werden kortikal für Sekundenbruchteile als sensorisches Gedächtnis gespeichert. Anschließend halten Neuronengruppen im Präfrontalhirn Gedächtnisinhalte über
reziproke Verbindungen mit sekundären Rindenfeldern verfügbar (Kurzzeitgedächtnis), während Verbindungen zur formatio reticularis zusätzlichen Informationsfluss über den Thalamus reduzieren und die Kapazität des Kurzzeitgedächtnisses limitieren (Fokussierung der Aufmerksamkeit). Ein Teil der im Kurzzeitgedächtnis gehaltenen Information wird dauerhaft gespeichert (Langzeitgedächtnis). Dieses teilt man ein in ein  -- deklaratives (explizites, bewusstes) Gedächtnis, vorwiegend im Temporallappen (Hippocampus) gespeichert (semantisch - Fakten, Bedeutungen; episodisch - was, wann, wo, warum), und ein  -- nicht-deklaratives (implizites) - "wissen wie". Das prozedurale Gedächtnis betrifft motorische Fertigkeiten und wird vorwiegend vom Striatum (nucleus caudatus und Putamen) gespeichert (das Kleinhirn verwaltet motorische Reflexe). Der Hippocampus speichert mit Hilfe reziproker Verbindungen mit dem gyrus parahippocampalis kontextuelle und episodische Gedächtnisinhalte und baut deklaratives Gedächtnis auf. Dazu bedarf es synaptischer Verstärkungen (Langzeitpotenzierung) und Neubildungen (Synapsen, lernfähige Kreisschaltungen). Glutamatrezeptoren (NMDAR) spielen für die Gedächtnisbildung eine Schlüsselrolle: Sie sind "Koinzidenzdetektoren" - sie öffnen, wenn sowohl der präsynaptische als auch der postsynaptische Teil der Synapse gleichzeitig oder knapp nacheinander aktiviert wird. Je häufiger das vorkommt, desto intensiver ist der synaptische Effekt (spike-timing dependent plasticity). Längerfristige Veränderungen können sowohl im Sinne einer Verstärkung (Langzeitpotenzierung) oder Abschwächung der Synapsenwirkung erfolgen (Langzeitdepression). |
 Arten von Gedächtnis
Arten von Gedächtnis  Hippocampus und Erinnerung
Hippocampus und Erinnerung  Weitere am Gedächtnis beteiligte Hirnregionen
Weitere am Gedächtnis beteiligte Hirnregionen  Synaptische Plastizität, Langzeitpotenzierung / Langzeitdepression
Synaptische Plastizität, Langzeitpotenzierung / Langzeitdepression  Arten des Lernens
Arten des Lernens

 Entorhinaler Cortex
Entorhinaler Cortex  Langzeitpotenzierung / Langzeitdepression
Langzeitpotenzierung / Langzeitdepression
 Core messages
Core messages Das korrekte Auswachsen von Axonen wird durch spezielle chemotrope Proteine gesteuert, deren Konzentrationsgradient auf die Bewegung bzw. Wachstumsrichtung von Zielzellen entweder anziehend (attraction) oder abweisend wirken (repulsion). Sie werden z.T. sezerniert und werden über
Rezeptoren an der Zellmembran von Zielzellen erkannt und
beeinflusst die Richtung ihrer Fortbewegung bzw. ihres Vorwachsens.
Das korrekte Auswachsen von Axonen wird durch spezielle chemotrope Proteine gesteuert, deren Konzentrationsgradient auf die Bewegung bzw. Wachstumsrichtung von Zielzellen entweder anziehend (attraction) oder abweisend wirken (repulsion). Sie werden z.T. sezerniert und werden über
Rezeptoren an der Zellmembran von Zielzellen erkannt und
beeinflusst die Richtung ihrer Fortbewegung bzw. ihres Vorwachsens. ähneln in ihrem Aufbau dem extrazellulären Matrixprotein Laminin und helfen den Wachstumskegeln vorwachsender Neuriten, ihre synaptischen Ziele zu finden.
ähneln in ihrem Aufbau dem extrazellulären Matrixprotein Laminin und helfen den Wachstumskegeln vorwachsender Neuriten, ihre synaptischen Ziele zu finden. leiten nicht nur - sowohl efferente als auch afferente - Axone bei
Entwicklung und Heilung, sondern erfüllen auch Aufgaben im Rahmen von
Immunfunktionen und Knochenwachstum.
leiten nicht nur - sowohl efferente als auch afferente - Axone bei
Entwicklung und Heilung, sondern erfüllen auch Aufgaben im Rahmen von
Immunfunktionen und Knochenwachstum. Langzeitgedächtnis
Langzeitgedächtnis Information von den Sinnesorganen gelangt zunächst in das Kurzzeitgedächtnis. Es wird vom sensorimotorischen sowie präfrontalen Cortex verwaltet; zum Aufbau des Gedächtnisses (Lernprozess) ist die Hippocampusformation unverzichtbar.
Information von den Sinnesorganen gelangt zunächst in das Kurzzeitgedächtnis. Es wird vom sensorimotorischen sowie präfrontalen Cortex verwaltet; zum Aufbau des Gedächtnisses (Lernprozess) ist die Hippocampusformation unverzichtbar.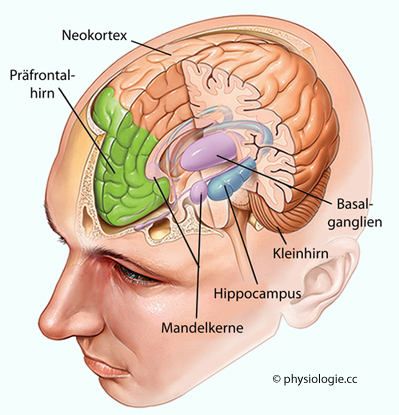
 Abbildung: Erinnerungen speichernde Gehirnregionen
Abbildung: Erinnerungen speichernde Gehirnregionen
 Ein Teil
der im Kurzzeitgedächtnis gehaltenen Information gelangt in das Arbeitsgedächtnis (working memory),
das Information für kurze Zeit speichert (z.B. Autonummer)
und für den Zeitraum einer betreffenden Tätigkeit andauert. Unter der Anleitung einer zentralen "Zuordnungsstation" (central executive) wird der Informationsstrom weitergeleitet - insbesondere zum dorsolateralen Präfrontalcortex, der für das Arbeitsgedächtnis essentiell ist.
Ein Teil
der im Kurzzeitgedächtnis gehaltenen Information gelangt in das Arbeitsgedächtnis (working memory),
das Information für kurze Zeit speichert (z.B. Autonummer)
und für den Zeitraum einer betreffenden Tätigkeit andauert. Unter der Anleitung einer zentralen "Zuordnungsstation" (central executive) wird der Informationsstrom weitergeleitet - insbesondere zum dorsolateralen Präfrontalcortex, der für das Arbeitsgedächtnis essentiell ist.| Das Arbeitsgedächtnis ist eine wesentliche Komponente des Kurzzeitgedächtnisses |
 ).
). Das sekundäre
Gedächtnis hat große Kapazität und speichert Information über längere Zeit (Minuten bis Jahre). Der Zugriff kann
länger dauern (”Einfallen“ z.B. von Prüfungsstoff durch
”Nachdenken“).
Das sekundäre
Gedächtnis hat große Kapazität und speichert Information über längere Zeit (Minuten bis Jahre). Der Zugriff kann
länger dauern (”Einfallen“ z.B. von Prüfungsstoff durch
”Nachdenken“).  Das tertiäre Gedächtnis speichert lebenslang (z.B. eigener Name) und ist durch raschen Zugriff
gekennzeichnet (kein langes Nachdenken nötig).
Das tertiäre Gedächtnis speichert lebenslang (z.B. eigener Name) und ist durch raschen Zugriff
gekennzeichnet (kein langes Nachdenken nötig).
 Abbildung: Formen und Sitz des Langzeitgedächtnisses
Abbildung: Formen und Sitz des Langzeitgedächtnisses
 Deklaratives (explizites, bewusstes) Gedächtnis (Wissensgedächtnis) ermöglicht die Wiedergabe von Fakten und Episoden ("wissen, dass"). Diese Inhalte werden vorwiegend im (mittleren) Temporalhirn
(insbesondere dem Hippocampus) gespeichert (elektrische Reizung des Temporalhirns kann vergessen
geglaubte Erinnerungen aktivieren).
Deklaratives (explizites, bewusstes) Gedächtnis (Wissensgedächtnis) ermöglicht die Wiedergabe von Fakten und Episoden ("wissen, dass"). Diese Inhalte werden vorwiegend im (mittleren) Temporalhirn
(insbesondere dem Hippocampus) gespeichert (elektrische Reizung des Temporalhirns kann vergessen
geglaubte Erinnerungen aktivieren).  semantisches (konzeptbasiertes: Fakten, Bedeutungen),
semantisches (konzeptbasiertes: Fakten, Bedeutungen),  episodisches (autobiografischen: Kontext - was, wann, wo, warum),
episodisches (autobiografischen: Kontext - was, wann, wo, warum),  räumliches (Orte) - eine Domäne des entorhinalen Cortex,
räumliches (Orte) - eine Domäne des entorhinalen Cortex, soziales Gedächtnis (Personen) - insbesondere durch CA2-Neuronen.
soziales Gedächtnis (Personen) - insbesondere durch CA2-Neuronen.  Nicht-deklaratives (implizites, nicht-bewusstes) Gedächtnis (Verhaltensgedächtnis) ermöglicht, zu "wissen, wie".
Dazu zählt auch die (unbewusst gesteuerte) korrekte Grammatik der
Sprache. Sitz des impliziten Gedächtnisses sind insbesondere das Kleinhirn (motorische Fähigkeiten) und die Mandelkerne (emotionale Reaktionen).
Das prozedurale Gedächtnis lernt und speichert Bewegungsabläufe (motorische Fertigkeiten - skill memory) vor allem im Bereich der Basalganglien (Striatum) - das Kleinhirn konzentriert sich auf die Präzision der Bewegungsdurchführung.
Nicht-deklaratives (implizites, nicht-bewusstes) Gedächtnis (Verhaltensgedächtnis) ermöglicht, zu "wissen, wie".
Dazu zählt auch die (unbewusst gesteuerte) korrekte Grammatik der
Sprache. Sitz des impliziten Gedächtnisses sind insbesondere das Kleinhirn (motorische Fähigkeiten) und die Mandelkerne (emotionale Reaktionen).
Das prozedurale Gedächtnis lernt und speichert Bewegungsabläufe (motorische Fertigkeiten - skill memory) vor allem im Bereich der Basalganglien (Striatum) - das Kleinhirn konzentriert sich auf die Präzision der Bewegungsdurchführung. ).
).| Basalganglien und Kleinhirn beteiligen sich an der Bildung des impliziten Gedächtnisses |
 Das Wiederabrufen von (Erinnern
an) im Langzeitgedächtnis gespeicherte(r) Information benötigt
gerichtete Aufmerksamkeit. Dieser Vorgang ermöglicht den Zugang zum
Gedächtnisinhalt, aber auch dessen (unbewusste) Bearbeitung.
Wiederholtes "Erinnern" kann die dentsprechenden Inhalte verstärken, aber auch verformen.
So werden die Gedächtnisinhalte bei wiederholtem Erinnerungsvorgang
zusehends verfälscht (Zeugenaussagen vor Gericht: Je länger das
Ereignis in der Vergangenheit liegt, desto stärker sind die
betreffenden Erinnerungsinhalte unbewusst verändert).
Das Wiederabrufen von (Erinnern
an) im Langzeitgedächtnis gespeicherte(r) Information benötigt
gerichtete Aufmerksamkeit. Dieser Vorgang ermöglicht den Zugang zum
Gedächtnisinhalt, aber auch dessen (unbewusste) Bearbeitung.
Wiederholtes "Erinnern" kann die dentsprechenden Inhalte verstärken, aber auch verformen.
So werden die Gedächtnisinhalte bei wiederholtem Erinnerungsvorgang
zusehends verfälscht (Zeugenaussagen vor Gericht: Je länger das
Ereignis in der Vergangenheit liegt, desto stärker sind die
betreffenden Erinnerungsinhalte unbewusst verändert). Das Arbeitsgedächtnis nutzt frontale und parietale Rindengebiete
Das Arbeitsgedächtnis nutzt frontale und parietale Rindengebiete Lernen und Erinnern erfordert die Kooperation zahlreicher Hirnregionen
Lernen und Erinnern erfordert die Kooperation zahlreicher Hirnregionen Unterschiedliche Formen des Gedächtnisses beruhen auf der Leistung
unterschiedlicher (wenn auch überlappender) Hirnregionen
Unterschiedliche Formen des Gedächtnisses beruhen auf der Leistung
unterschiedlicher (wenn auch überlappender) Hirnregionen Jede dieser Hirnregionen beteiligt sich an unterschiedlichen Gedächtnisleistungen
Jede dieser Hirnregionen beteiligt sich an unterschiedlichen Gedächtnisleistungen

 Abbildung: Hippocampusformation
Abbildung: Hippocampusformation
 Der im medialen Temporallappen gelegene entorhinale Cortex ist
ein Teil des (dreischichtigen, entwicklungsgeschichtlich älteren)
Allocortex und ist mit Gedächtnisaufbau, örtlicher und zeitlicher
Orientierung beschäftigt. Funktionell ist er zwischen Hippocampus und
Neocortex geschaltet. Seine Neuriten bilden Synapsen mit Zellen des
gyrus dentatus (
Der im medialen Temporallappen gelegene entorhinale Cortex ist
ein Teil des (dreischichtigen, entwicklungsgeschichtlich älteren)
Allocortex und ist mit Gedächtnisaufbau, örtlicher und zeitlicher
Orientierung beschäftigt. Funktionell ist er zwischen Hippocampus und
Neocortex geschaltet. Seine Neuriten bilden Synapsen mit Zellen des
gyrus dentatus ( Abbildung unten) und bauen Langzeitpotenzierung auf.
Abbildung unten) und bauen Langzeitpotenzierung auf. (eines Teils des Hippocampus, in der medialen Wand des Temporallappens) erreichen:
(eines Teils des Hippocampus, in der medialen Wand des Temporallappens) erreichen:  aus lamina II direkt sowie und über Zwischenschaltung im gyrus dentatus und
aus lamina II direkt sowie und über Zwischenschaltung im gyrus dentatus und aus lamina III direkt.
aus lamina III direkt. Abbildung unten). CA3-Neuronen
(Pyramidenzellen) bilden auch untereinander starke exzitatorische
Konnexe. Auch das dient offenbar der Verstärkung von Gedächtnisspuren,
kann aber bei Übererregung zur Auslösung von Krämpfen führen.
Abbildung unten). CA3-Neuronen
(Pyramidenzellen) bilden auch untereinander starke exzitatorische
Konnexe. Auch das dient offenbar der Verstärkung von Gedächtnisspuren,
kann aber bei Übererregung zur Auslösung von Krämpfen führen.  Abbildung):
Abbildung):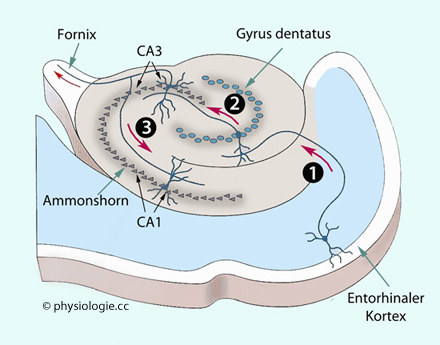
 Abbildung: Hippocampales Modellnetzwerk für Gedächtnisbildung
Abbildung: Hippocampales Modellnetzwerk für Gedächtnisbildung

 Zur Bedeutung des Hippocampus für Gedächtnis und Raumorientierung s. dort
Zur Bedeutung des Hippocampus für Gedächtnis und Raumorientierung s. dort zu
CA1-Zellen → Fasern zu Subiculum → Fasern zurück zum entorhinalen Cortex.
CA3-Zellen haben auto-assoziative Verstärkungskollateralen.
zu
CA1-Zellen → Fasern zu Subiculum → Fasern zurück zum entorhinalen Cortex.
CA3-Zellen haben auto-assoziative Verstärkungskollateralen.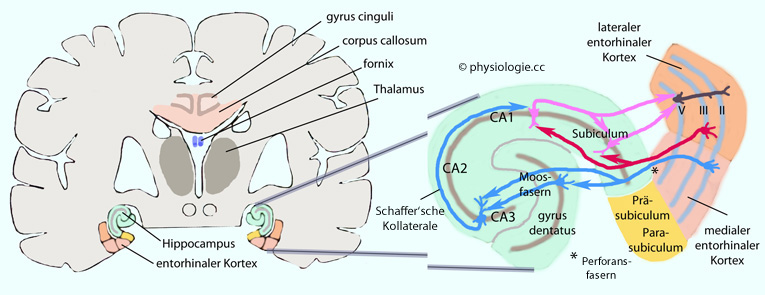
 Abbildung: Schaltungen in Subiculum und hippocampalem System
Abbildung: Schaltungen in Subiculum und hippocampalem System
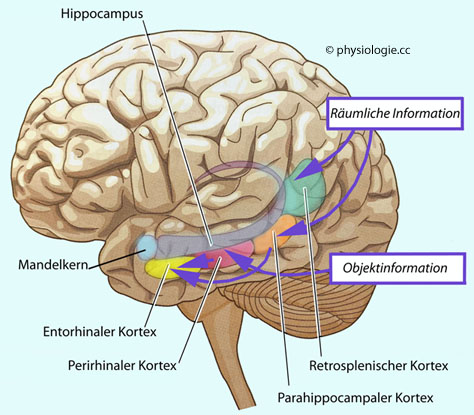
 Abbildung: An der Gedächtnisbildung beteiligte Regionen im mittleren Temporalhirn
Abbildung: An der Gedächtnisbildung beteiligte Regionen im mittleren Temporalhirn
 Abbildung) und im Präfrontalcortex. An den Hippocampus grenzen
Abbildung) und im Präfrontalcortex. An den Hippocampus grenzen  der retrosplenische Cortex
(entspricht Brodmann 29 und 30), ein assoziatives Rindengebiet, das
hinter dem Splenium des corpus callosum liegt und sich an episodischem
Gedächtnis, Raumanalyse und Körpernavigation ("ich" vs. "Umwelt")
beteiligt;
der retrosplenische Cortex
(entspricht Brodmann 29 und 30), ein assoziatives Rindengebiet, das
hinter dem Splenium des corpus callosum liegt und sich an episodischem
Gedächtnis, Raumanalyse und Körpernavigation ("ich" vs. "Umwelt")
beteiligt; der parahippocampale Cortex, zusammen mit dem retrosplenischen dient er offenbar vor allem der Projektion räumlicher Hinweise zur Gedächtnisbildung. Seine parahippocampal place area
(PPA) speichert und erkennt Umweltmuster (Räume, Landschaften), andere
Teile - vor allem im rechten gyrus parahippocampalis - erkennen soziale
Kontexte (z.B. Ironie, Sarkasmus);
der parahippocampale Cortex, zusammen mit dem retrosplenischen dient er offenbar vor allem der Projektion räumlicher Hinweise zur Gedächtnisbildung. Seine parahippocampal place area
(PPA) speichert und erkennt Umweltmuster (Räume, Landschaften), andere
Teile - vor allem im rechten gyrus parahippocampalis - erkennen soziale
Kontexte (z.B. Ironie, Sarkasmus); der perirhinale Cortex (Brodmann 35 / 36) verarbeitet Information über Objekte und ihre Identität;
der perirhinale Cortex (Brodmann 35 / 36) verarbeitet Information über Objekte und ihre Identität;  der entorhinale Cortex
(Brodmann 28 / 34) erhält und verwaltet Informationen, die über
getrennte Modalitäten hinausgehen können und sowohl räumliche als auch
zeitliche Komponenten haben.
der entorhinale Cortex
(Brodmann 28 / 34) erhält und verwaltet Informationen, die über
getrennte Modalitäten hinausgehen können und sowohl räumliche als auch
zeitliche Komponenten haben. 
 Abbildung: Netzwerke für Lernen und Gedächtnis
Abbildung: Netzwerke für Lernen und Gedächtnis
 Abbildung) sind in motorische Lern-, Merk- und Gedächtnisabläufe involviert. Zu entsprechenden Fähigkeiten des Kleinhirns s. dort.
Abbildung) sind in motorische Lern-, Merk- und Gedächtnisabläufe involviert. Zu entsprechenden Fähigkeiten des Kleinhirns s. dort. präsynaptisch - Variation der Menge des pro Aktionspotential ausgeschütteten und / oder wiederaufgenommenen Transmitters, und / oder
präsynaptisch - Variation der Menge des pro Aktionspotential ausgeschütteten und / oder wiederaufgenommenen Transmitters, und / oder postsynaptisch - bezüglich Transmittereffekt (Zahl und/oder Empfindlichkeit der Rezeptoren) und Transmitterabbau.
postsynaptisch - bezüglich Transmittereffekt (Zahl und/oder Empfindlichkeit der Rezeptoren) und Transmitterabbau. Werden
mehr Rezeptoren in die Synapse eingebaut als aus ihr entfernt, dann
wächst die Rezeptorzahl und damit das Ausmaß der Depolarisation (EPSP)
pro Quantum freigesetzten Glutamins;
Werden
mehr Rezeptoren in die Synapse eingebaut als aus ihr entfernt, dann
wächst die Rezeptorzahl und damit das Ausmaß der Depolarisation (EPSP)
pro Quantum freigesetzten Glutamins;  umgekehrt nimmt die Amplitude des EPSP ab, wenn mehr Rezeptoren endo- als exozytiert werden.
umgekehrt nimmt die Amplitude des EPSP ab, wenn mehr Rezeptoren endo- als exozytiert werden.  NMDA-Glutamatrezeptoren (NMDAR) öffnen nur, wenn die Membran (in der sie lokalisiert sind) depolarisiert wird. Sie sind im offenen Zustand durchgängig für Na+- und (vor allem) Ca++-Ionen. Lagern sie Glutamat im nicht-depolarisierten Zustand an, ist der Ionenkanal aber durch Mg++-Ionen blockiert (Magnesiumblock).
NMDA-Glutamatrezeptoren (NMDAR) öffnen nur, wenn die Membran (in der sie lokalisiert sind) depolarisiert wird. Sie sind im offenen Zustand durchgängig für Na+- und (vor allem) Ca++-Ionen. Lagern sie Glutamat im nicht-depolarisierten Zustand an, ist der Ionenkanal aber durch Mg++-Ionen blockiert (Magnesiumblock).  AMPA-Glutamatrezeptoren (AMPAR) sind bei Anlagerung von Glutamat zwar für Na+
durchgängig und lassen dieses auch in die Zelle, der Natriumeinstrom
führt aber nur zu relativ geringer Depolarisation, nicht zu
Calciumeinstrom.
AMPA-Glutamatrezeptoren (AMPAR) sind bei Anlagerung von Glutamat zwar für Na+
durchgängig und lassen dieses auch in die Zelle, der Natriumeinstrom
führt aber nur zu relativ geringer Depolarisation, nicht zu
Calciumeinstrom.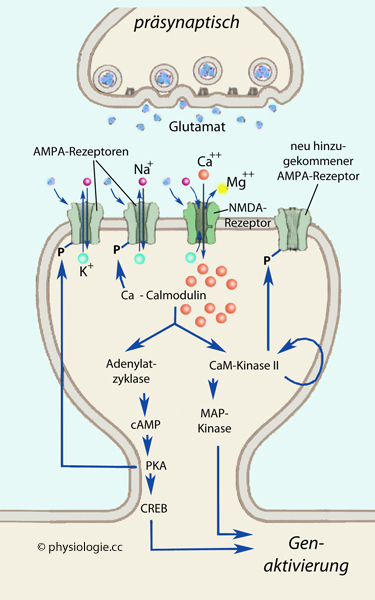
 Abbildung: Mechanismen der Langzeitpotenzierung
Abbildung: Mechanismen der Langzeitpotenzierung s. dort) und ermöglicht die Einwärtsdiffusion von Ca++-Ionen. Intrazelluläre Ca++-Ionen aktivieren zahlreiche Enzyme, u.a. Calmodulin; Ca++-Calmodulin
ist der entscheidende Signalstoff für die Langzeitpotenzierung: Es
aktiviert weitere Enzyme, wie Adenylylcyclase (Adenylatzyklase) und die
Ca++-Calmodulin-abhängige Proteinkinase (CaM-Kinase II), die sich selbst phosphoryliert.
s. dort) und ermöglicht die Einwärtsdiffusion von Ca++-Ionen. Intrazelluläre Ca++-Ionen aktivieren zahlreiche Enzyme, u.a. Calmodulin; Ca++-Calmodulin
ist der entscheidende Signalstoff für die Langzeitpotenzierung: Es
aktiviert weitere Enzyme, wie Adenylylcyclase (Adenylatzyklase) und die
Ca++-Calmodulin-abhängige Proteinkinase (CaM-Kinase II), die sich selbst phosphoryliert.
 Langzeitpotenzierung (LTP: Long-term potentiation) ist die Zunahme der Synapsenstärke, die für mindestens eine Stunde anhält. Das Gegenteil ist Langzeitdepression (LTD, long-term
depression),
die sich (bei niedriger Reizfrequenz, z.B. 10/s) an denselben Synapsen
bemerkbar machen kann, an denen (bei hoher Reizfrequenz, z.B. einige
hundert Aktionspotentiale bei 50 Hz) Langzeitpotenzierung erfolgt. Eine
Schlüsselrolle spielt dabei das intrazelluläre [Ca++]
- ist es hoch, werden vor allem Kinasen, ist es niedrig, vor allem
Phosphatasen aktiviert (s. unten). Voraussetzung für
Langzeitpotenzierung ist eine ausreichende Depolarisierung
der Empfängerzelle, die durch hohe Reizfrequenz erreicht werden kann
(einzelne oder niedrigfrequente Stimuli sind dazu nicht in der Lage).
Langzeitpotenzierung (LTP: Long-term potentiation) ist die Zunahme der Synapsenstärke, die für mindestens eine Stunde anhält. Das Gegenteil ist Langzeitdepression (LTD, long-term
depression),
die sich (bei niedriger Reizfrequenz, z.B. 10/s) an denselben Synapsen
bemerkbar machen kann, an denen (bei hoher Reizfrequenz, z.B. einige
hundert Aktionspotentiale bei 50 Hz) Langzeitpotenzierung erfolgt. Eine
Schlüsselrolle spielt dabei das intrazelluläre [Ca++]
- ist es hoch, werden vor allem Kinasen, ist es niedrig, vor allem
Phosphatasen aktiviert (s. unten). Voraussetzung für
Langzeitpotenzierung ist eine ausreichende Depolarisierung
der Empfängerzelle, die durch hohe Reizfrequenz erreicht werden kann
(einzelne oder niedrigfrequente Stimuli sind dazu nicht in der Lage). Wird die Membran stärker depolarisiert, dann dissoziiert Mg++ vom Ionenkanal des NMDA-Rezeptors, und dieser lässt bei Glutamatbindung Ca++-Ionen
eindringen.
Wird die Membran stärker depolarisiert, dann dissoziiert Mg++ vom Ionenkanal des NMDA-Rezeptors, und dieser lässt bei Glutamatbindung Ca++-Ionen
eindringen.  Diese aktivieren Proteinkinasen, welche AMPA-Rezeptoren phosphorylieren.
Diese aktivieren Proteinkinasen, welche AMPA-Rezeptoren phosphorylieren. Das wiederum fördert die Einlagerung von
AMPA-Rezeptoren in die postsynaptische Membran ("AMPAfizierung").
Das wiederum fördert die Einlagerung von
AMPA-Rezeptoren in die postsynaptische Membran ("AMPAfizierung").  Abbildung).
Abbildung).| Präsynaptische Aktionspotentialsalven führen zu Glutamatfreisetzung und postsynaptischen EPSPs durch Kationeneinstrom An nicht aktivierten glutamatergen Synapsen sind die NMDA-Rezeptoren durch Magnesiumionen blockiert Vordepolarisation öffnet NMDA-Rezeptoren, Ca++ strömt ein. Ca++-aktivierbare Proteinkinase phosphoryliert AMPA-Rezeptoren, die in die postsynaptische Membran eingelagert werden ("AMPAfizierung"), Na+ strömt ein und verstärkt die Depolarisation (Langzeitpotenzierung LTP) |
 Unter Basisbedingungen (Ruhepotential)
bewirkt - präsynaptisch freigesetztes - Glutamat an AMPA-Rezeptoren (AMPAR) geringgradigen postsynaptischen Natriumeinstrom, NMDA-Rezeptoren (NMDAR) sind hingegen durch Magnesiumionen (Mg2+) blockiert.
Unter Basisbedingungen (Ruhepotential)
bewirkt - präsynaptisch freigesetztes - Glutamat an AMPA-Rezeptoren (AMPAR) geringgradigen postsynaptischen Natriumeinstrom, NMDA-Rezeptoren (NMDAR) sind hingegen durch Magnesiumionen (Mg2+) blockiert. Ist die postsynaptische Membran depolarisiert (geringeres Ruhepotential), lösen sich Magnesiumionen vom NMDAR,
der Magnesiumblock wird durchbrochen, Natrium- und (vor allem) Calciumionen können bei Bindung von Glutamat einströmen. Erhöhtes [Ca++]
in der Zelle aktiviert Kinasen und triggert so zelluläre Reaktionen,
wie vermehrte Einlagerung von AMPAR in die postsynaptische Membran.
Solange der postsynaptische Fortsatz depolarisiert und der
Magnesiumblock aufgehoben ist, wirkt Glutamat am Dendriten-Dornenfortsatz (dendritic spine) weiter aktivierend.
Ist die postsynaptische Membran depolarisiert (geringeres Ruhepotential), lösen sich Magnesiumionen vom NMDAR,
der Magnesiumblock wird durchbrochen, Natrium- und (vor allem) Calciumionen können bei Bindung von Glutamat einströmen. Erhöhtes [Ca++]
in der Zelle aktiviert Kinasen und triggert so zelluläre Reaktionen,
wie vermehrte Einlagerung von AMPAR in die postsynaptische Membran.
Solange der postsynaptische Fortsatz depolarisiert und der
Magnesiumblock aufgehoben ist, wirkt Glutamat am Dendriten-Dornenfortsatz (dendritic spine) weiter aktivierend. AMPAR zirkulieren zwischen intra- und
extrazellulärer Position (Recycling). Dieses dynamische Gleichgewicht
kann durch vermehrte Einlagerung von Rezeptoren in Richtung
Langzeitpotenzierung (LTP), oder durch deren vermehrte Endozytose in Richtung
Langzeitdepression (LTD) verschoben werden.
AMPAR zirkulieren zwischen intra- und
extrazellulärer Position (Recycling). Dieses dynamische Gleichgewicht
kann durch vermehrte Einlagerung von Rezeptoren in Richtung
Langzeitpotenzierung (LTP), oder durch deren vermehrte Endozytose in Richtung
Langzeitdepression (LTD) verschoben werden. Nach Induktion einer Langzeitpotenzierung
durch fortlaufende ("tetanische") Reizung verstärkt sich die Exozytose
von AMPAR ("AMPAfizierung"), und die Rezeptoren werden durch einen Ca++-abhängigen
Prozess unter Wirkung von Proteinkinasen - u.a. CaMKII - und Fusion von
Endosomen (durch die GTPase Rab11a) in der Membran stabilisiert. Resultat ist die Konservierung von Gedächtnisspuren.
Nach Induktion einer Langzeitpotenzierung
durch fortlaufende ("tetanische") Reizung verstärkt sich die Exozytose
von AMPAR ("AMPAfizierung"), und die Rezeptoren werden durch einen Ca++-abhängigen
Prozess unter Wirkung von Proteinkinasen - u.a. CaMKII - und Fusion von
Endosomen (durch die GTPase Rab11a) in der Membran stabilisiert. Resultat ist die Konservierung von Gedächtnisspuren. Niedrige Stimulationsstärke induziert Langzeitdepression,
dabei verstärkt sich die Endozytose von AMPAR, wobei Phosphatasen
- wie
Calcineurin oder Proteinphosphatase 1 (PP1) - eine Rolle spielen. Die
Rezeptoren werden in der Zelle gespeichert oder abgebaut. Dieser
Mechanismus ist ein Gegengewicht zur Langzeitpotenzierung und dient der
Feineinstellung ("Schärfung") von Gedächtnismustern.
Niedrige Stimulationsstärke induziert Langzeitdepression,
dabei verstärkt sich die Endozytose von AMPAR, wobei Phosphatasen
- wie
Calcineurin oder Proteinphosphatase 1 (PP1) - eine Rolle spielen. Die
Rezeptoren werden in der Zelle gespeichert oder abgebaut. Dieser
Mechanismus ist ein Gegengewicht zur Langzeitpotenzierung und dient der
Feineinstellung ("Schärfung") von Gedächtnismustern. Ausreichende Depolarisierung der postsynaptischen Membran, um den "Magnesiumblock" an NMDA-Rezeptoren zu beseitigen
Ausreichende Depolarisierung der postsynaptischen Membran, um den "Magnesiumblock" an NMDA-Rezeptoren zu beseitigen Bindung von Glutamat an Glutamatrezeptoren
Bindung von Glutamat an Glutamatrezeptoren Bindung von Glyzin oder Serin an Glyzin-Bindungsstellen
Bindung von Glyzin oder Serin an Glyzin-Bindungsstellen Die
durch AMPA-Rezeptoren erfolgte Depolarisierung ist der primäre
sensitierende Vorgang: Depolarisierung der postsynaptischen Membran
ermöglicht prä-postsynaptische Koinzidenzdetektion durch
NMDA-Rezeptoren.
Die
durch AMPA-Rezeptoren erfolgte Depolarisierung ist der primäre
sensitierende Vorgang: Depolarisierung der postsynaptischen Membran
ermöglicht prä-postsynaptische Koinzidenzdetektion durch
NMDA-Rezeptoren. Nach
wiederholter gleichzeitiger Erregung
des prä- und postsynaptischen Neurons (Koinzidenz) bilden sich für Tage
bis Wochen (manchmal auch länger) verstärkte synaptische
Übertragungen aus. Calciumionen aktivieren Proteinkinasen, Phospholipasen und neuronale
NO-Synthase (nNOS), was u.a. zu Verstärkung der Synapsenwirkung und auch Erhöhung der Synapsenzahl führt. Im postsynaptischen Teil werden
AMPA-Rezeptoren in die Membran eingebaut, die synaptische Kapazität
steigt (Langzeitpotenzierung: "Neurons that fire together wire together").
Nach
wiederholter gleichzeitiger Erregung
des prä- und postsynaptischen Neurons (Koinzidenz) bilden sich für Tage
bis Wochen (manchmal auch länger) verstärkte synaptische
Übertragungen aus. Calciumionen aktivieren Proteinkinasen, Phospholipasen und neuronale
NO-Synthase (nNOS), was u.a. zu Verstärkung der Synapsenwirkung und auch Erhöhung der Synapsenzahl führt. Im postsynaptischen Teil werden
AMPA-Rezeptoren in die Membran eingebaut, die synaptische Kapazität
steigt (Langzeitpotenzierung: "Neurons that fire together wire together"). Werden der prä- und postsynaptische Teil hingegen desynchron oder nur schwach aktiviert
(fehlende oder unzureichende Koinzidenz), werden AMPA-Rezeptoren internalisiert
(endozytiert), die Synapseneffizienz nimmt ab, und es kann zur
Zurückbildung der Synapse kommen (Langzeitdepression: "Neurons that fire out of sync lose their link").
Werden der prä- und postsynaptische Teil hingegen desynchron oder nur schwach aktiviert
(fehlende oder unzureichende Koinzidenz), werden AMPA-Rezeptoren internalisiert
(endozytiert), die Synapseneffizienz nimmt ab, und es kann zur
Zurückbildung der Synapse kommen (Langzeitdepression: "Neurons that fire out of sync lose their link"). Abbildung unten). Ferner gibt es außer NMDAR auch andere Koinzidenzdetektoren, z.B. Phospholipase C an hippocampalen Synapsen - präsynaptisch und postsynaptisch.
Abbildung unten). Ferner gibt es außer NMDAR auch andere Koinzidenzdetektoren, z.B. Phospholipase C an hippocampalen Synapsen - präsynaptisch und postsynaptisch. 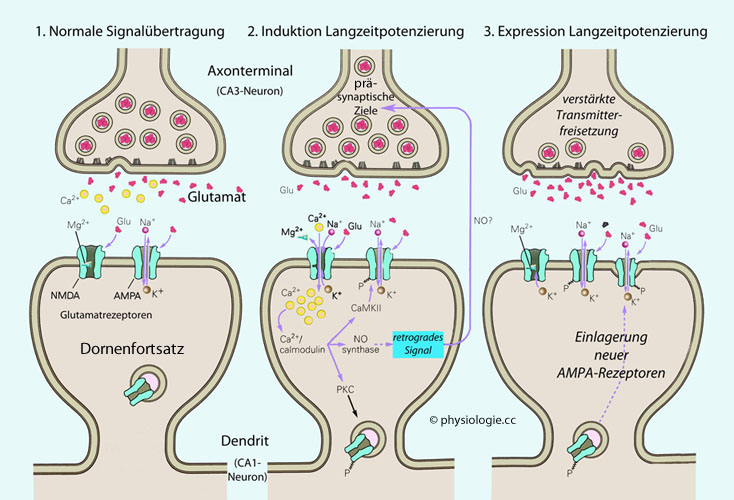
 Abbildung: Langzeitpotenzierung synaptischer Übertragung
Abbildung: Langzeitpotenzierung synaptischer Übertragung

 Abbildung). Dadurch wird der Effekt einer Synapsenaktivierung und auch die Synapsenzahl modifiziert.
Abbildung). Dadurch wird der Effekt einer Synapsenaktivierung und auch die Synapsenzahl modifiziert. werden vom angeregten postsynaptischen Apparat freigesetzt
und diffundieren zum präsynaptischen Teil, binden hier an entsprechende
Rezeptoren und modulieren die Transmitterfreisetzung - z.B. durch
Einfluss auf den Calciumeinstrom. Nimmt dieser zu, werden Vesikel
mobilisiert, die Transmitterfreisetzung vermehrt und die synaptische
Effizienz gesteigert (
werden vom angeregten postsynaptischen Apparat freigesetzt
und diffundieren zum präsynaptischen Teil, binden hier an entsprechende
Rezeptoren und modulieren die Transmitterfreisetzung - z.B. durch
Einfluss auf den Calciumeinstrom. Nimmt dieser zu, werden Vesikel
mobilisiert, die Transmitterfreisetzung vermehrt und die synaptische
Effizienz gesteigert ( Abbildung oben).
Abbildung oben).| Stickstoffmonoxid wirkt als retrograder Neurotransmitter |
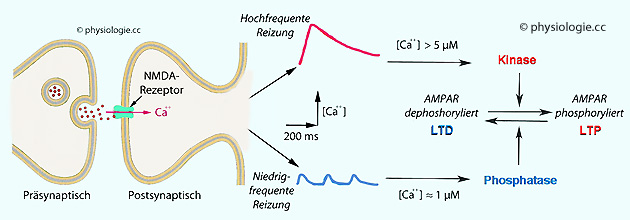
 Abbildung: Wie Ca++ sowohl LTP als auch LTD triggern kann
Abbildung: Wie Ca++ sowohl LTP als auch LTD triggern kann

 Abbildung): Hochfrequente Stimulierung der Synapse aktiviert über
starken Calciumeinstrom (intrazellulärer Ca++-Spiegel über 5 µM) Kinasen und
AMPA-Rezeptoren, was zu Verstärkung der Synapsenwirkung führt (LTP
erklärt sich auch über vermehrte AMPAR-Zahl).
Abbildung): Hochfrequente Stimulierung der Synapse aktiviert über
starken Calciumeinstrom (intrazellulärer Ca++-Spiegel über 5 µM) Kinasen und
AMPA-Rezeptoren, was zu Verstärkung der Synapsenwirkung führt (LTP
erklärt sich auch über vermehrte AMPAR-Zahl).  Das bedeutet, dass nahe an aktivierten Synapsen gelegene andere
Synapsen an LTP- und LTD-Prozessen mitbeteiligt sind (diese Synapsen
"lernen mit"), während weiter entfernt liegende von solchen lokalen
Vorgängen unbeeinflusst bleiben (Selektivität).
Das bedeutet, dass nahe an aktivierten Synapsen gelegene andere
Synapsen an LTP- und LTD-Prozessen mitbeteiligt sind (diese Synapsen
"lernen mit"), während weiter entfernt liegende von solchen lokalen
Vorgängen unbeeinflusst bleiben (Selektivität).  Abbildung) scheint eine Rolle zu spielen:
Abbildung) scheint eine Rolle zu spielen:
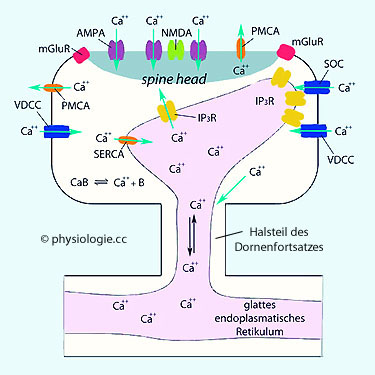
 Abbildung: Calciumverteilung in einem dendritischen Dornenfortsatz
Abbildung: Calciumverteilung in einem dendritischen Dornenfortsatz IP3R, IP3-Rezeptor
IP3R, IP3-Rezeptor  mGluR, metabotroper Glutamatrezeptor
mGluR, metabotroper Glutamatrezeptor  PMCA, Plasmamembran Ca++-ATPase
PMCA, Plasmamembran Ca++-ATPase  SERCA regelt das Wiederauffüllen des Calciumspeichers im endoplasmatischen Retikulum)
SERCA regelt das Wiederauffüllen des Calciumspeichers im endoplasmatischen Retikulum)  SOC, store-operated calcium channel (für die Aufnahme von Calciumionen)
SOC, store-operated calcium channel (für die Aufnahme von Calciumionen)  VDCC, voltage-dependent calcium channel. Calciumionen
triggern eine Kaskade intrazellulärer Folgevorgänge, inklusive die
Aktivierung von Kinasen, was schließlich zur Verstärkung der
synaptischen Übertragung führt
VDCC, voltage-dependent calcium channel. Calciumionen
triggern eine Kaskade intrazellulärer Folgevorgänge, inklusive die
Aktivierung von Kinasen, was schließlich zur Verstärkung der
synaptischen Übertragung führt
 : Eine wichtige Rolle für die Langzeitpotenzierung spielt das große (388 kD) Glykoprotein Reelin,
das der Gedächtnisverfestigung und der ontogenetischen
Organisation der Neuronenzellschichten im Hippocampus dient.
Es
beeinflusst Migration und Interaktion von Nervenzellen und regt die
Ausbildung von dendritischen Fortsätzen an. Ein Mangel an Reelin
scheint für die Entwicklung verschiedener neuropathologischer
Zustandsbilder eine Rolle zu spielen.
: Eine wichtige Rolle für die Langzeitpotenzierung spielt das große (388 kD) Glykoprotein Reelin,
das der Gedächtnisverfestigung und der ontogenetischen
Organisation der Neuronenzellschichten im Hippocampus dient.
Es
beeinflusst Migration und Interaktion von Nervenzellen und regt die
Ausbildung von dendritischen Fortsätzen an. Ein Mangel an Reelin
scheint für die Entwicklung verschiedener neuropathologischer
Zustandsbilder eine Rolle zu spielen.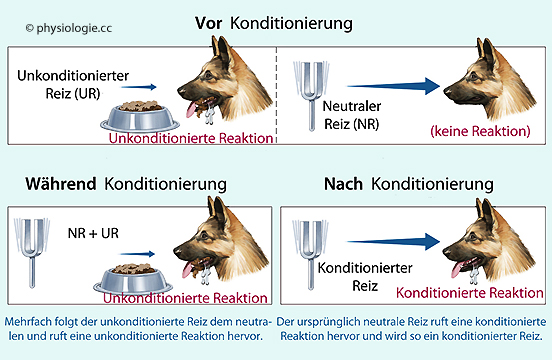
 Abbildung: Klassische Konditionierung
Abbildung: Klassische Konditionierung
 Klassische Konditionierung (
Klassische Konditionierung ( Abbildung): Hier geht es darum, eine neuronale Verknüpfung zwischen einem neutralen Sinnesreiz und einem knapp darauf folgenden unkonditionierten Reiz (unconditioned stimulus) herzustellen. Als unkonditioniert bezeichnet man einen Reiz, der zu einer physiologisch "vorprogrammierten" Antwort führt (z.B. Perzipierung von Futter → Salivation).
Abbildung): Hier geht es darum, eine neuronale Verknüpfung zwischen einem neutralen Sinnesreiz und einem knapp darauf folgenden unkonditionierten Reiz (unconditioned stimulus) herzustellen. Als unkonditioniert bezeichnet man einen Reiz, der zu einer physiologisch "vorprogrammierten" Antwort führt (z.B. Perzipierung von Futter → Salivation). Abbildung). Man sagt, der neutrale Reiz ist zu einem "konditionierten" geworden und löst eine konditionierte Reaktion (conditioned response) aus.
Abbildung). Man sagt, der neutrale Reiz ist zu einem "konditionierten" geworden und löst eine konditionierte Reaktion (conditioned response) aus. Operante Konditionierung: Von verschiedenen Verhaltensweisen (z.B. nach Futter suchen, zu einem Lichtsignal laufen,..) führt nur eine (z.B. Drücken eines Schalters) zum Erfolg (z.B. Fütterung). Das
lernt das Versuchstier nach dem Prinzip von Versuch und Irrtum. Das
Versuchsdesign kann auch bestimmte Verhaltensweisen bestrafen (z.B.
Stromschlag). Belohnung führt zu positiver, Bestrafung zu negativer Konditionierung.
Operante Konditionierung: Von verschiedenen Verhaltensweisen (z.B. nach Futter suchen, zu einem Lichtsignal laufen,..) führt nur eine (z.B. Drücken eines Schalters) zum Erfolg (z.B. Fütterung). Das
lernt das Versuchstier nach dem Prinzip von Versuch und Irrtum. Das
Versuchsdesign kann auch bestimmte Verhaltensweisen bestrafen (z.B.
Stromschlag). Belohnung führt zu positiver, Bestrafung zu negativer Konditionierung.  (infolge Hirnschädigung, Thiaminmangel, Alkoholabusus u.a.) oder schockartige Ereignisse (Unfall,
Blutung) verklingen neue Gedächtnisinhalte spurlos. Der Patient ist ab
dem auslösenden Ereignis unfähig, sich Neues zu merken; soeben Erlebtes wird gleich wieder vergessen.
(infolge Hirnschädigung, Thiaminmangel, Alkoholabusus u.a.) oder schockartige Ereignisse (Unfall,
Blutung) verklingen neue Gedächtnisinhalte spurlos. Der Patient ist ab
dem auslösenden Ereignis unfähig, sich Neues zu merken; soeben Erlebtes wird gleich wieder vergessen.  Das Kurzzeitgedächtnis speichert via limbisches System Sinnesmeldungen
in der Gehirnrinde. Zunächst entstehen sensorische Zwischenspeicher in
Form berarbeiteter Informationspakete (z.B. visuelle "Wo"-Inhalte im
Parietalhirn, "Was"-Inhalte im Temporalhirn)
Das Kurzzeitgedächtnis speichert via limbisches System Sinnesmeldungen
in der Gehirnrinde. Zunächst entstehen sensorische Zwischenspeicher in
Form berarbeiteter Informationspakete (z.B. visuelle "Wo"-Inhalte im
Parietalhirn, "Was"-Inhalte im Temporalhirn) Als Komponente des
Kurzzeitgedächtnisses speichert das Arbeitsgedächtnis für Sekunden sensorische Information in
einem Informationspuffer. Dabei steigt die Aktivität des Parahippocampus
und des Präfrontalhirns Als Komponente des
Kurzzeitgedächtnisses speichert das Arbeitsgedächtnis für Sekunden sensorische Information in
einem Informationspuffer. Dabei steigt die Aktivität des Parahippocampus
und des Präfrontalhirns Das Langzeitgedächtnis sitzt vor allem in Regionen, in welche der
betreffende Sinneseindruck projiziert wurde. Das sekundäre Gedächtnis
verfügt über große Kapazität und speichert über Jahre, der Zugriff
erfolgt über ”Nachdenken“. Inhalte im tertiären Gedächtnis sind sofort
verfügbar und gehen normalerweise nicht verloren
Das Langzeitgedächtnis sitzt vor allem in Regionen, in welche der
betreffende Sinneseindruck projiziert wurde. Das sekundäre Gedächtnis
verfügt über große Kapazität und speichert über Jahre, der Zugriff
erfolgt über ”Nachdenken“. Inhalte im tertiären Gedächtnis sind sofort
verfügbar und gehen normalerweise nicht verloren Deklaratives (explizites, bewusstes) Gedächtnis (Wissensgedächtnis)
speichert Fakten und Episoden, es wird im Temporallappen gespeichert.
Nicht-deklaratives (implizites, nicht-bewusstes) Gedächtnis
(Bewegungsabläufe - prozedurales Gedächtnis, Sprachgrammatik) wird in
Kleinhirn und Basalganglien gespeichert
Deklaratives (explizites, bewusstes) Gedächtnis (Wissensgedächtnis)
speichert Fakten und Episoden, es wird im Temporallappen gespeichert.
Nicht-deklaratives (implizites, nicht-bewusstes) Gedächtnis
(Bewegungsabläufe - prozedurales Gedächtnis, Sprachgrammatik) wird in
Kleinhirn und Basalganglien gespeichert Der Hippocampus ermöglicht das Entstehen von Erinnerungen. Dazu ist er
reziprok mit dem parahippocampalen Cortex verbunden - dieser bezieht
aktuelle Informationen aus kortikalen Assoziationsarealen - und ist in
die limbische Kreisschaltung ("Papez-Kreise") eingebaut, die zum Merken
und Erinnern notwendige Mechanismen aufbaut. Der Hippocampus erneuert
laufend seinen Neuronenpool, junge Neurone sind sehr erregbar und
bilden fortlaufend synaptische Kontakte aus, insbesondere
zur parahippocampalen Region. Junge Zellgruppen erfüllen dynamische
Gedächtnisfunktionen, z.B. zur Erkennung von Orten in der Umgebung
(Ortszellen,
Ortsfelder)
Der Hippocampus ermöglicht das Entstehen von Erinnerungen. Dazu ist er
reziprok mit dem parahippocampalen Cortex verbunden - dieser bezieht
aktuelle Informationen aus kortikalen Assoziationsarealen - und ist in
die limbische Kreisschaltung ("Papez-Kreise") eingebaut, die zum Merken
und Erinnern notwendige Mechanismen aufbaut. Der Hippocampus erneuert
laufend seinen Neuronenpool, junge Neurone sind sehr erregbar und
bilden fortlaufend synaptische Kontakte aus, insbesondere
zur parahippocampalen Region. Junge Zellgruppen erfüllen dynamische
Gedächtnisfunktionen, z.B. zur Erkennung von Orten in der Umgebung
(Ortszellen,
Ortsfelder) Das Speichern neuer Gedächtnisinhalte erfordert Neuroplastizität:
Präsynaptisch kann sich die freigesetzte / wiederaufgenommene
Transmittermenge (pro Aktionspotential), postsynaptisch der
Transmittereffekt (Zahl / Empfindlichkeit der Rezeptoren) bzw. -abbau
verändern; mit der Rezeptorzahl steigt der Effekt
(z.B. EPSP) pro Quantum freigesetzten Transmitters. Synapsen können
wachsen oder schrumpfen, verschwinden oder neu gebildet, ihr
Verbindungsmuster kann geändert werden
Das Speichern neuer Gedächtnisinhalte erfordert Neuroplastizität:
Präsynaptisch kann sich die freigesetzte / wiederaufgenommene
Transmittermenge (pro Aktionspotential), postsynaptisch der
Transmittereffekt (Zahl / Empfindlichkeit der Rezeptoren) bzw. -abbau
verändern; mit der Rezeptorzahl steigt der Effekt
(z.B. EPSP) pro Quantum freigesetzten Transmitters. Synapsen können
wachsen oder schrumpfen, verschwinden oder neu gebildet, ihr
Verbindungsmuster kann geändert werden Gliazellen beteiligen sich an Lernvorgängen: Astrozyten können Stellen
synaptischer Veränderung markieren, Oligodendrozyten die Myelinisierung verändern Gliazellen beteiligen sich an Lernvorgängen: Astrozyten können Stellen
synaptischer Veränderung markieren, Oligodendrozyten die Myelinisierung verändern Langzeitpotenzierung ist eine Zunahme der Synapsenstärke für mindestens
eine Stunde. Präsynaptische Aktionspotentialsalven führen zu
Glutamatfreisetzung und postsynaptischen EPSPs durch Kationeneinstrom.
An nicht aktivierten glutamatergen Synapsen sind die NMDA-Rezeptoren
durch Magnesiumionen blockiert. Vordepolarisation öffnet sie und Ca++
strömt ein, worauf Proteinkinase AMPA-Rezeptoren phosphoryliert, die in
die postsynaptische Membran eingeklagert werden ("AMPAfizierung"), Na+-Einstrom und Depolarisation verstärken (Langzeitpotenzierung LTP)
Langzeitpotenzierung ist eine Zunahme der Synapsenstärke für mindestens
eine Stunde. Präsynaptische Aktionspotentialsalven führen zu
Glutamatfreisetzung und postsynaptischen EPSPs durch Kationeneinstrom.
An nicht aktivierten glutamatergen Synapsen sind die NMDA-Rezeptoren
durch Magnesiumionen blockiert. Vordepolarisation öffnet sie und Ca++
strömt ein, worauf Proteinkinase AMPA-Rezeptoren phosphoryliert, die in
die postsynaptische Membran eingeklagert werden ("AMPAfizierung"), Na+-Einstrom und Depolarisation verstärken (Langzeitpotenzierung LTP) Wiederholte gleichzeitiger Erregung des prä- und postsynaptischen
Neurons (Koinzidenz: "Neurons that fire together wire together")
verstärkt entsprechende synaptische Verschaltungen für Tage bis Wochen.
Proteinkinasen, Phospholipasen und neuronale NO-Synthase erhöhen
Synapsenwirkung und -zahl, die synaptische Kapazität steigt
Wiederholte gleichzeitiger Erregung des prä- und postsynaptischen
Neurons (Koinzidenz: "Neurons that fire together wire together")
verstärkt entsprechende synaptische Verschaltungen für Tage bis Wochen.
Proteinkinasen, Phospholipasen und neuronale NO-Synthase erhöhen
Synapsenwirkung und -zahl, die synaptische Kapazität steigt Klassische Konditionierung
beruht auf der Verknüpfung eines (neutralen) Reizes (z.B. Glockenton)
mit einem knapp darauf folgenden unkonditionierten Reiz, der zu einer
Reflexantwort führt (z.B. Futter). Der neutrale Reiz reicht dann aus,
eine Antwort auszulösen: Er ist zu einem "konditionierten" geworden und
löst eine konditionierte Reaktion aus Klassische Konditionierung
beruht auf der Verknüpfung eines (neutralen) Reizes (z.B. Glockenton)
mit einem knapp darauf folgenden unkonditionierten Reiz, der zu einer
Reflexantwort führt (z.B. Futter). Der neutrale Reiz reicht dann aus,
eine Antwort auszulösen: Er ist zu einem "konditionierten" geworden und
löst eine konditionierte Reaktion aus Operante Konditionierung
ergibt sich, wenn von verschiedenen Verhaltensweisen nur eine zum
Erfolg führt (Versuch und Irrtum). Belohnung führt zu positiver,
Bestrafung zu negativer Konditionierung Operante Konditionierung
ergibt sich, wenn von verschiedenen Verhaltensweisen nur eine zum
Erfolg führt (Versuch und Irrtum). Belohnung führt zu positiver,
Bestrafung zu negativer Konditionierung |
