

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Viszerale
Sensibilität und
Schmerz
© H. Hinghofer-Szalkay
 Allodynie: άλλος = anders, οδύνη = Schmerz
Allodynie: άλλος = anders, οδύνη = Schmerz
Anandamid: Ananda (Sanskrit: Segen, Abwesenheit von Unglück), ein Cousin Buddhas
Cannabis: κάνναβις = Hanf
Endocannabinoide: ἔνδον = innen, cannabis sativa = Hanf
Endorphin: aus ἔνδον = innen und Morphin (vom Körper selbst produziertes Opioid)
Enkephaline: ἐγκέφαλος = Gehirn
Histamin: ἱστός = Gewebe, Amin von Ammonium
Hyperalgesie: ὑπέρ = über, ἄλγος = Schmerz
Lissauer'sche Zonen: Heinrich Lissauer
Morphin: Μορφεύς = gr. Gott der Träume (Morphin ist der Hauptbestandteil von Opium)
Nozizeptor: noxa = Schaden, recipere = empfangen, aufnehmen
opioiderg: ὄπιον = Opium (Alkaloid im Saft des Schlafmohns), εἶδος = ähnlich, εργον = Wirkung
Sylvi'sche Wasserleitung: Franciscus Sylvius
Tachykinine: ταχυς = schnell, κίνησις = Bewegung (lösen rasche Darmkontraktionen aus)
Vegetativum: vegetus = lebhaft, munter, rüstig
Viszerale Sensibilität wird von den Eingeweiden (Lungen, Herz, Kreislauf, gastrointestinales und Urogenitalsystem) über vegetative Afferenzen zur Insel geleitet, wo Interozeption - der "Blick nach innen" - erfolgt.
Schmerzreize (starke mechanische Stimulation, Temperaturextreme, Sauerstoffmangel, Chemikalien) sind potenziell zellschädigend. Sie führen zur Erregung von Schmerzfasern. Mediatoren sind u.a.

-- Wasserstoffionen (Absinken des pH-Wertes)

-- Kalium (extrazellulär) aus verletzten Zellen

-- Histamin, hauptsächlich aus
Mastzellen und Granulozyten; ihre Degranulierung an Gefäßen,
Schleimhäuten etc. führt neben Schmerz zu immunologischen Reaktionen

-- Kinine, die auch vasodilatierend wirken

-- Serotonin, vorwiegend aus
enterochromaffinen Zellen des Magen-Darm-Trakts, bewirkt Schmerz,
Vasodilatation, Ödembildung, Leukozytendiapedese, Rötung, Quaddelbildung

-- Substanz P aus Nervenzellen und Leukozyten
Schmerzrezeptoren (Nozizeptoren) können Ionenkanäle (ionotrop) oder metabotrop
(Kanäle sensibilisierend) sein. Die Afferenz erfolgt über Aδ- ("erster"
Schmerz) und C-Fasern ("zweiter" Schmerz) und im Rückenmark über die spinothalamische Bahn zum nucl. ventralis posterolateralis thalami und zum sensomotorischen Cortex (Ortung der Schmerzquelle), und die spinoretikuläre (spino-parabrachiale) Bahn zu medialem Thalamus und limbischen Strukturen (emotionale Dimension).
Der Körper verfügt über endogene Mechanismen zur Schmerzmodifikation: Das lipidbasierte Endocannabinoidsystem wirkt über Cannabinoidrezeptoren in Gehirn und Rückenmark. Endorphinesind
körpereigene Opioide (Endorphin, Enkephalin, Dynorphin), sie wirken
über μ-, δ- und κ-
Opiatrezeptoren im Thalamus und in anderen Teilen des Nervensystems.
Das Schmerzempfinden ist hemmbar - endogen u.a. im zentralen
Höhlengrau; in den
Hinterstrangkernen interferieren Schmerz- und
mechanosensible Fasern (Gate-control-Theorie). Zentrale Instanzen der Schmerzverarbeitung sind Thalamus, Mandelkerne, Insel, gyrus cinguli und Präfrontalhirn.
|
Sensibilität im Bereich der Eingeweise (viszerale Sensibilität)
betrifft die Summe aller Informationen, die von
den Eingeweiden zum Zentralnervensystem gesendet werden -  s. dazu über
s. dazu über
Viszerale Sensibilität erreicht das Gehirn über Hirnnerven (N. glossopharyngeus und vagus) - sie projizieren auf den nucleus tractus solitarii; und über Splanchnicusnerven,
die auf das Rückenmark projizieren. Von hier aus senden aszendierende
Bahnen die Information aus den Eingeweiden über den tractus
spinothalamicus zu nucleus tractus solitarii, laterale parabrachiale Kerne
und Thalamus. Der nucl. tractus solitarii seinerseits leitet die
Funktion der Eingeweide betreffende sensorische Impulse an
Reflexzentren in Hirmstamm und Rückenmark (einschließlich das
Kreislaufzentrum in der formatio reticularis, was die Durchblutung der
betreffenden Organe optimiert). Auch projiziert der nucl. tractus solitarii auf Hypothalamus und Großhirn (insbesondere Insel und limbisches System).
Die
Informationsmenge, die dem ZNS aus den Eingeweiden (Kopf, Brust-,
Bauch- und Beckenraum) zuströmt, ist umfangreich: Man schätzt, dass
5-15% der Afferenzen in das Rückenmark
viszeraler Natur sind; ~50% der sekundären spinalen Neurone sprechen
auf viszerale Afferenzen an, ein Zeichen starker neuronaler Ausbreítung
(Arborisation) inklusive gelegentlicher Seitenüberkreuzung im
Rückenmark. Der N. vagus
enthält mindestens zu 80% afferente (sensible) Fasern, die aus der
Speiseröhre sowie aus sämtlichen Brust- und Baucheingeweiden stammen;
dazu kommen noch Afferenzen über andere Hirnnerven.
Die Viszerosensibilität verfügt über zahlreiche Modalitäten: Dazu
gehören z.B. Chemosensibilität (Atemgase → Atemregulation, evt.
Atemnot; Peptide etc → Sekretionsanregung, endokrine Reaktionen; Toxine
in der Nahrung →
Übelkeit, Brechreiz etc), Mechanosensibilität (Füllung von
Darmabschnitten → motorische und sekretorische Reflexantworten),
Reaktionen auf Lichteinfall (Helligkeit → Miosis), oder
Schmerzempfinden (z.B. Überdehnung → Kolik). Die Erforschung dieser
Informationsbahnen ist nicht einfach, viele Aspekte der viszeralen
Sensibilität sind nach wie vor unklar.

Zu
viszerosensiblen Afferenzen s. auch
dort

Schmerz: Einleitung
Schmerz ist eine Wahrnehmung,
die physiologischerweise durch Erregung nozizeptiver Afferenzen hervorgerufen wird. Er kann in unterschiedlicher Form auftreten - von kurzen Warnsignalen (z.B.
Griff in eine Dorne) bis zu langanhaltenden Zuständen, von gut
lokalisierten bis zu dumpfen, eher allgemeinen Projektionen.
Schmerz kann aus drei perzeptiven Komponenten bestehend gesehen werden:
 Sensorische
Komponente - afferente Impulse ermöglichen die Wahrnehmung von Ort und
Intensität von Schmerzreizen. Zuständig ist der somatosensorische Cortex im Parietalhirn, der die afferenten Informationen via die ventralen posterioren Kerne des Thalamus erhält.
Sensorische
Komponente - afferente Impulse ermöglichen die Wahrnehmung von Ort und
Intensität von Schmerzreizen. Zuständig ist der somatosensorische Cortex im Parietalhirn, der die afferenten Informationen via die ventralen posterioren Kerne des Thalamus erhält.
 Unmittelbare emotionale Folgen - diese
leidvolle Komponente ist nicht primär eine Eigenheit der afferenten
Impulse (Aktionspotentiale wie bei anderen Sinnesafferenzen), sondern
wird vom Gehirn erzeugt (Insel, vorderer gyrus cinguli).
Unmittelbare emotionale Folgen - diese
leidvolle Komponente ist nicht primär eine Eigenheit der afferenten
Impulse (Aktionspotentiale wie bei anderen Sinnesafferenzen), sondern
wird vom Gehirn erzeugt (Insel, vorderer gyrus cinguli).
Defekte der Inselrinde können
Gleichgültigkeit gegenüber Schmerzreizen zur Folge haben. Gedämpfte
Aktivität des vorderen gyrus cinguli (Hypnose) reduziert ebenfalls den
unangenehmen Charakter des Schmerzerlebnisses.
 Längerfristige emotionale Folgen - Sorgen um zukünftiges Wohlbefinden / Schmerzzustände. Solche langfristigen Implikationen werden vom Präfrontalcortex reflektiert.
Längerfristige emotionale Folgen - Sorgen um zukünftiges Wohlbefinden / Schmerzzustände. Solche langfristigen Implikationen werden vom Präfrontalcortex reflektiert.
 Die International Association for the Study of Pain definiert Schmerz als "eine unangenehme sensorische und emotionale Erfahrung verbunden mit realer oder potentieller Gewebeschädigung,
oder wird mit Begriffen einer solchen beschrieben". Schmerz ist mehr als
eine simple physiologische Reaktion auf einen Reiz; es ist eine
komplexe Erfahrung, die stark von Kontext, Erwartung und Angst geprägt
ist.
Die International Association for the Study of Pain definiert Schmerz als "eine unangenehme sensorische und emotionale Erfahrung verbunden mit realer oder potentieller Gewebeschädigung,
oder wird mit Begriffen einer solchen beschrieben". Schmerz ist mehr als
eine simple physiologische Reaktion auf einen Reiz; es ist eine
komplexe Erfahrung, die stark von Kontext, Erwartung und Angst geprägt
ist.
Schmerzempfindlich sind die meisten Gewebe - mit Ausnahme des Nervengewebes (Gehirnhäute sind schmerzempfindlich). Schmerzreize können verschiedener Art sein (mechanische Überlastung, Hitze oder Kälte, Sauerstoffmangel, Verletzungen oder Entzündungen..). Sie werden von Nervenfasern detektiert, die morphologisch keine Besonderheiten aufweisen, aber mit eigenen Schmerzrezeptoren (Nozizeptoren )
ausgestattet sind. (Ein Gewebeschaden muss nicht bestehen, wenn Schmerz
empfunden wird, insoferne ist der Begriff "Nozizeption" - Noxe = Schaden - nicht immer
zutreffend.)
)
ausgestattet sind. (Ein Gewebeschaden muss nicht bestehen, wenn Schmerz
empfunden wird, insoferne ist der Begriff "Nozizeption" - Noxe = Schaden - nicht immer
zutreffend.)

 Abbildung: Übersicht zu Entstehung, Leitung und Verarbeitung von Schmerz
Nach Grace PM, Hutchinson MR, Maier SF, Watkins LR.
Pathological pain and the neuroimmune interface. Nature Rev Immunol
2014; 14: 217-31
Abbildung: Übersicht zu Entstehung, Leitung und Verarbeitung von Schmerz
Nach Grace PM, Hutchinson MR, Maier SF, Watkins LR.
Pathological pain and the neuroimmune interface. Nature Rev Immunol
2014; 14: 217-31
a: Freie Nervenendigungen mit Ionenkanälen: -
TRP-Kanäle vom Typ A
(ankyrin repeats), M
(melastatin), V
(vanilloid); spannungssensitive Natriumkanäle (Nav); Kaliumkanäle (KCNK); und säureempfindliche Kanäle (
Acid-Sensing Ion Channels, ASICs).
b: Aktionspotentiale werden über rasch (Aß, Aδ) und langsam
leitende (C-) Fasern ins Rückenmark geleitet. Nach synaptischer
Verarbeitung ziehen Impulse über 2. Neurone weiter.
c: Zahlreiche Gehirnregionen sind gemeinsam in die Schmerzverarbeitung involviert:

Somatosensorischer Cortex (S1)

anteriorer gyrus cinguli (ACC)

Mandelkerne (CeA)

Insel (IC)

präfrontaler Cortex (PFC)
Modulierung der Schmerzleitung durch absteigende Impulse
erfolgt im zentralen Höhlengrau (PAG), locus coeruleus (LC) und in der
rostralen ventromedialen medulla oblongata (RVM)

Schmerzrezeptoren sind meist nicht ausschließlich auf eine bestimmte
Modalität spezialisiert (z.B. brennend, schneidend, juckend...), sondern funktionieren eher polymodal. Es gibt aber auch spezifische Schmerzrezeptoren: Mechanische (Reaktion auf intensive Verformung), thermische (brennend heiß, extrem kalt), chemische (Histamin, pH, Kalium... etc) Nozizeptoren. Die Mehrzahl der rasch leitenden (A-δ)
Schmerzfasern sind mechanische Nozizeptoren, die durch Einwirkung
scharfer (schneidender, durchstechender) Objekte, oder auch das
Ausreißen von Haaren - also Reize hoher Intensität - erregt werden
(HTMRs: high-threshold mechanoreceptors). Viele solcher Fasern sprechen auch auf Hitze an (sie exprimieren TRPV2-Kanäle).
Das Ansprechverhalten von Nozizeptoren ist stark von vorausgehenden Reizungen abhängig; sowohl Sensitivierung als auch Ermüdung sind zu beobachten, d.h. die Schmerzmeldung kann mit fortlaufender Stimulation sowohl zu- als auch abnehmen.
Reizung
von Nozizeptoren und Empfindung von Schmerz sind nicht dasselbe. Es
kann sein, dass Rezeptoren und Schmerzafferenzen aktiv sind, ohne dass
es zu Schmerzempfindungen kommt; umgekehrt kann quälender Schmerz
auftreten, ohne dass in der Peripherie Nozizeptoren gereizt würden. Es kann also zu Dissoziation zwischen peripheren (Erregung
von "Schmerzrezeptoren", afferente Leitung von Aktionspotentialen) und
zentralen Komponenten des Schmerzes kommen. Das
liegt an der Struktur des Schmerzsystems: So kann die zentrale
Verarbeitung nozizeptiver Afferenzen das Bewusstwerden dieser Impulse
unterdrücken (Beispiel endogene Schmerzblockade,wie durch
Endocannabinoide); umgekehrt können Schmerzerlebnisse ohne aktuelle
Rezeptoraktivierung erfolgen (Beispiel Schmerzgedächtnis, Phantomschmerz: Neuropathischer Schmerz).
 Nozizeptiver Schmerz entsteht
durch Aktivierung von Nozizeptoren in der Haut oder darunterliegendem
Gewebe durch Verletzungen, und geht üblicherweise mit lokaler
Entzündung einher. Neuropathischer Schmerz entsteht
durch direkte Verletzung peripherer oder zentraler Neuronen infolge
Ischämie, Kompression, Durchtrennung, Blutung, oder chemischer Reizung.
Neuropathischer Schmerz wird als brennend, stechend, bohrend empfunden.
Zum neuropathischen Formenkreis zählt man auch
Phantomschmerzen sowie die Trigeminusneuralgie (deren Pathologie unklar
ist).
Nozizeptiver Schmerz entsteht
durch Aktivierung von Nozizeptoren in der Haut oder darunterliegendem
Gewebe durch Verletzungen, und geht üblicherweise mit lokaler
Entzündung einher. Neuropathischer Schmerz entsteht
durch direkte Verletzung peripherer oder zentraler Neuronen infolge
Ischämie, Kompression, Durchtrennung, Blutung, oder chemischer Reizung.
Neuropathischer Schmerz wird als brennend, stechend, bohrend empfunden.
Zum neuropathischen Formenkreis zählt man auch
Phantomschmerzen sowie die Trigeminusneuralgie (deren Pathologie unklar
ist).
 Nozizeptiver Schmerz spricht auf nichtsteroidale Entzündungshemmer (NSAIDs: Nonsteroidal anti-inflammatory drugs)
- in schweren Fällen auch Opioide - an. Im Gegensatz dazu lindern
NSAIDs neuropathische Schmerzen nicht, auch Opioide helfen kaum.
Nozizeptiver Schmerz spricht auf nichtsteroidale Entzündungshemmer (NSAIDs: Nonsteroidal anti-inflammatory drugs)
- in schweren Fällen auch Opioide - an. Im Gegensatz dazu lindern
NSAIDs neuropathische Schmerzen nicht, auch Opioide helfen kaum.
Schmerz
kann eine physiologische Warnfunktion haben ("physiologischer" Schmerz)
oder aber zur Krankheit werden ("pathologischer", chronischer Schmerz,z.B.
bei Entzündungen, Virusinfektionen, Neuropathien, Krebs - betrifft im
Laufe der Zeit ~20% der erwachsenen Bevölkerung): Hier
kann Schmerz ohne direkten Auslöser und nach Verschwinden / Abheilung
einer irritierten oder verletzten Körperregion weiterhin fortbestehen.
Grundlage sind zentrale Veränderungen, die auf verschiedenen Ebenen
(molekular, synaptisch, zellulär, Verschaltung in neuronalen
Netzwerken) ablaufen können. NMDA-Rezeptoren spielen bei der Entstehung von chronischem Schmerz eine tragende Rolle.
Der Axonreflex
ist charakterisiert durch Vasodilatation
in der Umgebung einer Hautverletzung: Nozizeptive Nervenfasern sind
nicht nur afferent, sondern auch parakrin aktiv. Sie bilden, speichern (vesikulär) und sezernieren (wenn erregt) Neuropeptide, die auf umliegende Gefäße als Entzündungsmediatoren wirken ( Abbildung).
Abbildung).

 Abbildung: Periphere Sensibilisierung und Axonreflex
Abbildung: Periphere Sensibilisierung und Axonreflex
C-Fasern leiten aus verletztem Gewebe
Schmerzimpulse zum ZNS (Rückenmark, Gehirn). Neben dieser afferenten
Funktion laufen Impulse über Kollateralen in benachbartes Gewebe und
setzen dort Substanz P und CGRP frei ("Axonreflex"). Das bewirkt
Vasodilatation (Rötung) und erhöhte Kapillarpermeabilität (Schwellung)
in der irritierten Zone.
Degranulierung von Mastzellen und Freisetzung von
Histamin kann ebenfalls stattfinden. Histamin kann eine 2-3 cm breiten
Rötungszone (flare) um das irritierte Gewebe verursachen.
Außer
Mastzellen sind auch neutrophile Granulozyten und Makrophagen an der
Abgabe von Entzündungsmediatoren beteiligt

Die "inflammatorische Suppe", die durch Wirkung des Axonreflexes im
entzündeten Gebiet entsteht, hat mehrere Komponenten. Einige davon:
 Substanz P steigert die Permeabilität von Kapillaren und fördert damit den Flüssigkeitsaustritt (ödematöse Schwellung: tumor)
Substanz P steigert die Permeabilität von Kapillaren und fördert damit den Flüssigkeitsaustritt (ödematöse Schwellung: tumor)
 CGRP (Calcitonin gene related peptide) entsteht durch alternatives Bearbeiten des Calcitoningens, es wirkt stärker vasodilatierend als
Prostaglandine oder Acetylcholin - schon in
femtomolarer Konzentration. Es relaxiert die Gefäßmuskelzellen und fördert Erwärmung (calor) und Rötung (rubor) entzündeter Stellen. Substanz P und CGRP fördern
die Freisetzung von Histamin aus Mastzellen (
CGRP (Calcitonin gene related peptide) entsteht durch alternatives Bearbeiten des Calcitoningens, es wirkt stärker vasodilatierend als
Prostaglandine oder Acetylcholin - schon in
femtomolarer Konzentration. Es relaxiert die Gefäßmuskelzellen und fördert Erwärmung (calor) und Rötung (rubor) entzündeter Stellen. Substanz P und CGRP fördern
die Freisetzung von Histamin aus Mastzellen ( Abbildung). Damit stimulieren sie auch die Schmerzentstehung (dolor)
Abbildung). Damit stimulieren sie auch die Schmerzentstehung (dolor)
 Der Wachstumsfaktor NGF erhöht die Empfindlichkeit gegenüber Hitze- und Schmerzreizen über Einfluss auf TRPV1-Kanäle
Der Wachstumsfaktor NGF erhöht die Empfindlichkeit gegenüber Hitze- und Schmerzreizen über Einfluss auf TRPV1-Kanäle
 Das Zytokin TNFα verstärkt die Entzündungsreaktion sowie die Freisetzung anderer entzündungsfördernder Stoffe
Das Zytokin TNFα verstärkt die Entzündungsreaktion sowie die Freisetzung anderer entzündungsfördernder Stoffe
Durch die Wirkung des Axonreflexes werden "stille" Schmerzfasern (Aδ
und C), die nicht auf noxische Reize alleine (auch wenn sie
gewebeschädigende Intensität haben) reagieren würden, auf Schmerzreize
sensibilisiert und tragen dann zur begleitenden Hyperalgesie bei.
Rötung, Erwärmung, Schwellung und Schmerz sind die klassischen Leitsymptome einer Entzündung.
Schmerzauslösende Substanzen und Ionenkanäle
Schmerzerregende Substanzen können Nervenendigungen direkt depolarisieren und erregen oder sensibilisieren, d.h. für die Erregung durch andere Transmitter empfänglicher machen (z.B. Prostaglandine). Noch vor einer Gewebeschädigung tritt nozizeptiver Schmerz
durch intensive mechanische oder thermische Reizung auf (z.B. an
Capsaicin-Rezeptoren, einem TRPV1-Kanal); verletzte Zellen und
Entzündungsprozesse setzen dann Mediatoren frei, die Entzündungsschmerz verursachen.
Unmittelbar depolarisierend und damit erregend wirken an Schmerzfasern durch spezielle Ionenkanäle einströmende Kationen (Na+, K+, Ca++, H+). Ionenkanäle in der Membran von Schmerzfasern können aktiviert werden
 durch Kationeneinstrom (voltage-gated),
durch Kationeneinstrom (voltage-gated),
 durch Bindung von Signalstoffen wie Serotonin oder ATP (ligand-gated),
durch Bindung von Signalstoffen wie Serotonin oder ATP (ligand-gated),
 durch Hitzeeinwirkung.
durch Hitzeeinwirkung.
Mechanische Schmerzreize wirken auf mechanisch aktivierte, thermische Schmerzreize auf thermisch aktivierte Nozizeptoren, und beide wirken auf polymodale Rezeptoren. Letztere bewirken verzögerten Schmerz (Leitung über Typ IV-Fasern), erstere sofortigen Schmerz (Leitung über Typ III-Fasern).
 Vertreter der TRP-Familie (transient receptor potential channels) - Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind nichtselektive Kationenkanäle, die u.a. für die Detektion von Schmerz (
Vertreter der TRP-Familie (transient receptor potential channels) - Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind nichtselektive Kationenkanäle, die u.a. für die Detektion von Schmerz ( Abbildung), aber
auch Temperatur, Geschmack (Capsaicin ist die Substanz, die Chili "scharf" macht), Mechano- und Photosensibilität
eine Rolle spielen.
Abbildung), aber
auch Temperatur, Geschmack (Capsaicin ist die Substanz, die Chili "scharf" macht), Mechano- und Photosensibilität
eine Rolle spielen.
 Abbildung: TRP-Ionenkanäle und Schmerzentstehung
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Abbildung: TRP-Ionenkanäle und Schmerzentstehung
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
TRP-Kanäle sind nichtselektiv für Kationen
durchgängig. Sie bestehen aus 4 gleichen Untereinheiten à 6 transmembranalen α-Helices. Die meisten weisen intrazelluläre
Ankyrin-Repeat- Domänen auf, mit denen sie am Zytoskelett befestigt sind.
Bestimmte Neuronengruppen
exprimieren bestimmte TRP-Sensoren und erlangen dadurch Spezifität.
Hitze und Wasserstoffionen wirken am extrazellulären, Capsaicin und endogene Agonisten am zellulären Pol von TRPV1-Kanälen
und erhöhen deren Öffnungswahrscheinlichkeit. Der Kanal lässt Natrium-
und Calciumionen in die Zelle eindringen und depolarisieren sie dadurch.
TRPV2-Kanäle reagieren auf gewebeschädigende Temperaturen (>50°C)
Die Capsaicin-empfindlichen TRPV-Rezeptoren (TRPVR1
- V für Vanilloid, den für den Capsaicin-Effekt entscheidenden Stoff) sind besonders für Hitze- (Temperatur über 43°C) und Säurereize
empfänglich (H+-Ionen können den TRPVR1 direkt aktivieren). Sie sprechen an auf Inhaltsstoffe z.B. in Chilischoten oder Wasabi, Endocannabinoide (Anandamid) u.a. Sie lassen in geöffnetem Zustand Ca++- und Na+-Ionen in die Zelle passieren. Die Information
wird über (langsame) C-Fasern geleitet und vermittelt
brennend-schmerzhafte Sensationen, insbesondere den "zweiten" Schmerz bei einer Verbrennung (vgl. TRPM3 weiter unten).
TRPV1-Kanäle sind unspezifische Kationenkanäle, die durch Capsaicin, Wasserstoffionen und Hitze aktivierbar und für Na+, K+, Ca++, H+ durchgängig sind ( Abbildung). Reizung der TRP-Kanäle bewirkt Na+- und Ca++-Einstrom,
Depolarisierung, Aktivierung spannungsabhängiger Natriumkanäle und
Aktionspotentialauslösung an afferenten nozizeptiven Nervenfasern.
Abbildung). Reizung der TRP-Kanäle bewirkt Na+- und Ca++-Einstrom,
Depolarisierung, Aktivierung spannungsabhängiger Natriumkanäle und
Aktionspotentialauslösung an afferenten nozizeptiven Nervenfasern.
TRPV-Rezeptoren können ihre Empfindlichkeit anpassen. Sie werden sensibilisiert durch Entzündungsmediatoren wie Prostaglandine (Prostaglandin E2 über Proteinkinase A) und Bradykinin (über Proteinkinase C), mit dem Resulat einer Hyperalgesie / Allodynie. Auf diese Weise können in gereiztem Gewebe "schlafende" Schmerzfasern aktiviert werden.
Desensibilisierung hängt mit intrazellulärem Ca++
zusammen, dessen intrazelluläre Konzentration bei wiederholter Reizung
ansteigt (es wird an Calmodulin / Calcineurin gebunden), und mit einem
Absinken von PIP2 in der Schmerzfaser. Dieser Effekt erklärt
wahrscheinlich den paradoxen analgetischen Effekt von Capsaicin.
Der nichtselektive Kationenkanal TRPV1 wird durch Capsaicin geöffnet
Der Effekt verstärkt sich bei Temperaturen über 43°C
Aktivierte TRPV1-Kanäle werden durchgängig für Ca++ und Na+
Entzündungsmediatoren (PG, Bradykinin) sensibilisieren Schmerzrezeptoren
|
Andere TRP-Rezeptoren sind auf Hitze und Kälte
ausgerichtet. Kältereize vermitteln insbesondere CMR1- (Cool-menthol-receptor 1) Rezeptoren, sie gehören ebenfalls zur Gruppe der TRP-Rezeptoren; sie sitzen ebenfalls auf C-Fasern.
 Höhere Temperaturen als der TRPV1-Rezeptor detektiert der Transient receptor potential cation channel subfamily M member 3-Rezeptor (TRPM3); er findet sich an Nervenfasern des Typs A-δ und übermittelt den ersten, scharfen Schmerz bei einer Verbrennung (vgl. TRPV1).
Höhere Temperaturen als der TRPV1-Rezeptor detektiert der Transient receptor potential cation channel subfamily M member 3-Rezeptor (TRPM3); er findet sich an Nervenfasern des Typs A-δ und übermittelt den ersten, scharfen Schmerz bei einer Verbrennung (vgl. TRPV1).
 P2X-Rezeptor (Purinorezeptor - ATP
tritt aus verletzten Zellen aus, z.B. Epithel in Gastrointestinal- oder
Urogenitalsystem bei starker Dehnung): Dieser Kationenkanal ist außer
für
Nozizeption - insbesondere chronischen Schmerz - an zahlreichen
weiteren
Funktionen beteiligt, wie Kommunikation zwischen Nerven- und
Gliazellen, Ino- und Chronotropie am Herzen, Einfluss auf den
Gefäßtonus, Kontraktion der Harnblase und des ductus deferens,
Makrophagenaktivierung, Plättchenaggregation.
P2X-Rezeptor (Purinorezeptor - ATP
tritt aus verletzten Zellen aus, z.B. Epithel in Gastrointestinal- oder
Urogenitalsystem bei starker Dehnung): Dieser Kationenkanal ist außer
für
Nozizeption - insbesondere chronischen Schmerz - an zahlreichen
weiteren
Funktionen beteiligt, wie Kommunikation zwischen Nerven- und
Gliazellen, Ino- und Chronotropie am Herzen, Einfluss auf den
Gefäßtonus, Kontraktion der Harnblase und des ductus deferens,
Makrophagenaktivierung, Plättchenaggregation.
P2X-Rezeptoren sind für Na+, K+, Ca++ permeabel, wenn sie ATP binden. ATP tritt aus verletzten Zellen aus und signalisiert dies über P2X-Rezeptoren.
 Wasserstoffionen treten extrazellulär vermehrt bei Verletzung / Entzündung auf. Protonenaktivierte säureempfindliche Natriumkanäle (ASICs: acid sensitive ion channels) lassen bei pH-Abfall Na+ in die Schmerzfaser einströmen. Das tun auch serotoninaktivierte Ionenkanäle (im Rahmen entzündlicher Prozesse entsteht auch Serotonin). Der Serotonin-Typ3- (5HT3) Rezeptor besteht - ähnlich dem nikotinischen Acetylcholinrezeptor - aus 5 Untereinheiten, die um einen zentralen Kationenkanal
gruppiert sind. (Andere Serotoninrezeptoren aktivieren
G-Proteine.) Im Gastrointestinaltrakt setzen enteroendokrine
Epithelzellen (die größte Serotoninquelle des Körpers) auf mechanische
oder chemische Reize hin Serotonin frei; etwa 30% der sensorischen
Nervenfasern des Colon haben 5HT3-Rezeptoren.
Wasserstoffionen treten extrazellulär vermehrt bei Verletzung / Entzündung auf. Protonenaktivierte säureempfindliche Natriumkanäle (ASICs: acid sensitive ion channels) lassen bei pH-Abfall Na+ in die Schmerzfaser einströmen. Das tun auch serotoninaktivierte Ionenkanäle (im Rahmen entzündlicher Prozesse entsteht auch Serotonin). Der Serotonin-Typ3- (5HT3) Rezeptor besteht - ähnlich dem nikotinischen Acetylcholinrezeptor - aus 5 Untereinheiten, die um einen zentralen Kationenkanal
gruppiert sind. (Andere Serotoninrezeptoren aktivieren
G-Proteine.) Im Gastrointestinaltrakt setzen enteroendokrine
Epithelzellen (die größte Serotoninquelle des Körpers) auf mechanische
oder chemische Reize hin Serotonin frei; etwa 30% der sensorischen
Nervenfasern des Colon haben 5HT3-Rezeptoren.
Koinzidenzdetektoren: Es gibt spezielle Ionenkanäle, die aus einem Komplex von H+-abhängigen Natriumkanälen und P2X-Rezeptoren bestehen und nur auf die Kombination von steigendem [ATP] und [H+] (sinkendem pH) ansprechen. Sie spielen z.B. bei der Entstehung von kardialem Ischämieschmerz (Herzinfarkt) eine Rolle; steigt nur [H+] oder [ATP] alleine an, reagieren diese Rezeptorkomplexe nicht.
Metabotrope Nozizeptoren wirken indirekt - sie sensibilisieren
nozizeptive Ionenkanäle. Prostaglandine, Bradykinin, Histamin bedienen
sich solcher Mechanismen:
 Prostaglandinrezeptoren sensibilisieren Neuronen im Rückenmark für
Schmerz und regulieren Entzündungsvorgänge;
Prostaglandinrezeptoren sensibilisieren Neuronen im Rückenmark für
Schmerz und regulieren Entzündungsvorgänge;
 Bradykininrezeptoren
mediieren Reaktionen auf pathophysiologische Vorgänge, die u.a. Schmerz
verursachen;
Bradykininrezeptoren
mediieren Reaktionen auf pathophysiologische Vorgänge, die u.a. Schmerz
verursachen;
 Histaminrezeptoren sind an zahlreichen Reaktionen auf
Schmerzreize beteiligt, z.B. im Immun- und Nervensystem.
Histaminrezeptoren sind an zahlreichen Reaktionen auf
Schmerzreize beteiligt, z.B. im Immun- und Nervensystem.
Die meisten Mediatorstoffe werden nicht gespeichert, sondern bei Verletzungsvorgängen neu synthetisiert. Sie wirken über zwei Wege:
 Direkte Aktivierung
von Nozizeptoren oder Erhöhung der Rezeptorempfindlichkeit auf die
Wirkung anderer Schmerzmediatoren
Direkte Aktivierung
von Nozizeptoren oder Erhöhung der Rezeptorempfindlichkeit auf die
Wirkung anderer Schmerzmediatoren
 Aktivierung von Immunzellen,
die ihrerseits Zytokine freisetzen (z.B. durch Wirkung von Histamin, Serotonin, Eikosanoiden,
Zytokinen): Die im Rahmen entzündlicher Vorgänge freigesetzten
Mediatorstoffe verstärken die Wirkung der Nozizeptoren.
Aktivierung von Immunzellen,
die ihrerseits Zytokine freisetzen (z.B. durch Wirkung von Histamin, Serotonin, Eikosanoiden,
Zytokinen): Die im Rahmen entzündlicher Vorgänge freigesetzten
Mediatorstoffe verstärken die Wirkung der Nozizeptoren.
Tachykinine  sind schmerzübertragende Neuropeptide. Sie wirken über Tachykininrezeptoren nicht nur schmerzauslösend, sondern auch auf glatte Muskelzellen
(vasodilatierend, bronchokonstriktorisch), T-Lymphozyten (als
Chemoattraktor), Nervenzellen (präfrontaler Cortex, limbisches System,
Vegetativum), endokrine Zellen.
sind schmerzübertragende Neuropeptide. Sie wirken über Tachykininrezeptoren nicht nur schmerzauslösend, sondern auch auf glatte Muskelzellen
(vasodilatierend, bronchokonstriktorisch), T-Lymphozyten (als
Chemoattraktor), Nervenzellen (präfrontaler Cortex, limbisches System,
Vegetativum), endokrine Zellen.
Tachykinine sind das Dekapeptid Neurokinin A, weiters Neuropeptid K ("verlängertes" Neurokinin A) sowie die aus 11 Aminosäuren aufgebaute Substanz P.
Substanz P bewirkt über den Tachykininrezeptor 1
(NK1) wird von Nervenzellen und Leukozyten gebildet und
steuert auch die Chemotaxis weißer Blutzellen (diese exprimieren NK1). Substanz P ist ein Transmitter primärer afferenter Neurone
und findet sich vor allem in Aδ- und C-Schmerzfasern, deren Empfindlichkeit sie erhöht. Verletzung, Hitze
oder Kontakt mit bestimmten Stoffen (z.B. Capsaicin) führt zu Freisetzung von Substanz P und bewirkt Vasodilatation,
Permeabilitätssteigerung der Gefäße und Freisetzung von Histamin und
Prostaglandinen aus Mastzellen (neurogene Entzündung), was einerseits Schmerz verursacht, andererseits zur Wundheilung beiträgt.
Kollateralen der Schmerzfasern geben im betroffenen Gewebe u.a. Substanz P
ab (im ZNS funktionieren die Fasern glutamaterg), welches an Mastzellen
die Freisetzung von Histamin und an Blutgefäßen eine Erweiterung
bewirken. Dies fördert entzündliche Veränderungen, welche Hyperalgesie  bewirken,
aber auch Reparatur- und Heilungsvorgänge unterstützen (sollen).
Substanz P findet sich auch reichlich in der substantia gelatinosa des
Hinterhorns im Rückenmark.
bewirken,
aber auch Reparatur- und Heilungsvorgänge unterstützen (sollen).
Substanz P findet sich auch reichlich in der substantia gelatinosa des
Hinterhorns im Rückenmark.
 Histamin
Histamin  wird hauptsächlich von Mastzellen sowie basophilen und eosinohilen
Granulozyten gebildet. Degranulierung - vor allem an
Schleimhäuten und im Bereich von Blutgefäßen - führt unter anderem zu
immunologischen Folgereaktionen. Geschädigte / gereizte Nozizeptoren geben an ihre Umgebung Substanz P ab, was Mastzellen zur Freisetzung von Histamin veranlasst und Entzündungsreaktionen triggert.
wird hauptsächlich von Mastzellen sowie basophilen und eosinohilen
Granulozyten gebildet. Degranulierung - vor allem an
Schleimhäuten und im Bereich von Blutgefäßen - führt unter anderem zu
immunologischen Folgereaktionen. Geschädigte / gereizte Nozizeptoren geben an ihre Umgebung Substanz P ab, was Mastzellen zur Freisetzung von Histamin veranlasst und Entzündungsreaktionen triggert.
Aktivierte Schmerzfasern bringen über Substanz P Mastzellen zur Histaminfreisetzung
|
Kinine sind Oligopeptide, die durch das Enzym Kallikrein aus Vorstufen (Kininogenen)
freigesetzt werden. Sie sind nicht nur an
Gerinnungsvorgängen, Blutdruckregulation (vasodilatierend) und Entzündungsvorgängen beteiligt, sondern auch an der Schmerzentstehung.
Bradykinin ist eine der aktivsten schmerzauslösenden Substanzen; es aktiviert
direkt G-Protein-gekoppelte Bradykininrezeptoren → Phospholipase C → Proteinkinase C (PKC) an A∂- und C-Schmerzfasern. PKC phosphoryliert und aktiviert die schmerzspezifischen TRPVR1-Kanäle,
was zu Kationeneinstrom, Depolarisation und Erregung der Nervenfaser
führt. Bradykinin erhöht auch die Synthese und Freisetzung von
Prostaglandinen aus umliegenden Zellen.
 Abbildung: Sensibilisierung von Schmerzrezeptoren durch entzündliche Vorgänge
Modifiziert nach einer Vorlage bei McMahon / Koltzenburg: Wall and
Melzack's Textbook of Pain, 5th ed. Churchill Livingstone, Philadelphia
2006
Abbildung: Sensibilisierung von Schmerzrezeptoren durch entzündliche Vorgänge
Modifiziert nach einer Vorlage bei McMahon / Koltzenburg: Wall and
Melzack's Textbook of Pain, 5th ed. Churchill Livingstone, Philadelphia
2006
Gereizte
Zellen setzen Mediatoren frei, welche Schmerzfasern indirekt oder
direkt sensibilisieren (links). Unterschiedliche nozizeptive Fasern
differieren in ihrer Ausstattung mit Rezeptoren. Immunzellen und
Keratinozyten üben
modulierende Effekte aus (rechts).
Schematische Darstellung (die gezeigte Faser weist eine Vielzahl möglicher Rezeptoren auf)
A2, P2X = Adenosinrezeptoren
 ASICS
ASICS =
acid-sensing ion channels  CRH
CRH = Corticotropin- Releasingfaktor
 GIRK
GIRK =
G protein-coupled inwardly rectifying potassium (K) channel  IL
IL = Interleukin

LIF =
leukemia inhibitory factor  µ
µ = Opioidrezeptor
 M2
M2 = muskarinischer Rezeptor
 NGF
NGF = Nervenwachstumsfaktor
 PAF
PAF = Plättchenaktivierender Faktor
 PKA / PKC
PKA / PKC = Proteinkinase A / C
 SSTR
SSTR = Somatostatinrezeptor
 TNF
TNF = Tumornektor
 TrkA
TrkA = Tyrosinkinaserezeptor A

TTXr =
Tetrodotoxin-resistant sodium channel

Prostaglandine werden durch Zyklooxygenase (COX) -Enzyme aus Arachidonsäure in der Zellmembran abgespalten. Prostaglandine der 2er-Serie (PGE2 u.a.) aktivieren über G-Protein-gekoppelte Prostaglandinrezeptoren über Adenylylcyclase und cAMP die Proteinkinase A (PKA). Wie PKC, phosphoryliert und aktiviert die PKA TRPVR1-Kanäle, was zu Kationeneinstrom, Depolarisation und Erregung der Nervenfaser führt.
 Aspirin und andere nicht-steroidale Analgetika blockieren die Aktivität der Zyklooxygenase, senken die Prostaglandinsynthese und werden häufig zur Schmerztherapie angewendet.
Aspirin und andere nicht-steroidale Analgetika blockieren die Aktivität der Zyklooxygenase, senken die Prostaglandinsynthese und werden häufig zur Schmerztherapie angewendet.
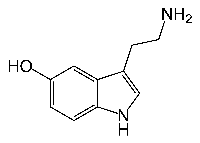 Serotonin
bindet an ionotrope Serotoninrezeptoren der Schmerzfasern; dies sind
Natriumkanäle, die durch Serotonin geöffnet werden (s. oben). Serotonin bewirkt darüber hinaus über
NO-Bildung Vasodilatation, Ödembildung und Leukozytendiapedese; Rötung
und Quaddelbildung sind die Folge.
Serotonin
bindet an ionotrope Serotoninrezeptoren der Schmerzfasern; dies sind
Natriumkanäle, die durch Serotonin geöffnet werden (s. oben). Serotonin bewirkt darüber hinaus über
NO-Bildung Vasodilatation, Ödembildung und Leukozytendiapedese; Rötung
und Quaddelbildung sind die Folge.
ATP wirkt schmerz- und
entzündungsauslösend, wenn es aus verletzten Zellen freigesetzt wird. Es wirkt über P2X-Rezeptoren (s. oben) an nozizeptiven Nervenfasern fördernd auf die Durchlässigkeit für Na+, K+ und Ca++.

 Abbildung: Verletzung und Schmerzaktivierung, Vasodilatation, Immunsystem
Nach Ren K, Dubner R, Interactions between the
immune and nervous systems in pain. Nature Medicine 2010; 16: 1267–76
Abbildung: Verletzung und Schmerzaktivierung, Vasodilatation, Immunsystem
Nach Ren K, Dubner R, Interactions between the
immune and nervous systems in pain. Nature Medicine 2010; 16: 1267–76
Werden Zellen verletzt, setzen sie verschiedene Mediatorstoffe frei (H+, Bradykinin, Serotonin, K+, Prostaglandine, NGF..: "Inflammatory soup"). Diese reizen nozizeptive Nervenfasern.
Mediatoren aktivieren Toll-like Rezeptoren an Keratinozyten und Mastzellen (MC) nahe an Nervenendigungen und Gefäßen. Degranulation der Mastzellen setzt Stoffe wie Histamin und Heparin
frei (zusätzliche Mediatoren).
Ebenfalls freigesetzte Vasodilatatoren befördern Anheftung und Migration von Immunzellen, u.a. T-Zellen (T), Neutrophilen (N) und Monozyten (MN) sowie den Nachschub von Makrophagen (Mo).
Diese aktivierten Zellen setzen zahlreiche Mediatoren frei, die
nozizeptive Rezeptoren stimulieren:

 Zytokinrezeptoren (CytR)
Zytokinrezeptoren (CytR)  G-Protein-gekoppelte Rezeptoren (GPCR)
G-Protein-gekoppelte Rezeptoren (GPCR)  ligandenaktivierte Kanäle (LGC) = ionotrope Rezeptoren
ligandenaktivierte Kanäle (LGC) = ionotrope Rezeptoren  Tyrosinkinase-Rezeptoren von Typ I (TrkA) u.a.
(1): Mastzelldegranulierung erfordert N-cadherin (N-cad), die Metalloproteinase MMP-24 baut N-cad ab und verhindert Mastzelldegranulierung
(2): Freisetzung von TNF-alpha und IL-15 durch Nerven- und Schwann-Zellen aktiviert die Peptidase MMP-9 (Matrix metallopeptidase 9) und rekrutiert Makrophagen
(3): Durch antidrome Erregung können schmerzempfindliche Nervenendigungen die Neuropeptide Substanz P (SP) und CGRP
sezernieren. Diese Stoffe bewirken Vasodilatation und Extravasation von
Immunzellen; sie werden durch neutrale Endopeptidase (NEP) abgebaut
Tyrosinkinase-Rezeptoren von Typ I (TrkA) u.a.
(1): Mastzelldegranulierung erfordert N-cadherin (N-cad), die Metalloproteinase MMP-24 baut N-cad ab und verhindert Mastzelldegranulierung
(2): Freisetzung von TNF-alpha und IL-15 durch Nerven- und Schwann-Zellen aktiviert die Peptidase MMP-9 (Matrix metallopeptidase 9) und rekrutiert Makrophagen
(3): Durch antidrome Erregung können schmerzempfindliche Nervenendigungen die Neuropeptide Substanz P (SP) und CGRP
sezernieren. Diese Stoffe bewirken Vasodilatation und Extravasation von
Immunzellen; sie werden durch neutrale Endopeptidase (NEP) abgebaut
Mastzellen
wurden ursprünglich der Phagozytose "verdächtigt" (daher der Name). Sie
finden sich in der Nähe von Nerven und Gefäßen,
Schleimhäuten (Atemwege, Darm), im Corium des Auges u.a. Sie speichern
Granula, aus denen sie bei Bedarf Stoffe wie Histamin, Serotonin,
Bradykinin und Prostaglandine freisetzen (Degranulation). Sie
beteiligen sich an allergischen (Typ I)
und anderen Reaktionen, die akute Symptome (u.a. Schmerz) auslösen können.

Periphere Schmerzafferenz
Nozizeptive Nervenfasern haben im Vergleich zu reinen mechano-, kälte-
oder wärmeempfindlichen Afferenzen eine relativ hohe Reizschwelle. Sie informieren das Gehirn über potentiell schädliche
(mechanische, thermische, chemische) Reize.
Die Ansprechcharakteristik
ist meist multimodal und nicht-adaptiv.
Nozizeptoren sind multimodal und adaptieren nicht
|
Reizung von Nozizeptoren
führt zu Veränderungen der Ionenströme der Nervenmembran, diese werden
durch Aktivierung von Natriumkanälen verstärkt und dies löst
Aktionspotentiale aus, die über "Schmerzfasern" nach zentral geleitet
werden. Dabei unterscheidet man einen "ersten" und einen "zweiten" Schmerz:
 Der ”erste“, rasch abklingende
”Delta-Schmerz“ (nach der Leitung über Nervenfasern des Typs A-δ) wird relativ rasch
geleitet (5-30 m/s) und ist gut lokalisierbar. Diese Schmerzfasern sind auf die Detektion mechanischer Verformung der Haut spezialisiert. Ihre rezeptiven Felder sind groß, aber innerhalb dieser ist die Schmerzsensitivität auf kleine Flächen ("pain spots")
limitiert (ähnlich wie bei rezeptiven Feldern der Thermosensibilität).
Stimulierung des Delta-Schmerzes führt zu reflektorischen Reaktionen
(Abwehr-, Ausweich- bzw. Fluchtreaktionen), um dem Auslöser des
Schmerzes zu entkommen.
Der ”erste“, rasch abklingende
”Delta-Schmerz“ (nach der Leitung über Nervenfasern des Typs A-δ) wird relativ rasch
geleitet (5-30 m/s) und ist gut lokalisierbar. Diese Schmerzfasern sind auf die Detektion mechanischer Verformung der Haut spezialisiert. Ihre rezeptiven Felder sind groß, aber innerhalb dieser ist die Schmerzsensitivität auf kleine Flächen ("pain spots")
limitiert (ähnlich wie bei rezeptiven Feldern der Thermosensibilität).
Stimulierung des Delta-Schmerzes führt zu reflektorischen Reaktionen
(Abwehr-, Ausweich- bzw. Fluchtreaktionen), um dem Auslöser des
Schmerzes zu entkommen.
 Der ”zweite“, schlecht lokalisierbare, dumpf-brennende,
langsam abklingende, quälende ”C-Schmerz“ ist benannt nach
Nervenfasern der Gruppe C,
welche die langsamste
Leitungsgeschwindigkeit (≤1 Meter pro Sekunde) aufweisen. Viszeraler
Schmerz (durch starke Dehnung oder Einengung, unempfindlich gegenüber
Schneiden oder Brennen) wird ausschließlich über C-Fasern geleitet
(eine Fluchtreaktion wie bei Reizung von A-delta-Fasern wäre nicht
sinnvoll, den eigenen Eingeweiden kann man nicht davonlaufen).
Viszeraler Schmerz wird diffus - oft auf Hautzonen projiziert - empfunden und löst vegetative Reaktionen aus (Schweißausbruch, Blutdruckerhöhung..).
Der ”zweite“, schlecht lokalisierbare, dumpf-brennende,
langsam abklingende, quälende ”C-Schmerz“ ist benannt nach
Nervenfasern der Gruppe C,
welche die langsamste
Leitungsgeschwindigkeit (≤1 Meter pro Sekunde) aufweisen. Viszeraler
Schmerz (durch starke Dehnung oder Einengung, unempfindlich gegenüber
Schneiden oder Brennen) wird ausschließlich über C-Fasern geleitet
(eine Fluchtreaktion wie bei Reizung von A-delta-Fasern wäre nicht
sinnvoll, den eigenen Eingeweiden kann man nicht davonlaufen).
Viszeraler Schmerz wird diffus - oft auf Hautzonen projiziert - empfunden und löst vegetative Reaktionen aus (Schweißausbruch, Blutdruckerhöhung..).
Es gibt unterschiedliche C-Fasern: Einige reagieren auf mechanische,
andere auf (extreme) thermische, wiederum andere auf chemische
Schmerzreize. Die
langsamsten von ihnen reagieren auf Histamin und übertragen die
Empfindung von
Jucken.
Experimentelle selektive Blockade von A-delta- oder C-Fasern zeigt eindrucksvoll, was den Unterschied zwischen diesen beiden Schmerzafferenzen ausmacht. Anoxie im Gewebe (wie sie durch Unterbrechung der Blutzufuhr z.B. mittels einer Manschette rasch herbeigeführt werden kann) blockiert zuerst die gut myelinisierten A-Fasern,
und nach Mechano- und Thermosensibilität fällt der "rasche" (gut
lokalisierbare) Schmerz aus, der schlecht lokalisierbare, brennende
C-Schmerz bleibt länger erhalten. Im Gegensatz dazu blockieren Lokalanästhetika zuerst die Leitung in schlecht myelinisierten C-Fasern, und die Reihenfolge der Ausfälle dreht sich um (langsam leitende C-Fasern sind zuerst betroffen).
Aktionspotentiale von Nozizeptoren werden über rasch (Aß), mäßig schnell (Aδ) und langsam
leitende (C-) Fasern vom Körper (periphere Innervation) in das Rückenmark bzw. vom Gesichtsbereich (Trigeminus) in den Hirnstamm geleitet.
A-Fasern
leiten rascher und ermöglichen größere Entladungsfrequenzen sowie ein
höheres Auflösungsvermögen als C-Fasern. Häufig werden die Kürzel AMH bzw. CMH verwendet: A- bzw. C-Faser mit Mechano- und Hitze-Sensibilität. Weiters spricht man von MSAs (Afferenzen, die auf mechanische Reize ansprechen, also sensitiv sind) und MIAs (Afferenzen, die auf mechanische Reize kaum ansprechen, also auf diese praktisch insensitiv
sind - MIAs sind 30-50% der Schmerzafferenzen aus der Haut und
wahrscheinlich ein geringerer Prozentsatz aus den Eingeweiden).
Nozizeptive Fasern können nach "Markern" unterschieden werden, d.h.
 Molekülen, die sie in ihrer Membran tragen (Rezeptoren, Glykokonjugate),
Molekülen, die sie in ihrer Membran tragen (Rezeptoren, Glykokonjugate),
 Molekülen, die sie speichern und freisetzen (z.B. Peptide),
Molekülen, die sie speichern und freisetzen (z.B. Peptide),
 Enzymen, die sie exprimieren bzw. nutzen.
Enzymen, die sie exprimieren bzw. nutzen.
Damit lassen sich Schmerzfasern zusätzlich definieren (z.B. sind
praktisch alle viszeralen Schmerzafferenzen peptiderg, aber nur jede
zweite von der Haut; bestimmte Neuronen projizieren in bestimmte
Rückenmarkszonen, etc). Entzündliche Veränderungen wirken sich auf das
Muster exprimierter Marker aus.
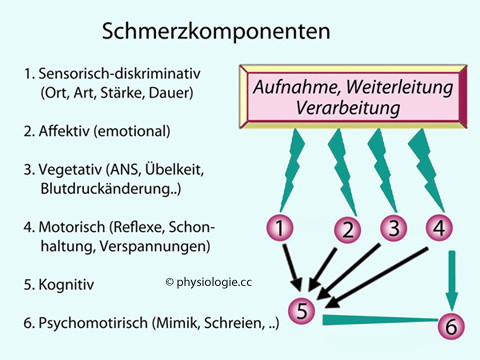
 Abbildung: Komponenten des Schmerzes
Abbildung: Komponenten des Schmerzes
Die Reihenfolge des zeitlichen Auftretens ist durch Zahlen gekennzeichnet
ANS = Autonomes ("vegetatives") Nervensystem

Von der Haut leiten nichtmyelinisierte (C-) Fasern Hitzeschmerz von unbehaarter Haut der Hände sowie Schmerz durch anhaltenden Druck; myelinisierte
(A-) Fasern scharfen Schmerz von Hitzewirkung auf behaarte Haut sowie
von scharfer mechanischer Reizung. Beide Fasergruppen leiten Schmerz,
der durch chemische Reize entsteht. Die Lokalisierung von Schmerzreizen ist in der Haut (rezeptive Felder nozizeptiver C-Fasern ~100 mm2) gut; die Zahl der "Schmerzpunkte" ist hoch, sie übersteigt die der Druckpunkte um eine Zehnerpotenz.
Muskelschmerzen entstehen durch diverse noxische Reize (ATP, Prostaglandine, Zytokine, H+...);
hier gibt es Überschneidungen zu einer Art der Mechanosensitivität, die
dem Gehirn den Belastungsgrad der Muskelzellen mitteilt. Die Lokalisierbarkeit von Schmerzreizen im Muskel ist geringer als in der Haut, aber besser als in den Eingeweiden. "Muskelkater"
entsteht durch Mikrotraumen im Muskelgewebe, Gelenkschmerzen entstehen durch Defekte (z.B. Einrisse) oder
Entzündungen (z.B. Osteoarthritis) im Bereich von Kapsel, Bändern und Synovialschleimhaut; die Lokalisation ist sehr gut.
Auch nozizeptive Afferenzen aus den
Eingeweiden werden durch
chemische, thermische sowie mechanische Reize - Dehnung von Hohlorganen oder Mesenterium (dieses enthält u.a. Pacini-Körperchen) - ausgelöst, ferner durch Unterdurchblutung (Ischämie)
sowie
Substanzen, die bei Entzündungen freiwerden. Das parietale Peritoneum
ist wesentlich stärker schmerzempfindlich als das viszerale.

Abbildung: Viszeraler Schmerz: Projektion in Hirnstamm und Rückenmark
Nach einer Vorlage in Barrett KE, Barman SM, Boitano S, Brooks H, in: Ganong's Review of Medical Physiology, 23rd ed. McGraw-Hill 2009
Viszerale Afferenzen
laufen über verschiedene Nervenbahnen, wobei weite Bereiche sowohl
vagal als auch über Fasern, die in das Rückenmark projizieren, afferent
versorgt werden:
 Nozizeptive Fasern, die in den Hirnstamm projizieren, nutzen Hirnnerven (IX und X - der N. vagus innerviert praktisch alle Brust- und Baucheingeweide und übernimmt Aspekte des Eingeweideschmerzes) und liegen über der "Thorax-Schmerzlinie"
Nozizeptive Fasern, die in den Hirnstamm projizieren, nutzen Hirnnerven (IX und X - der N. vagus innerviert praktisch alle Brust- und Baucheingeweide und übernimmt Aspekte des Eingeweideschmerzes) und liegen über der "Thorax-Schmerzlinie"
 Nozizeptive Afferenzen, die in das Sakralmark projizieren, liegen unter der "Becken-Schmerzlinie"
Nozizeptive Afferenzen, die in das Sakralmark projizieren, liegen unter der "Becken-Schmerzlinie"
 Andere viszerale Schmerzfasern projizieren in das dazwischenliegende Rückenmark (zervikal, thorakal und lumbal), sie liegen zwischen den beiden Schmerzlinien. Sie teilen sich die Schmerzversorgung der Eingeweide mit Fasern des X. Hirnnerven
Andere viszerale Schmerzfasern projizieren in das dazwischenliegende Rückenmark (zervikal, thorakal und lumbal), sie liegen zwischen den beiden Schmerzlinien. Sie teilen sich die Schmerzversorgung der Eingeweide mit Fasern des X. Hirnnerven
Reizung
unterschiedlicher schmerzsensibler Neurone aus ein und demselben Organ
kann differente Reaktionen zeitigen: So bedingt Stimulierung
zervikothorakal projizierender noxischer Afferenzen vom Herzen Tachykardie (Sympathikus) und Anginaschmerz, diejenige von vagalen Schmerzafferenzen hingegen Bradykardie (Parasympathikus) und Übelkeit.
Die Zuordnung der "Schmerzlinien" erfolgte ursprünglich in Hinblick auf
die in der Abbildung angedeutete autonom-nervöse Strukturierung des ZNS
(sympathisch: Thorakolumbalmark; parasympathisch: Hirnstamm und
Sakralmark)

Die Lokalisierbarkeit einer Schmerzquelle ist im viszeralen Bereich ausgesprochen ungenau und im Charakter diffus (so führt Aufblasen eines
Ösophagusballons auf mehr als 40 mmHg zu z.T. intensiver retrosternaler
Beklemmung mit Schmerzausstrahlung z.B. in Schulter, Hals und Kiefer;
Gewebeverletzungen in den Eingeweiden werden u.U.
überhaupt nicht wahrgenommen).
Viszerale Schmerzprojektionen und funktionelle Reaktionen sind von Organ zu
Organ unterschiedlich.
Viszeraler Schmerz kann reflektorisch die Skelettmuskulatur aktivieren,
und es kann durch polysynaptische Verschaltungen nicht nur zu
Kontraktionen im betreffenden Rückenmarksegment, sondern auch in
anderen Regionen kommen, z.B. Verspannungen der gesamten
Bauchmuskulatur bei Peritonitis (Bauchfellentzündung).
Afferente
Fasern der viszeralen Schmerzleitung geben oftmals Kollateralen zu
prävertebralen Ganglien ab, schalten dort um und beeinflussen so
motorische, Sekretions- oder endokrine Aktivitäten der Eingeweide. Im
Rückenmark erfolgen synaptische Umschaltungen im Hinterhorn (lamina I
und II - substantia gelatinosa), in benachbarten Rückenmarkssegmenten (Wirkung auf sympathische / parasympathische Neuronen sowie auf die laminae V und X), sowie Projektionen in das Gehirn.
Übertragener Schmerz: Head-sche Zonen
Viszerale
Afferenzen zum ZNS schließen sich autonom-nervösen Axonen an, ihre
Zellkörper liegen in "Spinalganglien" der betreffenden Hinterwurzel.
Alle Neuronen im Rückenmark, die Afferenzen aus den Eingeweiden
erhalten, haben auch solche aus einem (ihnen zugeordneten) somatischen
rezeptiven Gebiet. Wenn vegetative Afferenzen sensitiviert werden
(insbesondere durch entzüdliche Vorgänge in den Eingeweiden), erzeugen
sie Aktionspotentiale, die vom Gehirn als somatischer Schmerz
interpretiert und auf betreffende Hautareale projiziert werden.
Übertragener Schmerz (referred pain): Schmerzhafte Irritation innerer Organe bedingt Überempfindlichkeit / Schmerzempfinden bestimmter Hautareale ("übertragener" Schmerz). Diese als Head-sche Zonen
bezeichneten Hautflächen haben diagnostische Bedeutung ( Abbildung).
Abbildung).
 Abbildung: Head'sche Zonen
Abbildung: Head'sche Zonen
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Die Abbildung zeigt typische Projektionsgebiete innerer Organe
auf die Haut (Head-sche Zonen). Die in die jeweiligen Hinterhornsegmente des
Rückenmarks eintretenden Schmerzimpulse werden im Gehirn als von den
entsprechenden Hautsegmenten stammend interpretiert (übertragener
Schmerz, referred pain).
An
diesen Hautarealen empfundene Überempfindlichkeit bzw. Schmerzphänomene
geben diagnostische Hinweise auf innere Erkrankungen (z.B.
Herzinfarkt).
Die Head'schen Zonen sind in verschiedenen Quellen sehr unterschiedlich dargestellt

Der
Schmerz entsteht dadurch, dass über die Spinalnerven somatosensible und
viszerosensible Impulse nebeneinander
übertragen werden, die auf gemeinsame Interneurone konvergieren. Das an Impulse von "außen" gewöhnte Gehirn weiß nicht, ob die über den tractus spinothalamicus einlangende Information aus der Tiefe oder von der Körperoberfläche stammt und ordnet sie den entsprechenden sensiblen Hautgebieten zu.
Grundlage für übertragenen Schmerz ist die Konvergenz somatischer und viszeraler Afferenzen im spinalen Hinterhorn
Der in den linken Arm ausstrahlende Schmerz bei einem Myokardinfarkt ist ein übertragener Schmerz
|
Projizierter Schmerz: Das
Gehirn ordnet alle über Afferenzen eintreffenden Informationen dem
Ursprungsbegiet des betreffenden Nerven zu, also z.B. Schmerzreize auch
dann, wenn diese im Nerven selbst entstehen (z.B. schmerzt die Hand auf
der Kleinfingerseite wie nach einem Stromschlag, wenn der Ulnarisnerv
in der Ulnarisrinne der Ellenbogeninnenseite gequetscht wird -
"narrisches Bein").
Direkte Nervenreizung kann z.B. mechanisch erfolgen und betrifft u.a. Schmerzfasern
Das Gehirn interpretiert diese Impulse schmerzhaft (projizierter Schmerz)
|
Schmerz: Weiterleitung und zentrale Verarbeitung
Die
Fasern des Schmerzsystems ziehen nach ihrem Eintritt ins Rückenmark (vom Gesicht: in den Hirnstamm) einige Segmente auf-
und abwärts (in der - der substantia gelatinosa außen aufliegenden - Lissauer'schen Zone  ). Sie schalten dann glutamaterg sowie
mittels Substanz P (das durch höhere Aktionspotentialfrequenzen aus
Speichervesikeln freigesetzt wird und intensiven Schmerz verursacht)
auf das nächste Neuron.
). Sie schalten dann glutamaterg sowie
mittels Substanz P (das durch höhere Aktionspotentialfrequenzen aus
Speichervesikeln freigesetzt wird und intensiven Schmerz verursacht)
auf das nächste Neuron.
Vom 1. auf das 2. Schmerzneuron wird im Hinterhorn glutamaterg umgeschaltet
|
 Langsam leitende C-Fasern projizieren vor allem auf die Laminae I und II (etwa gleichzusetzen mit der substantia gelatinosa) - diese enthalten vor allem kurze Interneurone,
Langsam leitende C-Fasern projizieren vor allem auf die Laminae I und II (etwa gleichzusetzen mit der substantia gelatinosa) - diese enthalten vor allem kurze Interneurone,
 Schneller leitende Aδ-Fasern schalten in den Laminae I und V
des Hinterhorns um (hier können auch Kollateralen somatisch afferenter
Aβ-Fasern - deren Axone ipsilateral zu Hinterstrangkernen aufsteigen -
umschalten).
Schneller leitende Aδ-Fasern schalten in den Laminae I und V
des Hinterhorns um (hier können auch Kollateralen somatisch afferenter
Aβ-Fasern - deren Axone ipsilateral zu Hinterstrangkernen aufsteigen -
umschalten).
Viele Neuronen in der lamina I reagieren selektiv auf Schmerzeingänge (nociceptive-specific neurons);
sie projizieren auf Neurone in Mittelhirn und Thalamus. Andere
reagieren auch auf andere Sinnesmodalitäten (z.B. Kälte) und heißen WDR-Neurone (wide dynamic range).
Diese Umschaltungen im Hinterhorn können Angriffspunkt für schmerzverstärkende Veränderungen
sein. Traumatische Veränderungen wie chronische Rückenschmerzen oder
Amputation einer Extremität können hier zu verstärkter synaptischer
Effizienz führen, an denen Gliazellen (Astrozyten, Mikroglia) beteiligt sind.
Die Schmerzprojektionen verlaufen
getrennt von anderen
somästhetischen Afferenzen und werden parallel zu diesen verarbeitet. Kollaterale Äste
wirken über kurze auf- und absteigende Neuronen auf Nachbarsegmente des
Rückenmarks. Nach der synaptischen Zwischenstation im Hinterhorn übernehmen lange aufsteigende Fasern die Schmerzprojektion
zum Gehirn.
Schmerzinformation wird hauptsächlich über vier aufsteigende Systeme
zum Gehirn projiziert - den tractus spino- und trigeminothalamicus, den
tractus spinoreticularis, den tractus spinoparabrachialis und den
tractus spinohypothalamicus:
 Die spinothalamische Bahn (tractus spinothalamicus lateralis, anterolaterales System) ist die führende Schmerzprojektion
zum Gehirn. Ihre Fasern stammen aus den Rexed-Zonen I sowie V bis VII
des Hinterhorns. Diese kreuzen nahe ihrem Ursprungssegment auf die
Gegenseite und ziehen antertolateral (im Hirnstamm neben dem
lemniscus medialis gelegen) nach zentral. Der tractus spinothalamicus vermittelt Nozizeption von Haut, Gelenken und Muskeln und endet im Thalamus.
Die spinothalamische Bahn (tractus spinothalamicus lateralis, anterolaterales System) ist die führende Schmerzprojektion
zum Gehirn. Ihre Fasern stammen aus den Rexed-Zonen I sowie V bis VII
des Hinterhorns. Diese kreuzen nahe ihrem Ursprungssegment auf die
Gegenseite und ziehen antertolateral (im Hirnstamm neben dem
lemniscus medialis gelegen) nach zentral. Der tractus spinothalamicus vermittelt Nozizeption von Haut, Gelenken und Muskeln und endet im Thalamus.
Hier erfolgt
die Umschaltung auf ein drittes Neuron, wobei die Ortung des Schmerzes
sowie dessen Art, Dauer und Intensität berücksichtigt wird (Diskrimination). Die
thalamischen Adressaten der aufsteigenden Schmerzfasern sind einerseits
der nucl. ventralis posterolateralis (Schmerzkomponenten von anderen somatosensorischen getrennt repräsentiert), andererseits intralaminäre Kerne (breite kortikale Projektion).
Kollateralen gelangen im Hirnstamm zu Kerngebieten (wie zentrales Höhlengrau, formatio reticularis), die schmerzabhängiges Verhalten (z.B. Aufschreien) auslösen, also noch vor der Möglichkeit einer Kontrolle durch das Gehirn (soziale Warnfunktion).
Der Thalamus (laterale Kerne) vermittelt die diskriminatorische Schmerzkomponente
|
Der Thalamus projiziert schließlich auf den sensomotorischen Cortex
(vor allem S2), der Entstehungsort und Intensität des Schmerzreizes erkennt. Das ermöglicht Interozeption des Eingeweideschmerzes - endokrine, autonom-nervöse und Verhaltensänderungen sind die Folge.
Für die trigeminothalamische Bahn
(V, N.
trigeminus: Gesicht, Mund..) gilt ein analoges Schaltprinzip. WDR-Neurone vermitteln multimodale sensorische Information; nach Umschaltung im spinalen Trigeminuskern und Seitenkreuzung ziehen Fasern des trigeminalen Lemniscus zum lateralen Thalamus.
Neben
der spinothalamischen und trigeminalen Bahn gibt es weitere
schmerzleitende (und Information über Temperatur vermittelnde) Systeme
via alle Ebenen des Hirnstamms; diese tragen einerseits brennende und
quälende, andererseits "weckende" Komponenten bei. Dieses System ist
phylogentisch älter, involviert zentrale Thalamuskerne und projiziert
diffus auf formatio reticularis, Hypothalamus und das limbische System:
 Die spinoretikuläre Bahn (tractus spinoreticularis) entspringt in laminae VII und VIII des Hinterhorns und projiziert über Umschaltungen im Bereich der formatio reticularis zum medialen Thalamus. Dieses System überträgt diffuse, unscharf lokalisierbare Schmerzinformation.
Die spinoretikuläre Bahn (tractus spinoreticularis) entspringt in laminae VII und VIII des Hinterhorns und projiziert über Umschaltungen im Bereich der formatio reticularis zum medialen Thalamus. Dieses System überträgt diffuse, unscharf lokalisierbare Schmerzinformation.
 Die spino-parabrachiale Bahn projiziert über Umschaltungen im Bereich formatio reticularis und nucl. parabrachialis zum medialen Thalamus und zu limbischen
Strukturen. Sie vermittelt emotionale und aversive Komponenten, die
über limbisch-motorische Zugänge vermittelt werden (Mimik, Schreie,..)
und beeinflussen den Wachzustand.
Die spino-parabrachiale Bahn projiziert über Umschaltungen im Bereich formatio reticularis und nucl. parabrachialis zum medialen Thalamus und zu limbischen
Strukturen. Sie vermittelt emotionale und aversive Komponenten, die
über limbisch-motorische Zugänge vermittelt werden (Mimik, Schreie,..)
und beeinflussen den Wachzustand.
 Die spino-hypothalamische Bahn
führt Axone aus laminae I, V, VII und VIII. Die hypothalamischen
Neurone, auf die sie projizieren, regulieren Kreislauf- und
neuroendokrine Reaktionen auf Schmerzmeldungen.
Die spino-hypothalamische Bahn
führt Axone aus laminae I, V, VII und VIII. Die hypothalamischen
Neurone, auf die sie projizieren, regulieren Kreislauf- und
neuroendokrine Reaktionen auf Schmerzmeldungen.
Mehrere thalamische Kerne vermitteln Schmerzinformation an Adressaten im Gehirn, insbesondere die laterale (VPL, VPM, Pulvinar
- diese Kerne vermitteln präzise Ortung der Schmerzquelle, fußend auf
Information aus kleinen rezeptiven Feldern) und die mediale Kerngruppe
(mediodorsal, zentrolateral, intralaminar).
Veränderungen am Thalamus können das Schmerzerlebnis stark
beeinflussen. So ruft elektrische Reizung im Bereich der ventrobasalen
Kerne scharfen Schmerz, solche im Bereich der zentralen Kerne allgemein
unangenehme Sensationen hervor.
Läsionen im Thalamus können sehr unterschiedliche Auswirkungen auf das Schmerzempfinden haben - z.B. im Rahmen des Thalamussyndroms (thalamic pain syndrome), das als Folge lokaler Ischämie (ischemic stroke) oder Blutung (hemorrhagic stroke) auftreten kann.
 Abbildung: Schmerzafferenz und subkortikale / kortikale Schmerzverarbeitung
Abbildung: Schmerzafferenz und subkortikale / kortikale Schmerzverarbeitung
Nach Schweinhardt P, Bushnell MC. Pain imaging in health and disease - how far have we come? J Clin Invest. 2010; 120: 3788-97
Die
somatosensorischen Rindengebiete
S1 und S2 sowie der
gyrus cinguli
erhalten periphere Information über den Thalamus (der gyrus cinguli
vermittelt u.a. motorische Antworten auf Schmerzreize). Der
Insel- und
präfrontale Cortex sowie die
Amygdala spielen für Schmerzverarbeitung
eine zentrale Rolle. Schmerz aktiviert auch Basalganglien (
Striatum)
und das
Kleinhirn.
ACC,
anterior cingulate cortex, vorderer gyrus cinguli

Amyg, Mandelkerne

BG, Basalganglien

M1, primärer Motorcortex

HT, Hypothalamus

PAG, periaquäduktales Grau (zentrales Höhlengrau)

PB, nucl parabrachialis (dorsolaterale Brücke)
 PCC
PCC, posteriorer gyrus cinguli

PFC, präfrontaler Cortex

PPC, posteriorer Parietalcortex

S1 / S2, primäre / sekundäre somatosensorische Rinde

SMA, supplementär-motorisches Areal

Schmerzverarbeitung erfolgt nicht in einem einzelnen Zentrum alleine; zahlreiche
Gehirnregionen sind daran beteiligt. Das betrifft sowohl Oberflächen- wie auch
Tiefen- und viszeralen Schmerz.
 Der somatosensorische Cortex bildet Schmerzinformation somatotop organisiert ab; experimentelle Reizung des Cortex führt aber nicht zu Schmerzempfinden.
Der somatosensorische Cortex bildet Schmerzinformation somatotop organisiert ab; experimentelle Reizung des Cortex führt aber nicht zu Schmerzempfinden.

Die
Mandelkerne
ermöglichen emotionale Konditionierung sowie emotions-und
affektrelevante Lernvorgänge, insbesondere in Verbindung mit
Verunsicherung, Angst und Schmerz.
 Der mediale präfrontale Cortex ist das sensori-motorische Viszeralgehirn.
Reizung dieses Areals ruft verschiedene vegetative Effekte hervor, wie
Veränderungen des Blutdrucks oder Kontraktion des Magens. Es besteht
aus zwei interagierenden funktionellen Zonen:
Der mediale präfrontale Cortex ist das sensori-motorische Viszeralgehirn.
Reizung dieses Areals ruft verschiedene vegetative Effekte hervor, wie
Veränderungen des Blutdrucks oder Kontraktion des Magens. Es besteht
aus zwei interagierenden funktionellen Zonen:

Rostrale
Insel. Diese erhält Schmerzinformation sowohl vom Thalamus als auch von den
Mandelkernen; sie integriert sensorische, affektive und kognitive
Komponenten des Schmerzerlebnisses. Fällt die Insel aus, werden Ort und
Intensität des Schmerzes immer noch korrekt wahrgenommen, die affektive
Komponente verschwindet aber (Schmerz-Asymbolie).
 Vordere Spitze der Gürtelwindung (gyrus cinguli): Sie vermittelt u.a. motorische Antworten auf Schmerzreize. Der vordere gyrus cinguli (
Vordere Spitze der Gürtelwindung (gyrus cinguli): Sie vermittelt u.a. motorische Antworten auf Schmerzreize. Der vordere gyrus cinguli ( Abbildung: ACC - anterior cingulate cortex) ist ein Teil des limbischen Systems. Zusammen mit der Insel, aber auch dem posterioren gyrus cinguli ist der ACC in die emotionale Verarbeitung und Gewichtung von Schmerzen eingebunden, seine Aktivierung korreliert mit der Intensität der
Schmerzempfindung (oder deren Erwartung).
Abbildung: ACC - anterior cingulate cortex) ist ein Teil des limbischen Systems. Zusammen mit der Insel, aber auch dem posterioren gyrus cinguli ist der ACC in die emotionale Verarbeitung und Gewichtung von Schmerzen eingebunden, seine Aktivierung korreliert mit der Intensität der
Schmerzempfindung (oder deren Erwartung).
Der gyrus cinguli anterior vermittelt die affektive Schmerzverarbeitung (Angst usw)
|
Bei chronischen
Schmerzzuständen - und dem damit verbundenen Gefühl der Hilflosigkeit -
nimmt das Volumen des
dorsolateralen Präfrontalcortex rapide ab.
Modulierung der Schmerzleitung durch absteigende Impulse erfolgt im zentralen Höhlengrau, locus coeruleus und in der rostralen ventromedialen medulla oblongata.
Schmerzen an der Körperoberfläche führen typischerweise zu Abwehr- und
Schutz- (Flexor-) Reflexen, solche aus der Tiefe, insbesondere
viszerale Schmerzen zu emotionalen, Vermeidungs- und vegetativen
(autonom-nervösen) Reaktionen.
 Über schmerzinduzierte reflektorische Aktivierung von Flexoren s. dort
Über schmerzinduzierte reflektorische Aktivierung von Flexoren s. dort
Schmerzmodulation
Die
Bearbeitung von Schmerzinformation im ZNS erfolgt nicht nur afferent,
sondern auch efferent. Auf diese Weise fällt das Schmerzempfinden bei
gegebener aufsteigender nozizeptiver Impulsaktivität unterschiedlich
stark aus. So kann es im Schlaf reduziert sein, oder wenn die
Aufmerksamkeit auf andere Probleme gerichtet wird ("Ablenkung"). Man
spricht von Schmerzmodulation. Diese kann schon durch periphere
Rückkopplungen erfolgen oder durch übergeordnete Verschaltungen
(Abbildungen):

 Abbildung: Möglichkeiten peripherer Schmerzmodulation
Abbildung: Möglichkeiten peripherer Schmerzmodulation
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Im
Rahmen von Entzündungen oder bei Beschädigung setzen Zellen Stoffe wie
Prostaglandine oder Bradykinin frei. Diese werden von heptahelikalen
Rezeptoren (GPCRs) gebunden, second messengers
werden im nozizeptiven Neuron freigesetzt. Das aktiviert oder
sensitiviert Ionenkanäle (TRPV1, TRPA1) und steigert das
Schmerzempfinden (Hypersensitivität). Die second messengers
haben auch weitere Wirkungen und können in die Genexpression
eingreifen. Langfristige Veränderungen des Schmerzempfindens können die
Folge sein.
Sensorische Nervenendigungen geben auch Neuropeptide an ihre Umgebung frei (z.B. Substanz P oder CGRP). Diese regen wiederum benachbarte Zellen zur Freisetzung z.B. von Bradykinin und Prostaglandinen an

Die Schmerzmodulation fängt schon bei den peripheren Endigungen sensorischer Neurone an ( Abbildung). Verletzungen bedingen erhöhte Schmerzempfindlichkeit (Sensitivierung) des betroffenen Gebietes, bedingt durch die Freisetzung von Entzündungsmediatoren. Prostaglandine
(Lipide) oder das Peptid Bradykinin binden an Rezeptoren und triggern
dadurch intrazelluläre Folgereaktionen; das Neuron gibt Neuropeptide an
seine Umgebung ab, die wiederum Immunzellen und Epithelien zur
Produktion von schmerzauslösenden Mediatoren anregen (neurogene Entzündung).
Abbildung). Verletzungen bedingen erhöhte Schmerzempfindlichkeit (Sensitivierung) des betroffenen Gebietes, bedingt durch die Freisetzung von Entzündungsmediatoren. Prostaglandine
(Lipide) oder das Peptid Bradykinin binden an Rezeptoren und triggern
dadurch intrazelluläre Folgereaktionen; das Neuron gibt Neuropeptide an
seine Umgebung ab, die wiederum Immunzellen und Epithelien zur
Produktion von schmerzauslösenden Mediatoren anregen (neurogene Entzündung).
 Abbildung: Möglichkeiten zentraler Schmerzmodulation
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Abbildung: Möglichkeiten zentraler Schmerzmodulation
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Nervenzellen
im Hinterhorn des Rückenmarks beeinflussen die synaptische Übertragung
zwischen nozizeptiven sensorischen Neuronen und weiterleitenden
Hinterhornfasern. Sie setzen endogene Opioidpeptide frei, welche über
Opioidrezeptoren die Glutamatsekretion sensibler Neurone dämpfen und
die Depolarisierung postsynaptischer Neurone im Hinterhorn reduzieren.
Die Aktivität opioiderger Neurone wird ihrerseits durch deszendierende
Fasern beeinflusst, welche ihren Ursprung im Hirnstamm haben,
Noradrenalin, Serotonin oder GABA als Neurotransmitter verwenden und
Hinterhornneurone prä- oder postsynaptisch modulieren.
+/- bedeutet, dass die Erregbarkeit der Zielneurone gesteigert oder herabgesetzt werden kann
 Nozizeptive Neurone können
in zwei Richtungen wirksam sein: Sie signalisieren Schmerzsignale an
das Gehirn, im Rahmen ihrer Aktivität können ihre peripheren
Endigungen gleichzeitig auch Neuropeptide freisetzen und auf diese
Weise lokale Immunantworten beeinflussen. Opioidrezeptoren (die im ZNS
weit verbreitet exprimiert werden) finden sich sowohl in
präsynaptischen Endigungen sensorischer Fasern wie auch postsynaptisch
in Hinterhornneuronen. Werden sie angeregt, sinkt die
Transmitterfreisetzung sensorischer Neurone und die Ansprechbarkeit von
Hinterhornzellen (
Nozizeptive Neurone können
in zwei Richtungen wirksam sein: Sie signalisieren Schmerzsignale an
das Gehirn, im Rahmen ihrer Aktivität können ihre peripheren
Endigungen gleichzeitig auch Neuropeptide freisetzen und auf diese
Weise lokale Immunantworten beeinflussen. Opioidrezeptoren (die im ZNS
weit verbreitet exprimiert werden) finden sich sowohl in
präsynaptischen Endigungen sensorischer Fasern wie auch postsynaptisch
in Hinterhornneuronen. Werden sie angeregt, sinkt die
Transmitterfreisetzung sensorischer Neurone und die Ansprechbarkeit von
Hinterhornzellen ( Abbildung), was analgetisch wirkt.
Abbildung), was analgetisch wirkt.
Auch GABA-, serotonin- und noradrenerge Neurone in Hirnstammkernen
verfügen über zahlreiche Opioidrezeptoren, auch hier kann der Schmerz
beeinflusst werden - abgeschwächt oder verstärkt, je nach Typ der
absteigenden Fasern und der Zielzellen im Hinterhorn.
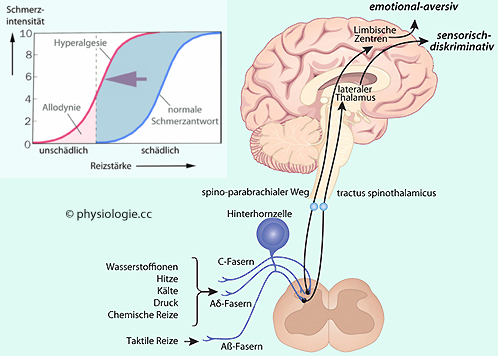
 Abbildung: Hyperalgesie und Allodynie; Schmerzleitung über den spinothalamischen und parabrachialen Weg
Abbildung: Hyperalgesie und Allodynie; Schmerzleitung über den spinothalamischen und parabrachialen Weg
Nach Kuner R, Central mechanisms of pathological pain. Nature Medicine 2010; 16: 1258–66, sowie (Inset) Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Inset: Verletzungen und Entzündungen verschieben die normale Empfinungskurve (blau) nach links (rote Kurve). Dadurch werden nicht-noxische Reize bereits als schmerzhaft (Allodynie) und nur geringgradig noxische Reize als deutlich schmerzhaft empfunden (Hyperalgesie).
Rechts: Schmerzafferenzen von
taktilen Schmerzsignalen über Aß-Fasern und den tr. spinothalamicus zum
lateralen Thalamus und von dort auf Cortexareale mit hoher
Ortsauflösung (sensorisch-diskriminativ), sowie über Aδ und C-Fasern
(mechanische, thermische, chemische Reize) und den spino-parabrachialen
Weg zum limbischen Cortex (emotional-aversive Reaktionen)
 Bei verstärkter Wahrnehmung von
Schmerzreizen spricht man von Hyperalgesie - einer Form von Hyperästhesie (=gesteigerte Empfindlichkeit afferenter Nerven). An der Stelle der Verletzung entsteht primäre Hyperalgesie, in der Umgebung sekundäre Hyperalgesie - bedingt durch die Sensitivierung von Neuronen im ZNS.
Bei verstärkter Wahrnehmung von
Schmerzreizen spricht man von Hyperalgesie - einer Form von Hyperästhesie (=gesteigerte Empfindlichkeit afferenter Nerven). An der Stelle der Verletzung entsteht primäre Hyperalgesie, in der Umgebung sekundäre Hyperalgesie - bedingt durch die Sensitivierung von Neuronen im ZNS.
 Verschiedene nicht-noxische Reize können die Empfindlichkeit des
Schmerzsystems steigern (die Schmerzschwelle senken); man spricht von
Allodynie
Verschiedene nicht-noxische Reize können die Empfindlichkeit des
Schmerzsystems steigern (die Schmerzschwelle senken); man spricht von
Allodynie  .
Dabei kommt es bereits bei geringer Reizintensität zu deutlicher
Schmerzwahrnehmung (pathologischer Schmerz,
.
Dabei kommt es bereits bei geringer Reizintensität zu deutlicher
Schmerzwahrnehmung (pathologischer Schmerz,  Abbildung).
Abbildung).
Der Körper verfügt über ein antinozizeptives System, das Schmerzafferenzen unterdrücken und dadurch
u.a. physiologische Funktionen in akuten Krisenlagen unterstützen kann
(Schmerzunempfindlichkeit bei extremer Stress-Situation). Man
unterscheidet Mechanismen der absteigenden (deszendierenden) und
aufsteigenden (aszendierenden) Schmerzmodifikation:
Das deszendierende System entspringt
im Frontalhirn und im Hypothalamus, beide projizieren auf das zentrale Höhlengrau. Dieses projiziert weiter auf Raphe-Kerne
der Pons sowie über den tractus
reticulospinalis zu den Hintersäulen des Rückenmarks. Diese serotoninerge Projektion erfolgt auf inhibitorische Neurone, die
übertragene Schmerzimpulse inhibieren.
Neuronen in den Raphekernen projizieren serotoninerg auf Neurone in den Hinterhörnern und hemmen die Schmerzübertragung
|
Opioiderge  Interneurone in der lamina II setzen Dynorphine oder Enkephaline
frei und hemmen so das Entladungsverhalten spinothalamischer
Projektionsneurone. Zur serotoninergen deszendierenden Schmerzhemmung kommt eine noradrenerge aus
dem locus coeruleus.
Interneurone in der lamina II setzen Dynorphine oder Enkephaline
frei und hemmen so das Entladungsverhalten spinothalamischer
Projektionsneurone. Zur serotoninergen deszendierenden Schmerzhemmung kommt eine noradrenerge aus
dem locus coeruleus.
Auf der Ebene des Hinterhorns erfolgt also bereits eine komplexe Modifikation der
Schmerzleitung. Über
dieses deszendierende 'Kontrollsystem' können aufsteigende
Schmerzimpulse 'abgefangen' werden, bevor sie an zentralere Orte
gelangen. Am Hinterhorn konvergieren die deszendierenden Bahnen zur Schmerzmodifikation.

 Abbildung: Afferente und efferente Beeinflussung der Schmerzleitung
Abbildung: Afferente und efferente Beeinflussung der Schmerzleitung
Nach Mendell LM, Computational functions of neurons and
circuits signaling injury: Relationship to pain behavior. PNAS 2011;
108 S3: 55596-601
Nozizeptive Eingänge (Aδ- und C-Fasern) in oberflächliche Schichten des Hinterhorns sind exzitatorisch (+). Aβ-Fasern haben auch inhibitorische Wirkungskomponenten (-).
Aus der rostralen ventromedialen medulla (RVM)
des Hirnstamms absteigende Systeme wirken exzitatorische (ON-Zellen) und inhibitorische
(OFF-Zellen) auf die Schmerzafferenz im Hinterhorn, und werden
vom mesenzephalen zentralen Höhlengrau (periaquäduktales Grau, PAG) getrennt angeregt.
Das zentrale Höhlengrau projiziert auch auf die Raphekerne und kann so die Schmerzafferenz aus dem Rückenmark modulieren. Es
wird seinerseits von Hypothalamus, Amygdala und gyrus cinguli anterior
gesteuert. RVM, PAG und Hypothalamus unterliegen Einflüssen durch
aufsteigende Schmerzprojektionen.
Parallel dazu existieren noradrenerge Einflüsse aus dem pontinen Tegmentum, die reziprok mit dem PAG-RVM-System verbunden sind (nicht gezeigt)

Die Rolle der zahlreichen Interneurone der oberflächlichen Rexed-Zonen
des Hinterhorns (glutaminerge exzitatorische, GABAerge inhibitorische)
in diesem Zusammenhang ist Gegenstand der Forschung. Klar ist, dass
diese Interneurone zahlreiche Cofaktoren und Rezeptoren exprimieren,
und dass hier große Flexibilität besteht (Hinauf- oder
Hinunterregulierung, z.B. bei entzündlichen Veränderungen).
Auch Lustgefühle haben schmerzblockierende Wirkung, wie sexuelle Aktivität oder im "high" körperlicher
Hochleistung. Der
Körper wird dadurch in die Lage versetzt, Tätigkeiten ohne besondere Irritation durch Schmerzreflexe zu
vollenden.
Berührung kann über Hyperalgesie zu schmerzhaften
Sensationen führen, umgekehrt kann die Aktivität von Schmerzfasern
durch Reizung von Mechanorezeptoren (und Aß-Fasern) reduziert werden (Reiben schmerzender Hautstellen,
Akupunktur u.a. lindern den Schmerz).
Gate-Control -Theorie und aszendierende Schmerzhemmung. Eine der Möglichkeiten, die Schmerzleitung zu schwächen
oder Schmerz auszuschalten, besteht in einer Interaktion von
Oberflächensensibilität und Schmerzleitung ( Abbildung):
Abbildung):

Abbildung: Konvergenz auf Projektionsneuronen und Schmerzmodulation
Nach einer Vorlage bei Pearson Education 2011
Nach der Gate control-Theorie
besteht für die Weiterleitung der Schmerzinformation (C-Faser, links)
ein "Tor" zu thalamopetalen Projektionsneuronen (links oben). Aktivität
nicht-nozizeptiver Mechanosensoren (rasche Aß-Fasern, rechts) kann dieses "Tor" durch Anregung inhibitorischer Interneurone (orange) schließen, bevor Impulse von Schmerzrezeptoren (langsame C-Fasern, links) eintreffen und die Aktivität der Interneurone hemmen.
+ = exzitatorische, - = inhibitorische Synapse. Das inhibitorische Interneuron wird durch Aß-Fasern aktiviert, durch Schmerzfasern gehemmt

Schmerzleitende C-Fasern betreten das Hinterhorn und schalten auf ein Projektionsneuron zum Thalamus ( Abbildung links). Diese Umschaltung unterliegt einem "Kontrolltor" (gate):
Abbildung links). Diese Umschaltung unterliegt einem "Kontrolltor" (gate): Erregung
mechanosensibler Rezeptoren in der Haut sendet Aktionspotentiale über
A-Fasern zu den Hintersträngen, und Kollateralen dieser Fasern
regen auf der Höhe des Eintritts ins Rückenmark inhibitorische Interneurone an. Dies schwächt die
Aktivierung des Projektionsneurons, das Schmerzimpulse erhält, und damit die Schmerzleitung an den
Thalamus (aszendierende Schmerzhemmung).
Ein
einfacher Versuch demonstriert dieses Phänomen: Ischämie (z.B. mittels
Manschette) schaltet zuerst die Empfindung von Druckreizen (Aß) aus,
die
Inhibition der Schmerzübertragung fällt aus, und die
Schmerzempfindung (C) im betroffenen Gebiet - z.B. durch Kneifen,
Stechen oder lokalen Kältereiz - ist gesteigert (brennender Schmerz mit
herabgesetztem Diskriminierungsvermögen).
Die inhibitorischen Interneurone werden durch Kollateralen der C-Faser gehemmt; diese Disinhibition
"sichert" die Schmerzübertragung vom primären auf das sekundäre noziduktive Neuron im Hinterstrangkern. Dieser Mechanismus funktioniert am besten, wenn er nicht durch aszendierende Schmerzhemmung "gestört" wird.
Der schmerzhemmende Effekt mechanischer Stimulation kann
verschiedentlich genutzt werden (Reiben verletzter Körperteile wirkt schmerzlindernd) und spielt
wahrscheinlich auch bei Akupunktur / Akupressur eine Rolle. Das Verfahren der transkutanen elektrischen Nervenstimulation (TENS),
bei der die Applikation schwacher Stromreize - gerade überschwellig für
gut myelinisierte, aber noch unterschwellig für C-Fasern -
schmerzverringernd wirkt, beruht ebenfalls auf diesem Effekt.
Im Hinterhorn des Rückenmarks konvergieren verschiedene
periphere Neuronen (teils somatosensorische, teils nozizeptive)
gemeinsam auf WDR-Neurone. Diese Verschaltung ist Angriffspunkt für die Modulation durch andere Neurone:

Afferente Aβ-Fasern hemmen die Übertragung auf WDR-Neurone über metabotrope
Glutamatrezeptoren - auf diese Weise wird die Übertragung nozizeptiver Impulse auf
Projektionsneuronen durch gleichzeitige mechanosensible Afferenz
abgeschwächt
(gate control theory)

Deszendierende Bahnen aus zentralem Höhlengrau und Raphekernen hemmen die Übertragung auf WDR-Neurone
serotoninerg

Deszendierende Bahnen aus zentralem Höhlengrau und Raphekernen innervieren hemmende
Interneurone, die endogene Opioide freisetzen (Erklärung des zentralen Opioid-Wirkungsmechanismus)
Das zentrale Höhlkengrau (PAG)
kann die Schmerzübertragung sowohl hemmen (endogene Schmerzlinderung)
als auch verstärken, z.B. bei übertragenem Schmerz in einem Gebiet, das
über Projektionsneuronen und zentrale Sensibilisierung überempfindlich
geworden ist

Auf diese Weise ist es komplex in kognitive sowie emotionale
Vorgänge eingebunden - ermöglicht durch Fasern, die
von gyrus cinguli, Insel, Hypothalamus und Mandelkernen zum zentralen
Höhlengrau absteigen. So hilft es beispielsweise, im Rahmen einer Stressreaktion (fight or flight) die Durchblutung des Körpers schwerpunktmäßig vom Verdauungssystem zur Muskulatur "umzuleiten".
Für das Schmerzsystem ist das zentrale Höhlengrau (PAG) sowohl in
absteigende als auch aufsteigende Informationsflüsse eingebunden.
Reizung hypothalamischer Kerngebiete
kann über Efferenzen zum zentrale
Höhlengrau sowohl Analgesie als auch Hyperalgesie hervorrufen. Afferente Information aus der Peripherie wird in die Schmerzverarbeitung integriert.
Das zentrale Höhlengrau projiziert - mit sowohl anregenden ("ON-") als auch hemmenden ("OFF-") Neuronen - auf rostrale ventromediale (RVM) Kerne: Diese umfassen Raphekerne und Teile der formatio reticularis. Aktivierung von OFF-Neuronen in rostralen ventromedialen Kernen ist für die schmerzmildernde
Wirkung von Opioiden notwendig; erhöhte ON-Neuronen-Aktivität
findet sich bei Hyperalgesie.

 Abbildung: Absteigende monoaminerge Schmerzhemmung
Abbildung: Absteigende monoaminerge Schmerzhemmung
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Das
zentrale Höhlengrau projiziert auf Neurone in Brücke und verlängertem
Mark, insbesondere den nucleus coeruleus, die noradrenerg auf
Hinterhornzellen projizieren; und auf den großen Raphekern (der
serotoninerg auf Hinterhornzellen projiziert). Diese Fasern hemmen Schmerzafferenzen teils direkt, teils über Interneurone - in den laminae I, II und V.
Die Mikropipetten zeigen Angriffspunkte für analgetische (blau) und Opiat-Schmerzblockade (grün)

RVM-Neurone beeinflussen dann die
Schmerzleitung im Hinterhorn (Rexed-Zonen I und II sowie V) des Rückenmarks.
Inhibition der Schmerzleitung kann hier auf verschiedene Weise erfolgen, z.B. durch
 Hemmung der Transmitterfreisetzung von afferenten Fasern
Hemmung der Transmitterfreisetzung von afferenten Fasern

 direkte postsynaptische Inhibition von Projektionsneuronen
direkte postsynaptische Inhibition von Projektionsneuronen

 Hemmung exzitatorischer Interneurone
Hemmung exzitatorischer Interneurone

 Anregung inhibitorischer Interneurone
Anregung inhibitorischer Interneurone
Aktivität
des zentralen Höhlengraus führt typischerweise zu Schmerzhemmung (analgetische Wirkung von Opioiden),
kann aber auch die Schmerzübertragung fördern (Hyperalgesie und
Allodynie bei Entzündungen, Gelenksschäden, Nervenschäden, Opioidentzug u.a.). Daher spricht man von einem schmerzmodulierenden System; in ihm finden sich Neuronen mit unterschiedlichen Transmittern (GABA, Serotonin, Noradrenealin etc.) und Neuropeptiden ( Abbildung).
Abbildung).
Verbindungen des RVM-Systems (rostrale ventromediale Kerne): Die Projektionen des zentralen Höhlengraus auf das RVM-System sind für seine absteigende Schmerzblockade entscheidend; ist der
rostrale ventromediale Kern ausgeschaltet (Läsion, Lidocaininjektion
oder Ähnliches), kann das PAG keine analgetische Wirkung ausüben. Neurone des RVM-Systems haben aufsteigende
Projektionen (zu Hypothalamus, Mandelkernen u.a.), deren Funktion
bislang ungeklärt ist; und sie erhalten umgekehrt deszendierende
(direkte) Projektion aus mehreren höheren Zentren für Emotionen und
vegetative Funktionen (limbisches System).
Auch Hormone können in das Schmerzgeschehen eingreifen. So gibt es Hinweise auf eine schmerzhemmende
Wirkung von Oxytozin über Modifikation der Schmerzübertragung im Hinterhorn des Rückenmarks.
Endocannabinoide 
Endocannabinoide (endogene Cannabinoide: Cannabinoide sind Wirkstoffe der Cannabispflanze)  sind körpereigene Lipide (
sind körpereigene Lipide ( über deren Synthese s. dort). Sie sind im
Gehirn weit verbreitet (Hippocampus, Kleinhirn, Basalganglien u.a.) und beeinflussen auch Gedächtnis, Schlaf, Koordinationsvermögen,
Stimmung und Appetit.
über deren Synthese s. dort). Sie sind im
Gehirn weit verbreitet (Hippocampus, Kleinhirn, Basalganglien u.a.) und beeinflussen auch Gedächtnis, Schlaf, Koordinationsvermögen,
Stimmung und Appetit.
Endocannabinoide
werden - wie Eikosanoide - nicht in der Zelle gespeichert, sondern nur
bei Bedarf synthetisiert und freigesetzt. Sie wirken im Gehirn als retrograde Botenstoffe, d.h. sie werden von postsynaptischen Zellen als transzelluläre Signalstoffe freigesetzt und beeinflussen die präsynaptische Freisetzung von Neurotransmittern.
Endocannabinoide wirken über CB1- und CB2- Cannabinoidrezeptoren. Diese funktionieren via G-Proteine:
 CB1-Rezeptoren sind Gi/0-Rezeptor-gekoppelt, sie bewirken Inhibition der Adenylylcyclase (↓cAMP) und spannungsgesteuerter Calciumkanäle sowie Aktivierung von GIRK-Kanälen, Kaliumausstrom und Hyperpolarisation der Zellmembran. Sie befinden sich in der neuronalen Zellmembran und hemmen die - durch Depolarisierung und Ca++-Einstrom bewirkte - Transmitterfreisetzung präsynaptischer Nervenendigungen.
Die Reduktion des cAMP kann außerdem die Expression von Genen
verstärken oder abschwächen - direkt durch Aktivierung der MAPK und indirekt durch Reduktion der Aktivität der Proteinkinase A (PKA). CB1R finden sich vor allem an Axonverzweigungen GABAerger
(inhibitorisch) und glutaminerger Fasern (exzitatorisch), deren Aktivität sie hemmen. Die Effekte ähneln denen von Opioidrezeptoren.
CB1-Rezeptoren sind Gi/0-Rezeptor-gekoppelt, sie bewirken Inhibition der Adenylylcyclase (↓cAMP) und spannungsgesteuerter Calciumkanäle sowie Aktivierung von GIRK-Kanälen, Kaliumausstrom und Hyperpolarisation der Zellmembran. Sie befinden sich in der neuronalen Zellmembran und hemmen die - durch Depolarisierung und Ca++-Einstrom bewirkte - Transmitterfreisetzung präsynaptischer Nervenendigungen.
Die Reduktion des cAMP kann außerdem die Expression von Genen
verstärken oder abschwächen - direkt durch Aktivierung der MAPK und indirekt durch Reduktion der Aktivität der Proteinkinase A (PKA). CB1R finden sich vor allem an Axonverzweigungen GABAerger
(inhibitorisch) und glutaminerger Fasern (exzitatorisch), deren Aktivität sie hemmen. Die Effekte ähneln denen von Opioidrezeptoren.
CB1R sind die häufigsten metabotropen Rezeptoren im Gehirn
- Großhirnrinde (Assoziationen), Hippocampus (Gedächtnis), Mandelkerne
(Emotionen), Striatum (Dopamin: Belohnung), Hypothalamus (Appetit,
Körpertemperatur),
Kleinhirn (Koordination) -, weiters in Rückenmark (lokale schmerzinhibitorische Schaltkreise) und peripheren Nerven. Der Hirnstamm enthält nur wenige CB1R (geringer Einfluss auf Kreislauf und Atmung). Reizung von CB1R
kann (wie Opioide) durch Hemmung inhibitorischer Funktionskreise auch
anregende Wirkungen haben, z.B. auf GABAerge Interneurone in
Mandelkernen und Hippocampus. CB1R finden sich auch in der Peripherie: Nervenfasern, Endothelzellen (Vasodilatation), Adipozyten (Anregung der Lipogenese).
 CB2-Rezeptoren sind ebenfalls Gi/0-Rezeptor-gekoppelt, hemmen wie CB1R Adenylylcyclase (↓cAMP) und PKA-Aktivität, aktivieren GIRK-Kanäle und MAPK, haben aber keine Wirkung auf spannungsgesteuerte Calciumkanäle, die von Immunzellen nicht exprimiert werden. CB2R finden sich vor allem im Immunsystem (lymphatisches Gewebe - Milz, Thymus, Tonsillen: B-Lymphozyten, Monozyten, Mastzellen, NK-Zellen) und in peripheren
Nerven. Schädigung der Gehirnsubstanz kann an Zellen der Mikroglia die Expression von CB2-R induzieren und durch deren Aktivierung zu chronischen Schmerzen beitragen.
CB2-Rezeptoren sind ebenfalls Gi/0-Rezeptor-gekoppelt, hemmen wie CB1R Adenylylcyclase (↓cAMP) und PKA-Aktivität, aktivieren GIRK-Kanäle und MAPK, haben aber keine Wirkung auf spannungsgesteuerte Calciumkanäle, die von Immunzellen nicht exprimiert werden. CB2R finden sich vor allem im Immunsystem (lymphatisches Gewebe - Milz, Thymus, Tonsillen: B-Lymphozyten, Monozyten, Mastzellen, NK-Zellen) und in peripheren
Nerven. Schädigung der Gehirnsubstanz kann an Zellen der Mikroglia die Expression von CB2-R induzieren und durch deren Aktivierung zu chronischen Schmerzen beitragen.
Emotionale Extremzustände beeinflussen das Endocannabinoidsystem. So kann Wut das Schmerzempfinden reduzieren (Stressanalgesie), Angst hingegen verstärken. Ansatzpunkt dieser Effekte ist das Endocannabinoidsystem.
Aktivierung hypothalamischer Cannabinoidrezeptoren reduziert die Sekretion von LH, Prolactin und Oxytocin.
Nachdem die Rezeptoren ihren Liganden gebunden haben, werden sie rasch
endozytiert - dies kann die Entwicklung von Cannabinoidtoleranz
erklären.

Abbildung: Wirkungsmechanismus von Endocannabinoiden
Nach Velasco G, Sánchez C, Guzmán M. Towards the use of cannabinoids as antitumour agents. Nature Rev Cancer 2012; 12: 436-44
Pflanzliche Cannabinoide wie das Δ9-Tetrahydrocannabinol
(THC) regen körpereigene Cannabinoidrezeptoren (CB1) an, die
physiologischerweise auf endogene Cannabinoide - Anandamid (AEA) und 2-Arachidonoylglycerol (2-AG) - ansprechen.
Wirkungsmechanismus: Postsynaptische Neurone - z.B. CA1
im Hippocampus - produzieren aus Vorläufermolekülen Endocannabinoide,
wenn der zytoplasmatische Calciumspiegel ansteigt. Diese koppeln an
präsynaptische CB1-Rezeptoren, was hier (via freigesetzte
βγ-G-Proteine) den Einstrom von Ca++ durch Calciumkanäle sowie den zytoplasmatischen Calciumspiegel - und
damit auch die Freisetzung des Neurotransmitters - reduziert. Das
bedeutet eine kurzfristig herabgesetzte Synapsenwirkung.
Endocannabinoide können die Neurotransmitterfreisetzung auch für
längere Zeit inhibieren (eCB-LTD, endocannabinoid long-term depression). Dieser Mechanismus wurde in mehreren Hirnregionen beobachtet (Neocortex, Kleinhirn, Striatum, Mandelkerne, Hippocampus)

Bindung eines Transmitters an seinen Rezeptor (metabotrop oder Ionenkanal) führt postsynaptisch zu steigendem Ca++-Spiegel. Das führt zur Bildung von Endocannabinoid- Vorläufermolekülen, von denen AEA oder
2-AG abgespalten werden. Diese binden dann an präsynaptische
Cannabinoidrezeptoren,
der Calciumeinstrom in die Zelle kann
dadurch reduziert und die Transmitterfreisetzung blockiert
werden ( Abbildung).
Abbildung).
Endocannabinoide vermitteln Feedback an die
präsynaptischen Endigungen: Als retrograde Signalstoffe unterdrücken
sie (über Cannabinoidrezeptoren) die Transmitterfreisetzung.
 Die
Wirkungsdauer ist gering: Freigesetzte Cannabinoide verschwinden rasch
wieder aus dem Extrazellulärraum, sie diffundieren (da fettlöslich) in
Zellen (zurück). Beim Abbau spielen Aufnahme in benachbarte Neuronen
(eventuell via spezifische EMT: endocannabinoid membrane transporter) und enzymatischer Abbau (mikrosomale Hydrolase FAAH: fatty acid amide hydrolase, weiters die Lipasen DAGL: diacylglycerol lipase, MAGL: monoacyl glycerol lipase) eine wichtige Rolle.
Die
Wirkungsdauer ist gering: Freigesetzte Cannabinoide verschwinden rasch
wieder aus dem Extrazellulärraum, sie diffundieren (da fettlöslich) in
Zellen (zurück). Beim Abbau spielen Aufnahme in benachbarte Neuronen
(eventuell via spezifische EMT: endocannabinoid membrane transporter) und enzymatischer Abbau (mikrosomale Hydrolase FAAH: fatty acid amide hydrolase, weiters die Lipasen DAGL: diacylglycerol lipase, MAGL: monoacyl glycerol lipase) eine wichtige Rolle.
Endorphine 
Endorphine sind körpereigene Opioidpeptide, welche die Schmerzwahrnehmung dämpfen und positive Gefühle verstärken können. Opioiderge  Verschaltungen
(Opiate sind Alkaloide des Schlafmohns) spielen - neben serotoninergen (5-HT) und noradrenergen (NA) - eine
Hauptrolle bei der zentralen Schmerzmodulation. Sie ermöglichen auch die schmerzstillende Wirkung von Placebos
- Gaben von Naloxon (einem Opioidantagonisten) hemmen den
schmerzlindernden Placebo-Effekt. Menschen, die gut auf Placebo
ansprechen (schmerzstillender Effekt), zeigen eine höhere Aktivierung
(durch Placebo) von Gehirngebieten mit Opioidrezeptoren als
Nonresponder. Die Erwartung eines Effekts durch eine Maßnahme verstärkt deren schmerzstillende Wirkung.
Verschaltungen
(Opiate sind Alkaloide des Schlafmohns) spielen - neben serotoninergen (5-HT) und noradrenergen (NA) - eine
Hauptrolle bei der zentralen Schmerzmodulation. Sie ermöglichen auch die schmerzstillende Wirkung von Placebos
- Gaben von Naloxon (einem Opioidantagonisten) hemmen den
schmerzlindernden Placebo-Effekt. Menschen, die gut auf Placebo
ansprechen (schmerzstillender Effekt), zeigen eine höhere Aktivierung
(durch Placebo) von Gehirngebieten mit Opioidrezeptoren als
Nonresponder. Die Erwartung eines Effekts durch eine Maßnahme verstärkt deren schmerzstillende Wirkung.
Drei Klassen opioider Peptide sind besonders gut untersucht:

 Die POMC-Gruppe (ß-Endorphin, Endomorphine; präferierter Rezeptor: μ) - Pro-Opio-Melanocortin ist das Propeptid. ß-Endorphin
produzierende Neurone befinden sich vor allem im Hypothalamus, ihre
Axone projizieren auf das zentrale Höhlengrau und auf noradrenerge
Nervenzellen im Hirnstamm.
Die POMC-Gruppe (ß-Endorphin, Endomorphine; präferierter Rezeptor: μ) - Pro-Opio-Melanocortin ist das Propeptid. ß-Endorphin
produzierende Neurone befinden sich vor allem im Hypothalamus, ihre
Axone projizieren auf das zentrale Höhlengrau und auf noradrenerge
Nervenzellen im Hirnstamm.

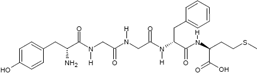 Enkephaline
Enkephaline sind endogene
Pentapeptide, die zur Klasse der Opioidpeptide gehören - definiert als
Bindungspartner von Opioidrezeptoren (präferierter Rezeptor: δ).
Enkephaline werden bei Tätigkeiten wie Joggen, Essen und anderen
Aktivitäten, die ein Belohnungsgefühl erzeugen (z.B. Glücksspiel),
freigesetzt; sie können Euphoriezustände verursachen.
sind endogene
Pentapeptide, die zur Klasse der Opioidpeptide gehören - definiert als
Bindungspartner von Opioidrezeptoren (präferierter Rezeptor: δ).
Enkephaline werden bei Tätigkeiten wie Joggen, Essen und anderen
Aktivitäten, die ein Belohnungsgefühl erzeugen (z.B. Glücksspiel),
freigesetzt; sie können Euphoriezustände verursachen.
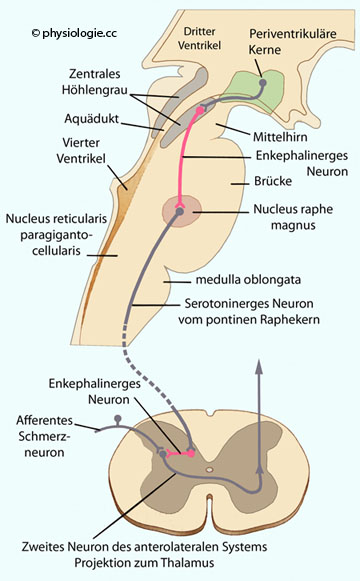
 Abbildung: Enkephalinerge Schmerzunterdrückung
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Abbildung: Enkephalinerge Schmerzunterdrückung
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Das enkephalinerge System blockiert Schmerzmeldungen auf mehreren Ebenen:

Inhibition der Weiterleitung aus der Peripherie eintreffender Schmerzimpulse auf der Ebene des Rückenmarks

Anregung schmerzhemmender Mechanismen durch Nerven im Hirnstamm
(periventrikuläre Kerne, periaquäduktales (zentrales) Höhlengrau,
Raphekerne, Reticulariskerne)

Das körpereigene System der durch Enkephaline bewirkten Schmerzunterdrückung (analgesia system) umfasst mehrere Komponetnen ( Abbildung).
Seine individuelle Beschaffenheit erklärt z.T. die großen
interpersonellen Unterschiede der endogenen Schmerzempfindlichkeit, die
in der ärztlichen Praxis zu beobachten sind. Involviert sind u.a.
Abbildung).
Seine individuelle Beschaffenheit erklärt z.T. die großen
interpersonellen Unterschiede der endogenen Schmerzempfindlichkeit, die
in der ärztlichen Praxis zu beobachten sind. Involviert sind u.a.
 periventrikuläre Kerne des
Hypothalamus in der Wand des dritten Ventrikels. Neben anderen
Wirkungen projizieren sie auf enkephalinerge Neuronen des zentralen
Höhlengraus im Mittelhirnbereich;
periventrikuläre Kerne des
Hypothalamus in der Wand des dritten Ventrikels. Neben anderen
Wirkungen projizieren sie auf enkephalinerge Neuronen des zentralen
Höhlengraus im Mittelhirnbereich;
 diese projizieren auf serotoninerge Neurone im nucleus magnus raphe der
Pons (dieser Raphekern blockiert Schmerzmeldungen im Rückenmark vor
allem in Kombination mit Efferenzen aus dem periaquäduktalen
Höhlengrau);
diese projizieren auf serotoninerge Neurone im nucleus magnus raphe der
Pons (dieser Raphekern blockiert Schmerzmeldungen im Rückenmark vor
allem in Kombination mit Efferenzen aus dem periaquäduktalen
Höhlengrau);
 zusammen mit Efferenzen aus dem nucleus reticularis
(paragigantocellularis) in Bereich der medulla oblongata projizieren
diese wiederum auf auf enkephalinerge Interneurone auf der Ebene des Rückenmarks, auf die sie anregend wirken;
zusammen mit Efferenzen aus dem nucleus reticularis
(paragigantocellularis) in Bereich der medulla oblongata projizieren
diese wiederum auf auf enkephalinerge Interneurone auf der Ebene des Rückenmarks, auf die sie anregend wirken;
 Schmerzafferenzen werden von diesen Interneuronen auf der Ebene des
zweiten afferenten Neurons im entsprechenden Rückenmarksegement
inhibiert und damit die anterolaterale Schmerzleitung zum Thalamus
reduziert.
Schmerzafferenzen werden von diesen Interneuronen auf der Ebene des
zweiten afferenten Neurons im entsprechenden Rückenmarksegement
inhibiert und damit die anterolaterale Schmerzleitung zum Thalamus
reduziert.
Es
gibt zahlreiche Berichte von fehlender Schmerzwahrnehmung in
Ausnahmesituationen - solche Phänomene lassen sich auf endogene
Schmerzunterdrückung zurückführen (z.B. das Nichtbemerken einer
schweren Verletzung im Getümmel einer Schlacht).

 Dynorphine (Dynorphin
A und B, Neoendorphin) entstehen durch Einwirken eines in
präsynaptischen Vesikeln gespeicherten Enzyms (PC2:
Proprotein-Concertase 2) aus der Vortsufe Prodynorphin und wirken vor allem über κ-Opioidrezeptoren (KOR). Diese
Opioide sind weit im ZNS verbreitet, man findet sie vor allem in
Hypothalamus (hier steuern sie zusammen mit Neurokinin B die pulsatile
Freisetzung von GnRH), Hippocampus, Striatum, Hirnstamm und Rückenmark.
Dynorphine (Dynorphin
A und B, Neoendorphin) entstehen durch Einwirken eines in
präsynaptischen Vesikeln gespeicherten Enzyms (PC2:
Proprotein-Concertase 2) aus der Vortsufe Prodynorphin und wirken vor allem über κ-Opioidrezeptoren (KOR). Diese
Opioide sind weit im ZNS verbreitet, man findet sie vor allem in
Hypothalamus (hier steuern sie zusammen mit Neurokinin B die pulsatile
Freisetzung von GnRH), Hippocampus, Striatum, Hirnstamm und Rückenmark.
Endophine wirken über Opioidrezeptoren, die man in der Membran sowohl afferenter Schmerzfasern als auch von Interneuronen im Hinterhorn des Rückenmarks findet: κ-Opioidrezeptoren (KOR), µ-Opioidrezeptoren (MOR), δ-Opioidrezeptoren (DOR).

 Abbildung: Signalwege von µ-Opioidrezeptoren
Abbildung: Signalwege von µ-Opioidrezeptoren
Nach Williams JT, Ingram SL, Henderson G, Chavkin C, von Zastrow M, Schulz S, Koch T, Evans CJ, MacDonald J Christie. Regulation of µ-Opioid Receptors: Desensitization, Phosphorylation, Internalization, and Tolerance. Pharmacol Rev 2013; 65: 223-54
Opioid- (Opiat-) rezeptoren sind heptahelikale Bindungsproteine für Opioide. Ihre Aktivierung
zeitigt zahlreiche intrazelluläre
Folgereaktionen, je nach Agonisten (der spezifisch Rezeptor-Untertypen
ansprechen kann).
G-Protein-abhängige Wege (links)
inkludieren Einflüsse auf Ionenkanäle oder Hemmung der Adenylylcyclase (A.C.); Desensitivierung kann u.a. mit selektiver
Kinase-Aktivierung einhergehen (Kinasen sind phosphatübertragende Transferasen).
G-Protein-unabhängige Wege (rechts) können u.a. Endozytose bedingen.
AP2, Activating protein 2, ein Transkriptionsfaktor  ßarr, Beta-Arrestin, reguliert die Aktivität von G-Protein-gekoppelten Rezeptoren (GPCR)
ßarr, Beta-Arrestin, reguliert die Aktivität von G-Protein-gekoppelten Rezeptoren (GPCR)  Clathrin
Clathrin  Dyn, Dynorphin
Dyn, Dynorphin  ERK, Extracellular-signal Regulated Kinase, vermittelt intrazelluläre Signaltransduktion
ERK, Extracellular-signal Regulated Kinase, vermittelt intrazelluläre Signaltransduktion  JNK, c-Jun N-terminale Kinasen, dienen der Signaltransduktion
JNK, c-Jun N-terminale Kinasen, dienen der Signaltransduktion  PKA, Proteinkinase A (cAMP-abhängig)
PKA, Proteinkinase A (cAMP-abhängig)  PKC, Proteinkinase C
PKC, Proteinkinase C  PLD-2, Phospholipase D2. hydrolysiert Phosphatidylcholin, es entsteht Cholin
PLD-2, Phospholipase D2. hydrolysiert Phosphatidylcholin, es entsteht Cholin
Opioidrezeptoren sind heptahelikal und wirken über G-Proteine
|
Enkephaline, Dynorphine und Endorphine binden teils an prä-, teils an postsynaptische metabotrope Opioidrezeptoren
( Abbildung). Man unterscheidet
Abbildung). Man unterscheidet
 μ- (μ1 präsynaptisch, μ2 postsynaptisch),
μ- (μ1 präsynaptisch, μ2 postsynaptisch),
 δ- (präsynaptisch),
δ- (präsynaptisch),
 κ-, ε- und Orphanin (FQ-) Rezeptoren (die Zuordnung bestimmter Transmitter zu
Rezeptoren ist unscharf).
κ-, ε- und Orphanin (FQ-) Rezeptoren (die Zuordnung bestimmter Transmitter zu
Rezeptoren ist unscharf).
μ-Rezeptoren sind besonders häufig an Stellen der Schmerzmodulation zu
finden: Oberflächliche Schichten des Hinterhorns im Rückenmark,
ventrale medulla oblongata, zentrales Höhlengrau. Man findet sie aber
auch an vielen anderen Stellen, was das breite Wirkungsmuster von
Opioiden (Morphin) erklärt. C-Faser-Nozizeptoren (dumpfer, "zweiter"
Schmerz) tragen mehr μ-Rezeptoren als Aδ-Fasern
(scharfer, "erster" Schmerz), was vielleicht erklärt, warum Morphin
besser gegen persistierende als gegen akute Schmerzen hilft.
In der
Membran präsynaptischer Endigungen der Schmerzafferenzen hemmen Opioidrezeptoren spannungsabhängige Ca++-Kanäle (das dämpft den schmerzauslösenden Eintritt von Ca++), in Lamina I- und Lamina II-Zielneuronen öffnen sie K+-Kanäle (das hyperpolarisiert die Nervenzelle und macht sie weniger erregbar).
So hemmen Endorphine inhibierender Interneurone (und extern verabreichte Opioide) die glutamaterge Schmerzleitung
(1. zu 2. Neuron) in Hirnstamm und Rückenmark ( Abbildung).
Abbildung).
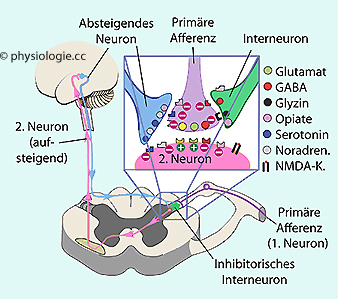
 Abbildung: Modifikation afferenter Schmerzinformation
Abbildung: Modifikation afferenter Schmerzinformation
Nach einer Vorlage bei physiologyatlarge.weebly.com/ blog-sensory-pathways/ pain-pathway
Im
Hinterhorn treffen 1. (Axonende, primäre Afferenz) und 2. Neuron (Soma
und Dendriten) aufeinander. Diese Synapsen werden von absteigenden
(blau dargestellt) und Interneuronen (grün) beeinflusst; beide geben u.a. Opiate ab.
Die primäre
Impulsübertragung erfolgt glutamaterg, alle anderen dargestellten
Transmitter haben inhibitorischen Einfluss auf ihre Zielmembran.
Auf diese Weise kann die Schmerzübertragung auf spinaler Ebene über mehrere Wege (u.a. serotoninerg, noradrenerg) gehemmt werden

Endorphine
können u.a. an der nozizeptiven Umschaltung im Hinterhorn des
Rückenmarks die Freisetzung (1. Neuron) des Transmitters Glutamat
hemmen
|

Zu den
Opiaten (Alkaloide des Schlafmohns und direkte Derivate davon) zählt
Morphin (Morphium), der wichtigste Bestandteil des Opiums ("Mohnsaft").
Bringt man Opiate spinal an die Neurone der Hintersäule
(Spinalanästhesie, z.B. bei Kaiserschnitt), werden dadurch zentrale
Nebenwirkungen durch Wirkung auf den
nucl. tractus solitarii (wie Atemunterdrückung, Kreislaufeffekte) vermieden.
Eine der
Nebenwirkungen therapeutisch verabreichter Opiate ist ein inhibierender Effekt auf die
Transportperistaltik im Dünndarm und infolgedessen
Darmträgheit.
Zentrale Wirkungen: Die Reizung von μ- und
δ- Rezeptoren löst Euphorie und Atemdepression, die von κ-Rezeptoren Unlustgefühle aus.
 Endogene Opioide (Endorphine) werden u.a. im hypothalamisch-hypophysären System aus Vorläuferproteinen gebildet.
Endogene Opioide (Endorphine) werden u.a. im hypothalamisch-hypophysären System aus Vorläuferproteinen gebildet.
 Opioidpeptide werden nach ihrer Freisetzung durch zellmembranständige
Enzyme (Enkephalinase) abgebaut. Blockade dieses Enzyms verlängert
die Opioidwirkung und wirkt schmerzreduzierend.
Opioidpeptide werden nach ihrer Freisetzung durch zellmembranständige
Enzyme (Enkephalinase) abgebaut. Blockade dieses Enzyms verlängert
die Opioidwirkung und wirkt schmerzreduzierend.

Schmerzklassifizierung nach Entstehungsort

Somatischer
Oberflächenschmerz (Haut, Schleimhäute), er ortet den Schmerz und löst Vermeidebewegungen aus. Der gut lokalisierbare
frühe Schmerz wird als scharf und hell empfunden und über Aδ-Fasern übertragen; der schlecht lokalisierbare
späte Schmerz ist dumpf und läuft über C-Fasern

Somatischer
Tiefenschmerz (Muskeln:
z.B. Krämpfe, Knochen, Gelenke: z.B. Entzündung, Bindegewebe;
Hirnhäute: Kopfschmerz) wird als dumpf empfunden, ist schlecht
lokalisierbar, strahlt in entfernte Körpergebiete aus. Er bewirkt
Schonung (Motorik) und unterstützt Reparaturvorgänge (Gerinnungs- und
Immunsystem)
 Viszeraler
Viszeraler Schmerz ist dumpf, schlecht lokalisierbar und strahlt in die Umgebung aus (vgl.
Head'sche Zonen). Er entsteht in Brust, Bauch und Beckenregion durch
starke Dehnung, Kompression, Sauerstoffmangel oder Entzündungen an serösen Häuten, Kapseln, Parenchym und Blutgefäßen. Er löst
autonom-nervöse Reaktionen (Blutdruckschwankungen, Übelkeit u.a.) sowie neuroendokrine Reaktionen aus.
 Zu übertragenem Schmerz s. oben
Zu übertragenem Schmerz s. oben
Schmerzklassifizierung nach Entstehungsmechanismus
 Nozizeptiven
Nozizeptiven (physiologischen
Nozizeptor-) Schmerz - er meldet potenziell schädigende Reize aus dem
Gewebe (Stich, Quetschung, Verbrennung) und hat eine Warn- und
Lenkfunktion
 Entzündungsschmerz
Entzündungsschmerz (pathophysiologischer
Nozizeptorschmerz), vermittelt durch Mediatoren aus verletztem Gewebe
und Immunzellen, diese sensibilisieren nozizeptive Afferenzen und
Rückenmark. Folge ist erhöhte Schmerzempfindlichkeit (
Hyperalgesie) und Schmerzempfindlichkeit (
Allodynie)
 Neuropathischen
Neuropathischen
Schmerz, durch veränderte Schmerzentstehung in entsprechenden
Afferenzen, z.B. nach Traumen (Amputation), Vergiftungen,
Stoffwechselstörung (Diabetes) oder bei Gürtelrose
(Varizella-Zoster-Virus-Reaktivierung)
 Funktionellen
Funktionellen Schmerz infolge pathologischer zentraler Schmerzverarbeitung (ohne erkennbare organische Ursache)
Nach der Dauer des Auftretens spricht man von
 akutem
Schmerz (Warnsignal, löst Reflexe aus - Zurückziehen, Flucht,
Ruhigstellung - und endet nach Verschwinden der auslösenden Noxe bzw.
abgeschlossener Wundheilung)
akutem
Schmerz (Warnsignal, löst Reflexe aus - Zurückziehen, Flucht,
Ruhigstellung - und endet nach Verschwinden der auslösenden Noxe bzw.
abgeschlossener Wundheilung)
 chronischem Schmerz (monatelange Dauer oder periodisches Auftreten, z.B. bei Migräne) durch Schädigung im neuronalen Schmerzsystem ("Schmerzgedächtnis",
z.B. durch erhöhte synaptische Übertragung nozizeptiver Afferenzen,
reduzierte Hemm-Mechanismen) oder Dauerreizung von Nozizeptoren
(Arthrosen, Tumore,..)
chronischem Schmerz (monatelange Dauer oder periodisches Auftreten, z.B. bei Migräne) durch Schädigung im neuronalen Schmerzsystem ("Schmerzgedächtnis",
z.B. durch erhöhte synaptische Übertragung nozizeptiver Afferenzen,
reduzierte Hemm-Mechanismen) oder Dauerreizung von Nozizeptoren
(Arthrosen, Tumore,..)


Abbildung: Schmerzbahn und Schmerzbearbeitung
Nach einer Vorlage bei fastbleep.com
Transduktion ist die Übersetzung des Schmerzreizes in Erregungsmuster an Nervenfasern,
Transmission die Leitung zu zentralnervösen Stationen,
Perzeption die Wahrnehmung,
Modulierung die Abänderung des Schmerzempfindens ( s. oben)
s. oben)

Hypersensitivität und chronischer Schmerz entstehen durch Veränderungen
auf verschiedenen (molekularen bis systemischen) Ebenen und im Rahmen
unterschiedlicher Zeitverläufe, und sind durch hohe (synaptische)
Plastizität gekennzeichnet. Zu den Mechanismen zählen
 reduzierte
Inhibition,
reduzierte
Inhibition,
 verstärkte präsynaptische Transmitterfreisetzung und/oder
verstärkte präsynaptische Transmitterfreisetzung und/oder
 postsynaptische Erregbarkeit,
postsynaptische Erregbarkeit,
 erhöhte Signalverstärkung von Rezeptor zu
Zellkern (Gentranskription),
erhöhte Signalverstärkung von Rezeptor zu
Zellkern (Gentranskription),
 Freisetzung von Neurotransmittern aus
Mikroglia / Astrozyten,
Freisetzung von Neurotransmittern aus
Mikroglia / Astrozyten,
 verstärkte Signalübermittlung im Gehirn.
verstärkte Signalübermittlung im Gehirn.
Nozizeptive Pfade können strukturelle Modifikation erfahren, was sich
z.B. in einer Reduktion der grauen Hirnsubstanz (im vorderen gyrus
cinguli, orbitofrontal, Inselcortex u.a.) ausdrücken kann.

 Schmerzblockade: Die Schmerzentstehung in
nozizeptiven Fasern kann ausgeschaltet werden, indem die Bildung von
Prostaglandinen (PGE2) gehemmt wird - etwa mit nichtsteroidalen
Analgetika wie Acetylsalizylsäure. PGE2 aktiviert Proteinkinase A (PKA) und
diese öffnen TRP-Kanäle, was die Zelle depolarisiert. Opioide hemmen die PKA.
Schmerzblockade: Die Schmerzentstehung in
nozizeptiven Fasern kann ausgeschaltet werden, indem die Bildung von
Prostaglandinen (PGE2) gehemmt wird - etwa mit nichtsteroidalen
Analgetika wie Acetylsalizylsäure. PGE2 aktiviert Proteinkinase A (PKA) und
diese öffnen TRP-Kanäle, was die Zelle depolarisiert. Opioide hemmen die PKA.
Lokalanästhetika hemmen
spannungsgesteuerte Natriumkanäle und damit die
periphere Schmerzleitung
(Leitungsanästhesie: gezielte Blockade an einem afferenten Nerv), ohne
das Bewusstsein auszuschalten. Dünne (wenig isolierte) Nervenfasern
(insbesondere C-Fasern!) sind rascher beeinflussbar als stark
isolierte. Wirkt ein Lokalanästhetikum auf afferente Fasern ein,
verschwinden (in dieser Reihenfolge) Schmerz-, Temperatur-, Berührungs-
und schließlich Druckempfinden.
So wie körpereigene Opioide (Enkephalin,
Dynorphin, Endorphin,  s. oben) wirkt auch Morphium (=Morphin; Alkaloid
in Rohopium): Es bindet an μ-Rezeptoren und beeinflusst so die zentrale Schmerzleitung in
Hirnstamm und Rückenmark.
s. oben) wirkt auch Morphium (=Morphin; Alkaloid
in Rohopium): Es bindet an μ-Rezeptoren und beeinflusst so die zentrale Schmerzleitung in
Hirnstamm und Rückenmark.


 Viszerale Sensibilität (chemisch, mechanisch, Licht, Schmerz) betrifft
Eingeweide (Kopf, Brust-, Bauch- und Beckenraum: Auge, Herz,
Kreislauf Atmung, Verdauungssystem, Defäkation, Nierenfunktion,
Blasenmotorik, Vegetativum). Etwa 10% der Afferenzen in das Rückenmark
sind viszeraler Natur (N. vagus über 80%), und ~50% der sekundären
spinalen Neurone sprechen auf viszerale Afferenzen an
Viszerale Sensibilität (chemisch, mechanisch, Licht, Schmerz) betrifft
Eingeweide (Kopf, Brust-, Bauch- und Beckenraum: Auge, Herz,
Kreislauf Atmung, Verdauungssystem, Defäkation, Nierenfunktion,
Blasenmotorik, Vegetativum). Etwa 10% der Afferenzen in das Rückenmark
sind viszeraler Natur (N. vagus über 80%), und ~50% der sekundären
spinalen Neurone sprechen auf viszerale Afferenzen an
 Nozizeptoren sind meist polymodal (mechanisch, thermisch, chemisch) und
adaptieren nicht. Spezielle Ionenkanäle lassen Kationen in nozizeptive
Faserrn einströmen. Schmerzerregende Substanzen sensibilisieren
Nervenendigungen oder depolarisieren sie direkt.Verletzte Zellen setzen
Mediatoren frei, auch nozizeptive Nervenfasern sind parakrin
aktiv (Axonreflex). Aktivierte Schmerzfasern bringen über Substanz P
Mastzellen zur Histaminfreisetzung
Nozizeptoren sind meist polymodal (mechanisch, thermisch, chemisch) und
adaptieren nicht. Spezielle Ionenkanäle lassen Kationen in nozizeptive
Faserrn einströmen. Schmerzerregende Substanzen sensibilisieren
Nervenendigungen oder depolarisieren sie direkt.Verletzte Zellen setzen
Mediatoren frei, auch nozizeptive Nervenfasern sind parakrin
aktiv (Axonreflex). Aktivierte Schmerzfasern bringen über Substanz P
Mastzellen zur Histaminfreisetzung
 Schmerzmediatoren: Die meisten Mediatorstoffe werden nicht gespeichert,
sondern bei Verletzungsvorgängen neu synthetisiert. Sie wirken über
zwei Wege: Direkte Aktivierung von Nozizeptoren oder Aktivierung von
Immunzellen (Histamin, Serotonin, Eikosanoide, Zytokine), diese
verstärken die Nozizeption. Zu Schmerzmediatoren gehören Histamin
(Degranulierung von Mastzellen,
basophilen und eosinohilen Granulozyten), Kinine, Prostaglandine,
Serotonin, ATP, Substanz P. Aktivierte Schmerzfasern triggern über
Substanz P die Histaminfreisetzung von Mastzellen
Schmerzmediatoren: Die meisten Mediatorstoffe werden nicht gespeichert,
sondern bei Verletzungsvorgängen neu synthetisiert. Sie wirken über
zwei Wege: Direkte Aktivierung von Nozizeptoren oder Aktivierung von
Immunzellen (Histamin, Serotonin, Eikosanoide, Zytokine), diese
verstärken die Nozizeption. Zu Schmerzmediatoren gehören Histamin
(Degranulierung von Mastzellen,
basophilen und eosinohilen Granulozyten), Kinine, Prostaglandine,
Serotonin, ATP, Substanz P. Aktivierte Schmerzfasern triggern über
Substanz P die Histaminfreisetzung von Mastzellen
 Schmerzrezeptoren: Vertreter der TRP-Familie (transient receptor potential channels)
- Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind
nichtselektive Kationenkanäle. Entzündungsmediatoren wie Prostaglandine
und Bradykinin sensibilisieren sie und aktivieren in gereiztem Gewebe
"schlafende" Schmerzfasern (Hyperalgesie / Allodynie). Metabotrope
Nozizeptoren (Prostaglandine, Bradykinin, Histamin) sensibilisieren
nozizeptive Ionenkanäle Schmerzrezeptoren: Vertreter der TRP-Familie (transient receptor potential channels)
- Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind
nichtselektive Kationenkanäle. Entzündungsmediatoren wie Prostaglandine
und Bradykinin sensibilisieren sie und aktivieren in gereiztem Gewebe
"schlafende" Schmerzfasern (Hyperalgesie / Allodynie). Metabotrope
Nozizeptoren (Prostaglandine, Bradykinin, Histamin) sensibilisieren
nozizeptive Ionenkanäle
 Schmerzafferenz: Man unterscheidet ”ersten“, schnell geleiteten, gut
lokalisierbaren, rasch abklingenden ”Delta-Schmerz“ (A-δ-Fasern) vom
”zweiten“, schlecht lokalisierbaren, dumpf-brennenden, langsam
abklingenden, quälenden ”C-Schmerz“ (C-Fasern). Nozizeptive Fasern sind
durch Marker identifizierbar: Membranmoleküle (Rezeptoren,
Glykokonjugate), gespeicherte / freigesetzte Peptide, Enzyme.
Schmerzafferenzen bilden oft Kollateralen zu prävertebralen Ganglien
und beeinflussen so motorische, Sekretions- oder endokrine Aktivitäten
der Eingeweide
Schmerzafferenz: Man unterscheidet ”ersten“, schnell geleiteten, gut
lokalisierbaren, rasch abklingenden ”Delta-Schmerz“ (A-δ-Fasern) vom
”zweiten“, schlecht lokalisierbaren, dumpf-brennenden, langsam
abklingenden, quälenden ”C-Schmerz“ (C-Fasern). Nozizeptive Fasern sind
durch Marker identifizierbar: Membranmoleküle (Rezeptoren,
Glykokonjugate), gespeicherte / freigesetzte Peptide, Enzyme.
Schmerzafferenzen bilden oft Kollateralen zu prävertebralen Ganglien
und beeinflussen so motorische, Sekretions- oder endokrine Aktivitäten
der Eingeweide
 C-Fasern projizieren vor allem auf Lamina I und II (substantia
gelatinosa), Aδ-Fasern auf Lamina I und V des Hinterhorns. Hier liegt
der Angriffspunkt für Schmerzverstärkung: Traumatische Veränderungen
können die synaptische Effizienz steigern. Übertragener Schmerz
entsteht durch Konvergenz somatischer und
viszeraler Afferenzen: Das ZNS ordnet Afferenzen dem Ursprungsbegiet
des betreffenden Nerven zu. Bei projiziertem Schmerz interpretiert das
Gehirn dann z.B. mechanische Reize als schmerzhaft
C-Fasern projizieren vor allem auf Lamina I und II (substantia
gelatinosa), Aδ-Fasern auf Lamina I und V des Hinterhorns. Hier liegt
der Angriffspunkt für Schmerzverstärkung: Traumatische Veränderungen
können die synaptische Effizienz steigern. Übertragener Schmerz
entsteht durch Konvergenz somatischer und
viszeraler Afferenzen: Das ZNS ordnet Afferenzen dem Ursprungsbegiet
des betreffenden Nerven zu. Bei projiziertem Schmerz interpretiert das
Gehirn dann z.B. mechanische Reize als schmerzhaft
 Der tractus spinothalamicus zieht (nach Seitenkreuzung) zum Hirnstamm,
wo er Kollateralen zu zentralem Höhlengrau und formatio reticularis
bildet (unwillkürliches Schmerzverhalten) und auf den posterolateralen
Thalamus projiziert. Die trigeminothalamische Bahn (Gesicht) kreuzt
nach Umschaltung im spinalen Trigeminuskern die Seite und zieht über
den trigeminalen Lemniscus zum lateralen Thalamus. An der
Schmerzverarbeitung beteiligen sich anschließend somatosernsorischer
Cortex, anteriorer gyrus cinguli, Mandelkerne, Insel, präfrontaler
Cortex
Der tractus spinothalamicus zieht (nach Seitenkreuzung) zum Hirnstamm,
wo er Kollateralen zu zentralem Höhlengrau und formatio reticularis
bildet (unwillkürliches Schmerzverhalten) und auf den posterolateralen
Thalamus projiziert. Die trigeminothalamische Bahn (Gesicht) kreuzt
nach Umschaltung im spinalen Trigeminuskern die Seite und zieht über
den trigeminalen Lemniscus zum lateralen Thalamus. An der
Schmerzverarbeitung beteiligen sich anschließend somatosernsorischer
Cortex, anteriorer gyrus cinguli, Mandelkerne, Insel, präfrontaler
Cortex
 Hyperalgesie ist eine verstärkte Wahrnehmung von Schmerzreizen - primär
an der Stelle der Verletzung, sekundär in der Umgebung - durch
Sensitivierung zentraler Neuronen. Verschiedene nicht-noxische Reize
können die Schmerzschwelle senken (Allodynie)
Hyperalgesie ist eine verstärkte Wahrnehmung von Schmerzreizen - primär
an der Stelle der Verletzung, sekundär in der Umgebung - durch
Sensitivierung zentraler Neuronen. Verschiedene nicht-noxische Reize
können die Schmerzschwelle senken (Allodynie)
 Endogene Schmerzhemmung erfolgt durch ein antinozizeptives System -
durch deszendierende (Frontalhirn und Hypothalamus
serotoninerg zu zentralem Höhlengrau, Raphekernen und tractus
reticulospinalis) oder aszendierende
Schmerzmodifikation. Raphekerne projizieren serotoninerg, der locus
coeruleus noradrenerg auf Hinterhornneurone und hemmen hier die
Schmerzübertragung (Gate-Control). Opioiderge Interneurone der lamina
II hemmen spinothalamische Projektionsneurone Endogene Schmerzhemmung erfolgt durch ein antinozizeptives System -
durch deszendierende (Frontalhirn und Hypothalamus
serotoninerg zu zentralem Höhlengrau, Raphekernen und tractus
reticulospinalis) oder aszendierende
Schmerzmodifikation. Raphekerne projizieren serotoninerg, der locus
coeruleus noradrenerg auf Hinterhornneurone und hemmen hier die
Schmerzübertragung (Gate-Control). Opioiderge Interneurone der lamina
II hemmen spinothalamische Projektionsneurone
 Endogene Cannabinoide (körpereigene Lipide) wirken über metabotrope
(heptahelikale) CB1- und CB2- Cannabinoidrezeptoren schmerzmodulierend
(Hippocampus, Kleinhirn, Basalganglien) und beeinflussen Gedächtnis,
Schlaf, Koordinationsvermögen, Stimmung und Appetit. CB1-Rezeptoren
finden sich in Gehirn (präsynaptisch-GABAerg), Rückenmark und
peripheren Nerven, CB2-Rezeptoren im Immunsystem
Endogene Cannabinoide (körpereigene Lipide) wirken über metabotrope
(heptahelikale) CB1- und CB2- Cannabinoidrezeptoren schmerzmodulierend
(Hippocampus, Kleinhirn, Basalganglien) und beeinflussen Gedächtnis,
Schlaf, Koordinationsvermögen, Stimmung und Appetit. CB1-Rezeptoren
finden sich in Gehirn (präsynaptisch-GABAerg), Rückenmark und
peripheren Nerven, CB2-Rezeptoren im Immunsystem
 Endorphine sind körpereigene Opioidpeptide, sie hemmen glutamaterge
Schmerzprojektionen (vom 1. auf das 2. Schmerzneuron wird im Hinterhorn
mittels Glutamat umgeschaltet). Opioidrezeptoren sind heptahelikal,
wirken über G-Proteine
Endorphine sind körpereigene Opioidpeptide, sie hemmen glutamaterge
Schmerzprojektionen (vom 1. auf das 2. Schmerzneuron wird im Hinterhorn
mittels Glutamat umgeschaltet). Opioidrezeptoren sind heptahelikal,
wirken über G-Proteine
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Allodynie: άλλος = anders, οδύνη = Schmerz
Allodynie: άλλος = anders, οδύνη = Schmerz





 Schmerz: Einleitung
Schmerz: Einleitung  Axonreflex
Axonreflex  Schmerzauslösende Substanzen
Schmerzauslösende Substanzen  Schmerzrezeptoren
Schmerzrezeptoren  Periphere Schmerzafferenz
Periphere Schmerzafferenz  Übertragener Schmerz, Head'sche Zonen
Übertragener Schmerz, Head'sche Zonen  Weiterleitung und zentrale Verarbeitung
Weiterleitung und zentrale Verarbeitung
 Schmerzmodulation
Schmerzmodulation  Schmerzhemmung, Gate-control-Theorie
Schmerzhemmung, Gate-control-Theorie  Zentrales Höhlengrau
Zentrales Höhlengrau  Endocannabinoidsystem
Endocannabinoidsystem  Endophinsystem
Endophinsystem
 Nozizeptiver / neuropathischer Schmerz
Nozizeptiver / neuropathischer Schmerz  Hyperalgesie, Hyperästhesie
Hyperalgesie, Hyperästhesie  Allodynie
Allodynie
 Core messages
Core messages s. dazu über
s. dazu über
 Die International Association for the Study of Pain definiert Schmerz als "eine unangenehme sensorische und emotionale Erfahrung verbunden mit realer oder potentieller Gewebeschädigung,
oder wird mit Begriffen einer solchen beschrieben". Schmerz ist mehr als
eine simple physiologische Reaktion auf einen Reiz; es ist eine
komplexe Erfahrung, die stark von Kontext, Erwartung und Angst geprägt
ist.
Die International Association for the Study of Pain definiert Schmerz als "eine unangenehme sensorische und emotionale Erfahrung verbunden mit realer oder potentieller Gewebeschädigung,
oder wird mit Begriffen einer solchen beschrieben". Schmerz ist mehr als
eine simple physiologische Reaktion auf einen Reiz; es ist eine
komplexe Erfahrung, die stark von Kontext, Erwartung und Angst geprägt
ist.  )
ausgestattet sind. (Ein Gewebeschaden muss nicht bestehen, wenn Schmerz
empfunden wird, insoferne ist der Begriff "Nozizeption" - Noxe = Schaden - nicht immer
zutreffend.)
)
ausgestattet sind. (Ein Gewebeschaden muss nicht bestehen, wenn Schmerz
empfunden wird, insoferne ist der Begriff "Nozizeption" - Noxe = Schaden - nicht immer
zutreffend.) 
 Abbildung: Übersicht zu Entstehung, Leitung und Verarbeitung von Schmerz
Abbildung: Übersicht zu Entstehung, Leitung und Verarbeitung von Schmerz Somatosensorischer Cortex (S1)
Somatosensorischer Cortex (S1)  anteriorer gyrus cinguli (ACC)
anteriorer gyrus cinguli (ACC)  Mandelkerne (CeA)
Mandelkerne (CeA)  Insel (IC)
Insel (IC)  präfrontaler Cortex (PFC)
präfrontaler Cortex (PFC)
 Nozizeptiver Schmerz entsteht
durch Aktivierung von Nozizeptoren in der Haut oder darunterliegendem
Gewebe durch Verletzungen, und geht üblicherweise mit lokaler
Entzündung einher. Neuropathischer Schmerz entsteht
durch direkte Verletzung peripherer oder zentraler Neuronen infolge
Ischämie, Kompression, Durchtrennung, Blutung, oder chemischer Reizung.
Neuropathischer Schmerz wird als brennend, stechend, bohrend empfunden.
Zum neuropathischen Formenkreis zählt man auch
Phantomschmerzen sowie die Trigeminusneuralgie (deren Pathologie unklar
ist).
Nozizeptiver Schmerz entsteht
durch Aktivierung von Nozizeptoren in der Haut oder darunterliegendem
Gewebe durch Verletzungen, und geht üblicherweise mit lokaler
Entzündung einher. Neuropathischer Schmerz entsteht
durch direkte Verletzung peripherer oder zentraler Neuronen infolge
Ischämie, Kompression, Durchtrennung, Blutung, oder chemischer Reizung.
Neuropathischer Schmerz wird als brennend, stechend, bohrend empfunden.
Zum neuropathischen Formenkreis zählt man auch
Phantomschmerzen sowie die Trigeminusneuralgie (deren Pathologie unklar
ist). Nozizeptiver Schmerz spricht auf nichtsteroidale Entzündungshemmer (NSAIDs: Nonsteroidal anti-inflammatory drugs)
- in schweren Fällen auch Opioide - an. Im Gegensatz dazu lindern
NSAIDs neuropathische Schmerzen nicht, auch Opioide helfen kaum.
Nozizeptiver Schmerz spricht auf nichtsteroidale Entzündungshemmer (NSAIDs: Nonsteroidal anti-inflammatory drugs)
- in schweren Fällen auch Opioide - an. Im Gegensatz dazu lindern
NSAIDs neuropathische Schmerzen nicht, auch Opioide helfen kaum. Abbildung).
Abbildung).
 Abbildung: Periphere Sensibilisierung und Axonreflex
Abbildung: Periphere Sensibilisierung und Axonreflex
 Substanz P steigert die Permeabilität von Kapillaren und fördert damit den Flüssigkeitsaustritt (ödematöse Schwellung: tumor)
Substanz P steigert die Permeabilität von Kapillaren und fördert damit den Flüssigkeitsaustritt (ödematöse Schwellung: tumor) CGRP (Calcitonin gene related peptide) entsteht durch alternatives Bearbeiten des Calcitoningens, es wirkt stärker vasodilatierend als
Prostaglandine oder Acetylcholin - schon in
femtomolarer Konzentration. Es relaxiert die Gefäßmuskelzellen und fördert Erwärmung (calor) und Rötung (rubor) entzündeter Stellen. Substanz P und CGRP fördern
die Freisetzung von Histamin aus Mastzellen (
CGRP (Calcitonin gene related peptide) entsteht durch alternatives Bearbeiten des Calcitoningens, es wirkt stärker vasodilatierend als
Prostaglandine oder Acetylcholin - schon in
femtomolarer Konzentration. Es relaxiert die Gefäßmuskelzellen und fördert Erwärmung (calor) und Rötung (rubor) entzündeter Stellen. Substanz P und CGRP fördern
die Freisetzung von Histamin aus Mastzellen ( Abbildung). Damit stimulieren sie auch die Schmerzentstehung (dolor)
Abbildung). Damit stimulieren sie auch die Schmerzentstehung (dolor) Der Wachstumsfaktor NGF erhöht die Empfindlichkeit gegenüber Hitze- und Schmerzreizen über Einfluss auf TRPV1-Kanäle
Der Wachstumsfaktor NGF erhöht die Empfindlichkeit gegenüber Hitze- und Schmerzreizen über Einfluss auf TRPV1-Kanäle Das Zytokin TNFα verstärkt die Entzündungsreaktion sowie die Freisetzung anderer entzündungsfördernder Stoffe
Das Zytokin TNFα verstärkt die Entzündungsreaktion sowie die Freisetzung anderer entzündungsfördernder Stoffe Vertreter der TRP-Familie (transient receptor potential channels) - Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind nichtselektive Kationenkanäle, die u.a. für die Detektion von Schmerz (
Vertreter der TRP-Familie (transient receptor potential channels) - Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind nichtselektive Kationenkanäle, die u.a. für die Detektion von Schmerz ( Abbildung), aber
auch Temperatur, Geschmack (Capsaicin ist die Substanz, die Chili "scharf" macht), Mechano- und Photosensibilität
eine Rolle spielen.
Abbildung), aber
auch Temperatur, Geschmack (Capsaicin ist die Substanz, die Chili "scharf" macht), Mechano- und Photosensibilität
eine Rolle spielen. 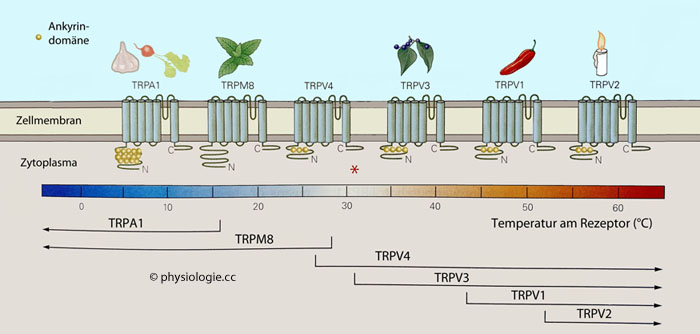
 Abbildung: TRP-Ionenkanäle und Schmerzentstehung
Abbildung: TRP-Ionenkanäle und Schmerzentstehung
 Abbildung). Reizung der TRP-Kanäle bewirkt Na+- und Ca++-Einstrom,
Depolarisierung, Aktivierung spannungsabhängiger Natriumkanäle und
Aktionspotentialauslösung an afferenten nozizeptiven Nervenfasern.
Abbildung). Reizung der TRP-Kanäle bewirkt Na+- und Ca++-Einstrom,
Depolarisierung, Aktivierung spannungsabhängiger Natriumkanäle und
Aktionspotentialauslösung an afferenten nozizeptiven Nervenfasern.  Höhere Temperaturen als der TRPV1-Rezeptor detektiert der Transient receptor potential cation channel subfamily M member 3-Rezeptor (TRPM3); er findet sich an Nervenfasern des Typs A-δ und übermittelt den ersten, scharfen Schmerz bei einer Verbrennung (vgl. TRPV1).
Höhere Temperaturen als der TRPV1-Rezeptor detektiert der Transient receptor potential cation channel subfamily M member 3-Rezeptor (TRPM3); er findet sich an Nervenfasern des Typs A-δ und übermittelt den ersten, scharfen Schmerz bei einer Verbrennung (vgl. TRPV1). P2X-Rezeptor (Purinorezeptor - ATP
tritt aus verletzten Zellen aus, z.B. Epithel in Gastrointestinal- oder
Urogenitalsystem bei starker Dehnung): Dieser Kationenkanal ist außer
für
Nozizeption - insbesondere chronischen Schmerz - an zahlreichen
weiteren
Funktionen beteiligt, wie Kommunikation zwischen Nerven- und
Gliazellen, Ino- und Chronotropie am Herzen, Einfluss auf den
Gefäßtonus, Kontraktion der Harnblase und des ductus deferens,
Makrophagenaktivierung, Plättchenaggregation.
P2X-Rezeptor (Purinorezeptor - ATP
tritt aus verletzten Zellen aus, z.B. Epithel in Gastrointestinal- oder
Urogenitalsystem bei starker Dehnung): Dieser Kationenkanal ist außer
für
Nozizeption - insbesondere chronischen Schmerz - an zahlreichen
weiteren
Funktionen beteiligt, wie Kommunikation zwischen Nerven- und
Gliazellen, Ino- und Chronotropie am Herzen, Einfluss auf den
Gefäßtonus, Kontraktion der Harnblase und des ductus deferens,
Makrophagenaktivierung, Plättchenaggregation. Wasserstoffionen treten extrazellulär vermehrt bei Verletzung / Entzündung auf. Protonenaktivierte säureempfindliche Natriumkanäle (ASICs: acid sensitive ion channels) lassen bei pH-Abfall Na+ in die Schmerzfaser einströmen. Das tun auch serotoninaktivierte Ionenkanäle (im Rahmen entzündlicher Prozesse entsteht auch Serotonin). Der Serotonin-Typ3- (5HT3) Rezeptor besteht - ähnlich dem nikotinischen Acetylcholinrezeptor - aus 5 Untereinheiten, die um einen zentralen Kationenkanal
gruppiert sind. (Andere Serotoninrezeptoren aktivieren
G-Proteine.) Im Gastrointestinaltrakt setzen enteroendokrine
Epithelzellen (die größte Serotoninquelle des Körpers) auf mechanische
oder chemische Reize hin Serotonin frei; etwa 30% der sensorischen
Nervenfasern des Colon haben 5HT3-Rezeptoren.
Wasserstoffionen treten extrazellulär vermehrt bei Verletzung / Entzündung auf. Protonenaktivierte säureempfindliche Natriumkanäle (ASICs: acid sensitive ion channels) lassen bei pH-Abfall Na+ in die Schmerzfaser einströmen. Das tun auch serotoninaktivierte Ionenkanäle (im Rahmen entzündlicher Prozesse entsteht auch Serotonin). Der Serotonin-Typ3- (5HT3) Rezeptor besteht - ähnlich dem nikotinischen Acetylcholinrezeptor - aus 5 Untereinheiten, die um einen zentralen Kationenkanal
gruppiert sind. (Andere Serotoninrezeptoren aktivieren
G-Proteine.) Im Gastrointestinaltrakt setzen enteroendokrine
Epithelzellen (die größte Serotoninquelle des Körpers) auf mechanische
oder chemische Reize hin Serotonin frei; etwa 30% der sensorischen
Nervenfasern des Colon haben 5HT3-Rezeptoren.  Prostaglandinrezeptoren sensibilisieren Neuronen im Rückenmark für
Schmerz und regulieren Entzündungsvorgänge;
Prostaglandinrezeptoren sensibilisieren Neuronen im Rückenmark für
Schmerz und regulieren Entzündungsvorgänge;  Bradykininrezeptoren
mediieren Reaktionen auf pathophysiologische Vorgänge, die u.a. Schmerz
verursachen;
Bradykininrezeptoren
mediieren Reaktionen auf pathophysiologische Vorgänge, die u.a. Schmerz
verursachen;  Histaminrezeptoren sind an zahlreichen Reaktionen auf
Schmerzreize beteiligt, z.B. im Immun- und Nervensystem.
Histaminrezeptoren sind an zahlreichen Reaktionen auf
Schmerzreize beteiligt, z.B. im Immun- und Nervensystem. Direkte Aktivierung
von Nozizeptoren oder Erhöhung der Rezeptorempfindlichkeit auf die
Wirkung anderer Schmerzmediatoren
Direkte Aktivierung
von Nozizeptoren oder Erhöhung der Rezeptorempfindlichkeit auf die
Wirkung anderer Schmerzmediatoren Aktivierung von Immunzellen,
die ihrerseits Zytokine freisetzen (z.B. durch Wirkung von Histamin, Serotonin, Eikosanoiden,
Zytokinen): Die im Rahmen entzündlicher Vorgänge freigesetzten
Mediatorstoffe verstärken die Wirkung der Nozizeptoren.
Aktivierung von Immunzellen,
die ihrerseits Zytokine freisetzen (z.B. durch Wirkung von Histamin, Serotonin, Eikosanoiden,
Zytokinen): Die im Rahmen entzündlicher Vorgänge freigesetzten
Mediatorstoffe verstärken die Wirkung der Nozizeptoren. sind schmerzübertragende Neuropeptide. Sie wirken über Tachykininrezeptoren nicht nur schmerzauslösend, sondern auch auf glatte Muskelzellen
(vasodilatierend, bronchokonstriktorisch), T-Lymphozyten (als
Chemoattraktor), Nervenzellen (präfrontaler Cortex, limbisches System,
Vegetativum), endokrine Zellen.
sind schmerzübertragende Neuropeptide. Sie wirken über Tachykininrezeptoren nicht nur schmerzauslösend, sondern auch auf glatte Muskelzellen
(vasodilatierend, bronchokonstriktorisch), T-Lymphozyten (als
Chemoattraktor), Nervenzellen (präfrontaler Cortex, limbisches System,
Vegetativum), endokrine Zellen.  bewirken,
aber auch Reparatur- und Heilungsvorgänge unterstützen (sollen).
Substanz P findet sich auch reichlich in der substantia gelatinosa des
Hinterhorns im Rückenmark.
bewirken,
aber auch Reparatur- und Heilungsvorgänge unterstützen (sollen).
Substanz P findet sich auch reichlich in der substantia gelatinosa des
Hinterhorns im Rückenmark. Histamin
Histamin  wird hauptsächlich von Mastzellen sowie basophilen und eosinohilen
Granulozyten gebildet. Degranulierung - vor allem an
Schleimhäuten und im Bereich von Blutgefäßen - führt unter anderem zu
immunologischen Folgereaktionen. Geschädigte / gereizte Nozizeptoren geben an ihre Umgebung Substanz P ab, was Mastzellen zur Freisetzung von Histamin veranlasst und Entzündungsreaktionen triggert.
wird hauptsächlich von Mastzellen sowie basophilen und eosinohilen
Granulozyten gebildet. Degranulierung - vor allem an
Schleimhäuten und im Bereich von Blutgefäßen - führt unter anderem zu
immunologischen Folgereaktionen. Geschädigte / gereizte Nozizeptoren geben an ihre Umgebung Substanz P ab, was Mastzellen zur Freisetzung von Histamin veranlasst und Entzündungsreaktionen triggert.
 Abbildung: Sensibilisierung von Schmerzrezeptoren durch entzündliche Vorgänge
Abbildung: Sensibilisierung von Schmerzrezeptoren durch entzündliche Vorgänge ASICS = acid-sensing ion channels
ASICS = acid-sensing ion channels  CRH = Corticotropin- Releasingfaktor
CRH = Corticotropin- Releasingfaktor  GIRK = G protein-coupled inwardly rectifying potassium (K) channel
GIRK = G protein-coupled inwardly rectifying potassium (K) channel  IL = Interleukin
IL = Interleukin  LIF = leukemia inhibitory factor
LIF = leukemia inhibitory factor  µ = Opioidrezeptor
µ = Opioidrezeptor  M2 = muskarinischer Rezeptor
M2 = muskarinischer Rezeptor  NGF = Nervenwachstumsfaktor
NGF = Nervenwachstumsfaktor  PAF = Plättchenaktivierender Faktor
PAF = Plättchenaktivierender Faktor  PKA / PKC = Proteinkinase A / C
PKA / PKC = Proteinkinase A / C  SSTR = Somatostatinrezeptor
SSTR = Somatostatinrezeptor  TNF = Tumornektor
TNF = Tumornektor  TrkA = Tyrosinkinaserezeptor A
TrkA = Tyrosinkinaserezeptor A  TTXr = Tetrodotoxin-resistant sodium channel
TTXr = Tetrodotoxin-resistant sodium channel
 Aspirin und andere nicht-steroidale Analgetika blockieren die Aktivität der Zyklooxygenase, senken die Prostaglandinsynthese und werden häufig zur Schmerztherapie angewendet.
Aspirin und andere nicht-steroidale Analgetika blockieren die Aktivität der Zyklooxygenase, senken die Prostaglandinsynthese und werden häufig zur Schmerztherapie angewendet. Serotonin
bindet an ionotrope Serotoninrezeptoren der Schmerzfasern; dies sind
Natriumkanäle, die durch Serotonin geöffnet werden (s. oben). Serotonin bewirkt darüber hinaus über
NO-Bildung Vasodilatation, Ödembildung und Leukozytendiapedese; Rötung
und Quaddelbildung sind die Folge.
Serotonin
bindet an ionotrope Serotoninrezeptoren der Schmerzfasern; dies sind
Natriumkanäle, die durch Serotonin geöffnet werden (s. oben). Serotonin bewirkt darüber hinaus über
NO-Bildung Vasodilatation, Ödembildung und Leukozytendiapedese; Rötung
und Quaddelbildung sind die Folge.
 Abbildung: Verletzung und Schmerzaktivierung, Vasodilatation, Immunsystem
Abbildung: Verletzung und Schmerzaktivierung, Vasodilatation, Immunsystem

 G-Protein-gekoppelte Rezeptoren (GPCR)
G-Protein-gekoppelte Rezeptoren (GPCR)  ligandenaktivierte Kanäle (LGC) = ionotrope Rezeptoren
ligandenaktivierte Kanäle (LGC) = ionotrope Rezeptoren  Tyrosinkinase-Rezeptoren von Typ I (TrkA) u.a.
Tyrosinkinase-Rezeptoren von Typ I (TrkA) u.a.
 Der ”erste“, rasch abklingende
”Delta-Schmerz“ (nach der Leitung über Nervenfasern des Typs A-δ) wird relativ rasch
geleitet (5-30 m/s) und ist gut lokalisierbar. Diese Schmerzfasern sind auf die Detektion mechanischer Verformung der Haut spezialisiert. Ihre rezeptiven Felder sind groß, aber innerhalb dieser ist die Schmerzsensitivität auf kleine Flächen ("pain spots")
limitiert (ähnlich wie bei rezeptiven Feldern der Thermosensibilität).
Stimulierung des Delta-Schmerzes führt zu reflektorischen Reaktionen
(Abwehr-, Ausweich- bzw. Fluchtreaktionen), um dem Auslöser des
Schmerzes zu entkommen.
Der ”erste“, rasch abklingende
”Delta-Schmerz“ (nach der Leitung über Nervenfasern des Typs A-δ) wird relativ rasch
geleitet (5-30 m/s) und ist gut lokalisierbar. Diese Schmerzfasern sind auf die Detektion mechanischer Verformung der Haut spezialisiert. Ihre rezeptiven Felder sind groß, aber innerhalb dieser ist die Schmerzsensitivität auf kleine Flächen ("pain spots")
limitiert (ähnlich wie bei rezeptiven Feldern der Thermosensibilität).
Stimulierung des Delta-Schmerzes führt zu reflektorischen Reaktionen
(Abwehr-, Ausweich- bzw. Fluchtreaktionen), um dem Auslöser des
Schmerzes zu entkommen. Der ”zweite“, schlecht lokalisierbare, dumpf-brennende,
langsam abklingende, quälende ”C-Schmerz“ ist benannt nach
Nervenfasern der Gruppe C,
welche die langsamste
Leitungsgeschwindigkeit (≤1 Meter pro Sekunde) aufweisen. Viszeraler
Schmerz (durch starke Dehnung oder Einengung, unempfindlich gegenüber
Schneiden oder Brennen) wird ausschließlich über C-Fasern geleitet
(eine Fluchtreaktion wie bei Reizung von A-delta-Fasern wäre nicht
sinnvoll, den eigenen Eingeweiden kann man nicht davonlaufen).
Viszeraler Schmerz wird diffus - oft auf Hautzonen projiziert - empfunden und löst vegetative Reaktionen aus (Schweißausbruch, Blutdruckerhöhung..).
Der ”zweite“, schlecht lokalisierbare, dumpf-brennende,
langsam abklingende, quälende ”C-Schmerz“ ist benannt nach
Nervenfasern der Gruppe C,
welche die langsamste
Leitungsgeschwindigkeit (≤1 Meter pro Sekunde) aufweisen. Viszeraler
Schmerz (durch starke Dehnung oder Einengung, unempfindlich gegenüber
Schneiden oder Brennen) wird ausschließlich über C-Fasern geleitet
(eine Fluchtreaktion wie bei Reizung von A-delta-Fasern wäre nicht
sinnvoll, den eigenen Eingeweiden kann man nicht davonlaufen).
Viszeraler Schmerz wird diffus - oft auf Hautzonen projiziert - empfunden und löst vegetative Reaktionen aus (Schweißausbruch, Blutdruckerhöhung..). Molekülen, die sie in ihrer Membran tragen (Rezeptoren, Glykokonjugate),
Molekülen, die sie in ihrer Membran tragen (Rezeptoren, Glykokonjugate), Molekülen, die sie speichern und freisetzen (z.B. Peptide),
Molekülen, die sie speichern und freisetzen (z.B. Peptide),  Enzymen, die sie exprimieren bzw. nutzen.
Enzymen, die sie exprimieren bzw. nutzen.
 Abbildung: Komponenten des Schmerzes
Abbildung: Komponenten des Schmerzes

 Abbildung: Viszeraler Schmerz: Projektion in Hirnstamm und Rückenmark
Abbildung: Viszeraler Schmerz: Projektion in Hirnstamm und Rückenmark Nozizeptive Fasern, die in den Hirnstamm projizieren, nutzen Hirnnerven (IX und X - der N. vagus innerviert praktisch alle Brust- und Baucheingeweide und übernimmt Aspekte des Eingeweideschmerzes) und liegen über der "Thorax-Schmerzlinie"
Nozizeptive Fasern, die in den Hirnstamm projizieren, nutzen Hirnnerven (IX und X - der N. vagus innerviert praktisch alle Brust- und Baucheingeweide und übernimmt Aspekte des Eingeweideschmerzes) und liegen über der "Thorax-Schmerzlinie" Nozizeptive Afferenzen, die in das Sakralmark projizieren, liegen unter der "Becken-Schmerzlinie"
Nozizeptive Afferenzen, die in das Sakralmark projizieren, liegen unter der "Becken-Schmerzlinie" Andere viszerale Schmerzfasern projizieren in das dazwischenliegende Rückenmark (zervikal, thorakal und lumbal), sie liegen zwischen den beiden Schmerzlinien. Sie teilen sich die Schmerzversorgung der Eingeweide mit Fasern des X. Hirnnerven
Andere viszerale Schmerzfasern projizieren in das dazwischenliegende Rückenmark (zervikal, thorakal und lumbal), sie liegen zwischen den beiden Schmerzlinien. Sie teilen sich die Schmerzversorgung der Eingeweide mit Fasern des X. Hirnnerven
 Abbildung).
Abbildung). 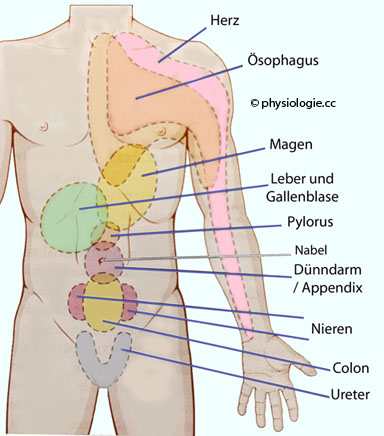
 Abbildung: Head'sche Zonen
Abbildung: Head'sche Zonen

 ). Sie schalten dann glutamaterg sowie
mittels Substanz P (das durch höhere Aktionspotentialfrequenzen aus
Speichervesikeln freigesetzt wird und intensiven Schmerz verursacht)
auf das nächste Neuron.
). Sie schalten dann glutamaterg sowie
mittels Substanz P (das durch höhere Aktionspotentialfrequenzen aus
Speichervesikeln freigesetzt wird und intensiven Schmerz verursacht)
auf das nächste Neuron. Langsam leitende C-Fasern projizieren vor allem auf die Laminae I und II (etwa gleichzusetzen mit der substantia gelatinosa) - diese enthalten vor allem kurze Interneurone,
Langsam leitende C-Fasern projizieren vor allem auf die Laminae I und II (etwa gleichzusetzen mit der substantia gelatinosa) - diese enthalten vor allem kurze Interneurone,  Schneller leitende Aδ-Fasern schalten in den Laminae I und V
des Hinterhorns um (hier können auch Kollateralen somatisch afferenter
Aβ-Fasern - deren Axone ipsilateral zu Hinterstrangkernen aufsteigen -
umschalten).
Schneller leitende Aδ-Fasern schalten in den Laminae I und V
des Hinterhorns um (hier können auch Kollateralen somatisch afferenter
Aβ-Fasern - deren Axone ipsilateral zu Hinterstrangkernen aufsteigen -
umschalten).  Die spinothalamische Bahn (tractus spinothalamicus lateralis, anterolaterales System) ist die führende Schmerzprojektion
zum Gehirn. Ihre Fasern stammen aus den Rexed-Zonen I sowie V bis VII
des Hinterhorns. Diese kreuzen nahe ihrem Ursprungssegment auf die
Gegenseite und ziehen antertolateral (im Hirnstamm neben dem
lemniscus medialis gelegen) nach zentral. Der tractus spinothalamicus vermittelt Nozizeption von Haut, Gelenken und Muskeln und endet im Thalamus.
Die spinothalamische Bahn (tractus spinothalamicus lateralis, anterolaterales System) ist die führende Schmerzprojektion
zum Gehirn. Ihre Fasern stammen aus den Rexed-Zonen I sowie V bis VII
des Hinterhorns. Diese kreuzen nahe ihrem Ursprungssegment auf die
Gegenseite und ziehen antertolateral (im Hirnstamm neben dem
lemniscus medialis gelegen) nach zentral. Der tractus spinothalamicus vermittelt Nozizeption von Haut, Gelenken und Muskeln und endet im Thalamus.  Die spinoretikuläre Bahn (tractus spinoreticularis) entspringt in laminae VII und VIII des Hinterhorns und projiziert über Umschaltungen im Bereich der formatio reticularis zum medialen Thalamus. Dieses System überträgt diffuse, unscharf lokalisierbare Schmerzinformation.
Die spinoretikuläre Bahn (tractus spinoreticularis) entspringt in laminae VII und VIII des Hinterhorns und projiziert über Umschaltungen im Bereich der formatio reticularis zum medialen Thalamus. Dieses System überträgt diffuse, unscharf lokalisierbare Schmerzinformation. Die spino-parabrachiale Bahn projiziert über Umschaltungen im Bereich formatio reticularis und nucl. parabrachialis zum medialen Thalamus und zu limbischen
Strukturen. Sie vermittelt emotionale und aversive Komponenten, die
über limbisch-motorische Zugänge vermittelt werden (Mimik, Schreie,..)
und beeinflussen den Wachzustand.
Die spino-parabrachiale Bahn projiziert über Umschaltungen im Bereich formatio reticularis und nucl. parabrachialis zum medialen Thalamus und zu limbischen
Strukturen. Sie vermittelt emotionale und aversive Komponenten, die
über limbisch-motorische Zugänge vermittelt werden (Mimik, Schreie,..)
und beeinflussen den Wachzustand.  Die spino-hypothalamische Bahn
führt Axone aus laminae I, V, VII und VIII. Die hypothalamischen
Neurone, auf die sie projizieren, regulieren Kreislauf- und
neuroendokrine Reaktionen auf Schmerzmeldungen.
Die spino-hypothalamische Bahn
führt Axone aus laminae I, V, VII und VIII. Die hypothalamischen
Neurone, auf die sie projizieren, regulieren Kreislauf- und
neuroendokrine Reaktionen auf Schmerzmeldungen.
 Abbildung: Schmerzafferenz und subkortikale / kortikale Schmerzverarbeitung
Abbildung: Schmerzafferenz und subkortikale / kortikale Schmerzverarbeitung Amyg, Mandelkerne
Amyg, Mandelkerne  BG, Basalganglien
BG, Basalganglien  M1, primärer Motorcortex
M1, primärer Motorcortex  HT, Hypothalamus
HT, Hypothalamus  PAG, periaquäduktales Grau (zentrales Höhlengrau)
PAG, periaquäduktales Grau (zentrales Höhlengrau)  PB, nucl parabrachialis (dorsolaterale Brücke)
PB, nucl parabrachialis (dorsolaterale Brücke)  PCC, posteriorer gyrus cinguli
PCC, posteriorer gyrus cinguli  PFC, präfrontaler Cortex
PFC, präfrontaler Cortex  PPC, posteriorer Parietalcortex
PPC, posteriorer Parietalcortex  S1 / S2, primäre / sekundäre somatosensorische Rinde
S1 / S2, primäre / sekundäre somatosensorische Rinde  SMA, supplementär-motorisches Areal
SMA, supplementär-motorisches Areal

 Der somatosensorische Cortex bildet Schmerzinformation somatotop organisiert ab; experimentelle Reizung des Cortex führt aber nicht zu Schmerzempfinden.
Der somatosensorische Cortex bildet Schmerzinformation somatotop organisiert ab; experimentelle Reizung des Cortex führt aber nicht zu Schmerzempfinden. Die Mandelkerne
ermöglichen emotionale Konditionierung sowie emotions-und
affektrelevante Lernvorgänge, insbesondere in Verbindung mit
Verunsicherung, Angst und Schmerz.
Die Mandelkerne
ermöglichen emotionale Konditionierung sowie emotions-und
affektrelevante Lernvorgänge, insbesondere in Verbindung mit
Verunsicherung, Angst und Schmerz. Der mediale präfrontale Cortex ist das sensori-motorische Viszeralgehirn.
Reizung dieses Areals ruft verschiedene vegetative Effekte hervor, wie
Veränderungen des Blutdrucks oder Kontraktion des Magens. Es besteht
aus zwei interagierenden funktionellen Zonen:
Der mediale präfrontale Cortex ist das sensori-motorische Viszeralgehirn.
Reizung dieses Areals ruft verschiedene vegetative Effekte hervor, wie
Veränderungen des Blutdrucks oder Kontraktion des Magens. Es besteht
aus zwei interagierenden funktionellen Zonen:  Rostrale Insel. Diese erhält Schmerzinformation sowohl vom Thalamus als auch von den
Mandelkernen; sie integriert sensorische, affektive und kognitive
Komponenten des Schmerzerlebnisses. Fällt die Insel aus, werden Ort und
Intensität des Schmerzes immer noch korrekt wahrgenommen, die affektive
Komponente verschwindet aber (Schmerz-Asymbolie).
Rostrale Insel. Diese erhält Schmerzinformation sowohl vom Thalamus als auch von den
Mandelkernen; sie integriert sensorische, affektive und kognitive
Komponenten des Schmerzerlebnisses. Fällt die Insel aus, werden Ort und
Intensität des Schmerzes immer noch korrekt wahrgenommen, die affektive
Komponente verschwindet aber (Schmerz-Asymbolie).  Vordere Spitze der Gürtelwindung (gyrus cinguli): Sie vermittelt u.a. motorische Antworten auf Schmerzreize. Der vordere gyrus cinguli (
Vordere Spitze der Gürtelwindung (gyrus cinguli): Sie vermittelt u.a. motorische Antworten auf Schmerzreize. Der vordere gyrus cinguli ( Abbildung: ACC - anterior cingulate cortex) ist ein Teil des limbischen Systems. Zusammen mit der Insel, aber auch dem posterioren gyrus cinguli ist der ACC in die emotionale Verarbeitung und Gewichtung von Schmerzen eingebunden, seine Aktivierung korreliert mit der Intensität der
Schmerzempfindung (oder deren Erwartung).
Abbildung: ACC - anterior cingulate cortex) ist ein Teil des limbischen Systems. Zusammen mit der Insel, aber auch dem posterioren gyrus cinguli ist der ACC in die emotionale Verarbeitung und Gewichtung von Schmerzen eingebunden, seine Aktivierung korreliert mit der Intensität der
Schmerzempfindung (oder deren Erwartung).
 Abbildung: Möglichkeiten peripherer Schmerzmodulation
Abbildung: Möglichkeiten peripherer Schmerzmodulation
 Abbildung). Verletzungen bedingen erhöhte Schmerzempfindlichkeit (Sensitivierung) des betroffenen Gebietes, bedingt durch die Freisetzung von Entzündungsmediatoren. Prostaglandine
(Lipide) oder das Peptid Bradykinin binden an Rezeptoren und triggern
dadurch intrazelluläre Folgereaktionen; das Neuron gibt Neuropeptide an
seine Umgebung ab, die wiederum Immunzellen und Epithelien zur
Produktion von schmerzauslösenden Mediatoren anregen (neurogene Entzündung).
Abbildung). Verletzungen bedingen erhöhte Schmerzempfindlichkeit (Sensitivierung) des betroffenen Gebietes, bedingt durch die Freisetzung von Entzündungsmediatoren. Prostaglandine
(Lipide) oder das Peptid Bradykinin binden an Rezeptoren und triggern
dadurch intrazelluläre Folgereaktionen; das Neuron gibt Neuropeptide an
seine Umgebung ab, die wiederum Immunzellen und Epithelien zur
Produktion von schmerzauslösenden Mediatoren anregen (neurogene Entzündung).
 Abbildung: Möglichkeiten zentraler Schmerzmodulation
Abbildung: Möglichkeiten zentraler Schmerzmodulation
 Abbildung), was analgetisch wirkt.
Abbildung), was analgetisch wirkt. 
 Abbildung: Hyperalgesie und Allodynie; Schmerzleitung über den spinothalamischen und parabrachialen Weg
Abbildung: Hyperalgesie und Allodynie; Schmerzleitung über den spinothalamischen und parabrachialen Weg  Bei verstärkter Wahrnehmung von
Schmerzreizen spricht man von Hyperalgesie - einer Form von Hyperästhesie (=gesteigerte Empfindlichkeit afferenter Nerven). An der Stelle der Verletzung entsteht primäre Hyperalgesie, in der Umgebung sekundäre Hyperalgesie - bedingt durch die Sensitivierung von Neuronen im ZNS.
Bei verstärkter Wahrnehmung von
Schmerzreizen spricht man von Hyperalgesie - einer Form von Hyperästhesie (=gesteigerte Empfindlichkeit afferenter Nerven). An der Stelle der Verletzung entsteht primäre Hyperalgesie, in der Umgebung sekundäre Hyperalgesie - bedingt durch die Sensitivierung von Neuronen im ZNS. Verschiedene nicht-noxische Reize können die Empfindlichkeit des
Schmerzsystems steigern (die Schmerzschwelle senken); man spricht von
Allodynie
Verschiedene nicht-noxische Reize können die Empfindlichkeit des
Schmerzsystems steigern (die Schmerzschwelle senken); man spricht von
Allodynie  .
Dabei kommt es bereits bei geringer Reizintensität zu deutlicher
Schmerzwahrnehmung (pathologischer Schmerz,
.
Dabei kommt es bereits bei geringer Reizintensität zu deutlicher
Schmerzwahrnehmung (pathologischer Schmerz,  Abbildung).
Abbildung). Interneurone in der lamina II setzen Dynorphine oder Enkephaline
frei und hemmen so das Entladungsverhalten spinothalamischer
Projektionsneurone. Zur serotoninergen deszendierenden Schmerzhemmung kommt eine noradrenerge aus
dem locus coeruleus.
Interneurone in der lamina II setzen Dynorphine oder Enkephaline
frei und hemmen so das Entladungsverhalten spinothalamischer
Projektionsneurone. Zur serotoninergen deszendierenden Schmerzhemmung kommt eine noradrenerge aus
dem locus coeruleus.
 Abbildung: Afferente und efferente Beeinflussung der Schmerzleitung
Abbildung: Afferente und efferente Beeinflussung der Schmerzleitung
 Abbildung):
Abbildung):
 Abbildung: Konvergenz auf Projektionsneuronen und Schmerzmodulation
Abbildung: Konvergenz auf Projektionsneuronen und Schmerzmodulation
 Abbildung links). Diese Umschaltung unterliegt einem "Kontrolltor" (gate): Erregung
mechanosensibler Rezeptoren in der Haut sendet Aktionspotentiale über
A-Fasern zu den Hintersträngen, und Kollateralen dieser Fasern regen auf der Höhe des Eintritts ins Rückenmark inhibitorische Interneurone an. Dies schwächt die
Aktivierung des Projektionsneurons, das Schmerzimpulse erhält, und damit die Schmerzleitung an den
Thalamus (aszendierende Schmerzhemmung).
Abbildung links). Diese Umschaltung unterliegt einem "Kontrolltor" (gate): Erregung
mechanosensibler Rezeptoren in der Haut sendet Aktionspotentiale über
A-Fasern zu den Hintersträngen, und Kollateralen dieser Fasern regen auf der Höhe des Eintritts ins Rückenmark inhibitorische Interneurone an. Dies schwächt die
Aktivierung des Projektionsneurons, das Schmerzimpulse erhält, und damit die Schmerzleitung an den
Thalamus (aszendierende Schmerzhemmung). Afferente Aβ-Fasern hemmen die Übertragung auf WDR-Neurone über metabotrope Glutamatrezeptoren - auf diese Weise wird die Übertragung nozizeptiver Impulse auf
Projektionsneuronen durch gleichzeitige mechanosensible Afferenz
abgeschwächt (gate control theory)
Afferente Aβ-Fasern hemmen die Übertragung auf WDR-Neurone über metabotrope Glutamatrezeptoren - auf diese Weise wird die Übertragung nozizeptiver Impulse auf
Projektionsneuronen durch gleichzeitige mechanosensible Afferenz
abgeschwächt (gate control theory) Deszendierende Bahnen aus zentralem Höhlengrau und Raphekernen hemmen die Übertragung auf WDR-Neurone serotoninerg
Deszendierende Bahnen aus zentralem Höhlengrau und Raphekernen hemmen die Übertragung auf WDR-Neurone serotoninerg  Deszendierende Bahnen aus zentralem Höhlengrau und Raphekernen innervieren hemmende Interneurone, die endogene Opioide freisetzen (Erklärung des zentralen Opioid-Wirkungsmechanismus)
Deszendierende Bahnen aus zentralem Höhlengrau und Raphekernen innervieren hemmende Interneurone, die endogene Opioide freisetzen (Erklärung des zentralen Opioid-Wirkungsmechanismus) Abbildung) - es umschließt den aquaeductus cerebri (Sylvische Wasserleitung
Abbildung) - es umschließt den aquaeductus cerebri (Sylvische Wasserleitung  ) - spielt für die deszendierende Schmerzhemmung zusammen mit Raphe- und Coeruleuskernen eine Schlüsselrolle.
Es erhält Afferenzen aus einem Großteil des zentralen autonomen
Systems, projiziert auf die formatio reticularis (Raphekerne) und ist
mit dem Großhirn (präfrontaler Cortex, Mandelkerne, Hypothalamus) reziprok verknüpft.
) - spielt für die deszendierende Schmerzhemmung zusammen mit Raphe- und Coeruleuskernen eine Schlüsselrolle.
Es erhält Afferenzen aus einem Großteil des zentralen autonomen
Systems, projiziert auf die formatio reticularis (Raphekerne) und ist
mit dem Großhirn (präfrontaler Cortex, Mandelkerne, Hypothalamus) reziprok verknüpft. 
 Abbildung: Zentrales Höhlengrau und Schmerzmodulierung
Abbildung: Zentrales Höhlengrau und Schmerzmodulierung

 Abbildung: Absteigende monoaminerge Schmerzhemmung
Abbildung: Absteigende monoaminerge Schmerzhemmung
 Hemmung der Transmitterfreisetzung von afferenten Fasern
Hemmung der Transmitterfreisetzung von afferenten Fasern
 direkte postsynaptische Inhibition von Projektionsneuronen
direkte postsynaptische Inhibition von Projektionsneuronen
 Hemmung exzitatorischer Interneurone
Hemmung exzitatorischer Interneurone
 Anregung inhibitorischer Interneurone
Anregung inhibitorischer Interneurone Abbildung).
Abbildung). sind körpereigene Lipide (
sind körpereigene Lipide ( über deren Synthese s. dort). Sie sind im
Gehirn weit verbreitet (Hippocampus, Kleinhirn, Basalganglien u.a.) und beeinflussen auch Gedächtnis, Schlaf, Koordinationsvermögen,
Stimmung und Appetit.
über deren Synthese s. dort). Sie sind im
Gehirn weit verbreitet (Hippocampus, Kleinhirn, Basalganglien u.a.) und beeinflussen auch Gedächtnis, Schlaf, Koordinationsvermögen,
Stimmung und Appetit.  CB1-Rezeptoren sind Gi/0-Rezeptor-gekoppelt, sie bewirken Inhibition der Adenylylcyclase (↓cAMP) und spannungsgesteuerter Calciumkanäle sowie Aktivierung von GIRK-Kanälen, Kaliumausstrom und Hyperpolarisation der Zellmembran. Sie befinden sich in der neuronalen Zellmembran und hemmen die - durch Depolarisierung und Ca++-Einstrom bewirkte - Transmitterfreisetzung präsynaptischer Nervenendigungen.
Die Reduktion des cAMP kann außerdem die Expression von Genen
verstärken oder abschwächen - direkt durch Aktivierung der MAPK und indirekt durch Reduktion der Aktivität der Proteinkinase A (PKA). CB1R finden sich vor allem an Axonverzweigungen GABAerger
(inhibitorisch) und glutaminerger Fasern (exzitatorisch), deren Aktivität sie hemmen. Die Effekte ähneln denen von Opioidrezeptoren.
CB1-Rezeptoren sind Gi/0-Rezeptor-gekoppelt, sie bewirken Inhibition der Adenylylcyclase (↓cAMP) und spannungsgesteuerter Calciumkanäle sowie Aktivierung von GIRK-Kanälen, Kaliumausstrom und Hyperpolarisation der Zellmembran. Sie befinden sich in der neuronalen Zellmembran und hemmen die - durch Depolarisierung und Ca++-Einstrom bewirkte - Transmitterfreisetzung präsynaptischer Nervenendigungen.
Die Reduktion des cAMP kann außerdem die Expression von Genen
verstärken oder abschwächen - direkt durch Aktivierung der MAPK und indirekt durch Reduktion der Aktivität der Proteinkinase A (PKA). CB1R finden sich vor allem an Axonverzweigungen GABAerger
(inhibitorisch) und glutaminerger Fasern (exzitatorisch), deren Aktivität sie hemmen. Die Effekte ähneln denen von Opioidrezeptoren.  CB2-Rezeptoren sind ebenfalls Gi/0-Rezeptor-gekoppelt, hemmen wie CB1R Adenylylcyclase (↓cAMP) und PKA-Aktivität, aktivieren GIRK-Kanäle und MAPK, haben aber keine Wirkung auf spannungsgesteuerte Calciumkanäle, die von Immunzellen nicht exprimiert werden. CB2R finden sich vor allem im Immunsystem (lymphatisches Gewebe - Milz, Thymus, Tonsillen: B-Lymphozyten, Monozyten, Mastzellen, NK-Zellen) und in peripheren
Nerven. Schädigung der Gehirnsubstanz kann an Zellen der Mikroglia die Expression von CB2-R induzieren und durch deren Aktivierung zu chronischen Schmerzen beitragen.
CB2-Rezeptoren sind ebenfalls Gi/0-Rezeptor-gekoppelt, hemmen wie CB1R Adenylylcyclase (↓cAMP) und PKA-Aktivität, aktivieren GIRK-Kanäle und MAPK, haben aber keine Wirkung auf spannungsgesteuerte Calciumkanäle, die von Immunzellen nicht exprimiert werden. CB2R finden sich vor allem im Immunsystem (lymphatisches Gewebe - Milz, Thymus, Tonsillen: B-Lymphozyten, Monozyten, Mastzellen, NK-Zellen) und in peripheren
Nerven. Schädigung der Gehirnsubstanz kann an Zellen der Mikroglia die Expression von CB2-R induzieren und durch deren Aktivierung zu chronischen Schmerzen beitragen.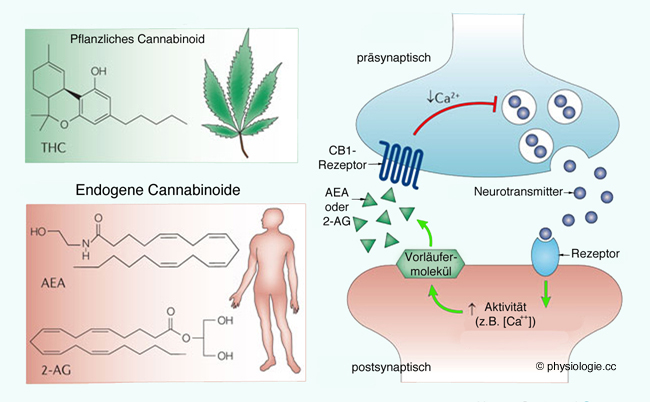
 Abbildung: Wirkungsmechanismus von Endocannabinoiden
Abbildung: Wirkungsmechanismus von Endocannabinoiden < Anandamid (AEA)
< Anandamid (AEA) das Arachidonsäurederivat Anandamid
das Arachidonsäurederivat Anandamid  (Arachidonylethanolamid,
AEA) entsteht durch die Aktivität einer spezifischen Phospholipase D und bindet an beide
Cannaboniodrezeptoren (an CB1R stärker als an CB2R) sowie an TRP-Rezeptoren. Es ist im Gehirn besonders stark vertreten. Anandamid ist
auch in Kakao und Schokolade enthalten
(Arachidonylethanolamid,
AEA) entsteht durch die Aktivität einer spezifischen Phospholipase D und bindet an beide
Cannaboniodrezeptoren (an CB1R stärker als an CB2R) sowie an TRP-Rezeptoren. Es ist im Gehirn besonders stark vertreten. Anandamid ist
auch in Kakao und Schokolade enthalten das Monoazylglyzerin 2-Arachidonoyl-glycerol (2-AG), das CB1R und CB2R gleich stark aktiviert
das Monoazylglyzerin 2-Arachidonoyl-glycerol (2-AG), das CB1R und CB2R gleich stark aktiviert das Eikosanoid Virodhamin O-Arachidonylethanolamid wirkt als CB1-Antagonist und CB2-Agonist
das Eikosanoid Virodhamin O-Arachidonylethanolamid wirkt als CB1-Antagonist und CB2-Agonist N-Arachidonoyl-dopamin (NADA) regt CB1- und TRPV-Rezeptoren an und scheint zahlreiche Funktionen zu haben, u.a. im Immunsystem
N-Arachidonoyl-dopamin (NADA) regt CB1- und TRPV-Rezeptoren an und scheint zahlreiche Funktionen zu haben, u.a. im Immunsystem
 Abbildung).
Abbildung).  Die
Wirkungsdauer ist gering: Freigesetzte Cannabinoide verschwinden rasch
wieder aus dem Extrazellulärraum, sie diffundieren (da fettlöslich) in
Zellen (zurück). Beim Abbau spielen Aufnahme in benachbarte Neuronen
(eventuell via spezifische EMT: endocannabinoid membrane transporter) und enzymatischer Abbau (mikrosomale Hydrolase FAAH: fatty acid amide hydrolase, weiters die Lipasen DAGL: diacylglycerol lipase, MAGL: monoacyl glycerol lipase) eine wichtige Rolle.
Die
Wirkungsdauer ist gering: Freigesetzte Cannabinoide verschwinden rasch
wieder aus dem Extrazellulärraum, sie diffundieren (da fettlöslich) in
Zellen (zurück). Beim Abbau spielen Aufnahme in benachbarte Neuronen
(eventuell via spezifische EMT: endocannabinoid membrane transporter) und enzymatischer Abbau (mikrosomale Hydrolase FAAH: fatty acid amide hydrolase, weiters die Lipasen DAGL: diacylglycerol lipase, MAGL: monoacyl glycerol lipase) eine wichtige Rolle.  Verschaltungen
(Opiate sind Alkaloide des Schlafmohns) spielen - neben serotoninergen (5-HT) und noradrenergen (NA) - eine
Hauptrolle bei der zentralen Schmerzmodulation. Sie ermöglichen auch die schmerzstillende Wirkung von Placebos
- Gaben von Naloxon (einem Opioidantagonisten) hemmen den
schmerzlindernden Placebo-Effekt. Menschen, die gut auf Placebo
ansprechen (schmerzstillender Effekt), zeigen eine höhere Aktivierung
(durch Placebo) von Gehirngebieten mit Opioidrezeptoren als
Nonresponder. Die Erwartung eines Effekts durch eine Maßnahme verstärkt deren schmerzstillende Wirkung.
Verschaltungen
(Opiate sind Alkaloide des Schlafmohns) spielen - neben serotoninergen (5-HT) und noradrenergen (NA) - eine
Hauptrolle bei der zentralen Schmerzmodulation. Sie ermöglichen auch die schmerzstillende Wirkung von Placebos
- Gaben von Naloxon (einem Opioidantagonisten) hemmen den
schmerzlindernden Placebo-Effekt. Menschen, die gut auf Placebo
ansprechen (schmerzstillender Effekt), zeigen eine höhere Aktivierung
(durch Placebo) von Gehirngebieten mit Opioidrezeptoren als
Nonresponder. Die Erwartung eines Effekts durch eine Maßnahme verstärkt deren schmerzstillende Wirkung. Die POMC-Gruppe (ß-Endorphin, Endomorphine; präferierter Rezeptor: μ) - Pro-Opio-Melanocortin ist das Propeptid. ß-Endorphin
produzierende Neurone befinden sich vor allem im Hypothalamus, ihre
Axone projizieren auf das zentrale Höhlengrau und auf noradrenerge
Nervenzellen im Hirnstamm.
Die POMC-Gruppe (ß-Endorphin, Endomorphine; präferierter Rezeptor: μ) - Pro-Opio-Melanocortin ist das Propeptid. ß-Endorphin
produzierende Neurone befinden sich vor allem im Hypothalamus, ihre
Axone projizieren auf das zentrale Höhlengrau und auf noradrenerge
Nervenzellen im Hirnstamm. Enkephaline
Enkephaline sind endogene
Pentapeptide, die zur Klasse der Opioidpeptide gehören - definiert als
Bindungspartner von Opioidrezeptoren (präferierter Rezeptor: δ).
Enkephaline werden bei Tätigkeiten wie Joggen, Essen und anderen
Aktivitäten, die ein Belohnungsgefühl erzeugen (z.B. Glücksspiel),
freigesetzt; sie können Euphoriezustände verursachen.
sind endogene
Pentapeptide, die zur Klasse der Opioidpeptide gehören - definiert als
Bindungspartner von Opioidrezeptoren (präferierter Rezeptor: δ).
Enkephaline werden bei Tätigkeiten wie Joggen, Essen und anderen
Aktivitäten, die ein Belohnungsgefühl erzeugen (z.B. Glücksspiel),
freigesetzt; sie können Euphoriezustände verursachen.
 Abbildung: Enkephalinerge Schmerzunterdrückung
Abbildung: Enkephalinerge Schmerzunterdrückung Inhibition der Weiterleitung aus der Peripherie eintreffender Schmerzimpulse auf der Ebene des Rückenmarks
Inhibition der Weiterleitung aus der Peripherie eintreffender Schmerzimpulse auf der Ebene des Rückenmarks Anregung schmerzhemmender Mechanismen durch Nerven im Hirnstamm
(periventrikuläre Kerne, periaquäduktales (zentrales) Höhlengrau,
Raphekerne, Reticulariskerne)
Anregung schmerzhemmender Mechanismen durch Nerven im Hirnstamm
(periventrikuläre Kerne, periaquäduktales (zentrales) Höhlengrau,
Raphekerne, Reticulariskerne)
 Abbildung).
Seine individuelle Beschaffenheit erklärt z.T. die großen
interpersonellen Unterschiede der endogenen Schmerzempfindlichkeit, die
in der ärztlichen Praxis zu beobachten sind. Involviert sind u.a.
Abbildung).
Seine individuelle Beschaffenheit erklärt z.T. die großen
interpersonellen Unterschiede der endogenen Schmerzempfindlichkeit, die
in der ärztlichen Praxis zu beobachten sind. Involviert sind u.a.  periventrikuläre Kerne des
Hypothalamus in der Wand des dritten Ventrikels. Neben anderen
Wirkungen projizieren sie auf enkephalinerge Neuronen des zentralen
Höhlengraus im Mittelhirnbereich;
periventrikuläre Kerne des
Hypothalamus in der Wand des dritten Ventrikels. Neben anderen
Wirkungen projizieren sie auf enkephalinerge Neuronen des zentralen
Höhlengraus im Mittelhirnbereich; diese projizieren auf serotoninerge Neurone im nucleus magnus raphe der
Pons (dieser Raphekern blockiert Schmerzmeldungen im Rückenmark vor
allem in Kombination mit Efferenzen aus dem periaquäduktalen
Höhlengrau);
diese projizieren auf serotoninerge Neurone im nucleus magnus raphe der
Pons (dieser Raphekern blockiert Schmerzmeldungen im Rückenmark vor
allem in Kombination mit Efferenzen aus dem periaquäduktalen
Höhlengrau); zusammen mit Efferenzen aus dem nucleus reticularis
(paragigantocellularis) in Bereich der medulla oblongata projizieren
diese wiederum auf auf enkephalinerge Interneurone auf der Ebene des Rückenmarks, auf die sie anregend wirken;
zusammen mit Efferenzen aus dem nucleus reticularis
(paragigantocellularis) in Bereich der medulla oblongata projizieren
diese wiederum auf auf enkephalinerge Interneurone auf der Ebene des Rückenmarks, auf die sie anregend wirken; Schmerzafferenzen werden von diesen Interneuronen auf der Ebene des
zweiten afferenten Neurons im entsprechenden Rückenmarksegement
inhibiert und damit die anterolaterale Schmerzleitung zum Thalamus
reduziert.
Schmerzafferenzen werden von diesen Interneuronen auf der Ebene des
zweiten afferenten Neurons im entsprechenden Rückenmarksegement
inhibiert und damit die anterolaterale Schmerzleitung zum Thalamus
reduziert.  Dynorphine (Dynorphin
A und B, Neoendorphin) entstehen durch Einwirken eines in
präsynaptischen Vesikeln gespeicherten Enzyms (PC2:
Proprotein-Concertase 2) aus der Vortsufe Prodynorphin und wirken vor allem über κ-Opioidrezeptoren (KOR). Diese
Opioide sind weit im ZNS verbreitet, man findet sie vor allem in
Hypothalamus (hier steuern sie zusammen mit Neurokinin B die pulsatile
Freisetzung von GnRH), Hippocampus, Striatum, Hirnstamm und Rückenmark.
Dynorphine (Dynorphin
A und B, Neoendorphin) entstehen durch Einwirken eines in
präsynaptischen Vesikeln gespeicherten Enzyms (PC2:
Proprotein-Concertase 2) aus der Vortsufe Prodynorphin und wirken vor allem über κ-Opioidrezeptoren (KOR). Diese
Opioide sind weit im ZNS verbreitet, man findet sie vor allem in
Hypothalamus (hier steuern sie zusammen mit Neurokinin B die pulsatile
Freisetzung von GnRH), Hippocampus, Striatum, Hirnstamm und Rückenmark.

 Abbildung: Signalwege von µ-Opioidrezeptoren
Abbildung: Signalwege von µ-Opioidrezeptoren ßarr, Beta-Arrestin, reguliert die Aktivität von G-Protein-gekoppelten Rezeptoren (GPCR)
ßarr, Beta-Arrestin, reguliert die Aktivität von G-Protein-gekoppelten Rezeptoren (GPCR)  Clathrin
Clathrin  Dyn, Dynorphin
Dyn, Dynorphin  ERK, Extracellular-signal Regulated Kinase, vermittelt intrazelluläre Signaltransduktion
ERK, Extracellular-signal Regulated Kinase, vermittelt intrazelluläre Signaltransduktion  JNK, c-Jun N-terminale Kinasen, dienen der Signaltransduktion
JNK, c-Jun N-terminale Kinasen, dienen der Signaltransduktion  PKA, Proteinkinase A (cAMP-abhängig)
PKA, Proteinkinase A (cAMP-abhängig)  PKC, Proteinkinase C
PKC, Proteinkinase C  PLD-2, Phospholipase D2. hydrolysiert Phosphatidylcholin, es entsteht Cholin
PLD-2, Phospholipase D2. hydrolysiert Phosphatidylcholin, es entsteht Cholin Abbildung). Man unterscheidet
Abbildung). Man unterscheidet μ- (μ1 präsynaptisch, μ2 postsynaptisch),
μ- (μ1 präsynaptisch, μ2 postsynaptisch),
 δ- (präsynaptisch),
δ- (präsynaptisch),  κ-, ε- und Orphanin (FQ-) Rezeptoren (die Zuordnung bestimmter Transmitter zu
Rezeptoren ist unscharf).
κ-, ε- und Orphanin (FQ-) Rezeptoren (die Zuordnung bestimmter Transmitter zu
Rezeptoren ist unscharf). 
 Abbildung).
Abbildung). 
 Abbildung: Modifikation afferenter Schmerzinformation
Abbildung: Modifikation afferenter Schmerzinformation
 Zu den Opiaten (Alkaloide des Schlafmohns und direkte Derivate davon) zählt Morphin (Morphium), der wichtigste Bestandteil des Opiums ("Mohnsaft").
Zu den Opiaten (Alkaloide des Schlafmohns und direkte Derivate davon) zählt Morphin (Morphium), der wichtigste Bestandteil des Opiums ("Mohnsaft"). Endogene Opioide (Endorphine) werden u.a. im hypothalamisch-hypophysären System aus Vorläuferproteinen gebildet.
Endogene Opioide (Endorphine) werden u.a. im hypothalamisch-hypophysären System aus Vorläuferproteinen gebildet. Opioidpeptide werden nach ihrer Freisetzung durch zellmembranständige
Enzyme (Enkephalinase) abgebaut. Blockade dieses Enzyms verlängert
die Opioidwirkung und wirkt schmerzreduzierend.
Opioidpeptide werden nach ihrer Freisetzung durch zellmembranständige
Enzyme (Enkephalinase) abgebaut. Blockade dieses Enzyms verlängert
die Opioidwirkung und wirkt schmerzreduzierend.
 Somatischer Oberflächenschmerz (Haut, Schleimhäute), er ortet den Schmerz und löst Vermeidebewegungen aus. Der gut lokalisierbare frühe Schmerz wird als scharf und hell empfunden und über Aδ-Fasern übertragen; der schlecht lokalisierbare späte Schmerz ist dumpf und läuft über C-Fasern
Somatischer Oberflächenschmerz (Haut, Schleimhäute), er ortet den Schmerz und löst Vermeidebewegungen aus. Der gut lokalisierbare frühe Schmerz wird als scharf und hell empfunden und über Aδ-Fasern übertragen; der schlecht lokalisierbare späte Schmerz ist dumpf und läuft über C-Fasern Somatischer Tiefenschmerz (Muskeln:
z.B. Krämpfe, Knochen, Gelenke: z.B. Entzündung, Bindegewebe;
Hirnhäute: Kopfschmerz) wird als dumpf empfunden, ist schlecht
lokalisierbar, strahlt in entfernte Körpergebiete aus. Er bewirkt
Schonung (Motorik) und unterstützt Reparaturvorgänge (Gerinnungs- und
Immunsystem)
Somatischer Tiefenschmerz (Muskeln:
z.B. Krämpfe, Knochen, Gelenke: z.B. Entzündung, Bindegewebe;
Hirnhäute: Kopfschmerz) wird als dumpf empfunden, ist schlecht
lokalisierbar, strahlt in entfernte Körpergebiete aus. Er bewirkt
Schonung (Motorik) und unterstützt Reparaturvorgänge (Gerinnungs- und
Immunsystem) Viszeraler Schmerz ist dumpf, schlecht lokalisierbar und strahlt in die Umgebung aus (vgl. Head'sche Zonen). Er entsteht in Brust, Bauch und Beckenregion durch
starke Dehnung, Kompression, Sauerstoffmangel oder Entzündungen an serösen Häuten, Kapseln, Parenchym und Blutgefäßen. Er löst
autonom-nervöse Reaktionen (Blutdruckschwankungen, Übelkeit u.a.) sowie neuroendokrine Reaktionen aus.
Viszeraler Schmerz ist dumpf, schlecht lokalisierbar und strahlt in die Umgebung aus (vgl. Head'sche Zonen). Er entsteht in Brust, Bauch und Beckenregion durch
starke Dehnung, Kompression, Sauerstoffmangel oder Entzündungen an serösen Häuten, Kapseln, Parenchym und Blutgefäßen. Er löst
autonom-nervöse Reaktionen (Blutdruckschwankungen, Übelkeit u.a.) sowie neuroendokrine Reaktionen aus. Zu übertragenem Schmerz s. oben
Zu übertragenem Schmerz s. oben Nozizeptiven (physiologischen
Nozizeptor-) Schmerz - er meldet potenziell schädigende Reize aus dem
Gewebe (Stich, Quetschung, Verbrennung) und hat eine Warn- und
Lenkfunktion
Nozizeptiven (physiologischen
Nozizeptor-) Schmerz - er meldet potenziell schädigende Reize aus dem
Gewebe (Stich, Quetschung, Verbrennung) und hat eine Warn- und
Lenkfunktion Entzündungsschmerz (pathophysiologischer
Nozizeptorschmerz), vermittelt durch Mediatoren aus verletztem Gewebe
und Immunzellen, diese sensibilisieren nozizeptive Afferenzen und
Rückenmark. Folge ist erhöhte Schmerzempfindlichkeit (Hyperalgesie) und Schmerzempfindlichkeit (Allodynie)
Entzündungsschmerz (pathophysiologischer
Nozizeptorschmerz), vermittelt durch Mediatoren aus verletztem Gewebe
und Immunzellen, diese sensibilisieren nozizeptive Afferenzen und
Rückenmark. Folge ist erhöhte Schmerzempfindlichkeit (Hyperalgesie) und Schmerzempfindlichkeit (Allodynie) Neuropathischen
Schmerz, durch veränderte Schmerzentstehung in entsprechenden
Afferenzen, z.B. nach Traumen (Amputation), Vergiftungen,
Stoffwechselstörung (Diabetes) oder bei Gürtelrose
(Varizella-Zoster-Virus-Reaktivierung)
Neuropathischen
Schmerz, durch veränderte Schmerzentstehung in entsprechenden
Afferenzen, z.B. nach Traumen (Amputation), Vergiftungen,
Stoffwechselstörung (Diabetes) oder bei Gürtelrose
(Varizella-Zoster-Virus-Reaktivierung) Funktionellen Schmerz infolge pathologischer zentraler Schmerzverarbeitung (ohne erkennbare organische Ursache)
Funktionellen Schmerz infolge pathologischer zentraler Schmerzverarbeitung (ohne erkennbare organische Ursache)  akutem
Schmerz (Warnsignal, löst Reflexe aus - Zurückziehen, Flucht,
Ruhigstellung - und endet nach Verschwinden der auslösenden Noxe bzw.
abgeschlossener Wundheilung)
akutem
Schmerz (Warnsignal, löst Reflexe aus - Zurückziehen, Flucht,
Ruhigstellung - und endet nach Verschwinden der auslösenden Noxe bzw.
abgeschlossener Wundheilung) chronischem Schmerz (monatelange Dauer oder periodisches Auftreten, z.B. bei Migräne) durch Schädigung im neuronalen Schmerzsystem ("Schmerzgedächtnis",
z.B. durch erhöhte synaptische Übertragung nozizeptiver Afferenzen,
reduzierte Hemm-Mechanismen) oder Dauerreizung von Nozizeptoren
(Arthrosen, Tumore,..)
chronischem Schmerz (monatelange Dauer oder periodisches Auftreten, z.B. bei Migräne) durch Schädigung im neuronalen Schmerzsystem ("Schmerzgedächtnis",
z.B. durch erhöhte synaptische Übertragung nozizeptiver Afferenzen,
reduzierte Hemm-Mechanismen) oder Dauerreizung von Nozizeptoren
(Arthrosen, Tumore,..)
 Abbildung: Schmerzbahn und Schmerzbearbeitung
Abbildung: Schmerzbahn und Schmerzbearbeitung s. oben)
s. oben)
 reduzierte
Inhibition,
reduzierte
Inhibition,  verstärkte präsynaptische Transmitterfreisetzung und/oder
verstärkte präsynaptische Transmitterfreisetzung und/oder
 postsynaptische Erregbarkeit,
postsynaptische Erregbarkeit,  erhöhte Signalverstärkung von Rezeptor zu
Zellkern (Gentranskription),
erhöhte Signalverstärkung von Rezeptor zu
Zellkern (Gentranskription),  Freisetzung von Neurotransmittern aus
Mikroglia / Astrozyten,
Freisetzung von Neurotransmittern aus
Mikroglia / Astrozyten,  verstärkte Signalübermittlung im Gehirn.
verstärkte Signalübermittlung im Gehirn.
 Schmerzblockade: Die Schmerzentstehung in
nozizeptiven Fasern kann ausgeschaltet werden, indem die Bildung von
Prostaglandinen (PGE2) gehemmt wird - etwa mit nichtsteroidalen
Analgetika wie Acetylsalizylsäure. PGE2 aktiviert Proteinkinase A (PKA) und
diese öffnen TRP-Kanäle, was die Zelle depolarisiert. Opioide hemmen die PKA.
Schmerzblockade: Die Schmerzentstehung in
nozizeptiven Fasern kann ausgeschaltet werden, indem die Bildung von
Prostaglandinen (PGE2) gehemmt wird - etwa mit nichtsteroidalen
Analgetika wie Acetylsalizylsäure. PGE2 aktiviert Proteinkinase A (PKA) und
diese öffnen TRP-Kanäle, was die Zelle depolarisiert. Opioide hemmen die PKA. s. oben) wirkt auch Morphium (=Morphin; Alkaloid
in Rohopium): Es bindet an μ-Rezeptoren und beeinflusst so die zentrale Schmerzleitung in
Hirnstamm und Rückenmark.
s. oben) wirkt auch Morphium (=Morphin; Alkaloid
in Rohopium): Es bindet an μ-Rezeptoren und beeinflusst so die zentrale Schmerzleitung in
Hirnstamm und Rückenmark.

 Viszerale Sensibilität (chemisch, mechanisch, Licht, Schmerz) betrifft
Eingeweide (Kopf, Brust-, Bauch- und Beckenraum: Auge, Herz,
Kreislauf Atmung, Verdauungssystem, Defäkation, Nierenfunktion,
Blasenmotorik, Vegetativum). Etwa 10% der Afferenzen in das Rückenmark
sind viszeraler Natur (N. vagus über 80%), und ~50% der sekundären
spinalen Neurone sprechen auf viszerale Afferenzen an
Viszerale Sensibilität (chemisch, mechanisch, Licht, Schmerz) betrifft
Eingeweide (Kopf, Brust-, Bauch- und Beckenraum: Auge, Herz,
Kreislauf Atmung, Verdauungssystem, Defäkation, Nierenfunktion,
Blasenmotorik, Vegetativum). Etwa 10% der Afferenzen in das Rückenmark
sind viszeraler Natur (N. vagus über 80%), und ~50% der sekundären
spinalen Neurone sprechen auf viszerale Afferenzen an Nozizeptoren sind meist polymodal (mechanisch, thermisch, chemisch) und
adaptieren nicht. Spezielle Ionenkanäle lassen Kationen in nozizeptive
Faserrn einströmen. Schmerzerregende Substanzen sensibilisieren
Nervenendigungen oder depolarisieren sie direkt.Verletzte Zellen setzen
Mediatoren frei, auch nozizeptive Nervenfasern sind parakrin
aktiv (Axonreflex). Aktivierte Schmerzfasern bringen über Substanz P
Mastzellen zur Histaminfreisetzung
Nozizeptoren sind meist polymodal (mechanisch, thermisch, chemisch) und
adaptieren nicht. Spezielle Ionenkanäle lassen Kationen in nozizeptive
Faserrn einströmen. Schmerzerregende Substanzen sensibilisieren
Nervenendigungen oder depolarisieren sie direkt.Verletzte Zellen setzen
Mediatoren frei, auch nozizeptive Nervenfasern sind parakrin
aktiv (Axonreflex). Aktivierte Schmerzfasern bringen über Substanz P
Mastzellen zur Histaminfreisetzung Schmerzmediatoren: Die meisten Mediatorstoffe werden nicht gespeichert,
sondern bei Verletzungsvorgängen neu synthetisiert. Sie wirken über
zwei Wege: Direkte Aktivierung von Nozizeptoren oder Aktivierung von
Immunzellen (Histamin, Serotonin, Eikosanoide, Zytokine), diese
verstärken die Nozizeption. Zu Schmerzmediatoren gehören Histamin
(Degranulierung von Mastzellen,
basophilen und eosinohilen Granulozyten), Kinine, Prostaglandine,
Serotonin, ATP, Substanz P. Aktivierte Schmerzfasern triggern über
Substanz P die Histaminfreisetzung von Mastzellen
Schmerzmediatoren: Die meisten Mediatorstoffe werden nicht gespeichert,
sondern bei Verletzungsvorgängen neu synthetisiert. Sie wirken über
zwei Wege: Direkte Aktivierung von Nozizeptoren oder Aktivierung von
Immunzellen (Histamin, Serotonin, Eikosanoide, Zytokine), diese
verstärken die Nozizeption. Zu Schmerzmediatoren gehören Histamin
(Degranulierung von Mastzellen,
basophilen und eosinohilen Granulozyten), Kinine, Prostaglandine,
Serotonin, ATP, Substanz P. Aktivierte Schmerzfasern triggern über
Substanz P die Histaminfreisetzung von Mastzellen Schmerzrezeptoren: Vertreter der TRP-Familie (transient receptor potential channels)
- Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind
nichtselektive Kationenkanäle. Entzündungsmediatoren wie Prostaglandine
und Bradykinin sensibilisieren sie und aktivieren in gereiztem Gewebe
"schlafende" Schmerzfasern (Hyperalgesie / Allodynie). Metabotrope
Nozizeptoren (Prostaglandine, Bradykinin, Histamin) sensibilisieren
nozizeptive Ionenkanäle
Schmerzrezeptoren: Vertreter der TRP-Familie (transient receptor potential channels)
- Typ A (ankyrin repeats), M (melastatin), V (vanilloid) - sind
nichtselektive Kationenkanäle. Entzündungsmediatoren wie Prostaglandine
und Bradykinin sensibilisieren sie und aktivieren in gereiztem Gewebe
"schlafende" Schmerzfasern (Hyperalgesie / Allodynie). Metabotrope
Nozizeptoren (Prostaglandine, Bradykinin, Histamin) sensibilisieren
nozizeptive Ionenkanäle Schmerzafferenz: Man unterscheidet ”ersten“, schnell geleiteten, gut
lokalisierbaren, rasch abklingenden ”Delta-Schmerz“ (A-δ-Fasern) vom
”zweiten“, schlecht lokalisierbaren, dumpf-brennenden, langsam
abklingenden, quälenden ”C-Schmerz“ (C-Fasern). Nozizeptive Fasern sind
durch Marker identifizierbar: Membranmoleküle (Rezeptoren,
Glykokonjugate), gespeicherte / freigesetzte Peptide, Enzyme.
Schmerzafferenzen bilden oft Kollateralen zu prävertebralen Ganglien
und beeinflussen so motorische, Sekretions- oder endokrine Aktivitäten
der Eingeweide
Schmerzafferenz: Man unterscheidet ”ersten“, schnell geleiteten, gut
lokalisierbaren, rasch abklingenden ”Delta-Schmerz“ (A-δ-Fasern) vom
”zweiten“, schlecht lokalisierbaren, dumpf-brennenden, langsam
abklingenden, quälenden ”C-Schmerz“ (C-Fasern). Nozizeptive Fasern sind
durch Marker identifizierbar: Membranmoleküle (Rezeptoren,
Glykokonjugate), gespeicherte / freigesetzte Peptide, Enzyme.
Schmerzafferenzen bilden oft Kollateralen zu prävertebralen Ganglien
und beeinflussen so motorische, Sekretions- oder endokrine Aktivitäten
der Eingeweide C-Fasern projizieren vor allem auf Lamina I und II (substantia
gelatinosa), Aδ-Fasern auf Lamina I und V des Hinterhorns. Hier liegt
der Angriffspunkt für Schmerzverstärkung: Traumatische Veränderungen
können die synaptische Effizienz steigern. Übertragener Schmerz
entsteht durch Konvergenz somatischer und
viszeraler Afferenzen: Das ZNS ordnet Afferenzen dem Ursprungsbegiet
des betreffenden Nerven zu. Bei projiziertem Schmerz interpretiert das
Gehirn dann z.B. mechanische Reize als schmerzhaft
C-Fasern projizieren vor allem auf Lamina I und II (substantia
gelatinosa), Aδ-Fasern auf Lamina I und V des Hinterhorns. Hier liegt
der Angriffspunkt für Schmerzverstärkung: Traumatische Veränderungen
können die synaptische Effizienz steigern. Übertragener Schmerz
entsteht durch Konvergenz somatischer und
viszeraler Afferenzen: Das ZNS ordnet Afferenzen dem Ursprungsbegiet
des betreffenden Nerven zu. Bei projiziertem Schmerz interpretiert das
Gehirn dann z.B. mechanische Reize als schmerzhaft Der tractus spinothalamicus zieht (nach Seitenkreuzung) zum Hirnstamm,
wo er Kollateralen zu zentralem Höhlengrau und formatio reticularis
bildet (unwillkürliches Schmerzverhalten) und auf den posterolateralen
Thalamus projiziert. Die trigeminothalamische Bahn (Gesicht) kreuzt
nach Umschaltung im spinalen Trigeminuskern die Seite und zieht über
den trigeminalen Lemniscus zum lateralen Thalamus. An der
Schmerzverarbeitung beteiligen sich anschließend somatosernsorischer
Cortex, anteriorer gyrus cinguli, Mandelkerne, Insel, präfrontaler
Cortex
Der tractus spinothalamicus zieht (nach Seitenkreuzung) zum Hirnstamm,
wo er Kollateralen zu zentralem Höhlengrau und formatio reticularis
bildet (unwillkürliches Schmerzverhalten) und auf den posterolateralen
Thalamus projiziert. Die trigeminothalamische Bahn (Gesicht) kreuzt
nach Umschaltung im spinalen Trigeminuskern die Seite und zieht über
den trigeminalen Lemniscus zum lateralen Thalamus. An der
Schmerzverarbeitung beteiligen sich anschließend somatosernsorischer
Cortex, anteriorer gyrus cinguli, Mandelkerne, Insel, präfrontaler
Cortex Hyperalgesie ist eine verstärkte Wahrnehmung von Schmerzreizen - primär
an der Stelle der Verletzung, sekundär in der Umgebung - durch
Sensitivierung zentraler Neuronen. Verschiedene nicht-noxische Reize
können die Schmerzschwelle senken (Allodynie)
Hyperalgesie ist eine verstärkte Wahrnehmung von Schmerzreizen - primär
an der Stelle der Verletzung, sekundär in der Umgebung - durch
Sensitivierung zentraler Neuronen. Verschiedene nicht-noxische Reize
können die Schmerzschwelle senken (Allodynie)  Endogene Schmerzhemmung erfolgt durch ein antinozizeptives System -
durch deszendierende (Frontalhirn und Hypothalamus
serotoninerg zu zentralem Höhlengrau, Raphekernen und tractus
reticulospinalis) oder aszendierende
Schmerzmodifikation. Raphekerne projizieren serotoninerg, der locus
coeruleus noradrenerg auf Hinterhornneurone und hemmen hier die
Schmerzübertragung (Gate-Control). Opioiderge Interneurone der lamina
II hemmen spinothalamische Projektionsneurone
Endogene Schmerzhemmung erfolgt durch ein antinozizeptives System -
durch deszendierende (Frontalhirn und Hypothalamus
serotoninerg zu zentralem Höhlengrau, Raphekernen und tractus
reticulospinalis) oder aszendierende
Schmerzmodifikation. Raphekerne projizieren serotoninerg, der locus
coeruleus noradrenerg auf Hinterhornneurone und hemmen hier die
Schmerzübertragung (Gate-Control). Opioiderge Interneurone der lamina
II hemmen spinothalamische Projektionsneurone Endogene Cannabinoide (körpereigene Lipide) wirken über metabotrope
(heptahelikale) CB1- und CB2- Cannabinoidrezeptoren schmerzmodulierend
(Hippocampus, Kleinhirn, Basalganglien) und beeinflussen Gedächtnis,
Schlaf, Koordinationsvermögen, Stimmung und Appetit. CB1-Rezeptoren
finden sich in Gehirn (präsynaptisch-GABAerg), Rückenmark und
peripheren Nerven, CB2-Rezeptoren im Immunsystem
Endogene Cannabinoide (körpereigene Lipide) wirken über metabotrope
(heptahelikale) CB1- und CB2- Cannabinoidrezeptoren schmerzmodulierend
(Hippocampus, Kleinhirn, Basalganglien) und beeinflussen Gedächtnis,
Schlaf, Koordinationsvermögen, Stimmung und Appetit. CB1-Rezeptoren
finden sich in Gehirn (präsynaptisch-GABAerg), Rückenmark und
peripheren Nerven, CB2-Rezeptoren im Immunsystem Endorphine sind körpereigene Opioidpeptide, sie hemmen glutamaterge
Schmerzprojektionen (vom 1. auf das 2. Schmerzneuron wird im Hinterhorn
mittels Glutamat umgeschaltet). Opioidrezeptoren sind heptahelikal,
wirken über G-Proteine
Endorphine sind körpereigene Opioidpeptide, sie hemmen glutamaterge
Schmerzprojektionen (vom 1. auf das 2. Schmerzneuron wird im Hinterhorn
mittels Glutamat umgeschaltet). Opioidrezeptoren sind heptahelikal,
wirken über G-Proteine