




 Dickdarm, Kontinenz und Defäkation
Dickdarm, Kontinenz und Defäkation
 Bauhin-Klappe: Caspar Bauhin
Bauhin-Klappe: Caspar Bauhin| Der Dickdarm enthält den Großteil der Darmflora. Diese schützt vor mikrobieller Überwucherung des Darms und bildet einige Vitamine (K, B12) und resorbierbare Energieträger. Die Motorik des Colons - tonische Inhibition, Peristaltik (colonic migrating motor complexes) und Antiperistaltik, Massenbewegungen (high-amplitude propagating contractions) - ist komplex gesteuert (mehrfache inhibitorische und exzitatorische Rückkopplungsmechanismen). Sie hat hohe Aufnahmekapazität und transportiert meist langsam, zeigt aber auch kraftvolle Misch- und Transportbewegungen. Segmentations- und Pendelbewegungen sowie reflektorisch (gastro-kolisch, ileo-kolisch) ausgelöste “Massenbewegungen” (3-4 pro Tag) befördern den Coloninhalt ins Rectum - das löst Stuhldrang aus. Die Passagezeit des Chymus im Dickdarm beträgt (soferne keine Diarrhoe auftritt) zwischen 5 und 70 Stunden. Die Resorptionsoberfläche des Colons und Enddarms ist mit ~1 m2 vergleichsweise gering, reicht aber für die Aufnahme von Flüssigkeit, kurzkettigen Fettsäuren (aus dem bakteriellen Metabolismus) und Pharmaka (Suppositorien). Die Resorption von Wasser ist an die Aufnahme von Elektrolyten geknüpft. Na/K-ATPase, Natriumkanäle, Na/H-Austauscher bauen - angeregt u.a. durch Aldosteron - osmotische Gradienten auf und dicken den Stuhl dadurch ein. Die Resorption von Flüssigkeit aus dem Dickdarm unterstützt auch den Kreislauf durch Stabilisierung des Blutvolumens. Das "Kontinenzorgan" am Darmausgang (Analsphincter, Venenpolster) bewirkt Dichtigkeit des Darmausgangs, vor allem durch einen hohen Ruhetonus des glattmuskulären m. sphincter ani internus. Der quergestreifte m. sphincter ani externus ist willkürlich steuerbar. Dehnung des Rectums verringert reflektorisch den Sphinctertonus am Beginn einer Defäkation (Reflexzentrum im Sakralmark, übergeordnete Kontrolle durch das Gehirn). |
 Resorption im Colon
Resorption im Colon  Resorption im Rectum
Resorption im Rectum  Steuerung der Colon-Motorik
Steuerung der Colon-Motorik  Kontinenz
Kontinenz  Defäkation
Defäkation
 Stuhl: Zusammensetzung, Untersuchung
Stuhl: Zusammensetzung, Untersuchung
 Core messages
Core messages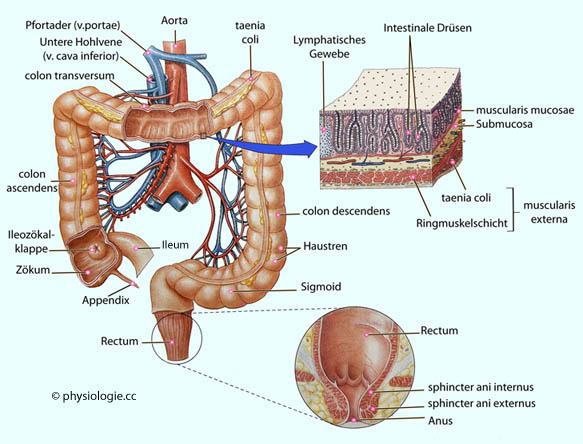
 Abbildung: Struktur des Dickdarns
Abbildung: Struktur des Dickdarns
 , ileocecal sphincter,
, ileocecal sphincter,  Abbildung) vorübergehend
öffnen, um die Passage vom Ileum in das Zökum (Blinddarm) freizugeben.
Sie steht unter der Kontrolle parasympathischer (Vagus),
sympathischer und enterisch-nervöser Einflüsse. Der Lumendruck im
Bereich
der Klappe ist generell höher als
davor oder dahinter (positiver Ruhedruck), ändert sich aber
reflektorisch: Dehnung des Ileum relaxiert, Dehnung im Colon tonisiert
den Sphincter.
Dadurch wird einerseits Darminhalt in den Dickdarm befördert,
endererseits eine retrograde Passage erschwert (
Abbildung) vorübergehend
öffnen, um die Passage vom Ileum in das Zökum (Blinddarm) freizugeben.
Sie steht unter der Kontrolle parasympathischer (Vagus),
sympathischer und enterisch-nervöser Einflüsse. Der Lumendruck im
Bereich
der Klappe ist generell höher als
davor oder dahinter (positiver Ruhedruck), ändert sich aber
reflektorisch: Dehnung des Ileum relaxiert, Dehnung im Colon tonisiert
den Sphincter.
Dadurch wird einerseits Darminhalt in den Dickdarm befördert,
endererseits eine retrograde Passage erschwert ( Abbildung unten).
Abbildung unten).
 Abbildung: Zeitverlauf des intraluminalen Drucks auf der Höhe der Ileozäkalklappe bei Dehnung des Ileum und des Colon
Abbildung: Zeitverlauf des intraluminalen Drucks auf der Höhe der Ileozäkalklappe bei Dehnung des Ileum und des Colon
 Resorption
von Flüssigkeit und Elektrolyten, wodurch auch die Konsistenz des
Stuhls beeinflusst wird. Diese Aufgabe übernimmt vor allem das colon
ascendens und transversum.
Resorption
von Flüssigkeit und Elektrolyten, wodurch auch die Konsistenz des
Stuhls beeinflusst wird. Diese Aufgabe übernimmt vor allem das colon
ascendens und transversum. Resorption kurzkettiger Fettsäuren (SCFAs, short-chain fatty acids), die durch bakterielle Fermentation aus Ballaststoffen gewonnen werden.
Resorption kurzkettiger Fettsäuren (SCFAs, short-chain fatty acids), die durch bakterielle Fermentation aus Ballaststoffen gewonnen werden. Zwischenspeicherung des Dickdarminhalts (Reservoirfunktion), insbesondere im colon descendens und Rectosigmoid.
Zwischenspeicherung des Dickdarminhalts (Reservoirfunktion), insbesondere im colon descendens und Rectosigmoid. Kontrollierte Entleerung des Stuhls (Defäkation).
Kontrollierte Entleerung des Stuhls (Defäkation).
 Abbildung: Wand des Colons
Abbildung: Wand des Colons
 Die Colonschleimhaut resorbiert aus dem Lumen Kochsalz und sezerniert Kaliumbicarbonat (Abbildungen unten). Letzteres dient zur Pufferung von kurzkettigen Fettsäuren
(Acetessigsäure, Buttersäure, Propionsäure), die durch bakteriellen
Abbau von pflanzlichen Faserstoffen entstehen und den Hauptteil der
Anionen im Colon ausmachen.
Die Colonschleimhaut resorbiert aus dem Lumen Kochsalz und sezerniert Kaliumbicarbonat (Abbildungen unten). Letzteres dient zur Pufferung von kurzkettigen Fettsäuren
(Acetessigsäure, Buttersäure, Propionsäure), die durch bakteriellen
Abbau von pflanzlichen Faserstoffen entstehen und den Hauptteil der
Anionen im Colon ausmachen.  Abbildung und
Abbildung und  vgl. dort).
vgl. dort).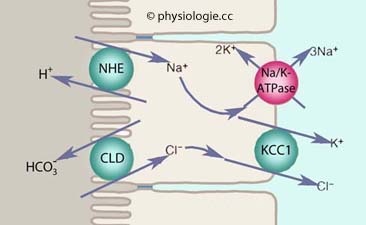
 Abbildung: Elektroneutrale Kochsalzresorption
Abbildung: Elektroneutrale Kochsalzresorption

 Abbildung: Elektrogene Kochsalzresorption im Colon
Abbildung: Elektrogene Kochsalzresorption im Colon Abbildung oben)
Abbildung oben)
 Abbildung), allerdings nur geringgradig - wegen des relativ hohen Widerstandes (im Vergleich zum Dünndarm ist das Schlussleistensystem dichter) wird der transepitheliale Weg bevorzugt (s. oben).
Abbildung), allerdings nur geringgradig - wegen des relativ hohen Widerstandes (im Vergleich zum Dünndarm ist das Schlussleistensystem dichter) wird der transepitheliale Weg bevorzugt (s. oben).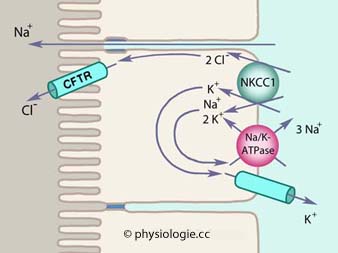
 Abbildung: Chloridsekretion im Darm
Abbildung: Chloridsekretion im Darm
 Aus dem Dickdarm können auch Pharmaka aufgenommen werden, allerdings ist die Resorptionsoberfläche mit ~1 m2 relativ gering (Dünndarm: >100 m2)
und die Füllung kann sehr unterschiedlich, die Dosierung von im Colon applizierten Pharmaka ungenau sein.
Aus dem Dickdarm können auch Pharmaka aufgenommen werden, allerdings ist die Resorptionsoberfläche mit ~1 m2 relativ gering (Dünndarm: >100 m2)
und die Füllung kann sehr unterschiedlich, die Dosierung von im Colon applizierten Pharmaka ungenau sein. 
 Abbildung: Venöse Abflüsse aus dem Rectum
Abbildung: Venöse Abflüsse aus dem Rectum
 hat eine Resorptionsfläche von 400-700 cm2, also 4-7% der Gesamtfläche des Dickdarms.
hat eine Resorptionsfläche von 400-700 cm2, also 4-7% der Gesamtfläche des Dickdarms.  Abbildung).
Abbildung).| Ballaststoffe (dietary fiber) verkürzen die Passagezeit im Dickdarm |
 Peristaltik,
Peristaltik, Haustrierungen (segmentale Bewegungen) - rhythmische Segmentations- und Pendelbewegungen
haben eine Frequenz von ~5/min - und
Haustrierungen (segmentale Bewegungen) - rhythmische Segmentations- und Pendelbewegungen
haben eine Frequenz von ~5/min - und propulsive Massenbewegungen,
bei denen Haustrierungen verschwinden, Tänien erschlaffen und
Darminhalt entlang des erschlafften Colons analwärts gelangt (oft
synchron mit einem gastrokolischen Reflex). Diese Massenbewegungen treten etwa 2-3mal täglich auf.
propulsive Massenbewegungen,
bei denen Haustrierungen verschwinden, Tänien erschlaffen und
Darminhalt entlang des erschlafften Colons analwärts gelangt (oft
synchron mit einem gastrokolischen Reflex). Diese Massenbewegungen treten etwa 2-3mal täglich auf.
 Abbildung: Tonische Inhibition im Dickdarm
Abbildung: Tonische Inhibition im Dickdarm
 Abbildung). Man spricht von einem
"okkulten Reflex" - er hemmt vor allem Neuronen, die in die Peristaltik
bzw. in rhythmische motorische Wellen des Dickdarms (colonic migrating motor complexes, CMMCs) involviert sind.
Abbildung). Man spricht von einem
"okkulten Reflex" - er hemmt vor allem Neuronen, die in die Peristaltik
bzw. in rhythmische motorische Wellen des Dickdarms (colonic migrating motor complexes, CMMCs) involviert sind. 
 Abbildung: Entstehung rhythmischer Transportwellen (CMMCs) im Dickdarm
Abbildung: Entstehung rhythmischer Transportwellen (CMMCs) im Dickdarm
 -
granulierte, gut färbbare neuroendokrine Zellen in der Darmmukosa -
serotoninerg Rezeptoren an intrinsisch primär-afferenten Neuronen (IPANs).
Diese fördern die Erregbarkeit sensorischer Neuronen, was wiederum
Aktivitätsmuster in der Darmmuskulatur triggert. Dabei erfolgt die
Aktivierung der Motorik über mehrere Zwischenstufen, was zahlreiche
Möglichkeiten der Kontrolle und Beeinflussung der Dickdarmmotorik
ergibt (
-
granulierte, gut färbbare neuroendokrine Zellen in der Darmmukosa -
serotoninerg Rezeptoren an intrinsisch primär-afferenten Neuronen (IPANs).
Diese fördern die Erregbarkeit sensorischer Neuronen, was wiederum
Aktivitätsmuster in der Darmmuskulatur triggert. Dabei erfolgt die
Aktivierung der Motorik über mehrere Zwischenstufen, was zahlreiche
Möglichkeiten der Kontrolle und Beeinflussung der Dickdarmmotorik
ergibt ( Abbildung).
Abbildung). (Dichtigkeit) des Darmausgangs wird durch den geknickten Verlauf des
Rectumausgangs (erfolgt funktionell durch die Puborektalis-Muskelschlinge,
welche das Rectum hinten erfasst und nach vorne zum Schambein zieht) sowie einen dreifach geschichteten Verschlussmechanismus
ermöglicht - auch bei körperlicher Aktivität, trotz der dabei
auftretenden Druckspitzen im Bauchraum.
(Dichtigkeit) des Darmausgangs wird durch den geknickten Verlauf des
Rectumausgangs (erfolgt funktionell durch die Puborektalis-Muskelschlinge,
welche das Rectum hinten erfasst und nach vorne zum Schambein zieht) sowie einen dreifach geschichteten Verschlussmechanismus
ermöglicht - auch bei körperlicher Aktivität, trotz der dabei
auftretenden Druckspitzen im Bauchraum.  Das aus einem Venengeflecht bestehende corpus cavernosum recti direkt unter die Schleimhaut des Anus wirkt wie eine abdichtende Manschette. Bei der Defäkation wird es durch die Stuhlpassage vorübergehend ausgepresst.
Das aus einem Venengeflecht bestehende corpus cavernosum recti direkt unter die Schleimhaut des Anus wirkt wie eine abdichtende Manschette. Bei der Defäkation wird es durch die Stuhlpassage vorübergehend ausgepresst. Sympathisch-efferente
Fasern (präganglionär) aus L1-L3 ziehen zum ggl. mesentericum inferius und
von dort (postganglionär) zum glattmuskulären m. sphincter ani internus, den sie zu einem Dauertonus anregen.
Sympathisch-efferente
Fasern (präganglionär) aus L1-L3 ziehen zum ggl. mesentericum inferius und
von dort (postganglionär) zum glattmuskulären m. sphincter ani internus, den sie zu einem Dauertonus anregen.
 Somatisch-efferente Fasern aus dem Sakralmark ziehen über den N. pudendus
Somatisch-efferente Fasern aus dem Sakralmark ziehen über den N. pudendus  zum M. sphincter ani externus, den sie tonisieren (3 in der
zum M. sphincter ani externus, den sie tonisieren (3 in der  Abbildung rechts unten).
Dieser Mechanismus tritt in Gang, wenn das (üblicherweise leere) Rectum
gefüllt wird und unterstützt die Kontinenz des Darmausganges, bis der
Defäkationsreflex freigegeben wird.
Abbildung rechts unten).
Dieser Mechanismus tritt in Gang, wenn das (üblicherweise leere) Rectum
gefüllt wird und unterstützt die Kontinenz des Darmausganges, bis der
Defäkationsreflex freigegeben wird.
 Abbildung: Kontinenzorgan
Abbildung: Kontinenzorgan 
 Abbildung):
Abbildung):  Von außen verschließt
quergestreifte Muskulatur, bestehend aus Puborektalschlinge, musculus
levator ani und dem ringförmigen äußeren Schließmuskel (m. sphincter ani
externus) den Analausgang. Der äußere Schließmuskel wird somatomotorisch durch den
N. pudendus (aus dem Sakralmark,
Von außen verschließt
quergestreifte Muskulatur, bestehend aus Puborektalschlinge, musculus
levator ani und dem ringförmigen äußeren Schließmuskel (m. sphincter ani
externus) den Analausgang. Der äußere Schließmuskel wird somatomotorisch durch den
N. pudendus (aus dem Sakralmark,  Abbildung ganz oben) kontrolliert.
Abbildung ganz oben) kontrolliert.  Als mittlere
Schicht wirkt ein glattmuskulärer Ausläufer der Darmwand mit dem m.
sphincter ani internus
(innerer Schließmuskel). Dieser ist
parasympathisch aus dem Sakralmark, sympathisch aus dem Lendenmark
versorgt. Der Sympathikus unterstützt im Sinne einer Dauertonus (der
nur während der Defäkation unterbrochen ist) die Schließfunktion (α1-adrenerg), der Parasympathikus die Relaxation (cholinerg).
Als mittlere
Schicht wirkt ein glattmuskulärer Ausläufer der Darmwand mit dem m.
sphincter ani internus
(innerer Schließmuskel). Dieser ist
parasympathisch aus dem Sakralmark, sympathisch aus dem Lendenmark
versorgt. Der Sympathikus unterstützt im Sinne einer Dauertonus (der
nur während der Defäkation unterbrochen ist) die Schließfunktion (α1-adrenerg), der Parasympathikus die Relaxation (cholinerg).  Die innere
polsterartige Abdichtung durch die Schleimhaut gewährleistet die volle
Kontinenz. Arterio-venöse Kurzschlussgefäße füllen sich durch
Kontraktion der ableitenden Venen (V. haemorrhoidalis media) mit Blut;
es ergibt sich ein Schwellkörper (corpus cavernosum recti), der den
Analkanal abdichtet.
Die innere
polsterartige Abdichtung durch die Schleimhaut gewährleistet die volle
Kontinenz. Arterio-venöse Kurzschlussgefäße füllen sich durch
Kontraktion der ableitenden Venen (V. haemorrhoidalis media) mit Blut;
es ergibt sich ein Schwellkörper (corpus cavernosum recti), der den
Analkanal abdichtet. 
 Abbildung unten) und dann für einige Zeit auf
einem niedrigenen Plateauwert (<10 mmHg) verbleibt. So wird der
Austritt von Stuhl verhindert (der Muskel bildet einen Verschlussring um das untere Rectum).
Abbildung unten) und dann für einige Zeit auf
einem niedrigenen Plateauwert (<10 mmHg) verbleibt. So wird der
Austritt von Stuhl verhindert (der Muskel bildet einen Verschlussring um das untere Rectum). integriert.
integriert. 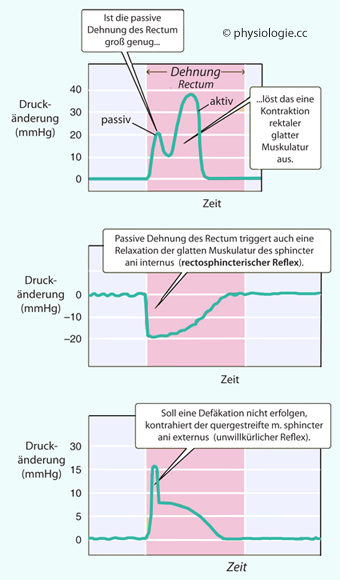
 Abbildung: Zeitverlauf des intraluminalen Drucks auf der Höhe des
inneren und äußeren Analsphincters bei Dehnung des Mastdarms (rectosphincterischer Reflex)
Abbildung: Zeitverlauf des intraluminalen Drucks auf der Höhe des
inneren und äußeren Analsphincters bei Dehnung des Mastdarms (rectosphincterischer Reflex)
 Abbildung); beide Reaktionen (rectosphincterischer Reflex, Stuhldrang, meist ausgelöst durch die Anwesenheit von Stuhl im Rectum) gehen rasch vorüber, denn die Dehnungsrezeptoren adaptieren deutlich. Das Rectum kann beträchtliche Volumina speichern (maximales Volumen ~2 Liter).
Abbildung); beide Reaktionen (rectosphincterischer Reflex, Stuhldrang, meist ausgelöst durch die Anwesenheit von Stuhl im Rectum) gehen rasch vorüber, denn die Dehnungsrezeptoren adaptieren deutlich. Das Rectum kann beträchtliche Volumina speichern (maximales Volumen ~2 Liter). durch kräftige Kontraktionen des Sigmoid (parasympathischer Reflex: Dehnung Rectum → Afferenz zu Sakralmark → parasympathische Efferenz → Tonuszunahme glatte Muskulatur)
durch kräftige Kontraktionen des Sigmoid (parasympathischer Reflex: Dehnung Rectum → Afferenz zu Sakralmark → parasympathische Efferenz → Tonuszunahme glatte Muskulatur)  sowie die Bauchpresse (diese kann Spitzen-Druckwerte von über 60 mmHg erzeugen; Zwerchfell und Bauchdeckenmuskulatur kontrahieren).
sowie die Bauchpresse (diese kann Spitzen-Druckwerte von über 60 mmHg erzeugen; Zwerchfell und Bauchdeckenmuskulatur kontrahieren).| Kontraktionen des colon sigmoideum beteiligen sich an der Defäkation |
 Dehnungsrezeptoren im Rectum stehen am Anfang der dehnungsafferenten Komponente (Fasern im N. splanchnicus - 1 in der
Dehnungsrezeptoren im Rectum stehen am Anfang der dehnungsafferenten Komponente (Fasern im N. splanchnicus - 1 in der  Abbildung)
Abbildung) Reflexzentren gibt es im Rückenmark (parasympathisch-sakral: spinale
Ebene), Hirnstamm und Großhirn (supraspinale
Ebene - entwickelt sich in den ersten Lebensjahren, wobei das Halten
des Stuhls willkürlich kontrollierbar wird)
Reflexzentren gibt es im Rückenmark (parasympathisch-sakral: spinale
Ebene), Hirnstamm und Großhirn (supraspinale
Ebene - entwickelt sich in den ersten Lebensjahren, wobei das Halten
des Stuhls willkürlich kontrollierbar wird) Der parasympathisch-efferente Teil (aus S3, Fasern im N. splanchnicus - 2 in der
Der parasympathisch-efferente Teil (aus S3, Fasern im N. splanchnicus - 2 in der  Abbildung) erreicht intramurale Ganglien; postganglionäre Fasern hemmen den M. sphincter ani internus.
Abbildung) erreicht intramurale Ganglien; postganglionäre Fasern hemmen den M. sphincter ani internus.
 Abbildung: Defäkationsreflex
Abbildung: Defäkationsreflex
 Parasympathische Wirkung auf den gesamten Enddarm: Kontraktion des colon descendens, Sigmoid und Rectums -
cholinerg und purinerg
Parasympathische Wirkung auf den gesamten Enddarm: Kontraktion des colon descendens, Sigmoid und Rectums -
cholinerg und purinerg Relaxation
des Sphincterapparats - Abnahme des adrenergen Einflusses auf den
inneren, und des cholinergen auf den äußeren Sphincter, plus nitriderger Einfluss
Relaxation
des Sphincterapparats - Abnahme des adrenergen Einflusses auf den
inneren, und des cholinergen auf den äußeren Sphincter, plus nitriderger Einfluss Gleichzeitig wird durch Anspannung der Bauchdeckenmuskulatur
und des Zwerchfells der Druck im Abdominalraum erhöht.
Gleichzeitig wird durch Anspannung der Bauchdeckenmuskulatur
und des Zwerchfells der Druck im Abdominalraum erhöht. 

 Abbildung: Stuhlfärbung und ihre Beurteilung
Abbildung: Stuhlfärbung und ihre Beurteilung
 Zur Darmflora s. dort
Zur Darmflora s. dort Zu Darmgasen s. auch dort
Zu Darmgasen s. auch dort
 Abbildung: Physiologische Zusammensetzung des Stuhls
Abbildung: Physiologische Zusammensetzung des Stuhls
 Abbildung), Geruch, Zusammensetzung.
Abbildung), Geruch, Zusammensetzung. und Indol sowie Schwefelverbindungen (H2S, Thiole).
und Indol sowie Schwefelverbindungen (H2S, Thiole). Patienten sollen
nach Operationen oder längerer Bettlägrigkeit nicht unbeaufsichtigt die
Toilette aufsuchen: Betätigung der Bauchpresse kann den Blutrückstrom
aus den Extremitäten zum Herzen so behindern, dass kreislauflabile
Patienten kollabieren (vgl. Valsalva-Versuch).
Patienten sollen
nach Operationen oder längerer Bettlägrigkeit nicht unbeaufsichtigt die
Toilette aufsuchen: Betätigung der Bauchpresse kann den Blutrückstrom
aus den Extremitäten zum Herzen so behindern, dass kreislauflabile
Patienten kollabieren (vgl. Valsalva-Versuch). Erweiterte,
entzündete und thrombosierte Venen bilden Hämorrhoidalknoten, welche
(bei Hämorrhoiden
Erweiterte,
entzündete und thrombosierte Venen bilden Hämorrhoidalknoten, welche
(bei Hämorrhoiden  2. Grades nur beim Pressen, bei solchen 3. Grades
reponierbar, bei solchen 4. Grades nicht reponierbar) nach außen treten
und je nach Schweregrad konservativ bis chirurgisch behandelt werden müssen.
2. Grades nur beim Pressen, bei solchen 3. Grades
reponierbar, bei solchen 4. Grades nicht reponierbar) nach außen treten
und je nach Schweregrad konservativ bis chirurgisch behandelt werden müssen.  Durchfälle können durch bakterielle Toxine verursacht werden, welche
das Gleichgewicht der Ionen- und Wasserbewegung über die Darmwand
zugunsten der Sekretion verschieben (Choleratoxin steigert [cAMP] durch Blockade der G-Protein-Inaktivierung und Daueraktivierung der Adenylatzyklase,
Clostridientoxin steigert [cGMP] in Enterozyten). Eine einfache und wirksame
Therapie ist die orale Rehydration (Trinken von Kochsalz-Glucose-Lösungen).
Durchfälle können durch bakterielle Toxine verursacht werden, welche
das Gleichgewicht der Ionen- und Wasserbewegung über die Darmwand
zugunsten der Sekretion verschieben (Choleratoxin steigert [cAMP] durch Blockade der G-Protein-Inaktivierung und Daueraktivierung der Adenylatzyklase,
Clostridientoxin steigert [cGMP] in Enterozyten). Eine einfache und wirksame
Therapie ist die orale Rehydration (Trinken von Kochsalz-Glucose-Lösungen).

 Die
Ileozäkalklappe hat einen hohen Grundtonus, lässt aber Chymus aus
dem Ileum übertreten, wenn dort der Druck ansteigt; eine retrograde
Passage (Druckanstieg im Colon) verhindert sie reflektorisch. Im
proximalen Dickdarm überwiegt Segmentationsmotorik (12-60 s Dauer, bis
50 mmHg) zur Unterstützung der Resorption von Wasser und Elektrolyten.
1-3mal pro Tag lösen Dehnungsreize in Magen und Dünndarm
Massenbewegungen aus (gastro-kolische und ileo-kolische Reflexe), dabei verschwinden distal des Kontraktionsgürtels Segmentationen
und Haustren. Gesteuert wird die Motorik durch interstitielle (Cajal-)
Zellen, Darmnerven, Nerven des autonomen Systems (Reflexe über
Mesenterialganglien und Rückenmark, deszendierende Einflüsse auf die
Dickdarmmotorik), lokale Wirkstoffe, Hormone (Gastrin und CCK fördern,
Adrenalin hemmt die Motorik im Dickdarm). Die Darmflora
(hunderte Species, 99% anaerob) bewirkt Gärungs- und Fäulnisprozesse, bildet auch Vitamine (z.B. K, B12) Die
Ileozäkalklappe hat einen hohen Grundtonus, lässt aber Chymus aus
dem Ileum übertreten, wenn dort der Druck ansteigt; eine retrograde
Passage (Druckanstieg im Colon) verhindert sie reflektorisch. Im
proximalen Dickdarm überwiegt Segmentationsmotorik (12-60 s Dauer, bis
50 mmHg) zur Unterstützung der Resorption von Wasser und Elektrolyten.
1-3mal pro Tag lösen Dehnungsreize in Magen und Dünndarm
Massenbewegungen aus (gastro-kolische und ileo-kolische Reflexe), dabei verschwinden distal des Kontraktionsgürtels Segmentationen
und Haustren. Gesteuert wird die Motorik durch interstitielle (Cajal-)
Zellen, Darmnerven, Nerven des autonomen Systems (Reflexe über
Mesenterialganglien und Rückenmark, deszendierende Einflüsse auf die
Dickdarmmotorik), lokale Wirkstoffe, Hormone (Gastrin und CCK fördern,
Adrenalin hemmt die Motorik im Dickdarm). Die Darmflora
(hunderte Species, 99% anaerob) bewirkt Gärungs- und Fäulnisprozesse, bildet auch Vitamine (z.B. K, B12) Der Dickdarm resorbiert Wasser, Salze, Fettsäuren, Vitamine. ~1 l/d Wasser gelangt aus dem Ileum in das Colon, davon werden ~90% osmotisch (mit NaCl) rückresorbiert: Die Schleimhaut resorbiert Kochsalz para- und transzellulär (apikal Na+ im Austausch gegen H+, Cl- im Austausch gegen Bicarbonat; basolateral wirken Na/K-ATPase, CFTR, K/Cl-Kotransporter) und sezerniert Kaliumbicarbonat (Pufferung von Fettsäuren). Aldosteron fördert die Na-Resorption. Das
Schlussleistensystem ist im Colon dichter als im Dünndarm, der
Aufbau osmotischer Gradienten ermöglicht die Eindickung des Stuhls. Das
Rectum (4-7% der Gesamtfläche des Dickdarms) kann Arzneimittel resorbieren - zum Teil unter Umgehung des Pfortaderkreislaufs Der Dickdarm resorbiert Wasser, Salze, Fettsäuren, Vitamine. ~1 l/d Wasser gelangt aus dem Ileum in das Colon, davon werden ~90% osmotisch (mit NaCl) rückresorbiert: Die Schleimhaut resorbiert Kochsalz para- und transzellulär (apikal Na+ im Austausch gegen H+, Cl- im Austausch gegen Bicarbonat; basolateral wirken Na/K-ATPase, CFTR, K/Cl-Kotransporter) und sezerniert Kaliumbicarbonat (Pufferung von Fettsäuren). Aldosteron fördert die Na-Resorption. Das
Schlussleistensystem ist im Colon dichter als im Dünndarm, der
Aufbau osmotischer Gradienten ermöglicht die Eindickung des Stuhls. Das
Rectum (4-7% der Gesamtfläche des Dickdarms) kann Arzneimittel resorbieren - zum Teil unter Umgehung des Pfortaderkreislaufs  Die Passagezeit des ~1,5 m langen Dickdarms beträgt ~30 (5 bis 70) Stunden. Motorische Muster sind Peristaltik, Segmentations- und
Pendelbewegungen (~5/min), propulsive Massenbewegungen. SIP ist ein
elektrophysiologisches Synzytium aus glatten Muskelzellen,
interstitiellen (Cajal-) Zellen und PDGFRα+- Zellen und wird durch NO
und Purine aktiviert. Peristaltische Aktivitätswellen des Colon (CMMCs)
haben Transportfunktion. Enterochromaffine
Zellen wirken serotoninerg auf intrinsisch primär-afferente Neuronen
(IPANs), fördern die Erregbarkeit sensorischer Neuronen und aktivieren so die Motorik. Antiperistaltische Wellen dienen der Durchmischung und unterstützen die Resorption. Peristaltik und Massenbewegungen des Colon sind die meiste Zeit unterdrückt (tonische Inhibition) Die Passagezeit des ~1,5 m langen Dickdarms beträgt ~30 (5 bis 70) Stunden. Motorische Muster sind Peristaltik, Segmentations- und
Pendelbewegungen (~5/min), propulsive Massenbewegungen. SIP ist ein
elektrophysiologisches Synzytium aus glatten Muskelzellen,
interstitiellen (Cajal-) Zellen und PDGFRα+- Zellen und wird durch NO
und Purine aktiviert. Peristaltische Aktivitätswellen des Colon (CMMCs)
haben Transportfunktion. Enterochromaffine
Zellen wirken serotoninerg auf intrinsisch primär-afferente Neuronen
(IPANs), fördern die Erregbarkeit sensorischer Neuronen und aktivieren so die Motorik. Antiperistaltische Wellen dienen der Durchmischung und unterstützen die Resorption. Peristaltik und Massenbewegungen des Colon sind die meiste Zeit unterdrückt (tonische Inhibition)  Mehrere Faktoren bedingen die Kontinenz
des Darmausgangs: Geknickter
Verlauf des Rektumausgangs, dreifach geschichteter
Verschlussmechanismus:
Außen
(quergestreift) Puborektalschlinge, musculus levator ani, m.
sphincter ani externus (innerviert durch N. pudendus); in der Mitte
(glattmuskulär) Ausläufer der
Darmwand mit dem m. sphincter ani internus - parasympathisch aus dem
Sakralmark, sympathisch aus dem
Lendenmark (L1-L3) versorgt); innen die vom corpus cavernosum
recti unterfütterte Schleimhaut.
Die Kontinenz ist durch
somatomotorische Tonisierung des äußeren und (vor allem) sympathische (α1-adrenerg) des inneren Schließmuskels gewährleistet Mehrere Faktoren bedingen die Kontinenz
des Darmausgangs: Geknickter
Verlauf des Rektumausgangs, dreifach geschichteter
Verschlussmechanismus:
Außen
(quergestreift) Puborektalschlinge, musculus levator ani, m.
sphincter ani externus (innerviert durch N. pudendus); in der Mitte
(glattmuskulär) Ausläufer der
Darmwand mit dem m. sphincter ani internus - parasympathisch aus dem
Sakralmark, sympathisch aus dem
Lendenmark (L1-L3) versorgt); innen die vom corpus cavernosum
recti unterfütterte Schleimhaut.
Die Kontinenz ist durch
somatomotorische Tonisierung des äußeren und (vor allem) sympathische (α1-adrenerg) des inneren Schließmuskels gewährleistet Gelangt Stuhl in das (meist leere) Rectum, steigt der Druck um ~20 mmHg. Dies löst
Stuhldrang (meist verhindert Kontraktion des äußeren Schließmuskels eine Stuhlentleerung) und einen rectosphincterischen Reflex aus: Beides geht rasch
vorüber, die Dehnungsrezeptoren adaptieren. Das Rectum
kann maximal ~2 Liter Volumen aufnehmen. Ist der Reiz
intensiv genug und unterbleibt eine zentrale Hemmung, steigert der
Defäkationsreflex den rectalen Druck in einer von colon descendens und Sigmoid ausgehenden
Kontraktionswelle (cholinerg / purinerg) auf ~40 mmHg, Zwerchfell und Bauchdeckenmuskulatur kontrahieren (Spitzendruck >60 mmHg), der Darmausgang wird begradigt, die Puborektalschlinge erschlafft, die Tonisierung des äußeren Schließmuskels aufgegeben, Aktivität
von Ästen des Splanchnicusnerven (S2-S4) relaxieren den inneren
Schließmuskel - der Druckgradient steigt, der Fließwiderstand sinkt, Stuhl
wird ausgepresst. Rezeptoren des Anoderm ermöglichen die Wahrnehmung der Stuhlkonsistenz. Bei gefüllter Blase kommt es mit der Defäkation automatisch auch zur Detrusion Gelangt Stuhl in das (meist leere) Rectum, steigt der Druck um ~20 mmHg. Dies löst
Stuhldrang (meist verhindert Kontraktion des äußeren Schließmuskels eine Stuhlentleerung) und einen rectosphincterischen Reflex aus: Beides geht rasch
vorüber, die Dehnungsrezeptoren adaptieren. Das Rectum
kann maximal ~2 Liter Volumen aufnehmen. Ist der Reiz
intensiv genug und unterbleibt eine zentrale Hemmung, steigert der
Defäkationsreflex den rectalen Druck in einer von colon descendens und Sigmoid ausgehenden
Kontraktionswelle (cholinerg / purinerg) auf ~40 mmHg, Zwerchfell und Bauchdeckenmuskulatur kontrahieren (Spitzendruck >60 mmHg), der Darmausgang wird begradigt, die Puborektalschlinge erschlafft, die Tonisierung des äußeren Schließmuskels aufgegeben, Aktivität
von Ästen des Splanchnicusnerven (S2-S4) relaxieren den inneren
Schließmuskel - der Druckgradient steigt, der Fließwiderstand sinkt, Stuhl
wird ausgepresst. Rezeptoren des Anoderm ermöglichen die Wahrnehmung der Stuhlkonsistenz. Bei gefüllter Blase kommt es mit der Defäkation automatisch auch zur Detrusion Stuhl (60-300 ml/d, pH zwischen 6,0 und 7,3, ~360 mOsm, jeweils 8% Nahrungsreste, Bakterien, Schleimhaut) wird mit einem Schleimfilm überzogen ausgeschieden. Seine Braunfärbung ist durch Gallenfarbstoffe (Sterkobilin) bedingt. Kohlenhydratreiche Kost macht ihn weicher, eiweißreiche härter Stuhl (60-300 ml/d, pH zwischen 6,0 und 7,3, ~360 mOsm, jeweils 8% Nahrungsreste, Bakterien, Schleimhaut) wird mit einem Schleimfilm überzogen ausgeschieden. Seine Braunfärbung ist durch Gallenfarbstoffe (Sterkobilin) bedingt. Kohlenhydratreiche Kost macht ihn weicher, eiweißreiche härter |
