




 Kreislaufregulation über Volumina und Elektrolyte
Kreislaufregulation über Volumina und Elektrolyte
 Aszites: ἀσκίτης = Bauchwassersucht
Aszites: ἀσκίτης = Bauchwassersucht| Die Kreislaufregulation ist auf adäquate Füllung des Systems (Blutvolumen) angewiesen - Hypovolämie macht es schwer, physiologische Druckwerte aufrechtzuerhalten, Hypervolämie
überfordert auf Dauer das Herz (soferne es nicht ausreichend zu
adaptiven Veränderungen - Compliance-Erhöhung etc - kommt). Da das Blut
zu mehr als 50% aus
extrazellulärer Flüssigkeit (Blutplasma) besteht, unterliegt
die kardiovaskuläre Volumenregulation dem regulativen Zugriff auf das
extrazelluläre Volumen. Als Sensoren des zentralen "effektiven zirkulierenden Volumens" wirken arterielle (Barorezeptoren in Karotissinus und Aortenbogen) und kardiopulmonale (Volumen-) Rezeptoren (Herzräume, Pulmonalgefäße), sowie die vasa afferentia in der Niere. Osmorezeptoren befinden sich im Hypothalamus, er reguliert über Salzbilanz und Osmolalität extrazelluläres und - indirekt - Blutvolumen. Effektoren umfassen nervöse (Sympathikus) und hormonelle Faktoren (Renin - Angiotensin - Aldosteron, Vasopressin, natriuretische Peptide). Kurzfristig wirken sie auf Wasserbilanz (Durst) und kardiovaskuläres System (Blutdruck), mittelfristig auf die Nierenfunktion (Salz-Wasser-Handling, Harnproduktion). Die tägliche Wasserbilanz nach außen umfasst getrunkene Flüssigkeit einerseits, ausgeschiedene (Harn, Atmung, Haut, Stuhl) andererseits (~2 l/d). Innerhalb des Körpers wird ein Vielfaches davon umgesetzt, allein die Nieren bilden in 24 Stunden 150-200 Liter glomeruläres Filtrat (das zu 99% wieder rückresorbiert wird). |
 Zentrales Volumen
Zentrales Volumen  Flüssigkeits- und Ionenbilanz im Darm
Flüssigkeits- und Ionenbilanz im Darm  Mechanismen der Osmo- und Volumenregulation
Mechanismen der Osmo- und Volumenregulation
 Core messages
Core messages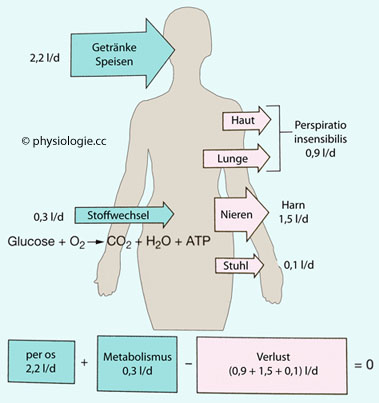
 Abbildung: Wasserbilanz des Körpers
Abbildung: Wasserbilanz des Körpers
Tägliche Wasserzufuhr und -ausscheidung Nach Valtin H: Renal dysfunction: Mechanisms involved in fluid and solute imbalance. Boston, Little, Brown 1979 |
|
| Zufuhr (24 Stunden) |
|
| Quelle |
Volumen (ml) |
| Getränke |
1200 |
| Speisen |
1000 |
| Oxidationswasser (Metabolismus) |
300 |
| Gesamt |
2500 |
| Ausscheidung (24 Stunden) |
|
| Route |
Volumen (ml) |
| Harn |
1500 |
| Stuhl |
100 |
| Schweiß |
550 |
| Atemluft (perspiratio insensibilis) |
350 |
| Gesamt |
2500 |
 vom Gehirn präzise
geregelt ist (~290 mOsm/kg), bestimmt die in der extrazellulären
Flüssigkeit vorhandene Natriummenge auch das extrazelluläre
Flüssigkeitsvolumen - die Volumeneinstellung erfolgt über die
Natriumbilanz.
vom Gehirn präzise
geregelt ist (~290 mOsm/kg), bestimmt die in der extrazellulären
Flüssigkeit vorhandene Natriummenge auch das extrazelluläre
Flüssigkeitsvolumen - die Volumeneinstellung erfolgt über die
Natriumbilanz.  Ödeme, Aszites
Ödeme, Aszites  u.ä. pathologische Flüssigkeitsansammlungen entgehen
diesem Messvorgang und müssen unter Zuhilfenahme u.a. von Diuretika aus dem Körper gebracht
werden.
u.ä. pathologische Flüssigkeitsansammlungen entgehen
diesem Messvorgang und müssen unter Zuhilfenahme u.a. von Diuretika aus dem Körper gebracht
werden. Abbildung zeigt im Gastrointestinaltrakt täglich
umgesetzte Wasservolumina. Pro Tag gelangen im Dünndarm ~7 Liter
Flüssigkeit (oder mehr) zur Resorption, davon stammen 1-2 Liter aus der oralen
Aufnahme (Getränke, Nahrung) und 5-7 Liter von Sekreten (Speichel,
Magensaft, Pankreassekret, Galle, intestinales Sekret).
Abbildung zeigt im Gastrointestinaltrakt täglich
umgesetzte Wasservolumina. Pro Tag gelangen im Dünndarm ~7 Liter
Flüssigkeit (oder mehr) zur Resorption, davon stammen 1-2 Liter aus der oralen
Aufnahme (Getränke, Nahrung) und 5-7 Liter von Sekreten (Speichel,
Magensaft, Pankreassekret, Galle, intestinales Sekret). 
 Abbildung: Wasserbilanz einer erwachsenen Person
Abbildung: Wasserbilanz einer erwachsenen Person vgl. dort
vgl. dort 
 die hohe Kaliumkonzentration im Dickdarm und
die hohe Kaliumkonzentration im Dickdarm und  der hohe Bicarbonatwert im distalen Dünndarm,
der hohe Bicarbonatwert im distalen Dünndarm, Ionale Zusammensetzung Chymusflüssigkeit (mM) Nach Werten in Hilal-Dandan / Brunton, Goodman & Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw Hill Education 2014 |
||||
| |
[Na+] | [K+] | [Cl-] | [HCO3-] |
| Duodenum |
60 |
15 |
60 |
15 |
| Übergang Jejunum - Ileum |
140 |
6 |
100 |
30 |
| Distales Ileum |
140 |
8 |
60 |
70 |
| Rectum |
40 |
90 |
15 |
40 |
 Das
extrazelluläre Volumen (bzw. das "effektive zirkulierende Volumen", ein vage definierter funktioneller Begriff, der das zirkulatorisch wirksame Blutvolumen bedeuten soll) wird über die Kochsalzmenge im Körper reguliert. Besonders bedeutsam für die Langzeitregulation der Natriumausscheidung (Stunden bis Tage) ist dabei der renale Perfusionsdruck bzw. die Durchblutung der vasa afferentia.
Das
extrazelluläre Volumen (bzw. das "effektive zirkulierende Volumen", ein vage definierter funktioneller Begriff, der das zirkulatorisch wirksame Blutvolumen bedeuten soll) wird über die Kochsalzmenge im Körper reguliert. Besonders bedeutsam für die Langzeitregulation der Natriumausscheidung (Stunden bis Tage) ist dabei der renale Perfusionsdruck bzw. die Durchblutung der vasa afferentia. Die Osmolalität - wesentlich für das Funktionieren der Zellen - über den Wassergehalt
des Körpers.
Die Osmolalität - wesentlich für das Funktionieren der Zellen - über den Wassergehalt
des Körpers. | Sensoren |
Arterielle Barorezeptoren Kardiopulmonale Rezeptoren  Vasa afferentia |
hypothalamische Osmorezeptoren |
| Mechanismus |
Renin- Angiotensin- Aldosteron- System  Sympathikus  Vasopressin, natriuretische Peptide |
Adiuretin Durstmechanismus |
| Effektor |
Kurzfristig: Kreislauf Langfristig: Nieren |
Nieren Trinkverhalten |
| Beeinflusste Größe |
Kurzfristig (Sekunden / Minuten): Blutdruck Langfristig (Stunden / Tage): Natriumausscheidung |
Wasserausscheidung (Harn) Wasseraufnahme (Trinken) |
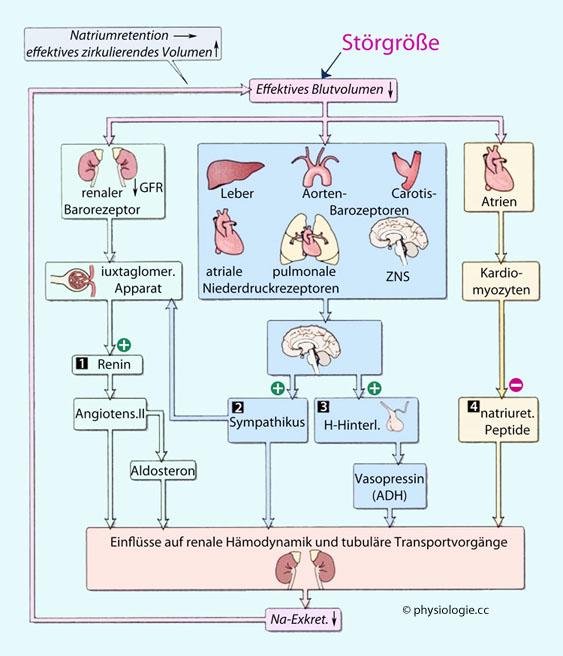
 Abbildung: Feedback-Kontrolle des effektiven zirkulierenden Blutvolumens
Abbildung: Feedback-Kontrolle des effektiven zirkulierenden Blutvolumens
 Anregung des Renin-Angiotensin-Aldosteron-Mechanismus
Anregung des Renin-Angiotensin-Aldosteron-Mechanismus
 Steigerung des Sympathikustonus
Steigerung des Sympathikustonus 
 Freisetzung von Adiuretin
Freisetzung von Adiuretin
 herabgesetzte Freisetzung natriuretischer Peptide
herabgesetzte Freisetzung natriuretischer Peptide Rezeptoren
im Kreislauf (arterielle Barorezeptoren in Aortenbogen und
Karotissinus, Volumenrezeptoren in den Vorhöfen des Herzens und großen
Lungengefäßen), die von hier ausgehende Erregungsgröße
(Aktionspotentialfrequenzen) nimmt bei Volumenreduktion ab und setzt im
nucl. tractus solitarii entsprechende Kompensationen in Gang;
Rezeptoren
im Kreislauf (arterielle Barorezeptoren in Aortenbogen und
Karotissinus, Volumenrezeptoren in den Vorhöfen des Herzens und großen
Lungengefäßen), die von hier ausgehende Erregungsgröße
(Aktionspotentialfrequenzen) nimmt bei Volumenreduktion ab und setzt im
nucl. tractus solitarii entsprechende Kompensationen in Gang; Barorezeptoren in den Nieren, die einen verringerten Perfusionsdruck mit vermehrter Reninausschüttung beantworten;
Barorezeptoren in den Nieren, die einen verringerten Perfusionsdruck mit vermehrter Reninausschüttung beantworten; Rezeptoren in anderen Organen (ZNS, Leber).
Rezeptoren in anderen Organen (ZNS, Leber).


 Signale für die Volumenregulation stammen
von Sensoren im zentralen Niederdruckteil des Kreislaufs
(kardiopulmonale Rezeptoren), sie sprechen auf die Höhe des "effektiven zirkulierenden
Blutvolumens" bzw. deren Änderung an und steuern die Natriumbilanz (Resorption intestinal,
Exkretion renal). Pro Tag werden im Dünndarm ~2 Liter oral aufgenommenes und ~7
Liter sezerniertes Wasser (Speichel, Magensaft, Pankreassekret, Galle,
intestinales Sekret) resorbiert: Das Duodenum passieren ~9 l/d, die Ileozökalklappe ~1,5 l/d, ~0,1
l/d werden mit dem Stuhl ausgeschieden. Der Inhalt des distalen
Dünndarms ist reich an Bicarbonat, der des Colons reich an Kalium Signale für die Volumenregulation stammen
von Sensoren im zentralen Niederdruckteil des Kreislaufs
(kardiopulmonale Rezeptoren), sie sprechen auf die Höhe des "effektiven zirkulierenden
Blutvolumens" bzw. deren Änderung an und steuern die Natriumbilanz (Resorption intestinal,
Exkretion renal). Pro Tag werden im Dünndarm ~2 Liter oral aufgenommenes und ~7
Liter sezerniertes Wasser (Speichel, Magensaft, Pankreassekret, Galle,
intestinales Sekret) resorbiert: Das Duodenum passieren ~9 l/d, die Ileozökalklappe ~1,5 l/d, ~0,1
l/d werden mit dem Stuhl ausgeschieden. Der Inhalt des distalen
Dünndarms ist reich an Bicarbonat, der des Colons reich an Kalium  Volumen und
Osmolarität der extrazellulären Flüssigkeit sind entscheidend für die
Kreislauffunktion. Deren Erfassung dienen periphere und zentrale Rezeptorsysteme:
Arterielle Barorezeptoren, vasa afferentia und kardiopulmonale
Rezeptoren sind drucksensitiv; Osmorezeptoren befinden sich im
Hypothalamus. Durst führt zu Flüssigkeitsaufnahme; Vasopressin
reduziert die Wasserausscheidung, Aldosteron die von Salz; der
Sympathikus wirkt volumenkonservierend Volumen und
Osmolarität der extrazellulären Flüssigkeit sind entscheidend für die
Kreislauffunktion. Deren Erfassung dienen periphere und zentrale Rezeptorsysteme:
Arterielle Barorezeptoren, vasa afferentia und kardiopulmonale
Rezeptoren sind drucksensitiv; Osmorezeptoren befinden sich im
Hypothalamus. Durst führt zu Flüssigkeitsaufnahme; Vasopressin
reduziert die Wasserausscheidung, Aldosteron die von Salz; der
Sympathikus wirkt volumenkonservierend Dehydration ist eine Verringerung, Hyperhydration eine Vermehrung eines Flüssigkeitsvolumens (im Allgemeinen ist der Extrazellulärraum gemeint). Bleibt
die osmotische Konzentration dabei unverändert, spricht man von
isotoner, wenn sie steigt, von hypertoner, wenn sie sinkt, von
hypotoner Störung. Der Austausch von Flüssigkeit über die Kapillaren erfolgt im
Minuten-, der über Zellmembranen im Stundenbereich Dehydration ist eine Verringerung, Hyperhydration eine Vermehrung eines Flüssigkeitsvolumens (im Allgemeinen ist der Extrazellulärraum gemeint). Bleibt
die osmotische Konzentration dabei unverändert, spricht man von
isotoner, wenn sie steigt, von hypertoner, wenn sie sinkt, von
hypotoner Störung. Der Austausch von Flüssigkeit über die Kapillaren erfolgt im
Minuten-, der über Zellmembranen im Stundenbereich |
