




 Mikrozirkulation, Interstitium, Lymphtransport
Mikrozirkulation, Interstitium, Lymphtransport
 Cadherine: nach engl. calcium adhering
Cadherine: nach engl. calcium adhering| Gewebe, Blut- und Lymphgefäße tauschen über Kapillarwände eine als Filtrat bezeichnete Flüssigkeit aus. Druckgradienten (hydrostatisch, osmotisch) treiben diesen Austausch an. Bei normalen kapillären Blutdruckwerten strömt Ultrafiltrat
(das kaum Makromoleküle enthält) aus dem Blut, gelangt in das
Interstitium und über Lymphgefäße zurück in den Kreislauf. Das sorgt für konvektiven Austausch gelöster Stoffe. Die Kräfte, welche die Filtration der Flüssigkeit steuern, sind in der Starling-Filtrationsgleichung definiert. Sie sind einerseits durch den Blut- und Gewebedruck bestimmt (hydrostatisch), andererseits durch unterschiedliche Eiweißkonzentration an der Kapillarwand (kolloidosmotisch). Permeabilität ist die Durchlässigkeit der Kapillarwände, sie ist regional sehr unterschiedlich - je nach Gefäßtyp - und lässt sich über die hydraulische Leitfähigkeit quantifizieren. Der Betrag der Permeabilität für einen Stoff erklärt sich aus den Eigenschaften der Moleküle (Größe, Form, Ladung) und der Gefäßwand. Einige Gebiete der Mikrozirkulation weisen besonders dichte Kapillaren auf. Die Blut-Hirn-Schranke zum Beispiel lässt außer Wasser, Atemgasen und einigen kleineren Molekülen nur an besonderen Stellen (zirkumventrikulären Organen) auch größere Moleküle hindurchtreten. Lipidlösliche Stoffe gelangen leichter durch diese Barrieren. Spezielle Transporter (Carrier) stehen für den Übertritt bestimmter (polarer) Stoffe zur Verfügung. Plasmaproteine gelangen aus dem Interstitium über das Lymphgefäßsystem in den Kreislauf. Die tägliche Lymphproduktion wird bei einer erwachsenen Person auf rund 10 l/d geschätzt und lässt sich durch Anregung der Propulsion (rhythmisch kontrahierende "Lymphherzen", Gefäßklappen) stark (~10-fach) steigern. Funktioniert die physiologische Lymphdrainage nicht (chirurgische Entfernung von Lymphbahnen), dann verursacht die steigende Konzentration an Makromolekülen einen hohen kolloidosmotischen (=onkotischen) Effekt, und Flüssigkeit staut sich im Gewebe zurück (Lymphödem). |
 Starling-Gleichgewicht
Starling-Gleichgewicht  Permeabilität und Endotheltyp
Permeabilität und Endotheltyp  Endothelien: Funktion und Regulation
Endothelien: Funktion und Regulation  Blut-Hirn-, Blut-Liquor-, und arachnoidale Schranke
Blut-Hirn-, Blut-Liquor-, und arachnoidale Schranke  Lymphsystem
Lymphsystem Permeabilität
Permeabilität  Perizyt
Perizyt  Hydraulische Leitfähigkeit
Hydraulische Leitfähigkeit
 Core messages
Core messages Abbildung).
Abbildung).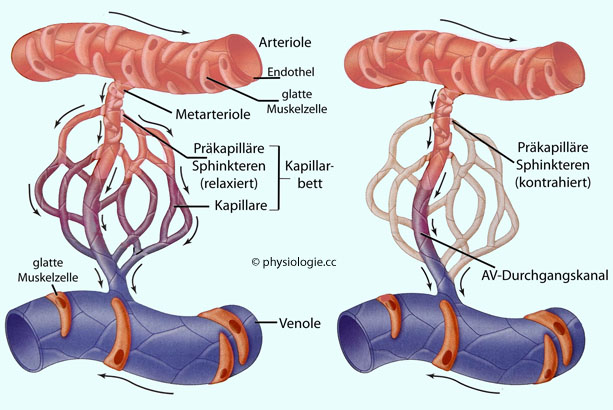
 Abbildung: Mikrozirkulation
Abbildung: Mikrozirkulation liegt zwischen Zellen (Intrazellulärraum) und Gefäßen (Intravasalraum). Es ist ein
"Marktplatz" des Stoffaustausches über die interstitielle Flüssigkeit.
Diese hat eine Zusammensetzung, die bezüglich der Elektrolyte und
kleineren organischen Moleküle, wie z.B. Glucose, sehr ähnliche
Konzentrationswerte aufweist wie das Blutplasma (
liegt zwischen Zellen (Intrazellulärraum) und Gefäßen (Intravasalraum). Es ist ein
"Marktplatz" des Stoffaustausches über die interstitielle Flüssigkeit.
Diese hat eine Zusammensetzung, die bezüglich der Elektrolyte und
kleineren organischen Moleküle, wie z.B. Glucose, sehr ähnliche
Konzentrationswerte aufweist wie das Blutplasma ( s. dort).
s. dort). 
 Abbildung: Organisation der Mikrozirkulation
Abbildung: Organisation der Mikrozirkulation
 durchströmt; ob eine Kapillare offen ist, hängt vom Kontraktionszustand der vorgeschalteten terminalen Arteriole
ab. Beispielsweise ist im ruhenden Skelettmuskel ein Teil der
Kapillaren "geschlossen", da ihre terminale Arteriole kontrahiert ist;
andere sind offen (terminale Arteriole relaxiert), insgesamt oszilliert
das Durchblutungsmuster (heterogene Perfusion
in ruhendem Gewebe). Die einzelnen Arteriolen bleiben nicht lange
kontrahiert oder relaxiert, der Zustand wechselt alle etwa 15 Sekunden (Vasomotion)
- die Intervalle können auch länger (bis zu mehrere Minuten) dauern. Je
mehr Arteriolen dilatieren (bei zunehmender Aktivierung des Muskels),
desto homogener wird die Durchblutung.
durchströmt; ob eine Kapillare offen ist, hängt vom Kontraktionszustand der vorgeschalteten terminalen Arteriole
ab. Beispielsweise ist im ruhenden Skelettmuskel ein Teil der
Kapillaren "geschlossen", da ihre terminale Arteriole kontrahiert ist;
andere sind offen (terminale Arteriole relaxiert), insgesamt oszilliert
das Durchblutungsmuster (heterogene Perfusion
in ruhendem Gewebe). Die einzelnen Arteriolen bleiben nicht lange
kontrahiert oder relaxiert, der Zustand wechselt alle etwa 15 Sekunden (Vasomotion)
- die Intervalle können auch länger (bis zu mehrere Minuten) dauern. Je
mehr Arteriolen dilatieren (bei zunehmender Aktivierung des Muskels),
desto homogener wird die Durchblutung. Über Gewebeversorgung, perikapillären Sauerstoffpartialdruck und Krogh'schen Zylinder s. dort
Über Gewebeversorgung, perikapillären Sauerstoffpartialdruck und Krogh'schen Zylinder s. dort mit 150-200 l/d nicht mitgerechnet) wird großteils
durch Lymphkapillaren aus dem Interstitium abtransportiert
(
mit 150-200 l/d nicht mitgerechnet) wird großteils
durch Lymphkapillaren aus dem Interstitium abtransportiert
(  Abbildung). Dabei werden auch Makromoleküle (vor allem Proteine)
weiterbefördert, um über die großen Lymphgefäße wieder in den
Blutkreislauf zurück zu gelangen. Das interstitielle Flüssigkeitsvolumen
macht ~15% des Körpergewichts aus, bei Entwicklung von Ödemen
Abbildung). Dabei werden auch Makromoleküle (vor allem Proteine)
weiterbefördert, um über die großen Lymphgefäße wieder in den
Blutkreislauf zurück zu gelangen. Das interstitielle Flüssigkeitsvolumen
macht ~15% des Körpergewichts aus, bei Entwicklung von Ödemen
 (=Flüssigkeitsansammlungen im Gewebe) nimmt dieser Prozentsatz zu.
(=Flüssigkeitsansammlungen im Gewebe) nimmt dieser Prozentsatz zu. Über die Zusammensetzung der interstitiellen Flüssigkeit s. dort
Über die Zusammensetzung der interstitiellen Flüssigkeit s. dort Filtrationskoeffizient
Filtrationskoeffizient  Hydrostatischer Druck
Hydrostatischer Druck  Kolloidosmotischer (onkotischer) Druck
Kolloidosmotischer (onkotischer) Druck  Reflexionskoeffizient
Reflexionskoeffizient (vaskulär-endothelial)
an Kontaktstellen benachbarter Endothelzellen (diese haben keine
Desmosomen). Cadherine kommen auch in anderen Geweben vor und weisen
spezifische Expressionsmuster auf.
(vaskulär-endothelial)
an Kontaktstellen benachbarter Endothelzellen (diese haben keine
Desmosomen). Cadherine kommen auch in anderen Geweben vor und weisen
spezifische Expressionsmuster auf. Hydrostatisch (Druck innen minus Druck außen)
und
Hydrostatisch (Druck innen minus Druck außen)
und kolloidosmotisch (Druck außen minus Druck innen; der kolloidosmotische (onkotische
kolloidosmotisch (Druck außen minus Druck innen; der kolloidosmotische (onkotische
 ) Effekt entsteht durch die Strömung kleiner Teilchen (Wasser, Elektrolyte, Glucose,...) durch eine
Dialysemembran (wie die "Glykokalyx-Matte" des Endothels), welche Makromoleküle wie Proteine nicht passieren
lässt. Wie bei der Osmose, strömt das Lösungsmittel (in diesem Fall Ultrafiltrat) auf die Seite der höheren Konzentration der gelösten Moleküle (in diesem Falle Proteine), die nicht durch die (Dialyse-) Membran passieren können.
) Effekt entsteht durch die Strömung kleiner Teilchen (Wasser, Elektrolyte, Glucose,...) durch eine
Dialysemembran (wie die "Glykokalyx-Matte" des Endothels), welche Makromoleküle wie Proteine nicht passieren
lässt. Wie bei der Osmose, strömt das Lösungsmittel (in diesem Fall Ultrafiltrat) auf die Seite der höheren Konzentration der gelösten Moleküle (in diesem Falle Proteine), die nicht durch die (Dialyse-) Membran passieren können. Abbildung) folgt dem effektiven (Netto-) Filtrationsdruck.
Abbildung) folgt dem effektiven (Netto-) Filtrationsdruck.
 Abbildung: Filtrationskräfte (Starling-Gleichgewicht
Abbildung: Filtrationskräfte (Starling-Gleichgewicht  )
)


| Kontraktion postkapillärer Venolen steigert Filtrationsdruck und Auswärtsfiltration |
 In den Kapillaren der Beine kann die Filtrationsfraktion durch mehrstündiges
ruhiges Sitzen ("economy class syndrome") durch Auswärtsfiltration (das Fußvolumen nimmt dabei um ~30 ml/h zu) von wenigen Promille auf bis zu 27% ansteigen (was den Lymphfluss aus den Beinen steigert), der kolloidosmotische
Druck im Blut der Beinvenen kann von 25 auf bis zu ~45 mmHg fast
verdoppelt werden; der
kolloidosmotische Druck des Blutplasmas im gesamten Kreislauf steigt dabei um bis zu 20% (von 25 auf ~30 mmHg)
In den Kapillaren der Beine kann die Filtrationsfraktion durch mehrstündiges
ruhiges Sitzen ("economy class syndrome") durch Auswärtsfiltration (das Fußvolumen nimmt dabei um ~30 ml/h zu) von wenigen Promille auf bis zu 27% ansteigen (was den Lymphfluss aus den Beinen steigert), der kolloidosmotische
Druck im Blut der Beinvenen kann von 25 auf bis zu ~45 mmHg fast
verdoppelt werden; der
kolloidosmotische Druck des Blutplasmas im gesamten Kreislauf steigt dabei um bis zu 20% (von 25 auf ~30 mmHg)  In den vasa recta der Nierentubuli
ist der Betrag des kolloidosmotischen Drucks aufgrund der
vorausgegangenen intensiven glomerulären Filtration ~40 mmHg. Das
ergibt eine starke absorptive Kraft für die Rückresorption von
Flüssigkeit in die Gefäße
In den vasa recta der Nierentubuli
ist der Betrag des kolloidosmotischen Drucks aufgrund der
vorausgegangenen intensiven glomerulären Filtration ~40 mmHg. Das
ergibt eine starke absorptive Kraft für die Rückresorption von
Flüssigkeit in die Gefäße Im
Lungengewebe herrscht ein hoher (16-20 mmHg) kolloidosmotischer Druck
(Proteinkonzentration ~70% derjeniger im Blutplasma); die kapilläre
Filtration ist dadurch minimiert.
Im
Lungengewebe herrscht ein hoher (16-20 mmHg) kolloidosmotischer Druck
(Proteinkonzentration ~70% derjeniger im Blutplasma); die kapilläre
Filtration ist dadurch minimiert.
 Abbildung: Reflexionskoeffizient
Abbildung: Reflexionskoeffizient
 Einerseits (Js) dem Transport von Proteinmolekülen durch die Kapillarwand (transendothelialer Caveola-Vesikel-Mechanismus, s. unten und
Einerseits (Js) dem Transport von Proteinmolekülen durch die Kapillarwand (transendothelialer Caveola-Vesikel-Mechanismus, s. unten und  Abbildung),
Abbildung),
 Abbildung: Kapillarwand
Abbildung: Kapillarwand
 andererseits (Jv) der Strömung von Wasser aus der Kapillare (Auswärtsfiltration); es gilt die interstitielle Verdünnungsgleichung:
andererseits (Jv) der Strömung von Wasser aus der Kapillare (Auswärtsfiltration); es gilt die interstitielle Verdünnungsgleichung: Abbildung).
Abbildung). Die Permeabilität einer Gefäßwand ist definiert als die Diffusion eines Stoffes pro
Membranfläche pro Konzentrationsunterschied dieses Stoffes (analog zum
Fick'schen Diffusionsgesetz). Sie hat die Dimension einer Geschwindigkeit (z.B. 10-6cm/s, Tabelle):
Die Permeabilität einer Gefäßwand ist definiert als die Diffusion eines Stoffes pro
Membranfläche pro Konzentrationsunterschied dieses Stoffes (analog zum
Fick'schen Diffusionsgesetz). Sie hat die Dimension einer Geschwindigkeit (z.B. 10-6cm/s, Tabelle):  Kapillarpermeabilität für gelöste Stoffe  Modifiziert nach Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018 |
|||||
| Substanz |
Masse (Da) |
Diffusions- koeffizient (10-5cm2/s) |
Stokes- Einstein- Radius * (nm) |
Kapillartyp |
Permeabilität (10-6cm/s) |
| O2 |
32 |
2,11 |
0,16 |
kontinuierlich |
105 |
| Harnstoff |
60 |
1,90 |
0,26 |
kontinuierlich | 26-28 |
| Glucose |
180 |
0,91 |
0,36 |
kontinuierlich | 9-13 |
| Saccharose |
342 |
0,72 |
0,47 |
kontinuierlich | 6-9 |
| zerebral |
0,1 |
||||
| fenestriert |
>270 |
||||
| Albumin |
69.103 |
0,085 |
3,55 |
kontinuierlich | 0,03-0,01 |
| fenestriert |
0,04 |
||||
 Abbildung):
Abbildung):
 Abbildung: Der parazelluläre Weg: Kapilläre Gefäßwandstruktur
Abbildung: Der parazelluläre Weg: Kapilläre Gefäßwandstruktur
 Der parazelluläre
Weg zwischen den Endothelzellen steht hydrophilen Molekülen offen; die
vorhandene Austauschfläche
ist allerdings gering: Unterbrechungen der tight-junction-Leisten
gestatten den Stoffaustausch durch ein System gegeneinander versetzter
Spalträume. Diese Spalten machen 0,2-0,4% der gesamten
Kapillaroberfläche aus.
Der parazelluläre
Weg zwischen den Endothelzellen steht hydrophilen Molekülen offen; die
vorhandene Austauschfläche
ist allerdings gering: Unterbrechungen der tight-junction-Leisten
gestatten den Stoffaustausch durch ein System gegeneinander versetzter
Spalträume. Diese Spalten machen 0,2-0,4% der gesamten
Kapillaroberfläche aus.  Occludin und Claudin (Bestandteile von tight junctions),
Occludin und Claudin (Bestandteile von tight junctions), E-Cadherin (stabilisiert Kontakte zwischen Endothelzellen),
E-Cadherin (stabilisiert Kontakte zwischen Endothelzellen),
 Zonula-occludens-Protein (ZO-1),
Zonula-occludens-Protein (ZO-1),  Junctional adhesion molecule (JAM-1),
Junctional adhesion molecule (JAM-1),
 Catenine (Schaltstellen zwischen Cadherinen und Aktinfilamenten),
Catenine (Schaltstellen zwischen Cadherinen und Aktinfilamenten),  Actinin (notwendig für die Anheftung von Aktinfilamenten)
Actinin (notwendig für die Anheftung von Aktinfilamenten) Abbildung), zwischen denen sich Wasser- und wasserlösliche
Moleküle slalomartig hindurchdrängen und so zwischen Blut und
Interstitium wechseln können. Die interzellulären Kontaktproteine -
Claudin, Occludin, JAM an tight junctions einerseits, Cadherine (die
durch Ca++ stabilisiert werden) und Catenine andererseits - sind über α-Actinin mit Aktinfilamenten in der Zelle verknüpft.
Abbildung), zwischen denen sich Wasser- und wasserlösliche
Moleküle slalomartig hindurchdrängen und so zwischen Blut und
Interstitium wechseln können. Die interzellulären Kontaktproteine -
Claudin, Occludin, JAM an tight junctions einerseits, Cadherine (die
durch Ca++ stabilisiert werden) und Catenine andererseits - sind über α-Actinin mit Aktinfilamenten in der Zelle verknüpft. Für den Transport durch
die Endothelzellen müssen hauptsächlich transmembranale Möglichkeiten genutzt werden
(Vorteil: große Membranfläche): Die Zellmembran ist für lipophile
(Lösung in der Membran) oder auch sehr kleine hydrophile Moleküle relativ leicht permeabel (Membranporen: ~0,3 nm Durchmesser, das funktioniert z.B. für Harnstoff mit 0,2 nm, aber nicht mehr z.B.
für Zucker- oder Aminosäuremoleküle); größere polare Stoffe sind auf
die zahlreichen "Kanäle", Transporter und "Pumpen" angewiesen, um durch
die Membranbarriere zu gelangen.
Für den Transport durch
die Endothelzellen müssen hauptsächlich transmembranale Möglichkeiten genutzt werden
(Vorteil: große Membranfläche): Die Zellmembran ist für lipophile
(Lösung in der Membran) oder auch sehr kleine hydrophile Moleküle relativ leicht permeabel (Membranporen: ~0,3 nm Durchmesser, das funktioniert z.B. für Harnstoff mit 0,2 nm, aber nicht mehr z.B.
für Zucker- oder Aminosäuremoleküle); größere polare Stoffe sind auf
die zahlreichen "Kanäle", Transporter und "Pumpen" angewiesen, um durch
die Membranbarriere zu gelangen. 
 Abbildung: Kapillartypen
Abbildung: Kapillartypen
 Eine
weitere Möglichkeit ist die des "Shuttling"
durch die Zelle mittels
rezeptor-mediierter Endozytose und anschließender Exozytose am anderen
Zellpol (Transzytose). Auf diese Weise können z.B. Lipoproteine oder Transferrin aus
dem Blut in das Interstitium gelangen (
Eine
weitere Möglichkeit ist die des "Shuttling"
durch die Zelle mittels
rezeptor-mediierter Endozytose und anschließender Exozytose am anderen
Zellpol (Transzytose). Auf diese Weise können z.B. Lipoproteine oder Transferrin aus
dem Blut in das Interstitium gelangen (  Abbildung). Dabei bilden
sich gelegentlich auch durchgehende "Passagetunnel" (transendotheliale Kanäle) durch transientes
Konfluieren mehrerer Caveolae bzw. Vesikel. Die als Caveolae
bezeichneten Einstülpungen der Zellmembran sind auf der
zytoplasmatischen Seite mit Caveolin bedeckt und tragen Rezeptoren für
Albumin, Transferrin, Coeruloplasmin, Insulin.
Abbildung). Dabei bilden
sich gelegentlich auch durchgehende "Passagetunnel" (transendotheliale Kanäle) durch transientes
Konfluieren mehrerer Caveolae bzw. Vesikel. Die als Caveolae
bezeichneten Einstülpungen der Zellmembran sind auf der
zytoplasmatischen Seite mit Caveolin bedeckt und tragen Rezeptoren für
Albumin, Transferrin, Coeruloplasmin, Insulin.  Abbildung):
Abbildung):
 Kontinuierliche Kapillarwände
- dieser Typus findet sich am häufigsten im Körper (Skelettmuskel,
Herzmuskel, Haut, Lunge, Bindegewebe, Fettgewebe). 1-3 Endothelzellen
bilden den Kapillarquerschnitt, umgeben von einer Basalmembran sowie
fallweise Perizyten, die regulativ tätig und kontraktil sein können.
Die transkapilläre Diffusionsstrecke beträgt ~0,3 µm. Die
Spalten zwischen den
Endothelzellen sind nur 10-15 nm weit, sie lassen wegen der Glykokalyx
(die sich wie eine Matte über die luminale Seite der interzellulären
Spalten legt) nur kleine Moleküle passieren. Das Caveola-Vesikel-System (s. oben und
Kontinuierliche Kapillarwände
- dieser Typus findet sich am häufigsten im Körper (Skelettmuskel,
Herzmuskel, Haut, Lunge, Bindegewebe, Fettgewebe). 1-3 Endothelzellen
bilden den Kapillarquerschnitt, umgeben von einer Basalmembran sowie
fallweise Perizyten, die regulativ tätig und kontraktil sein können.
Die transkapilläre Diffusionsstrecke beträgt ~0,3 µm. Die
Spalten zwischen den
Endothelzellen sind nur 10-15 nm weit, sie lassen wegen der Glykokalyx
(die sich wie eine Matte über die luminale Seite der interzellulären
Spalten legt) nur kleine Moleküle passieren. Das Caveola-Vesikel-System (s. oben und  Abbildung oben) kann auch Makromoleküle transferieren, wenn auch nur vereinzelt: Der Reflexionskoeffizient (σ) beträgt fast 1, der kolloidosmotische Effekt kommt im Starling-Gleichgewicht deutlich zum Ausdruck.
Abbildung oben) kann auch Makromoleküle transferieren, wenn auch nur vereinzelt: Der Reflexionskoeffizient (σ) beträgt fast 1, der kolloidosmotische Effekt kommt im Starling-Gleichgewicht deutlich zum Ausdruck. Perizyten
(Rouget-Zellen) sind komtraktile Bindegewebszellen, die den
Endothelzellen von Blutkapillaren außen anliegen und mit denen sie
durch die Basalmembran hindurch (physikalisch: Cadherin, Connexin, Fibronectin; und parakrin)
kommunizieren. Sie wirken in vielen Organen und Geweben, z.B.
beteiligen sie sich an der Regulierung des kapillären Blutflusses, an
der Angiogenese, an der Synthese von Erythropoetin in der Niere, der Blut-Hirn-Schranke, oder an der Entfernung
(Phagozytose) von Abbauprodukten.
Perizyten
(Rouget-Zellen) sind komtraktile Bindegewebszellen, die den
Endothelzellen von Blutkapillaren außen anliegen und mit denen sie
durch die Basalmembran hindurch (physikalisch: Cadherin, Connexin, Fibronectin; und parakrin)
kommunizieren. Sie wirken in vielen Organen und Geweben, z.B.
beteiligen sie sich an der Regulierung des kapillären Blutflusses, an
der Angiogenese, an der Synthese von Erythropoetin in der Niere, der Blut-Hirn-Schranke, oder an der Entfernung
(Phagozytose) von Abbauprodukten.  Fenestrierte
Kapillarwände haben eine mindestens 10-fach größere Permeabilität für
kleinmolekulare Stoffe als kontinuierliche, der Reflexionskoeffizient (σ) hat einen Betrag deutlich unter 1. Fenestrierte Kapillaren finden sich in der Niere, in exokrinen und endokrinen Drüsen, im Darm (Mukosa), in den plexus chorioidei, Gelenksauskleidungen (Synovia), im Ziliarkörper des Auges. Fenestrierungen (~50-70 nm Durchmesser) erleichtern
den Durchtritt auszutauschender Stoffe, sind aber von einer Glykokalyx-Matte bedeckt (
Fenestrierte
Kapillarwände haben eine mindestens 10-fach größere Permeabilität für
kleinmolekulare Stoffe als kontinuierliche, der Reflexionskoeffizient (σ) hat einen Betrag deutlich unter 1. Fenestrierte Kapillaren finden sich in der Niere, in exokrinen und endokrinen Drüsen, im Darm (Mukosa), in den plexus chorioidei, Gelenksauskleidungen (Synovia), im Ziliarkörper des Auges. Fenestrierungen (~50-70 nm Durchmesser) erleichtern
den Durchtritt auszutauschender Stoffe, sind aber von einer Glykokalyx-Matte bedeckt (  Abbildung). Die Fenster der Glomerulumkapillaren in der
Niere sind offen, andere mit
einer dünnen (4-5 nm), aus Glykoproteinen aufgebauten Membran versehen,
die eine Struktur wie Speichen eines Wagenrades aufweist, zwischen
denen filtrierte Moleküle die Seite wechseln.
Abbildung). Die Fenster der Glomerulumkapillaren in der
Niere sind offen, andere mit
einer dünnen (4-5 nm), aus Glykoproteinen aufgebauten Membran versehen,
die eine Struktur wie Speichen eines Wagenrades aufweist, zwischen
denen filtrierte Moleküle die Seite wechseln. 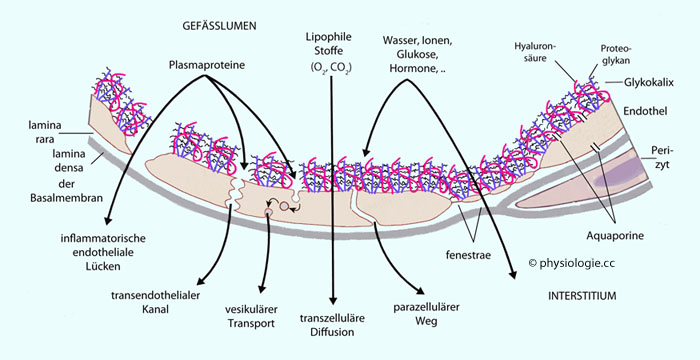
 Abbildung: Transportwege über die Kapillarwand
Abbildung: Transportwege über die Kapillarwand
 Diskontinuierliche
Kapillarwände - hier finden sich neben Fenestrierungen auch große
Spalträume (>100 nm weit) zwischen den Endothelzellen. Die Basalmembran ist nicht
durchgehend; folglich können nicht nur Makromoleküle (Leber), sondern
u.U. auch Blutkörperchen zwischen Intra- und Extravasalraum durchtreten
(Milz). Man spricht von Sinusoiden; die Permeabilität ist extrem hoch, der Betrag des Reflexionskoeffizienten (σ) ist nahe Null.
Diskontinuierliche
Kapillarwände - hier finden sich neben Fenestrierungen auch große
Spalträume (>100 nm weit) zwischen den Endothelzellen. Die Basalmembran ist nicht
durchgehend; folglich können nicht nur Makromoleküle (Leber), sondern
u.U. auch Blutkörperchen zwischen Intra- und Extravasalraum durchtreten
(Milz). Man spricht von Sinusoiden; die Permeabilität ist extrem hoch, der Betrag des Reflexionskoeffizienten (σ) ist nahe Null.  Der kapilläre Austausch kleiner Moleküle erfolgt hauptsächlich durch Diffusion. Alle Teilchen, die sich in der Mikrozirkulation bewegen (Wasser, gelöste Stoffe, Lipide),
können dies - außer durch Strömung mit dem Blut - mittels Diffusion
(Konzentrationsgradienten folgend) oder Filtration (konvektiv) tun. Die
transkapilläre Passage - z.B. von Glucose - erfolgt zum Großteil durch
Diffusion (nicht Filtration) - z.B. im ruhenden Skelettmuskel 98% des
Übertritts von Glucose aus dem Blut in das Gewebe (vs. 2% durch
Konvektion).
Der kapilläre Austausch kleiner Moleküle erfolgt hauptsächlich durch Diffusion. Alle Teilchen, die sich in der Mikrozirkulation bewegen (Wasser, gelöste Stoffe, Lipide),
können dies - außer durch Strömung mit dem Blut - mittels Diffusion
(Konzentrationsgradienten folgend) oder Filtration (konvektiv) tun. Die
transkapilläre Passage - z.B. von Glucose - erfolgt zum Großteil durch
Diffusion (nicht Filtration) - z.B. im ruhenden Skelettmuskel 98% des
Übertritts von Glucose aus dem Blut in das Gewebe (vs. 2% durch
Konvektion).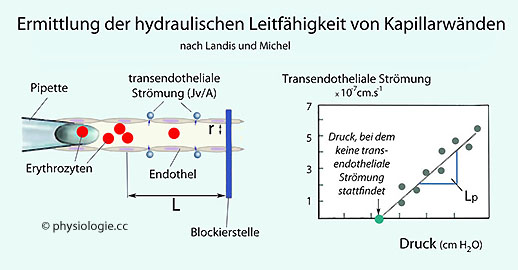
 Abbildung: Ermittlung der Kapillarpermeabilität über die hydraulische Leitfähigkeit (Landis-Michel-Methode)
Abbildung: Ermittlung der Kapillarpermeabilität über die hydraulische Leitfähigkeit (Landis-Michel-Methode)
 Hydraulische Leitfähigkeit (LP) ist eine Proportionalitätskonstante: Sie erlaubt die Berechnung des Netto-Flusses (Jv)
von Wasser durch eine Barriere (z.B. Zellmembran, Kapillarwand) aus dem
von innen (i) nach außen (a) gerichteten hydrostatischen
Druckgradienten (Pi - pa) und dem osmotischen - von außen nach innen gerichteten - osmotischen Gradienten:
Hydraulische Leitfähigkeit (LP) ist eine Proportionalitätskonstante: Sie erlaubt die Berechnung des Netto-Flusses (Jv)
von Wasser durch eine Barriere (z.B. Zellmembran, Kapillarwand) aus dem
von innen (i) nach außen (a) gerichteten hydrostatischen
Druckgradienten (Pi - pa) und dem osmotischen - von außen nach innen gerichteten - osmotischen Gradienten: Bei aufrechter Körperlage ist es vor allem der hydrostatische Druckgradient.
Im Stehen herrschen umso höhere (venöse, arterielle und Kapillar-)
Drucke, je weiter unten sich die Region befindet. Im Kopf finden sich
im venösen und kapillären Bereich einer aufrecht stehenden oder
sitzenden Person teilweise subatmosphärische Druckbeträge; im Berich
der Füße stark positive Beträge (pro Meter Höhenunterschied um 100 cm Wassersäule oder 75 mmHg oder 10 kPa).
Bei aufrechter Körperlage ist es vor allem der hydrostatische Druckgradient.
Im Stehen herrschen umso höhere (venöse, arterielle und Kapillar-)
Drucke, je weiter unten sich die Region befindet. Im Kopf finden sich
im venösen und kapillären Bereich einer aufrecht stehenden oder
sitzenden Person teilweise subatmosphärische Druckbeträge; im Berich
der Füße stark positive Beträge (pro Meter Höhenunterschied um 100 cm Wassersäule oder 75 mmHg oder 10 kPa).  In den Glomerulumkapillaren
der Niere wird ein hoher Blutdruck (um 50 mmHg) eingestellt (Widerstand
der vasa efferentia), dadurch ist der erforderliche hohe Betrag der
glomerulären Filtration sichergestellt.
In den Glomerulumkapillaren
der Niere wird ein hoher Blutdruck (um 50 mmHg) eingestellt (Widerstand
der vasa efferentia), dadurch ist der erforderliche hohe Betrag der
glomerulären Filtration sichergestellt. Leber und Milz liegen etwa auf der Höhe des venösen hydrostatischen Indifferenzpunktes;
Veränderungen der Körperlage bewirken an ihrem anatomischen Ort nur geringe
Druckschwankungen - und damit kaum Filtrationseffekte. Da der Betrag des Reflexionskoeffizienten
in diesen Organen extrem niedrig ist, hängt
das Ausmaß der Filtration so gut wie ausschließlich von hydrostatischen
Filtrationskräften ab - Kolloidosmose spielt hier keine Rolle.
Leber und Milz liegen etwa auf der Höhe des venösen hydrostatischen Indifferenzpunktes;
Veränderungen der Körperlage bewirken an ihrem anatomischen Ort nur geringe
Druckschwankungen - und damit kaum Filtrationseffekte. Da der Betrag des Reflexionskoeffizienten
in diesen Organen extrem niedrig ist, hängt
das Ausmaß der Filtration so gut wie ausschließlich von hydrostatischen
Filtrationskräften ab - Kolloidosmose spielt hier keine Rolle. Eiweißmoleküle wandern kontinuierlich aus dem Plasma ins Gewebe. Das tun sie durch transepithelial-vesikulären Transport (
Eiweißmoleküle wandern kontinuierlich aus dem Plasma ins Gewebe. Das tun sie durch transepithelial-vesikulären Transport ( s. dort),
der langsam aber stetig, parallel zum - und unabhängig vom -
kolloidosmotischen Effekt erfolgt. Kapillaren mit diskontinuierlicher
(offener) Wand, wie in Leber, Milz oder Knochenmark lassen allerdings
freien Durchtritt von Proteinen zu.
s. dort),
der langsam aber stetig, parallel zum - und unabhängig vom -
kolloidosmotischen Effekt erfolgt. Kapillaren mit diskontinuierlicher
(offener) Wand, wie in Leber, Milz oder Knochenmark lassen allerdings
freien Durchtritt von Proteinen zu. Weiters findet je nach Erfordernis ein Austritt von Leukozyten (weißen Blutkörperchen) in das Interstitium statt (Diapedese).
Weiters findet je nach Erfordernis ein Austritt von Leukozyten (weißen Blutkörperchen) in das Interstitium statt (Diapedese).  Expression zahlreicher Moleküle und Einlagerung in die Zellwand (Adhäsionsmoleküle wie E-Selektin, ICAM-1, VCAM-1, Komplementrezeptoren, Toll-like Rezeptoren) zur Interaktion von Endothel und Leukozyten (
Expression zahlreicher Moleküle und Einlagerung in die Zellwand (Adhäsionsmoleküle wie E-Selektin, ICAM-1, VCAM-1, Komplementrezeptoren, Toll-like Rezeptoren) zur Interaktion von Endothel und Leukozyten ( s. u.a. dort)
s. u.a. dort) Transvaskulärer Austausch von Immunglobulinen (insbesondere IgG bei Feten / Neugeborenen)
Transvaskulärer Austausch von Immunglobulinen (insbesondere IgG bei Feten / Neugeborenen) Beteiligung an der angeborenen Immunabwehr (Erkennung von Pathogenen über TLRs)
Beteiligung an der angeborenen Immunabwehr (Erkennung von Pathogenen über TLRs) Antigenpräsentation
Antigenpräsentation Glucosetransport Blut zu je 100g Muskel  Nach Crone C, Levitt DG, in Renkin / Michel (eds): Handbook of Physiology: the Cardiovascular System, Section 2, Vol IV, Microcirculation. American Physiological Society, Bethesda, MD 1984 |
|||
| Ruhe |
Belastung |
Quotient |
|
| Glucoseverbrauch | 1,4 µM/min |
60 µM/min | 43 |
| arterielle Konzentration |
5,0 mM |
5,0 mM |
1 |
| venöse Konzentration |
4,44 mM |
4,0 mM |
0,9 |
| Extraktion |
11,2% |
20% |
1,8 |
| Perfusion |
2,5 ml/min |
60 ml/min |
24 |
| Dichte perfundierter Kapillaren |
250/mm2 |
1000/mm2 | 4 |
| Diffusionskapazität |
5 cm3/min |
20 cm3/min | 4 |
| Konzentrationsdifferenz über Kapillarmembran (Durchschnittswert) |
0,3 mM |
3 mM |
10 |
| Mittlere perikapilläre Konzentration |
4,7 mM |
2 mM |
0,4 |
| Radius des Krogh-Zylinders |
36 µm |
18 µm |
0,5 |
 Endothel wirkt als Trennwand zwischen Thrombozyten und Gerinnungsfaktoren einerseits, subendothelialen prothrombotischen Faktoren (Kollagen und anderen Gewebebestandteilen) andererseits
Endothel wirkt als Trennwand zwischen Thrombozyten und Gerinnungsfaktoren einerseits, subendothelialen prothrombotischen Faktoren (Kollagen und anderen Gewebebestandteilen) andererseits Endothel sezerniert (blutseitig) Heparansulfat, das über Antithrombin
vor Aktivierung von Gerinnungsfaktoren schützt
Endothel sezerniert (blutseitig) Heparansulfat, das über Antithrombin
vor Aktivierung von Gerinnungsfaktoren schützt NO und PGI2 wirken der Aktivierung von Thrombozyzen entgegen, indem sie einem Anstieg der [Ca++] in den Plättchen vorbeugen
NO und PGI2 wirken der Aktivierung von Thrombozyzen entgegen, indem sie einem Anstieg der [Ca++] in den Plättchen vorbeugen Endothelzellen
setzen tPA (Gewebeaktivator des Plasminogens) frei. Dieser aktiviert
Plasmin aus Plasminogen, Plasmin baut allfällig vorhandenes Fibrin ab
Endothelzellen
setzen tPA (Gewebeaktivator des Plasminogens) frei. Dieser aktiviert
Plasmin aus Plasminogen, Plasmin baut allfällig vorhandenes Fibrin ab Endothelzellen exprimieren (blutseitig) CD39, das (plättchenaktivierendes) ADP zu (unwirksamem) AMP abbaut
Endothelzellen exprimieren (blutseitig) CD39, das (plättchenaktivierendes) ADP zu (unwirksamem) AMP abbaut Endothelien exprimieren auch Adhäsionsmoleküle, wie Integrine oder Addressine (MAdCAM-1, mucosal vascular addressin cell adhesion molecule 1), das das lymphozytäre Homing unterstützt
Endothelien exprimieren auch Adhäsionsmoleküle, wie Integrine oder Addressine (MAdCAM-1, mucosal vascular addressin cell adhesion molecule 1), das das lymphozytäre Homing unterstützt Abbildung) werden freigesetzt und
wirken prothrombotisch.
Abbildung) werden freigesetzt und
wirken prothrombotisch. 
 Abbildung: Funktionen des Endothels
Abbildung: Funktionen des Endothels
 Abbildung):
Abbildung): Abbildung), sprechen u.a. calciumsensitive Kaliumkanäle an, was den Kaliumausstrom erhöht und das Endothel hyperpolarisiert. Das erhöht den Gradienten für den Ca++-Einstrom und kann sich über gap junctions
auf umliegende glatte Muskelzellen - im Sinne einer Vasodilatation -
auswirken. Endothelzellen sind mit Kaliumkanälen vom Typ SKCa und IKCa ausgestattet, glatte Gefäßmuskelzellen mit solchen vom Typ BKCa.
Abbildung), sprechen u.a. calciumsensitive Kaliumkanäle an, was den Kaliumausstrom erhöht und das Endothel hyperpolarisiert. Das erhöht den Gradienten für den Ca++-Einstrom und kann sich über gap junctions
auf umliegende glatte Muskelzellen - im Sinne einer Vasodilatation -
auswirken. Endothelzellen sind mit Kaliumkanälen vom Typ SKCa und IKCa ausgestattet, glatte Gefäßmuskelzellen mit solchen vom Typ BKCa. Endotheliales cGMP steigert, cAMP senkt die Kapillarpermeabilität.
Endotheliales cGMP steigert, cAMP senkt die Kapillarpermeabilität.
 Abbildung: Blick auf Endothelzellen von der Fläche (oben) und im Schnittbild (unten)
Abbildung: Blick auf Endothelzellen von der Fläche (oben) und im Schnittbild (unten)
 Abbildung). Die Basalmembran ist eine Stützschicht, sie ist auch für Makromoleküle durchlässig. Vor
allem Kapillaren werden durch sie stabilisiert und widerstehen dem
Blutdruck; die Basalmembran ist sehr dünn, die Wandspannung daher hoch (Laplace-Gesetz).
Abbildung). Die Basalmembran ist eine Stützschicht, sie ist auch für Makromoleküle durchlässig. Vor
allem Kapillaren werden durch sie stabilisiert und widerstehen dem
Blutdruck; die Basalmembran ist sehr dünn, die Wandspannung daher hoch (Laplace-Gesetz).  kontrahierende (vasokonstriktorische) Faktoren (Angiotensin II, auf Thromboxan-Rezeptoren wirkende Prostaglandine, Endotheline) - diese Faktoren wirken auch mitogen auf glatte Gefäßmuskelzellen, andererseits
kontrahierende (vasokonstriktorische) Faktoren (Angiotensin II, auf Thromboxan-Rezeptoren wirkende Prostaglandine, Endotheline) - diese Faktoren wirken auch mitogen auf glatte Gefäßmuskelzellen, andererseits relaxierende (vasodilatatorische) Faktoren (NO, ursprünglich EDRF (endothelium-derived relaxing factor) genannt, Natriuretische Peptide vom C-Typ, Adrenomedullin, Prostazyklin, oder der Endothelium-derived hyperpolarizing factor EDHF) - diese wirken teils auf glatte Muskelzellen in der Gefäßwand,
teils auf Endothelzellen selbst ein. Viele beeinflussen weiters die
Mitosebereitschaft der Gefäßmuskelzellen und spielen damit eine Rolle bei Gefäßaussprossung (Neovaskularisierung) und Wundheilung.
relaxierende (vasodilatatorische) Faktoren (NO, ursprünglich EDRF (endothelium-derived relaxing factor) genannt, Natriuretische Peptide vom C-Typ, Adrenomedullin, Prostazyklin, oder der Endothelium-derived hyperpolarizing factor EDHF) - diese wirken teils auf glatte Muskelzellen in der Gefäßwand,
teils auf Endothelzellen selbst ein. Viele beeinflussen weiters die
Mitosebereitschaft der Gefäßmuskelzellen und spielen damit eine Rolle bei Gefäßaussprossung (Neovaskularisierung) und Wundheilung.Endotheliale vasoaktive Stoffe Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
|
| Dilatatoren |
Konstriktoren |
| NO (Stickstoffmonoxid) |
Endothelin |
| EDHF (endothelialer hyperpolarisierender Faktor) |
EDCF1 (endothelialer konstriktorischer Faktor 1) |
| PGI2 (Prostazyklin) |
EDCF2 (endothelialer konstriktorischer Faktor 2) |
 DAG (Diacylglycerin) - was den Einstrom von extrazellulärem Ca++ über rezeptoraktivierte Kanäle (ROC) anregt - sowie
DAG (Diacylglycerin) - was den Einstrom von extrazellulärem Ca++ über rezeptoraktivierte Kanäle (ROC) anregt - sowie IP3 (Inositoltriphosphat) - dadurch steigt der Zustrom aus im endoplasmatischen Retikulum gespeicherten Ca++ an.
IP3 (Inositoltriphosphat) - dadurch steigt der Zustrom aus im endoplasmatischen Retikulum gespeicherten Ca++ an. Kapillarendothelzellen
Kapillarendothelzellen Astrozytenfortsätze (glia limitans)
Astrozytenfortsätze (glia limitans) Perizyten (perivaskuläre Zellen, die sich
an Immunabwehr und Gefäßintegrität beteiligen)
Perizyten (perivaskuläre Zellen, die sich
an Immunabwehr und Gefäßintegrität beteiligen)  Abbildung), so genannt, weil sie in der Wand der Gehirnventrikel
liegen. Hier hat die perikapilläre Flüssigkeit etwa die Zusammensetzung
eines Ultrafiltrats des Plasmas; ependymale Zellen dichten diese
kleinen Regionen gegen die übrige extrazelluläre Hirnflüssigkeit bzw.
den liquor cerebrospinalis ab.
Abbildung), so genannt, weil sie in der Wand der Gehirnventrikel
liegen. Hier hat die perikapilläre Flüssigkeit etwa die Zusammensetzung
eines Ultrafiltrats des Plasmas; ependymale Zellen dichten diese
kleinen Regionen gegen die übrige extrazelluläre Hirnflüssigkeit bzw.
den liquor cerebrospinalis ab.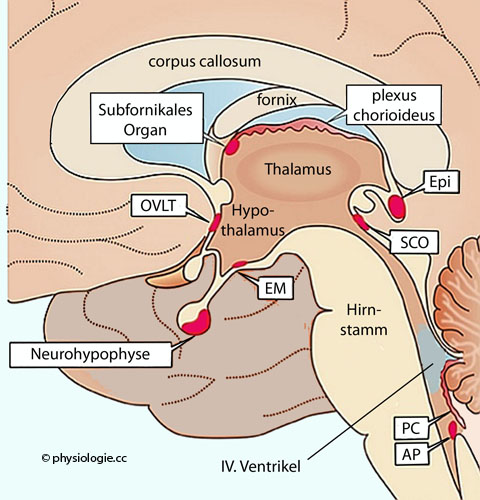
 Abbildung: Zirkumventrikuläre Organe
Abbildung: Zirkumventrikuläre Organe ). PC = plexus chorioideus. Die area postrema (AP) ist ein chemorezeptives Organ am Boden der Rautengrube, nahe dem nucl. tractus solitarii.
). PC = plexus chorioideus. Die area postrema (AP) ist ein chemorezeptives Organ am Boden der Rautengrube, nahe dem nucl. tractus solitarii. (Epi, Zirbeldrüse) stabilisiert photoperiodische Zyklen, sezerniert Melatonin. Das Subkommissuralorgan (SCO) liegt unter der hinteren Kommissur, ist
Teil des Epithalamus (zu dem auch die Zirbeldrüse gehört) und ist
wahrscheinlich für die Liquorströmung (III. zu IV. Ventrikel) bedeutsam
(Epi, Zirbeldrüse) stabilisiert photoperiodische Zyklen, sezerniert Melatonin. Das Subkommissuralorgan (SCO) liegt unter der hinteren Kommissur, ist
Teil des Epithalamus (zu dem auch die Zirbeldrüse gehört) und ist
wahrscheinlich für die Liquorströmung (III. zu IV. Ventrikel) bedeutsam Zum Gehirn als "immunprivilegiertes Organ" s. dort
Zum Gehirn als "immunprivilegiertes Organ" s. dort Zu Neurohypophyse / Hypophysenhinterlappen
Zu Neurohypophyse / Hypophysenhinterlappen  Zu zirkumventrikluären Organen s. auch dort
Zu zirkumventrikluären Organen s. auch dort
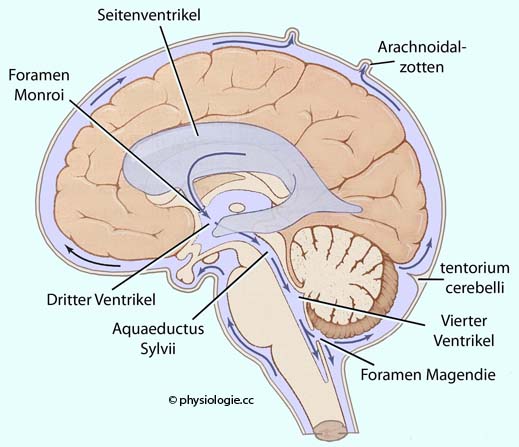
 Abbildung: Kreislauf der Hirn-Rückenmark-Flüssigkeit
Abbildung: Kreislauf der Hirn-Rückenmark-Flüssigkeit
 Die Blut-Liquor-Schranke befindet sich an den plexus chorioidei der Ventrikel. Das Endothel ist hier fenestriert, die Schranke ergibt sich durch tight junctions zwischen Plexuszellen.
Die Blut-Liquor-Schranke befindet sich an den plexus chorioidei der Ventrikel. Das Endothel ist hier fenestriert, die Schranke ergibt sich durch tight junctions zwischen Plexuszellen.  Die arachnoidale Schranke
umhüllt das gesamte Gehirn - an der Innenseite der dura mater,
bestehend aus mehreren Epithelzell-Lagen. Die innerste Schicht verfügt
über tight junctions, hier erfolgt die Abdichtung. Zwar ist diese
Barriere nicht durch Gefäße aufgebaut, aber es stülpen sich villi
arachnoidales in den sinus sagittalis, und liquor fließt hier aus dem
Hirnraum ab.
Die arachnoidale Schranke
umhüllt das gesamte Gehirn - an der Innenseite der dura mater,
bestehend aus mehreren Epithelzell-Lagen. Die innerste Schicht verfügt
über tight junctions, hier erfolgt die Abdichtung. Zwar ist diese
Barriere nicht durch Gefäße aufgebaut, aber es stülpen sich villi
arachnoidales in den sinus sagittalis, und liquor fließt hier aus dem
Hirnraum ab. Zu lymphatischem Gewebe s. auch dort
Zu lymphatischem Gewebe s. auch dort
 lat. lympha = Quellwasser
lat. lympha = Quellwasser
 Abbildung: Lymphtransport
Abbildung: Lymphtransport Ein Anstieg der Flüssigkeitsmenge im Gewebe führt dazu, dass die Strukturelemente des Gewebes auseinanderrücken, was Verankerungsfilamente zwischen Gewebe und Lymphkapillare (grün dargestellt)
anspannt und Spalten zwischen den Lymphendothelzellen öffnet. Obwohl in
diesem Fall der hydrostatische Druck im Interstitium (pi) größer ist als in der Lymphkapillare (pL),
werden die "Klappen" durch den steigenden interstitiellen Druck nicht
zugedrückt, sondern bleiben durch die Filamente aufgespannt und
interstitielle Flüssigkeit fließt in die Lymphkapillaren ab.
Ein Anstieg der Flüssigkeitsmenge im Gewebe führt dazu, dass die Strukturelemente des Gewebes auseinanderrücken, was Verankerungsfilamente zwischen Gewebe und Lymphkapillare (grün dargestellt)
anspannt und Spalten zwischen den Lymphendothelzellen öffnet. Obwohl in
diesem Fall der hydrostatische Druck im Interstitium (pi) größer ist als in der Lymphkapillare (pL),
werden die "Klappen" durch den steigenden interstitiellen Druck nicht
zugedrückt, sondern bleiben durch die Filamente aufgespannt und
interstitielle Flüssigkeit fließt in die Lymphkapillaren ab. Dreht sich der Druckgradient um (pL>pi),
schließen die Klappen druckpassiv, Lymphe fließt Richtung
Lymphherzen weiter. Die Lymphherzen sind ihrerseits mit Eingangs- und
Ausgangsklappen ausgestattet, was nur einen Lymphstrom von der
Peripherie (Gewebe) in Richtung Lymphknoten und Kreislauf zulässt
Dreht sich der Druckgradient um (pL>pi),
schließen die Klappen druckpassiv, Lymphe fließt Richtung
Lymphherzen weiter. Die Lymphherzen sind ihrerseits mit Eingangs- und
Ausgangsklappen ausgestattet, was nur einen Lymphstrom von der
Peripherie (Gewebe) in Richtung Lymphknoten und Kreislauf zulässt
 Abbildung).
Abbildung).
 Abbildung: Schematischer Aufbau eines Lymphknotens
Abbildung: Schematischer Aufbau eines Lymphknotens
 Abbildung) und verläßt das Organ über efferente Lymphgefäße im Bereich des Hilus (der auch Blutgefäße und Nervenfasern führt).
Abbildung) und verläßt das Organ über efferente Lymphgefäße im Bereich des Hilus (der auch Blutgefäße und Nervenfasern führt).
 Abbildung: Blut- und Lymphkreislauf
Abbildung: Blut- und Lymphkreislauf
 (
( Abbildung). Täglich gelangen etwa 200 Gramm
Plasmaeiweiß durch die Kapillarwände ins Gewebe (
Abbildung). Täglich gelangen etwa 200 Gramm
Plasmaeiweiß durch die Kapillarwände ins Gewebe ( vgl. dort) und werden vom
Lymphsystem ins Blut zurückgebracht.
vgl. dort) und werden vom
Lymphsystem ins Blut zurückgebracht. Abbildung).
Abbildung). | Lymphflüssigkeit enthält Gerinnungsfaktoren und kann daher koagulieren |
 .
.
 Abbildung: Extrazellulärer Kreislauf von Flüssigkeit und Protein
Abbildung: Extrazellulärer Kreislauf von Flüssigkeit und Protein
 Abbildung). Meist handelt es sich um sekundäre
Lymphödeme (9 von 10 Fällen), d.h. der Lymphabfluss ist durch eine
Primärerkrankung (Entzündung, Tumor), Bestrahlung oder auf Grund
operativer Entfernung von Lymphknoten behindert.
Abbildung). Meist handelt es sich um sekundäre
Lymphödeme (9 von 10 Fällen), d.h. der Lymphabfluss ist durch eine
Primärerkrankung (Entzündung, Tumor), Bestrahlung oder auf Grund
operativer Entfernung von Lymphknoten behindert. 
 Abbildung: Gesunder vs. lymphödematöser Fuß
Abbildung: Gesunder vs. lymphödematöser Fuß
 Die Mikrozirkulation kann durch äußere mechanische Krafteinwirkung
behindert werden. Längere Druckeinwirkung auf die Haut führt infolge
mangelnder Versorgung mit Sauerstoff und Nährstoffen zu
Gewebeschädigung bis hin zur Geschwürbildung (Wundliegen, Dekubitus
Die Mikrozirkulation kann durch äußere mechanische Krafteinwirkung
behindert werden. Längere Druckeinwirkung auf die Haut führt infolge
mangelnder Versorgung mit Sauerstoff und Nährstoffen zu
Gewebeschädigung bis hin zur Geschwürbildung (Wundliegen, Dekubitus  )
und stellt bei immobilisierten Patienten ein pflegerisches
Problem dar.
)
und stellt bei immobilisierten Patienten ein pflegerisches
Problem dar. 
 Das Interstitium (~15% des Körpergewichts) - zwischen Intrazellulärraum (Zellen) und Intravasalraum (Blutgefäße) gelegen - ist Teil des Extrazellulärraums. Der Hauptbestandteil der interstitiellen Matrix sind Glykosaminoglykane. Die
Konzenrationswerte für Ionen und kleinere organische Moleküle (Glucose,
Laktat...) sind sehr ähnlich wie im Blutplasma, diejenige für größere
(Proteine) liegen darunter (meist 20-70%). Das gilt auch für
Lymphe (=abtransportierte interstitielle Flüssigkeit -
aus den Beinen mit
~25, aus dem Darm
~35, aus der Lunge
~45,
aus der Leber
~60
g/l Protein (Blutplasma ~70 g/l). Proteine im Interstitium verstärken den Filtrationsdruck (Kolloidosmose) Das Interstitium (~15% des Körpergewichts) - zwischen Intrazellulärraum (Zellen) und Intravasalraum (Blutgefäße) gelegen - ist Teil des Extrazellulärraums. Der Hauptbestandteil der interstitiellen Matrix sind Glykosaminoglykane. Die
Konzenrationswerte für Ionen und kleinere organische Moleküle (Glucose,
Laktat...) sind sehr ähnlich wie im Blutplasma, diejenige für größere
(Proteine) liegen darunter (meist 20-70%). Das gilt auch für
Lymphe (=abtransportierte interstitielle Flüssigkeit -
aus den Beinen mit
~25, aus dem Darm
~35, aus der Lunge
~45,
aus der Leber
~60
g/l Protein (Blutplasma ~70 g/l). Proteine im Interstitium verstärken den Filtrationsdruck (Kolloidosmose) Die Kapillaren im Körper (100-300 m2 Austauschfläche, Strömungsgeschwindigkeit ~1 mm/s) sind umso dichter angeordnet, je
stoffwechselintensiver das Gewebe ist (Herzmuskel, graue Substanz im ZNS ~500, Lunge ~3500 cm2 Endotheloberfläche / g Gewebe).
In Ruhe ist die Mehrzahl der Kapillaren nicht
perfundiert (Arteriolen kontrahiert), das Durchblutungsmuster oszilliert alle
~15 Sekunden (Vasomotion, heterogene Perfusion). Mit zunehmender Aktivität nimmt die Zahl durchbluteter Kapillaren zu, die Perfusion wird homogener. Der kapilläre Stoffaustausch erfolgt vorwiegend über Diffusion, nicht Konvektion (Filtration). Extraktion
nennt man den Anteil des aus einer Kapillare entfernten Stoffes;
multipliziert mit der Plasmaströmung ergibt sich die Clearance. Bei
hoher Permeabilität wird die Austauschkapazität rasch erreicht (Äquilibrierung) und die Perfusion ist für den Austausch limitierend; bei geringer Permeabilität bleibt die Äquilibrierung unvollständig und die Diffusion der limitierende Faktor Die Kapillaren im Körper (100-300 m2 Austauschfläche, Strömungsgeschwindigkeit ~1 mm/s) sind umso dichter angeordnet, je
stoffwechselintensiver das Gewebe ist (Herzmuskel, graue Substanz im ZNS ~500, Lunge ~3500 cm2 Endotheloberfläche / g Gewebe).
In Ruhe ist die Mehrzahl der Kapillaren nicht
perfundiert (Arteriolen kontrahiert), das Durchblutungsmuster oszilliert alle
~15 Sekunden (Vasomotion, heterogene Perfusion). Mit zunehmender Aktivität nimmt die Zahl durchbluteter Kapillaren zu, die Perfusion wird homogener. Der kapilläre Stoffaustausch erfolgt vorwiegend über Diffusion, nicht Konvektion (Filtration). Extraktion
nennt man den Anteil des aus einer Kapillare entfernten Stoffes;
multipliziert mit der Plasmaströmung ergibt sich die Clearance. Bei
hoher Permeabilität wird die Austauschkapazität rasch erreicht (Äquilibrierung) und die Perfusion ist für den Austausch limitierend; bei geringer Permeabilität bleibt die Äquilibrierung unvollständig und die Diffusion der limitierende Faktor Filtrationsfraktion ist der filtrierte Anteil des Plasmavolumens - meist <0,3%; in renalen Glomeruli (effektiver Filtrationsdruck
~10 mmHg) 20%. Durch Filtration steigt die
Proteinkonzentration (kolloidosmotischer Effekt 25 → bis ~45 mmHg: renale vasa recta), die Filtration (=effektiver Filtrationsdruck mal Filtrationskoeffizient) nimmt ab. Der effektive Filtrationsdruck bleibt meist im positiven Bereich (Auswärtsfiltration im Körper ~10 l/d; solvent drag nimmt gelöste Stoffe mit). Der präkapilläre Widerstand ist meist ~4-mal höher als der postkapilläre, das steuert den kapillären
Blutdruck. Präkapilläre Kontraktion senkt, postkapilläre steigert die
Filtration Filtrationsfraktion ist der filtrierte Anteil des Plasmavolumens - meist <0,3%; in renalen Glomeruli (effektiver Filtrationsdruck
~10 mmHg) 20%. Durch Filtration steigt die
Proteinkonzentration (kolloidosmotischer Effekt 25 → bis ~45 mmHg: renale vasa recta), die Filtration (=effektiver Filtrationsdruck mal Filtrationskoeffizient) nimmt ab. Der effektive Filtrationsdruck bleibt meist im positiven Bereich (Auswärtsfiltration im Körper ~10 l/d; solvent drag nimmt gelöste Stoffe mit). Der präkapilläre Widerstand ist meist ~4-mal höher als der postkapilläre, das steuert den kapillären
Blutdruck. Präkapilläre Kontraktion senkt, postkapilläre steigert die
Filtration Der kolloidosmotische Effekt (~90% durch Albumin) hängt von der Proteinkonzentration innerhalb
(Plasma) und außerhalb (Interstitium) der Kapillare sowie vom Betrag
des Reflexionskoeffizienten σ ab (für Plasmaproteine bei den meisten Kapillarwänden zwischen 0,8 und 0,95 - ergibt 80-95% des theoretisch erreichbaren Drucks). Ist die Kapillarwand völlig undurchlässig, ist [σ]=1
(alle Teilchen werden reflektiert, kolloidosmotischer Effekt voll
wirksam); ist sie für Eiweiß durchlässig (Milz, Leber), ist [σ]
nahe null (kein kolloidosmotischer Effekt). Die interstitielle
Proteinkonzentration ändert sich mit der Filtration (Auswascheffekt);
ohne Filtration steigt die interstitielle Eiweißkonzentration. Blutverlust verstärkt reflektorisch die Kontraktion
der Arteriolen, der Kapillardruck sinkt so stark, dass interstitielle Flüssigkeit resorbiert wird ("Autotransfusion": Hämatokrit nimmt ab), das Blutvolumen steigt an Der kolloidosmotische Effekt (~90% durch Albumin) hängt von der Proteinkonzentration innerhalb
(Plasma) und außerhalb (Interstitium) der Kapillare sowie vom Betrag
des Reflexionskoeffizienten σ ab (für Plasmaproteine bei den meisten Kapillarwänden zwischen 0,8 und 0,95 - ergibt 80-95% des theoretisch erreichbaren Drucks). Ist die Kapillarwand völlig undurchlässig, ist [σ]=1
(alle Teilchen werden reflektiert, kolloidosmotischer Effekt voll
wirksam); ist sie für Eiweiß durchlässig (Milz, Leber), ist [σ]
nahe null (kein kolloidosmotischer Effekt). Die interstitielle
Proteinkonzentration ändert sich mit der Filtration (Auswascheffekt);
ohne Filtration steigt die interstitielle Eiweißkonzentration. Blutverlust verstärkt reflektorisch die Kontraktion
der Arteriolen, der Kapillardruck sinkt so stark, dass interstitielle Flüssigkeit resorbiert wird ("Autotransfusion": Hämatokrit nimmt ab), das Blutvolumen steigt an Die Anzahl offener Poren (typischerweise ~10%) sowie die Glykokalyx beeinflussen die Permeabilität der Kapillarwände. Proteine können via Transzytose durch Endothelien gelangen. Die Passage erfolgt transzellulär (große Membranfläche, Diffusion / Kanäle / Pumpen) oder parazellulär (<0,4% der Kapillaroberfläche, größer bei diskontinhierlichem Endothel). Kontinuierliche
Kapillarwände
(Skelett- und Herzmuskel, Haut, Lunge, Bindegewebe, Fettgewebe) lassen nur kleine Moleküle
passieren, in Gehirngefäßen bauen
tight junctions eine Blut-Hirn-Schranke auf. Fenestrierte Kapillaren (Poren: ~60 nm Durchmesser - Niere, Drüsen, Darmmukosa, plexus chorioidei, Synovia, Ziliarkörper) haben ≥10-mal größere Permeabilität als kontinuierliche. Bei diskontinuierlichen Kapillaren (Sinusoide; >100
nm weite Spalten) hat auch die Basalmembran Lücken, sie sind sogar für Blutkörperchen offen (Milz) Die Anzahl offener Poren (typischerweise ~10%) sowie die Glykokalyx beeinflussen die Permeabilität der Kapillarwände. Proteine können via Transzytose durch Endothelien gelangen. Die Passage erfolgt transzellulär (große Membranfläche, Diffusion / Kanäle / Pumpen) oder parazellulär (<0,4% der Kapillaroberfläche, größer bei diskontinhierlichem Endothel). Kontinuierliche
Kapillarwände
(Skelett- und Herzmuskel, Haut, Lunge, Bindegewebe, Fettgewebe) lassen nur kleine Moleküle
passieren, in Gehirngefäßen bauen
tight junctions eine Blut-Hirn-Schranke auf. Fenestrierte Kapillaren (Poren: ~60 nm Durchmesser - Niere, Drüsen, Darmmukosa, plexus chorioidei, Synovia, Ziliarkörper) haben ≥10-mal größere Permeabilität als kontinuierliche. Bei diskontinuierlichen Kapillaren (Sinusoide; >100
nm weite Spalten) hat auch die Basalmembran Lücken, sie sind sogar für Blutkörperchen offen (Milz) Der mittlere Kapillardruck hängt ab von Körperlage (je weiter unten, desto höher der Druck: 75mmHg/m), Sympathikustonus, Autoregulation und
metabolischen Faktoren. Ist
der hydrostatische Druck (netto) größer als der (effektive) onkotische,
wandert Flüssigkeit aus der Kapillare in das Gewebe (und wird von
Lymphgefäßen weitertransportiert); überwiegt der Betrag des
kolloidosmotischen Effekts, wird nicht filtriert. Leber und Milz liegen auf der Höhe
des venösen hydrostatischen Indifferenzpunktes, Veränderungen der
Körperlage bewirken hier kaum Filtrationseffekte
Der mittlere Kapillardruck hängt ab von Körperlage (je weiter unten, desto höher der Druck: 75mmHg/m), Sympathikustonus, Autoregulation und
metabolischen Faktoren. Ist
der hydrostatische Druck (netto) größer als der (effektive) onkotische,
wandert Flüssigkeit aus der Kapillare in das Gewebe (und wird von
Lymphgefäßen weitertransportiert); überwiegt der Betrag des
kolloidosmotischen Effekts, wird nicht filtriert. Leber und Milz liegen auf der Höhe
des venösen hydrostatischen Indifferenzpunktes, Veränderungen der
Körperlage bewirken hier kaum Filtrationseffekte Endothelzellen sind mechanosensibel, über gap junctions miteinander verbunden, reagieren auf Scherbelastungen und
vasoaktive Substanzen und beeinflussen die Durchblutung
bedarfsabhängig. Gap junctions
zwischen Endothelzellen und glatten Muskelzellen (heterozellulär) vermitteln lokal geregelte Vasodilatation. Acetylcholin, ATP, Bradykinin, Substanz P, Thrombin binden an rezeptorgesteuerte Ca++-Kanäle, einige davon sind durch Scherkräfte aktivierbar. Zusammen mit Myosin baut Aktin Stressfasern auf, die Endothelzellen an der Basalmembran befestigen. Endotheliales cGMP steigert, cAMP senkt die Kapillarpermeabilität. Endothelzellen sind enzymatisch aktiv (z.B. Angiotensin-konvertierendes Enzym). Unverletztes Endothel sezerniert Heparansulfat und tPA (Gewebeaktivator des Plasminogens), NO und PGI werden kontinuierlich produziert und wirken vasodilatierend und aggregationshemmend. Beschädigtes Endothel wirkt prothrombotisch, gibt vermehrt vonWillebrand-Faktor (vWF) ab. Die Basalmembran ist eine auch für Makromoleküle durchlässige Stützschicht. Vor allem Kapillaren werden durch sie stabilisiert und widerstehen dem Blutdruck Endothelzellen sind mechanosensibel, über gap junctions miteinander verbunden, reagieren auf Scherbelastungen und
vasoaktive Substanzen und beeinflussen die Durchblutung
bedarfsabhängig. Gap junctions
zwischen Endothelzellen und glatten Muskelzellen (heterozellulär) vermitteln lokal geregelte Vasodilatation. Acetylcholin, ATP, Bradykinin, Substanz P, Thrombin binden an rezeptorgesteuerte Ca++-Kanäle, einige davon sind durch Scherkräfte aktivierbar. Zusammen mit Myosin baut Aktin Stressfasern auf, die Endothelzellen an der Basalmembran befestigen. Endotheliales cGMP steigert, cAMP senkt die Kapillarpermeabilität. Endothelzellen sind enzymatisch aktiv (z.B. Angiotensin-konvertierendes Enzym). Unverletztes Endothel sezerniert Heparansulfat und tPA (Gewebeaktivator des Plasminogens), NO und PGI werden kontinuierlich produziert und wirken vasodilatierend und aggregationshemmend. Beschädigtes Endothel wirkt prothrombotisch, gibt vermehrt vonWillebrand-Faktor (vWF) ab. Die Basalmembran ist eine auch für Makromoleküle durchlässige Stützschicht. Vor allem Kapillaren werden durch sie stabilisiert und widerstehen dem Blutdruck  Tight
junctions, kaum Transzytose, dicke Basalmembran, zusätzliche
Barrieren bildende Glia erklären die niedrige Permeabilität
der Blut-Hirn-Schranke. Selektive Transportmechanismen ermöglichen den Austausch bestimmter Substanzen. Im Bereich der zirkumventrikulären Organe ist die Blut-Hirn-Schranke aufgehoben:
Das ermöglicht Chemorezeption, Messung von Hormonkonzentrationen im
Blut (Rückkopplung) und Neurosekretion. Die Blut-Liquor-Schranke
befindet sich an den plexus chorioidei der Ventrikel. Das Endothel ist
hier fenestriert, die Schranke ergibt sich durch tight junctions
zwischen Plexuszellen. Die arachnoidale Schranke
umhüllt das gesamte Gehirn an der Innenseite der dura mater, die
innerste Schicht verfügt über tight junctions, villi arachnoidales lassen Liquor in den sinus sagittalis abfließen Tight
junctions, kaum Transzytose, dicke Basalmembran, zusätzliche
Barrieren bildende Glia erklären die niedrige Permeabilität
der Blut-Hirn-Schranke. Selektive Transportmechanismen ermöglichen den Austausch bestimmter Substanzen. Im Bereich der zirkumventrikulären Organe ist die Blut-Hirn-Schranke aufgehoben:
Das ermöglicht Chemorezeption, Messung von Hormonkonzentrationen im
Blut (Rückkopplung) und Neurosekretion. Die Blut-Liquor-Schranke
befindet sich an den plexus chorioidei der Ventrikel. Das Endothel ist
hier fenestriert, die Schranke ergibt sich durch tight junctions
zwischen Plexuszellen. Die arachnoidale Schranke
umhüllt das gesamte Gehirn an der Innenseite der dura mater, die
innerste Schicht verfügt über tight junctions, villi arachnoidales lassen Liquor in den sinus sagittalis abfließen Lymphkapillaren
nehmen aus dem Interstitium kapilläres Ultrafiltrat, Makromoleküle sowie mobile Zellen durch offene Spalten zwischen den
Endothelzellen auf. Verankerungsfilamente stellen
sicher, dass die Flüssigkeit im Lymphkompartiment verbleibt und weitertransportiert wird. Der Nachschub
an Flüssigkeit ändert sich mit den Druckverhältnissen - je höher der
effektive Filtrationsdruck, desto mehr Lymphe entsteht (kann bis auf das Zehnfache des Ruhewertes ansteigen: Pumpleistung steigt mit Volumenangebot). Durch Semilunarklappen separierte spontanaktive "Lymphherzen" (~8-15 Kontraktionen pro Minute, bei Dehnung frequenter, Auswurffraktion ~25%) erzeugen
einen Sogeffekt aus dem Interstitium heraus und pumpen Lymphe in Richtung
Lymphknoten und Kreislauf. Lymphgefäße werden
noradrenerg-sympathisch und peptiderg (Substanz P) angeregt, durch NO
gebremst. Unter Ruhebedingungen stammen 30-50% der Körperlymphe aus der
Leber. Lymphknoten resorbieren 4-8 l/d der primären Lymphe (
~10 l/d),
Plasmaproteine bleiben zurück, sekundäre Lymphe hat ~60 g/l Proteine.
Lymphe transportiert Antigene via dendritische Zellen aus epithelialen
Oberflächen Lymphkapillaren
nehmen aus dem Interstitium kapilläres Ultrafiltrat, Makromoleküle sowie mobile Zellen durch offene Spalten zwischen den
Endothelzellen auf. Verankerungsfilamente stellen
sicher, dass die Flüssigkeit im Lymphkompartiment verbleibt und weitertransportiert wird. Der Nachschub
an Flüssigkeit ändert sich mit den Druckverhältnissen - je höher der
effektive Filtrationsdruck, desto mehr Lymphe entsteht (kann bis auf das Zehnfache des Ruhewertes ansteigen: Pumpleistung steigt mit Volumenangebot). Durch Semilunarklappen separierte spontanaktive "Lymphherzen" (~8-15 Kontraktionen pro Minute, bei Dehnung frequenter, Auswurffraktion ~25%) erzeugen
einen Sogeffekt aus dem Interstitium heraus und pumpen Lymphe in Richtung
Lymphknoten und Kreislauf. Lymphgefäße werden
noradrenerg-sympathisch und peptiderg (Substanz P) angeregt, durch NO
gebremst. Unter Ruhebedingungen stammen 30-50% der Körperlymphe aus der
Leber. Lymphknoten resorbieren 4-8 l/d der primären Lymphe (
~10 l/d),
Plasmaproteine bleiben zurück, sekundäre Lymphe hat ~60 g/l Proteine.
Lymphe transportiert Antigene via dendritische Zellen aus epithelialen
Oberflächen |
