




 Plasmaproteine
Plasmaproteine
 Albumin: albus = weiß (Eiweiß)
Albumin: albus = weiß (Eiweiß)| Die Proteinkonzentration im Blutplasma beträgt etwa 70 g/l.
Plasmaproteine werden nach ihrer elektrischen Ladung (elektrophoretischen Beweglichkeit) in Albumine sowie α, β- und γ-Globuline eingeteilt. Sie
werden vor allem von Leberparenchymzellen (Albumin, meiste Globuline) und Immunsystem (γ-Globuline) gebildet und haben vielerlei
Funktionen: Pufferung, onkotischer Effekt (vor allem Albumin), Abwehr (γ-Globuline sind Immunproteine), Steuerung (Hormone,
Zytokine), Gerinnung und Fibrinolyse, Transport, enzymatische
Aktivität. Für den Lipidtransport werden Proteine benötigt, weil fettlösliche Substanzen sonst nicht mit dem Blut befördert werden könnten. Die Fette lagern sich an geeignete Stellen der Eiweißmoleküle an, das Resultat sind Lipoproteine, die auch transportoptimierte Molekülanordnungen aufweisen. Plasmaproteine haben eine bestimmte - nach Proteinfraktion unterschiedliche - Lebensdauer (biologische Halbwertszeit), nach deren Ablauf sie abgebaut werden. Geschieht dies in gleichem Ausmaß wie die Neusynthese, bleibt die Konzentration im Blut unverändert (Fließgleichgewicht). Globuline sind meist glykosyliert, Verlust ihrer Sialinsäure markiert sie für den Abbau durch endotheliale Neuraminidase. Sialinsäureloses Protein wird von Leberzellen aufgenommen und verwertet. Der Abbau des Albumins ist anders gesteuert, es ist nicht glykosyliert und wird vermutlich renal eliminiert, abhängig von onkotischem Effekt und Blutvolumen. |
 Dynamik extrazellulärer Proteine
Dynamik extrazellulärer Proteine  Proteinabbau, Sialinsäure, Neuraminidase
Proteinabbau, Sialinsäure, Neuraminidase  Bildung und Abbau
Bildung und Abbau  Proteinfraktionen: Aufgabe und Eigenschaften
Proteinfraktionen: Aufgabe und Eigenschaften

 Abbildung: Eiweißaustritt aus Kapillaren
Abbildung: Eiweißaustritt aus Kapillaren s. dort). Das
tägliche 'Turnover' macht im Schnitt etwa den gesamten intravasalen
Plasmaproteinpool (~200 Gramm) aus. Der Durchtritt von Proteinen durch die Kapillarwand ist aber im
Vergleich zu anderen Molekülen meist (abhängig vom Endotheltyp) vernachlässigbar, daher können sie ihren
onkotischen Effekt ausüben.
s. dort). Das
tägliche 'Turnover' macht im Schnitt etwa den gesamten intravasalen
Plasmaproteinpool (~200 Gramm) aus. Der Durchtritt von Proteinen durch die Kapillarwand ist aber im
Vergleich zu anderen Molekülen meist (abhängig vom Endotheltyp) vernachlässigbar, daher können sie ihren
onkotischen Effekt ausüben.
 Die Osmolalität des Blutplasmas beträgt ~290 mOsm/l, der
osmotische Druck ~750 kPa (zu 96% durch Kochsalz verursacht), der
kolloidosmotische ~3,3 kPa (hauptsächlich durch Albumin).
Die Osmolalität des Blutplasmas beträgt ~290 mOsm/l, der
osmotische Druck ~750 kPa (zu 96% durch Kochsalz verursacht), der
kolloidosmotische ~3,3 kPa (hauptsächlich durch Albumin).  Die
Massendichte (Masse / Volumen)
des Blutplasmas beträgt (bei Körpertemperatur) 1020 g/l (in erster
Linie abhängig von der
Eiweißkonzentration, s. Tabelle unten), sodass die dichteren
Blutkörperchen (Leukozyten ~1050 g/l, Erythrozyten ~1090 g/l) bei
Einwirken eines Schwerefeldes zur Sedimentation neigen (Blutsenkung).
Die
Massendichte (Masse / Volumen)
des Blutplasmas beträgt (bei Körpertemperatur) 1020 g/l (in erster
Linie abhängig von der
Eiweißkonzentration, s. Tabelle unten), sodass die dichteren
Blutkörperchen (Leukozyten ~1050 g/l, Erythrozyten ~1090 g/l) bei
Einwirken eines Schwerefeldes zur Sedimentation neigen (Blutsenkung). 
 Abbildung: Anteile am Blutplasma (bezogen auf die Masse)
Abbildung: Anteile am Blutplasma (bezogen auf die Masse) Zum Vergleich: Molare Konzentrationen s. dort
Zum Vergleich: Molare Konzentrationen s. dort
 bzw. Blutkörperchenkonzentrat sowie zur
klassischen Hämatokritbestimmung genutzt wird.
bzw. Blutkörperchenkonzentrat sowie zur
klassischen Hämatokritbestimmung genutzt wird. Woher stammen die Plasmaeiweiße? Mit
einigen Ausnahmen, z.B. aus spezifischen Zellen stammenden Enzymen
(Enzymdiagnostik) oder Hormonen (Peptidhormone), wird für den
extrazellulären Gebrauch bestimmtes Protein ("Plasmaeiweiß") vorwiegend
von Leberzellen
produziert und sezerniert - das trifft zu auf Albumin
Woher stammen die Plasmaeiweiße? Mit
einigen Ausnahmen, z.B. aus spezifischen Zellen stammenden Enzymen
(Enzymdiagnostik) oder Hormonen (Peptidhormone), wird für den
extrazellulären Gebrauch bestimmtes Protein ("Plasmaeiweiß") vorwiegend
von Leberzellen
produziert und sezerniert - das trifft zu auf Albumin
 (Albuminverringerung bei eingeschränkter Leberleistung) und die meisten
Globuline
(Albuminverringerung bei eingeschränkter Leberleistung) und die meisten
Globuline  (s. unten). Das bedeutet, dass die entsprechenden Regulationsvorgänge an Hepatozyten angreifen. Leberzellen bilden mehr als 80% der im Blutplasma vorhandenen Proteinmasse.
(s. unten). Das bedeutet, dass die entsprechenden Regulationsvorgänge an Hepatozyten angreifen. Leberzellen bilden mehr als 80% der im Blutplasma vorhandenen Proteinmasse.| Plasmaeiweißsynthese ~20 g/d (steigerbar auf >60 g/d) |
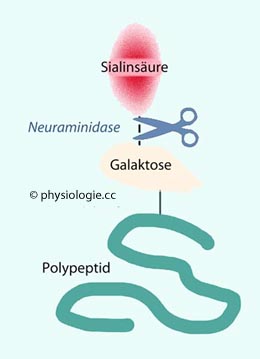
 Abbildung: Glykoproteinabbau
Abbildung: Glykoproteinabbau schützen Proteine vor dem Abbau durch Proteasen. Die Mehrzahl
extrazellulärer Proteine ("Plasmaproteine") verfügen über Sialinsäure,
die mittels Galactose an der Peptidkette angeheftet ist. Sialylasen der
Gefäßwände, wie die Neuraminidase,
können die Sialinsäure entfernen und die Galactose liegt frei. Diese
Stelle wird von Asialo-Glykoprotein-Rezeptoren - diese finden sich an
Leberzellen - erkannt, gebunden und endozytiert.
schützen Proteine vor dem Abbau durch Proteasen. Die Mehrzahl
extrazellulärer Proteine ("Plasmaproteine") verfügen über Sialinsäure,
die mittels Galactose an der Peptidkette angeheftet ist. Sialylasen der
Gefäßwände, wie die Neuraminidase,
können die Sialinsäure entfernen und die Galactose liegt frei. Diese
Stelle wird von Asialo-Glykoprotein-Rezeptoren - diese finden sich an
Leberzellen - erkannt, gebunden und endozytiert.
 Wo und wie werden Plasmaeiweiße abgebaut? Die durchschnittliche Lebensdauer der Plasmaproteine ist sehr
unterschiedlich und hängt von ihrer chemischen Struktur ab. Im
Wesentlichen bestehen zwei Abbauwege:
Wo und wie werden Plasmaeiweiße abgebaut? Die durchschnittliche Lebensdauer der Plasmaproteine ist sehr
unterschiedlich und hängt von ihrer chemischen Struktur ab. Im
Wesentlichen bestehen zwei Abbauwege: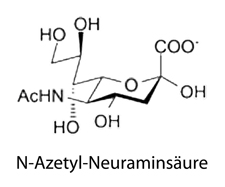
 Die meisten Globuline sind Glykoproteine. Auf ihnen haften Zuckerreste, an deren endständigen Galactosemolekül Sialinsäure
Die meisten Globuline sind Glykoproteine. Auf ihnen haften Zuckerreste, an deren endständigen Galactosemolekül Sialinsäure  (NANA = N-Acetyl-Neuraminsäure) angebracht ist. Die Innenwand der Blutgefäße verfügt über ein Enzym (Neuraminidase),
das die Sialinsäure entfernt (
(NANA = N-Acetyl-Neuraminsäure) angebracht ist. Die Innenwand der Blutgefäße verfügt über ein Enzym (Neuraminidase),
das die Sialinsäure entfernt ( Abbildung).
Auf diese Weise
werden die
betreffenden Moleküle als "gealtert" markiert. Wie bald das passiert,
ist genetisch determiniert - es hängt von der Dichte an
Sialinsäureresten und der Umgebung der Glykosylierung ab. Daraus
resultiert die Tatsache, dass Proteine unterschiedliche biologische Halbwertszeiten aufweisen.
Abbildung).
Auf diese Weise
werden die
betreffenden Moleküle als "gealtert" markiert. Wie bald das passiert,
ist genetisch determiniert - es hängt von der Dichte an
Sialinsäureresten und der Umgebung der Glykosylierung ab. Daraus
resultiert die Tatsache, dass Proteine unterschiedliche biologische Halbwertszeiten aufweisen. Albumin wird in der Leber nicht
glykosyliert und ist damit dem hepatischen Abbau entzogen. An der Entfernung von Albumin beteiligt sich wahrscheinlich die Niere,
die täglich einige Gramm Albumin glomerulär filtriert,
teils tubulär zurückgewinnt und teils abbaut. Vermutlich erfolgt über
diesen Mechanismus eine Regulation des kolloidosmotischen Drucks.
Albumin wird in der Leber nicht
glykosyliert und ist damit dem hepatischen Abbau entzogen. An der Entfernung von Albumin beteiligt sich wahrscheinlich die Niere,
die täglich einige Gramm Albumin glomerulär filtriert,
teils tubulär zurückgewinnt und teils abbaut. Vermutlich erfolgt über
diesen Mechanismus eine Regulation des kolloidosmotischen Drucks.

 Abbildung: Elektropherogramm einer Plasmaprobe
Abbildung: Elektropherogramm einer Plasmaprobe
| Plasmaproteine Nach Aaronson / Ward / Connolly, The Cardiovascular System at a Glance, 4th ed. Wiley Blackwell 2020 und Gressner / Arndt, Lexikon der Medizinischen Lanoratoriumsdiagnostik, 2. Aufl. Springer 2013 |
|||
| Proteinfraktion |
Konzentration (g/l) |
Molekular- gewicht (kDa) |
Funktionen |
| Albumine |
35-50 |
69 |
kolloidosmotischer Druck Transport (Hormone etc) |
| α-Globuline |
α1: 1,3-3,9 α2: 5,4-11,3 |
16-90 |
Antiprotease Transport (Kupfer, Hormone) |
| ß-Globuline |
|||
| Transferrin |
3,0 |
90 |
Transport (Eisen) |
| Prothrombin * |
1,0 |
68 |
Blutgerinnung |
| Plasminogen |
0,7 |
140 |
Blutgerinnung |
| Komplementfaktoren |
1,6 |
~200 | Immunsystem |
| Fibrinogen |
3,0 |
350 |
Blutgerinnung |
| γ-Globuline |
5,8-15,2 |
150-1000 | Immunglobuline |
| Albumin liefert den Hauptanteil (~80%) des kolloidosmotischen Effekts in der Mikrozirkulation |
 zur Folge haben: Interstitielle Flüssigkeit staut sich
im Gewebe zurück, weil der kolloidosmotische Effekt nicht ausreicht,
der kapillären Filtration
zur Folge haben: Interstitielle Flüssigkeit staut sich
im Gewebe zurück, weil der kolloidosmotische Effekt nicht ausreicht,
der kapillären Filtration  (bedingt durch den Blutdruck) ausreichend
einwärtsgerichteten onkotischen Druck entgegenzusetzen.
(bedingt durch den Blutdruck) ausreichend
einwärtsgerichteten onkotischen Druck entgegenzusetzen.  Trennung unterscheidet man
Trennung unterscheidet man α1-Antitrypsin: Blut enthält mehrere (meist Serin-) Proteasen, die durch Proteaseinhibitoren in Schach gehalten werden. α1-Antitrypsin ist ein solches enzymhemmendes (Akutphasen-) Protein. Es führt die α1-Globuline mit ~250 mg/dl mengenmäßig an. Ein Mangel an α1-Antitrypsin
betrifft vor allem Leber (defektes Protein kann Hepatozyt nicht
verlassen) und Lunge (Proteaseaktivität führt zu Lungenödem)
α1-Antitrypsin: Blut enthält mehrere (meist Serin-) Proteasen, die durch Proteaseinhibitoren in Schach gehalten werden. α1-Antitrypsin ist ein solches enzymhemmendes (Akutphasen-) Protein. Es führt die α1-Globuline mit ~250 mg/dl mengenmäßig an. Ein Mangel an α1-Antitrypsin
betrifft vor allem Leber (defektes Protein kann Hepatozyt nicht
verlassen) und Lunge (Proteaseaktivität führt zu Lungenödem) Saures α1-Glykoprotein: Dieses Akutphasenprotein stellt mit ~50 mg/dl fast den gesamten Rest an α1-Globulin
Saures α1-Glykoprotein: Dieses Akutphasenprotein stellt mit ~50 mg/dl fast den gesamten Rest an α1-Globulin HDL-Lipoproteine
HDL-Lipoproteine Transcortin transportiert Steroide
Transcortin transportiert Steroide Transcobalamin transportiert Vitamin B12 im Blut
Transcobalamin transportiert Vitamin B12 im Blut Thyroxinbindendes Globulin (TBG) transportiert Thyroxin und T3 äquimolar (ein Molekül TBG bindet ein
Schilddrüsenhormonmolekül)
Thyroxinbindendes Globulin (TBG) transportiert Thyroxin und T3 äquimolar (ein Molekül TBG bindet ein
Schilddrüsenhormonmolekül) Vitamin D-bindendes Protein ((V)DBG) transportiert Vitamin D (BP = binding protein)
Vitamin D-bindendes Protein ((V)DBG) transportiert Vitamin D (BP = binding protein) Aus α2-Makroglobulin können Kininogene freiwerden. Seine Konzentration macht mit ~300 mg/dl etwa die Hälfte der α2-Globuline aus
Aus α2-Makroglobulin können Kininogene freiwerden. Seine Konzentration macht mit ~300 mg/dl etwa die Hälfte der α2-Globuline aus Haptoglobin
transportiert freigewordenes Hämoglobin (was physiologischerweise kaum
auftreten sollte - z.B. nach Hämolyse). Seine Konzentration beträgt
normalerweise ~200 mg/dl, wenn es aber Hämoglobin bindet, wird der
Komplex in der Leber abgebaut und die Haptoglobinkonzentration im Blut
nimmt ab
Haptoglobin
transportiert freigewordenes Hämoglobin (was physiologischerweise kaum
auftreten sollte - z.B. nach Hämolyse). Seine Konzentration beträgt
normalerweise ~200 mg/dl, wenn es aber Hämoglobin bindet, wird der
Komplex in der Leber abgebaut und die Haptoglobinkonzentration im Blut
nimmt ab Coeruloplasmin transportiert Kupferionen
Coeruloplasmin transportiert Kupferionen Aus Plasminogen entsteht bei der Fibrinolyse Plasmin, α2-Makroglobuline sind Proteaseinhibitoren, α2-Antithrombin ist ein Gerinnungshemmer
Aus Plasminogen entsteht bei der Fibrinolyse Plasmin, α2-Makroglobuline sind Proteaseinhibitoren, α2-Antithrombin ist ein Gerinnungshemmer Aus Prothrombin wird bei der Gerinnung Thrombin
Aus Prothrombin wird bei der Gerinnung Thrombin LDL- Lipoproteine
LDL- Lipoproteine  Hämopexin
transportiert Hämgruppen (diese werden zur Leber transportiert und dort abgebaut -
das schützt vor oxidativem Schaden, den freies Häm anrichten kann, und
Eisen wird wiederverwertet)
Hämopexin
transportiert Hämgruppen (diese werden zur Leber transportiert und dort abgebaut -
das schützt vor oxidativem Schaden, den freies Häm anrichten kann, und
Eisen wird wiederverwertet) Transferrin transportiert Eisen (je Molekül 2 Fe3+), das in freier Form toxisch wäre. Konzentration: ~300 mg/dl (etwa 1/3 aller β-Globuline)
Transferrin transportiert Eisen (je Molekül 2 Fe3+), das in freier Form toxisch wäre. Konzentration: ~300 mg/dl (etwa 1/3 aller β-Globuline) Fibrinogen (~300 mg/dl) ist die Vorstufe des Fibrins
Fibrinogen (~300 mg/dl) ist die Vorstufe des Fibrins CRP - C-reaktives Protein - ist ein Akutphasenprotein
CRP - C-reaktives Protein - ist ein Akutphasenprotein| LDL befinden sich in der Serum- Gelelektrophorese in der β-Globulin-Fraktion |
| Immunoglobuline finden sich weitgehend in der γ-Globulin-Fraktion |
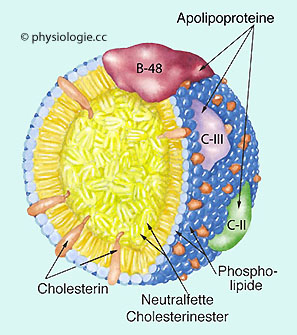
 Abbildung: Chylomikron im Blutplasma
Abbildung: Chylomikron im Blutplasma Zu den Aufgaben der Plasmaeiweiße gehören:
Zu den Aufgaben der Plasmaeiweiße gehören: Kolloidosmotische Wirkung
Kolloidosmotische Wirkung Transport von
Fetten (
Transport von
Fetten ( Abbildung), Hormonen, Spurenelementen, Pharmaka (dabei kann gegenseitige
Verdrängung von Molekülen an einem gemeinsamen Transporteiweiß
auftreten)
Abbildung), Hormonen, Spurenelementen, Pharmaka (dabei kann gegenseitige
Verdrängung von Molekülen an einem gemeinsamen Transporteiweiß
auftreten)
 Abwehrwirkung von Antikörpern, Komplementfaktoren und anderen Proteinen
Abwehrwirkung von Antikörpern, Komplementfaktoren und anderen Proteinen Hämostase- und Fibrinolysesystem
Hämostase- und Fibrinolysesystem  Stabilisierung des Säurewertes (pH-Wertes), weil Eiweiße Puffer sind
Stabilisierung des Säurewertes (pH-Wertes), weil Eiweiße Puffer sind Enzymatische (=spezifische Umbau-) Aktivitäten
Enzymatische (=spezifische Umbau-) Aktivitäten Plasmaproteine
Plasmaproteine| Proteinkonzentration (g/l) |
Dichte, g/l (37°C) | |
| Blutplasma |
70 |
1020 |
| Leukozyten |
~200 |
~1050 |
| Erythrozyten |
340 (MCHC) |
1090 |

 Plasmaproteine (>1000
verschiedene Molekülarten unterschiedlicher Größe, Form, elektrischer
Ladung und Funktion) sind mobil, sie treten durch Kapillaren aus (Transzytose), zirkulieren durch das Interstitium
und werden mit der Lymphe wieder der Blutbahn zugeführt; der tägliche
Umsatz entspricht dem gesamten intravasalen Plasmaproteinpool (~200-250
Gramm). Plasmaproteine werden von Leberzellen (>80%), Immunzellen, endokrinen Zellen gebildet und eine entsprechende Menge von Leber (Globuline), Nieren (Albumin) und anderen Zellen abgebaut. Plasmaproteine transportieren schwer lösliche Stoffe (Bindungsproteine) Plasmaproteine (>1000
verschiedene Molekülarten unterschiedlicher Größe, Form, elektrischer
Ladung und Funktion) sind mobil, sie treten durch Kapillaren aus (Transzytose), zirkulieren durch das Interstitium
und werden mit der Lymphe wieder der Blutbahn zugeführt; der tägliche
Umsatz entspricht dem gesamten intravasalen Plasmaproteinpool (~200-250
Gramm). Plasmaproteine werden von Leberzellen (>80%), Immunzellen, endokrinen Zellen gebildet und eine entsprechende Menge von Leber (Globuline), Nieren (Albumin) und anderen Zellen abgebaut. Plasmaproteine transportieren schwer lösliche Stoffe (Bindungsproteine) Die Massendichte des Blutplasmas beträgt 1020 g/l und ist in erster Linie abhängig von der Eiweißkonzentration (~70 g/l). Blut hat (je nach Hämatokrit) eine Dichte von
~1050 g/l; Blutkörperchen haben eine höhere Proteinkonzentration als das Blutplasma, in fließendem Blut bleiben sie in Suspension (Blutströmung, elektrische Ladungskräfte),
in nichtströmendem Blut setzen sie sich ab (Blutsenkung). Der
Dichteunterschied ermöglicht die rasche Trennung von Blutkörperchen und
Blutplasma durch Zentrifugation. Plasmaproteine sind bei physiologischem pH-Wert negativ geladen - am stärksten Albumin, am wenigsten Gamma-Globuline. Elektrophorese trennt Plasmaproteine nach ihrer Ladung; Merkregel: α1-Globulin
~4%, α2-Globulin
~8%, β-Globulin
~12%, γ-Globulin (Immunglobuline)
~16% der Proteinmasse, zusammen
~40% (Albumin
~60%) Die Massendichte des Blutplasmas beträgt 1020 g/l und ist in erster Linie abhängig von der Eiweißkonzentration (~70 g/l). Blut hat (je nach Hämatokrit) eine Dichte von
~1050 g/l; Blutkörperchen haben eine höhere Proteinkonzentration als das Blutplasma, in fließendem Blut bleiben sie in Suspension (Blutströmung, elektrische Ladungskräfte),
in nichtströmendem Blut setzen sie sich ab (Blutsenkung). Der
Dichteunterschied ermöglicht die rasche Trennung von Blutkörperchen und
Blutplasma durch Zentrifugation. Plasmaproteine sind bei physiologischem pH-Wert negativ geladen - am stärksten Albumin, am wenigsten Gamma-Globuline. Elektrophorese trennt Plasmaproteine nach ihrer Ladung; Merkregel: α1-Globulin
~4%, α2-Globulin
~8%, β-Globulin
~12%, γ-Globulin (Immunglobuline)
~16% der Proteinmasse, zusammen
~40% (Albumin
~60%) Albumin
macht molar über 80% der Plasmaeiweiße aus
und besteht aus einer einheitlichen Molekülart (~66 kD); seine
Halbwertszeit beträgt 2-3 Wochen. Es bewirkt ~70-90% des
kolloiodosmotischen Effekts (Erhaltung des Plasmavolumens), ist ein
Reserve- und Transporteiweiß (Bindungsstellen für Thyroxin, Steroide,
Häm, Fettsäuren, Tryptophan, Calcium, Zink, Kupfer, Vitamine,
Gallensalze, Bilirubin) und wirkt antioxidativ. Albuminbindende Moleküle ermöglichen es Zellen (Fibroblasten, Tubuluszellen), Albumin aufzunehmen und zu verwerten Albumin
macht molar über 80% der Plasmaeiweiße aus
und besteht aus einer einheitlichen Molekülart (~66 kD); seine
Halbwertszeit beträgt 2-3 Wochen. Es bewirkt ~70-90% des
kolloiodosmotischen Effekts (Erhaltung des Plasmavolumens), ist ein
Reserve- und Transporteiweiß (Bindungsstellen für Thyroxin, Steroide,
Häm, Fettsäuren, Tryptophan, Calcium, Zink, Kupfer, Vitamine,
Gallensalze, Bilirubin) und wirkt antioxidativ. Albuminbindende Moleküle ermöglichen es Zellen (Fibroblasten, Tubuluszellen), Albumin aufzunehmen und zu verwerten  Globuline
stellen eine Vielfalt von Eiweißen unterschiedlicher Größe, Gestalt,
Herkunft und Funktion dar. Die Globulinkonzentration im Blutplasma
beträgt 20-30 g/l (massenmäßig ~40% des Plasmaproteins). Zu ihren
Aufgaben gehören der Transport von Fetten, Hormonen, Spurenelementen, Hämostase und
Fibrinolyse, Stabilisierung des pH-Wertes, enzymatische Aktivitäten, Abwehr (Antikörper, Komplementfaktoren etc) Globuline
stellen eine Vielfalt von Eiweißen unterschiedlicher Größe, Gestalt,
Herkunft und Funktion dar. Die Globulinkonzentration im Blutplasma
beträgt 20-30 g/l (massenmäßig ~40% des Plasmaproteins). Zu ihren
Aufgaben gehören der Transport von Fetten, Hormonen, Spurenelementen, Hämostase und
Fibrinolyse, Stabilisierung des pH-Wertes, enzymatische Aktivitäten, Abwehr (Antikörper, Komplementfaktoren etc) Die
Mehrzahl extrazellulärer Proteine (nicht Albumin) haben über Galactose
Sialinsäuren gebunden. Diese
schützen Proteine vor dem Abbau durch Proteasen im Kreislauf. Sie können durch endotheliale Sialylasen
entfernt werden, die Galactose liegt frei, Leberzellen binden an
Asialo-Glykoprotein- Rezeptoren ("Galactoserezeptoren") und endozytieren das markierte Protein. Bei
geringer Zufuhr von Aminosäuren nimmt der Eiweißumsatz ab, bei
vermehrtem Bedarf (Wachstum, Reparaturvorgänge) nimmt er zu (von 15-20 bis auf >60 g/d) Die
Mehrzahl extrazellulärer Proteine (nicht Albumin) haben über Galactose
Sialinsäuren gebunden. Diese
schützen Proteine vor dem Abbau durch Proteasen im Kreislauf. Sie können durch endotheliale Sialylasen
entfernt werden, die Galactose liegt frei, Leberzellen binden an
Asialo-Glykoprotein- Rezeptoren ("Galactoserezeptoren") und endozytieren das markierte Protein. Bei
geringer Zufuhr von Aminosäuren nimmt der Eiweißumsatz ab, bei
vermehrtem Bedarf (Wachstum, Reparaturvorgänge) nimmt er zu (von 15-20 bis auf >60 g/d) |
