

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Phasen der spezifischen Immunabwehr
© H. Hinghofer-Szalkay

Antigen: Antibody generating
Epitop: ἐπί = auf, bei; τόπος = Ort
Opsonierung: ὀψωνἰαζω = mit Speise versorgen
Während
das angeborene Immunsystem konstante Merkmale fremder Zellen erkennt
und sofort zur Verfügung steht, benötigt das adaptive mehrere Tage, bis
Antigene zu "passenden" Lymphozyten gefunden haben und diese zu einer
spezifischen Reaktion veranlassen. Die Antwort des adaptiven
Immunsystems auf eine immunologische Herausforderung läuft in drei
Phasen ab:
-- Afferente Phase (Gefahrenerkennung): Zellen präsentieren Lymphozyten mit passenden
T-Rezeptoren MHC-gekoppelte Peptide aus intrazellulärem Abbau und regen sie dadurch an
-- Induktionsphase (Aufrüstung): Spezifisch angeregte Lymphozyten (T-Zellen, B-Zellen) vermehren sich (Klonselektion)
-- Efferente Phase (Gegenangriff): Helfer- und andere T-Zellen vollführen spezifische Abwehrmechanismen.
Nach Abschluss der efferenten Phase unterliegen die meisten Lymphozyten der Apoptose (sie werden nicht weiter benötigt), einige werden hingegen zu Gedächtniszellen.
Gedächtniszellen beschleunigen die spezifische Immunantwort im Falle einer
wiederholten Infektion mit gleichen Antigenträgern um das 10-
bis 100-fache.
|
Übersicht  Adaptive Immunität
Adaptive Immunität  Afferente Phase
Afferente Phase
 Induktionsphase
Induktionsphase  Efferente Phase
Efferente Phase  Immunologische Toleranz
Immunologische Toleranz  Immunologisches Gedächtnis
Immunologisches Gedächtnis
 Selbsttoleranz
Selbsttoleranz  Boosterung
Boosterung  Lymphozyten
Lymphozyten
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Das adaptive Immunsystem
ist eine "Erfindung" der Wirbeltiere. Es wird von Komponenten des
angeborenen Immunsystems mobilisiert, wenn dieses keinen ausreichenden
Schutz vor bestimmten Pathogenen bietet. Das adaptive System hat
folgende besonderen Eigenschaften:
 Ausgeprägte Spezifität: Es kann auch geringste molekulare Unterschiede (von Antigenen) erkennen und unterscheiden
Ausgeprägte Spezifität: Es kann auch geringste molekulare Unterschiede (von Antigenen) erkennen und unterscheiden
 Hohe Anpassungsfähigkeit: Es reagiert auf eine praktisch unbegrenzte Zahl verschiedener Moleküle
Hohe Anpassungsfähigkeit: Es reagiert auf eine praktisch unbegrenzte Zahl verschiedener Moleküle
 Immunologisches Gedächtnis: "Gedächtniszellen" ermöglichen bei wiederholtem Kontakt mit einem Antigen eine raschere und verstärkte Immunantwort
Immunologisches Gedächtnis: "Gedächtniszellen" ermöglichen bei wiederholtem Kontakt mit einem Antigen eine raschere und verstärkte Immunantwort
Außerdem hat jeder Mensch seine persönliche "Vorerfahrung" mit Antigenen und hat dementsprechend ein individuelles Muster an Immunität.
Es
gibt zwei Arten adaptiver Immunität: Humorale und zelluläre. Diese
werden von verschiedenen Lymphozytenarten gesteuert (B-Lymphozyten:
humoral, T-Lymphozyten: zellulär) und bewirken die Eliminierung
verschiedener Gruppen von Mikroben. T-Lymphozyten sind insbesondere ein wichtiges antivirales Abwehrsystem.
 Lymphozyten sind weiße Blutkörperchen (Leukozyten) mit einem großen runden Zellkern. Man unterscheidet thymusabhängige (T-), knochenmarkabhängige (B-) und innate lymphoid cells (ILCs), von denen natürliche Killerzellen (NK) einen wichtigen Subtypus darstellen. S. auch dort
Lymphozyten sind weiße Blutkörperchen (Leukozyten) mit einem großen runden Zellkern. Man unterscheidet thymusabhängige (T-), knochenmarkabhängige (B-) und innate lymphoid cells (ILCs), von denen natürliche Killerzellen (NK) einen wichtigen Subtypus darstellen. S. auch dort
Adaptive Immunität bildet spezifische Abwehr gegen Mikroben
Schafft es das angeborene Immunsystem nicht,
potentielle Krankheitserreger schon auf Haut und Schleimhäuten in
Schach zu halten und am Eindringen in den Körper zu hindern, und
erweisen sich nicht-adaptive (angeborene, "unspezifische")
Kontrollmechanismen als nicht ausreichend wirksam gegen eine Infektion,
dann kommt es zur Aktivierung adaptiver ("spezifischer") Immunantworten.
Kennzeichnend ist dabei das Auftreten
erregerspezifischer Rezeptoren.
 Abbildung: Sequenz der Phasen spezifischer Immunantwort
Abbildung: Sequenz der Phasen spezifischer Immunantwort
Man kann drei Phasen unterscheiden:
> Eine afferente, bei der Lymphozyten alarmiert werden;
> eine Induktionsphase, bei der eine große Zahl von Effektorzellen entsteht; und
> eine efferente, in der sich diese spezialisierten Immunzellen zum Kampfort begeben

Zwischen angeborenem und adaptivem
System gibt es mehrfache
Überschneidungen bzw. Kooperationen:
 Zunächst stellen sich den Erregern phagozytierende
Zellen in den Weg. Im Gewebe stehen Makrophagen und dendritische Zellen
(
Zunächst stellen sich den Erregern phagozytierende
Zellen in den Weg. Im Gewebe stehen Makrophagen und dendritische Zellen
( Abbildung unten) bereit, dazu kommen aus dem Blut ausgerückte
Granulozyten. Makrophagen und dendritische Zellen erkennen Erreger über Toll-ähnliche Rezeptoren sowie den DC-Faktor DEC-205 (auch: LY75, DC205; bindet dieser einen Infektionserreger, wird dessen Phagozytose gestartet).
Abbildung unten) bereit, dazu kommen aus dem Blut ausgerückte
Granulozyten. Makrophagen und dendritische Zellen erkennen Erreger über Toll-ähnliche Rezeptoren sowie den DC-Faktor DEC-205 (auch: LY75, DC205; bindet dieser einen Infektionserreger, wird dessen Phagozytose gestartet).
Dendritische Zellen (DC) finden
sich an allen Grenzflächen nach außen (Haut - hier heißen sie
Langerhans-Zellen -, Schleimhäute - Bronchien, Magen-Darm- und
Urogenitaltrakt u.a.). Sie checken den Antigenstatus der Umgebung und
wandern (als "unreife" DCs) kontinuierlich in regionale Lymphknoten (homöostatische DC-Migration),
wo sie ihr "Messergebnis" an naive T-Zellen präsentieren. Das sind
meist Peptide aus normalen (körpereigenen) Proteinen, auf diese Weise
wird die Selbsttoleranz nur verstärkt (kaum Ausbildung von
Kostimulatoren, keine inflammatorische Reaktion).
 Selbsttoleranz
ist das Nicht-Ansprechen des adaptiven Immunsystems auf Eigenantigene.
Sie beruht hauptsächlich auf der Inaktivierung selbstreaktiver
Lymphozyten. Fehlerhafte Selbsttoleranz führt zu Autoimmunerkrankungen.
Selbsttoleranz
ist das Nicht-Ansprechen des adaptiven Immunsystems auf Eigenantigene.
Sie beruht hauptsächlich auf der Inaktivierung selbstreaktiver
Lymphozyten. Fehlerhafte Selbsttoleranz führt zu Autoimmunerkrankungen.
 Haben DCs im Gewebe hingegen Fremdmerkmale registriert, stoppen sie die
Pinozytose, regulieren die Zahl der PRR-Moleküle in ihrer Membran
herunter und konservieren so den ermittelten Gefahrenstatus ("reife"
DCs). Auf dem Weg in den Lymphknoten bearbeiten sie die aufgenommenen Antigene. Im Lymphknoten angekommen, präsentieren sie als differenzierte antigenpräsentierende Zellen ihre MHC-II / Peptidkomplexe an CD4+- (Helfer-) Lymphozyten. Auch erhöhen sie die Expression von Cofaktoren (wie CD80/86).
Haben DCs im Gewebe hingegen Fremdmerkmale registriert, stoppen sie die
Pinozytose, regulieren die Zahl der PRR-Moleküle in ihrer Membran
herunter und konservieren so den ermittelten Gefahrenstatus ("reife"
DCs). Auf dem Weg in den Lymphknoten bearbeiten sie die aufgenommenen Antigene. Im Lymphknoten angekommen, präsentieren sie als differenzierte antigenpräsentierende Zellen ihre MHC-II / Peptidkomplexe an CD4+- (Helfer-) Lymphozyten. Auch erhöhen sie die Expression von Cofaktoren (wie CD80/86).
 Die T-Zellen verhalten sich bei diesem Vorgang sehr aktiv und "suchen"
die dendritischen Zellen im Lymphknoten regelrecht nach passenden
MHC-II / Peptid-Komplexen ab. Haben sie den "passenden" Komplex
entdeckt, teilen sie sich und bilden einen T-Zell-Klon, der spezifisch
auf das erkannte Antigen anspricht.
Die T-Zellen verhalten sich bei diesem Vorgang sehr aktiv und "suchen"
die dendritischen Zellen im Lymphknoten regelrecht nach passenden
MHC-II / Peptid-Komplexen ab. Haben sie den "passenden" Komplex
entdeckt, teilen sie sich und bilden einen T-Zell-Klon, der spezifisch
auf das erkannte Antigen anspricht.
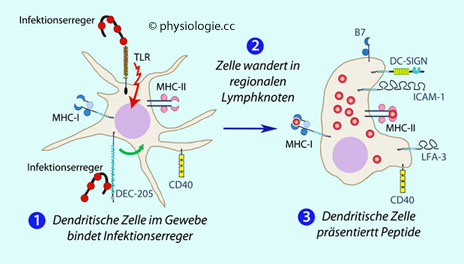
 Abbildung: Dendritische Zellen und afferente Phase der Immunantwort
Abbildung: Dendritische Zellen und afferente Phase der Immunantwort
Nach einer Vorlage in Hof / Dörries, Medizinische Mikrobiologie, 5. Aufl. Duale Reihe, Thieme 2014
Dendritische Zellen können Erreger im Gewebe binden und verarbeiten (links): TLR (toll-like receptors)
aktivieren die Zelle zur Abwanderung über Lymphbahnen,
DEC-205-Rezeptoren vermitteln die Phagozytose, deren Peptidfragmente
über MHC-Moleküle präsentiert werden. Das Protein DEC-205 wird auch als lymphocyte antigen 75 oder CD205 bezeichnet.
Im Lymphknoten (rechts)
exprimiert die dendritische Zelle immunstimulatorische (B5, CD40) und
adhäsionsfördernde Moleküle (DC-SIGN, ICAM-1, LFA-3). Antigene Peptide
werden T-Lymphozyten an MHC-Moleküle gebunden präsentiert

Die Mobilisierung der dendritischen Zellen (Loslösung und Transport über die Lymphbahn in sekundäres lymphatisches Gewebe) wird von mehreren Faktoren ausgelöst bzw. verstärkt:
 TNF-α aus aktivierten
Makrophagen,
TNF-α aus aktivierten
Makrophagen,
 Aktivierung verschiedener Rezeptoren (Mannoserezeptor,
DEC-205, Komplementrezeptoren) und
Aktivierung verschiedener Rezeptoren (Mannoserezeptor,
DEC-205, Komplementrezeptoren) und
 Zytokine, die zum Teil
autokrin-verstärkend auf die gereizte Zelle einwirken.
Zytokine, die zum Teil
autokrin-verstärkend auf die gereizte Zelle einwirken.
Diese exprimiert
darauf vermehrt MHC-Moleküle, an denen sie Peptidbruchstücke aus dem lysosomalen Erregerabbau präsentieren kann.
Afferente Phase spezifischer Immunantworten
Damit
beginnt der Prozess der spezifischen Erkennung und Abwehr: Im Lymphknoten werden die Peptide - an MHC gebunden - vorbeiwandernden
T-Lymphozyten so lange hergezeigt, bis solche mit passenden
T-Rezeptoren "hängenbleiben" und sich zu vermehren beginnen
(Klonselektion). Außerdem werden die Lymphozyten von Faktoren der
dendritische Zelle angeregt (B7-Moleküle - diese gehören zur
Immunglobulin-Superfamilie).
Dass
naive (noch keinem Antigenreiz ausgesetzte) rezirkulierende
T-Lymphozyten in den Lymphknoten gelangen, ist ebenfalls molekular
gesteuert: Mit ihren Selektin- und
LFA-1-Membranmolekülen binden sie an Adressine und ICAM-1 des
Gefäßendothels (Selektin-Adressin locker, LFA-1-ICAM-1-Bindung fester)
und wandern durch das Endothel in den Lymphknoten ein.
Mehrfache Passung. Die Anhaftung an dendritische Zellen erfolgt dann über mehrere
Molekülpaare: LFA-1-ICAM-1; ICAM-2-DC-SIGN; CD-2-LFA-3. Der
T-Zell-Rezeptor (TCR) prüft indes, wie gut er mit dem molekularen
MHC-Peptid-Komplex zusammenpasst.
Solange die "Passform" nicht
befriedigend ist, bleiben die interzellulären Kontakte lose; Lymphozyt
für Lymphozyt "pilgert" an den dendritischen (antigenpräsentierenden)
Zellen vorbei und löst sich wieder ab - bis der "richtige Partner"
gefunden ist. In diesem Fall werden die Bindungskräfte verstärkt, die T-Zelle bleibt stationär und wird antigenspezifisch stimuliert.
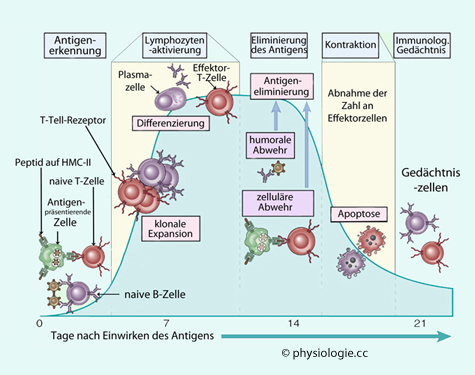
 Abbildung: Phasen der adaptiven Immunantwort
Nach Abbas AK, Lichtman AH, Pillai S, Cellular and Molecular Immunology, 6ed Saunders Elsevier 2007
Abbildung: Phasen der adaptiven Immunantwort
Nach Abbas AK, Lichtman AH, Pillai S, Cellular and Molecular Immunology, 6ed Saunders Elsevier 2007
Auf
die Erkennung der Antigene folgt Differenzierung und klonale Expansion.
Nach Eliminierung der Antigene durch zelluläre und humorale Abwehr fällt die Aktivierung über antigenspezifische T-Zell-Rezeptoren weg, die Zahl der spezifischen Effektorzellen nimmt ab (klonale Kontraktion, clonal downsizing).
Ein
immunologisches Gedächtnis bleibt bestehen

Induktionsphase spezifischer Immunantworten
In der Induktionsphase wird eine Antwort der Lymphozyten (T-Zellen, B-Zellen) auf die antigene Stimulation hin angeregt.
Haben
naive T-Zellen ihren molekularen Bindungspartner (passender
MHC-Peptid-Komplex) gefunden, reicht das noch nicht zu ihrer
Aktivierung. Diese bedarf zusätzlicher Wechselwirkungen: Neben der
TCR-MHC-Passung ("Signal 1") muss mindestens auch CD28 des Lymphozyten
mit B7-Molekülen der dendritischen Zelle interagieren ("Signal 2").
Erst dann beginnen sich die (selektionierten) Lymphozyten zu teilen
(Proliferationsphase) und IL-2
zu bilden, was ihre Vermehrung autokrin stimuliert. Das Ergebnis sind
(nach einigen Tagen) tausende T-Lymphozyten mit identischen
Antigenrezeptoren (klonale Selektion), die sich zu Effektorzellen entwickelt haben.
Ähnliches trifft auf die Stimulation von B-Zellen
zu. Naive B-Lymphozyten treten aus dem Blutkreislauf in sekundäre
lymphatische Gewebe aus, wo sie durch T-Zell-abhängige Bereiche
hindurch zu B-Zell-Zonen gelangen.
Treffen sie hier auf passende
Antigene  , exprimieren sie vermehrt Chemokinmoleküle und
Adhäsionsrezeptoren, was ihre Verweildauer in der T-Zell-Zone
verlängert. Dies erhöht die Effizienz der Wechselwirkung mit bereits
antigenspezifisch aktivierten CD4+-T-Zellen
(wobei dasselbe Antigen erkannt werden muss!).
, exprimieren sie vermehrt Chemokinmoleküle und
Adhäsionsrezeptoren, was ihre Verweildauer in der T-Zell-Zone
verlängert. Dies erhöht die Effizienz der Wechselwirkung mit bereits
antigenspezifisch aktivierten CD4+-T-Zellen
(wobei dasselbe Antigen erkannt werden muss!).
 B-Zellen erkennen
antigene Epitope
B-Zellen erkennen
antigene Epitope  direkt im Extrazellulärraum (sie binden u.U.
auch ganze Viren) - T-Zellen nur im Kontext mit Antigenpräsentation (MHC-Restriktion). Die
B-Zelle kann auch zur antigenpräsentierenden Zelle
werden (und dann alle möglichen Abbauprodukte z.B. eines
internalisierten Virus herzeigen).
direkt im Extrazellulärraum (sie binden u.U.
auch ganze Viren) - T-Zellen nur im Kontext mit Antigenpräsentation (MHC-Restriktion). Die
B-Zelle kann auch zur antigenpräsentierenden Zelle
werden (und dann alle möglichen Abbauprodukte z.B. eines
internalisierten Virus herzeigen).

Zur
Immunogenität von Antigenen s. auch
dort
Effektor-Lymphozyten verlassen den Lymphknoten und gelangen über
das Lymphgefäßsystem in die Blutbahn. Von hier aus können sie praktisch
jede Stelle des Körpers erreichen - insbesondere natürlich dort, wo sie
benötigt werden (infiziertes Gewebe).
Efferente Phase (Effektorphase) spezifischer Immunantworten
Dort können Effektor-Lymphozyten wieder in das Gewebe austreten (homing),
und zwar antigen-unabhängig. So können auch Lymphozyten extravasieren,
die gar keine antigenspezifischen Rezeptoren haben; dennoch stürzen sie
sich in die Schlacht. Lymphozyten ohne passende Rezeptoren verlassen
allerdings bald wieder den Ort des Getümmels.
An der efferenten Phase der Immunabwehr sind zelluläre und humorale Komponenten beteiligt, deren Funktion auf den folgenden Seiten genauer beschrieben wird: Lymphozyten (B-Effektorzellen, die Antikörper bilden; zytotoxische CD8+-T-Zellen; CD4+-T-Helferzellen), Komplementfaktoren, Zytokine (vgl. dazu dort).
Aktivierung durch zwei Signale. Sowohl T- als auch B-Lymphozyten bedürfen einer doppelten Anregung - durch T-Zell-Rezeptoren oder Immunglobuline, die an (peptidbeladene) MHC binden (Signal 1),
sowie costimulierende Molekülbrücken (Sognal 2) -, um entsprechende
Gene zun aktivieren und spezifische Abwehrvorgänge zu starten.
 CD4+-T-Effektorzellen (Helferzellen) werden durch unterschiedliche Zytokine dazu angeregt, sich in Th- (T-helper) Subklassen zu entwickeln, die unterschiedliche Funktionen erfüllen: Th1, Th2, Th17 und Treg-Lymphozyten. Diese üben ihre Funktionen durch die Sekretion von Zytokinen aus.
CD4+-T-Effektorzellen (Helferzellen) werden durch unterschiedliche Zytokine dazu angeregt, sich in Th- (T-helper) Subklassen zu entwickeln, die unterschiedliche Funktionen erfüllen: Th1, Th2, Th17 und Treg-Lymphozyten. Diese üben ihre Funktionen durch die Sekretion von Zytokinen aus.


Abbildung: Interaktion TH1-Zelle / Makrophage
Nach einer Vorlage in Hof / Dörries, Medizinische Mikrobiologie, 5. Aufl. Duale Reihe, Thieme 2014
Widerstehen Infektionserreger der Phagozytose, verstärken TH1-Zellen die
Abwehrpotenz von Phagozyten (hier: Makrophagen).
Diese Makrophagen aktivieren sich durch die Aufnahme des Antigens und
präsentieren dessen Peptide über MHC-II. Der Komplex wird über
T-Zell-Rezeptoren (TCR) erkannt. Abgesichert durch eine zusätzliche
Interaktion von CD40 am Makrophagen mit CD40-Liganden des Lymphozyten,
sezerniert dieser Interferon (IFN-γ), was den Phagozyten zusätzlich
anregt und zur Sekretion von Tumornekrosefaktor α, Radikalen und
anderen Wirkstoffen führt, die Bakterien abtöten können

 Th1-Zellen regulieren Entzündungsprozesse und interagieren mit antigenpräsentierenden Makrophagen, die sie über Zytokine aktivieren. Molekulare Brückenbildungen (T-Zell-Rezeptor und antigenbeladenes MHC-II, CD40-CD40-Ligand) und Interferon-γ (IFN-γ)
regen Makrophagen an, entzündungsanregendes TNF-α sowie toxische
Stoffe zu bilden (Sauerstoffradikale, Stickoxide, Proteasen,
bakterizide Stoffe) und Eisen aufzunehmen (dieses fehlt dann den Bakterien).
Th1-Zellen regulieren Entzündungsprozesse und interagieren mit antigenpräsentierenden Makrophagen, die sie über Zytokine aktivieren. Molekulare Brückenbildungen (T-Zell-Rezeptor und antigenbeladenes MHC-II, CD40-CD40-Ligand) und Interferon-γ (IFN-γ)
regen Makrophagen an, entzündungsanregendes TNF-α sowie toxische
Stoffe zu bilden (Sauerstoffradikale, Stickoxide, Proteasen,
bakterizide Stoffe) und Eisen aufzunehmen (dieses fehlt dann den Bakterien).
So tragen Th1-Zellen maßgeblich zur Abwehr von Bakterien und anderen
Infektionserregern bei: Sollten diese der Zerstörung in den
Phagolysosomen der Phagozyten widerstehen, verstärkt die Th1-Zelle die
Abwehrpotenz der Phagozyten durch Mechanismen, die z.T. in der  Abbildung dargestellt sind.
Abbildung dargestellt sind.
Gleichzeitig wirken Th1-Zellen regulatorisch, indem sie über Interferon-γ Th2-Zellen supprimieren. Weiters lösen sie (über IFN-γ) an B-Zellen einen Isotypenswitch von IgM zu IgG aus.
 Th2-Zellen wehren zusammen mit Eosinophilen Parasitenbefall ab.
Eosinophile Granulozyten präsentieren über MHC-II-Moleküle aus dem
Abbau stammende Fremdpeptide; Th2-Zellen "sehen" das über ihre
T-Zell-Rezeptoren und sezernieren Zytokine, was die Eosinophilen über
antiparasitär wirkende Stoffe effizienter macht und an B-Lymphozyten
einen Isotypenswitch zu IgE veranlasst (IgE-bedeckte Parasiten sind
über Fc-Rezeptoren an den Granulozyten leichter erkennbar).
Th2-Zellen wehren zusammen mit Eosinophilen Parasitenbefall ab.
Eosinophile Granulozyten präsentieren über MHC-II-Moleküle aus dem
Abbau stammende Fremdpeptide; Th2-Zellen "sehen" das über ihre
T-Zell-Rezeptoren und sezernieren Zytokine, was die Eosinophilen über
antiparasitär wirkende Stoffe effizienter macht und an B-Lymphozyten
einen Isotypenswitch zu IgE veranlasst (IgE-bedeckte Parasiten sind
über Fc-Rezeptoren an den Granulozyten leichter erkennbar).
Auch Th2-Zellen wirken regulatorisch: Sie supprimieren die Funktion von
Th1-Zellen. Auf diese Weise wirken sie entzündungshemmend.
 Abbildung: Lymphozyten des adaptiven Immunsystems
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Abbildung: Lymphozyten des adaptiven Immunsystems
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Die
verschiedenen Lymphozytenklassen erkennen unterschiedliche Antigenarten
und differenzieren sich in Effektorzellen, deren Funktion es ist,
Antigene zu eliminieren.
B-Zellen
erkennen lösliche oder Oberflächenantigene und entwickeln sich zu
antikörpersezernierenden Zellen (Plasmazellen). Antikörper können
Mikroben neutralisieren, Komplement aktivieren und die Phagozytose
extrazellulärer Mikroben anregen.
Helfer-T-Zellen
erkennen Antigene an der Oberfläche antigenpräsentierender Zellen und
sondern Zytokine ab; diese regen diverse Immunmechanismen (Aktivierung von Makrophagen, Aktivierung von B-Lymphozyten) und
Entzündungsvorgänge an.
Zytotoxische T-Zellen (CTL, CD8+-Zellen) erkennen MHC-I gebundene Fremdantigene
(z.B. viralen Ursprungs) - oder veränderte Eigenmerkmale (Krebszelle) -
und töten entsprechende infizierte / veränderte Zellen ab (veranlassen
sie zur Apoptose). Makrophagen im Gewebe phagozytieren anschließend die
abgestorbenen Zellen und töten intrazelluläre Pathogene dabei ab.
Dieser Vorgang benötigt keine Antikörper.
Regulatorische T-Zellen (TReg) beschränken die Aktivierung anderer Lymphozyten - insbesondere T-Zellen - und verhindern Autoimmunität

 Tfh-Zellen
(follicular helper cells) helfen bei der Antikörperproduktion,
Tfh-Zellen
(follicular helper cells) helfen bei der Antikörperproduktion,
indem sie die Funktion entsprechender
B-Zellen verstärken.
Voraussetzung ist deren MHC-II-mediierte Präsentation von Antigenen,
welche die Tfh-Zelle
erkennt. Dabei ist auch eine CD40/CD40L-Passung erforderlich (s. oben).
Die Anregung der B-Zellen - die zu Plasmazellen werden - erfolgt über
Zytokine. Tfh-Zellen sind durch ihren B-Zell-
Follikel-
Homing-Rezeptor CXCR5 identifizierbar, den sie konstitutiv exprimieren.
 Th17-Zellen locken neutrophile Granulozyten an.
Th17-Zellen locken neutrophile Granulozyten an. Das
tun sie, indem sie Interleukin 17 ausschütten (daher ihr Name), was
umliegende Zellen zur Bildung von IL-8 veranlasst - dieses lockt
Neutrophile an, sie dann in das entzündete Gewebe übertreten.
Th17-Zellen können sich an der Aktivierung von Makrophagen beteiligen
(

Abbildung).
 CD4+-Treg-Zellen wirken immunsuppressiv
CD4+-Treg-Zellen wirken immunsuppressiv
(
regulatorisch). Sie spielen bei der Unterdrückung unerwünschter Immunreaktionen eine
Rolle, z.B. werden Reaktionen gegen Nahrungsbestandteile, normale
Darmflora oder Umweltfaktoren möglichst klein gehalten.
 CD8+-T-Effektorzellen (zytotoxische T-Lymphozyten) zerstören Zellen, in denen sich Krankheitserreger vermehren (in erster Linie Viren). Erkennen T-Zellen fremde Peptide an den MHC-I-Molekülen
infizierter Zellen, lösen sie ein Programm aus, das - einmal in Gang
gesetzt - zum Untergang der infizierten Zelle
führt ("kiss of death"). CD8+-T-Lymphozyten setzen ihre Patrouille fort und machen sich auf die Suche nach weiteren passenden Zielzellen.
CD8+-T-Effektorzellen (zytotoxische T-Lymphozyten) zerstören Zellen, in denen sich Krankheitserreger vermehren (in erster Linie Viren). Erkennen T-Zellen fremde Peptide an den MHC-I-Molekülen
infizierter Zellen, lösen sie ein Programm aus, das - einmal in Gang
gesetzt - zum Untergang der infizierten Zelle
führt ("kiss of death"). CD8+-T-Lymphozyten setzen ihre Patrouille fort und machen sich auf die Suche nach weiteren passenden Zielzellen.
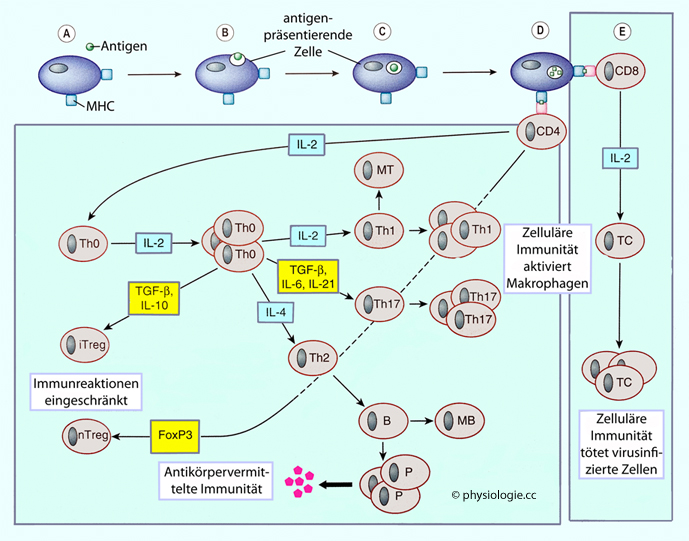
 Abbildung: Aktivierung von Lymphozyten in der Induktions- und Effektorphase
Abbildung: Aktivierung von Lymphozyten in der Induktions- und Effektorphase
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
A-D: Antigen- präsentierende Zellen phagozytieren und verarbeiten Antigen und präsentieren die entstandenen Peptide naiven CD8+- Zellen über MHC-I, oder naiven CD4+- Zellen über MHC-II.
E: Aktivierte CD8+- Zellen exprimieren IL-2- Rezeptoren und bilden IL-2. Diese Selbstimulation macht aus ihnen zytotoxische T-Zellen (TC), die virusinfizierte Zellen töten können.
Großer Block links: Aktivierte CD4+- Zellen exprimieren IL-2- Rezeptoren und bilden IL-2. Diese Selbstimulation führt zu Proliferation und Entstehung von Th0-Zellen.
Autokrin gebildete Zytokine - z.B. IL-4 - machen aus einigen von ihnen
Th2-Zellen, aus denen humorale Immunität hervorgeht (MB =
memory-B-cell, P = Plasmazelle). Andere Zytokine lassen Th1, Th17
(beide aktivieren Makrophagen) oder Treg (n = naturally occurring, i =
inducible) entstehen; Treg verhindern überschießende Immunreaktionen.

Damit es zu einem erfolgreichen Andocken an eine Zielzelle
kommt,
 müssen LFA-1-Moleküle des Lymphozyten an ICAM-1-Moleküle der
geprüften Zelle binden (Kontaktnahme).
müssen LFA-1-Moleküle des Lymphozyten an ICAM-1-Moleküle der
geprüften Zelle binden (Kontaktnahme).
 Dann prüfen Rezeptoren des
Lymphozyten (TCR), ob sie mit der präsentierten
MHC-I-Peptid-Kombination der potentiellen Zielzelle zusammenpassen.
Dann prüfen Rezeptoren des
Lymphozyten (TCR), ob sie mit der präsentierten
MHC-I-Peptid-Kombination der potentiellen Zielzelle zusammenpassen.
 Wenn ja, sezerniert die CD8+-T-Effektorzelle Perforin (das in die Zielzelle Membranporen schlägt) und Granzyme, welche dann in die Zelle eindringen und dort die Apoptosekaskade
initiieren (diese kann auch rezeptormediiert erfolgen).
Wenn ja, sezerniert die CD8+-T-Effektorzelle Perforin (das in die Zielzelle Membranporen schlägt) und Granzyme, welche dann in die Zelle eindringen und dort die Apoptosekaskade
initiieren (diese kann auch rezeptormediiert erfolgen).
Dieser
potentiell gefährliche Mechanismus kann, wenn er nicht nur
zielgerichtet auf infizierte Zellen wirkt, Gewebeschäden auslösen (z.B.
bei Virushepatitis - immunpathologische Komponente).
 B-Effektorzellen treten
auf den Plan, wenn der T-Zell-Mechanismus zur Erregerbekämpfung nicht
ausreicht oder Bakterien Toxine produzieren, die durch T-Zellen nicht
inaktiviert werden können. Wie auf der nächsten Seite genauer beschrieben, können Antikörper dreierlei bewirken:
B-Effektorzellen treten
auf den Plan, wenn der T-Zell-Mechanismus zur Erregerbekämpfung nicht
ausreicht oder Bakterien Toxine produzieren, die durch T-Zellen nicht
inaktiviert werden können. Wie auf der nächsten Seite genauer beschrieben, können Antikörper dreierlei bewirken:
 Neutralisation
durch Blockade antigener Strukturen, vor allem durch IgG und IgA.
Bindet der Antikörper, dann verliert das Antigen seine schädigende
Wirkung. Handelt es sich um Toxine, dann blockt die Bindung des Antikörpers die rezeptorvermittelte Aufnahme des Giftes in die Zelle. Sind es virale
Antigene, dann bedeutet die Bindung des Antikörpers, dass das Virus
nicht mehr an Oberflächenstrukturen der Zielzelle koppeln kann. Sind
Viren dennoch in die Zelle eingedrungen, kann ihre Replikation
blockiert werden, indem Antikörper die Ablesbarkeit der viralen
Nukleinsäuren behindern. Schließlich kann auch die Anheftung von Bakterien verhindert werden, indem ihre Adhäsionsmoleküle mit Antikörpern besetzt werden.
Neutralisation
durch Blockade antigener Strukturen, vor allem durch IgG und IgA.
Bindet der Antikörper, dann verliert das Antigen seine schädigende
Wirkung. Handelt es sich um Toxine, dann blockt die Bindung des Antikörpers die rezeptorvermittelte Aufnahme des Giftes in die Zelle. Sind es virale
Antigene, dann bedeutet die Bindung des Antikörpers, dass das Virus
nicht mehr an Oberflächenstrukturen der Zielzelle koppeln kann. Sind
Viren dennoch in die Zelle eingedrungen, kann ihre Replikation
blockiert werden, indem Antikörper die Ablesbarkeit der viralen
Nukleinsäuren behindern. Schließlich kann auch die Anheftung von Bakterien verhindert werden, indem ihre Adhäsionsmoleküle mit Antikörpern besetzt werden.
 Komplement: Bestimmte Antikörper können Komplement aktivieren und so Zielzellen angreifen (
Komplement: Bestimmte Antikörper können Komplement aktivieren und so Zielzellen angreifen ( s. dort).
s. dort).
 Bindung von Antikörpern an Fc-Rezeptoren:
Bindung von Antikörpern an Fc-Rezeptoren:  s. dort.
s. dort.
Immunologische Toleranz
Unter den vielen - durch somatische Hypermutation hervorgegangenen - antigenspezifischen Spielarten von (naiven) Lymphozyten entstehen auch solche, die körpereigene Merkmale (Epitope)
erkennen und potentiell angreifen können. Um zu verhindern, dass es
hier zu Klonselektion und Autoimmunreaktionen kommt, existieren
Toleranzmechanismen, die das verhindern.

Man unterscheidet
 zentrale Toleranz, welche die Entwicklung entsprechender Lymphozyten in zentralen lymphatischen Organen (B-Zellen: Knochenmark, T-Zellen: Thymus) verhindert, und
zentrale Toleranz, welche die Entwicklung entsprechender Lymphozyten in zentralen lymphatischen Organen (B-Zellen: Knochenmark, T-Zellen: Thymus) verhindert, und
 periphere Toleranz, die sich auf schon reife (immunkompetente) Lymphozyten in der Peripherie auswirkt.
periphere Toleranz, die sich auf schon reife (immunkompetente) Lymphozyten in der Peripherie auswirkt.
 Zentrale Toleranz und T-Lymphozyten: Über die Entwicklung der T-Zellen im Thymus (positive / negative Selektion) s. dort.
Zentrale Toleranz und T-Lymphozyten: Über die Entwicklung der T-Zellen im Thymus (positive / negative Selektion) s. dort.
Zentrale Toleranz und B-Lymphozyten: Reife B-Zellen exprimieren B-Zell-Rezeptoren
vom IgM-Typ. Mit diesen wird die Bindungsstärke an umliegende Antigene
getestet und die Antigenspezifität kann durch Rekombination mit V- und
J-Elementen verändert werden (Rezeptoredition).
Dadurch wird die Spezifität des Antikörpers variiert. Trifft die reife
B-Zelle später auf ein körpereigenes Antigen, unterliegt sie entweder
der Apoptose (Deletion), oder es gelingt ihr, die Zahl der Rezeptoren in ihrer Membran herunterzuregulieren und dadurch nicht aktiviert zu werden (Rezeptormodulation).
Periphere Toleranz: Die zentralen Toleranzmechanismen können nicht verhindern, dass im Körper zahlreiche reife autoreaktive Lymphozyten vorkommen.
Verschiedene Mechanismen sorgen normalerweise dafür, dass
Autoimmunkomplikationen dennoch ausbleiben. Dazu zählen u.a. Deletion,
Anergie (Ausbleiben von Proliferation / Zytokinproduktion), Suppression
(unterdrückte Aktivierung), Ignoranz (des Epitops) u.a. Autoreaktiven
B-Zellen kann die Hilfe durch T-Zellen verweigert werden (periphere
B-Zell-Toleranz).
Immunologisches Gedächtnis
 vgl. dort
vgl. dort
Ist
die Effektorphase abgeschlossen, verschwindet der Großteil der
beteiligten Lymphozyten - sie benötigen für ihr Überleben Kontakt mit
dem betreffenden Epitop, fehlt dieses, unterliegen sie der Apoptose
(und die entstehenden Bruchstücke
werden phagozytiert).
Gedächtniszellen (memory cells)
eines speziellen Lymphozytenklons bleiben für Jahre oder sogar
lebenslang bestehen, nachdem der entsprechende Antigenstimulus
stattgefunden hat (im Gegensatz zu Effektorzellen,
die bald nach Ablauf der Immunantwort wieder verschwinden).
Gedächtniszellen verfügen über Antigenrezeptoren besonders hoher
Affinität zu "ihrem" Epitop, sowie über eine sehr effektive Kombination
von Adhäsionsmolekülen und Zytokinrezeptoren. Das macht ihre
Extravasation (Auswanderung aus der Blutbahn in betreffendes Gewebe)
besonders wirksam.
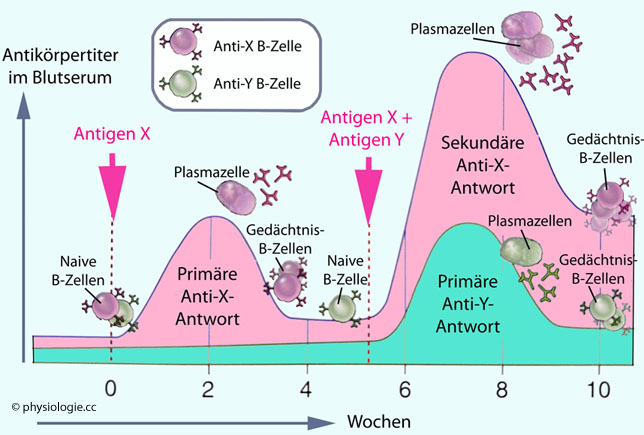

Abbildung: Primäre und sekundäre Immunantwort, immunologisches Gedächtnis (schematisch)
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
X
und Y sind in den Organismus verbrachte Antigene. Sie führen zur
Selektion entsprechender Lymphozytenklone und zur Bildung spezifischer
Antikörper. Der entsprechende
Antikörpertiter
steigt
nach Erstkontakt mit einem Antigen (bei X links, bei Y rechts) nur
mäßig an; nach einem Zweitkontakt (mehrere Wochen später) mit demselben
Antigen (bei X, rechts) steigt der Antikörpertiter wesentlich
rascher und (bis hundertfach) stärker an (Effekt der Gedächtniszellen).
Nach einem Erstkontakt vergehen meist 1-3 Wochen bis zur effektiven Reaktion
(primäre Immunantwort), nach einem Zweitkontakt hingegen nur 2-7 Tage
(sekundäre Immunantwort).
Der Antikörpertiter nimmt nach jeder Reaktion auf das Antigen im Laufe
ca. einer Woche nach der stärksten Reaktion wieder ab - auf einen im
Vergleich zum Zustand vor dem Antigenkontakt erhöhten Blutspiegel.
Die Abbildung zeigt die Dynamik der Reaktion von B-Lymphozyten; T-Lymphozyten zeigen einen analogen Reaktionsverlauf

Was sich nach dem ersten Kontakt mit einem Antigenträger bzw. Pathogen
im adaptiven Immunsystem abspielt, wird als primäre Immunantwort (primary immune response)
bezeichnet. Um für eine mögliche weitere Begegnung mit dem Pathogen
besser gewappnet zu sein, bildet sich ein immunologisches Gedächtnis
aus; dieses ist dann zu einer - rascher und effizienter wirkenden -
sekundären Immunantwort (secondary immune response) fähig.
Alle Immunantworten sind selbstbeschränkt,
d.h. nach der Beseitigung der Infektionserreger nimmt die Zahl der
entsprechenden Klonzellen und der Serumspiegel der Antikörper wieder
ab, verbleibt aber auf einem höheren Pegel als vor dem Erstkontakt.
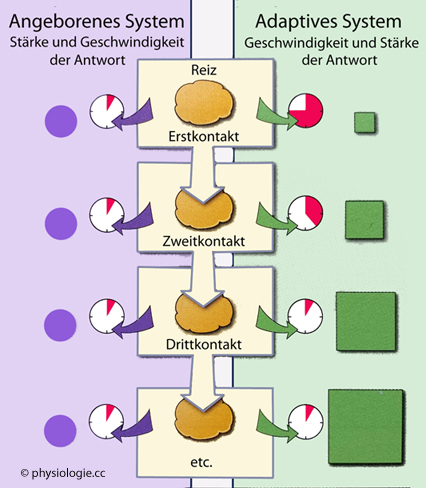
 Abbildung: Vergleich angeborenes / adaptives System
Abbildung: Vergleich angeborenes / adaptives System
Nach einer Vorlage in Doan / Lievano /
Swanson-Mungerson / Viselli, Immunology (3rd ed). Lippincott
Illustrated Reviews, Wolters Kluwer 2022
Das
angeborene System (links) reagiert immer gleich intensiv und rasch auf eine
gegebene Reizung. Das adaptive hingegen (rechts) verstärkt seine
Antwort und verkürzt die Reaktionsdauer mit wiederholter Exponierung (immunologisches Gedächtnis)

Einige Zellen des betreffenden Lymphozytenklons gehen nicht zugrunde, sondern werden zu Gedächtniszellen.
Diese wandern in lymphoide Organe, Schleimhäute, Haut und andere Gewebe
aus und behalten auch in Abwesenheit des Antigens
weiter Effektorfunktion gegen "ihr" Antigen. Gedächtniszellen wandern -
so wie andere Lymphozyten - ständig zwischen Kreislauf und Gewebe hin
und her, sozusagen auf der Suche nach möglicherweise vorhandenen
passenden Antigenen (zirkulierender Lymphozytenpool).
Betritt ein Erreger, gegen den schon eine Immunantwort ins Laufen
gebracht wurde, den Organismus nochmals, kommt es zu einer sekunfären Immunantwort: Diese ist aufgrund der Anwesenheit betreffender Gedächtniszellen um 1-2 Zehnerpotenzen verstärkt und zeitlich
beschleunigt, d.h. es entstehen wesentlich mehr spezifische Lymphozyten
als bei der ersten Exposition (Grundlage des Impfeffekts).
Dies gilt im
Prinzip sowohl für B- als auch für T-Zellen, wobei die Mechanismen im
Einzelnen unterschiedlich sind und im Detail noch erforscht werden.
 Das B-Zell-Gedächtnis wird
getragen von spezialisierten B-Gedächtniszellen sowie Plasmazellen mit
hoher Lebensdauer. Während bei der primären Immunantwort zunächst IgM
oder IgD in der Membran von T-Lymphozyten als Rezeptoren dienen, die
Antigen binden und seine Phagozytose einleiten (was zur Präsentation
von Bruchstücken über MHC-II an Th-Lymphozyten führt), bilden B-Gedächtniszellen von Anfang an IgG.
Das B-Zell-Gedächtnis wird
getragen von spezialisierten B-Gedächtniszellen sowie Plasmazellen mit
hoher Lebensdauer. Während bei der primären Immunantwort zunächst IgM
oder IgD in der Membran von T-Lymphozyten als Rezeptoren dienen, die
Antigen binden und seine Phagozytose einleiten (was zur Präsentation
von Bruchstücken über MHC-II an Th-Lymphozyten führt), bilden B-Gedächtniszellen von Anfang an IgG.
Die Sekundärantwort operiert von Anfang an mit IgG, die Latenzzeit ist kürzer als bei der Primärantwort
|
Bei erneutem Antigenkontakt teilen sich die
betreffenden Gedächtniszellen und bilden neue Gedächtnis- sowie kurz- und
langlebige Plasmazellen. Letztere wandern in das Knochenmark, wo sie
kontinuierlich vermehrt Antikörper bilden (was einen oft über Jahre
anhaltenden spezifischen Schutz verleiht).
 Das T-Zell-Gedächtnis beruht
auf einer über Monate erfolgenden Vermehrung der Zellen betreffender
Klone; die (relativ kleinen) Gedächtniszellen entwickeln ein breites
Expressionsspektrum für verschiedene Zytokine. Gedächtnis-T-Zellen
entwickeln sich in mehrere spezialisierte Subpopulationen; einige einige kehren nicht mehr in die Blutbahn zurück und verbleiben in lymphatischem Gewebe, andere wandern in periphere Gewebe aus.
Das T-Zell-Gedächtnis beruht
auf einer über Monate erfolgenden Vermehrung der Zellen betreffender
Klone; die (relativ kleinen) Gedächtniszellen entwickeln ein breites
Expressionsspektrum für verschiedene Zytokine. Gedächtnis-T-Zellen
entwickeln sich in mehrere spezialisierte Subpopulationen; einige einige kehren nicht mehr in die Blutbahn zurück und verbleiben in lymphatischem Gewebe, andere wandern in periphere Gewebe aus.
 Booster-Effekt (Boosterung): Wiederholter Antigenkontakt - mit Krankheitserregern, oder im Rahmen von Auffrischungsimpfungen
(aktive Immunisierung) - hat Immunreaktionen zunehmender Stärke, und
damit wachsenden Schutz vor der betreffenden Krankheit zur Folge.
Booster-Effekt (Boosterung): Wiederholter Antigenkontakt - mit Krankheitserregern, oder im Rahmen von Auffrischungsimpfungen
(aktive Immunisierung) - hat Immunreaktionen zunehmender Stärke, und
damit wachsenden Schutz vor der betreffenden Krankheit zur Folge.
 Zu den Typen der Hypersensitivität (Coombs-Schema: Typ I bis IV)
Zu den Typen der Hypersensitivität (Coombs-Schema: Typ I bis IV)  s. dort
s. dort


 Angeborenes und adaptives Immunsystem kooperieren mehrfach.
Granulozyten, Makrophagen und dendritische Zellen (DC) erkennen
mikrobielle Molekülmuster; DCs, die im Gewebe Antigene gefunden und
aufgenommen haben, werden zu "reifen" DCs: Sie präsentieren in
regionalen Lymphknoten Antigenbruchstücke über MHC-II an Helferzellen
(CD4+) und steigern die Expression von Cofaktoren
Angeborenes und adaptives Immunsystem kooperieren mehrfach.
Granulozyten, Makrophagen und dendritische Zellen (DC) erkennen
mikrobielle Molekülmuster; DCs, die im Gewebe Antigene gefunden und
aufgenommen haben, werden zu "reifen" DCs: Sie präsentieren in
regionalen Lymphknoten Antigenbruchstücke über MHC-II an Helferzellen
(CD4+) und steigern die Expression von Cofaktoren
 T-Zellen suchen dendritische Zellen im Lymphknoten nach passenden
MHC-II / Peptid-Komplexen ab und bilden (bei deren Vorhandensein) einen
Klon, der auf das erkannte Antigen spezifisch anspricht (Klonselektion) T-Zellen suchen dendritische Zellen im Lymphknoten nach passenden
MHC-II / Peptid-Komplexen ab und bilden (bei deren Vorhandensein) einen
Klon, der auf das erkannte Antigen spezifisch anspricht (Klonselektion)
 Induktionsphase: Die Aktivierung der T-Zellen bedarf zusätzlicher
Wechselwirkungen (Signal 1: TCR-MHC-Passung, Signal 2: Interaktion
lymphozytäres CD28 - dendritisches B7; eventuell auch weitere
Interaktionen); T-Zellen sind MHC-restringiert
Induktionsphase: Die Aktivierung der T-Zellen bedarf zusätzlicher
Wechselwirkungen (Signal 1: TCR-MHC-Passung, Signal 2: Interaktion
lymphozytäres CD28 - dendritisches B7; eventuell auch weitere
Interaktionen); T-Zellen sind MHC-restringiert
 Naive B-Zellen wandern in lymphatischem Gewebe durch T-Zell-abhängige
Bereiche hindurch zu B-Zell-Zonen. B-Zellen erkennen antigene Epitope
im Extrazellulärraum, können auch ganze Viren binden und Antigene
präsentieren Naive B-Zellen wandern in lymphatischem Gewebe durch T-Zell-abhängige
Bereiche hindurch zu B-Zell-Zonen. B-Zellen erkennen antigene Epitope
im Extrazellulärraum, können auch ganze Viren binden und Antigene
präsentieren
 Effektorphase: Effektor-Lymphozyten wandern in die Blutbahn und können an beliebigen Stellen in das Gewebe austreten. Effektorphase: Effektor-Lymphozyten wandern in die Blutbahn und können an beliebigen Stellen in das Gewebe austreten.
-- Helferzellen (CD4+) bilden Zytokine;
-- Th1-Zellen interagieren mit
antigenpräsentierenden Makrophagen, regen Phagozyten an und wirken
regulatorisch;
-- Th2-Zellen bekämpfen Parasiten und supprimieren Th1-Zellen;
-- Tfh-Zellen stimulieren B-Zellen;
-- Th17-Zellen locken neutrophile Granulozyten an;
-- CD4+-Treg-Zellen wirken immunsuppressiv;
-- CD8+-T-Effektorzellen (zytotoxische T-Lymphozyten) zerstören Zellen, in denen sich Krankheitserreger vermehren
 Immuntoleranz: Zentrale Toleranz verhindert die Entwicklung
entsprechender Lymphozyten in zentralen lymphatischen Organen
(Knochenmark für B-Zellen, Thymus für T-Zellen), periphere
Toleranz wirkt auf periphere immunkompetente Lymphozyten
Immuntoleranz: Zentrale Toleranz verhindert die Entwicklung
entsprechender Lymphozyten in zentralen lymphatischen Organen
(Knochenmark für B-Zellen, Thymus für T-Zellen), periphere
Toleranz wirkt auf periphere immunkompetente Lymphozyten
 Immunologisches Gedächtnis: Einige Lymphozytenklons werden zu
Gedächtniszellen. Sie wandern in lymphoide Organe, Schleimhäute, Haut
u.a. aus und behalten auch ohne Anregung durch "ihr" Antigen
Effektorfunktion. Späterer Antigenkontakt verstärkt die Immunreaktionen
Immunologisches Gedächtnis: Einige Lymphozytenklons werden zu
Gedächtniszellen. Sie wandern in lymphoide Organe, Schleimhäute, Haut
u.a. aus und behalten auch ohne Anregung durch "ihr" Antigen
Effektorfunktion. Späterer Antigenkontakt verstärkt die Immunreaktionen
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Adaptive Immunität
Adaptive Immunität  Afferente Phase
Afferente Phase
 Induktionsphase
Induktionsphase  Efferente Phase
Efferente Phase  Immunologische Toleranz
Immunologische Toleranz  Immunologisches Gedächtnis
Immunologisches Gedächtnis

 Boosterung
Boosterung  Lymphozyten
Lymphozyten
 Core messages
Core messages Lymphozyten sind weiße Blutkörperchen (Leukozyten) mit einem großen runden Zellkern. Man unterscheidet thymusabhängige (T-), knochenmarkabhängige (B-) und innate lymphoid cells (ILCs), von denen natürliche Killerzellen (NK) einen wichtigen Subtypus darstellen. S. auch dort
Lymphozyten sind weiße Blutkörperchen (Leukozyten) mit einem großen runden Zellkern. Man unterscheidet thymusabhängige (T-), knochenmarkabhängige (B-) und innate lymphoid cells (ILCs), von denen natürliche Killerzellen (NK) einen wichtigen Subtypus darstellen. S. auch dort
 Abbildung: Sequenz der Phasen spezifischer Immunantwort
Abbildung: Sequenz der Phasen spezifischer Immunantwort
 Zunächst stellen sich den Erregern phagozytierende
Zellen in den Weg. Im Gewebe stehen Makrophagen und dendritische Zellen
(
Zunächst stellen sich den Erregern phagozytierende
Zellen in den Weg. Im Gewebe stehen Makrophagen und dendritische Zellen
( Abbildung unten) bereit, dazu kommen aus dem Blut ausgerückte
Granulozyten. Makrophagen und dendritische Zellen erkennen Erreger über Toll-ähnliche Rezeptoren sowie den DC-Faktor DEC-205 (auch: LY75, DC205; bindet dieser einen Infektionserreger, wird dessen Phagozytose gestartet).
Abbildung unten) bereit, dazu kommen aus dem Blut ausgerückte
Granulozyten. Makrophagen und dendritische Zellen erkennen Erreger über Toll-ähnliche Rezeptoren sowie den DC-Faktor DEC-205 (auch: LY75, DC205; bindet dieser einen Infektionserreger, wird dessen Phagozytose gestartet).  Selbsttoleranz
ist das Nicht-Ansprechen des adaptiven Immunsystems auf Eigenantigene.
Sie beruht hauptsächlich auf der Inaktivierung selbstreaktiver
Lymphozyten. Fehlerhafte Selbsttoleranz führt zu Autoimmunerkrankungen.
Selbsttoleranz
ist das Nicht-Ansprechen des adaptiven Immunsystems auf Eigenantigene.
Sie beruht hauptsächlich auf der Inaktivierung selbstreaktiver
Lymphozyten. Fehlerhafte Selbsttoleranz führt zu Autoimmunerkrankungen. Haben DCs im Gewebe hingegen Fremdmerkmale registriert, stoppen sie die
Pinozytose, regulieren die Zahl der PRR-Moleküle in ihrer Membran
herunter und konservieren so den ermittelten Gefahrenstatus ("reife"
DCs). Auf dem Weg in den Lymphknoten bearbeiten sie die aufgenommenen Antigene. Im Lymphknoten angekommen, präsentieren sie als differenzierte antigenpräsentierende Zellen ihre MHC-II / Peptidkomplexe an CD4+- (Helfer-) Lymphozyten. Auch erhöhen sie die Expression von Cofaktoren (wie CD80/86).
Haben DCs im Gewebe hingegen Fremdmerkmale registriert, stoppen sie die
Pinozytose, regulieren die Zahl der PRR-Moleküle in ihrer Membran
herunter und konservieren so den ermittelten Gefahrenstatus ("reife"
DCs). Auf dem Weg in den Lymphknoten bearbeiten sie die aufgenommenen Antigene. Im Lymphknoten angekommen, präsentieren sie als differenzierte antigenpräsentierende Zellen ihre MHC-II / Peptidkomplexe an CD4+- (Helfer-) Lymphozyten. Auch erhöhen sie die Expression von Cofaktoren (wie CD80/86). Die T-Zellen verhalten sich bei diesem Vorgang sehr aktiv und "suchen"
die dendritischen Zellen im Lymphknoten regelrecht nach passenden
MHC-II / Peptid-Komplexen ab. Haben sie den "passenden" Komplex
entdeckt, teilen sie sich und bilden einen T-Zell-Klon, der spezifisch
auf das erkannte Antigen anspricht.
Die T-Zellen verhalten sich bei diesem Vorgang sehr aktiv und "suchen"
die dendritischen Zellen im Lymphknoten regelrecht nach passenden
MHC-II / Peptid-Komplexen ab. Haben sie den "passenden" Komplex
entdeckt, teilen sie sich und bilden einen T-Zell-Klon, der spezifisch
auf das erkannte Antigen anspricht.
 Abbildung: Dendritische Zellen und afferente Phase der Immunantwort
Abbildung: Dendritische Zellen und afferente Phase der Immunantwort
 TNF-α aus aktivierten
Makrophagen,
TNF-α aus aktivierten
Makrophagen,  Aktivierung verschiedener Rezeptoren (Mannoserezeptor,
DEC-205, Komplementrezeptoren) und
Aktivierung verschiedener Rezeptoren (Mannoserezeptor,
DEC-205, Komplementrezeptoren) und  Zytokine, die zum Teil
autokrin-verstärkend auf die gereizte Zelle einwirken.
Zytokine, die zum Teil
autokrin-verstärkend auf die gereizte Zelle einwirken. 
 Abbildung: Phasen der adaptiven Immunantwort
Abbildung: Phasen der adaptiven Immunantwort
 , exprimieren sie vermehrt Chemokinmoleküle und
Adhäsionsrezeptoren, was ihre Verweildauer in der T-Zell-Zone
verlängert. Dies erhöht die Effizienz der Wechselwirkung mit bereits
antigenspezifisch aktivierten CD4+-T-Zellen
(wobei dasselbe Antigen erkannt werden muss!).
, exprimieren sie vermehrt Chemokinmoleküle und
Adhäsionsrezeptoren, was ihre Verweildauer in der T-Zell-Zone
verlängert. Dies erhöht die Effizienz der Wechselwirkung mit bereits
antigenspezifisch aktivierten CD4+-T-Zellen
(wobei dasselbe Antigen erkannt werden muss!).  B-Zellen erkennen
antigene Epitope
B-Zellen erkennen
antigene Epitope  direkt im Extrazellulärraum (sie binden u.U.
auch ganze Viren) - T-Zellen nur im Kontext mit Antigenpräsentation (MHC-Restriktion). Die
B-Zelle kann auch zur antigenpräsentierenden Zelle
werden (und dann alle möglichen Abbauprodukte z.B. eines
internalisierten Virus herzeigen).
direkt im Extrazellulärraum (sie binden u.U.
auch ganze Viren) - T-Zellen nur im Kontext mit Antigenpräsentation (MHC-Restriktion). Die
B-Zelle kann auch zur antigenpräsentierenden Zelle
werden (und dann alle möglichen Abbauprodukte z.B. eines
internalisierten Virus herzeigen). CD4+-T-Effektorzellen (Helferzellen) werden durch unterschiedliche Zytokine dazu angeregt, sich in Th- (T-helper) Subklassen zu entwickeln, die unterschiedliche Funktionen erfüllen: Th1, Th2, Th17 und Treg-Lymphozyten. Diese üben ihre Funktionen durch die Sekretion von Zytokinen aus.
CD4+-T-Effektorzellen (Helferzellen) werden durch unterschiedliche Zytokine dazu angeregt, sich in Th- (T-helper) Subklassen zu entwickeln, die unterschiedliche Funktionen erfüllen: Th1, Th2, Th17 und Treg-Lymphozyten. Diese üben ihre Funktionen durch die Sekretion von Zytokinen aus. 
 Abbildung: Interaktion TH1-Zelle / Makrophage
Abbildung: Interaktion TH1-Zelle / Makrophage
 Th1-Zellen regulieren Entzündungsprozesse und interagieren mit antigenpräsentierenden Makrophagen, die sie über Zytokine aktivieren. Molekulare Brückenbildungen (T-Zell-Rezeptor und antigenbeladenes MHC-II, CD40-CD40-Ligand) und Interferon-γ (IFN-γ)
regen Makrophagen an, entzündungsanregendes TNF-α sowie toxische
Stoffe zu bilden (Sauerstoffradikale, Stickoxide, Proteasen,
bakterizide Stoffe) und Eisen aufzunehmen (dieses fehlt dann den Bakterien).
Th1-Zellen regulieren Entzündungsprozesse und interagieren mit antigenpräsentierenden Makrophagen, die sie über Zytokine aktivieren. Molekulare Brückenbildungen (T-Zell-Rezeptor und antigenbeladenes MHC-II, CD40-CD40-Ligand) und Interferon-γ (IFN-γ)
regen Makrophagen an, entzündungsanregendes TNF-α sowie toxische
Stoffe zu bilden (Sauerstoffradikale, Stickoxide, Proteasen,
bakterizide Stoffe) und Eisen aufzunehmen (dieses fehlt dann den Bakterien).  Abbildung dargestellt sind.
Abbildung dargestellt sind. Th2-Zellen wehren zusammen mit Eosinophilen Parasitenbefall ab.
Eosinophile Granulozyten präsentieren über MHC-II-Moleküle aus dem
Abbau stammende Fremdpeptide; Th2-Zellen "sehen" das über ihre
T-Zell-Rezeptoren und sezernieren Zytokine, was die Eosinophilen über
antiparasitär wirkende Stoffe effizienter macht und an B-Lymphozyten
einen Isotypenswitch zu IgE veranlasst (IgE-bedeckte Parasiten sind
über Fc-Rezeptoren an den Granulozyten leichter erkennbar).
Th2-Zellen wehren zusammen mit Eosinophilen Parasitenbefall ab.
Eosinophile Granulozyten präsentieren über MHC-II-Moleküle aus dem
Abbau stammende Fremdpeptide; Th2-Zellen "sehen" das über ihre
T-Zell-Rezeptoren und sezernieren Zytokine, was die Eosinophilen über
antiparasitär wirkende Stoffe effizienter macht und an B-Lymphozyten
einen Isotypenswitch zu IgE veranlasst (IgE-bedeckte Parasiten sind
über Fc-Rezeptoren an den Granulozyten leichter erkennbar).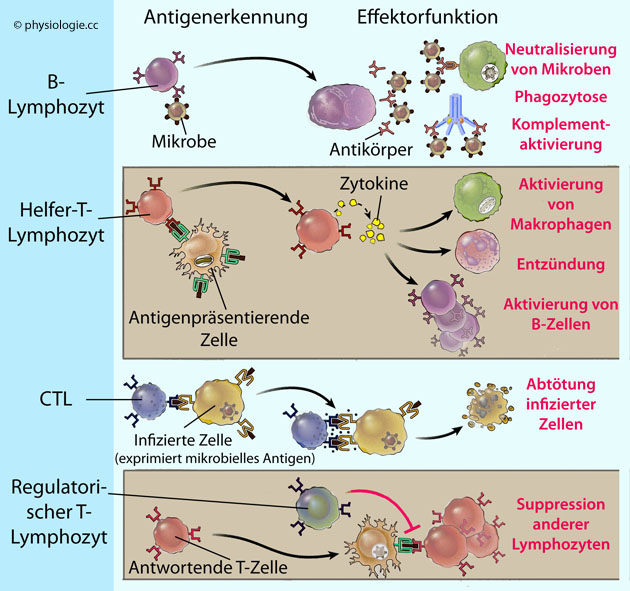
 Abbildung: Lymphozyten des adaptiven Immunsystems
Abbildung: Lymphozyten des adaptiven Immunsystems
 Tfh-Zellen
(follicular helper cells) helfen bei der Antikörperproduktion,
indem sie die Funktion entsprechender B-Zellen verstärken.
Voraussetzung ist deren MHC-II-mediierte Präsentation von Antigenen,
welche die Tfh-Zelle erkennt. Dabei ist auch eine CD40/CD40L-Passung erforderlich (s. oben).
Die Anregung der B-Zellen - die zu Plasmazellen werden - erfolgt über
Zytokine. Tfh-Zellen sind durch ihren B-Zell-Follikel-Homing-Rezeptor CXCR5 identifizierbar, den sie konstitutiv exprimieren.
Tfh-Zellen
(follicular helper cells) helfen bei der Antikörperproduktion,
indem sie die Funktion entsprechender B-Zellen verstärken.
Voraussetzung ist deren MHC-II-mediierte Präsentation von Antigenen,
welche die Tfh-Zelle erkennt. Dabei ist auch eine CD40/CD40L-Passung erforderlich (s. oben).
Die Anregung der B-Zellen - die zu Plasmazellen werden - erfolgt über
Zytokine. Tfh-Zellen sind durch ihren B-Zell-Follikel-Homing-Rezeptor CXCR5 identifizierbar, den sie konstitutiv exprimieren. Th17-Zellen locken neutrophile Granulozyten an. Das
tun sie, indem sie Interleukin 17 ausschütten (daher ihr Name), was
umliegende Zellen zur Bildung von IL-8 veranlasst - dieses lockt
Neutrophile an, sie dann in das entzündete Gewebe übertreten.
Th17-Zellen können sich an der Aktivierung von Makrophagen beteiligen
(
Th17-Zellen locken neutrophile Granulozyten an. Das
tun sie, indem sie Interleukin 17 ausschütten (daher ihr Name), was
umliegende Zellen zur Bildung von IL-8 veranlasst - dieses lockt
Neutrophile an, sie dann in das entzündete Gewebe übertreten.
Th17-Zellen können sich an der Aktivierung von Makrophagen beteiligen
( Abbildung).
Abbildung). CD4+-Treg-Zellen wirken immunsuppressiv
(regulatorisch). Sie spielen bei der Unterdrückung unerwünschter Immunreaktionen eine
Rolle, z.B. werden Reaktionen gegen Nahrungsbestandteile, normale
Darmflora oder Umweltfaktoren möglichst klein gehalten.
CD4+-Treg-Zellen wirken immunsuppressiv
(regulatorisch). Sie spielen bei der Unterdrückung unerwünschter Immunreaktionen eine
Rolle, z.B. werden Reaktionen gegen Nahrungsbestandteile, normale
Darmflora oder Umweltfaktoren möglichst klein gehalten.
 CD8+-T-Effektorzellen (zytotoxische T-Lymphozyten) zerstören Zellen, in denen sich Krankheitserreger vermehren (in erster Linie Viren). Erkennen T-Zellen fremde Peptide an den MHC-I-Molekülen
infizierter Zellen, lösen sie ein Programm aus, das - einmal in Gang
gesetzt - zum Untergang der infizierten Zelle
führt ("kiss of death"). CD8+-T-Lymphozyten setzen ihre Patrouille fort und machen sich auf die Suche nach weiteren passenden Zielzellen.
CD8+-T-Effektorzellen (zytotoxische T-Lymphozyten) zerstören Zellen, in denen sich Krankheitserreger vermehren (in erster Linie Viren). Erkennen T-Zellen fremde Peptide an den MHC-I-Molekülen
infizierter Zellen, lösen sie ein Programm aus, das - einmal in Gang
gesetzt - zum Untergang der infizierten Zelle
führt ("kiss of death"). CD8+-T-Lymphozyten setzen ihre Patrouille fort und machen sich auf die Suche nach weiteren passenden Zielzellen.
 Abbildung: Aktivierung von Lymphozyten in der Induktions- und Effektorphase
Abbildung: Aktivierung von Lymphozyten in der Induktions- und Effektorphase
 müssen LFA-1-Moleküle des Lymphozyten an ICAM-1-Moleküle der
geprüften Zelle binden (Kontaktnahme).
müssen LFA-1-Moleküle des Lymphozyten an ICAM-1-Moleküle der
geprüften Zelle binden (Kontaktnahme).  Dann prüfen Rezeptoren des
Lymphozyten (TCR), ob sie mit der präsentierten
MHC-I-Peptid-Kombination der potentiellen Zielzelle zusammenpassen.
Dann prüfen Rezeptoren des
Lymphozyten (TCR), ob sie mit der präsentierten
MHC-I-Peptid-Kombination der potentiellen Zielzelle zusammenpassen.
 Wenn ja, sezerniert die CD8+-T-Effektorzelle Perforin (das in die Zielzelle Membranporen schlägt) und Granzyme, welche dann in die Zelle eindringen und dort die Apoptosekaskade
initiieren (diese kann auch rezeptormediiert erfolgen).
Wenn ja, sezerniert die CD8+-T-Effektorzelle Perforin (das in die Zielzelle Membranporen schlägt) und Granzyme, welche dann in die Zelle eindringen und dort die Apoptosekaskade
initiieren (diese kann auch rezeptormediiert erfolgen).  B-Effektorzellen treten
auf den Plan, wenn der T-Zell-Mechanismus zur Erregerbekämpfung nicht
ausreicht oder Bakterien Toxine produzieren, die durch T-Zellen nicht
inaktiviert werden können. Wie auf der nächsten Seite genauer beschrieben, können Antikörper dreierlei bewirken:
B-Effektorzellen treten
auf den Plan, wenn der T-Zell-Mechanismus zur Erregerbekämpfung nicht
ausreicht oder Bakterien Toxine produzieren, die durch T-Zellen nicht
inaktiviert werden können. Wie auf der nächsten Seite genauer beschrieben, können Antikörper dreierlei bewirken: Neutralisation
durch Blockade antigener Strukturen, vor allem durch IgG und IgA.
Bindet der Antikörper, dann verliert das Antigen seine schädigende
Wirkung. Handelt es sich um Toxine, dann blockt die Bindung des Antikörpers die rezeptorvermittelte Aufnahme des Giftes in die Zelle. Sind es virale
Antigene, dann bedeutet die Bindung des Antikörpers, dass das Virus
nicht mehr an Oberflächenstrukturen der Zielzelle koppeln kann. Sind
Viren dennoch in die Zelle eingedrungen, kann ihre Replikation
blockiert werden, indem Antikörper die Ablesbarkeit der viralen
Nukleinsäuren behindern. Schließlich kann auch die Anheftung von Bakterien verhindert werden, indem ihre Adhäsionsmoleküle mit Antikörpern besetzt werden.
Neutralisation
durch Blockade antigener Strukturen, vor allem durch IgG und IgA.
Bindet der Antikörper, dann verliert das Antigen seine schädigende
Wirkung. Handelt es sich um Toxine, dann blockt die Bindung des Antikörpers die rezeptorvermittelte Aufnahme des Giftes in die Zelle. Sind es virale
Antigene, dann bedeutet die Bindung des Antikörpers, dass das Virus
nicht mehr an Oberflächenstrukturen der Zielzelle koppeln kann. Sind
Viren dennoch in die Zelle eingedrungen, kann ihre Replikation
blockiert werden, indem Antikörper die Ablesbarkeit der viralen
Nukleinsäuren behindern. Schließlich kann auch die Anheftung von Bakterien verhindert werden, indem ihre Adhäsionsmoleküle mit Antikörpern besetzt werden. Komplement: Bestimmte Antikörper können Komplement aktivieren und so Zielzellen angreifen (
Komplement: Bestimmte Antikörper können Komplement aktivieren und so Zielzellen angreifen ( s. dort).
s. dort). Bindung von Antikörpern an Fc-Rezeptoren:
Bindung von Antikörpern an Fc-Rezeptoren:  s. dort.
s. dort. Man unterscheidet
Man unterscheidet  zentrale Toleranz, welche die Entwicklung entsprechender Lymphozyten in zentralen lymphatischen Organen (B-Zellen: Knochenmark, T-Zellen: Thymus) verhindert, und
zentrale Toleranz, welche die Entwicklung entsprechender Lymphozyten in zentralen lymphatischen Organen (B-Zellen: Knochenmark, T-Zellen: Thymus) verhindert, und periphere Toleranz, die sich auf schon reife (immunkompetente) Lymphozyten in der Peripherie auswirkt.
periphere Toleranz, die sich auf schon reife (immunkompetente) Lymphozyten in der Peripherie auswirkt. Zentrale Toleranz und T-Lymphozyten: Über die Entwicklung der T-Zellen im Thymus (positive / negative Selektion) s. dort.
Zentrale Toleranz und T-Lymphozyten: Über die Entwicklung der T-Zellen im Thymus (positive / negative Selektion) s. dort. vgl. dort
vgl. dort
 Abbildung: Primäre und sekundäre Immunantwort, immunologisches Gedächtnis (schematisch)
Abbildung: Primäre und sekundäre Immunantwort, immunologisches Gedächtnis (schematisch)

 Abbildung: Vergleich angeborenes / adaptives System
Abbildung: Vergleich angeborenes / adaptives System
 Das B-Zell-Gedächtnis wird
getragen von spezialisierten B-Gedächtniszellen sowie Plasmazellen mit
hoher Lebensdauer. Während bei der primären Immunantwort zunächst IgM
oder IgD in der Membran von T-Lymphozyten als Rezeptoren dienen, die
Antigen binden und seine Phagozytose einleiten (was zur Präsentation
von Bruchstücken über MHC-II an Th-Lymphozyten führt), bilden B-Gedächtniszellen von Anfang an IgG.
Das B-Zell-Gedächtnis wird
getragen von spezialisierten B-Gedächtniszellen sowie Plasmazellen mit
hoher Lebensdauer. Während bei der primären Immunantwort zunächst IgM
oder IgD in der Membran von T-Lymphozyten als Rezeptoren dienen, die
Antigen binden und seine Phagozytose einleiten (was zur Präsentation
von Bruchstücken über MHC-II an Th-Lymphozyten führt), bilden B-Gedächtniszellen von Anfang an IgG. Das T-Zell-Gedächtnis beruht
auf einer über Monate erfolgenden Vermehrung der Zellen betreffender
Klone; die (relativ kleinen) Gedächtniszellen entwickeln ein breites
Expressionsspektrum für verschiedene Zytokine. Gedächtnis-T-Zellen
entwickeln sich in mehrere spezialisierte Subpopulationen; einige einige kehren nicht mehr in die Blutbahn zurück und verbleiben in lymphatischem Gewebe, andere wandern in periphere Gewebe aus.
Das T-Zell-Gedächtnis beruht
auf einer über Monate erfolgenden Vermehrung der Zellen betreffender
Klone; die (relativ kleinen) Gedächtniszellen entwickeln ein breites
Expressionsspektrum für verschiedene Zytokine. Gedächtnis-T-Zellen
entwickeln sich in mehrere spezialisierte Subpopulationen; einige einige kehren nicht mehr in die Blutbahn zurück und verbleiben in lymphatischem Gewebe, andere wandern in periphere Gewebe aus.  Booster-Effekt (Boosterung): Wiederholter Antigenkontakt - mit Krankheitserregern, oder im Rahmen von Auffrischungsimpfungen
(aktive Immunisierung) - hat Immunreaktionen zunehmender Stärke, und
damit wachsenden Schutz vor der betreffenden Krankheit zur Folge.
Booster-Effekt (Boosterung): Wiederholter Antigenkontakt - mit Krankheitserregern, oder im Rahmen von Auffrischungsimpfungen
(aktive Immunisierung) - hat Immunreaktionen zunehmender Stärke, und
damit wachsenden Schutz vor der betreffenden Krankheit zur Folge. 
 Angeborenes und adaptives Immunsystem kooperieren mehrfach.
Granulozyten, Makrophagen und dendritische Zellen (DC) erkennen
mikrobielle Molekülmuster; DCs, die im Gewebe Antigene gefunden und
aufgenommen haben, werden zu "reifen" DCs: Sie präsentieren in
regionalen Lymphknoten Antigenbruchstücke über MHC-II an Helferzellen
(CD4+) und steigern die Expression von Cofaktoren
Angeborenes und adaptives Immunsystem kooperieren mehrfach.
Granulozyten, Makrophagen und dendritische Zellen (DC) erkennen
mikrobielle Molekülmuster; DCs, die im Gewebe Antigene gefunden und
aufgenommen haben, werden zu "reifen" DCs: Sie präsentieren in
regionalen Lymphknoten Antigenbruchstücke über MHC-II an Helferzellen
(CD4+) und steigern die Expression von Cofaktoren T-Zellen suchen dendritische Zellen im Lymphknoten nach passenden
MHC-II / Peptid-Komplexen ab und bilden (bei deren Vorhandensein) einen
Klon, der auf das erkannte Antigen spezifisch anspricht (Klonselektion)
T-Zellen suchen dendritische Zellen im Lymphknoten nach passenden
MHC-II / Peptid-Komplexen ab und bilden (bei deren Vorhandensein) einen
Klon, der auf das erkannte Antigen spezifisch anspricht (Klonselektion) Induktionsphase: Die Aktivierung der T-Zellen bedarf zusätzlicher
Wechselwirkungen (Signal 1: TCR-MHC-Passung, Signal 2: Interaktion
lymphozytäres CD28 - dendritisches B7; eventuell auch weitere
Interaktionen); T-Zellen sind MHC-restringiert
Induktionsphase: Die Aktivierung der T-Zellen bedarf zusätzlicher
Wechselwirkungen (Signal 1: TCR-MHC-Passung, Signal 2: Interaktion
lymphozytäres CD28 - dendritisches B7; eventuell auch weitere
Interaktionen); T-Zellen sind MHC-restringiert Naive B-Zellen wandern in lymphatischem Gewebe durch T-Zell-abhängige
Bereiche hindurch zu B-Zell-Zonen. B-Zellen erkennen antigene Epitope
im Extrazellulärraum, können auch ganze Viren binden und Antigene
präsentieren
Naive B-Zellen wandern in lymphatischem Gewebe durch T-Zell-abhängige
Bereiche hindurch zu B-Zell-Zonen. B-Zellen erkennen antigene Epitope
im Extrazellulärraum, können auch ganze Viren binden und Antigene
präsentieren Effektorphase: Effektor-Lymphozyten wandern in die Blutbahn und können an beliebigen Stellen in das Gewebe austreten.
Effektorphase: Effektor-Lymphozyten wandern in die Blutbahn und können an beliebigen Stellen in das Gewebe austreten. Immuntoleranz: Zentrale Toleranz verhindert die Entwicklung
entsprechender Lymphozyten in zentralen lymphatischen Organen
(Knochenmark für B-Zellen, Thymus für T-Zellen), periphere
Toleranz wirkt auf periphere immunkompetente Lymphozyten
Immuntoleranz: Zentrale Toleranz verhindert die Entwicklung
entsprechender Lymphozyten in zentralen lymphatischen Organen
(Knochenmark für B-Zellen, Thymus für T-Zellen), periphere
Toleranz wirkt auf periphere immunkompetente Lymphozyten Immunologisches Gedächtnis: Einige Lymphozytenklons werden zu
Gedächtniszellen. Sie wandern in lymphoide Organe, Schleimhäute, Haut
u.a. aus und behalten auch ohne Anregung durch "ihr" Antigen
Effektorfunktion. Späterer Antigenkontakt verstärkt die Immunreaktionen
Immunologisches Gedächtnis: Einige Lymphozytenklons werden zu
Gedächtniszellen. Sie wandern in lymphoide Organe, Schleimhäute, Haut
u.a. aus und behalten auch ohne Anregung durch "ihr" Antigen
Effektorfunktion. Späterer Antigenkontakt verstärkt die Immunreaktionen