

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Lymphoidale
Organe und Lymphozyten-trafficking
© H. Hinghofer-Szalkay
 Chemokin: χημεία = Gießerei (im Sinne von „Umwandlung“), κίνἔω = antreiben, bewegen
Chemokin: χημεία = Gießerei (im Sinne von „Umwandlung“), κίνἔω = antreiben, bewegen
Dendritische Zelle: δένδρον = Baum (baumartige Zellfortsätze)
Diapedese: δια = (hin)durch, pes = Fuß
Lymphe: lympha = klares Wasser
Leukozyten verlassen die Blutbahn (Diapedese) - parazellulär oder auch transzellulär - als Antwort auf immunologische Reize, zuerst in lymphatischen Organen (Homing:
'Erfahrene' T-Zellen konzentrieren sich auf Orte, wo das betreffende
Antigen schon präsentiert wurde) und dann allgemein im Gewebe, wobei
das Endothel zur Diapedese notwendige Kontaktfaktoren exprimiert (ICAM, Selectine).
In Lymphknoten
treffen Lymphozyten auf Antigene (bzw. deren
Abbauprodukte) auf antigenpräsentierenden Zellen: Im äußersten Eintrittsbereich
überwiegen Makrophagen, in der äußeren Rinde B-Zellen, in der inneren
Rinde T-Zellen. Im Sinus sammelt sich Lymphe, die dann den Lymphknoten verlässt und in die Blutbahn gelangt.
Die Milz
kann mit ihrer weißen Pulpa in ~30 Minuten das gesamte Blutvolumen auf
Pathogene im Blut überprüfen.
Zur Antigenpräsentation dienen T-Zell-reiche periarterioläre
lymphatische Scheiden mit dendritischen Zellen. Wenn nötig, attackieren NK-Zellen infizierte Zellen, eosinophile Granulozyten eingedrungene Parasiten und Zytotoxine infizierte Zellen und Parasiten; Interferone blockieren das Eindringen von Viren, Komplementfaktoren verstärken allfällige Entzündungsprozesse.
|
Übersicht  Lymphozyten: Entwicklung
Lymphozyten: Entwicklung  Lymphknoten
Lymphknoten  Milz
Milz  Haut und Schleimhäute
Haut und Schleimhäute  Aktivierung von Abwehrmechanismen
Aktivierung von Abwehrmechanismen  Diapedese
Diapedese
 Primäte / sekundäre lymphatische Organe
Primäte / sekundäre lymphatische Organe  PALS
PALS  Homing, Addressine
Homing, Addressine
 Core messages
Core messages
Lymphatisches Gewebe (lymphoid tissue) - Lymphknoten, Milz, Thymus, intestinale Plaques, Tonsillen - kann Lymphozyten
 produzieren (primäre, zentrale, generative Immungewebe, generative lymphoid organs). Bei Feten anfänglich in Leber und Milz, erfolgt die Hämatopoese im späteren Leben im roten Knochenmark. Hier werden Lymphozyten aus Stammzellen nachgebildet.
Auch das Thymus wird als "primäres" lymphatisches Organ bezeichnet,
obwohl es T-Lymphozyten nur "trainiert" - die Entstehung ihrer
Frühformen erfolgt im Knochenmark;
produzieren (primäre, zentrale, generative Immungewebe, generative lymphoid organs). Bei Feten anfänglich in Leber und Milz, erfolgt die Hämatopoese im späteren Leben im roten Knochenmark. Hier werden Lymphozyten aus Stammzellen nachgebildet.
Auch das Thymus wird als "primäres" lymphatisches Organ bezeichnet,
obwohl es T-Lymphozyten nur "trainiert" - die Entstehung ihrer
Frühformen erfolgt im Knochenmark;
 bearbeiten (Lymphozyten reifen und immunkompetent werden lassen: T-Zellen im Thymus, B-Zellen im Knochenmark). Im sekundären (peripheren) Immungewebe (secondary lymphoid organs) beginnen adaptive Immunantworten auf die Anwesenheit von Mikroben (Lymphknoten, Milz, mucosa-assoziiertes sowie kutanes Immungewebe). Sekundäre lymphatische Organe
wirken als Filterstationen, die abgestorbene Zellen, Fremdmaterial und
Proteinaggregate aus dem Kreislauf entfernen. Lymphozyten, Monozyten
und dendritische Zellen können
sich in das lymphatische Gewebe hinein- oder aus ihm
hinausbewegen. Verschiedene Zelltypen müssen interaktiv kommunizieren,
um effiziente Immunantworten zu bewirken, auch wenn die
Wahrscheinlichkeit ihres Aufeinandertreffens gering ist: Beispielsweise
regen Helfer-T-Zellen B-Zellen, die auf dasselbe Antigen reagieren, zur
Antikörperproduktion an. Zwischen Lymphozyten und umliegenden Zellen
werden zahlreiche Signale ausgetauscht;
bearbeiten (Lymphozyten reifen und immunkompetent werden lassen: T-Zellen im Thymus, B-Zellen im Knochenmark). Im sekundären (peripheren) Immungewebe (secondary lymphoid organs) beginnen adaptive Immunantworten auf die Anwesenheit von Mikroben (Lymphknoten, Milz, mucosa-assoziiertes sowie kutanes Immungewebe). Sekundäre lymphatische Organe
wirken als Filterstationen, die abgestorbene Zellen, Fremdmaterial und
Proteinaggregate aus dem Kreislauf entfernen. Lymphozyten, Monozyten
und dendritische Zellen können
sich in das lymphatische Gewebe hinein- oder aus ihm
hinausbewegen. Verschiedene Zelltypen müssen interaktiv kommunizieren,
um effiziente Immunantworten zu bewirken, auch wenn die
Wahrscheinlichkeit ihres Aufeinandertreffens gering ist: Beispielsweise
regen Helfer-T-Zellen B-Zellen, die auf dasselbe Antigen reagieren, zur
Antikörperproduktion an. Zwischen Lymphozyten und umliegenden Zellen
werden zahlreiche Signale ausgetauscht;
 speichern - z.B. in Lymphknoten (190 Milliarden Lymphozyten), Milz (70), Knochenmark (50), Darmschleimhaut (50), Lunge (30), Haut (20), Leber (10), Blut (10 Milliarden Lymphozyten).
speichern - z.B. in Lymphknoten (190 Milliarden Lymphozyten), Milz (70), Knochenmark (50), Darmschleimhaut (50), Lunge (30), Haut (20), Leber (10), Blut (10 Milliarden Lymphozyten).
Mobilität: Eine Besonderheit
der Lymphozyten besteht darin, dass sie über den Kreislauf wiederholt
ihre Position im Körper wechseln, aus dem Blut austreten, durch das
Gewebe wandern und sich über die Lymphbahnen in das Blut zurückbegeben
können.
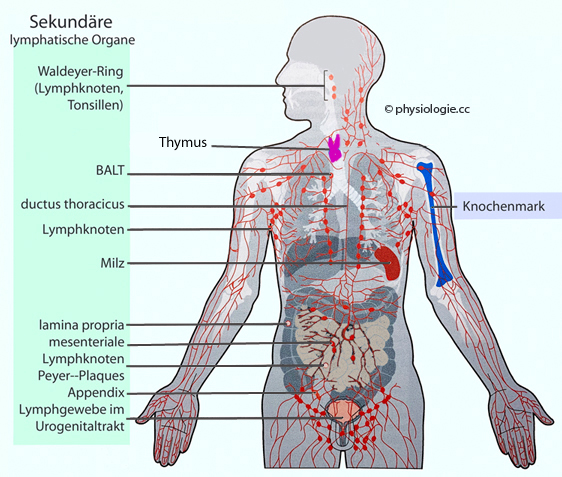
 Abbildung: Lymphatisches Gewebe im Körper
Abbildung: Lymphatisches Gewebe im Körper
Modifiziert nach einer Vorlage in Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
Das Knochenmark (rechts)
bildet Lymphozyten aus Stammzellen nach - sowohl B-Zellen, die hier
auch reifen, als auch T-Zellen, die als Frühformen das rote Knochenmark
verlassen und in das Thymus einwandern.
Im Thymus reifen die T-Lymphozyten - sie lernen, MHC-"Selbst"-Moleküle richtig zu erkennen. Knochenmark und Thymus gelten als "primäre" lymphatische Organe.
Sekundäre lymphatische Organe (links)
sind die Orte, an denen B- und T-Zellen auf Antikörper treffen und zu
adaptiven Immunreaktionen angeregt werden. Dazu gehören Lymphknoten
(filtern Antigene aus Lymphe) und Milz (filtert Antikörper aus dem
Blut).
BALT = Bronchien-assoziiertes lymphatisches Gewebe
 Zum Lymphtransport s. dort
Zum Lymphtransport s. dort
 Als primäre lymphatische Gewebe (primary lymphoid organs) bezeichnet man solche, in denen sich Lymphozyten entwickeln (Knochenmark und Thymus); als sekundäre lymphatische Gewebe (secondary lymphoid organs)
solche, die Immunogene einfangen und konzentrieren, und die
Kontaktwahrscheinlichkeit zwischen ihnen und Immunzellen erhöhen
(Lymphknoten, Milz, mucosa-assoziierte / lymphoepitheliale Gewebe).
Als primäre lymphatische Gewebe (primary lymphoid organs) bezeichnet man solche, in denen sich Lymphozyten entwickeln (Knochenmark und Thymus); als sekundäre lymphatische Gewebe (secondary lymphoid organs)
solche, die Immunogene einfangen und konzentrieren, und die
Kontaktwahrscheinlichkeit zwischen ihnen und Immunzellen erhöhen
(Lymphknoten, Milz, mucosa-assoziierte / lymphoepitheliale Gewebe).
Lymphozyten: Entwicklung
Adaptive Immunität beruht auf der Fähigkeit von Lymphozyten, Rezeptoren auszubilden, die spezifisch gegen antigene Epitope gerichtet sind. Aus rotem Knochenmark und Thymus stammend, bauen sie im Zuge ihrer Reifung aus einem beschränkten genetischen Repertoire eine
schier unbegrenzte Zahl verschiedener Rezeptoren / Antikörper auf. Das
schaffen sie durch Rekombination einer limitierten Zahl von
DNA-Segmenten.
Dabei entstehen auch Rezeptoren, die normale körpereigene Merkmale ("Selbst"-Epitope) erkennen - und ein Selektionsmechanismus
vernichtet solche T- (im Thymus) und B-Zellen (im roten Knochenmark),
bevor sie volle Funktionstüchtigkeit erlangen und den Körper schädigen
könnten.

Abbildung: Stadien der Lymphozytenreifung
Nach einer Vorlage in Abbas / Lichtman / Pillai: Cellular and Molecular Immunology, 9th ed. 2018
Multipotente
Stammzellen in fetalem Gewebe (Knochenmark und Leber) sind die Quelle
aller blutbildenden Zellen, darunter gemeinsame Vorläufer lymphoider
Zellen. Aus diesen entstehen T- und B-Zellen, NK- und einige
dendritische Zellen.
Das Bild zeigt die Entwicklung von B-Lymphozyten. T-Lymphozyten entwickeln sich analog

Lymphozyten, die auf ein bestimmtes (zu bekämpfendes)
Epitop exakt passende Rezeptoren exprimieren, vermehren sich für
mehrere Tage ungehemmt (klonale Expansion) und bauen so eine
hochspezifische und effiziente Abwehr auf (Immunität).
Die Entwicklung von T- und B-Lymphozyten vollzieht sich in generativen lymphoiden Organen - postpartal Thymus und rotes Knochenmark - und umfasst die folgenden Schritte ( Abbildung):
Abbildung):
 Bindung zu einer Zelllinie (commitment):
Hier fällt die Entscheidung, ob aus der Stammzelle ein B- oder
T-Prolymphozyt wird. Das Signal dazu geht von verschiedenen Rezeptoren
an der Oberfläche der Zelle aus, welche dann Transkriptionsfaktoren - über Wirkung an entsprechenden Gen-Loci - zur Expression von B- oder T-spezifischen Rezeptor-Arrangements anregen.
Bindung zu einer Zelllinie (commitment):
Hier fällt die Entscheidung, ob aus der Stammzelle ein B- oder
T-Prolymphozyt wird. Das Signal dazu geht von verschiedenen Rezeptoren
an der Oberfläche der Zelle aus, welche dann Transkriptionsfaktoren - über Wirkung an entsprechenden Gen-Loci - zur Expression von B- oder T-spezifischen Rezeptor-Arrangements anregen.
 Zellwachstum und -teilung (proliferation) führt zur Bildung von Gruppen (pools) spezialisierter Lymphozyten, angeregt durch Zytokine und später - an Zellen mit erfolgreich angeordneten Antigenrezeptor-Genen - durch Signale von Präantigenrezeptoren
Zellwachstum und -teilung (proliferation) führt zur Bildung von Gruppen (pools) spezialisierter Lymphozyten, angeregt durch Zytokine und später - an Zellen mit erfolgreich angeordneten Antigenrezeptor-Genen - durch Signale von Präantigenrezeptoren:
 Lymphozyten müssen die Gensequenzen für ihre Antigenrezeptoren in einer
Weise anordnen, dass der Erkennungsvorgang funktioniert (recombination, rearrangement). Diese Rekombinationsvorgänge erfolgen für T-Zellen im Thymus und für B-Zellen im Knochenmark. Dies geschieht nach dem Zufallsprinzip ohne Antigenkontakt.
Auf diese Weise entsteht ein großes Repertoire unterschiedlich
antigenempfänglicher Zellen - jeder Mensch entwickelt etwa 10 Millionen
bis eine Milliarde Lymphozytenklone mit jeweils einer bestimmten
Erkennungs- und Bindungscharakteristik ihrer Rezeptoren.
Lymphozyten müssen die Gensequenzen für ihre Antigenrezeptoren in einer
Weise anordnen, dass der Erkennungsvorgang funktioniert (recombination, rearrangement). Diese Rekombinationsvorgänge erfolgen für T-Zellen im Thymus und für B-Zellen im Knochenmark. Dies geschieht nach dem Zufallsprinzip ohne Antigenkontakt.
Auf diese Weise entsteht ein großes Repertoire unterschiedlich
antigenempfänglicher Zellen - jeder Mensch entwickelt etwa 10 Millionen
bis eine Milliarde Lymphozytenklone mit jeweils einer bestimmten
Erkennungs- und Bindungscharakteristik ihrer Rezeptoren.
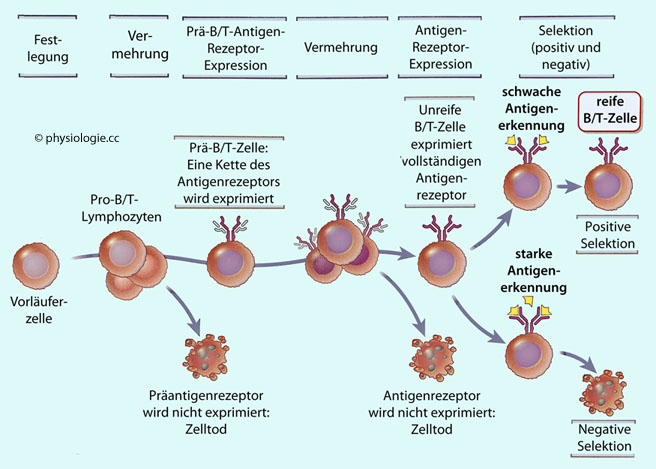
 Abbildung: Weichenstellungen bei der Lymphozytenreifung
Abbildung: Weichenstellungen bei der Lymphozytenreifung
Nach einer Vorlage in Abbas / Lichtman / Pillai, Basic Immunology, 7rh ed. Elsevier 2024
Während ihrer
Entwicklung proliferieren B- und T-Lymphozyten und exprimieren
Rezeptoren, deren Epitoperkennung durch Genrekombination bestimmt ist.
Ihre Anwesenheit entscheidet darüber, ob sie sich weiterentwickeln und reifen können
(positive Selektion) oder absterben (die Entscheidungspunkte nennt man auch checkpoints).
Das Absterben erfolgt durch Apoptose - entweder weil die Rezeptoren
nicht funktionsfähig sind oder weil sie Antigene zu intensiv binden
(negative Selektion).
 Selektion: Lymphozyten werden nach verschiedenen Kriterien ausgesucht:
Haben sie keine brauchbaren Rezeptoren gebildet oder erkennen sie
"Selbst"-Antigene zu stark, werden sie eliminiert. Dabei spielen
Präantigen- und Antigenrezeptoren eine entscheidende Rolle
(
Selektion: Lymphozyten werden nach verschiedenen Kriterien ausgesucht:
Haben sie keine brauchbaren Rezeptoren gebildet oder erkennen sie
"Selbst"-Antigene zu stark, werden sie eliminiert. Dabei spielen
Präantigen- und Antigenrezeptoren eine entscheidende Rolle
( Abbildung). Nur voll taugliche (und für den Körper ungefährliche)
Zellen überleben.
Abbildung). Nur voll taugliche (und für den Körper ungefährliche)
Zellen überleben.
 Differenzierung: Schließlich entstehen voll ausgereifte B- und T-Lymphozyten (CD4+, CD8+, NKT und andere).
Differenzierung: Schließlich entstehen voll ausgereifte B- und T-Lymphozyten (CD4+, CD8+, NKT und andere).
An entscheidenden Stellen (Checkpoints)
der Lymphozytenentwicklung werden die Zellen auf erfolgreiche
Entwicklungsschritte getestet.
Am ersten "Checkpoint" vermitteln Präantigenrezeptoren (mit nur einer Polypeptidkette: µ-Kette bei pre-BCRs, ß-Kette bei pre-TCRs, "Erfolgsquote" ~30%) Signale in den sich entwickelnden Lymphozyten, die für Überleben, Entwicklung und Reifung essentiell sind.
Beim nächsten sind dafür komplette Antigenrezeptoren notwendig: Erkennen diese in Thymus oder Knochenmark körpereigene Antigene, wird die Zelle eliminiert (negative Selektion, clonal deletion);
erkennen sie sowohl (das richtige) MHC- als auch zugehörige CD-Moleküle
in Kombination mit präsentierten Peptiden in angemessenem Ausmaß,
können sie sich zu reifen Lymphozyten weiterentwickeln (positive
Selektion).
Entwicklungsschritte, genetische
Umgruppierungen und involvierte Rezeptoren sind für T- und
B-Lymphozyten unterschiedlich und außerordentlich komplex geregelt.
 Für T-Zellen: s. dort
Für T-Zellen: s. dort
Lymphknoten sind Tauschbörsen immunologischer Information
Lymphknoten
sind Kapselorgane mit eigener Blutversorgung, wo antigenpräsentierende
Zellen und Lymphozyten
zusammentreffen und immunologische Information austauschen - sie
begünstigen das Zusammentreffen von Lymphozyten, Monozyten und
dendritischen Zellen. Sie stellen weiters "Reinigungsstationen" für die
sie durchströmende Lymphe dar (von der ein Teil direkt in den
Blutkreislauf rückresorbiert wird).
 Lymphknoten unterstützen adaptive Immunantworten
auf Antigene, die ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden.
Lymphknoten unterstützen adaptive Immunantworten
auf Antigene, die ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden.
 Abbildung: Gliederung eines Lymphknotens
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Abbildung: Gliederung eines Lymphknotens
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Der
Mensch verfügt über ~600 Lymphknoten. Diese sind in Rinde (cortex) und Mark (medulla) untergliedert. Die äußere Rindenzone enthält Lymphozytencluster, die als Noduli oder Follikel bezeichnet werden (hautsächlich B-Zellen: "Thymus-unabhängige Zone"). Die innere Rindenzone ist reich an T-Zellen.
Der retikuläre
Aufbau begünstigt das Aufeinandertreffen unterschiedlicher Zellen, die
kooperieren müssen (z.B. B- und T-Zellen mit gleicher
Antigenspezifität). Primäre Lymphe strömt über
afferente Lymphgefäße zu, Flüssigkeit wird im Lymphknoten
rückresorbiert, proteinreichere sekundäre Lymphe fließt über das
efferente Lymphgefäß in Richtung Blutkreislauf ab.
Hochendotheliale Venolen (HEV)
sind darauf spezialisiert, Lymphozyten vom Blut in das Stroma
sekundärer lymphatischer Organe austreten zu lassen. Dazu dienen
spezielle Adhäsionsmoleküle, welche HEV-Zellen an ihrer Oberfläche
tragen und die naive sowie Gedächtnis- B/T-Lymphozyten binden können

Funktion und Bewegung der Zellen innerhalb des Lymphknotens werden u.a. durch Chemokine  koordiniert. Diese werden lokal unterschiedlich freigesetzt, und die Zahl der Chemokinrezeptoren in der Wand der Immunzellen wird je nach Erfordernis hinauf- oder hinunterreguliert.
koordiniert. Diese werden lokal unterschiedlich freigesetzt, und die Zahl der Chemokinrezeptoren in der Wand der Immunzellen wird je nach Erfordernis hinauf- oder hinunterreguliert.
Lymphozyten können Lymphknoten
über das Blut (hochendotheliale Venolen) oder, dem
Drainageweg folgend, über afferente Lymphgefäße betreten (auf diesem
Weg gelangen auch antigenbeladene dendritische Zellen  in
den Lymphknoten). Lymphknoten weisen eine funktionelle Gliederung in
Zonen auf (
in
den Lymphknoten). Lymphknoten weisen eine funktionelle Gliederung in
Zonen auf ( Abbildung), deren Organisation von verschiedenen - auch
bindegewebigen - Zellen und deren Zytokinen abhängt:
Abbildung), deren Organisation von verschiedenen - auch
bindegewebigen - Zellen und deren Zytokinen abhängt:

Ganz außen - am Rand des Knotens, im Bereich des
subkapsulären Sinus - tritt primäre Lymphe

ein. Hier
befinden sich zahlreiche
Makrophagen, was der Bekämpfung aus dem Gewebe
eingelangter Erreger dient

Die
Rinde ist reich an
B-Zellen und enthält Follikel, wo
follikuläre dendritische Zellen (diese präsentieren
opsonisiertes Antigen) die Proliferation von B-Zellen befördern

Die innere Rinde (
Parakortex) ist die T-Zell-Zone, die auch das hochendotheliale Endothel enthält. In dieser Zone werden T-Zellen
durch
Adhäsionsmoleküle zurückgehalten und treffen
mit hier ebenfalls angereicherten dendritischen Zellen zusammen

In der innersten Zone, dem
Sinus, sammelt sich die Lymphe, die über das efferente Lymphgefäß den Knoten Richtung Blut verlässt.
 Die Anreicherung von B-Zellen in den Follikeln, und der T-Zellen im Parakortex ist durch Zytokine
gesteuert. Treffen die Lymphozyten auf "ihre" Antigene, ändern sie ihre
Zytokinrezeptor-Expression, wandern aufeinander zu und treffen sich am
Rand der Follikel, wo Helfer-T-Zellen B-Zellen bei ihrer
Differenzierung zu Plasmazellen unterstützen.
Die Anreicherung von B-Zellen in den Follikeln, und der T-Zellen im Parakortex ist durch Zytokine
gesteuert. Treffen die Lymphozyten auf "ihre" Antigene, ändern sie ihre
Zytokinrezeptor-Expression, wandern aufeinander zu und treffen sich am
Rand der Follikel, wo Helfer-T-Zellen B-Zellen bei ihrer
Differenzierung zu Plasmazellen unterstützen.
So wird das Gesamtsystem sehr effizient aktiviert, abhängig von der immunologischen
Herausforderung in dem Gewebe, das die Lymphgefäße des betreffenden
Knotens drainieren. Aktivierte ('erfahrene')
Helferzellen gelangen ins Blut, von dort ins lymphatische System und
triggern / koordinieren die spezifische Abwehr (Aktivierung von
B-Zellen, Zytokinproduktion).

Über
Lymphproduktion und -transport s.
dort
 Über Peyer-Plaques s. dort
Über Peyer-Plaques s. dort
Die Milz scannt Blut auf Pathogene und entfermt gealterte Erythrozyten
Die Milz (spleen - normalerweise ~150 g Gewicht) ist
stark durchblutet (~250 ml/min) und "filtert" das gesamte
Blutvolumen in etwa einer halben Stunde. Sie überprüft auf Intaktheit
von Blutkörperchen und die mögliche Anwesenheit von Pathogenen. Sie
entfernt Zellklumpen und Fremdmaterial aus dem Kreislauf und
konzentriert aus dem Blut stammende Antigene und Mikroben. Neben
Lymphozyten enthält sie zahlreiche Plasmazellen, die Antikörper
produzieren. Sie besteht aus erythrozytenreicher roter Pulpa sowie um Arteriolen angeordneter, lymphozytenreicher weißer Pulpa (pulpa lat. Fleisch):
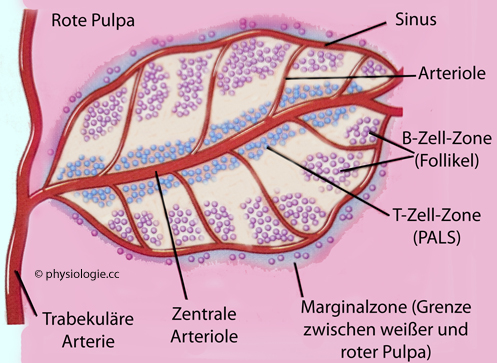
 Abbildung: Milz
Abbildung: Milz
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
In
der roten Pulpa
passieren rote Blutkörperchen mechanische Hindernisse - sie müssen vor
dem Eintritt in Sinusoide zwischen Kollagenfäden - sogenannten Pulpa-
oder Billroth-Strängen - hindurchtreten; Makrophagen erkennen gealterte
Erythrozyten und bauen diese ab. Eisen aus dem Hämoglobinabbau wird
abtransportiert (Transferrin) und zum Großteil im roten Knochenmark im Rahmen der Erythropoese wieder verwertet.
In
der weißen Pulpa erfolgen
Antigenpräsentation und Immunabwehr über humorale und zell-mediierte
Wege: Die lymphoiden Follikel sind reich an B-Zellen, die
periarteriolären Scheiden (PALS) reich an T-Zellen. PALS und lymphoide Follikel zusammen machen die weiße Pulpa aus

 Die
Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und opsonisierte Bakterien aus dem Kreislauf, und
initiiert adaptive Immunantworten gegen Antigene im Blut.
Die
Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und opsonisierte Bakterien aus dem Kreislauf, und
initiiert adaptive Immunantworten gegen Antigene im Blut.
In der roten Pulpa entfernen
Zellen des mononukleären Phagozytensystems gealterte Erythrozyten aus dem Kreislauf. Die Alterung wird über Sialinsäure (Acetylneuraminsäure) detektiert, welche die Erys im Laufe der Zeit von ihrer Oberfläche verlieren.
Sialinsäure ist Bestandteil u.a. von Glykoproteinen, die in Zellmembranen, Blutplasma und
Sekreten vorkommen. Als Bestandteil von
Aminozuckern hat sie Bedeutung für die Verständigung von Zellen
untereinander.
Nach der Phagozytose der Erys wird deren Hämoglobin in seine Bestandteile zerlegt
(Globin → Aminosäuren, Häm → Eisen und Biliverdin). Die dabei
gewonnenen Eisenatome werden wiederverwertet: Innerhalb von Minuten
tauchen sie an der Oberfläche der Makrophagen auf und werden dort von Transferrin zum Weitertransport (vor allem in das rote Knochenmark) übernommen.
In der weißen Pulpa ( Abbildung) erfolgt im Bedarfsfall antigeninduzierte Differenzierung und Vermehrung von B- und T-Lymphozyten. Anders als bei Lymphknoten und Peyer-Plaques sind für
den Eintritt von Leukozyten keine hochendothelialen Venolen nötig; die
Milz ist ein "offenes" Organ mit diskontinuierlichem Endothel. Um die Arteriolen sitzen periarterioläre lymphatische Scheiden (PALS), darum herum verzweigen sich marginale Sinus
mit B-Zellen und Lymphfollikeln.
Abbildung) erfolgt im Bedarfsfall antigeninduzierte Differenzierung und Vermehrung von B- und T-Lymphozyten. Anders als bei Lymphknoten und Peyer-Plaques sind für
den Eintritt von Leukozyten keine hochendothelialen Venolen nötig; die
Milz ist ein "offenes" Organ mit diskontinuierlichem Endothel. Um die Arteriolen sitzen periarterioläre lymphatische Scheiden (PALS), darum herum verzweigen sich marginale Sinus
mit B-Zellen und Lymphfollikeln.
 Unter PALS
(periarteriolar lymphoid sheaths) versteht man lymphatisches Gewebe der Milz, das in der Nähe von
Lymphfollikeln kleine Arteriolen umgibt. Es enthält zahlreiche T-Zellen
(2/3 CD4+, 1/3 CD8+).
Unter PALS
(periarteriolar lymphoid sheaths) versteht man lymphatisches Gewebe der Milz, das in der Nähe von
Lymphfollikeln kleine Arteriolen umgibt. Es enthält zahlreiche T-Zellen
(2/3 CD4+, 1/3 CD8+).
Die
sehr zahlreichen Phagozyten der Milz nehmen in das Blut gelangte
Mikroben auf und zerstören sie (wie sie das auch mit ausrangierten
Erythrozyten machen) - neben Makrophagen auch (residente,
d.h. in der Milz verbleibende) dendritische Zellen. Sie erfüllen die Aufgabe der Antigenpräsentation an Lymphozyten (über MHC-II bei extrazellulären, MHC-I bei intrazellulären Antigenen).
Menschen, denen die Milz entfernt wurde, neigen zu disseminierten Infektionen, z.B. mit Pneumo- oder Meningokokken.
 Zur Stellung der Milz im Immunsystem s. auch dort
Zur Stellung der Milz im Immunsystem s. auch dort
Haut und Schleimhäute
 Abbildung: Immunsystem an Schleimhäuten
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Abbildung: Immunsystem an Schleimhäuten
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024
Beispiel
Dünndarmschleimhaut. Im Lumen befinden sich zahlreiche Bakterien
(Kommensalen). Die muköse Schleimschichte verleiht einen primären
Infektionsschutz. M-Zellen und andere spezielle Epithelzellen
erleichtern den Transport von Antigenen in darunterliegendes Gewebe.
Immunglobulin A (IgA) wird von der lamina propria in das Lumen befördert und kann hier Mikroben neutralisieren.
Zellen der lamina propria (dendritische Zellen, Makrophagen, T-Zellen
u.a.) verleihen angeborenen und adaptiven Infektionsschutz. Einige
dieser Zellen sind zu Strukturen versammelt, z.B. Peyer'sche Plaques.
Hier können Immunreaktionen auf Pathogene (oder andere mit der Nahrung
aufgenommene Antigene) im Darmlumen ihren Ausgang nehmen. Diese Plaques (Peyer's patches) bestehen hauptsächlich aus B-Zellen, oft mit einem Keimzentrum - ähnlich wie in Lymphknoten
 Das Immunsystem der Haut und der Schleimhäute (MALT: mucosa-associated lymphatic tissue; in Luftwegen - BALT, bronchienassoziiert; im Darm - GALT; s. dort) besteht aus spezialisiertem lymphatischem Gewebe. An bestimmten Stellen finden sich hier Lymphozyten und antigenpräsentierende Zellen funktionell ähnlich arrangiert wie in Lymphknoten (
Das Immunsystem der Haut und der Schleimhäute (MALT: mucosa-associated lymphatic tissue; in Luftwegen - BALT, bronchienassoziiert; im Darm - GALT; s. dort) besteht aus spezialisiertem lymphatischem Gewebe. An bestimmten Stellen finden sich hier Lymphozyten und antigenpräsentierende Zellen funktionell ähnlich arrangiert wie in Lymphknoten ( Abbildung).
Abbildung).
Ein
beträchtlicher Anteil der Lymphozyten in Schleimhäuten sind
Gedächtniszellen. Diese können direkt an gefährdeten Stellen aktiviert
werden, rasch klonal expandieren und innerhalb weniger Tage
entsprechenden adaptiven Schutz bieten sowie an allfällig nötig
gewordenen Reparaturvorgängen teilnehmen.
Besonders bemerkenswert ist die Fähigkeit der kutanen und mukösen
Immunsysteme, Pathogene abzuwehren, ohne aber auf die enorm zahlreichen
Kommensalen (normale mikrobielle Flora) zu reagieren. Mehrere
Mechanismen tragen zu dieser besonderen Eigenschaft bei, inklusive die
Aktivität von regulatorischen (Treg) Lymphozyten.
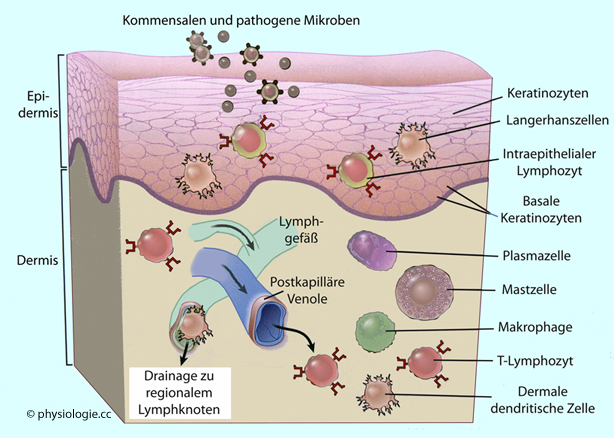
 Abbildung: Immunsystem der Haut
Abbildung: Immunsystem der Haut
Nach einer Vorlage bei Abbas / Lichtman / Pillai, Basic Immunology, 7th ed. Elsevier 2024

Eine diffuse Verteilung der am Schutz beteiligten Zellen findet sich in der Haut ( Abbildung). Die Haut (bei erwachsenen Personen ca. 1,5-2 m2,
3,5-10 kg Gewicht) beinhaltet den größten Anteil der Zellen des
angeborenen sowie des adaptiven Immunsystems, was ihre große Bedeutung
für den primären Schutz vor dem Eindringen von Pathogenen
unterstreicht.
Abbildung). Die Haut (bei erwachsenen Personen ca. 1,5-2 m2,
3,5-10 kg Gewicht) beinhaltet den größten Anteil der Zellen des
angeborenen sowie des adaptiven Immunsystems, was ihre große Bedeutung
für den primären Schutz vor dem Eindringen von Pathogenen
unterstreicht.
 Zur Haut als Immunorgan vgl. dort
Zur Haut als Immunorgan vgl. dort
Aktivierung von Abwehrmechanismen
Gelangen
Mikroorganismen über die Haut-Schleimhaut-Barriere - bei Verletzungen,
Vitaminmangel, durch enzymatische Aktivität von Bakterien u.a. -,
wird die zweite Abwehrfront des Immunsystems aktiviert:
 Interferone blockieren
den Virusbefall von Zellen
Interferone blockieren
den Virusbefall von Zellen
 Komplementfaktoren wirken u.a.
entzündungsfördernd
Komplementfaktoren wirken u.a.
entzündungsfördernd
 Abbildung: Regulierung von NK-Zellen
Abbildung: Regulierung von NK-Zellen
Nach einer Vorlage bei ikcells.com
Um den Körper
gegen Viren und andere Pathogene verteidigen zu können, müssen
NK-Zellen erkennen, welche (körpereigenen) Zellen von diesen befallen
sind und welche nicht. Wie das geht, ist noch nicht ganz klar; aber man
weiss, dass NK-Zellen über zwei Rezeptortypen verfügen: Aktivierende
und inhibierende.
Letztere erkennen MHC-I-Moleküle;
fehlen diese an der Zielzelle ("missing self recognition"),
ist wahrscheinlich der molekulare Check gestört (Virusbefall?), und die
NK-Zelle startet über den Perforin-Granzym-Mechanismus eine
"Kill"-Attacke auf die vermutlich befallene Zelle

 Natürliche Killerzellen (NK-Zellen) greifen infizierte Zellen an (
Natürliche Killerzellen (NK-Zellen) greifen infizierte Zellen an ( Abbildung)
Abbildung)
 Eingedrungene Parasiten werden von
eosinophilen Granulozyten attackiert (
Eingedrungene Parasiten werden von
eosinophilen Granulozyten attackiert ( s. auch dort)
s. auch dort)
 Zytotoxine greifen infizierte Zellen und Parasiten an
Zytotoxine greifen infizierte Zellen und Parasiten an
Signalstoffe werden in Gewebe und Blut abgegeben, um die Abwehr zu
koordinieren. Das Immunsystem erkennt und zerstört eingedrungene
Fremdstoffe und Mikroorganismen.
Mikroorganismen
werden von Phagozyten aufgenommen und die entstandenen Bruchstücke über
MHC-II den T-Lymphozyten “präsentiert”. T-Zellen mit passenden
Rezeptoren reagieren auf die
präsentierten Antigene und aktivieren die Bildung von Antikörpern.
Diapedese: Durchtritt von Leukozyten durch die Gefäßwand
 vgl. dort
vgl. dort
Das Austreten von Leukozyten aus der Blutbahn nennt man Leukodiapedese  bzw. Transmigration (leukocyte extravasation).
Dazu
ist die
sequentielle Aktivierung von Faktoren notwendig, die diese Zellen nach
dem
Schlüssel-Schloss-Prinzip am Endothel "bremsen", festhalten und
schließlich ihre Diapedese ermöglichen. In verletztem bzw. entzündlich
verändertem Gewebe verlassen aktivierte
Leukozyten - wie Granulozyten, Monozyten, Makrophagen (angeborene
Abwehr), Lymphozyten (adaptive Abwehr) - die Mikrozirkulation
(Kapillaren, Venolen). Diapedese kann
in jedem vaskularisierten Gewebe im Rahmen von immunologischen
Prozessen stattfinden: Im Gewebe allgemein z.B. zur Bekämpfung von
Mikroben, oder in lymphatischen Organen, wo sie der Passage bzw. der
Interaktion von Immunzellen dient.
bzw. Transmigration (leukocyte extravasation).
Dazu
ist die
sequentielle Aktivierung von Faktoren notwendig, die diese Zellen nach
dem
Schlüssel-Schloss-Prinzip am Endothel "bremsen", festhalten und
schließlich ihre Diapedese ermöglichen. In verletztem bzw. entzündlich
verändertem Gewebe verlassen aktivierte
Leukozyten - wie Granulozyten, Monozyten, Makrophagen (angeborene
Abwehr), Lymphozyten (adaptive Abwehr) - die Mikrozirkulation
(Kapillaren, Venolen). Diapedese kann
in jedem vaskularisierten Gewebe im Rahmen von immunologischen
Prozessen stattfinden: Im Gewebe allgemein z.B. zur Bekämpfung von
Mikroben, oder in lymphatischen Organen, wo sie der Passage bzw. der
Interaktion von Immunzellen dient.
Diapedese kann zwischen oder durch Endothelzellen erfolgen ( Abbildung):
Abbildung):
 Abbildung: Transmigration
Nach Ley K, Laudanna C, Cybulsky MI, Nourshargh S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Rev Immunol 2007; 7: 678-89
Abbildung: Transmigration
Nach Ley K, Laudanna C, Cybulsky MI, Nourshargh S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Rev Immunol 2007; 7: 678-89
Die
Migration von Leukozyten durch die Wand von Venolen erfordert die
Penetration mehrerer Schichten: Endothelzellen, Basalmembran und
Perizyten.
Links oben: Der Leukozyt haftet an der Gefäßwand und "kriecht" an ihr entlang (Crawling). Bindung von MAC1 (macrophage antigen 1) an ICAM1 (intercellular adhesion molecule 1) triggert den Leukozyten: Er bildet Protrusionen in und zwischen die Endothelzellen.
Links unten: Der Weg zwischen Endothelzellen (parazellulär). ESAM = endothelial cell-selective adhesion molecule
 JAM = junctional adhesion molecule
JAM = junctional adhesion molecule
 LFA1 = lymphocyte function-associated antigen 1
LFA1 = lymphocyte function-associated antigen 1
 PECAM1 = platelet/endothelial-cell adhesion molecule 1
PECAM1 = platelet/endothelial-cell adhesion molecule 1
 VE-Cadherin = endothelial-expressed vascular endothelial cadherin
Rechts unten: Der Weg durch die Endothelzelle (transzellulär). Aktivierte ICAM1-Moleküle wandern an Aktin- und Caveolae-reiche Stellen. Caveolae fließen zu vesiculo-vacuolar organelles
(VVO) zusammen, diese bilden einen Kanal für den Durchtritt des
Leukozyten. Zusätzliche Proteine unterstützen den Vorgang: ERM-Proteine
(der Name stammt von seinen drei Paralogen Ezrin, Radixin, Moesin)
verknüpfen Aktinfilamente mit der Zellmembran.
Rechts oben: Der Weg durch Basalmembran und Perizytenschicht. Bevorzugte Orte sind Lücken zwischen den Perizyten sowie Stellen mit geringer Proteinanlagerung an der Matrix.
MMPs, Matrix-Metalloproteinasen; NE, Neutrophile Elastase
VE-Cadherin = endothelial-expressed vascular endothelial cadherin
Rechts unten: Der Weg durch die Endothelzelle (transzellulär). Aktivierte ICAM1-Moleküle wandern an Aktin- und Caveolae-reiche Stellen. Caveolae fließen zu vesiculo-vacuolar organelles
(VVO) zusammen, diese bilden einen Kanal für den Durchtritt des
Leukozyten. Zusätzliche Proteine unterstützen den Vorgang: ERM-Proteine
(der Name stammt von seinen drei Paralogen Ezrin, Radixin, Moesin)
verknüpfen Aktinfilamente mit der Zellmembran.
Rechts oben: Der Weg durch Basalmembran und Perizytenschicht. Bevorzugte Orte sind Lücken zwischen den Perizyten sowie Stellen mit geringer Proteinanlagerung an der Matrix.
MMPs, Matrix-Metalloproteinasen; NE, Neutrophile Elastase
 Zu Cadherinen s. dort
Zu Cadherinen s. dort

 Parazellulär, wobei der Leukozyt Lamellopodien
zwischen die Endothelzellen steckt, interzelluläre Verbindungen (tight
junctions) auflöst (dabei sind Moleküle wie Cadherin, ICAM und PECAM im
Spiel) und durch den so entstandenen Spaltraum schlüpft; oder
Parazellulär, wobei der Leukozyt Lamellopodien
zwischen die Endothelzellen steckt, interzelluläre Verbindungen (tight
junctions) auflöst (dabei sind Moleküle wie Cadherin, ICAM und PECAM im
Spiel) und durch den so entstandenen Spaltraum schlüpft; oder
 Transzellulär, wobei der Leukozyt aktinreiche Podosomen
bildet, mit denen er sich an die Oberfläche der Endothelzelle
"einzapft" und diese zur Transzytose (Aufnahme in die Endothelzelle und
Transfer auf die Gewebeseite) veranlasst. Stellen
mit geringem Endotheldurchmesser werden bevorzugt. Nach Bindung wandern
ICAM1-Moleküle an Stellen, die reich an Aktin und caveolae sind.
Letztere fließen zu vesikulo-vakuolären Organellen zusammen, welche einen Kanal für den Durchtritt des Leukozyten bilden.
Transzellulär, wobei der Leukozyt aktinreiche Podosomen
bildet, mit denen er sich an die Oberfläche der Endothelzelle
"einzapft" und diese zur Transzytose (Aufnahme in die Endothelzelle und
Transfer auf die Gewebeseite) veranlasst. Stellen
mit geringem Endotheldurchmesser werden bevorzugt. Nach Bindung wandern
ICAM1-Moleküle an Stellen, die reich an Aktin und caveolae sind.
Letztere fließen zu vesikulo-vakuolären Organellen zusammen, welche einen Kanal für den Durchtritt des Leukozyten bilden.

Anschließend passieren sie die
Basalmembran (proteolytisch? mechanisch?)
- in Venolen wandern sie auch
zwischen Perizyten hindurch - und gelangen so in das Gewebe.
Diapedese im Gewebe
allgemein
Lymphozyten
halten sich nur für kurze Zeit in der Blutbahn auf; die meisten von
ihnen befinden sich extravasal, vor allem in lymphatischem Gewebe
(Lymphknoten, intestinale Plaques, Adenoide u.a.). Die Interaktion von Adhäsionsmolekülen, die von
Lymphozyten und Endothelzellen je nach ihrem Zustand
sowohl an der Zellmembran als auch
im umgebenden Gewebe unterschiedlich exprimiert bzw. präsentiert werden, steuert den Übertritt der Lymphozyten in das Gewebe.
 Abbildung: Fixierung von Leukozyten - hier: neutrophilen Granulozyten - am Endothel, Ablauf der Diapedese ("roll, sniff, stop, exit")
Nach
einer Vorlage in Kumar / Abbas / Fausto / Aster, Robbin and Cotran's
Pathological Basis of Disease, 8th ed. Saunders / Elsevier 2010
Abbildung: Fixierung von Leukozyten - hier: neutrophilen Granulozyten - am Endothel, Ablauf der Diapedese ("roll, sniff, stop, exit")
Nach
einer Vorlage in Kumar / Abbas / Fausto / Aster, Robbin and Cotran's
Pathological Basis of Disease, 8th ed. Saunders / Elsevier 2010
Endothelzellen verfügen auf
ihrer luminalen Oberfläche über eine "Haut" (Glykokalyx), welche die
Anlagerung von Leukozyten behindert.
Hier können aber auch u.a. Chemokine
an Proteoglykanmoleküle und dann an Rezeptoren vorbeirollender
Leukozyten binden, was deren Integrine in eine bindungsfreudige Form
überführt (leukozytäres Integrin bindet an endotheliales ICAM, VCAM
u.a.).
Mikrobenaktivierte Makrophagen setzen Zytokine, wie TNF und IL-1, frei. Darauf reagieren Endothelzellen mit der Bildung von Selectinen. PECAM-1 (Platelet endothelial cell adhesion molecule, CD31) ist ein Rezeptor,
den Endothelzellen in entzündetem Gewebe vermehrt exprimieren. Leukozyten heften sich an und können die Blutbahn verlassen
(Diapedese).
Angelagerte Leukozyten gelangen parazellulär
(zwischen Endothelzellen) oder transzellulär (durch Endothelzellen:
Bildung eines 'transmigratory cup', Aufnahme in Endothelzelle, Exozytose auf Gewebeseite) in das Interstitium
IL-1, Interleukin 1; TNF, Tumornekrosefaktor

Einige Integrine (VLA-4, VLA-5 - very late antigens) auf T-Zellen binden an Fibronektin, ein weiteres Adhäsionsmolekül (CD44) an Hyaluronsäure in der extrazellulären Matrix. Erkennen CD4+-Zellen ihr Antigen, regen sie - über Sekretion von Zytokinen - andere
Leukozyten zu dessen Zerstörung an. So können auch Mikroben erfolgreich
bekämpft werden, die der angeborenen zellulären Abwehr alleine
widerstehen würden (kooperative Verstärkung der Phagozytose).

Über verschiedene
T-Lymphozyten-Subsets und deren Funktionen s.
dort
 Endothel exprimiert normalerweise nur ICAM, aber kein Selectin; erst
wenn aktivierte Makrophagen im Gewebe Stoffe wie Interleukin-1 (IL-1)
und Tumornekrosefaktor (TNF) abgeben, exprimieren die Endothelzellen Selectin (das braucht etwa 6 Stunden).
Endothel exprimiert normalerweise nur ICAM, aber kein Selectin; erst
wenn aktivierte Makrophagen im Gewebe Stoffe wie Interleukin-1 (IL-1)
und Tumornekrosefaktor (TNF) abgeben, exprimieren die Endothelzellen Selectin (das braucht etwa 6 Stunden).
 Dann können Leukozyten
vermittels ihres spezifischen Kohlenhydrats (dieser wird als Selectin-Ligand bezeichnet) an das Endothel fixiert
werden, was sie zum "Rollen" entlang des Endothels veranlasst, also
einbremst.
Dann können Leukozyten
vermittels ihres spezifischen Kohlenhydrats (dieser wird als Selectin-Ligand bezeichnet) an das Endothel fixiert
werden, was sie zum "Rollen" entlang des Endothels veranlasst, also
einbremst.
Der solchermaßen "entschleunigte" Leukozyt hat nun Zeit, die allfällige
Anwesenheit entzündungsindizierender Stoffe (z.B. C5a)
"auszuschnüffeln". Liegen solche vor, exprimiert er Integrin, dieses
bindet an ICAM - diese Bindung ermöglicht nun eine Diapedese.
Die
Aktivierung des Integrins erfolgt sehr schnell (es liegt bereits im
Leukozyt gespeichert vor), da ansonsten der Leukozyt wieder aus der
betreffenden Kapillare fortgespült würde, bevor die
Integrin-ICAM-Bindung erfolgt. Nun folgt die Zelle dem chemischen
Gradienten "attraktiver" Stoffe aus dem Entzündungsherd, begibt sich in das Gewebe und setzt sein Kampfpotential ein.
Diapedese in lymphatischem Gewebe
Immunzellen können lymphatische Organe routinemäßig über
afferente Lymphgefäße (die das Interstitium drainieren) oder über den
Blutkreislauf betreten - letzteres durch hochendotheliale Venolen (high endothelial venules HEV,  Abbildung)
in T-Zell-Zonen von Lymphknoten oder mukösen lymphoiden Geweben, wo sie
zwischen Endothelzellen relativ leicht hindurchgelangen
(betrifft jede Sekunde zehntausende Lymphozyten). HEVs sind
spezialisierte postkapilläre Venolen, deren Endothelzellen mit
Adhäsionsmolekülen und Chemokinen ausgestattet sind und dadurch das
Auswandern von Lymphozyten in das sekundäre lymphatische Organ
erleichtern.
Abbildung)
in T-Zell-Zonen von Lymphknoten oder mukösen lymphoiden Geweben, wo sie
zwischen Endothelzellen relativ leicht hindurchgelangen
(betrifft jede Sekunde zehntausende Lymphozyten). HEVs sind
spezialisierte postkapilläre Venolen, deren Endothelzellen mit
Adhäsionsmolekülen und Chemokinen ausgestattet sind und dadurch das
Auswandern von Lymphozyten in das sekundäre lymphatische Organ
erleichtern.
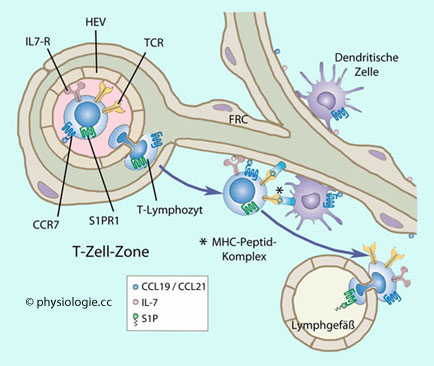
 Abbildung: T-Zellen verlassen den Blutstrom über hochendotheliale Venolen (HEV),
wandern durch die T-Zell-Zone eines Lymphknotens und gelangen in ein
Lymphgefäß
Abbildung: T-Zellen verlassen den Blutstrom über hochendotheliale Venolen (HEV),
wandern durch die T-Zell-Zone eines Lymphknotens und gelangen in ein
Lymphgefäß
Nach Takada K, Jameson SC. Naive T cell homeostasis: from awareness of space to a sense of place. Nature Rev Immunol 2009; 9: 823-32
Beim
Austritt aus dem Blut exprimieren T-Lymphozyten viel Chemokinrezeptor 7
(CCR7), um durch die HEV gelangen zu können. Das Blut enthält viel
Sphingosin-1-Phosphat (S1P), daher haben die T-Zellen die Expression
des Sphingosin 1-Phosphat Rezeptor 1 (S1PR1)
herunterreguliert.
Einmal aus dem Kreislauf ausgetreten, bewegen sich
naive Lymphozyten in der T-Zell-Zone an Fibroblasten entlang (fibroblastic reticular cell network,
FRC), unterstützt durch Chemokinliganden (CCL19, CCL21). Dabei treffen
sie auf zusammenwirkende Faktoren (CCR7-Liganden; IL-7, Interleukin 7;
MHC-Komplexe)
IL7R, IL-7 Rezeptor; TCR, T-Zell-Rezeptor

 'Unerfahrene' Lymphozyten (T und B) tun dies beliebig (eine
Rezirkulation benötigt 12-24 Stunden - die Lebenserwartung der Zelle
beträgt ~6 Wochen),
nur nicht in entzündetem Gewebe.
'Unerfahrene' Lymphozyten (T und B) tun dies beliebig (eine
Rezirkulation benötigt 12-24 Stunden - die Lebenserwartung der Zelle
beträgt ~6 Wochen),
nur nicht in entzündetem Gewebe.
 'Erfahrene' T-Zellen hingegen haben
eine "Spezialpass" und konzentrieren sich auf Orte, wo 'ihr'
Antigen schon präsentiert wurde
und dabei ein Klon 'erfahrener' Lymphozyten entstanden ist. Auf diese
Weise konzentrieren sich spezialisierte Helfer- und Killerzellen auf
die Orte des Kampfgeschehens.
'Erfahrene' T-Zellen hingegen haben
eine "Spezialpass" und konzentrieren sich auf Orte, wo 'ihr'
Antigen schon präsentiert wurde
und dabei ein Klon 'erfahrener' Lymphozyten entstanden ist. Auf diese
Weise konzentrieren sich spezialisierte Helfer- und Killerzellen auf
die Orte des Kampfgeschehens.
Wie sich Immunzellen in der Mikrozirkulation verhalten, hängt also von
Proteinen ab, die ihre transvaskuläre Wanderung steuern: Chemokine, Selectine, Integrine. T-Lymphozyten nehmen in unterschiedlichen Phasen ihres Daseins unterschiedliche Wege durch den Körper:
 Naive T-Zellen
haben noch keinen Kontakt mit ihrem Antigen gehabt,
d.h. es ist zu keiner Bindung mit ihren spezifischen
TC-Rezeptoren gekommen.
Naive T-Zellen exprimieren das Adhäsionsmolekül L-Selectin (CD62L) und den Chemokinrezeptor CCR7.
Diese vermitteln die spezifische Migration von naiven T-Zellen durch
hochendotheliale Venolen in Lymphknoten. Deren Endothelien exprimieren
Kohlenhydratliganden, die L-Selectin binden, und haben Chemokine, die
nur in lymphatischem Gewebe vorkommen und spezifisch von CCR7 erkannt
werden.
Naive T-Zellen
haben noch keinen Kontakt mit ihrem Antigen gehabt,
d.h. es ist zu keiner Bindung mit ihren spezifischen
TC-Rezeptoren gekommen.
Naive T-Zellen exprimieren das Adhäsionsmolekül L-Selectin (CD62L) und den Chemokinrezeptor CCR7.
Diese vermitteln die spezifische Migration von naiven T-Zellen durch
hochendotheliale Venolen in Lymphknoten. Deren Endothelien exprimieren
Kohlenhydratliganden, die L-Selectin binden, und haben Chemokine, die
nur in lymphatischem Gewebe vorkommen und spezifisch von CCR7 erkannt
werden.
Treffen ausgewanderte Lymphozyten nicht auf "ihr" Antigen, verlassen
sie den Lymphknoten innerhalb eines halben Tages wieder, gelangen
über efferente Lymphgefäße in den Blutkreislauf zurück und
wandern zwischen Blut und sekundären Lymphgeweben durch den Organismus,
bis sie in einem lymphoiden Organ auf dendritische Zellen stoßen, die
(mikrobiuelle) Antigene präsentieren, welche die naive T-Zelle erkennt
(passende Rezeptoren).

Wenn
antigenpräsentierende Zellen (mittels MHC-II-Molekülen) T-Zellen mit passenden Rezeptoren
Antigene vorzeigen, treten diese in eine
Teilungssequenz ein und bilden spezifische Klone mit Effektor-
sowie Gedächtniszellen
. Diese wandern dann in Gewebe aus, das mit entsprechenden Mikroben infiziert ist und sorgen für deren Abtötung.
Zunächst haften Lymphozyten in sekundären lymphatischen Organen an sogenannte Homing-Rezeptoren (diese gehören zur Familie der Selectine) an hochendothelialem Endothel postkapillärer Venolen.
Diese Rezeptoren wirken relativ schwach, Verknüpfungen lösen sich
wieder, neue werden aufgenommen, sodass die Zellen am Endothel langsam
entlangrollen.
 Unter lymphocyte homing
versteht man das gezielte Auswandern (Migration) zirkulierender
Lymphozyten in bestimmte Gewebe. Reguliert wird dieser Vorgang durch
selektive (gewebespezifische) Expression endothelialer Chemokine und Adhäsionsmoleküle. Zu letzteren gehören Addressine (sie gehören zur Immunglobulin-Superfamilie) - z.B. exprimieren Peyer'sche Plaques MAdCAM (mucosal addressin cell adhesion molecules) und das Chemokin CCL25, und diese binden im betreffenden Darmabschnitt an lymphozytäre Homing-Rezeptoren.
Unter lymphocyte homing
versteht man das gezielte Auswandern (Migration) zirkulierender
Lymphozyten in bestimmte Gewebe. Reguliert wird dieser Vorgang durch
selektive (gewebespezifische) Expression endothelialer Chemokine und Adhäsionsmoleküle. Zu letzteren gehören Addressine (sie gehören zur Immunglobulin-Superfamilie) - z.B. exprimieren Peyer'sche Plaques MAdCAM (mucosal addressin cell adhesion molecules) und das Chemokin CCL25, und diese binden im betreffenden Darmabschnitt an lymphozytäre Homing-Rezeptoren.
Lymphozyten haften nur bedingt an - und rollen über - Endothelien von Kapillaren und hochendothelialen Venolen, bis im Gewebe gebildete Chemokine
an lymphozytäre Rezeptoren fest binden (dieses Adhäsionssystem wirkt
intensiver) und die Zellen aus der Blutbahn in das Interstitium leiten (Diapedese
), z.B. in das T-Zell-Areal eines Lymphknotens (lymphocyte trafficking / routing). Dieser Vorgang erfordert zusätzliche Adhäsionsproteine (wie CD31
).
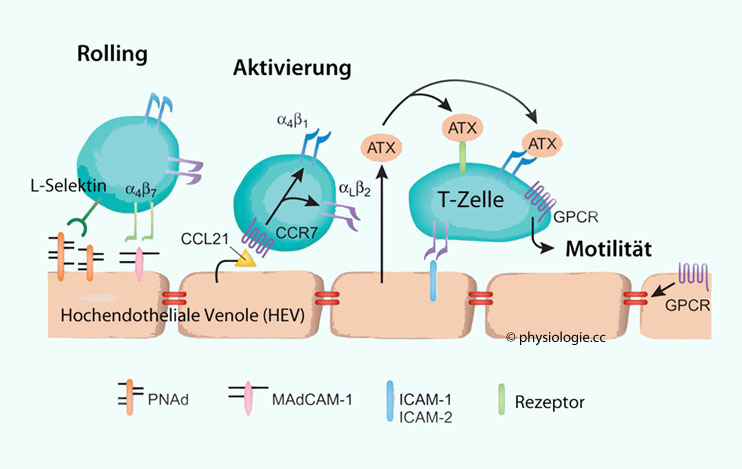

Abbildung: Lymphozyten-Homing in sekundären lymphatischen Organen
Nach Vestweber D, Wild MK. A new player in lymphocyte homing. Nature Immunol 2008; 9: 347-8
Das "Einfangen" (capture) der Lymphozyten wird durch L-Selectin und α4β7-Integrin eingeleitet, diese binden an PNAd (peripheral node addressin) und MAdCAM (s. Text).
Bindung des Chemokins CCL21 an seinen Rezeptor CCR7 (CC wegen 2 Cysteinresten, L = Ligand, R = Rezeptor) aktiviert das Integrin αLβ2 - dieses bewirkt das Festhalten (arrest) des Lymphozyten.
 Autotaxin (ATX) ist ein von hochendothelialen Venolen sezerniertes phospholipidproduzierendes Enzym,
das den Austritt von Lymphozyten in sekundäre lymphatische Organe
begünstigt. ICAMs (intercellular adhesion molecules) befördern diese Bindung.
Autotaxin (ATX) ist ein von hochendothelialen Venolen sezerniertes phospholipidproduzierendes Enzym,
das den Austritt von Lymphozyten in sekundäre lymphatische Organe
begünstigt. ICAMs (intercellular adhesion molecules) befördern diese Bindung.
Die lymphozytäre Motilität wird durch Bindung an GPCR (G protein-coupled receptors) begünstigt

Erfahrene B-Zellen siedeln sich in
Knochenmark oder sekundärem lymphatischem Gewebe - vor allem in der
Milz - an, werden zu Plasmazellen und produzieren Antikörper, die ohnehin mit dem Kreislauf überallhin gelangen.
 Selectine und
ihre Liganden werden von Leukozyten und Endothelzellen exprimiert.
Histamin- oder Thrombin-aktivierte Endothelzellen exprimieren
P-Selectin, Zytokin-aktivierte E-Selectin. Leukozyten exprimieren
L-Selectin, dieses wird für das homing naiver B- und T-Lymphozyten benötigt:
Selectine und
ihre Liganden werden von Leukozyten und Endothelzellen exprimiert.
Histamin- oder Thrombin-aktivierte Endothelzellen exprimieren
P-Selectin, Zytokin-aktivierte E-Selectin. Leukozyten exprimieren
L-Selectin, dieses wird für das homing naiver B- und T-Lymphozyten benötigt:
'Naive'
T-Zellen exprimieren L-Selectin, welches an das Proteoglykan GlyCAM-1
(Glycosylation-dependent cell adhesion molecule-1) bindet, das vom HEV-Endothel aller sekundären lymphatischen Gewebe
(z.B. Lymphknoten) exprimiert wird. Auf diese Weise besuchen
'unerfahrene'
T-Zellen mittels ihres L-Selectin beliebige sekundäre lymphatische
Organe und deren antigenpräsentierende Zellen. Bleiben
sie inaktiviert, wiederholen sie ihren Streifzug durch den
Körper (eine Rezirkulation durch Kreislauf und Lymphsystem
dauert 12-24 Stunden), bis sie nach einiger Zeit vergeblicher
Suche nach 'ihrem' Antigen durch Apoptose absterben.
 Findet eine
T-Zelle 'ihr' Antigen auf antigenpräsentierenden Zellen, wird sie aktiviert und
zur 'erfahrenen' ('reifen') T-Zelle. Sie stattet sich jetzt mit
Adhäsionsmolekülen aus, die ihr vorzugsweise Zugang zum Gewebe
verschaffen, in dem sie aktiviert wurde (die Expression anderer
Adhäsionsmoleküle wird heruntergefahren).
Findet eine
T-Zelle 'ihr' Antigen auf antigenpräsentierenden Zellen, wird sie aktiviert und
zur 'erfahrenen' ('reifen') T-Zelle. Sie stattet sich jetzt mit
Adhäsionsmolekülen aus, die ihr vorzugsweise Zugang zum Gewebe
verschaffen, in dem sie aktiviert wurde (die Expression anderer
Adhäsionsmoleküle wird heruntergefahren).
Wird z.B. eine
T-Zelle in einem Peyer'schen Plaque aktiviert, exprimiert sie ein
spezifisches Integrin (α4β7) und nur mehr wenig
L-Selectin. α4β7-Integrin bindet Addressin (=MAdCAM-1, mucosal vascular addressin cell adhesion molecule 1, das sich
vorwiegend auf Venolen-Endothelzellen von Peyer'schen Plaques und
mesenterialen Lymphknoten findet. So kommt es zu einer
Konzentrierung und zu effizienter Kooperation mit anderen
aktivierten (zytotoxischen, B-) Zellen.


 Lymphozyten entwickeln sich in generativen lymphoiden Organen (Thymus,
rotes Knochenmark) schrittweise: Bindung zu einer Zelllinie (wird aus
der Stammzelle ein B- oder T-Prolymphozyt?), Zellwachstum und -teilung
(Bildung spezialisierter Lymphozyten, angeregt durch Zytokine und
Signale von Präantigenrezeptoren)
Lymphozyten entwickeln sich in generativen lymphoiden Organen (Thymus,
rotes Knochenmark) schrittweise: Bindung zu einer Zelllinie (wird aus
der Stammzelle ein B- oder T-Prolymphozyt?), Zellwachstum und -teilung
(Bildung spezialisierter Lymphozyten, angeregt durch Zytokine und
Signale von Präantigenrezeptoren)
 Lymphozyten organisieren
Gensequenzen für ihre Rezeptoren (für T-Zellen im Thymus, für B-Zellen
im Knochenmark) ohne Antigenkontakt nach dem Zufallsprinzip (Repertoire
unterschiedlich antigenempfänglicher Zellen)
Lymphozyten organisieren
Gensequenzen für ihre Rezeptoren (für T-Zellen im Thymus, für B-Zellen
im Knochenmark) ohne Antigenkontakt nach dem Zufallsprinzip (Repertoire
unterschiedlich antigenempfänglicher Zellen)
 Lymphknoten unterstützen adaptive Immunantworten auf Antigene, die
ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden. In
den subkapsulären Sinus (reich an Makrophagen) tritt primäre Lymphe
ein. Follikuläre dendritische Zellen präsentieren Antigene an B-Zellen.
Die innere Rinde enthält T-Zellen und hochendotheliales Endothel
(T-Zellen treffen dendritische Zellen). Im inneren Sinus sammelt sich
Lymphe, die Richtung Blut abfließt
Lymphknoten unterstützen adaptive Immunantworten auf Antigene, die
ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden. In
den subkapsulären Sinus (reich an Makrophagen) tritt primäre Lymphe
ein. Follikuläre dendritische Zellen präsentieren Antigene an B-Zellen.
Die innere Rinde enthält T-Zellen und hochendotheliales Endothel
(T-Zellen treffen dendritische Zellen). Im inneren Sinus sammelt sich
Lymphe, die Richtung Blut abfließt
 Die Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und Bakterien aus dem Kreislauf, und startet adaptive
Immunantworten
Die Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und Bakterien aus dem Kreislauf, und startet adaptive
Immunantworten
 Sekundäre lymphatische Organe haben Venolen mit hochendothelialen
Endothelien, über die Leukozyten - gesteuert durch Adhäsionsmoleküle
auf Leukozyten und Endothelzellen - die Blutbahn verlassen können
(Diapedese), gesteuert durch Chemokine aus dem Gewebe. Leukozyten
verlassen die Mikrozirkulation sowohl parazellulär
(Lamellopodien werden zwischen die Endothelzellen gesteckt,
interzelluläre Verbindungen aufgelöst) oder transzellulär (mittels
Podosomen). Passen
(von antigenpräsentierenden Zellen mittels MHC-II-Molekülen gezeigte)
Peptide auf die Rezeptoren entsprechender T-Zellen, teilen sich diese
und bilden Effektor- und Gedächtniszellklone
Sekundäre lymphatische Organe haben Venolen mit hochendothelialen
Endothelien, über die Leukozyten - gesteuert durch Adhäsionsmoleküle
auf Leukozyten und Endothelzellen - die Blutbahn verlassen können
(Diapedese), gesteuert durch Chemokine aus dem Gewebe. Leukozyten
verlassen die Mikrozirkulation sowohl parazellulär
(Lamellopodien werden zwischen die Endothelzellen gesteckt,
interzelluläre Verbindungen aufgelöst) oder transzellulär (mittels
Podosomen). Passen
(von antigenpräsentierenden Zellen mittels MHC-II-Molekülen gezeigte)
Peptide auf die Rezeptoren entsprechender T-Zellen, teilen sich diese
und bilden Effektor- und Gedächtniszellklone
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Chemokin: χημεία = Gießerei (im Sinne von „Umwandlung“), κίνἔω = antreiben, bewegen
Chemokin: χημεία = Gießerei (im Sinne von „Umwandlung“), κίνἔω = antreiben, bewegen Lymphozyten: Entwicklung
Lymphozyten: Entwicklung  Lymphknoten
Lymphknoten  Milz
Milz  Haut und Schleimhäute
Haut und Schleimhäute  Aktivierung von Abwehrmechanismen
Aktivierung von Abwehrmechanismen  Diapedese
Diapedese

 PALS
PALS  Homing, Addressine
Homing, Addressine
 produzieren (primäre, zentrale, generative Immungewebe, generative lymphoid organs). Bei Feten anfänglich in Leber und Milz, erfolgt die Hämatopoese im späteren Leben im roten Knochenmark. Hier werden Lymphozyten aus Stammzellen nachgebildet.
Auch das Thymus wird als "primäres" lymphatisches Organ bezeichnet,
obwohl es T-Lymphozyten nur "trainiert" - die Entstehung ihrer
Frühformen erfolgt im Knochenmark;
produzieren (primäre, zentrale, generative Immungewebe, generative lymphoid organs). Bei Feten anfänglich in Leber und Milz, erfolgt die Hämatopoese im späteren Leben im roten Knochenmark. Hier werden Lymphozyten aus Stammzellen nachgebildet.
Auch das Thymus wird als "primäres" lymphatisches Organ bezeichnet,
obwohl es T-Lymphozyten nur "trainiert" - die Entstehung ihrer
Frühformen erfolgt im Knochenmark; bearbeiten (Lymphozyten reifen und immunkompetent werden lassen: T-Zellen im Thymus, B-Zellen im Knochenmark). Im sekundären (peripheren) Immungewebe (secondary lymphoid organs) beginnen adaptive Immunantworten auf die Anwesenheit von Mikroben (Lymphknoten, Milz, mucosa-assoziiertes sowie kutanes Immungewebe). Sekundäre lymphatische Organe
wirken als Filterstationen, die abgestorbene Zellen, Fremdmaterial und
Proteinaggregate aus dem Kreislauf entfernen. Lymphozyten, Monozyten
und dendritische Zellen können
sich in das lymphatische Gewebe hinein- oder aus ihm
hinausbewegen. Verschiedene Zelltypen müssen interaktiv kommunizieren,
um effiziente Immunantworten zu bewirken, auch wenn die
Wahrscheinlichkeit ihres Aufeinandertreffens gering ist: Beispielsweise
regen Helfer-T-Zellen B-Zellen, die auf dasselbe Antigen reagieren, zur
Antikörperproduktion an. Zwischen Lymphozyten und umliegenden Zellen
werden zahlreiche Signale ausgetauscht;
bearbeiten (Lymphozyten reifen und immunkompetent werden lassen: T-Zellen im Thymus, B-Zellen im Knochenmark). Im sekundären (peripheren) Immungewebe (secondary lymphoid organs) beginnen adaptive Immunantworten auf die Anwesenheit von Mikroben (Lymphknoten, Milz, mucosa-assoziiertes sowie kutanes Immungewebe). Sekundäre lymphatische Organe
wirken als Filterstationen, die abgestorbene Zellen, Fremdmaterial und
Proteinaggregate aus dem Kreislauf entfernen. Lymphozyten, Monozyten
und dendritische Zellen können
sich in das lymphatische Gewebe hinein- oder aus ihm
hinausbewegen. Verschiedene Zelltypen müssen interaktiv kommunizieren,
um effiziente Immunantworten zu bewirken, auch wenn die
Wahrscheinlichkeit ihres Aufeinandertreffens gering ist: Beispielsweise
regen Helfer-T-Zellen B-Zellen, die auf dasselbe Antigen reagieren, zur
Antikörperproduktion an. Zwischen Lymphozyten und umliegenden Zellen
werden zahlreiche Signale ausgetauscht; speichern - z.B. in Lymphknoten (190 Milliarden Lymphozyten), Milz (70), Knochenmark (50), Darmschleimhaut (50), Lunge (30), Haut (20), Leber (10), Blut (10 Milliarden Lymphozyten).
speichern - z.B. in Lymphknoten (190 Milliarden Lymphozyten), Milz (70), Knochenmark (50), Darmschleimhaut (50), Lunge (30), Haut (20), Leber (10), Blut (10 Milliarden Lymphozyten).
 Abbildung: Lymphatisches Gewebe im Körper
Abbildung: Lymphatisches Gewebe im Körper Zum Lymphtransport s. dort
Zum Lymphtransport s. dort  Als primäre lymphatische Gewebe (primary lymphoid organs) bezeichnet man solche, in denen sich Lymphozyten entwickeln (Knochenmark und Thymus); als sekundäre lymphatische Gewebe (secondary lymphoid organs)
solche, die Immunogene einfangen und konzentrieren, und die
Kontaktwahrscheinlichkeit zwischen ihnen und Immunzellen erhöhen
(Lymphknoten, Milz, mucosa-assoziierte / lymphoepitheliale Gewebe).
Als primäre lymphatische Gewebe (primary lymphoid organs) bezeichnet man solche, in denen sich Lymphozyten entwickeln (Knochenmark und Thymus); als sekundäre lymphatische Gewebe (secondary lymphoid organs)
solche, die Immunogene einfangen und konzentrieren, und die
Kontaktwahrscheinlichkeit zwischen ihnen und Immunzellen erhöhen
(Lymphknoten, Milz, mucosa-assoziierte / lymphoepitheliale Gewebe).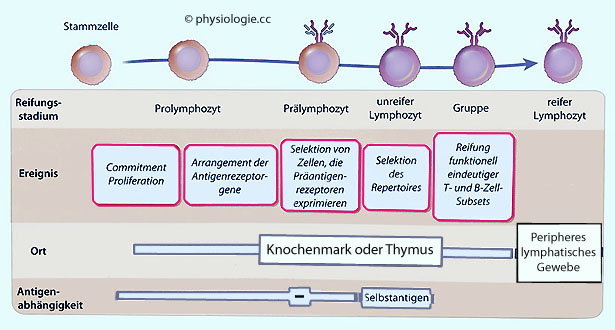
 Abbildung: Stadien der Lymphozytenreifung
Abbildung: Stadien der Lymphozytenreifung
 Abbildung):
Abbildung): Bindung zu einer Zelllinie (commitment):
Hier fällt die Entscheidung, ob aus der Stammzelle ein B- oder
T-Prolymphozyt wird. Das Signal dazu geht von verschiedenen Rezeptoren
an der Oberfläche der Zelle aus, welche dann Transkriptionsfaktoren - über Wirkung an entsprechenden Gen-Loci - zur Expression von B- oder T-spezifischen Rezeptor-Arrangements anregen.
Bindung zu einer Zelllinie (commitment):
Hier fällt die Entscheidung, ob aus der Stammzelle ein B- oder
T-Prolymphozyt wird. Das Signal dazu geht von verschiedenen Rezeptoren
an der Oberfläche der Zelle aus, welche dann Transkriptionsfaktoren - über Wirkung an entsprechenden Gen-Loci - zur Expression von B- oder T-spezifischen Rezeptor-Arrangements anregen. Zellwachstum und -teilung (proliferation) führt zur Bildung von Gruppen (pools) spezialisierter Lymphozyten, angeregt durch Zytokine und später - an Zellen mit erfolgreich angeordneten Antigenrezeptor-Genen - durch Signale von Präantigenrezeptoren:
Zellwachstum und -teilung (proliferation) führt zur Bildung von Gruppen (pools) spezialisierter Lymphozyten, angeregt durch Zytokine und später - an Zellen mit erfolgreich angeordneten Antigenrezeptor-Genen - durch Signale von Präantigenrezeptoren: Lymphozyten müssen die Gensequenzen für ihre Antigenrezeptoren in einer
Weise anordnen, dass der Erkennungsvorgang funktioniert (recombination, rearrangement). Diese Rekombinationsvorgänge erfolgen für T-Zellen im Thymus und für B-Zellen im Knochenmark. Dies geschieht nach dem Zufallsprinzip ohne Antigenkontakt.
Auf diese Weise entsteht ein großes Repertoire unterschiedlich
antigenempfänglicher Zellen - jeder Mensch entwickelt etwa 10 Millionen
bis eine Milliarde Lymphozytenklone mit jeweils einer bestimmten
Erkennungs- und Bindungscharakteristik ihrer Rezeptoren.
Lymphozyten müssen die Gensequenzen für ihre Antigenrezeptoren in einer
Weise anordnen, dass der Erkennungsvorgang funktioniert (recombination, rearrangement). Diese Rekombinationsvorgänge erfolgen für T-Zellen im Thymus und für B-Zellen im Knochenmark. Dies geschieht nach dem Zufallsprinzip ohne Antigenkontakt.
Auf diese Weise entsteht ein großes Repertoire unterschiedlich
antigenempfänglicher Zellen - jeder Mensch entwickelt etwa 10 Millionen
bis eine Milliarde Lymphozytenklone mit jeweils einer bestimmten
Erkennungs- und Bindungscharakteristik ihrer Rezeptoren. 
 Abbildung: Weichenstellungen bei der Lymphozytenreifung
Abbildung: Weichenstellungen bei der Lymphozytenreifung
 Selektion: Lymphozyten werden nach verschiedenen Kriterien ausgesucht:
Haben sie keine brauchbaren Rezeptoren gebildet oder erkennen sie
"Selbst"-Antigene zu stark, werden sie eliminiert. Dabei spielen
Präantigen- und Antigenrezeptoren eine entscheidende Rolle
(
Selektion: Lymphozyten werden nach verschiedenen Kriterien ausgesucht:
Haben sie keine brauchbaren Rezeptoren gebildet oder erkennen sie
"Selbst"-Antigene zu stark, werden sie eliminiert. Dabei spielen
Präantigen- und Antigenrezeptoren eine entscheidende Rolle
( Abbildung). Nur voll taugliche (und für den Körper ungefährliche)
Zellen überleben.
Abbildung). Nur voll taugliche (und für den Körper ungefährliche)
Zellen überleben. Differenzierung: Schließlich entstehen voll ausgereifte B- und T-Lymphozyten (CD4+, CD8+, NKT und andere).
Differenzierung: Schließlich entstehen voll ausgereifte B- und T-Lymphozyten (CD4+, CD8+, NKT und andere).  Für T-Zellen: s. dort
Für T-Zellen: s. dort Lymphknoten unterstützen adaptive Immunantworten
auf Antigene, die ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden.
Lymphknoten unterstützen adaptive Immunantworten
auf Antigene, die ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden.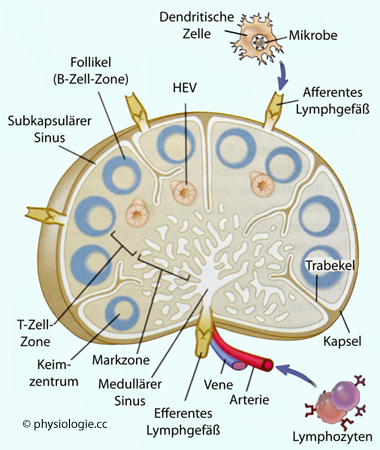
 Abbildung: Gliederung eines Lymphknotens
Abbildung: Gliederung eines Lymphknotens
 koordiniert. Diese werden lokal unterschiedlich freigesetzt, und die Zahl der Chemokinrezeptoren in der Wand der Immunzellen wird je nach Erfordernis hinauf- oder hinunterreguliert.
koordiniert. Diese werden lokal unterschiedlich freigesetzt, und die Zahl der Chemokinrezeptoren in der Wand der Immunzellen wird je nach Erfordernis hinauf- oder hinunterreguliert. in
den Lymphknoten). Lymphknoten weisen eine funktionelle Gliederung in
Zonen auf (
in
den Lymphknoten). Lymphknoten weisen eine funktionelle Gliederung in
Zonen auf ( Abbildung), deren Organisation von verschiedenen - auch
bindegewebigen - Zellen und deren Zytokinen abhängt:
Abbildung), deren Organisation von verschiedenen - auch
bindegewebigen - Zellen und deren Zytokinen abhängt: Ganz außen - am Rand des Knotens, im Bereich des subkapsulären Sinus - tritt primäre Lymphe
Ganz außen - am Rand des Knotens, im Bereich des subkapsulären Sinus - tritt primäre Lymphe  ein. Hier
befinden sich zahlreiche Makrophagen, was der Bekämpfung aus dem Gewebe
eingelangter Erreger dient
ein. Hier
befinden sich zahlreiche Makrophagen, was der Bekämpfung aus dem Gewebe
eingelangter Erreger dient Die Rinde ist reich an B-Zellen und enthält Follikel, wo follikuläre dendritische Zellen (diese präsentieren opsonisiertes Antigen) die Proliferation von B-Zellen befördern
Die Rinde ist reich an B-Zellen und enthält Follikel, wo follikuläre dendritische Zellen (diese präsentieren opsonisiertes Antigen) die Proliferation von B-Zellen befördern Die innere Rinde (Parakortex) ist die T-Zell-Zone, die auch das hochendotheliale Endothel enthält. In dieser Zone werden T-Zellen
durch Adhäsionsmoleküle zurückgehalten und treffen
mit hier ebenfalls angereicherten dendritischen Zellen zusammen
Die innere Rinde (Parakortex) ist die T-Zell-Zone, die auch das hochendotheliale Endothel enthält. In dieser Zone werden T-Zellen
durch Adhäsionsmoleküle zurückgehalten und treffen
mit hier ebenfalls angereicherten dendritischen Zellen zusammen In der innersten Zone, dem Sinus, sammelt sich die Lymphe, die über das efferente Lymphgefäß den Knoten Richtung Blut verlässt.
In der innersten Zone, dem Sinus, sammelt sich die Lymphe, die über das efferente Lymphgefäß den Knoten Richtung Blut verlässt. Die Anreicherung von B-Zellen in den Follikeln, und der T-Zellen im Parakortex ist durch Zytokine
gesteuert. Treffen die Lymphozyten auf "ihre" Antigene, ändern sie ihre
Zytokinrezeptor-Expression, wandern aufeinander zu und treffen sich am
Rand der Follikel, wo Helfer-T-Zellen B-Zellen bei ihrer
Differenzierung zu Plasmazellen unterstützen.
Die Anreicherung von B-Zellen in den Follikeln, und der T-Zellen im Parakortex ist durch Zytokine
gesteuert. Treffen die Lymphozyten auf "ihre" Antigene, ändern sie ihre
Zytokinrezeptor-Expression, wandern aufeinander zu und treffen sich am
Rand der Follikel, wo Helfer-T-Zellen B-Zellen bei ihrer
Differenzierung zu Plasmazellen unterstützen.
 Abbildung: Milz
Abbildung: Milz
 Die
Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und opsonisierte Bakterien aus dem Kreislauf, und
initiiert adaptive Immunantworten gegen Antigene im Blut.
Die
Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und opsonisierte Bakterien aus dem Kreislauf, und
initiiert adaptive Immunantworten gegen Antigene im Blut. Abbildung) erfolgt im Bedarfsfall antigeninduzierte Differenzierung und Vermehrung von B- und T-Lymphozyten. Anders als bei Lymphknoten und Peyer-Plaques sind für
den Eintritt von Leukozyten keine hochendothelialen Venolen nötig; die
Milz ist ein "offenes" Organ mit diskontinuierlichem Endothel. Um die Arteriolen sitzen periarterioläre lymphatische Scheiden (PALS), darum herum verzweigen sich marginale Sinus
mit B-Zellen und Lymphfollikeln.
Abbildung) erfolgt im Bedarfsfall antigeninduzierte Differenzierung und Vermehrung von B- und T-Lymphozyten. Anders als bei Lymphknoten und Peyer-Plaques sind für
den Eintritt von Leukozyten keine hochendothelialen Venolen nötig; die
Milz ist ein "offenes" Organ mit diskontinuierlichem Endothel. Um die Arteriolen sitzen periarterioläre lymphatische Scheiden (PALS), darum herum verzweigen sich marginale Sinus
mit B-Zellen und Lymphfollikeln.  Unter PALS
(periarteriolar lymphoid sheaths) versteht man lymphatisches Gewebe der Milz, das in der Nähe von
Lymphfollikeln kleine Arteriolen umgibt. Es enthält zahlreiche T-Zellen
(2/3 CD4+, 1/3 CD8+).
Unter PALS
(periarteriolar lymphoid sheaths) versteht man lymphatisches Gewebe der Milz, das in der Nähe von
Lymphfollikeln kleine Arteriolen umgibt. Es enthält zahlreiche T-Zellen
(2/3 CD4+, 1/3 CD8+).  Zur Stellung der Milz im Immunsystem s. auch dort
Zur Stellung der Milz im Immunsystem s. auch dort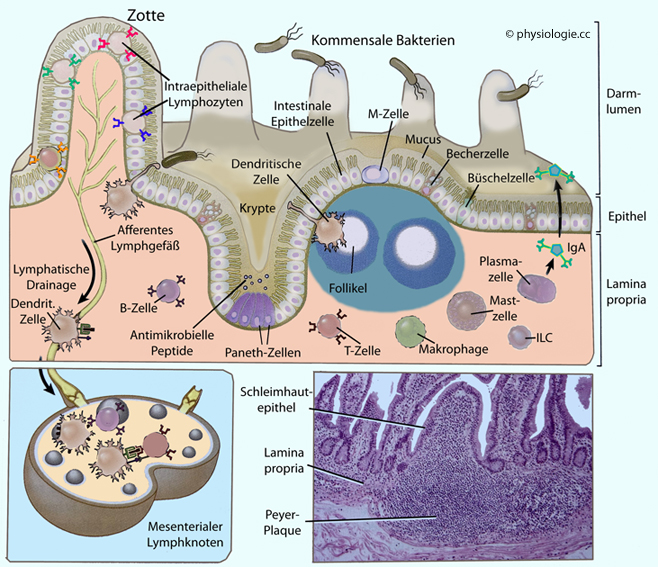
 Abbildung: Immunsystem an Schleimhäuten
Abbildung: Immunsystem an Schleimhäuten
 Abbildung).
Abbildung).
 Abbildung: Immunsystem der Haut
Abbildung: Immunsystem der Haut Mehr zu: Keratinozyten
Mehr zu: Keratinozyten  Langerhanszellen
Langerhanszellen  Dendritischen Zellen
Dendritischen Zellen  Plasmazellen
Plasmazellen  Mastzellen
Mastzellen  Makrophagen
Makrophagen  T-Lymphozyten
T-Lymphozyten  Lymphatischer Drainage
Lymphatischer Drainage

 Abbildung). Die Haut (bei erwachsenen Personen ca. 1,5-2 m2,
3,5-10 kg Gewicht) beinhaltet den größten Anteil der Zellen des
angeborenen sowie des adaptiven Immunsystems, was ihre große Bedeutung
für den primären Schutz vor dem Eindringen von Pathogenen
unterstreicht.
Abbildung). Die Haut (bei erwachsenen Personen ca. 1,5-2 m2,
3,5-10 kg Gewicht) beinhaltet den größten Anteil der Zellen des
angeborenen sowie des adaptiven Immunsystems, was ihre große Bedeutung
für den primären Schutz vor dem Eindringen von Pathogenen
unterstreicht. Interferone blockieren
den Virusbefall von Zellen
Interferone blockieren
den Virusbefall von Zellen Komplementfaktoren wirken u.a.
entzündungsfördernd
Komplementfaktoren wirken u.a.
entzündungsfördernd
 Abbildung: Regulierung von NK-Zellen
Abbildung: Regulierung von NK-Zellen
 Natürliche Killerzellen (NK-Zellen) greifen infizierte Zellen an (
Natürliche Killerzellen (NK-Zellen) greifen infizierte Zellen an ( Abbildung)
Abbildung) Eingedrungene Parasiten werden von
eosinophilen Granulozyten attackiert (
Eingedrungene Parasiten werden von
eosinophilen Granulozyten attackiert ( s. auch dort)
s. auch dort) Zytotoxine greifen infizierte Zellen und Parasiten an
Zytotoxine greifen infizierte Zellen und Parasiten an vgl. dort
vgl. dort bzw. Transmigration (leukocyte extravasation).
Dazu
ist die
sequentielle Aktivierung von Faktoren notwendig, die diese Zellen nach
dem
Schlüssel-Schloss-Prinzip am Endothel "bremsen", festhalten und
schließlich ihre Diapedese ermöglichen. In verletztem bzw. entzündlich
verändertem Gewebe verlassen aktivierte
Leukozyten - wie Granulozyten, Monozyten, Makrophagen (angeborene
Abwehr), Lymphozyten (adaptive Abwehr) - die Mikrozirkulation
(Kapillaren, Venolen). Diapedese kann
in jedem vaskularisierten Gewebe im Rahmen von immunologischen
Prozessen stattfinden: Im Gewebe allgemein z.B. zur Bekämpfung von
Mikroben, oder in lymphatischen Organen, wo sie der Passage bzw. der
Interaktion von Immunzellen dient.
bzw. Transmigration (leukocyte extravasation).
Dazu
ist die
sequentielle Aktivierung von Faktoren notwendig, die diese Zellen nach
dem
Schlüssel-Schloss-Prinzip am Endothel "bremsen", festhalten und
schließlich ihre Diapedese ermöglichen. In verletztem bzw. entzündlich
verändertem Gewebe verlassen aktivierte
Leukozyten - wie Granulozyten, Monozyten, Makrophagen (angeborene
Abwehr), Lymphozyten (adaptive Abwehr) - die Mikrozirkulation
(Kapillaren, Venolen). Diapedese kann
in jedem vaskularisierten Gewebe im Rahmen von immunologischen
Prozessen stattfinden: Im Gewebe allgemein z.B. zur Bekämpfung von
Mikroben, oder in lymphatischen Organen, wo sie der Passage bzw. der
Interaktion von Immunzellen dient. Abbildung):
Abbildung):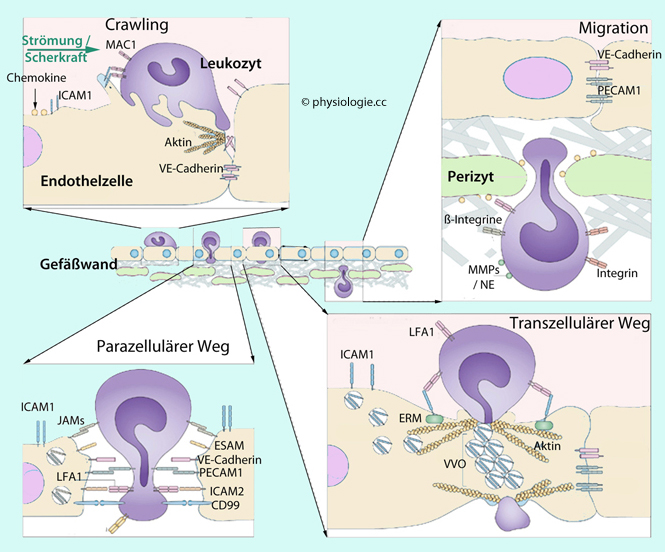
 Abbildung: Transmigration
Abbildung: Transmigration JAM = junctional adhesion molecule
JAM = junctional adhesion molecule
 LFA1 = lymphocyte function-associated antigen 1
LFA1 = lymphocyte function-associated antigen 1
 PECAM1 = platelet/endothelial-cell adhesion molecule 1
PECAM1 = platelet/endothelial-cell adhesion molecule 1
 VE-Cadherin = endothelial-expressed vascular endothelial cadherin
VE-Cadherin = endothelial-expressed vascular endothelial cadherin Zu Cadherinen s. dort
Zu Cadherinen s. dort 
 Parazellulär, wobei der Leukozyt Lamellopodien
zwischen die Endothelzellen steckt, interzelluläre Verbindungen (tight
junctions) auflöst (dabei sind Moleküle wie Cadherin, ICAM und PECAM im
Spiel) und durch den so entstandenen Spaltraum schlüpft; oder
Parazellulär, wobei der Leukozyt Lamellopodien
zwischen die Endothelzellen steckt, interzelluläre Verbindungen (tight
junctions) auflöst (dabei sind Moleküle wie Cadherin, ICAM und PECAM im
Spiel) und durch den so entstandenen Spaltraum schlüpft; oder Transzellulär, wobei der Leukozyt aktinreiche Podosomen
bildet, mit denen er sich an die Oberfläche der Endothelzelle
"einzapft" und diese zur Transzytose (Aufnahme in die Endothelzelle und
Transfer auf die Gewebeseite) veranlasst. Stellen
mit geringem Endotheldurchmesser werden bevorzugt. Nach Bindung wandern
ICAM1-Moleküle an Stellen, die reich an Aktin und caveolae sind.
Letztere fließen zu vesikulo-vakuolären Organellen zusammen, welche einen Kanal für den Durchtritt des Leukozyten bilden.
Transzellulär, wobei der Leukozyt aktinreiche Podosomen
bildet, mit denen er sich an die Oberfläche der Endothelzelle
"einzapft" und diese zur Transzytose (Aufnahme in die Endothelzelle und
Transfer auf die Gewebeseite) veranlasst. Stellen
mit geringem Endotheldurchmesser werden bevorzugt. Nach Bindung wandern
ICAM1-Moleküle an Stellen, die reich an Aktin und caveolae sind.
Letztere fließen zu vesikulo-vakuolären Organellen zusammen, welche einen Kanal für den Durchtritt des Leukozyten bilden. Anschließend passieren sie die Basalmembran (proteolytisch? mechanisch?) - in Venolen wandern sie auch zwischen Perizyten hindurch - und gelangen so in das Gewebe.
Anschließend passieren sie die Basalmembran (proteolytisch? mechanisch?) - in Venolen wandern sie auch zwischen Perizyten hindurch - und gelangen so in das Gewebe.
 Abbildung: Fixierung von Leukozyten - hier: neutrophilen Granulozyten - am Endothel, Ablauf der Diapedese ("roll, sniff, stop, exit")
Abbildung: Fixierung von Leukozyten - hier: neutrophilen Granulozyten - am Endothel, Ablauf der Diapedese ("roll, sniff, stop, exit")
 Endothel exprimiert normalerweise nur ICAM, aber kein Selectin; erst
wenn aktivierte Makrophagen im Gewebe Stoffe wie Interleukin-1 (IL-1)
und Tumornekrosefaktor (TNF) abgeben, exprimieren die Endothelzellen Selectin (das braucht etwa 6 Stunden).
Endothel exprimiert normalerweise nur ICAM, aber kein Selectin; erst
wenn aktivierte Makrophagen im Gewebe Stoffe wie Interleukin-1 (IL-1)
und Tumornekrosefaktor (TNF) abgeben, exprimieren die Endothelzellen Selectin (das braucht etwa 6 Stunden).  Dann können Leukozyten
vermittels ihres spezifischen Kohlenhydrats (dieser wird als Selectin-Ligand bezeichnet) an das Endothel fixiert
werden, was sie zum "Rollen" entlang des Endothels veranlasst, also
einbremst.
Dann können Leukozyten
vermittels ihres spezifischen Kohlenhydrats (dieser wird als Selectin-Ligand bezeichnet) an das Endothel fixiert
werden, was sie zum "Rollen" entlang des Endothels veranlasst, also
einbremst.  Abbildung)
in T-Zell-Zonen von Lymphknoten oder mukösen lymphoiden Geweben, wo sie
zwischen Endothelzellen relativ leicht hindurchgelangen
(betrifft jede Sekunde zehntausende Lymphozyten). HEVs sind
spezialisierte postkapilläre Venolen, deren Endothelzellen mit
Adhäsionsmolekülen und Chemokinen ausgestattet sind und dadurch das
Auswandern von Lymphozyten in das sekundäre lymphatische Organ
erleichtern.
Abbildung)
in T-Zell-Zonen von Lymphknoten oder mukösen lymphoiden Geweben, wo sie
zwischen Endothelzellen relativ leicht hindurchgelangen
(betrifft jede Sekunde zehntausende Lymphozyten). HEVs sind
spezialisierte postkapilläre Venolen, deren Endothelzellen mit
Adhäsionsmolekülen und Chemokinen ausgestattet sind und dadurch das
Auswandern von Lymphozyten in das sekundäre lymphatische Organ
erleichtern.
 Abbildung: T-Zellen verlassen den Blutstrom über hochendotheliale Venolen (HEV),
wandern durch die T-Zell-Zone eines Lymphknotens und gelangen in ein
Lymphgefäß
Abbildung: T-Zellen verlassen den Blutstrom über hochendotheliale Venolen (HEV),
wandern durch die T-Zell-Zone eines Lymphknotens und gelangen in ein
Lymphgefäß
 'Unerfahrene' Lymphozyten (T und B) tun dies beliebig (eine
Rezirkulation benötigt 12-24 Stunden - die Lebenserwartung der Zelle
beträgt ~6 Wochen),
nur nicht in entzündetem Gewebe.
'Unerfahrene' Lymphozyten (T und B) tun dies beliebig (eine
Rezirkulation benötigt 12-24 Stunden - die Lebenserwartung der Zelle
beträgt ~6 Wochen),
nur nicht in entzündetem Gewebe.  'Erfahrene' T-Zellen hingegen haben
eine "Spezialpass" und konzentrieren sich auf Orte, wo 'ihr'
Antigen schon präsentiert wurde
und dabei ein Klon 'erfahrener' Lymphozyten entstanden ist. Auf diese
Weise konzentrieren sich spezialisierte Helfer- und Killerzellen auf
die Orte des Kampfgeschehens.
'Erfahrene' T-Zellen hingegen haben
eine "Spezialpass" und konzentrieren sich auf Orte, wo 'ihr'
Antigen schon präsentiert wurde
und dabei ein Klon 'erfahrener' Lymphozyten entstanden ist. Auf diese
Weise konzentrieren sich spezialisierte Helfer- und Killerzellen auf
die Orte des Kampfgeschehens.  Naive T-Zellen
haben noch keinen Kontakt mit ihrem Antigen gehabt,
d.h. es ist zu keiner Bindung mit ihren spezifischen
TC-Rezeptoren gekommen.
Naive T-Zellen exprimieren das Adhäsionsmolekül L-Selectin (CD62L) und den Chemokinrezeptor CCR7.
Diese vermitteln die spezifische Migration von naiven T-Zellen durch
hochendotheliale Venolen in Lymphknoten. Deren Endothelien exprimieren
Kohlenhydratliganden, die L-Selectin binden, und haben Chemokine, die
nur in lymphatischem Gewebe vorkommen und spezifisch von CCR7 erkannt
werden.
Naive T-Zellen
haben noch keinen Kontakt mit ihrem Antigen gehabt,
d.h. es ist zu keiner Bindung mit ihren spezifischen
TC-Rezeptoren gekommen.
Naive T-Zellen exprimieren das Adhäsionsmolekül L-Selectin (CD62L) und den Chemokinrezeptor CCR7.
Diese vermitteln die spezifische Migration von naiven T-Zellen durch
hochendotheliale Venolen in Lymphknoten. Deren Endothelien exprimieren
Kohlenhydratliganden, die L-Selectin binden, und haben Chemokine, die
nur in lymphatischem Gewebe vorkommen und spezifisch von CCR7 erkannt
werden. Wenn antigenpräsentierende Zellen (mittels MHC-II-Molekülen) T-Zellen mit passenden Rezeptoren Antigene vorzeigen, treten diese in eine
Teilungssequenz ein und bilden spezifische Klone mit Effektor-
sowie Gedächtniszellen. Diese wandern dann in Gewebe aus, das mit entsprechenden Mikroben infiziert ist und sorgen für deren Abtötung.
Wenn antigenpräsentierende Zellen (mittels MHC-II-Molekülen) T-Zellen mit passenden Rezeptoren Antigene vorzeigen, treten diese in eine
Teilungssequenz ein und bilden spezifische Klone mit Effektor-
sowie Gedächtniszellen. Diese wandern dann in Gewebe aus, das mit entsprechenden Mikroben infiziert ist und sorgen für deren Abtötung. Unter lymphocyte homing
versteht man das gezielte Auswandern (Migration) zirkulierender
Lymphozyten in bestimmte Gewebe. Reguliert wird dieser Vorgang durch
selektive (gewebespezifische) Expression endothelialer Chemokine und Adhäsionsmoleküle. Zu letzteren gehören Addressine (sie gehören zur Immunglobulin-Superfamilie) - z.B. exprimieren Peyer'sche Plaques MAdCAM (mucosal addressin cell adhesion molecules) und das Chemokin CCL25, und diese binden im betreffenden Darmabschnitt an lymphozytäre Homing-Rezeptoren.
Unter lymphocyte homing
versteht man das gezielte Auswandern (Migration) zirkulierender
Lymphozyten in bestimmte Gewebe. Reguliert wird dieser Vorgang durch
selektive (gewebespezifische) Expression endothelialer Chemokine und Adhäsionsmoleküle. Zu letzteren gehören Addressine (sie gehören zur Immunglobulin-Superfamilie) - z.B. exprimieren Peyer'sche Plaques MAdCAM (mucosal addressin cell adhesion molecules) und das Chemokin CCL25, und diese binden im betreffenden Darmabschnitt an lymphozytäre Homing-Rezeptoren. 
 Abbildung: Lymphozyten-Homing in sekundären lymphatischen Organen
Abbildung: Lymphozyten-Homing in sekundären lymphatischen Organen Autotaxin (ATX) ist ein von hochendothelialen Venolen sezerniertes phospholipidproduzierendes Enzym,
das den Austritt von Lymphozyten in sekundäre lymphatische Organe
begünstigt. ICAMs (intercellular adhesion molecules) befördern diese Bindung.
Autotaxin (ATX) ist ein von hochendothelialen Venolen sezerniertes phospholipidproduzierendes Enzym,
das den Austritt von Lymphozyten in sekundäre lymphatische Organe
begünstigt. ICAMs (intercellular adhesion molecules) befördern diese Bindung.
 Selectine und
ihre Liganden werden von Leukozyten und Endothelzellen exprimiert.
Histamin- oder Thrombin-aktivierte Endothelzellen exprimieren
P-Selectin, Zytokin-aktivierte E-Selectin. Leukozyten exprimieren
L-Selectin, dieses wird für das homing naiver B- und T-Lymphozyten benötigt:
Selectine und
ihre Liganden werden von Leukozyten und Endothelzellen exprimiert.
Histamin- oder Thrombin-aktivierte Endothelzellen exprimieren
P-Selectin, Zytokin-aktivierte E-Selectin. Leukozyten exprimieren
L-Selectin, dieses wird für das homing naiver B- und T-Lymphozyten benötigt:
 Findet eine
T-Zelle 'ihr' Antigen auf antigenpräsentierenden Zellen, wird sie aktiviert und
zur 'erfahrenen' ('reifen') T-Zelle. Sie stattet sich jetzt mit
Adhäsionsmolekülen aus, die ihr vorzugsweise Zugang zum Gewebe
verschaffen, in dem sie aktiviert wurde (die Expression anderer
Adhäsionsmoleküle wird heruntergefahren).
Findet eine
T-Zelle 'ihr' Antigen auf antigenpräsentierenden Zellen, wird sie aktiviert und
zur 'erfahrenen' ('reifen') T-Zelle. Sie stattet sich jetzt mit
Adhäsionsmolekülen aus, die ihr vorzugsweise Zugang zum Gewebe
verschaffen, in dem sie aktiviert wurde (die Expression anderer
Adhäsionsmoleküle wird heruntergefahren).
 Lymphozyten entwickeln sich in generativen lymphoiden Organen (Thymus,
rotes Knochenmark) schrittweise: Bindung zu einer Zelllinie (wird aus
der Stammzelle ein B- oder T-Prolymphozyt?), Zellwachstum und -teilung
(Bildung spezialisierter Lymphozyten, angeregt durch Zytokine und
Signale von Präantigenrezeptoren)
Lymphozyten entwickeln sich in generativen lymphoiden Organen (Thymus,
rotes Knochenmark) schrittweise: Bindung zu einer Zelllinie (wird aus
der Stammzelle ein B- oder T-Prolymphozyt?), Zellwachstum und -teilung
(Bildung spezialisierter Lymphozyten, angeregt durch Zytokine und
Signale von Präantigenrezeptoren) Lymphozyten organisieren
Gensequenzen für ihre Rezeptoren (für T-Zellen im Thymus, für B-Zellen
im Knochenmark) ohne Antigenkontakt nach dem Zufallsprinzip (Repertoire
unterschiedlich antigenempfänglicher Zellen)
Lymphozyten organisieren
Gensequenzen für ihre Rezeptoren (für T-Zellen im Thymus, für B-Zellen
im Knochenmark) ohne Antigenkontakt nach dem Zufallsprinzip (Repertoire
unterschiedlich antigenempfänglicher Zellen) Lymphknoten unterstützen adaptive Immunantworten auf Antigene, die
ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden. In
den subkapsulären Sinus (reich an Makrophagen) tritt primäre Lymphe
ein. Follikuläre dendritische Zellen präsentieren Antigene an B-Zellen.
Die innere Rinde enthält T-Zellen und hochendotheliales Endothel
(T-Zellen treffen dendritische Zellen). Im inneren Sinus sammelt sich
Lymphe, die Richtung Blut abfließt
Lymphknoten unterstützen adaptive Immunantworten auf Antigene, die
ihnen aus dem Gewebe über afferente Lymphgefäße zugeführt wurden. In
den subkapsulären Sinus (reich an Makrophagen) tritt primäre Lymphe
ein. Follikuläre dendritische Zellen präsentieren Antigene an B-Zellen.
Die innere Rinde enthält T-Zellen und hochendotheliales Endothel
(T-Zellen treffen dendritische Zellen). Im inneren Sinus sammelt sich
Lymphe, die Richtung Blut abfließt Die Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und Bakterien aus dem Kreislauf, und startet adaptive
Immunantworten
Die Milz entfernt gealterte / beschädigte Blutkörperchen sowie Partikel
(Immunkomplexe) und Bakterien aus dem Kreislauf, und startet adaptive
Immunantworten Sekundäre lymphatische Organe haben Venolen mit hochendothelialen
Endothelien, über die Leukozyten - gesteuert durch Adhäsionsmoleküle
auf Leukozyten und Endothelzellen - die Blutbahn verlassen können
(Diapedese), gesteuert durch Chemokine aus dem Gewebe. Leukozyten
verlassen die Mikrozirkulation sowohl parazellulär
(Lamellopodien werden zwischen die Endothelzellen gesteckt,
interzelluläre Verbindungen aufgelöst) oder transzellulär (mittels
Podosomen). Passen
(von antigenpräsentierenden Zellen mittels MHC-II-Molekülen gezeigte)
Peptide auf die Rezeptoren entsprechender T-Zellen, teilen sich diese
und bilden Effektor- und Gedächtniszellklone
Sekundäre lymphatische Organe haben Venolen mit hochendothelialen
Endothelien, über die Leukozyten - gesteuert durch Adhäsionsmoleküle
auf Leukozyten und Endothelzellen - die Blutbahn verlassen können
(Diapedese), gesteuert durch Chemokine aus dem Gewebe. Leukozyten
verlassen die Mikrozirkulation sowohl parazellulär
(Lamellopodien werden zwischen die Endothelzellen gesteckt,
interzelluläre Verbindungen aufgelöst) oder transzellulär (mittels
Podosomen). Passen
(von antigenpräsentierenden Zellen mittels MHC-II-Molekülen gezeigte)
Peptide auf die Rezeptoren entsprechender T-Zellen, teilen sich diese
und bilden Effektor- und Gedächtniszellklone