

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

 Anämie: ἀν = ohne, αἷμα = Blut
Anämie: ἀν = ohne, αἷμα = Blut
Chlorose: χλωρός = bleich
Ferritin, Ferroportin: ferrum = Eisen, portare = tragen, bringen
Hämoglobin: αἷμα = Blut, globus = Kugel (kugelförmiges Eiweiß)
Hämosiderin: αἷμα = Blut, σίδηρος = Eisen
Hepcidin: Aus der Leber (hepar), antimikrobiell (cadere = fallen)
Hephästin: Von seinem Entdecker C.D. Vulpe nach Hephaistos (Gott der Schmiede) benannt
Sideropenie: σίδηρος = Eisen, πενία = Mangel
Transferrin: trans = hinüber, ferrum = Eisen
Eisen
ist reaktionsfreudig, bildet verschiedene Oxidationsstufen und vermittelt -
oxidativ / reduktiv - die intrazelluläre Elektronenübertragung. Zahlreiche Oxidoreduktasen nehmen Eisen für ihre Funktion zu Hilfe. Auch in Zytochromen (Atmungskette) und Schwefelkomplexen wird Eisen benötigt.
Vor allem dient Eisen in Hämoglobin
(75% des Körpereisens) und Myoglobin (5%) als Bestandteil des
Häm-Komplexes, über den Sauerstoff reversibel gebunden wird (Atemgastransport). Anämie
- reduzierte Sauerstoff-Transportfähigkeit - ist ein weltweites Problem, das meist durch
alimentären Eisenmangel (geringes Fleischangebot) bedingt ist.
Der Körper einer erwachsenen Person enthält etwa 3-4 g Eisen, kaum
mehr als 1 mg täglich muss neu zugeführt werden (Eisen ist ein
Spurenelement). Eisen wird weder von den Nieren noch vom Darm
ausgeschieden - ein Verlust nach außen findet fast ausschließlich über
Blutverlust statt. Reguliert wird die Eisenbilanz über die Aufnahme in den Körper: An der apikalen Membran der Darmschleimhautzellen sorgen Häm-Transporter für die Aufnahme, an der
basolateralen Membran Ferroportin für die Weitergabe an die Blutbahn und Hephästin
für die Oxidation von zwei- zu dreiwertigem Eisen.
Die Leber bildet Hepcidin, und zwar umso stärker, je mehr Eisen bzw. Sauerstoff im Körper zur
Verfügung steht: Es blockiert Ferroportin, auf diese Weise wird
die Eisenresorption gehemmt - der Darm nimmt nur so viel Eisen auf, wie
im Stoffwechsel benötigt wird ("Eisenbremse").
Im Kreislauf dient Transferrin
dem Eisentransport, es gibt dem Plasma seine bernsteinartige Färbung;
normalerweise ist es nur zu etwa 30% mit Eisen beladen, seine Eisenbindungskapazität ist nicht ausgeschöpft. In den Zellen wird Eisen an Transferrin angelagert gespeichert; je mehr Eisen im Körper vorhanden ist, desto mehr Transferrin ist im Blutplasma nachweisbar.
|
Eisenresorption  Kinetik des Eisens
Kinetik des Eisens  Eisenreserven im Körper
Eisenreserven im Körper  Steuerung des Eisenaustauschs
Steuerung des Eisenaustauschs
 Transferrinsättigung
Transferrinsättigung
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Der
Körper benötigt das Spurenelement Eisen als Bestandteil von Hämoglobin,
Myoglobin, Zytochromen und anderen Enzymen. Eisen wird mit der Nahrung
aufgenommen (üblicherweise ca. 1-2 mg/d) und verbleibt so lange im
Körper (ca. 3 g in Erythrozyten und 1,3 g in anderen Speichern - Leber,
Milz, rotes Knochenmark; Werte bei Frauen im Schnitt um bis zu 45%
niedriger als bei Männern), bis es ihn gelegentlich mit Blutverlusten
(Menses, Verletzungen) wieder verlässt. Verluste über Harn, Stuhl (abgeschilfertes Darmepithel, Gallenflüssigkeit),
Haare, Hautschuppen und Schweiß sind minimal. Die Regulation des Eisendepots im Körper erfolgt über die Resorption im Darm.
Gegenwärtig leiden etwa eine halbe Milliarde Menschen weltweit unter Eisenmangel.
 Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
Das Übergangsmetall Eisen wird für Sauerstofftransport und Elektronenaustausch benötigt
Wozu braucht der Organismus Eisen? Eisen ist ein "Übergangsmetall", das verschiedene Oxidationsstufen bilden kann (Fe2+ - ferrous iron - und Fe3+ - ferric iron).
Der Übergang von einer zur anderen Form erfolgt durch
Elektronentransfer - von einem Spender (Elektronendonator, diesen nennt
man Reduktionsmittel, z.B. NADH oder Fe2+) zu einem Empfänger (Elektronenakzeptor, diesen nennt man Oxidationsmittel, z.B. Fe3+). Man spricht von einer Redox-Reaktion:
Diese ist reversibel und besteht aus zwei korrespondierenden
Teilreaktionen (Oxidation und Reduktion), die über Elektronenaustausch
miteinander verknüpft sind.
Eisen
kann Elektronen rasch aufnehmen oder abgeben, in freier Form ist es
daher toxisch. Proteine mit an diese gebundenen prosthetischen Gruppen
(=katalytisch wirksame Nichtproteinkomponenten, die stark an das
Protein gebunden sind - z.B. Häm in Cytochrom c oder Hämoglobin)
"zähmen" diese
Reaktionsbereitschaft im Organismus.


 Abbildung: Regulation der Eisenresorption
Abbildung: Regulation der Eisenresorption
Nach einer Vorlage in Kumar / Abbas / Fausto / Aster,
Robbin and Cotran's Pathological Basis of Disease, 8th ed. Saunders /
Elsevier 2010
Eisen
wird von der Darmschleimhaut aus dem Chymus resorbiert (apikale
Membran, links) und von der basolateralen Membran (rechts) an den
Kreislauf abgegeben (apikale / basolaterale Membran s.
dort).
Apikale Membran (links): Hämeisen wird über einen Hämtransporter (Heme-Carrier Protein HCP-1) resorbiert und intrazellulär durch eine Hämoxygenase als Fe2+ freigesetzt. Nicht-Häm-Eisen (Fe3+)
wird für die Resorption zunächst zu Fe2+ reduziert (Ferri-Reduktase bzw. Zytochrom B) und über einen Transporter (DMT1 = divalent metal transporter) aufgenommen.
Basolaterale Membran (rechts): Ferroportin
schleust Fe2+ aus der Zelle (aktiviert durch Calciumionen), das dann durch die Ferroxidase Hephästin
zu Fe3+ oxidiert wird und in dieser Form von Transferrin im Kreislauf transportiert.
Bei normalen Eisenreserven
und intakter Blutbildung produziert die Leber Hepcidin, der
Plasma-Hepcidinspiegel ist hoch. Das führt zu Herunterregulierung von
Ferroportin,
was bewirkt, dass das resorbierte Eisen nicht über die basolaterale
Membran zum Blut weitergereicht, sondern in der Mukosa festgehalten und
über den Epithelverlust wieder entfernt wird (Mukosablock,
"Eisenbremse").
Besteht hingegen
Eisenmangel bzw. Hypoxie, stellt die Leber die Hepcidinproduktion ein,
der Hepcidinspiegel nimmt ab, die Aktivität von
Ferroportin steigt, Eisen gelangt in den Körper und wird an das rote
Knochenmark (Blutbildung!) weitergeleitet. Damit nimmt der Hämatokrit
und die Sauerstoff-Transportkapazität des Blutes zu.
Die Eisenresorption im Darm wird über die Verfügbarkeit von Sauerstoff im Gewebe gesteuert
 Zur Eisenresorption im Darm s. dort
Zur Eisenresorption im Darm s. dort

Das Transmembran-Protein Ferroportin 1 (Fpn,  Abbildung)
ist der einzige bekannte Transporter, der Eisen aus der Zelle in den
Extrazellulärraum befördert (und auch andere Spurenelemente: Zink,
Kobalt, Nickel). Ferroportin regelt nicht nur die intestinale
Eisenaufnahme, sondern auch die Abgabe von Eisen aus Makrophagen in
Leber und Milz. Ferroportin wird durch das hepatische Proteohormon Hepcidin
gesteuert, das an Ferroportin bindet und dessen Eisen-Export limitiert.
Das Wechselspiel dieser beiden Proteine ist die Grundlage des
Eisenhaushalts im Körper.
Abbildung)
ist der einzige bekannte Transporter, der Eisen aus der Zelle in den
Extrazellulärraum befördert (und auch andere Spurenelemente: Zink,
Kobalt, Nickel). Ferroportin regelt nicht nur die intestinale
Eisenaufnahme, sondern auch die Abgabe von Eisen aus Makrophagen in
Leber und Milz. Ferroportin wird durch das hepatische Proteohormon Hepcidin
gesteuert, das an Ferroportin bindet und dessen Eisen-Export limitiert.
Das Wechselspiel dieser beiden Proteine ist die Grundlage des
Eisenhaushalts im Körper.
 Zeichen der Anämie sind in Asien schon seit mindestens viertausend
Jahren bekannt. Schwerer Eisenmangel (Sideropenie
Zeichen der Anämie sind in Asien schon seit mindestens viertausend
Jahren bekannt. Schwerer Eisenmangel (Sideropenie  ) wurde seit dem Mittelalter als Chlorose
) wurde seit dem Mittelalter als Chlorose
 ("Bleichsucht") beschrieben. Der Engländer Thomas Sydenham
behandelte Anämikerinnen erstmals mit Eisensalzen und berichtete über
die Wirkung: ".. the effects of steel on chlorosis: The pulse
gains
strength and frequency, the surface warmth, the face - no longer pale
and deathlike - a fresh ruddy color..".
("Bleichsucht") beschrieben. Der Engländer Thomas Sydenham
behandelte Anämikerinnen erstmals mit Eisensalzen und berichtete über
die Wirkung: ".. the effects of steel on chlorosis: The pulse
gains
strength and frequency, the surface warmth, the face - no longer pale
and deathlike - a fresh ruddy color..".
1925 gelang der Nachweis einer Transportform von
Eisen in roten Blutkörperchen. Die Regulation des Eisenstoffwechsels
wurde erst um die Jahrtausendwende klarer, als man die Rolle des Hepcidins als Eisenhormon aufklärte.
Eisen spielt im Organismus eine doppelte Rolle:
 Sauerstofftransport
Sauerstofftransport: Fe als Anlagerungsstelle für O
2 in
in Hämoglobin und Myoglobin (1 g Hämoglobin  enthält 3,5 mg Eisen) - und damit im Zentrum des Sauerstofftransports.
enthält 3,5 mg Eisen) - und damit im Zentrum des Sauerstofftransports.
 Elektronentransport
Elektronentransport: Fe als Cofaktor für
Oxidoreduktasen und Zytochrome. Eisen-Schwefel-Komplexe sind Bestandteile von Atmungskettenkomplexen (I bis III); zahlreiche Enzyme
sind nur mit Eisen funktionsfähig. Wegen all dieser wichtigen
Eigenschaften ist Eisen unverzichtbar für Energiestoffwechsel,
Intermediärstoffwechsel, Nukleotidsynthese, Signalwege und Immunabwehr. Eisen ist Bestandteil zahlreicher
Enzyme, z.B. Cytochromen, Katalase, Guanylylcyclase etc.
Weltweit
sind fast zwei Milliarden Menschen von Eisenmangel betroffen, was
Anämie  (Blutarmut) verursacht. Dies betrifft vor allem Frauen: Der
Tagesbedarf (Männer ~1 mg/d) hängt vom Blutverlust ab (Menstruation:
30-60 ml, entspricht 15-30 mg Eisen). Schwangere vor der Niederkunft
brauchen 5 mg/d für die Blutbildung des Feten, was die maximale
Eisentransportkapazität der intestinalen Resorption meist übersteigt.
Fast jede zweite menstruierende Frau hat Eisenmangel (niedrige
Ferritinwerte
(Blutarmut) verursacht. Dies betrifft vor allem Frauen: Der
Tagesbedarf (Männer ~1 mg/d) hängt vom Blutverlust ab (Menstruation:
30-60 ml, entspricht 15-30 mg Eisen). Schwangere vor der Niederkunft
brauchen 5 mg/d für die Blutbildung des Feten, was die maximale
Eisentransportkapazität der intestinalen Resorption meist übersteigt.
Fast jede zweite menstruierende Frau hat Eisenmangel (niedrige
Ferritinwerte  ).
).
Mit der Nahrung muss, entsprechend dem
niedrigen Fe-Ausnützungsgrad, ein
Mehrfaches der vom Körper neu benötigten Menge zugeführt werden
(Eisenresorption im Darm  s. dort).
s. dort).
Kinetik des Eisens
 vgl. dort
vgl. dort
Andererseits
muss die Eisenaufnahme in den Körper auf dessen
Bedürfnisse beschränkt bleiben: Im Übermaß zugeführtes Eisen wäre
toxisch (etwa wenn große Mengen Fleisch, Leber oder Blutprodukte
aufgenommen werden), hätte der Körper nicht ein aus mehreren
Komponenten bestehendes System zur Verfügung, das die Eisenaufnahme
begrenzt (und
überschüssiges Eisen kompartmentiert bzw. über Blut- oder
Epithelverlust entfernt).

 Abbildung: Kinetik des Körpereisens: Aufnahme, Verteilung, Ausscheidung
Abbildung: Kinetik des Körpereisens: Aufnahme, Verteilung, Ausscheidung
Kombiniert nach Abbildungen in: Fleming RE, Britton RS.
Iron Imports. VI. HFE and regulation of intestinal iron absorption. Am
J Physiol 2006; 290: G590-4
1: Enterozyt (Darmmukosazelle), s.  Abbildung oben.
Abbildung oben.
2:
Transferrin bindet u.a. an Transferrinrezeptoren von Leberzellen, Eisen wird von Hepatozyten aufgenommen.
3: Leberzellen sezernieren bei hohem Eisenbestand Hepcidin...
4: ...dieses blockiert die Freisetzung weiteren (gespeicherten) Eisens aus Makrophagen und Darmschleimhautzellen an den Extrazellulärraum
5: Eisen wird im Rahmen der Abschilferung von Mukosaepithel aus
dem Körper entfernt, das ist (außer Blutverlust) der wichtigste
Fe-Entsorgungsweg

Die wichtigste Quelle im Körper umgesetzten Eisens (20-30 mg/d) sind mononukleäre Phagozyten (Makrophagen,  Abbildung), die ausgemusterte Erythrozyten aufnehmen (Milz), abbauen, das gewonnene Hämeisen
zwischenspeichern (sie sind reich an Ferritin) und - hauptsächlich zur
Neusynthese von Hämoglobin im roten Knochenmark - rezirkulieren.
Abbildung), die ausgemusterte Erythrozyten aufnehmen (Milz), abbauen, das gewonnene Hämeisen
zwischenspeichern (sie sind reich an Ferritin) und - hauptsächlich zur
Neusynthese von Hämoglobin im roten Knochenmark - rezirkulieren.
Wertigkeit des Eisens. Wie bewegt sich Eisen durch den Körper? Es wechselt mehrfach zwischen
 zweiwertiger Form (ferrous iron, Fe++ - so tritt es
durch Zellmembranen. Darmschleimhautzellen können Eisen nur in zweiwertiger Form resorbieren) und
zweiwertiger Form (ferrous iron, Fe++ - so tritt es
durch Zellmembranen. Darmschleimhautzellen können Eisen nur in zweiwertiger Form resorbieren) und
 dreiwertiger Form (ferric iron, Fe+++ - so liegt es
z.B. im Blut an Transferrin, in der Zelle an Ferritin gebunden vor).
dreiwertiger Form (ferric iron, Fe+++ - so liegt es
z.B. im Blut an Transferrin, in der Zelle an Ferritin gebunden vor).
Zum Wechsel der Wertigkeit bedarf es der Aktivität von
 Oxidasen: Ferroxidase / Coeruloplasmin (ein kupferbindendes Globulin) oxidiert Eisen: Fe2+ → Fe3+ oder
Oxidasen: Ferroxidase / Coeruloplasmin (ein kupferbindendes Globulin) oxidiert Eisen: Fe2+ → Fe3+ oder
 Reduktasen: Ferrireduktase: Fe3+ → Fe2+.
Reduktasen: Ferrireduktase: Fe3+ → Fe2+.
Üblicherweise kommt das meiste Eisen, das über den Kreislauf transportiert wird, aus dem Abbau gealterter oder defekter Erythrozyten. Vor
allem in der Milz nehmen Zellen des
mononukleären Phagozytensystems (MPS) Hämoglobin auf und zerlegen es in
seine Bestandteile; Globin einerseits (→ Aminosäuren), Häm
andererseits.
Eine Hämoxygenase setzt in den Phagozyten aus Häm Fe3+ und Kohlenmonoxid frei (etwa 1% des zirkulierenden Hämoglobins enthält Kohlenmonoxid aus dem Hämabbau); der Rest ist
Biliverdin. Innerhalb von Minuten taucht das abgespaltene Eisen an der
Makrophagen-Außenmembran auf und wird an ein Transportprotein -
Transferrin  - überreicht. Dieses transportiert das dreiwertige Eisen, das die Hämoxygenase aus Häm freigesetzt hat.
- überreicht. Dieses transportiert das dreiwertige Eisen, das die Hämoxygenase aus Häm freigesetzt hat.
Eisen ist ein essentieller Cofaktor in peritubulären
Fibroblasten der Nierenrinde, welche das systemische Sauerstoffangebot
messen. Erniedrigte Sauerstoff- oder Eisenverfügbarkeit regt die
Transkription des Erythropoetin
(Epo)-Gens an. Erreicht Epo das rote Knochenmark, regt es dort die
Hämatopoese an - Eisen wird verbraucht. Um die Eisenversorgung zu
sichern, wirken in Erythroblasten synthetisierte hypoxie-induzierte Faktoren wie Erythroferron, growth differentiation factor 15, platelet-derived growth factor u.a.

 Abbildung: Hepcidin und Regulierung der Eisenresorption
Abbildung: Hepcidin und Regulierung der Eisenresorption
Modifiziert nach Stein J, Hartmann F, Dignass AU.
Diagnosis and management of iron deficiency anemia in patients with
IBD. Nature Rev Gastroenterol Hepatol 2010; 7: 599-610
Hepcidin
bindet an Ferroportin und triggert dessen lysosomalen Abbau; dies
reduziert die Eisenabgabe von Darmschleimhautzellen und Makrophagen.
Der Hepcidinspiegel korreliert mit der Größe des Eisenspeichers im
Körper

 , das Ferroportin (Fpn)
, das Ferroportin (Fpn)  bindet und zu seiner Internalisierung
(und Inaktivierung) führt (
bindet und zu seiner Internalisierung
(und Inaktivierung) führt (  Abbildung). Reduziertes Hepcidin erhöht die
Verfügbarkeit und Aktivität von Ferroportin, Eisen wird vermehrt aus
internen Speichern (z.B. Makrophagen, die Erythrozyten abbauen) und aus
der Nahrung gewonnen (Duodenum).
Abbildung). Reduziertes Hepcidin erhöht die
Verfügbarkeit und Aktivität von Ferroportin, Eisen wird vermehrt aus
internen Speichern (z.B. Makrophagen, die Erythrozyten abbauen) und aus
der Nahrung gewonnen (Duodenum).
Zusätzlich fördern Hypoxie und Eisenmangel die intestinale
Eisenresorption: Ähnlich wie in der Niere stabilisiert Sauerstoff- oder
Eisenverfügbarkeit HIF-2α, das die Transkription von Faktoren anregt,
welche die Eisenresorption kontrollieren: Ferrireduktase (Duodenal cytochrome B, dcytb), den
apikalen divalenten Metalltransporter DMT-1 und den Eisenexporter
Ferroportin. Das aus Makrophagen und Darm gewonnene Eisen wird dann an
Transferrin (Tf) gebunden zum Knochenmark gebracht.
 Der Transport des Eisens im Blutplasma erfolgt durch Transferrin. Das eisenbeladene
Transferrin gibt dem Plasma seine gelbliche Eigenfarbe (Plasma von
Eisenmangelanämie-Patienten ist auffallend blass). Transferrin
ist ein Glykoprotein, das Eisen fest bindet und für den Eisentransport
durch Blut und Extrazellulärraum nötig ist. Obwohl transferringebundenes Eisen nur einen sehr
kleinen Teil des gesamten Körpereisens repräsentiert (~0,1%), ist es
wegen der hohen Umsatzrate (1 mg/h) enorm bedeutsam. 75% des Transferrins wird für den Eisenbedarf des
Knochenmarks (für die Blutbildung) benötigt.
Der Transport des Eisens im Blutplasma erfolgt durch Transferrin. Das eisenbeladene
Transferrin gibt dem Plasma seine gelbliche Eigenfarbe (Plasma von
Eisenmangelanämie-Patienten ist auffallend blass). Transferrin
ist ein Glykoprotein, das Eisen fest bindet und für den Eisentransport
durch Blut und Extrazellulärraum nötig ist. Obwohl transferringebundenes Eisen nur einen sehr
kleinen Teil des gesamten Körpereisens repräsentiert (~0,1%), ist es
wegen der hohen Umsatzrate (1 mg/h) enorm bedeutsam. 75% des Transferrins wird für den Eisenbedarf des
Knochenmarks (für die Blutbildung) benötigt.
 Transferrin
Transferrin (Serum)
2,0-3,6 g/l
 Transferrinsättigung
Transferrinsättigung
 Anteil des mit Eisen beladenen Transferrrins im Serum
Erwachsene >15%, Kinder >10%, Senioren >8%
Generell <50%
Anteil des mit Eisen beladenen Transferrrins im Serum
Erwachsene >15%, Kinder >10%, Senioren >8%
Generell <50%
Die Transferrinsättigung im Blutplasma beträgt physiologischerweise unter 50%
|
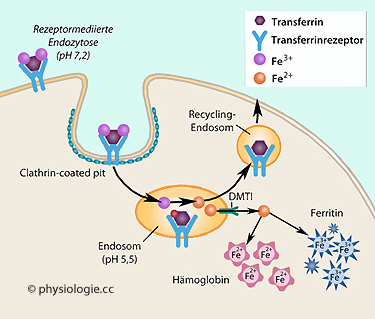
 Abbildung: Transferrinrezeptor und Eisenresorption
Abbildung: Transferrinrezeptor und Eisenresorption
Nach einer Vorlage bei nexcelom.co.uk
Die
Resorption von transferringebundenem dreiwertigem Eisen aus der
extrazellulären Flüssigkeit erfolgt mittels Endozytose über den
Clathrin-Mechanismus. Das Transferrinmolekül wird an die Zelloberfläche recycelt.
Die Abkopplung des Eisens erfolgt in saurem
Milieu in Endosomen, das Eisen wird zweiwertig und kann z.B. in
Hämoglobin oder Ferritin eingelagert werden
DMT1 = divalent metal transporter 1

Transferrinrezeptor: Die Aufnahme des
eisenbeladenen Transferrins in eine Zelle erfolgt über Transferrinrezeptor-mediierte Endozytose. Der Transferrinrezeptor 1 - TfR1 - findet sich an fast allen Zellen des Körpers, insbesondere an Erythroblasten).
Bei dem leicht
basischen pH-Wert der extrazellulären Flüssigkeit bindet Transferrin
mit hoher Affinität an den Transferrinrezeptor - gefolgt von Endozytose
mittels clathrinbedeckter Vesikel. Durch den niedrigen pH-Wert (~5,5)
in den Vesikeln wird Eisen
vom Transferrin entkoppelt, über DMT-1 (Divalent metal transporter 1) reduziert und kann in der Zelle an Ferritin angelagert gespeichert werden ( Abbildung).
Abbildung).
So kann Eisen in das Zytoplasma aufgenommen
werden und ist damit Bestandteil des zytoplasmatischen labilen Eisenpools.
Aus diesem Vorrat wird Eisen für die Synthese von Zytochromen,
Eisen-Schwefel-Clusterproteinen und Mitochondrien (Hämsynthese!)
verbraucht.
Das nach Entkopplung des Eisens übriggebliebene Apotransferrin
bleibt fest an den Rezeptor gebunden, der Komplex wandert zur
Zellmembran zurück (Recycling-Endosom,  Abbildung), wo das
Apotransferrin - bedingt durch den höheren extrazellulären pH-Wert, dem
es nun wieder ausgesetzt ist - vom Rezeptor freigesetzt wird und für den Eisentransport im Kreislauf erneut zur Verfügung steht.
Abbildung), wo das
Apotransferrin - bedingt durch den höheren extrazellulären pH-Wert, dem
es nun wieder ausgesetzt ist - vom Rezeptor freigesetzt wird und für den Eisentransport im Kreislauf erneut zur Verfügung steht.
Bleibt Eisen ungebraucht, wird es in Ferritin gespeichert und kann von
da aus wiederverwendet werden (oder es wird via Desquamation entfernt).
 Umsatz. Der Eisenaustausch im
Körper übertrifft Aufnahme und Verlust (1-2 mg/d) um ein Vielfaches (
Umsatz. Der Eisenaustausch im
Körper übertrifft Aufnahme und Verlust (1-2 mg/d) um ein Vielfaches (  Abbildung):
Der Eisenpool im
Blutplasma (transferringebunden) einer
erwachsenen Person beträgt 3-4 mg, der tägliche
Eisenumsatz über den Kreislauf ist zehnmal so groß (30-40
mg/d). Der Großteil davon (~80%) entfällt auf die Blutbildung (frisch
gebildete Erythrozyten verbleiben für vier Monate im Kreislauf).
Abbildung):
Der Eisenpool im
Blutplasma (transferringebunden) einer
erwachsenen Person beträgt 3-4 mg, der tägliche
Eisenumsatz über den Kreislauf ist zehnmal so groß (30-40
mg/d). Der Großteil davon (~80%) entfällt auf die Blutbildung (frisch
gebildete Erythrozyten verbleiben für vier Monate im Kreislauf).
Werden die Erythrozyten anschließend abgebaut, gelangt das Eisen in das
retikuloendotheliale System (Phagozyten), das es an den Plasmapool
retourniert (~25 mg/d) - teils unmittelbar, teils verzögert über
vorübergehende Bindung an intrazelluläre Ferritinspeicher. Daneben
werden 5-6 mg/d an Parenchymzellen (vor allem in der Leber)
weitergegeben und gelangen über die interstitielle Flüssigkeit wieder
zum Plasmapool zurück.

 Abbildung: Umsatz von Eisen im Körper einer erwachsenen Person
Nach einer Vorlage in DeJong Gl, van Dijk JP, van Eijk HG, The biology of transferrin. Clin Chem Acta 1990; 190: 1-46
Abbildung: Umsatz von Eisen im Körper einer erwachsenen Person
Nach einer Vorlage in DeJong Gl, van Dijk JP, van Eijk HG, The biology of transferrin. Clin Chem Acta 1990; 190: 1-46
Der
Eisenpool im Blutplasma (an Transferrin gebunden: 3-4 mg) tauscht sich
mit den Körperreserven mehrmals täglich aus (insgesamt ~50 mg/d). Der
Körper speichert physiologischerweise mehrere tausend Milligramm Eisen
(bis ~5 Gramm).
Der Großteil des für die rote
Blutbildung benötigten Eisens stammt aus Makrophagen, die pro Tag 20-25
mg Eisen rezirkulieren, das aus dem Erythrozytenabbau gewonnen wurde.
Blaue Zahlen Speicher (hier zusammen ~3,8 g), rote Zahlen Umsatzwerte

Ohne Blutverlust geht dem Körper pro Tag ca. 1 mg Eisen verloren. Dieser Eisen-Output ist nicht reguliert, sondern ergibt sich aus der Summe der Faktoren abgeschilferte Darmschleimhaut, Hautschuppen, Haare und Nägel,
Schweiß, Galle und Harn.
Der Eisenspeicher im Körper einer erwachsenen Person beträgt normalerweise 3-5 Gramm (Männer 40-60 mg/kg, Frauen 30-45 mg/kg Körpergewicht):

Eisenspeicher
(mg/kg KG, gerundete Mittelwerte)

Nach Goodman & Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw Hill Education 2014

|
|
Männer
|
Frauen
|
Hämoglobin
|
31
|
28
|
Myoglobin, Enzyme
|
6
|
5
|
Speichereisen
|
13
|
4
|
Gesamt
|
50
|
37
|
Eisenspeicher
im Organismus sind vor allem die Leber, Milz, das Knochenmark sowie
Epithelzellen im Gastrointestinaltrakt. Im Darm wird - falls nötig - Fe+++ (Nicht-Häm-Eisen) zu Fe++
reduziert, in dieser Form resorbiert (apikal), mittels Ferroportin
durch die Mucosazelle transportiert und (basolateral) via Ferroportin
aus der Zelle geschleust und (extrazellulär) über Hephästin wieder zu Fe+++ oxidiert. Dann wird Fe+++ im Blut an Transferrin gebunden transportiert (Abbildung oben). In Körperzellen wird es an Apoferritin gebunden gespeichert (Ferritinspeicher).
Wie verlässt Eisen den Körper? Bleiben
Blutverluste aus (Blutungen nach außen, Blutspenden), verliert eine
erwachsene Person nur ~1 mg Eisen pro Tag - oder ~10% des im Körper
gespeicherten Eisens pro Jahr, vor allem (~70%) mit dem Stuhl, als in
den Darm ausgetretene Erythrozyten, Eisen in Gallenflüssigkeit und in
abgeschilferten Mukosazellen. Die restlichen ~30% verlassen den Körper
mit abgeschilferten Hautzellen und mit dem Harn.
Eisen im Körper
(gerundete Mittelwerte, Männer, 70 kg KG)

Nach Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
|
Protein
|
Gewebe
|
Eisengehalt (mg)
|
Hämoglobin
|
Erythrozyten |
2600
|
Myoglobin
|
Muskel
|
400
|
Enzyme
|
Leber und andere Gewebe
|
25
|
Transferrin
|
Plasma, extrazelluläre Flüssigkeiten |
8
|
Ferritin und Hämosiderin
|
Leber
Milz
Knochenmark |
410
48
300
|

Der größte Teil des Körpereisens (~70%, oder 2000 bis 4000 mg) befindet sich im Hämoglobin der
Erythrozyten;
ein Liter Vollblut (Hkt ~ 0,4) enthält ~500 mg Eisen (ein Liter
Erythrozytenkonzentrat mindestens 1 Gramm). Bei einem Blutvolumen von 5 Litern
ergibt sich (bei normalem roten Blutbild) z.B. 2-3 g "Bluteisen". Weiters findet sich Eisen im Häm des
Myoglobins der
Muskulatur (~10%, oder ~300 mg). Hämeisen dient dem
Sauerstofftransport.

Etwa 1/3 des Gesamtspeichers (1000 - 1500 mg) verteilt sich auf
Leber (~1000 mg), das
Monozyten-Makrophagen-System und das
Knochenmark. Mehr als die Hälfte dieses Anteils (~60%) gilt als Speichereisen
(storage iron), der Rest (~40%) als Funktionseisen
(essential iron).

Nur etwa 3 mg (0,1% des gesamten Eisenspeichers) zirkulieren an
Transferrin gebunden in der Blutbahn.
In diesen Zellen wird Eisen in Ferritin und Hämosiderin  gespeichert:
gespeichert:
 Ferritin
Ferritin
ist
ein aus 24 identischen Polypeptid-Untereinheiten bestehender
wasserlöslicher Molekülkomplex. Es stellt einen rasch mobilisierbaren
Speicher dar und hat
einen Eisenanteil (Fe
3+)
von 20-25 Gewichts-% (jeder Ferritinkomplex kann bis zu 4500 Eisenionen
einlagern). Ferritin findet sich in so gut wie allen Zellen,
insbesondere in Darmschleimhaut, Phagozyten, Leberzellen und rotem
Knochenmark. Eisenfreies
Apoferritin nimmt Eisen in zweiwertiger Form auf, oxidiert (zu Fe
3+) und speichert es in dreiwertiger Form - aus der das Eisen leicht mobilisiert und genutzt werden kann. Die biologische
Halbwertszeit eisenbeladenen Ferritins beträgt nur
wenige Tage.
Ein wenig Ferritin gelangt laufend ins Blut - hauptsächlich aus Makrophagen -, seine Konzentration im
Blutplasma
korreliert mit dem Eisenvorrat im Körper (besser als der Plasma-Eisenspiegel):
1 µg/l
Serumferritin entspricht bei einer gesunden erwachsenen Person ~10 mg Speichereisen.

Um Eisen aus Ferritin wieder freizusetzen, muss es aus der dreiwertigen (Fe
+++) in die zweiwertige Form (Fe
++)
übergeführt (reduziert) werden. Ferritingebundenes Eisen im Blutplasma
steht in einem Äquilibrium mit den zellulären Eisenspeichern in den
Geweben.
 Ferritin
Ferritin (Serum, Plasma)
Frauen (>16a) 15-150 ng/ml, Männer (>16a) 30-400 ng/ml
Werte unter 20 ng/ml signalisieren moderate, unter 10 ng/ml schwere Anämie
Kinder: bis 30 Tage 150-450, bis 90 Tage 80-500, bis 16 Jahre 20-200 ng/ml
Halbwertszeit ~10 Minuten

Bei
Eisen-Überangebot wird immer mehr Ferritin gebildet (um das toxische
Eisen zu binden), das dann zum Teil lysosomal zu
Hämosiderin mutiert. Dies ist eine partiell abgebaute Form von Ferritin
;
hier liegen die eisenhältigen Kerngebiete mehrerer Ferritinmoleküle in
aggregierter Form vor, ein Teil der Proteinhülle der Ferritinkomplexe
fehlt bereits. Hämosiderin enthält 30-35 Gewichts-% Eisen (Ferritin 20-25%), es ist
kaum (und wenn, dann unkontrolliert) mobilisierbar.
Hämosiderose ist ein Begriff der Pathologie (zelluläre Eisenüberladung). Bei
Eisenspeichererkrankungen kann die im Körper vorhandene Menge bis ~40 g Fe betragen (Normalwert 3-4 g), bevor klinisch auffällige Symptome auftreten
(Hämochromatose: Schäden an Leber, Herzmuskel, Pankreas u.a.).
Regulation des Eisenstoffwechsels
Hepatische Regulation der Eisenresorption durch Hepcidin. Der Eisenhaushalt wird im Wesentlichen nur über die Aufnahme (intestinale Resorption) geregelt; die Abgabe erfolgt überwiegend über Blutverlust (Menstruation, Verletzungen) und damit ohne spezifische Steuerung.
Das Proteohormon Hepcidin wird in der Leber gebildet, sobald im Körper kein Bedarf an
"frischem" Eisen besteht (gute
Eisenversorgung, ausreichender Sauerstofftransport). Hepcidin blockiert Ferroportin an Enterozyten und Makrophagen, und damit den Austritt von Eisen in die Zirkulation ("Mukosablock").
Auf diese Weise wird die Menge an Eisen reguliert, die aus zellulären Speichern den
Extrazellulärraum betritt:
 Steigender Eisenspiegel stimuliert die Bildung von Hepcidin (weniger Fe betritt die extrazelluläre
Flüssigkeit - negative Rückkopplung) - Hepcidin fungiert als "Eisenbremse".
Steigender Eisenspiegel stimuliert die Bildung von Hepcidin (weniger Fe betritt die extrazelluläre
Flüssigkeit - negative Rückkopplung) - Hepcidin fungiert als "Eisenbremse".
 Umgekehrt hemmen Eisenmangel, Hypoxie und Anämie
die
Hepcidinbildung (Lösung der "Eisenbremse", verbesserte
Eisenverfügbarkeit). Die Hemmung der Hepcidinsynthese erfolgt unter
Beteiligung einer Serinprotease (Matriptase 2); Mutation des
Matriptase-Gens enthemmt die Hepcidinbildung und führt zu schwerer
Eisenmangelanämie, die resistent auf orale Eisengabe ist (IRIDA-Anämie:
Iron therapy refractory iron deficiency anemia).
Umgekehrt hemmen Eisenmangel, Hypoxie und Anämie
die
Hepcidinbildung (Lösung der "Eisenbremse", verbesserte
Eisenverfügbarkeit). Die Hemmung der Hepcidinsynthese erfolgt unter
Beteiligung einer Serinprotease (Matriptase 2); Mutation des
Matriptase-Gens enthemmt die Hepcidinbildung und führt zu schwerer
Eisenmangelanämie, die resistent auf orale Eisengabe ist (IRIDA-Anämie:
Iron therapy refractory iron deficiency anemia).

 Viel Eisen → Hepcidin↑→ Ferroportin↓→ Eisenresorption↓
Viel Eisen → Hepcidin↑→ Ferroportin↓→ Eisenresorption↓
 Wenig Eisen → Hepcidin↓→ Ferroportin↑→ Eisenresorption↑
Wenig Eisen → Hepcidin↓→ Ferroportin↑→ Eisenresorption↑
Auf Eisenmangel reagiert die Leber außerdem mit erhöhter Produktion von Transferrin,
was die Eisen-Transportkapazität im Blut steigert - sowohl die totale
als auch die latente Eisenbindungskapazität (EBK) nehmen zu, der
Sättigungsgrad transferringebundenen Eisens sinkt ( s. dort). Umgekehrt führt erhöhtes Eisenangebot zur Reduktion der Transferrinbildung, totale und latente EBK nehmen ab.
s. dort). Umgekehrt führt erhöhtes Eisenangebot zur Reduktion der Transferrinbildung, totale und latente EBK nehmen ab.
Die
Genexpression von Hepcidin wird auch durch Faktoren reguliert, die
nicht eisenabhängig sind, z.B. Interleukin 6 (Entzündungsvorgänge).

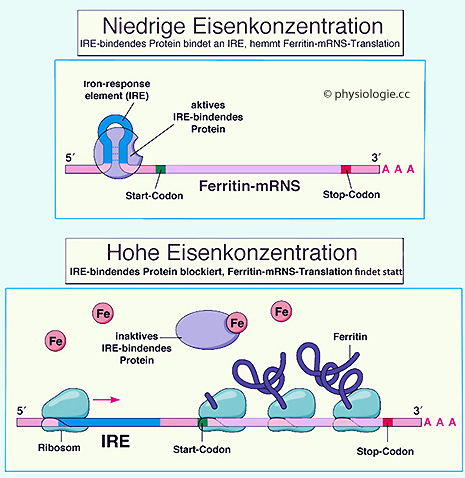
 Abbildung: Der intrazelluläre Eisenspiegel steuert die Ferritin-Expression
Abbildung: Der intrazelluläre Eisenspiegel steuert die Ferritin-Expression
Nach einer Vorlage bei Pearson Education 2012
Die
Regulierung erfolgt über Interaktion eines eisenregulierenden Proteins
(IRP) und einer Sequenz (IRE) der Ferritin-mRNS.
Bei ausreichendem Fe-Spiegel verhindert die Bindung von Eisen
an das regulierende Protein dessen Bindung an IRE (unten), es wird Ferritin gebildet.
Bei Eisenmangel hingegen findet
die Bindung des Proteins an IRE statt, wobei die RNS eine Schleife
bildet (oben), die Ablesung des Ferritin-Codes - und damit die Ferritinsynthese - ist
blockiert

Regulation auf der Ebene eisenspeichernder Zellen.
Zellen können ihre Eisen-Einlagerung und Speicherkapazität entsprechend
der aktuellen Eisenverfügbarkeit auf der Ebene von RNS-Transkripten für
Apoferritin ( Abbildung) und Transferrinrezeptoren (Endozytose)
feinregulieren.
Abbildung) und Transferrinrezeptoren (Endozytose)
feinregulieren.
Das Eisenangebot reguliert posttranskriptionell die Synthese von Apoferritin und Transferrinrezeptoren:
Eisenregulierende Proteine (iron-responsive element-binding proteins IRP1 und IRP2) im Zytoplasma binden bei niedrigem Eisenspiegel eisenregulierende Elemente (iron-responsive elements, IREs) in der mRNS, die den Bauplan für Apoferritin und Transferrinrezeptoren enthält.
Diese Bindung führt einerseits zu verringerter Bildung (Translation) von Apoferritin, andererseits zu Stabilisierung des Transferrinrezeptor-Transkripts und damit verstärkter Transferrinrezeptor-Produktion.
Damit senkt die Zelle die zytoplasmatische Eisenfixierung (Ferritin↓)
und bereitet sich auf verstärkte Aufnahme vor (Transferrinrezeptor↑).
Befindet sich umgekehrt viel Eisen in der Zelle, dann synthetisiert
diese mehr Apoferritin (Eisenspeichermoleküle) und senkt die Bildung
von Transferrinrezeptoren (Schutz vor Eisenüberlastung).
Regulation verfügbaren extrazellulären Eisens:
Täglich werden im Darm ≥1-2 mg Eisen aus dem Chymus aufgenommen (maximale Aufnahme ca. 5 mg/d) - freies Eisen über den DMT-1-Transporter, und Hämeisen über HCP-1 ( s. dort). In der Darmschleimhaut legt der Körper eine transiente Eisenreserve an, Steuersubstanzen beeinflussen die Eisenfreisetzung:
s. dort). In der Darmschleimhaut legt der Körper eine transiente Eisenreserve an, Steuersubstanzen beeinflussen die Eisenfreisetzung:
 Die Ferri-Reduktase DMT1 (Divalent metal transporter) am Bürstensaum der Enterozyten reduziert in der Nahrung vorhandenes dreiwertiges Nonhäm-Eisen zu Fe2+, damit es resorbiert werden kann. Mit zunehmendem Eisenspeicher im Körper nimmt ihre Expression ab - das heißt, je besser der Körper mit Eisen versorgt ist, desto weniger Eisen kann im Darm aufgenommen werden.
Die Ferri-Reduktase DMT1 (Divalent metal transporter) am Bürstensaum der Enterozyten reduziert in der Nahrung vorhandenes dreiwertiges Nonhäm-Eisen zu Fe2+, damit es resorbiert werden kann. Mit zunehmendem Eisenspeicher im Körper nimmt ihre Expression ab - das heißt, je besser der Körper mit Eisen versorgt ist, desto weniger Eisen kann im Darm aufgenommen werden.
 Das in die Enterozyten aufgenommene Eisen
Das in die Enterozyten aufgenommene Eisen
 speist als labiler Eisenpool den (hauptsächlich mitochondrialen) Stoffwechsel. Es kann weiters als "eiserne Reserve" an Ferritin gebunden verbleiben. Sollte der Eisenbedarf des
Organismus plötzlich steigen, kann das Eisen von hier mobilisiert und
dem Körper zur Verfügung gestellt werden; wenn nicht, geht es innerhalb
weniger Tage mit den Mukosazellen über den Stuhl verloren: Schleimhaut-Desquamation.
speist als labiler Eisenpool den (hauptsächlich mitochondrialen) Stoffwechsel. Es kann weiters als "eiserne Reserve" an Ferritin gebunden verbleiben. Sollte der Eisenbedarf des
Organismus plötzlich steigen, kann das Eisen von hier mobilisiert und
dem Körper zur Verfügung gestellt werden; wenn nicht, geht es innerhalb
weniger Tage mit den Mukosazellen über den Stuhl verloren: Schleimhaut-Desquamation.
 Wird Eisen vom Körper benötigt
Wird Eisen vom Körper benötigt, wird es von den Enterozyten basolateral als Fe
2+ über
Ferroportin in den Kreislauf freigesetzt. Die unmittelbar neben Ferroportin lokalisierte Ferroxidase, welche das Eisen wieder zu Fe
3+ oxidiert, heisst
Hephästin 
(
 Abbildung
Abbildung). Außerdem kann Eisen im Blut durch
Coeruloplasmin oxidiert werden - es wirkt ebenfalls als Ferroxidase. Anschließend kann Fe
3+ an
Transferrin abgegeben und im Blut weitertransportiert werden.


 Abbildung: Eisenstoffwechsel: Makrophage
Nach Evstatiev R & Gasche C, Iron sensing and signalling. Gut 2012; 61: 933-52
Abbildung: Eisenstoffwechsel: Makrophage
Nach Evstatiev R & Gasche C, Iron sensing and signalling. Gut 2012; 61: 933-52
Makrophagen
beteiligen sich besonders emsig an der "Verwaltung" des Eisenpools im
Körper: Einerseits als Eisenspeicher, andererseits indem sie Zytokine
bilden, die wiederum die Einlagerung von Eisen im
retikulo-endothelialen System anregen
Apo-Tf, Apo-Transferrin

CD163, ein
Scavenger-Rezeptor für den Hämoglobin-Haptoglobin-Komplex auf Monozyten / Makrophagen

DcytB, duodenales Cytochrom B beschleunigt die Reduktion von Eisen

DMT-1,
Divalent metal transporter befördert zweiwertiges Eisen in Darmzelle

HCP-1,
Haem carrier protein 1 ist ein Häm-Rezeptor an der luminalen Oberfläche der Enterozyten, über den Hämeisen aufgenommen werden kann

HO-1, Hämoxygenase ist ein mikrosomales Enzym, das Eisen oxydiert

ISC,
Iron-sulfur cluster, Eisen-Schwefel-Komplexe, die enzymatisch aktiv sind
 Nramp-1
Nramp-1,
Natural resistance-associated macrophage protein 1, ein eisentrasportierendes Protein

Steap3, eine Metalloreduktase, reduziert Fe
3+ zu Fe
2+ 
Tf,
Transferrin  TfR1, Transferrinrezeptor 1
TfR1, Transferrinrezeptor 1

Über diese Mechanismen erfolgt die
Regulation des Körpereisens, das im Wesentlichen nur durch Blutverlust
(plus ein wenig - ca. 1 mg/d - über Zellen, Körpersäfte etc) verringert
werden kann. Wahrscheinlich spielt auch eine Regulation der
Eryrthropoese (Signalmoleküle aus dem Knochenmark?) sowie der
Eisenaufnahme in Kryptenzellen des Darms eine regulative Rolle.
Makrophagen
phagozytieren gealterte Erythrozyten und setzen Eisen in regulierter
Weise an den Extrazellulärraum frei (  Abbildung). Hämgebundenes Eisen wird über
Hämoxygenase freigesetzt. Der Großteil des Plasma-Ferritins stammt aus Makrophagen.
Abbildung). Hämgebundenes Eisen wird über
Hämoxygenase freigesetzt. Der Großteil des Plasma-Ferritins stammt aus Makrophagen.
 Zu Makrophagen s. dort
Zu Makrophagen s. dort
Erythroblasten ( Abbildung) sind die hauptsächlichen Eisenkonsumenten im Körper. Sie nehmen Eisen über den Transferrinrezeptor 1
auf; jeder
Erythroblast verfügt über einige 105 Transferrinrezeptoren. Die Aufgabe der Eythroblasten ist die Bildung roter Blutkörperchen (Erythropoese).
Abbildung) sind die hauptsächlichen Eisenkonsumenten im Körper. Sie nehmen Eisen über den Transferrinrezeptor 1
auf; jeder
Erythroblast verfügt über einige 105 Transferrinrezeptoren. Die Aufgabe der Eythroblasten ist die Bildung roter Blutkörperchen (Erythropoese).
 Zur Hämatopoese s. dort
Zur Hämatopoese s. dort

 Abbildung: Eisenstoffwechsel: Erythroblast
Abbildung: Eisenstoffwechsel: Erythroblast
Nach Evstatiev R & Gasche C, Iron sensing and signalling. Gut 2012; 61: 933-52
Ist die Verwertung von Eisen gestört, können sich Erythroblasten zu "Eisenfallen" entwickeln und heißen
Sideroblasten.
Apo-Tf, Apo-Transferrin

CD163, ein Scavenger-Rezeptor für den Hämoglobin-Haptoglobin-Komplex auf Monozyten / Makrophagen

DcytB,
duodenales
Cytochrom
B beschleunigt die Reduktion von Eisen

DMT-1,
Divalent metal transporter befördert zweiwertiges Eisen in Darmzellen

FLVCR, ein Transporterprotein

HCP-1,
Haem carrier protein 1 ist ein Häm-Rezeptor an der luminalen Oberfläche der Enterozyten, über den Hämeisen aufgenommen werden kann

HO-1, Hämoxygenase ist ein mikrosomales Enzym, das Eisen oxydiert

ISC,
Iron-sulfur cluster, Eisen-Schwefel-Komplexe, die enzymatisch aktiv sind
 Nramp-1
Nramp-1,
Natural resistance-associated macrophage protein 1, ein eisentrasportierendes Protein

Steap3, eine Metalloreduktase, reduziert Fe
3+ zu Fe
2+  Tf
Tf,
Transferrin  TfR1, Transferrinrezeptor 1
TfR1, Transferrinrezeptor 1
 Eisen-3 wird durch das
Enzym Staep3 reduziert und über DMT-1 ins Zytosol exportiert
(Transferrin und sein Rezeptor werden in die Zellmembran recycelt).
Eisen-3 wird durch das
Enzym Staep3 reduziert und über DMT-1 ins Zytosol exportiert
(Transferrin und sein Rezeptor werden in die Zellmembran recycelt).
Überschusseisen wird über den Transporter FLVCR (nach Feline leukemia virus subgroup C receptor-related protein - ein Membranprotein, das zur Major-Facilitator-Superfamilie
- der größten Gruppe von Transportereiweißen - gehört) ausgeschleust
oder durch Hämoxygenase abgebaut ( Abbildung).
Abbildung).
 Zu Eisen und Schwangerschaft s. dort
Zu Eisen und Schwangerschaft s. dort

Eisenmangel
wirkt sich auf die Blutbildung aus. Eisenmangelanämie gehört weltweit
zu den häufigsten Erkrankungen. Über Zusammenhänge mit dem Blutbild  s. dort.
s. dort.
Anämien können verschiedene Ursachen haben. Im
physiologischen Sinn ist das gemeinsame Kennzeichen aller Anämien eine
herabgesetzte Transportkapazität für Sauerstoff
im Blut. Diese beträgt normalerweise ~20 Vol-%, was bedeutet, dass 100
ml Blut 20 ml Sauerstoff binden können (15 g Hämoglobin pro 100 ml
Blut; 1 Gramm Hb kann 1,34 ml O2 aufnehmen, 15 x 1,34 = 20).


 Eisen nimmt Elektronen auf oder
gibt sie ab (Fe2+ / Fe3+),
es übernimmt Elektronentransport als Cofaktor für Oxidoreduktasen und
Zytochrome. Eisen tritt in zweiwertiger Form durch Zellmembranen;
gebunden an Ferritin (Zelle) oder Transferrin (Blut) ist es dreiwertig.
Oxidasen (Ferroxidase, Coeruloplasmin) oxidieren Eisen (Fe2+ → Fe3+), Reduktasen (Ferrireduktase) reduzieren es (Fe3+ → Fe2+) Eisen nimmt Elektronen auf oder
gibt sie ab (Fe2+ / Fe3+),
es übernimmt Elektronentransport als Cofaktor für Oxidoreduktasen und
Zytochrome. Eisen tritt in zweiwertiger Form durch Zellmembranen;
gebunden an Ferritin (Zelle) oder Transferrin (Blut) ist es dreiwertig.
Oxidasen (Ferroxidase, Coeruloplasmin) oxidieren Eisen (Fe2+ → Fe3+), Reduktasen (Ferrireduktase) reduzieren es (Fe3+ → Fe2+)
 Eisen-Schwefel-Komplexe sind Bestandteile von
Atmungskettenkomplexen; zahlreiche Enzyme sind nur mit Eisen
funktionsfähig (Energiestoffwechsel, Intermediärstoffwechsel,
Nukleotidsynthese, Signalwege, Immunabwehr) Eisen-Schwefel-Komplexe sind Bestandteile von
Atmungskettenkomplexen; zahlreiche Enzyme sind nur mit Eisen
funktionsfähig (Energiestoffwechsel, Intermediärstoffwechsel,
Nukleotidsynthese, Signalwege, Immunabwehr)
 Eisenresorption: Über die apikale Enterozytenmembran wird Hämeisen über
einen
Hämtransporter (HCP-1) aufgenommen und intrazellulär als Fe2+ freigesetzt. Nicht-Häm-Eisen (Fe3+) wird zu Fe2+ reduziert und über einen Transporter (DMT1) aufgenommen. An der basolateralen Membran gelangt Fe2+ über Ferroportin aus der Zelle, wird durch die Ferroxidase Hephästin zu Fe3+ oxidiert und an Transferrin im Blut weitergereicht. Mit der Nahrung
muss, entsprechend dem niedrigen Fe-Ausnützungsgrad, ein Mehrfaches der
vom Körper neu benötigten Menge zugeführt werden Eisenresorption: Über die apikale Enterozytenmembran wird Hämeisen über
einen
Hämtransporter (HCP-1) aufgenommen und intrazellulär als Fe2+ freigesetzt. Nicht-Häm-Eisen (Fe3+) wird zu Fe2+ reduziert und über einen Transporter (DMT1) aufgenommen. An der basolateralen Membran gelangt Fe2+ über Ferroportin aus der Zelle, wird durch die Ferroxidase Hephästin zu Fe3+ oxidiert und an Transferrin im Blut weitergereicht. Mit der Nahrung
muss, entsprechend dem niedrigen Fe-Ausnützungsgrad, ein Mehrfaches der
vom Körper neu benötigten Menge zugeführt werden
 Der Eisenspeicher im Körper einer erwachsenen Person beträgt
normalerweise 3-5 Gramm (Männer 40-60 mg/kg, Frauen 30-45 mg/kg).
Ohne Blutverlust geht dem Körper pro Tag ca. 1 mg Eisen verloren: Dieser unregulierte Verlust ergibt sich aus abgeschilferter
Darmschleimhaut, Galle (Stuhl ~70%), Hautschuppen, Haaren, Nägeln, Harn, Schweiß. Darüber
hinausgehender Bedarf hängt vom
Blutverlust ab (Menstruation: 30-60 ml, entspricht 15-30 mg Eisen).
Schwangere
vor der Niederkunft brauchen 5 mg/d für den Feten. Der größte Teil des
Körpereisens (~70%) befindet sich im Hämoglobin der Erythrozyten.
Eisenmangel bewirkt Anämie (Blutarmut) Der Eisenspeicher im Körper einer erwachsenen Person beträgt
normalerweise 3-5 Gramm (Männer 40-60 mg/kg, Frauen 30-45 mg/kg).
Ohne Blutverlust geht dem Körper pro Tag ca. 1 mg Eisen verloren: Dieser unregulierte Verlust ergibt sich aus abgeschilferter
Darmschleimhaut, Galle (Stuhl ~70%), Hautschuppen, Haaren, Nägeln, Harn, Schweiß. Darüber
hinausgehender Bedarf hängt vom
Blutverlust ab (Menstruation: 30-60 ml, entspricht 15-30 mg Eisen).
Schwangere
vor der Niederkunft brauchen 5 mg/d für den Feten. Der größte Teil des
Körpereisens (~70%) befindet sich im Hämoglobin der Erythrozyten.
Eisenmangel bewirkt Anämie (Blutarmut)
 Bei normalen Eisenreserven und intakter Blutbildung produziert die
Leber Hepcidin. Hohe Plasma-Hepcidinspiegel reduzieren die Aktivität
von Ferroportin, resorbiertes Eisen gelangt nicht weiter in das Blut -
es bleibt in der Mukosa und wird über die Abschilferung des Epithels
wieder entfernt (Mukosablock, "Eisenbremse"). Hypoxie oder Eisenmangel
hingegen blockiert die Produktion von Hepcidin, die Aktivität von
Ferroportin steigt, Eisen gelangt in das rote
Knochenmark. Blutbildung, Hämatokrit und Sauerstoff-Transportkapazität
nehmen zu Bei normalen Eisenreserven und intakter Blutbildung produziert die
Leber Hepcidin. Hohe Plasma-Hepcidinspiegel reduzieren die Aktivität
von Ferroportin, resorbiertes Eisen gelangt nicht weiter in das Blut -
es bleibt in der Mukosa und wird über die Abschilferung des Epithels
wieder entfernt (Mukosablock, "Eisenbremse"). Hypoxie oder Eisenmangel
hingegen blockiert die Produktion von Hepcidin, die Aktivität von
Ferroportin steigt, Eisen gelangt in das rote
Knochenmark. Blutbildung, Hämatokrit und Sauerstoff-Transportkapazität
nehmen zu
 Beim Abbau gealterter Erythrozyten (Milz) bauen Phagozyten Hämoglobin
zu Aminosäuren und Häm ab, das eine Hämoxygenase in Fe3+
und Biliverdin verwandelt. Peritubuläre Fibroblasten der Nierenrinde
bilden bei reduzierter Sauerstoff- oder Eisenverfügbarkeit
Erythropoetin, dieses regt die Hämatopoese an. Hypoxie und Eisenmangel
fördern die Eisenresorption im Darm
Beim Abbau gealterter Erythrozyten (Milz) bauen Phagozyten Hämoglobin
zu Aminosäuren und Häm ab, das eine Hämoxygenase in Fe3+
und Biliverdin verwandelt. Peritubuläre Fibroblasten der Nierenrinde
bilden bei reduzierter Sauerstoff- oder Eisenverfügbarkeit
Erythropoetin, dieses regt die Hämatopoese an. Hypoxie und Eisenmangel
fördern die Eisenresorption im Darm
 Ferritin ist wasserlöslich, rasch mobilisierbar (Darmschleimhaut,
Phagozyten, Leberzellen, rotes Knochenmark) und hat einen Eisenanteil
von 20-25 Gewichts-% (bis zu 4500 Eisenionen pro Ferritinmolekül). 1
µg/l Serumferritin entspricht bei einer gesunden Person ~10 mg
Speichereisen
Ferritin ist wasserlöslich, rasch mobilisierbar (Darmschleimhaut,
Phagozyten, Leberzellen, rotes Knochenmark) und hat einen Eisenanteil
von 20-25 Gewichts-% (bis zu 4500 Eisenionen pro Ferritinmolekül). 1
µg/l Serumferritin entspricht bei einer gesunden Person ~10 mg
Speichereisen
 Die Verfügbarkeit von Sauerstoff im Gewebe steuert die intestinale
Fe-Resorption. Im Gewebe reguliert das Eisenangebot posttranskriptionell die Synthese von
Apoferritin und Transferrinrezeptoren: Zellen mit viel Eisen
synthetisieren vermehrt
Apoferritin (Eisenspeichermoleküle) und vermindert
Transferrinrezeptoren (Schutz vor Eisenüberlastung) Die Verfügbarkeit von Sauerstoff im Gewebe steuert die intestinale
Fe-Resorption. Im Gewebe reguliert das Eisenangebot posttranskriptionell die Synthese von
Apoferritin und Transferrinrezeptoren: Zellen mit viel Eisen
synthetisieren vermehrt
Apoferritin (Eisenspeichermoleküle) und vermindert
Transferrinrezeptoren (Schutz vor Eisenüberlastung)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Anämie: ἀν = ohne, αἷμα = Blut
Anämie: ἀν = ohne, αἷμα = Blut Kinetik des Eisens
Kinetik des Eisens  Eisenreserven im Körper
Eisenreserven im Körper  Steuerung des Eisenaustauschs
Steuerung des Eisenaustauschs Transferrinsättigung
Transferrinsättigung
 Core messages
Core messages Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort

 Abbildung: Regulation der Eisenresorption
Abbildung: Regulation der Eisenresorption Zur Eisenresorption im Darm s. dort
Zur Eisenresorption im Darm s. dort
 Abbildung)
ist der einzige bekannte Transporter, der Eisen aus der Zelle in den
Extrazellulärraum befördert (und auch andere Spurenelemente: Zink,
Kobalt, Nickel). Ferroportin regelt nicht nur die intestinale
Eisenaufnahme, sondern auch die Abgabe von Eisen aus Makrophagen in
Leber und Milz. Ferroportin wird durch das hepatische Proteohormon Hepcidin
gesteuert, das an Ferroportin bindet und dessen Eisen-Export limitiert.
Das Wechselspiel dieser beiden Proteine ist die Grundlage des
Eisenhaushalts im Körper.
Abbildung)
ist der einzige bekannte Transporter, der Eisen aus der Zelle in den
Extrazellulärraum befördert (und auch andere Spurenelemente: Zink,
Kobalt, Nickel). Ferroportin regelt nicht nur die intestinale
Eisenaufnahme, sondern auch die Abgabe von Eisen aus Makrophagen in
Leber und Milz. Ferroportin wird durch das hepatische Proteohormon Hepcidin
gesteuert, das an Ferroportin bindet und dessen Eisen-Export limitiert.
Das Wechselspiel dieser beiden Proteine ist die Grundlage des
Eisenhaushalts im Körper. Zeichen der Anämie sind in Asien schon seit mindestens viertausend
Jahren bekannt. Schwerer Eisenmangel (Sideropenie
Zeichen der Anämie sind in Asien schon seit mindestens viertausend
Jahren bekannt. Schwerer Eisenmangel (Sideropenie  ) wurde seit dem Mittelalter als Chlorose
) wurde seit dem Mittelalter als Chlorose
 ("Bleichsucht") beschrieben. Der Engländer Thomas Sydenham
behandelte Anämikerinnen erstmals mit Eisensalzen und berichtete über
die Wirkung: ".. the effects of steel on chlorosis: The pulse
gains
strength and frequency, the surface warmth, the face - no longer pale
and deathlike - a fresh ruddy color..".
("Bleichsucht") beschrieben. Der Engländer Thomas Sydenham
behandelte Anämikerinnen erstmals mit Eisensalzen und berichtete über
die Wirkung: ".. the effects of steel on chlorosis: The pulse
gains
strength and frequency, the surface warmth, the face - no longer pale
and deathlike - a fresh ruddy color..".  Sauerstofftransport: Fe als Anlagerungsstelle für O2 in in Hämoglobin und Myoglobin (1 g Hämoglobin
Sauerstofftransport: Fe als Anlagerungsstelle für O2 in in Hämoglobin und Myoglobin (1 g Hämoglobin  enthält 3,5 mg Eisen) - und damit im Zentrum des Sauerstofftransports.
enthält 3,5 mg Eisen) - und damit im Zentrum des Sauerstofftransports. Elektronentransport: Fe als Cofaktor für Oxidoreduktasen und Zytochrome. Eisen-Schwefel-Komplexe sind Bestandteile von Atmungskettenkomplexen (I bis III); zahlreiche Enzyme
sind nur mit Eisen funktionsfähig. Wegen all dieser wichtigen
Eigenschaften ist Eisen unverzichtbar für Energiestoffwechsel,
Intermediärstoffwechsel, Nukleotidsynthese, Signalwege und Immunabwehr. Eisen ist Bestandteil zahlreicher Enzyme, z.B. Cytochromen, Katalase, Guanylylcyclase etc.
Elektronentransport: Fe als Cofaktor für Oxidoreduktasen und Zytochrome. Eisen-Schwefel-Komplexe sind Bestandteile von Atmungskettenkomplexen (I bis III); zahlreiche Enzyme
sind nur mit Eisen funktionsfähig. Wegen all dieser wichtigen
Eigenschaften ist Eisen unverzichtbar für Energiestoffwechsel,
Intermediärstoffwechsel, Nukleotidsynthese, Signalwege und Immunabwehr. Eisen ist Bestandteil zahlreicher Enzyme, z.B. Cytochromen, Katalase, Guanylylcyclase etc. (Blutarmut) verursacht. Dies betrifft vor allem Frauen: Der
Tagesbedarf (Männer ~1 mg/d) hängt vom Blutverlust ab (Menstruation:
30-60 ml, entspricht 15-30 mg Eisen). Schwangere vor der Niederkunft
brauchen 5 mg/d für die Blutbildung des Feten, was die maximale
Eisentransportkapazität der intestinalen Resorption meist übersteigt.
Fast jede zweite menstruierende Frau hat Eisenmangel (niedrige
Ferritinwerte
(Blutarmut) verursacht. Dies betrifft vor allem Frauen: Der
Tagesbedarf (Männer ~1 mg/d) hängt vom Blutverlust ab (Menstruation:
30-60 ml, entspricht 15-30 mg Eisen). Schwangere vor der Niederkunft
brauchen 5 mg/d für die Blutbildung des Feten, was die maximale
Eisentransportkapazität der intestinalen Resorption meist übersteigt.
Fast jede zweite menstruierende Frau hat Eisenmangel (niedrige
Ferritinwerte  ).
). s. dort).
s. dort).
 Abbildung: Kinetik des Körpereisens: Aufnahme, Verteilung, Ausscheidung
Abbildung: Kinetik des Körpereisens: Aufnahme, Verteilung, Ausscheidung Abbildung oben.
Abbildung oben. 
 Abbildung), die ausgemusterte Erythrozyten aufnehmen (Milz), abbauen, das gewonnene Hämeisen
zwischenspeichern (sie sind reich an Ferritin) und - hauptsächlich zur
Neusynthese von Hämoglobin im roten Knochenmark - rezirkulieren.
Abbildung), die ausgemusterte Erythrozyten aufnehmen (Milz), abbauen, das gewonnene Hämeisen
zwischenspeichern (sie sind reich an Ferritin) und - hauptsächlich zur
Neusynthese von Hämoglobin im roten Knochenmark - rezirkulieren.  zweiwertiger Form (ferrous iron, Fe++ - so tritt es
durch Zellmembranen. Darmschleimhautzellen können Eisen nur in zweiwertiger Form resorbieren) und
zweiwertiger Form (ferrous iron, Fe++ - so tritt es
durch Zellmembranen. Darmschleimhautzellen können Eisen nur in zweiwertiger Form resorbieren) und dreiwertiger Form (ferric iron, Fe+++ - so liegt es
z.B. im Blut an Transferrin, in der Zelle an Ferritin gebunden vor).
dreiwertiger Form (ferric iron, Fe+++ - so liegt es
z.B. im Blut an Transferrin, in der Zelle an Ferritin gebunden vor).  Oxidasen: Ferroxidase / Coeruloplasmin (ein kupferbindendes Globulin) oxidiert Eisen: Fe2+ → Fe3+ oder
Oxidasen: Ferroxidase / Coeruloplasmin (ein kupferbindendes Globulin) oxidiert Eisen: Fe2+ → Fe3+ oder  Reduktasen: Ferrireduktase: Fe3+ → Fe2+.
Reduktasen: Ferrireduktase: Fe3+ → Fe2+.  - überreicht. Dieses transportiert das dreiwertige Eisen, das die Hämoxygenase aus Häm freigesetzt hat.
- überreicht. Dieses transportiert das dreiwertige Eisen, das die Hämoxygenase aus Häm freigesetzt hat. 
 Abbildung: Hepcidin und Regulierung der Eisenresorption
Abbildung: Hepcidin und Regulierung der Eisenresorption
 , das Ferroportin (Fpn)
, das Ferroportin (Fpn)  bindet und zu seiner Internalisierung
(und Inaktivierung) führt (
bindet und zu seiner Internalisierung
(und Inaktivierung) führt (  Abbildung). Reduziertes Hepcidin erhöht die
Verfügbarkeit und Aktivität von Ferroportin, Eisen wird vermehrt aus
internen Speichern (z.B. Makrophagen, die Erythrozyten abbauen) und aus
der Nahrung gewonnen (Duodenum).
Abbildung). Reduziertes Hepcidin erhöht die
Verfügbarkeit und Aktivität von Ferroportin, Eisen wird vermehrt aus
internen Speichern (z.B. Makrophagen, die Erythrozyten abbauen) und aus
der Nahrung gewonnen (Duodenum).  Der Transport des Eisens im Blutplasma erfolgt durch Transferrin. Das eisenbeladene
Transferrin gibt dem Plasma seine gelbliche Eigenfarbe (Plasma von
Eisenmangelanämie-Patienten ist auffallend blass). Transferrin
ist ein Glykoprotein, das Eisen fest bindet und für den Eisentransport
durch Blut und Extrazellulärraum nötig ist. Obwohl transferringebundenes Eisen nur einen sehr
kleinen Teil des gesamten Körpereisens repräsentiert (~0,1%), ist es
wegen der hohen Umsatzrate (1 mg/h) enorm bedeutsam. 75% des Transferrins wird für den Eisenbedarf des
Knochenmarks (für die Blutbildung) benötigt.
Der Transport des Eisens im Blutplasma erfolgt durch Transferrin. Das eisenbeladene
Transferrin gibt dem Plasma seine gelbliche Eigenfarbe (Plasma von
Eisenmangelanämie-Patienten ist auffallend blass). Transferrin
ist ein Glykoprotein, das Eisen fest bindet und für den Eisentransport
durch Blut und Extrazellulärraum nötig ist. Obwohl transferringebundenes Eisen nur einen sehr
kleinen Teil des gesamten Körpereisens repräsentiert (~0,1%), ist es
wegen der hohen Umsatzrate (1 mg/h) enorm bedeutsam. 75% des Transferrins wird für den Eisenbedarf des
Knochenmarks (für die Blutbildung) benötigt. Transferrinsättigung
Transferrinsättigung Anteil des mit Eisen beladenen Transferrrins im Serum
Anteil des mit Eisen beladenen Transferrrins im Serum
 Abbildung: Transferrinrezeptor und Eisenresorption
Abbildung: Transferrinrezeptor und Eisenresorption

 Abbildung).
Abbildung).  Abbildung), wo das
Apotransferrin - bedingt durch den höheren extrazellulären pH-Wert, dem
es nun wieder ausgesetzt ist - vom Rezeptor freigesetzt wird und für den Eisentransport im Kreislauf erneut zur Verfügung steht.
Abbildung), wo das
Apotransferrin - bedingt durch den höheren extrazellulären pH-Wert, dem
es nun wieder ausgesetzt ist - vom Rezeptor freigesetzt wird und für den Eisentransport im Kreislauf erneut zur Verfügung steht. Umsatz. Der Eisenaustausch im
Körper übertrifft Aufnahme und Verlust (1-2 mg/d) um ein Vielfaches (
Umsatz. Der Eisenaustausch im
Körper übertrifft Aufnahme und Verlust (1-2 mg/d) um ein Vielfaches (  Abbildung):
Der Eisenpool im
Blutplasma (transferringebunden) einer
erwachsenen Person beträgt 3-4 mg, der tägliche
Eisenumsatz über den Kreislauf ist zehnmal so groß (30-40
mg/d). Der Großteil davon (~80%) entfällt auf die Blutbildung (frisch
gebildete Erythrozyten verbleiben für vier Monate im Kreislauf).
Abbildung):
Der Eisenpool im
Blutplasma (transferringebunden) einer
erwachsenen Person beträgt 3-4 mg, der tägliche
Eisenumsatz über den Kreislauf ist zehnmal so groß (30-40
mg/d). Der Großteil davon (~80%) entfällt auf die Blutbildung (frisch
gebildete Erythrozyten verbleiben für vier Monate im Kreislauf). 
 Abbildung: Umsatz von Eisen im Körper einer erwachsenen Person
Abbildung: Umsatz von Eisen im Körper einer erwachsenen Person




 Der größte Teil des Körpereisens (~70%, oder 2000 bis 4000 mg) befindet sich im Hämoglobin der Erythrozyten;
ein Liter Vollblut (Hkt ~ 0,4) enthält ~500 mg Eisen (ein Liter
Erythrozytenkonzentrat mindestens 1 Gramm). Bei einem Blutvolumen von 5 Litern
ergibt sich (bei normalem roten Blutbild) z.B. 2-3 g "Bluteisen". Weiters findet sich Eisen im Häm des
Myoglobins der Muskulatur (~10%, oder ~300 mg). Hämeisen dient dem Sauerstofftransport.
Der größte Teil des Körpereisens (~70%, oder 2000 bis 4000 mg) befindet sich im Hämoglobin der Erythrozyten;
ein Liter Vollblut (Hkt ~ 0,4) enthält ~500 mg Eisen (ein Liter
Erythrozytenkonzentrat mindestens 1 Gramm). Bei einem Blutvolumen von 5 Litern
ergibt sich (bei normalem roten Blutbild) z.B. 2-3 g "Bluteisen". Weiters findet sich Eisen im Häm des
Myoglobins der Muskulatur (~10%, oder ~300 mg). Hämeisen dient dem Sauerstofftransport. Etwa 1/3 des Gesamtspeichers (1000 - 1500 mg) verteilt sich auf Leber (~1000 mg), das Monozyten-Makrophagen-System und das Knochenmark. Mehr als die Hälfte dieses Anteils (~60%) gilt als Speichereisen (storage iron), der Rest (~40%) als Funktionseisen (essential iron).
Etwa 1/3 des Gesamtspeichers (1000 - 1500 mg) verteilt sich auf Leber (~1000 mg), das Monozyten-Makrophagen-System und das Knochenmark. Mehr als die Hälfte dieses Anteils (~60%) gilt als Speichereisen (storage iron), der Rest (~40%) als Funktionseisen (essential iron). Nur etwa 3 mg (0,1% des gesamten Eisenspeichers) zirkulieren an Transferrin gebunden in der Blutbahn.
Nur etwa 3 mg (0,1% des gesamten Eisenspeichers) zirkulieren an Transferrin gebunden in der Blutbahn.  gespeichert:
gespeichert: Ferritin
ist
ein aus 24 identischen Polypeptid-Untereinheiten bestehender
wasserlöslicher Molekülkomplex. Es stellt einen rasch mobilisierbaren
Speicher dar und hat
einen Eisenanteil (Fe3+)
von 20-25 Gewichts-% (jeder Ferritinkomplex kann bis zu 4500 Eisenionen
einlagern). Ferritin findet sich in so gut wie allen Zellen,
insbesondere in Darmschleimhaut, Phagozyten, Leberzellen und rotem
Knochenmark. Eisenfreies Apoferritin nimmt Eisen in zweiwertiger Form auf, oxidiert (zu Fe3+) und speichert es in dreiwertiger Form - aus der das Eisen leicht mobilisiert und genutzt werden kann. Die biologische Halbwertszeit eisenbeladenen Ferritins beträgt nur wenige Tage.
Ferritin
ist
ein aus 24 identischen Polypeptid-Untereinheiten bestehender
wasserlöslicher Molekülkomplex. Es stellt einen rasch mobilisierbaren
Speicher dar und hat
einen Eisenanteil (Fe3+)
von 20-25 Gewichts-% (jeder Ferritinkomplex kann bis zu 4500 Eisenionen
einlagern). Ferritin findet sich in so gut wie allen Zellen,
insbesondere in Darmschleimhaut, Phagozyten, Leberzellen und rotem
Knochenmark. Eisenfreies Apoferritin nimmt Eisen in zweiwertiger Form auf, oxidiert (zu Fe3+) und speichert es in dreiwertiger Form - aus der das Eisen leicht mobilisiert und genutzt werden kann. Die biologische Halbwertszeit eisenbeladenen Ferritins beträgt nur wenige Tage.  Um Eisen aus Ferritin wieder freizusetzen, muss es aus der dreiwertigen (Fe+++) in die zweiwertige Form (Fe++)
übergeführt (reduziert) werden. Ferritingebundenes Eisen im Blutplasma
steht in einem Äquilibrium mit den zellulären Eisenspeichern in den
Geweben.
Um Eisen aus Ferritin wieder freizusetzen, muss es aus der dreiwertigen (Fe+++) in die zweiwertige Form (Fe++)
übergeführt (reduziert) werden. Ferritingebundenes Eisen im Blutplasma
steht in einem Äquilibrium mit den zellulären Eisenspeichern in den
Geweben. Ferritin (Serum, Plasma)
Ferritin (Serum, Plasma) Bei
Eisen-Überangebot wird immer mehr Ferritin gebildet (um das toxische
Eisen zu binden), das dann zum Teil lysosomal zu Hämosiderin mutiert. Dies ist eine partiell abgebaute Form von Ferritin;
hier liegen die eisenhältigen Kerngebiete mehrerer Ferritinmoleküle in
aggregierter Form vor, ein Teil der Proteinhülle der Ferritinkomplexe
fehlt bereits. Hämosiderin enthält 30-35 Gewichts-% Eisen (Ferritin 20-25%), es ist
kaum (und wenn, dann unkontrolliert) mobilisierbar.
Bei
Eisen-Überangebot wird immer mehr Ferritin gebildet (um das toxische
Eisen zu binden), das dann zum Teil lysosomal zu Hämosiderin mutiert. Dies ist eine partiell abgebaute Form von Ferritin;
hier liegen die eisenhältigen Kerngebiete mehrerer Ferritinmoleküle in
aggregierter Form vor, ein Teil der Proteinhülle der Ferritinkomplexe
fehlt bereits. Hämosiderin enthält 30-35 Gewichts-% Eisen (Ferritin 20-25%), es ist
kaum (und wenn, dann unkontrolliert) mobilisierbar.  s. auch dort
s. auch dort
 Steigender Eisenspiegel stimuliert die Bildung von Hepcidin (weniger Fe betritt die extrazelluläre
Flüssigkeit - negative Rückkopplung) - Hepcidin fungiert als "Eisenbremse".
Steigender Eisenspiegel stimuliert die Bildung von Hepcidin (weniger Fe betritt die extrazelluläre
Flüssigkeit - negative Rückkopplung) - Hepcidin fungiert als "Eisenbremse". Umgekehrt hemmen Eisenmangel, Hypoxie und Anämie
die
Hepcidinbildung (Lösung der "Eisenbremse", verbesserte
Eisenverfügbarkeit). Die Hemmung der Hepcidinsynthese erfolgt unter
Beteiligung einer Serinprotease (Matriptase 2); Mutation des
Matriptase-Gens enthemmt die Hepcidinbildung und führt zu schwerer
Eisenmangelanämie, die resistent auf orale Eisengabe ist (IRIDA-Anämie:
Iron therapy refractory iron deficiency anemia).
Umgekehrt hemmen Eisenmangel, Hypoxie und Anämie
die
Hepcidinbildung (Lösung der "Eisenbremse", verbesserte
Eisenverfügbarkeit). Die Hemmung der Hepcidinsynthese erfolgt unter
Beteiligung einer Serinprotease (Matriptase 2); Mutation des
Matriptase-Gens enthemmt die Hepcidinbildung und führt zu schwerer
Eisenmangelanämie, die resistent auf orale Eisengabe ist (IRIDA-Anämie:
Iron therapy refractory iron deficiency anemia).
 Viel Eisen → Hepcidin↑→ Ferroportin↓→ Eisenresorption↓
Viel Eisen → Hepcidin↑→ Ferroportin↓→ Eisenresorption↓ Wenig Eisen → Hepcidin↓→ Ferroportin↑→ Eisenresorption↑
Wenig Eisen → Hepcidin↓→ Ferroportin↑→ Eisenresorption↑ s. dort). Umgekehrt führt erhöhtes Eisenangebot zur Reduktion der Transferrinbildung, totale und latente EBK nehmen ab.
s. dort). Umgekehrt führt erhöhtes Eisenangebot zur Reduktion der Transferrinbildung, totale und latente EBK nehmen ab.

 Abbildung: Der intrazelluläre Eisenspiegel steuert die Ferritin-Expression
Abbildung: Der intrazelluläre Eisenspiegel steuert die Ferritin-Expression
 Abbildung) und Transferrinrezeptoren (Endozytose)
feinregulieren.
Abbildung) und Transferrinrezeptoren (Endozytose)
feinregulieren.
 s. dort). In der Darmschleimhaut legt der Körper eine transiente Eisenreserve an, Steuersubstanzen beeinflussen die Eisenfreisetzung:
s. dort). In der Darmschleimhaut legt der Körper eine transiente Eisenreserve an, Steuersubstanzen beeinflussen die Eisenfreisetzung: Die Ferri-Reduktase DMT1 (Divalent metal transporter) am Bürstensaum der Enterozyten reduziert in der Nahrung vorhandenes dreiwertiges Nonhäm-Eisen zu Fe2+, damit es resorbiert werden kann. Mit zunehmendem Eisenspeicher im Körper nimmt ihre Expression ab - das heißt, je besser der Körper mit Eisen versorgt ist, desto weniger Eisen kann im Darm aufgenommen werden.
Die Ferri-Reduktase DMT1 (Divalent metal transporter) am Bürstensaum der Enterozyten reduziert in der Nahrung vorhandenes dreiwertiges Nonhäm-Eisen zu Fe2+, damit es resorbiert werden kann. Mit zunehmendem Eisenspeicher im Körper nimmt ihre Expression ab - das heißt, je besser der Körper mit Eisen versorgt ist, desto weniger Eisen kann im Darm aufgenommen werden. Das in die Enterozyten aufgenommene Eisen
Das in die Enterozyten aufgenommene Eisen  speist als labiler Eisenpool den (hauptsächlich mitochondrialen) Stoffwechsel. Es kann weiters als "eiserne Reserve" an Ferritin gebunden verbleiben. Sollte der Eisenbedarf des
Organismus plötzlich steigen, kann das Eisen von hier mobilisiert und
dem Körper zur Verfügung gestellt werden; wenn nicht, geht es innerhalb
weniger Tage mit den Mukosazellen über den Stuhl verloren: Schleimhaut-Desquamation.
speist als labiler Eisenpool den (hauptsächlich mitochondrialen) Stoffwechsel. Es kann weiters als "eiserne Reserve" an Ferritin gebunden verbleiben. Sollte der Eisenbedarf des
Organismus plötzlich steigen, kann das Eisen von hier mobilisiert und
dem Körper zur Verfügung gestellt werden; wenn nicht, geht es innerhalb
weniger Tage mit den Mukosazellen über den Stuhl verloren: Schleimhaut-Desquamation.  Wird Eisen vom Körper benötigt, wird es von den Enterozyten basolateral als Fe2+ über Ferroportin in den Kreislauf freigesetzt. Die unmittelbar neben Ferroportin lokalisierte Ferroxidase, welche das Eisen wieder zu Fe3+ oxidiert, heisst Hephästin
Wird Eisen vom Körper benötigt, wird es von den Enterozyten basolateral als Fe2+ über Ferroportin in den Kreislauf freigesetzt. Die unmittelbar neben Ferroportin lokalisierte Ferroxidase, welche das Eisen wieder zu Fe3+ oxidiert, heisst Hephästin  (
(  Abbildung). Außerdem kann Eisen im Blut durch Coeruloplasmin oxidiert werden - es wirkt ebenfalls als Ferroxidase. Anschließend kann Fe3+ an Transferrin abgegeben und im Blut weitertransportiert werden.
Abbildung). Außerdem kann Eisen im Blut durch Coeruloplasmin oxidiert werden - es wirkt ebenfalls als Ferroxidase. Anschließend kann Fe3+ an Transferrin abgegeben und im Blut weitertransportiert werden.
 Abbildung: Eisenstoffwechsel: Makrophage
Abbildung: Eisenstoffwechsel: Makrophage CD163, ein Scavenger-Rezeptor für den Hämoglobin-Haptoglobin-Komplex auf Monozyten / Makrophagen
CD163, ein Scavenger-Rezeptor für den Hämoglobin-Haptoglobin-Komplex auf Monozyten / Makrophagen  DcytB, duodenales Cytochrom B beschleunigt die Reduktion von Eisen
DcytB, duodenales Cytochrom B beschleunigt die Reduktion von Eisen  DMT-1, Divalent metal transporter befördert zweiwertiges Eisen in Darmzelle
DMT-1, Divalent metal transporter befördert zweiwertiges Eisen in Darmzelle  HCP-1, Haem carrier protein 1 ist ein Häm-Rezeptor an der luminalen Oberfläche der Enterozyten, über den Hämeisen aufgenommen werden kann
HCP-1, Haem carrier protein 1 ist ein Häm-Rezeptor an der luminalen Oberfläche der Enterozyten, über den Hämeisen aufgenommen werden kann  HO-1, Hämoxygenase ist ein mikrosomales Enzym, das Eisen oxydiert
HO-1, Hämoxygenase ist ein mikrosomales Enzym, das Eisen oxydiert  ISC, Iron-sulfur cluster, Eisen-Schwefel-Komplexe, die enzymatisch aktiv sind
ISC, Iron-sulfur cluster, Eisen-Schwefel-Komplexe, die enzymatisch aktiv sind  Nramp-1, Natural resistance-associated macrophage protein 1, ein eisentrasportierendes Protein
Nramp-1, Natural resistance-associated macrophage protein 1, ein eisentrasportierendes Protein  Steap3, eine Metalloreduktase, reduziert Fe3+ zu Fe2+
Steap3, eine Metalloreduktase, reduziert Fe3+ zu Fe2+  Tf, Transferrin
Tf, Transferrin  TfR1, Transferrinrezeptor 1
TfR1, Transferrinrezeptor 1
 Abbildung). Hämgebundenes Eisen wird über
Hämoxygenase freigesetzt. Der Großteil des Plasma-Ferritins stammt aus Makrophagen.
Abbildung). Hämgebundenes Eisen wird über
Hämoxygenase freigesetzt. Der Großteil des Plasma-Ferritins stammt aus Makrophagen. Abbildung) sind die hauptsächlichen Eisenkonsumenten im Körper. Sie nehmen Eisen über den Transferrinrezeptor 1
auf; jeder
Erythroblast verfügt über einige 105 Transferrinrezeptoren. Die Aufgabe der Eythroblasten ist die Bildung roter Blutkörperchen (Erythropoese).
Abbildung) sind die hauptsächlichen Eisenkonsumenten im Körper. Sie nehmen Eisen über den Transferrinrezeptor 1
auf; jeder
Erythroblast verfügt über einige 105 Transferrinrezeptoren. Die Aufgabe der Eythroblasten ist die Bildung roter Blutkörperchen (Erythropoese).
 Abbildung: Eisenstoffwechsel: Erythroblast
Abbildung: Eisenstoffwechsel: Erythroblast CD163, ein Scavenger-Rezeptor für den Hämoglobin-Haptoglobin-Komplex auf Monozyten / Makrophagen
CD163, ein Scavenger-Rezeptor für den Hämoglobin-Haptoglobin-Komplex auf Monozyten / Makrophagen  DcytB, duodenales Cytochrom B beschleunigt die Reduktion von Eisen
DcytB, duodenales Cytochrom B beschleunigt die Reduktion von Eisen  DMT-1, Divalent metal transporter befördert zweiwertiges Eisen in Darmzellen
DMT-1, Divalent metal transporter befördert zweiwertiges Eisen in Darmzellen  FLVCR, ein Transporterprotein
FLVCR, ein Transporterprotein  HCP-1, Haem carrier protein 1 ist ein Häm-Rezeptor an der luminalen Oberfläche der Enterozyten, über den Hämeisen aufgenommen werden kann
HCP-1, Haem carrier protein 1 ist ein Häm-Rezeptor an der luminalen Oberfläche der Enterozyten, über den Hämeisen aufgenommen werden kann  HO-1, Hämoxygenase ist ein mikrosomales Enzym, das Eisen oxydiert
HO-1, Hämoxygenase ist ein mikrosomales Enzym, das Eisen oxydiert  ISC, Iron-sulfur cluster, Eisen-Schwefel-Komplexe, die enzymatisch aktiv sind
ISC, Iron-sulfur cluster, Eisen-Schwefel-Komplexe, die enzymatisch aktiv sind  Nramp-1, Natural resistance-associated macrophage protein 1, ein eisentrasportierendes Protein
Nramp-1, Natural resistance-associated macrophage protein 1, ein eisentrasportierendes Protein  Steap3, eine Metalloreduktase, reduziert Fe3+ zu Fe2+
Steap3, eine Metalloreduktase, reduziert Fe3+ zu Fe2+  Tf, Transferrin
Tf, Transferrin  TfR1, Transferrinrezeptor 1
TfR1, Transferrinrezeptor 1

 Abbildung).
Abbildung). Zu Eisen und Schwangerschaft s. dort
Zu Eisen und Schwangerschaft s. dort s. dort.
s. dort.
 Eisen nimmt Elektronen auf oder
gibt sie ab (Fe2+ / Fe3+),
es übernimmt Elektronentransport als Cofaktor für Oxidoreduktasen und
Zytochrome. Eisen tritt in zweiwertiger Form durch Zellmembranen;
gebunden an Ferritin (Zelle) oder Transferrin (Blut) ist es dreiwertig.
Oxidasen (Ferroxidase, Coeruloplasmin) oxidieren Eisen (Fe2+ → Fe3+), Reduktasen (Ferrireduktase) reduzieren es (Fe3+ → Fe2+)
Eisen nimmt Elektronen auf oder
gibt sie ab (Fe2+ / Fe3+),
es übernimmt Elektronentransport als Cofaktor für Oxidoreduktasen und
Zytochrome. Eisen tritt in zweiwertiger Form durch Zellmembranen;
gebunden an Ferritin (Zelle) oder Transferrin (Blut) ist es dreiwertig.
Oxidasen (Ferroxidase, Coeruloplasmin) oxidieren Eisen (Fe2+ → Fe3+), Reduktasen (Ferrireduktase) reduzieren es (Fe3+ → Fe2+) Eisen-Schwefel-Komplexe sind Bestandteile von
Atmungskettenkomplexen; zahlreiche Enzyme sind nur mit Eisen
funktionsfähig (Energiestoffwechsel, Intermediärstoffwechsel,
Nukleotidsynthese, Signalwege, Immunabwehr)
Eisen-Schwefel-Komplexe sind Bestandteile von
Atmungskettenkomplexen; zahlreiche Enzyme sind nur mit Eisen
funktionsfähig (Energiestoffwechsel, Intermediärstoffwechsel,
Nukleotidsynthese, Signalwege, Immunabwehr) Eisenresorption: Über die apikale Enterozytenmembran wird Hämeisen über
einen
Hämtransporter (HCP-1) aufgenommen und intrazellulär als Fe2+ freigesetzt. Nicht-Häm-Eisen (Fe3+) wird zu Fe2+ reduziert und über einen Transporter (DMT1) aufgenommen. An der basolateralen Membran gelangt Fe2+ über Ferroportin aus der Zelle, wird durch die Ferroxidase Hephästin zu Fe3+ oxidiert und an Transferrin im Blut weitergereicht. Mit der Nahrung
muss, entsprechend dem niedrigen Fe-Ausnützungsgrad, ein Mehrfaches der
vom Körper neu benötigten Menge zugeführt werden
Eisenresorption: Über die apikale Enterozytenmembran wird Hämeisen über
einen
Hämtransporter (HCP-1) aufgenommen und intrazellulär als Fe2+ freigesetzt. Nicht-Häm-Eisen (Fe3+) wird zu Fe2+ reduziert und über einen Transporter (DMT1) aufgenommen. An der basolateralen Membran gelangt Fe2+ über Ferroportin aus der Zelle, wird durch die Ferroxidase Hephästin zu Fe3+ oxidiert und an Transferrin im Blut weitergereicht. Mit der Nahrung
muss, entsprechend dem niedrigen Fe-Ausnützungsgrad, ein Mehrfaches der
vom Körper neu benötigten Menge zugeführt werden Der Eisenspeicher im Körper einer erwachsenen Person beträgt
normalerweise 3-5 Gramm (Männer 40-60 mg/kg, Frauen 30-45 mg/kg).
Ohne Blutverlust geht dem Körper pro Tag ca. 1 mg Eisen verloren: Dieser unregulierte Verlust ergibt sich aus abgeschilferter
Darmschleimhaut, Galle (Stuhl ~70%), Hautschuppen, Haaren, Nägeln, Harn, Schweiß. Darüber
hinausgehender Bedarf hängt vom
Blutverlust ab (Menstruation: 30-60 ml, entspricht 15-30 mg Eisen).
Schwangere
vor der Niederkunft brauchen 5 mg/d für den Feten. Der größte Teil des
Körpereisens (~70%) befindet sich im Hämoglobin der Erythrozyten.
Eisenmangel bewirkt Anämie (Blutarmut)
Der Eisenspeicher im Körper einer erwachsenen Person beträgt
normalerweise 3-5 Gramm (Männer 40-60 mg/kg, Frauen 30-45 mg/kg).
Ohne Blutverlust geht dem Körper pro Tag ca. 1 mg Eisen verloren: Dieser unregulierte Verlust ergibt sich aus abgeschilferter
Darmschleimhaut, Galle (Stuhl ~70%), Hautschuppen, Haaren, Nägeln, Harn, Schweiß. Darüber
hinausgehender Bedarf hängt vom
Blutverlust ab (Menstruation: 30-60 ml, entspricht 15-30 mg Eisen).
Schwangere
vor der Niederkunft brauchen 5 mg/d für den Feten. Der größte Teil des
Körpereisens (~70%) befindet sich im Hämoglobin der Erythrozyten.
Eisenmangel bewirkt Anämie (Blutarmut) Bei normalen Eisenreserven und intakter Blutbildung produziert die
Leber Hepcidin. Hohe Plasma-Hepcidinspiegel reduzieren die Aktivität
von Ferroportin, resorbiertes Eisen gelangt nicht weiter in das Blut -
es bleibt in der Mukosa und wird über die Abschilferung des Epithels
wieder entfernt (Mukosablock, "Eisenbremse"). Hypoxie oder Eisenmangel
hingegen blockiert die Produktion von Hepcidin, die Aktivität von
Ferroportin steigt, Eisen gelangt in das rote
Knochenmark. Blutbildung, Hämatokrit und Sauerstoff-Transportkapazität
nehmen zu
Bei normalen Eisenreserven und intakter Blutbildung produziert die
Leber Hepcidin. Hohe Plasma-Hepcidinspiegel reduzieren die Aktivität
von Ferroportin, resorbiertes Eisen gelangt nicht weiter in das Blut -
es bleibt in der Mukosa und wird über die Abschilferung des Epithels
wieder entfernt (Mukosablock, "Eisenbremse"). Hypoxie oder Eisenmangel
hingegen blockiert die Produktion von Hepcidin, die Aktivität von
Ferroportin steigt, Eisen gelangt in das rote
Knochenmark. Blutbildung, Hämatokrit und Sauerstoff-Transportkapazität
nehmen zu Beim Abbau gealterter Erythrozyten (Milz) bauen Phagozyten Hämoglobin
zu Aminosäuren und Häm ab, das eine Hämoxygenase in Fe3+
und Biliverdin verwandelt. Peritubuläre Fibroblasten der Nierenrinde
bilden bei reduzierter Sauerstoff- oder Eisenverfügbarkeit
Erythropoetin, dieses regt die Hämatopoese an. Hypoxie und Eisenmangel
fördern die Eisenresorption im Darm
Beim Abbau gealterter Erythrozyten (Milz) bauen Phagozyten Hämoglobin
zu Aminosäuren und Häm ab, das eine Hämoxygenase in Fe3+
und Biliverdin verwandelt. Peritubuläre Fibroblasten der Nierenrinde
bilden bei reduzierter Sauerstoff- oder Eisenverfügbarkeit
Erythropoetin, dieses regt die Hämatopoese an. Hypoxie und Eisenmangel
fördern die Eisenresorption im Darm  Ferritin ist wasserlöslich, rasch mobilisierbar (Darmschleimhaut,
Phagozyten, Leberzellen, rotes Knochenmark) und hat einen Eisenanteil
von 20-25 Gewichts-% (bis zu 4500 Eisenionen pro Ferritinmolekül). 1
µg/l Serumferritin entspricht bei einer gesunden Person ~10 mg
Speichereisen
Ferritin ist wasserlöslich, rasch mobilisierbar (Darmschleimhaut,
Phagozyten, Leberzellen, rotes Knochenmark) und hat einen Eisenanteil
von 20-25 Gewichts-% (bis zu 4500 Eisenionen pro Ferritinmolekül). 1
µg/l Serumferritin entspricht bei einer gesunden Person ~10 mg
Speichereisen Die Verfügbarkeit von Sauerstoff im Gewebe steuert die intestinale
Fe-Resorption. Im Gewebe reguliert das Eisenangebot posttranskriptionell die Synthese von
Apoferritin und Transferrinrezeptoren: Zellen mit viel Eisen
synthetisieren vermehrt
Apoferritin (Eisenspeichermoleküle) und vermindert
Transferrinrezeptoren (Schutz vor Eisenüberlastung)
Die Verfügbarkeit von Sauerstoff im Gewebe steuert die intestinale
Fe-Resorption. Im Gewebe reguliert das Eisenangebot posttranskriptionell die Synthese von
Apoferritin und Transferrinrezeptoren: Zellen mit viel Eisen
synthetisieren vermehrt
Apoferritin (Eisenspeichermoleküle) und vermindert
Transferrinrezeptoren (Schutz vor Eisenüberlastung) 