




 Niere: Metabolisch, endokrin
Niere: Metabolisch, endokrin
 Clathrin: clatri = Gitter
Clathrin: clatri = Gitter | Glomerulär filtriertes Protein
(1-3 g/d - etwa 60 kg Protein strömen täglich durch die
glomerulären Kapillaren, die Filtration beträgt also nur ca. 0,003% dieser Menge)
wird von den Tubuli endozytotisch
wiederaufgenommen und (als Peptide und Aminosäuren) an das Blut
zurückgeführt. Normalerweise werden nur etwa 0,03 Gramm täglich (rund 1% der filtrierten
Menge) mit dem Harn
ausgeschieden. Die Nieren beteiligen sich am Abbau extrazellulären Proteins ("Plasmaproteine"), Nierenversagen kann zu Erhöhung des Blutspiegels zahlreicher Peptidhormone führen. Die Niere ist nicht nur endokrine Abbau-, sondern auch Synthesestelle: Sie bildet Erythropoetin und aktiviert Vitamin-D-Hormon; Renin stößt den Angiotensin-Aldosteron-Mechanismus an. Kinine sind gefäßerweiternd, fördern die Ureterperistaltik und wirken - teils über Prostaglandine - natriuretisch. In der Einstellung des Säure-Basen-Haushaltes spielen die Nieren eine zentrale Rolle: Sie bilden Bicarbonat (hauptsächlich im proximalen Tubulus), dieses puffert tubulär sezernierte Säuren (der Harn-pH würde andernfalls von ~5,4 auf ~1,3 absinken). Glomerulär filtriertes Phosphat wird zu 10% ausgeschieden und dient ebenfalls der Pufferung. Die Nieren tragen etwa 10% zum Ruheumsatz des Organismus bei, sie verbrauchen ~30 ml Sauerstoff pro Minute (rund ein Zehntel des gesamten Ruhe-O2-Bedarfs). Der Großteil des renalen Energiestoffwechsels wird für die Rückresorption von Kochsalz aus den Tubuli benötigt. |
 Säure-Basen-Haushalt
Säure-Basen-Haushalt  Niere und Energiestoffwechsel
Niere und Energiestoffwechsel  Niere und Hormone
Niere und Hormone
 s. dort.)
s. dort.) | Oligopeptide werden im proximalen Tubulus luminal abgebaut, Di- und Tripeptide im Austausch gegen H+ resorbiert |
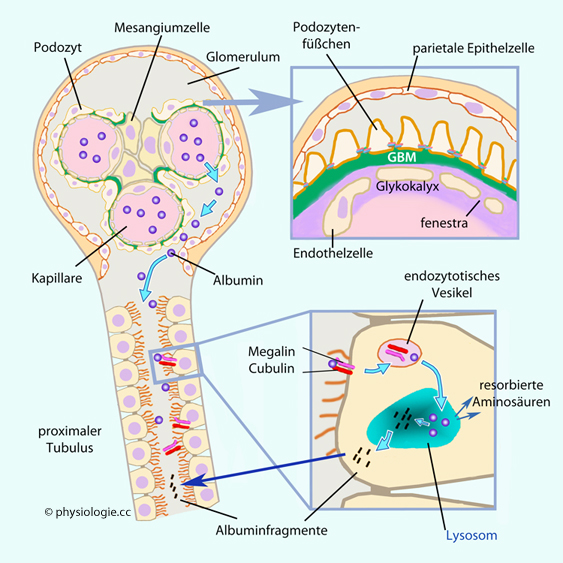
 Abbildung: Wie die Niere mit filtriertem Albumin umgeht
Abbildung: Wie die Niere mit filtriertem Albumin umgeht haften sich an die Basalmembran, zwischen ihren fußartigen Fortsätzen bestimmen Proteine die Größenbarriere dieses Filters (slit diaphragm). Nur einige Albuminmoleküle schlüpfen durch dieses Sieb.
haften sich an die Basalmembran, zwischen ihren fußartigen Fortsätzen bestimmen Proteine die Größenbarriere dieses Filters (slit diaphragm). Nur einige Albuminmoleküle schlüpfen durch dieses Sieb.
 ) resorbiert (Megalin / Cubulin:
) resorbiert (Megalin / Cubulin:  Abbildung).
Abbildung).  Megalin
Megalin (LRP2, low density lipoprotein receptor-related protein 2) und
Cubilin (mit dem Megalin einen Komplex bilden kann) sind Endozytose-Rezeptoren, die vor allem im proximalen Tubulus
exprimiert werden (
(LRP2, low density lipoprotein receptor-related protein 2) und
Cubilin (mit dem Megalin einen Komplex bilden kann) sind Endozytose-Rezeptoren, die vor allem im proximalen Tubulus
exprimiert werden ( Abbildung). Sie finden sich in Membranen verschiedener Epithelzellen, die sich an der Endozytose zahlreicher Substanzen, u.a. Proteinen, beteiligen.
Abbildung). Sie finden sich in Membranen verschiedener Epithelzellen, die sich an der Endozytose zahlreicher Substanzen, u.a. Proteinen, beteiligen.  Substratmoleküle selbst synthetisieren, wie Glucose und
Aminobutyrat;
Substratmoleküle selbst synthetisieren, wie Glucose und
Aminobutyrat; den Säure-Basen-Haushalt beeinflussen, indem
sie je nach Bedarf saure oder basisch-puffernde Valenzen ausscheiden;
und
den Säure-Basen-Haushalt beeinflussen, indem
sie je nach Bedarf saure oder basisch-puffernde Valenzen ausscheiden;
und  Hormone freisetzen.
Hormone freisetzen. 
 Abbildung: Niere und Säure-Basen-Haushalt
Abbildung: Niere und Säure-Basen-Haushalt H2CO3
H2CO3  HCO3- + H+
HCO3- + H+
 Bicarbonat: Glomerulär filtriertes
Bicarbonat (~4500 mM pro Tag) wird in der Niere so gut wie vollständig rückresorbiert (85%
im proximalen Tubulus, 15% im distalen Tubulus). Zusätzlich bildet die Niere (bei ausgeglichener Stoffwechsellage) pro Tag etwa 70 mM Bicarbonat (hauptsächlich im proximalen Tubulus) und
liefert so Pufferbasen nach. Die Niere muss tubulär sezernierte Säuren
puffern, ansonsten würde der Harn-pH auf einen Wert von ~1,3 absinken
(~70 mM H+ in ~1,5 Liter Harn) - tatsächlich beträgt der pH-Wert des Urins im Durchschnitt 5,4 (Spanne je nach Stoffwechselsituation pH 4,6 bis pH 7,5).
Bicarbonat: Glomerulär filtriertes
Bicarbonat (~4500 mM pro Tag) wird in der Niere so gut wie vollständig rückresorbiert (85%
im proximalen Tubulus, 15% im distalen Tubulus). Zusätzlich bildet die Niere (bei ausgeglichener Stoffwechsellage) pro Tag etwa 70 mM Bicarbonat (hauptsächlich im proximalen Tubulus) und
liefert so Pufferbasen nach. Die Niere muss tubulär sezernierte Säuren
puffern, ansonsten würde der Harn-pH auf einen Wert von ~1,3 absinken
(~70 mM H+ in ~1,5 Liter Harn) - tatsächlich beträgt der pH-Wert des Urins im Durchschnitt 5,4 (Spanne je nach Stoffwechselsituation pH 4,6 bis pH 7,5).  Ammonium: Die Bicarbonatsynthese erfolgt vorwiegend über den Ammoniummechanismus (durch NH3 → NH4+) sowie den Phosphatmechanismus (Bicarbonatbildung durch Hydrogenphosphat → Dihydrogenhosphat);
Ammonium: Die Bicarbonatsynthese erfolgt vorwiegend über den Ammoniummechanismus (durch NH3 → NH4+) sowie den Phosphatmechanismus (Bicarbonatbildung durch Hydrogenphosphat → Dihydrogenhosphat);  s. dort.
s. dort. Phosphat: Glomerulär filtriertes Phosphat
wird zu 90% renal rückgewonnen; 10%
werden ausgeschieden und dienen der Pufferung. Das ist wichtig, denn
die Epithelzellen der (relativ empfindlichen) Tubuli müssen vor
pH-Werten unter 4,5 geschützt werden (filtriertes und renal aus CO2
neugebildetes Bicarbonat wird vollständig resorbiert - der Inhalt
distaler Tubulusanteile hat meist einen pH-Wert unter 5,5). Phosphat
stellt ~80% der "titrierbaren Säure" (hierzu zählt z.B. auch Citrat oder Sulfat) im Harn.
Phosphat: Glomerulär filtriertes Phosphat
wird zu 90% renal rückgewonnen; 10%
werden ausgeschieden und dienen der Pufferung. Das ist wichtig, denn
die Epithelzellen der (relativ empfindlichen) Tubuli müssen vor
pH-Werten unter 4,5 geschützt werden (filtriertes und renal aus CO2
neugebildetes Bicarbonat wird vollständig resorbiert - der Inhalt
distaler Tubulusanteile hat meist einen pH-Wert unter 5,5). Phosphat
stellt ~80% der "titrierbaren Säure" (hierzu zählt z.B. auch Citrat oder Sulfat) im Harn.  zwischen H3PO4 und H2PO4- bei ~2,1
zwischen H3PO4 und H2PO4- bei ~2,1 zwischen H2PO4- und HPO42- bei 6,8 (d.h. bei pH=6,8 liegen primäres und sekundäres Phosphat in gleich hoher Konzentration vor)
zwischen H2PO4- und HPO42- bei 6,8 (d.h. bei pH=6,8 liegen primäres und sekundäres Phosphat in gleich hoher Konzentration vor) zwischen HPO42- und PO43- bei 12,4
zwischen HPO42- und PO43- bei 12,4 Zur Beteiligung der Leber am Ammonium-Harnstoff-Mechanismus s. dort
Zur Beteiligung der Leber am Ammonium-Harnstoff-Mechanismus s. dort Zur Beteiligung der Niere am Säure-Basen-Haushalt s. auch dort
Zur Beteiligung der Niere am Säure-Basen-Haushalt s. auch dort Zum tubulu-glomerulären Feedback s. dort
Zum tubulu-glomerulären Feedback s. dort Der Sauerstoffverbrauch
der Nieren ist - bezogen auf das renale Organgewicht - enorm hoch: So
steuern die Nieren (~0.5% des Körpergewichts) etwa 10% zum
gesamten Ruheumsatz bei. Dieser Umsatz wird zum Großteil für den
aktiven Transport von Salzen (vor allem NaCl) durch das Tubulussystem
benötigt. Der proximale Tubulus sowie der dicke aufsteigende Teil der Henle-Schleife haben eine besonders hohe Dichte an Mitochondrien,
das hier (oxidativ) gebildete ATP wird vorwiegend zum Betrieb der
Na/K-ATPase in der basolateralen Membran der Tubuluszellen benötigt.
Der Sauerstoffverbrauch
der Nieren ist - bezogen auf das renale Organgewicht - enorm hoch: So
steuern die Nieren (~0.5% des Körpergewichts) etwa 10% zum
gesamten Ruheumsatz bei. Dieser Umsatz wird zum Großteil für den
aktiven Transport von Salzen (vor allem NaCl) durch das Tubulussystem
benötigt. Der proximale Tubulus sowie der dicke aufsteigende Teil der Henle-Schleife haben eine besonders hohe Dichte an Mitochondrien,
das hier (oxidativ) gebildete ATP wird vorwiegend zum Betrieb der
Na/K-ATPase in der basolateralen Membran der Tubuluszellen benötigt.  Etwa 80% des renalen Energieaufkommens werden für die Rückresorption glomerulär filtrierten Natriums aufgewendet.
Etwa 80% des renalen Energieaufkommens werden für die Rückresorption glomerulär filtrierten Natriums aufgewendet. Bei
inneren Blutungen im Bereich der Nieren (Trauma, postoperativ) können
daher in kurzer Zeit große Blutmengen in den Bauchraum austreten, das
Blutvolumen im Kreislauf sinkt und es kann rasch zu Schocksymptomen
kommen (Blutdruckabfall, Tachykardie), ohne dass von aussen ein
Blutverlust erkennbar wird.
Bei
inneren Blutungen im Bereich der Nieren (Trauma, postoperativ) können
daher in kurzer Zeit große Blutmengen in den Bauchraum austreten, das
Blutvolumen im Kreislauf sinkt und es kann rasch zu Schocksymptomen
kommen (Blutdruckabfall, Tachykardie), ohne dass von aussen ein
Blutverlust erkennbar wird. Renin / Aldosteron
Renin / Aldosteron  Vitamin D-Hormon
Vitamin D-Hormon Erythropoetin
(Epo)
Erythropoetin
(Epo)  wird bei steigendem Sauerstoffbedarf aus erythropoetinbildenden
Zellen in der Nierenrinde freigesetzt, die sich durch den Hypoxiereiz
aus Perizyten und fibroblastenähnlichen Zellen differenzieren und im
Interstitium peritubulär zu finden sind (
wird bei steigendem Sauerstoffbedarf aus erythropoetinbildenden
Zellen in der Nierenrinde freigesetzt, die sich durch den Hypoxiereiz
aus Perizyten und fibroblastenähnlichen Zellen differenzieren und im
Interstitium peritubulär zu finden sind ( Abbildung).
Abbildung). 
 Abbildung: Erythropoetinbildende Zellen in der Niere
Abbildung: Erythropoetinbildende Zellen in der Niere
 Die Freisetzung von Erythropoetin aus Fibroblasten-ähnlichen
interstitiellen Zellen in der Nierenrinde wird durch lokale Hypoxie
stimuliert. Dies kann auftreten infolge
Die Freisetzung von Erythropoetin aus Fibroblasten-ähnlichen
interstitiellen Zellen in der Nierenrinde wird durch lokale Hypoxie
stimuliert. Dies kann auftreten infolge verringerter renaler Perfusion
verringerter renaler Perfusion Hämatokritabfall, z.B. nach intensivem Blutverlust (Einströmen interstitieller Flüssigkeit in den Kreislauf)
Hämatokritabfall, z.B. nach intensivem Blutverlust (Einströmen interstitieller Flüssigkeit in den Kreislauf) Reduktion des pO2 in der Atemluft (Höhenaufenthalt)
Reduktion des pO2 in der Atemluft (Höhenaufenthalt) Abbildung) bezeichnet wird.
Abbildung) bezeichnet wird.  HIF-1 dominiert die Regulation der renalen
Erythropoetinproduktion,
HIF-1 dominiert die Regulation der renalen
Erythropoetinproduktion, 
 HIF-2 regt die Epo-Synthese in Niere
und Leber an.
HIF-2 regt die Epo-Synthese in Niere
und Leber an. 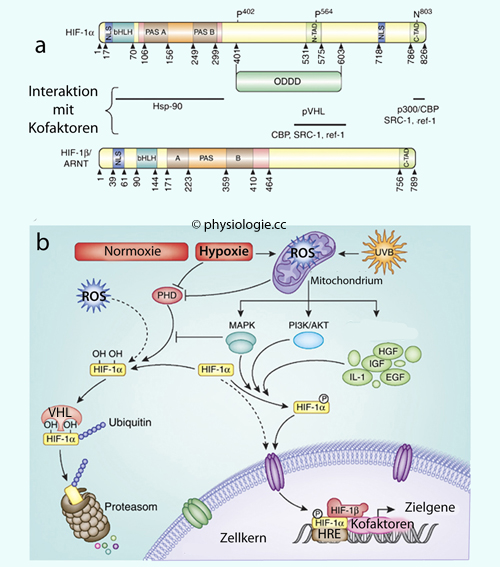

 Abbildung: Regulierung des HIF-1 (Hypoxia-inducible factor-1)
Abbildung: Regulierung des HIF-1 (Hypoxia-inducible factor-1) ARNT, aryl hydrocarbon receptor nuclear translocator (HIF-1β), ß-Einheit des Transkriptionsfaktors HIF
ARNT, aryl hydrocarbon receptor nuclear translocator (HIF-1β), ß-Einheit des Transkriptionsfaktors HIF  HGF, hepatocyte growth factor
HGF, hepatocyte growth factor  Hsp-90, Hitzeschockprotein-90, eines der am häufigsten vorkommenden Proteine in der Zelle
Hsp-90, Hitzeschockprotein-90, eines der am häufigsten vorkommenden Proteine in der Zelle  MAPK, mitogen-activated protein kinase
MAPK, mitogen-activated protein kinase  NLS, nuclear localization signal (Kernlokalisierungssignal), aus Aminosäuren bestehende Signalsequenz
NLS, nuclear localization signal (Kernlokalisierungssignal), aus Aminosäuren bestehende Signalsequenz  N-TAD, N-terminal transactivation domain (Transaktivierungsdomäne), Teilbereich eines Transkriptionsfaktor
N-TAD, N-terminal transactivation domain (Transaktivierungsdomäne), Teilbereich eines Transkriptionsfaktor  PHD, Prolyl-Hydroxylasen, katalysieren die Hydroxylierung von Prolylresten in Proteinen
PHD, Prolyl-Hydroxylasen, katalysieren die Hydroxylierung von Prolylresten in Proteinen  PI3K, Phosphoinositid 3-kinase, katalysiert die Phosphorylierung von Inositol in der Zellmembran
PI3K, Phosphoinositid 3-kinase, katalysiert die Phosphorylierung von Inositol in der Zellmembran  pVHL, Protein VHL (Von Hippel-Lindau)
pVHL, Protein VHL (Von Hippel-Lindau)  ROS, reactive oxygen species
ROS, reactive oxygen species Über HIF s. auch dort
Über HIF s. auch dort
 Abbildung).
Abbildung).  Gewebehypoxie (Sauerstoffmangel)
hemmt die verantwortlichen Enzyme (Hydroxylasen), wodurch
Gewebehypoxie (Sauerstoffmangel)
hemmt die verantwortlichen Enzyme (Hydroxylasen), wodurch 
 HIF-1
langsamer abgebaut wird,
HIF-1
langsamer abgebaut wird, 
 seine Aktivität steigt und die Erythropoese
zunimmt.
seine Aktivität steigt und die Erythropoese
zunimmt. 
 Folge: Hämatokrit, Sauerstofftransportvermögen des Blutes und
arterieller Sauerstoffpartialdruck nehmen zu (negative Rückkopplung).
Folge: Hämatokrit, Sauerstofftransportvermögen des Blutes und
arterieller Sauerstoffpartialdruck nehmen zu (negative Rückkopplung).  Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort
Zur Interaktiom von Darm (Resorption), Leber (Speicherung), Knochenmark (Erythropoese), Milz (Ery-Abbau) und Nieren (Erythropoetin) s. auch dort Die Freisetzung des Enzyms Renin (spaltet aus einem Globulin Angiotensin I ab) aus
juxtaglomerulären Zellen im vas afferens steht unter sympathischer
Kontrolle und wird lokal reguliert (Blutdruck, NaCl-Konzentration in
macula densa, tubulo-glomeruläres Feedback -
Die Freisetzung des Enzyms Renin (spaltet aus einem Globulin Angiotensin I ab) aus
juxtaglomerulären Zellen im vas afferens steht unter sympathischer
Kontrolle und wird lokal reguliert (Blutdruck, NaCl-Konzentration in
macula densa, tubulo-glomeruläres Feedback -  Abbildung). Die distalen
Tubuli resorbieren etwa 5% des glomerulär filtrierten Natriums (15-20 mM/min), und zwar unter Kontrolle des Aldosterons, das
(nicht nur in der Niere) Na+-Rückresorption und K+-Ausscheidung bewirkt. Die
Rückgewinnung von Natrium erfolgt durch
Abbildung). Die distalen
Tubuli resorbieren etwa 5% des glomerulär filtrierten Natriums (15-20 mM/min), und zwar unter Kontrolle des Aldosterons, das
(nicht nur in der Niere) Na+-Rückresorption und K+-Ausscheidung bewirkt. Die
Rückgewinnung von Natrium erfolgt durch  rasche Anregung des Na+/H+-Austausches (direkter Effekt),
rasche Anregung des Na+/H+-Austausches (direkter Effekt),
 Expression von Na+-Kanälen in der apikalen Membran der Tubuluszellen (verzögerter Effekt),
Expression von Na+-Kanälen in der apikalen Membran der Tubuluszellen (verzögerter Effekt),
 Erhöhung der Zahl von Na+-K+-ATPase-Molekülen in der basolateralen Membran (langfristig wirkender Effekt).
Erhöhung der Zahl von Na+-K+-ATPase-Molekülen in der basolateralen Membran (langfristig wirkender Effekt).

 Abbildung: Vitamin-D-Synthese
Abbildung: Vitamin-D-Synthese
 Vit. D (D-Hormon): Calcitriol induziert im Darm calcium-transportierende Proteine und steigert
so die Calciumaufnahme in den Körper.
Vit. D (D-Hormon): Calcitriol induziert im Darm calcium-transportierende Proteine und steigert
so die Calciumaufnahme in den Körper.  Abbildung):
Abbildung): in der Leber durch enzymatische Hydroxylierung zu Calcidiol und 24,25-(OH)2D3 und dann
in der Leber durch enzymatische Hydroxylierung zu Calcidiol und 24,25-(OH)2D3 und dann in der Niere zu Calcitriol (sowie inaktive Metabolite).
in der Niere zu Calcitriol (sowie inaktive Metabolite). 25-(OH)D3 mittels CYP27 B1 zum biologisch aktiven Calcitriol 1,25-(OH)2D3, und
25-(OH)D3 mittels CYP27 B1 zum biologisch aktiven Calcitriol 1,25-(OH)2D3, und mittels CYP24 A1 zur inaktiven Calcitroinsäure.
mittels CYP24 A1 zur inaktiven Calcitroinsäure.  Parathormon regt die Hydroxylierung über CYP27 B1 an und verursacht so eine Vitamin-D-Wirkung.
Parathormon regt die Hydroxylierung über CYP27 B1 an und verursacht so eine Vitamin-D-Wirkung. Die Niere bildet diverse Mediatoren: Kinine wirken gefäßerweiternd, fördern die Ureterperistaltik und wirken - teils über Prostaglandine - natriuretisch; damit fördern sie die Wasserausscheidung.
Die Niere bildet diverse Mediatoren: Kinine wirken gefäßerweiternd, fördern die Ureterperistaltik und wirken - teils über Prostaglandine - natriuretisch; damit fördern sie die Wasserausscheidung.  Die Niere baut Peptidhormone ab.
Die Niere baut Peptidhormone ab.
 Täglich werden
1-3 g Albumin filtriert (im Primärfiltrat ≤4
mg/l), aber
nur ~30 mg/d (1-2% der filtrierten Menge) ausgeschieden - der größte
Teil (~98%) wird über Megalin / Cubulin - Rezeptoren der Tubulusepithelien in Vesikel aufgenommen und lysosomal abgebaut. Peptide (bis ~40 Aminosäuren: Angiotensin, ANP, Gastrin, Glukagon, Parathormon, Hypophysenhormone) werden durch Peptidasen im Bürstensaum in Aminosäuren und Peptidfragmente zerlegt; Insulin wird endozytiert und lysosomal abgebaut (~50% des Insulins katabolisiert die Leber) Täglich werden
1-3 g Albumin filtriert (im Primärfiltrat ≤4
mg/l), aber
nur ~30 mg/d (1-2% der filtrierten Menge) ausgeschieden - der größte
Teil (~98%) wird über Megalin / Cubulin - Rezeptoren der Tubulusepithelien in Vesikel aufgenommen und lysosomal abgebaut. Peptide (bis ~40 Aminosäuren: Angiotensin, ANP, Gastrin, Glukagon, Parathormon, Hypophysenhormone) werden durch Peptidasen im Bürstensaum in Aminosäuren und Peptidfragmente zerlegt; Insulin wird endozytiert und lysosomal abgebaut (~50% des Insulins katabolisiert die Leber) Die Niere sezerniert nichtflüchtige Säuren (wie Phosphat, Citrat, Sulfat); ungepuffert würde der Harn-pH ~1,3 betragen (entsprechend ~70 mM H+ in ~1,5 Liter), Puffersysteme im Harn heben den Wert auf 5,4 (4,6-7,5). Glomerulär filtriertes Bicarbonat (~4500 mM/d) wird rückresorbiert (85% im proximalen - der zusätzlich Bicarbonat produziert -, 15% im distalen Tubulus). Bei
Alkalose sinkt die Bicarbonat- Rückresorption bis auf ~65%, bis
zu 35% des filtrierten Bicarbonats werden dann mit dem Harn ausgeschieden.
Die Bicarbonatsynthese erfolgt über den Ammonium- und
Phosphatmechanismus. Glomerulär filtriertes Phosphat wird zu 90% rückresorbiert; 10% werden ausgeschieden und dienen der Pufferung (pK-Wert 6,8 des primär / sekundären Phosphatsystems). Je saurer der Harn, desto mehr H+ puffert das Phosphat Die Niere sezerniert nichtflüchtige Säuren (wie Phosphat, Citrat, Sulfat); ungepuffert würde der Harn-pH ~1,3 betragen (entsprechend ~70 mM H+ in ~1,5 Liter), Puffersysteme im Harn heben den Wert auf 5,4 (4,6-7,5). Glomerulär filtriertes Bicarbonat (~4500 mM/d) wird rückresorbiert (85% im proximalen - der zusätzlich Bicarbonat produziert -, 15% im distalen Tubulus). Bei
Alkalose sinkt die Bicarbonat- Rückresorption bis auf ~65%, bis
zu 35% des filtrierten Bicarbonats werden dann mit dem Harn ausgeschieden.
Die Bicarbonatsynthese erfolgt über den Ammonium- und
Phosphatmechanismus. Glomerulär filtriertes Phosphat wird zu 90% rückresorbiert; 10% werden ausgeschieden und dienen der Pufferung (pK-Wert 6,8 des primär / sekundären Phosphatsystems). Je saurer der Harn, desto mehr H+ puffert das Phosphat Die Nieren (~0.5% des Körpergewichts) verbrauchen
~10%
des Ruheumsatzes - vor allem für den tubulären Transport von Salzen
(Na/K-ATPase in der basolateralen Membran) in der Rinde (9 ml O2/min/100g). Substrat
sind vor allem Fettsäuren, auch Ketonkörper: Proximale Tubuli
bilden aus α-Ketoglutarat Glucose. Sie sind auf kontinuierliche
Sauerstoffzufuhr angewiesen (keine glykolytische Kapazität), die
spezifische Durchblutung beträgt ~400 ml/min/100g (mehr als maximal
aktives Myokard) Die Nieren (~0.5% des Körpergewichts) verbrauchen
~10%
des Ruheumsatzes - vor allem für den tubulären Transport von Salzen
(Na/K-ATPase in der basolateralen Membran) in der Rinde (9 ml O2/min/100g). Substrat
sind vor allem Fettsäuren, auch Ketonkörper: Proximale Tubuli
bilden aus α-Ketoglutarat Glucose. Sie sind auf kontinuierliche
Sauerstoffzufuhr angewiesen (keine glykolytische Kapazität), die
spezifische Durchblutung beträgt ~400 ml/min/100g (mehr als maximal
aktives Myokard)  Erythropoetin aus peritubulären interstitiellen Zellen
wird auf lokale Hypoxie hin (verminderte Durchblutung,
Hämoglobinmangel, Höhenaufenthalt) freigesetzt und regt die Neubildung
roter Blutkörperchen im Knochenmark an, so erhöht sich die Zahl der
Erythrozyten und die O2-Transportkapazität. Der Transkriptionsfaktor Hyopoxia-inducible factor (HIF-1 in der Niere, HIF-2 in Niere und Leber) reguliert die Ablesung des Epo-Gens. Ohne Epo-Wirkung sinkt der Hämatokrit auf mindestens die Hälfte des Normalwertes Erythropoetin aus peritubulären interstitiellen Zellen
wird auf lokale Hypoxie hin (verminderte Durchblutung,
Hämoglobinmangel, Höhenaufenthalt) freigesetzt und regt die Neubildung
roter Blutkörperchen im Knochenmark an, so erhöht sich die Zahl der
Erythrozyten und die O2-Transportkapazität. Der Transkriptionsfaktor Hyopoxia-inducible factor (HIF-1 in der Niere, HIF-2 in Niere und Leber) reguliert die Ablesung des Epo-Gens. Ohne Epo-Wirkung sinkt der Hämatokrit auf mindestens die Hälfte des Normalwertes Renin
stammt aus juxtaglomerulären Zellen im vas afferens, dieses steht unter
sympathischer Kontrolle und wird lokal reguliert (Blutdruck, [NaCl] in
der macula densa, tubulo-glomeruläres Feedback). Über Angiotensin
steigt die Freisetzung von Aldosteron, unter dessen Wirkung das distale Tubulussystem
~5%
des glomerulär filtrierten Natriums resorbiert: Durch rasche Anregung
des Na/H-Austausches (direkter Effekt), Expression von Na+-Kanälen in
der apikalen Membran (verzögerter Effekt) sowie Vermehrung von
Na/K-ATPase in der basolateralen Membran (langfristiger Effekt) Renin
stammt aus juxtaglomerulären Zellen im vas afferens, dieses steht unter
sympathischer Kontrolle und wird lokal reguliert (Blutdruck, [NaCl] in
der macula densa, tubulo-glomeruläres Feedback). Über Angiotensin
steigt die Freisetzung von Aldosteron, unter dessen Wirkung das distale Tubulussystem
~5%
des glomerulär filtrierten Natriums resorbiert: Durch rasche Anregung
des Na/H-Austausches (direkter Effekt), Expression von Na+-Kanälen in
der apikalen Membran (verzögerter Effekt) sowie Vermehrung von
Na/K-ATPase in der basolateralen Membran (langfristiger Effekt)  Die Niere metabolisiert 25-(OH)D3 mittels des Zytochrom P-450-Enzyms CYP 27B1 zum biologisch aktiven Vit-D3-Hormon Calcitriol 1,25-(OH)2D3. Parathormon regt diese Hydroxylierung an. - Kinine werden von der Niere gebildet, diese wirken gefäßerweiternd, teils über Prostaglandine natriuretisch, und fördern die Ureterperistaltik Die Niere metabolisiert 25-(OH)D3 mittels des Zytochrom P-450-Enzyms CYP 27B1 zum biologisch aktiven Vit-D3-Hormon Calcitriol 1,25-(OH)2D3. Parathormon regt diese Hydroxylierung an. - Kinine werden von der Niere gebildet, diese wirken gefäßerweiternd, teils über Prostaglandine natriuretisch, und fördern die Ureterperistaltik |
