

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Funktionelle
Organisation des Lebergewebes
Funktionelle
Organisation des Lebergewebes
 Azinus: acinus (lat) = Beere, Traube; Drüsenbeere
Azinus: acinus (lat) = Beere, Traube; Drüsenbeere| Die
meisten im Darm resorbierten Stoffe gelangen über den
Pfortaderkreislauf direkt zur Leber. Hier werden sie gespeichert,
umgebaut, (in)aktiviert, für Syntheseprozesse verwendet - darum kümmern
sich die Hepatozyten. Andere (nichtparenchymale) Zellen übernehmen immunologische Schutz- und
Abwehrfunktionen. Auch endokrin ist die Leber aktiv (Hepatokine,
IGF). Die Leber bildet Gallesekret und nimmt damit u.a. an Fettverdauung (Gallensäuren) und Hämabbau teil (Gallenfarbstoffe). Als stark durchblutetes Organ ist die Leber sehr kreislaufwirksam (~30% des Ruhe-Herzminutenvolumens) und weist einen höheren spezifischen Sauerstoffverbrauch auf (>5 ml/min/100g) als das Gehirn (3,5 ml/min/100g). Auch im Säure-Basen-Gleichgewicht hat die Leber eine wichtige Position: Im periportalen Bereich baut sie den Großteil der Ammoniumionen zu Harnstoff um, im perivenösen Bereich baut sie Ammonium in Glutamat ein (dabei entsteht Glutamin). Die Stoffwechselleistung der Leberläppchen hängt vom lokalen Sauerstoffpartialdruck ab: Die sauerstoffreichen periportalen Felder konzentrieren sich auf die Synthese von Harnstoff, Cholesterin, Glucose und Gallensäuren, den oxidativen Energiemetabolismus sowie den Abbau von Aminosäuren und Glykogen; die sauerstoffärmeren perivenösen Felder auf Abbau, Entgiftung und Ausscheidung, Biotransformation, Glykolyse, Glutamin- und Lipidsynthese. |
 Leber und Kreislauf
Leber und Kreislauf  Galle: Produktion und Aufgaben
Galle: Produktion und Aufgaben  Säure-Basen-Haushalt
Säure-Basen-Haushalt  Mikrostruktur
Mikrostruktur Disse-Raum
Disse-Raum
 idg. Wurzel *(s)lei- kleben, beharren; Sitz des Lebens
idg. Wurzel *(s)lei- kleben, beharren; Sitz des Lebens
 Abbildung: Stoffwechselaufgaben der Leber und ihre Steuerung
Abbildung: Stoffwechselaufgaben der Leber und ihre Steuerung BCAA, Branched-Chain Amino Acid - die verzweigtkettigen essentiellen Aminosäuren Valin, Leuzin und Isoleuzin
BCAA, Branched-Chain Amino Acid - die verzweigtkettigen essentiellen Aminosäuren Valin, Leuzin und Isoleuzin
 FFA, Free Fatty Acid, freie Fettsäure - stammt aus dem Abbau von Triglyzeriden
FFA, Free Fatty Acid, freie Fettsäure - stammt aus dem Abbau von Triglyzeriden
 FGF, Fibroblastenwachstumsfaktor
FGF, Fibroblastenwachstumsfaktor
 GH, Wachstumshormon
GH, Wachstumshormon  TGs, Triglyzeride
TGs, Triglyzeride
 TH, TSH s. Schilddrüse
TH, TSH s. Schilddrüse
 HDL, LDL, VLDL, reverser Lipidtransport s. dort
HDL, LDL, VLDL, reverser Lipidtransport s. dort
 second messenger s. dort
second messenger s. dort
 Leber und Insulin s. dort
Leber und Insulin s. dort
 Leber und Glucagon s. dort
Leber und Glucagon s. dort 
 ), Biotransformation, Bildung und Sekretion der Galle, Abbau von Signalmolekülen (inkl. Hormonen), Säure-Basen-Regulation, Bildung verschiedener Signalstoffe, z.B. Zytokine. Da die Leberkapillaren (Sinusoide) fenestrierte Endothelien
haben und so nicht nur für Mikro-, sondern auch für Makromoleküle
durchgängig sind, haben Hepatozyten über den Disse-Raum zu allen diesen
Komponenten (und Nährstoffen) direkten Zugang.
), Biotransformation, Bildung und Sekretion der Galle, Abbau von Signalmolekülen (inkl. Hormonen), Säure-Basen-Regulation, Bildung verschiedener Signalstoffe, z.B. Zytokine. Da die Leberkapillaren (Sinusoide) fenestrierte Endothelien
haben und so nicht nur für Mikro-, sondern auch für Makromoleküle
durchgängig sind, haben Hepatozyten über den Disse-Raum zu allen diesen
Komponenten (und Nährstoffen) direkten Zugang. Abbildung). Die
Leber beteiligt sich an fast allen Stoffwechselvorgängen. Dabei ist
ihre Aktivität Rhythmen unterworfen:
Abbildung). Die
Leber beteiligt sich an fast allen Stoffwechselvorgängen. Dabei ist
ihre Aktivität Rhythmen unterworfen:  In der Resorptionsphase
(2-4 Stunden) nimmt sie im Überschuss aus dem Darm anflutende
Nährstoffe auf (in dieser Phase ist vor allem Insulin
wirksam). Die Entfernung im Darm resorbierten Zuckers aus dem Blut
(Pfortaderblut kann postprandial leicht 10 mM Glucose enthalten, mehr
als das Doppelte des Nüchternwerts) durch Umwandlung zu Glykogen in der
Leber bedeutet, dass der sonst unvermeidliche Anstieg der Osmolalität
im systemischen Kreislauf verhindert wird. Glucose wird auch zu Fett
umgebaut, das dann exportiert wird (s.
VLDL);
In der Resorptionsphase
(2-4 Stunden) nimmt sie im Überschuss aus dem Darm anflutende
Nährstoffe auf (in dieser Phase ist vor allem Insulin
wirksam). Die Entfernung im Darm resorbierten Zuckers aus dem Blut
(Pfortaderblut kann postprandial leicht 10 mM Glucose enthalten, mehr
als das Doppelte des Nüchternwerts) durch Umwandlung zu Glykogen in der
Leber bedeutet, dass der sonst unvermeidliche Anstieg der Osmolalität
im systemischen Kreislauf verhindert wird. Glucose wird auch zu Fett
umgebaut, das dann exportiert wird (s.
VLDL); in der Postresorptionsphase
stellt die Leber z.B. Glucose für ZNS (~6 g/h), Erythrozyten (~1,5
g/h), Nierenmark u.a. zur Verfügung (dazu bedient sie sich rasch auch
der Gluconeogenese).
in der Postresorptionsphase
stellt die Leber z.B. Glucose für ZNS (~6 g/h), Erythrozyten (~1,5
g/h), Nierenmark u.a. zur Verfügung (dazu bedient sie sich rasch auch
der Gluconeogenese). 
 Abbildung: Mikrostruktur der Leber
Abbildung: Mikrostruktur der Leber
 Speicherung / Bereitstellung von Blut
Speicherung / Bereitstellung von Blut Bildung von Gallenflüssigkeit - Ausscheidung und Beteiligung an Verdauungsvorgängen
Bildung von Gallenflüssigkeit - Ausscheidung und Beteiligung an Verdauungsvorgängen Bildung von Hormonen, wie IGF-1 (IGF-Rezeptoren werden von fast allen Zellen des Körpers exprimiert), Angiotensinogen (die Leber ist die primäre Angiotensinogenquelle), Hepcidin, Thrombopoetin
Bildung von Hormonen, wie IGF-1 (IGF-Rezeptoren werden von fast allen Zellen des Körpers exprimiert), Angiotensinogen (die Leber ist die primäre Angiotensinogenquelle), Hepcidin, Thrombopoetin Aktivierung von Hormonen, z.B. von Vitamin D (25-Hydroxylierung durch CYP-Oxidasen zu Calcidiol und Speicherung) oder die Umformung von T4 zu T3 (Leberzellen exprimieren Dejodinase 1)
Aktivierung von Hormonen, z.B. von Vitamin D (25-Hydroxylierung durch CYP-Oxidasen zu Calcidiol und Speicherung) oder die Umformung von T4 zu T3 (Leberzellen exprimieren Dejodinase 1)  Inaktivierung
von Hormonen, z.B. von Insulin (nur die Hälfte des im Pankreas
gebildeten Insulins "entkommt" dem Abbau bei der hepatischen Passage),
Vasopressin, Aldosteron, Östrogenen, Schilddrüsenhormone (Konjugation mit Sulfat oder Glucuronsäure)
Inaktivierung
von Hormonen, z.B. von Insulin (nur die Hälfte des im Pankreas
gebildeten Insulins "entkommt" dem Abbau bei der hepatischen Passage),
Vasopressin, Aldosteron, Östrogenen, Schilddrüsenhormone (Konjugation mit Sulfat oder Glucuronsäure)| Endokrine Funktionen der Leber Nach Rhyu J, Yu R. Newly discovered endocrine functions of the liver. World J Hepatol 2021; 13: 1611-28 |
|||
| Hormon |
Funktion (Leber) |
Zielorgan(e) |
Wirkung an Zielorganen |
| 25-OH-D |
Produktion |
Darm |
Prohormon von Calcitriol |
| IGF1 |
Produktion |
weit verbreitet |
Anregung Wachstum und Differenzierung |
| Angiotensinogen |
Produktion |
Kreislauf |
Vorläufer Angiotensin II (Gefäßtonus, Natriumresorption) |
| Schilddrüsenhormon |
T4 → T3 Inaktivierung TBG-Produktion |
weit verbreitet | Stoffwechsel Energiebildung |
| GLP-1 |
Abbau |
Darm, Pankreas, Gehirn |
Insulinbildung + Darmmotilität - Appetit - |
| Sexualhormone |
Metabolismus SHBG-Produktion |
weit verbreitet | zahlreich |
| Glucocorticoide |
Metabolismus Transcortinproduktion |
weit verbreitet | zahlreich |
| Mineralcorticoide |
Metabolismus | Kreislauf |
Elektrolythaushalt Blutdruck |
 Bildung verschiedener Gerinnungsfaktoren
Bildung verschiedener Gerinnungsfaktoren  Synthese hormonbindender Proteine, wie das sexhormon-bindende Globulin SHBP und das thyroxinbindende Globulin TBG
Synthese hormonbindender Proteine, wie das sexhormon-bindende Globulin SHBP und das thyroxinbindende Globulin TBG Synthese verschiedener Transportproteine (Albumin, diverse Globuline)
Synthese verschiedener Transportproteine (Albumin, diverse Globuline) Bildung von Protease-Inhibitoren, insbesondere von α1-Antitrypsin, das vor der Wirkung von Enzymen schützt, die im Rahmen entzündlicher Vorgänge entstehen (z.B. Elastase aus Neutrophilen)
Bildung von Protease-Inhibitoren, insbesondere von α1-Antitrypsin, das vor der Wirkung von Enzymen schützt, die im Rahmen entzündlicher Vorgänge entstehen (z.B. Elastase aus Neutrophilen) Bildung von Hepatokinen (mit diesen kann die Leber hormonell auf den Glucosestoffwechsel einwirken):
Bildung von Hepatokinen (mit diesen kann die Leber hormonell auf den Glucosestoffwechsel einwirken): Fetuine, Bindeproteine wie Albumin, die besonders in fötalem Blutplasma zu finden sind (daher der Name). Fetuin-A ist ein α2-Glykoprotein,
das die Leber bei hohem Blutzuckerspiegel und Überernährung bildet. Es
reduziert die Insulinwirkung in Leber- (parakrin) und Muskelgewebe
(endokrin), ruft also einen Zustand der Insulinresistenz hervor; die Glucoseaufnahme in die Zellen wird verringert
Fetuine, Bindeproteine wie Albumin, die besonders in fötalem Blutplasma zu finden sind (daher der Name). Fetuin-A ist ein α2-Glykoprotein,
das die Leber bei hohem Blutzuckerspiegel und Überernährung bildet. Es
reduziert die Insulinwirkung in Leber- (parakrin) und Muskelgewebe
(endokrin), ruft also einen Zustand der Insulinresistenz hervor; die Glucoseaufnahme in die Zellen wird verringert FGF-21 (Fibroblasten-Wachstumsfaktor 21) wirkt ebenfalls auf Insulinsensitivität und Glucoseaufnahme (beim Menschen vermutlich ähnlich wie Fetuin-A)
FGF-21 (Fibroblasten-Wachstumsfaktor 21) wirkt ebenfalls auf Insulinsensitivität und Glucoseaufnahme (beim Menschen vermutlich ähnlich wie Fetuin-A) Betatrophin (Lipasin) fördert die Proliferation pankreatischer ß-Zellen
Betatrophin (Lipasin) fördert die Proliferation pankreatischer ß-Zellen Metabolische Aufgaben:
Metabolische Aufgaben: Speicherung / Bereitstellung von Vitaminen und Spurenelementen, z.B. Eisen
Speicherung / Bereitstellung von Vitaminen und Spurenelementen, z.B. Eisen  Beteiligung am Säure-Basen-Haushalt
Beteiligung am Säure-Basen-Haushalt Beteiligung an Immunfunktionen. Zu diesen Aufgaben gehören
Beteiligung an Immunfunktionen. Zu diesen Aufgaben gehören Phagozytose: Kupffer-Zellen "fangen" Viren, Bakterien oder Parasiten
aus der Blutbahn, bevor sie nach einem Eindringen in die v. portae in
den systemischen Kreislauf gelangen
Phagozytose: Kupffer-Zellen "fangen" Viren, Bakterien oder Parasiten
aus der Blutbahn, bevor sie nach einem Eindringen in die v. portae in
den systemischen Kreislauf gelangen Proteinsynthese: Die Leber synthetisiert Komponenten des angeborenen Abwehrsystems, wie Komplementfaktoren oder C-reaktives Protein
Proteinsynthese: Die Leber synthetisiert Komponenten des angeborenen Abwehrsystems, wie Komplementfaktoren oder C-reaktives Protein Entzündungsreaktion: Kupffer-Zellen können proinflammatorische Zytokine bilden und dadurch entzündliche Abwehrreaktionen triggern
Entzündungsreaktion: Kupffer-Zellen können proinflammatorische Zytokine bilden und dadurch entzündliche Abwehrreaktionen triggern Beteiligung am Körperwachstum - Rolle bei der Wachstumsregulierung: Expression von IGFs als auch die von IGF-Bindungsproteinen unterliegt der Kontrolle durch GH
Beteiligung am Körperwachstum - Rolle bei der Wachstumsregulierung: Expression von IGFs als auch die von IGF-Bindungsproteinen unterliegt der Kontrolle durch GH s. dort) durch die Zellmembran von Hepatozyten.
s. dort) durch die Zellmembran von Hepatozyten. Mehr zur Durchblutung der Leber s. dort
Mehr zur Durchblutung der Leber s. dort
 Abbildung: Blutversorgung der Leber
Abbildung: Blutversorgung der Leber
 Das Pfortaderblut bringt resorbierte Stoffe aus dem Darm und beteiligt
sich zu 70-75% an der Perfusion, aber nur zu 50-60% an der Sauerstoffversorgung der Leber (Pfortaderblut hat ~65% Sauerstoffsättigung, arterielles fast 100%).
Das Pfortaderblut bringt resorbierte Stoffe aus dem Darm und beteiligt
sich zu 70-75% an der Perfusion, aber nur zu 50-60% an der Sauerstoffversorgung der Leber (Pfortaderblut hat ~65% Sauerstoffsättigung, arterielles fast 100%). Die restlichen 25-30% sind arterielles Blut (Aufzweigungen der a.
hepatica), das zu 40-50% zur Sauerstoffversorgung der Leber beiträgt. Spezielle
Widerstandsgefäße
(lange Arteriolen → relativ hoher Reibungsverlust) reduzieren den
Blutdruck in diesen Gefäßen von arteriellen (~100 mmHg) auf venöse
Blutdruckwerte (≤10 mmHg), bevor das Blut in die Sinusoide eintritt.
Die restlichen 25-30% sind arterielles Blut (Aufzweigungen der a.
hepatica), das zu 40-50% zur Sauerstoffversorgung der Leber beiträgt. Spezielle
Widerstandsgefäße
(lange Arteriolen → relativ hoher Reibungsverlust) reduzieren den
Blutdruck in diesen Gefäßen von arteriellen (~100 mmHg) auf venöse
Blutdruckwerte (≤10 mmHg), bevor das Blut in die Sinusoide eintritt. Als Disse-Raum
Als Disse-Raum  (perisinusoidal space)
bezeichnet man den extrazellulären Spaltraum zwischen der basolateralen
Zellmembran von Hepatozyten einerseits und sinusoidalen Endothelzellen
andererseits. Die basolateralen Membranen der Hepatozyten haben
Mikrovilli, welche die Fläche zum Disse-Raum um ein Mehrfaches
vergrößern und den Austausch von Stoffen mit dem Blut intensivieren.
(perisinusoidal space)
bezeichnet man den extrazellulären Spaltraum zwischen der basolateralen
Zellmembran von Hepatozyten einerseits und sinusoidalen Endothelzellen
andererseits. Die basolateralen Membranen der Hepatozyten haben
Mikrovilli, welche die Fläche zum Disse-Raum um ein Mehrfaches
vergrößern und den Austausch von Stoffen mit dem Blut intensivieren. Unter Ruhebedingungen stammt etwa die Hälfte der
im ganzen Körper produzierten Lymphflüssigkeit aus der Leber.
Unter Ruhebedingungen stammt etwa die Hälfte der
im ganzen Körper produzierten Lymphflüssigkeit aus der Leber. Abbildung: Strukturierung von Leberläppchen
Abbildung: Strukturierung von Leberläppchen
 Ausscheidung
zahlreicher Stoffe, die nicht über die Nieren entfernt werden (können)
- u.a. weil sie nach allfälliger glomerulärer Filtration tubulär
rückresorbiert werden, z.B. Gallensäuren -, wie Cholesterin,
Gallenfarbstoffe, lipophile Substanzen (u.a. Medikamente, pflanzliche
Sterole), oxidiertes Glutathion, Antigen-Antikörper-Komplexe u.a.
Ausscheidung
zahlreicher Stoffe, die nicht über die Nieren entfernt werden (können)
- u.a. weil sie nach allfälliger glomerulärer Filtration tubulär
rückresorbiert werden, z.B. Gallensäuren -, wie Cholesterin,
Gallenfarbstoffe, lipophile Substanzen (u.a. Medikamente, pflanzliche
Sterole), oxidiertes Glutathion, Antigen-Antikörper-Komplexe u.a.  Bereitstellung von gallensauren Salzen bzw. Gallensäuren für Fettverdauung und -resorption.
Bereitstellung von gallensauren Salzen bzw. Gallensäuren für Fettverdauung und -resorption. sezernierte
Gallenflüssigkeit gelangt etwa zur Hälfte direkt in den Darm und zur
Hälfte in die Gallenblase.
sezernierte
Gallenflüssigkeit gelangt etwa zur Hälfte direkt in den Darm und zur
Hälfte in die Gallenblase.  Dieser Anteil an primärer ("Leber"-) Galle
kann hier innerhalb von ~4 Stunden auf 10% des ursprünglichen Volumens
eingedickt werden ("Blasengalle").
Dieser Anteil an primärer ("Leber"-) Galle
kann hier innerhalb von ~4 Stunden auf 10% des ursprünglichen Volumens
eingedickt werden ("Blasengalle").  Mehr zu Sekretion, Transport und Funktion des Gallensafts s. dort
Mehr zu Sekretion, Transport und Funktion des Gallensafts s. dort 70-95% des NH4+ werden im periportalen Feld, d.h. in sauerstoffreichen
Teilen der Leberläppchen unter Verbrauch von Bicarbonat in Harnstoff umgewandelt,
70-95% des NH4+ werden im periportalen Feld, d.h. in sauerstoffreichen
Teilen der Leberläppchen unter Verbrauch von Bicarbonat in Harnstoff umgewandelt,  der Rest (5-30%) im sauerstoffärmeren perivenösen Feld zur Bildung von Glutamin aus Glutamat verwendet.
der Rest (5-30%) im sauerstoffärmeren perivenösen Feld zur Bildung von Glutamin aus Glutamat verwendet.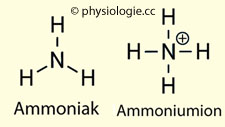

 Ammonium im Serum:
Erhöhte Werte sind fast immer auf gestörte Ausscheidung (Erkrankungen
der Leber) zurückzuführen. Schon Konzentrationen von weniger als 100
µM wirken neurotoxisch
(Händezittern, Sprachstörungen, eingeschränktes Sehvermögen,
Verwirrtheitszustände, bei höheren Dosen Bewusstseinsverlust, Koma).
Ammonium im Serum:
Erhöhte Werte sind fast immer auf gestörte Ausscheidung (Erkrankungen
der Leber) zurückzuführen. Schon Konzentrationen von weniger als 100
µM wirken neurotoxisch
(Händezittern, Sprachstörungen, eingeschränktes Sehvermögen,
Verwirrtheitszustände, bei höheren Dosen Bewusstseinsverlust, Koma). Abbildung):
Abbildung):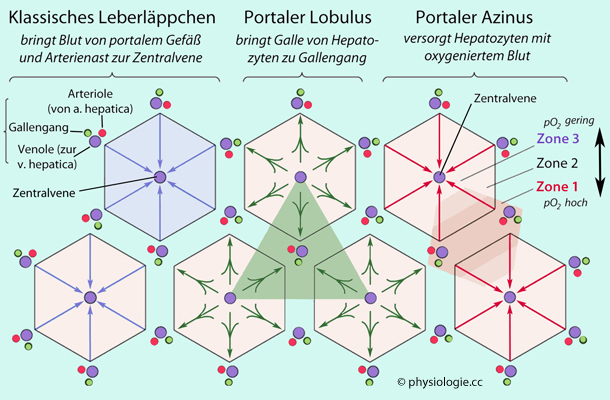
 Abbildung: Organisation des Lebergewebes
Abbildung: Organisation des Lebergewebes
 Einerseits ist das (klassische) Leberläppchen (hepatic lobule)
das Zustromgebiet zu einer (zentral gelegenen) Vene - Zellbalken sind
hier radiär um die Vene angeordnet, an der Peripherie liegen (jeweils
in einem Glisson'schen Dreieck
Einerseits ist das (klassische) Leberläppchen (hepatic lobule)
das Zustromgebiet zu einer (zentral gelegenen) Vene - Zellbalken sind
hier radiär um die Vene angeordnet, an der Peripherie liegen (jeweils
in einem Glisson'schen Dreieck )
eine Arterie, interlobuläre Vene und ein Gallengang (ductus
interlobularis) als portale Trias ("Lebertrias"). Das Kriterium für
diese Sicht ist die Blutströmung.
)
eine Arterie, interlobuläre Vene und ein Gallengang (ductus
interlobularis) als portale Trias ("Lebertrias"). Das Kriterium für
diese Sicht ist die Blutströmung.  Andererseits bietet sich als funktionelle Einheit der portale Acinus (liver acinus) an: Dieses Konzept orientiert sich am Sauerstoffpartialdruck,
der von Zone 1 (Nähe zu arteriellen Gefäßen) zu Zone 3 (Gegend der
Zentralvene) abnimmt und dementsprechend unterschiedliche metabolische
Schwerpunkte aufweist (Zone 1 z.B. ß-Oxidation, Zone 3 z.B. Entgiftung,
s. unten).
Andererseits bietet sich als funktionelle Einheit der portale Acinus (liver acinus) an: Dieses Konzept orientiert sich am Sauerstoffpartialdruck,
der von Zone 1 (Nähe zu arteriellen Gefäßen) zu Zone 3 (Gegend der
Zentralvene) abnimmt und dementsprechend unterschiedliche metabolische
Schwerpunkte aufweist (Zone 1 z.B. ß-Oxidation, Zone 3 z.B. Entgiftung,
s. unten). Orientiert man sich an der Strömung der Galle, steht das Konzept des portalen Lobulus (portal lobule) im Vordergrund (und die portale Trias im Zentrum).
Orientiert man sich an der Strömung der Galle, steht das Konzept des portalen Lobulus (portal lobule) im Vordergrund (und die portale Trias im Zentrum). Ein klassisches Leberläppchen ist das Drainagegebiet zu einer (hepatischen,
"zentralen") Venole und kann sechseckig gedacht werden (Drainage des
Blutes von bis zu 6 hepatischen Arteriolen und Portalvenen im
periportalen Feld, s.
Ein klassisches Leberläppchen ist das Drainagegebiet zu einer (hepatischen,
"zentralen") Venole und kann sechseckig gedacht werden (Drainage des
Blutes von bis zu 6 hepatischen Arteriolen und Portalvenen im
periportalen Feld, s.  Abbildung oben).
Abbildung oben).  Ein portaler Lobulus ist das Drainagegebiet zu einem Gallengang und kann als Dreieck gedacht
werden, dessen Eckpunkte drei Zentralvenen darstellen. Sein Mittelpunkt
ist eine portale Triade (=Arterie, Portalvene, Gallenkanälchen).
Ein portaler Lobulus ist das Drainagegebiet zu einem Gallengang und kann als Dreieck gedacht
werden, dessen Eckpunkte drei Zentralvenen darstellen. Sein Mittelpunkt
ist eine portale Triade (=Arterie, Portalvene, Gallenkanälchen). Ein portaler Azinus
Ein portaler Azinus  ist etwa rautenförmig - außen liegen Zentralvenen (Zone 3), innen
zwei portale Triaden (Zone 1). Das Modell des
portalen Azinus orientiert sich am Gefälle des Sauerstoffpartialdrucks im Lebergewebe.
ist etwa rautenförmig - außen liegen Zentralvenen (Zone 3), innen
zwei portale Triaden (Zone 1). Das Modell des
portalen Azinus orientiert sich am Gefälle des Sauerstoffpartialdrucks im Lebergewebe. 
 Zone 1 nahe der
Leberarteriole (periportal) weist einen hohen Sauerstoffpartialdruck auf und
konzentriert sich auf oxidativen Metabolismus. Diese Zellen sind
besonders resistent (sie sind aus dem Darm kommenden Stoffen direkt ausgesetzt). Hier überwiegen
Zone 1 nahe der
Leberarteriole (periportal) weist einen hohen Sauerstoffpartialdruck auf und
konzentriert sich auf oxidativen Metabolismus. Diese Zellen sind
besonders resistent (sie sind aus dem Darm kommenden Stoffen direkt ausgesetzt). Hier überwiegen Synthese
von Harnstoff (aus Ammoniak: Harnstoffzyklus), Cholesterin (eine der
kompliziertesten Biosynthesen), Glucose (Gluconeogenese), Gallensäuren
Synthese
von Harnstoff (aus Ammoniak: Harnstoffzyklus), Cholesterin (eine der
kompliziertesten Biosynthesen), Glucose (Gluconeogenese), Gallensäuren
 ß-Oxidation
(Abbau der Fettsäuren - liefert Acetyl-CoA), oxidativer
Energiemetabolismus (Abbau von Acetyl-CoA aus Kohlenhydraten, Lipiden,
Aminosäuren → Energie, CO2, Reduktionsäquivalente - NADH/H+, FADH2)
ß-Oxidation
(Abbau der Fettsäuren - liefert Acetyl-CoA), oxidativer
Energiemetabolismus (Abbau von Acetyl-CoA aus Kohlenhydraten, Lipiden,
Aminosäuren → Energie, CO2, Reduktionsäquivalente - NADH/H+, FADH2) Abbau
von Aminosäuren (Transaminierung entfernt die Aminogruppe, die
entstehende Ketosäure wird decarboxyliert), Glykogen
Abbau
von Aminosäuren (Transaminierung entfernt die Aminogruppe, die
entstehende Ketosäure wird decarboxyliert), Glykogen  Zone 2 ist ein Übergangsgebiet mit gemischter Funktion.
Sauerstoffpartialdruck und Syntheseprofile liegen zwischen denen der
Zone 1 und Zone 3.
Zone 2 ist ein Übergangsgebiet mit gemischter Funktion.
Sauerstoffpartialdruck und Syntheseprofile liegen zwischen denen der
Zone 1 und Zone 3. Zone 3 nahe der Zentralvene (perivenös) weist den geringsten Sauerstoffpartialdruck auf und konzentriert sich auf Detoxifizierung. In diesem Gebiet finden vorwiegend folgende Vorgänge statt:
Zone 3 nahe der Zentralvene (perivenös) weist den geringsten Sauerstoffpartialdruck auf und konzentriert sich auf Detoxifizierung. In diesem Gebiet finden vorwiegend folgende Vorgänge statt: Synthese von Glutamin
(Glutamin-Synthetase,
Synthese von Glutamin
(Glutamin-Synthetase,  Abbildung), Lipiden (Lipogenese - vollständig im
Zytoplasma, in Kombination mit dem Pentosephosphatweg, der das dazu notwendige NADPH/H+ liefert. Die Leber ist ein Hauptproduzent von Lipiden), Glykogen (hepatische Reserve), evt. Ketonkörpern
Abbildung), Lipiden (Lipogenese - vollständig im
Zytoplasma, in Kombination mit dem Pentosephosphatweg, der das dazu notwendige NADPH/H+ liefert. Die Leber ist ein Hauptproduzent von Lipiden), Glykogen (hepatische Reserve), evt. Ketonkörpern Glykolyse (Abbau von Glucose bis Pyruvat)
Glykolyse (Abbau von Glucose bis Pyruvat) Abbau / Entgiftung / Ausscheidung (Biotransformation: Hormone, Medikamente, Alkohol, Toxine ..)
Abbau / Entgiftung / Ausscheidung (Biotransformation: Hormone, Medikamente, Alkohol, Toxine ..)


 Zu den Aufgaben
der Leber zählen Energie-, Hunger-, Lipidstoffwechsel; Proteinsynthese;
Gallesekretion; Blutspeicher; Aktivierung / Inaktivierung / Entgiftung
von Hormonen, Medikamenten, Toxinen; Speicherung von Glykogen, Eiweiß,
Vitaminen und Spurenelementen; Beteiligung am Wachstum (Expression von IGFs, IGF-Bindungsproteinen). Hunderte
Gene werden dazu situationsabhängig aktiviert. Die Leber ist nachts besonders aktiv
(zirkadianer Rhythmus). Substratabhängige, autonom-nervöse und
endokrine Signale steuern die Leberfunktionen (z.B. Speicherung vs.
Entspeicherung) Zu den Aufgaben
der Leber zählen Energie-, Hunger-, Lipidstoffwechsel; Proteinsynthese;
Gallesekretion; Blutspeicher; Aktivierung / Inaktivierung / Entgiftung
von Hormonen, Medikamenten, Toxinen; Speicherung von Glykogen, Eiweiß,
Vitaminen und Spurenelementen; Beteiligung am Wachstum (Expression von IGFs, IGF-Bindungsproteinen). Hunderte
Gene werden dazu situationsabhängig aktiviert. Die Leber ist nachts besonders aktiv
(zirkadianer Rhythmus). Substratabhängige, autonom-nervöse und
endokrine Signale steuern die Leberfunktionen (z.B. Speicherung vs.
Entspeicherung)  In der Resorptionsphase (2-4 Stunden) nimmt die Leber Nährstoffe aus
dem Darm auf und baut Zucker zu Fett um; in der
Postresorptionsphase stellt die Leber Glucose für Gehirn, Erythrozyten, Nebennieren
u.a. zur Verfügung. Die
meisten metabolischen Aufgaben übernehmen Hepatozyten: Um-, Ab-,
Neuaufbau von Nährstoffen, Bereitstellung von Energieträgern (Glucose,
Fettsäuren, Ketonkörper ), Biotransformation, Gallebildung,
Säure-Basen-Regulation, Bildung von Hepatokinen, Abbau von Hormonen,
Zytokinen u.a. Nichtparenchymzellen (Endothel, Kupffer'sche
Sternzellen, Stellatumzellen) übernehmen Phagozytose, Toxinelimination, Antigenpräsentation, Perfusionssteuerung,
Vitaminspeicherung In der Resorptionsphase (2-4 Stunden) nimmt die Leber Nährstoffe aus
dem Darm auf und baut Zucker zu Fett um; in der
Postresorptionsphase stellt die Leber Glucose für Gehirn, Erythrozyten, Nebennieren
u.a. zur Verfügung. Die
meisten metabolischen Aufgaben übernehmen Hepatozyten: Um-, Ab-,
Neuaufbau von Nährstoffen, Bereitstellung von Energieträgern (Glucose,
Fettsäuren, Ketonkörper ), Biotransformation, Gallebildung,
Säure-Basen-Regulation, Bildung von Hepatokinen, Abbau von Hormonen,
Zytokinen u.a. Nichtparenchymzellen (Endothel, Kupffer'sche
Sternzellen, Stellatumzellen) übernehmen Phagozytose, Toxinelimination, Antigenpräsentation, Perfusionssteuerung,
Vitaminspeicherung Lange Arteriolen gleichen den Druck vom arteriellen (~100 mmHg) auf den
Wert in Lebersinusoiden (≤10 mmHg) an; die Leberlymphe (aus Disse-Räumen) ist sehr
proteinreich; die Leber produziert den Großteil der Plasmaproteine. Der Sauerstoffverbrauch der Leber (~4-5 ml/100 g/min)
beträgt ~20% des gesamten Ruheverbrauchs des Körpers in Ruhe Lange Arteriolen gleichen den Druck vom arteriellen (~100 mmHg) auf den
Wert in Lebersinusoiden (≤10 mmHg) an; die Leberlymphe (aus Disse-Räumen) ist sehr
proteinreich; die Leber produziert den Großteil der Plasmaproteine. Der Sauerstoffverbrauch der Leber (~4-5 ml/100 g/min)
beträgt ~20% des gesamten Ruheverbrauchs des Körpers in Ruhe Gallenflüssigkeit entsteht zu 80% in Hepatozyten, 20% im
Gallengangepithel - täglich ~700 ml ("Lebergalle"). Sie gelangt zur
Hälfte direkt in den Darm, zur Hälfte in die Gallenblase - und wird
innerhalb von ~4 Stunden auf ~10% des ursprünglichen Volumens
eingedickt ("Blasengalle"). Mit dem Ammonium-Mechanismus beteiligt sich
die Leber am Säure-Basen-Haushalt: Der Großteil des
Gallenflüssigkeit entsteht zu 80% in Hepatozyten, 20% im
Gallengangepithel - täglich ~700 ml ("Lebergalle"). Sie gelangt zur
Hälfte direkt in den Darm, zur Hälfte in die Gallenblase - und wird
innerhalb von ~4 Stunden auf ~10% des ursprünglichen Volumens
eingedickt ("Blasengalle"). Mit dem Ammonium-Mechanismus beteiligt sich
die Leber am Säure-Basen-Haushalt: Der Großteil desAmmoniums aus dem Proteinabbau wird unter Verbrauch von Bicarbonat in Harnstoff umgewandelt, der Rest zur Bildung von Glutamin (aus Glutamat) verwendet. Bei Azidose verlagert sich die Stickstoffausscheidung in Richtung Ammonium (normalerweise ~40 mM/d), bei Alkalose in Richtung Harnstoff (~450 mM/d)  50-100 tausend klassische Leberläppchen empfangen Blut von bis zu 6 hepatischen Arteriolen und Portalvenen im periportalen Feld. Portale Lobuli drainieren zu einem Gallengang, ihr Mittelpunkt ist eine portale Triade (Arterie, Portalvene, Gallenkanälchen). Portale Azini sind nach dem
Gefälle des Sauerstoffpartialdrucks orientiert (Zone 1 nahe einer
Arteriole konzentriert sich auf oxidativen Metabolismus: Harnstoff-,
Cholesterin-, Gallensäurensynthese, Glykogenolyse, Gluconeogenese,
ß-Oxidation, Transaminierungen; Zone 3 nahe der Zentralvene:
Detoxifizierung, Glutaminsynthese, Ketonkörperbildung. Die
Zonen-Spezialisierung kann sich entsprechend dem Sauerstoffangebot
verändern 50-100 tausend klassische Leberläppchen empfangen Blut von bis zu 6 hepatischen Arteriolen und Portalvenen im periportalen Feld. Portale Lobuli drainieren zu einem Gallengang, ihr Mittelpunkt ist eine portale Triade (Arterie, Portalvene, Gallenkanälchen). Portale Azini sind nach dem
Gefälle des Sauerstoffpartialdrucks orientiert (Zone 1 nahe einer
Arteriole konzentriert sich auf oxidativen Metabolismus: Harnstoff-,
Cholesterin-, Gallensäurensynthese, Glykogenolyse, Gluconeogenese,
ß-Oxidation, Transaminierungen; Zone 3 nahe der Zentralvene:
Detoxifizierung, Glutaminsynthese, Ketonkörperbildung. Die
Zonen-Spezialisierung kann sich entsprechend dem Sauerstoffangebot
verändern |
