




Follikel: folliculus = Hülle, Hülse, Ledersack
Pendrin: Vaughan Pendred
Plummerung: Henry S. Plummer
Thyreoidea: θυρεός = türähnliches (θυρα = Türe) Schild (Schilddrüse), εἶδος = ähnlich, verwandt
Transthyretin: transports thyroxine and retinol
Wolff-Chaikoff-Effekt: Israel Chaikoff
| Trijodthyronin (T3) ist die biologisch aktive, Thyroxin
(T4) die Transportform (Blut) des Schilddrüsenhormons. Beide Formen sind im
Extrazellulärraum weitgehend an Protein gebunden; T3 zu ≥99,5%
(Halbwertszeit ein Tag), T4 sogar zu ≥99,95% (Halbwertszeit eine Woche). Die Konstruktion der Schilddrüse ist - angesichts schwankenden Jodangebotes in der Ernährung - auf Speicherkapazität ausgelegt: Die hormonbildenden Epithelzellen sind um einen zentralen Follikel angeordnet, in dessen Matrix (das Kolloid) sie ein Trägereiweiß (das Thyreoglobulin) produzieren, auf dem die Hormonmoleküle zusammengesetzt und jodiert werden. Wird Hormon im Organismus benötigt, resorbieren die Epithelzellen aus diesem Speicher und reichen T3/T4 an das Blut weiter. Das hypothalamisch-hypophysäre System mit seinen Steuersubstanzen TRH (magnozelluläre Zellen im nucl. paraventricularis) / TSH (Adenohypophyse) reagiert auf den aktuellen T4/T3-Spiegel im Blut und wird von zahlreichen weiteren Faktoren beeinflusst; beispielsweise regt Leptin die Expression von TRH (und damit den Stoffwechsel) an. Das Wirkungsspektrum der Schilddrüsenhormone ist enorm breit: Dazu gehören -- Förderung von Entwicklung, Differenzierung und Wachstum -- Stimulierung des Stoffwechsels -- Anregung von Sauerstoffverbrauch, Atmung und Kreislauf -- Förderung der Hirnentwicklung -- Steigerung der Körpertemperatur -- Beschleunigung der Muskelfunktion. |
 Bildung, Jodierung, Transport & Ausscheidung
Bildung, Jodierung, Transport & Ausscheidung  Aktivierung und Inaktivierung
Aktivierung und Inaktivierung  Transport und Regulation
Transport und Regulation  Blutwerte
Blutwerte  Wirkungen
Wirkungen
 Core messages
Core messages Als
Medikament ist T4 voll wirksam, da es im Gewebe in T3 umgewandelt wird.
Es kann per os genommen werden, da es im oberen Dünndarm zu ca. 60-80%
resorbiert wird.
Als
Medikament ist T4 voll wirksam, da es im Gewebe in T3 umgewandelt wird.
Es kann per os genommen werden, da es im oberen Dünndarm zu ca. 60-80%
resorbiert wird.
 Abbildung: Morphologie der Schilddrüse
Abbildung: Morphologie der Schilddrüse
 -
gebunden an ein Eiweiß, Thyreoglobulin,
im Kolloid - gespeichert, um
bei Bedarf
rasch abgegeben werden zu können. Thyreoglobulin wird von
Follikelepithelzellen exozytiert und auch wieder endozytiert, so kann
es je nach Bedarf zwischen Intra- und Extrazellulärraum pendeln.
-
gebunden an ein Eiweiß, Thyreoglobulin,
im Kolloid - gespeichert, um
bei Bedarf
rasch abgegeben werden zu können. Thyreoglobulin wird von
Follikelepithelzellen exozytiert und auch wieder endozytiert, so kann
es je nach Bedarf zwischen Intra- und Extrazellulärraum pendeln.| In der Schilddrüse befinden sich kolloidgefüllte Follikel (0,02 bis ~1 mm Durchmesser) |
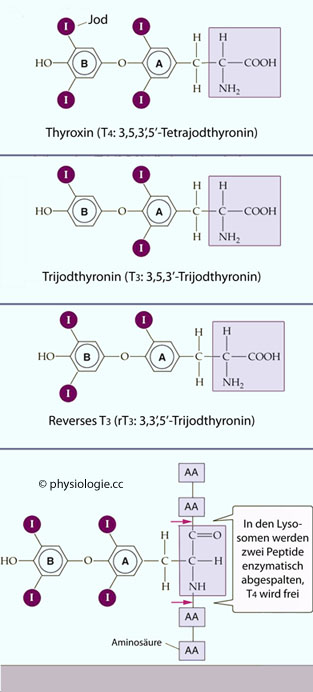
 Abbildung: Struktur von T4, T3 und rT3
Abbildung: Struktur von T4, T3 und rT3 s. unten).
s. unten).
 hormonellen Kontrolle durch TSH (
hormonellen Kontrolle durch TSH ( Abbildung unten)
Abbildung unten) noradrenerg (Anregung der Hormonproduktion),
noradrenerg (Anregung der Hormonproduktion),  cholinerg (Hemmung der Hormonproduktion) und
cholinerg (Hemmung der Hormonproduktion) und  peptiderg (VIP: Verstärkung TSH-induzierter Hormonproduktion)
peptiderg (VIP: Verstärkung TSH-induzierter Hormonproduktion)  1909 wurde dem Schweizer Chirurgen Theodor Kocher
der Nobelpreis für Physiologie oder Medizin verliehen, und zwar für seine
Arbeiten "über Physiologie, Pathologie und Chirurgie der Schilddrüse".
Noch im späten 19. Jahrhundert war eine Entfernung der Schilddrüse mit
einer hohen Mortalität behaftet. Kocher, der etwa 5000 Thyroidektomien
durchführte, senkte die Mortalitätsrate auf weniger als 0,5%, indem er
äußerst vorsichtig und unter Schonung der Nebenschilddrüsen vorging. Er
stellte fest, dass eine vollständige Entfernung des Schilddrüsengewebes
schwere Folgen (Kretinismus) zeitigt und schuf die Grundlagen zum
Verständnis der Wirkung der Schilddrüsenhormone.
1909 wurde dem Schweizer Chirurgen Theodor Kocher
der Nobelpreis für Physiologie oder Medizin verliehen, und zwar für seine
Arbeiten "über Physiologie, Pathologie und Chirurgie der Schilddrüse".
Noch im späten 19. Jahrhundert war eine Entfernung der Schilddrüse mit
einer hohen Mortalität behaftet. Kocher, der etwa 5000 Thyroidektomien
durchführte, senkte die Mortalitätsrate auf weniger als 0,5%, indem er
äußerst vorsichtig und unter Schonung der Nebenschilddrüsen vorging. Er
stellte fest, dass eine vollständige Entfernung des Schilddrüsengewebes
schwere Folgen (Kretinismus) zeitigt und schuf die Grundlagen zum
Verständnis der Wirkung der Schilddrüsenhormone.  ). Das kann dann sogar eine vorübergehende Schilddrüsenunterfunktion auslösen.
). Das kann dann sogar eine vorübergehende Schilddrüsenunterfunktion auslösen. 
 Abbildung: Jodid, Epithelzelle, Kolloid und TSH-Wirkungen
Abbildung: Jodid, Epithelzelle, Kolloid und TSH-Wirkungen Die Follikelepithelzellen verfügen in ihrer basolateralen Membran über einen ATP-abhängigen (sekundär-aktiven) Natrium-Jodid-Cotransporter (Natrium-Jodid-Symporter, NIS,
Die Follikelepithelzellen verfügen in ihrer basolateralen Membran über einen ATP-abhängigen (sekundär-aktiven) Natrium-Jodid-Cotransporter (Natrium-Jodid-Symporter, NIS,  Abbildung),
welcher den Natriumgradienten für den Import des Jodids in die
Follikelepithelzelle nützt ("Jodidfalle") und es so in der Zelle
anreichert (Jodination).
Abbildung),
welcher den Natriumgradienten für den Import des Jodids in die
Follikelepithelzelle nützt ("Jodidfalle") und es so in der Zelle
anreichert (Jodination). | Jodid gelangt über Symport mit Natrium in Follikelepithelzellen |

 TSH (das bei
Jodmangel vermehrt sezerniert wird) regt die Expression des NIS und
seinen Einbau in die basolaterale Membran in einer funktionsfähigen
Konfiguration an, die Aufnahme von Jodid in die Follikelepithelzelle
steigt. Bei niedriger Jodaufnahme mit der Nahrung steigt die Jodidaufnahme der Schilddrüse bis auf 90% der angebotenen Menge. Umgekehrt hemmt gesteigerter Jodidspiegel die NIS-Expression,
die Jodideinlagerung der Schilddrüse sinkt.
TSH (das bei
Jodmangel vermehrt sezerniert wird) regt die Expression des NIS und
seinen Einbau in die basolaterale Membran in einer funktionsfähigen
Konfiguration an, die Aufnahme von Jodid in die Follikelepithelzelle
steigt. Bei niedriger Jodaufnahme mit der Nahrung steigt die Jodidaufnahme der Schilddrüse bis auf 90% der angebotenen Menge. Umgekehrt hemmt gesteigerter Jodidspiegel die NIS-Expression,
die Jodideinlagerung der Schilddrüse sinkt.  Jodidaufnahme: Die basolaterale Membran (Blutseite) nimmt Jodid gegen einen Konzentrationsgradienten von etwa 25:1 mittels eines Natrium-Jodid- Symporters (NIS) in die Zelle auf (die Energie stammt von der Na/K-ATPase;
Jodidaufnahme: Die basolaterale Membran (Blutseite) nimmt Jodid gegen einen Konzentrationsgradienten von etwa 25:1 mittels eines Natrium-Jodid- Symporters (NIS) in die Zelle auf (die Energie stammt von der Na/K-ATPase;  Abbildung oben). An der follikulären Seite (apikale Membran) wird Jodid mittels des Transporters Pendrin im Austausch gegen Chlorid oder Bicarbonat zum Kolloid gebracht.
Abbildung oben). An der follikulären Seite (apikale Membran) wird Jodid mittels des Transporters Pendrin im Austausch gegen Chlorid oder Bicarbonat zum Kolloid gebracht.  Im Follikel wird
Jod sofort oxidiert und vom tyrosinreichen Glykoprotein Thyreoglobulin (das vom Follikelepithel in das Kolloid sezerniert wurde) in die
Tyrosinreste eingebaut (Jodisation). Auf jedes
Molekül Thyreoglobulin entfallen etwa 115 Tyrosinreste, von denen
jeweils nur ein Bruchteil (<20) jodiert wird.
Im Follikel wird
Jod sofort oxidiert und vom tyrosinreichen Glykoprotein Thyreoglobulin (das vom Follikelepithel in das Kolloid sezerniert wurde) in die
Tyrosinreste eingebaut (Jodisation). Auf jedes
Molekül Thyreoglobulin entfallen etwa 115 Tyrosinreste, von denen
jeweils nur ein Bruchteil (<20) jodiert wird.  So entstehen Mono- und Dijodtyrosin (MIT, DIT), diese
werden von der Peroxidase anschließend (unter Verbrauch von H2O2 und Abspaltung von Alanin) zu T3 und T4
zusammengebaut. Aus zwei Molekülen DIT wird ein T4, aus MIT und DIT entsteht T3. MIT und DIT werden im Übrigen durch intrathyreoidale Dejodinasen rasch und spezifisch dejodiniert und das so gewonnene Jod für die Synthese von T3 und T4 wiederverwendet.
So entstehen Mono- und Dijodtyrosin (MIT, DIT), diese
werden von der Peroxidase anschließend (unter Verbrauch von H2O2 und Abspaltung von Alanin) zu T3 und T4
zusammengebaut. Aus zwei Molekülen DIT wird ein T4, aus MIT und DIT entsteht T3. MIT und DIT werden im Übrigen durch intrathyreoidale Dejodinasen rasch und spezifisch dejodiniert und das so gewonnene Jod für die Synthese von T3 und T4 wiederverwendet. An
Thyreoglobulin findet sich vor allem Thyroxin (T4) angelagert, und
T4 ist die vorwiegende Form des in das Blut abgegebenen Hormons. Die
Abgabe aus der Follikelepithelzelle an das Blut erfolgt durch einfache
Diffusion (dem Konzentrationsgefälle folgend, lipophile Stoffe können
die Zellmembran passieren).
An
Thyreoglobulin findet sich vor allem Thyroxin (T4) angelagert, und
T4 ist die vorwiegende Form des in das Blut abgegebenen Hormons. Die
Abgabe aus der Follikelepithelzelle an das Blut erfolgt durch einfache
Diffusion (dem Konzentrationsgefälle folgend, lipophile Stoffe können
die Zellmembran passieren).| Schilddrüsenhormone werden an Thyreoglobulin gebunden im Kolloid gespeichert |
 Schilddrüsenhormone verlieren ihre Wirksamkeit teils durch Abbau, teils
durch Ausscheidung. Ihre lange Halbwertszeit erklärt sich durch die
starke Proteinbindung, die sie vor der renalen Elimination schützt. Die
proteingebundene Form ist auch eine Art der Speicherung, was mit der
nicht permanenten Verfügbarkeit von Jod zusammenhängt (s. oben).
Schilddrüsenhormone verlieren ihre Wirksamkeit teils durch Abbau, teils
durch Ausscheidung. Ihre lange Halbwertszeit erklärt sich durch die
starke Proteinbindung, die sie vor der renalen Elimination schützt. Die
proteingebundene Form ist auch eine Art der Speicherung, was mit der
nicht permanenten Verfügbarkeit von Jod zusammenhängt (s. oben).
 T3
T3
 T4
T4 T4 ist leichter dosierbar als T3 und
wird zur Substitutionstherapie verwendet (die Umwandlung in das
wirksamere T3 erfolgt ohnehin in der Peripherie).
T4 ist leichter dosierbar als T3 und
wird zur Substitutionstherapie verwendet (die Umwandlung in das
wirksamere T3 erfolgt ohnehin in der Peripherie).  Abbildung oben).
Abbildung oben).
 Jodid gelangt im Cotransport mit Na+ (sekundär aktiv) in die Follikelepithelzelle
Jodid gelangt im Cotransport mit Na+ (sekundär aktiv) in die Follikelepithelzelle Thyreoglobulin bewegt sich via Endo- und Exozytose zwischen Kolloid und Epithelzellen
Thyreoglobulin bewegt sich via Endo- und Exozytose zwischen Kolloid und Epithelzellen T3 / T4 verlassen die Follikelepithelzellen durch einfache Diffusion
T3 / T4 verlassen die Follikelepithelzellen durch einfache Diffusion Abbildung oben).
Abbildung oben). Aus der Schilddrüse wird vorwiegend T4 freigesetzt, T3 ist andererseits die
bei weitem wirksamere Hormonform. Dejodinasen der Zellen am Angriffsort
können aus T4 durch Abspaltung eines Jodatoms T3 erzeugen (dabei
entsteht äquimolar das unwirksame reverse Hormon, rT3). Dejodinasen aktivieren (T4 zu T3) und inaktivieren Schilddrüsenhormone (z.B. T3 zu T2). Diese selenabhängigen Enzyme unterliegen zahlreichen Steuerungseinflüssen.
Aus der Schilddrüse wird vorwiegend T4 freigesetzt, T3 ist andererseits die
bei weitem wirksamere Hormonform. Dejodinasen der Zellen am Angriffsort
können aus T4 durch Abspaltung eines Jodatoms T3 erzeugen (dabei
entsteht äquimolar das unwirksame reverse Hormon, rT3). Dejodinasen aktivieren (T4 zu T3) und inaktivieren Schilddrüsenhormone (z.B. T3 zu T2). Diese selenabhängigen Enzyme unterliegen zahlreichen Steuerungseinflüssen.
 Abbildung: Dejodinasen
Abbildung: Dejodinasen Typ-1-Dejodinase (D1) wird in Schilddrüse,
Leber, Nieren und Skelettmuskeln gebildet; diese Organe geben T3 an das Blut ab.
D1 baut - mit relativ geringer Affinität - sowohl vom äußeren als auch vom inneren Tyrosinring Jod ab. D1 ist wahrscheinlich vor allem ein Scavenger-Enzym, das Jod von sulfatiertem Thyroidhormon entfernt, bevor es mit Galle oder Harn ausgeschieden wird.
Typ-1-Dejodinase (D1) wird in Schilddrüse,
Leber, Nieren und Skelettmuskeln gebildet; diese Organe geben T3 an das Blut ab.
D1 baut - mit relativ geringer Affinität - sowohl vom äußeren als auch vom inneren Tyrosinring Jod ab. D1 ist wahrscheinlich vor allem ein Scavenger-Enzym, das Jod von sulfatiertem Thyroidhormon entfernt, bevor es mit Galle oder Harn ausgeschieden wird.
 Typ-2-Dejodinase (D2)
baut im endoplasmatischen Retikulum mit hoher Affinität Jod am äußeren
Ring ab und verwandelt T4 zu T3. Es kommt vor allem im Zentralnervensystem (insbesondere Hypophyse) und in der Plazenta vor. D2 stellt im Gewebe -
abhängig von lokalen Umständen (z.B. im Gehirn, wo der T3-Spiegel stabilisiert wird) - das biologisch aktive Trijodthyronin her.
Typ-2-Dejodinase (D2)
baut im endoplasmatischen Retikulum mit hoher Affinität Jod am äußeren
Ring ab und verwandelt T4 zu T3. Es kommt vor allem im Zentralnervensystem (insbesondere Hypophyse) und in der Plazenta vor. D2 stellt im Gewebe -
abhängig von lokalen Umständen (z.B. im Gehirn, wo der T3-Spiegel stabilisiert wird) - das biologisch aktive Trijodthyronin her. Typ-3-Dejodinase (D3) ist ein hochaffines inaktivierendes Enzym, das T4 in reverses (inaktives) rT3 verwandelt. D3 findet
sich in Gehirn, Haut, Uterus und Plazenta, sowie an Entzündungsherden.
Ihre Aktivität erhöht sich bei Schilddrüsenüberfunktion, was die
T4-Überproduktion (teilweise) kompensiert.
Typ-3-Dejodinase (D3) ist ein hochaffines inaktivierendes Enzym, das T4 in reverses (inaktives) rT3 verwandelt. D3 findet
sich in Gehirn, Haut, Uterus und Plazenta, sowie an Entzündungsherden.
Ihre Aktivität erhöht sich bei Schilddrüsenüberfunktion, was die
T4-Überproduktion (teilweise) kompensiert. 
 Der
Abbau der Schilddrüsenhormone erfolgt durch Dejodierung, Desaminierung,
Decarboxylierung und Konjugation mit Glucuronat / Sulfat in den
jeweiligen Zielgeweben. Ein Hauptort des Abbaus ist die Leber, die
Ausscheidung der Produkte erfolgt via Gallensekret und Harn.
Der
Abbau der Schilddrüsenhormone erfolgt durch Dejodierung, Desaminierung,
Decarboxylierung und Konjugation mit Glucuronat / Sulfat in den
jeweiligen Zielgeweben. Ein Hauptort des Abbaus ist die Leber, die
Ausscheidung der Produkte erfolgt via Gallensekret und Harn.
 Spezifische Affinität hat das thyroxinbindende Globulin (TBG);
es bindet äquimolar, d.h. ein Molekül TBG bindet ein
Schilddrüsenhormonmolekül. Seine Konzentration im Serum beträgt ~0,3
µM. TBG bindet ~70% des zirkulierenden T3 und T4. Seine Bindungsstärke ist die höchste, seine Konzentration die niedrigste aller Transporter für Schilddrüsenhormone im Blutplasma.
Spezifische Affinität hat das thyroxinbindende Globulin (TBG);
es bindet äquimolar, d.h. ein Molekül TBG bindet ein
Schilddrüsenhormonmolekül. Seine Konzentration im Serum beträgt ~0,3
µM. TBG bindet ~70% des zirkulierenden T3 und T4. Seine Bindungsstärke ist die höchste, seine Konzentration die niedrigste aller Transporter für Schilddrüsenhormone im Blutplasma. Albumin transportiert 15-20% des zirkulierenden T3 und T4. Es hat die höchste Konzentration, aber die niedrigste Bindungsstärke aller Transporter für Schilddrüsenhormone im Blut.
Albumin transportiert 15-20% des zirkulierenden T3 und T4. Es hat die höchste Konzentration, aber die niedrigste Bindungsstärke aller Transporter für Schilddrüsenhormone im Blut.
 Transthyretin
Transthyretin  (TTR oder TBPA, ursprünglich als "Präalbumin" bezeichnet) transportiert 10-15% des T4 und T3. Darüber hinaus bringt es Retinol
zur Leber (zusammen mit retinolbindendem Protein RBP). Transthyretin
ist also ein mehrfacher Hormontransporter und hat seinen Namen so
erhalten (transports thyroxine and retinol). Es liegt im Extrazellulärraum als Tetramer vor, was mit seiner Bindungskinetik zu tun hat:
(TTR oder TBPA, ursprünglich als "Präalbumin" bezeichnet) transportiert 10-15% des T4 und T3. Darüber hinaus bringt es Retinol
zur Leber (zusammen mit retinolbindendem Protein RBP). Transthyretin
ist also ein mehrfacher Hormontransporter und hat seinen Namen so
erhalten (transports thyroxine and retinol). Es liegt im Extrazellulärraum als Tetramer vor, was mit seiner Bindungskinetik zu tun hat:
 Abbildung: Transthyretin-Protein
Abbildung: Transthyretin-Protein

 Abbildung: Transthyretin-Kreislauf
Abbildung: Transthyretin-Kreislauf Transthyretin wird als Tetramer sezerniert: In den liquor
cerebrospinalis (vom plexus chorioideus) und in die Blutbahn (von der Leber). Im Blut ist Transthyretin teilweise an retinolbindendes Globulin (ein wenig auch an HDL) gebunden.
Transthyretin wird als Tetramer sezerniert: In den liquor
cerebrospinalis (vom plexus chorioideus) und in die Blutbahn (von der Leber). Im Blut ist Transthyretin teilweise an retinolbindendes Globulin (ein wenig auch an HDL) gebunden. Der Abbau erfolgt in Leber, Nieren (über Megalin), Muskeln und Haut
Der Abbau erfolgt in Leber, Nieren (über Megalin), Muskeln und Haut
 Weiters beteiligen sich zu einigen % Sexualhormon-bindendes Globulin (SHBG) und Lipoproteine am Transport der Schilddrüsenhormone durch den Kreislauf. All diese Transporter werden von der Leber synthetisiert.
Weiters beteiligen sich zu einigen % Sexualhormon-bindendes Globulin (SHBG) und Lipoproteine am Transport der Schilddrüsenhormone durch den Kreislauf. All diese Transporter werden von der Leber synthetisiert.  Das
biologisch inaktive reverse T3
(rT3,
Das
biologisch inaktive reverse T3
(rT3,  Abbildung) - das überall im Körper durch 5-Dejodination aus
T4 gebildet wird - bindet viel schwächer an
Serumproteine als T3 und T4, seine Halbwertszeit beträgt nur ~4
Stunden. Durch Steuerung der Ausstattung mit Dejodinasen können die
Zellen in der Peripherie die stoffwechselanregende Wirkung des
Thyreoidsystems an ihre Erfordernisse anpassen:
Abbildung) - das überall im Körper durch 5-Dejodination aus
T4 gebildet wird - bindet viel schwächer an
Serumproteine als T3 und T4, seine Halbwertszeit beträgt nur ~4
Stunden. Durch Steuerung der Ausstattung mit Dejodinasen können die
Zellen in der Peripherie die stoffwechselanregende Wirkung des
Thyreoidsystems an ihre Erfordernisse anpassen:
 Abbildung: Dejodierung des Thyroxins
Abbildung: Dejodierung des Thyroxins
 Abbildung) - Dejodinase 1/2
oder Dejodinase 3 - ermöglich ihnen eine Selbstregulation des Effekts,
den sie über Schilddrüsenhormone benötigen.
Abbildung) - Dejodinase 1/2
oder Dejodinase 3 - ermöglich ihnen eine Selbstregulation des Effekts,
den sie über Schilddrüsenhormone benötigen. Das ist wichtig zu berücksichtigen, denn der TSH-Spiegel ist eine
Schlüsselgröße für die Abschätzung der Schilddrüsenfunktion.
Das ist wichtig zu berücksichtigen, denn der TSH-Spiegel ist eine
Schlüsselgröße für die Abschätzung der Schilddrüsenfunktion. Vermehrte
Kalorienaufnahme mit der Nahrung (vor allem in Form von Kohlenhydraten)
erhöht die Bildung von Schilddrüsenhormonen - T3 vermehrt Energieumsatz
und Wärmeabgabe des Körpers.
Vermehrte
Kalorienaufnahme mit der Nahrung (vor allem in Form von Kohlenhydraten)
erhöht die Bildung von Schilddrüsenhormonen - T3 vermehrt Energieumsatz
und Wärmeabgabe des Körpers.  Umgekehrt
regulieren Zustände, welche eine Energiekonservierung erfordern
(Erkrankung, Traumen), den hypothalamisch-hypophysären Sollwert nach
unten und senken die Schilddrüsenhormonproduktion, um Energie zu sparen
(sick euthyroid syndrome).
Umgekehrt
regulieren Zustände, welche eine Energiekonservierung erfordern
(Erkrankung, Traumen), den hypothalamisch-hypophysären Sollwert nach
unten und senken die Schilddrüsenhormonproduktion, um Energie zu sparen
(sick euthyroid syndrome).
 Exzessive
Jodspiegel im Blut (z.B. infolge einer Jodidgabe, die dem 30-fachen des
Tagesbedarfs entspricht) hemmen die Hormonproduktion der Schilddrüse
(im Gegensatz zu physiologischen Jodidwerten, welche auf die
Schilddrüsenfunktion anregend wirken). So kann die Schilddrüse durch
eine Jodgabe "ruhiggestellt" werden, z.B. präoperativ ("Plummerung "
Exzessive
Jodspiegel im Blut (z.B. infolge einer Jodidgabe, die dem 30-fachen des
Tagesbedarfs entspricht) hemmen die Hormonproduktion der Schilddrüse
(im Gegensatz zu physiologischen Jodidwerten, welche auf die
Schilddrüsenfunktion anregend wirken). So kann die Schilddrüse durch
eine Jodgabe "ruhiggestellt" werden, z.B. präoperativ ("Plummerung " ).
). s. dort
s. dort
| Schilddrüsenhormone sind hydrophob und werden an Protein gebunden transportiert |
 TRα - TR-α1 wird von Herz- und Skelettmuskelzellen, in braunem Fettgewebe und Knochen exprimiert, TR-α2 und TR-α3 in Skelettmuskel, Nieren, Gehirn
TRα - TR-α1 wird von Herz- und Skelettmuskelzellen, in braunem Fettgewebe und Knochen exprimiert, TR-α2 und TR-α3 in Skelettmuskel, Nieren, Gehirn TRß1 in Gehirn, Leber und Nieren,
TRß1 in Gehirn, Leber und Nieren,  TRß2 in Hypothalamus, Hypophyse (Rückkopplung von T3 auf TRH / TSH-Freisetzung), Netzhaut und Innenohr.
TRß2 in Hypothalamus, Hypophyse (Rückkopplung von T3 auf TRH / TSH-Freisetzung), Netzhaut und Innenohr.  Abbildung unten). Bindung eines Hormons an den Komplex kann
die Transkription von Zielgenen fördern oder auch unterdrücken. Der
Zellkern hat gegenüber T3 eine 10-fach höhere Affinität als gegenüber
T4. Insgesamt sind (im euthyreoten Zustand) die Bindungsstellen zu ~90% von T3 (und nur zu ~10% von T4) besetzt.
Abbildung unten). Bindung eines Hormons an den Komplex kann
die Transkription von Zielgenen fördern oder auch unterdrücken. Der
Zellkern hat gegenüber T3 eine 10-fach höhere Affinität als gegenüber
T4. Insgesamt sind (im euthyreoten Zustand) die Bindungsstellen zu ~90% von T3 (und nur zu ~10% von T4) besetzt.
 Abbildung: Achse Hypothalamus - Hypophyse - Schilddrüse - Peripherie
Abbildung: Achse Hypothalamus - Hypophyse - Schilddrüse - Peripherie Typ-1-Dejodinase (D1) wird in Schilddrüse,
Leber und Nieren gebildet; diese Organe geben T3 an das Blut ab.
Typ-1-Dejodinase (D1) wird in Schilddrüse,
Leber und Nieren gebildet; diese Organe geben T3 an das Blut ab. Typ-2-Dejodinase (D2) kommt in der Schilddrüse, in Herz- und
Skelettmuskel, Gehirn und Hirnanhangdrüse vor
Typ-2-Dejodinase (D2) kommt in der Schilddrüse, in Herz- und
Skelettmuskel, Gehirn und Hirnanhangdrüse vor
 Zeitabhängigkeit: Dieser Vorgang braucht
Zeit, Effekte auf Wachstum und Reifung treten verzögert auf (Stunden). Es gibt auch rasche Effekte (Minuten), die über membrangebundene, mitochondriale und Zytoskelett-Komponenten greifen.
Zeitabhängigkeit: Dieser Vorgang braucht
Zeit, Effekte auf Wachstum und Reifung treten verzögert auf (Stunden). Es gibt auch rasche Effekte (Minuten), die über membrangebundene, mitochondriale und Zytoskelett-Komponenten greifen. Dosisabhängigkeit:
Mäßige T3-Konzentrationen steigern, hohe T3-Werte senken die
Proteinsynthese (und steigern die Proteolyse sowie den Kalkabbau im
Knochen).
Dosisabhängigkeit:
Mäßige T3-Konzentrationen steigern, hohe T3-Werte senken die
Proteinsynthese (und steigern die Proteolyse sowie den Kalkabbau im
Knochen).
 Abbildung: Wirkung der Schilddrüsenhormone an Zielzellen
Abbildung: Wirkung der Schilddrüsenhormone an Zielzellen| Werden Schilddrüsenhormonrezeptoren übermäßig erregt (z.B. Gain-of-function- Mutation: Gen hyperaktiv; oder Mb. Basedow: TSH-stimulierende Autoantikörper), sinkt die Konzentration von TRH und TSH |
 Kardiopulmonales System: Anregung von Atmung und Kreislauf
(Atemgastransport), Erhöhung der Sensibilität des Herzmuskels für
Katecholamine (→
positiv inotrope, chronotrope und lusitrope Wirkung: Kräftigung, Pulsbeschleunigung, verkürzte Relaxationszeit; vermehrte Ca++-Aufnahme durch die Herzmuskelzellen), periphere Vasodilatation; bei Überschuss Kardiotoxizität. T3 erhöht die Transportkapazität der Ca++-Transportsysteme (Ryanodin, SERCA).
Kardiopulmonales System: Anregung von Atmung und Kreislauf
(Atemgastransport), Erhöhung der Sensibilität des Herzmuskels für
Katecholamine (→
positiv inotrope, chronotrope und lusitrope Wirkung: Kräftigung, Pulsbeschleunigung, verkürzte Relaxationszeit; vermehrte Ca++-Aufnahme durch die Herzmuskelzellen), periphere Vasodilatation; bei Überschuss Kardiotoxizität. T3 erhöht die Transportkapazität der Ca++-Transportsysteme (Ryanodin, SERCA). Stoff- und Energiewechsel: Erhöhter Grundumsatz (früher: Schilddrüsenfunktionsdiagnostik); Förderung des Cholesterinabbaus, Steigerung der Proteinsynthese (wichtig für Wachstum und Reifung), Erhöhung des Sauerstoffbedarfs, Erhöhung des Energieumsatzes
(Glykogenolyse und damit Glucoseproduktion in der Leber durch Induktion von Schlüsselenzymen,
Glukoneogenese, Lipolyse; Zunahme des Blutzuckerspiegels, der freien Fettsäuren, Abnahme der
Triglyzeride im Blut; Abnahme der Insulinempfindlichkeit →
diabetogene Wirkung), Erhöhung der Körpertemperatur - bei Mangel Hypothermie, reduzierter Energieumsatz.
Stoff- und Energiewechsel: Erhöhter Grundumsatz (früher: Schilddrüsenfunktionsdiagnostik); Förderung des Cholesterinabbaus, Steigerung der Proteinsynthese (wichtig für Wachstum und Reifung), Erhöhung des Sauerstoffbedarfs, Erhöhung des Energieumsatzes
(Glykogenolyse und damit Glucoseproduktion in der Leber durch Induktion von Schlüsselenzymen,
Glukoneogenese, Lipolyse; Zunahme des Blutzuckerspiegels, der freien Fettsäuren, Abnahme der
Triglyzeride im Blut; Abnahme der Insulinempfindlichkeit →
diabetogene Wirkung), Erhöhung der Körpertemperatur - bei Mangel Hypothermie, reduzierter Energieumsatz. Nervensystem: Gehirnwachstum und -reifung
(insbesondere in der
Embryogenese! Myelinisierung, Wachstum der Axone, Ausbildung von Dendriten, Synapsenbildung) -
beispielsweise sind Schilddrüsenhormone für die Ausbildung des
Dendritenbaums der Purkinje-Zellen im Kleinhirn und der an ihm angreifenden Synapsen von Parallelfasern unabdingbar. Weiters Stabilisierung der Erregbarkeit - bei Mangel Apathie, bei Überschuss gesteigerte Erregbarkeit (Schlafmangel,..).
Nervensystem: Gehirnwachstum und -reifung
(insbesondere in der
Embryogenese! Myelinisierung, Wachstum der Axone, Ausbildung von Dendriten, Synapsenbildung) -
beispielsweise sind Schilddrüsenhormone für die Ausbildung des
Dendritenbaums der Purkinje-Zellen im Kleinhirn und der an ihm angreifenden Synapsen von Parallelfasern unabdingbar. Weiters Stabilisierung der Erregbarkeit - bei Mangel Apathie, bei Überschuss gesteigerte Erregbarkeit (Schlafmangel,..). Muskel- und Knochensystem: Induktion von Proteinen, die am Kontraktionsmechanismus beteiligt sind; Verkürzung der
Kontraktionszeit von Muskeln - bei Mangel Myopathie, Reflexverlangsamung. Der
Proteinabbau wird stärker angeregt als die Neusynthese, der
Knochenstoffwechsel (enchondrale Ossifikation) beschleunigt. Auch die
Zahnentwicklung (Durchbruch) steht unter T3-Einfluss.
Muskel- und Knochensystem: Induktion von Proteinen, die am Kontraktionsmechanismus beteiligt sind; Verkürzung der
Kontraktionszeit von Muskeln - bei Mangel Myopathie, Reflexverlangsamung. Der
Proteinabbau wird stärker angeregt als die Neusynthese, der
Knochenstoffwechsel (enchondrale Ossifikation) beschleunigt. Auch die
Zahnentwicklung (Durchbruch) steht unter T3-Einfluss.  Beim embryonalen Wachstum
spielt der Übertitt von T3 über die Plazentarschranke eine Rolle; etwa
zur Schwangerschaftsmitte wird die fetale Schilddrüsenachse
funktionsfähig. Bei fetaler Unterfunktion kommt es zu kongenitalem
Hypothyreoidismus (früher Cretinismus) mit schweren
Entwicklungsdefiziten (mentale Retardation) und Wachstumsstörungen.
Beim embryonalen Wachstum
spielt der Übertitt von T3 über die Plazentarschranke eine Rolle; etwa
zur Schwangerschaftsmitte wird die fetale Schilddrüsenachse
funktionsfähig. Bei fetaler Unterfunktion kommt es zu kongenitalem
Hypothyreoidismus (früher Cretinismus) mit schweren
Entwicklungsdefiziten (mentale Retardation) und Wachstumsstörungen. Immunsystem: T3 fördert die Lymphozytenreifung.
Immunsystem: T3 fördert die Lymphozytenreifung. Darm:
Ausbildung der Krypten, Expression von mikrovillösen Enzymen,
Steigerung der Motilität. T3 erhöht die Resorption von Glucose
(Energieproduktion) und Vitaminen (Folat, B12, für erhöhte
Erythropoese).
Darm:
Ausbildung der Krypten, Expression von mikrovillösen Enzymen,
Steigerung der Motilität. T3 erhöht die Resorption von Glucose
(Energieproduktion) und Vitaminen (Folat, B12, für erhöhte
Erythropoese). Fettgewebe: T3
steigert die Lipolyse durch Erhöhung der Zahl an ß-Adrenozeptoren,
fördert aber auch die Lipogenese: Die Synthese von Fettsäuren durch die
Leber wird durch physiologische Schilddrüsenhormonspiegel angeregt.
Fettgewebe: T3
steigert die Lipolyse durch Erhöhung der Zahl an ß-Adrenozeptoren,
fördert aber auch die Lipogenese: Die Synthese von Fettsäuren durch die
Leber wird durch physiologische Schilddrüsenhormonspiegel angeregt. Haut: T3
beeinflusst das Wachstum und die Reifung der Haut; Hypo- oder
Hyperthyreose kann zu Haarverlust und abnormem Nagelwachstum führen.
Haut: T3
beeinflusst das Wachstum und die Reifung der Haut; Hypo- oder
Hyperthyreose kann zu Haarverlust und abnormem Nagelwachstum führen. Nieren: T3 erhöht GFR, RPF, und den tubulären Transport zahlreicher Substanzen.
Nieren: T3 erhöht GFR, RPF, und den tubulären Transport zahlreicher Substanzen. Sexualorgane: T3 beeinflusst Aktivität, Fertilität und Zyklus bzw. Spermatogenese.
Sexualorgane: T3 beeinflusst Aktivität, Fertilität und Zyklus bzw. Spermatogenese.  Sinnesorgane: Entwicklung von Netzhaut (Photorezeptoren) und Innenohr (TRß2, s. oben).
Sinnesorgane: Entwicklung von Netzhaut (Photorezeptoren) und Innenohr (TRß2, s. oben). Grundsubstanz: Anregende Wirkung auf den Stoffwechsel der
bindegewebigen Grundsubstanz
Grundsubstanz: Anregende Wirkung auf den Stoffwechsel der
bindegewebigen Grundsubstanz Physiologische Wirkungen von T3/T4 Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
||
| Ziel |
Niedriger Hormonspiegel (Hypothyreose) |
Hoher Hormonspiegel (Hyperthyreose) |
| Grundumsatz |
↓ | ↑ |
| Kohlenhydrat- stoffwechsel |
↓Gluconeogenese ↓Glykogenolyse Blutzuckerspiegel im Normbereich |
↑Gluconeogenese ↑Glykogenolyse Blutzuckerspiegel im Normbereich |
| Protein- stoffwechsel |
↓Synthese ↓Proteolyse |
↑Synthese ↑Proteolyse |
| Lipid- stoffwechsel |
↓Lipogenese ↓Lipolyse ↑Cholesterinspiegel |
↑Lipogenese ↑Lipolyse ↓Cholesterinspiegel |
| Thermogenese |
↓ | ↑ |
| Autonomes Nervensystem |
Katecholaminspiegel im physiologischen Bereich |
↑ Expression von ß-Adrenozeptoren - Katecholamin- sensitivität ↑(bei normalem Serumspiegel) |

 Abbildung: Wirkungsspektrum der Schilddrüsenhormone
Abbildung: Wirkungsspektrum der Schilddrüsenhormone ACC1, acetyl‐CoA carboxylase
1
ACC1, acetyl‐CoA carboxylase
1  CYP7a1, cytochrome P‐450 7A1
CYP7a1, cytochrome P‐450 7A1  CPT‐1α, carnitine palmitoyltransferase
1α
CPT‐1α, carnitine palmitoyltransferase
1α  LDL‐R, low‐density lipoprotein receptor
LDL‐R, low‐density lipoprotein receptor

 SERCA = sarcoplasmic reticulum Ca2+‐ATPase
SERCA = sarcoplasmic reticulum Ca2+‐ATPase CD1 = Cyclin 1 (Cycline beteiligen sich an der Steuerung des Zellzyklus
CD1 = Cyclin 1 (Cycline beteiligen sich an der Steuerung des Zellzyklus

| Charakteristika von Schilddrüsenhormonen |
| Tyrosinderivate, Jodierung von Thyronin |
| Lipophil, an Thyreoglobulin in Follikeln gespeichert |
| Regulation über Synthese, Jodierung, Sekretion |
| Transport im Blut eng an Protein gebunden (höchste biologische Halbwertszeiten) |
| Wirkung über intrazelluläre Rezeptoren (nukleär) |
| Orale Gabe möglich |

 Abbildung: Struma
Abbildung: Struma
 Jodmangel
ist die häufigste Ursache für eine Struma (=Schilddrüsenvergrößerung,
Kropf, goiter). Das vermehrte Drüsenwachstum ist durch starke TRS /
TSH-Freisetzung aus dem hypothalamisch-hypophysären System bedingt
(negative Rückkopplung).
Jodmangel
ist die häufigste Ursache für eine Struma (=Schilddrüsenvergrößerung,
Kropf, goiter). Das vermehrte Drüsenwachstum ist durch starke TRS /
TSH-Freisetzung aus dem hypothalamisch-hypophysären System bedingt
(negative Rückkopplung). In seltenen Fällen tritt eine Reizung des Schilddrüsengewebes durch
Autoantikörper auf. Diese stimulieren den TSH-Rezeptor (Mb. Basedow).
In seltenen Fällen tritt eine Reizung des Schilddrüsengewebes durch
Autoantikörper auf. Diese stimulieren den TSH-Rezeptor (Mb. Basedow).| Mb. Basedow kann die Katecholaminwirkung am Herzen verstärken (Schilddrüsenhormone erhöhen die ß1-Rezeptor-Expression) |

 Abbildung: Schilddrüse und Nebenschilddrüsen
Abbildung: Schilddrüse und Nebenschilddrüsen
 T3-Mangel
(Hypothyreose) erniedrigt Grundumsatz (bis 50%) und Wärmebildung,
verlangsamt Atmung, Kreislauf und Hirnleistung, und bewirkt eine
Ansammlung bindegewebiger Grundsubstanz im Unterhautgewebe (Myxödem).
Schilddrüsenunterfunktion beeinträchtigt den Stoffwechsel: Es kommt zu
Hypertriglyzeridämie, verminderte Muskelaktivität und Gewichtszunahme.
T3-Mangel
(Hypothyreose) erniedrigt Grundumsatz (bis 50%) und Wärmebildung,
verlangsamt Atmung, Kreislauf und Hirnleistung, und bewirkt eine
Ansammlung bindegewebiger Grundsubstanz im Unterhautgewebe (Myxödem).
Schilddrüsenunterfunktion beeinträchtigt den Stoffwechsel: Es kommt zu
Hypertriglyzeridämie, verminderte Muskelaktivität und Gewichtszunahme. Hormonmangel vor
und nach der Geburt kann die geistige Reifung behindern und zu
Debilität führen, einem Krankheitsbild, das als Kretinismus bezeichnet
wird (Zwergwuchs, Intelligenzdefekte, Krampfneigung). Seine Entwicklung
kann mit Substitution mit Schilddrüsenhormon verhindert werden. Einige
Tage nach der Geburt überprüft man beim Baby daher routinemäßig
(Kapillarblut aus der Ferse) die Schilddrüsen-Hormonkonzentration.
Hormonmangel vor
und nach der Geburt kann die geistige Reifung behindern und zu
Debilität führen, einem Krankheitsbild, das als Kretinismus bezeichnet
wird (Zwergwuchs, Intelligenzdefekte, Krampfneigung). Seine Entwicklung
kann mit Substitution mit Schilddrüsenhormon verhindert werden. Einige
Tage nach der Geburt überprüft man beim Baby daher routinemäßig
(Kapillarblut aus der Ferse) die Schilddrüsen-Hormonkonzentration. Erhöhte
T3-Konzentration (Hyperthyreose) führt zu vermehrtem Energieumsatz,
erhöhter Körpertemperatur, Schweißsekretion, Ruhelosigkeit; der
Grundumsatz kann bis zum Doppelten erhöht sein. Das Reizleitungssystem
des Herzens kann gefährlich übererregbar werden (Thyreotoxikose).
Erhöhte
T3-Konzentration (Hyperthyreose) führt zu vermehrtem Energieumsatz,
erhöhter Körpertemperatur, Schweißsekretion, Ruhelosigkeit; der
Grundumsatz kann bis zum Doppelten erhöht sein. Das Reizleitungssystem
des Herzens kann gefährlich übererregbar werden (Thyreotoxikose).  Das Pendred-Syndrom
ist durch einen defekten Jodaustauscher (Pendrin
Das Pendred-Syndrom
ist durch einen defekten Jodaustauscher (Pendrin  , ein Anionen-Antiporter) bedingt und
durch Taubheit und Bildung eines hypothyreotischen Kropfs
gekennzeichnet.
, ein Anionen-Antiporter) bedingt und
durch Taubheit und Bildung eines hypothyreotischen Kropfs
gekennzeichnet.
 Die pulsatile Freisetzung von Thyreoliberin (TRH) aus dem Hypothalamus
regt die hypophysäre TSH-Sekretion an; sie wird durch Temperaturabfall
und noradrenerg gefördert, durch Cortisol
und Somatostatin gehemmt. Thyreotropin (TSH) regt
Schilddrüsenhormonsekretion und Follikelwachstum an, seine
Freisetzung wird durch T4 gehemmt (negative Rückkopplung). Die
Schilddrüse sezerniert hauptsächlich das Prohormon Thyroxin (T4),
Trijodthyronin (T3) ist hingegen die biologisch aktive Hormonform
Die pulsatile Freisetzung von Thyreoliberin (TRH) aus dem Hypothalamus
regt die hypophysäre TSH-Sekretion an; sie wird durch Temperaturabfall
und noradrenerg gefördert, durch Cortisol
und Somatostatin gehemmt. Thyreotropin (TSH) regt
Schilddrüsenhormonsekretion und Follikelwachstum an, seine
Freisetzung wird durch T4 gehemmt (negative Rückkopplung). Die
Schilddrüse sezerniert hauptsächlich das Prohormon Thyroxin (T4),
Trijodthyronin (T3) ist hingegen die biologisch aktive Hormonform T3 enthält drei, T4 vier Jodatome. Die Jodidkonzentration
im Blut steuert die Hormonsekretion
unabhängig von TRH/TSH: Je höher [J-],
desto weniger Schilddrüsenhormon
wird sezerniert; niedrige Jodidspiegel fördern Jodidaufnahme
im Darm und Hormonproduktion in der Schilddrüse. Die Schilddrüse
speichert 7-8 mg Jod. Bei Jodmangel sinkt die Jodidausscheidung mit dem
Harn: Sie sollte
100-200 µg/l Harn betragen,
niedrigere Werte deuten auf Jodmangel, höhere auf überhöhtes
Jodangebot hin T3 enthält drei, T4 vier Jodatome. Die Jodidkonzentration
im Blut steuert die Hormonsekretion
unabhängig von TRH/TSH: Je höher [J-],
desto weniger Schilddrüsenhormon
wird sezerniert; niedrige Jodidspiegel fördern Jodidaufnahme
im Darm und Hormonproduktion in der Schilddrüse. Die Schilddrüse
speichert 7-8 mg Jod. Bei Jodmangel sinkt die Jodidausscheidung mit dem
Harn: Sie sollte
100-200 µg/l Harn betragen,
niedrigere Werte deuten auf Jodmangel, höhere auf überhöhtes
Jodangebot hin T3/T4 werden im Follikel auf (von Follikelepithelzellen
synthetisiertem) Thyreoglobulin zusammengebaut (Synthese des Thyronin
aus Tyrosin, Einbau von Jod) und zwischengespeichert. Der Hormonvorrat
kann den Bedarf für mehrere Monate decken. Thyreoglobulin wird bei
Bedarf endozytiert, die Hormonmoleküle an das Blut weitergegeben. Das
dynamische Gleichgewicht Neubildung / Verbrauch ist abhängig vom
(schwankenden) Jodidangebot (Tagesbedarf ~0,1 mg) und der
Anregung durch TSH, Noradrenalin, VIP
(Acetylcholin wirkt inhibierend). Die Jodaufnahme erfolgt über einen
basolateralen (TSH-abhängigen) Natrium-Jodid-Symporter ("Jodfalle"),
die apikale Weitergabe an das Kolloid über Pendrin. Die Hormonbildung
steigt mit der
Jodidzufuhr; überhöhte Jodaufnahme (>1 mg/d) unterdrückt hingegen
Jodidaufnahme und Hormonsynthese (Wolff-Chaikoff- Effekt)
T3/T4 werden im Follikel auf (von Follikelepithelzellen
synthetisiertem) Thyreoglobulin zusammengebaut (Synthese des Thyronin
aus Tyrosin, Einbau von Jod) und zwischengespeichert. Der Hormonvorrat
kann den Bedarf für mehrere Monate decken. Thyreoglobulin wird bei
Bedarf endozytiert, die Hormonmoleküle an das Blut weitergegeben. Das
dynamische Gleichgewicht Neubildung / Verbrauch ist abhängig vom
(schwankenden) Jodidangebot (Tagesbedarf ~0,1 mg) und der
Anregung durch TSH, Noradrenalin, VIP
(Acetylcholin wirkt inhibierend). Die Jodaufnahme erfolgt über einen
basolateralen (TSH-abhängigen) Natrium-Jodid-Symporter ("Jodfalle"),
die apikale Weitergabe an das Kolloid über Pendrin. Die Hormonbildung
steigt mit der
Jodidzufuhr; überhöhte Jodaufnahme (>1 mg/d) unterdrückt hingegen
Jodidaufnahme und Hormonsynthese (Wolff-Chaikoff- Effekt) T3/T4 gelangen über einen energieabhängigen Carrier in die Zielzelle.
Diese verwandelt T4 in T3 (Typ-2-Dejodinasen: Schilddrüse, Muskel,
Gehirn) und biologisch inaktives rT3 (Typ-3-Dejodinasen). T3 wirkt über
Thyroidhormon-Rezeptoren (TR) im Zellkern. Diese finden sich in Herz-
und Skelettmuskel (TRα), Gehirn, Leber und Nieren (TRß1), Hypothalamus,
Hypophyse, Netzhaut und Innenohr (TRß2). Der Hormon-Rezeptor-Komplex
lagert sich an das Thyroid hormone response element (TRE), eine
DNA-Sequenz im Promotorbereich, an; Gensequenzen werden aktiviert oder
reprimiert. Mäßige T3-Konzentrationen steigern die Proteinsynthese
(Na/K-ATPase, Enzyme,..), hohe eher die Proteolyse
T3/T4 gelangen über einen energieabhängigen Carrier in die Zielzelle.
Diese verwandelt T4 in T3 (Typ-2-Dejodinasen: Schilddrüse, Muskel,
Gehirn) und biologisch inaktives rT3 (Typ-3-Dejodinasen). T3 wirkt über
Thyroidhormon-Rezeptoren (TR) im Zellkern. Diese finden sich in Herz-
und Skelettmuskel (TRα), Gehirn, Leber und Nieren (TRß1), Hypothalamus,
Hypophyse, Netzhaut und Innenohr (TRß2). Der Hormon-Rezeptor-Komplex
lagert sich an das Thyroid hormone response element (TRE), eine
DNA-Sequenz im Promotorbereich, an; Gensequenzen werden aktiviert oder
reprimiert. Mäßige T3-Konzentrationen steigern die Proteinsynthese
(Na/K-ATPase, Enzyme,..), hohe eher die Proteolyse Zu den Hormonwirkungen gehören Gehirnwachstum, -reifung, -anregung;
positiv
inotrope / chronotrope / lusitrope Wirkung auf das Herz, erhöhtes
Blutvolumen (gesteigertes Angiotensin, Aldosteron, Erythropoetin),
periphere Vasodilatation; erhöhter Energieumsatz (Glykogenolyse,
Glukoneogenese, Lipolyse; Zunahme Glucose, freie Fettsäuren, Abnahme
Triglyzeride im Blut), Temperaturanstieg; beschleunigter Umsatz in
Bindegewebe und Knochen (bei Hormonmangel Myxödem), gesteigerte
intestinale Resorption; Anregung der renalen Filtration und tubulären
Transportvorgänge
Zu den Hormonwirkungen gehören Gehirnwachstum, -reifung, -anregung;
positiv
inotrope / chronotrope / lusitrope Wirkung auf das Herz, erhöhtes
Blutvolumen (gesteigertes Angiotensin, Aldosteron, Erythropoetin),
periphere Vasodilatation; erhöhter Energieumsatz (Glykogenolyse,
Glukoneogenese, Lipolyse; Zunahme Glucose, freie Fettsäuren, Abnahme
Triglyzeride im Blut), Temperaturanstieg; beschleunigter Umsatz in
Bindegewebe und Knochen (bei Hormonmangel Myxödem), gesteigerte
intestinale Resorption; Anregung der renalen Filtration und tubulären
Transportvorgänge Die Bindung an Plasmaeiweiß beträgt bei T4 >99,9%, bei T3 >99% -
dieser proteingebundene Hormonpool erhöht die Halbweitszeit (T3 ein
Tag, T4 eine Woche), bildet
einen Hormonvorrat und verhindert glomerulären Verlust der kleinen
T3/T4- Moleküle. Frei gelöst (fT4, fT3) und damit für das Gewebe
verfügbar sind nur Bruchteile eines Prozent. Thyroxinbindendes Globulin
(TBG, Serumkonzentration ~0,3 µM) bindet
spezifisch und äquimolar 70% des zirkulierenden T3 und T4, Albumin 15-20%, Transthyretin
(TTR: Hormontransport zum
Zentralnervensystem) 10-15%. Entfernung der Jodatome - vorwiegend in
Leber, Nieren, Muskeln, Haut - inaktiviert das Hormon, nach
Glukuronierung /
Sulfatierung ist auch direkte Ausscheidung mit der Galle möglich
Die Bindung an Plasmaeiweiß beträgt bei T4 >99,9%, bei T3 >99% -
dieser proteingebundene Hormonpool erhöht die Halbweitszeit (T3 ein
Tag, T4 eine Woche), bildet
einen Hormonvorrat und verhindert glomerulären Verlust der kleinen
T3/T4- Moleküle. Frei gelöst (fT4, fT3) und damit für das Gewebe
verfügbar sind nur Bruchteile eines Prozent. Thyroxinbindendes Globulin
(TBG, Serumkonzentration ~0,3 µM) bindet
spezifisch und äquimolar 70% des zirkulierenden T3 und T4, Albumin 15-20%, Transthyretin
(TTR: Hormontransport zum
Zentralnervensystem) 10-15%. Entfernung der Jodatome - vorwiegend in
Leber, Nieren, Muskeln, Haut - inaktiviert das Hormon, nach
Glukuronierung /
Sulfatierung ist auch direkte Ausscheidung mit der Galle möglich Mb. Basedow kann die Katecholaminwirkung am Herzen verstärken
(Schilddrüsenhormone erhöhen die ß1-Rezeptor-Expression)
Mb. Basedow kann die Katecholaminwirkung am Herzen verstärken
(Schilddrüsenhormone erhöhen die ß1-Rezeptor-Expression) |
