

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Wirkungsweise lipophiler Hormone
Wirkungsweise lipophiler Hormone
 Östrogen: οἶστρος = Leidenschaft, Stachel
Östrogen: οἶστρος = Leidenschaft, Stachel| Fettlösliche Hormone - Steroidhormone, Vitamin-D-Hormon und Schilddrüsenhormone - wirken über intrazelluläre Rezeptoren, d.h. sie diffundieren in die Zelle und binden dort an ihren Rezeptor. Steroidhormon-Rezeptoren haben Hitzeschockprotein (HSP) gebunden. Gelangt das passende Hormon in die Zelle, wird es gegen HSP getauscht, es entsteht ein Hormon-Rezeptor-Komplex. Dieser gelangt in den Zellkern, bindet an hormone response elements (HRE) und initiiert die Synthese bestimmter Zielproteine. Die Superfamilie der Steroid- und Thyroidrezeptoren bindet Kortikoide (Aldosteron, Cortisol), Sexualhormone (Östrogene, Progesteron, Testosteron), Schilddrüsenhormone, Calcitriol. Im Blutplasma werden lipophile Hormone an Protein gebunden transportiert (Transportproteine), gelangen deshalb nur eingeschränkt aus dem Blut zu den Gewebszellen - je intensiver die Bindung, desto langsamer. Der Transport erfolgt teils unspezifisch (an Albumin), teils spezifisch (sexualhormonbindendes Globulin SHBG, Transkortin CBG, thyroxinbindendes Präalbumin, thyroxinbindendes Globulin). Nur der freie Anteil ist biologisch aktiv; der gebundene Anteil stellt eine Hormonreserve dar. |
 Rezeptoren
Rezeptoren  Steroidhormone: Bildung, Sekretion, Transport, Wirkung, Abbau
Steroidhormone: Bildung, Sekretion, Transport, Wirkung, Abbau
 StAR-Protein
StAR-Protein

 Abbildung: Steroidsynthese aus Cholesterin
Abbildung: Steroidsynthese aus Cholesterin 80% werden über LDL-Partikel aus dem Blut aufgenommen (rezeptormediierte Enozytose mittels coated pits)
80% werden über LDL-Partikel aus dem Blut aufgenommen (rezeptormediierte Enozytose mittels coated pits) 20% werden von Nebennierenrinde und Gonaden aus Acetyl-Coenzym A neu gebildet
20% werden von Nebennierenrinde und Gonaden aus Acetyl-Coenzym A neu gebildet
 und Thyroid-
und Thyroid-  Rezeptoren umfasst mehr als 40 Mitglieder; sie alle verfügen über mehrere Domänen, darunter die
Rezeptoren umfasst mehr als 40 Mitglieder; sie alle verfügen über mehrere Domänen, darunter die  Ligandenbindungsdomäne LBD (hormone binding domain), die spezifisch für jedes Hormon ist und nur dieses bindet, und
Ligandenbindungsdomäne LBD (hormone binding domain), die spezifisch für jedes Hormon ist und nur dieses bindet, und DNA-Bindedomäne DBD (DNA binding domain).
DNA-Bindedomäne DBD (DNA binding domain).
 Sexualhormon-bindendes Globulin (sex hormon-bindung globulin SHBG) transportiert Androgene (Testosteron) und Östrogene. Andere Steroidhormone - Progesteron, Corticosteroide - binden an Transcortin
(corticosteroid-binding globulin
CBG). Testosteron und Östrogene binden an Albumin (zu etwa 54%) und SHGB
(ca. 44%), nur 1-2% liegen im Blut frei vor, können den Kreislauf
verlassen und sind so biologisch aktiv. Je stärker ihre Bindung an
Plasmaproteine im Blut, desto geringer fällt die biologische Wirkung
der Hormone aus. Die Produktion von SHBG wird durch Testosteron,
Insulin und Retinol gefördert.
Sexualhormon-bindendes Globulin (sex hormon-bindung globulin SHBG) transportiert Androgene (Testosteron) und Östrogene. Andere Steroidhormone - Progesteron, Corticosteroide - binden an Transcortin
(corticosteroid-binding globulin
CBG). Testosteron und Östrogene binden an Albumin (zu etwa 54%) und SHGB
(ca. 44%), nur 1-2% liegen im Blut frei vor, können den Kreislauf
verlassen und sind so biologisch aktiv. Je stärker ihre Bindung an
Plasmaproteine im Blut, desto geringer fällt die biologische Wirkung
der Hormone aus. Die Produktion von SHBG wird durch Testosteron,
Insulin und Retinol gefördert.
 Abbildung: Steroide lösen Proteinsynthese aus
Abbildung: Steroide lösen Proteinsynthese aus Glukokortikoidrezeptoren (glucocorticoid receptor GR) - sie werden fast überall im Körper in z.T. organspezifischer Form
ausgebildet. Sie regulieren den Stoffwechsel, aber auch körperliche
Entwicklungs- und Immunfunktionen
Glukokortikoidrezeptoren (glucocorticoid receptor GR) - sie werden fast überall im Körper in z.T. organspezifischer Form
ausgebildet. Sie regulieren den Stoffwechsel, aber auch körperliche
Entwicklungs- und Immunfunktionen Mineralkortikoidrezeptoren (Aldosteronrezeptoren, mineralocorticoid receptor MR) - sie finden sich im Zytosol und binden an Mineral-
und Glukokortikoide gleich gut. Sie werden von Zellen exprimiert, die am
Flüssigkeitshaushalt beteiligt sind (Nieren, Colon, Schweißdrüsen),
aber auch von anderen (ZNS, Herz, braunes Fettgewebe, Epithelzellen).
Ihre Aktivierung erhöht u.a. das extrazelluläre Flüssigkeitsvolumen und
den Blutdruck
Mineralkortikoidrezeptoren (Aldosteronrezeptoren, mineralocorticoid receptor MR) - sie finden sich im Zytosol und binden an Mineral-
und Glukokortikoide gleich gut. Sie werden von Zellen exprimiert, die am
Flüssigkeitshaushalt beteiligt sind (Nieren, Colon, Schweißdrüsen),
aber auch von anderen (ZNS, Herz, braunes Fettgewebe, Epithelzellen).
Ihre Aktivierung erhöht u.a. das extrazelluläre Flüssigkeitsvolumen und
den Blutdruck Östrogenrezeptoren
Östrogenrezeptoren  (estrogen receptor ER) wirken vor allem als DNA-bindender
Transkriptionsfaktor und beeinflussen so die Genexpression der
Zielzellen
(estrogen receptor ER) wirken vor allem als DNA-bindender
Transkriptionsfaktor und beeinflussen so die Genexpression der
Zielzellen Ähnliches gilt für Progesteronrezeptoren (progesterone receptor PR); ist kein Hormon gebunden, hemmt dies die Transkription der entsprechenden Genabschnitte
Ähnliches gilt für Progesteronrezeptoren (progesterone receptor PR); ist kein Hormon gebunden, hemmt dies die Transkription der entsprechenden Genabschnitte Androgenrezeptoren
(androgen receptor AR) werden in den meisten Geweben exprimiert. Sie erhalten nicht nur
während der Entwicklung des Embryos und der Pubertät, sondern während
des gesamten Lebens die Ausprägung des männlichen Erscheinungsbilds und
Verhaltens
Androgenrezeptoren
(androgen receptor AR) werden in den meisten Geweben exprimiert. Sie erhalten nicht nur
während der Entwicklung des Embryos und der Pubertät, sondern während
des gesamten Lebens die Ausprägung des männlichen Erscheinungsbilds und
Verhaltens Vitamin D- (Calcitriol)-Rezeptoren (vitamin D receptor VDR) treten in allelen Variationen auf (Polymorphismus) und binden vorzugsweise Vit.D3 - 1,25(OH)2 (um zwei Zehnerpotenzen stärker als 25(OH)D3 und 24,25(OH)2D3)
Vitamin D- (Calcitriol)-Rezeptoren (vitamin D receptor VDR) treten in allelen Variationen auf (Polymorphismus) und binden vorzugsweise Vit.D3 - 1,25(OH)2 (um zwei Zehnerpotenzen stärker als 25(OH)D3 und 24,25(OH)2D3) Retinsäurerezeptoren
Retinsäurerezeptoren  (retinoic acid receptor RAR) treten in mehreren Formen auf (α, β, γ) und werden durch all-trans- sowie 9-cis-Retinsäure aktiviert,
d.h. sie wirken dann als Transkriptionsfaktoren, was u.a. für die
Funktionsfähigkeit des Nervengewebes wichtig ist
(retinoic acid receptor RAR) treten in mehreren Formen auf (α, β, γ) und werden durch all-trans- sowie 9-cis-Retinsäure aktiviert,
d.h. sie wirken dann als Transkriptionsfaktoren, was u.a. für die
Funktionsfähigkeit des Nervengewebes wichtig ist Schilddrüsenhormonrezeptoren (thyroid hormone receptor
TR) binden T3 und T4. Aktiviert wirken sie als Transkriptionsfaktoren,
regulieren den Stoffwechsel, spielen eine kritische Rolle für die
Entwicklung des Organismus und beeinflussen die Herzfrequenz (positiv
chronotrop).
Schilddrüsenhormonrezeptoren (thyroid hormone receptor
TR) binden T3 und T4. Aktiviert wirken sie als Transkriptionsfaktoren,
regulieren den Stoffwechsel, spielen eine kritische Rolle für die
Entwicklung des Organismus und beeinflussen die Herzfrequenz (positiv
chronotrop). Progestine (21 C), z.B. Progesteron. Wirkung vor allem über den Progesteronrezeptor
Progestine (21 C), z.B. Progesteron. Wirkung vor allem über den Progesteronrezeptor Mineralcorticoide (21 C), z.B. Aldosteron. Wirkung vor allem über den Mineralcorticoidrezeptor
Mineralcorticoide (21 C), z.B. Aldosteron. Wirkung vor allem über den Mineralcorticoidrezeptor Glukocorticoide (21 C), z.B. Cortisol. Wirkung vor allem über den Glucocorticoidrezeptor
Glukocorticoide (21 C), z.B. Cortisol. Wirkung vor allem über den Glucocorticoidrezeptor Androgene (19 C), z.B. Testosteron. Wirkung vor allem über den Androgenrezeptor
Androgene (19 C), z.B. Testosteron. Wirkung vor allem über den Androgenrezeptor Östrogene (18 C), z.B. Östradiol, Östriol. Wirkung vor allem über den Östrogenrezeptor
Östrogene (18 C), z.B. Östradiol, Östriol. Wirkung vor allem über den Östrogenrezeptor  Cholecalciferol (Vitamin-D-Hormon, 1,25-(OH)2-D3), ein Secosteroid, d.h. einer von 4 Sechserringen ist aufgebrochen. Wirkung über den Vitamin-D-Rezeptor
Cholecalciferol (Vitamin-D-Hormon, 1,25-(OH)2-D3), ein Secosteroid, d.h. einer von 4 Sechserringen ist aufgebrochen. Wirkung über den Vitamin-D-Rezeptor Steroide entstehen in Zellen, welche über
entsprechende Enzyme verfügen, welche die Neusynthese der Steroide
ermöglichen (
Steroide entstehen in Zellen, welche über
entsprechende Enzyme verfügen, welche die Neusynthese der Steroide
ermöglichen ( Abbildung).
Nur
bei Bedarf werden sie aus Cholesterin (dessen Ester werden dazu
hydrolysiert) neu gebildet und an den Exrazellulärraum abgegeben,
nachdem sie durch Zytoplasma und Zellmembran diffundiert sind. Steroide gehören zur Gruppe der Isoprenoide, zu denen auch die Gallensäuren
gehören. Beide - Steroide und Gallensäuren - werden von der Zelle aus
Acetyl-CoA über die 5C-Zwischenstufe Isopentenyl-Pyrophosphat (IPP,
"aktives Isopren") aufgebaut.
Abbildung).
Nur
bei Bedarf werden sie aus Cholesterin (dessen Ester werden dazu
hydrolysiert) neu gebildet und an den Exrazellulärraum abgegeben,
nachdem sie durch Zytoplasma und Zellmembran diffundiert sind. Steroide gehören zur Gruppe der Isoprenoide, zu denen auch die Gallensäuren
gehören. Beide - Steroide und Gallensäuren - werden von der Zelle aus
Acetyl-CoA über die 5C-Zwischenstufe Isopentenyl-Pyrophosphat (IPP,
"aktives Isopren") aufgebaut.
 Abbildung: Steroidhormonbildung
Abbildung: Steroidhormonbildung
 Abbildung); es wird von der Zelle teils aus Acetat neu gebildet, teils aus dem Extrazellulärraum aufgenommen - über rezeptorvermittelte Endozytose hauptsächlich aus LDL-Partikeln -, z.B. in der zona fasciculata der Nebennierenrinde.
Abbildung); es wird von der Zelle teils aus Acetat neu gebildet, teils aus dem Extrazellulärraum aufgenommen - über rezeptorvermittelte Endozytose hauptsächlich aus LDL-Partikeln -, z.B. in der zona fasciculata der Nebennierenrinde.  ACAT wirkt also in Richtung Speicherung von Cholesterinestern in Fetttröpfchen, HSL in die Gegenrichtung (Mobilisierung von freiem Cholesterin).
ACAT wirkt also in Richtung Speicherung von Cholesterinestern in Fetttröpfchen, HSL in die Gegenrichtung (Mobilisierung von freiem Cholesterin).| Charakteristika von Steroidhormonen |
| Bei Bedarf / Anregung Synthese aus Cholesterin durch enzymatische Aktivität (regulierte Zwischenschritte) |
| Keine Speicherung in Vesikeln |
| Transport im Blut in eiweißgebundener Form (Bindungsproteine) |
| Rasche Wirkung über membranständige, verzögerte Wirkung über intrazelluläre Rezeptoren |
| Orale Gabe möglich (Resorption intakter Moleküle) |
 Das StAR-Protein (StAR, STARD1, steroidogenic acute regulatory protein) ist der geschwindigkeitsbestimmende Faktor der Steroidsynthese. Es fördert den Cholesterintransport über äußere und innere Mitochondrienmembran und den dazwischen liegenden Intermembranraum (Mechanismus unklar: Shuttle? Cholesterinkanal? Membrankontakte?).
Man findet das StAR-Protein in steroidbildenden Zellen: Ovarien
(Theca-Zellen, Gelbkörperzellen), Hoden (Leydig-Zwischenzellen),
Nebennierenrinde. Seine Synthese wird durch LH, ACTH und Angiotensin II angeregt.
Das StAR-Protein (StAR, STARD1, steroidogenic acute regulatory protein) ist der geschwindigkeitsbestimmende Faktor der Steroidsynthese. Es fördert den Cholesterintransport über äußere und innere Mitochondrienmembran und den dazwischen liegenden Intermembranraum (Mechanismus unklar: Shuttle? Cholesterinkanal? Membrankontakte?).
Man findet das StAR-Protein in steroidbildenden Zellen: Ovarien
(Theca-Zellen, Gelbkörperzellen), Hoden (Leydig-Zwischenzellen),
Nebennierenrinde. Seine Synthese wird durch LH, ACTH und Angiotensin II angeregt.  Zur Verwandlung des Cholesterins zu einem bestimmten Steroidhormon bedarf es bestimmter Enzyme (
Zur Verwandlung des Cholesterins zu einem bestimmten Steroidhormon bedarf es bestimmter Enzyme ( Abbildung). So entsteht aus Pregnonolon durch Einwirkung von 3ß-HSD2 (Hydroxysteroiddehydrogenase) Progesteron
- einerseits selbst als Gestagen wirksam, andererseits eine Vorstufe
für Mineral- und Glukokortikoide, Testosteron und Östrogene.
Abbildung). So entsteht aus Pregnonolon durch Einwirkung von 3ß-HSD2 (Hydroxysteroiddehydrogenase) Progesteron
- einerseits selbst als Gestagen wirksam, andererseits eine Vorstufe
für Mineral- und Glukokortikoide, Testosteron und Östrogene. | Hormon-Produktionsrate (gesamt) = Sekretionsrate (aus Hormondrüsen) + zusätzliche Synthese (Gewebe) |
 Transport von Steroidhormonen im Blutplasma  Modifiziert nach Wilkinson / Brown: An Introduction to Neuroendocrinology, 2nd ed., Cambridge University Press 2015 Zahlen gerundet |
||||||
| Steroid |
Konzentration gesamt (nM) | % frei (ungebunden) |
% gebunden |
|||
| an CBG |
an Albumin |
an SHBG |
Halbwertszeit (min) |
|||
| Cortisol |
400 |
4 |
90 |
6 |
0,1 |
50-100 |
| Aldosteron |
0,4 |
40 |
20 |
40 |
0,1 |
~10 |
| Progesteron |
0,6 |
2,4 |
17 |
80 |
0,6 |
~5 |
| Testosteron |
20 |
2,0 |
3 |
40 |
55 |
~10 |
| Östradiol |
0,1 |
2,0 |
0 |
68 |
30 |
20 |
 Abbildung).
Abbildung).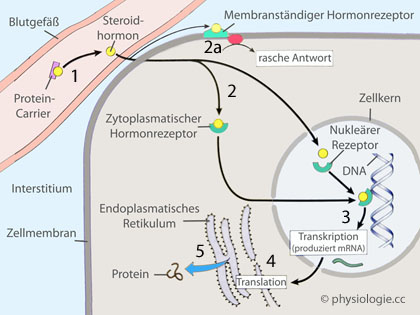
 Abbildung: Rasche und verzögerte Steroidwirkungen
Abbildung: Rasche und verzögerte Steroidwirkungen

 Abbildung: Hormonelle Wirkmechanismen
Abbildung: Hormonelle Wirkmechanismen
 Inaktiviert werden Steroidhormone hauptsächlich
über Sulfatierung und Glukuronierung, Jodothyronine (Schilddrüsenhomone) über Abspaltung
der Jodatome (Dejodasen). Sie
werden dadurch in eine biologisch inaktive und besser lösliche Form
gebracht. Letzteres reduziert die Bindung an Plasmaproteine und
erleichtert die Ausscheidung über den Harn, zu einem geringeren Teil
auch über die Galle.
Inaktiviert werden Steroidhormone hauptsächlich
über Sulfatierung und Glukuronierung, Jodothyronine (Schilddrüsenhomone) über Abspaltung
der Jodatome (Dejodasen). Sie
werden dadurch in eine biologisch inaktive und besser lösliche Form
gebracht. Letzteres reduziert die Bindung an Plasmaproteine und
erleichtert die Ausscheidung über den Harn, zu einem geringeren Teil
auch über die Galle. Über molekulare Mechanismen der Wirkung von Östrogenen auf Zielzellen s. dort
Über molekulare Mechanismen der Wirkung von Östrogenen auf Zielzellen s. dort Über Stoffwechsewirkungen von Cortisol und Aldosteron s. dort
Über Stoffwechsewirkungen von Cortisol und Aldosteron s. dort Über die Physiologie der Schilddrüsenhormone s. dort
Über die Physiologie der Schilddrüsenhormone s. dort Über die Physiologie der Sexualhormone s. dort
Über die Physiologie der Sexualhormone s. dort
 Cholesterin ist die Ausgangssubstanz aller Steroide. Zu ~4/5 wird es mittels rezeptormediierter Enozytose (coated pits) aus
LDL-Partikeln aus dem Blut aufgenommen, ~1/5 wird bedarfsabhängig aus Acetat neu gebildet.
Die intrazelluläre
Speicherung erfolgt als Cholesterinester (ACAT:
Acyl-CoA-Cholesterintransferase) in zytoplasmatischen
Lipidtröpfchen. Hormonsensitive Lipase (HSL) setzt daraus freies
Cholesterin frei (ACTH-Effekt in der Nebennierenrinde). Dieses gelangt
an die innere Mitochondrienmembran (geschwindigkeitslimitierender
Schritt), das Enzym CYP11A1 erzeugt daraus Pregnenolon, die
Ausgangssubstanz aller weiteren Steroidhormone (bis zu 6 enzymatische Stufen in Mitochondrien und glattem endoplasmatischem Retikulum) Cholesterin ist die Ausgangssubstanz aller Steroide. Zu ~4/5 wird es mittels rezeptormediierter Enozytose (coated pits) aus
LDL-Partikeln aus dem Blut aufgenommen, ~1/5 wird bedarfsabhängig aus Acetat neu gebildet.
Die intrazelluläre
Speicherung erfolgt als Cholesterinester (ACAT:
Acyl-CoA-Cholesterintransferase) in zytoplasmatischen
Lipidtröpfchen. Hormonsensitive Lipase (HSL) setzt daraus freies
Cholesterin frei (ACTH-Effekt in der Nebennierenrinde). Dieses gelangt
an die innere Mitochondrienmembran (geschwindigkeitslimitierender
Schritt), das Enzym CYP11A1 erzeugt daraus Pregnenolon, die
Ausgangssubstanz aller weiteren Steroidhormone (bis zu 6 enzymatische Stufen in Mitochondrien und glattem endoplasmatischem Retikulum) Steroidhormone entstehen in Nebennierenrinde, Ovarien, Testes, Plazenta. Sie
haben folgende Eigenschaftern: Synthese durch enzymatische Aktivität
aus Cholesterin, keine Speicherung in Vesikeln, Regulation über enzymatische Zwischenschritte, Transport im Blut an Bindungsproteinen, Wirkung über intrazelluläre Rezeptoren, orale Gabe möglich Steroidhormone entstehen in Nebennierenrinde, Ovarien, Testes, Plazenta. Sie
haben folgende Eigenschaftern: Synthese durch enzymatische Aktivität
aus Cholesterin, keine Speicherung in Vesikeln, Regulation über enzymatische Zwischenschritte, Transport im Blut an Bindungsproteinen, Wirkung über intrazelluläre Rezeptoren, orale Gabe möglich Die Produktionsrate setzt sich zusammen aus der Sekretionsrate spezifischer Hormondrüsen und zusätzlicher Synthese im Gewebe. Sezernierte
Steroidhormone können weiter verändert werden (periphere Konversion), z.B.
verwandelt Aromatase in Fett-, Muskel- und anderen Geweben Testosteron zu Östradiol, beteiligen sich Mutter und Fetus gemeinsam an der plazentaren Steroidsynthese Die Produktionsrate setzt sich zusammen aus der Sekretionsrate spezifischer Hormondrüsen und zusätzlicher Synthese im Gewebe. Sezernierte
Steroidhormone können weiter verändert werden (periphere Konversion), z.B.
verwandelt Aromatase in Fett-, Muskel- und anderen Geweben Testosteron zu Östradiol, beteiligen sich Mutter und Fetus gemeinsam an der plazentaren Steroidsynthese Steroidhormone können an Rezeptoren wirken, die Hauptangriffspunkt anderer Steroide sind (Cross-talk). Bei Anlagerung des Hormons dissoziieren die Rezeptoren HSP ab
und dimerisieren; sie haben eine hormonerkennende und eine DNA-erkennende Domäne. Letztere lagert sich an HRE, das startet die Genexpression. Neben nukleären
gibt es auch Membranrezeptoren für Steroide, sie wirken innerhalb von
Sekunden bis Minuten (second messenger, intrazelluläre Verstärkung,
Wirkung auf Ionenkanäle) Steroidhormone können an Rezeptoren wirken, die Hauptangriffspunkt anderer Steroide sind (Cross-talk). Bei Anlagerung des Hormons dissoziieren die Rezeptoren HSP ab
und dimerisieren; sie haben eine hormonerkennende und eine DNA-erkennende Domäne. Letztere lagert sich an HRE, das startet die Genexpression. Neben nukleären
gibt es auch Membranrezeptoren für Steroide, sie wirken innerhalb von
Sekunden bis Minuten (second messenger, intrazelluläre Verstärkung,
Wirkung auf Ionenkanäle) Hydrophobe Hormone binden im Blutplasma an Transportproteine, teils
unspezifisch (Albumin), teils spezifisch (sexualhormonbindendes
Globulin SHBG, Transkortin CBG, thyroxinbindendes Präalbumin,
thyroxinbindendes Globulin TBG). Sie entziehen
sich dadurch raschem Abbau und haben eine Halbwertszeit von Minuten
(Progesteron ~5, Testosteron / Östradiol / Aldosteron 10-20, Cortisol
50-100) bis Tagen (T3, T4). Diese Proteine
regulieren Bioverfügbarkeit und Lebensdauer der Hormone und sind ein rasch verfügbarer Speicher. Der freie
Anteil des Hormons ist biologisch aktiv Hydrophobe Hormone binden im Blutplasma an Transportproteine, teils
unspezifisch (Albumin), teils spezifisch (sexualhormonbindendes
Globulin SHBG, Transkortin CBG, thyroxinbindendes Präalbumin,
thyroxinbindendes Globulin TBG). Sie entziehen
sich dadurch raschem Abbau und haben eine Halbwertszeit von Minuten
(Progesteron ~5, Testosteron / Östradiol / Aldosteron 10-20, Cortisol
50-100) bis Tagen (T3, T4). Diese Proteine
regulieren Bioverfügbarkeit und Lebensdauer der Hormone und sind ein rasch verfügbarer Speicher. Der freie
Anteil des Hormons ist biologisch aktiv  Steroidhormone werden je nach Typ enzymatisch inaktiviert (z.B. Cytochrom-P450-abhängige Monooxygenasen), Schilddrüsenhomone über Dejodierung, anschließend sulfatiert / glukoruniert, renal und biliär ausgeschieden Steroidhormone werden je nach Typ enzymatisch inaktiviert (z.B. Cytochrom-P450-abhängige Monooxygenasen), Schilddrüsenhomone über Dejodierung, anschließend sulfatiert / glukoruniert, renal und biliär ausgeschieden |
