

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

 Allele: αλλήλων = einander, gegenseitig
Allele: αλλήλων = einander, gegenseitig
Chiasma: χίασμα = Kreuzung
Diakinese: διά = (hin-) durch, κίνησις =Bewegung
Diktyotän: δικτον = (Fang-) Netz, ταινἰα = Band
Dimorphismus: δίμορφος = zweigestaltig
Diplotän: διπλόος = doppelt, ταινἰα = Band
diploid: διπλόος = doppelt
Euploidie: εὖ = gut, richtig, πλόος = -fach
Gamete: γαμετή(ς) = Ehefrau, Ehemann / γάμος = Hochzeit
Gonade: γονή = Geschlecht, Zeugung, αδένας = Drüse
haploid: ἁπλόος = einfach
Leptotän: λεπτός = dünn, ταινἰα = Band
Meiose: μείωσις = Verkleinerung, Verminderung
Müller-Gänge: Johannes Peter Müller
Pachytän: παχύς = dick, ταινἰα = Band
Parthenogenese: παρθένος = Jungfrau, γένεσις = Entstehung, Geburt
synaptonemal: συναψις = Verbindung, νῆμα = Faden
Wolff-Gänge: Kaspar Wolff
Zygote: ζύγόν = Joch (Zusammengespanntes), ζυγουν = verbinden (zwei Zellen)
Sexuelle
Reproduktion bringt in der
Generationenfolge hohe molekulare Variabilität und bessere
Anpassungsfähigkeit, z.B. in der immunologischen Abwehr.
Genetische Ausstattung, Hormone, endokrine Rezeptoren, Modifikationen in der Proteinsynthese sind Faktoren, welche die Funktion der
Geschlechtsorgane und die Ausbildung von Geschlechtsmerkmalen bestimmen. Die
Geschlechtlichkeit unterliegt auch psychischen und
Umweltfaktoren.
Die primäre Anlage der Wolff- und Müller-Gänge ist bei beiden Geschlechtern vorhanden. Das
Zusammenwirken mehrerer Faktoren - pro-männlich, anti-männlich,
pro-weiblich, anti-weiblich genannt - bestimmt die geschlechtliche
Differenzierung: Treten z.B. TDF, MIF und Testosteron auf, bilden sich männliche, bleiben sie aus, weibliche Geschlechtsorgane.
Die Reifeteilung (Meiose) verteilt das mütterliche und väterliche
Genom auf gemischte Chromatiden. Durch die Neukombination der Gene von
Generation zu Generation treten immer neue molekulare Muster auf, die
z.B. immunologische Diversität und Anpassungsfähigkeit fördern.
|
Übersicht  Geschlechtlichkeit
Geschlechtlichkeit  Entwicklung der Sexualorgane
Entwicklung der Sexualorgane  Gametogenese
Gametogenese  Meiose
Meiose Ploidie
Ploidie

Geschlechtsdetermination  Mitose, Meiose, Zytokinese
Mitose, Meiose, Zytokinese  Homologie
Homologie  Gamete, Fetilisierung, Haplo- / Diploidie, Zygote
Gamete, Fetilisierung, Haplo- / Diploidie, Zygote  Rekombination
Rekombination  synaptonemal
synaptonemal  Ploidie
Ploidie
 Core messages
Core messages
Sexuelle Reproduktion beruht auf der individuellen Ausbildung eines weiblichen bzw. männlichen Sexualsystems (sexuelle Differenzierung). Dazu notwendige Gene befinden sich auf Sexchromosomen (Heterosomen:
X und Y). Sowohl der väterliche als auch der mütterliche
Chromosomensatz steuert je ein solches Heterosom (X oder Y) bei; das
resultierende Chromosomenpaar lautet normalerweise entweder XX (→ weiblicher Organismus) oder XY (→ männlicher Organismus).
Das genotypische Geschlecht ist durch die im Zellkern vorhandenen Geschlechtschromosomen bestimmt. Dieses führt zu einem entsprechenden gonadalen Geschlecht (Anlage der Gonaden: Ovarien, Hoden), und dieses schließlich zu einem durch spezifische Hormonmuster determinierten phänotypischen Geschlecht (männliches / weibliches Erscheinungsbild).
Urkeimzellen (primordial germ cells,
PGCs) stammen aus dem Dottersack, teilen sich mitotisch und wandern
sekundär in die Keimanlagen ein, wo sie etwa nach fünf Wochen
embryonaler Entwicklung ihre Position einnehmen.
Die Gonadenanlagen sind zunächst nicht unterscheidbar (indifferent);
die weitere Differenzierungn hängt von der Anwesenheit von Keimzellen (Gameten, germ cells) - Spermatogonien oder Oogonien
- ab. Die Anwesenheit von Y-Chromosomen triggert die Entwicklung von
Testes (Testosteronproduktion durch Leydig-Zellen ab der 10.
Entwicklungswoche); ihre Abwesenheit führt zur Differenzierung in
Richtung von Ovarien.
Hormone wirken sich auf körperliche und Verhaltenseigenschaften aus
Warum Sex? Welchen biologischen Vorteil sexuelle gegenüber asexueller Fortpflanzung (Parthenogenese  ) hat, ist nach wie vor Gegenstand evolutionstheoretischer Diskussion. Nicht
wenige Arten verzichten auf sexuelle Reproduktion, klonale Vermehrung
ist eine alternative Option, die ihre Vorteile hat.
) hat, ist nach wie vor Gegenstand evolutionstheoretischer Diskussion. Nicht
wenige Arten verzichten auf sexuelle Reproduktion, klonale Vermehrung
ist eine alternative Option, die ihre Vorteile hat.
So verleiht z.B.
die Kombination eines normalen und eines spezifisch mutierten
Hämoblobin-Gens (Heterozygotie) Schutz gegenüber Malaria.
Bei parthenogenetischer Reproduktion bliebe diese vorteilhafte
Kombination bei allen Nachkommen erhalten; bei sexueller Fortpflanzung
von Eltern mit dieser gemischten Anlage nur
bei jedem zweiten (25% der Nachkommen erben zwei Chromosomen mit
normalem Hb-Gen, der Schutz vor Malaria ist verloren; 25% haben zwei
mutierte Gene und erkranken an Sichelzellanämie).

Abbildung: Meiose und Mitose
Nach einer Vorlage bei McGraw-Hill Comp.
Zweck der Meiose ist die Verteilung väterlichen und
mütterlichen Erbgutes (diploider
Chromosomensatz: Allele jeweils doppelt vorhanden) auf Chromatiden mit
gemischtem Erbgut. Eizelle und Samenzelle haben einen einfachen
Chromosomensatz (haploid, N).
Ein Allel  ist eine (von meist zwei: von Vater und von Mutter stammende) Form eines Gens.
ist eine (von meist zwei: von Vater und von Mutter stammende) Form eines Gens.
Bei der Befruchtung entstehen
diploide Zellen. Bei der Mitose verdoppeln sich diploide Zellen (2N)

Die
Vorteile der geschlechlichen Variante sind (auch mathematisch) nicht
unmittelbar
einsichtig, aber es scheint so zu sein, dass ständige Gendurchmischung
über Generationen einen Überlebens- und Anpassungsvorteil bietet. Die Meiose
ermöglicht freies Kombinieren der Gene aus früheren Generationen beider
Eltern, wie beim Mischen von Spielkarten entstehen dabei immer neue
Muster, und bekanntlich ist molekularbiologisch kein Individuum mit
einem anderen ident.
Selbst die Zellen eines
Individuums sind genetisch nicht ident ausgestattet: Während der
Ontogenese können Abweichungen vom ursprünglichen Genmuster auftreten,
vielleicht schon nach der ersten Teilung der befruchteten Eizelle -
jeweils eine Hälfte des Organismus verfügt dann über einen etwas anderen
Gensatz; bei späteren Abweichungen resultieren entsprechend kleinere
genetisch diverse Einheiten (z.B. Organe).
Aus sexueller Reproduktion mit ihrer hohen Variabilität molekularer Muster ergibt sich offenbar eine bessere
Anpassungsfähigkeit, z.B. im Immunsystem (gegenüber Infektionen).
Tatsächlich scheinen Arten, die sich asexuell reproduzieren, relativ
jung zu sein und über phylogenetisch kurze Zeiträume (Jahrtausende)
wieder auszusterben.
 Unter Geschlechtsdetermination (Sex determination) versteht man den Vorgang in der Embryonalperiode, durch den das chromosomale Geschlecht (Karyotyp: Muster an Geschlechtschromosomen - Gonosomen, Heterosomen -: XX, XY) die Ausbildung des gonadalen Geschlechts (Vorhandensein von Ovarien, Testes: Gonaden
Unter Geschlechtsdetermination (Sex determination) versteht man den Vorgang in der Embryonalperiode, durch den das chromosomale Geschlecht (Karyotyp: Muster an Geschlechtschromosomen - Gonosomen, Heterosomen -: XX, XY) die Ausbildung des gonadalen Geschlechts (Vorhandensein von Ovarien, Testes: Gonaden  ) bestimmt.
) bestimmt.
Geschlechtshormone aus den Gonaden bzw. deren Wirkung auf Hormonrezeptoren (überall im Körper) bestimmen die Geschlechtsmerkmale.
 Primäre Geschlechtsmerkmale betreffen die Geschlechtsorgane;
Primäre Geschlechtsmerkmale betreffen die Geschlechtsorgane;

 sekundäre bilden sich während der Pubertät aus, z.B. Brüste, Behaarungstyp,
Körperbau, Stimmlage (bei Männern um eine Oktave tiefer als bei
Frauen);
sekundäre bilden sich während der Pubertät aus, z.B. Brüste, Behaarungstyp,
Körperbau, Stimmlage (bei Männern um eine Oktave tiefer als bei
Frauen);

 als tertiäre
Merkmale kann man solche (mehr oder weniger geschlechtstypische
Charakteristika) verstehen, die sich in Psyche und sozialem Verhalten
äußern.
als tertiäre
Merkmale kann man solche (mehr oder weniger geschlechtstypische
Charakteristika) verstehen, die sich in Psyche und sozialem Verhalten
äußern.
Chromosomale Unterschiede. Ein X-Chromosom hat schätzungsweise 800 Gene, ein Y-Chromosom nur etwa
50. Die meisten geschlechtsspezifischen Unterschiede erklären sich allerdings durch ungleiche
Realisierung von Genen an anderen Chromosomen (Autosomen): Allein im
Skelettmuskel werden über 3000 Gene geschlechtsabhängig unterschiedlich
exprimiert. Dies ist z.B. der Grund, warum Frauen über einen
(durchschnittlich) höheren Prozentsatz an Typ-I- (slow twitch-) Fasern
verfügen als Männer; diese Fasern zeichnen sich durch höhere Ausdauer
aus. (Männer verfügen hingegen über mehr Typ-II-Fasern, die hohe
Kontraktionskraft liefern, aber rasch ermüden.)
Unterschiedliche Muster an Hormonen - und differierende Aktivitäten von Hormonrezeptoren - resultieren so in sexuellem Dimorphismus
 (Unterschiede in Form und Funktion von Organismen, die durch das
Geschlecht bedingt sind). Dieser Dimorphismus
zeigt sich fast überall: Körpergröße, Gewicht, Fettverteilung, Körperformen, Körperzusammensetzung, Haut- und Behaarungstyp, Atemvolumina, Knochendichte und -form, Blut (Erythrozytenzahl), Muskelmasse, Gehirn etc.
(Unterschiede in Form und Funktion von Organismen, die durch das
Geschlecht bedingt sind). Dieser Dimorphismus
zeigt sich fast überall: Körpergröße, Gewicht, Fettverteilung, Körperformen, Körperzusammensetzung, Haut- und Behaarungstyp, Atemvolumina, Knochendichte und -form, Blut (Erythrozytenzahl), Muskelmasse, Gehirn etc.

 Abbildung: Transformation des genitalen Gangsystems
Abbildung: Transformation des genitalen Gangsystems
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Das
genitale Gangsystem ermöglicht den Transport von Eizellen bzw.
Spermatozoen zum Ort der Befruchtung.
Die (mesonephrischen)
Wolff-Gänge entwickeln
sich im männlichen Organismus zu ductus deferens (Samenleiter) und
anderen Strukturen, die Müller-Gänge degenerieren.
Die (paramesonephrischen) Müller-Gänge werden im
weiblichen Organismus zu Eileiter, Uterus und oberer Vagina - die
Wolff-Gänge degenerieren

Entwicklung des Reproduktionstrakts
Die
Entwicklung der Geschlechtsorgane beginnt mit einer generellen
Grundorganisation ( Abbildung): Die primären Anlagen für die Wolff- und Müller-Gänge
Abbildung): Die primären Anlagen für die Wolff- und Müller-Gänge
 sind zunächst beide vorhanden. Dann kommt es zu einer hormonellen Weichenstellung:
sind zunächst beide vorhanden. Dann kommt es zu einer hormonellen Weichenstellung:
 Entweder werden "männliche" Faktoren
(TDF, AMH, Testosteron) gebildet, das führt zur Bildung
von Hoden (ab der 6. Gestationswoche), Samenleitern und Begleitdrüsen, Regression der Müller-Gänge (ab der 8. Gestationswoche), Ausbildung männlicher Genitalien (ab 9.-12. Gestationswoche, d.h. nach Beginn der letzten Mensesblutung),
Entweder werden "männliche" Faktoren
(TDF, AMH, Testosteron) gebildet, das führt zur Bildung
von Hoden (ab der 6. Gestationswoche), Samenleitern und Begleitdrüsen, Regression der Müller-Gänge (ab der 8. Gestationswoche), Ausbildung männlicher Genitalien (ab 9.-12. Gestationswoche, d.h. nach Beginn der letzten Mensesblutung),
 oder diese
Signale bleiben aus, was die Atresierung der Wolff-Gänge (ab der 8. Gestationswoche) und Differenzierung
in Richtung Eileiter, Uterus, weiblichen Genitalien zur Folge hat.
oder diese
Signale bleiben aus, was die Atresierung der Wolff-Gänge (ab der 8. Gestationswoche) und Differenzierung
in Richtung Eileiter, Uterus, weiblichen Genitalien zur Folge hat.
Stromazellen in den Gonaden beider Geschlechter entwickeln sich zu androgenproduzierenden endokrinen Zellen.
Die
Geschlechtlichkeit bildet sich entsprechend dem Zusammenwirken mehrerer Gene und entsprechend exprimierter Faktoren aus (XY sex-determination system). Je nach Wirkungsprofil werden diese manchmal als
pro-männlich (pro-male, z.B. der Testis-determining factor TDF, der durch das SRY-Gen codiert wird), anti-männlich (anti-male), pro-weiblich (pro-female) und anti-weiblich (anti-female)
bezeichnet. Ohne Anwesenheit bzw. Wirkung von SRY geht die Entwicklung automatisch in Richtung weiblicher (default program), mit SRY in Richtung männlicher Organismus. Für die Differenzierung der Hoden bedarf es eines weiteren Transkriptionsfaktors, SOX9 (codiert durch das SOX9-Gen).
SRY bedeutet sex-determining region on Y - dieses Gen befindet sich normalerweise auf dem kurzen Arm von Y-Chromosomen. Es codiert einen Transkriptionsfaktor,
der die Expression mehrerer Gene reguliert. Einige von diesen Genen
stoßen die Differenzierung in Richtung männlicher Gonaden (und damit
u.a. intensive Testosteronproduktion) an.
 Das SRY-Gen codiert die geschlechtsbestimmende Wirkung des Y-Chromosoms.
Seine Aktivität ist notwendig, um die Maskulinisierung der embryonalen
Gonaden hervorzurufen - das SRY-Gen legt sozusagen den Schalter in
Richtung Entwicklung eines männlichen Organismus um. Beim weiblichen
Embryo ist kein SRY-Gen vorhanden (XX), was
die Expression "weiblicher" Transkriptionsfaktoren und die
Differenzierung der Gonaden zu Ovarien zur Folge hat.
Das SRY-Gen codiert die geschlechtsbestimmende Wirkung des Y-Chromosoms.
Seine Aktivität ist notwendig, um die Maskulinisierung der embryonalen
Gonaden hervorzurufen - das SRY-Gen legt sozusagen den Schalter in
Richtung Entwicklung eines männlichen Organismus um. Beim weiblichen
Embryo ist kein SRY-Gen vorhanden (XX), was
die Expression "weiblicher" Transkriptionsfaktoren und die
Differenzierung der Gonaden zu Ovarien zur Folge hat.
Dabei kommt es nicht darauf an, auf welchem Chromosom das Gen zu liegen kommt, sondern dass es intakt ist.
Ist das SRY-Gen defekt (XY∆SRY), entsteht ein phänotypisch weiblicher Organismus. Transloziert das SRY-Gen auf ein X-Chromosom (XXSRY), resultiert ein phänotypisch männlicher Organismus.
Die Bandbreite der phänotypischen Verteilung von geschlechtstypischen Merkmalen
ist groß. Es kann vorkommen, dass die Ausbildung männlicher bzw.
weiblicher Merkmale in mehr oder weniger gemischter Form erfolgt. Das
liegt nicht nur am Hormonmuster an sich; von großer Bedeutung ist auch Expression und Funktion von Hormonrezeptoren.
Deren Aktivität kann wiederum unter hormoneller Kontrolle stehen; so ist z.B. zur Induktion des Progesteronrezeptors (ein Transkriptionsfaktor wie auch andere Steroidrezeptoren: Die aktive Form startet im Zellkern die Proteinsynthese)
Progesteron selbst notwendig. (Die Induktion zum aktiven
Transkriptionsfaktor erfolgt durch Strukturänderung des
Rezeptormoleküls; diese kann durch Progesteronantagonisten verhindert
werden.)

 Abbildung: Steuerung der geschlechtlichen Entwicklung
Abbildung: Steuerung der geschlechtlichen Entwicklung
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Der Y-chromosomal codierte Testis determining factor TDF wird auch als Sex-determining region Y (SRY) protein
bezeichnet. Er ist ein Transkriptionsfaktor, der nach einer "neutralen"
frühen Entwicklungsphase aktiv wird. Fehlt er, entwickeln sich die
Gonadenanlagen zu Ovarien.
Das aus den Sertoli-Zellen stammende Glykoprotein 'Anti-Müller-Hormon' (AMH, Müllerian inhibiting factor
MIF) bewirkt während der ersten Schwangerschaftswochen die Rückbildung
der Müller-Gänge.
Die Wolff-Gänge entwickeln sich zu Nebenhoden,
Samenleiter und Samenblase; Testosteron fördert ihre Differenzierung

 Die
Geschlechtlichkeit einer Person wird durch mehrere Faktoren bestimmt. Biologische Faktoren sind:
Die
Geschlechtlichkeit einer Person wird durch mehrere Faktoren bestimmt. Biologische Faktoren sind:
 Genotypisch-chromosomal: Zur Ausbildung männlicher Merkmale
ist das Y-Chromosom notwendig. Sein SRY-Gen (Sex determining region of Y) kodiert einen Transkriptionsfaktor, den Testis-determining factor (TDF); dieser steuert die weitere Entwicklung zum männlichen Geschlecht.
Genotypisch-chromosomal: Zur Ausbildung männlicher Merkmale
ist das Y-Chromosom notwendig. Sein SRY-Gen (Sex determining region of Y) kodiert einen Transkriptionsfaktor, den Testis-determining factor (TDF); dieser steuert die weitere Entwicklung zum männlichen Geschlecht.
 Gonadal-hormonell: Hormonbildung in Ovarien oder Hoden.
Gonadal-hormonell: Hormonbildung in Ovarien oder Hoden.
 Phänotypisch (genitales Geschlecht, zu seiner Ausbildung muss die Rezeptorausstattung der betreffenden Gewebe intakt sein).
Phänotypisch (genitales Geschlecht, zu seiner Ausbildung muss die Rezeptorausstattung der betreffenden Gewebe intakt sein).
Die
Geschlechtlichkeit (Sexualität) hat neben biologischen auch andere
Aspekte (z.B. verhaltensbiologisch, emotional, soziologisch).
Neurophysiologisch steht der Hypothalamus im Zentrum, er koordiniert hormonelle und neurale Steuerungsmechanismen der Sexualiutät.
 Afferenzen schließen
so gut wie alle Sinnerorgane ein (visuelle, akustische, Geruchs-,
Berührungsreize), weiters viszerale Signale u.a. von den
Geschlechtsorganen.
Afferenzen schließen
so gut wie alle Sinnerorgane ein (visuelle, akustische, Geruchs-,
Berührungsreize), weiters viszerale Signale u.a. von den
Geschlechtsorganen.
 Efferenzen gelangen auf dem Blutweg (endokrine Signale) und über das Nervensystem - insbesondere autonome ("vegetative") Signale - zu motorischen und sekretorischen Erfolgsorganen.
Efferenzen gelangen auf dem Blutweg (endokrine Signale) und über das Nervensystem - insbesondere autonome ("vegetative") Signale - zu motorischen und sekretorischen Erfolgsorganen.
Das weibliche Geschlechtshomon Progesteron ist der Vorläufer von
Testosteron, und aus Testosteron entsteht (durch Wirkung einer
Aromatase) das Östrogen 17-ß-Östradiol - oder (durch Wirkung einer
Reduktase) das Androgen DHT (5α-Dihydrotestosteron). Enzyme bestimmen
also, ob "weibliche" oder "männliche" Hormone gebildet werden. So haben
z.B. die Ovarien starke, die Testes hingegen keine Atomatase-Aktivität.
 Unterschiedliche Expression von Enzymen ist die Urasche für den sexuellen Dimorphismus der Hormonmuster im Kreislauf.
Unterschiedliche Expression von Enzymen ist die Urasche für den sexuellen Dimorphismus der Hormonmuster im Kreislauf.
Geschlechtshormone haben zwei hauptsächliche Aufgaben:
 Sie organisieren das Differenzierungsmuster von Zellen und Geweben (organizational role)
- z.B. die Ausbildung der inneren Geschlechtsorgane. Solche Wirkungen
erfolgen früh in der embryonalen Entwicklung und sind im Allgemeinen
irreversibel.
Sie organisieren das Differenzierungsmuster von Zellen und Geweben (organizational role)
- z.B. die Ausbildung der inneren Geschlechtsorgane. Solche Wirkungen
erfolgen früh in der embryonalen Entwicklung und sind im Allgemeinen
irreversibel.
 Später lösen sie bestimmte physiologische und Verhaltensmuster aus (activational role); diese Wirkungen sind reversibel.
Später lösen sie bestimmte physiologische und Verhaltensmuster aus (activational role); diese Wirkungen sind reversibel.
Gametogenese - die Ausbildung von Gameten - beginnt mit Mitosen und geht dann in meiotische Reifeteilungen
über, die haploide Zellen (Spermien aus Spermatogonien, Eizellen
aus Oogonien) erzeugen.
 Gameten
Gameten  sind haploide Geschlechtszellen (Spermien-, Eizelle), deren Vereinigung im Rahmen der Befruchtung die sexuelle Fortpflanzung trägt. Ploidie ist die Anzahl der Chromosomensätze in einer Zelle - haploid
sind haploide Geschlechtszellen (Spermien-, Eizelle), deren Vereinigung im Rahmen der Befruchtung die sexuelle Fortpflanzung trägt. Ploidie ist die Anzahl der Chromosomensätze in einer Zelle - haploid  ist ein einfacher (1N DNA - Gameten), diploid
ist ein einfacher (1N DNA - Gameten), diploid  ein zweifacher (2N DNA - somatische Zellen), tretraploid
ein vierfacher Chromosomensatz (4N DNA - primäre Oozyten /
Spermatozyten, vgl. Abbildungen unten). Somatische Zellen haben jeweils
22 Autosomenpaare (à 2 homologen Chromosomen) und ein Paar
Geschlechtschromosomen (XX oder XY), also insgesamt 46 Chromosomen pro Kern. Eine Zygote
ein zweifacher (2N DNA - somatische Zellen), tretraploid
ein vierfacher Chromosomensatz (4N DNA - primäre Oozyten /
Spermatozyten, vgl. Abbildungen unten). Somatische Zellen haben jeweils
22 Autosomenpaare (à 2 homologen Chromosomen) und ein Paar
Geschlechtschromosomen (XX oder XY), also insgesamt 46 Chromosomen pro Kern. Eine Zygote  ist die Zelle, die durch Fertilisierung entstanden ist - sie ist diploid.
ist die Zelle, die durch Fertilisierung entstanden ist - sie ist diploid.
Die Gametogenese wird in vier Phasen eingeteilt:
 Phase 1: Extraembryonaler Ursprung der Keimzellen / Wanderung in die Gonaden. Urkeimzellen (Gonozyten, primordial germ cells PGCs) - die frühesten Vorläufer der Gameten
- werden außerhalb der Gonaden, im Epiblast (Epithelschicht zwischen
Hypoblast und Amnionhöhle) des frühen Embryo, auf ihre "Laufbahn"
festgelegt (spezifiziert). Dabei spielen Steuerfaktoren (bone morphopoetic proteins BMP) eine Rolle, die einige Zellen zur Bildung von regulatorischen Proteinen (B lymphocyte-induced maturation protein-1
BLIMP1) veranlassen, welche die Expression gonozytenspezifischer Gene
regulieren (Repression von Genen, welche die Entwicklung zu somatischen
Zellen anstoßen würden).
Phase 1: Extraembryonaler Ursprung der Keimzellen / Wanderung in die Gonaden. Urkeimzellen (Gonozyten, primordial germ cells PGCs) - die frühesten Vorläufer der Gameten
- werden außerhalb der Gonaden, im Epiblast (Epithelschicht zwischen
Hypoblast und Amnionhöhle) des frühen Embryo, auf ihre "Laufbahn"
festgelegt (spezifiziert). Dabei spielen Steuerfaktoren (bone morphopoetic proteins BMP) eine Rolle, die einige Zellen zur Bildung von regulatorischen Proteinen (B lymphocyte-induced maturation protein-1
BLIMP1) veranlassen, welche die Expression gonozytenspezifischer Gene
regulieren (Repression von Genen, welche die Entwicklung zu somatischen
Zellen anstoßen würden).
Urkeimzellen werden darauf hin mobil und
wandern in das Epithel im Bereich Enddarm / Dottersack der Embryonalanlage ein ( Abbildung).
Bei ihrem Weg durch das dorsale Mesenterium orientieren sie sich an der
Anwesenheit zellulärer und extrazellulärer Faktoren. Ihre Rezeptoren
erkennen Konzentrationsgradienten von Orientierungsfaktoren aus den Gonaden und dem Mesenterium (stromal cell-derived factor 1 SDF1, stem cell factor SCF).
Abbildung).
Bei ihrem Weg durch das dorsale Mesenterium orientieren sie sich an der
Anwesenheit zellulärer und extrazellulärer Faktoren. Ihre Rezeptoren
erkennen Konzentrationsgradienten von Orientierungsfaktoren aus den Gonaden und dem Mesenterium (stromal cell-derived factor 1 SDF1, stem cell factor SCF).
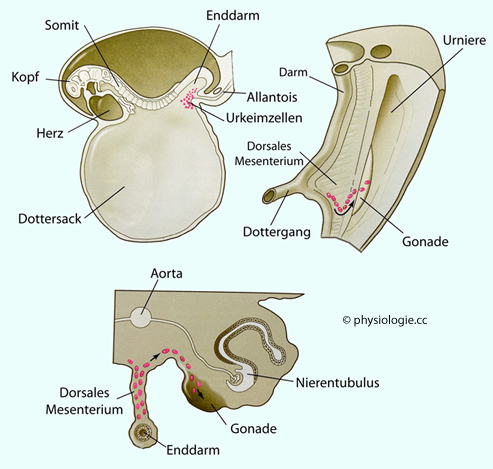
 Abbildung: Ursprung und Wanderung der Urkeimzellen
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Abbildung: Ursprung und Wanderung der Urkeimzellen
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Links oben:
Lage der Urkeimzellen in einem Embryo (16-Somiten-Stadium; Somit =
"Ursegment"). Die Zellen werden durch regulatorische Proteine an einer
Entwicklung zu somatischen Zellen gehindert.
Rechts oben: Eine Woche später
verlassen die Urkeimzellen die Darmwand und betreten das dorsale
Mesenterium auf ihrem Weg zu den Gonaden. Die Migration wird durch die
Anwesenheit von Fibronektin in der extrazelluläre Matrix erleichtert.
Unten: Querschnitt durch den
Migrationspfad. In der Gonadenanlage angelangt, beginnen die
Urkeimzellen mit Gewebezellen zu interagieren, um sich in ihrer
Umgebung als Oogonien oder Spermatogonien zu etablieren.
Pfeile deuten die Bewegungsrichtung der Urkeimzellen an

 Phase 2: Mitotische Zunahme der Zahl an Keimzellen. In den Gonaden angelangt, durchlaufen die Urkeimzellen zahlreiche mitotische Zellteilungen. Ihre Zahl nimmt exponentiell zu. Oogonien teilen sich nur während der Embryonal- / Fetalperiode - ab dem 2. Schwangerschaftsmonat, im 5. Schwangerschaftsmonat ist die Höchstzahl
von 7 Millionen erreicht. Anschließend atresieren viele Oogonien - bei
der Geburt finden sich in den Ovarien des neugeborenen Mädchens noch 2 Millionen, postnatal nimmt die Zahl bis
zur Menopause kontinuierlich weiter ab. Spermatogonien
folgen einem anderen Vermehrungsmuster: Ihre
mitotische Multiplikation in den Hodenanlagen stoppt um die Mitte der
Schwangerschaft und nimmt erst mit Erreichen der Pubertät wieder an
Fahrt auf, um sich für das gesamte restliche Leben
fortzusetzen.
Phase 2: Mitotische Zunahme der Zahl an Keimzellen. In den Gonaden angelangt, durchlaufen die Urkeimzellen zahlreiche mitotische Zellteilungen. Ihre Zahl nimmt exponentiell zu. Oogonien teilen sich nur während der Embryonal- / Fetalperiode - ab dem 2. Schwangerschaftsmonat, im 5. Schwangerschaftsmonat ist die Höchstzahl
von 7 Millionen erreicht. Anschließend atresieren viele Oogonien - bei
der Geburt finden sich in den Ovarien des neugeborenen Mädchens noch 2 Millionen, postnatal nimmt die Zahl bis
zur Menopause kontinuierlich weiter ab. Spermatogonien
folgen einem anderen Vermehrungsmuster: Ihre
mitotische Multiplikation in den Hodenanlagen stoppt um die Mitte der
Schwangerschaft und nimmt erst mit Erreichen der Pubertät wieder an
Fahrt auf, um sich für das gesamte restliche Leben
fortzusetzen.
 Phase 3: Meiotische Halbierung der Chromosomenzahl
(diploid zu haploid). Im weiblichen Organismus beginnt die Meiose im 5
Monate alten Embryo. Sie wird zweimal unterbrochen: Im Diplotänstadium
der Prophase I (bis zur Pubertät, mit dekondensiertem und gut
ablesbarem Chromatin) und in der Metaphase II (bis zur Befruchtung) -
vgl. dort. Im männlichen Organismus beginnen meiotische Teilungen mit der Pubertät.
Phase 3: Meiotische Halbierung der Chromosomenzahl
(diploid zu haploid). Im weiblichen Organismus beginnt die Meiose im 5
Monate alten Embryo. Sie wird zweimal unterbrochen: Im Diplotänstadium
der Prophase I (bis zur Pubertät, mit dekondensiertem und gut
ablesbarem Chromatin) und in der Metaphase II (bis zur Befruchtung) -
vgl. dort. Im männlichen Organismus beginnen meiotische Teilungen mit der Pubertät.
 Phase 4: Reifung der Ei- und Samenzellen.
Phase 4: Reifung der Ei- und Samenzellen.
Diese Vorgänge sind in den folgenden Abschnitten beschrieben.
Meiose  (Reifeteilung)
(Reifeteilung)
Schon in den embryonalen Gonaden teilen sich diploide Urkeimzellen (primordial germ cells) mehrfach mitotisch,
es entstehen Spermatogonien und Oogonien, später Spermatozyten und
Oozyten. Diese diploiden Zellen unterziehen sich schließlich einer
Reifeteilung (Meiose). Meiose ist eine spezielle Form der Zellteilung, wobei genetisch rekombinierte, mit hoher Wahrscheinlichkeit untereinander verschiedene Eizellen und Spermien entstehen.
 Abbildung: Meiose
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Abbildung: Meiose
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Schematische Darstellung - generalisierte Keimzelle. In Prophase I findet Genaustausch statt (crossing over).
In den Metaphasen formieren sich Äquatorialplatten, in den Anaphasen
wandern die Chromosomen zu den Zellpolen, in den Telophasen teilt sich
die Zelle.
Vor der ersten meiotischen Teilung hat eine Replikation der DNA bereits
stattgefunden, die Zelle ist diploid und hat eine normale Zahl an
Chromosomen (2n), aber der DNA-Gehalt ist das Doppelte des sonst
üblichen, da das Chromosom vier Chromatiden enthält (4c).
Die erste
Reifeteilung (Reduktionsteilung) hat eine verlängerte Prophase und wird
eingeteilt in Leptotän, Zygotän, Pachytän und Diplotän, gefolgt von der
Diakinese. Die erste Reifeteilung ermöglicht genetische Rekombination; die Tochterzellen sind haploid (1n), aber jedes Chromosom hat zwei Chromatiden (2c).
Die zweite
Reifeteilung (Äquatorialteilung) enztspricht einer Mitose, nur dass die
Zelle vor der Teilung haploid ist (1n, 2c). Die Tochterzellen sind
wirklich haploid (1n, 1c).
 Zu Zentromer, Zentrosom s. dort
Zu Zentromer, Zentrosom s. dort

 Mitose ist die Aufteilung des kopierten Chromosomensatzes auf zwei Tochterkerne, Zytokinese die Aufteilung des Zytoplasmas auf zwei Tochterzellen. Meiose ist die Verteilung des (auf getrennten Chromatiden gespeicherten) väterlichen und
mütterlichen Erbgutes (diploider
Mitose ist die Aufteilung des kopierten Chromosomensatzes auf zwei Tochterkerne, Zytokinese die Aufteilung des Zytoplasmas auf zwei Tochterzellen. Meiose ist die Verteilung des (auf getrennten Chromatiden gespeicherten) väterlichen und
mütterlichen Erbgutes (diploider  Chromosomensatz: Allele
Chromosomensatz: Allele  jeweils doppelt vorhanden) auf "kombinierte" Chromatiden - sie ermöglicht zufallsgesteuerte chromosomale Rekombination (
jeweils doppelt vorhanden) auf "kombinierte" Chromatiden - sie ermöglicht zufallsgesteuerte chromosomale Rekombination ( Abbildung oben).
Abbildung oben).
Die Gametogenese
(Produktion von Geschlechtszellen / Keimzellen) beginnt mit mehrfacher
mitotischer Teilung von Keimzellen (Spermatogonien im männlichen,
Oogonien im weiblichen Embryo). Das erhöht die Zahl dipolider
Vorläuferzellen für spätere Spermatozyten bzw. Oozyten.
Wie die  Abbildung zeigt, stoppt die Gametogenese bei männlichen Feten die Mitosesequenz bereits in utero,
während sich der Vorgang bei weiblichen Feten bis an die Schwelle zur 1.
Reifeteilung mit der Komplettierung primärer Oozyten fortsetzt. So
kommen weibliche Babys bereits mit ihrem endgültigen Satz primärer
Eizellen zur Welt. Männliche Organismen hingegen nehmen die
Spermatogenese erst wieder mit dem Eintritt in die Pubertät auf; die
Spermienbildung läuft dann bei Männern ein Leben lang weiter.
Abbildung zeigt, stoppt die Gametogenese bei männlichen Feten die Mitosesequenz bereits in utero,
während sich der Vorgang bei weiblichen Feten bis an die Schwelle zur 1.
Reifeteilung mit der Komplettierung primärer Oozyten fortsetzt. So
kommen weibliche Babys bereits mit ihrem endgültigen Satz primärer
Eizellen zur Welt. Männliche Organismen hingegen nehmen die
Spermatogenese erst wieder mit dem Eintritt in die Pubertät auf; die
Spermienbildung läuft dann bei Männern ein Leben lang weiter.
Die Meiose
(Reifeteilung) lässt aus einer diploiden Keimzelle haploide Gameten entstehen.
 Abbildung: Gametogenese
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Abbildung: Gametogenese
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Aus
Gründen der Übersichtlichkeit zeigt (auch) diese Abbildung nicht die
vollen Chromosomensätze pro Zelle, sondern nur eines von 22 Autosomen.
Mitosen,
Wachstum und Differenzierung ergeben (diploide)
primäre Spermatozyten bzw. Oozyten, die in der Lage sind, in
Reifeteilungen (Meiosen) einzutreten. Im Rahmen der Meiosen bleiben die
entstandenen Schwesterchromatiden über Zentromere aneinander gekoppelt.
Meiose 1:
Replikation der DNA macht die Zellen tetraploid. Die anschließende
Teilung macht die Tochterzellen diploid. Die Zellteilung ist beim Mann
symmetrisch, bei der Frau wird das Zytoplasma ungleich auf
Tochterzellen aufgeteilt (große sekundäre Eizelle, kleiner Polkörper).
Meiose II. Die sekundären Zellen teilen sich noch einmal - ohne DNA-Replikation, die Tochterzellen sind haploid.
Aus Spermatiden
werden reife Spermatozoen, aus der sekundären wird eine reife Eizelle.
Bei der Befruchtung tragen die Gameten (Spermium und Eizelle) jeweils
ein Autosom zum entsprechenden Paar der Zygote bei

 Entwicklungsstadium von Gameten bei Neugeborenen: Bei männlichen Babys Spermatogonien, bei weiblichen Babys primäre Oozyten.
Entwicklungsstadium von Gameten bei Neugeborenen: Bei männlichen Babys Spermatogonien, bei weiblichen Babys primäre Oozyten.
 Beim Mann werden aus einem primären Spermatozyten 4 reife Spermatozoen
- zuerst aus einem tetraploiden primären Spermatozyt zwei diploide
sekundäre Spermatozyten, dann aus diesen vier haploide Spermatiden, die
sich anschließend zu reifen Spermatozoen differenzieren. Dieser Vorgang
läuft ab der Pubertät für die gesamte verbleibende Lebensspanne des
Mannes ab.
Beim Mann werden aus einem primären Spermatozyten 4 reife Spermatozoen
- zuerst aus einem tetraploiden primären Spermatozyt zwei diploide
sekundäre Spermatozyten, dann aus diesen vier haploide Spermatiden, die
sich anschließend zu reifen Spermatozoen differenzieren. Dieser Vorgang
läuft ab der Pubertät für die gesamte verbleibende Lebensspanne des
Mannes ab.
 Bei
der Frau beginnt die Meiose I in der Fetalphase (5 Monate
Gestationsalter) und stoppt in der Prophase I mindestens bis zur
Erlangung der Geschlechtsreife; dann hängt es vom Schicksal der
betreffenden Eizelle ab, wie und wann der Vorgang sich fortsetzt - eventuell bis zur Ovulation. Es entstehen aus einem primären Oozyten zuerst ein sekundärer
Oozyt (durch ungleiche Aufteilung des Zytoplasmas ist dieser so groß
wie der primäre Oozyt) und ein Polkörper, dann aus dem sekundären
Oozyt eine reife Eizelle und 1-2 weitere Polkörper. Die
Komplettierung der Meiose erfolgt ab der Pubertät der Frau jeweils für
eine Eizelle pro Menstruationszyklus - bis zur Menopause.
Bei
der Frau beginnt die Meiose I in der Fetalphase (5 Monate
Gestationsalter) und stoppt in der Prophase I mindestens bis zur
Erlangung der Geschlechtsreife; dann hängt es vom Schicksal der
betreffenden Eizelle ab, wie und wann der Vorgang sich fortsetzt - eventuell bis zur Ovulation. Es entstehen aus einem primären Oozyten zuerst ein sekundärer
Oozyt (durch ungleiche Aufteilung des Zytoplasmas ist dieser so groß
wie der primäre Oozyt) und ein Polkörper, dann aus dem sekundären
Oozyt eine reife Eizelle und 1-2 weitere Polkörper. Die
Komplettierung der Meiose erfolgt ab der Pubertät der Frau jeweils für
eine Eizelle pro Menstruationszyklus - bis zur Menopause.
Die Meiose besteht aus zwei
aufeinander folgenden Phasen, der 1. und 2. Reifeteilung (Meiose 1 und
Meiose 2):
Meiose 1 (Reduktionsteilung): Rekombination des Erbmaterials
Bevor die erste Reifeteilung (Meiose 1)
beginnt, verdoppelt sich der Chromosomensatz der diploiden Zelle, jedes
der Chromosom enthält nun zwei Chromatiden (4N DNA: Tetraploidie). Dann werden
homologe Chromosomen durch Zug
des Spindelapparates (Kinetochoren) getrennt, nicht aber die
Chromatiden: Es entstehen Schwesterchromatiden, die eng aneinander
liegen bleiben und in der Anaphase zum selben Zellpol wandern.
Die erste meiotische Teilung (Abbildung oben) beginnt mit der Prophase I, die Wochen bis Jahrzehnte dauern kann (die Eizelle verweilt bis zur Ovulation im Diktyotän  -
nachdem der weibliche Fetus bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel gebildet hat, arretieren diese bis zur
Pubertät in der Meiose 1).
-
nachdem der weibliche Fetus bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel gebildet hat, arretieren diese bis zur
Pubertät in der Meiose 1).
 Abbildung: Meiose I - fünf Stadien
Nach einer Vorlage in Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
Abbildung: Meiose I - fünf Stadien
Nach einer Vorlage in Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
In der kurzen Leptotänphase
beginnen die duplizierten Chromosomen (jedes mit Schwesterchromatiden)
zu kondensieren und Paare zu bilden, bleiben aber separiert. Im Bild
sind - stellvertretend für alle 23 - die Chromosomen-Homologe 1 (das
längere) und 7 (das kürzere) vom Vater (blau) und der Mutter (rot)
gezeigt.
Im Zygotän lagern sich
Abschnitte homologer väterlicher und mütterlicher Chromosomenabschnitte aneinander (Synapsis), es bilden sich Tetraden
(Bivalente) aus jeweils 4 Chromatiden. Ein synaptonemaler Komplex bildet sich zwischen den beiden homologen Chromosomen aus - eine Proteinstruktur, die vermutlich den Genaustausch des Crossing-over erleichtert.
Im Pachytän
brechen väterliche und mütterliche Chromatiden auf und werden so
rekombiniert, dass sich der väterliche im mütterlichen DNA-Strang
fortsetzt, und umgekehrt (crossing over).
Die Abbildung zeigt eine Überkreuzung in Chromosom 7 und zwei in
Chromosom 1 - hier der Einfachheit halber in denselben zwei Chromatiden
(die Überkreuzungen können auch über 3 oder alle der 4 Chromatiden
einer Tetrade erfolgen).
Im Diplotän beginnen die synaptonemalen Komplexe zu verschwinden, die Chromosomen lösen sich zum Teil voneinander, außer an den Chiasmata. Teile der DNA werden ablesbar (sie dekondensieren).
Während der Diakinese
- der letzten Komponente der Prophase I - kondensieren und kontrahieren
sich die Chromosomen, es folgt der Übergang zur Metaphase I.

Die Prophase I wird in fünf Stadien unterteilt (  Abbildung):
Abbildung):
 Leptotän
Leptotän  (leptotene stage, leptonema): Die
Chromosomen, bestehend aus zwei (mit identischen Genorten versehenen)
Chromatiden, beginnen sich zu verdichten (zu kondensieren). Die
Telomere (Chromosomenenden) sind an der inneren Kernmembran fixiert.
(leptotene stage, leptonema): Die
Chromosomen, bestehend aus zwei (mit identischen Genorten versehenen)
Chromatiden, beginnen sich zu verdichten (zu kondensieren). Die
Telomere (Chromosomenenden) sind an der inneren Kernmembran fixiert.
 Zygotän
Zygotän  (zygotene stage, zygonema): Homologe (von beiden Eltern stammende) Chromosomen lagern sich paarweise aneinander - es bildet sich ein synaptonemaler Komplex, eine Ansammlung von Proteinen, die in Intervallen große "Rekombinationsknoten" (recombination nodules) aufweist, die wahrscheinlich die DNA-Rekombination beeinflussen.
Dieser Vorgang läuft von den Enden der Chromatiden her
reißverschlussartig ab, wobei der synaptonemale Komplex die beiden
Stränge zusammenhält. Dabei bilden sich - aus vier Chromatiden bestehende -
Bivalente (=Tetraden), beim Mann auch zwischen X- und Y-Chromosomen
(obwohl diese sehr verschiedene Sequenzen aufweisen - die Paarung
erfolgt bei den Geschlechtschromosomen (Heterosomen) vor allem an den
beiden Chromosomenenden, die auch als pseudoautosomale Regionen bezeichnet werden).
(zygotene stage, zygonema): Homologe (von beiden Eltern stammende) Chromosomen lagern sich paarweise aneinander - es bildet sich ein synaptonemaler Komplex, eine Ansammlung von Proteinen, die in Intervallen große "Rekombinationsknoten" (recombination nodules) aufweist, die wahrscheinlich die DNA-Rekombination beeinflussen.
Dieser Vorgang läuft von den Enden der Chromatiden her
reißverschlussartig ab, wobei der synaptonemale Komplex die beiden
Stränge zusammenhält. Dabei bilden sich - aus vier Chromatiden bestehende -
Bivalente (=Tetraden), beim Mann auch zwischen X- und Y-Chromosomen
(obwohl diese sehr verschiedene Sequenzen aufweisen - die Paarung
erfolgt bei den Geschlechtschromosomen (Heterosomen) vor allem an den
beiden Chromosomenenden, die auch als pseudoautosomale Regionen bezeichnet werden).
 Ist der synaptosomale Komplex komplett, kann das Pachytän
Ist der synaptosomale Komplex komplett, kann das Pachytän  (pachytene stage, pachynema) beginnen. Die gepaarten Chromosomen kondensieren weiter, und an Überkreuzungspunkten (chiasmata) erfolgt crossing over,
ein Austausch zwischen väterlichen und mütterlichen DNA-Sequenzen. Beim
Mann bilden sich im Durchschnitt 55, bei der Frau 90 Chiasmata pro
Miose (pro Zelle). So entstehen Chromosomen, die eine
Kombination aus Genabschnitten von Vater und Mutter darstellen, und
damit ein neues individualspezifisches Genmuster. Darüber hinaus tragen die Chiasmata wahrscheinlich zur korrekten Trennung der Chromosomen während der Meiose I bei.
(pachytene stage, pachynema) beginnen. Die gepaarten Chromosomen kondensieren weiter, und an Überkreuzungspunkten (chiasmata) erfolgt crossing over,
ein Austausch zwischen väterlichen und mütterlichen DNA-Sequenzen. Beim
Mann bilden sich im Durchschnitt 55, bei der Frau 90 Chiasmata pro
Miose (pro Zelle). So entstehen Chromosomen, die eine
Kombination aus Genabschnitten von Vater und Mutter darstellen, und
damit ein neues individualspezifisches Genmuster. Darüber hinaus tragen die Chiasmata wahrscheinlich zur korrekten Trennung der Chromosomen während der Meiose I bei.
 Schließlich zerfällt der synaptonemale Komplex, und die Zelle tritt in das Diplotän
Schließlich zerfällt der synaptonemale Komplex, und die Zelle tritt in das Diplotän  (diplotene stage, diplonema) ein: Die
Chromatidenpaare setzen sich voneinander ab. Homologe Chromosomen
beginnen sich zu trennen, die Chiasmata bleiben hingegen intakt und halten die väterlichen und mütterlichen Homologe jedes Chromosoms an der Spindel bis zur Anaphase 1 zusammen. Dadurch haben sie eine ähnliche Rolle wie die Zentromere der Mitose und der Meiose II.
(diplotene stage, diplonema) ein: Die
Chromatidenpaare setzen sich voneinander ab. Homologe Chromosomen
beginnen sich zu trennen, die Chiasmata bleiben hingegen intakt und halten die väterlichen und mütterlichen Homologe jedes Chromosoms an der Spindel bis zur Anaphase 1 zusammen. Dadurch haben sie eine ähnliche Rolle wie die Zentromere der Mitose und der Meiose II.
Oozyten
(mehrere Millionen an der Zahl - bis zur Pubertät bleiben etwa 0,4
Millionen in Primärfollikeln vital) arretieren in einer Ruhephase, dem Diktyotän, das Jahrzehnte andauern kann (Oozyten sind schon bei der Geburt ausgebildet).
 Diakinese
Diakinese  (diakinesis stage): Die RNA-Synthese sistiert, Chromosomen kondensieren. Damit endet die Prophase I, die Chromatidentetraden verkürzen sich, die Zellkernhülle löst sich auf, und der Spindelapparat kann sich ausbilden.
(diakinesis stage): Die RNA-Synthese sistiert, Chromosomen kondensieren. Damit endet die Prophase I, die Chromatidentetraden verkürzen sich, die Zellkernhülle löst sich auf, und der Spindelapparat kann sich ausbilden.
Abschluss der Meiose I: Anschließend erfolgt die Reduktion auf je einen haploiden
 Chromosomensatz pro Zelle. Während der Metaphase I ordnen sich die Chomosomenpaare (Tatraden) in der Äquatorialplatte, in der Anaphase I wandert je ein Chromosom (eines homologen Paares) zu dem einen, das andere zum entgegengesetzen Pol (Abbildung oben).
Chromosomensatz pro Zelle. Während der Metaphase I ordnen sich die Chomosomenpaare (Tatraden) in der Äquatorialplatte, in der Anaphase I wandert je ein Chromosom (eines homologen Paares) zu dem einen, das andere zum entgegengesetzen Pol (Abbildung oben).
Die Telophase und Zytokinese schließlich dienen der endgültigen
Zellteilung; die beiden Tochterzellen sind genetisch unterschiedlich
ausgestattet (Unterschied
zur Mitose, bei der sie genetisch
identisch sind), und haben eine haploide (1n) Zahl an Chromosomen, die allerdings zwei Chromatiden enthalten (2c), die jeweils über ein Kinetochor miteinander verbunden sind - weshalb in der Meiose II keine DNA-Replikation mehr erforderlich ist.
 Die erste Reifeteilung (Meiose I) hat den Chromosomensatz pro Zelle halbiert (auf 23: haploid), und zwischen homologen (väterlichen und mütterlichen) Chromatiden hat genetische Rekombinationen stattgefunden, resultierend in neu kombinierten Chromosomen.
Die erste Reifeteilung (Meiose I) hat den Chromosomensatz pro Zelle halbiert (auf 23: haploid), und zwischen homologen (väterlichen und mütterlichen) Chromatiden hat genetische Rekombinationen stattgefunden, resultierend in neu kombinierten Chromosomen.
In der Meiose findet bei der Rekombination der Chromatiden ein Austausch von DNA-Sequenzen zwischen homologen Chromosomen statt.
Als Ergebnis werden unterschiedliche Versionen (Allele) desselben Gens
in neuer Kombination mit anderen Genen sozusagen auf Nützlichkeit
getestet.
In der rascher ablaufenden zweiten Reifeteilung (Meiose 2) werden dann
die Chromatiden separiert; es entstehen haploide Gameten
(befruchtungsfähige Zellen mit je einem Chromatid - bereit für die
Paarung mit einer gegengeschlechtlichen Gamete).
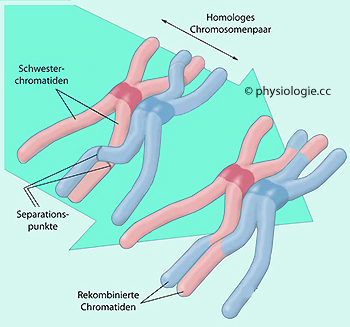
 Abbildung: Crossing over: Die genetischen Karten werden neu gemischt
Nach einer Vorlage bei online.science.psu.edu
Abbildung: Crossing over: Die genetischen Karten werden neu gemischt
Nach einer Vorlage bei online.science.psu.edu
Allele sind alternative Formen eines bestimmten Gens. Bei der Meiose kommt es zu Brückenbildungen (chiasmata) zwischen "mütterlichen" und "väterlichen" Chromatiden (crossing over). Da die Chromosomen homolog sind, ist dies ohne Veränderung der Genzahl möglich.
 Homologe (homologe Chromosomen)
sind Kopien eines Chromosoms - eine von der Mutter, eine vom Vater
stammend -, welche die gleichen Gene an gleichen Genorten (Genloci)
aufweisen. Das ermöglicht eine Paarung (Synapsis) der Chromosomen im Rahmen der Fertisisierung und den geordneten Austausch von Genen im Zuge genetischer Rekombination.
Auf diese Weise entstehen neue Genkombinationen - jedes Kind besitzt
mit rekombinierten Chromatiden ein individuell neu gemischtes
genetisches Blatt (das dann individuell weiter mutieren kann)
Homologe (homologe Chromosomen)
sind Kopien eines Chromosoms - eine von der Mutter, eine vom Vater
stammend -, welche die gleichen Gene an gleichen Genorten (Genloci)
aufweisen. Das ermöglicht eine Paarung (Synapsis) der Chromosomen im Rahmen der Fertisisierung und den geordneten Austausch von Genen im Zuge genetischer Rekombination.
Auf diese Weise entstehen neue Genkombinationen - jedes Kind besitzt
mit rekombinierten Chromatiden ein individuell neu gemischtes
genetisches Blatt (das dann individuell weiter mutieren kann)

Brückenbildungen (chiasmata  ) zwischen von Vater und Mutter stammenden
Chromatiden (crossing over) ergeben neue
individuelle Genkombinationen. Dieser Vorgang erfolgt im Pachytänstadium. Die Anzahl möglicher Chromosomenkombinationen beträgt 223 (23 Chromosomenpaare), entsprechend über 8 Millionen genetisch unterschiedlichen Gameten (dieses Repertoire an Möglichkeiten besteht für jede einzelne Meiose).
) zwischen von Vater und Mutter stammenden
Chromatiden (crossing over) ergeben neue
individuelle Genkombinationen. Dieser Vorgang erfolgt im Pachytänstadium. Die Anzahl möglicher Chromosomenkombinationen beträgt 223 (23 Chromosomenpaare), entsprechend über 8 Millionen genetisch unterschiedlichen Gameten (dieses Repertoire an Möglichkeiten besteht für jede einzelne Meiose).
 Rekombination ist der Vorgang, durch den bei der Bildung von Ei- oder Samenzellen DNA
zwischen zwei äquivalenten Chromosomen ausgetauscht wird ("crossing over",
Rekombination ist der Vorgang, durch den bei der Bildung von Ei- oder Samenzellen DNA
zwischen zwei äquivalenten Chromosomen ausgetauscht wird ("crossing over",  Abbildung). Die Überkreuzung der DNA-Stränge erfolgt an Anhaftungspunkten, die Chiasmata oder hot spots genannt
werden (vorgegeben durch Proteine - z.B. Cohesin -, welche die Chromosomen in der frühen Meiose organisieren). Überkreuzung erfolgt auch zwischen homologen Regionen der X- und Y-Chromosomen.
Abbildung). Die Überkreuzung der DNA-Stränge erfolgt an Anhaftungspunkten, die Chiasmata oder hot spots genannt
werden (vorgegeben durch Proteine - z.B. Cohesin -, welche die Chromosomen in der frühen Meiose organisieren). Überkreuzung erfolgt auch zwischen homologen Regionen der X- und Y-Chromosomen.
Crossing over erfolgt im Pachytänstadium der Prophase 1. Es kann einfach oder auch doppelt erfolgen (double crossing over). Der korrekte Ablauf wird durch - aus Proteinen und Nukleinsäuren bestehende, während des Leptotäns entstehende - synaptonemale (synaptische) Komplexe (synaptonemal complex SC) stabilisiert; diese mehrteilige Struktur bildet eine Brücke zwischen meiotisch gekoppelten Chromosomen.
 Als synaptonemal
Als synaptonemal  bezeichnet man einen Proteinkomplex
(synaptonemaler / synaptischer Komplex, synaptonemal complex SC) zur Vermittlung der Paarung und Rekombination homologer Chromosomen im
Rahmen der Reifeteilung (Meiose). Der synaptonemale Komplex bildet
sich entlang der gesamten Länge jedes Chromatids im Rahmen eines
Vorgangs, der als Synapsis bezeichnet wird. Er ermöglicht die Rekombination von DNA zwischen homologen Chromosomen.
bezeichnet man einen Proteinkomplex
(synaptonemaler / synaptischer Komplex, synaptonemal complex SC) zur Vermittlung der Paarung und Rekombination homologer Chromosomen im
Rahmen der Reifeteilung (Meiose). Der synaptonemale Komplex bildet
sich entlang der gesamten Länge jedes Chromatids im Rahmen eines
Vorgangs, der als Synapsis bezeichnet wird. Er ermöglicht die Rekombination von DNA zwischen homologen Chromosomen.
Zweck der Rekombination: Der zufallsgesteuerte Austausch homologer väterlicher und
mütterlicher Chromatinabschnitte ergibt einen Mix aus Erbanlagen von
Vater und Mutter. In einer sich ständig ändernden Umwelt (z.B. neue
Krankheitserreger) erhöhen sich die Chancen der Spezies - indem
fortlaufend Individuen mit geeigneteren Genen einen Überlebensvorteil erlangen. Die
Anpassungsfähigkeit steigt, die Evolution wird beschleunigt.
Im Durchschnitt erfolgen bei jeder Meiose 2 bis 3 Crossover-Vorgänge je Chromosom.
(Zwischen X- und Y-Chromosom besteht eine kurze Sequenz der Homologie,
sodass auch hier Crossover-Prozesse erfolgen können.) Auf das gesamte Genom bezogen bedeutet das etwa 50 bis 80 Rekombinationen pro meiotischer Teilung.
Meiose 2 (Äquationsteilung): Distribution auf haploide Zellen
Die zweite Reifeteilung (Meiose II, Äquationsteilung)
ähnelt einer Mitose, nur dass 23 (nicht 46) Chromosomen teilnehmen. Sie
dient der Aufteilung der (jeweils zwei, wegen vorausgegangener
DNA-Rekombination genetisch meist verschiedenen) in der Meiose I
entstandenen
Chromatiden auf (jeweils 3-4) Gameten. Sie erfolgt unmittelbar nach der
ersten Reifeteilung, zwischen Meiose I und Meiose II erfolgt keine
Interphase oder S-Phase.
 Abbildung: Von der Metaphase I zur Bildung der Gameten
Abbildung: Von der Metaphase I zur Bildung der Gameten
Nach einer Vorlage in Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
A: In der Metaphase I
ordnen sich die Tetraden entlang der Mitte der sich teilenden Zelle an
und bilden dadurch die sogenannte Metaphasenplatte (=Äquatorialplatte),
an der auch die Mikrotubuli des Spindelapparates angreifen (gelbe
Pfeile: Richtung der Separation in Richtung der Spindelpole).
B: Nach dem Aufbrechen der
Chiasmata erfolgt die vollständige Trennung der Chromosomen und damit
die Zytokinese und der Übergang zur Anaphase I.
C: Durch Rekombination der DNA-Sequenzen im Zuge des crossing over sind die über ihr Zentromer verknüpften Chromatiden nicht mehr identisch.
D: So entstehen im Zuge der
Meiose II (2. Reifeteilung) haploide Gameten (Spermatozyten) mit
unterschiedlichen genetischen Mustern (die Abbildung zeigt nur zwei
Chromosomen und daher nur vier der möglichen 8,389 Millionen
DNA-Kombinationen). Die Meiose produziert bei der Frau nur jeweils eine reife Eizelle

In der Meiose II werden die Chromatiden ähnlich wie bei einer Mitose getrennt und so
aufgeteilt, dass Keimzellen entstehen: Gameten mit jeweils einem
Chromatid
jedes Typs verfügen damit über den für eine Befruchtung
benötigten haploiden Chromosomensatz. Die Tochterzellen der zweiten
Reifeteilung haben einen wirklich hapoliden Chromosomensatz (1n, 1c).
Vergleich Mitose - Meiose

Nach Strachan / Read, Human Molecular Genetics, 5th ed. 2020 (CRC Press)
|
Merkmal
|
Mitose
|
Meiose
|
Wo?
|
Alle Gewebe
|
Hoden / Ovar
|
Ergebnis
|
Diploide somatische Zelle
|
Haploide Gamete (Spermium, Eizelle)
|
Replikation, Zellteilung
|
Meist eine Replikation pro Teilung
|
Eine Replikation pro 2 Teilungen
|
Dauer der Prophase
|
Etwa 30 Minuten
|
Kann Jahrzehnte dauern
|
Paarung väterlicher und mütterlicher Homologe
|
nein
|
Während Meiose I
|
Rekombination
|
Selten, abnorm
|
Bei jeder Meiose, meist ≥1 pro Chromosomenarm nach Paarung väterlicher / mütterlicher Homologe
|
Tochterzellen
|
Genetisch identisch
|
Genetisch unterschiedlich
|
Meiose und funktionelle Reifung im weiblichen Körper
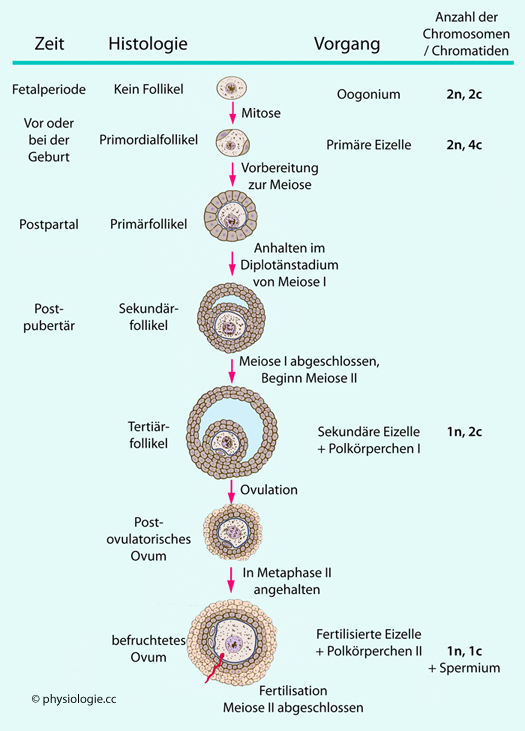
 Abbildung: Oogenese und follikuläre Entwicklung
Abbildung: Oogenese und follikuläre Entwicklung
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
O
ogonien vermehren sich zunächst mitotisch in
der Embryonal- bzw. Fetalperiode. Die erste Reifeteilung beginnen sie
erst in der späten Fetalphase.
Verdopplung des Chromatidensatzes - bei gleichbleibender Zahl an
Chromosomen - macht sie zu primären Eizellen (2n, 2c → 2n, 4c).
Anders als beim männlichen Geschlecht (Spermatogonien treten zu ganz
unterschiedlichen Zeitpunkten im Laufe des Lebens in die Meiose ein)
beginnt die erste Reifeteilung bei allen Oogonien um den
Zeitpunkt der Geburt (ab einige Tage davor); Meiose I erfolgt bis in
die frühe postpartale Periode und arretiert im Diplotänstadium. In
diesem verharren die primären Eizellen bis zum Eintreten der
Geschlechtsreife.
Der nächste markante Zeitpunkt ist derjenige des Eisprungs. 10 bis 12 Stunden vor der Ovulation schließen Oozyten die erste
Reifeteilung ab und beginnen mit Meiose II. Diese wird in Metaphase II
angehalten, bis im Zuge einer allfälligen Fertilisierung auch die zweite Reifeteilung
abgeschlossen wird.
Oogonien in den fetalen Gonaden haben keine Begleitzellen, aber mit
Beginn der
Meiose (wenn sie zu Oozyten geworden sind) bilden sich Follikel aus.
Primäre Follikel sind von einer einzelligen,
sekundäre von einer mehrzelligen Schicht an Granulosazellen
umgeben. Tertiäre Follikel haben ein flüssigkeitsgefülltes Antrum. Man
unterscheidet tertiäre Follikel von der Klasse 1 (0,2 mm Durchmesser)
bis Klasse 8 (etwa 20 mm Durchmesser)
Parallel
zu den Vorgängen der Reifeteilung (Umverteilung des Genmaterials)
laufen begleitende zelluläre Aktivitäten ab. Knapp vor oder während der
Geburt bilden sich durch mitotische Verdopplung des Genmaterials (je 2
Chromosomen mit je 2 Chromatiden, 4c) aus Oogonien primäre
Eizellen ( Abbildung), die nun für Jahre im Diplotänstadium "eingefroren" bleiben.
Abbildung), die nun für Jahre im Diplotänstadium "eingefroren" bleiben.
Erst nach Eintreten der Pubertät setzt sich der Vorgang fort. Etwa 10-30 primäre Oozyten vollenden ihre meiotische Teilung pro Zyklus (alle übrigen Eizellen verharren im Diplotänstadium).
Ungleiche Aufteilung zytoplasmatischer Ressourcen führen zur Bildung von Polkörpern (Polkörperchen, Richtungskörper, polar bodies), zytoplasmaarme Produkte der Meiose von Eizellen; so viel Zytoplasma wie möglich verbleibt bei der Eizelle.
Für die
vollständige Entwicklung eines Oozyten braucht es 110 bis 120 Tage; der
sprungreife (Graaf'sche) Follikel hat schließlich genügend Ressourcen
(Zytoplasma, Zellorganellen, Genprodukte wie Transkriptionsregulatoren
für die ersten Teilungen) angesammelt, um den Embryo für die ersten Tage
seiner Existenz zu versorgen.
Von den etwa zwei Millionen primären Eizellen, mit denen weibliche Neugeborene auf die Welt kommen, überleben etwa 4.104
(im Diplotänstadium der Meiose I "eingefroren") bis zum Erreichen der
Pubertät. Zur Ovulation gelangt davon etwa jede hundertste (~400 Zyklen bis zur Menopause). Alle anderen verlassen das Ovar nicht - zu einem gegebenen Zeitpunkt atresieren sie.

Über weitere Entwicklungsschritte s.
dort und
dort
Meiose und funktionelle Reifung im männlichen Körper
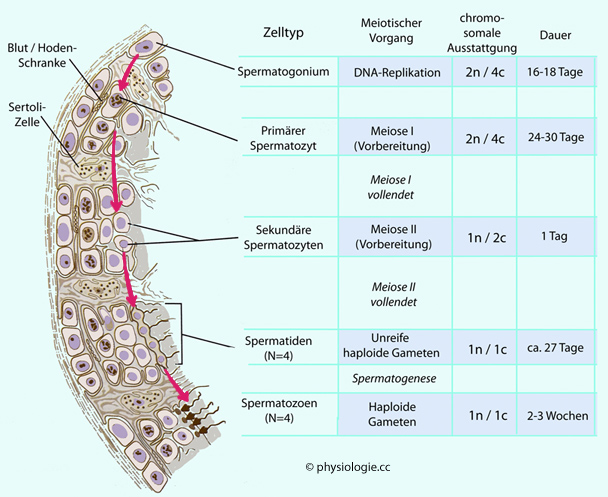
 Abbildung: Spermatogenese in einem Hodenkanälchen (tubulus seminiferus)
Abbildung: Spermatogenese in einem Hodenkanälchen (tubulus seminiferus)
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Schematische Darstellung der sequentiellen Abfolge der Vorgänge

Ploidie: Zahl und Verteilung von Chromosomen
Der Gehalt an
genetischer Information (DNA, Chromosomen) ist durch die Anzahl der
verschiedenen in einer Zelle enthaltenen Chromosomen (chromosome set) bestimmt - beim Menschen normalerweise ~3,5 pg DNA (C-value) in 23
Chromosomen. (Der Referenz-C-Wert ist die DNA-Menge in einer Zelle der
betreffenden Species mit einem haploiden Chomosomenset.)
Beide Werte (Chromosomenzahl und DNA-Gehalt) hängen von der Ploidie der Zelle ab.

 Abbildung: Normale Reifeteilungen (rechts) und Non-Disjunctionen, die zu Mono- bzw. Trisomie führen
Nach einer Vorlage in Leeper-Woodford / Adkison, Integrated Systems. Lippincott Illustrades Reviews, Wolters Cluver 2016
Abbildung: Normale Reifeteilungen (rechts) und Non-Disjunctionen, die zu Mono- bzw. Trisomie führen
Nach einer Vorlage in Leeper-Woodford / Adkison, Integrated Systems. Lippincott Illustrades Reviews, Wolters Cluver 2016
Fehlerhafte
Separation homologer Chromosomen (Fehlsegregationen, Non-Disjunctionen)
führt zu Aneuploidie (Abweichung von einer normalen Chromosomenzahl).
Das Problem kann in der 1. Reifeteilung (Ausbleiben der Trennung
homologer Chromosomen, links) oder in der Metaphase der 2. Reifeteilung
auftreten (fehlende Trennung von Schwesterchromatiden, rechts).
Die Fehlverteilung erfolgt im Rahmen der Fertilisation und pflanzt sich auf Zellen des neu entstehenden Organismus fort

 Als Ploidie bezeichnet man die Anzahl der im Set einer Zelle enthaltenen Chromosomen, s. oben. Euploidie
Als Ploidie bezeichnet man die Anzahl der im Set einer Zelle enthaltenen Chromosomen, s. oben. Euploidie  bedeutet, dass der Chromosomenbesatz "stimmt", Aneuploidie hingegen, dass die meiotische Aufteilung der Chromosomen nicht überall erfolgreich abgelaufen ist (Fehlsegregation, nondisjunction).
bedeutet, dass der Chromosomenbesatz "stimmt", Aneuploidie hingegen, dass die meiotische Aufteilung der Chromosomen nicht überall erfolgreich abgelaufen ist (Fehlsegregation, nondisjunction).
Auf diese Weise können Fehlverteilungen von Chromosomen auftreten ( Abbildung),
die sich auf den durch die Fertilisation einer Eizelle entstandenen
Organismus fortsetzen (auf alle oder nur einen Teil der Zellen): Fehlt
ein Chromosom, spricht man von Monosomie, ist eines zu viel, von Trisomie (z.B. Trisomie 21, ein Down-Syndrom).
Die meisten somatischen Zellen sind diploid (2N Chromosomen, 2C DNA-Gehalt). Einige sind nulliploid, d.h. sie haben ihre Zellkerne verloren und enthalten keine DNS (Erythrozyten, Thrombozyten, reife Keratinozyten); andere sind polyploid
Abbildung),
die sich auf den durch die Fertilisation einer Eizelle entstandenen
Organismus fortsetzen (auf alle oder nur einen Teil der Zellen): Fehlt
ein Chromosom, spricht man von Monosomie, ist eines zu viel, von Trisomie (z.B. Trisomie 21, ein Down-Syndrom).
Die meisten somatischen Zellen sind diploid (2N Chromosomen, 2C DNA-Gehalt). Einige sind nulliploid, d.h. sie haben ihre Zellkerne verloren und enthalten keine DNS (Erythrozyten, Thrombozyten, reife Keratinozyten); andere sind polyploid - durch mehrere
Replikationen ohne Zellteilung, z.B. Hepatozyten (<8C), Kardiomyozyten (4C-8C) oder Megakaryozyten (16C-64C), oder durch Zellfusionen (synzytiale Zellen, z.B. Skelettmuskelfasern).


 Geschlechtschromosomen (Heterosomen, Gonosomen) bestimmen das
genetische Geschlecht (XX, XY). X-Chromosomen verfügen über ~800 Gene, Y-Chromosomen über ~50.
Die meisten geschlechtsspezifischen Unterschiede erklären sich durch
ungleiche Realisierung von autosomalen Genen. Männliche Feten bilden
Testosteron, weibliche Östrogene. Die Wirkung der Geschlechtshormone
auf (intrazelluläre) Rezeptoren bestimmen die Geschlechtsmerkmale
(sexueller Dimorphismus)
Geschlechtschromosomen (Heterosomen, Gonosomen) bestimmen das
genetische Geschlecht (XX, XY). X-Chromosomen verfügen über ~800 Gene, Y-Chromosomen über ~50.
Die meisten geschlechtsspezifischen Unterschiede erklären sich durch
ungleiche Realisierung von autosomalen Genen. Männliche Feten bilden
Testosteron, weibliche Östrogene. Die Wirkung der Geschlechtshormone
auf (intrazelluläre) Rezeptoren bestimmen die Geschlechtsmerkmale
(sexueller Dimorphismus)
 Eine frühe hormonelle Weichenstellung führt bei männlichen Feten zur
Bildung von TDF, AMH, Testosteron, Hoden, Samenleitern und
Begleitdrüsen, Regression der Müller-Gänge und Ausbildung männlicher
Genitalien. Bleiben frühe endokrine Signale aus (der weibliche Embryo
hat kein SRY-Gen), atresieren die Wolff-Gänge, aus den Müller-Gängen
entstehen Eileiter und Uterus, weibliche Geschlechtsmerkmale bilden
sich aus
Eine frühe hormonelle Weichenstellung führt bei männlichen Feten zur
Bildung von TDF, AMH, Testosteron, Hoden, Samenleitern und
Begleitdrüsen, Regression der Müller-Gänge und Ausbildung männlicher
Genitalien. Bleiben frühe endokrine Signale aus (der weibliche Embryo
hat kein SRY-Gen), atresieren die Wolff-Gänge, aus den Müller-Gängen
entstehen Eileiter und Uterus, weibliche Geschlechtsmerkmale bilden
sich aus
 Viele verschiedene Gene beeinflussen die Geschlechtlichkeit und wirken
sich somatisch (z.B. Muskelstärke, Blutbildung) und
hormonell aus (Hormone, Rezeptoren). Das SRY-Gen des Y-Chromosoms
kodiert den Transkriptionsfaktor TDF, der die Bildung eines
männlichen Organismus triggert; ohne SRY-Gen läuft die
Entwicklung in Richtung weiblicher Organismus
Viele verschiedene Gene beeinflussen die Geschlechtlichkeit und wirken
sich somatisch (z.B. Muskelstärke, Blutbildung) und
hormonell aus (Hormone, Rezeptoren). Das SRY-Gen des Y-Chromosoms
kodiert den Transkriptionsfaktor TDF, der die Bildung eines
männlichen Organismus triggert; ohne SRY-Gen läuft die
Entwicklung in Richtung weiblicher Organismus
 Die Meiose (Reifeteilung) verteilt Gene von Mutter und Vater auf
"kombinierte" Chromatiden mit dem Resultat einer neuen individuellen
Genkombination. Jede Reifeteilung ergibt 2-3 Crossover-Vorgänge je
Chromosom, entsprechend 50-80 Rekombinationen für den gesamten
Chromosomensatz. Die Meiose wird unterteilt in Leptotän, Zygotän,
Pachytän, Diplotän und Diakinese
Die Meiose (Reifeteilung) verteilt Gene von Mutter und Vater auf
"kombinierte" Chromatiden mit dem Resultat einer neuen individuellen
Genkombination. Jede Reifeteilung ergibt 2-3 Crossover-Vorgänge je
Chromosom, entsprechend 50-80 Rekombinationen für den gesamten
Chromosomensatz. Die Meiose wird unterteilt in Leptotän, Zygotän,
Pachytän, Diplotän und Diakinese
 Der weibliche Fetus bildet bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel. Die Prophase der ersten meiotischen
Teilung kann Jahrzente dauern, die Eizelle verweilt im Diktyotän. Die
zweite meiotische Teilung (Äquationsteilung) verläuft ähnlich einer
Mitose
Der weibliche Fetus bildet bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel. Die Prophase der ersten meiotischen
Teilung kann Jahrzente dauern, die Eizelle verweilt im Diktyotän. Die
zweite meiotische Teilung (Äquationsteilung) verläuft ähnlich einer
Mitose
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.







 Allele: αλλήλων = einander, gegenseitig
Allele: αλλήλων = einander, gegenseitig Geschlechtlichkeit
Geschlechtlichkeit  Entwicklung der Sexualorgane
Entwicklung der Sexualorgane  Gametogenese
Gametogenese  Meiose
Meiose Ploidie
Ploidie
 Mitose, Meiose, Zytokinese
Mitose, Meiose, Zytokinese  Homologie
Homologie  Gamete, Fetilisierung, Haplo- / Diploidie, Zygote
Gamete, Fetilisierung, Haplo- / Diploidie, Zygote  Rekombination
Rekombination  synaptonemal
synaptonemal  Ploidie
Ploidie
 ) hat, ist nach wie vor Gegenstand evolutionstheoretischer Diskussion. Nicht
wenige Arten verzichten auf sexuelle Reproduktion, klonale Vermehrung
ist eine alternative Option, die ihre Vorteile hat.
) hat, ist nach wie vor Gegenstand evolutionstheoretischer Diskussion. Nicht
wenige Arten verzichten auf sexuelle Reproduktion, klonale Vermehrung
ist eine alternative Option, die ihre Vorteile hat. 
 Abbildung: Meiose und Mitose
Abbildung: Meiose und Mitose ist eine (von meist zwei: von Vater und von Mutter stammende) Form eines Gens.
ist eine (von meist zwei: von Vater und von Mutter stammende) Form eines Gens.
 Unter Geschlechtsdetermination (Sex determination) versteht man den Vorgang in der Embryonalperiode, durch den das chromosomale Geschlecht (Karyotyp: Muster an Geschlechtschromosomen - Gonosomen, Heterosomen -: XX, XY) die Ausbildung des gonadalen Geschlechts (Vorhandensein von Ovarien, Testes: Gonaden
Unter Geschlechtsdetermination (Sex determination) versteht man den Vorgang in der Embryonalperiode, durch den das chromosomale Geschlecht (Karyotyp: Muster an Geschlechtschromosomen - Gonosomen, Heterosomen -: XX, XY) die Ausbildung des gonadalen Geschlechts (Vorhandensein von Ovarien, Testes: Gonaden  ) bestimmt.
) bestimmt. Primäre Geschlechtsmerkmale betreffen die Geschlechtsorgane;
Primäre Geschlechtsmerkmale betreffen die Geschlechtsorgane; 
 sekundäre bilden sich während der Pubertät aus, z.B. Brüste, Behaarungstyp,
Körperbau, Stimmlage (bei Männern um eine Oktave tiefer als bei
Frauen);
sekundäre bilden sich während der Pubertät aus, z.B. Brüste, Behaarungstyp,
Körperbau, Stimmlage (bei Männern um eine Oktave tiefer als bei
Frauen); 
 als tertiäre
Merkmale kann man solche (mehr oder weniger geschlechtstypische
Charakteristika) verstehen, die sich in Psyche und sozialem Verhalten
äußern.
als tertiäre
Merkmale kann man solche (mehr oder weniger geschlechtstypische
Charakteristika) verstehen, die sich in Psyche und sozialem Verhalten
äußern. (Unterschiede in Form und Funktion von Organismen, die durch das
Geschlecht bedingt sind). Dieser Dimorphismus
zeigt sich fast überall: Körpergröße, Gewicht, Fettverteilung, Körperformen, Körperzusammensetzung, Haut- und Behaarungstyp, Atemvolumina, Knochendichte und -form, Blut (Erythrozytenzahl), Muskelmasse, Gehirn etc.
(Unterschiede in Form und Funktion von Organismen, die durch das
Geschlecht bedingt sind). Dieser Dimorphismus
zeigt sich fast überall: Körpergröße, Gewicht, Fettverteilung, Körperformen, Körperzusammensetzung, Haut- und Behaarungstyp, Atemvolumina, Knochendichte und -form, Blut (Erythrozytenzahl), Muskelmasse, Gehirn etc.
 Abbildung: Transformation des genitalen Gangsystems
Abbildung: Transformation des genitalen Gangsystems
 Abbildung): Die primären Anlagen für die Wolff- und Müller-Gänge
Abbildung): Die primären Anlagen für die Wolff- und Müller-Gänge
 sind zunächst beide vorhanden. Dann kommt es zu einer hormonellen Weichenstellung:
sind zunächst beide vorhanden. Dann kommt es zu einer hormonellen Weichenstellung: Entweder werden "männliche" Faktoren
(TDF, AMH, Testosteron) gebildet, das führt zur Bildung
von Hoden (ab der 6. Gestationswoche), Samenleitern und Begleitdrüsen, Regression der Müller-Gänge (ab der 8. Gestationswoche), Ausbildung männlicher Genitalien (ab 9.-12. Gestationswoche, d.h. nach Beginn der letzten Mensesblutung),
Entweder werden "männliche" Faktoren
(TDF, AMH, Testosteron) gebildet, das führt zur Bildung
von Hoden (ab der 6. Gestationswoche), Samenleitern und Begleitdrüsen, Regression der Müller-Gänge (ab der 8. Gestationswoche), Ausbildung männlicher Genitalien (ab 9.-12. Gestationswoche, d.h. nach Beginn der letzten Mensesblutung), oder diese
Signale bleiben aus, was die Atresierung der Wolff-Gänge (ab der 8. Gestationswoche) und Differenzierung
in Richtung Eileiter, Uterus, weiblichen Genitalien zur Folge hat.
oder diese
Signale bleiben aus, was die Atresierung der Wolff-Gänge (ab der 8. Gestationswoche) und Differenzierung
in Richtung Eileiter, Uterus, weiblichen Genitalien zur Folge hat.  Das SRY-Gen codiert die geschlechtsbestimmende Wirkung des Y-Chromosoms.
Seine Aktivität ist notwendig, um die Maskulinisierung der embryonalen
Gonaden hervorzurufen - das SRY-Gen legt sozusagen den Schalter in
Richtung Entwicklung eines männlichen Organismus um. Beim weiblichen
Embryo ist kein SRY-Gen vorhanden (XX), was
die Expression "weiblicher" Transkriptionsfaktoren und die
Differenzierung der Gonaden zu Ovarien zur Folge hat.
Das SRY-Gen codiert die geschlechtsbestimmende Wirkung des Y-Chromosoms.
Seine Aktivität ist notwendig, um die Maskulinisierung der embryonalen
Gonaden hervorzurufen - das SRY-Gen legt sozusagen den Schalter in
Richtung Entwicklung eines männlichen Organismus um. Beim weiblichen
Embryo ist kein SRY-Gen vorhanden (XX), was
die Expression "weiblicher" Transkriptionsfaktoren und die
Differenzierung der Gonaden zu Ovarien zur Folge hat. 
 Abbildung: Steuerung der geschlechtlichen Entwicklung
Abbildung: Steuerung der geschlechtlichen Entwicklung
 Die
Geschlechtlichkeit einer Person wird durch mehrere Faktoren bestimmt. Biologische Faktoren sind:
Die
Geschlechtlichkeit einer Person wird durch mehrere Faktoren bestimmt. Biologische Faktoren sind: Genotypisch-chromosomal: Zur Ausbildung männlicher Merkmale
ist das Y-Chromosom notwendig. Sein SRY-Gen (Sex determining region of Y) kodiert einen Transkriptionsfaktor, den Testis-determining factor (TDF); dieser steuert die weitere Entwicklung zum männlichen Geschlecht.
Genotypisch-chromosomal: Zur Ausbildung männlicher Merkmale
ist das Y-Chromosom notwendig. Sein SRY-Gen (Sex determining region of Y) kodiert einen Transkriptionsfaktor, den Testis-determining factor (TDF); dieser steuert die weitere Entwicklung zum männlichen Geschlecht. Gonadal-hormonell: Hormonbildung in Ovarien oder Hoden.
Gonadal-hormonell: Hormonbildung in Ovarien oder Hoden. Phänotypisch (genitales Geschlecht, zu seiner Ausbildung muss die Rezeptorausstattung der betreffenden Gewebe intakt sein).
Phänotypisch (genitales Geschlecht, zu seiner Ausbildung muss die Rezeptorausstattung der betreffenden Gewebe intakt sein). Afferenzen schließen
so gut wie alle Sinnerorgane ein (visuelle, akustische, Geruchs-,
Berührungsreize), weiters viszerale Signale u.a. von den
Geschlechtsorganen.
Afferenzen schließen
so gut wie alle Sinnerorgane ein (visuelle, akustische, Geruchs-,
Berührungsreize), weiters viszerale Signale u.a. von den
Geschlechtsorganen. Efferenzen gelangen auf dem Blutweg (endokrine Signale) und über das Nervensystem - insbesondere autonome ("vegetative") Signale - zu motorischen und sekretorischen Erfolgsorganen.
Efferenzen gelangen auf dem Blutweg (endokrine Signale) und über das Nervensystem - insbesondere autonome ("vegetative") Signale - zu motorischen und sekretorischen Erfolgsorganen. Unterschiedliche Expression von Enzymen ist die Urasche für den sexuellen Dimorphismus der Hormonmuster im Kreislauf.
Unterschiedliche Expression von Enzymen ist die Urasche für den sexuellen Dimorphismus der Hormonmuster im Kreislauf. Sie organisieren das Differenzierungsmuster von Zellen und Geweben (organizational role)
- z.B. die Ausbildung der inneren Geschlechtsorgane. Solche Wirkungen
erfolgen früh in der embryonalen Entwicklung und sind im Allgemeinen
irreversibel.
Sie organisieren das Differenzierungsmuster von Zellen und Geweben (organizational role)
- z.B. die Ausbildung der inneren Geschlechtsorgane. Solche Wirkungen
erfolgen früh in der embryonalen Entwicklung und sind im Allgemeinen
irreversibel. Später lösen sie bestimmte physiologische und Verhaltensmuster aus (activational role); diese Wirkungen sind reversibel.
Später lösen sie bestimmte physiologische und Verhaltensmuster aus (activational role); diese Wirkungen sind reversibel. Gameten
Gameten  sind haploide Geschlechtszellen (Spermien-, Eizelle), deren Vereinigung im Rahmen der Befruchtung die sexuelle Fortpflanzung trägt. Ploidie ist die Anzahl der Chromosomensätze in einer Zelle - haploid
sind haploide Geschlechtszellen (Spermien-, Eizelle), deren Vereinigung im Rahmen der Befruchtung die sexuelle Fortpflanzung trägt. Ploidie ist die Anzahl der Chromosomensätze in einer Zelle - haploid  ist ein einfacher (1N DNA - Gameten), diploid
ist ein einfacher (1N DNA - Gameten), diploid  ein zweifacher (2N DNA - somatische Zellen), tretraploid
ein vierfacher Chromosomensatz (4N DNA - primäre Oozyten /
Spermatozyten, vgl. Abbildungen unten). Somatische Zellen haben jeweils
22 Autosomenpaare (à 2 homologen Chromosomen) und ein Paar
Geschlechtschromosomen (XX oder XY), also insgesamt 46 Chromosomen pro Kern. Eine Zygote
ein zweifacher (2N DNA - somatische Zellen), tretraploid
ein vierfacher Chromosomensatz (4N DNA - primäre Oozyten /
Spermatozyten, vgl. Abbildungen unten). Somatische Zellen haben jeweils
22 Autosomenpaare (à 2 homologen Chromosomen) und ein Paar
Geschlechtschromosomen (XX oder XY), also insgesamt 46 Chromosomen pro Kern. Eine Zygote  ist die Zelle, die durch Fertilisierung entstanden ist - sie ist diploid.
ist die Zelle, die durch Fertilisierung entstanden ist - sie ist diploid.  Phase 1: Extraembryonaler Ursprung der Keimzellen / Wanderung in die Gonaden. Urkeimzellen (Gonozyten, primordial germ cells PGCs) - die frühesten Vorläufer der Gameten
- werden außerhalb der Gonaden, im Epiblast (Epithelschicht zwischen
Hypoblast und Amnionhöhle) des frühen Embryo, auf ihre "Laufbahn"
festgelegt (spezifiziert). Dabei spielen Steuerfaktoren (bone morphopoetic proteins BMP) eine Rolle, die einige Zellen zur Bildung von regulatorischen Proteinen (B lymphocyte-induced maturation protein-1
BLIMP1) veranlassen, welche die Expression gonozytenspezifischer Gene
regulieren (Repression von Genen, welche die Entwicklung zu somatischen
Zellen anstoßen würden).
Phase 1: Extraembryonaler Ursprung der Keimzellen / Wanderung in die Gonaden. Urkeimzellen (Gonozyten, primordial germ cells PGCs) - die frühesten Vorläufer der Gameten
- werden außerhalb der Gonaden, im Epiblast (Epithelschicht zwischen
Hypoblast und Amnionhöhle) des frühen Embryo, auf ihre "Laufbahn"
festgelegt (spezifiziert). Dabei spielen Steuerfaktoren (bone morphopoetic proteins BMP) eine Rolle, die einige Zellen zur Bildung von regulatorischen Proteinen (B lymphocyte-induced maturation protein-1
BLIMP1) veranlassen, welche die Expression gonozytenspezifischer Gene
regulieren (Repression von Genen, welche die Entwicklung zu somatischen
Zellen anstoßen würden).  Abbildung).
Bei ihrem Weg durch das dorsale Mesenterium orientieren sie sich an der
Anwesenheit zellulärer und extrazellulärer Faktoren. Ihre Rezeptoren
erkennen Konzentrationsgradienten von Orientierungsfaktoren aus den Gonaden und dem Mesenterium (stromal cell-derived factor 1 SDF1, stem cell factor SCF).
Abbildung).
Bei ihrem Weg durch das dorsale Mesenterium orientieren sie sich an der
Anwesenheit zellulärer und extrazellulärer Faktoren. Ihre Rezeptoren
erkennen Konzentrationsgradienten von Orientierungsfaktoren aus den Gonaden und dem Mesenterium (stromal cell-derived factor 1 SDF1, stem cell factor SCF). 
 Abbildung: Ursprung und Wanderung der Urkeimzellen
Abbildung: Ursprung und Wanderung der Urkeimzellen
 Phase 2: Mitotische Zunahme der Zahl an Keimzellen. In den Gonaden angelangt, durchlaufen die Urkeimzellen zahlreiche mitotische Zellteilungen. Ihre Zahl nimmt exponentiell zu. Oogonien teilen sich nur während der Embryonal- / Fetalperiode - ab dem 2. Schwangerschaftsmonat, im 5. Schwangerschaftsmonat ist die Höchstzahl
von 7 Millionen erreicht. Anschließend atresieren viele Oogonien - bei
der Geburt finden sich in den Ovarien des neugeborenen Mädchens noch 2 Millionen, postnatal nimmt die Zahl bis
zur Menopause kontinuierlich weiter ab. Spermatogonien
folgen einem anderen Vermehrungsmuster: Ihre
mitotische Multiplikation in den Hodenanlagen stoppt um die Mitte der
Schwangerschaft und nimmt erst mit Erreichen der Pubertät wieder an
Fahrt auf, um sich für das gesamte restliche Leben
fortzusetzen.
Phase 2: Mitotische Zunahme der Zahl an Keimzellen. In den Gonaden angelangt, durchlaufen die Urkeimzellen zahlreiche mitotische Zellteilungen. Ihre Zahl nimmt exponentiell zu. Oogonien teilen sich nur während der Embryonal- / Fetalperiode - ab dem 2. Schwangerschaftsmonat, im 5. Schwangerschaftsmonat ist die Höchstzahl
von 7 Millionen erreicht. Anschließend atresieren viele Oogonien - bei
der Geburt finden sich in den Ovarien des neugeborenen Mädchens noch 2 Millionen, postnatal nimmt die Zahl bis
zur Menopause kontinuierlich weiter ab. Spermatogonien
folgen einem anderen Vermehrungsmuster: Ihre
mitotische Multiplikation in den Hodenanlagen stoppt um die Mitte der
Schwangerschaft und nimmt erst mit Erreichen der Pubertät wieder an
Fahrt auf, um sich für das gesamte restliche Leben
fortzusetzen.  Phase 3: Meiotische Halbierung der Chromosomenzahl
(diploid zu haploid). Im weiblichen Organismus beginnt die Meiose im 5
Monate alten Embryo. Sie wird zweimal unterbrochen: Im Diplotänstadium
der Prophase I (bis zur Pubertät, mit dekondensiertem und gut
ablesbarem Chromatin) und in der Metaphase II (bis zur Befruchtung) -
vgl. dort. Im männlichen Organismus beginnen meiotische Teilungen mit der Pubertät.
Phase 3: Meiotische Halbierung der Chromosomenzahl
(diploid zu haploid). Im weiblichen Organismus beginnt die Meiose im 5
Monate alten Embryo. Sie wird zweimal unterbrochen: Im Diplotänstadium
der Prophase I (bis zur Pubertät, mit dekondensiertem und gut
ablesbarem Chromatin) und in der Metaphase II (bis zur Befruchtung) -
vgl. dort. Im männlichen Organismus beginnen meiotische Teilungen mit der Pubertät. Phase 4: Reifung der Ei- und Samenzellen.
Phase 4: Reifung der Ei- und Samenzellen. Abbildung: Meiose
Abbildung: Meiose Zu Zentromer, Zentrosom s. dort
Zu Zentromer, Zentrosom s. dort
 Mitose ist die Aufteilung des kopierten Chromosomensatzes auf zwei Tochterkerne, Zytokinese die Aufteilung des Zytoplasmas auf zwei Tochterzellen. Meiose ist die Verteilung des (auf getrennten Chromatiden gespeicherten) väterlichen und
mütterlichen Erbgutes (diploider
Mitose ist die Aufteilung des kopierten Chromosomensatzes auf zwei Tochterkerne, Zytokinese die Aufteilung des Zytoplasmas auf zwei Tochterzellen. Meiose ist die Verteilung des (auf getrennten Chromatiden gespeicherten) väterlichen und
mütterlichen Erbgutes (diploider  Chromosomensatz: Allele
Chromosomensatz: Allele  jeweils doppelt vorhanden) auf "kombinierte" Chromatiden - sie ermöglicht zufallsgesteuerte chromosomale Rekombination (
jeweils doppelt vorhanden) auf "kombinierte" Chromatiden - sie ermöglicht zufallsgesteuerte chromosomale Rekombination ( Abbildung oben).
Abbildung oben).  Abbildung zeigt, stoppt die Gametogenese bei männlichen Feten die Mitosesequenz bereits in utero,
während sich der Vorgang bei weiblichen Feten bis an die Schwelle zur 1.
Reifeteilung mit der Komplettierung primärer Oozyten fortsetzt. So
kommen weibliche Babys bereits mit ihrem endgültigen Satz primärer
Eizellen zur Welt. Männliche Organismen hingegen nehmen die
Spermatogenese erst wieder mit dem Eintritt in die Pubertät auf; die
Spermienbildung läuft dann bei Männern ein Leben lang weiter.
Abbildung zeigt, stoppt die Gametogenese bei männlichen Feten die Mitosesequenz bereits in utero,
während sich der Vorgang bei weiblichen Feten bis an die Schwelle zur 1.
Reifeteilung mit der Komplettierung primärer Oozyten fortsetzt. So
kommen weibliche Babys bereits mit ihrem endgültigen Satz primärer
Eizellen zur Welt. Männliche Organismen hingegen nehmen die
Spermatogenese erst wieder mit dem Eintritt in die Pubertät auf; die
Spermienbildung läuft dann bei Männern ein Leben lang weiter.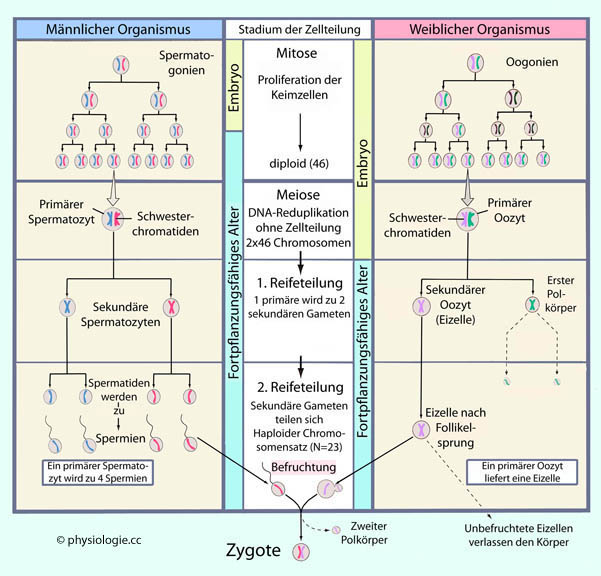
 Abbildung: Gametogenese
Abbildung: Gametogenese
 Entwicklungsstadium von Gameten bei Neugeborenen: Bei männlichen Babys Spermatogonien, bei weiblichen Babys primäre Oozyten.
Entwicklungsstadium von Gameten bei Neugeborenen: Bei männlichen Babys Spermatogonien, bei weiblichen Babys primäre Oozyten. -
nachdem der weibliche Fetus bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel gebildet hat, arretieren diese bis zur
Pubertät in der Meiose 1).
-
nachdem der weibliche Fetus bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel gebildet hat, arretieren diese bis zur
Pubertät in der Meiose 1). 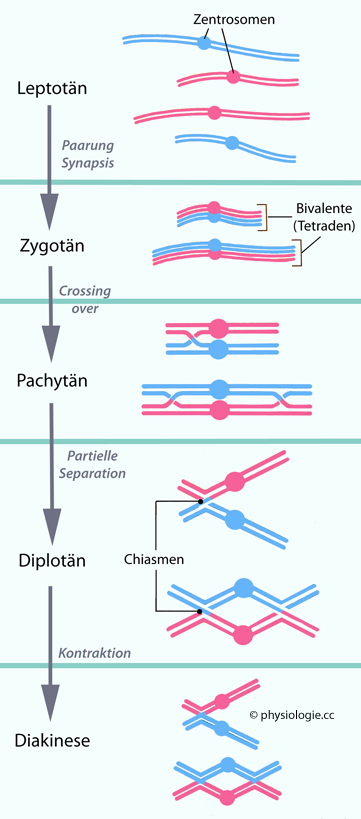
 Abbildung: Meiose I - fünf Stadien
Abbildung: Meiose I - fünf Stadien
 Abbildung):
Abbildung): Leptotän
Leptotän  (leptotene stage, leptonema): Die
Chromosomen, bestehend aus zwei (mit identischen Genorten versehenen)
Chromatiden, beginnen sich zu verdichten (zu kondensieren). Die
Telomere (Chromosomenenden) sind an der inneren Kernmembran fixiert.
(leptotene stage, leptonema): Die
Chromosomen, bestehend aus zwei (mit identischen Genorten versehenen)
Chromatiden, beginnen sich zu verdichten (zu kondensieren). Die
Telomere (Chromosomenenden) sind an der inneren Kernmembran fixiert.  Zygotän
Zygotän  (zygotene stage, zygonema): Homologe (von beiden Eltern stammende) Chromosomen lagern sich paarweise aneinander - es bildet sich ein synaptonemaler Komplex, eine Ansammlung von Proteinen, die in Intervallen große "Rekombinationsknoten" (recombination nodules) aufweist, die wahrscheinlich die DNA-Rekombination beeinflussen.
Dieser Vorgang läuft von den Enden der Chromatiden her
reißverschlussartig ab, wobei der synaptonemale Komplex die beiden
Stränge zusammenhält. Dabei bilden sich - aus vier Chromatiden bestehende -
Bivalente (=Tetraden), beim Mann auch zwischen X- und Y-Chromosomen
(obwohl diese sehr verschiedene Sequenzen aufweisen - die Paarung
erfolgt bei den Geschlechtschromosomen (Heterosomen) vor allem an den
beiden Chromosomenenden, die auch als pseudoautosomale Regionen bezeichnet werden).
(zygotene stage, zygonema): Homologe (von beiden Eltern stammende) Chromosomen lagern sich paarweise aneinander - es bildet sich ein synaptonemaler Komplex, eine Ansammlung von Proteinen, die in Intervallen große "Rekombinationsknoten" (recombination nodules) aufweist, die wahrscheinlich die DNA-Rekombination beeinflussen.
Dieser Vorgang läuft von den Enden der Chromatiden her
reißverschlussartig ab, wobei der synaptonemale Komplex die beiden
Stränge zusammenhält. Dabei bilden sich - aus vier Chromatiden bestehende -
Bivalente (=Tetraden), beim Mann auch zwischen X- und Y-Chromosomen
(obwohl diese sehr verschiedene Sequenzen aufweisen - die Paarung
erfolgt bei den Geschlechtschromosomen (Heterosomen) vor allem an den
beiden Chromosomenenden, die auch als pseudoautosomale Regionen bezeichnet werden).  Ist der synaptosomale Komplex komplett, kann das Pachytän
Ist der synaptosomale Komplex komplett, kann das Pachytän  (pachytene stage, pachynema) beginnen. Die gepaarten Chromosomen kondensieren weiter, und an Überkreuzungspunkten (chiasmata) erfolgt crossing over,
ein Austausch zwischen väterlichen und mütterlichen DNA-Sequenzen. Beim
Mann bilden sich im Durchschnitt 55, bei der Frau 90 Chiasmata pro
Miose (pro Zelle). So entstehen Chromosomen, die eine
Kombination aus Genabschnitten von Vater und Mutter darstellen, und
damit ein neues individualspezifisches Genmuster. Darüber hinaus tragen die Chiasmata wahrscheinlich zur korrekten Trennung der Chromosomen während der Meiose I bei.
(pachytene stage, pachynema) beginnen. Die gepaarten Chromosomen kondensieren weiter, und an Überkreuzungspunkten (chiasmata) erfolgt crossing over,
ein Austausch zwischen väterlichen und mütterlichen DNA-Sequenzen. Beim
Mann bilden sich im Durchschnitt 55, bei der Frau 90 Chiasmata pro
Miose (pro Zelle). So entstehen Chromosomen, die eine
Kombination aus Genabschnitten von Vater und Mutter darstellen, und
damit ein neues individualspezifisches Genmuster. Darüber hinaus tragen die Chiasmata wahrscheinlich zur korrekten Trennung der Chromosomen während der Meiose I bei. Schließlich zerfällt der synaptonemale Komplex, und die Zelle tritt in das Diplotän
Schließlich zerfällt der synaptonemale Komplex, und die Zelle tritt in das Diplotän  (diplotene stage, diplonema) ein: Die
Chromatidenpaare setzen sich voneinander ab. Homologe Chromosomen
beginnen sich zu trennen, die Chiasmata bleiben hingegen intakt und halten die väterlichen und mütterlichen Homologe jedes Chromosoms an der Spindel bis zur Anaphase 1 zusammen. Dadurch haben sie eine ähnliche Rolle wie die Zentromere der Mitose und der Meiose II.
(diplotene stage, diplonema) ein: Die
Chromatidenpaare setzen sich voneinander ab. Homologe Chromosomen
beginnen sich zu trennen, die Chiasmata bleiben hingegen intakt und halten die väterlichen und mütterlichen Homologe jedes Chromosoms an der Spindel bis zur Anaphase 1 zusammen. Dadurch haben sie eine ähnliche Rolle wie die Zentromere der Mitose und der Meiose II. Diakinese
Diakinese  (diakinesis stage): Die RNA-Synthese sistiert, Chromosomen kondensieren. Damit endet die Prophase I, die Chromatidentetraden verkürzen sich, die Zellkernhülle löst sich auf, und der Spindelapparat kann sich ausbilden.
(diakinesis stage): Die RNA-Synthese sistiert, Chromosomen kondensieren. Damit endet die Prophase I, die Chromatidentetraden verkürzen sich, die Zellkernhülle löst sich auf, und der Spindelapparat kann sich ausbilden.  Chromosomensatz pro Zelle. Während der Metaphase I ordnen sich die Chomosomenpaare (Tatraden) in der Äquatorialplatte, in der Anaphase I wandert je ein Chromosom (eines homologen Paares) zu dem einen, das andere zum entgegengesetzen Pol (Abbildung oben).
Chromosomensatz pro Zelle. Während der Metaphase I ordnen sich die Chomosomenpaare (Tatraden) in der Äquatorialplatte, in der Anaphase I wandert je ein Chromosom (eines homologen Paares) zu dem einen, das andere zum entgegengesetzen Pol (Abbildung oben).  Die erste Reifeteilung (Meiose I) hat den Chromosomensatz pro Zelle halbiert (auf 23: haploid), und zwischen homologen (väterlichen und mütterlichen) Chromatiden hat genetische Rekombinationen stattgefunden, resultierend in neu kombinierten Chromosomen.
Die erste Reifeteilung (Meiose I) hat den Chromosomensatz pro Zelle halbiert (auf 23: haploid), und zwischen homologen (väterlichen und mütterlichen) Chromatiden hat genetische Rekombinationen stattgefunden, resultierend in neu kombinierten Chromosomen. 
 Abbildung: Crossing over: Die genetischen Karten werden neu gemischt
Abbildung: Crossing over: Die genetischen Karten werden neu gemischt Homologe (homologe Chromosomen)
sind Kopien eines Chromosoms - eine von der Mutter, eine vom Vater
stammend -, welche die gleichen Gene an gleichen Genorten (Genloci)
aufweisen. Das ermöglicht eine Paarung (Synapsis) der Chromosomen im Rahmen der Fertisisierung und den geordneten Austausch von Genen im Zuge genetischer Rekombination.
Homologe (homologe Chromosomen)
sind Kopien eines Chromosoms - eine von der Mutter, eine vom Vater
stammend -, welche die gleichen Gene an gleichen Genorten (Genloci)
aufweisen. Das ermöglicht eine Paarung (Synapsis) der Chromosomen im Rahmen der Fertisisierung und den geordneten Austausch von Genen im Zuge genetischer Rekombination.
 ) zwischen von Vater und Mutter stammenden
Chromatiden (crossing over) ergeben neue
individuelle Genkombinationen. Dieser Vorgang erfolgt im Pachytänstadium. Die Anzahl möglicher Chromosomenkombinationen beträgt 223 (23 Chromosomenpaare), entsprechend über 8 Millionen genetisch unterschiedlichen Gameten (dieses Repertoire an Möglichkeiten besteht für jede einzelne Meiose).
) zwischen von Vater und Mutter stammenden
Chromatiden (crossing over) ergeben neue
individuelle Genkombinationen. Dieser Vorgang erfolgt im Pachytänstadium. Die Anzahl möglicher Chromosomenkombinationen beträgt 223 (23 Chromosomenpaare), entsprechend über 8 Millionen genetisch unterschiedlichen Gameten (dieses Repertoire an Möglichkeiten besteht für jede einzelne Meiose).  Rekombination ist der Vorgang, durch den bei der Bildung von Ei- oder Samenzellen DNA
zwischen zwei äquivalenten Chromosomen ausgetauscht wird ("crossing over",
Rekombination ist der Vorgang, durch den bei der Bildung von Ei- oder Samenzellen DNA
zwischen zwei äquivalenten Chromosomen ausgetauscht wird ("crossing over",  Abbildung). Die Überkreuzung der DNA-Stränge erfolgt an Anhaftungspunkten, die Chiasmata oder hot spots genannt
werden (vorgegeben durch Proteine - z.B. Cohesin -, welche die Chromosomen in der frühen Meiose organisieren). Überkreuzung erfolgt auch zwischen homologen Regionen der X- und Y-Chromosomen.
Abbildung). Die Überkreuzung der DNA-Stränge erfolgt an Anhaftungspunkten, die Chiasmata oder hot spots genannt
werden (vorgegeben durch Proteine - z.B. Cohesin -, welche die Chromosomen in der frühen Meiose organisieren). Überkreuzung erfolgt auch zwischen homologen Regionen der X- und Y-Chromosomen. Als synaptonemal
Als synaptonemal  bezeichnet man einen Proteinkomplex
(synaptonemaler / synaptischer Komplex, synaptonemal complex SC) zur Vermittlung der Paarung und Rekombination homologer Chromosomen im
Rahmen der Reifeteilung (Meiose). Der synaptonemale Komplex bildet
sich entlang der gesamten Länge jedes Chromatids im Rahmen eines
Vorgangs, der als Synapsis bezeichnet wird. Er ermöglicht die Rekombination von DNA zwischen homologen Chromosomen.
bezeichnet man einen Proteinkomplex
(synaptonemaler / synaptischer Komplex, synaptonemal complex SC) zur Vermittlung der Paarung und Rekombination homologer Chromosomen im
Rahmen der Reifeteilung (Meiose). Der synaptonemale Komplex bildet
sich entlang der gesamten Länge jedes Chromatids im Rahmen eines
Vorgangs, der als Synapsis bezeichnet wird. Er ermöglicht die Rekombination von DNA zwischen homologen Chromosomen.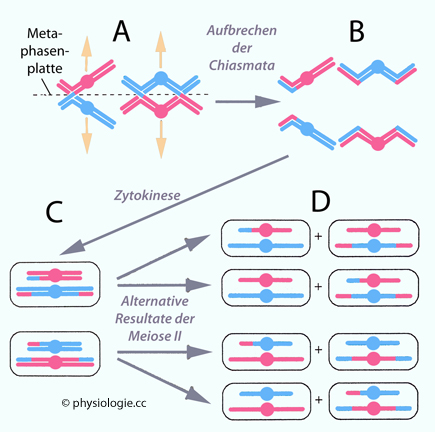
 Abbildung: Von der Metaphase I zur Bildung der Gameten
Abbildung: Von der Metaphase I zur Bildung der Gameten


 Abbildung: Oogenese und follikuläre Entwicklung
Abbildung: Oogenese und follikuläre Entwicklung
 Abbildung), die nun für Jahre im Diplotänstadium "eingefroren" bleiben.
Abbildung), die nun für Jahre im Diplotänstadium "eingefroren" bleiben. 
 Abbildung: Spermatogenese in einem Hodenkanälchen (tubulus seminiferus)
Abbildung: Spermatogenese in einem Hodenkanälchen (tubulus seminiferus)
 Abbildung)
erst mit dem Eintritt in die Pubertät. Im Gegensatz zu primären Oozyten
beim weiblichen Organismus treten Spermatogonien zu unterschiedlichen
Zeiten in die Meiosetphase ein. Zahlreiche Spermatogonien verharren für
Jahre oder Jahrzehnte im mitotischen Zyklus.
Abbildung)
erst mit dem Eintritt in die Pubertät. Im Gegensatz zu primären Oozyten
beim weiblichen Organismus treten Spermatogonien zu unterschiedlichen
Zeiten in die Meiosetphase ein. Zahlreiche Spermatogonien verharren für
Jahre oder Jahrzehnte im mitotischen Zyklus.  Abbildung).
Daraus entstehen zwei sekundäre Spermatozyten, die unverzüglich in die
Meiose II eintreten und diese nach acht Stunden beendet haben, mit dem
Resultat von vier hapoiden Spermatiden - die sich schließlich zu
fertigen Spermatozoen entwickeln (Reduktion des Zytoplasmas,
Differenzierung des Schwanzteils).
Abbildung).
Daraus entstehen zwei sekundäre Spermatozyten, die unverzüglich in die
Meiose II eintreten und diese nach acht Stunden beendet haben, mit dem
Resultat von vier hapoiden Spermatiden - die sich schließlich zu
fertigen Spermatozoen entwickeln (Reduktion des Zytoplasmas,
Differenzierung des Schwanzteils). Näheres zur Spermatogenese und Samenbildung s. dort
Näheres zur Spermatogenese und Samenbildung s. dort
 Abbildung: Normale Reifeteilungen (rechts) und Non-Disjunctionen, die zu Mono- bzw. Trisomie führen
Abbildung: Normale Reifeteilungen (rechts) und Non-Disjunctionen, die zu Mono- bzw. Trisomie führen
 Als Ploidie bezeichnet man die Anzahl der im Set einer Zelle enthaltenen Chromosomen, s. oben. Euploidie
Als Ploidie bezeichnet man die Anzahl der im Set einer Zelle enthaltenen Chromosomen, s. oben. Euploidie  bedeutet, dass der Chromosomenbesatz "stimmt", Aneuploidie hingegen, dass die meiotische Aufteilung der Chromosomen nicht überall erfolgreich abgelaufen ist (Fehlsegregation, nondisjunction).
bedeutet, dass der Chromosomenbesatz "stimmt", Aneuploidie hingegen, dass die meiotische Aufteilung der Chromosomen nicht überall erfolgreich abgelaufen ist (Fehlsegregation, nondisjunction). Abbildung),
die sich auf den durch die Fertilisation einer Eizelle entstandenen
Organismus fortsetzen (auf alle oder nur einen Teil der Zellen): Fehlt
ein Chromosom, spricht man von Monosomie, ist eines zu viel, von Trisomie (z.B. Trisomie 21, ein Down-Syndrom).
Abbildung),
die sich auf den durch die Fertilisation einer Eizelle entstandenen
Organismus fortsetzen (auf alle oder nur einen Teil der Zellen): Fehlt
ein Chromosom, spricht man von Monosomie, ist eines zu viel, von Trisomie (z.B. Trisomie 21, ein Down-Syndrom).
 Geschlechtschromosomen (Heterosomen, Gonosomen) bestimmen das
genetische Geschlecht (XX, XY). X-Chromosomen verfügen über ~800 Gene, Y-Chromosomen über ~50.
Die meisten geschlechtsspezifischen Unterschiede erklären sich durch
ungleiche Realisierung von autosomalen Genen. Männliche Feten bilden
Testosteron, weibliche Östrogene. Die Wirkung der Geschlechtshormone
auf (intrazelluläre) Rezeptoren bestimmen die Geschlechtsmerkmale
(sexueller Dimorphismus)
Geschlechtschromosomen (Heterosomen, Gonosomen) bestimmen das
genetische Geschlecht (XX, XY). X-Chromosomen verfügen über ~800 Gene, Y-Chromosomen über ~50.
Die meisten geschlechtsspezifischen Unterschiede erklären sich durch
ungleiche Realisierung von autosomalen Genen. Männliche Feten bilden
Testosteron, weibliche Östrogene. Die Wirkung der Geschlechtshormone
auf (intrazelluläre) Rezeptoren bestimmen die Geschlechtsmerkmale
(sexueller Dimorphismus)  Eine frühe hormonelle Weichenstellung führt bei männlichen Feten zur
Bildung von TDF, AMH, Testosteron, Hoden, Samenleitern und
Begleitdrüsen, Regression der Müller-Gänge und Ausbildung männlicher
Genitalien. Bleiben frühe endokrine Signale aus (der weibliche Embryo
hat kein SRY-Gen), atresieren die Wolff-Gänge, aus den Müller-Gängen
entstehen Eileiter und Uterus, weibliche Geschlechtsmerkmale bilden
sich aus
Eine frühe hormonelle Weichenstellung führt bei männlichen Feten zur
Bildung von TDF, AMH, Testosteron, Hoden, Samenleitern und
Begleitdrüsen, Regression der Müller-Gänge und Ausbildung männlicher
Genitalien. Bleiben frühe endokrine Signale aus (der weibliche Embryo
hat kein SRY-Gen), atresieren die Wolff-Gänge, aus den Müller-Gängen
entstehen Eileiter und Uterus, weibliche Geschlechtsmerkmale bilden
sich aus Viele verschiedene Gene beeinflussen die Geschlechtlichkeit und wirken
sich somatisch (z.B. Muskelstärke, Blutbildung) und
hormonell aus (Hormone, Rezeptoren). Das SRY-Gen des Y-Chromosoms
kodiert den Transkriptionsfaktor TDF, der die Bildung eines
männlichen Organismus triggert; ohne SRY-Gen läuft die
Entwicklung in Richtung weiblicher Organismus
Viele verschiedene Gene beeinflussen die Geschlechtlichkeit und wirken
sich somatisch (z.B. Muskelstärke, Blutbildung) und
hormonell aus (Hormone, Rezeptoren). Das SRY-Gen des Y-Chromosoms
kodiert den Transkriptionsfaktor TDF, der die Bildung eines
männlichen Organismus triggert; ohne SRY-Gen läuft die
Entwicklung in Richtung weiblicher Organismus Die Meiose (Reifeteilung) verteilt Gene von Mutter und Vater auf
"kombinierte" Chromatiden mit dem Resultat einer neuen individuellen
Genkombination. Jede Reifeteilung ergibt 2-3 Crossover-Vorgänge je
Chromosom, entsprechend 50-80 Rekombinationen für den gesamten
Chromosomensatz. Die Meiose wird unterteilt in Leptotän, Zygotän,
Pachytän, Diplotän und Diakinese
Die Meiose (Reifeteilung) verteilt Gene von Mutter und Vater auf
"kombinierte" Chromatiden mit dem Resultat einer neuen individuellen
Genkombination. Jede Reifeteilung ergibt 2-3 Crossover-Vorgänge je
Chromosom, entsprechend 50-80 Rekombinationen für den gesamten
Chromosomensatz. Die Meiose wird unterteilt in Leptotän, Zygotän,
Pachytän, Diplotän und Diakinese Der weibliche Fetus bildet bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel. Die Prophase der ersten meiotischen
Teilung kann Jahrzente dauern, die Eizelle verweilt im Diktyotän. Die
zweite meiotische Teilung (Äquationsteilung) verläuft ähnlich einer
Mitose
Der weibliche Fetus bildet bis zum 5. Schwangerschaftsmonat ~7
Millionen Primordialfollikel. Die Prophase der ersten meiotischen
Teilung kann Jahrzente dauern, die Eizelle verweilt im Diktyotän. Die
zweite meiotische Teilung (Äquationsteilung) verläuft ähnlich einer
Mitose