




| Die
Befruchtung
der Eizelle erfolgt in mehreren Phasen: Im Ejakulat sind
die Spermien von Glykoproteinen eingehüllt und gelangen so rasch durch
den Zervixschleim, sind vor immunologischer Abwehr geschützt und bilden
in der Tube ein
Spermien-Reservoir, in dem sie bei niedrigen pH-Werten immobilisiert
sind. Zum Zeitpunkt der Ovulation steigt der pH-Wert, die Spermien werden aktiv, verlieren ihre Beschichtung, ihre Oberflächenmerkmale werden freigelegt (Kapazitation) und Enzyme aktiviert, sie können die Eihügelmatrix (corona radiata) und zona pellucida durchdringen. Passieren sie schließlich die Eizellmembran (Imprägnation), gelangt ihr Zellkern in die Eizelle (Befruchtung, Konzeption, Empfängnis, Fertilisation) - männlicher und weiblicher Vorkern verschmelzen (Konjugation, Fusion), eine neue eukaryotische (dipoloide) Zelle - die Zygote - ist entstanden. Die Zygote erreicht nach 4 Tagen die Uterushöhle, nach 6-7 Tagen startet die Einnistung (Nidation, Implantation) in die Uterusschleimhaut; diese bildet zahlreiche Peptide und Proteine. Mit der erfolgreichen Implantation beginnt die Gestationsphase (Schwangerschaft). Das rasche Auftreten des Blastozystenhormons HCG (Chorion-Gonadotropin, “Schwangerschaftshormon”) - schon wenige Tage nach der Befruchtung - verhindert eine Mensesblutung: HCG regt die Hormonbildung im Gelbkörper an, das stabilisiert die Schleimhaut und erhält damit die Schwangerschaft. |
 Empfängnis
Empfängnis  Implantation, Schwangerschaftsdauer
Implantation, Schwangerschaftsdauer  HCG und hPL
HCG und hPL  Plazentation und Embryogenese
Plazentation und Embryogenese  Extraembryonale Membransysteme und Amnionflüssigkeit
Extraembryonale Membransysteme und Amnionflüssigkeit  Brustdrüse, hormonelle Umstellungen
Brustdrüse, hormonelle Umstellungen

 Befruchtung
Befruchtung  Kapazitation
Kapazitation  Akrosomale Reaktion
Akrosomale Reaktion  Implantation (Nidation)
Implantation (Nidation)  Progestations-, Gestationsphase
Progestations-, Gestationsphase  Dezidualisierung
Dezidualisierung  Trimenon
Trimenon  Chorion, Amnion, Dottersack, Allantois
Chorion, Amnion, Dottersack, Allantois
 in die Uterusschleimhaut
(Nidation, Implantation). Klinisch wird die Schwangerschaftsdauer meist
ab dem ersten Tag der letzten Menstruastion berechnet (SSW =
Schwangerschaftswoche). Das - biologisch relevantere - Konzeptionsalter (p.c.: post conceptionem) des sich entwickelnden Keims ist der zeitliche Abstand zur Befruchtung.
in die Uterusschleimhaut
(Nidation, Implantation). Klinisch wird die Schwangerschaftsdauer meist
ab dem ersten Tag der letzten Menstruastion berechnet (SSW =
Schwangerschaftswoche). Das - biologisch relevantere - Konzeptionsalter (p.c.: post conceptionem) des sich entwickelnden Keims ist der zeitliche Abstand zur Befruchtung. Unter pränataler Entwicklung versteht man die Vorgänge ab der Empfängnis:
Unter pränataler Entwicklung versteht man die Vorgänge ab der Empfängnis: Blastemzeit (period of early embryo): Befruchung bis Gastrulation, d.h. Entstehung der Keimblätter, 1.-3. Woche (16.-19. Tag) p.c.
Blastemzeit (period of early embryo): Befruchung bis Gastrulation, d.h. Entstehung der Keimblätter, 1.-3. Woche (16.-19. Tag) p.c.  Embryonalzeit
(period of embryonic organogenesis): Auflösung der Somiten, Entwicklung des
kardiovaskulären Systems, des Neural- und Darmrohres, der Anlagen von Armen
und Beinen, 4.-8. Woche p.c.
Embryonalzeit
(period of embryonic organogenesis): Auflösung der Somiten, Entwicklung des
kardiovaskulären Systems, des Neural- und Darmrohres, der Anlagen von Armen
und Beinen, 4.-8. Woche p.c. Fetalzeit (fetal period) ab 9. Woche p.c. bis unmittelbar vor der Geburt.
Fetalzeit (fetal period) ab 9. Woche p.c. bis unmittelbar vor der Geburt.  Die Perinatalperiode wird vom Ende der 28.
Schwangerschaftswoche bis
zum 7. postnatalen Tag (nach der Geburt) gerechnet. In dieser
(kritischen und mit relativ hoher Morbidität / Mortalität behafteten)
Zeit werden die Organe auf die sich ändernden
Anforderungen während und nach der Geburt umgestellt.
Die Perinatalperiode wird vom Ende der 28.
Schwangerschaftswoche bis
zum 7. postnatalen Tag (nach der Geburt) gerechnet. In dieser
(kritischen und mit relativ hoher Morbidität / Mortalität behafteten)
Zeit werden die Organe auf die sich ändernden
Anforderungen während und nach der Geburt umgestellt.  Anschließend
folgt die Postnatal- (bezieht sich auf das Neugeborene) bzw. Postpartalperiode (bezieht
sich auf die Mutter). Sie umfasst die ersten beiden Jahre nach der
Geburt, in denen sich die Mutter von der Schwangerschaft erholt
(Restitution verschiedener Körperreserven, z.B. Calcium, Eisen) und das
Kind elementare Fähigkeiten (Motorik, Sprachentwicklung) erlangt -
parallel mit insbesondere zerebralem Wachstum (der Mensch kommt
biologisch gesehen als Frühgeburt zur Welt, insbesondere bezogen auf
die Hirnentwicklung).
Anschließend
folgt die Postnatal- (bezieht sich auf das Neugeborene) bzw. Postpartalperiode (bezieht
sich auf die Mutter). Sie umfasst die ersten beiden Jahre nach der
Geburt, in denen sich die Mutter von der Schwangerschaft erholt
(Restitution verschiedener Körperreserven, z.B. Calcium, Eisen) und das
Kind elementare Fähigkeiten (Motorik, Sprachentwicklung) erlangt -
parallel mit insbesondere zerebralem Wachstum (der Mensch kommt
biologisch gesehen als Frühgeburt zur Welt, insbesondere bezogen auf
die Hirnentwicklung). (Eihaut, Glashaut) - eine dünne Glykoproteinhülle extrazellulärer Matrix
um den Oozyten (von diesem durch einen extrazellulären Spalt - den
Perivitellinraum - getrennt). Die zona pellucida regt einerseits die akrosomale
Reaktion der
Spermienköpfe an und beteiligt sich andererseits daran, dass nur ein Spermium in die Eizelle eindringen kann.
(Eihaut, Glashaut) - eine dünne Glykoproteinhülle extrazellulärer Matrix
um den Oozyten (von diesem durch einen extrazellulären Spalt - den
Perivitellinraum - getrennt). Die zona pellucida regt einerseits die akrosomale
Reaktion der
Spermienköpfe an und beteiligt sich andererseits daran, dass nur ein Spermium in die Eizelle eindringen kann.  Als Befruchtung (Fertilisation, Konzeption, Empfängnis, (generative) (human) fertilization, impregnation, syngamy) bezeichnet man die Fusion zweier haploider Gameten (Spermium und Eizelle); sie erfolgt typischerweise am 15.-17. Zyklustag. Das Ergebnis ist eine Zygote, also eine diploide Zelle (2N DNA)
mit einem neuen individuellen Genmuster: Sie verfügt über einen individualspezifischen
Mix mütterlicher und väterlicher DNA und repräsentiert das früheste
Entwicklungsstadium eines neu entstandenen Organismus.
Als Befruchtung (Fertilisation, Konzeption, Empfängnis, (generative) (human) fertilization, impregnation, syngamy) bezeichnet man die Fusion zweier haploider Gameten (Spermium und Eizelle); sie erfolgt typischerweise am 15.-17. Zyklustag. Das Ergebnis ist eine Zygote, also eine diploide Zelle (2N DNA)
mit einem neuen individuellen Genmuster: Sie verfügt über einen individualspezifischen
Mix mütterlicher und väterlicher DNA und repräsentiert das früheste
Entwicklungsstadium eines neu entstandenen Organismus.  Unter Kapazitation versteht man die eine endgültige Reifung der Spermien, die notwendig ist, um
befruchtungsfähig zu werden;
sie ermöglicht ihnen die Durchdringung der zona pellucida. Dieser
Vorgang erfolgt hauptsächlich im Ovidukt (Tube), er modifiziert die
Spermatozoen: Durch die Ovulation steigt im Eileiter die Bicarbonatkonzentration und
damit der pH-Wert an, worauf die Spermien ihre Defensinbeschichtung verlieren (in der Tube
vermitteln Defensine die Anhaftung der Spermien an Epithelzellen) und wieder mobil werden.
Cholesterin verschwindet aus der Membran der Spermien, ebenso Proteine
und Kohlenhydrate, welche Bindungsstellen an die Eizelle blockieren
könnten. Akrosomale Enzyme - wie die Protease Acrosin und Hyaluronidase
PH20 (sperm adhesion molecule 1, SPAM1) - sowie Rezeptoren für die Eizelle werden freigesetzt.
So kann das Spermium nicht nur die extrazelluläre Matrix der corona
radiata sowie die zona pellucida durchdringen, sondern auch die
Zellmembran der Eizelle perforieren.
Unter Kapazitation versteht man die eine endgültige Reifung der Spermien, die notwendig ist, um
befruchtungsfähig zu werden;
sie ermöglicht ihnen die Durchdringung der zona pellucida. Dieser
Vorgang erfolgt hauptsächlich im Ovidukt (Tube), er modifiziert die
Spermatozoen: Durch die Ovulation steigt im Eileiter die Bicarbonatkonzentration und
damit der pH-Wert an, worauf die Spermien ihre Defensinbeschichtung verlieren (in der Tube
vermitteln Defensine die Anhaftung der Spermien an Epithelzellen) und wieder mobil werden.
Cholesterin verschwindet aus der Membran der Spermien, ebenso Proteine
und Kohlenhydrate, welche Bindungsstellen an die Eizelle blockieren
könnten. Akrosomale Enzyme - wie die Protease Acrosin und Hyaluronidase
PH20 (sperm adhesion molecule 1, SPAM1) - sowie Rezeptoren für die Eizelle werden freigesetzt.
So kann das Spermium nicht nur die extrazelluläre Matrix der corona
radiata sowie die zona pellucida durchdringen, sondern auch die
Zellmembran der Eizelle perforieren.
 Abbildung: Befruchtungssequenz
Abbildung: Befruchtungssequenz
 Die corona ratiata (gebildet aus der innersten Lage der um die Eizelle angeordneten Granulosazellen),
Die corona ratiata (gebildet aus der innersten Lage der um die Eizelle angeordneten Granulosazellen),  die aus extrazellulärer Matrix bestehende zona
pellucida,
die aus extrazellulärer Matrix bestehende zona
pellucida, die Zellmembran der Eizelle.
die Zellmembran der Eizelle. Abbildung) gebunden, die daher erst freigelegt werden muss, um wirksam werden zu können. Dazu bedarf es einer akrosomalen Reaktion:
Abbildung) gebunden, die daher erst freigelegt werden muss, um wirksam werden zu können. Dazu bedarf es einer akrosomalen Reaktion: Als akrosomale Reaktion bezeichnet
man den Vorgang, der sich im Akrosom des Spermiums bei der Annäherung
an die Eizelle abspielt. Die akrosomale Reaktion beginnt schon, bevor das Spermium die zona pellucida erreicht hat - also am Weg durch die corona radiata, aufgebaut
durch Granulosazellen. Dabei
verschmelzen Teile der äußeren akrosomalen Membran mit der
darüberliegenden Zellmembran, spalten sich als kleine Vesikel ab und geben lytische Enzyme frei (akrosomale Exozytose, mediiert durch cAMP und cGMP über CNG-Kanäle).
Als akrosomale Reaktion bezeichnet
man den Vorgang, der sich im Akrosom des Spermiums bei der Annäherung
an die Eizelle abspielt. Die akrosomale Reaktion beginnt schon, bevor das Spermium die zona pellucida erreicht hat - also am Weg durch die corona radiata, aufgebaut
durch Granulosazellen. Dabei
verschmelzen Teile der äußeren akrosomalen Membran mit der
darüberliegenden Zellmembran, spalten sich als kleine Vesikel ab und geben lytische Enzyme frei (akrosomale Exozytose, mediiert durch cAMP und cGMP über CNG-Kanäle). 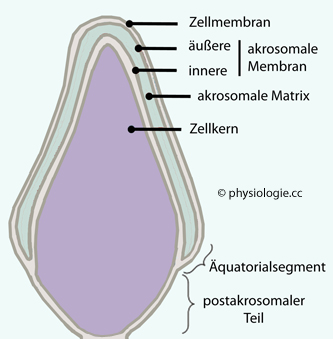
 Abbildung: Spermienkopf
Abbildung: Spermienkopf
 (diese wurden im Zuge der akrosomalen Reaktion von der akrosomalen
Membran des Spermiums in seine Membran des Äquatorialsegments
verlagert) und JUNO
(diese wurden im Zuge der akrosomalen Reaktion von der akrosomalen
Membran des Spermiums in seine Membran des Äquatorialsegments
verlagert) und JUNO (in der Zellmembran der Eizelle). Das gesamte
Spermium dringt in die Eizelle ein, Flagellum und Mitochondrien zerfallen,
die DNA dekondensiert. Der Spermakopf bildet einen Vorkern.
(in der Zellmembran der Eizelle). Das gesamte
Spermium dringt in die Eizelle ein, Flagellum und Mitochondrien zerfallen,
die DNA dekondensiert. Der Spermakopf bildet einen Vorkern.| Die Befruchtung findet meist im ampullären Teil der Tube statt |
Aktivierung der Eizelle durch Ca++-Wellen Nach Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 |
1. Zinkfreisetzung  2. Freisetzung kortikaler Granula 2. Freisetzung kortikaler Granula 3. Ende der Blockade der Metaphase II  4. Rekrutierung und Abbau maternaler mRNA  5. Entwicklung der Vorkerne  6. Steigerung der Zellatmung  7. Metabolische Aktivierung  8. Beginn der Genexpression des Embryo |
 Abbildung). Der Inhalt spezieller (als kortikale Granula bezeichneter) Vesikel wird in den Perivitellinraum freigesetzt:
Abbildung). Der Inhalt spezieller (als kortikale Granula bezeichneter) Vesikel wird in den Perivitellinraum freigesetzt:  Proteasen zur Spaltung perivitelliner Verankerungsproteine,
Proteasen zur Spaltung perivitelliner Verankerungsproteine,  Peroxidasen zur Härtung der zona pellucida (zona block - dieser ist innerhalb einer halben Stunde komplett ausgebildet),
Peroxidasen zur Härtung der zona pellucida (zona block - dieser ist innerhalb einer halben Stunde komplett ausgebildet),  Glykosaminoglykane zur Ansammlung von Wasser und das "Abheben" der zona pellucida vom Oozyten.
Glykosaminoglykane zur Ansammlung von Wasser und das "Abheben" der zona pellucida vom Oozyten. 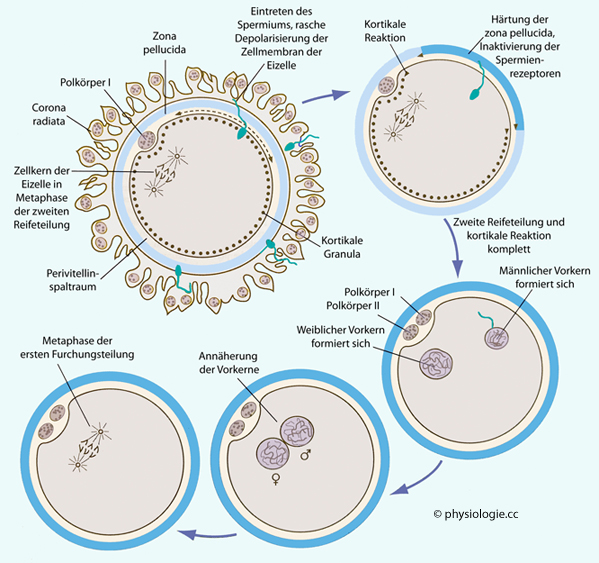
 Abbildung: Schritte der Befruchtung
Abbildung: Schritte der Befruchtung
 (mit 46 Chromosomen) ist entstanden und das chromosomale Geschlecht ist
festgelegt (männlich, wenn das Spermium ein Y-Chromosom beigestellt
hat). Innerhalb von vier Stunden nach der Fertilisierung wird das
väterliche Genom (der aus dem Spermium stammende Erbteil) intensiv demethlyiert;
die Demethylierung des mütterlichen Genoms (das aus der Eizelle)
erfolgt langsamer (bis zum Morulastadium des Embryos, zu diesem
Zeitpunkt ist die DNA maximal demethyliert). Die innere Zellmasse wird
anschließend remethyliert; die Remethylierung ist im späten
Blastozystenstadium abgeschlossen.
(mit 46 Chromosomen) ist entstanden und das chromosomale Geschlecht ist
festgelegt (männlich, wenn das Spermium ein Y-Chromosom beigestellt
hat). Innerhalb von vier Stunden nach der Fertilisierung wird das
väterliche Genom (der aus dem Spermium stammende Erbteil) intensiv demethlyiert;
die Demethylierung des mütterlichen Genoms (das aus der Eizelle)
erfolgt langsamer (bis zum Morulastadium des Embryos, zu diesem
Zeitpunkt ist die DNA maximal demethyliert). Die innere Zellmasse wird
anschließend remethyliert; die Remethylierung ist im späten
Blastozystenstadium abgeschlossen. Abbildung).
Abbildung). 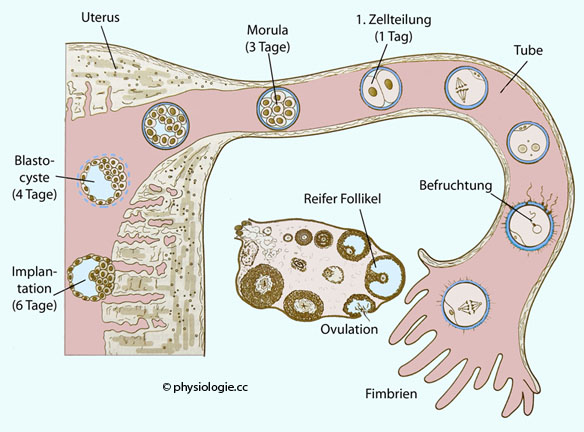
 Abbildung: Transport von Eizelle / Zygote / Morula / Blastozyste in den Uterus
Abbildung: Transport von Eizelle / Zygote / Morula / Blastozyste in den Uterus
 ) in die Uterusschleimhaut, welche dabei zahlreiche Peptide und Proteine bildet.
) in die Uterusschleimhaut, welche dabei zahlreiche Peptide und Proteine bildet. Abbildung), die anschließend - mit dem Embryonalpol voraus - in das Endometrium einzuwandern beginnt.
Abbildung), die anschließend - mit dem Embryonalpol voraus - in das Endometrium einzuwandern beginnt.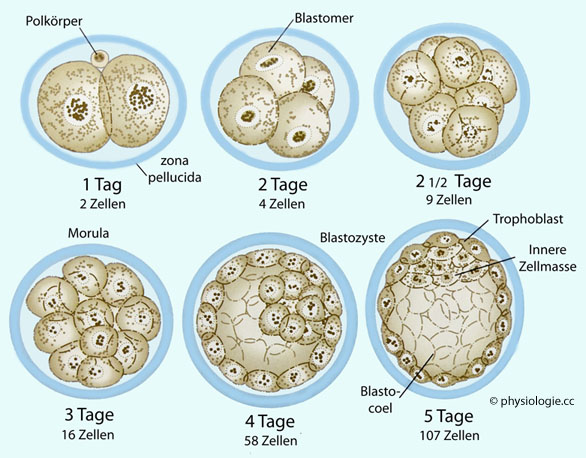
 Abbildung: Frühe Furchungsteilungen
Abbildung: Frühe Furchungsteilungen
 Abbildung). Die entstehenden Zellen nennt man Blastomere. Die Größe des Embryos verändert sich bei diesen sogenannten Furchungsteilungen (cleavage) nicht, stattdessen resultieren kleinere Zellen. Die zona pellucida umschließt die Zygote bzw. die
daraus durch Zellteilung entstehenden Blastomeren (Zellen, die durch
Furchung bzw. Abschnürung entstanden sind) nach wie vor.
Abbildung). Die entstehenden Zellen nennt man Blastomere. Die Größe des Embryos verändert sich bei diesen sogenannten Furchungsteilungen (cleavage) nicht, stattdessen resultieren kleinere Zellen. Die zona pellucida umschließt die Zygote bzw. die
daraus durch Zellteilung entstehenden Blastomeren (Zellen, die durch
Furchung bzw. Abschnürung entstanden sind) nach wie vor.  (Keimblase) aus (cavitation). Die Blastocoelflüssigkeit füllt den Hohlraum der (durch hydrostatischen Druck, der Zellkontakte aufbricht, entstandenen) Blastozyste aus.
Das Blastocoel
(primäre Leibeshöhle, cleavage cavity) bildet sich ab dem 32-Zellen-Stadium aus. In diesem Stadium hat der
Zellhaufen die Tuben passiert und die Uterushöhle erreicht.
(Keimblase) aus (cavitation). Die Blastocoelflüssigkeit füllt den Hohlraum der (durch hydrostatischen Druck, der Zellkontakte aufbricht, entstandenen) Blastozyste aus.
Das Blastocoel
(primäre Leibeshöhle, cleavage cavity) bildet sich ab dem 32-Zellen-Stadium aus. In diesem Stadium hat der
Zellhaufen die Tuben passiert und die Uterushöhle erreicht.  zunehmen.
zunehmen.  Abbildung unten).
Aus dem Hypoblast entstehen später das extra-embryonale Endoderm um den
primären Dottersack, aus dem Epiblast das Amnion und extraembryonale
Mesoderm, die Urkeimzellen (primordial germ cells) sowie die Keimblätter (germ layers) - embryonales Ektoderm, Mesoderm und Entoderm (
Abbildung unten).
Aus dem Hypoblast entstehen später das extra-embryonale Endoderm um den
primären Dottersack, aus dem Epiblast das Amnion und extraembryonale
Mesoderm, die Urkeimzellen (primordial germ cells) sowie die Keimblätter (germ layers) - embryonales Ektoderm, Mesoderm und Entoderm ( Abbildung). Mit anderen Worten, der Embryo entsteht ausschließlich aus Zellen des Epiblasten.
Abbildung). Mit anderen Worten, der Embryo entsteht ausschließlich aus Zellen des Epiblasten. Als
Implantation (Nidation
Als
Implantation (Nidation ) bezeichnet man die Einnistung der Blastozyste
in die Schleimhaut der Gebärmutter (Endometrium), beginnend 5-7 Tage
nach der Befruchtung der Eizelle oder im Mittel 21-22 Tage nach Beginn
der letzten Blutung (also etwa am Ende der 3. Gestationswoche). Die
Uterusschleimhaut wird unter der Wirkung von Progesteron in einen
Zustand versetzt, der die Implantation ermöglicht bzw. begünstigt.
) bezeichnet man die Einnistung der Blastozyste
in die Schleimhaut der Gebärmutter (Endometrium), beginnend 5-7 Tage
nach der Befruchtung der Eizelle oder im Mittel 21-22 Tage nach Beginn
der letzten Blutung (also etwa am Ende der 3. Gestationswoche). Die
Uterusschleimhaut wird unter der Wirkung von Progesteron in einen
Zustand versetzt, der die Implantation ermöglicht bzw. begünstigt.  Abbildung), ist nach wenigen
Tagen abgeschlossen (Nidation im Schnitt zwischen 16. bis 19. Zyklustag) und geht mit einer Veränderung der oberflächlichen
Schleimhaut (Dezidualisierung)
einher. An der Implantation sind zahlreiche Faktoren
beteiligt, von denen viele auch andere Funktionen im Körper
übernehmen (Beispiel L-Selektin: Es knüpft die Blastozyste an Oligosaccharide der Uterusschleimhaut, ermöglicht aber auch Leukozyten den Austritt aus dem Blutkreislauf Richtung lymphatische Gewebe).
Abbildung), ist nach wenigen
Tagen abgeschlossen (Nidation im Schnitt zwischen 16. bis 19. Zyklustag) und geht mit einer Veränderung der oberflächlichen
Schleimhaut (Dezidualisierung)
einher. An der Implantation sind zahlreiche Faktoren
beteiligt, von denen viele auch andere Funktionen im Körper
übernehmen (Beispiel L-Selektin: Es knüpft die Blastozyste an Oligosaccharide der Uterusschleimhaut, ermöglicht aber auch Leukozyten den Austritt aus dem Blutkreislauf Richtung lymphatische Gewebe).
 Abbildung: An der Implantation in die Gebärmutterschleimhaut beteiligte Faktoren
Abbildung: An der Implantation in die Gebärmutterschleimhaut beteiligte Faktoren hCG, Chorion-Gonadotropin
hCG, Chorion-Gonadotropin  Integrine s. dort
Integrine s. dort  Matrix-Metalloproteasen (s. dort) spalten Peptidbindungen in Proteinen. Sie können extrazelluläre Matrix abbauen (Gewebeumbau)
Matrix-Metalloproteasen (s. dort) spalten Peptidbindungen in Proteinen. Sie können extrazelluläre Matrix abbauen (Gewebeumbau)  Pinopodien
sind Fortsätze endometrialer Epithelzellen, die Flüssigkeit resorbieren
(Pinozytose) - das bringt die Blastozyste näher an das Epithel und
immobilisiert sie
Pinopodien
sind Fortsätze endometrialer Epithelzellen, die Flüssigkeit resorbieren
(Pinozytose) - das bringt die Blastozyste näher an das Epithel und
immobilisiert sie  Plasminogenaktivator s. dort
Plasminogenaktivator s. dort  Selektine s. dort
Selektine s. dort  Trophinin ist ein Adhäsionsmolekül aus Trophoblastenzellen, das die Adhäsion der Blastozyste unterstützt
Trophinin ist ein Adhäsionsmolekül aus Trophoblastenzellen, das die Adhäsion der Blastozyste unterstützt

 Abbildung).
Abbildung).  Die Dezidualisierung
Die Dezidualisierung  ist eine Antwort der Gebärmutterschleimhaut auf die Implantation. Oberflächliche
Stromazellen des Endometriums lagern Glykogen ein und heißen nunmehr
Deziduazellen. Inseln solcher Zellen bilden als dichte Lage (zona compacta) eine Abdichtung um den Embryo
(Schlussleistensystem), der dessen weitere Migration verhindert, und
bilden Faktoren wie Inhibitoren von Metalloproteinasen (TIMPs: Tissue inhibitors of metalloproteinases), welche die Aktivität hydrolytischer Enzyme in der endometriellen Matrix abschwächen.
ist eine Antwort der Gebärmutterschleimhaut auf die Implantation. Oberflächliche
Stromazellen des Endometriums lagern Glykogen ein und heißen nunmehr
Deziduazellen. Inseln solcher Zellen bilden als dichte Lage (zona compacta) eine Abdichtung um den Embryo
(Schlussleistensystem), der dessen weitere Migration verhindert, und
bilden Faktoren wie Inhibitoren von Metalloproteinasen (TIMPs: Tissue inhibitors of metalloproteinases), welche die Aktivität hydrolytischer Enzyme in der endometriellen Matrix abschwächen. Zellbarriere:
Die sich entwickelnden Trophoblastenzellen bilden eine Art anatomischen
Schutzwall um den Keim, der den Zutritt mütterlicher Immunzellen zu
fetalem Gewebe abriegelt. Trophoblastenzellen scheinen bestimmte vom
Vater stammende MHC (HLA-G) nicht zu exprimieren; die Dezidua könnte
ein Ort funktioneller Inhibition von Immunreaktionen sein.
Zellbarriere:
Die sich entwickelnden Trophoblastenzellen bilden eine Art anatomischen
Schutzwall um den Keim, der den Zutritt mütterlicher Immunzellen zu
fetalem Gewebe abriegelt. Trophoblastenzellen scheinen bestimmte vom
Vater stammende MHC (HLA-G) nicht zu exprimieren; die Dezidua könnte
ein Ort funktioneller Inhibition von Immunreaktionen sein. Immunsuppression: Spezielle Lymphozyten (Treg-Zellen)
behindern Entzündungsreaktionen, Chemokine gelangen nicht an die
Implantationsstelle. Der Embryo beteiligt sich am Immunschutz und
bildet immundämpfende Faktoren wie IL-10 und TGF-ß (lokale
Immunsuppression).
Immunsuppression: Spezielle Lymphozyten (Treg-Zellen)
behindern Entzündungsreaktionen, Chemokine gelangen nicht an die
Implantationsstelle. Der Embryo beteiligt sich am Immunschutz und
bildet immundämpfende Faktoren wie IL-10 und TGF-ß (lokale
Immunsuppression).  Spezielle Art der Antigenpräsentation:
Die Zellen des Fetus benützen eine Form der Antigenpräsentation (via
HLA-C), welche eine schwächere Antigenerkennung durch das mütterliche
Immunsystem zur Folge hat.
Spezielle Art der Antigenpräsentation:
Die Zellen des Fetus benützen eine Form der Antigenpräsentation (via
HLA-C), welche eine schwächere Antigenerkennung durch das mütterliche
Immunsystem zur Folge hat. Weiters bildet die Blastozyste Proteasen, Wachstumsfaktoren und hCG. Defensine tragen vermutlich zu immunologischer
"Unauffälligkeit" bei.
Weiters bildet die Blastozyste Proteasen, Wachstumsfaktoren und hCG. Defensine tragen vermutlich zu immunologischer
"Unauffälligkeit" bei.  ist ein Organismus, der genetisch unterschiedliche Zellen enthält).
Dieser Mikrochimärismus erhöht vermutlich die immunologische Toleranz
gegenüber dem "anderen" Gewebe.
ist ein Organismus, der genetisch unterschiedliche Zellen enthält).
Dieser Mikrochimärismus erhöht vermutlich die immunologische Toleranz
gegenüber dem "anderen" Gewebe. Synchronisation:
Für die Implantation steht nur ein relativ enges Zeitfenster zur
Verfügung, da sowohl die Uterusschleimhaut als auch der Embryo
vorgegebene Entwicklungen durchlaufen, die zeitlich aufeinander
abgestimmt sein müssen, um eine erfolgreiche Nidation zu ermöglichen.
Die Anwesenheit eines Embryos führt zur Dezidualisierung des Endometriums.
Synchronisation:
Für die Implantation steht nur ein relativ enges Zeitfenster zur
Verfügung, da sowohl die Uterusschleimhaut als auch der Embryo
vorgegebene Entwicklungen durchlaufen, die zeitlich aufeinander
abgestimmt sein müssen, um eine erfolgreiche Nidation zu ermöglichen.
Die Anwesenheit eines Embryos führt zur Dezidualisierung des Endometriums.| Die Implantation der Blastozyste erfolgt meist an der Uterus-Hinterwand |
 Um den Embryo herum bildet sich der Zytotrophoblast
(Langhans-Schicht
Um den Embryo herum bildet sich der Zytotrophoblast
(Langhans-Schicht ) aus.
) aus.  Einige der einkernigen Zellen des Zytotrophoblasten wachsen in den Synzytiotrophoblasten vor und bilden primäre Chorionzotten (primary chorionic villi), zunächst gefäßlose Epithelausstülpungen.
Einige der einkernigen Zellen des Zytotrophoblasten wachsen in den Synzytiotrophoblasten vor und bilden primäre Chorionzotten (primary chorionic villi), zunächst gefäßlose Epithelausstülpungen.  In diese wachsen mesenchymale Zellen ein, man spricht von sekundären Chorionzotten (secondary chorionic villi).
In diese wachsen mesenchymale Zellen ein, man spricht von sekundären Chorionzotten (secondary chorionic villi).  2-3 Wochen p.c. beginnen diese mesenchymalen Zellen Blutgefäße aufzubauen, man spricht von tertiären Chorionzotten (tertiary chorionic villi) (s. Abbildung unten).
2-3 Wochen p.c. beginnen diese mesenchymalen Zellen Blutgefäße aufzubauen, man spricht von tertiären Chorionzotten (tertiary chorionic villi) (s. Abbildung unten). Synzytiotrophoblastenzellen bauen die
Plazenta auf. Der Synzytiotrophoblast entsteht durch die Fusion
von Trophoblastenzellen (Synzytium!) und ist daher multinukleär. Seine
fingerförmigen Fortsätze wachsen durch das Endothel zunächst kleiner
endometrialer Blutgefäße und dann auch der Spiralarterien in tieferen
Schichten des Uterus. Damit kommunizieren die Lakunen im Trophoblasten
direkt mit dem Blut der Mutter.
Synzytiotrophoblastenzellen bauen die
Plazenta auf. Der Synzytiotrophoblast entsteht durch die Fusion
von Trophoblastenzellen (Synzytium!) und ist daher multinukleär. Seine
fingerförmigen Fortsätze wachsen durch das Endothel zunächst kleiner
endometrialer Blutgefäße und dann auch der Spiralarterien in tieferen
Schichten des Uterus. Damit kommunizieren die Lakunen im Trophoblasten
direkt mit dem Blut der Mutter.  Adhäsiv (Anhaftung an das Endometrium durch Cadherine / Integrine)
Adhäsiv (Anhaftung an das Endometrium durch Cadherine / Integrine) Invasiv (interstitielle Implantation: Einwandern in das uterine Bindegewebe)
Invasiv (interstitielle Implantation: Einwandern in das uterine Bindegewebe)  Endokrin (Bildung von hCG, nach einigen Wochen auch von Steroiden, sowie von Enzymen und weiteren Hormonen)
Endokrin (Bildung von hCG, nach einigen Wochen auch von Steroiden, sowie von Enzymen und weiteren Hormonen) Immunologisch
(Schutz des Embryos: Das Synzytium verhält sich wie eine einzige Zelle,
indem es keine Spalten für das Einwandern mütterlicher Immunzellen
erlaubt und so Reaktionen gegen vom Vater stammende Gewebemerkmale
vorbeugt).
Immunologisch
(Schutz des Embryos: Das Synzytium verhält sich wie eine einzige Zelle,
indem es keine Spalten für das Einwandern mütterlicher Immunzellen
erlaubt und so Reaktionen gegen vom Vater stammende Gewebemerkmale
vorbeugt). Abbildung: Von der Auflösung der zona pellucida bis zur Invasion in die Gebärmutterschleimhaut
Abbildung: Von der Auflösung der zona pellucida bis zur Invasion in die Gebärmutterschleimhaut Die Zeit von der
Ovulation bis zur Implantation heißt Progestationsphase; mit der erfolgreichen Implantation beginnt die Gestationsphase (Schwangerschaft).
Die Zeit von der
Ovulation bis zur Implantation heißt Progestationsphase; mit der erfolgreichen Implantation beginnt die Gestationsphase (Schwangerschaft).  Als Embryogenese
bezeichnet man die Zeitspanne von der Bildung der Zygote bis zu dem
Zeitpunkt, an dem alle großen Organsysteme angelegt sind - das ist das
Ende der 8. Entwicklungswoche der Frucht bzw. das Ende der 10.
Gestationswoche.
Als Embryogenese
bezeichnet man die Zeitspanne von der Bildung der Zygote bis zu dem
Zeitpunkt, an dem alle großen Organsysteme angelegt sind - das ist das
Ende der 8. Entwicklungswoche der Frucht bzw. das Ende der 10.
Gestationswoche. | Die Dauer einer Schwangerschaft wird in der Regel vom 1. Tag der letzten Monatsblutung aus gerechnet (Zusatz p.m. für "post menstruationem") - obwohl die Frau erst mit der Implantation schwanger ist. Man spricht von Schwangerschaftsdauer, Tragzeit oder Gestationsalter (gestational age). Dieses beträgt im Mittel 40 Schwangerschaftswochen (10 Lunarmonate) oder ~280 Tage. Für die Beurteilung der Entwicklung des Embryo / Fetus ist der Zeitpunkt der Ovulation / Konzeption relevant (Zusatz p.c. für "post conceptionem"). Dieser ist aber unsicher (meist liegt er 14-16 Tage nach dem 1. Tag der letzten Monatsblutung). Das Ovulationsalter zählt ab diesem Zeitpunkt; die Geburt erfolgt im Durchschnitt 38 Wochen (9,5 Lunarmonate) p.c. (264-268 Tage). Fehlt der Zusatz "p.c.", ist in der Regel das Schwangerschaftsalter p.m. gemeint. Spricht man z.B. von der 10. Schwangerschaftswoche (SSW, gestation week), ist der Embryo höchstwahrscheinlich 7-8 Wochen alt. |
 Das
Ausbleiben einer Menstruationsblutung ist oft der erste Hinweis auf
eine Schwangerschaft. Die Woche nach dem "Ausfall" der Monatsblutung
(Woche 5 p.m.) fällt mit der dritten Woche p.c. zusammen. Ab diesem
Zeitpunkt sind ein Trophoblast und Dottersack (umbilical vesicle, yolk sac) im Ultraschallbild sichtbar; Übelkeit und Erbrechen können auftreten. Die Nidation kann eine Implantationsblutung
auslösen, die mit der Monatsblutung verwechselt werden kann (das
Auftreten einer Blutung beweist nicht das Ausbleiben einer
Schwangerschaft). HCG im Blutserum wird im Fall einer Schwangerschaft
bereits 6 Tage vor dem Ausbleiben der Monatsblutung nachweisbar.
Das
Ausbleiben einer Menstruationsblutung ist oft der erste Hinweis auf
eine Schwangerschaft. Die Woche nach dem "Ausfall" der Monatsblutung
(Woche 5 p.m.) fällt mit der dritten Woche p.c. zusammen. Ab diesem
Zeitpunkt sind ein Trophoblast und Dottersack (umbilical vesicle, yolk sac) im Ultraschallbild sichtbar; Übelkeit und Erbrechen können auftreten. Die Nidation kann eine Implantationsblutung
auslösen, die mit der Monatsblutung verwechselt werden kann (das
Auftreten einer Blutung beweist nicht das Ausbleiben einer
Schwangerschaft). HCG im Blutserum wird im Fall einer Schwangerschaft
bereits 6 Tage vor dem Ausbleiben der Monatsblutung nachweisbar. (hCG, human choriongonadotropin), das wie LH wirkt.
(hCG, human choriongonadotropin), das wie LH wirkt. | Schwangeschaftstests beruhen im Allgemeinen auf dem Nachweis von hCG im Harn |
 hat drei Aufgabenbereiche:
hat drei Aufgabenbereiche: Sie ermöglicht den Stoffaustausch zwischen mütterlichem und embryonalem / fetalem Kreislauf (Atemgase, Nährstoffe, metabolische Endprodukte etc)
Sie ermöglicht den Stoffaustausch zwischen mütterlichem und embryonalem / fetalem Kreislauf (Atemgase, Nährstoffe, metabolische Endprodukte etc) Sie wirkt immunprotektiv, d.h. sie schützt den Feten vor Angriffen des mütterlichen Immunsystems
Sie wirkt immunprotektiv, d.h. sie schützt den Feten vor Angriffen des mütterlichen Immunsystems Sie bildet zahlreiche Hormone, d.h. sie wirkt als endokrines Organ
Sie bildet zahlreiche Hormone, d.h. sie wirkt als endokrines Organ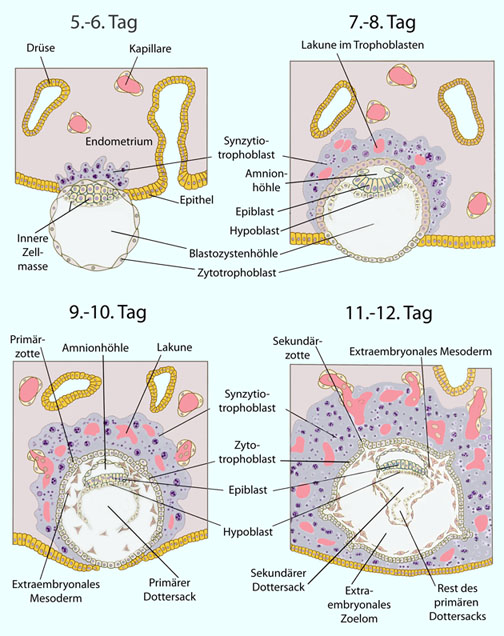
 Abbildung: Frühe Embryogenese
Abbildung: Frühe Embryogenese Die
Plazentation, d.h. die Ausbildung einer - zunächst den gesamten
Keimling umgebenden - Plazenta, beginnt vier Tage nach Abschluss der Implantation. Die Plazenta übernimmt
innerhalb von zwei Monaten zu einem immer größeren Anteil die Bildung der Geschlechtshormone
(Östrogene und Progesteron), deren Konzentration immer stärker zunimmt, vom corpus luteum graviditatis.
Der Gelbkörper stellt parallel dazu die Hormonproduktion zusehends ein.
Die
Plazentation, d.h. die Ausbildung einer - zunächst den gesamten
Keimling umgebenden - Plazenta, beginnt vier Tage nach Abschluss der Implantation. Die Plazenta übernimmt
innerhalb von zwei Monaten zu einem immer größeren Anteil die Bildung der Geschlechtshormone
(Östrogene und Progesteron), deren Konzentration immer stärker zunimmt, vom corpus luteum graviditatis.
Der Gelbkörper stellt parallel dazu die Hormonproduktion zusehends ein. Abbildung: Tag 9). Aus dem Epiblast gehen ab dem 12. Tag drei Keimblätter hervor (
Abbildung: Tag 9). Aus dem Epiblast gehen ab dem 12. Tag drei Keimblätter hervor ( Abbildung):
Abbildung): Das Ektoderm läßt die äußere Hautschicht, Nervensystem, Auge, Innenohr und Bindegewebe entstehen;
Das Ektoderm läßt die äußere Hautschicht, Nervensystem, Auge, Innenohr und Bindegewebe entstehen; aus dem Mesoderm bilden sich Herz, Teile des Kreislaufsystems, Knochen, Muskeln und Nieren;
aus dem Mesoderm bilden sich Herz, Teile des Kreislaufsystems, Knochen, Muskeln und Nieren; das Entoderm steht am Beginn der Entwicklung von Lungen, gastrointestinalem System und Blase.
das Entoderm steht am Beginn der Entwicklung von Lungen, gastrointestinalem System und Blase. Als Trimenon (auch Trimester) bezeichnet man einen dreimonatigen Schwangerschaftsabschnitt (das entspricht 13 Schwangerschaftswochen). Das erste
Trimenon ist durch intensive hormonelle Umstellungen (verbunden damit
häufige Übelkeit und Spannungsgefühle in den Brüsten) und rasche
Entwicklung des Embryos charakterisiert, das zweite Trimenon durch Nachlassen unangenehmer Begleiterscheinungen und ausgeglichene Gefühlslage, das dritte
durch die Vorbereitung auf die bevorstehende Geburt und entsprechende
Begleiterscheinungen wie Kurzatmigkeit, Rückenschmerzen, Hämorrhoiden,
Blasenschwäche (Gewicht, Druckausübung auf Lunge, Bewegungsapparat,
Verdauungssystem, Blase).
Als Trimenon (auch Trimester) bezeichnet man einen dreimonatigen Schwangerschaftsabschnitt (das entspricht 13 Schwangerschaftswochen). Das erste
Trimenon ist durch intensive hormonelle Umstellungen (verbunden damit
häufige Übelkeit und Spannungsgefühle in den Brüsten) und rasche
Entwicklung des Embryos charakterisiert, das zweite Trimenon durch Nachlassen unangenehmer Begleiterscheinungen und ausgeglichene Gefühlslage, das dritte
durch die Vorbereitung auf die bevorstehende Geburt und entsprechende
Begleiterscheinungen wie Kurzatmigkeit, Rückenschmerzen, Hämorrhoiden,
Blasenschwäche (Gewicht, Druckausübung auf Lunge, Bewegungsapparat,
Verdauungssystem, Blase).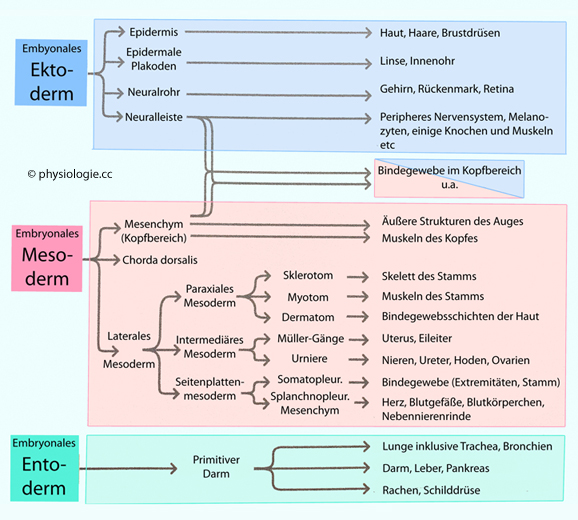
 Abbildung: Was aus den drei Keimblättern entsteht
Abbildung: Was aus den drei Keimblättern entsteht Signale (Botenstoffe: Hormon / Transmitter / Mediator),
Signale (Botenstoffe: Hormon / Transmitter / Mediator), passende / aktivierbare Rezeptoren,
passende / aktivierbare Rezeptoren,  Freigabe oder Inhibition intrazellulärer Signalkaskaden.
Freigabe oder Inhibition intrazellulärer Signalkaskaden.  Wachstumsfaktoren (wie FGF),
sie vermitteln Interaktionen zwischen Epithelien und Mesenchym
(Induktion und Wachstum); Auswachsen der Extremitäten; Gefäßbildung;
Gliederung des ZNS u.a. Wirkungen von Faktoren der FGF-Familie sind
bekannt für mindetens 9 der 23 bekannten FGFs, z.B. Induktion der
frühen Leberanlage (FGF 1,
2, 8), Anregung der Keratinozytenbildung (FGF 1, 2), Induktion des
Haarwachstums (FGF 2), der Nierentubuli (FGF 2), der Ausbildung des
Innenohrs (FGF 3), der Zahnanlagen (FGF 8) etc.
Wachstumsfaktoren (wie FGF),
sie vermitteln Interaktionen zwischen Epithelien und Mesenchym
(Induktion und Wachstum); Auswachsen der Extremitäten; Gefäßbildung;
Gliederung des ZNS u.a. Wirkungen von Faktoren der FGF-Familie sind
bekannt für mindetens 9 der 23 bekannten FGFs, z.B. Induktion der
frühen Leberanlage (FGF 1,
2, 8), Anregung der Keratinozytenbildung (FGF 1, 2), Induktion des
Haarwachstums (FGF 2), der Nierentubuli (FGF 2), der Ausbildung des
Innenohrs (FGF 3), der Zahnanlagen (FGF 8) etc. Mitglieder der TGFß-Familie,
sie beeinflussen u.a. die Synthese von Bausteinen der extrazellulären
Matrix (Kollagen, Proteoglykane, Integrinrezeptoren), induzieren die
Differenzierung verschiedener Zelltypen, bewirken die Rückbildung der
Müller-Gänge (Anti-Müller-Hormon). Zur TGFß-Familie gehören auch die knochenmorphogenetischen Proteine (BMPs,
15 verschiedene Proteine), die sich an der Entwicklung der meisten
embryonalen Strukturen beteiligen und oft eine inhibierende Wirkung
haben (sie müssen ihrerseits gehemmt werden, um bestimmte Vorgänge zu
ermöglichen, z.B. Entwicklungsschritte im ZNS).
Mitglieder der TGFß-Familie,
sie beeinflussen u.a. die Synthese von Bausteinen der extrazellulären
Matrix (Kollagen, Proteoglykane, Integrinrezeptoren), induzieren die
Differenzierung verschiedener Zelltypen, bewirken die Rückbildung der
Müller-Gänge (Anti-Müller-Hormon). Zur TGFß-Familie gehören auch die knochenmorphogenetischen Proteine (BMPs,
15 verschiedene Proteine), die sich an der Entwicklung der meisten
embryonalen Strukturen beteiligen und oft eine inhibierende Wirkung
haben (sie müssen ihrerseits gehemmt werden, um bestimmte Vorgänge zu
ermöglichen, z.B. Entwicklungsschritte im ZNS).  Mitglieder der Hedgehog-Familie: Morphogenetisch aktive Proteine,
welche u.a. die Anlage des embryonalen Neuralrohrs und des
Verdauungssystems (zusammen mit anderen Faktoren wie FGF) steuern.
Mitglieder der Hedgehog-Familie: Morphogenetisch aktive Proteine,
welche u.a. die Anlage des embryonalen Neuralrohrs und des
Verdauungssystems (zusammen mit anderen Faktoren wie FGF) steuern. Mitglieder der WNT-Familie: Signalproteine, die sich an zahlreichen
Entwicklungsvorgängen beteiligen (Differenzierung des
Urogenitalsystems, Ausbildung von Gliedmaßen, Segmenten des
Körperstamms etc).
Mitglieder der WNT-Familie: Signalproteine, die sich an zahlreichen
Entwicklungsvorgängen beteiligen (Differenzierung des
Urogenitalsystems, Ausbildung von Gliedmaßen, Segmenten des
Körperstamms etc). Ein besonders gravierendes
Problem stellt - mit relativ hohen Fallzahlen - das fetale Alkoholsyndrom (FAS; auch: Alkoholembryopathie, Fetal alcohol spectrum disorders FASDs, zahlreiche weitere Bezeichnungen) dar. Alkohol gilt als Teratogen.
Zu den Symptomen gehören mangelndes Körperwachstum und Untergewicht,
reduzierter Kopfumfang, diverse Merkmale im Gesichtsbereich,
neurologische Funktionsstörungen.
Ein besonders gravierendes
Problem stellt - mit relativ hohen Fallzahlen - das fetale Alkoholsyndrom (FAS; auch: Alkoholembryopathie, Fetal alcohol spectrum disorders FASDs, zahlreiche weitere Bezeichnungen) dar. Alkohol gilt als Teratogen.
Zu den Symptomen gehören mangelndes Körperwachstum und Untergewicht,
reduzierter Kopfumfang, diverse Merkmale im Gesichtsbereich,
neurologische Funktionsstörungen. gelangen Substanzen in den Organismus des Feten.
gelangen Substanzen in den Organismus des Feten.  Einfache Diffusion (z.B. von Atemgasen)
Einfache Diffusion (z.B. von Atemgasen) Erleichterte Diffusion (z.B. Glucose über GLUT1)
Erleichterte Diffusion (z.B. Glucose über GLUT1) Aktiver Transport (z.B. Elektrolyte über ATPasen)
Aktiver Transport (z.B. Elektrolyte über ATPasen) Sekundär aktiver Transport (z.B. Aminosäuren über spezifische Transporter)
Sekundär aktiver Transport (z.B. Aminosäuren über spezifische Transporter) Pinozytose / Transzytose (z.B. Eisen-Transferrin-Komplexe)
Pinozytose / Transzytose (z.B. Eisen-Transferrin-Komplexe) Das Chorion
Das Chorion  (
( s. auch dort) ist die äußere den Embryo umgebende (extraembryonale) Fetalmembran (die innere nennt man das Amnion
s. auch dort) ist die äußere den Embryo umgebende (extraembryonale) Fetalmembran (die innere nennt man das Amnion  - die innere Eihaut, welche die Fruchtblase umschließt). Diese beiden bauen die Fruchtblase (Amnionsack, amniotic sac) auf, der den Fetus beschützt (
- die innere Eihaut, welche die Fruchtblase umschließt). Diese beiden bauen die Fruchtblase (Amnionsack, amniotic sac) auf, der den Fetus beschützt ( Abbildung). Weitere Fetalmembranen sind der Dottersack (Umbilikalvesikel),
der beim Menschen keinen Dotter enthält, sondern in der Frühphase Blut
bildet und einige hepatische Funktionen erfüllt, sowie die Allantois
Abbildung). Weitere Fetalmembranen sind der Dottersack (Umbilikalvesikel),
der beim Menschen keinen Dotter enthält, sondern in der Frühphase Blut
bildet und einige hepatische Funktionen erfüllt, sowie die Allantois  , ein weiteres sackförmiges Organ, aus dessen Blutgefäßen die Nabelschnurgefäße entstehen.
, ein weiteres sackförmiges Organ, aus dessen Blutgefäßen die Nabelschnurgefäße entstehen.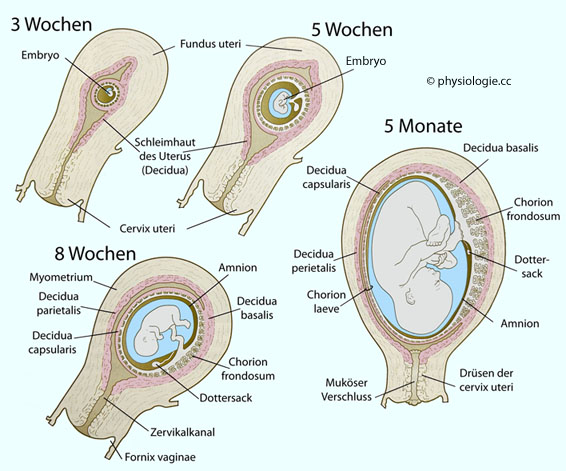
 Abbildung: Embryo, Plazenta und Uterus mit 3, 5, 8 Wochen und 5 Monaten p.c.
Abbildung: Embryo, Plazenta und Uterus mit 3, 5, 8 Wochen und 5 Monaten p.c.
 Das Fruchtwasservolumen kann sonographisch semiquantitativ abgeschätzt werden. Dabei gibt es unterschiedliche Zugänge: Ultraschallbestimmung des sogenannten Fruchtwasserindex (amniotic fluid index AFI) an in vier Quadranten (Addition der Messwerte) oder Messung des größten Flüssigkeitsdepots (single deepest pocket SDP). Die Referenzbereiche sind abhängig von der Schwangerschaftsdauer. Niedrige
Werte (<500 ml: Oligohydramnion) können u.a. auf Flüssigkeitsverlust
infolge einer Membranruptur, Dehydrierung
der Mutter oder renale Ursachen beim Feten zurückgehen, erhöhte Werte (>1500 ml: Polyhydramnion)
zeigt an, dass der Fetus (aus verschiedenen Gründen) zu wenig
Fruchtwasser aufnimmt.
Das Fruchtwasservolumen kann sonographisch semiquantitativ abgeschätzt werden. Dabei gibt es unterschiedliche Zugänge: Ultraschallbestimmung des sogenannten Fruchtwasserindex (amniotic fluid index AFI) an in vier Quadranten (Addition der Messwerte) oder Messung des größten Flüssigkeitsdepots (single deepest pocket SDP). Die Referenzbereiche sind abhängig von der Schwangerschaftsdauer. Niedrige
Werte (<500 ml: Oligohydramnion) können u.a. auf Flüssigkeitsverlust
infolge einer Membranruptur, Dehydrierung
der Mutter oder renale Ursachen beim Feten zurückgehen, erhöhte Werte (>1500 ml: Polyhydramnion)
zeigt an, dass der Fetus (aus verschiedenen Gründen) zu wenig
Fruchtwasser aufnimmt.
 Die Produktion
entfällt (nach Reifung der fetalen Nieren, um die 12. SSW) zu ~75% auf
die Nieren (Harn) und zu ~25% auf die Lunge (Pulmonalsekret).
Die Produktion
entfällt (nach Reifung der fetalen Nieren, um die 12. SSW) zu ~75% auf
die Nieren (Harn) und zu ~25% auf die Lunge (Pulmonalsekret).  Die Resorption
läuft zu ~55% über den Gastrointestinaltrakt (verschlucktes
Amnionwasser), zu ~30% über das Amnion und zu ~15% über die Lunge
(Atembewegungen).
Die Resorption
läuft zu ~55% über den Gastrointestinaltrakt (verschlucktes
Amnionwasser), zu ~30% über das Amnion und zu ~15% über die Lunge
(Atembewegungen). Die HPL-Werte im
Blut steigen stetig bis zur 37. Schwangerschaftswoche an. Die
HPL-Konzentration im Blut ist parallel zum Gewicht von Fetus und
Plazenta und daher von diagnostischem Wert.
Die HPL-Werte im
Blut steigen stetig bis zur 37. Schwangerschaftswoche an. Die
HPL-Konzentration im Blut ist parallel zum Gewicht von Fetus und
Plazenta und daher von diagnostischem Wert. Progesteron erhält die Frühschwangerschaft und wird vom Fetus für dessen Cortisolproduktion benötigt. Ausgangspunkt für die plazentare Progesteronproduktion
ist hauptsächlich LDL-Cholesterin aus dem Blut der Mutter. Neusynthese
aus Acetat sowie fetales Pregnenolon spielen eine untergeordnete Rolle.
Progesteron erhält die Frühschwangerschaft und wird vom Fetus für dessen Cortisolproduktion benötigt. Ausgangspunkt für die plazentare Progesteronproduktion
ist hauptsächlich LDL-Cholesterin aus dem Blut der Mutter. Neusynthese
aus Acetat sowie fetales Pregnenolon spielen eine untergeordnete Rolle.
 Etwa einhundert Spermien eines Ejakulats erreichen die Tubenampulle -
unterstützt durch Kontraktionen von Zervix, Uterus und Tuben sowie chemotaktische
Anziehung durch Follikelflüssigkeit Etwa einhundert Spermien eines Ejakulats erreichen die Tubenampulle -
unterstützt durch Kontraktionen von Zervix, Uterus und Tuben sowie chemotaktische
Anziehung durch Follikelflüssigkeit Beta-Defensin auf den Spermien erleichtert den Spermien
die Passage durch den Zervixschleim (beide tragen negative
Ladungen). Immunreaktionen gegen väterlich codiertes HMC bleiben aus
("Immunprivileg"). pH-Anstieg und Absinken des Glucosegehalts legen
Oberflächenmerkmale der Spermien (Hyaluronidase,
Rezeptoren) frei. Bei Kontakt mit einer Eizelle schalten sie auf
endgültige Reifung (Kapazitation) um, verlieren die Defensinbeschichtung, werden wieder
mobil und bilden Oberflächenmerkmale wie Hyaluronidase und Eizellrezeptoren. Ca++-Einstrom triggert akrosomale Reaktion und Beweglichkeit
Beta-Defensin auf den Spermien erleichtert den Spermien
die Passage durch den Zervixschleim (beide tragen negative
Ladungen). Immunreaktionen gegen väterlich codiertes HMC bleiben aus
("Immunprivileg"). pH-Anstieg und Absinken des Glucosegehalts legen
Oberflächenmerkmale der Spermien (Hyaluronidase,
Rezeptoren) frei. Bei Kontakt mit einer Eizelle schalten sie auf
endgültige Reifung (Kapazitation) um, verlieren die Defensinbeschichtung, werden wieder
mobil und bilden Oberflächenmerkmale wie Hyaluronidase und Eizellrezeptoren. Ca++-Einstrom triggert akrosomale Reaktion und Beweglichkeit  Die Befruchtung findet meist im ampullären Teil der Tube statt. Imprägnation ist das Eindringen der Spermienzelle in die Eizelle. Nach Durchdringen
von Eihügelmatrix, zona pellucida (aufgebaut aus
Zona-pellucida-Glykoproteinen ZP 1-4) und Oolemm zerfallen Flagellum und Mitochondrien, die
2. Reifeteilung wird abgeschlossen und DNA dekondensiert; der Vorkern verschmilzt mit dem Kern der Eizelle (Fusion, Konjugation). Ergebnis ist eine Zygote (mit 46 Chromosomen), das chromosomale
Geschlecht ist festgelegt Die Befruchtung findet meist im ampullären Teil der Tube statt. Imprägnation ist das Eindringen der Spermienzelle in die Eizelle. Nach Durchdringen
von Eihügelmatrix, zona pellucida (aufgebaut aus
Zona-pellucida-Glykoproteinen ZP 1-4) und Oolemm zerfallen Flagellum und Mitochondrien, die
2. Reifeteilung wird abgeschlossen und DNA dekondensiert; der Vorkern verschmilzt mit dem Kern der Eizelle (Fusion, Konjugation). Ergebnis ist eine Zygote (mit 46 Chromosomen), das chromosomale
Geschlecht ist festgelegt Spermienspezifische Phospholipase C (PLCζ) stimuliert den Stoffwechsel der Eizelle durch Öffnung von Ca++-Kanälen,
die Embryonalentwicklung beginnt. Kortikale Vesikel entleeren ihren
Inhalt in den Perivitellinraum, die zona pellucida wird dadurch für
Spermien unpassierbar (Verhinderung einer Polyspermie). Die Zeit von
der Ovulation bis zur Implantation heißt
Progestationsphase; mit der erfolgreichen Implantation beginnt die
Gestationsphase (Schwangerschaft) Spermienspezifische Phospholipase C (PLCζ) stimuliert den Stoffwechsel der Eizelle durch Öffnung von Ca++-Kanälen,
die Embryonalentwicklung beginnt. Kortikale Vesikel entleeren ihren
Inhalt in den Perivitellinraum, die zona pellucida wird dadurch für
Spermien unpassierbar (Verhinderung einer Polyspermie). Die Zeit von
der Ovulation bis zur Implantation heißt
Progestationsphase; mit der erfolgreichen Implantation beginnt die
Gestationsphase (Schwangerschaft)  Implantation (Nidation) ist
die Einnistung der Blastozyste in das - durch verringerte
Muzinsekretion und vermehrte Expression von Adhäsionsmolekülen
vorbereitete - Endometrium (Ende 3. / Anfang 4. Gestationswoche) -
meist an der Uterus-Hinterwand.
Sie besteht aus Apposition, Adhäsion und Invasion, ist nach wenigen Tagen abgeschlossen und geht mit Dezidualisierung einher. Pinopodien resorbieren Flüssigkeit und fixieren die Blastozyste.
Matrix-Metalloporoteinasen und Plasminogenaktivator ermöglichen tiefere
Invasion in das
Endometrium. Synzytiotrophoblasten bilden hCG, nach einigen Wochen auch
Steroide, Enzyme und weitere Hormone. Schwangeschaftstests beruhen auf
dem Nachweis von hCG im Harn. Embryogenese erstreckt sich von der Bildung der Zygote
bis zur Anlage aller großen Organsysteme (Ende SSW 10). In den
ersten drei Monaten ernährt sich der Embryo histotroph, später
hämatotroph Implantation (Nidation) ist
die Einnistung der Blastozyste in das - durch verringerte
Muzinsekretion und vermehrte Expression von Adhäsionsmolekülen
vorbereitete - Endometrium (Ende 3. / Anfang 4. Gestationswoche) -
meist an der Uterus-Hinterwand.
Sie besteht aus Apposition, Adhäsion und Invasion, ist nach wenigen Tagen abgeschlossen und geht mit Dezidualisierung einher. Pinopodien resorbieren Flüssigkeit und fixieren die Blastozyste.
Matrix-Metalloporoteinasen und Plasminogenaktivator ermöglichen tiefere
Invasion in das
Endometrium. Synzytiotrophoblasten bilden hCG, nach einigen Wochen auch
Steroide, Enzyme und weitere Hormone. Schwangeschaftstests beruhen auf
dem Nachweis von hCG im Harn. Embryogenese erstreckt sich von der Bildung der Zygote
bis zur Anlage aller großen Organsysteme (Ende SSW 10). In den
ersten drei Monaten ernährt sich der Embryo histotroph, später
hämatotroph Amnionflüssigkeit wird von der Fruchtblase gebildet. Sie schützt den
Feten und dient als Ausscheidungsroute fetaler Stoffwechselprodukte;
sie wird mindestens einmal pro Tag erneuert, ihr Volumen beträgt zum
Termin 500-1500 ml. Produziert wird sie durch fetale Nieren (~75%) und
Lunge (~25%), resorbiert von Gastrointestinaltrakt (~55%), Lunge (~15%)
sowie Amnion (~30%)
Amnionflüssigkeit wird von der Fruchtblase gebildet. Sie schützt den
Feten und dient als Ausscheidungsroute fetaler Stoffwechselprodukte;
sie wird mindestens einmal pro Tag erneuert, ihr Volumen beträgt zum
Termin 500-1500 ml. Produziert wird sie durch fetale Nieren (~75%) und
Lunge (~25%), resorbiert von Gastrointestinaltrakt (~55%), Lunge (~15%)
sowie Amnion (~30%) Für die Ausreifung braucht die Brust Östrogene (Ausführungsgänge),
Progesteron (Alveolen), HPL (Vorbereitung zur Milchsynthese) und
Prolaktin (Milchbildung), weiters STH, Schilddrüsenhormone und
CCortisol. HPL im Blut steigt bis SSW 37 parallel zum Gewicht von Fetus
und Plazenta
Für die Ausreifung braucht die Brust Östrogene (Ausführungsgänge),
Progesteron (Alveolen), HPL (Vorbereitung zur Milchsynthese) und
Prolaktin (Milchbildung), weiters STH, Schilddrüsenhormone und
CCortisol. HPL im Blut steigt bis SSW 37 parallel zum Gewicht von Fetus
und Plazenta Der Fetus benötigt Progesteron für die Kortisolproduktion. Cortisol
unterstützt die Reifung der Lunge und verhindert vorzeitiges Auftreten
der Wehen: Es hyperpolarisiert das Myometrium und macht es unempfindlich gegenüber Oxytozin
Der Fetus benötigt Progesteron für die Kortisolproduktion. Cortisol
unterstützt die Reifung der Lunge und verhindert vorzeitiges Auftreten
der Wehen: Es hyperpolarisiert das Myometrium und macht es unempfindlich gegenüber Oxytozin |
