

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Grundlagen und Methoden der Physiologie; molekulare und zelluläre Aspekte
©
H. Hinghofer-Szalkay



 Aktin: ακτίς = Strahl
Aktin: ακτίς = Strahl| Proteine
übernehmen unzählige Funktionen in der Zelle: Metabolismus (Enzyme),
Zellteilung (Mitoseapparat), Eiweißsynthese (Transkription, Translation),
Fortbewegung (Aktin, Myosin etc), Wachstum, Abbau (Apoptose). Auch Rezeptoren,
Permeasen und Pumpen in der Zellmembran bestehen aus Proteinen. Beispiele für Motilität von Körperzellen sind Leukozytenmigration, Spermienmotorik, angiogenetische Zellwanderung, Neurozyten- und Gliamobilität. Kräfte vom Zellinneren übertragen sich über Zytoskelett und membranale Anknüpfungspunkte auf umgebende extrazelluläre Strukturen; Membranrezeptoren verlagern sich im Lauf der Bewegung; Permeasen erlauben die transmembranale Verlagerung von Flüssigkeit. Bei chemotaktischer Bewegung strebt die Zelle zu einer Signalstoffquelle hin oder von dieser weg. Glatte Muskelzellen können vom Single-Unit-Typ sein (funktionelles Synzytium ähnlich wie im Herzmuskel, Beispiel Uterus) oder vom Multi-Unit-Typ (über vegetative Nervenfasern präzise gesteuert, Beispiel innere Augenmuskeln). Glatte Muskelzellen zeigen häufig spontane Aktivität (Eigenrhythmen), diese folgen Oszillationen der intrazellulären Ca++-Konzentration (basaler Organrhythmus) und bestimmen die Kontraktionsfrequenz. Unterschreitet das Membranpotential einen bestimmten Schwellenbetrag, wird die Zelle erregt (Aktionspotential). |
 Membranproteine
Membranproteine  Intrazelluläre Struktur- und Transportproteine, axonaler Transport
Intrazelluläre Struktur- und Transportproteine, axonaler Transport  Proteolyse
Proteolyse  Mechanismus des Zilienschlages
Mechanismus des Zilienschlages  Extrazelluläre Proteine
Extrazelluläre Proteine  Fortbewegung von Zellen
Fortbewegung von Zellen  Glatte Muskulatur
Glatte Muskulatur
 Proteom
Proteom  Motilität
Motilität  Proteasomen
Proteasomen  Ubiquitine
Ubiquitine  Chemotax
Chemotax

 Core messages
Core messages Zu Aminosäuren und Proteinen s. auch dort
Zu Aminosäuren und Proteinen s. auch dort Abbildung) bewerkstelligen unterschiedlichste Aufgaben. Die wichtigsten Beispiele, nach chemischer
Struktur gruppiert:
Abbildung) bewerkstelligen unterschiedlichste Aufgaben. Die wichtigsten Beispiele, nach chemischer
Struktur gruppiert: Glykogen (Polysaccharid aus Glucose-Einheiten) ist eine kurzfristig aktivierbare Energiespeicherform in der Muskel- und Leberzelle, während Fettgewebe den Energiebedarf für mehrere Wochen speichern kann.
Glykogen (Polysaccharid aus Glucose-Einheiten) ist eine kurzfristig aktivierbare Energiespeicherform in der Muskel- und Leberzelle, während Fettgewebe den Energiebedarf für mehrere Wochen speichern kann.
 Abbildung: Biomoleküle
Abbildung: Biomoleküle
 Nukleinsäuren als Informationsträger - hierher zählen Desoxyribonukleinsäure (DNA) und Ribonukleinsäure (RNA), die unter Verwendung des genetischen Codes die Erbinformation speichern und verwerten können.
Nukleinsäuren als Informationsträger - hierher zählen Desoxyribonukleinsäure (DNA) und Ribonukleinsäure (RNA), die unter Verwendung des genetischen Codes die Erbinformation speichern und verwerten können.
 Lipide und Kohlenhydrate als Baustoffe insbesondere für die Zellmembran,
wo sich Lipide zu hydrophoben Doppellamellen formieren. Kohlenhydrate
finden sich an Membranproteine gebunden und vermitteln z.B.
Blutgruppeneigenschaften.
Lipide und Kohlenhydrate als Baustoffe insbesondere für die Zellmembran,
wo sich Lipide zu hydrophoben Doppellamellen formieren. Kohlenhydrate
finden sich an Membranproteine gebunden und vermitteln z.B.
Blutgruppeneigenschaften. Proteine
Proteine  mit
ihrer meist komplexen Form binden spezifisch an bestimmte andere Moleküle
(Liganden) - selektiv an nur eine oder wenige Molekülarten - und wirken
als Struktur- und Funktionsträger (Gerüstproteine, Enzyme, Filamente, Rezeptoren...).
mit
ihrer meist komplexen Form binden spezifisch an bestimmte andere Moleküle
(Liganden) - selektiv an nur eine oder wenige Molekülarten - und wirken
als Struktur- und Funktionsträger (Gerüstproteine, Enzyme, Filamente, Rezeptoren...). Als α-Helix bezeichnet
man die spiralen- bzw. zylinderförmige Sekundärstruktur der Abschnitte
eines Proteinmoleküls, deren Aminosäuresequenzen diese Form zur Folge
haben. α-Helices
sind die Teile von Proteinmolekülen, welche Membranen (Zellmembran
usw.) durchspannen (transmembranale Abschnitte), weil die Anordnung
ihrer Atome und Bindungsstellen die Außenseite dieser Sequenzen
hydrophob / lipophil machen und damit geeignet sind, das Eiweißmolekül
in der Membran zu "verankern".
Als α-Helix bezeichnet
man die spiralen- bzw. zylinderförmige Sekundärstruktur der Abschnitte
eines Proteinmoleküls, deren Aminosäuresequenzen diese Form zur Folge
haben. α-Helices
sind die Teile von Proteinmolekülen, welche Membranen (Zellmembran
usw.) durchspannen (transmembranale Abschnitte), weil die Anordnung
ihrer Atome und Bindungsstellen die Außenseite dieser Sequenzen
hydrophob / lipophil machen und damit geeignet sind, das Eiweißmolekül
in der Membran zu "verankern". 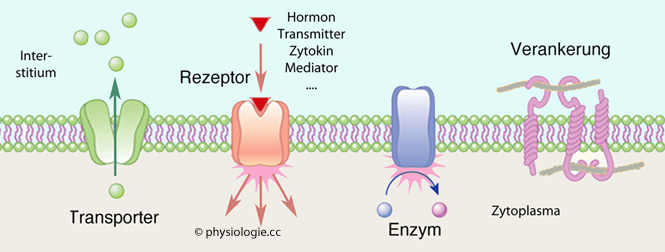
 Abbildung: Proteine in der Zellmembran
Abbildung: Proteine in der Zellmembran
 Sie sind für die Kommunikation der Zelle mit ihrer Umgebung unverzichtbar (Rezeptoren
ermöglichen die spezifische Erkennung von Hormonen, Neurotransmittern,
Zytokinen, Wachstumsfaktoren usw) und setzen diesen Reiz - je nach
Rezeptortyp unterschiedlich - in intrazelluläre Folgereaktionen um.
Sie sind für die Kommunikation der Zelle mit ihrer Umgebung unverzichtbar (Rezeptoren
ermöglichen die spezifische Erkennung von Hormonen, Neurotransmittern,
Zytokinen, Wachstumsfaktoren usw) und setzen diesen Reiz - je nach
Rezeptortyp unterschiedlich - in intrazelluläre Folgereaktionen um. Sie
ermöglichen die Passage von Ionen (z.B. Natrium, Kalium, Calcium,
Magnesium, Chlorid...) durch die Zellmembran - was aufgrund deren
mangelnder Fettlöslichkeit sonst kaum möglich wäre - und tun dies mehr
oder weniger spezifisch, entweder dem Konzentrationsmuster folgend
(Diffusion), oder unter Verbrauch von Energie (z.B. Na-K-Pumpe).
Sie
ermöglichen die Passage von Ionen (z.B. Natrium, Kalium, Calcium,
Magnesium, Chlorid...) durch die Zellmembran - was aufgrund deren
mangelnder Fettlöslichkeit sonst kaum möglich wäre - und tun dies mehr
oder weniger spezifisch, entweder dem Konzentrationsmuster folgend
(Diffusion), oder unter Verbrauch von Energie (z.B. Na-K-Pumpe). Membranproteine
versorgen die Zelle mit Nährstoffen, indem sie z.B. Ionen gegen
organische Moleküle austauschen (wie Glucose und Aminosäuren).
Membranproteine
versorgen die Zelle mit Nährstoffen, indem sie z.B. Ionen gegen
organische Moleküle austauschen (wie Glucose und Aminosäuren). Sie wirken als Enzyme auf intrazelluläre Moleküle ein (z.B. Insulinrezeptor).
Sie wirken als Enzyme auf intrazelluläre Moleküle ein (z.B. Insulinrezeptor). Sie
verankern die Zelle an extrazellulären Strukturen und vermitteln Kräfte
in Richting Intrazellulärraum (z.B. Wachstum, Fortbewegung, Diapedese,
Knochenstoffwechsel).
Sie
verankern die Zelle an extrazellulären Strukturen und vermitteln Kräfte
in Richting Intrazellulärraum (z.B. Wachstum, Fortbewegung, Diapedese,
Knochenstoffwechsel).  Membranproteine dienen als verschiedenartigste Rezeptoren
- für Hormone, Transmitter, Zytokine, lokale Mediatoren, aber auch
mechanische und anorganisch-chemische Einwirkungen. Dadurch ermöglichen
sie die ganze Bandbreite spezifischer Interaktionen mit der Umwelt der
Zelle.
Membranproteine dienen als verschiedenartigste Rezeptoren
- für Hormone, Transmitter, Zytokine, lokale Mediatoren, aber auch
mechanische und anorganisch-chemische Einwirkungen. Dadurch ermöglichen
sie die ganze Bandbreite spezifischer Interaktionen mit der Umwelt der
Zelle. Axonaler Transport
Axonaler Transport  Weitere intrazelluläre Proteine
Weitere intrazelluläre Proteine Abbildung). Dystroglycan bindet seinerseits an extrazelluläre Proteine, zusammen mit anderen Proteinen wie Sarcoglycanen, Sarcospan, etc. Verschiedene Adhäsionsmoleküle sind bei zellulären Anhaftungsprozessen involviert.
Abbildung). Dystroglycan bindet seinerseits an extrazelluläre Proteine, zusammen mit anderen Proteinen wie Sarcoglycanen, Sarcospan, etc. Verschiedene Adhäsionsmoleküle sind bei zellulären Anhaftungsprozessen involviert.
 Abbildung: Proteine in der Zellmembran einer Skelettmuskelzelle
Abbildung: Proteine in der Zellmembran einer Skelettmuskelzelle Über Adhäsionsmoleküle s. dort
Über Adhäsionsmoleküle s. dort 
 Abbildung) erreicht - je nach Mechanismus und Transportgut -
Geschwindigkeiten zwischen <1 und ~400
mm/Tag. Über ihn können nicht nur Biomoleküle, sondern auch
Zellorganellen - Vesikel, Mitochondrien, Tubuli, Filamente - durch die
Zelle befördert werden.
Abbildung) erreicht - je nach Mechanismus und Transportgut -
Geschwindigkeiten zwischen <1 und ~400
mm/Tag. Über ihn können nicht nur Biomoleküle, sondern auch
Zellorganellen - Vesikel, Mitochondrien, Tubuli, Filamente - durch die
Zelle befördert werden.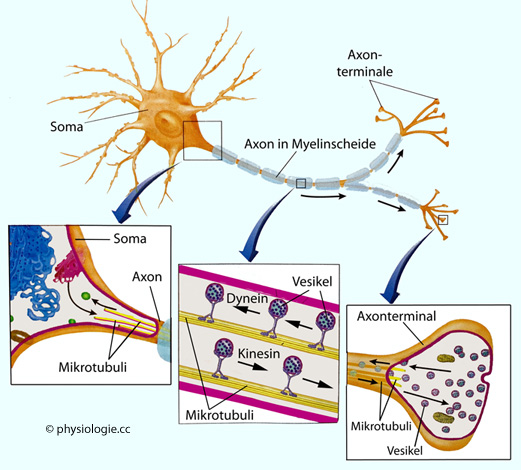
 Abbildung: Neuronaler Transport
Abbildung: Neuronaler Transport
 schnellen anterograden Transport mit Geschwindigkeiten bis zu ~5 µm/s (~400 mm/d). Er ist ATP-verbrauchend und bringt mittels Kinesinen
schnellen anterograden Transport mit Geschwindigkeiten bis zu ~5 µm/s (~400 mm/d). Er ist ATP-verbrauchend und bringt mittels Kinesinen Proteine und verschiedene Zellorganellen entlang von Mikrotubuli in die Axonperipherie;
Proteine und verschiedene Zellorganellen entlang von Mikrotubuli in die Axonperipherie; langsamen anterograden Transport (1-10 mm/d), er befördert Neuropeptide, Enzyme und Teile des Zytoskeletts vom Soma das Axon entlang.
langsamen anterograden Transport (1-10 mm/d), er befördert Neuropeptide, Enzyme und Teile des Zytoskeletts vom Soma das Axon entlang. und
unterstützt physiologischerweise vermutlich für die Proteinsynthese,
vielleicht wandern Mitochondrien auf diesem Wege zum Soma.
und
unterstützt physiologischerweise vermutlich für die Proteinsynthese,
vielleicht wandern Mitochondrien auf diesem Wege zum Soma.
 Animation: Kinesin "wandert" einen Mikrotubulus entlang
Animation: Kinesin "wandert" einen Mikrotubulus entlang
 ) sind sind kleine (~13 kD) basische Proteine aus der Familie der Wachstumsfaktoren: Nervenwachstumsfaktor NGF, brain-derived neurotrophic factor BDNF, Neurotrophin3 bis 5 (NT-3 bis NT-5). Sie werden von benachbarten Zellen produziert und sichern Überleben (Verhinderung einer Apoptose),
Differenzierung und Wachstum von Neuronen und damit auch den
Fortbestand neuronaler Verbindungen. Sie sichern und kontrollieren auch
die Bildung neuer Nervenzellen (Neurogenese), ein Vorgang, der auch beim erwachsenen Menschen im Hippocampus abläuft.
) sind sind kleine (~13 kD) basische Proteine aus der Familie der Wachstumsfaktoren: Nervenwachstumsfaktor NGF, brain-derived neurotrophic factor BDNF, Neurotrophin3 bis 5 (NT-3 bis NT-5). Sie werden von benachbarten Zellen produziert und sichern Überleben (Verhinderung einer Apoptose),
Differenzierung und Wachstum von Neuronen und damit auch den
Fortbestand neuronaler Verbindungen. Sie sichern und kontrollieren auch
die Bildung neuer Nervenzellen (Neurogenese), ein Vorgang, der auch beim erwachsenen Menschen im Hippocampus abläuft.  Abbildung).
Die zahlreichen (oft über 1000) spezifischen Eiweißmoleküle pro Zelle
(Proteom) liegen zum Großteil in sehr
geringer Konzentration vor.
Abbildung).
Die zahlreichen (oft über 1000) spezifischen Eiweißmoleküle pro Zelle
(Proteom) liegen zum Großteil in sehr
geringer Konzentration vor.  Das Proteom ist die im Genom verankerte Gesamtheit der Proteine (in einem Zellkompartiment, einer Zelle, einem Gewebe oder
Lebewesen - unter definierten Bedingungen).
Das Proteom ist die im Genom verankerte Gesamtheit der Proteine (in einem Zellkompartiment, einer Zelle, einem Gewebe oder
Lebewesen - unter definierten Bedingungen).
 Abbildung: Aktin
Abbildung: Aktin
 Motilität ist
die Fähigkeit von Zellbestandteilen (z.B. axonaler Transport), Zellen
(z.B. amöboide Fortbewegung), Organen (z.B. Peristaltik) oder
Organismen (Lokomotion) zu unabhängiger Bewegung unter Verbrauch
metabolischer Energie. Dabei spielen die Motorproteine Aktin und Myosin eine Schlüsselrolle (Abbildungen).
Motilität ist
die Fähigkeit von Zellbestandteilen (z.B. axonaler Transport), Zellen
(z.B. amöboide Fortbewegung), Organen (z.B. Peristaltik) oder
Organismen (Lokomotion) zu unabhängiger Bewegung unter Verbrauch
metabolischer Energie. Dabei spielen die Motorproteine Aktin und Myosin eine Schlüsselrolle (Abbildungen). 
 Abbildung: Muskeltyp-Myosinmolekül
Abbildung: Muskeltyp-Myosinmolekül
 Abbildung unten) bezeichneten Strukturen organisiert, in glatter Muskulatur zwischen sogenannten Desmosomen.
Aktinfilamente bestehen aus zwei umeinander gewickelten Ketten von
Aktinmolekülen, Myosinfilamente aus Myosinmolekülen, die komplex
ineinander "gesteckt" sind. Myosinmoleküle bestehen aus aufgebaut
sind, aktiv verformbar sind und aus einem Kopfteil (head, Kopfdomäne),
Abbildung unten) bezeichneten Strukturen organisiert, in glatter Muskulatur zwischen sogenannten Desmosomen.
Aktinfilamente bestehen aus zwei umeinander gewickelten Ketten von
Aktinmolekülen, Myosinfilamente aus Myosinmolekülen, die komplex
ineinander "gesteckt" sind. Myosinmoleküle bestehen aus aufgebaut
sind, aktiv verformbar sind und aus einem Kopfteil (head, Kopfdomäne),  Tubulin, Lamine, Vimentin, Keratin etc.
Tubulin, Lamine, Vimentin, Keratin etc.
 Abbildung: Proteinstrukturen im Z-Streifen-Bereich einer Herzmuskelzelle
Abbildung: Proteinstrukturen im Z-Streifen-Bereich einer Herzmuskelzelle
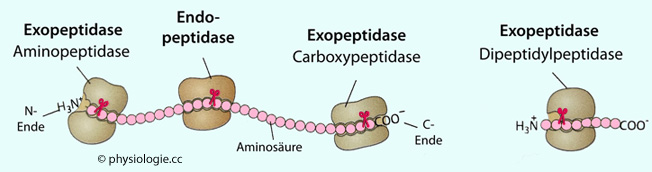
 Abbildung: Proteolytische Enzyme
Abbildung: Proteolytische Enzyme
 Exopeptidasen
- diese trennen vom N- (Aminopeptidasen) oder C-Ende
(Carboxypeptidasen) der Peptidkette eine oder zwei Aminosäuren ab
Exopeptidasen
- diese trennen vom N- (Aminopeptidasen) oder C-Ende
(Carboxypeptidasen) der Peptidkette eine oder zwei Aminosäuren ab Endopeptidasen
(Proteinasen, Proteasen) - diese spalten die Peptidketten von innen,
und zwar an spezifischen Stellen (Aminosäurepaaren). Es gibt mehrere
Typen, die nach ihrer katalytischen Stelle bezeichnet werden:
Serinproteasen, Cysteinproteasen, Aspartatproteasen, Metalloproteinasen.
Endopeptidasen
(Proteinasen, Proteasen) - diese spalten die Peptidketten von innen,
und zwar an spezifischen Stellen (Aminosäurepaaren). Es gibt mehrere
Typen, die nach ihrer katalytischen Stelle bezeichnet werden:
Serinproteasen, Cysteinproteasen, Aspartatproteasen, Metalloproteinasen. Abbau über Lysosomen oder
Abbau über Lysosomen oder  proteasomal (Ubiquitin-Proteasom-Mechanismus):
proteasomal (Ubiquitin-Proteasom-Mechanismus): Proteasomen (
Proteasomen ( Abbildung) sind komplexe Eiweißstrukturen, bestehend aus einer
zentralen Kammer (20 S), daran anschließenden Vorkammern (19 S), und jeweils einer
regulatorischen Kappe an den beiden Enden. Sie werden von der Zelle schrittweise aus mehr als 70
Komponenten aufgebaut. An der Innenseite ihrer ringförmigen Elemente befinden sich Enzyme, die eine breite proteolytische Aktivität entfalten. Proteasomen
finden sich im Zytoplasma der meisten Zellen, wo sie markierte (falsch
gefaltete, mikrobielle, antigene) Proteine kontinuierlich abbauen. Dazu
müssen die Zielproteine zuerst entfaltet, mehrfach kovalent mit
Ubiquitinen markiert und schließlich durch das Proteasom gezogen
werden. Die Enzymausstattung der Proteasome kann verändert (an die
aktuelle Situation angepasst) werden, z.B. durch Zytokine.
Abbildung) sind komplexe Eiweißstrukturen, bestehend aus einer
zentralen Kammer (20 S), daran anschließenden Vorkammern (19 S), und jeweils einer
regulatorischen Kappe an den beiden Enden. Sie werden von der Zelle schrittweise aus mehr als 70
Komponenten aufgebaut. An der Innenseite ihrer ringförmigen Elemente befinden sich Enzyme, die eine breite proteolytische Aktivität entfalten. Proteasomen
finden sich im Zytoplasma der meisten Zellen, wo sie markierte (falsch
gefaltete, mikrobielle, antigene) Proteine kontinuierlich abbauen. Dazu
müssen die Zielproteine zuerst entfaltet, mehrfach kovalent mit
Ubiquitinen markiert und schließlich durch das Proteasom gezogen
werden. Die Enzymausstattung der Proteasome kann verändert (an die
aktuelle Situation angepasst) werden, z.B. durch Zytokine.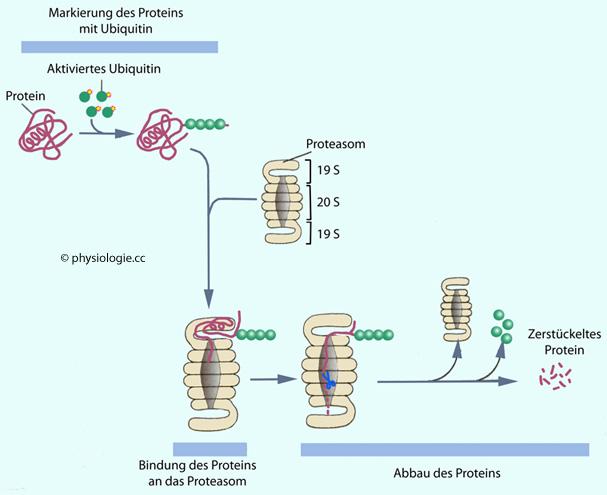
 Abbildung: Ubiquitin- Proteasom- Abbauweg
Abbildung: Ubiquitin- Proteasom- Abbauweg ,
ein durch Ultrazentrifugation bestimmter Sedimentationskoeffizient, der
indirekt Auskunft über die Größe eines Partikels gibt (die Beziehung
ist nichtlinear) und von der Masse, Dichte und Gestalt des Partikels abhängt. 1 S entspricht 100 Femtosekunden (s. Biochemie)
,
ein durch Ultrazentrifugation bestimmter Sedimentationskoeffizient, der
indirekt Auskunft über die Größe eines Partikels gibt (die Beziehung
ist nichtlinear) und von der Masse, Dichte und Gestalt des Partikels abhängt. 1 S entspricht 100 Femtosekunden (s. Biochemie) Ubiquitine sind kleine Peptide (76 Aminosäuren), die zur Markierung der Zielproteine genutzt werden (Ubiquitinierung, ubiquitylation,
Ubiquitine sind kleine Peptide (76 Aminosäuren), die zur Markierung der Zielproteine genutzt werden (Ubiquitinierung, ubiquitylation,  Abbildung). Sie binden reversibel an Zielproteine, deren Eigenschaften (Funktion, Lebenszeit, Verteilung) sie dadurch verändern. Je nach
markiertem Protein und der Zahl der angekoppelten Ubiquitine werden die Zielproteine für den Abbau bestimmt oder nehmen an Vorgängen wie Endozytose, Proteintransport, Transkription oder im Zellzyklus teil.
Abbildung). Sie binden reversibel an Zielproteine, deren Eigenschaften (Funktion, Lebenszeit, Verteilung) sie dadurch verändern. Je nach
markiertem Protein und der Zahl der angekoppelten Ubiquitine werden die Zielproteine für den Abbau bestimmt oder nehmen an Vorgängen wie Endozytose, Proteintransport, Transkription oder im Zellzyklus teil. "Primäre"
Zilien - wie sie z.B. in Sinnesorganen oder im Knochen vorkommen - sind mechano- (Innenohr, Knochenkanälchen) oder chemosensibel (Geruchssinn), meist nicht aktiv
beweglich und enthalten Axoneme aus jeweils 9 Paaren (Dimeren) von
Mikrotubuli (Bauplan 9 mal 2).
"Primäre"
Zilien - wie sie z.B. in Sinnesorganen oder im Knochen vorkommen - sind mechano- (Innenohr, Knochenkanälchen) oder chemosensibel (Geruchssinn), meist nicht aktiv
beweglich und enthalten Axoneme aus jeweils 9 Paaren (Dimeren) von
Mikrotubuli (Bauplan 9 mal 2).  "Sekundäre" Zilien (auch Flimmerhärchen oder Kinozilien)
beinhalten zusätzlich zwei zentrale Mikrotubuli (Bauplan 9 mal 2 plus
2); sie sind aktiv beweglich. Der Bauplan von Zilien ist in der Natur
ziemlich konstant, z.B. in den "Wimpern" einzelliger Paramecien
(Pantoffeltierchen) gleich wie im Flimmerepithel der Lunge des Menschen.
"Sekundäre" Zilien (auch Flimmerhärchen oder Kinozilien)
beinhalten zusätzlich zwei zentrale Mikrotubuli (Bauplan 9 mal 2 plus
2); sie sind aktiv beweglich. Der Bauplan von Zilien ist in der Natur
ziemlich konstant, z.B. in den "Wimpern" einzelliger Paramecien
(Pantoffeltierchen) gleich wie im Flimmerepithel der Lunge des Menschen.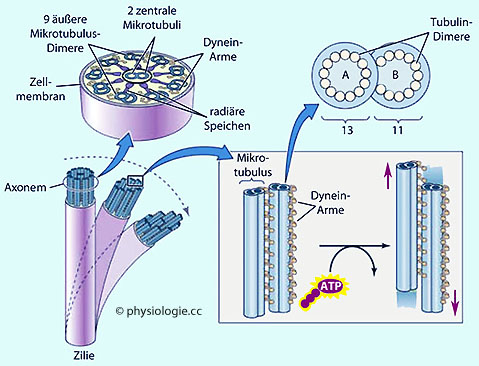
 Abbildung: Zilienschlag durch Dyneinbewegung
Abbildung: Zilienschlag durch Dyneinbewegung
 Abbildung).
Abbildung). 
 Abbildung: Molekulare Motoren bewegen sich entlang von Mikrotubuli
Abbildung: Molekulare Motoren bewegen sich entlang von Mikrotubuli
 Schlagfolge: Die Zilien schlagen koordiniert,
d.h. um kleine Zeitbeträge gegeneinander verschoben, sodass sich
wellenförmige Bewegungsmuster ergeben (sieht aus wie das Wogen von
Kornhalmen im Wind), was eine optimale Fortbewegung des jeweiligen
Schleimfilmes ermöglicht.
Schlagfolge: Die Zilien schlagen koordiniert,
d.h. um kleine Zeitbeträge gegeneinander verschoben, sodass sich
wellenförmige Bewegungsmuster ergeben (sieht aus wie das Wogen von
Kornhalmen im Wind), was eine optimale Fortbewegung des jeweiligen
Schleimfilmes ermöglicht.  Abwehr (als Antikörper und Komplementfaktoren)
Abwehr (als Antikörper und Komplementfaktoren) Intaktheit der Gefäßwände (Gerinnungs- und Fibrinolysefaktoren)
Intaktheit der Gefäßwände (Gerinnungs- und Fibrinolysefaktoren) Transport von Fett, Hormonen, Spurenelementen usw. (Plasmaeiweiß)
Transport von Fett, Hormonen, Spurenelementen usw. (Plasmaeiweiß) Aufbau
extrazellulärer Strukturen:
Aufbau
extrazellulärer Strukturen: 
 Fasern aus Kollagen (~30% der Gesamtmasse an Körpereiweiß) für Faszien, Sehnen,
Bänder, Unterhautgewebe, Knorpel, Knochen
Fasern aus Kollagen (~30% der Gesamtmasse an Körpereiweiß) für Faszien, Sehnen,
Bänder, Unterhautgewebe, Knorpel, Knochen Elastin für dehnbare
Strukturen (Lunge, Haut, Blutgefäße u.a.) und spezielle Proteine, wie
Elastin für dehnbare
Strukturen (Lunge, Haut, Blutgefäße u.a.) und spezielle Proteine, wie Fibronektin für Hämostase, Gewebsreparatur, Zelladhäsion und -migration, Embryogenese
Fibronektin für Hämostase, Gewebsreparatur, Zelladhäsion und -migration, Embryogenese Laminin, mit Bindungsstellen für zelluläre Rezeptoren; häufig in Basalmembranen
Laminin, mit Bindungsstellen für zelluläre Rezeptoren; häufig in Basalmembranen Integrine für
die Verbindung zwischen Zellen untereinander und mit extrazellulären Strukturen.
Integrine für
die Verbindung zwischen Zellen untereinander und mit extrazellulären Strukturen. Abbildung).
Durch rezeptorvermittelte Kopplung an den Untergrund fixiert sich die
Zelle und verlagert diese Kontaktstellen nach Maßgabe der
zurückgelegten Fortbewegungsstrecke.
Abbildung).
Durch rezeptorvermittelte Kopplung an den Untergrund fixiert sich die
Zelle und verlagert diese Kontaktstellen nach Maßgabe der
zurückgelegten Fortbewegungsstrecke.
 Abbildung: Amöboide Bewegung einer Zelle
Abbildung: Amöboide Bewegung einer Zelle
 In der Embryogenese wandern Neuriten aus der Neuralleiste und an Leitstrukturen entlang;
In der Embryogenese wandern Neuriten aus der Neuralleiste und an Leitstrukturen entlang;  Immunzellen
"jagen" Fremdkörper, "verdächtige" Zellen und Mikroorganismen
(Migration von Leukozyten zwischen Blutbahn und extravasalem
Raum, Auswanderung von antigenpräsentierenden Zellen aus dem Gewebe);
Immunzellen
"jagen" Fremdkörper, "verdächtige" Zellen und Mikroorganismen
(Migration von Leukozyten zwischen Blutbahn und extravasalem
Raum, Auswanderung von antigenpräsentierenden Zellen aus dem Gewebe);  Enterozyten wandern entlang der Krypten-Zotten-Achse;
Enterozyten wandern entlang der Krypten-Zotten-Achse;  Gefäßwandzellen sprossen während der Angiogenese vor;
Gefäßwandzellen sprossen während der Angiogenese vor;  Fibroblasten schließen Wunden und bilden frisches Gewebe;
Fibroblasten schließen Wunden und bilden frisches Gewebe;  Spermien bewegen sich gezielt in eine Richtung.
Spermien bewegen sich gezielt in eine Richtung.  Chemotaxis
Chemotaxis  ist
die Fortbewegung von Zellen entlang chemischer Konzentrationsgradienten
von Leitsubstanzen wie z.B. Chemokinen, vermittelt u.a. über CNG-Kanäle. Dieser Mechanismus lockt
Leukozyten zu einem Entzündungsherd, Spermien zur Eizelle, Bakterien zu
einer Glucosequelle, auswachsende Neuritenfortsätze auf den richtigen
Weg usw. So steuern Ephrine durch Bindung
an Ephrinrezeptoren die Entwicklung von
Nervenbahnen (Vorwachsen der Axone von Ganglienzellen in der Netzhaut zu ihren Zielen im Hirnstamm). Positive
Chemotaxis veranlasst die Bewegung betreffender Zellen oder
Zellfortsätze zu Orten höherer Konzentration (zur Quelle) des
Signalstoffes hin, negative Chemotaxis von solchen Orten weg. Regt ein Stoff nur ungerichtete Zellbewegung an, nennt man den Vorgang Chemokinese.
ist
die Fortbewegung von Zellen entlang chemischer Konzentrationsgradienten
von Leitsubstanzen wie z.B. Chemokinen, vermittelt u.a. über CNG-Kanäle. Dieser Mechanismus lockt
Leukozyten zu einem Entzündungsherd, Spermien zur Eizelle, Bakterien zu
einer Glucosequelle, auswachsende Neuritenfortsätze auf den richtigen
Weg usw. So steuern Ephrine durch Bindung
an Ephrinrezeptoren die Entwicklung von
Nervenbahnen (Vorwachsen der Axone von Ganglienzellen in der Netzhaut zu ihren Zielen im Hirnstamm). Positive
Chemotaxis veranlasst die Bewegung betreffender Zellen oder
Zellfortsätze zu Orten höherer Konzentration (zur Quelle) des
Signalstoffes hin, negative Chemotaxis von solchen Orten weg. Regt ein Stoff nur ungerichtete Zellbewegung an, nennt man den Vorgang Chemokinese. Abbildung).
Abbildung). 
 Abbildung: Zellmigration
Abbildung: Zellmigration AQP, Aquaporin
AQP, Aquaporin  CIC3, ein temporär exprimiertes Protein
CIC3, ein temporär exprimiertes Protein  ENaC, epithelialer Natriumkanal
ENaC, epithelialer Natriumkanal  KCa, calciumaktivierter Kaliumkanal
KCa, calciumaktivierter Kaliumkanal  NHE1, Natrium- Wasserstoffionen- Austauscher
NHE1, Natrium- Wasserstoffionen- Austauscher  NKCC1, Natrium- Kalium- Chlorid- Cotransporter
NKCC1, Natrium- Kalium- Chlorid- Cotransporter  VRAC, Volume-regulated anion channels, transportieren außer Chlorid auch organische Moleküle (Taurin, Glutamat, Aspartat) und beteiligen sich an der Regulation der Osmolalität in der Zelle
VRAC, Volume-regulated anion channels, transportieren außer Chlorid auch organische Moleküle (Taurin, Glutamat, Aspartat) und beteiligen sich an der Regulation der Osmolalität in der Zelle
 ) bzw. aus ihr heraus gelangen zu lassen (Endpartie: Retraktion) - diese Vorgänge müssen nicht synchron, sie können auch unabhängig voneinander erfolgen.
) bzw. aus ihr heraus gelangen zu lassen (Endpartie: Retraktion) - diese Vorgänge müssen nicht synchron, sie können auch unabhängig voneinander erfolgen.  Abbildung); die Bindung von Integrin kann
Kaliumkanäle aktivieren; calciumsensitive Proteine (wie das an Zellmotilität und -teilung beteiligte proteolytische Enzym Calpain)
sprechen auf Ca++-Einstrom (und damit auch das Membranpotential) an. Veränderungen der Osmolalität (Aquaporine!)
können zum An- oder Abschwellen entsprechender Zellpartien genutzt
werden; die Wirkung der Permeasen kann darüber hinaus über reinen
Ionentransport hinausgehen (nicht-konduktive Eigenschaften).
Abbildung); die Bindung von Integrin kann
Kaliumkanäle aktivieren; calciumsensitive Proteine (wie das an Zellmotilität und -teilung beteiligte proteolytische Enzym Calpain)
sprechen auf Ca++-Einstrom (und damit auch das Membranpotential) an. Veränderungen der Osmolalität (Aquaporine!)
können zum An- oder Abschwellen entsprechender Zellpartien genutzt
werden; die Wirkung der Permeasen kann darüber hinaus über reinen
Ionentransport hinausgehen (nicht-konduktive Eigenschaften). Calcium
Calcium  Organisation
Organisation  Elektrophysiologie
Elektrophysiologie  Steuerung
Steuerung Abbildung).
Abbildung).
 Abbildung: Glatte Muskelzelle
Abbildung: Glatte Muskelzelle
 Zuerst binden je vier Calciumionen an je ein Calmodulinmolekül (CaM) in der Muskelzelle. Es entsteht ein Ca++-CaM-Komplex, der sich so verformt, dass er auf ein MLCK- (Myosin-Leichtkettenkinase) Molekül "passt".
Zuerst binden je vier Calciumionen an je ein Calmodulinmolekül (CaM) in der Muskelzelle. Es entsteht ein Ca++-CaM-Komplex, der sich so verformt, dass er auf ein MLCK- (Myosin-Leichtkettenkinase) Molekül "passt". Der Ca++-CaM-Komplex bindet an das Enzym MLCK, welche dann ATP nutzt, um Myosin
an seiner regulatorischen leichten Kette (RLC: regulatory light chain) zu phosphorylieren (ADP wird
dabei frei). Die Phosphorylierung der
Myosin-Leichtkette (MLC) ist durch den Ca++-CaM-Komplex reguliert, und dessen Aktivität hängt wiederum vom intrazellulären [Ca++] ab. (Die regulatorische Leichtkette sitzt auf dem Halsteil der
schweren Kette des Myosinmoleküls.) Wird ein Myosin-Dimer aktiviert, reagiert es mit Aktin
(Kontraktion bzw. Tonuserhöhung). RLC ist in die Regulierung von Kontraktion, Zytokinese und Mitose involviert.
Der Ca++-CaM-Komplex bindet an das Enzym MLCK, welche dann ATP nutzt, um Myosin
an seiner regulatorischen leichten Kette (RLC: regulatory light chain) zu phosphorylieren (ADP wird
dabei frei). Die Phosphorylierung der
Myosin-Leichtkette (MLC) ist durch den Ca++-CaM-Komplex reguliert, und dessen Aktivität hängt wiederum vom intrazellulären [Ca++] ab. (Die regulatorische Leichtkette sitzt auf dem Halsteil der
schweren Kette des Myosinmoleküls.) Wird ein Myosin-Dimer aktiviert, reagiert es mit Aktin
(Kontraktion bzw. Tonuserhöhung). RLC ist in die Regulierung von Kontraktion, Zytokinese und Mitose involviert.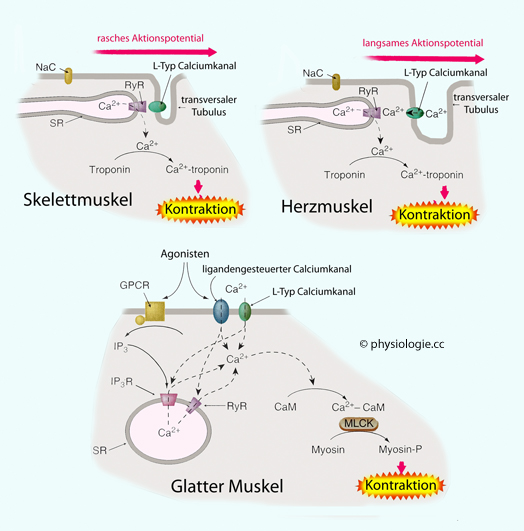
 Abbildung: Vergleich der elektromechanischen Kopplung bei quergestreifter (oben) und glatter Muskulatur (unten)
Abbildung: Vergleich der elektromechanischen Kopplung bei quergestreifter (oben) und glatter Muskulatur (unten)
 Caldesmon bindet Ca++-Calmodulin,
Actin, Myosin, Tropomyosin. Glatte Muskulatur enthält die Isoform 1, es
reguliert die Kontraktion glatter Muskelzellen und kann Aktinfilamente
stabilisieren. (Die Isoformen 2 bis 5 werden von anderen Zelltypen
gebildet).
Caldesmon bindet Ca++-Calmodulin,
Actin, Myosin, Tropomyosin. Glatte Muskulatur enthält die Isoform 1, es
reguliert die Kontraktion glatter Muskelzellen und kann Aktinfilamente
stabilisieren. (Die Isoformen 2 bis 5 werden von anderen Zelltypen
gebildet). Calponin bindet Ca++ und kann - wie Caldesmon - die ATPase-Aktivität des Myosins tonisch inhibieren und
relaxiert dadurch den glatten Muskel.
Calponin bindet Ca++ und kann - wie Caldesmon - die ATPase-Aktivität des Myosins tonisch inhibieren und
relaxiert dadurch den glatten Muskel. | Kontraktionen
(Tonuserhöhung) glatter Muskulatur erfolgen langsamer als bei
Skelettmuskeln, können aber lange anhalten und sind kaum
ermüdbar |

 Abbildung: Mechanismen der Steuerung von Kontraktion und Dilatation glatter Muskulatur
Abbildung: Mechanismen der Steuerung von Kontraktion und Dilatation glatter Muskulatur s. auch weiter unten
s. auch weiter unten Entweder wird Ca++ durch die Zellmembran nach außen transportiert (Expulsion), dazu stehen Ca++-ATPasen (Calciumexportpumpen, Plasma membrane calcium ATPases: PMCAs) sowie Ca/Na-Austauscher (die durch den Natriumgradienten in die Zelle angetrieben werden) zur Verfügung;
Entweder wird Ca++ durch die Zellmembran nach außen transportiert (Expulsion), dazu stehen Ca++-ATPasen (Calciumexportpumpen, Plasma membrane calcium ATPases: PMCAs) sowie Ca/Na-Austauscher (die durch den Natriumgradienten in die Zelle angetrieben werden) zur Verfügung;  oder in das sarkoplasmatische Retikulum (Sequestrierung), über ebenfalls ATP-verbrauchende Ca++-Transporter (SERCA: Sarco / endoplasmic reticulum Ca++-ATPase) des endoplasmatischen Retikulums.
oder in das sarkoplasmatische Retikulum (Sequestrierung), über ebenfalls ATP-verbrauchende Ca++-Transporter (SERCA: Sarco / endoplasmic reticulum Ca++-ATPase) des endoplasmatischen Retikulums. Abbildung), wobei es fließende Übergänge gibt:
Abbildung), wobei es fließende Übergänge gibt:
 Abbildung: Organisation glatter Muskulatur
Abbildung: Organisation glatter Muskulatur
 Der häufig vorkommende Single-Unit-Typ
(visceral smooth muscle) ist ein funktionelles Synzytium mit intensiven Kopplungen über gap junctions und eher
globaler Steuerbarkeit (single unit: Funktionelle Gesamtheit). Die Muskelzellen kontrahieren synchron, ähnlich
wie im Herzmuskel (aber wesentlich langsamer im Ablauf). Beispiele: Die meisten Blutgefäße, Lymphgefäße, Ureter, Darmwand, Gallenblase, Uterus. In einigen dieser Strukturen kann rhythmische Aktivität auftreten (z.B. Aktivität der "Lymphherzen", peristaltische
Kontraktionen im Gastrointestinaltrakt, im Harnleiter, Wehentätigkeit
der Gebärmutter). Viszeraler glatter Muskel kann auch ohne neuronale
Anregung Kontraktionen generieren, z.B. in Reaktion auf mechanische
oder hormonelle Anregung.
Der häufig vorkommende Single-Unit-Typ
(visceral smooth muscle) ist ein funktionelles Synzytium mit intensiven Kopplungen über gap junctions und eher
globaler Steuerbarkeit (single unit: Funktionelle Gesamtheit). Die Muskelzellen kontrahieren synchron, ähnlich
wie im Herzmuskel (aber wesentlich langsamer im Ablauf). Beispiele: Die meisten Blutgefäße, Lymphgefäße, Ureter, Darmwand, Gallenblase, Uterus. In einigen dieser Strukturen kann rhythmische Aktivität auftreten (z.B. Aktivität der "Lymphherzen", peristaltische
Kontraktionen im Gastrointestinaltrakt, im Harnleiter, Wehentätigkeit
der Gebärmutter). Viszeraler glatter Muskel kann auch ohne neuronale
Anregung Kontraktionen generieren, z.B. in Reaktion auf mechanische
oder hormonelle Anregung. Der Multi-Unit-Typ
zeichnet sich durch präzisere Steuerbarkeit mittels vegetativer
Nervenfasern aus (multi-unit: Funktionelle Untergliederung). Der Transmitterstoff beeinflusst glatte Muskelzellen auf kurze Distanz (Synapsen "en passant").
Die Zellen können unabhängig voneinander aktiviert, also präzise gesteuert werden, ähnlich
(aber nicht so ausschließlich) wie im Skelettmuskel. Beispiele: Innere Augenmuskeln (Pupillenweite, Akkommodation), Atemwege (Strömungswiderstand), m. arrectores pilorum ("Gänsehaut").
Der Multi-Unit-Typ
zeichnet sich durch präzisere Steuerbarkeit mittels vegetativer
Nervenfasern aus (multi-unit: Funktionelle Untergliederung). Der Transmitterstoff beeinflusst glatte Muskelzellen auf kurze Distanz (Synapsen "en passant").
Die Zellen können unabhängig voneinander aktiviert, also präzise gesteuert werden, ähnlich
(aber nicht so ausschließlich) wie im Skelettmuskel. Beispiele: Innere Augenmuskeln (Pupillenweite, Akkommodation), Atemwege (Strömungswiderstand), m. arrectores pilorum ("Gänsehaut").| Multi-unit-Zellen können unabhängig voneinander aktiviert werden (keine gap junctions) Single-unit-Zellen sind über gap junctions verbunden und funktionieren als Einheit |
 Aktionspotentiale
glatter Muskelzellen sind durch Calciumeinstrom bedingt, nicht wie bei
Skelettmuskelfasern durch Natriumeinstrom. Daher beeinflusst das
Nervengift Tetrodotoxin (das rasche spannungsgesteuerte Natriumkanäle
blockiert) auch nicht die Erregbarkeit glatter Muskelzellen.
Aktionspotentiale
glatter Muskelzellen sind durch Calciumeinstrom bedingt, nicht wie bei
Skelettmuskelfasern durch Natriumeinstrom. Daher beeinflusst das
Nervengift Tetrodotoxin (das rasche spannungsgesteuerte Natriumkanäle
blockiert) auch nicht die Erregbarkeit glatter Muskelzellen.
 Abbildung: Rhythmische Depolarisation glatter Muskulatur
Abbildung: Rhythmische Depolarisation glatter Muskulatur
 vor (z.B.
für spannungsgesteuerte Calciumkanäle), diese kann also je nach Bedingungen im
Gewebe wechseln.
vor (z.B.
für spannungsgesteuerte Calciumkanäle), diese kann also je nach Bedingungen im
Gewebe wechseln. Abbildung oben). Der Aktinanteil ist
in glatten Muskelzellen mindestens 10mal größer als der Myosinanteil
Abbildung oben). Der Aktinanteil ist
in glatten Muskelzellen mindestens 10mal größer als der Myosinanteil  (im quergestreiften Muskel
beträgt der Aktin-Myosin-Quotient
2:1 bis 4:1).
(im quergestreiften Muskel
beträgt der Aktin-Myosin-Quotient
2:1 bis 4:1).  Glatte Muskelzellen können sich bis auf ein Viertel ihrer
entspannten "Ruhelänge" verkürzen (Skelettmuskelfasern nur bis auf ~60%).
Glatte Muskelzellen können sich bis auf ein Viertel ihrer
entspannten "Ruhelänge" verkürzen (Skelettmuskelfasern nur bis auf ~60%).
 Abbildung: Glatte Muskelzellen bilden je nach Typus verschiedene Entladungsmuster aus
Abbildung: Glatte Muskelzellen bilden je nach Typus verschiedene Entladungsmuster aus
 Der Tonus ist z.T. alleine durch die Höhe des Membranpotentials bedingt
(z.B. in Arterienwänden), es genügt schon eine Reduktion des Membranpotentials (Depolarisation), um ihn zu erhöhen;
Der Tonus ist z.T. alleine durch die Höhe des Membranpotentials bedingt
(z.B. in Arterienwänden), es genügt schon eine Reduktion des Membranpotentials (Depolarisation), um ihn zu erhöhen;  in anderen
glatten Muskelfasern bedarf es zur Tonussteigerung plötzlicher Entladungen (Spikes). Spikes ähneln Aktionspotentialen (die in quergestreifter
Muskulatur zur Kontraktionsauslösung notwendig sind).
in anderen
glatten Muskelfasern bedarf es zur Tonussteigerung plötzlicher Entladungen (Spikes). Spikes ähneln Aktionspotentialen (die in quergestreifter
Muskulatur zur Kontraktionsauslösung notwendig sind).
 Abbildung: Kontraktionsauslösung in glattem Muskel
Abbildung: Kontraktionsauslösung in glattem Muskel Abbildung). Solche Stoffe können z.B. Neurotransmitter
sein.
Abbildung). Solche Stoffe können z.B. Neurotransmitter
sein.  Eine Senkung der IP3-Konzentration führt umgekehrt zu einer Verminderung des [Ca++] im Zytosol und senkt damit den Tonus der glatten Muskelzelle.
Eine Senkung der IP3-Konzentration führt umgekehrt zu einer Verminderung des [Ca++] im Zytosol und senkt damit den Tonus der glatten Muskelzelle.  Außer durch Öffnung rezeptorgesteuerter sarkolemmaler Calciumkanäle (VOC) bzw. Aktivierung metabotroper Rezeptoren kann die Ca++-Konzentration im Sarkoplasma auch gesteigert werden, wenn die anschließende Entfernung der Calciumionen aus dem Zytosol blockiert wird: Das ist möglich durch Hemmung entsprechender Transportsysteme, wie der Calciumexportpumpe nach extrazellulär (PMCA) oder der Calcium-ATPase des sarkoplasmatischen Retikulums (SERCA).
Außer durch Öffnung rezeptorgesteuerter sarkolemmaler Calciumkanäle (VOC) bzw. Aktivierung metabotroper Rezeptoren kann die Ca++-Konzentration im Sarkoplasma auch gesteigert werden, wenn die anschließende Entfernung der Calciumionen aus dem Zytosol blockiert wird: Das ist möglich durch Hemmung entsprechender Transportsysteme, wie der Calciumexportpumpe nach extrazellulär (PMCA) oder der Calcium-ATPase des sarkoplasmatischen Retikulums (SERCA).
 Abbildung: Regulierung der MLC-Phosphorylierung in einer glatten Muskelzelle (Gallengang)
Abbildung: Regulierung der MLC-Phosphorylierung in einer glatten Muskelzelle (Gallengang) ERK, extracellular signal-regulated kinases, gehören zu den mitogenaktivierten Kinasen (MAPK)
ERK, extracellular signal-regulated kinases, gehören zu den mitogenaktivierten Kinasen (MAPK)  ET-1, Endothelin-1
ET-1, Endothelin-1  ETR, endothelin receptor
ETR, endothelin receptor  MAPK, MAP-Kinase, mitogenaktivierte Proteinkinase (Signalweg enthält mindestens drei in Serie geschaltete Kinasen)
MAPK, MAP-Kinase, mitogenaktivierte Proteinkinase (Signalweg enthält mindestens drei in Serie geschaltete Kinasen)  MYPT-1, myosin phosphatase target subunit 1
MYPT-1, myosin phosphatase target subunit 1 GPCR,
G-protein coupled receptor
GPCR,
G-protein coupled receptor  IP3, Inositoltriphosphat
IP3, Inositoltriphosphat  PI3K, Phosphatidylinositol 3-Kinase
PI3K, Phosphatidylinositol 3-Kinase  PKC, Proteinkinase C
PKC, Proteinkinase C  PLCβ, Phospholipase C β
PLCβ, Phospholipase C β 
 Abbildung):
Abbildung):
 Öffnung spannungsgesteuerter Calciumkanäle: (VOCs) oder Bindung von Signalsubstanzen (wie Endothelin) an Membranrezeptoren (ROCs) bewirkt Ca++-Einstrom in die Muskelzelle - im ersten Fall aus dem Interstitium, im letzteren via PLC und IP3 aus dem sarkoplasmatischen Retikulum.
Öffnung spannungsgesteuerter Calciumkanäle: (VOCs) oder Bindung von Signalsubstanzen (wie Endothelin) an Membranrezeptoren (ROCs) bewirkt Ca++-Einstrom in die Muskelzelle - im ersten Fall aus dem Interstitium, im letzteren via PLC und IP3 aus dem sarkoplasmatischen Retikulum. | Depolarisierung der Membran öffnet Ca++-Kanäle, Bindung bestimmter Signalstoffe aktiviert den PLC-IP3-Mechanismus. Beides erhöht intrazelluläres [Ca++] |
 Nach intrazellulär gelangtes freies Ca++ bildet einen Komplex mit dem calciumbindenden Protein Calmodulin. Glatte Muskelzellen besitzen kein Troponin (wie quergestreifte Fasern), sondern Calmodulin, das Ca++ bindet und die enzymatische Reaktion auslöst.
Nach intrazellulär gelangtes freies Ca++ bildet einen Komplex mit dem calciumbindenden Protein Calmodulin. Glatte Muskelzellen besitzen kein Troponin (wie quergestreifte Fasern), sondern Calmodulin, das Ca++ bindet und die enzymatische Reaktion auslöst.| Calmodulin bindet Ca++-Ionen. Ca++-Calmodulin aktiviert Myosin-Leichtkettenkinase (MLCK) |
 Der Ca++-Calmodulin-Komplex aktiviert das phosphorylierende (aber selbst nicht phosphorylierte) Enzym Myosin-Leichtkettenkinase MLCK (Myosin-Leichtketten - MLC: Myosin light chain - sind Bestandteile des Myosins)
Der Ca++-Calmodulin-Komplex aktiviert das phosphorylierende (aber selbst nicht phosphorylierte) Enzym Myosin-Leichtkettenkinase MLCK (Myosin-Leichtketten - MLC: Myosin light chain - sind Bestandteile des Myosins) Durch Phosphorylierung der MLC kommt es zu aktiver Verlagerung zwischen Aktin- und Myosinfäden (Kontraktion)
Durch Phosphorylierung der MLC kommt es zu aktiver Verlagerung zwischen Aktin- und Myosinfäden (Kontraktion)| MLCK phosphoryliert Myosinleichtketten und erhöht den Tonus glatter Muskelzellen |
 Abbildung oben).
Abbildung oben). | Hemmung der MLCP stabilisiert die Phosphorylierung von MLC und steigert den Tonus glatter Muskelzellen |

 Abbildung: Spontane Oszillationen (slow waves) in glatter Muskulatur
Abbildung: Spontane Oszillationen (slow waves) in glatter Muskulatur
 Auf Konstriktion folgt Relaxation: Der Gegenspieler der Leichtkettenkinase ist die Leichtketten-Phosphatase (MLCP,
Auf Konstriktion folgt Relaxation: Der Gegenspieler der Leichtkettenkinase ist die Leichtketten-Phosphatase (MLCP,  Abbildung), sie dephosphoryliert - und hemmt dadurch - das Myosin. Ca++-Ionen werden über eine ATP-abhängige Pumpe (SERCA) in das sarkoplasmatische Retikulum zurückbefördert. Beim Transport nach extrazellulär hilft zusätzlich ein Na+-Ca++-Austauscher (NCX), der wesentlich ist für die zelluläre Ca++-Homöostase.
Abbildung), sie dephosphoryliert - und hemmt dadurch - das Myosin. Ca++-Ionen werden über eine ATP-abhängige Pumpe (SERCA) in das sarkoplasmatische Retikulum zurückbefördert. Beim Transport nach extrazellulär hilft zusätzlich ein Na+-Ca++-Austauscher (NCX), der wesentlich ist für die zelluläre Ca++-Homöostase.  Kontraktion und Relaxation glatter Muskulatur (z.B. in Gefäßen, im Darm etc.) steht im Mittelpunkt
zahlreicher pharmakologischer Wirkungen (Calciumblocker,
Hormonagonisten und -antagonisten etc). Meist werden dabei entweder
Ionenströme durch die Membran oder die Aktivität von Signalstoffen
modifiziert (die involvierten Rezeptoren können ionotrop oder metabotrop sein).
Kontraktion und Relaxation glatter Muskulatur (z.B. in Gefäßen, im Darm etc.) steht im Mittelpunkt
zahlreicher pharmakologischer Wirkungen (Calciumblocker,
Hormonagonisten und -antagonisten etc). Meist werden dabei entweder
Ionenströme durch die Membran oder die Aktivität von Signalstoffen
modifiziert (die involvierten Rezeptoren können ionotrop oder metabotrop sein).

 Abbildung: Kooperation Glatte Gefäßmuskelzelle und Endothelzelle (schematisch)
Abbildung: Kooperation Glatte Gefäßmuskelzelle und Endothelzelle (schematisch)

 Abbildung). Dieses beeinflusst den Blutdruck auf unterschiedliche
Weise (z.B. Erhöhung des Blutvolumens über Anreicherung des
Extrazellulärraums mit Kochsalz), aber auch über Wirkung auf Transkriptionsvorgänge im Zellkern.
Abbildung). Dieses beeinflusst den Blutdruck auf unterschiedliche
Weise (z.B. Erhöhung des Blutvolumens über Anreicherung des
Extrazellulärraums mit Kochsalz), aber auch über Wirkung auf Transkriptionsvorgänge im Zellkern.| Glatte Muskulatur |
Skelettmuskulatur |
|
| Verhältnis Aktin / Myosin |
~15:1, unregelmäßig angeordnet |
2:1, als "Querstreifung" regelmäßig angeordnet (wie Herzmuskel) |
| Dimensionen |
Länge bis 0,2 mm |
Länge bis mehrere cm, Durchmesser bis 80 µm |
| Kontraktionsauslösung |
Bindung Ca++ an Calmodulin |
Bindung Ca++ an Troponin |
| Dauerkontraktion durch |
erhöhte Transmitterkonzentration (Tonus) |
dauerhaft hohe Aktionspotentialfrequenz (Tetanus) |
| Ermüdung |
nein |
ja |
| Innervation |
Nerven / Schrittmacherzellen / Transmitter (Acetylcholin, Noradrenalin, etc) |
Motoneuron / motorische Endplatte (Acetylcholin) |
 Schutz gegenüber chemischen Störfaktoren
Schutz gegenüber chemischen Störfaktoren
 Erkennung potentiell schädlicher Fremdzellen
Erkennung potentiell schädlicher Fremdzellen
 Gewebetyperkennung
Gewebetyperkennung
 Krebsresistenz
Krebsresistenz
 Zelladhäsion
Zelladhäsion
 Entzündungsvorgänge
Entzündungsvorgänge
 Fertilisierung (Erkennung der Eizelle durch Spermien)
Fertilisierung (Erkennung der Eizelle durch Spermien)
 Embryonale Entwicklung / Differenzierung
Embryonale Entwicklung / Differenzierung  Membranproteine verankern die Zelle an extrazellulären Strukturen und
übertragen Kräfte in den Intrazellulärraum, versorgen die Zelle
mit Nährstoffen, wirken als Informationsvermittler und Enzyme. Biomoleküle sind Baustoffe, Energie- und Informationsträger. Proteine haben spezifische, reversible Bindungseigenschaften über Wasserstoffbrücken, van der Waals-Kräfte,
elektrostatische Wechselwirkungen und hydrophobe Kräfte, und dienen als Gerüstproteine, Enzyme, Filamente, Rezeptoren, Permeasen,
Transporter. Zellen enthalten meist mehrere
tausend spezifische Proteinarten
Membranproteine verankern die Zelle an extrazellulären Strukturen und
übertragen Kräfte in den Intrazellulärraum, versorgen die Zelle
mit Nährstoffen, wirken als Informationsvermittler und Enzyme. Biomoleküle sind Baustoffe, Energie- und Informationsträger. Proteine haben spezifische, reversible Bindungseigenschaften über Wasserstoffbrücken, van der Waals-Kräfte,
elektrostatische Wechselwirkungen und hydrophobe Kräfte, und dienen als Gerüstproteine, Enzyme, Filamente, Rezeptoren, Permeasen,
Transporter. Zellen enthalten meist mehrere
tausend spezifische Proteinarten Intrazelluläre
Proteine ermöglichen Wachstum, Bewegung, Transport, aktive Verformung. Mikrotubuli, Mikrofilamente und Intermediärfilamente bilden die Hauptmasse des Zytoskeletts - aufgebaut aus Aktin, Tubulin, Laminen, Vimentin, Keratin etc. Sie transportieren Moleküle und Zellorganellen: Anterograd (Kinesine, ~400 mm/d) oder retrograd (Dyneine, bis 200 mm/d) entlang von Mikrotubuli. Dyneine betreiben auch den Zilienschlag des Flimmerepithels, Kinesine
die mitotische Bewegung von Chromosomen. Zilien sind teils passiv
(Sinneshaare), teils ATP-verbrauchend koordiniert
beweglich (Kinozilien schlagen 5- bis 20mal pro Sekunde:
Dynein-Motorproteine, Gleitfilamentmechanismus) Intrazelluläre
Proteine ermöglichen Wachstum, Bewegung, Transport, aktive Verformung. Mikrotubuli, Mikrofilamente und Intermediärfilamente bilden die Hauptmasse des Zytoskeletts - aufgebaut aus Aktin, Tubulin, Laminen, Vimentin, Keratin etc. Sie transportieren Moleküle und Zellorganellen: Anterograd (Kinesine, ~400 mm/d) oder retrograd (Dyneine, bis 200 mm/d) entlang von Mikrotubuli. Dyneine betreiben auch den Zilienschlag des Flimmerepithels, Kinesine
die mitotische Bewegung von Chromosomen. Zilien sind teils passiv
(Sinneshaare), teils ATP-verbrauchend koordiniert
beweglich (Kinozilien schlagen 5- bis 20mal pro Sekunde:
Dynein-Motorproteine, Gleitfilamentmechanismus) Außerhalb der Zelle beteiligen sich Proteine an Abwehr (Antikörper,
Komplementfaktoren), Intaktheit der Gefäßwände (Gerinnungs-,
Fibrinolysefaktoren), Transport (Plasmaproteine), Aufbau extrazellulärer
Strukturen (Kollagen, Elastin, Fibronektin, Integrine). Faktoren wie NGF, BDNF, Neurotrophine sichern Überleben,
Differenzierung und Wachstum von Neuronen und kontrollieren die
Neurogenese Außerhalb der Zelle beteiligen sich Proteine an Abwehr (Antikörper,
Komplementfaktoren), Intaktheit der Gefäßwände (Gerinnungs-,
Fibrinolysefaktoren), Transport (Plasmaproteine), Aufbau extrazellulärer
Strukturen (Kollagen, Elastin, Fibronektin, Integrine). Faktoren wie NGF, BDNF, Neurotrophine sichern Überleben,
Differenzierung und Wachstum von Neuronen und kontrollieren die
Neurogenese  Zellen sind mobil, z.B. Immunzellen (Diapedese, Gewebepatrouille), Enterozyten
(Krypten-Zotten-Achse), Gefäßwandzellen (Angiogenese), Fibroblasten
(Wundheilung), Spermien. Sie orientieren sich an vorhandenen
Strukturen sowie an Konzentrationsgradienten von Chemokinen,
Komplementfaktoren u.a. (Chemotaxis). Sie strecken Podosomen vor und
ziehen sich an ihnen vorwärts; Rezeptoren werden fortlaufend
verlagert, Membrankanäle (Aquaporine, Ionenkanäle, Co-Transporter, Austauscher) unterstützen Verformung und Bewegung Zellen sind mobil, z.B. Immunzellen (Diapedese, Gewebepatrouille), Enterozyten
(Krypten-Zotten-Achse), Gefäßwandzellen (Angiogenese), Fibroblasten
(Wundheilung), Spermien. Sie orientieren sich an vorhandenen
Strukturen sowie an Konzentrationsgradienten von Chemokinen,
Komplementfaktoren u.a. (Chemotaxis). Sie strecken Podosomen vor und
ziehen sich an ihnen vorwärts; Rezeptoren werden fortlaufend
verlagert, Membrankanäle (Aquaporine, Ionenkanäle, Co-Transporter, Austauscher) unterstützen Verformung und Bewegung Glatte Muskelzellen kontrahieren langanhaltend, kaum ermüdbar (glattmuskulärer Tonus) und können sich bis auf 25% ihrer Ruhelänge verkürzen. Das Membranpotential - meistens zwischen -40 und -65 mV - schwankt abhängig von der Summe einwirkender Reize.
Depolarisation alleine kann den Tonus erhöhen (z.B.
Arterien), oder es braucht dazu Aktionspotentiale (z.B. Uterus) von unterschiedlicher Höhe und Form. Depolarisierung und Tonussteigerung erfolgt über Ca++-Einstrom, Re- bzw. Hyperpolarisierung über K+-Ausstrom (Relaxation). Im Multi-unit-Typ sind Muskelzellen in motorische Einheiten organisiert (Muskelzellen separiert, vom Vegetativum präzise steuerbar: z.B. innere Augenmuskeln, Atemwege), im Single-unit-Typ über gap junctions zu funktionellen Synzytien verknüpft (z.B. Gallenblase, Uterus). Der Typus kann je nach Anforderung wechseln (phänotypische Plastizität) Glatte Muskelzellen kontrahieren langanhaltend, kaum ermüdbar (glattmuskulärer Tonus) und können sich bis auf 25% ihrer Ruhelänge verkürzen. Das Membranpotential - meistens zwischen -40 und -65 mV - schwankt abhängig von der Summe einwirkender Reize.
Depolarisation alleine kann den Tonus erhöhen (z.B.
Arterien), oder es braucht dazu Aktionspotentiale (z.B. Uterus) von unterschiedlicher Höhe und Form. Depolarisierung und Tonussteigerung erfolgt über Ca++-Einstrom, Re- bzw. Hyperpolarisierung über K+-Ausstrom (Relaxation). Im Multi-unit-Typ sind Muskelzellen in motorische Einheiten organisiert (Muskelzellen separiert, vom Vegetativum präzise steuerbar: z.B. innere Augenmuskeln, Atemwege), im Single-unit-Typ über gap junctions zu funktionellen Synzytien verknüpft (z.B. Gallenblase, Uterus). Der Typus kann je nach Anforderung wechseln (phänotypische Plastizität) Ca++-Ionen aktivieren den kontraktilen Apparat bei
Reizung der Muskelzelle (über Nachbarzellen oder aktivierte Rezeptoren), indem sie aus
Extrazellulärraum und sarkoplasmatischem Retikulum in das
Sarkoplasma einströmen. Dies erfolgt (elektromechanische Kopplung) durch Depolarisierung und Öffnung spannungsgesteuerter Kationenkanäle (voltage-operated channels, VOCs) oder (pharmakomechanische Kopplung) durch Bindung eines Signalstoffs an Rezeptoren (aktiviert den PLC-IP3-Mechanismus: receptor-operated channels, ROCs) - gelegentlich auch ohne Depolarisierung. Ca++ bindet an
Calmodulin (statt Troponin), das aktiviert die Myosin-Leichtkettenkinase (MLCK), diese phosphoryliert die leichte Kette des
Myosinmoleküls, Myosin reagiert mit Aktin (Kontraktion). Spontankontraktionen beruhen auf Oszillationen der Calciumkonzentration (Eigenrhythmus: Schrittmacher, z.B. Cajal-Zellen im Darm). Calciumexportpumpen (PMCA) bringen Ca++ nach extrazellulär, Calcium-ATPase (SERCA) in das sarkoplasmatischen Retikulum; wird dies blockiert, bleibt der Tonus erhöht. Myosin- Leichtkettenphosphatase (MLCP) dephosphoryliert Myosin und reduziert dadurch den Muskeltonus; Hemmung der MLCP stabilisiert den Muskeltonus Ca++-Ionen aktivieren den kontraktilen Apparat bei
Reizung der Muskelzelle (über Nachbarzellen oder aktivierte Rezeptoren), indem sie aus
Extrazellulärraum und sarkoplasmatischem Retikulum in das
Sarkoplasma einströmen. Dies erfolgt (elektromechanische Kopplung) durch Depolarisierung und Öffnung spannungsgesteuerter Kationenkanäle (voltage-operated channels, VOCs) oder (pharmakomechanische Kopplung) durch Bindung eines Signalstoffs an Rezeptoren (aktiviert den PLC-IP3-Mechanismus: receptor-operated channels, ROCs) - gelegentlich auch ohne Depolarisierung. Ca++ bindet an
Calmodulin (statt Troponin), das aktiviert die Myosin-Leichtkettenkinase (MLCK), diese phosphoryliert die leichte Kette des
Myosinmoleküls, Myosin reagiert mit Aktin (Kontraktion). Spontankontraktionen beruhen auf Oszillationen der Calciumkonzentration (Eigenrhythmus: Schrittmacher, z.B. Cajal-Zellen im Darm). Calciumexportpumpen (PMCA) bringen Ca++ nach extrazellulär, Calcium-ATPase (SERCA) in das sarkoplasmatischen Retikulum; wird dies blockiert, bleibt der Tonus erhöht. Myosin- Leichtkettenphosphatase (MLCP) dephosphoryliert Myosin und reduziert dadurch den Muskeltonus; Hemmung der MLCP stabilisiert den Muskeltonus |
