

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Physiologie
des Herzens

 Erregungsausbreitung im Herzmuskel
Erregungsausbreitung im Herzmuskel
© H. Hinghofer-Szalkay
 Arrhythmie: ἄρρυϑμος = unrhythmisch (ῥυθμός = Rhythmus)
Arrhythmie: ἄρρυϑμος = unrhythmisch (ῥυθμός = Rhythmus)
Aschoff-Tawara-Knoten: Ludwig Aschoff, Sunao Tawara
Bradykardie: βραδύς = langsam, καρδιά = muskuläres Hohlorgan, Herz
His'sches Bündel: Wilhelm His
Keith-Flack-Knoten: Arthur Keith, Martin Flack
Myokard: μυς = Muskel
Purkinje-Fasern: Jan Purkinje
Stannius'sche Ligaturen: Hermann Stannius
Tachykardie: ταχυς = schnell
Der Herzmuskel als "funktionelles Synzytium": Alle Myokardzellen sind mit ihren Nachbarn elektrisch (über gap junctions)
verschaltet. Entsteht im Herzen eine
Erregung (normalerweise im Sinusknoten),
pflanzt sich diese über das ganze Organ fort (soferne die
Nachbarzellen erregbar sind). Die dabei auftretenden Aktionspotentiale
der einzelnen Zellen
erzeugen zusammen elektrische Felder, die sich über das Gewebe
ausbreiten und von der Körperoberfläche als EKG-Signal ableitbar sind.
Die Erregungswelle im Herzen löst über elektro-mechanische Kopplung eine
Kontraktion (einen Herzschlag) aus. An der elektromechanischen Kopplung sind Ca++-Ionen beteiligt, die teils aus dem Extrazellulärraum, teils aus dem sarkoplasmatischen Retikulum der Kardiomyozyten stammen.
Aufbau und Eigenschaften des Herzmuskels ergeben einen
physiologischen Erregungsablauf, der die Pumpfunktion des Herzens
optimiert. Spezielle Zellen dienen der Erregungsbildung (Sinusknoten im Vorhof) und Reizleitung
(AV-Knoten und His-sches Bündel an der
Grenze zu den Ventrikeln, Kammerschenkel und Purkinje-Fasern in den
Kammern). Der Sinusknoten gibt die Herzfrequenz vor (kardialer Schrittmacher); der AV-Knoten sitzt wie ein elektrophysiologischer Pförtner vor den Ventrikeln und
bestimmt, wann und ob Aktionspotentiale von Vorhof- auf Kammergewebe
weitergegeben werden; das His-Bündel
leitet die Erregungswelle weiter und verteilt sie auf die Kammerschenkel, die zusammen mit den Purkinje-Fasern die Aktionspotentialwelle räumlich-zeitlich optimiert auf beide Ventrikel verteilen.
Verzögerte Repolarisierung (Plateauphase des Aktionspotentials) verlängert die Refraktärzeit, in der die Zellen unerregbar (weiterer Reizung nicht
zugänglich) sind. Das schützt den Kontraktionsablauf - das
Myokard ist untetanisierbar. Erregbarkeit und Aktionspotentialform der Zellen werden durch zahlreiche verschiedene Ionenkanäle in deren Membran reguliert. Diese sind auch Ansatzpunkt spezieller herzwirksamer Pharmaka.
Autonome (vegetative) Nervenfasern beeinflussen die Eigenschaften des Herzmuskelsystems: So bremst im Ruhezutand parasympathischer
Einfluss die Spontanentladungsfrequenz des Sinusknotens (~100/min) auf etwa 60/min (Ruhefrequenz); sympathische Aktivität steigert Herzfrequenz und Schlagkraft (positiv chronotrope und inotrope Wirkung).
|
Ruhepotential  Erregtes Myokard
Erregtes Myokard  Aktionspotential des Arbeitsmyokards
Aktionspotential des Arbeitsmyokards  Triggerung eines Herzschlags
Triggerung eines Herzschlags  Reizleitungssystem
Reizleitungssystem  Erregungsausbreitung
Erregungsausbreitung  Einfluss des autonomen Nervensystems
Einfluss des autonomen Nervensystems
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Das
Herz schlägt autonom.
Es wurde schon früh beobachtet, dass ein Herz auch dann noch
weiterschlägt, wenn es aus dem Körper entfernt wird (z.B. Opferkult der
Azteken, oder im Rahmen "klassischer" Physiologieübungen: Spontan
schlagendes isoliertes Froschherz). Das bedeutet, dass es zur Auslösung
eines Herzschlags keiner
Anregung von außen bedarf (wie dies beim Skelettmuskel der Fall ist,
der durch Aktionspotentiale von motorischen Vorderhornzellen aktiviert
wird, also auf Steuerimpulse aus dem Zentralnervensystem angewiesen
ist).
Die ruhende Myokardzelle
Die große Mehrheit der Herzmuskelzellen (Kardiomyozyten) gehört zum
"Arbeitsmyokard", das so heißt, weil seine Aufgabe die Kontraktion ist
(und nicht die Erregungsbildung). Solange Arbeitsmyokardzellen nicht gereizt werden oder pathologisch verändert sind, haben sie ein konstantes Ruhepotential. Dieses entsteht im Wesentlichen durch Diffusion von Kaliumionen aus der Zelle heraus.
Wie bei anderen Zellen auch, ist die Na/K-ATPase ("Pumpe") Grundlage des zugrunde liegenden Konzentrationsunterschieds ([Na+]: innen / außen ~1/14, [K+]: innen / außen ~35/1):
Ruhende Arbeitsmyokardzelle: Ionenkonzentrationen, pH und Gleichgewichtspotentiale

Nach Herring / Paterson: Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
|
|
Intrazellulär
(mM)
|
Extrazellulär
(mM)
|
Gleichgewichts-
potential
(mV)
|
| K+ |
140
|
4
|
-94
|
| Na+ |
10
|
140
|
+70
|
Ca++
|
0,0001
|
1,2
|
+124
|
Cl-
|
30
|
120
|
-37
|
pH
|
7,0 - 7,1
|
7,4
|
|
Die Gleichgewichtspotentiale lassen erkennen, dass - bei einem Ruhemembranpotential der Herzmuskelzelle von -80 bis -90 mV - Na+ und (besonders intensiv) Ca++ in die Zelle diffundieren würde. Wie verhält es sich mit der Permeabilität der Zellmembran (des Sarkolemms) für diese Ionen?
 Der rasche Natriumkanal (Nav1.5) im Herzmuskel ist einer von 8 Typen spannungsabhängiger Na+-Permeasen im Genom des Menschen. Eine einzige Aminosäurenkette (etwa 2000 Aminosäuren eines Proteinmoleküls) bildet hier 4 Domänen mit jeweils 6 membrandurchspannenden α-Helices (wie in Kv-Kanälen), und zwischen den Domänen 3 und 4 erstreckt sich eine intrazelluläre Schleife mit einem "Inaktivierungstor" (inactivation gate).
Der rasche Natriumkanal (Nav1.5) im Herzmuskel ist einer von 8 Typen spannungsabhängiger Na+-Permeasen im Genom des Menschen. Eine einzige Aminosäurenkette (etwa 2000 Aminosäuren eines Proteinmoleküls) bildet hier 4 Domänen mit jeweils 6 membrandurchspannenden α-Helices (wie in Kv-Kanälen), und zwischen den Domänen 3 und 4 erstreckt sich eine intrazelluläre Schleife mit einem "Inaktivierungstor" (inactivation gate).
Natriumionen gelangen bei ungereizten Myokardzellen trotz des nach innen gerichteten elektrochemischen Gradienten kaum durch die Membran, da die Natriumkanäle während des Ruhepotentials geschlossen sind. (Ein geringer Natrium-"Leckstrom" (backgroud leak, inward backgroud current ib) reduziert das Ruhepotential auf einen Betrag, der etwas unter dem des K+-Gleichgewichtspotentials von -94 mV liegt.)
 Ähnlich verhält es sich für Calcium: Auch Ca++-Ionen
prallen bei ruhenden Myozyten sozusagen an der Zellmembran ab und
können in unerregte Zellen nicht eindringen. Der im Herzmiskel
vorhandene L-Typ Calciumkanal öffnet bei Depolarisierung der Zelle (Aktionspotential). Der resultierende Anstieg intrazellulären [Ca++] befördert anschließend (Calmodulin-abhängig) die Schließung des Calciumkanals.
Ähnlich verhält es sich für Calcium: Auch Ca++-Ionen
prallen bei ruhenden Myozyten sozusagen an der Zellmembran ab und
können in unerregte Zellen nicht eindringen. Der im Herzmiskel
vorhandene L-Typ Calciumkanal öffnet bei Depolarisierung der Zelle (Aktionspotential). Der resultierende Anstieg intrazellulären [Ca++] befördert anschließend (Calmodulin-abhängig) die Schließung des Calciumkanals.
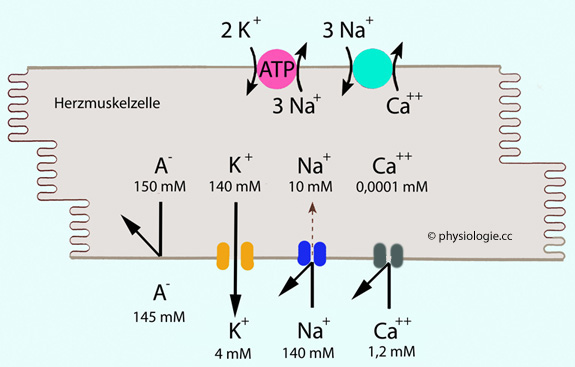
 Abbildung: Transmembranale Gradienten und Ionenströme in einer unerregten Herzmuskelzelle
Abbildung: Transmembranale Gradienten und Ionenströme in einer unerregten Herzmuskelzelle
Modifiziert nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Oben: Na/K-ATPase (rosa) befördert aktiv 3 Na+ aus der, und 2 K+ in die Zelle; der Na/Ca-Antiporter (grün) tauscht sekundär-aktiv 3 Na+ gegen 1 Ca++. Kombiniert bringt dieser - insgesamt elektroneutrale - Vorgang Kalium in die, Calcium aus der Zelle.
Unten: Bei Vorliegen des Ruhepotentials (-80 bis -90 mV, nahe dem
-94 mV Kalium- Gleichgewichtspotential) durchquert nur Kalium (via Kir-Kanäle, orange) die Membran; Na-Kanäle (dunkelblau) sind weitgehend geschlossen. Calciumkanäle (L-type calcium channels, grau) sind geschlossen und öffnen erst bei Erregung der Zelle.
Anionen wie Phosphat oder geladene Aminosäuren können die Zelle (mangels geeigneter Permeasen) nicht verlassen
A = Anionen (Phosphat, Aminosäuren u.a.)
 Für Kalium ist die Situation anders:
Für Kalium ist die Situation anders:
 "Einwärts-gleichrichtende" Kaliumkanäle (Kir: ir = inward rectifying) haben beim Betrag des Ruhepotentials eine relativ hohe "Offen"-Wahrscheinlichkeit (
"Einwärts-gleichrichtende" Kaliumkanäle (Kir: ir = inward rectifying) haben beim Betrag des Ruhepotentials eine relativ hohe "Offen"-Wahrscheinlichkeit (  Abbildung) und ermöglichen
Kaliumionen, aus der Zelle zu diffundieren. Die Zahl verschiedener Kaliumkanäle im menschlichen Genom ist hoch (spannungsabhängige, calciumabhängige, Kir-Kanäle). Die Kaliumselektivität der zentralen Pore der Kir-Kanäle ist durch ein spezielles Aminosäuremotiv bedingt, das zwar nicht zu den spannungssensitiven Schleifen zählt, aber bei abnehmendem Membranpotential seine
Kaliumleitfähigkeit reduziert (daher "inward rectifying") -
intrazelluläre Magnesiumionen und Polyamine verengen den Kanal bei
Auswärtsstrom. Das bedeutet, bei Depolarisierung der Herzmuskelzelle nimmt die Leitfähigkeit der Kir-Kanäle ab, die Zelle verliert weniger Kalium - wichtig vor allem während des langen Aktionspotentials mit dem Plateau nahe der Nulllinie.
Abbildung) und ermöglichen
Kaliumionen, aus der Zelle zu diffundieren. Die Zahl verschiedener Kaliumkanäle im menschlichen Genom ist hoch (spannungsabhängige, calciumabhängige, Kir-Kanäle). Die Kaliumselektivität der zentralen Pore der Kir-Kanäle ist durch ein spezielles Aminosäuremotiv bedingt, das zwar nicht zu den spannungssensitiven Schleifen zählt, aber bei abnehmendem Membranpotential seine
Kaliumleitfähigkeit reduziert (daher "inward rectifying") -
intrazelluläre Magnesiumionen und Polyamine verengen den Kanal bei
Auswärtsstrom. Das bedeutet, bei Depolarisierung der Herzmuskelzelle nimmt die Leitfähigkeit der Kir-Kanäle ab, die Zelle verliert weniger Kalium - wichtig vor allem während des langen Aktionspotentials mit dem Plateau nahe der Nulllinie.
Kir-Kanäle wurden so benannt, weil sie bei Hyperpolarisation (künstlich herbeigeführt: Voltage-clamp-Situation) Kalium in
die Zelle lassen; die Bezeichnung "Einwärts-Gleichrichter" ist
eigentlich irreführend, da diese Kanäle physiologischerweise Kalium aus
der Zelle diffundieren lassen und damit das Ruhepotential
stabilisieren.
Groß ist der Betrag des Kaliumaustritts nicht, da das Ruhepotential
(-80 bis -90 mV) nahe am Gleichgewichtspotential für Kalium liegt (-94 mV, s. Tabelle). Bereits ein einziges ausgetretenes Kaliumion pro ~1015 Ionenpaaren in der Zelle kreiert eine Membranpotential von -80 mV.
Steigt die extrazelluläre
Kaliumkonzentration stark an (allgemein bei Nierenversagen, lokal bei
kardialer Ischämie), nimmt das Ruhepotential ab, was Arrhythmien des
Herzschlags zur Folge haben kann.
 Zu den zahlreichen spannungsgesteuerten Kaliumkanälen (Kv) zählen "langsame" (delayed rectifyer (slow) channels Ks) und transient outward K+ channels Kto (s. weiter unten).
Zu den zahlreichen spannungsgesteuerten Kaliumkanälen (Kv) zählen "langsame" (delayed rectifyer (slow) channels Ks) und transient outward K+ channels Kto (s. weiter unten).
Na/K-ATPase
Die Na/K-ATPase
stabilisiert währenddessen die Ionenkonzentrationen. Sie befördert
Kaliumionen aktiv in die Zelle (im Austausch gegen Natriumionen im
Verhältnis 2:3). Der Natrium-Leckstrom in die Zelle (background current) wird kompensiert ("pump-leak" model) und das Membranpotential auf -80 bis -90 mV gehalten.
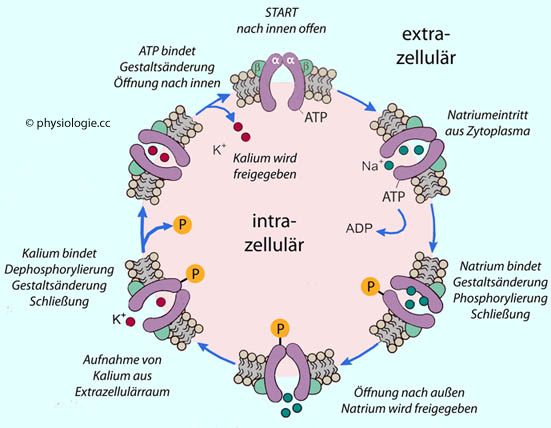
 Abbildung: Funktionszyklus einer Na/K-ATPase
Nach einer Vorlage in Butler / Brown / Stephenson /
Speakman, Animal physiology - An environmental perspective. Oxford
University Press 2021
Abbildung: Funktionszyklus einer Na/K-ATPase
Nach einer Vorlage in Butler / Brown / Stephenson /
Speakman, Animal physiology - An environmental perspective. Oxford
University Press 2021
Schematische Darstellung
 Erhöht
sich die extrazelluläre Kaliumkonzentration z.B. auf 10 mM -
was bei Nierenversagen (systemisch) oder Ischämie des Herzmuskels
(lokal) auftreten kann -, ergibt sich ein
Kalium-Gleichgewichtspotential von -70 mV, und das Myokard würde um ~20
mV depolarisiert. Hyperkaliämie depolarisiert die Herzmuskelzelle; das kann Arrhythmien verursachen.
Erhöht
sich die extrazelluläre Kaliumkonzentration z.B. auf 10 mM -
was bei Nierenversagen (systemisch) oder Ischämie des Herzmuskels
(lokal) auftreten kann -, ergibt sich ein
Kalium-Gleichgewichtspotential von -70 mV, und das Myokard würde um ~20
mV depolarisiert. Hyperkaliämie depolarisiert die Herzmuskelzelle; das kann Arrhythmien verursachen.
Im Zytosol vorhandenes Ca++ wird im Austausch gegen jeweils 3Na+ unter Ausnützung des transmembranalen Natriumgradienten stetig aus der Zelle entfernt - dieser Na/Ca-Austauscher übernimmt ca. 75% des Ca++-Auswärtstransportes des Kariomyozyten, den Rest übernehmen Ca++-Pumpen. Zusammen bewirken diese Transportsysteme die niedrige Ca++-Konzentration (10-7 M) im Zytosol der ruhenden Herzmuskelzelle.
In ähnlicher Weise entfernen Na/H-Austauscher (NHE) H+-Ionen aus der Herzmuskelzelle durch Austausch gegen Natrium. Na+ wird dann über die Na/K-Pumpe aktiv wieder aus der Zelle gebracht.
Minderdurchblutung (Ischämie)
bedingt Sauerstoffmangel, reduziert die Verfügbarkeit von ATP und damit
die Aktivität der Na/K-ATPase, steigert die intrazelluläre
Natriumkonzentration, senkt den Gradienten für den Na/H-Austauscher, Wasserstoffionen reichern sich im Zytosol an, der intrazelluläre pH-Wert sinkt (Azidose).
Die erregte Myokardzelle
Die
Depolarisierung einer Herzmuskelzelle bewirkt
Änderungen in verschiedenen Membrankanälen: Einige Kanäle
öffnen, andere schließen, und das mit unterschiedlicher Intensität und
Zeitcharakteristik. Dieses Zusammenwirken
verschiedener Ionenströme ergibt das charakteristische Aktionspotential
einer Herzmuskelzelle.
Arbeitsmuskelzellen einerseits, Schrittmacherzellen andererseits sind unterschiedlich mit Ionenkanälen ausgestattet. Je nach der zellulären Expression / Ausstattung
mit Kanalproteinen nimmt dieses unterschiedliche Form und Dauer an. Natrium-,
Kalium- und Calciumströme divergieren in ihrer Beteiligung am
Aktionspotential, das dementsprechend verschieden ausgestaltet ist:
 Natriumkanäle ermöglichen Natriumeinstrom (INa) in der Phase-0-Depolarisation von Arbeitsmuskelzellen (nicht Schrittmacherzellen)
Natriumkanäle ermöglichen Natriumeinstrom (INa) in der Phase-0-Depolarisation von Arbeitsmuskelzellen (nicht Schrittmacherzellen)
 Calciumkanäle ermöglichen Calciumeinstrom (ICa) für die Depolarisation in Schrittmacherzellen (Sinusknoten, AV-Knoten)
Calciumkanäle ermöglichen Calciumeinstrom (ICa) für die Depolarisation in Schrittmacherzellen (Sinusknoten, AV-Knoten)
 Allen Herzmuskelzellen ist gemeinsam, dass verschiedene Kaliumkanäle den Kaliumausstrom (IK) und damit die Repolarisierung ermöglichen - angeregt durch das Membranpotential oder durch Signalstoffe wie ATP oder Acetylcholin
Allen Herzmuskelzellen ist gemeinsam, dass verschiedene Kaliumkanäle den Kaliumausstrom (IK) und damit die Repolarisierung ermöglichen - angeregt durch das Membranpotential oder durch Signalstoffe wie ATP oder Acetylcholin.
 Durch nichtselektive Kationenkanäle fließt Schrittmacherstrom (If), der sich an der Depolarisation von Schrittmacherzellen (Sinusknoten-, AV-Knoten-, Purkinjefasern) beteiligt.
Durch nichtselektive Kationenkanäle fließt Schrittmacherstrom (If), der sich an der Depolarisation von Schrittmacherzellen (Sinusknoten-, AV-Knoten-, Purkinjefasern) beteiligt.
Die Abläufe sind durch die Tatsache kompliziert, dass im Laufe des
Aktionspotentials Änderungen des Membranspotentials die Leitfähigkeit
für verschiedene Ionen (in spezifischer Weise) modifizieren und die
resultierenden Veränderungen der Ionenströme ihrerseits das
Membranpotential beeinflussen.
Elektrogen wirken die Na/K-Pumpe sowie Na/Ca-Austauscher.
Wichtigste Ionenströme in einer Arbeitsmuskelzelle

Nach Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
|
Strom
|
Ion
|
Richtung
|
Funktion
|
iK (gesamt)
|
Kalium
|
nach außen
|
1. Ruhepotential
2. Repolarisierung
|
ib (background)
|
Natrium (vorwiegend)
|
nach innen
|
Einstrom verringert Betrag des Ruhepotentials (<EK)
|
iNa
|
Natrium
|
nach innen
|
Rasche Depolarisierung unterstützt Erregungsausbreitung
|
iCa
|
Calcium
|
nach innen
|
1. Elektromechanische Kopplung
2. Erhaltung Plateau
|
iNa/Ca
|
3 Na+ gegen 1 Ca++
|
Na+ nach innen, Ca++ nach außen ("Vorwärts"-Modus)
|
Erhaltung der späten Plateauphase, Entfernung von Ca++
aus Sarkoplasma
|
Phylogenese:
Vermutlich haben sich Kir-Kanäle (mit zwei transmembranalen Helices pro
porenbildender α-Untereinheit) in spannungsabhängige Kaliumkanäle (mit
6 transmembranalen Helices) und diese in Na/Ca-Kanäle entwickelt. Alle
haben 4 transmembranale α-Subeinheiten, die eine ringförmige Pore bilden - entweder von einem (Na+-, Ca++-Kanäle) oder von mehreren Proteinen
gebildet (K+-Kanäle).
 Calciumkanäle
in Herzmuskelzellen funktionieren unterschiedlich: In Zellen des
Arbeitsmyokards öffnen sie erst, wenn die Zellmembran vollständig
depolarisiertt ist und bleiben während der Plateauphase geöffnet; in
autorhythmischen Zellen öffnen sie schon bei einem Membranpotential von
-50 mV und schließen, wenn +20 mV erreicht sind.
Calciumkanäle
in Herzmuskelzellen funktionieren unterschiedlich: In Zellen des
Arbeitsmyokards öffnen sie erst, wenn die Zellmembran vollständig
depolarisiertt ist und bleiben während der Plateauphase geöffnet; in
autorhythmischen Zellen öffnen sie schon bei einem Membranpotential von
-50 mV und schließen, wenn +20 mV erreicht sind.
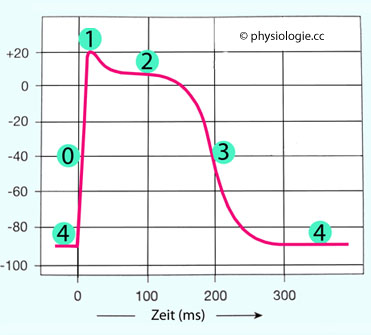
 Abbildung: Aktionspotential und Refrakterität
Abbildung: Aktionspotential und Refrakterität
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Gezeigt sind die Phasen des Aktionspotentials sowie der Zustandswechsel der Ionenkanäle in der Zellmembran einer Arbeitsmuskelzelle. Zuerst öffnen die Natriumkanäle (Aufstrich, rasche
Umpolung), dann sind die Natriumkanäle inaktiviert, anschließend
geschlossen und lassen kein weiteres Aktionspotential zu. Erst mit "Erholung" der Kanäle zum geschlossenen Ruhezustand sind sie wieder aktivierbar.
0: Natriumkanäle offen
1: Natriumkanäle schließen
2: Calciumkanäle offen, rasche Kaliumkanäle schließen
3: Calciukanäle schließen, langsame Kaliumkanäle offen. In dieser Phase ist die Beteiligung der inward-rectifier potassium channels (IRK, Kir) besonders intensiv und gewährleistet die Repolarisation der Herzmuskelzelle
4: Ruhepotential
In den Phasen 0
bis 3 ist die Herzmuskelzelle refraktär (nicht oder nur schwer
erregbar): In den Phasen 0 bis 2 sind die Zellen absolut refraktär (effective refractory period ERP), in Phase 3 nur erschwert (relativ) refraktär (relative refractory period RRP)

Das Aktionspotential des Arbeitsmyokards ist einerseits geprägt durch (  Abbildung)
Abbildung)
 blitzartigen
Natriumeinstrom (wie bei Nervenzellen) - bei Zellen des
Erregungsbildungs- und -leitungssystems stattdessen ein etwas
langsameres Einströmen von Calciumionen -, was rasche
Depolarisierung und Erregungsausbreitung ermöglicht;
blitzartigen
Natriumeinstrom (wie bei Nervenzellen) - bei Zellen des
Erregungsbildungs- und -leitungssystems stattdessen ein etwas
langsameres Einströmen von Calciumionen -, was rasche
Depolarisierung und Erregungsausbreitung ermöglicht;
 andererseits durch lange Refrakterität, was die sich kontrahierende Zelle vor irregulärer Erregung und Arrhythmien
andererseits durch lange Refrakterität, was die sich kontrahierende Zelle vor irregulärer Erregung und Arrhythmien  schützt. Diese Refraktärperiode - gekennzeichnet durch das "Plateau" im Aktionspotentialverlauf - verhindert vorzeitige
Wiedererregung und gewährleistet ordnungsgemäße
Synchronisation der pumpenden Muskelzellen.
schützt. Diese Refraktärperiode - gekennzeichnet durch das "Plateau" im Aktionspotentialverlauf - verhindert vorzeitige
Wiedererregung und gewährleistet ordnungsgemäße
Synchronisation der pumpenden Muskelzellen.
Aktionspotentiale in Skelettmuskel- vs. Herzmuskelzellen

Nach Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
|
|
Skelettmuskel
|
Arbeitsmyokard
|
Autorhythmische Zellen (Sinusknoten bis Purkinje-Fasern)
|
Membranpotential
|
-70 mV, stabil
|
-90 mV, stabil
|
Instabil, startet bei ca. -60 mV
|
Reiz
|
Na+-Einstrom (cholinerge Kanäle)
|
Depolarisierung über gap junctions
|
Na+-Einstrom durch If-Kanäle, verstärkt durch Ca++-Einstrom
|
Aufstrich
|
Na+-Einstrom
|
Na+-Einstrom
|
Ca++-Einstrom |
Repolarisierung
|
rasch
(K+-Ausstrom)
|
Plateau durch Ca++-Einstrom, dann rascher K+-Ausstrom |
rasch (K+-Ausstrom)
|
Hyperpolarisierung
|
Verlängerter K+-Ausstrom |
keine
|
keine
|
Dauer des Aktionspotentials
|
1-2 ms
|
ca. 200 ms
|
≥150 ms
|
Refraktärität
|
kurz
|
lang
|
keine
|
Natriumkanäle
Spannunsgesteuerte (voltage gated) Natriumkanäle des kardialen Typs (Nav1.5, fast sodium channels) finden sich in Zellen des Arbeitsmyokards - vor allem in der Nähe von Glanzstreifen (interzelluläre Kontaktzonen mit gap junctions und Desmosomen). Sie durchlaufen einen Zyklus von aufeinander folgenden Zuständen, die
Natriumionen durch sie hindurchtreten lassen - oder nicht
( Abbildung). Dabei reagieren sie auf den Betrag des aktuellen Membranpotentials, sie fungieren als Spannunssensoren.
Abbildung). Dabei reagieren sie auf den Betrag des aktuellen Membranpotentials, sie fungieren als Spannunssensoren.

 Abbildung: Spannungssensitiver Natriumkanal
Abbildung: Spannungssensitiver Natriumkanal
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Spannungsgesteuerte Natriumkanäle
reagieren auf den Betrag des Membranpotentials. Sie sind aus
jeweils 4 (fast identen) Domänen aufgebaut (I-IV), diese bestehen
wiederum aus jeweils 6 transmembranalen Sequenzen; eine davon (S4, durch
rote Zylinder symbolisiert) enthält Arginin und Lysin (positiv geladene Aminosäuren), die als Spannungssensor wirken (gating charges). Ist die Membran
aufgeladen bzw. hyperpolarisiert, sind die Natriumkanäle geschlossen
und blockieren den Na+-Einstrom (unten links).
Depolarisierung
führt zu einer Konformationsänderung, die S4-Regionen der Domänen I, II
und III rücken nach außen, der Kanal nimmt den offenen Zustand an, und
Natrium
strömt in die Zelle (Mitte).
Sehr
rasch (~1 ms) kommt es dann zu einer weiteren
Konformationsänderung - die S4-Region der Domäne IV rückt verzögert
nach außen -, und ein Teil
des Porenkomplexes - das Inaktivierungsmotiv (inactivation gate) - verschließt darauf hin
den Kanal, der dadurch in einen dritten, inaktivierten Zustand gerät und den
Natriumeinstrom beendet (rechts).
Erst wenn die Zelle repolarisiert, stellt sich der "geschlossene" - und damit erregbare - Zustand (links) wieder her

 Im Ruhezustand (Ruhepotential) liegen sie in einem durch einen Teil des Porenkomplexes blockierten Zustand vor, sie sind "geschlossen".
Im Ruhezustand (Ruhepotential) liegen sie in einem durch einen Teil des Porenkomplexes blockierten Zustand vor, sie sind "geschlossen".
 Depolarisiert
die Zelle über den Betrag des Schwellenpotentials (-60 bis -65 mV) - weil sie im Zuge einer Erregungsausbreitung von
Nachbarzellen gereizt wird -, kommt es zu einer sterischen Umlagerung
im Proteinkomplex, und der Kanal ist "offen", die Permeabilität steigt auf das 100-fache, Natrium strömt ein (fast inward current iNa: ~104 Ionen pro Millisekunde). Der Natriumkanal funktioniert spannungsabhängig (er öffnet bei einem bestimmten Potential) und zeitabhängig (die Öffnungszeit ist limitiert).
Depolarisiert
die Zelle über den Betrag des Schwellenpotentials (-60 bis -65 mV) - weil sie im Zuge einer Erregungsausbreitung von
Nachbarzellen gereizt wird -, kommt es zu einer sterischen Umlagerung
im Proteinkomplex, und der Kanal ist "offen", die Permeabilität steigt auf das 100-fache, Natrium strömt ein (fast inward current iNa: ~104 Ionen pro Millisekunde). Der Natriumkanal funktioniert spannungsabhängig (er öffnet bei einem bestimmten Potential) und zeitabhängig (die Öffnungszeit ist limitiert).
Ein Kardiomyozyt enthält etwa 2.1011 Natriumionen, während der Depolarisierungsphase strömen ~4.107 in die Zelle ein - 0,02% des intrazellulären Bestandes. Der entsprechende Kaliumaustausch ist noch geringer, lediglich 0,001% des intrazellulären Bestandes.
Diese Zahlen zeigen, mit welch geringem Ionenaustausch die
Ladungsveränderungen während einer Erregung erfolgen. Sie belegen auch,
dass die erforderlichen Na/K- und Na/Ca-Transporte durch die
Zellmembran mit relativ geringem metabolischem Aufwand zu bewältigen
sind.
 Nach
etwa einer Millisekunde im depolarisierten Zustand verändert sich die
Gestalt des Kanals wiederum: Ein anderer Teil des Porenkomplexes legt
sich in die Öffnung und "inaktiviert" (verschließt) den Kanal (Verschluss der Pore durch das Inaktivierungsmotiv,
Nach
etwa einer Millisekunde im depolarisierten Zustand verändert sich die
Gestalt des Kanals wiederum: Ein anderer Teil des Porenkomplexes legt
sich in die Öffnung und "inaktiviert" (verschließt) den Kanal (Verschluss der Pore durch das Inaktivierungsmotiv,  Abbildung), der Natriumeinstrom versiegt. Das Natrium-Gleichgewichtspotential (+70 mV) wird nicht erreicht, die Spitze des Aktionspotentials liegt bei +30 bis +40 mV.
Abbildung), der Natriumeinstrom versiegt. Das Natrium-Gleichgewichtspotential (+70 mV) wird nicht erreicht, die Spitze des Aktionspotentials liegt bei +30 bis +40 mV.
Erst wenn die Zelle repolarisiert (was auf Grund der langen
Refraktärzeit einige Zehntelsekunden dauert), stellt sich die
"geschlossene" Konformation wieder ein, die im Gegensatz zur
"inaktivierten" jederzeit wieder durch Depolarisierung beendet werden
kann.

Der Natriumkanalblocker
Lidocain - der üblicherweise zur Lokalanästhesie angewendet wird - wirkt auch antiarrhythmisch
am Herzen. Lidocain bindet in der Phase 0 des
Herzmuskelaktionspotentials an einige der offenen Natriumkanäle und
blockiert sie vorübergehend. Lidocain
dissoziiert von den Kanälen rasch genug, dass diese beim nächsten
regulären Aktionspotential wieder frei sind; aber nicht so rasch, dass
dies auch bei verfrühten Erregungen der Fall wäre - daher der
rhythmusstabilisierende Effekt.
Weitere Ionenkanäle
Herzmuskelzellen exprimieren eine breite Palette an Ionenkanälen - diese sind z.T. nach bevorzugten Ionen benannt, z.T. nach ihrem Verhalten (z.B. Kir = inward rectifyer potassium channel, TO = transient outward potassium channel) und der Ionenstrom entsprechend mit dem Buchstaben "i" (z.B. iKir, iTO etc). Auffallend ist die hohe Anzahl an Kaliumkanälen (Kir, TO, Ks, Kr, Kur etc). Wie die  Abbildung zeigt,
lassen diese Kanäle im Laufe eines Aktionspotentials bestimmte Ionen zu
unterschiedlichen Zeiten (und unterschiedlich stark) durch die
Zellmembran strömen:
Abbildung zeigt,
lassen diese Kanäle im Laufe eines Aktionspotentials bestimmte Ionen zu
unterschiedlichen Zeiten (und unterschiedlich stark) durch die
Zellmembran strömen:
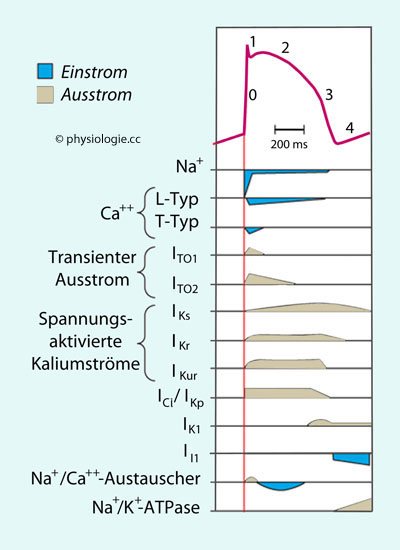
 Abbildung: Aktionspotential und Ionenströme in Myokardzellen (Synposis)
Abbildung: Aktionspotential und Ionenströme in Myokardzellen (Synposis)
Nach einer Vorlage bei Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
Phase 0: Bei Überschreiten des Schwellenwertes strömt Na+ durch spannungssensitive Natriumkanäle ein.
Zentrale Sinusknotenzellen exprimieren diesen Kanal nicht - im Sinusknoten strömt Ca++
durch L-Typ-Calciumkanäle ein, was langsamere Depolarisierung bewirkt.
 Phase 1: Die Natriumkanäle schließen wieder, transienter Kalium-Ausstrom (ITO: transient outward current) wirkt leicht repolarisierend (early repolarization). Durch L-Typ Ca++-Kanäle strömt Ca++ ein.
Phase 1: Die Natriumkanäle schließen wieder, transienter Kalium-Ausstrom (ITO: transient outward current) wirkt leicht repolarisierend (early repolarization). Durch L-Typ Ca++-Kanäle strömt Ca++ ein.
In der Plateauphase (Phase 2) halten sich depolarisierende (L-Typ Ca++-Kanäle) und repolarisierende Ströme (IKr, IKs)
für 200-400 ms etwa die Waage (zum Vergleich: Aktionspotentiale von
Nerven- oder Skelettmuskelzellen dauern 1-4 ms). Das Membranpotential
ist leicht negativ (0 bis -20 mV)
In Phase 3 (Repolarisierungsphase) überwiegt der (repolarisierende) Kalium-Ausstrom; die Ca++-Kanäle sind inaktiviert. Mehrere Kaliumkanäle wirken zusammen, die als transient-outward (TO), ultra-rapid (ur), rapid (r) und slow (s) delayed-rectifier bezeichnet werden.
Während des Aktionspotentials eingeströmtes Natrium und Calcium wird durch Na+/K+-ATPase und Na+-Ca++-Austauscher aus der Zelle entfernt.
Phase 4: In
Schrittmacherzellen bewirkt ein durch Hyperpolarisation aktivierter
"Schrittmacherstrom" (If) Natrium- und Kaliumeinstrom und damit
spontane Depolarisierung. Dieser
Mechanismus fehlt im Arbeitsmyokard, dessen Ruhepotential stabil ist
 Die folgende Tabelle vergleicht beispielhaft myokardiale
Die folgende Tabelle vergleicht beispielhaft myokardiale  Ionenkanäle und ihre funktionelle Bedeutung:
Ionenkanäle und ihre funktionelle Bedeutung:
Kanal
|
Gating- Mechanismus
|
Strom
|
Funktion
|
K+ (inward rectifier)
|
Potential
|
IirK1
oder I
|
Erhält hohe Kaliumpermeabilität in Phase 4.
Abfall trägt zu diastolischer Depolarisierung bei.
In Phase 0 bis 2 unterdrückt (Beitrag zu Plateau)
|
Na+ (fast): Rascher Natriumkanal an Nicht-
Schrittmacherzellen
|
Potential
|
INa
|
Phase 0 des Aktionspotentials
|
K+ (transient outward) Nicht-
Schrittmacherzellen |
Potential
|
Ito
|
Beitrag zu Phase 1 des Aktionspotentials |
Ca++ (slow inward, L-Typ)
Langsamer, langanhaltender Einstrom
|
Beides
|
ICa-L
|
Beitrag zu Phase 2 des Aktionspotentials von Nicht-
Schrittmacherzellen.
Beitrag zu Phase 4 und 0 an Schrittmacherzellen.
Verstärkt durch Sympathikus / ß-adrenerge Substanzen
|
K+ (delayed rectifier)
|
Potential
|
IK
|
Bewirkt Phase 3 des Aktionspotentials.
Verstärkt durch erhöhtes intrazelluläres [Ca++]
|
K+ (ATP sensitiv)
|
Ligand
|
IKATP
|
Erhöht Kaliumpermeabilität bei niedrigem [ATP]
|
K+ (Acetylcholin-
aktiviert) |
Ligand
|
IKACh
|
Vermittelt parasympathische
Reduziert diastolische Depolarisierung und Herzfrequenz.
Erhöht Ruhepotential.
Verkürzt Phase 2 des Aktionspotentials Effekte (cholinerg). |
Na+, Ca++, K+
(Langsamer Na+- bzw. HCN-Kanal: Schrittmacherwirkung)
|
Beides
|
If
(funny)
|
Aktiviert durch Hyperpolarisierung und zyklische Nukleotide.
Trägt zu diastolischer Depolarisierung bei.
Verstärkt durch Sympathikus / ß-adrenerge Substanzen.
Durch parasympathischen
Einfluss abgeschwächt
|

 Modifiziert nach Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Modifiziert nach Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Aktionspotential einer Arbeitsmuskelzelle
 Depolarisationsphase ("Aufstrich"): In der ersten Phase (Phase 0) des Aktionspotentials
erfolgt - nach einer Depolariation auf ein kritisches Potential von -55 bis -65 mV (Schwellenpotential) - im Arbeitsmyokard rascher Natriumeinstrom (iNa) durch spannungsgesteuerte Na+-Kanäle
(wie bei Nervenfasern)
und explosionsartige Depolarisation ("Alles-oder-Nichts"). Dabei steigt
die Leitfähigkeit der Membran für Natriumionen etwa 100-fach an, es kommt zu kurzzeitiger "Umpolung" der Zelle. Der
Wert des Natrium-Gleichgewichtspotentials
von +70 mV (Nernst-Gleichung!) wird nicht erreicht, weil auch ein Kalium-Gegenstrom besteht - der Höchstwert des Membranpotentials für ein Leifähigkeitsverhältnis Na/K von 10:1 wäre +55 mV -, inactivation gates der Natriumkanäle schließen und der Natriumeinstrom rasch
wieder erlischt.
Depolarisationsphase ("Aufstrich"): In der ersten Phase (Phase 0) des Aktionspotentials
erfolgt - nach einer Depolariation auf ein kritisches Potential von -55 bis -65 mV (Schwellenpotential) - im Arbeitsmyokard rascher Natriumeinstrom (iNa) durch spannungsgesteuerte Na+-Kanäle
(wie bei Nervenfasern)
und explosionsartige Depolarisation ("Alles-oder-Nichts"). Dabei steigt
die Leitfähigkeit der Membran für Natriumionen etwa 100-fach an, es kommt zu kurzzeitiger "Umpolung" der Zelle. Der
Wert des Natrium-Gleichgewichtspotentials
von +70 mV (Nernst-Gleichung!) wird nicht erreicht, weil auch ein Kalium-Gegenstrom besteht - der Höchstwert des Membranpotentials für ein Leifähigkeitsverhältnis Na/K von 10:1 wäre +55 mV -, inactivation gates der Natriumkanäle schließen und der Natriumeinstrom rasch
wieder erlischt.
Rasche Depolarisation von Kardiomyozyten ("Aufstrich" des Aktionspotentials) beruht im Arbeitsmyokard auf einem Einstrom von Na+ durch spannungsabhängige Na+-Kanäle
|
Etwa 10 Millisekunden nach Auftreten der Phase 0 beginnt sich der Myozyt zu kontrahieren.
Die Zellen des Sinusknotens und AV-Knotens exprimieren keine Natriumkanäle; hier strömt Ca++
durch spannungsgesteuerte Calciumkanäle (L-Typ-Ca++-Kanäle) ein, was langsamere Depolarisierung bewirkt (s. Phase 1); die Phase der raschen Na+-betriebenen Depolarisierung fehlt hier.

 Abbildung: Aktionspotential einer Arbeitsmuskelzelle (fast-response)
Abbildung: Aktionspotential einer Arbeitsmuskelzelle (fast-response)
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Typische Verläufe des Membranpotentials (rot)
und der Leitfähigkeiten für Natrium-, Calcium- und Kaliumionen
(blauviolett) in subepikardialen Myozyten und Purkinje-Fasern.
Explosiver Natriumeinstrom verursacht rasche
Depolarisierung (Phase 0), protrahierter Eintrom von Calciumionen in
das Sarkoplasma die Plateauphase (Phase 2), komplette "Erholung" des
Kaliumausstroms die abschließende Repolarisation (Phase 3). Die
Leitfähigkeitskurve für Kaliumionen entspricht der Summe der
Öffnungswahrscheinlichkeiten der verschiedenen Kaliumkanäle in der
Zellmembran (vgl.  Abbildung oben).
Abbildung oben).
Kaliumausstrom durch transient geöffnete Kaliumkanäle bewirkt eine
frühe partielle Repolarisierung nach der Spitze des Aktionspotentials
(Phase 1)
 Anschließend ("Spitze" des Aktionspotentials) werden die Natriumkanäle (und/oder Calciumkanäle) inaktiviert, der Einstrom von Na+ kommt zum Stillstand. Diese Inaktivierung ist der führende Beitrag zum Zustandekommen der Phase 1 und bewirkt (wenn vorhanden) eine erste kurze Repolarisation (Phase 1) (
Anschließend ("Spitze" des Aktionspotentials) werden die Natriumkanäle (und/oder Calciumkanäle) inaktiviert, der Einstrom von Na+ kommt zum Stillstand. Diese Inaktivierung ist der führende Beitrag zum Zustandekommen der Phase 1 und bewirkt (wenn vorhanden) eine erste kurze Repolarisation (Phase 1) ( Abbildung).
Kalium- und Chloridionen können sich weiterhin durch die Membran bewegen - Kalium durch TO-Kanäle (transient outward) aus der Zelle, Chlorid durch Chloridkanäle in die Zelle; dies trägt zur Entstehung der Phase 1 bei. Subepikardiale und Purkinje-Zellen zeigen eine ausgeprägte Phase 1.
Abbildung).
Kalium- und Chloridionen können sich weiterhin durch die Membran bewegen - Kalium durch TO-Kanäle (transient outward) aus der Zelle, Chlorid durch Chloridkanäle in die Zelle; dies trägt zur Entstehung der Phase 1 bei. Subepikardiale und Purkinje-Zellen zeigen eine ausgeprägte Phase 1.
Subepikardiale Myozyten exprimieren mehr iTO-Kanäle als subendokardiale, was ihr Aktionspotential (im Vergleich zu subendokardialen) verkürzt; exprimieren Myozyten weniger iTO-Kanäle, nimmt die Dauer ihrer Aktionspotentiale zu.
 Plateauphase (Phase 2): Verzögerte Repolarisation. Synchron mit dem explosiven Einstrom von Na+ (Phase 0) beginnt auch der Einstrom von Ca++ durch L-Typ-Ca++-Kanäle (DHPR: Dihydropyridinrezeptoren), die besonders dicht in transversalen Tubuli vertreten sind. Dieser Calciumstrom ICa
erreicht schon in Phase 1 etwa 40% seines Maximums. Sein Betrag ist
niedriger als derjenige durch rasche Natriumkanäle, aber gerade groß
genug, um den Effekt des Kaliumausstroms aus der Zelle zu kompensieren;
das Membranpotential bleibt nahe 0 mV stabilisiert (Plateau). Während Na+-Kanäle nach ihrer explosiven Öffnung innerhalb weniger Millisekunden wieder verschlossen sind, erreicht der Ca++-Einstrom
sein Maximum nach 2-7 ms und bleibt dann lange erhalten, wenn auch mit
sinkender Tendenz - die Kanäle inaktivieren nur langsam, das Plateau kann 200-400 ms dauern.
Plateauphase (Phase 2): Verzögerte Repolarisation. Synchron mit dem explosiven Einstrom von Na+ (Phase 0) beginnt auch der Einstrom von Ca++ durch L-Typ-Ca++-Kanäle (DHPR: Dihydropyridinrezeptoren), die besonders dicht in transversalen Tubuli vertreten sind. Dieser Calciumstrom ICa
erreicht schon in Phase 1 etwa 40% seines Maximums. Sein Betrag ist
niedriger als derjenige durch rasche Natriumkanäle, aber gerade groß
genug, um den Effekt des Kaliumausstroms aus der Zelle zu kompensieren;
das Membranpotential bleibt nahe 0 mV stabilisiert (Plateau). Während Na+-Kanäle nach ihrer explosiven Öffnung innerhalb weniger Millisekunden wieder verschlossen sind, erreicht der Ca++-Einstrom
sein Maximum nach 2-7 ms und bleibt dann lange erhalten, wenn auch mit
sinkender Tendenz - die Kanäle inaktivieren nur langsam, das Plateau kann 200-400 ms dauern.
Die Länge des
Herzmuskel-Aktionspotentials sowie die
Kontraktion selbst hängen wesentlich vom langsamen Calciumeinstrom (ICa) in die Zelle ab. Dieser stimuliert die Freisetzung von Ca++ aus dem sarkoplasmatischen Retikulum (durch Ryanodinrezeptor-Kanäle), dies unterhält die elektromechanische Kopplung und damit den Herzschlag. Katecholamine erhöhen den Ca++-Einstrom
und intensivieren so den Herzschlag; das Aktionspotential einer
Einzelzelle zeigt dabei eine Positivierung ("Buckel") der Plateauphase.
|
In der Plateauphase öffnen spannungsgesteuerte L-Typ- Ca++-Kanäle. Hemmung dieser Kanäle verkürzt die Plateauphase des Aktionspotentials
|
Zytoplasmatisches Ca++ wird durch eine Ca++-ATPase in das sarkoplasmatische Retikulum zurückgepumpt. Gleichzeitig fördert ein Na+/Ca++-Austauscher - angetrieben durch den Natriumgradienten - Ca++ aus der Zelle: 1 Ca++ wird gegen 3 Na+ getauscht (elektrogen). Gleichzeitige Aktivität der Na/K-ATPase wirkt in Richtung Neutralisation dieses elektrogenen Effekts (vgl.  Abbildung oben).
Abbildung oben).
Der - durch das erhöhte sarkoplasmatische [Ca++] angetriebene - Natriumeinstrom in der späten Phase 2 hilft das "Plateau" des Aktionspotentials zu erhalten, während die Leitfähigkeit der L-Typ-Ca++-Kanäle stetig abnimmt.
 L-Typ-Ca++-Kanäle werden durch Ca++-Kanalblocker
("Calciumblocker", "Calciumantagonisten") wie Verapamil, Diltiazem oder
Dihydropyridin teilweise inaktiviert. Diese Stoffgruppe wird zur Schonung des Myokards
eingesetzt, z.B. bei Durchblutungsstörungen (Angina pectoris) oder
Bluthochdruck.
L-Typ-Ca++-Kanäle werden durch Ca++-Kanalblocker
("Calciumblocker", "Calciumantagonisten") wie Verapamil, Diltiazem oder
Dihydropyridin teilweise inaktiviert. Diese Stoffgruppe wird zur Schonung des Myokards
eingesetzt, z.B. bei Durchblutungsstörungen (Angina pectoris) oder
Bluthochdruck.
Während der Phasen 1 und 2 ist die Herzmuskelzelle absolut refraktär (unerregbar). Die Dauer der Refraktärperiode
hängt von der jeweiligen Ausstattung mit - und Interaktion von
- Ionenkanälen ab. Sie reduziert sich mit steigender Herzfrequenz
(Sympathikuswirkung: Beschleunigung des Kaliumausstroms, s. unten). Am
Ende der Refraktärzeit ist der Myozyt dabei, zu relaxieren (der
Herzmuskel ist "untetanisierbar", was für seine Funktion als Pumpe
entscheidend ist).
 In der Plateauphase werden depolarisierende Ionenströme (Ca++-Einstrom, Na+/Ca++-Antiporter) durch K+-Ströme aus der Zelle ausbalanciert. Im depolarisierten Zustand ist der Kaliumstrom IKir durch die "delayed-rectifier"-Kaliumkanäle
- durch Anlagerung von Magnesiumionen und Polyaminen an der
Kanalinnenseite - ohnehin reduziert; auf diese Weise wird die Zahl der
ausströmenden K+- und einströmenden Ca++-Ionen während der lange dauernden Phase 2 gering gehalten und damit Energie gespart.
In der Plateauphase werden depolarisierende Ionenströme (Ca++-Einstrom, Na+/Ca++-Antiporter) durch K+-Ströme aus der Zelle ausbalanciert. Im depolarisierten Zustand ist der Kaliumstrom IKir durch die "delayed-rectifier"-Kaliumkanäle
- durch Anlagerung von Magnesiumionen und Polyaminen an der
Kanalinnenseite - ohnehin reduziert; auf diese Weise wird die Zahl der
ausströmenden K+- und einströmenden Ca++-Ionen während der lange dauernden Phase 2 gering gehalten und damit Energie gespart.
 Die Bedeutung von Ca++-Ionen für die Herzfunktion wurde zufällig im Labor des britischen Physiologen und Pharmakologen Sidney Ringer (berühmt vor allem durch die nach ihm benannte Ringer-Lösung,
die neben Natrium- und Kalium- auch Calciumchlorid enthält) entdeckt (damit beim Ansetzen der Ringer‐Lösung keine Eintrübung
erfolgt - Calciumhydroxid‐Fällung -, kommt es wesentlich auf die
Reihenfolge zur Mischung der Komponenten an):
Statt destilliertem Wasser verwendete sein Assistent bei der
Zubereitung von NaCl- und KCl-Lösungen Leitungswasser, dessen [Ca++]
ähnlich hoch wie im Blut ist (die Beobachtung erfolgte in einem Labor
in London).
Die Bedeutung von Ca++-Ionen für die Herzfunktion wurde zufällig im Labor des britischen Physiologen und Pharmakologen Sidney Ringer (berühmt vor allem durch die nach ihm benannte Ringer-Lösung,
die neben Natrium- und Kalium- auch Calciumchlorid enthält) entdeckt (damit beim Ansetzen der Ringer‐Lösung keine Eintrübung
erfolgt - Calciumhydroxid‐Fällung -, kommt es wesentlich auf die
Reihenfolge zur Mischung der Komponenten an):
Statt destilliertem Wasser verwendete sein Assistent bei der
Zubereitung von NaCl- und KCl-Lösungen Leitungswasser, dessen [Ca++]
ähnlich hoch wie im Blut ist (die Beobachtung erfolgte in einem Labor
in London).

Der Effekt war, dass isolierte Herzpräparate viel länger
schlugen als bei Verwendung einer calciumfreien Flüssigkeit. Erst
später erkannte man die Bedeutung extrazellulären Calciums für die
elektromechanische Kopplung im Herzen (transversales Tubulussystem).
 Endgültige Repolarisation (Phase 3): Schließlich kommt es zu
verstärktem Kaliumausstrom durch "untraschnelle" (Kur: ultra-rapid), "schnelle" (Kr: rapid) und "langsame" (Ks: slow) Kaliumkanäle bei gleichzeitig versiegendem Ca++-Einstrom. Später kommen noch weitere Kaliumkanäle dazu, wie KP (p für Plateau) oder K1. Auch ein Chloridkanal (KCl)
mischt mit - Chlorideinstrom trägt zur Repolarisierung bei.
Endgültige Repolarisation (Phase 3): Schließlich kommt es zu
verstärktem Kaliumausstrom durch "untraschnelle" (Kur: ultra-rapid), "schnelle" (Kr: rapid) und "langsame" (Ks: slow) Kaliumkanäle bei gleichzeitig versiegendem Ca++-Einstrom. Später kommen noch weitere Kaliumkanäle dazu, wie KP (p für Plateau) oder K1. Auch ein Chloridkanal (KCl)
mischt mit - Chlorideinstrom trägt zur Repolarisierung bei.
Die Repolarisierung erfolgt durch Ausstrom von K+, Hemmung des Ca++-Einstroms sowie Einstrom von Cl-
|
Die Membran repolarisiert sich zum Ruhepotential
("Abstrich") und die Zelle ist wieder erregbar: Ab -50 mV
Membranpotential wechseln einige der "schnellen" Natriumkanäle vom
"inaktivierten" zum "geschlossenen" (und damit aktivierbaren) Zustand
zurück. (Da einige Kanäle noch nicht aktivierbar sind, bedarf es
während der relativen Refraktärperiode eines verstärkten Reizes, um die
Zelle zu erregen.)
 Phase 4 entspricht der "elektrischen Diastole" und wird auch als diastolisches Potential bezeichnet.
Phase 4 entspricht der "elektrischen Diastole" und wird auch als diastolisches Potential bezeichnet.
Im Arbeitsmyokard ist dies ein stabiles Ruhepotential, das erst durch die Ankunft einer Erregungswelle unterbrochen wird. In
Schrittmacherzellen tritt zunächst ein maximales diastolisches Potential auf (am stärksten vom Nullpotential entfernt). Dieses ist der Startpunkt der darauf folgenden spontanen langsamen Depolarisierung, bewirkt durch einen "Schrittmacher-Kaliumeinstrom" (If). Einer der verantwortlichen Kanäle ist der durch zyklische Nukleotide angeregte HCN-Kanal, der sowohl für Na+ als auch für K+ durchgängig ist. Auch fehlen Schrittmacherzellen inward-rectifier-Kaliumkanäle, die im Arbeitsmyokard das Ruhepotential stabilisieren.
Am Ende der Repolarisationsphase sorgen Ca++-Pumpen (ATPasen) für den Rücktransport von Calciumionen in das sarkoplasmatische Retikulum sowie Na/Ca-Antiporter (Austauscher) NCX für die Entfernung von Ca++ aus der Zelle.
Ein Na+/Ca++-Antiporter befördert zum Schluss der Repolarisation Calcium aus der Zelle
|

 Abbildung: Aktionspotential, intrazelluläre Calciumkonzentration und Kontraktionskraft einer Arbeitsmyokardzelle
Nach Scoote Ml, Poole-Wilson PA, Williams AJ. The
therapeutic potential of new insights into myocardial
excitation-contraction coupling. Heart 2003; 89: 371-6
Abbildung: Aktionspotential, intrazelluläre Calciumkonzentration und Kontraktionskraft einer Arbeitsmyokardzelle
Nach Scoote Ml, Poole-Wilson PA, Williams AJ. The
therapeutic potential of new insights into myocardial
excitation-contraction coupling. Heart 2003; 89: 371-6
Die Verfügbarkeit freien Calciums (rot)
nimmt während der Refraktärperiode laufend ab. Elektromechanische
Kopplung und Kraftentwicklung erfolgen in der Frühphase der Systole am
effizientesten.
Calciuminduzierte Calciumfreisetzung (CICR) durch die Wand des
sarkoplasmatischen Retikulums erfolgt durch Calciumkanäle namens
Ryanodinrezeptoren (RyR). Mehrere RyRs bilden jeweils Cluster in der
Membran, vor allem in der Nähe von L-Typ Calciumkanälen in der Wand
transversaler Tubuli. Diese werden durch Depolarisierung geöffnet und
triggern an benachbarten RyR-Clustern sogenannte Calciumfunken ("Calcium sparks"). Die synchronisierte Freisetzung mehrerer Calcium sparks löst einen intrazellulären Anstieg des [Ca++] aus, der groß genug für eine Kontraktion ist
 Die während eines Aktionspotentials über die Membran ausgetauschte Menge an Natrium- und Kaliumionen ist sehr gering ([Na+] in der Zelle steigt um ~0,02%, [K+] sinkt um ~0,001%
der in der Zelle enthaltenen Menge). Die Na/K-Pumpe läuft
kontinuierlich und stabilisiert die zellulären Ionenkonzentrationen.
Die während eines Aktionspotentials über die Membran ausgetauschte Menge an Natrium- und Kaliumionen ist sehr gering ([Na+] in der Zelle steigt um ~0,02%, [K+] sinkt um ~0,001%
der in der Zelle enthaltenen Menge). Die Na/K-Pumpe läuft
kontinuierlich und stabilisiert die zellulären Ionenkonzentrationen.
Dauer des Aktionspotentials: Insgesamt dauert das gesamte Aktionspotential bei niedriger
Herzfrequenz (Ruhezustand) ~350 ms, bei hoher Frequenz (Aufregung,
Muskelarbeit, Hitzeeinwirkung) weniger als 200 ms.
 Erhöhter Sympathikustonus
steigert den repolarisierenden Kaliumausstrom
und verkürzt das Aktionspotential. Das ist notwendig, um Zeit für
höhere Schlagfrequenzen einzusparen (positive Chronotropie /
Tachykardie bei Belastung). Dies erfolgt durch Phosphorylierung der
Kaliumkanäle, was den repolarisierenden Kaliumausstrom anregt und die
Dauer des Plateaus verkürzt.
Erhöhter Sympathikustonus
steigert den repolarisierenden Kaliumausstrom
und verkürzt das Aktionspotential. Das ist notwendig, um Zeit für
höhere Schlagfrequenzen einzusparen (positive Chronotropie /
Tachykardie bei Belastung). Dies erfolgt durch Phosphorylierung der
Kaliumkanäle, was den repolarisierenden Kaliumausstrom anregt und die
Dauer des Plateaus verkürzt.
 Hypokaliämie reduziert den Kaliumausstrom durch Kr und stört so die Repolarisationsphase (EKG: ST-Senkung, T-Welle abgeflacht, evt. U-Welle).
Hypokaliämie reduziert den Kaliumausstrom durch Kr und stört so die Repolarisationsphase (EKG: ST-Senkung, T-Welle abgeflacht, evt. U-Welle).
 Ischämie / Hypoxie verkürzt die Dauer des Aktionspotentials ebenfalls durch Öffnung von KATP-Kanälen.
Ischämie / Hypoxie verkürzt die Dauer des Aktionspotentials ebenfalls durch Öffnung von KATP-Kanälen.
 Defekte Ionenkanäle (Natrium, Kalium) können eine Verlängerung der QT-Zeit (Long-QT-Syndrom) und Herzrhythmusstörungen bewirken.
Defekte Ionenkanäle (Natrium, Kalium) können eine Verlängerung der QT-Zeit (Long-QT-Syndrom) und Herzrhythmusstörungen bewirken.
Die Refrakterität (Unerregbarkeit) der Herzmuskelzellen gliedert sich in folgende Phasen:
 Im inaktiven Zustand (s. oben) sind Natriumkanäle auch bei stärksten Reizen nicht aktivierbar, die Zelle ist absolut refraktär (Phase 0 bis Beginn der Phase 3).
Im inaktiven Zustand (s. oben) sind Natriumkanäle auch bei stärksten Reizen nicht aktivierbar, die Zelle ist absolut refraktär (Phase 0 bis Beginn der Phase 3).
 In der Übergangsphase zwischen 100% inaktiven und 100% wieder
"erholten" Natriumkanälen - also während des späten Aktionspotentials -
ist die Zelle relativ refraktär (späte Phase 3).
Aktionspotentiale sind in diesem Zustand zwar auslösbar, aber sie
dauern kürzer und ihre Anstiegsflanke ist flacher also sonst.
In der Übergangsphase zwischen 100% inaktiven und 100% wieder
"erholten" Natriumkanälen - also während des späten Aktionspotentials -
ist die Zelle relativ refraktär (späte Phase 3).
Aktionspotentiale sind in diesem Zustand zwar auslösbar, aber sie
dauern kürzer und ihre Anstiegsflanke ist flacher also sonst.
Der Sinn der langen Refrakterität der Herzmuskelzellen besteht darin,
dass dadurch ein Schutz des synchronisierten Kontraktionsablaufes
(Vorhöfe, dann Ventrikel) gegeben und eine Störung der geordneten
Pumpwirkung (durch allfällige zusätzliche Reizung während der Systole)
möglichst ausgeschlossen ist.
Aktionspotential einer Schrittmacherzelle

 Abbildung: Aktionspotential einer Schrittmacherzelle
Modifiziert nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Abbildung: Aktionspotential einer Schrittmacherzelle
Modifiziert nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Die Abbildung zeigt den Ablauf der Phasen des Aktionspotentials einer autorhythmischen Herzmuskelzelle.
Langsame
Depolarisierung: Während der spontanen Depolarisation
(Schrittmacherpotential) stehen If-Kanäle offen, Natriumionen strömen
in die Zelle ein und depolarisieren sie. Am Ende dieses Vorgangs
schließen die If-Kanäle und öffnen einige Calciumkanäle.
Rasche Depolarisierung: Sobald die Reizschwelle erreicht ist, öffnen
sich Calciumkanäle und lassen zusätzlich Calciumionen einströmen
(Beginn des eigentlichen Aktionspotentials), was die Membran bis über
die Nulllinie hinaus depolarisiert.
An der Spitze des Aktionspotentials schließen die Calcium- und öffnen
Kaliumkanäle, es kommt zum Ausstrom von Kaliumionen und zur
Repolarisierung.
Ist der höchste Spannungswert erreicht (Ende des Aktionspotentials),
schließen die Kaliumkanäle. If-Kanäle öffnen wieder, das Spiel beginnt
von neuem

Was löst einen Herzschlag aus?
Eingenschaften spontanaktiver Herzmuskelzellen  Sinusknoten
Sinusknoten  Nachgeschaltetes Erregungsleitungssystem
Nachgeschaltetes Erregungsleitungssystem
Das
Tempo der Entladung einer Herzmuskelzelle bestimmt wesentlich die
Geschwindigkeit der Erregungsausbreitung mit; so kann die
natriumbedingte Umpolung an Purkinjezellen (die auch einen besonders
großen Zelldurchmesser und damit geringen axialen elektrischen
Widerstand aufweisen) etwa 500 V/s betragen, d.h. sie können in kaum
mehr als einer Zehntel Millisekunde vollständig entladen sein
(Leitungsfunktion). Zellen des Sinus- oder AV-Knotens haben hingengen
langsame (calciumbetriebene) Aktionspotentiale und leiten die Erregung
entsprechend verzögert weiter; sie haben aber die lebenswichtige
Fähigkeit zur spontanen Depolarisierung (Schrittmacherfunktion).
Eigenschaften spontanaktiver Herzmuskelzellen: Die Zellen des Reizleitungs- bzw. "Erregungssystems"
(Sinusknoten, AV-Knoten) haben calciumbetriebene
Aktionspotentiale ( Abbildung). Sinusknotenzellen haben wesentlich weniger Kir-Kaliumkanäle als das umgebende Myokard, dafür verfügen sie über spannungsabhängige (delayed rectifier) Kaliumkanäle (Kv). Daher
erreicht das Membranpotential lediglich -50 bis -70 mV (Arbeitsmyokard -80
bis -90 mV) und ist instabil ("Schrittmacherpotential", pacemaker potential).
Abbildung). Sinusknotenzellen haben wesentlich weniger Kir-Kaliumkanäle als das umgebende Myokard, dafür verfügen sie über spannungsabhängige (delayed rectifier) Kaliumkanäle (Kv). Daher
erreicht das Membranpotential lediglich -50 bis -70 mV (Arbeitsmyokard -80
bis -90 mV) und ist instabil ("Schrittmacherpotential", pacemaker potential).
Die Steilheit
(slope) des Schrittmacherpotentials bestimmt den Zeitpunkt des Überschreitens
der Reizschwelle (die bei -40 bis -55 mV liegt: threshold potential)
und damit die Herzfrequenz (die mit zunehmender Steilheit der
Depolarisation ansteigt). Die "Neigung" des Schrittmacherpotentials
wird beeinflusst durch das Verhalten verschiedener Ionenkanäle in der Zellmembran - resultierend in abnehmendem Kaliumausstrom sowie wachsendem Natrium- bzw. Calciumeinstrom.
Vergleicht
man die Charakteristika von Arbeitsmyokardzellen mit denen von Schrittmacherzellen, dann
zeigen sich Unterschiede sowohl im Mechanismus der Depolarisation, als
auch in der Dauer der Aktionspotentiale ( Abbildung):
Abbildung):
 "Fast-response" -Myozyten werden durch blitzartigen Natriumeinstrom
depolarisiert, das erhöht die
Depolarisationsgeschwindigkeit und ermöglicht rasches Weiterleiten von
Erregungswellen.
"Fast-response" -Myozyten werden durch blitzartigen Natriumeinstrom
depolarisiert, das erhöht die
Depolarisationsgeschwindigkeit und ermöglicht rasches Weiterleiten von
Erregungswellen.
Außerdem ist ihre Depolarisation verlängert (Phase 2,
"Plateauphase"), was ihre Refrakterität verlängert und das Myokard vor
Unordnung beim Ablauf der Kontraktion schützt ("Untetanisierbarkeit").
 "Slow-response" -Myozyten hingegen werden durch Calciumeinstrom und
sinkenden Kaliumausstrom depolarisiert, und ihr Aktionspotential sieht
insgesamt runder aus; diese Zellen sind auf Spontandepolarisation
ausgerichtet (Schrittmachereigenschaft).
"Slow-response" -Myozyten hingegen werden durch Calciumeinstrom und
sinkenden Kaliumausstrom depolarisiert, und ihr Aktionspotential sieht
insgesamt runder aus; diese Zellen sind auf Spontandepolarisation
ausgerichtet (Schrittmachereigenschaft).
 Abbildung: Aktionspotential in Arbeitsmyokard und Schrittmacherzellen
Nach
Vorlagen bei Pappano / Wier, Cardiovascular Physiology, 11th ed, Mosby
2019 (oben) und Mohrman DE / Heller LJ, Cardiovascular
Physiology, 8th ed. McGraw Hill 2014 (unten)
Abbildung: Aktionspotential in Arbeitsmyokard und Schrittmacherzellen
Nach
Vorlagen bei Pappano / Wier, Cardiovascular Physiology, 11th ed, Mosby
2019 (oben) und Mohrman DE / Heller LJ, Cardiovascular
Physiology, 8th ed. McGraw Hill 2014 (unten)
Links: Fast-response-
Zellen
(Arbeitsmyocard, Purkinje-Fasern) zeigen einen überschießenden
Natriumeinstrom zu Beginn des
Aktionspotentials, ähnlich wie Nervenzellen. Zum Zeitpunkt b erfolgt
das Einstechen einer intrazellulären Registrierelektrode
(Mikropipette), zum Zeitpunkt c wird ein Aktionspotential ausgelöst,
getriggert durch explosiven Natriumeinstrom, der zu kurzfristiger
Umpolung der Zelle führt (1). Der anschließende Calciumeinstrom sowie der anhaltend niedrige Kaliumausstrom halten das
Membranpotential für einige Zehntelsekunden in der Nähe der Nulllinie
(2: Plateaubildung). Dadurch ist die Zelle während dieser Zeit unerregbar
(refraktär). Am Ende der Phase 3 kann vorübergehend eine vulnerable ("supranormale") Phase auftreten, in welcher die Kaliumpermeabilität noch erhöht unf der Myozyt besonders erregbar ist. Das folgende Ruhepotential in Phase 4 ist stabil.
Rechts: Slow-response-
Zellen
(Sinusknoten, AV-Knoten) haben ein instabiles Membranpotential in Phase
4; die
Kaliumpermeabilität sinkt, diejenige für Natrium steigt, bis das
Membranpotential von selbst zusammenbricht. Der explosive
Natriumeinstrom (wie bei Fast response-Zellen) fehlt; die Entladung
(Phase 0) ist
stattdessen im Wesentlichen durch den Calciumeinstrom getragen. Solche
Permeabilitäts- bzw. Potentialverläufe sind für Schrittmacherzellen
typisch.
ARP = absolute Refraktärperiode, RRP = relative Refraktärperiode

Spannungsabhängige Ionenkanäle (voltage gated ion channels) fungieren als Spannungssensoren. Ihre Öffnungswahrscheinlichkeit
ist abhängig von
 dem aktuellen Membranpotential
dem aktuellen Membranpotential

 den
intra / extrazellulären Ionenkonzentrationen
den
intra / extrazellulären Ionenkonzentrationen

 der Anwesenheit zyklischer
Nukleotide an Schrittmacherpermeasen
der Anwesenheit zyklischer
Nukleotide an Schrittmacherpermeasen

 dem
Phosphorylierungsgrad von Calciumkanälen
dem
Phosphorylierungsgrad von Calciumkanälen
Infolge der speziellen Ausstattung der Membran mit Ionenkanälen kommt es zu spontaner Depolarisation: Die Leitfähigkeit für K+-Ionen nimmt ab, die für Na+- und Ca++-Ionen zu (Schrittmacherpotential), bis das Schwellenpotential erreicht ist und ein Aktionspotential auftritt - ohne äußere Reize (Autorhythmie).
Lage und
Abfolge der Potentiale und Erregungsphasen unterscheiden sich im
Schrittmachergewebe in mehreren Aspekten vom Arbeitsmyokard:
 Niedrigeres Ruhepotential (-50 bis -60 mV im Sinusknoten, -80 bis -90 mV im Arbeitsmyokard)
Niedrigeres Ruhepotential (-50 bis -60 mV im Sinusknoten, -80 bis -90 mV im Arbeitsmyokard)

 Calcium- statt raschem Natriumeinstrom bei Aktionspotentialbeginn
Calcium- statt raschem Natriumeinstrom bei Aktionspotentialbeginn
 Spontane Depolarisation in Phase 4 (Schrittmacherstom If)
Spontane Depolarisation in Phase 4 (Schrittmacherstom If)
Im Detail:
Nach einem vorausgegangenen Aktionspotential wird ein maximaler Membranpotentialwert (bei Zellen des Erregungssystems -50 bis -70 mV) erreicht.
 Spontane Depolarisierung: Anschließend kommt es zu Veränderung des Zustands mehrerer Ionenkanalsysteme:
Spontane Depolarisierung: Anschließend kommt es zu Veränderung des Zustands mehrerer Ionenkanalsysteme:
 Allmähliche Inaktivierung des Kv-Kanals (delayed rectifier voltage-activated potassium channel) und Abnahme des K+-Ausstroms iK. Durch diesen Kanal erfolgt auch die Repolarisierung am Ende der Erregung
Allmähliche Inaktivierung des Kv-Kanals (delayed rectifier voltage-activated potassium channel) und Abnahme des K+-Ausstroms iK. Durch diesen Kanal erfolgt auch die Repolarisierung am Ende der Erregung
 Geringgradiger Na+-Einstrom ib (background current), in manchen Sinusknotenzellen außerdem via - durch Hyperpolarisierung aktivierbare - funny channels (if). Diese nukleotidregulierten (cAMP) unspezifischen Kationenkanäle ("schrittmacheraktive" HCN-Kanäle) lassen in dieser Phase wegen der
Lage des Natrium-Gleichgewichtspotentials vor allem Natriumionen
durch die Membran eintreten, was die Zelle depolarisiert. ib und if tragen zum frühen Anteil der spontanen Depolarisierung bei
Geringgradiger Na+-Einstrom ib (background current), in manchen Sinusknotenzellen außerdem via - durch Hyperpolarisierung aktivierbare - funny channels (if). Diese nukleotidregulierten (cAMP) unspezifischen Kationenkanäle ("schrittmacheraktive" HCN-Kanäle) lassen in dieser Phase wegen der
Lage des Natrium-Gleichgewichtspotentials vor allem Natriumionen
durch die Membran eintreten, was die Zelle depolarisiert. ib und if tragen zum frühen Anteil der spontanen Depolarisierung bei
 Na/Ca-Austauscher erzeugen einen Netto-Natriumeinstrom iNa-Ca (3Na+ gegen 1 Ca++), der zur zum späteren Anteil der spontanen Depolarisierung wesentlich beiträgt
Na/Ca-Austauscher erzeugen einen Netto-Natriumeinstrom iNa-Ca (3Na+ gegen 1 Ca++), der zur zum späteren Anteil der spontanen Depolarisierung wesentlich beiträgt
 Ab einem Membranpotential von -55 mV beginnt ein Ca++-Einstrom iCa durch Typ T-Calciumkanäle und bei weiterer Depolarisierung auch durch Typ L-Calciumkanäle.
Der Calciumeinstrom trägt zum letzten Drittel der spontanen
Depolarisierung bei und geht dann in das Aktionspotential über
Ab einem Membranpotential von -55 mV beginnt ein Ca++-Einstrom iCa durch Typ T-Calciumkanäle und bei weiterer Depolarisierung auch durch Typ L-Calciumkanäle.
Der Calciumeinstrom trägt zum letzten Drittel der spontanen
Depolarisierung bei und geht dann in das Aktionspotential über
 Bei Überschreiten des Schwellenpotentials (-40 bis -55 mV) entsteht ein Aktionspotential, das Ca++-betrieben ist. Der rasche Natriumeinstrom fehlt, das Aktionspotential ist relativ klein und rund.
Bei Überschreiten des Schwellenpotentials (-40 bis -55 mV) entsteht ein Aktionspotential, das Ca++-betrieben ist. Der rasche Natriumeinstrom fehlt, das Aktionspotential ist relativ klein und rund.
 Die
Repolarisation erfolgt via Kaliumausstrom (iK) durch aktivierte spannungsgesteuerte
Kaliumkanäle. Bei nunmehr geschlossenen Calciumkanälen wird das Ruhepotential wieder
erreicht, das Spiel (spontane Depolarisation...) beginnt von neuem.
Die
Repolarisation erfolgt via Kaliumausstrom (iK) durch aktivierte spannungsgesteuerte
Kaliumkanäle. Bei nunmehr geschlossenen Calciumkanälen wird das Ruhepotential wieder
erreicht, das Spiel (spontane Depolarisation...) beginnt von neuem.
Autorhythmie
Der Sinusknoten (Sinoatrialknoten, SA-node) ist ein ~20 mm langes und ~4 mm dickes spindelförmiges Gebilde aus kleinen, modifizierten Herzmuskelzellen (wenig
Myofibrillen, kein stabiles Membranpotential) in der dorsalen Wand des
rechten Vorhofs nahe am Ansatz der v. cava superior. Der Name leitet
sich aus dem Umstand ab, dass sich der Sinusknoten aus dem sinus
venosus entwickelt hat.
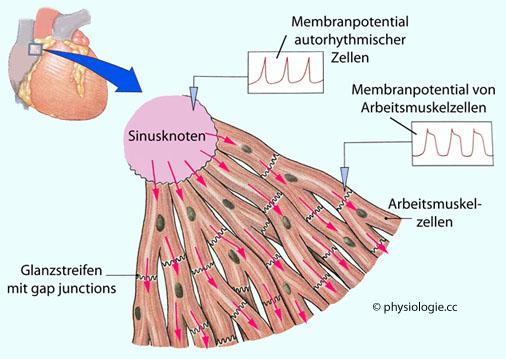

Abbildung: Vom Sinusknoten ausgehende Erregungsausbreitung
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Autorhythmische Zellen des Sinusknotens lösen
Aktionspotentiale aus, die sich über benachbartes kontraktiles Myokard
via gap junctions an Glanzstreifen ausbreiten
Einstrom von Ca++-Ionen (funny current If ) durch HCN-Kanäle
depolarisiert Schrittmacherzellen. Hemmung dieser Kanäle verlangsamt
die Schlagfrequenz des Herzens (negativ chronotrope Wirkung)
|
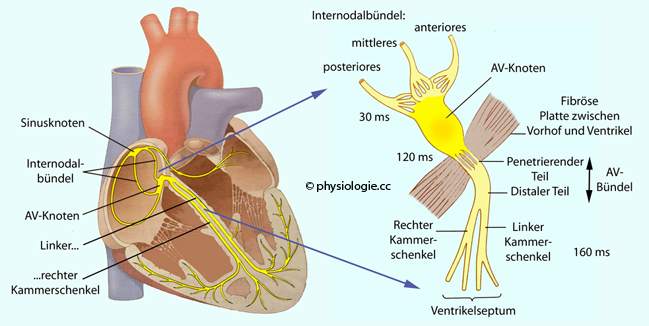
 Abbildung: Reizleitungssystem
Abbildung: Reizleitungssystem
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Links:
Reizleitungssystem vom Sinusknoten über die drei (vorderes, mittleres und hinteres) Internodalbündel
(internodal pathways)
zum AV-Knoten und von dort über AV-Bündel und
linken und rechten Kammerschenkel zu den Purkinje-Fasern. Eine direkte
Leitungsbahn vom rechten zum linken Vorhof (das aus dem gemeinsamen
Stamm mit dem vorderen Internodalbündel entspringende Bachmann-Bündel,
vgl. folgende Abbildung) ist ebenfalls dargestellt.
Rechts:
Gebiet um den AV-Knoten mit Afferenzen (Internodalbündel) und Efferenz
(AV-Bündel). Die Zahlen geben die gerundete Dauer (in Millisekunden)
an, die unter Ruhebedingungen vom Start der Erregungswelle aus dem
Sinusknoten bis zu ihrer Ankunft an der jeweiligen Stelle vergeht

 Erhöhte
Konzentration an Schilddrüsenhormonen steigert die Herzfrequenz. Auch die Körpertemperatur beeinflusst die Herzfrequenz: Pro °C Anstieg nimmt die Pulsfrequenz um ~8 Schläge pro Minute zu.
Erhöhte
Konzentration an Schilddrüsenhormonen steigert die Herzfrequenz. Auch die Körpertemperatur beeinflusst die Herzfrequenz: Pro °C Anstieg nimmt die Pulsfrequenz um ~8 Schläge pro Minute zu.
 Beim
Aufrichten des Körpers bzw. Aufstehen (orthostatische Reaktion) kommt es bereits zu einer
merklichen Zunahme der Herzfrequenz (um 10-20/min), bei
intensiverem Stress
- etwa im Rahmen von sportlicher Betätigung - kann der Puls bis zur
Belastungsgrenze zunehmen (Maximalpuls-Faustregel: 200 minus Alter in
Jahren).
Beim
Aufrichten des Körpers bzw. Aufstehen (orthostatische Reaktion) kommt es bereits zu einer
merklichen Zunahme der Herzfrequenz (um 10-20/min), bei
intensiverem Stress
- etwa im Rahmen von sportlicher Betätigung - kann der Puls bis zur
Belastungsgrenze zunehmen (Maximalpuls-Faustregel: 200 minus Alter in
Jahren).
 Neugeborene haben einen wesentlich höheren Ruhepuls (etwa 140
bpm, Kinder mit 10 Jahren noch ~90 bpm) als erweachsene Personen.
Neugeborene haben einen wesentlich höheren Ruhepuls (etwa 140
bpm, Kinder mit 10 Jahren noch ~90 bpm) als erweachsene Personen.
 Schon
1839 beschrieb der böhmische Physiologe Jan E. Purkinje Muskelfasern,
die der Erregungsleitung im Ventrikel dienen und nach ihm benannt
wurden. 1893 fand der Internist Wilhelm His das nach ihm benannte
Muskelbündel, das eine Erregungsübertragung von den Vorhöfen auf die
Ventrikel ermöglicht. 1907 beschrieben Arthur Keith und Martin Flack
erstmals den Sinusknoten. Keith nannte die von ihm gefundene Gruppe
spezialisierter Muskelfasern den sino-atrialen Knoten.
Schon
1839 beschrieb der böhmische Physiologe Jan E. Purkinje Muskelfasern,
die der Erregungsleitung im Ventrikel dienen und nach ihm benannt
wurden. 1893 fand der Internist Wilhelm His das nach ihm benannte
Muskelbündel, das eine Erregungsübertragung von den Vorhöfen auf die
Ventrikel ermöglicht. 1907 beschrieben Arthur Keith und Martin Flack
erstmals den Sinusknoten. Keith nannte die von ihm gefundene Gruppe
spezialisierter Muskelfasern den sino-atrialen Knoten.
Wie wird die Erregung über das Myokard verteilt?
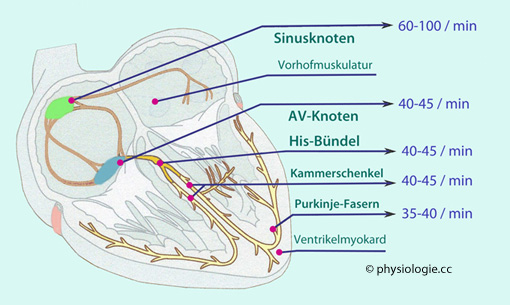
 Abbildung: Spontanentladungsfrequenzen im Reizleitungssystem
Nach einer Vorlage in Textbook of Cardiology (CardioNetworks.org)
Abbildung: Spontanentladungsfrequenzen im Reizleitungssystem
Nach einer Vorlage in Textbook of Cardiology (CardioNetworks.org)
Das Bild stellt
die spontanen Entladungsfrequenzen des Erregungsbildungs- /
Leitungssystems dar. Die Zellpopulation mit der höchsten
Entladungsfrequenz übernimmt die Schrittmacherfunktion (normalerweise
der Sinusknoten).
Zwischen Sinusknoten und AV-Knoten gibt es drei Vorzugswege der Erregungsübertragung (internodal pathways): Der vordere Bachmann-Pfad (ein Zweig davon - das Bachmann-Bündel - leitet Aktionspoptentiale zum linken Vorhof), der mittlere Wenckebach-Pfad und der posteriore Thorel-Pfad.

Erregungsbildungs- und -leitungssystem: Im Myokard breiten sich Aktionspotentiale über gap junctions (disci intercalares) aus,
an denen der elektrische Membranwiderstand auf ein Tausendstel des
üblichen Wertes reduziert ist. Auf diese Weise kann ein
überschwelliger Reizstrom von Zelle zu Zelle fließen und sich die
Erregung wie ein Lauffeuer über das Herzmuskelgewebe ausbreiten.
Die Geschwindigkeiten der Erregungsleitung sind sehr unterschiedlich - am geringsten in Sinus- und AV-Knoten, am höchsten im Bereich der Purkinje-Fasern (Tabelle):
Leitungsgeschwindigkeiten im Herzmuskel

Nach Boron / Boulpaep, Medical Physiology, Saunders 2003
|
Gewebe
|
Leitungsgeschwindigkeit
(m/s)
|
Sinusknoten
|
0,05
|
Vorhöfe
|
1
|
AV-Knoten
|
0,05
|
His-Bündel
|
1
|
Purkinje-Fasern
|
4
|
Ventrikel
|
1
|
 Im "klassischen" Physiologiepraktikum war die Durchführung der Stannius'schen Ligaturen
Im "klassischen" Physiologiepraktikum war die Durchführung der Stannius'schen Ligaturen  obligat (Hermann Stannius war ein deutscher Physiologe). Man legte am schlagenden Froschherzen zwischen Vorhof und Kammer mit
einem Zwirnfaden eine Schlinge; zog man die Schlinge komplett zu, hörte der
Ventrikel zu schlagen auf, da durch die Kompression des Myokards die
Überleitung der Aktionspotentiale vom Sinusknoten auf das
Reizleitungssystem der Kammern unterbrochen war.
obligat (Hermann Stannius war ein deutscher Physiologe). Man legte am schlagenden Froschherzen zwischen Vorhof und Kammer mit
einem Zwirnfaden eine Schlinge; zog man die Schlinge komplett zu, hörte der
Ventrikel zu schlagen auf, da durch die Kompression des Myokards die
Überleitung der Aktionspotentiale vom Sinusknoten auf das
Reizleitungssystem der Kammern unterbrochen war.
Nachdem
der Sinusknoten einen Impuls generiert hat, laufen Aktionspotentiale
über das umliegende Herzmuskelgewebe wie eine Welle von Muskelfaser zu
Muskelfaser. Folgende Zellen sind auf rasche Erregungsleitung
("Reizleitung") spezialisiert:
 Sinusknoten s. oben.
Sinusknoten s. oben.
 AV- (Aschoff-Tawara)-Knoten
AV- (Aschoff-Tawara)-Knoten  : Aktionspotentiale laufen (vom Sinusknoten ausgehend) über die Vorhofmuskulatur und treffen am
atrio-ventrikuläre Knoten ein. Dieser hat eine Eigenfrequenz
von 40-50/min; die spontane Depolarisation (Phase 4, s. oben) erfolgt
langsamer als in den Zellen des Sinusknotens. Normalerweise hat der
AV-Knoten daher keine
Schrittmacherfunktion, er wird jedesmal vom Sinusknoten "überholt",
bevor er selbst eine Erregung generiert hat.
: Aktionspotentiale laufen (vom Sinusknoten ausgehend) über die Vorhofmuskulatur und treffen am
atrio-ventrikuläre Knoten ein. Dieser hat eine Eigenfrequenz
von 40-50/min; die spontane Depolarisation (Phase 4, s. oben) erfolgt
langsamer als in den Zellen des Sinusknotens. Normalerweise hat der
AV-Knoten daher keine
Schrittmacherfunktion, er wird jedesmal vom Sinusknoten "überholt",
bevor er selbst eine Erregung generiert hat.
Der Grund
für die langsame Überleitung (~0,05-0,1 m/s) im AV-Knoten ist
die Tatsache, dass die Aufstrichphase des Aktionspotentials (Phase 0) nicht
durch
raschen Natrium-, sondern durch eher bedächtigen Calciumeinstrom
erfolgt und daher das Schwellenpotential der jeweils noch unerregten
Nachbarzellen nicht so schnell erreicht wird wie im Arbeitsmyokard.
Außerdem sind die Zellen des
AV-Knotens sehr klein (2-3 µm), der Vorgang wiederholt sich auf kurzen
Strecken (vergleichbar einem Hürdenlauf, bei dem der Abstand zwischen
den Balken verringert wurde).
Indem
der AV-Knoten die Erregung langsam
weiterleitet, verhindert er, dass sich die Kammern zu früh (vor
Abschluss der Vorhofaktion) kontrahieten.
 His'sches
Bündel
His'sches
Bündel  :
Es stellt die einzige elektrophysiologische Verbindung zwischen
Vorhöfen und Kammern dar (die bindegewebigen Klappenansatzringe - das
"Herzskelett" - ist nicht erregbar) und leitet die Erregungswelle zügig auf
das Ventrikelmyokard weiter. Die Aktionspotentiale sind denen in der
Arbeitsmuskulatur sehr ähnlich, sie weisen deutliche Plateaubildung mit
einer Länge von 0,2-0,4 Sekunden auf.
:
Es stellt die einzige elektrophysiologische Verbindung zwischen
Vorhöfen und Kammern dar (die bindegewebigen Klappenansatzringe - das
"Herzskelett" - ist nicht erregbar) und leitet die Erregungswelle zügig auf
das Ventrikelmyokard weiter. Die Aktionspotentiale sind denen in der
Arbeitsmuskulatur sehr ähnlich, sie weisen deutliche Plateaubildung mit
einer Länge von 0,2-0,4 Sekunden auf.
 Tawara-
Tawara-  bzw. Kammerschenkel: Der rechte und (zweibündelige: vorderer und hinterer Faszikel) linke Kammerschenkel
leiten die Aktionspotentiale in der Kammerscheidewand rasch (bis 4 m/s)
zur Herzspitze und von dort über die Seitenwände der Ventrikel. Bei Ausfall eines
Kammerschenkels umgeht die Erregungswelle diesen "Schenkelblock" über normales Arbeitsmyokard, was länger dauert und im EKG als Deformation des QRS-Komplexes sichtbar wird. Die Eigenfrequenz des Kammer-Erregungsleitungssystems beträgt ≤45/Minute.
bzw. Kammerschenkel: Der rechte und (zweibündelige: vorderer und hinterer Faszikel) linke Kammerschenkel
leiten die Aktionspotentiale in der Kammerscheidewand rasch (bis 4 m/s)
zur Herzspitze und von dort über die Seitenwände der Ventrikel. Bei Ausfall eines
Kammerschenkels umgeht die Erregungswelle diesen "Schenkelblock" über normales Arbeitsmyokard, was länger dauert und im EKG als Deformation des QRS-Komplexes sichtbar wird. Die Eigenfrequenz des Kammer-Erregungsleitungssystems beträgt ≤45/Minute.
 Purkinje-Fasern
Purkinje-Fasern
 schließen
an die Kammerschenkel an und dienen der weiteren raschen,
zeitlich-räumlich koordinierten Erregungsausbreitung in den Ventrikeln.
Sie sind die Zellen mit dem größten Durchmesser (40-80 µm) im
Herzmuskel, daher haben sie die höchste (3-5
m/s) Leitungsgeschwindigkeit (starker INa-Strom, geringer axialer elektrischer Widerstand).
schließen
an die Kammerschenkel an und dienen der weiteren raschen,
zeitlich-räumlich koordinierten Erregungsausbreitung in den Ventrikeln.
Sie sind die Zellen mit dem größten Durchmesser (40-80 µm) im
Herzmuskel, daher haben sie die höchste (3-5
m/s) Leitungsgeschwindigkeit (starker INa-Strom, geringer axialer elektrischer Widerstand).
Purkinje-Fasern versorgen die subendokardialen Schichten
mit Aktionspotentialen, die sich dann mit ≤1 m/s quer durch das Myokard
zu subepikardialen Schichten ausbreiten ( Abbildung). Der ganze Vorgang dauert
weniger als eine Zehntelsekunde (EKG!).
Abbildung). Der ganze Vorgang dauert
weniger als eine Zehntelsekunde (EKG!).
Purkinje-Fasern verfügen über Kanäle für Na+-, K+-, Ca++- und If-
Ströme (s. folgende Tabelle). Sie sind spontaner Depolarisation fähig,
ihre Eigenfrequenz beträgt etwa 20/min. Im Falle eines Ausfalls des
übergeordneten Schrittmachersystems (Sinusknoten bis His-Bindel) können
sie als "tertiärer Schrittmacher" die Rhythmusbildung der Ventrikel
übernehmen - allerdings um den Preis extremer Bradykardie.
Purkinje-Fasern
haben von allen Zellen des Reizleitungssystems das am längsten dauernde
Aktionspotential, d.h. sie sind relativ lange refraktär (Schutz vor
Wiedererregung)
|
Das Reizleitungssystem zwischen AV-Knoten und Ventrikelmyokard wird auch als His-Purkinje fiber system zusammengefasst.
Alle Anteile
des Reizleitungssystems können Aktionspotentiale bilden, kommen
normalerweise aber nicht dazu, weil sie eine niedrigere
Entladungsfrequenz als der Sinusknoten haben. Bei einem Ausfall des
Sinusknotens oder Unterbrechung der Erregungsleitung, z.B. im His´schen
Bündel (Herzblock, sino-atrialer Block) schlagen die Kammern in ihrem langsameren Eigenrhythmus.
Die folgende Tabelle fasst elektrische Eigenschaften der verschiedenen
spezialisierten Myozyten nochmals zusammen (bezogen auf Herzfrequenz: chronotrop; auf Erregungsleitungsgeschwindigkeit: dromotrop; auf Schlagkraft: inotorop).

Eigenschaften spezialisierter Myozyten

Modifiziert nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
Gewebe
|
Funktion
|
Ionenströme
(hauptsächlich)
|
ß-adrenerge Effekte
|
Cholinerge Effekte
|
Sinusknoten
|
Schrittmacher
(primär)
|
ICa, IK, If
|
positiv dromotrop
positiv chronotrop
|
negativ chronotrop
negativ dromotrop |
Vorhofmuskulatur
|
Pumpfunktion
|
INa, ICa, IK |
positiv inotrop
|
(gering)
|
AV-Knoten
|
Schrittmacher (sekundär)
|
ICa, IK, If |
positiv dromotrop
positiv chronotrop |
negativ chronotrop
negativ dromotrop |
Purkinjefasern
|
Rasche Erregungsleitung, tertiärer Schrittmacher
|
INa, ICa, IK, If |
positiv chronotrop |
negativ dromotrop |
ventrikuläre Muskulatur
|
Pumpfunktion
|
INa, ICa, IK |
positiv inotrop
|
(gering)
|
Die Erregung breitet sich wie ein Lauffeuer über den gesamten Herzmuskel aus
Die
Konzentration freier Calciumionen ist in der extrazellulären
Flüssigkeit mit ~1 mM um 4 Zehnerpotenzen höher als im ruhenden
Kardiomyozyt. Der niedrige Betrag des zytoplasmatischen freien [Ca++] (~10-4 mM) wird durch Ca++-ATPasen (PMCA, plasma membrane calcium ATPases, Calcium-Exportpumpen) sowie Na/Ca-Austauscher (NCX) aufrechterhalten - erstere nutzen ATP, letztere den Natriumgradienten (sekundär-aktiv) als Energiequelle für den Ca++-Export.
Die Auslösung der Herzaktion erfolgt im Moykard selbst: Das Reizleitungssystem hat kein stabiles Ruhepotential, sondern generiert und
verteilt Erregungswellen über Milliarden Herzmuskelzellen in einem
räumlich-zeitlich optimierten Ablaufplan. Dabei fließen - durch gap junctions - zwischen erregten ("Quelle") und unerregten Nachbarzellen exzitatorische intrazelluläre Ströme (positive Ladungen in die noch unerregte Zelle), balanciert durch entgegengesetzte extrazelluläre Ströme (an der Membran freiwerdende positive Ladungen zur erregten Zone). Letztere lassen in ihrer Summe das EKG-Signal entstehen.
Dieser Ablauf der Erregungswellen löst die Kontraktion des Herzmuskels (die Systole) aus. Vorgegeben wird der "Takt" der Erregungsbildung im rechten Vorhof vom Sinusknoten, dieser wird als (physiologischer) Schrittmacher (pacemaker) des Herzens bezeichnet.
 Abbildung: Erregungsübertragung von Herzmuskelzelle zu Herzmuskelzelle
Kombiniert nach Vorlagen in quizlet.com, courstudy.com
Abbildung: Erregungsübertragung von Herzmuskelzelle zu Herzmuskelzelle
Kombiniert nach Vorlagen in quizlet.com, courstudy.com
Herzmuskelzellen (Kardiomyozyten) sind 50-100 µm lang und 10-20 µm dick; einige sind verzweigt. Mechanisch sind sie über Desmosomen miteinander verknüpft; die Übertragung der Erregung erfolgt mittels gap junctions
(Nexus), an denen sich die Membranen benachbarter Zellen auf 2-4 nm
annähern und Erregungsströme durch Konnexone von einer auf die nächste
Zelle übergreifen

Der "Sprung" der Aktionspotentiale von Muskelfaser zu Muskelfaser erfolgt im Herzen - wie in glatter Muskulatur - mittels gap junctions,
deren - aus jeweils 12 Konnexinmolekülen (gap junction proteins) aufgebauten - Konnexone eine direkte Verbindung der
benachbarten Interzellulärraume herstellt (Abbildungen). Gap junctions sind Stellen
stark reduzierten elektrischen Widerstandes, Stromlinien suchen ihren
Weg von Herzmuskelzelle zu Herzmuskelzelle. In diesem Bereich der Zellmembran konzentrieren
sich auch spannungsgesteuerte Natriumkanäle, welche das
Aktionspotential von Zelle zu Zelle rasch weiterleiten (Phase 0,  s. oben).
s. oben).
Gap junctions und Desmosomen liegen in streifenförmigen Kontaktzonen
(Glanzstreifen, intercalated discs), die sowohl der mechanischen
(Desmosomen) als auch der elektrischen Verbindung
(Konnexone) dienen. An Desmosomen setzen intrazellulär Desminfilamente zur mechanischen Verankerung an;
sie enthalten das transmembranale Glykoprotein Cadherin, das 25 nm
weite Spalten zwischen benachbarten Herzmuskelzellen überbrückt.
Die Durchlässigkeit der gap junctions sinkt, wenn der intrazelluläre pH sinkt (die [H+] ansteigt) oder die intrazelluläre Ca++-Konzentration zunimmt.
Steigt [Ca++] oder [H+] in der Zelle, sinkt die Durchlässigkeit der gap junctions
|
Unterdurchblutung (myokardiale Ischämie) erhöht [H+] und [Ca++]
in der Herzmuskelzelle; das führt zum Verschluss eines Teils der
Konnexone und erleichtert das Auftreten von Herzrhythmusstörungen (Arrhythmien).
Da alle Herzmuskelzellen miteinander via gap junctions elektrisch verbunden sind, pflanzt sich normalerweise jede Erregungswelle über das gesamte Myokard fort (das Herz ist ein funktionelles Synzytium, seine Kontraktionen sind automatisch Maxima, d.h. alle Muskelfasern nehmen daran teil). Der bindegewebige Ansatzapparat für die Herzklappen - der anulus fibrosus (cardiac skeleton) - leitet keine Erregung, das His-sche Bündel ist die (normalerweise einzige) Überbrückung zwischen Vorhof- und Kammermyokard.
Ein Herzblock liegt vor, wenn die Überleitung an dieser Stelle unterbrochen ist.

Grundbaustein einer gap junction
ist das Konnexin. 6 Konnexinmoleküle vereinigen sich in der Membran
einer Zelle zu einem Konnexon, dieses lässt einen rührenförmigen
Innenraum erkennen. Legen sich zwei Konnexone benachbarter
Zellmembranen aneinander, bildet sich ein interzellulärer Kanal, durch
den Stoffe (bis ~2 kD) zwischen den Zellen ausgetauscht werden und
elektrische Ströme fließen können.
Der extrazelluläre Spaltraum (gap) zwischen den Zellmembranen ist 2-4 nm (0,002-0,004 µm) weit. Ein Areal mit zahlreichen Konnexon-Kanälen heißt gap junction
Je dichter Herzmuskelzellen mit gap junctions ausgestattet sind, desto rascher breitet sich in einer solchen Myokardzone die Erregung aus. Das erklärt die regional unterschiedlichen Ausbreitungsgeschwindigkeiten
Im AV-Knoten breitet sich die Erregungswelle besonders langsam aus (Filterfunktion)
|
Der transmembranale Reizstrom führt in Bruchteilen von Millisekunden zu
einem überschwelligen Effekt an der nächsten Zelle, und so setzt sich
die Erregung wie ein Lauffeuer von Zelle zu Zelle fort. Im EKG
entstehen dadurch als Summeneffekte
 die P-Welle als Zeichen der
Erregungsausbreitung über das Vorhofmyokard und
die P-Welle als Zeichen der
Erregungsausbreitung über das Vorhofmyokard und
 der QRS-Komplex als Resultat der Erregungsausbreitung über das Ventrikelmyokard.
der QRS-Komplex als Resultat der Erregungsausbreitung über das Ventrikelmyokard.
Die Funktionsweise von "Arbeitsmyokardzellen" und "Schrittmacherzellen"
(Erregungsleitungszellen) unterscheidet sich in mehreren Aspekten.
Entscheidend ist dabei die Exprimierung von Ionenkanälen in der
Zellmembran, die den Muskelfasern ein entsprechend charakteristisches
elektrophysiologisches Verhalten verleiht.
Jeder Ionenkanal hat seine eigene Aktivierungs- und
Inaktivierungscharakteristik: Beispielsweise schließen schnelle Natriumkanäle nach
wenigen Millisekunden des Offenseins, auch wenn die Membran depolarisiert
bleibt; langsame ("L" für long) Calciumkanäle hingegen erst nach ~200 ms.


Abbildung: Erregungsfortpflanzung von Herzmuskelzelle zu Herzmuskelzelle
Nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Stromlinien
konventionell von Orten positiver zu Orten negativer Ladung gezeichnet.
Der transmembranale Widerstand ist an gap junctions (Nexus) stark reduziert,
der Strom wandert durch sie hindurch


Die rasche Weiterleitung der Aktionspotentiale über gap junctions im
Herzmuskelgewebe gewährleistet eine koordinierte Abfolge der
Erregungswelle und damit eine weitgehend synchrone Aktivierung des
Myokards. Das ist eine Grundvoraussetzung für die Tätigkeit des
Herzmuskels als mechanische Pumpe: Das Herz kann als funktionelles Synzytium gesehen werden, weil alle Myokardzellen elektrisch leitend miteinander verbunden sind - Erregung einer (beliebigen) Stelle des Herzmuskels führt zu dessen vollständiger Erregung.

 Abbildung: Struktur des Herzmuskelgewebes
Nach einer Vorlage bei Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Abbildung: Struktur des Herzmuskelgewebes
Nach einer Vorlage bei Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Desmosomen dienen der mechanischen (Kraftübertragung - vgl. dort), gap junctions der elektrischen Verknüpfung (Übergreifen der Erregung im Herzmuskel - funktionelles Synzytium). Gap junctions und Desmosomen sind in streifenförmige Zonen zusammengefasst, die als Glanzstreifen bezeichnet werden.
Mutationen von Genen, die
Komponenten der Desmosomen codieren (z.B. Plakoglobin, Plakophilin,
Desmoplakin), können Kardiomyopathien verursachen

Der
Ablauf der Erregung über das Herz ist durch die Morphologie sowie die
Ausstattung der einzelnen Muskelzellen mit Ionenkanälen vorgegeben:
 Der größte Teil der Muskelmasse besteht aus Arbeitsmyokard, das ein stabiles Ruhepotential von -80 mV hat (es verfügt über inward-rectifier-Kaliumkanäle, die das Ruhepotential stabilisieren (K+-Ausstrom); HCN-Kanäle fehlen).
Der größte Teil der Muskelmasse besteht aus Arbeitsmyokard, das ein stabiles Ruhepotential von -80 mV hat (es verfügt über inward-rectifier-Kaliumkanäle, die das Ruhepotential stabilisieren (K+-Ausstrom); HCN-Kanäle fehlen).
 Umgekehrt verfügen Zellen des Erregungsleitungssystems über HCN-Kanäle, die spontane Depolarisation (Na+- und Ca++-Einstrom) ermöglichen. Die Ionenkanalbesetzung ist unterschiedlich, sodass diese Zellen sich in ihrem Verhalten unterscheiden:
Umgekehrt verfügen Zellen des Erregungsleitungssystems über HCN-Kanäle, die spontane Depolarisation (Na+- und Ca++-Einstrom) ermöglichen. Die Ionenkanalbesetzung ist unterschiedlich, sodass diese Zellen sich in ihrem Verhalten unterscheiden:
Die Zellen des Sinusknotens
haben die intensivste Spontanentladung und erreichen daher am
raschesten ihr Schwellenpotential, von dem aus ein Aktionspotential
auftritt. Das macht den Sinusknoten zum "Schrittmacher" des gesamten
Herzens: Nach Ablauf eines Herzschlags gibt er den Zeitpunkt der
nächsten Erregungswelle vor. Der Sinusknoten liegt im rechetn Vorhof,
der dadurch zum Sitz des kardialen "Uhrwerks" wird.
Die nächste spezielle Station ist der Aschoff-Tawara-
(Atrioventrikular-, AV-) Knoten, der die aus dem Vorhof kommende
Erregung besonders langsam weiterleitet - und zwar auf das His'sche
Bündel, das normalerweise die einzige leitende Struktur zwischen
Vorhof- und Kammermyokard ist. Diese Positionierung macht das AV-Knoten - His-Bündel - System
zum "Pförtner" jeder Exzitation vom Vorhof- in den Ventrikelbereich.
Der AV-Knoten leitet sehr langsam, und die nachfolgende
Erregungsleitungsbahn ist sehr lange refraktär ( Abbildung).
Abbildung).
Diese Anordnung hat eine wichtige Schutzfunktion: Auf diese Weise wird
bei vorzeitigen Erregungsphänomenen im Bereich der Atrien (z.B. bei
Vorhofflimmern) verhindert, dass die Herzkammern gefährliche
Tachykardien bzw. Kammerflimmern entwickeln.
Für die Herzmechanik bedeutet
die Verzögerung der Überleitung zwischen Vorhof- und Kammerbereich eine
Erleichterung: Die Vorhöfe schlagen nicht gegen eine sich schon
kontrahierende Kammer (und eine dadurch schließende AV-Klappe) - wie
das bei unmittelbarem Übergreifen der Erregungswelle auf das
Kammermyokard der Fall wäre -, sondern in einen (spätdiastolisch) noch
dehnungsfähigen Ventrikelraum, was die ventrikuläre Füllung nicht
unwesentlich komplettiert.

 Abbildung: Erregungsausbreitung im Herzen
Modifiziert nach Nerbonne JM, Kass RS. Molecular physiology of cardiac repolarization. Physiol Rev 2005; 85:1205-53
Abbildung: Erregungsausbreitung im Herzen
Modifiziert nach Nerbonne JM, Kass RS. Molecular physiology of cardiac repolarization. Physiol Rev 2005; 85:1205-53
Sinusknoten und AV-Knoten zeigen auffallend runde Aktionspotentialverläufe, bedingt durch relativ langsame Ca++-Ströme; Plateauphasen sind nicht zu erkennen.
Alle anderen Aktionspotentiale zeigen rasche Depolarisierung (Na+-Einstrom) und ausgeprägte Refrakterität (Plateaus) von unterschiedlicher Form und Dauer.
Die Ankunft der Erregung an den Purkinje-Fasern ist durch die langsame
Leitung im AV-Knoten deutlich verzögert.
Subendokardiale Zellen
werden früher und bleiben länger erregt als subepikardiale (lange Plateauphase: gestrichelte Linien)

I
st die Erregung einmal in den
Kammerbereich vorgedrungen, läuft sie über das Reizleitungssystem der
Ventrikel (His-Bündel, Kammerschenkel, Purkinje-Fasern) und das
Arbeitsmyokard als charakteristische, funktionsoptimierte
räumlich-zeitliche Abfolge über Septum und Ventrikelwände.
Die
Erregungswelle ist zuerst zur Herzspitze (Apex) hin gerichtet und läuft
dann nach links und rechts oben, die subendokardialen Schichten zuerst
und die subepikardialen zuletzt erfassend (Abbildungen). Die besonders
ausgeprägte Plateauphase der subendokardialen Zellen macht sie lange
refraktär und schützt sie vor früher Wiedererregung.
Dieses komplexe Muster erzeugt im Körper elektrische Felder, deren
räumlich-zeitliche Auswirkung von der Körperoberfläche abgegriffen
werden kann und bei entsprechender Elektrodenanordnung in definierten
Ableiteschemata Elektrokardiogramme erzeugt ( s. dort).
s. dort).
Die Kardiomyozyten der Ventrikelmuskulatur haben ein stabiles Ruhepotential (-80 mV, keine If-Kanäle).
Sie verfügen über Natrium-, Calcium- (Depolarisation,
elektromechanische Kopplung, lange Refrakterität) und Kaliumkanäle
(Repolarisation) (s. Tabelle oben).
Das Herz schlägt autonom und unterliegt neurohumoraler Steuerung
Es
gibt mehrere Möglichkeiten, die Herzfrequenz zu verändern: Die spontane
Entladung kann rascher oder langsamer erfolgen, das Schwellenpotential
kann erhöht oder erniedrigt werden, und auch das maximale
Membranpotential, von dem aus die Depolarisierung beginnt, kann seine
Lage verändern.
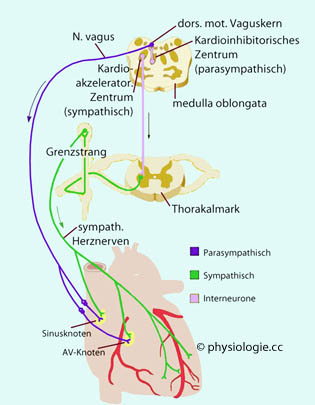
 Abbildung: Steuerung der Herzaktivität
Abbildung: Steuerung der Herzaktivität
Nach einer Vorlage bei Pearson Education 2004
Der Sinusknoten erzeugt - auf sich alleine gestellt - Spontanentladungen mit einer Frequenz von 90-100/min. Einfluss des Parasympathikus (cholinerg) reduziert diese Frequenz (kardioinhibitorisches Zentrum),
im Ruhezustand - liegend - auf ~60/min ("Ruhefrequenz").
Schon das
Aufrichten des Körpers senkt den Vaguseinfluss wegen sinkenden
arteriellen Drucks im Karotissinus, die Ruhefrequenz steigt im Stehen
auf ca. 75/min (posturale Reaktion).
Physische / psychische Belastung
steigert den Sympathikuseinfluss (adrenerg), die Herzfrequenz nimmt über Wirkung auf das kardioakzeleratorische Zentrum zu

 Zum Kreislaufzentrum s. dort
Zum Kreislaufzentrum s. dort
Das
Herz steht
unter dem Einfluss unterschiedlicher Faktoren: Hormonell (z.B.
Adrenalin), physikalisch (z.B. Temperatur), und vor allem steuernder
Einflüsse des autonomen Nervensystems:

Impulse aus dem
Sympathikus beschleunigen und kräftigen (kardioakzeleratorisches Zentrum)

solche aus dem Parasympathikus
bremsen die Herztätigkeit (kardioinhibitorisches Zentrum in der medulla oblongata).
Ein frisch transplantiertes denerviertes Herz schlägt mit der
Spontanfrequenz des Sinusknotens: 90-100 mal pro Minute. Normalerweise beträgt die
Ruhefrequenz einer erwachsenen Person nur ~60/min (Normokardie); dies wegen der
in Ruhe überwiegenden
Vaguswirkung. Bei abnehmender Vaguswirkung und/oder zunehmendem
Sympathikustonus steigt die Herzfrequenz, maximal bis zu ~200/min (fight or flight).
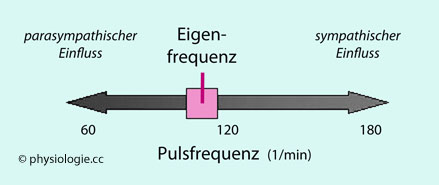
 Abbildung: Autonom-nervöse Balance
Abbildung: Autonom-nervöse Balance
Nach einer Vorlage in Praktische Physiologie
Der
unbeeinflusste Sinusknoten einer erwachsenen Person entlädt sich mit
einer "Eigenfrequenz" von ca. 100/min.
Überwiegt der
Einfluss des
Parasympathikus bzw. negativ chronotrop
wirkender Mediatoren, liegt die Schlagfreqiuenz niedriger (z.B.
Ruhefrequenz von ~60/min), überwiegt derjenige des Sympathikus bzw.
positiv chronotrop wirkender Mediatoren, liegt sie darüber (z.B. bei
körperlicher Belastung)

Die Herzfrequenz
beträgt im Ruhezustand rund 60 (im Liegen) bis 80 (im Stehen) Schläge pro Minute (Normokardie).

Liegt die Herzfrequenz über 100 / min, spricht man von
Tachykardie. Bei Neugeborenen ist "Tachykardie" im Ruhezustand nach dieser Definition physiologisch (

s.
dort). Die Eigenfrequenz des Sinusknotens liegt bei etwa 105 / min, im Ruhezustand wird er durch parasympathischen Einfluss auf
60-80 / min reduziert.
 Bradykardie
ist eine Frequenz unter 60 / min; eine bradykarde Ruhefrequenz
findet sich bei ausgeprägtem Trainingszustand, Hochtrainierte können eine
Ruhefrequenz bis unter 40 zeigen (hoher Parasympathikustonus; dies kann mit einem Herzblock verwechselt werden, bei dem
der Sinusknoten nicht wirksam wird: der AV-Knoten hat eine ähnlich
niedrige Eigenfrequenz wie das gesunde Herz einer hochtrainierten
Person im Ruhezustand). Auch im Schlaf (non-REM) sinkt die Herzfrequenz auf niedrigere Werte ab.
Bradykardie
ist eine Frequenz unter 60 / min; eine bradykarde Ruhefrequenz
findet sich bei ausgeprägtem Trainingszustand, Hochtrainierte können eine
Ruhefrequenz bis unter 40 zeigen (hoher Parasympathikustonus; dies kann mit einem Herzblock verwechselt werden, bei dem
der Sinusknoten nicht wirksam wird: der AV-Knoten hat eine ähnlich
niedrige Eigenfrequenz wie das gesunde Herz einer hochtrainierten
Person im Ruhezustand). Auch im Schlaf (non-REM) sinkt die Herzfrequenz auf niedrigere Werte ab.
Parasympathischer Wirkungsmechanismus
 s. auch dort
s. auch dort
Parasympathische Reizung des Herzens bewirkt u.a.
 reduzierte Schlagfrequenz und Automatizität
reduzierte Schlagfrequenz und Automatizität
 verlagnsamte AV-Erregungsüberleitung (bis zu Herzstillstand bei extremer cholinerger Reizung)
verlagnsamte AV-Erregungsüberleitung (bis zu Herzstillstand bei extremer cholinerger Reizung)
Cholinerge Effekte auf das Herz (negative Chronotropie - Bradykardie etc) werden über M2-Acetylcholinrezeptoren vermittelt. Sinkendes [cAMP]
senkt die Öffnungswahrscheinlichkeit von L-Typ Calciumkanälen und
erhöht die Öffnungswahrscheinlichkeit von Acetylcholin-aktivierten
Kaliumkanälen (GIRKs). Das Ruhepotential wird verstärkt (geringer
Calciumeinstrim, intensiverer Kaliumausstrom), die Spontanentladung
verlangsamt, die Herzfrequenz verlangsamt.
 Die unbeeinflusste "intrinsische" Spontanentladungsfolge des Sinusknotens beträgt etwa 100/min. Im Ruhezustand senkt der Parasympathikus (cholinerg)
die Frequenz durch Verstärkung des Ruhepotentials und Verflachung des
Schrittmacherpotentials; starke Parasympathikuswirkung kann die
Spontanentladungsfolge weiter senken (<60/min, Bradykardie
Die unbeeinflusste "intrinsische" Spontanentladungsfolge des Sinusknotens beträgt etwa 100/min. Im Ruhezustand senkt der Parasympathikus (cholinerg)
die Frequenz durch Verstärkung des Ruhepotentials und Verflachung des
Schrittmacherpotentials; starke Parasympathikuswirkung kann die
Spontanentladungsfolge weiter senken (<60/min, Bradykardie  ),
extrem intensive reflektorisch bedingte Parasympathikuswirkung kann den
Herzschlag sogar vollständig unterdrücken (Beispiel Bolustod).
),
extrem intensive reflektorisch bedingte Parasympathikuswirkung kann den
Herzschlag sogar vollständig unterdrücken (Beispiel Bolustod).
Der
parasympathische Einfluss ist im Ruhezustand hoch und senkt die
Herzfrequenz vom Eigenrhythmus des Sinusknotens (um die 100/min) auf
etwa 60/min ab. Die Wirkung erfolgt über M2-Rezeptoren. Nach Aktivierung des G
i-Proteins spaltet sich dieses in G
α1 und G
βγ, und beide Untereinheiten diffundieren an benachbarte Zielproteine in der Membran:

Die G
α1-Komponente
hemmt die Adenylylcyclase, dadurch sinkt der cAMP-Spiegel, was die
Öffnungswahrscheinlichkeit von
HCN-Kanälen reduziert. Diese lassen den
depolarisierenden
Schrittmacherstrom
zu, also wird die Depolarisation der Sinusknotenzelle gebremst
(

Abbildung: Flacherer Depolarisationsverlauf), die Herzfrequenz
nimmt ab.

Die G
βγ-Komponente aktiviert Kaliumkanäle, was die Zelle stärker aufladet und ebenfalls die Depolarisationszeit erhöht.


Abbildung: Wie die Herzfrequenz gesenkt werden kann
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Rote Kurven: Unbeeinflusster Aktionspotentialverlauf.
Überlagert sind Möglichkeiten zu negativ chronotroper Wirkung.
Oben: Flacherer Spontanentladungsverlauf durch Reduktion des I
f.
Mitte: Stärker negatives Startpotential durch erhöhten Kaliumausstrom (Öffnung von GIRK-Kanälen).
Unten: Reduzierter I
Ca-Strom rückt das Schwellenpotential näher zur Nulllinie.
Cholinerge Aktivität nutzt die Kombination aller drei Mechanismen

Das Wirkungsspektrum ist ein mehrfaches:
 Negativ chronotroper Effekt: Muskarinerge Rezeptoren im Sinusknoten beeinflussen Kalium-(IKACh), Calcium-(ICa) und If-Ströme (s.
Negativ chronotroper Effekt: Muskarinerge Rezeptoren im Sinusknoten beeinflussen Kalium-(IKACh), Calcium-(ICa) und If-Ströme (s.  oben): Kaliumkanäle (GIRK1) werden geöffnet, das maximale Phase-4-Membranpotential negativiert; ICa wird reduziert, die Depolarisierung langsamer, das Schwellenpotential angehoben; und der schwächere If verlangsamt die diastolische Depolarisierung. Ergebnis: Die Herzfrequenz
sinkt.
oben): Kaliumkanäle (GIRK1) werden geöffnet, das maximale Phase-4-Membranpotential negativiert; ICa wird reduziert, die Depolarisierung langsamer, das Schwellenpotential angehoben; und der schwächere If verlangsamt die diastolische Depolarisierung. Ergebnis: Die Herzfrequenz
sinkt.
 Negativ dromotroper
Effekt: Am AV-Knoten wird die Überleitung
verlangsamt (verzögerte Aufstrichphase "0").
Negativ dromotroper
Effekt: Am AV-Knoten wird die Überleitung
verlangsamt (verzögerte Aufstrichphase "0").
 Negativ inotroper Effekt:
Der Parasympathikus hat (entgegen der früheren Lehrmeinung) auch
direkten Einfluss auf die Kontraktilität des menschlichen Herzens, die
er verringert (negative Inotropie). Mögliche Mechanismen: Beschleunigte Repolarisation (IKACh) verringert Calciumeinstrom durch L-Typ Calciumkanäle; Hemmung der Adenylylcyclase senkt [cAMP] und wirkt adrenergen Einflüssen entgegen.
Negativ inotroper Effekt:
Der Parasympathikus hat (entgegen der früheren Lehrmeinung) auch
direkten Einfluss auf die Kontraktilität des menschlichen Herzens, die
er verringert (negative Inotropie). Mögliche Mechanismen: Beschleunigte Repolarisation (IKACh) verringert Calciumeinstrom durch L-Typ Calciumkanäle; Hemmung der Adenylylcyclase senkt [cAMP] und wirkt adrenergen Einflüssen entgegen.
Hyperkaliämie,
Azidose und Sauerstoffmangel (Hypoxie) gehören (neben parasympathischer
Aktivität) zu den Faktoren, welche die Kontraktilität des
Herzmuskels senken. Sie können bei Schädigung bzw. ungenügender
Perfusion des Herzmuskels auftreten (Herzinfarkt) und Arrhythmien
auslösen. Insbesondere Azidose wirkt stark negativ inotrop.
Sympathischer Wirkungsmechanismus
 s. auch dort
s. auch dort
Sympathische Reizung des Herzens bewirkt u.a.
 verstärkte Kontraktion des Myokards (positiv inotroper Effekt)
verstärkte Kontraktion des Myokards (positiv inotroper Effekt)
 erhöhte Schlagfrequenz (positiv chronotroper Effekt)
erhöhte Schlagfrequenz (positiv chronotroper Effekt)
 verringerte kardiale Effizienz (Sauerstoffverbrauch des Myokards steigt stärker an als seine Leistung)
verringerte kardiale Effizienz (Sauerstoffverbrauch des Myokards steigt stärker an als seine Leistung)
 verstärkte Automatizität (Neigung zur Bildung ektopischer Herzschläge)
verstärkte Automatizität (Neigung zur Bildung ektopischer Herzschläge)
An Sinusknotenzellen regt die ß1-Rezeptor-mediierte Aktivierung von GS-Proteinen
die Adenylylcyclase an; [cAMP] steigt in der Zelle, dies erhöht die
Öffnungswahrscheinlichkeit von HCN-Kanälen, und der depolarisierende
Kationeneinstrom if nimmt zu. Dadurch steigt die Entladungsrate, da das Schwellenpotential früher erreicht wird als ohne adrenerge Wirkung. Der Sympathikus beschleunigt (adrenerg) die Entladung in Phase 4 und erhöht die Herzfrequenz (>100/min: Tachykardie  ).
).
Aktivierung von β1-Adrenozeptoren führt über
cAMP zur Aktivierung von Proteinkinase A, welche Ca++-Kanäle
phosphoryliert und ihre Offenwahrscheinlichkeit steigert; dadurch wird
auch vermehrt Ca++ aus dem sarkoplasmatischen Retikulum mobilisiert, die Zelle depolarisiert rascher (positiv chronotrope Wirkung von Katecholaminen).
Der
Mechanismus der Wirkung von Adrenalin / Noradrenalin auf das Herz -
insbesondere positiv chronotrop (Beschleunigung) und inotrop
(Kräftigung) - ist eine Kombination mehrerer Faktoren:
 Am Sinusknoten
erfolgt beschleunigte Depolarisation (positiv chronotroper Effekt durch Aktivierung von If-Kanälen). Der Wirkungsmechanismus: ß1-Rezeptoren → Gs-Protein → cAMP → Proteinkinase A → Phosphorylierung zahlreicher Zielproteine.
Am Sinusknoten
erfolgt beschleunigte Depolarisation (positiv chronotroper Effekt durch Aktivierung von If-Kanälen). Der Wirkungsmechanismus: ß1-Rezeptoren → Gs-Protein → cAMP → Proteinkinase A → Phosphorylierung zahlreicher Zielproteine.

 Am
AV-Knoten zeigt sich ein rascherer Aufstrich des Aktionspotentials (positiv
dromotroper Effekt durch verbesserte Überleitung an gap junctions).
Am
AV-Knoten zeigt sich ein rascherer Aufstrich des Aktionspotentials (positiv
dromotroper Effekt durch verbesserte Überleitung an gap junctions).

Sowohl im Sinus- als auch im AV-Knoten nimmt der ICa
zu, was sowohl das Schwellenpotential näher zum Membranpotential rückt als auch die Phase-4-Depolarisation beschleunigt - beides steigert die
Herzfrequenz. Der Betrag des maximalen diastolischen Potentials wird
durch Katecholamine nicht verändert.

 Am Arbeitsmykoard verstärken Katecholamine den ICa-Strom (aus dem Extrazellulärraum) und erhöhen die Sensitivität der Calciumkanäle des sarkoplasmatischen Retikulums gegenüber steigendem sarkoplasmatischem [Ca++]. Auch
die anschließende Rückführung von Calcium in das Retikulum mittels
SERCA-Pumpe wird intensiviert und erhöht den sarkoplasmatischen
Calciumvorrat. All dies intensiviert die Kontraktion (positiv inotroper Effekt).
Am Arbeitsmykoard verstärken Katecholamine den ICa-Strom (aus dem Extrazellulärraum) und erhöhen die Sensitivität der Calciumkanäle des sarkoplasmatischen Retikulums gegenüber steigendem sarkoplasmatischem [Ca++]. Auch
die anschließende Rückführung von Calcium in das Retikulum mittels
SERCA-Pumpe wird intensiviert und erhöht den sarkoplasmatischen
Calciumvorrat. All dies intensiviert die Kontraktion (positiv inotroper Effekt).

 Die Aktionspotentiale verkürzen ihre Dauer durch Aktivierung des verzögerten IK-Stroms.
Die Aktionspotentiale verkürzen ihre Dauer durch Aktivierung des verzögerten IK-Stroms.

 Die Myozyten relaxieren rascher (positiv lusitroper Effekt durch erhöhte Ca++-Aufnahme in das sarkoplasmatische Retikulum).
Die Myozyten relaxieren rascher (positiv lusitroper Effekt durch erhöhte Ca++-Aufnahme in das sarkoplasmatische Retikulum).
 "Betablocker"
(genauer: ß1-Rezeptor-Antagonisten) dämpfen die Noradrenalinwirkung auf das Herz und wirken herzschonend, vermindern
aber auch unter Umständen die Anpassungsfähigkeit des Kreislaufs bei Belastung. Je nach Wirkungsspektrum auf adrenerge (nicht nur ausschließlich ß1-) Rezeptoren üben sie unterschiedliche Effekte auf Myokarddurchblutung, Erregungsbildung etc. aus.
"Betablocker"
(genauer: ß1-Rezeptor-Antagonisten) dämpfen die Noradrenalinwirkung auf das Herz und wirken herzschonend, vermindern
aber auch unter Umständen die Anpassungsfähigkeit des Kreislaufs bei Belastung. Je nach Wirkungsspektrum auf adrenerge (nicht nur ausschließlich ß1-) Rezeptoren üben sie unterschiedliche Effekte auf Myokarddurchblutung, Erregungsbildung etc. aus.
Neben autonom-nervösen unterliegt das Herz auch endokrinen (z.B. Adrenalin) und metabolischen Einflüssen.


 Fieber, Hyperthyreose,
Entzündungen von Herzbeutel bzw. Herzmuskel oder Lungenembolie sind
Zustände, welche die Herzfrequenz steigern können (Sinustachykardie).
Fieber, Hyperthyreose,
Entzündungen von Herzbeutel bzw. Herzmuskel oder Lungenembolie sind
Zustände, welche die Herzfrequenz steigern können (Sinustachykardie).
 Hypothermie, Hypothyreose, auch intensives körperliches Training
(starke Aktivität des parasympathischen Systems im Ruhezustand), können
Sinusbradykardie zur Folge haben.
Hypothermie, Hypothyreose, auch intensives körperliches Training
(starke Aktivität des parasympathischen Systems im Ruhezustand), können
Sinusbradykardie zur Folge haben.
 Ein plötzlicher
Ausfall des Sinusknotens wird nicht immer durch sofortiges Einspringen
niedrigerer Schrittmacher kompensiert. Vergehen mehrere Sekunden, sinkt
der Blutdruck so stark ab, Bewusstlosigkeit tritt ein
(Adams-Stokes-Anfall). Weiters reicht der auftretende Eigenrhythmus
manchmal für eine ausreichende Durchblutung (vor allem des Gehirns)
nicht aus. Es kann gelingen, den Ohnmachtsanfall durch Flachlagerung
(Wegfall der Orthostasebelastung!) zu beenden.
Ein plötzlicher
Ausfall des Sinusknotens wird nicht immer durch sofortiges Einspringen
niedrigerer Schrittmacher kompensiert. Vergehen mehrere Sekunden, sinkt
der Blutdruck so stark ab, Bewusstlosigkeit tritt ein
(Adams-Stokes-Anfall). Weiters reicht der auftretende Eigenrhythmus
manchmal für eine ausreichende Durchblutung (vor allem des Gehirns)
nicht aus. Es kann gelingen, den Ohnmachtsanfall durch Flachlagerung
(Wegfall der Orthostasebelastung!) zu beenden.
 Als AV-Block bezeichnet man atrioventrikuläre Überleitungsstörungen. Man teilt sie ein in
Als AV-Block bezeichnet man atrioventrikuläre Überleitungsstörungen. Man teilt sie ein in
 AV-Block I. Grades (PQ-Intervall regelmäßig auf ≤200 ms verlängert)
AV-Block I. Grades (PQ-Intervall regelmäßig auf ≤200 ms verlängert)
 AV-Block II. Grades: Nicht jede Erregung gelangt erfolgreich zum
Ventrikel - entweder nimmt die PQ-Zeit von Systole zu Systole zu, bis
die Überleitung ganz ausbleibt (Typ Wenckebach bzw. Mobitz I), oder das
Schlagverhältnis ist fixiert - z.B. 2:1-Block (Typ Mobitz II)
AV-Block II. Grades: Nicht jede Erregung gelangt erfolgreich zum
Ventrikel - entweder nimmt die PQ-Zeit von Systole zu Systole zu, bis
die Überleitung ganz ausbleibt (Typ Wenckebach bzw. Mobitz I), oder das
Schlagverhältnis ist fixiert - z.B. 2:1-Block (Typ Mobitz II)
 AV-Block III. Grades: Keine Überleitung, die Kammer bildet sich ihren eigenen Rhythmus (sekundärer Schrittmacher)
AV-Block III. Grades: Keine Überleitung, die Kammer bildet sich ihren eigenen Rhythmus (sekundärer Schrittmacher)
Kennzeichen eines AV-Blocks II. Grades: EKG zeigt mehr P-Wellen, als Herzschläge auftreten
AV-Block III. Grades: P-Wellen und QRS-Komplexe (seltener) treten unabhängig voneinander, jeweil in eigenem Rhythmus auf
|
 Vorhofflattern
(Vorhof-Schlagfrequenz 230-350/min) kann vorübegehend (paroxysmal) auch
bei herzgesunden Personen auftreten (z.B. Stress, exzessiver
Kaffeegenuss), oder - organisch - bei koronarer Herzkrankheit,
Kardiomyopathie, Mitralklappenstenose u.a. Da der AV-Überleitungsfilter
funktioniert, werden nicht alle Erregungswellen auf den Kammerbereich
übertragen (z.B. 2:1, 3:1), und die Hämodynamik ist im Allgemeinen so
gut wie nicht beeinträchtigt.
Vorhofflattern
(Vorhof-Schlagfrequenz 230-350/min) kann vorübegehend (paroxysmal) auch
bei herzgesunden Personen auftreten (z.B. Stress, exzessiver
Kaffeegenuss), oder - organisch - bei koronarer Herzkrankheit,
Kardiomyopathie, Mitralklappenstenose u.a. Da der AV-Überleitungsfilter
funktioniert, werden nicht alle Erregungswellen auf den Kammerbereich
übertragen (z.B. 2:1, 3:1), und die Hämodynamik ist im Allgemeinen so
gut wie nicht beeinträchtigt.
 Unorganisierte Depolarisationsabläufe im Vorhof, die keine effektive Vorhofkontraktion ergeben, erzeugen Vorhofflimmern (Frequenz >300/min). Sie entstehen durch ektope Erregungsbildung bzw. multiple kreisende Erregungen (multiples re-entry). Im EKG ist keine P-Welle nachweisbar, AV-Überleitung und RR-Intervalle sind völlig unregelmäßig (absolute Arrhythmie).
Unorganisierte Depolarisationsabläufe im Vorhof, die keine effektive Vorhofkontraktion ergeben, erzeugen Vorhofflimmern (Frequenz >300/min). Sie entstehen durch ektope Erregungsbildung bzw. multiple kreisende Erregungen (multiples re-entry). Im EKG ist keine P-Welle nachweisbar, AV-Überleitung und RR-Intervalle sind völlig unregelmäßig (absolute Arrhythmie).
Vorhofflimmern geht mit unregelmäßigem Puls einher
|
 Kammerflattern (250-350/min) bzw. -flimmern
(>350/min) ist ein lebensbedrohlicher Zustand. Es tritt auf, wenn
die Erregung im Ventrikelgebiet unkoordiniert zu kreisen beginnt (re-entry)
und die Pumpfunktion des Herzens zum Erliegen kommt. Die Folge ist ein
funktioneller Kreislaufstillstand (Bewusstlosigkeit innerhalb von 10-15
Sekunden). Im EKG ist keine
klare Trennung zwischen Kammeranfangsschwankung (QRS) und Kammerendteil
mehr möglich (Flattern) oder es sind überhaupt keine koordinierten
Muster erkennbar (Flimmern). Sofortige Defibrillation / Reanimation ist
durchzuführen.
Kammerflattern (250-350/min) bzw. -flimmern
(>350/min) ist ein lebensbedrohlicher Zustand. Es tritt auf, wenn
die Erregung im Ventrikelgebiet unkoordiniert zu kreisen beginnt (re-entry)
und die Pumpfunktion des Herzens zum Erliegen kommt. Die Folge ist ein
funktioneller Kreislaufstillstand (Bewusstlosigkeit innerhalb von 10-15
Sekunden). Im EKG ist keine
klare Trennung zwischen Kammeranfangsschwankung (QRS) und Kammerendteil
mehr möglich (Flattern) oder es sind überhaupt keine koordinierten
Muster erkennbar (Flimmern). Sofortige Defibrillation / Reanimation ist
durchzuführen.

Abbildung: Herzschrittmacher. Steuereinheit subkutan, Reizelektroden in Vorhof und Spitze des rechten Ventrikels
Nach einer Vorlage in caifl.com / cardiac devices
Die
Elektroden diesen sowohl dem Monitoring (EKG) als auch zur Stimulation,
wobei unterschiedliche EKG-Signale als Triggerkriterium genutzt werden
können

 Künstliche Herzschrittmacher erzeugen elektrische Reize in der Kammermuskulatur (
Künstliche Herzschrittmacher erzeugen elektrische Reize in der Kammermuskulatur ( Abbildung). Sie werden über einen Venenkatheter in die Herzräume (rechter Vorhof / Ventrikel)
vorgeschoben und hier befestigt. Die Steuereinheit wird -
nach lokaler Betäubung - subkutan implantiert. Die Impulse haben eine
Spannung von ~3 V und dauern ~0,5 ms, Lithium-Jod-Batterien ermöglichen
eine Betriebszeit von ~10 Jahren.
Abbildung). Sie werden über einen Venenkatheter in die Herzräume (rechter Vorhof / Ventrikel)
vorgeschoben und hier befestigt. Die Steuereinheit wird -
nach lokaler Betäubung - subkutan implantiert. Die Impulse haben eine
Spannung von ~3 V und dauern ~0,5 ms, Lithium-Jod-Batterien ermöglichen
eine Betriebszeit von ~10 Jahren.
 Der Calciumeinstrom ist Angriffspunkt sowohl physiologischer (autonome
Nervenfasern, Hormone) als auch pharmakologischer Beeinflussung der
Herztätigkeit.
Der Calciumeinstrom ist Angriffspunkt sowohl physiologischer (autonome
Nervenfasern, Hormone) als auch pharmakologischer Beeinflussung der
Herztätigkeit.
 Azidose
Azidose und
Calciumantagonisten hemmen den Calcium-Einstrom,
Katecholamine verstärken ihn.
Calciumantagonisten
verkürzen die Dauer des Aktionspotentials und haben einen
blutdrucksenkenden Effekt - sowohl durch herabgesetzte Schlagkraft am Herzen
(negative Inotropie) als auch durch vaskuläre Dilatation (Herabsetzung des peripheren Widerstands).
 Erhöhung der H+- und Ca++-Konzentration in Herzmuskelzellen tritt bei Sauerstoffmangel (Mangeldurchblutung: Ischämie)
auf und führt zu einer Schließung von Konnexonen an gap
junctions. Das behindert den Stromfluss zwischen den Zellen (erhöhter
Innenwiderstand) und verlangsamt die Erregungsausbreitung. Dies wiederum erhöht
die Wahrscheinlichkeit eines Auftretens von kreisenden Erregungen (Re-entry) in
Vorhöfen / Ventrikeln, was Flattern oder Flimmern zur Folge haben kann
(Kammerflimmern ist lebensbedrohlich - Defibrillation erforderlich).
Erhöhung der H+- und Ca++-Konzentration in Herzmuskelzellen tritt bei Sauerstoffmangel (Mangeldurchblutung: Ischämie)
auf und führt zu einer Schließung von Konnexonen an gap
junctions. Das behindert den Stromfluss zwischen den Zellen (erhöhter
Innenwiderstand) und verlangsamt die Erregungsausbreitung. Dies wiederum erhöht
die Wahrscheinlichkeit eines Auftretens von kreisenden Erregungen (Re-entry) in
Vorhöfen / Ventrikeln, was Flattern oder Flimmern zur Folge haben kann
(Kammerflimmern ist lebensbedrohlich - Defibrillation erforderlich).
Je
langsamer sich die Erregung ausbreitet und je kürzer die Refraktärzeit
(Plateauphase) dauert, umso größer wird die Wahrscheinlichkeit eines Reentry
|
Rhythmusstörungen werden mit Antiarrhythmika
behandelt (Klasse I - Natriumkanalblocker, Klasse II - Betablocker,
Klasse III - Kaliumkanalblocker, Klasse IV - Calciumkanalblocker).
 "Channelopathien":
Kommt es durch Genmutation zu Veränderung der Struktur oder Zahl von
Ionenkanälen (z.B. Natrium-, Kaliumkanälen) oder ist deren Expression in der
Membran von Kardiomyozyten herunterreguliert (z.B. bei
Herzinsuffizienz), können Extrasystolen, Herzblock oder Arrhythmien
auftreten, die u.U. einen plötzlichen Herztod bedingen (z.B. Brugada-Syndrom:
Ionenkanalstörung, die meist asymptomatisch bleibt, aber zu
prlötzlichem Herztod führen kann). Kaliumkanal-Defekte bewirken
gestörte Repolarisation, Verlängerung des Aktionspotentials (Long-QT-Syndrom) und erhöhtes Risiko für Kammerflattern oder -flimmern.
"Channelopathien":
Kommt es durch Genmutation zu Veränderung der Struktur oder Zahl von
Ionenkanälen (z.B. Natrium-, Kaliumkanälen) oder ist deren Expression in der
Membran von Kardiomyozyten herunterreguliert (z.B. bei
Herzinsuffizienz), können Extrasystolen, Herzblock oder Arrhythmien
auftreten, die u.U. einen plötzlichen Herztod bedingen (z.B. Brugada-Syndrom:
Ionenkanalstörung, die meist asymptomatisch bleibt, aber zu
prlötzlichem Herztod führen kann). Kaliumkanal-Defekte bewirken
gestörte Repolarisation, Verlängerung des Aktionspotentials (Long-QT-Syndrom) und erhöhtes Risiko für Kammerflattern oder -flimmern.
 Die extrazelluläre Kaliumkonzentration beeinflusst die Herzfunktion:
Die extrazelluläre Kaliumkonzentration beeinflusst die Herzfunktion:
 Hypokaliämie
Hypokaliämie
(<3,5 mM) kann in Folge von Kaliumverlust (Diuretikatherapie:
Thiazide), intensivem Erbrechen, schwerer Diarrhoe oder Verbrennungen
auftreten. Der niedrige extrazelluläre Kaliumspiegel reduziert die
Aktivität der Na/K-ATPase und der Kaliumkanäle (K
ir, K
v),
was den repolarisierenden Kaliumstrom senkt. Die Plateauphase und
Phase-3-Repolarisierung werden dadurch verlängert, das kann
Arrhythmien
(Herzrhythmusstörungen) bewirken (die Herzmuskelzelle versucht, die
erhöhte Calciumlast des verlängerten Aktionspotentials durch
verstärkten Natriumeinstrom loszuwerden); im EKG kann eine U-Welle
auftreten.
 Hyperkaliämie kann bei
Hyperkaliämie kann bei Niereninsuffizienz, Crush-Syndrom, Transfusion abgelaufener Blutkonserven,
Hämolyse (z.B. Süßwasser in der Lunge) auftreten
. Sie reduziert den Betrag von Ruhe- und Aktionspotential
(geringer transmembranaler Kaliumgradient), stört die Erregungsleitung und kann ebenfalls Arrhythmien hervorrufen. Ist der Kaliumspiegel
stark erhöht
(>7,5 mM), nehmen
Sinusknotenfunktion, Leitungsgeschwindigkeit und
Aktionspotentialdauer sowie Calciumeintritt in die Zelle ab,
ventrikuläre Tachykardie kann auftreten, das Herz in Diastole
stillstehen (Asystolie).
Ab ~10 mM extrazellulärer Kaliumkonzentration sind Herzmuskelzellen stark depolarisiert und können asystolisch werden
|
Kardiopleg(isch)e Lösungen
mit hoher Kaliumkonzentration (>12 mM, typischerweise 20 mM) werden in der Herzchirurgie
eingesetzt, um das Myokard vorübergehend unerregbar zu machen und den
Herzschlag anzuhalten (Spenderherz). Kardioplegische Lösungen werden über die Koronararterien zugeführt, um die Herzmuskelzellen effizient zu erreichen.


 Ungereizte Arbeitsmyokardzellen haben ein konstantes Ruhepotential. Dieses entsteht durch Kaliumausstrom via "einwärts- gleichrichtende" Kaliumkanäle (Kir) und hält
die Natriumkanäle geschlossen. Der Betrag des Kaliumaustritts ist
gering, da das Ruhepotential (-80 bis -90 mV) nahe am
Gleichgewichtspotential für Kalium liegt (-94 mV). Bei Depolarisierung
verliert die Zelle weniger Kalium. Im
Zytosol vorhandenes Ca++ wird gegen 3Na+ ausgetauscht (~75% des Ca++-Auswärtstransportes).
Ähnlich nutzen Na/H-Austauscher des Natriumgradienten zur Entfernung
von H-Ionen aus der Herzmuskelzelle (Na+ wird über die basolaterale Na/K-ATPase aus der Zelle gebracht). Restliches Ca++ wird durch eine Ca-ATPase in das sarkoplasmatische Retikulum gepumpt Ungereizte Arbeitsmyokardzellen haben ein konstantes Ruhepotential. Dieses entsteht durch Kaliumausstrom via "einwärts- gleichrichtende" Kaliumkanäle (Kir) und hält
die Natriumkanäle geschlossen. Der Betrag des Kaliumaustritts ist
gering, da das Ruhepotential (-80 bis -90 mV) nahe am
Gleichgewichtspotential für Kalium liegt (-94 mV). Bei Depolarisierung
verliert die Zelle weniger Kalium. Im
Zytosol vorhandenes Ca++ wird gegen 3Na+ ausgetauscht (~75% des Ca++-Auswärtstransportes).
Ähnlich nutzen Na/H-Austauscher des Natriumgradienten zur Entfernung
von H-Ionen aus der Herzmuskelzelle (Na+ wird über die basolaterale Na/K-ATPase aus der Zelle gebracht). Restliches Ca++ wird durch eine Ca-ATPase in das sarkoplasmatische Retikulum gepumpt
 Ein komplexes
Zusammenwirken verschiedener Ionenströme ergibt das charakteristische
Aktionspotential einer Herzmuskelzelle. Je nach Ausstattung mit
Kanalproteinen nimmt dieses unterschiedliche Form und Dauer an. Das
Aktionspotential der Arbeitsmuskelzellen (<200 bis 350 ms) erfolgt durch raschen
Natriumeinstrom via spannunsgesteuerte Natriumkanäle. Im Ruhezustand
sind diese geschlossen; bei Überschreitung des Schwellenpotentials
durch Erregung von Nachbarzellen öffnet der Kanal, Natrium strömt ein -
für 1 ms, dann wird der Kanal inaktiviert,
der Natriumeinstrom versiegt. Erst am Ende der Refraktärzeit
(Plateauphase: depolarisierende Ca++- und repolarisierende K+-Ströme halten sich die Waage) stellt sich die "geschlossene" Konformation der Natriumkanäle wieder ein,
die im Gegensatz zur "inaktivierten" durch Depolarisierung beendet
werden kann. Im Sinusknoten erfolgt die (langsamere) Depolarisierung durch Ca++-Einstrom (L-Typ-Calciumkanäle). Die Repolarisierung erfolgt durch Kaliumausstrom; erhöhter
Sympathikustonus steigert diesen und
verkürzt das Aktionspotential (Zeit für höhere Schlagfrequenzen). Etwa 10 ms nach Auftreten des Aktionspotentials beginnt die Kontraktion Ein komplexes
Zusammenwirken verschiedener Ionenströme ergibt das charakteristische
Aktionspotential einer Herzmuskelzelle. Je nach Ausstattung mit
Kanalproteinen nimmt dieses unterschiedliche Form und Dauer an. Das
Aktionspotential der Arbeitsmuskelzellen (<200 bis 350 ms) erfolgt durch raschen
Natriumeinstrom via spannunsgesteuerte Natriumkanäle. Im Ruhezustand
sind diese geschlossen; bei Überschreitung des Schwellenpotentials
durch Erregung von Nachbarzellen öffnet der Kanal, Natrium strömt ein -
für 1 ms, dann wird der Kanal inaktiviert,
der Natriumeinstrom versiegt. Erst am Ende der Refraktärzeit
(Plateauphase: depolarisierende Ca++- und repolarisierende K+-Ströme halten sich die Waage) stellt sich die "geschlossene" Konformation der Natriumkanäle wieder ein,
die im Gegensatz zur "inaktivierten" durch Depolarisierung beendet
werden kann. Im Sinusknoten erfolgt die (langsamere) Depolarisierung durch Ca++-Einstrom (L-Typ-Calciumkanäle). Die Repolarisierung erfolgt durch Kaliumausstrom; erhöhter
Sympathikustonus steigert diesen und
verkürzt das Aktionspotential (Zeit für höhere Schlagfrequenzen). Etwa 10 ms nach Auftreten des Aktionspotentials beginnt die Kontraktion
 Sinusknotenzellen verfügen über spannungsabhängige Kaliumkanäle, ihr Membranpotential erreicht lediglich
-50 bis -70 mV (Arbeitsmyokard -80 bis -90 mV) und ist instabil. Die Steilheit dieses Schrittmacherpotentials
wird von Na- und Ca-Einstrom durch verschiedene Ionenkanäle
beeinflusst. Ein Schrittmacherstrom (If) durch unspezifische Kationenkanäle (HCN-Kanäle) bewirkt spontane Depolarisierung. Sympathikuseinfluss
steigert über cAMP die Öffnungswahrscheinlichkeit der HCN-Kanäle, der
depolarisierende Kationeneinstrom nimmt zu. Bei Erreichen des Schwellenpotentials (-40 bis -55 mV) entsteht ein Ca++-betriebenes Aktionspotential. In der Repolarisierungsphase schließen die Ca++-Kanäle,
spannungsgesteuerte K-Kanäle öffnen, die Zelle repolarisiert.
Die intrinsische Frequenz des Sinusknotens beträgt
~100/min, sie wird durch parasympathischen Einfluss gesenkt (Ruhefrequenz) Sinusknotenzellen verfügen über spannungsabhängige Kaliumkanäle, ihr Membranpotential erreicht lediglich
-50 bis -70 mV (Arbeitsmyokard -80 bis -90 mV) und ist instabil. Die Steilheit dieses Schrittmacherpotentials
wird von Na- und Ca-Einstrom durch verschiedene Ionenkanäle
beeinflusst. Ein Schrittmacherstrom (If) durch unspezifische Kationenkanäle (HCN-Kanäle) bewirkt spontane Depolarisierung. Sympathikuseinfluss
steigert über cAMP die Öffnungswahrscheinlichkeit der HCN-Kanäle, der
depolarisierende Kationeneinstrom nimmt zu. Bei Erreichen des Schwellenpotentials (-40 bis -55 mV) entsteht ein Ca++-betriebenes Aktionspotential. In der Repolarisierungsphase schließen die Ca++-Kanäle,
spannungsgesteuerte K-Kanäle öffnen, die Zelle repolarisiert.
Die intrinsische Frequenz des Sinusknotens beträgt
~100/min, sie wird durch parasympathischen Einfluss gesenkt (Ruhefrequenz)
 Erregungsbildung und Reizleitung im Herzen erfolgt über Sinusknoten
(physiologischer Schrittmacher), AV-Knoten (langsame Leitung), His-Bündel (Verbindung
Vorhof-Kammer), Kammerschenkel, Purkinje-Fasern (optimale Erregungsverteilung, lange Refrakterität).
Aktionspotentiale breiten sich über über gap junctions (disci
intercalares: Stellen stark reduzierten elektrischen Widerstandes mit
hoher Dichte spannungsgesteuerter Natriumkanäle) auf das gesamte Myokard aus (funktionelles Synzytium). Das erzeugt elektrische Felder, deren räumlich-zeitliche Auswirkung von der Körperoberfläche abgegriffen werden kann: Im
EKG bedeutet die P-Welle die Erregungsausbreitung über die Vorhöfe und
der QRS-Komplex die Erregungsausbreitung über die Ventrikel Erregungsbildung und Reizleitung im Herzen erfolgt über Sinusknoten
(physiologischer Schrittmacher), AV-Knoten (langsame Leitung), His-Bündel (Verbindung
Vorhof-Kammer), Kammerschenkel, Purkinje-Fasern (optimale Erregungsverteilung, lange Refrakterität).
Aktionspotentiale breiten sich über über gap junctions (disci
intercalares: Stellen stark reduzierten elektrischen Widerstandes mit
hoher Dichte spannungsgesteuerter Natriumkanäle) auf das gesamte Myokard aus (funktionelles Synzytium). Das erzeugt elektrische Felder, deren räumlich-zeitliche Auswirkung von der Körperoberfläche abgegriffen werden kann: Im
EKG bedeutet die P-Welle die Erregungsausbreitung über die Vorhöfe und
der QRS-Komplex die Erregungsausbreitung über die Ventrikel
 Das Herz steht unter dem Einfluss hormoneller, neuraler und physikalischer Faktoren. Sympathischer Einfluss aus dem kardioakzeleratorischen Zentrum der medulla oblongata beschleunigt
und kräftigt, parasympathischer bremst die Herztätigkeit
(kardioinhibitorisches Zentrum). Die
Herzfrequenz beträgt im Ruhezustand rund 60 (im Liegen) bis 80 (im
Stehen) Schläge pro Minute (Normokardie). Herzfrequenz über 100/min
heisst Tachykardie (z.B. Stress), Bradykardie ist eine Frequenz unter 60 (z.B. non-REM-Schlaf) Das Herz steht unter dem Einfluss hormoneller, neuraler und physikalischer Faktoren. Sympathischer Einfluss aus dem kardioakzeleratorischen Zentrum der medulla oblongata beschleunigt
und kräftigt, parasympathischer bremst die Herztätigkeit
(kardioinhibitorisches Zentrum). Die
Herzfrequenz beträgt im Ruhezustand rund 60 (im Liegen) bis 80 (im
Stehen) Schläge pro Minute (Normokardie). Herzfrequenz über 100/min
heisst Tachykardie (z.B. Stress), Bradykardie ist eine Frequenz unter 60 (z.B. non-REM-Schlaf)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Erregungsausbreitung im Herzmuskel
Erregungsausbreitung im Herzmuskel
 Arrhythmie: ἄρρυϑμος = unrhythmisch (ῥυθμός = Rhythmus)
Arrhythmie: ἄρρυϑμος = unrhythmisch (ῥυθμός = Rhythmus) Erregtes Myokard
Erregtes Myokard  Aktionspotential des Arbeitsmyokards
Aktionspotential des Arbeitsmyokards  Triggerung eines Herzschlags
Triggerung eines Herzschlags  Reizleitungssystem
Reizleitungssystem  Erregungsausbreitung
Erregungsausbreitung  Einfluss des autonomen Nervensystems
Einfluss des autonomen Nervensystems
 Core messages
Core messages

 Abbildung: Transmembranale Gradienten und Ionenströme in einer unerregten Herzmuskelzelle
Abbildung: Transmembranale Gradienten und Ionenströme in einer unerregten Herzmuskelzelle
 Abbildung) und ermöglichen
Kaliumionen, aus der Zelle zu diffundieren. Die Zahl verschiedener Kaliumkanäle im menschlichen Genom ist hoch (spannungsabhängige, calciumabhängige, Kir-Kanäle). Die Kaliumselektivität der zentralen Pore der Kir-Kanäle ist durch ein spezielles Aminosäuremotiv bedingt, das zwar nicht zu den spannungssensitiven Schleifen zählt, aber bei abnehmendem Membranpotential seine
Kaliumleitfähigkeit reduziert (daher "inward rectifying") -
intrazelluläre Magnesiumionen und Polyamine verengen den Kanal bei
Auswärtsstrom. Das bedeutet, bei Depolarisierung der Herzmuskelzelle nimmt die Leitfähigkeit der Kir-Kanäle ab, die Zelle verliert weniger Kalium - wichtig vor allem während des langen Aktionspotentials mit dem Plateau nahe der Nulllinie.
Abbildung) und ermöglichen
Kaliumionen, aus der Zelle zu diffundieren. Die Zahl verschiedener Kaliumkanäle im menschlichen Genom ist hoch (spannungsabhängige, calciumabhängige, Kir-Kanäle). Die Kaliumselektivität der zentralen Pore der Kir-Kanäle ist durch ein spezielles Aminosäuremotiv bedingt, das zwar nicht zu den spannungssensitiven Schleifen zählt, aber bei abnehmendem Membranpotential seine
Kaliumleitfähigkeit reduziert (daher "inward rectifying") -
intrazelluläre Magnesiumionen und Polyamine verengen den Kanal bei
Auswärtsstrom. Das bedeutet, bei Depolarisierung der Herzmuskelzelle nimmt die Leitfähigkeit der Kir-Kanäle ab, die Zelle verliert weniger Kalium - wichtig vor allem während des langen Aktionspotentials mit dem Plateau nahe der Nulllinie. 
 Abbildung: Funktionszyklus einer Na/K-ATPase
Abbildung: Funktionszyklus einer Na/K-ATPase
 Natriumkanäle ermöglichen Natriumeinstrom (INa) in der Phase-0-Depolarisation von Arbeitsmuskelzellen (nicht Schrittmacherzellen)
Natriumkanäle ermöglichen Natriumeinstrom (INa) in der Phase-0-Depolarisation von Arbeitsmuskelzellen (nicht Schrittmacherzellen) Calciumkanäle ermöglichen Calciumeinstrom (ICa) für die Depolarisation in Schrittmacherzellen (Sinusknoten, AV-Knoten)
Calciumkanäle ermöglichen Calciumeinstrom (ICa) für die Depolarisation in Schrittmacherzellen (Sinusknoten, AV-Knoten) Allen Herzmuskelzellen ist gemeinsam, dass verschiedene Kaliumkanäle den Kaliumausstrom (IK) und damit die Repolarisierung ermöglichen - angeregt durch das Membranpotential oder durch Signalstoffe wie ATP oder Acetylcholin.
Allen Herzmuskelzellen ist gemeinsam, dass verschiedene Kaliumkanäle den Kaliumausstrom (IK) und damit die Repolarisierung ermöglichen - angeregt durch das Membranpotential oder durch Signalstoffe wie ATP oder Acetylcholin.  Durch nichtselektive Kationenkanäle fließt Schrittmacherstrom (If), der sich an der Depolarisation von Schrittmacherzellen (Sinusknoten-, AV-Knoten-, Purkinjefasern) beteiligt.
Durch nichtselektive Kationenkanäle fließt Schrittmacherstrom (If), der sich an der Depolarisation von Schrittmacherzellen (Sinusknoten-, AV-Knoten-, Purkinjefasern) beteiligt.
 Calciumkanäle
in Herzmuskelzellen funktionieren unterschiedlich: In Zellen des
Arbeitsmyokards öffnen sie erst, wenn die Zellmembran vollständig
depolarisiertt ist und bleiben während der Plateauphase geöffnet; in
autorhythmischen Zellen öffnen sie schon bei einem Membranpotential von
-50 mV und schließen, wenn +20 mV erreicht sind.
Calciumkanäle
in Herzmuskelzellen funktionieren unterschiedlich: In Zellen des
Arbeitsmyokards öffnen sie erst, wenn die Zellmembran vollständig
depolarisiertt ist und bleiben während der Plateauphase geöffnet; in
autorhythmischen Zellen öffnen sie schon bei einem Membranpotential von
-50 mV und schließen, wenn +20 mV erreicht sind.
 Abbildung: Aktionspotential und Refrakterität
Abbildung: Aktionspotential und Refrakterität
 Abbildung)
Abbildung) blitzartigen
Natriumeinstrom (wie bei Nervenzellen) - bei Zellen des
Erregungsbildungs- und -leitungssystems stattdessen ein etwas
langsameres Einströmen von Calciumionen -, was rasche
Depolarisierung und Erregungsausbreitung ermöglicht;
blitzartigen
Natriumeinstrom (wie bei Nervenzellen) - bei Zellen des
Erregungsbildungs- und -leitungssystems stattdessen ein etwas
langsameres Einströmen von Calciumionen -, was rasche
Depolarisierung und Erregungsausbreitung ermöglicht;  andererseits durch lange Refrakterität, was die sich kontrahierende Zelle vor irregulärer Erregung und Arrhythmien
andererseits durch lange Refrakterität, was die sich kontrahierende Zelle vor irregulärer Erregung und Arrhythmien  schützt. Diese Refraktärperiode - gekennzeichnet durch das "Plateau" im Aktionspotentialverlauf - verhindert vorzeitige
Wiedererregung und gewährleistet ordnungsgemäße
Synchronisation der pumpenden Muskelzellen.
schützt. Diese Refraktärperiode - gekennzeichnet durch das "Plateau" im Aktionspotentialverlauf - verhindert vorzeitige
Wiedererregung und gewährleistet ordnungsgemäße
Synchronisation der pumpenden Muskelzellen.
 Abbildung). Dabei reagieren sie auf den Betrag des aktuellen Membranpotentials, sie fungieren als Spannunssensoren.
Abbildung). Dabei reagieren sie auf den Betrag des aktuellen Membranpotentials, sie fungieren als Spannunssensoren.
 Abbildung: Spannungssensitiver Natriumkanal
Abbildung: Spannungssensitiver Natriumkanal
 Im Ruhezustand (Ruhepotential) liegen sie in einem durch einen Teil des Porenkomplexes blockierten Zustand vor, sie sind "geschlossen".
Im Ruhezustand (Ruhepotential) liegen sie in einem durch einen Teil des Porenkomplexes blockierten Zustand vor, sie sind "geschlossen".  Depolarisiert
die Zelle über den Betrag des Schwellenpotentials (-60 bis -65 mV) - weil sie im Zuge einer Erregungsausbreitung von
Nachbarzellen gereizt wird -, kommt es zu einer sterischen Umlagerung
im Proteinkomplex, und der Kanal ist "offen", die Permeabilität steigt auf das 100-fache, Natrium strömt ein (fast inward current iNa: ~104 Ionen pro Millisekunde). Der Natriumkanal funktioniert spannungsabhängig (er öffnet bei einem bestimmten Potential) und zeitabhängig (die Öffnungszeit ist limitiert).
Depolarisiert
die Zelle über den Betrag des Schwellenpotentials (-60 bis -65 mV) - weil sie im Zuge einer Erregungsausbreitung von
Nachbarzellen gereizt wird -, kommt es zu einer sterischen Umlagerung
im Proteinkomplex, und der Kanal ist "offen", die Permeabilität steigt auf das 100-fache, Natrium strömt ein (fast inward current iNa: ~104 Ionen pro Millisekunde). Der Natriumkanal funktioniert spannungsabhängig (er öffnet bei einem bestimmten Potential) und zeitabhängig (die Öffnungszeit ist limitiert). Nach
etwa einer Millisekunde im depolarisierten Zustand verändert sich die
Gestalt des Kanals wiederum: Ein anderer Teil des Porenkomplexes legt
sich in die Öffnung und "inaktiviert" (verschließt) den Kanal (Verschluss der Pore durch das Inaktivierungsmotiv,
Nach
etwa einer Millisekunde im depolarisierten Zustand verändert sich die
Gestalt des Kanals wiederum: Ein anderer Teil des Porenkomplexes legt
sich in die Öffnung und "inaktiviert" (verschließt) den Kanal (Verschluss der Pore durch das Inaktivierungsmotiv,  Abbildung), der Natriumeinstrom versiegt. Das Natrium-Gleichgewichtspotential (+70 mV) wird nicht erreicht, die Spitze des Aktionspotentials liegt bei +30 bis +40 mV.
Abbildung), der Natriumeinstrom versiegt. Das Natrium-Gleichgewichtspotential (+70 mV) wird nicht erreicht, die Spitze des Aktionspotentials liegt bei +30 bis +40 mV.  Der Natriumkanalblocker Lidocain - der üblicherweise zur Lokalanästhesie angewendet wird - wirkt auch antiarrhythmisch
am Herzen. Lidocain bindet in der Phase 0 des
Herzmuskelaktionspotentials an einige der offenen Natriumkanäle und
blockiert sie vorübergehend. Lidocain
dissoziiert von den Kanälen rasch genug, dass diese beim nächsten
regulären Aktionspotential wieder frei sind; aber nicht so rasch, dass
dies auch bei verfrühten Erregungen der Fall wäre - daher der
rhythmusstabilisierende Effekt.
Der Natriumkanalblocker Lidocain - der üblicherweise zur Lokalanästhesie angewendet wird - wirkt auch antiarrhythmisch
am Herzen. Lidocain bindet in der Phase 0 des
Herzmuskelaktionspotentials an einige der offenen Natriumkanäle und
blockiert sie vorübergehend. Lidocain
dissoziiert von den Kanälen rasch genug, dass diese beim nächsten
regulären Aktionspotential wieder frei sind; aber nicht so rasch, dass
dies auch bei verfrühten Erregungen der Fall wäre - daher der
rhythmusstabilisierende Effekt. Abbildung zeigt,
lassen diese Kanäle im Laufe eines Aktionspotentials bestimmte Ionen zu
unterschiedlichen Zeiten (und unterschiedlich stark) durch die
Zellmembran strömen:
Abbildung zeigt,
lassen diese Kanäle im Laufe eines Aktionspotentials bestimmte Ionen zu
unterschiedlichen Zeiten (und unterschiedlich stark) durch die
Zellmembran strömen:
 Abbildung: Aktionspotential und Ionenströme in Myokardzellen (Synposis)
Abbildung: Aktionspotential und Ionenströme in Myokardzellen (Synposis) Phase 1: Die Natriumkanäle schließen wieder, transienter Kalium-Ausstrom (ITO: transient outward current) wirkt leicht repolarisierend (early repolarization). Durch L-Typ Ca++-Kanäle strömt Ca++ ein.
Phase 1: Die Natriumkanäle schließen wieder, transienter Kalium-Ausstrom (ITO: transient outward current) wirkt leicht repolarisierend (early repolarization). Durch L-Typ Ca++-Kanäle strömt Ca++ ein.
 Ionenkanäle und ihre funktionelle Bedeutung:
Ionenkanäle und ihre funktionelle Bedeutung:

 Depolarisationsphase ("Aufstrich"): In der ersten Phase (Phase 0) des Aktionspotentials
erfolgt - nach einer Depolariation auf ein kritisches Potential von -55 bis -65 mV (Schwellenpotential) - im Arbeitsmyokard rascher Natriumeinstrom (iNa) durch spannungsgesteuerte Na+-Kanäle
(wie bei Nervenfasern)
und explosionsartige Depolarisation ("Alles-oder-Nichts"). Dabei steigt
die Leitfähigkeit der Membran für Natriumionen etwa 100-fach an, es kommt zu kurzzeitiger "Umpolung" der Zelle. Der
Wert des Natrium-Gleichgewichtspotentials
von +70 mV (Nernst-Gleichung!) wird nicht erreicht, weil auch ein Kalium-Gegenstrom besteht - der Höchstwert des Membranpotentials für ein Leifähigkeitsverhältnis Na/K von 10:1 wäre +55 mV -, inactivation gates der Natriumkanäle schließen und der Natriumeinstrom rasch
wieder erlischt.
Depolarisationsphase ("Aufstrich"): In der ersten Phase (Phase 0) des Aktionspotentials
erfolgt - nach einer Depolariation auf ein kritisches Potential von -55 bis -65 mV (Schwellenpotential) - im Arbeitsmyokard rascher Natriumeinstrom (iNa) durch spannungsgesteuerte Na+-Kanäle
(wie bei Nervenfasern)
und explosionsartige Depolarisation ("Alles-oder-Nichts"). Dabei steigt
die Leitfähigkeit der Membran für Natriumionen etwa 100-fach an, es kommt zu kurzzeitiger "Umpolung" der Zelle. Der
Wert des Natrium-Gleichgewichtspotentials
von +70 mV (Nernst-Gleichung!) wird nicht erreicht, weil auch ein Kalium-Gegenstrom besteht - der Höchstwert des Membranpotentials für ein Leifähigkeitsverhältnis Na/K von 10:1 wäre +55 mV -, inactivation gates der Natriumkanäle schließen und der Natriumeinstrom rasch
wieder erlischt. 
 Abbildung: Aktionspotential einer Arbeitsmuskelzelle (fast-response)
Abbildung: Aktionspotential einer Arbeitsmuskelzelle (fast-response) Abbildung oben).
Abbildung oben). Anschließend ("Spitze" des Aktionspotentials) werden die Natriumkanäle (und/oder Calciumkanäle) inaktiviert, der Einstrom von Na+ kommt zum Stillstand. Diese Inaktivierung ist der führende Beitrag zum Zustandekommen der Phase 1 und bewirkt (wenn vorhanden) eine erste kurze Repolarisation (Phase 1) (
Anschließend ("Spitze" des Aktionspotentials) werden die Natriumkanäle (und/oder Calciumkanäle) inaktiviert, der Einstrom von Na+ kommt zum Stillstand. Diese Inaktivierung ist der führende Beitrag zum Zustandekommen der Phase 1 und bewirkt (wenn vorhanden) eine erste kurze Repolarisation (Phase 1) ( Abbildung).
Kalium- und Chloridionen können sich weiterhin durch die Membran bewegen - Kalium durch TO-Kanäle (transient outward) aus der Zelle, Chlorid durch Chloridkanäle in die Zelle; dies trägt zur Entstehung der Phase 1 bei. Subepikardiale und Purkinje-Zellen zeigen eine ausgeprägte Phase 1.
Abbildung).
Kalium- und Chloridionen können sich weiterhin durch die Membran bewegen - Kalium durch TO-Kanäle (transient outward) aus der Zelle, Chlorid durch Chloridkanäle in die Zelle; dies trägt zur Entstehung der Phase 1 bei. Subepikardiale und Purkinje-Zellen zeigen eine ausgeprägte Phase 1. Plateauphase (Phase 2): Verzögerte Repolarisation. Synchron mit dem explosiven Einstrom von Na+ (Phase 0) beginnt auch der Einstrom von Ca++ durch L-Typ-Ca++-Kanäle (DHPR: Dihydropyridinrezeptoren), die besonders dicht in transversalen Tubuli vertreten sind. Dieser Calciumstrom ICa
erreicht schon in Phase 1 etwa 40% seines Maximums. Sein Betrag ist
niedriger als derjenige durch rasche Natriumkanäle, aber gerade groß
genug, um den Effekt des Kaliumausstroms aus der Zelle zu kompensieren;
das Membranpotential bleibt nahe 0 mV stabilisiert (Plateau). Während Na+-Kanäle nach ihrer explosiven Öffnung innerhalb weniger Millisekunden wieder verschlossen sind, erreicht der Ca++-Einstrom
sein Maximum nach 2-7 ms und bleibt dann lange erhalten, wenn auch mit
sinkender Tendenz - die Kanäle inaktivieren nur langsam, das Plateau kann 200-400 ms dauern.
Plateauphase (Phase 2): Verzögerte Repolarisation. Synchron mit dem explosiven Einstrom von Na+ (Phase 0) beginnt auch der Einstrom von Ca++ durch L-Typ-Ca++-Kanäle (DHPR: Dihydropyridinrezeptoren), die besonders dicht in transversalen Tubuli vertreten sind. Dieser Calciumstrom ICa
erreicht schon in Phase 1 etwa 40% seines Maximums. Sein Betrag ist
niedriger als derjenige durch rasche Natriumkanäle, aber gerade groß
genug, um den Effekt des Kaliumausstroms aus der Zelle zu kompensieren;
das Membranpotential bleibt nahe 0 mV stabilisiert (Plateau). Während Na+-Kanäle nach ihrer explosiven Öffnung innerhalb weniger Millisekunden wieder verschlossen sind, erreicht der Ca++-Einstrom
sein Maximum nach 2-7 ms und bleibt dann lange erhalten, wenn auch mit
sinkender Tendenz - die Kanäle inaktivieren nur langsam, das Plateau kann 200-400 ms dauern.  Abbildung oben).
Abbildung oben). L-Typ-Ca++-Kanäle werden durch Ca++-Kanalblocker
("Calciumblocker", "Calciumantagonisten") wie Verapamil, Diltiazem oder
Dihydropyridin teilweise inaktiviert. Diese Stoffgruppe wird zur Schonung des Myokards
eingesetzt, z.B. bei Durchblutungsstörungen (Angina pectoris) oder
Bluthochdruck.
L-Typ-Ca++-Kanäle werden durch Ca++-Kanalblocker
("Calciumblocker", "Calciumantagonisten") wie Verapamil, Diltiazem oder
Dihydropyridin teilweise inaktiviert. Diese Stoffgruppe wird zur Schonung des Myokards
eingesetzt, z.B. bei Durchblutungsstörungen (Angina pectoris) oder
Bluthochdruck. In der Plateauphase werden depolarisierende Ionenströme (Ca++-Einstrom, Na+/Ca++-Antiporter) durch K+-Ströme aus der Zelle ausbalanciert. Im depolarisierten Zustand ist der Kaliumstrom IKir durch die "delayed-rectifier"-Kaliumkanäle
- durch Anlagerung von Magnesiumionen und Polyaminen an der
Kanalinnenseite - ohnehin reduziert; auf diese Weise wird die Zahl der
ausströmenden K+- und einströmenden Ca++-Ionen während der lange dauernden Phase 2 gering gehalten und damit Energie gespart.
In der Plateauphase werden depolarisierende Ionenströme (Ca++-Einstrom, Na+/Ca++-Antiporter) durch K+-Ströme aus der Zelle ausbalanciert. Im depolarisierten Zustand ist der Kaliumstrom IKir durch die "delayed-rectifier"-Kaliumkanäle
- durch Anlagerung von Magnesiumionen und Polyaminen an der
Kanalinnenseite - ohnehin reduziert; auf diese Weise wird die Zahl der
ausströmenden K+- und einströmenden Ca++-Ionen während der lange dauernden Phase 2 gering gehalten und damit Energie gespart. Die Bedeutung von Ca++-Ionen für die Herzfunktion wurde zufällig im Labor des britischen Physiologen und Pharmakologen Sidney Ringer (berühmt vor allem durch die nach ihm benannte Ringer-Lösung,
die neben Natrium- und Kalium- auch Calciumchlorid enthält) entdeckt (damit beim Ansetzen der Ringer‐Lösung keine Eintrübung
erfolgt - Calciumhydroxid‐Fällung -, kommt es wesentlich auf die
Reihenfolge zur Mischung der Komponenten an):
Statt destilliertem Wasser verwendete sein Assistent bei der
Zubereitung von NaCl- und KCl-Lösungen Leitungswasser, dessen [Ca++]
ähnlich hoch wie im Blut ist (die Beobachtung erfolgte in einem Labor
in London).
Die Bedeutung von Ca++-Ionen für die Herzfunktion wurde zufällig im Labor des britischen Physiologen und Pharmakologen Sidney Ringer (berühmt vor allem durch die nach ihm benannte Ringer-Lösung,
die neben Natrium- und Kalium- auch Calciumchlorid enthält) entdeckt (damit beim Ansetzen der Ringer‐Lösung keine Eintrübung
erfolgt - Calciumhydroxid‐Fällung -, kommt es wesentlich auf die
Reihenfolge zur Mischung der Komponenten an):
Statt destilliertem Wasser verwendete sein Assistent bei der
Zubereitung von NaCl- und KCl-Lösungen Leitungswasser, dessen [Ca++]
ähnlich hoch wie im Blut ist (die Beobachtung erfolgte in einem Labor
in London). 
 Endgültige Repolarisation (Phase 3): Schließlich kommt es zu
verstärktem Kaliumausstrom durch "untraschnelle" (Kur: ultra-rapid), "schnelle" (Kr: rapid) und "langsame" (Ks: slow) Kaliumkanäle bei gleichzeitig versiegendem Ca++-Einstrom. Später kommen noch weitere Kaliumkanäle dazu, wie KP (p für Plateau) oder K1. Auch ein Chloridkanal (KCl)
mischt mit - Chlorideinstrom trägt zur Repolarisierung bei.
Endgültige Repolarisation (Phase 3): Schließlich kommt es zu
verstärktem Kaliumausstrom durch "untraschnelle" (Kur: ultra-rapid), "schnelle" (Kr: rapid) und "langsame" (Ks: slow) Kaliumkanäle bei gleichzeitig versiegendem Ca++-Einstrom. Später kommen noch weitere Kaliumkanäle dazu, wie KP (p für Plateau) oder K1. Auch ein Chloridkanal (KCl)
mischt mit - Chlorideinstrom trägt zur Repolarisierung bei.  Phase 4 entspricht der "elektrischen Diastole" und wird auch als diastolisches Potential bezeichnet.
Phase 4 entspricht der "elektrischen Diastole" und wird auch als diastolisches Potential bezeichnet. 
 Abbildung: Aktionspotential, intrazelluläre Calciumkonzentration und Kontraktionskraft einer Arbeitsmyokardzelle
Abbildung: Aktionspotential, intrazelluläre Calciumkonzentration und Kontraktionskraft einer Arbeitsmyokardzelle Die während eines Aktionspotentials über die Membran ausgetauschte Menge an Natrium- und Kaliumionen ist sehr gering ([Na+] in der Zelle steigt um ~0,02%, [K+] sinkt um ~0,001%
der in der Zelle enthaltenen Menge). Die Na/K-Pumpe läuft
kontinuierlich und stabilisiert die zellulären Ionenkonzentrationen.
Die während eines Aktionspotentials über die Membran ausgetauschte Menge an Natrium- und Kaliumionen ist sehr gering ([Na+] in der Zelle steigt um ~0,02%, [K+] sinkt um ~0,001%
der in der Zelle enthaltenen Menge). Die Na/K-Pumpe läuft
kontinuierlich und stabilisiert die zellulären Ionenkonzentrationen.  Erhöhter Sympathikustonus
steigert den repolarisierenden Kaliumausstrom
und verkürzt das Aktionspotential. Das ist notwendig, um Zeit für
höhere Schlagfrequenzen einzusparen (positive Chronotropie /
Tachykardie bei Belastung). Dies erfolgt durch Phosphorylierung der
Kaliumkanäle, was den repolarisierenden Kaliumausstrom anregt und die
Dauer des Plateaus verkürzt.
Erhöhter Sympathikustonus
steigert den repolarisierenden Kaliumausstrom
und verkürzt das Aktionspotential. Das ist notwendig, um Zeit für
höhere Schlagfrequenzen einzusparen (positive Chronotropie /
Tachykardie bei Belastung). Dies erfolgt durch Phosphorylierung der
Kaliumkanäle, was den repolarisierenden Kaliumausstrom anregt und die
Dauer des Plateaus verkürzt. Hypokaliämie reduziert den Kaliumausstrom durch Kr und stört so die Repolarisationsphase (EKG: ST-Senkung, T-Welle abgeflacht, evt. U-Welle).
Hypokaliämie reduziert den Kaliumausstrom durch Kr und stört so die Repolarisationsphase (EKG: ST-Senkung, T-Welle abgeflacht, evt. U-Welle). Ischämie / Hypoxie verkürzt die Dauer des Aktionspotentials ebenfalls durch Öffnung von KATP-Kanälen.
Ischämie / Hypoxie verkürzt die Dauer des Aktionspotentials ebenfalls durch Öffnung von KATP-Kanälen. Defekte Ionenkanäle (Natrium, Kalium) können eine Verlängerung der QT-Zeit (Long-QT-Syndrom) und Herzrhythmusstörungen bewirken.
Defekte Ionenkanäle (Natrium, Kalium) können eine Verlängerung der QT-Zeit (Long-QT-Syndrom) und Herzrhythmusstörungen bewirken.  Im inaktiven Zustand (s. oben) sind Natriumkanäle auch bei stärksten Reizen nicht aktivierbar, die Zelle ist absolut refraktär (Phase 0 bis Beginn der Phase 3).
Im inaktiven Zustand (s. oben) sind Natriumkanäle auch bei stärksten Reizen nicht aktivierbar, die Zelle ist absolut refraktär (Phase 0 bis Beginn der Phase 3).
 In der Übergangsphase zwischen 100% inaktiven und 100% wieder
"erholten" Natriumkanälen - also während des späten Aktionspotentials -
ist die Zelle relativ refraktär (späte Phase 3).
Aktionspotentiale sind in diesem Zustand zwar auslösbar, aber sie
dauern kürzer und ihre Anstiegsflanke ist flacher also sonst.
In der Übergangsphase zwischen 100% inaktiven und 100% wieder
"erholten" Natriumkanälen - also während des späten Aktionspotentials -
ist die Zelle relativ refraktär (späte Phase 3).
Aktionspotentiale sind in diesem Zustand zwar auslösbar, aber sie
dauern kürzer und ihre Anstiegsflanke ist flacher also sonst. 
 Abbildung: Aktionspotential einer Schrittmacherzelle
Abbildung: Aktionspotential einer Schrittmacherzelle
 Sinusknoten
Sinusknoten  Nachgeschaltetes Erregungsleitungssystem
Nachgeschaltetes Erregungsleitungssystem Abbildung). Sinusknotenzellen haben wesentlich weniger Kir-Kaliumkanäle als das umgebende Myokard, dafür verfügen sie über spannungsabhängige (delayed rectifier) Kaliumkanäle (Kv). Daher
erreicht das Membranpotential lediglich -50 bis -70 mV (Arbeitsmyokard -80
bis -90 mV) und ist instabil ("Schrittmacherpotential", pacemaker potential).
Abbildung). Sinusknotenzellen haben wesentlich weniger Kir-Kaliumkanäle als das umgebende Myokard, dafür verfügen sie über spannungsabhängige (delayed rectifier) Kaliumkanäle (Kv). Daher
erreicht das Membranpotential lediglich -50 bis -70 mV (Arbeitsmyokard -80
bis -90 mV) und ist instabil ("Schrittmacherpotential", pacemaker potential).  Abbildung):
Abbildung): "Fast-response" -Myozyten werden durch blitzartigen Natriumeinstrom
depolarisiert, das erhöht die
Depolarisationsgeschwindigkeit und ermöglicht rasches Weiterleiten von
Erregungswellen.
"Fast-response" -Myozyten werden durch blitzartigen Natriumeinstrom
depolarisiert, das erhöht die
Depolarisationsgeschwindigkeit und ermöglicht rasches Weiterleiten von
Erregungswellen.  "Slow-response" -Myozyten hingegen werden durch Calciumeinstrom und
sinkenden Kaliumausstrom depolarisiert, und ihr Aktionspotential sieht
insgesamt runder aus; diese Zellen sind auf Spontandepolarisation
ausgerichtet (Schrittmachereigenschaft).
"Slow-response" -Myozyten hingegen werden durch Calciumeinstrom und
sinkenden Kaliumausstrom depolarisiert, und ihr Aktionspotential sieht
insgesamt runder aus; diese Zellen sind auf Spontandepolarisation
ausgerichtet (Schrittmachereigenschaft). 
 Abbildung: Aktionspotential in Arbeitsmyokard und Schrittmacherzellen
Abbildung: Aktionspotential in Arbeitsmyokard und Schrittmacherzellen
 dem aktuellen Membranpotential
dem aktuellen Membranpotential
 den
intra / extrazellulären Ionenkonzentrationen
den
intra / extrazellulären Ionenkonzentrationen
 der Anwesenheit zyklischer
Nukleotide an Schrittmacherpermeasen
der Anwesenheit zyklischer
Nukleotide an Schrittmacherpermeasen
 dem
Phosphorylierungsgrad von Calciumkanälen
dem
Phosphorylierungsgrad von Calciumkanälen Niedrigeres Ruhepotential (-50 bis -60 mV im Sinusknoten, -80 bis -90 mV im Arbeitsmyokard)
Niedrigeres Ruhepotential (-50 bis -60 mV im Sinusknoten, -80 bis -90 mV im Arbeitsmyokard)
 Calcium- statt raschem Natriumeinstrom bei Aktionspotentialbeginn
Calcium- statt raschem Natriumeinstrom bei Aktionspotentialbeginn Spontane Depolarisation in Phase 4 (Schrittmacherstom If)
Spontane Depolarisation in Phase 4 (Schrittmacherstom If)
 Allmähliche Inaktivierung des Kv-Kanals (delayed rectifier voltage-activated potassium channel) und Abnahme des K+-Ausstroms iK. Durch diesen Kanal erfolgt auch die Repolarisierung am Ende der Erregung
Allmähliche Inaktivierung des Kv-Kanals (delayed rectifier voltage-activated potassium channel) und Abnahme des K+-Ausstroms iK. Durch diesen Kanal erfolgt auch die Repolarisierung am Ende der Erregung Geringgradiger Na+-Einstrom ib (background current), in manchen Sinusknotenzellen außerdem via - durch Hyperpolarisierung aktivierbare - funny channels (if). Diese nukleotidregulierten (cAMP) unspezifischen Kationenkanäle ("schrittmacheraktive" HCN-Kanäle) lassen in dieser Phase wegen der
Lage des Natrium-Gleichgewichtspotentials vor allem Natriumionen
durch die Membran eintreten, was die Zelle depolarisiert. ib und if tragen zum frühen Anteil der spontanen Depolarisierung bei
Geringgradiger Na+-Einstrom ib (background current), in manchen Sinusknotenzellen außerdem via - durch Hyperpolarisierung aktivierbare - funny channels (if). Diese nukleotidregulierten (cAMP) unspezifischen Kationenkanäle ("schrittmacheraktive" HCN-Kanäle) lassen in dieser Phase wegen der
Lage des Natrium-Gleichgewichtspotentials vor allem Natriumionen
durch die Membran eintreten, was die Zelle depolarisiert. ib und if tragen zum frühen Anteil der spontanen Depolarisierung bei Na/Ca-Austauscher erzeugen einen Netto-Natriumeinstrom iNa-Ca (3Na+ gegen 1 Ca++), der zur zum späteren Anteil der spontanen Depolarisierung wesentlich beiträgt
Na/Ca-Austauscher erzeugen einen Netto-Natriumeinstrom iNa-Ca (3Na+ gegen 1 Ca++), der zur zum späteren Anteil der spontanen Depolarisierung wesentlich beiträgt Ab einem Membranpotential von -55 mV beginnt ein Ca++-Einstrom iCa durch Typ T-Calciumkanäle und bei weiterer Depolarisierung auch durch Typ L-Calciumkanäle.
Der Calciumeinstrom trägt zum letzten Drittel der spontanen
Depolarisierung bei und geht dann in das Aktionspotential über
Ab einem Membranpotential von -55 mV beginnt ein Ca++-Einstrom iCa durch Typ T-Calciumkanäle und bei weiterer Depolarisierung auch durch Typ L-Calciumkanäle.
Der Calciumeinstrom trägt zum letzten Drittel der spontanen
Depolarisierung bei und geht dann in das Aktionspotential über
 Abbildung: Reizleitungssystem im Herzen
Abbildung: Reizleitungssystem im Herzen
 Sinusknoten (physiologischer Schrittmacher),
Sinusknoten (physiologischer Schrittmacher), Atrioventrikular (AV-)
knoten,
Atrioventrikular (AV-)
knoten,  His'schem Bündel (elektrophysiologische Verbindungsbahn von
Vorhof- zu Kammerbereich),
His'schem Bündel (elektrophysiologische Verbindungsbahn von
Vorhof- zu Kammerbereich),  Kammerschenkeln und
Kammerschenkeln und  Purkinje-Fasern
(optimierte Aufteilung der Erregung im Kammerbereich).
Purkinje-Fasern
(optimierte Aufteilung der Erregung im Kammerbereich). 
 Abbildung: Vom Sinusknoten ausgehende Erregungsausbreitung
Abbildung: Vom Sinusknoten ausgehende Erregungsausbreitung

 Abbildung: Reizleitungssystem
Abbildung: Reizleitungssystem
 Erhöhte
Konzentration an Schilddrüsenhormonen steigert die Herzfrequenz. Auch die Körpertemperatur beeinflusst die Herzfrequenz: Pro °C Anstieg nimmt die Pulsfrequenz um ~8 Schläge pro Minute zu.
Erhöhte
Konzentration an Schilddrüsenhormonen steigert die Herzfrequenz. Auch die Körpertemperatur beeinflusst die Herzfrequenz: Pro °C Anstieg nimmt die Pulsfrequenz um ~8 Schläge pro Minute zu. Beim
Aufrichten des Körpers bzw. Aufstehen (orthostatische Reaktion) kommt es bereits zu einer
merklichen Zunahme der Herzfrequenz (um 10-20/min), bei
intensiverem Stress
- etwa im Rahmen von sportlicher Betätigung - kann der Puls bis zur
Belastungsgrenze zunehmen (Maximalpuls-Faustregel: 200 minus Alter in
Jahren).
Beim
Aufrichten des Körpers bzw. Aufstehen (orthostatische Reaktion) kommt es bereits zu einer
merklichen Zunahme der Herzfrequenz (um 10-20/min), bei
intensiverem Stress
- etwa im Rahmen von sportlicher Betätigung - kann der Puls bis zur
Belastungsgrenze zunehmen (Maximalpuls-Faustregel: 200 minus Alter in
Jahren).  Neugeborene haben einen wesentlich höheren Ruhepuls (etwa 140
bpm, Kinder mit 10 Jahren noch ~90 bpm) als erweachsene Personen.
Neugeborene haben einen wesentlich höheren Ruhepuls (etwa 140
bpm, Kinder mit 10 Jahren noch ~90 bpm) als erweachsene Personen. Schon
1839 beschrieb der böhmische Physiologe Jan E. Purkinje Muskelfasern,
die der Erregungsleitung im Ventrikel dienen und nach ihm benannt
wurden. 1893 fand der Internist Wilhelm His das nach ihm benannte
Muskelbündel, das eine Erregungsübertragung von den Vorhöfen auf die
Ventrikel ermöglicht. 1907 beschrieben Arthur Keith und Martin Flack
erstmals den Sinusknoten. Keith nannte die von ihm gefundene Gruppe
spezialisierter Muskelfasern den sino-atrialen Knoten.
Schon
1839 beschrieb der böhmische Physiologe Jan E. Purkinje Muskelfasern,
die der Erregungsleitung im Ventrikel dienen und nach ihm benannt
wurden. 1893 fand der Internist Wilhelm His das nach ihm benannte
Muskelbündel, das eine Erregungsübertragung von den Vorhöfen auf die
Ventrikel ermöglicht. 1907 beschrieben Arthur Keith und Martin Flack
erstmals den Sinusknoten. Keith nannte die von ihm gefundene Gruppe
spezialisierter Muskelfasern den sino-atrialen Knoten.
 Abbildung: Spontanentladungsfrequenzen im Reizleitungssystem
Abbildung: Spontanentladungsfrequenzen im Reizleitungssystem

 Im "klassischen" Physiologiepraktikum war die Durchführung der Stannius'schen Ligaturen
Im "klassischen" Physiologiepraktikum war die Durchführung der Stannius'schen Ligaturen  obligat (Hermann Stannius war ein deutscher Physiologe). Man legte am schlagenden Froschherzen zwischen Vorhof und Kammer mit
einem Zwirnfaden eine Schlinge; zog man die Schlinge komplett zu, hörte der
Ventrikel zu schlagen auf, da durch die Kompression des Myokards die
Überleitung der Aktionspotentiale vom Sinusknoten auf das
Reizleitungssystem der Kammern unterbrochen war.
obligat (Hermann Stannius war ein deutscher Physiologe). Man legte am schlagenden Froschherzen zwischen Vorhof und Kammer mit
einem Zwirnfaden eine Schlinge; zog man die Schlinge komplett zu, hörte der
Ventrikel zu schlagen auf, da durch die Kompression des Myokards die
Überleitung der Aktionspotentiale vom Sinusknoten auf das
Reizleitungssystem der Kammern unterbrochen war.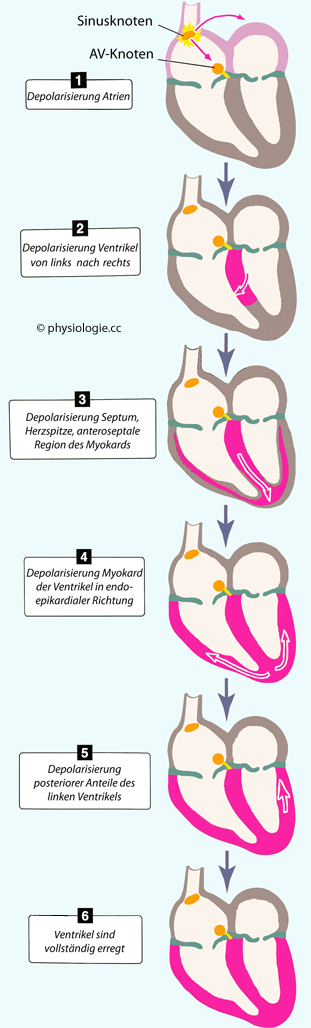

 Abbildung: Abfolge der Depolasisierung des Herzmuskels
Abbildung: Abfolge der Depolasisierung des Herzmuskels Sinusknoten s. oben.
Sinusknoten s. oben. AV- (Aschoff-Tawara)-Knoten
AV- (Aschoff-Tawara)-Knoten  : Aktionspotentiale laufen (vom Sinusknoten ausgehend) über die Vorhofmuskulatur und treffen am
atrio-ventrikuläre Knoten ein. Dieser hat eine Eigenfrequenz
von 40-50/min; die spontane Depolarisation (Phase 4, s. oben) erfolgt
langsamer als in den Zellen des Sinusknotens. Normalerweise hat der
AV-Knoten daher keine
Schrittmacherfunktion, er wird jedesmal vom Sinusknoten "überholt",
bevor er selbst eine Erregung generiert hat.
: Aktionspotentiale laufen (vom Sinusknoten ausgehend) über die Vorhofmuskulatur und treffen am
atrio-ventrikuläre Knoten ein. Dieser hat eine Eigenfrequenz
von 40-50/min; die spontane Depolarisation (Phase 4, s. oben) erfolgt
langsamer als in den Zellen des Sinusknotens. Normalerweise hat der
AV-Knoten daher keine
Schrittmacherfunktion, er wird jedesmal vom Sinusknoten "überholt",
bevor er selbst eine Erregung generiert hat.  His'sches
Bündel
His'sches
Bündel  :
Es stellt die einzige elektrophysiologische Verbindung zwischen
Vorhöfen und Kammern dar (die bindegewebigen Klappenansatzringe - das
"Herzskelett" - ist nicht erregbar) und leitet die Erregungswelle zügig auf
das Ventrikelmyokard weiter. Die Aktionspotentiale sind denen in der
Arbeitsmuskulatur sehr ähnlich, sie weisen deutliche Plateaubildung mit
einer Länge von 0,2-0,4 Sekunden auf.
:
Es stellt die einzige elektrophysiologische Verbindung zwischen
Vorhöfen und Kammern dar (die bindegewebigen Klappenansatzringe - das
"Herzskelett" - ist nicht erregbar) und leitet die Erregungswelle zügig auf
das Ventrikelmyokard weiter. Die Aktionspotentiale sind denen in der
Arbeitsmuskulatur sehr ähnlich, sie weisen deutliche Plateaubildung mit
einer Länge von 0,2-0,4 Sekunden auf. Tawara-
Tawara-  bzw. Kammerschenkel: Der rechte und (zweibündelige: vorderer und hinterer Faszikel) linke Kammerschenkel
leiten die Aktionspotentiale in der Kammerscheidewand rasch (bis 4 m/s)
zur Herzspitze und von dort über die Seitenwände der Ventrikel. Bei Ausfall eines
Kammerschenkels umgeht die Erregungswelle diesen "Schenkelblock" über normales Arbeitsmyokard, was länger dauert und im EKG als Deformation des QRS-Komplexes sichtbar wird. Die Eigenfrequenz des Kammer-Erregungsleitungssystems beträgt ≤45/Minute.
bzw. Kammerschenkel: Der rechte und (zweibündelige: vorderer und hinterer Faszikel) linke Kammerschenkel
leiten die Aktionspotentiale in der Kammerscheidewand rasch (bis 4 m/s)
zur Herzspitze und von dort über die Seitenwände der Ventrikel. Bei Ausfall eines
Kammerschenkels umgeht die Erregungswelle diesen "Schenkelblock" über normales Arbeitsmyokard, was länger dauert und im EKG als Deformation des QRS-Komplexes sichtbar wird. Die Eigenfrequenz des Kammer-Erregungsleitungssystems beträgt ≤45/Minute. Purkinje-Fasern
Purkinje-Fasern
 schließen
an die Kammerschenkel an und dienen der weiteren raschen,
zeitlich-räumlich koordinierten Erregungsausbreitung in den Ventrikeln.
Sie sind die Zellen mit dem größten Durchmesser (40-80 µm) im
Herzmuskel, daher haben sie die höchste (3-5
m/s) Leitungsgeschwindigkeit (starker INa-Strom, geringer axialer elektrischer Widerstand).
schließen
an die Kammerschenkel an und dienen der weiteren raschen,
zeitlich-räumlich koordinierten Erregungsausbreitung in den Ventrikeln.
Sie sind die Zellen mit dem größten Durchmesser (40-80 µm) im
Herzmuskel, daher haben sie die höchste (3-5
m/s) Leitungsgeschwindigkeit (starker INa-Strom, geringer axialer elektrischer Widerstand).  Abbildung). Der ganze Vorgang dauert
weniger als eine Zehntelsekunde (EKG!).
Abbildung). Der ganze Vorgang dauert
weniger als eine Zehntelsekunde (EKG!).


 Abbildung: Erregungsübertragung von Herzmuskelzelle zu Herzmuskelzelle
Abbildung: Erregungsübertragung von Herzmuskelzelle zu Herzmuskelzelle
 s. oben).
s. oben).
 Abbildung: Konnexin, Konnexon, interzellulärer Kanal, gap junction
Abbildung: Konnexin, Konnexon, interzellulärer Kanal, gap junction die P-Welle als Zeichen der
Erregungsausbreitung über das Vorhofmyokard und
die P-Welle als Zeichen der
Erregungsausbreitung über das Vorhofmyokard und  der QRS-Komplex als Resultat der Erregungsausbreitung über das Ventrikelmyokard.
der QRS-Komplex als Resultat der Erregungsausbreitung über das Ventrikelmyokard. 
 Abbildung: Erregungsfortpflanzung von Herzmuskelzelle zu Herzmuskelzelle
Abbildung: Erregungsfortpflanzung von Herzmuskelzelle zu Herzmuskelzelle


 Abbildung: Struktur des Herzmuskelgewebes
Abbildung: Struktur des Herzmuskelgewebes
 Der größte Teil der Muskelmasse besteht aus Arbeitsmyokard, das ein stabiles Ruhepotential von -80 mV hat (es verfügt über inward-rectifier-Kaliumkanäle, die das Ruhepotential stabilisieren (K+-Ausstrom); HCN-Kanäle fehlen).
Der größte Teil der Muskelmasse besteht aus Arbeitsmyokard, das ein stabiles Ruhepotential von -80 mV hat (es verfügt über inward-rectifier-Kaliumkanäle, die das Ruhepotential stabilisieren (K+-Ausstrom); HCN-Kanäle fehlen).  Umgekehrt verfügen Zellen des Erregungsleitungssystems über HCN-Kanäle, die spontane Depolarisation (Na+- und Ca++-Einstrom) ermöglichen. Die Ionenkanalbesetzung ist unterschiedlich, sodass diese Zellen sich in ihrem Verhalten unterscheiden:
Umgekehrt verfügen Zellen des Erregungsleitungssystems über HCN-Kanäle, die spontane Depolarisation (Na+- und Ca++-Einstrom) ermöglichen. Die Ionenkanalbesetzung ist unterschiedlich, sodass diese Zellen sich in ihrem Verhalten unterscheiden:  Abbildung).
Abbildung). 
 Abbildung: Erregungsausbreitung im Herzen
Abbildung: Erregungsausbreitung im Herzen
 s. dort).
s. dort).
 Abbildung: Steuerung der Herzaktivität
Abbildung: Steuerung der Herzaktivität Impulse aus dem
Sympathikus beschleunigen und kräftigen (kardioakzeleratorisches Zentrum)
Impulse aus dem
Sympathikus beschleunigen und kräftigen (kardioakzeleratorisches Zentrum) solche aus dem Parasympathikus
bremsen die Herztätigkeit (kardioinhibitorisches Zentrum in der medulla oblongata).
solche aus dem Parasympathikus
bremsen die Herztätigkeit (kardioinhibitorisches Zentrum in der medulla oblongata). 
 Abbildung: Autonom-nervöse Balance
Abbildung: Autonom-nervöse Balance
 Liegt die Herzfrequenz über 100 / min, spricht man von
Tachykardie. Bei Neugeborenen ist "Tachykardie" im Ruhezustand nach dieser Definition physiologisch (
Liegt die Herzfrequenz über 100 / min, spricht man von
Tachykardie. Bei Neugeborenen ist "Tachykardie" im Ruhezustand nach dieser Definition physiologisch ( s. dort). Die Eigenfrequenz des Sinusknotens liegt bei etwa 105 / min, im Ruhezustand wird er durch parasympathischen Einfluss auf 60-80 / min reduziert.
s. dort). Die Eigenfrequenz des Sinusknotens liegt bei etwa 105 / min, im Ruhezustand wird er durch parasympathischen Einfluss auf 60-80 / min reduziert. Bradykardie
ist eine Frequenz unter 60 / min; eine bradykarde Ruhefrequenz
findet sich bei ausgeprägtem Trainingszustand, Hochtrainierte können eine
Ruhefrequenz bis unter 40 zeigen (hoher Parasympathikustonus; dies kann mit einem Herzblock verwechselt werden, bei dem
der Sinusknoten nicht wirksam wird: der AV-Knoten hat eine ähnlich
niedrige Eigenfrequenz wie das gesunde Herz einer hochtrainierten
Person im Ruhezustand). Auch im Schlaf (non-REM) sinkt die Herzfrequenz auf niedrigere Werte ab.
Bradykardie
ist eine Frequenz unter 60 / min; eine bradykarde Ruhefrequenz
findet sich bei ausgeprägtem Trainingszustand, Hochtrainierte können eine
Ruhefrequenz bis unter 40 zeigen (hoher Parasympathikustonus; dies kann mit einem Herzblock verwechselt werden, bei dem
der Sinusknoten nicht wirksam wird: der AV-Knoten hat eine ähnlich
niedrige Eigenfrequenz wie das gesunde Herz einer hochtrainierten
Person im Ruhezustand). Auch im Schlaf (non-REM) sinkt die Herzfrequenz auf niedrigere Werte ab. s. auch dort
s. auch dort reduzierte Schlagfrequenz und Automatizität
reduzierte Schlagfrequenz und Automatizität verlagnsamte AV-Erregungsüberleitung (bis zu Herzstillstand bei extremer cholinerger Reizung)
verlagnsamte AV-Erregungsüberleitung (bis zu Herzstillstand bei extremer cholinerger Reizung) Die unbeeinflusste "intrinsische" Spontanentladungsfolge des Sinusknotens beträgt etwa 100/min. Im Ruhezustand senkt der Parasympathikus (cholinerg)
die Frequenz durch Verstärkung des Ruhepotentials und Verflachung des
Schrittmacherpotentials; starke Parasympathikuswirkung kann die
Spontanentladungsfolge weiter senken (<60/min, Bradykardie
Die unbeeinflusste "intrinsische" Spontanentladungsfolge des Sinusknotens beträgt etwa 100/min. Im Ruhezustand senkt der Parasympathikus (cholinerg)
die Frequenz durch Verstärkung des Ruhepotentials und Verflachung des
Schrittmacherpotentials; starke Parasympathikuswirkung kann die
Spontanentladungsfolge weiter senken (<60/min, Bradykardie  ),
extrem intensive reflektorisch bedingte Parasympathikuswirkung kann den
Herzschlag sogar vollständig unterdrücken (Beispiel Bolustod).
),
extrem intensive reflektorisch bedingte Parasympathikuswirkung kann den
Herzschlag sogar vollständig unterdrücken (Beispiel Bolustod).
 Die Gα1-Komponente
hemmt die Adenylylcyclase, dadurch sinkt der cAMP-Spiegel, was die
Öffnungswahrscheinlichkeit von HCN-Kanälen reduziert. Diese lassen den
depolarisierenden Schrittmacherstrom
zu, also wird die Depolarisation der Sinusknotenzelle gebremst
(
Die Gα1-Komponente
hemmt die Adenylylcyclase, dadurch sinkt der cAMP-Spiegel, was die
Öffnungswahrscheinlichkeit von HCN-Kanälen reduziert. Diese lassen den
depolarisierenden Schrittmacherstrom
zu, also wird die Depolarisation der Sinusknotenzelle gebremst
( Abbildung: Flacherer Depolarisationsverlauf), die Herzfrequenz
nimmt ab.
Abbildung: Flacherer Depolarisationsverlauf), die Herzfrequenz
nimmt ab. Die Gβγ-Komponente aktiviert Kaliumkanäle, was die Zelle stärker aufladet und ebenfalls die Depolarisationszeit erhöht.
Die Gβγ-Komponente aktiviert Kaliumkanäle, was die Zelle stärker aufladet und ebenfalls die Depolarisationszeit erhöht.
 Abbildung: Wie die Herzfrequenz gesenkt werden kann
Abbildung: Wie die Herzfrequenz gesenkt werden kann
 Negativ chronotroper Effekt: Muskarinerge Rezeptoren im Sinusknoten beeinflussen Kalium-(IKACh), Calcium-(ICa) und If-Ströme (s.
Negativ chronotroper Effekt: Muskarinerge Rezeptoren im Sinusknoten beeinflussen Kalium-(IKACh), Calcium-(ICa) und If-Ströme (s.  oben): Kaliumkanäle (GIRK1) werden geöffnet, das maximale Phase-4-Membranpotential negativiert; ICa wird reduziert, die Depolarisierung langsamer, das Schwellenpotential angehoben; und der schwächere If verlangsamt die diastolische Depolarisierung. Ergebnis: Die Herzfrequenz
sinkt.
oben): Kaliumkanäle (GIRK1) werden geöffnet, das maximale Phase-4-Membranpotential negativiert; ICa wird reduziert, die Depolarisierung langsamer, das Schwellenpotential angehoben; und der schwächere If verlangsamt die diastolische Depolarisierung. Ergebnis: Die Herzfrequenz
sinkt.  Negativ dromotroper
Effekt: Am AV-Knoten wird die Überleitung
verlangsamt (verzögerte Aufstrichphase "0").
Negativ dromotroper
Effekt: Am AV-Knoten wird die Überleitung
verlangsamt (verzögerte Aufstrichphase "0"). Negativ inotroper Effekt:
Der Parasympathikus hat (entgegen der früheren Lehrmeinung) auch
direkten Einfluss auf die Kontraktilität des menschlichen Herzens, die
er verringert (negative Inotropie). Mögliche Mechanismen: Beschleunigte Repolarisation (IKACh) verringert Calciumeinstrom durch L-Typ Calciumkanäle; Hemmung der Adenylylcyclase senkt [cAMP] und wirkt adrenergen Einflüssen entgegen.
Negativ inotroper Effekt:
Der Parasympathikus hat (entgegen der früheren Lehrmeinung) auch
direkten Einfluss auf die Kontraktilität des menschlichen Herzens, die
er verringert (negative Inotropie). Mögliche Mechanismen: Beschleunigte Repolarisation (IKACh) verringert Calciumeinstrom durch L-Typ Calciumkanäle; Hemmung der Adenylylcyclase senkt [cAMP] und wirkt adrenergen Einflüssen entgegen. verstärkte Kontraktion des Myokards (positiv inotroper Effekt)
verstärkte Kontraktion des Myokards (positiv inotroper Effekt) erhöhte Schlagfrequenz (positiv chronotroper Effekt)
erhöhte Schlagfrequenz (positiv chronotroper Effekt) verringerte kardiale Effizienz (Sauerstoffverbrauch des Myokards steigt stärker an als seine Leistung)
verringerte kardiale Effizienz (Sauerstoffverbrauch des Myokards steigt stärker an als seine Leistung) verstärkte Automatizität (Neigung zur Bildung ektopischer Herzschläge)
verstärkte Automatizität (Neigung zur Bildung ektopischer Herzschläge) ).
).  Am Sinusknoten
erfolgt beschleunigte Depolarisation (positiv chronotroper Effekt durch Aktivierung von If-Kanälen). Der Wirkungsmechanismus: ß1-Rezeptoren → Gs-Protein → cAMP → Proteinkinase A → Phosphorylierung zahlreicher Zielproteine.
Am Sinusknoten
erfolgt beschleunigte Depolarisation (positiv chronotroper Effekt durch Aktivierung von If-Kanälen). Der Wirkungsmechanismus: ß1-Rezeptoren → Gs-Protein → cAMP → Proteinkinase A → Phosphorylierung zahlreicher Zielproteine.
 Am
AV-Knoten zeigt sich ein rascherer Aufstrich des Aktionspotentials (positiv
dromotroper Effekt durch verbesserte Überleitung an gap junctions).
Am
AV-Knoten zeigt sich ein rascherer Aufstrich des Aktionspotentials (positiv
dromotroper Effekt durch verbesserte Überleitung an gap junctions).

 Am Arbeitsmykoard verstärken Katecholamine den ICa-Strom (aus dem Extrazellulärraum) und erhöhen die Sensitivität der Calciumkanäle des sarkoplasmatischen Retikulums gegenüber steigendem sarkoplasmatischem [Ca++]. Auch
die anschließende Rückführung von Calcium in das Retikulum mittels
SERCA-Pumpe wird intensiviert und erhöht den sarkoplasmatischen
Calciumvorrat. All dies intensiviert die Kontraktion (positiv inotroper Effekt).
Am Arbeitsmykoard verstärken Katecholamine den ICa-Strom (aus dem Extrazellulärraum) und erhöhen die Sensitivität der Calciumkanäle des sarkoplasmatischen Retikulums gegenüber steigendem sarkoplasmatischem [Ca++]. Auch
die anschließende Rückführung von Calcium in das Retikulum mittels
SERCA-Pumpe wird intensiviert und erhöht den sarkoplasmatischen
Calciumvorrat. All dies intensiviert die Kontraktion (positiv inotroper Effekt).
 Die Aktionspotentiale verkürzen ihre Dauer durch Aktivierung des verzögerten IK-Stroms.
Die Aktionspotentiale verkürzen ihre Dauer durch Aktivierung des verzögerten IK-Stroms.
 Die Myozyten relaxieren rascher (positiv lusitroper Effekt durch erhöhte Ca++-Aufnahme in das sarkoplasmatische Retikulum).
Die Myozyten relaxieren rascher (positiv lusitroper Effekt durch erhöhte Ca++-Aufnahme in das sarkoplasmatische Retikulum). "Betablocker"
(genauer: ß1-Rezeptor-Antagonisten) dämpfen die Noradrenalinwirkung auf das Herz und wirken herzschonend, vermindern
aber auch unter Umständen die Anpassungsfähigkeit des Kreislaufs bei Belastung. Je nach Wirkungsspektrum auf adrenerge (nicht nur ausschließlich ß1-) Rezeptoren üben sie unterschiedliche Effekte auf Myokarddurchblutung, Erregungsbildung etc. aus.
"Betablocker"
(genauer: ß1-Rezeptor-Antagonisten) dämpfen die Noradrenalinwirkung auf das Herz und wirken herzschonend, vermindern
aber auch unter Umständen die Anpassungsfähigkeit des Kreislaufs bei Belastung. Je nach Wirkungsspektrum auf adrenerge (nicht nur ausschließlich ß1-) Rezeptoren üben sie unterschiedliche Effekte auf Myokarddurchblutung, Erregungsbildung etc. aus.
 Fieber, Hyperthyreose,
Entzündungen von Herzbeutel bzw. Herzmuskel oder Lungenembolie sind
Zustände, welche die Herzfrequenz steigern können (Sinustachykardie).
Fieber, Hyperthyreose,
Entzündungen von Herzbeutel bzw. Herzmuskel oder Lungenembolie sind
Zustände, welche die Herzfrequenz steigern können (Sinustachykardie).
 Hypothermie, Hypothyreose, auch intensives körperliches Training
(starke Aktivität des parasympathischen Systems im Ruhezustand), können
Sinusbradykardie zur Folge haben.
Hypothermie, Hypothyreose, auch intensives körperliches Training
(starke Aktivität des parasympathischen Systems im Ruhezustand), können
Sinusbradykardie zur Folge haben. Ein plötzlicher
Ausfall des Sinusknotens wird nicht immer durch sofortiges Einspringen
niedrigerer Schrittmacher kompensiert. Vergehen mehrere Sekunden, sinkt
der Blutdruck so stark ab, Bewusstlosigkeit tritt ein
(Adams-Stokes-Anfall). Weiters reicht der auftretende Eigenrhythmus
manchmal für eine ausreichende Durchblutung (vor allem des Gehirns)
nicht aus. Es kann gelingen, den Ohnmachtsanfall durch Flachlagerung
(Wegfall der Orthostasebelastung!) zu beenden.
Ein plötzlicher
Ausfall des Sinusknotens wird nicht immer durch sofortiges Einspringen
niedrigerer Schrittmacher kompensiert. Vergehen mehrere Sekunden, sinkt
der Blutdruck so stark ab, Bewusstlosigkeit tritt ein
(Adams-Stokes-Anfall). Weiters reicht der auftretende Eigenrhythmus
manchmal für eine ausreichende Durchblutung (vor allem des Gehirns)
nicht aus. Es kann gelingen, den Ohnmachtsanfall durch Flachlagerung
(Wegfall der Orthostasebelastung!) zu beenden. Als AV-Block bezeichnet man atrioventrikuläre Überleitungsstörungen. Man teilt sie ein in
Als AV-Block bezeichnet man atrioventrikuläre Überleitungsstörungen. Man teilt sie ein in  AV-Block I. Grades (PQ-Intervall regelmäßig auf ≤200 ms verlängert)
AV-Block I. Grades (PQ-Intervall regelmäßig auf ≤200 ms verlängert) AV-Block II. Grades: Nicht jede Erregung gelangt erfolgreich zum
Ventrikel - entweder nimmt die PQ-Zeit von Systole zu Systole zu, bis
die Überleitung ganz ausbleibt (Typ Wenckebach bzw. Mobitz I), oder das
Schlagverhältnis ist fixiert - z.B. 2:1-Block (Typ Mobitz II)
AV-Block II. Grades: Nicht jede Erregung gelangt erfolgreich zum
Ventrikel - entweder nimmt die PQ-Zeit von Systole zu Systole zu, bis
die Überleitung ganz ausbleibt (Typ Wenckebach bzw. Mobitz I), oder das
Schlagverhältnis ist fixiert - z.B. 2:1-Block (Typ Mobitz II) AV-Block III. Grades: Keine Überleitung, die Kammer bildet sich ihren eigenen Rhythmus (sekundärer Schrittmacher)
AV-Block III. Grades: Keine Überleitung, die Kammer bildet sich ihren eigenen Rhythmus (sekundärer Schrittmacher) Vorhofflattern
(Vorhof-Schlagfrequenz 230-350/min) kann vorübegehend (paroxysmal) auch
bei herzgesunden Personen auftreten (z.B. Stress, exzessiver
Kaffeegenuss), oder - organisch - bei koronarer Herzkrankheit,
Kardiomyopathie, Mitralklappenstenose u.a. Da der AV-Überleitungsfilter
funktioniert, werden nicht alle Erregungswellen auf den Kammerbereich
übertragen (z.B. 2:1, 3:1), und die Hämodynamik ist im Allgemeinen so
gut wie nicht beeinträchtigt.
Vorhofflattern
(Vorhof-Schlagfrequenz 230-350/min) kann vorübegehend (paroxysmal) auch
bei herzgesunden Personen auftreten (z.B. Stress, exzessiver
Kaffeegenuss), oder - organisch - bei koronarer Herzkrankheit,
Kardiomyopathie, Mitralklappenstenose u.a. Da der AV-Überleitungsfilter
funktioniert, werden nicht alle Erregungswellen auf den Kammerbereich
übertragen (z.B. 2:1, 3:1), und die Hämodynamik ist im Allgemeinen so
gut wie nicht beeinträchtigt.  Unorganisierte Depolarisationsabläufe im Vorhof, die keine effektive Vorhofkontraktion ergeben, erzeugen Vorhofflimmern (Frequenz >300/min). Sie entstehen durch ektope Erregungsbildung bzw. multiple kreisende Erregungen (multiples re-entry). Im EKG ist keine P-Welle nachweisbar, AV-Überleitung und RR-Intervalle sind völlig unregelmäßig (absolute Arrhythmie).
Unorganisierte Depolarisationsabläufe im Vorhof, die keine effektive Vorhofkontraktion ergeben, erzeugen Vorhofflimmern (Frequenz >300/min). Sie entstehen durch ektope Erregungsbildung bzw. multiple kreisende Erregungen (multiples re-entry). Im EKG ist keine P-Welle nachweisbar, AV-Überleitung und RR-Intervalle sind völlig unregelmäßig (absolute Arrhythmie). Kammerflattern (250-350/min) bzw. -flimmern
(>350/min) ist ein lebensbedrohlicher Zustand. Es tritt auf, wenn
die Erregung im Ventrikelgebiet unkoordiniert zu kreisen beginnt (re-entry)
und die Pumpfunktion des Herzens zum Erliegen kommt. Die Folge ist ein
funktioneller Kreislaufstillstand (Bewusstlosigkeit innerhalb von 10-15
Sekunden). Im EKG ist keine
klare Trennung zwischen Kammeranfangsschwankung (QRS) und Kammerendteil
mehr möglich (Flattern) oder es sind überhaupt keine koordinierten
Muster erkennbar (Flimmern). Sofortige Defibrillation / Reanimation ist
durchzuführen.
Kammerflattern (250-350/min) bzw. -flimmern
(>350/min) ist ein lebensbedrohlicher Zustand. Es tritt auf, wenn
die Erregung im Ventrikelgebiet unkoordiniert zu kreisen beginnt (re-entry)
und die Pumpfunktion des Herzens zum Erliegen kommt. Die Folge ist ein
funktioneller Kreislaufstillstand (Bewusstlosigkeit innerhalb von 10-15
Sekunden). Im EKG ist keine
klare Trennung zwischen Kammeranfangsschwankung (QRS) und Kammerendteil
mehr möglich (Flattern) oder es sind überhaupt keine koordinierten
Muster erkennbar (Flimmern). Sofortige Defibrillation / Reanimation ist
durchzuführen.
 Abbildung: Herzschrittmacher. Steuereinheit subkutan, Reizelektroden in Vorhof und Spitze des rechten Ventrikels
Abbildung: Herzschrittmacher. Steuereinheit subkutan, Reizelektroden in Vorhof und Spitze des rechten Ventrikels
 Künstliche Herzschrittmacher erzeugen elektrische Reize in der Kammermuskulatur (
Künstliche Herzschrittmacher erzeugen elektrische Reize in der Kammermuskulatur ( Abbildung). Sie werden über einen Venenkatheter in die Herzräume (rechter Vorhof / Ventrikel)
vorgeschoben und hier befestigt. Die Steuereinheit wird -
nach lokaler Betäubung - subkutan implantiert. Die Impulse haben eine
Spannung von ~3 V und dauern ~0,5 ms, Lithium-Jod-Batterien ermöglichen
eine Betriebszeit von ~10 Jahren.
Abbildung). Sie werden über einen Venenkatheter in die Herzräume (rechter Vorhof / Ventrikel)
vorgeschoben und hier befestigt. Die Steuereinheit wird -
nach lokaler Betäubung - subkutan implantiert. Die Impulse haben eine
Spannung von ~3 V und dauern ~0,5 ms, Lithium-Jod-Batterien ermöglichen
eine Betriebszeit von ~10 Jahren. Der Calciumeinstrom ist Angriffspunkt sowohl physiologischer (autonome
Nervenfasern, Hormone) als auch pharmakologischer Beeinflussung der
Herztätigkeit.
Der Calciumeinstrom ist Angriffspunkt sowohl physiologischer (autonome
Nervenfasern, Hormone) als auch pharmakologischer Beeinflussung der
Herztätigkeit. Azidose und Calciumantagonisten hemmen den Calcium-Einstrom, Katecholamine verstärken ihn.
Azidose und Calciumantagonisten hemmen den Calcium-Einstrom, Katecholamine verstärken ihn. Erhöhung der H+- und Ca++-Konzentration in Herzmuskelzellen tritt bei Sauerstoffmangel (Mangeldurchblutung: Ischämie)
auf und führt zu einer Schließung von Konnexonen an gap
junctions. Das behindert den Stromfluss zwischen den Zellen (erhöhter
Innenwiderstand) und verlangsamt die Erregungsausbreitung. Dies wiederum erhöht
die Wahrscheinlichkeit eines Auftretens von kreisenden Erregungen (Re-entry) in
Vorhöfen / Ventrikeln, was Flattern oder Flimmern zur Folge haben kann
(Kammerflimmern ist lebensbedrohlich - Defibrillation erforderlich).
Erhöhung der H+- und Ca++-Konzentration in Herzmuskelzellen tritt bei Sauerstoffmangel (Mangeldurchblutung: Ischämie)
auf und führt zu einer Schließung von Konnexonen an gap
junctions. Das behindert den Stromfluss zwischen den Zellen (erhöhter
Innenwiderstand) und verlangsamt die Erregungsausbreitung. Dies wiederum erhöht
die Wahrscheinlichkeit eines Auftretens von kreisenden Erregungen (Re-entry) in
Vorhöfen / Ventrikeln, was Flattern oder Flimmern zur Folge haben kann
(Kammerflimmern ist lebensbedrohlich - Defibrillation erforderlich).
 "Channelopathien":
Kommt es durch Genmutation zu Veränderung der Struktur oder Zahl von
Ionenkanälen (z.B. Natrium-, Kaliumkanälen) oder ist deren Expression in der
Membran von Kardiomyozyten herunterreguliert (z.B. bei
Herzinsuffizienz), können Extrasystolen, Herzblock oder Arrhythmien
auftreten, die u.U. einen plötzlichen Herztod bedingen (z.B. Brugada-Syndrom:
Ionenkanalstörung, die meist asymptomatisch bleibt, aber zu
prlötzlichem Herztod führen kann). Kaliumkanal-Defekte bewirken
gestörte Repolarisation, Verlängerung des Aktionspotentials (Long-QT-Syndrom) und erhöhtes Risiko für Kammerflattern oder -flimmern.
"Channelopathien":
Kommt es durch Genmutation zu Veränderung der Struktur oder Zahl von
Ionenkanälen (z.B. Natrium-, Kaliumkanälen) oder ist deren Expression in der
Membran von Kardiomyozyten herunterreguliert (z.B. bei
Herzinsuffizienz), können Extrasystolen, Herzblock oder Arrhythmien
auftreten, die u.U. einen plötzlichen Herztod bedingen (z.B. Brugada-Syndrom:
Ionenkanalstörung, die meist asymptomatisch bleibt, aber zu
prlötzlichem Herztod führen kann). Kaliumkanal-Defekte bewirken
gestörte Repolarisation, Verlängerung des Aktionspotentials (Long-QT-Syndrom) und erhöhtes Risiko für Kammerflattern oder -flimmern. Die extrazelluläre Kaliumkonzentration beeinflusst die Herzfunktion:
Die extrazelluläre Kaliumkonzentration beeinflusst die Herzfunktion:  Hypokaliämie
(<3,5 mM) kann in Folge von Kaliumverlust (Diuretikatherapie:
Thiazide), intensivem Erbrechen, schwerer Diarrhoe oder Verbrennungen
auftreten. Der niedrige extrazelluläre Kaliumspiegel reduziert die
Aktivität der Na/K-ATPase und der Kaliumkanäle (Kir, Kv),
was den repolarisierenden Kaliumstrom senkt. Die Plateauphase und
Phase-3-Repolarisierung werden dadurch verlängert, das kann Arrhythmien
(Herzrhythmusstörungen) bewirken (die Herzmuskelzelle versucht, die
erhöhte Calciumlast des verlängerten Aktionspotentials durch
verstärkten Natriumeinstrom loszuwerden); im EKG kann eine U-Welle
auftreten.
Hypokaliämie
(<3,5 mM) kann in Folge von Kaliumverlust (Diuretikatherapie:
Thiazide), intensivem Erbrechen, schwerer Diarrhoe oder Verbrennungen
auftreten. Der niedrige extrazelluläre Kaliumspiegel reduziert die
Aktivität der Na/K-ATPase und der Kaliumkanäle (Kir, Kv),
was den repolarisierenden Kaliumstrom senkt. Die Plateauphase und
Phase-3-Repolarisierung werden dadurch verlängert, das kann Arrhythmien
(Herzrhythmusstörungen) bewirken (die Herzmuskelzelle versucht, die
erhöhte Calciumlast des verlängerten Aktionspotentials durch
verstärkten Natriumeinstrom loszuwerden); im EKG kann eine U-Welle
auftreten.  Hyperkaliämie kann bei Niereninsuffizienz, Crush-Syndrom, Transfusion abgelaufener Blutkonserven, Hämolyse (z.B. Süßwasser in der Lunge) auftreten. Sie reduziert den Betrag von Ruhe- und Aktionspotential
(geringer transmembranaler Kaliumgradient), stört die Erregungsleitung und kann ebenfalls Arrhythmien hervorrufen. Ist der Kaliumspiegel stark erhöht
(>7,5 mM), nehmen
Sinusknotenfunktion, Leitungsgeschwindigkeit und
Aktionspotentialdauer sowie Calciumeintritt in die Zelle ab,
ventrikuläre Tachykardie kann auftreten, das Herz in Diastole
stillstehen (Asystolie).
Hyperkaliämie kann bei Niereninsuffizienz, Crush-Syndrom, Transfusion abgelaufener Blutkonserven, Hämolyse (z.B. Süßwasser in der Lunge) auftreten. Sie reduziert den Betrag von Ruhe- und Aktionspotential
(geringer transmembranaler Kaliumgradient), stört die Erregungsleitung und kann ebenfalls Arrhythmien hervorrufen. Ist der Kaliumspiegel stark erhöht
(>7,5 mM), nehmen
Sinusknotenfunktion, Leitungsgeschwindigkeit und
Aktionspotentialdauer sowie Calciumeintritt in die Zelle ab,
ventrikuläre Tachykardie kann auftreten, das Herz in Diastole
stillstehen (Asystolie).
 Ungereizte Arbeitsmyokardzellen haben ein konstantes Ruhepotential. Dieses entsteht durch Kaliumausstrom via "einwärts- gleichrichtende" Kaliumkanäle (Kir) und hält
die Natriumkanäle geschlossen. Der Betrag des Kaliumaustritts ist
gering, da das Ruhepotential (-80 bis -90 mV) nahe am
Gleichgewichtspotential für Kalium liegt (-94 mV). Bei Depolarisierung
verliert die Zelle weniger Kalium. Im
Zytosol vorhandenes Ca++ wird gegen 3Na+ ausgetauscht (~75% des Ca++-Auswärtstransportes).
Ähnlich nutzen Na/H-Austauscher des Natriumgradienten zur Entfernung
von H-Ionen aus der Herzmuskelzelle (Na+ wird über die basolaterale Na/K-ATPase aus der Zelle gebracht). Restliches Ca++ wird durch eine Ca-ATPase in das sarkoplasmatische Retikulum gepumpt
Ungereizte Arbeitsmyokardzellen haben ein konstantes Ruhepotential. Dieses entsteht durch Kaliumausstrom via "einwärts- gleichrichtende" Kaliumkanäle (Kir) und hält
die Natriumkanäle geschlossen. Der Betrag des Kaliumaustritts ist
gering, da das Ruhepotential (-80 bis -90 mV) nahe am
Gleichgewichtspotential für Kalium liegt (-94 mV). Bei Depolarisierung
verliert die Zelle weniger Kalium. Im
Zytosol vorhandenes Ca++ wird gegen 3Na+ ausgetauscht (~75% des Ca++-Auswärtstransportes).
Ähnlich nutzen Na/H-Austauscher des Natriumgradienten zur Entfernung
von H-Ionen aus der Herzmuskelzelle (Na+ wird über die basolaterale Na/K-ATPase aus der Zelle gebracht). Restliches Ca++ wird durch eine Ca-ATPase in das sarkoplasmatische Retikulum gepumpt Ein komplexes
Zusammenwirken verschiedener Ionenströme ergibt das charakteristische
Aktionspotential einer Herzmuskelzelle. Je nach Ausstattung mit
Kanalproteinen nimmt dieses unterschiedliche Form und Dauer an. Das
Aktionspotential der Arbeitsmuskelzellen (<200 bis 350 ms) erfolgt durch raschen
Natriumeinstrom via spannunsgesteuerte Natriumkanäle. Im Ruhezustand
sind diese geschlossen; bei Überschreitung des Schwellenpotentials
durch Erregung von Nachbarzellen öffnet der Kanal, Natrium strömt ein -
für 1 ms, dann wird der Kanal inaktiviert,
der Natriumeinstrom versiegt. Erst am Ende der Refraktärzeit
(Plateauphase: depolarisierende Ca++- und repolarisierende K+-Ströme halten sich die Waage) stellt sich die "geschlossene" Konformation der Natriumkanäle wieder ein,
die im Gegensatz zur "inaktivierten" durch Depolarisierung beendet
werden kann. Im Sinusknoten erfolgt die (langsamere) Depolarisierung durch Ca++-Einstrom (L-Typ-Calciumkanäle). Die Repolarisierung erfolgt durch Kaliumausstrom; erhöhter
Sympathikustonus steigert diesen und
verkürzt das Aktionspotential (Zeit für höhere Schlagfrequenzen). Etwa 10 ms nach Auftreten des Aktionspotentials beginnt die Kontraktion
Ein komplexes
Zusammenwirken verschiedener Ionenströme ergibt das charakteristische
Aktionspotential einer Herzmuskelzelle. Je nach Ausstattung mit
Kanalproteinen nimmt dieses unterschiedliche Form und Dauer an. Das
Aktionspotential der Arbeitsmuskelzellen (<200 bis 350 ms) erfolgt durch raschen
Natriumeinstrom via spannunsgesteuerte Natriumkanäle. Im Ruhezustand
sind diese geschlossen; bei Überschreitung des Schwellenpotentials
durch Erregung von Nachbarzellen öffnet der Kanal, Natrium strömt ein -
für 1 ms, dann wird der Kanal inaktiviert,
der Natriumeinstrom versiegt. Erst am Ende der Refraktärzeit
(Plateauphase: depolarisierende Ca++- und repolarisierende K+-Ströme halten sich die Waage) stellt sich die "geschlossene" Konformation der Natriumkanäle wieder ein,
die im Gegensatz zur "inaktivierten" durch Depolarisierung beendet
werden kann. Im Sinusknoten erfolgt die (langsamere) Depolarisierung durch Ca++-Einstrom (L-Typ-Calciumkanäle). Die Repolarisierung erfolgt durch Kaliumausstrom; erhöhter
Sympathikustonus steigert diesen und
verkürzt das Aktionspotential (Zeit für höhere Schlagfrequenzen). Etwa 10 ms nach Auftreten des Aktionspotentials beginnt die Kontraktion Sinusknotenzellen verfügen über spannungsabhängige Kaliumkanäle, ihr Membranpotential erreicht lediglich
-50 bis -70 mV (Arbeitsmyokard -80 bis -90 mV) und ist instabil. Die Steilheit dieses Schrittmacherpotentials
wird von Na- und Ca-Einstrom durch verschiedene Ionenkanäle
beeinflusst. Ein Schrittmacherstrom (If) durch unspezifische Kationenkanäle (HCN-Kanäle) bewirkt spontane Depolarisierung. Sympathikuseinfluss
steigert über cAMP die Öffnungswahrscheinlichkeit der HCN-Kanäle, der
depolarisierende Kationeneinstrom nimmt zu. Bei Erreichen des Schwellenpotentials (-40 bis -55 mV) entsteht ein Ca++-betriebenes Aktionspotential. In der Repolarisierungsphase schließen die Ca++-Kanäle,
spannungsgesteuerte K-Kanäle öffnen, die Zelle repolarisiert.
Die intrinsische Frequenz des Sinusknotens beträgt
~100/min, sie wird durch parasympathischen Einfluss gesenkt (Ruhefrequenz)
Sinusknotenzellen verfügen über spannungsabhängige Kaliumkanäle, ihr Membranpotential erreicht lediglich
-50 bis -70 mV (Arbeitsmyokard -80 bis -90 mV) und ist instabil. Die Steilheit dieses Schrittmacherpotentials
wird von Na- und Ca-Einstrom durch verschiedene Ionenkanäle
beeinflusst. Ein Schrittmacherstrom (If) durch unspezifische Kationenkanäle (HCN-Kanäle) bewirkt spontane Depolarisierung. Sympathikuseinfluss
steigert über cAMP die Öffnungswahrscheinlichkeit der HCN-Kanäle, der
depolarisierende Kationeneinstrom nimmt zu. Bei Erreichen des Schwellenpotentials (-40 bis -55 mV) entsteht ein Ca++-betriebenes Aktionspotential. In der Repolarisierungsphase schließen die Ca++-Kanäle,
spannungsgesteuerte K-Kanäle öffnen, die Zelle repolarisiert.
Die intrinsische Frequenz des Sinusknotens beträgt
~100/min, sie wird durch parasympathischen Einfluss gesenkt (Ruhefrequenz) Erregungsbildung und Reizleitung im Herzen erfolgt über Sinusknoten
(physiologischer Schrittmacher), AV-Knoten (langsame Leitung), His-Bündel (Verbindung
Vorhof-Kammer), Kammerschenkel, Purkinje-Fasern (optimale Erregungsverteilung, lange Refrakterität).
Aktionspotentiale breiten sich über über gap junctions (disci
intercalares: Stellen stark reduzierten elektrischen Widerstandes mit
hoher Dichte spannungsgesteuerter Natriumkanäle) auf das gesamte Myokard aus (funktionelles Synzytium). Das erzeugt elektrische Felder, deren räumlich-zeitliche Auswirkung von der Körperoberfläche abgegriffen werden kann: Im
EKG bedeutet die P-Welle die Erregungsausbreitung über die Vorhöfe und
der QRS-Komplex die Erregungsausbreitung über die Ventrikel
Erregungsbildung und Reizleitung im Herzen erfolgt über Sinusknoten
(physiologischer Schrittmacher), AV-Knoten (langsame Leitung), His-Bündel (Verbindung
Vorhof-Kammer), Kammerschenkel, Purkinje-Fasern (optimale Erregungsverteilung, lange Refrakterität).
Aktionspotentiale breiten sich über über gap junctions (disci
intercalares: Stellen stark reduzierten elektrischen Widerstandes mit
hoher Dichte spannungsgesteuerter Natriumkanäle) auf das gesamte Myokard aus (funktionelles Synzytium). Das erzeugt elektrische Felder, deren räumlich-zeitliche Auswirkung von der Körperoberfläche abgegriffen werden kann: Im
EKG bedeutet die P-Welle die Erregungsausbreitung über die Vorhöfe und
der QRS-Komplex die Erregungsausbreitung über die Ventrikel  Das Herz steht unter dem Einfluss hormoneller, neuraler und physikalischer Faktoren. Sympathischer Einfluss aus dem kardioakzeleratorischen Zentrum der medulla oblongata beschleunigt
und kräftigt, parasympathischer bremst die Herztätigkeit
(kardioinhibitorisches Zentrum). Die
Herzfrequenz beträgt im Ruhezustand rund 60 (im Liegen) bis 80 (im
Stehen) Schläge pro Minute (Normokardie). Herzfrequenz über 100/min
heisst Tachykardie (z.B. Stress), Bradykardie ist eine Frequenz unter 60 (z.B. non-REM-Schlaf)
Das Herz steht unter dem Einfluss hormoneller, neuraler und physikalischer Faktoren. Sympathischer Einfluss aus dem kardioakzeleratorischen Zentrum der medulla oblongata beschleunigt
und kräftigt, parasympathischer bremst die Herztätigkeit
(kardioinhibitorisches Zentrum). Die
Herzfrequenz beträgt im Ruhezustand rund 60 (im Liegen) bis 80 (im
Stehen) Schläge pro Minute (Normokardie). Herzfrequenz über 100/min
heisst Tachykardie (z.B. Stress), Bradykardie ist eine Frequenz unter 60 (z.B. non-REM-Schlaf)