

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Physiologie
des Herzens

 Untersuchung der Herzfunktion
Untersuchung der Herzfunktion
© H. Hinghofer-Szalkay
 Auskultation: auscultare = aufmerksam zuhören (auris = Ohr)
Auskultation: auscultare = aufmerksam zuhören (auris = Ohr)
Doppler-Effekt: Christian Doppler
Elektrokardiogramm: ἤλεκτρον = Bernstein, καρδία = Herz, γράμμα = Geschriebenes
Fick'sches Prinzip: Adolf E. Fick
Infarkt: farcire = füllen, stopfen
Sonographie: sonare = tönen, klingen; γραφή = Schrift
Sphygmographie: σφύγμός = Puls, Herzklopfen
Swan-Ganz-Katheter: Jeremy Swan, William Ganz
Das Herz gibt Signale von sich, die auf seinen Zustand schließen lassen:

-- Elektrisch: Mittels EKG kann der Erregungsablauf registriert und analysiert werden

-- Akustisch: Herztöne (und Herzgeräusche) sind von Klappenspiel und Blutströmung beeinflusst

-- Biochemisch: Blutanalysen lassen erkennen, ob geschädigte Zellen biochemische Marker ans Blut abgeben

-- Mechanisch: Auch Pulskurven geben Auskunft über Details des Herzschlages.
Herztöne (S1, S2, ..) und allfällige Herzgeräusche werden mittels
Stethoskop abgehört (Auskultation); ihre Registrierung wird als
Phonokardiographie bezeichnet, das Ergebnis ist ein Phonokardiogramm (PKG). Carotis-Pulskurven (Sphygmogramme) zeigen die Dauer der Austreibungszeit an. In Kombination mit einem PKG (S2:
Beginn der Diastole) sowie einem EKG (QRS-Komplex: Beginn
der ventrikulären Erregung) kann die Dauer der "Vorbereitungsphase" der
Ventrikelaktion (pre-ejection period)
mit der Dauer der Austreibungszeit
in Beziehung gesetzt und die Effizienz des Herzschlags
abgeschätzt werden.
Beklopfen des Thorax (Perkussion) oder Aussenden von Ultraschallpulsen, und die Analyse akustischer Reflexionen lassen Rückschlüsse auf Strukturen, Bewegungen
und Strömungen zu (Sonographie, Echokardiographie). Ultrasonografische Untersuchung des Herzens (Echokardiographie)
erlaubt morphologische und zeitliche Zuordnungen sowie die Messung der Bewegung
von Gewebe (Myokard, Gefäßwände) und Blut (Perfusion, Wirbelströmungen).
Nichtinvasive Verfahren erlauben u.a. die Abschätzung von Blutvolumina, die sich in den Herzräumen befinden. Die Effizienz der Pumpaktion kann über den Anteil (Schlagvolumen) des
enddiastolischen Volumens ermittelt werden, der systolisch ausgeworfen
wird. Diese ejection fraction sollte mindestens 50% betragen.
Invasiv ist das Vorschieben eines Herzkatheters zum Herzen
(arteriell oder venös). So können elektrische Signale herznahe
abgeleitet, Drucke und Bluttemperatur gemessen, Indikatorstoffe injiziert
werden. Solche Maßnahmen sind nur invasiv möglich, erlauben aber u.a. eine verlässliche Bestimmung des Herzminutenvolumens.
|
Kardiologische Untersuchungsmöglichkeiten reichen von der
Beobachtung des Patienten (Kurzatmigkeit? Fallneigung? Verhalten und
mentale Leistung? usw) über einfache Untersuchungen (Herzschall,
Blutdruck, ...), Laboruntersuchungen (myokardspezifische Enzyme etc),
Belastungstests (Ergometrie), EKG, bildgebende Verfahren (CT,
Ultraschall, ...), Herzkatheteruntersuchungen bis hin zu
molekularbiologischen Untersuchungen (Biopsie).
Wie beurteilt man Zustand und Funktionsfähigkeit des Herzens?

 Abbildung: Echokardiographischer Untersuchungsplatz
Abbildung: Echokardiographischer Untersuchungsplatz
(Wikipedia)
Untersucht wird u.a. auf Funktionsstörungen des Myokards, der Aorten- und der Mitralklappe


 Anamnese und körperliche Untersuchung
Anamnese und körperliche Untersuchung

Gesamteindruck,
Bewusstseinslage (eingeschränkt?)


Auskultation

, Perkussion

Organfunktionen (Durchblutung?)

Kreislauffunktion (Blutdruck stabil?)
Folgende 5 Kriterien sind bei der Erstuntersuchung besonders zu
beachten: Arterieller Puls (Frequenz, Intensität), Blutdruck (sytolisch
/ diastolisch), Jugularvenenpuls, Herzspitzenstoß an vorderer Brustwand
(ictus cordis), Herztöne / -geräusche.
 Apparativ-diagnostische Verfahren
Apparativ-diagnostische Verfahren
 Elektrokardiographie
Elektrokardiographie  ,
Phonokardiographie, Echokardiographie (
,
Phonokardiographie, Echokardiographie ( Abbildung: Untersuchungsplatz), Myokard (perfusions) szintigraphie (99mTechnetium
wird nur von gesunden Herzmuskelzellen aufgenommen),
Röntgenuntersuchung (Computertomographie).
Abbildung: Untersuchungsplatz), Myokard (perfusions) szintigraphie (99mTechnetium
wird nur von gesunden Herzmuskelzellen aufgenommen),
Röntgenuntersuchung (Computertomographie).
 Die Auswurffraktion
(ejection fraction) gibt an, welcher Prozentsatz der enddiastolischen Füllung während der
Systole ausgeworfen wird (normalerweise ≥0,5). Sie lässt sich z.B.
mittels Ultraschall-Bildgebungsverfahren bestimmen, meist kombiniert mit Doppler-Sonographie.
Die Auswurffraktion
(ejection fraction) gibt an, welcher Prozentsatz der enddiastolischen Füllung während der
Systole ausgeworfen wird (normalerweise ≥0,5). Sie lässt sich z.B.
mittels Ultraschall-Bildgebungsverfahren bestimmen, meist kombiniert mit Doppler-Sonographie. 
 Untersuchungen können bei körperlicher Ruhe oder während / nach Belastung
(Ergometrie) vorgenommen werden (kardiale Reserve, koronare Flussreserve: Maximale Koronarperfusion unter Belastung / Koronarperfusion in Ruhe). Das zeigt
auf, wie gut das Myokard bei Bedarf seine Pumpfunktion steigern kann.
Normalerweise lässt sich das Herzzeitvolumen mindestens 4-fach erhöhen
(bei erwachsenen Personen von ~5-7 auf ~20-30 Liter/Minute), insbesondere bei gutem Trainingszustand.
Untersuchungen können bei körperlicher Ruhe oder während / nach Belastung
(Ergometrie) vorgenommen werden (kardiale Reserve, koronare Flussreserve: Maximale Koronarperfusion unter Belastung / Koronarperfusion in Ruhe). Das zeigt
auf, wie gut das Myokard bei Bedarf seine Pumpfunktion steigern kann.
Normalerweise lässt sich das Herzzeitvolumen mindestens 4-fach erhöhen
(bei erwachsenen Personen von ~5-7 auf ~20-30 Liter/Minute), insbesondere bei gutem Trainingszustand.
 Über Herzschall s. dort
Über Herzschall s. dort
 Über Herzqualitäten (Chronotropie, Inotropie etc) s. dort
Über Herzqualitäten (Chronotropie, Inotropie etc) s. dort
 Über Herzfrequenzvariabilität s. dort
Über Herzfrequenzvariabilität s. dort
Elektrokardiographie
Das normale EKG besteht aus drei Teilen: Der P-Welle (Ausbreitung der Erregung über beide Atrien), dem QRS-Komplex (Ausbreitung
der Erregung über beide Ventrikel) und der T-Welle (Repolarisierung
beider Ventrikel). Getrennt sind diese Teile durch die PQ-Strecke
einerseits (Atrien erregt, Ventrikel unerregt), die ST-Strecke
andererseits (Atrien unerregt, Ventrikel erregt); während dieser
Abschnitte sind von der Körperoberfläche keine Potentialänderungen
ableitbar. Die Repolarisierung der Vorhöfe ruft ebenfalls keine
ausreichend starken Potentialänderungen hervor, um im EKG deutlich zu
werden (und das Signal wird vom wesentlich stärkeren der Ventrikelerregungsausbreitung überlagert).
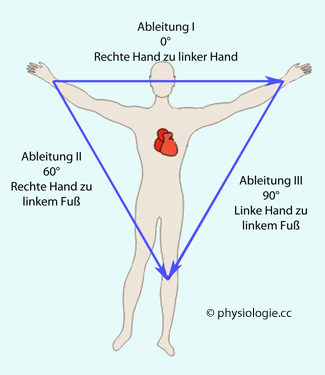
 Abbildung: Bipolare Ableitungen nach Einthoven
Abbildung: Bipolare Ableitungen nach Einthoven
Nach einer Vorlage bei Plonsey/ Malmivuo / Plonsey,
Bioelectromagnetism - Principles and Applications of Bioelectric and
Biomagnetis Fields. Oxford University Press 1995
Dieses
Schema erlaubt die Ableitung von EKG-Signalen von den Extremitäten bei
0°, 60° und 120°. Ableitepunkte sind die Haut im Bereich der beiden
Handgelenke (bezeichnet als R und L) sowie die Haut im Bereich des linken Fußgelenks (bezeichnet als F). Am rechten Fußgelenk wird ebenfalls eine Elektrode angebracht, diese Stelle dient als "Masse"-Bezugspunkt (nicht gezeigt).
Die Extremitäten
dienen als leitendes Gewebe (elektrolythältige extrazelluläre
Flüssigkeit) zwischen Körperstamm und Registrierelektroden, die Ableitestellen
über Hand- und Fußgelenk minimieren einen allfälligen Störeinfluss
durch elektrische Aktivität von Skelettmuskeln (EMG)
Elektrokardiographische Ableitungen können - wie auch andere extrazelluläre Ableitungen - unipolar oder bipolar vorgenommen werden, d.h. sie stellen die Signale von einem differenten gegen einen indifferenten Ableitepunkt dar (unipolar) oder sie vergleichen die Potentiale zweier differenter Ableitepunkte (bipolar).
Der elektrische Potentialverlauf an einem differenten
Ableitepunkt ist von dem interessierenden Biopotentialverlauf
wesentlich beeinflusst, d.h. das Potential an dieser Stelle unterliegt
Schwankungen, die von dem Organ von Interesse (in diesem Fall dem
Herzen) in messbarer Weise bestimmt werden.
Im Falle der Extremitätenableitungen nach Einthoven werden jeweils zwei differente Punkte für bipolare Ableitungen
verwendet ( Abbildung). Sie erlauben mit ziemlicher Präzision die
"Projektion" des Verlaufs der elektrischen Herzaktivität auf die
Frontalebene des Körpers, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III).
Abbildung). Sie erlauben mit ziemlicher Präzision die
"Projektion" des Verlaufs der elektrischen Herzaktivität auf die
Frontalebene des Körpers, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III).
Bipolare Extremitätenableitungen nach Einthoven:
Ableitung I - rechter Arm → linker Arm (0°)
Ableitung II - rechter Arm → linker Fuß (60°)
Ableitung III - linker Arm → linker Fuß (120°)
|
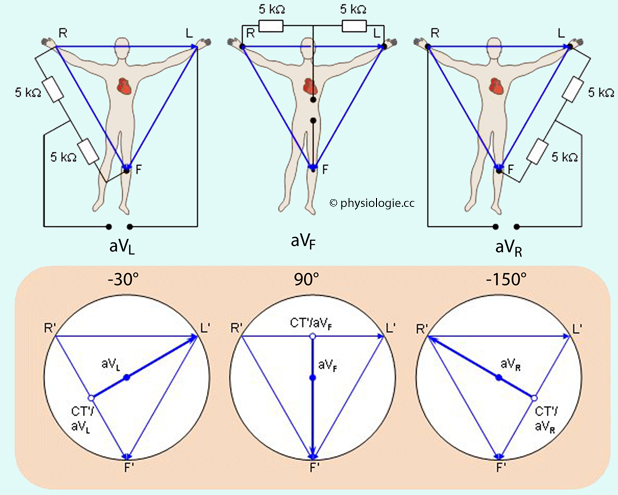
 Abbildung: "Pseudo-unipolare" Ableitungen nach Goldberger
Abbildung: "Pseudo-unipolare" Ableitungen nach Goldberger
Nach
einer Vorlage bei Plonsey/ Malmivuo / Plonsey, Bioelectromagnetism -
Principles and Applications of Bioelectric and Biomagnetis Fields.
Oxford University Press 1995
Dieses
Schema schaltet jeweils zwei differente Punkte über einen Widerstand
von jeweils 5 Kiloohm zu einem Vergleichspotential zusammen, dessen
Verlauf weitgehend, aber nicht vollständig unabhängig vom EKG (und
daher
"pseudo-indifferent") ist. Der differente Ableitepunkt ist jeweils
einer der drei auch bei Einthoven verwendeten Hautstellen (R. L, F).
Die Ableitungen werden dann als aVR, aVL und aVF bezeichnet (aV = augmented vector), sie zeigen jeweils zu der differenten Stelle (Winkelbezüge sind unten angegeben).
Am
rechten Fußgelenk wird ebenfalls eine Elektrode angebracht (nicht
gezeigt), sie verbindet den Körper mit der "Masse" des EKG-Gerätes
 Da
das Herz den Potentialverlauf praktisch der gesamten Körperoberfläche
(also an beliebigen Ableitestellen der Haut) beeinflusst, bietet die
Haut kaum einen geeigneten indifferenten
Bezugspunkt. Will man einen solchen erhalten, muss er kreiert werden - beispielsweise bei Brustwandableitungen durch "Addition" der Potentiale dreier differenter Punkte.
Da
das Herz den Potentialverlauf praktisch der gesamten Körperoberfläche
(also an beliebigen Ableitestellen der Haut) beeinflusst, bietet die
Haut kaum einen geeigneten indifferenten
Bezugspunkt. Will man einen solchen erhalten, muss er kreiert werden - beispielsweise bei Brustwandableitungen durch "Addition" der Potentiale dreier differenter Punkte.
Im Falle der Extremitätenableitungen kann man durch
wechselweises Zusammenschalten jeweils zweier der bei Einthoven
definierten Ableitepunkte Vergleichspotentiale
gewinnen, die
("pseudo-indifferente") Bezugspotentiale liefern. So
ergeben sich die pseudo-unipolaren Ableitungen nach Goldberger,
die zur rechten Hand (aVR), linken Hand (aVL) und zum linken Fuß (aVF)
weisen (aV steht für augmented vector). Die Winkelbezüge sind nunmehr -150°, -30° und 90°
( Abbildung).
Abbildung).
Pseudounipolare Extremitätenableitungen nach Goldberger:
aVR-Ableitung zum rechten Arm (-150°)
aVL-Ableitung zum linken Arm (-30°)
aVF-Ableitung zum linken Fuß (90°)
|
 Die
6 Extremitätenableitungen bilden eine komplette 30°-Abdeckung in der
Frontalebene, von aVL (-30°) über I (0°), -aVR (30°), II (60°), aVF
(90°) bis III (120°). Die Abfolge dieser Ableitungen wird im Cabrera-Kreis (hexaxial reference system, Cabrera system -
Die
6 Extremitätenableitungen bilden eine komplette 30°-Abdeckung in der
Frontalebene, von aVL (-30°) über I (0°), -aVR (30°), II (60°), aVF
(90°) bis III (120°). Die Abfolge dieser Ableitungen wird im Cabrera-Kreis (hexaxial reference system, Cabrera system -  Abbildung) dargestellt.
Abbildung) dargestellt.
In den Cabrera-Kreis kann man die verschiedenen Lagetypen des EKG projizieren. Der Lagetyp ist durch die Richtung des intensivsten Vektors im QRS-Komplex (also der Erregungsausbreitung über die Ventrikel, s. unten) definiert:
Physiologische Lagetypen:
Linkstyp: -30° bis 30°
Indifferenztyp (Mitteltyp): 30 bis 60°
Steiltyp (Semivertikaltyp): 60° bis 90°
Rechtstyp (Vertikaltyp): 90° bis 120°
|
Der Lagetyp ist abhängig von der Anatomie (situs inversus?) und
Herzphysiologie (Hypertrophie?..), aber auch von Konstitutionstyp
(breiter / schmaler Thorax), Atemtiefe (Inspiration stellt das Herz
auf), Körperlage (liegen / sitzen / stehen), Füllungszustand des
Bauches, Schwangerschaft (→links),
Alter (steil → links)
u.a.

 Abbildung: Unipolare Brustwandableitungen nach Wilson
Abbildung: Unipolare Brustwandableitungen nach Wilson
Nach
einer Vorlage bei Plonsey/ Malmivuo / Plonsey, Bioelectromagnetism -
Principles and Applications of Bioelectric and Biomagnetis Fields.
Oxford University Press 1995
Diese
Ableitepunkte liegen ungefähr auf einer Horizontalen. Ihr -
differenter - Potentialverlauf wird jeweils gegen den - indifferenten -
Zusammenschluss (mit zwischengeschalteten Widerständen) der drei
Extremitäten-Ableitepunkte (s. oben) geschaltet. Dadurch ergeben sich
unipolare Ableitungen, die im Wesentlichen auf eine transversale
Schnittebene (also etwa rechtwinkelig auf die Extremitätenableitungen)
projizieren.
Die Haut im Bereich des rechten Fußgelenks dient wiederum als Masse-Bezugspunkt
 Eine "perfekte" Projektion der Abläufe, die aus der elektrischen Aktivität
des Herzens resultieren, wäre gegeben, wenn das Herz im Mittelpunkt
einer elektrisch homogenen Kugel läge, von deren Oberfläche man
EKG-Signale ableitet. In der Realität ist der Körper weder homogen noch
kugelförmig, und daher sind die ableitbaren Signale nur näherungsweise
auf Körperflächen bzw. -ebenen bezogen.
Eine "perfekte" Projektion der Abläufe, die aus der elektrischen Aktivität
des Herzens resultieren, wäre gegeben, wenn das Herz im Mittelpunkt
einer elektrisch homogenen Kugel läge, von deren Oberfläche man
EKG-Signale ableitet. In der Realität ist der Körper weder homogen noch
kugelförmig, und daher sind die ableitbaren Signale nur näherungsweise
auf Körperflächen bzw. -ebenen bezogen.
So ist das auch bei den unipolaren Brustwandableitungen nach Wilson:
Der Zusammenschluss der drei Extremitätenpunkte (oben) ergibt
(idealisiert nach der Kirchhoff'schen Regel, da die
Extremitätenableitungen jeweils um 60° gegeneinander gewinkelt sind und
sich der Zusammenschluss der drei Ableitepunkte ein Nullpotential
ergeben müsste - analog zum Dreiphasen-Drehstrom). Tatsächlich ergeben
die resultierenden sechs Ableitungen (V1 bis V6 - Definition der
Ableitepunkte siehe  Abbildung) brauchbare Annäherungen an ein
"Abtasten" der EKG-Signale entlang einer horizontalen Projektion
(Transversalebene).
Abbildung) brauchbare Annäherungen an ein
"Abtasten" der EKG-Signale entlang einer horizontalen Projektion
(Transversalebene).

 Abbildung: Schematische Projektion von Extremitäten- und Brustwandableitungen auf die drei Schnittebenen des Körpers
Abbildung: Schematische Projektion von Extremitäten- und Brustwandableitungen auf die drei Schnittebenen des Körpers
Nach
einer Vorlage bei Plonsey/ Malmivuo / Plonsey, Bioelectromagnetism -
Principles and Applications of Bioelectric and Biomagnetis Fields.
Oxford University Press 1995
Zu den Körperebenen vgl. dort. In der Projektion auf die Sagittalebene dienen die Ableitungen V2 (Wilson) sowie aVF (Goldberger) als Referenzen für 0° und 90°. In der Frontalebene
(Blick von vorne auf den Körper) liegen die Extremitätenableitungen in
30°-Intervallen. Die Brustwandableitungen projizieren auf die Transversalebene (horizontal), in idealisierter Darstellung ebenfalls in 30°-Sektoren

I
n der Realität projiziert das Herz auf
die Brustwand-Ableitepunkte mit unterschiedlicher Intensität;
beispielsweise sind (meistens) die Signale von V2 bis V4 besonders
stark und die EKG-Zacken bzw. Wellen entsprechend hoch - abgesehen von
der Winkelprojektion der einzelnen Phänomene.
Der Ablauf der elektrischen Abläufe kann mit der dreidimensionalen
Bewegung eines Lichtpunktes verglichen werden, der nach vorübergehenden
"Ausflügen" immer wieder in einen stabilen Ausgangspunkt zurückkehrt.
Das liegt an den ausgeprägten kapazitiven Eigenschaften
der Gewebe zwischen Herz und Ableiteelektrode: Sobald ein bestimmtes
Potentialmuster stabil (zeitlich unverändert) bleibt, fällt ein
allfälliger Potentialunterschied (an der Quelle, d.h. im Herzen) an der
Haut - zwischen zwei Ableitestellen - in ein stabiles Nullpotential
zusammen. Im EKG ableitbar sind daher immer nur zeitliche Veränderungen (Differentiale) von Potentialmustern
in / auf dem Körper. Konstante Potentialunterschiede (z.B.
Verletzungspotentiale, wie bei Herzinfarkt) bleiben ohne (bleibende)
Auswirkung auf das EKG.
Das ist auch der Grund, warum jede Welle / Zacke im EKG von einer stabilen Mittellinie (der Isopotentiallinie, isoelectric state) aus startet und dann wieder in diese zurückfällt.
Die elektrischen Phänomene während Änderungen der Erregungssituation im
Herzen bilden sich also im EKG als Exkursionen von der
Isopotentiallinie ab - je nach Aussehen dieser Abweichungen spricht man
von "Wellen" (P-, T-Welle) oder "Zacken" (Q, R, S-Zacke, zusammen als
QRS-Komplex bezeichnet). Diese Phänomene haben jeweils eine bestimmte Größe und Richtung, die als räumliche Vektoren darstellbar sind.
Der zeitliche Verlauf dieser
Vektoren bildet sich auf die verschiedenen EKG-Ableitungen ab. Steht -
zu einem bestimmten Zeitpunkt - der betreffende Vektor parallel zu einer Ableitung, so bildet er sich in dieser maximal ab; steht er im rechten Winkel (90°) zu dieser Ableitung, bildet er sich in ihr nicht
ab. Daher ist es auch sinnvoll, mehrere Ableitungen gleichzeitig
aufzuzeichnen, weil man dann auch Phänomene erkennt, die sich in einer
einzigen Ableitung womöglich nicht abbilden würden.
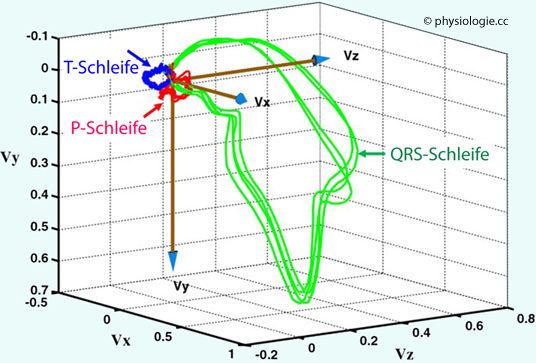
 Abbildung: Vektorschleifen
Nach Yang H, Bukkapatnam STS, Komanduri R:
Spatiotenporal representation of cardiac vectorcardiogram (VCG)
signals. BioMed Eng OnLine 2012; 11: 16
Abbildung: Vektorschleifen
Nach Yang H, Bukkapatnam STS, Komanduri R:
Spatiotenporal representation of cardiac vectorcardiogram (VCG)
signals. BioMed Eng OnLine 2012; 11: 16
Dreidimensionale
Projektionen eines physiologischen Vektorverlaufs. Hervorgerufen wird
die P-Schleife durch den Lauf der Erregung (Depolarisierung) über die
Muskulatur der Vorhöfe, die QRS-Schleife entsteht durch die Ausbreitung
der Erregung über das Ventrikelmyokard, die T-Schleife ist das Ergebnis der Erregungsrückbildung (Repolarisierung) im Ventrikelbereich

Körperachsen vgl.
dort
 Registriert man den Verlauf der Vektoren nicht eindimensional als
Funktion der Zeit (EKG), sondern auf eine Fläche projiziert (also
zweidimensional, z.B. auf die Frontalebene 0° vs. 90°), erhält man
sogenannte Vektorkardiogramme (VKG). In diesen sieht man statt Wellen schleifenförmige Gebilde (Vektorschleifen),
die aus einem stabilen Raumpunkt (entsprechend der Isopotentiallinie im
EKG) herauswachsen (
Registriert man den Verlauf der Vektoren nicht eindimensional als
Funktion der Zeit (EKG), sondern auf eine Fläche projiziert (also
zweidimensional, z.B. auf die Frontalebene 0° vs. 90°), erhält man
sogenannte Vektorkardiogramme (VKG). In diesen sieht man statt Wellen schleifenförmige Gebilde (Vektorschleifen),
die aus einem stabilen Raumpunkt (entsprechend der Isopotentiallinie im
EKG) herauswachsen (
A
bbildung) und wieder in diesen zurückfallen (P-Schleife,
QRS-Schleife, T-Schleife).
Der Vorteil des VKG ist die klare räumliche
Darstellung, der Nachteil der Verlust der Zeitinformation.
Die Darstellung der Vektorschleifen ist auch dreidimensional
möglich, als räumliche Projektion eines Vorgangs, der aus dem stabilen
Nullpunkt des Isopotentialzustandes (die PQ-Strecke und ST-Strecke
liegen normalerweise ebenfalls in diesem Punkt) "herauswächst" und
wieder in diesen zurückfällt (P-Schleife, QRS-Schleife, T-Schleife).
Welches sind nun die typischen Zacken und Wellen eines normalen EKG?
Besonders sticht (in den meisten Ableitungen) die R-Zacke hervor - sie
entsteht durch die Erregungsausbreitung im Ventrikelmyokard und kündigt
damit die Systole an. Der zeitliche Abstand der R-Zacken (das RR-Intervall) wird routinemäßig als Kriterium für die Messung der Herzfrequenz herangezogen:
Verkürzung des RR-Intervalls bedeutet Erhöhung der Pulsfrequenz
|


 Abbildung: Referenzwerte der Anteile eines normalen EKG
Nach einer Vorlage in Heinecker, EKG in Praxis und Klinik, 12. Aufl. Thieme 1986
Abbildung: Referenzwerte der Anteile eines normalen EKG
Nach einer Vorlage in Heinecker, EKG in Praxis und Klinik, 12. Aufl. Thieme 1986
Die QT-Dauer (Beginn Q-Zacke bis Ende T-Welle) wird auch als QT-Intervall bezeichnet

Die Teile des EKG sind Kurven und Zacken, die aus der Isopotentiallinie
(“Nulllinie”) herausragen. Das normale EKG besteht aus einem Vorhofteil
und einem Kammerteil.
Der Vorhofteil enthält die
 P-Welle: Sie entsteht durch die Erregungsausbreitung über die Vorhöfe; und die
P-Welle: Sie entsteht durch die Erregungsausbreitung über die Vorhöfe; und die
 PQ-Strecke: Sie zeigt, dass sich die Erregungsfront auf dem Weg in die Kammern befindet.
PQ-Strecke: Sie zeigt, dass sich die Erregungsfront auf dem Weg in die Kammern befindet.
Der Kammerteil besteht aus
 QRS-Komplex:
Dieser entsteht durch die Erregungsausbreitung über die Ventrikel. Der
Ablauf ist räumlich-zeitlich kompliziert gegliedert, daher stellt sich
der QRS-Komplex meist mehrzackig dar;
QRS-Komplex:
Dieser entsteht durch die Erregungsausbreitung über die Ventrikel. Der
Ablauf ist räumlich-zeitlich kompliziert gegliedert, daher stellt sich
der QRS-Komplex meist mehrzackig dar;
 ST-Strecke: Sie zeigt an, dass die Ventrikelmuskulatur erregt ist.
Die Zellen des Herzmuskels sind lange (~0,3 Sekunden) refraktär. Dies
schützt vor einer zusätzlichen Erregung, die den Ablauf des
Herzschlages stören könnte;
ST-Strecke: Sie zeigt an, dass die Ventrikelmuskulatur erregt ist.
Die Zellen des Herzmuskels sind lange (~0,3 Sekunden) refraktär. Dies
schützt vor einer zusätzlichen Erregung, die den Ablauf des
Herzschlages stören könnte;
 T-Welle: Sie entsteht durch die Erregungsrückbildung in den Ventrikeln.
T-Welle: Sie entsteht durch die Erregungsrückbildung in den Ventrikeln.
Das QT-Intervall (=QT-Dauer) kann bei genetisch bedingter Inaktivierung spannungsgesteuerter Calciumkanäle verlängert sein.
P-Welle: Erregungsausbreitung über die Vorhöfe
PQ-Strecke: Atrioventrikuläre Überleitung
QRS-Komplex: Erregungsausbreitung über die Ventrikel (Dauer 60-100 ms)
ST-Strecke: Ventrikel sind erregt
T-Welle: Erregungsrückbildung der Ventrikel
Ein verlängertes QT-Intervall weist auf verzögerte Repolarisation hin
|
Die wichtigsten Kriterien zur Beurteilung eines EKG:
 Dauer
Dauer der einzelnen Teile

Größe (Amplitude)
 Lagetyp
Lagetyp

Rhythmik der Vorhof- und Kammerteile

Muster, das die Teile des
EKG bilden.
Eine
räumliche Darstellung gibt die Vektorkardiographie. P-Welle,
QRS-Komplex und T-Welle nehmen die Form von Schleifen an, die von einem
Mittelpunkt (entsprechend der Isopotentiallinie des EKG) ausgehen und
in ihn zurückkehren.
Das EKG ist pathologisch verändert bei
 Schädigungen des Myokards (z.B. Durchblutungsstörungen, Infarkt-EKG
Schädigungen des Myokards (z.B. Durchblutungsstörungen, Infarkt-EKG  )
)
 Störungen der Erregungsbildung und Erregungsleitung (z.B. Extrasystolen)
Störungen der Erregungsbildung und Erregungsleitung (z.B. Extrasystolen)
 Elektrolytstoffwechselstörungen (veränderte Kalium-, Calciumwerte im Blut).
Elektrolytstoffwechselstörungen (veränderte Kalium-, Calciumwerte im Blut).

 Abbildung: Klassische Versuchsanordnung zur Ableitung eines EKG
Nach Barron SL, Development of the electrocardiograph in Great Britain. Br Med J 1: 720-5, 1950
Abbildung: Klassische Versuchsanordnung zur Ableitung eines EKG
Nach Barron SL, Development of the electrocardiograph in Great Britain. Br Med J 1: 720-5, 1950
Kommerziell
erhältliche EKG-Registrierstation aus dem Jahre 1911. Begleittext:
"Photograph of a complete electrocardiograph, showing the manner in
which the electodes are attached to the patient, in this case the hands
and one foot being immersed in jars of salt solution."
Die Registrierung der Spannungsschwankungen erfolgte mit einem Galvanometer

 Elektrische Ableitungen kardialer Aktivität wurden bereits im 19. Jahrhundert vorgenommen (Carlo Matteuchi: Taubenherzen, Augustus D. Waller: Hundeherzen). Willem Einthoven
untersuchte die Veränderung von Oberflächenpotentialen, die mit der
Herztätigeit zusammenhängen, legte mathematische Grundlagen
und Formalisierungen fest („Einthoven-Dreieck“ ) und beschrieb
zahlreiche pathologische Veränderungen. 1924 wurde er "für seine Entdeckung des Mechanismus des Elektrokardiogramms“ mit dem
Nobelpreis für Physiologie oder Medizin geehrt.
Elektrische Ableitungen kardialer Aktivität wurden bereits im 19. Jahrhundert vorgenommen (Carlo Matteuchi: Taubenherzen, Augustus D. Waller: Hundeherzen). Willem Einthoven
untersuchte die Veränderung von Oberflächenpotentialen, die mit der
Herztätigeit zusammenhängen, legte mathematische Grundlagen
und Formalisierungen fest („Einthoven-Dreieck“ ) und beschrieb
zahlreiche pathologische Veränderungen. 1924 wurde er "für seine Entdeckung des Mechanismus des Elektrokardiogramms“ mit dem
Nobelpreis für Physiologie oder Medizin geehrt.
Systolische Zeitintervalle
Die Bestimmung der "systolischen Zeitintervalle" ist eine einfache, weniger aussagekräftige Alternative, nichtinvasiv einen Einblick in die
Herzfunktion zu erhalten ( Abbildung):
Abbildung):

Aus
Pulskurve von der Halsschlagader (oben), Phonokardiogramm (Mitte) und
EKG (unten) lassen sich die Austreibungszeit des linken Ventrikels
(LVET, aus Pulskurve) und die 'pre-ejection period' (PEP:
Beginn QRS-Komplex bis Beginn 2. Herzton) ermitteln.
Je höher der
Zeitbetrag der LVET als % von PEP, desto besser (suffiziente
Herztätigkeit)

Gleichzeitige Ableitung

einer
Pulskurve (Sphygmogramm

)
von einem herznahen Gefäß (a. carotis), sie zeigt die Dauer der
Austreibungszeit des linken Ventrikels an (Systole: left ventricular
ejection time, LVET);

eines
PKG (Phonokardiogramm) - es zeigt den Zeitpunkt des Übergangs von Systole zu Diastole an (Kriterium: Beginn des 2. Herztons); und

eines
EKG (Elektrokardiogramm) - es zeigt den Beginn der Erregungsausbreitung im Ventrikel an (
QRS-Komplex).
 Man bestimmt
die Zeit von Beginn des QRS-Komplexes bis zum Beginn des 1. Herztons -
diese Dauer nennt man die "pre-ejection period" (PEP)
Man bestimmt
die Zeit von Beginn des QRS-Komplexes bis zum Beginn des 1. Herztons -
diese Dauer nennt man die "pre-ejection period" (PEP)
 Aus der Pulskurve bestimmt man die LVET
Aus der Pulskurve bestimmt man die LVET
 Die Summe der beiden Zeiten wird als die Dauer der "elektro-mechanische Systole" bezeichnet (
Die Summe der beiden Zeiten wird als die Dauer der "elektro-mechanische Systole" bezeichnet ( Abbildung).
Abbildung).
Bewertung: Die Dauer der elektro-mechanischen Systole sollte möglichst für die
Austreibungszeit (LVET) genutzt sein, die PEP relativ kurz dauern
(niedriger PEP/LVET-Quotient deutet auf gute Kontraktilität hin).
Gefäßpulsationen
Die Pulsation herznaher Gefäße kann mit mechanischen Aufnehmern
registriert werden (Sphygmographie ), oder unter Zuhilfenahme von
Ultraschall-Gefäßdarstellungen, z.B. von der Halsschlagader
(
), oder unter Zuhilfenahme von
Ultraschall-Gefäßdarstellungen, z.B. von der Halsschlagader
( Abbildung).
Abbildung).

 Abbildung: Ultraschall-Scan von der Halsschlagader
Nach einer Vorlage in hopkinsmedicine.org
Abbildung: Ultraschall-Scan von der Halsschlagader
Nach einer Vorlage in hopkinsmedicine.org
Dopplersonographie der Halsschlagader ermöglicht die Darstellung der Wanddicke sowie die Abschätzung der Elastizität und der Fließgeschwindigkeit des Blutes.
Gefäßveränderungen lassen Rückschlüsse auf die Durchgängigkeit
insbesondere der a. carotis interna und damit auf die Hirndurchblutung
zu.
Schon ein Wechsel von liegender zu aufrechter Körperposition senkt
physiologischerweise die Hirndurchblutung
 Über den Venenpuls s. dort
Über den Venenpuls s. dort
Sonographie / Echokardiographie
 Als Echokardiographie bezeichnet man die Untersuchung des Herzens mittels Ultraschall. Echokardiographische
Methoden werden zur quantitativen Bewertung der Arbeit des Herzens
herangezogen. Aus dem aufgefangenen Signal wird ein Bild rekonstruiert. Die Verwendung von Ultraschall zur Darstellung anatomischer Strukturen mit unterschiedlichen Reflexionseigenschaften nennt man Sonographie
Als Echokardiographie bezeichnet man die Untersuchung des Herzens mittels Ultraschall. Echokardiographische
Methoden werden zur quantitativen Bewertung der Arbeit des Herzens
herangezogen. Aus dem aufgefangenen Signal wird ein Bild rekonstruiert. Die Verwendung von Ultraschall zur Darstellung anatomischer Strukturen mit unterschiedlichen Reflexionseigenschaften nennt man Sonographie  .
.
Die Untersuchung kann transthorakal
oder transösophageal durchgeführt werden. Grenzflächen anatomischer Strukturen reflektieren eingestrahlten Ultraschall (transthorakal 2-4 MHz, bei Kindern 5 MHz; transösophageal
5-10 MHz - je geringer die Wellenlänge bzw. höher die Frequenz, desto
besser ist die räumliche Auflösung) je nach akustischer Dichte der
Gewebe unterschiedlich.
Die Ultraschall-Pulse dauern nur Mikrosekunden, gefolgt von einer
Millisekunde Registrierung der reflektoerten Schallwellen. Dieser
Vorgang wiederholt sich 1000-mal pro Sekunde. Aus dem reflektierten
Schallsignal rekonstruiert der Computer ein Bild der Strukturen des
Herzens und deren Bewegungen ( Abbildung).
Abbildung).

 Abbildung: EKG, Herztöne und Echokardiogramm
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: EKG, Herztöne und Echokardiogramm
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Diese
Registrierungen erfassen elektrische (EKG), akustische (PKG) und
sonographische Zeichen der Herzaktivität. Im Echokardiogramm lassen
sich die Bewegungen der Klappen (Schließen / Öffnen) und damit
Zeitmarken der mechanischen Herzaktion darstellen.
Ultraschallkardiographie (UKG) /
transthorakale Echokardiographie (TTE) wird von verschiedenen
Positionen vorgenommen: Parasternal
(3.-5. Interkostalraum), apikal (7.-9. Interkostalraum), subkostal oder
suprasternal. Manchmal ist auch eine transösophageale Darstellung
sinnvoll

Je nach Zielsetzung und Fragestellung werden unterschiedliche Sonomodi verwendet:
 Im M-Mode erfolgt eine eindimensionale Darstellung von Bewegungsabläufen (motion) von Ventrikelwand, Klappensegel etc als Funktion der Zeit (Ort-Zeit-Diagramm, auch TM-mode nach time motion).
Die untersuchende Person haltet den Transducer auf eine fixe Stelle der
Brustwand, Resultat ist ein eindimensionales Schnittbild, die Bewegung
der betreffenden Strukturen (Herzwand, Septen, Klappen) stellt sich am
Bildschirm dar. Durch Schwenken des Schallkopfs ändert sich die
Schnittlinie.
Im M-Mode erfolgt eine eindimensionale Darstellung von Bewegungsabläufen (motion) von Ventrikelwand, Klappensegel etc als Funktion der Zeit (Ort-Zeit-Diagramm, auch TM-mode nach time motion).
Die untersuchende Person haltet den Transducer auf eine fixe Stelle der
Brustwand, Resultat ist ein eindimensionales Schnittbild, die Bewegung
der betreffenden Strukturen (Herzwand, Septen, Klappen) stellt sich am
Bildschirm dar. Durch Schwenken des Schallkopfs ändert sich die
Schnittlinie.
 Im A-Mode (A für amplitude
modulation) wird auf der x-Achse die Eindringtiefe und auf der y-Achse
die Echostärke dargestellt. Je höher der Ausschlag, desto echogener ist
das Gewebe in der jeweiligen Tiefe.
Im A-Mode (A für amplitude
modulation) wird auf der x-Achse die Eindringtiefe und auf der y-Achse
die Echostärke dargestellt. Je höher der Ausschlag, desto echogener ist
das Gewebe in der jeweiligen Tiefe.
 Im B-Mode (B für brightness
modulation) wird die Echointensität in Helligkeit umgesetzt. Durch
Bewegen der Sonde überstreicht der Messstrahl eine Fläche ungefähr
senkrecht zur Hautoberfläche. Der Grauwert der Bildpunkte ist ein Maß
für die Amplitude des Echos an dieser Stelle. Im
zweidimensionalen (2D-) Echtzeitmodus wird ein Schnittbild des Gewebes
durch Verschwenkung des Messstrahls und Synchronisierung der
B-mode-Darstellung in Echtzeit erzeugt. Man kann sehen, wie z.B. eine
Arterie pulsiert.
Im B-Mode (B für brightness
modulation) wird die Echointensität in Helligkeit umgesetzt. Durch
Bewegen der Sonde überstreicht der Messstrahl eine Fläche ungefähr
senkrecht zur Hautoberfläche. Der Grauwert der Bildpunkte ist ein Maß
für die Amplitude des Echos an dieser Stelle. Im
zweidimensionalen (2D-) Echtzeitmodus wird ein Schnittbild des Gewebes
durch Verschwenkung des Messstrahls und Synchronisierung der
B-mode-Darstellung in Echtzeit erzeugt. Man kann sehen, wie z.B. eine
Arterie pulsiert.
 Mittels zweidimensionaler Echokardiographie (2-D Modus) können linksventrikuläre Volumina abgeschätzt werden: Das enddiastolische (LVEDV: left ventricular end-diastolic volume) und endsystolische Volumen (LVESV: left ventricular end-systolic volume), also das Restvolumen. Daraus errechnet sich das Schlagvolumen (SV: LVEDV - LVESV) und die Auswurffraktion (LVEF, left ventricular ejection fraction: SV / LVEDV).
Mittels zweidimensionaler Echokardiographie (2-D Modus) können linksventrikuläre Volumina abgeschätzt werden: Das enddiastolische (LVEDV: left ventricular end-diastolic volume) und endsystolische Volumen (LVESV: left ventricular end-systolic volume), also das Restvolumen. Daraus errechnet sich das Schlagvolumen (SV: LVEDV - LVESV) und die Auswurffraktion (LVEF, left ventricular ejection fraction: SV / LVEDV).
Echokardiographische Abschätzungen des Volumens des rechten Ventrikels sind wegen der komplexen Form schwierig. Der linke Ventrikel erscheint im Querschnitt rund und im Längsschnitt konisch, Volumenabschätzungen sind gut durchführbar.
Normale echokardiographische Befunde für den linken Ventrikel

Nach Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018 |
Septumdicke
|
0,6-1,2 cm
|
Enddiastolischer Innendurchmesser
|
Frauen: 3,9-5,3 cm
Männer: 4,2-5,9 cm
|
Auswurffraktion (ejection fraction)
|
>55%
|
Fläche Aortenklappe
|
>2,0 cm
|
 Durch Anwendung des Dopplereffekts (Doppler-Sonographie) werden Geschwindigkeiten darstellbar (in Farbe: F-Mode - Bewegung zur Schallquelle rot, von ihr weg blau dargestellt).
Bewegte Gewebeteile verändern die Frequenz des
zurückgeworfenen Schalls.
Durch Anwendung des Dopplereffekts (Doppler-Sonographie) werden Geschwindigkeiten darstellbar (in Farbe: F-Mode - Bewegung zur Schallquelle rot, von ihr weg blau dargestellt).
Bewegte Gewebeteile verändern die Frequenz des
zurückgeworfenen Schalls.
Doppler-Sonographie kann kontinuierlich erfolgen (CW-Doppler: continuous wave zur Bestimmung von Strömungsgeschwindigkeiten) oder mit abwechselndem Senden / Empfangen (tiefenselektiver PW-Doppler: pulsed wave, lokalisiert die Strukturen)
Gewebe-Dopplerechokardiographie erfasst die Bewegungen des Myokards (asynchrone Systole, dysfunktionale Diastole erkennbar)
Die Erfassung der Bewegung von Blutkörperchen ermöglicht die Darstellung von Blutströmung und erlaubt die Beurteilung von Stenosen, Shunts, Klappenfehlern u.a.
 Die Kombination B-Bild mit gepulstem Doppler nennt man auch Duplex-Sonographie
Die Kombination B-Bild mit gepulstem Doppler nennt man auch Duplex-Sonographie
 Bei entsprechender Programmausstattung ist es auch möglich, aus 2D-Bildern in Echtzeit Rekonstruktionen in verschiedenen Schnittebenen anzeigen zu lassen (3D-Echokardiographie)
Bei entsprechender Programmausstattung ist es auch möglich, aus 2D-Bildern in Echtzeit Rekonstruktionen in verschiedenen Schnittebenen anzeigen zu lassen (3D-Echokardiographie)
Zur Erhöhung der
Abbildungsdeutlichkeit können Kontrastmittel (gasgefüllte
Mikrobläschen mit Eiweißschale) eingesetzt werden (Kontrastechokardiographie).
Ermittlung des Schlagvolumens
Das Schlagvolumen des Ventrikels kann mittels folgender Methoden nichtinvasiv ermittelt werden:
 Pulskonturanalyse.
Da der systolische Anteil der Pulswelle (zusammen mit anderen Faktoren)
in Zusammenhang mit dem Schlagvolumen steht, kann man aus der Fläche
unter der systolischen Druckkurve (auf Basis des diastolischen Drucks)
auf die Größe des Schlagvolumens rückschließen. Das Produkt aus dieser
Fläche (area under the curve AUC) mal der Pulsfrequenz (bpm) ergibt das Herzminutenvolumen. Die Standardisierung des Verfahrens sollte mittels einer invasiven Methode vorgenommen werden.
Pulskonturanalyse.
Da der systolische Anteil der Pulswelle (zusammen mit anderen Faktoren)
in Zusammenhang mit dem Schlagvolumen steht, kann man aus der Fläche
unter der systolischen Druckkurve (auf Basis des diastolischen Drucks)
auf die Größe des Schlagvolumens rückschließen. Das Produkt aus dieser
Fläche (area under the curve AUC) mal der Pulsfrequenz (bpm) ergibt das Herzminutenvolumen. Die Standardisierung des Verfahrens sollte mittels einer invasiven Methode vorgenommen werden.
 Radionuklid-Ventrikulographie:
Ein Gammastrahler - meist Technetium-99, das an Erythrozyten gekoppelt
ist - wird i.v. injiziert; eine präkordial positionierte Gammakamera
registriert anschließend die enddiastolische und endsystolische
Aktivität, woraus man Schlagvolumen und Auswurffraktion errechnen kann.
Radionuklid-Ventrikulographie:
Ein Gammastrahler - meist Technetium-99, das an Erythrozyten gekoppelt
ist - wird i.v. injiziert; eine präkordial positionierte Gammakamera
registriert anschließend die enddiastolische und endsystolische
Aktivität, woraus man Schlagvolumen und Auswurffraktion errechnen kann.

 Abbildung: Echokardiographische Untersuchung
Abbildung: Echokardiographische Untersuchung
Nach einer Vorlage bei medicine.unimelb.edu.au
Zu
erkennen ist der Winkel, in dem die Schallwellen austreten (die
innerhalb des Schallkegels liegenden Strukturen werden auf dem
Bildschirm dargestellt). Bildgebende Ultraschallverfahren erlauben die Ausmessung der
Herzgeometrie und die Abschätzung von Schlagvolumen, Restvolumen und Auswurffraktion

 Echokardiographie
(
Echokardiographie
( Abbildung). Zweidimensionale Darstellung des endsystolischen und
enddiastolischen Zustandes in mehreren Achsen erlaubt die Berechnung
der Ventrikeldimensionen (bei angenommener Geometrie des Ventrikels).
Unter Ausnützung des Doppler-Effekts kann auch die Strömung in der
Aortenwurzel verfolgt werden. Multiplikation des
mittleren Schlagvolumens mit der Herzfrequenz ergibt das
Herzzeitvolumen. Vorteil: nichtinvasiv, hohe Zeitauflösung, in der
Anwendung
kostengünstig. Nachteil: Schwierige Eichung.
Abbildung). Zweidimensionale Darstellung des endsystolischen und
enddiastolischen Zustandes in mehreren Achsen erlaubt die Berechnung
der Ventrikeldimensionen (bei angenommener Geometrie des Ventrikels).
Unter Ausnützung des Doppler-Effekts kann auch die Strömung in der
Aortenwurzel verfolgt werden. Multiplikation des
mittleren Schlagvolumens mit der Herzfrequenz ergibt das
Herzzeitvolumen. Vorteil: nichtinvasiv, hohe Zeitauflösung, in der
Anwendung
kostengünstig. Nachteil: Schwierige Eichung.
 Impedanzkardiographie
- durch die Herzschläge bedingte Schwankungen des elektrischen
Widerstandes (Impedanz) über dem Brustkorb werden aus
Spannungsänderungen ermittelt, die sich bei Einwirken eines
applizierten konstanten Messstroms ergeben. Das Schlagvolumen in der Aorta wird ermittelt. Vorteil:
Beat-to-beat-Ermittlung des Schlagvolumens (ähnlich Echokardiographie),
Nichtinvasivität. Nachteil: Sehr indirektes Verfahren.
Impedanzkardiographie
- durch die Herzschläge bedingte Schwankungen des elektrischen
Widerstandes (Impedanz) über dem Brustkorb werden aus
Spannungsänderungen ermittelt, die sich bei Einwirken eines
applizierten konstanten Messstroms ergeben. Das Schlagvolumen in der Aorta wird ermittelt. Vorteil:
Beat-to-beat-Ermittlung des Schlagvolumens (ähnlich Echokardiographie),
Nichtinvasivität. Nachteil: Sehr indirektes Verfahren.
 Kernspinuntersuchung (Magnetresonanztomographie, magnetic resonance imaging
MRI) stellt - EKG-zeitgesteuert - die Strukturen des Herzens sehr genau
dar und kann auch (mit kontrastgebenden - z.B. Gadolinium-basierten -
Agentien) zur Messung von Blutströmung und myokardialer Durchblutung
genutzt werden. Vorteil: Nichinvasivität, bessere Darstellung der
Gewebegrenzen als bei der Echokardiographie. Nachteil: Hohe Kosten (
Kernspinuntersuchung (Magnetresonanztomographie, magnetic resonance imaging
MRI) stellt - EKG-zeitgesteuert - die Strukturen des Herzens sehr genau
dar und kann auch (mit kontrastgebenden - z.B. Gadolinium-basierten -
Agentien) zur Messung von Blutströmung und myokardialer Durchblutung
genutzt werden. Vorteil: Nichinvasivität, bessere Darstellung der
Gewebegrenzen als bei der Echokardiographie. Nachteil: Hohe Kosten ( vgl. dort).
vgl. dort).
 Minimalinvasive Methoden sind ösophageale Doppler-Strömungsmessungen und transösophageale Echokardiographie.
Minimalinvasive Methoden sind ösophageale Doppler-Strömungsmessungen und transösophageale Echokardiographie.
Die
Doppler-Methode benutzt Ultraschall-Transducer an der Spitze einer
Sonde, die über die Nase in die Speiseröhre (Hähe der Aorta descendens)
eingeführt wird. Durch Multiplikation der Strömungswerte mit dem
Aortendurchmesser gelangt man zum jeweiligen Schlagvolumen. Es können
weitere Variable ermittelt werden, wie die Spitzengeschwindigkeit des
Blutes (Indikator für die linksventrikuläre Kontraktilität). Dieser
Wert ist altersabhängig (ca. 100 cm/s bei jungen Menschen, 50-80 cm/s
bei 70jährigen).
Transösophageale
Echokardiographie (TOE) wird unter Anästhesie vorgenommen und ist
relativ aufwändig. Sie stützt sich auf Volumen- (aus Längs- und
Querdimensionen) oder Strömungsdaten (Doppler). Auch Information über
die Funktion der Klappen wird gewonnen.
 Nimmt das Herzminutenvolumen ab, muss die Sauerstoffausnützung des Blutes (AVDO2) zunehmen, um das Gewebe ausreichend mit O2
zu versorgen. Ist die Sauerstoffsättigung im zentralvenösen Blut (d.h.
im rechten Herzen) inadäquat niedrig, weist das klinisch auf
herabgesetzte Herzleistung hin.
Nimmt das Herzminutenvolumen ab, muss die Sauerstoffausnützung des Blutes (AVDO2) zunehmen, um das Gewebe ausreichend mit O2
zu versorgen. Ist die Sauerstoffsättigung im zentralvenösen Blut (d.h.
im rechten Herzen) inadäquat niedrig, weist das klinisch auf
herabgesetzte Herzleistung hin.
Nuklearmedizinische Untersuchung
Ein häufig eingesetzter Marker in der Nuklearmedizin ist metastabiles Technetium (99mTc).
Es ist ein (in einem der weltweit wenigen einschlägigen Reaktoren
gewonnener) Gammastrahler mit hoher Strahlungsintensität, aber kurzer
Halbwertszeit (6 Stunden), der sich an Erythrozyten und andere
Gewebszellen bindet.
99mTc wird zum Großteil aus dem Körper wieder ausgeschieden. Nach Abgabe der Gammastrahlung wird es zu 99Tc,
einem schwachen ß-Strahler mit sehr langer Halbwertszeit; der im Körper
verbleibende Rest trägt nur unwesentlich zur Strahlenbelastung des
Organismus bei.
Nach Injektion einer Dosis 99mTc können die Ventrikel anhand
der Strahlung dargestellt werden; über zahlreiche Herzzyklen werden
bestimmte Zeitabschnitte - wiederholt auf bestimmte Teile des EKG
bezogen - quantifiziert (gated radionuclide imaging) und so die Volumenunterschiede zwischen Enddiastole und Endsystole und damit die Auswurffraktion (ejection fraction) quantifiziert werden (Abschätzung der Kontraktilität).
Myokardperfusionsszintigraphie (MPI: Myocardial perfusion imaging)
ist eine nuklearmedizinische Methode zur Untersuchung der Myokardfunktion und der Koronardurchblutung. Sie nutzt
gamma-aktive Isotope (früher Thallium 201, heutzutage 99mTc)
- die i.v. injiziert werden - zur Markierung
von durchströmendem Blut (Perfusion des Myokards: Systole vs. Diastole)
bzw. die Aufnahme in das Myokard (Ischämien, Narben). Alternativ kann
die Menge des vom Myokard aus dem Kreislauf aufgenommenen Markers
ermittelt werden (in Ruhe und bei körperlicher Belastung).
Bei der Untersuchung erfolgt eine Belastung (ergometrisch oder pharmakologisch, z. B. mit Adenosin),
an deren Ende der Marker injiziert wird. Die Strahlungsverteilung wird
sofort ("Stress") und einige Stunden später ("Ruhe") nochmals
registriert, die Verteilung des Nuklids auf die Organe quantifiziert
und mit der Verteilung in einem Referenzkollektiv verglichen.
Insbesondere Durchmesser und Beweglichkeit der Wand des linken
Ventrikels werden erfasst.
Bei Beschädigung der Myokardzellen vermehrt in den Kreislauf abgegebene Enzyme ("Herzmarker") können in Blutproben quantifiziert werden (minimalinvasiv): Troponin T, Kreatinkinase, sowie weniger spezifische
Marker wie Myoglobin, Laktatdehydrogenase, Aspartat-Transaminase (AST, früher GOT).
Das Enzym Kreatinkinase (CK: creatine kinase, CPK: creatine phosphokinase, phosphocreatine kinase)
überträgt auf Kreatin - ein Molekül, das im Körper zu >90% in
Muskelgewebe vorkommt - Phosphat und macht es so zu einem
Energiespeicher, der im Bedarfsfall sein Phosphat wieder an ADP abgibt
und so ATP für die Muskelaktivität direkt verfügbar macht. Die vom
Herzmuskel exprimierte Isoform ist CK2 (oder CK-MB). Bei Beschädigung
von Herzmuskelgewebe (Herzinfarkt) steigt der CK2-Spiegel im Blut
innerhalb weniger Stunden an und erreicht nach 12-24 Stunden einen
Höchstwert. (Die von Skelettmuskelzellen exprimierte Isoform ist CK3,
diese steigt im Kreislauf nach Verletzungen im Bewegungsapparat an.)
Zeitverlauf: Die Konzentrationswerte von "Herzenzymen" im Blut treten zu unterschiedlichen Zeiten nach einem Infarktereignis (Infarktbeginn) auf: Myoglobin (Höchstwert nach ~12 Stunden), Kreatinkinase (Höchstwert nach <20 Stunden), Troponin (Höchstwert nach ~24 Stunden), AST (Höchstwert nach ~30 Stunden), LDH (Höchstwert nach ~40 Stunden).

Kardiales Troponin T (Serum, Plasma, Blut)
herstellerabhängig (Kontrollkollektiv)
Halbwertszeit 120 min
Kreatinkinase (CK, gesamt, Serum)
Frauen 10-70 (<167) U/l, Männer 25-90 (<190) U/l
CK-MB (Myokardtyp, auch CK2 genannt) <6% Gesamt-CK
Bei Neugeborenen höhere Werte, z.B. 1. Tag <712 U/l
Referenzbereiche bei Kindern alters- und geschlechtsabhängig
Laktatdehydrogenase (LDH, Plasma)
<260 U/l
Neugeborene <600 U/l, Kinder <300 U/l
LDH-1 und LDH-2 erhöht u.a. bei Herzinfarkt
Aspartat-Aminotransferase (AST, früher GOT; Serum): Frauen 10-35 U/l, Männer 10-50 U/l
erhöht u.a. bei Herzinfarkt
Geben nichtinvasive diagnostische Methoden
nicht ausreichend Auskunft, kommen invasive Techniken in Betracht, z.B.
Katheterisierung, Myokardbiopsie. Druck- (mechano-elektrischer Wandler) und Strömungsmessungen (Thermodilution: Herzzeitvolumen über Zeitverlauf der Bluttemperatur nach Injektion kühler Flüssigkeit) im zentralen Kreislaufanschnitt können mittels Herzkathetern
( Abbildung) erfolgen. Über diese kann z.B. auch Kontrastmittel in
definierte Räume eingebracht werden (z.B. Koronarangiographie).
Abbildung) erfolgen. Über diese kann z.B. auch Kontrastmittel in
definierte Räume eingebracht werden (z.B. Koronarangiographie).

 Abbildung: Swan-Ganz-Katheter
Abbildung: Swan-Ganz-Katheter 
Ballon an der Spitze des Katheters für Demonstrationszwecke aufgeblasen. Das System wird als Einschwemmkatheter, flow-directed, balloon-tipped pulmonary artery catheter (PAC), Pulmonaliskatheter, right heart catheter oder Swan-Ganz catheter bezeichnet.
Der Katheter wird unter Röntgenkontrolle über die rechte v. jugularis
in das rechte Herz und von dort in eine Verzweigung der a. pulmonalis
vorgeschoben. Der anschließend mit steriler Kochsalzlösung aufgeblasene
Ballon blockiert die hydrostatische Verbindung zum rechten Ventrikel
und der sich distal der Verengung einstellende Druck (pulmonary capillary
wedged pressure) entspricht dem Druck im linken Vorhof. Dieser Druck wird an der Katheterspitze gemessen

Aus der maximalen Druckanstiegsgeschwindigkeit (pd/dtmax) kann die Schlagkraft (Inotropie)
des Herzens beurteilt werden, der Referenzbereich für den linken
Ventrikel beträgt 1500 bis 2500 mmHg/s. Auch die Auswurffraktion (EF: ejection fraction) gilt als Kriterium (Schlagvolumen in % der enddiastolischen Füllung, normalerweise 50-70%), sie kann echokardiographisch ermittelt werden. Über Referenzbereiche der Druckwerte vor und hinter dem Herzen  s. dort.
s. dort.
Zur Messung der Vorlast des linken Ventrikels zwecks
Kreislaufüberwachung in kritischen Situationen (z.B. Intensivpatienten)
kann der
Pulmonalkapillaren- Verschlussdruck ("Wedge-Druck": pulmonary capillary
wedged pressure, PCWP) mittels Swan-Ganz-Einschwemmkathetern ( Abbildung) registriert werden.
Abbildung) registriert werden.
 Um korrekte Werte zu erhalten, muss die Katheterspitze in der Zone 3
(nach J.B. West - Gefäße immer offen) zu
liegen kommen - andernfalls wäre eine kontinuierliche hydrostatische Verbindung zum linken
Vorhofbereich nicht gegeben.
Um korrekte Werte zu erhalten, muss die Katheterspitze in der Zone 3
(nach J.B. West - Gefäße immer offen) zu
liegen kommen - andernfalls wäre eine kontinuierliche hydrostatische Verbindung zum linken
Vorhofbereich nicht gegeben.
Herzminutenvolumenbestimmung
[ca-cv] ist die arteriovenöse Konzentrationsdifferenz, bei Sauerstoff AVDO2 genannt - arteriovenöse Sauerstoffdifferenz, wobei [cv]
in gemischt-venösem Blut zu ermitteln ist, d.h. Blut aus dem Bereich
des rechten Ventrikels (repräsentativ für den gesamten Körper mit
seinen sehr verschiedenen regionalen O2-Verbrauchswerten).

 Abbildung: Herzminutenvolumenbestimmung mittels Sauerstoffmethode
Nach einer Vorlage bei www.78stepshealth.us
Abbildung: Herzminutenvolumenbestimmung mittels Sauerstoffmethode
Nach einer Vorlage bei www.78stepshealth.us
Im steady state
entspricht das Herzzeitvolumen (HZV) der Sauerstoffaufnahme (z.B. 250
ml/min) dividiert durch die Differenz zwischen arterieller (z.B. 0,19)
und gemisch-venöser Sauerstoffkonzentration (z.B. 0,14 ml O2 / ml Blut). In diesem Fall wäre die Rechnung: 250 / 0,05, also 5000 ml/min (5 Liter pro Minute).
Diese experimentelle Vorgangsweise kann als Referenz zur "Eichung"
nichtinvasiver Methoden verwendet werden, z.B. Herzminutenbestimmung
mittels Ultraschall

 Da das gesamte Herzminutenvolumen durch die Lungen strömt, kann zu seiner Bestimmung Sauerstoff als Indikator verwendet werden. Man bestimmt der Sauerstoffaufnahme (Atemluft) und die zentrale arterio-venösen Sauerstoffdifferenz (arterielle und rechtsherzvenöse Blutprobe:
Da das gesamte Herzminutenvolumen durch die Lungen strömt, kann zu seiner Bestimmung Sauerstoff als Indikator verwendet werden. Man bestimmt der Sauerstoffaufnahme (Atemluft) und die zentrale arterio-venösen Sauerstoffdifferenz (arterielle und rechtsherzvenöse Blutprobe:  Abbildung). Diese Methode hat mehrere Vorteile:
Abbildung). Diese Methode hat mehrere Vorteile:
 Sauerstoff ist ein physiologischer Indikator, der ohnehin eingeatmet
wird, sein Verbrauch wird für 5-10 Minuten spirometrisch bestimmt
(
Sauerstoff ist ein physiologischer Indikator, der ohnehin eingeatmet
wird, sein Verbrauch wird für 5-10 Minuten spirometrisch bestimmt
( Abbildung);
Abbildung);
 Die
arterielle (aus dem Herzen) und venöse Sauerstoffkonzentration im Blut (zur Lunge) bleibt während
der Beobachtungszeit konstant, soferne ein
Fließgleichgewicht zwischen Antransport und Verbrauch besteht (andernfalls ergibt die Messung keine validen Daten).
Die
arterielle (aus dem Herzen) und venöse Sauerstoffkonzentration im Blut (zur Lunge) bleibt während
der Beobachtungszeit konstant, soferne ein
Fließgleichgewicht zwischen Antransport und Verbrauch besteht (andernfalls ergibt die Messung keine validen Daten).
Der Nachteil der Methode ist die Invasivität (Herzkatheter):
Gemischt-venöses Blut wird aus dem rechten Ventrikel oder - besser - der
Pulmonalarterie entnommen.
Warum Herzkatheter? Peripher-venöses Blut wäre zwar einfacher zu gewinnen, seine
Sauerstoffkonzentration ist aber je nach perfundiertem Gewebe höchst
unterschiedlich, z.B. ist venöses Blut aus der Niere noch fast
vollständig sauerstoffgesättigt (~170ml O2/l
Blut oder 17 Vol-%), Blut aus dem Koronarsinus enthält hingegen nur
etwa 70 ml/l. Eine weitgehende Durchmischung der diversen
Blutfraktionen erfolgt erst im rechten Ventrikel. Entnimmt man Blut aus
der Pulmonalarterie (Pulmonalarterienkatheter; PAC), kann man davon
ausgehen, dass hier tatsächlich "gemischt-venöses" Blut (gleichermaßen aus v. cava superior und inferior, also aus oberer und unterer Körperhälfte stammend) vorliegt.
Arterielles Blut kann aus jeder beliebigen (peripheren) Arterie
gewonnen werden ( Abbildung: a. radialis), die Sauerstoffsättigung
ist immer die gleiche (normalerweise knapp 100%).
Abbildung: a. radialis), die Sauerstoffsättigung
ist immer die gleiche (normalerweise knapp 100%).
 Der deutsche Arzt Werner Forßmann
löste als Erster das Problem der Gewinnung gemischt-venösen Blutes.
1929 schob er sich selbst unter Röntgenkontrolle einen Harnkatheter von
einer Armvene in das rechte Herz - die erste Herzkatheterisierung.
Zunächst fand sein mutiger Selbstversuch kaum Beachtung, 1956
schließlich erhielt er den Nobelpreis für Physiologie oder Medizin.
Der deutsche Arzt Werner Forßmann
löste als Erster das Problem der Gewinnung gemischt-venösen Blutes.
1929 schob er sich selbst unter Röntgenkontrolle einen Harnkatheter von
einer Armvene in das rechte Herz - die erste Herzkatheterisierung.
Zunächst fand sein mutiger Selbstversuch kaum Beachtung, 1956
schließlich erhielt er den Nobelpreis für Physiologie oder Medizin.
Die bei der Bolusmethode (s. unten) erforderliche Berechnung einer Fläche
(AUC) entfällt: Die arterielle und venöse Sauerstoffkonzentration
bleibt im Messzeitraum unverändert, es wird einfach die arteriovenöse
Sauerstoffdifferenz AVDO2 (arterielle ca minus gemischt-venöse Sauerstoffkonzentration cv) eingesetzt:
Herzzeitvolumen (l/min) =
Sauerstoffaufnahme (ml/min) / AVDO2 (ml/l)
|
oder - in anderer Formulierung (Berechnung des Herzzeitvolumens nach der Indikatorverdünnungsmethode):
HZV = XO2 / (Carteriell - Cvenös) O2 (l/min)
|
wobei XO2 die Sauerstoffaufnahme (pro Minute) und (Carteriell - Cvenös) O2 die arteriovenöse Sauerstoffdifferenz bedeutet.
 Beispiel: Eine Person verbraucht 0,3 l Sauerstoff in der Minute. Das
arterielle Blut enthält 200 ml/l Blut, das gemischt-venöse
(Herzkatheter!) 150 ml/l - die AVDO2 beträgt 50 ml/l. - Berechnung des Herzminutenvolumens: O2-Verbrauch 300 ml/min, AVDO2 50 ml/l → HMV = (300 / 50) = 6 l/min
Beispiel: Eine Person verbraucht 0,3 l Sauerstoff in der Minute. Das
arterielle Blut enthält 200 ml/l Blut, das gemischt-venöse
(Herzkatheter!) 150 ml/l - die AVDO2 beträgt 50 ml/l. - Berechnung des Herzminutenvolumens: O2-Verbrauch 300 ml/min, AVDO2 50 ml/l → HMV = (300 / 50) = 6 l/min
Man kann auch das Schlagvolumen
bestimmen - nichtinvasiv: sonographisch (Echokardiographie),
Radionuklidmessung - und daraus durch Multiplikation mit der
Herzfrequenz das Herzzeitvolumen (HZV) berechnen:
(mittleres) Schlagvolumen = HZV / Pulsfrequenz
|
Umgekehrt kann bei Kenntnis des
HZV der Betrag des mittleren Schlagvolumens einfach berechnet werden (HZV / Pulsfrequenz).
 Bolusmethode:
Ein Bolus geeigneten Farbstoffs (Messung der Farbintensität) oder kalter Flüssigkeit (Messung der Temperatur) wird in den
Kreislauf gebracht und der Durchgang des Farb- (Blutproben → Zentrifugation →
Plasmaproben → Spektroskopie) oder Temperaturbolus aufgezeichnet (Thermosonde, Swan-Ganz-Katheter).
Bolusmethode:
Ein Bolus geeigneten Farbstoffs (Messung der Farbintensität) oder kalter Flüssigkeit (Messung der Temperatur) wird in den
Kreislauf gebracht und der Durchgang des Farb- (Blutproben → Zentrifugation →
Plasmaproben → Spektroskopie) oder Temperaturbolus aufgezeichnet (Thermosonde, Swan-Ganz-Katheter).
Als Farbstoff kommen Evans blue oder indocyanine green
in Betracht.
Die Thermodilutionsmethode
kommt häufig zum Einsatz und gilt als Goldstandard für die
Herzminutenvolumenbestimmung. Bei diesem Verfahren lässt man einen
Swan-Ganz-Katheter (mit aufgeblasenem Ballon an der Spitze) in die
Pulmonalarterie einschwemmen, dann werden 10-15 ml kalter
Kochsalzlösung über ein poximales Lumen in den rechten Vorhof injiziert
und der Durchlauf des Temperaturabfalls in der Pulmonalarterie mittels
Thermistor aufgezeichnet. Blutabnahmen sind nicht notwendig, ein
zweiter Gipfel (wie bei Farbstoffbolus) bleibt aus (das Blut hat sich rasch gleichmäßig erwärmt), und die Messung kann leicht wiederholt werden.

 Abbildung: Zeitverlauf eines Indikatordurchganges
Abbildung: Zeitverlauf eines Indikatordurchganges
Der
Durchgang eines Indikatorbolus (Temperatur, Farbintensität) wird als
Funktion der Zeit aufgetragen. Wegen der Geschlossenheit des Kreislaufs rezirkuliert die Farbe (wenn auch verdünnt), nach etwa 15 Sekunden tritt ein zweiter, niedrigerer Farbgipfel auf. Dieser
wird ignoriert, stattdessen wird der absteigende Teil der ersten Kurve
gegen
"Null" (logarithmische Skala: Meist 1% des Gipfelwertes) extrapoliert
und so die Passagezeit des Bolus (grüner Doppelpfeil) ermittelt.
Für diese gilt
dann die mittlere Indikatorkonzentration bzw. Temperaturstufe. Diese
wird mittels Planimetrie aus der Fläche unter der Kurve (area under the curve: AUC) ermitteltt

Der Indikator
wird so in die Zirkulation eingebracht, dass das Blut, in dem er
weitertransportiert wird, durch das Herz strömt und sein
Konzentrationsverlauf daher Rückschluss auf des Herzzeitvolumen
erlaubt: Aus dem Kurvenverlauf wird das Verteilungsvolumen / Zeit
(Herzzeitvolumen)
berechnet. Die Methode ist invasiv (Herzkatheter), liefert aber bei
richtiger Anwendung (automatisierbar) genaue Ergebnisse.
Wie resultiert aus dem Durchgang des Indikators das Herzzeitvolumen?
Die Konzentration des Indikators (der injiziert wird und dessen Menge
bekannt ist) macht einen nichtlinearen Zeitverlauf durch, und der
Indikator taucht kreislaufbedingt an der Messstelle wieder auf
(Rezirkulation). Daher wird der absteigende Konzentrationsverlauf gegen
Null extrapoliert, über diesen Schnittpunkt eine entsprechende
"Beobachtungszeit" (grüner Doppelpfeil in der  Abbildung) ermittelt und für
diese die mittlere Konzentration (Temperatur) errechnet.
Abbildung) ermittelt und für
diese die mittlere Konzentration (Temperatur) errechnet.
Das Prinzip beruht auf dem Prinzip Volumen = Menge /
Konzentration. Auf die Beobachtungszeit umgelegt, bedeutet dies
Stewart-Hamilton-Gleichung:
Herzzeitvolumen = verabreichte Indikatormenge / mittlere Indikatorkonzentration (während der Passagezeit)
|
Da sich der Farbstoff an Plasmaproteine bindet und daher zunächst das Plasmavolumen (VP)
ermittelt wird, das in der Passagezeit an der Messstelle vorbeigeströmt
ist, rechnet man anschließend auf das entsprechende Blutvolumen (VB) über den Hämatokrit (Ht) hoch:
Eine neue Methode verwendet als Indikator Lithiumchlorid,
das i.v. injiziert wird und dessen Konzentration im arteriellen Blut
mit einer ionensensitiven Elektrode verfolgt wird (der Verlust über die
Lunge ist in der Messzeit vernachlässigbar). Diese (ebenfalls invasive) Methode kann zur Kalibrierung verwendet werden.


 Kardiologische Untersuchungen inkludieren Auskultation, Perkussion, Herzschall, Blutdruck, EKG, Ergometrie, Laboruntersuchungen
(myokardspezifische Enzyme: Kardiales Troponin T, Kreatinkinase,
Laktatdehydrogenase, Aspartat-Aminotransferase), bildgebende Verfahren, Herzkatheteruntersuchungen,
Myokardbiopsie. Bei der Erstuntersuchung besonders zu beachten sind
arterieller Puls (Frequenz, Intensität), Blutdruck (sytolisch /
diastolisch), Jugularvenenpuls, Herzspitzenstoß, Herztöne / -geräusche.
Die koronare Flussreserve ist die maximale Koronarperfusion unter Belastung bezogen auf den Ruhewert (das Herzzeitvolumen sollte mindestens 4-fach steigerbar sein) Kardiologische Untersuchungen inkludieren Auskultation, Perkussion, Herzschall, Blutdruck, EKG, Ergometrie, Laboruntersuchungen
(myokardspezifische Enzyme: Kardiales Troponin T, Kreatinkinase,
Laktatdehydrogenase, Aspartat-Aminotransferase), bildgebende Verfahren, Herzkatheteruntersuchungen,
Myokardbiopsie. Bei der Erstuntersuchung besonders zu beachten sind
arterieller Puls (Frequenz, Intensität), Blutdruck (sytolisch /
diastolisch), Jugularvenenpuls, Herzspitzenstoß, Herztöne / -geräusche.
Die koronare Flussreserve ist die maximale Koronarperfusion unter Belastung bezogen auf den Ruhewert (das Herzzeitvolumen sollte mindestens 4-fach steigerbar sein)
 Das EKG
besteht aus P-Welle (Ausbreitung der Erregung über die Vorhöfe),
QRS-Komplex (Ausbreitung der Erregung über die Ventrikel), T-Welle
(Repolarisierung beider Ventrikel), getrennt durch PQ-Strecke und
ST-Strecke. Die Signale starten von der Isopotentiallinie und kehren zu dieser zurück.
Extremitätenableitungen (Projektion auf die Frontalebene) nach
Einthoven sind bipolar, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III); diejenigen nach Goldberger
sind "pseudo-unipolar" mit -150° (aVR), -30° (aVL), +90° (aVF).
Als physiologische Lagetypen gelten: Linkstyp (-30° bis 30°),
Indifferenztyp (30 bis 60°), Steiltyp (60° bis 90°), Rechtstyp (90° bis
120°) - bei situs inversus entsprechend gespiegelt. Die
Brustwandableitungen nach Wilson (Projektion auf die Transversalebene)
sind unipolar (V1, V2...). Registriert man den Verlauf statt
eindimensional als Funktion der Zeit (EKG) auf eine Fläche projiziert
(zweidimensional), erhält man ein Vektorkardiogramm (VKG) mit
Vektorschleifen, die aus einem Isopotentialpunkt herauswachsen und in
diesen zurückfallen (P-Schleife, QRS-Schleife, T-Schleife).
Pathologische Veränderungen ergeben sich bei Myokardschäden (Infarkt),
Störungen des Erregungsablaufs (Extrasystolen), Elektrolytstoffwechselstörungen (Kalium, Calcium) Das EKG
besteht aus P-Welle (Ausbreitung der Erregung über die Vorhöfe),
QRS-Komplex (Ausbreitung der Erregung über die Ventrikel), T-Welle
(Repolarisierung beider Ventrikel), getrennt durch PQ-Strecke und
ST-Strecke. Die Signale starten von der Isopotentiallinie und kehren zu dieser zurück.
Extremitätenableitungen (Projektion auf die Frontalebene) nach
Einthoven sind bipolar, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III); diejenigen nach Goldberger
sind "pseudo-unipolar" mit -150° (aVR), -30° (aVL), +90° (aVF).
Als physiologische Lagetypen gelten: Linkstyp (-30° bis 30°),
Indifferenztyp (30 bis 60°), Steiltyp (60° bis 90°), Rechtstyp (90° bis
120°) - bei situs inversus entsprechend gespiegelt. Die
Brustwandableitungen nach Wilson (Projektion auf die Transversalebene)
sind unipolar (V1, V2...). Registriert man den Verlauf statt
eindimensional als Funktion der Zeit (EKG) auf eine Fläche projiziert
(zweidimensional), erhält man ein Vektorkardiogramm (VKG) mit
Vektorschleifen, die aus einem Isopotentialpunkt herauswachsen und in
diesen zurückfallen (P-Schleife, QRS-Schleife, T-Schleife).
Pathologische Veränderungen ergeben sich bei Myokardschäden (Infarkt),
Störungen des Erregungsablaufs (Extrasystolen), Elektrolytstoffwechselstörungen (Kalium, Calcium)
 Echokardiographie (transthorakal oder transösophageal) rekonstruiert aus reflektierten Ultraschallsignalen anatomische Strukturen (Sonographie). Im M-Mode (motion) werden
Bewegungsabläufe, im A-Mode (amplitude) die Echostärke als Funktion der
Eindringtiefe dargestellt; im B-Mode (brightness) entspricht die
Helligkeit der Echointensität. Der zweidimensionale Echtzeitmodus zeigt
ein Schnittbild (z.B. Gefäßpulsationen). Doppler-Sonographie stellt
Geschwindigkeiten dar - mit alternierendem Senden / Empfangen (tiefenselektiver PW-Doppler: pulsed wave, lokalisiert Strukturen)
oder kontinuierlich (CW-Doppler: continuous wave - Bestimmung von
Strömungsgeschwindigkeiten). Zur Erhöhung der Abbildungsdeutlichkeit
dienen Kontrastmittel (Kontrastechokardiographie). Myokardperfusionsszintigraphie
(MPI: Nuclear perfusion imaging) nutzt gamma-aktive Isotope (Technetium
99m, Thallium 201) zur Markierung strömenden Blutes (Systole vs.
Diastole); auch die linksventrikuläre Auswurffraktion (ejection
fraction: Schlagvolumen als Prozentsatz der
enddiastolischen Füllung) kann damit bestimmt werden Echokardiographie (transthorakal oder transösophageal) rekonstruiert aus reflektierten Ultraschallsignalen anatomische Strukturen (Sonographie). Im M-Mode (motion) werden
Bewegungsabläufe, im A-Mode (amplitude) die Echostärke als Funktion der
Eindringtiefe dargestellt; im B-Mode (brightness) entspricht die
Helligkeit der Echointensität. Der zweidimensionale Echtzeitmodus zeigt
ein Schnittbild (z.B. Gefäßpulsationen). Doppler-Sonographie stellt
Geschwindigkeiten dar - mit alternierendem Senden / Empfangen (tiefenselektiver PW-Doppler: pulsed wave, lokalisiert Strukturen)
oder kontinuierlich (CW-Doppler: continuous wave - Bestimmung von
Strömungsgeschwindigkeiten). Zur Erhöhung der Abbildungsdeutlichkeit
dienen Kontrastmittel (Kontrastechokardiographie). Myokardperfusionsszintigraphie
(MPI: Nuclear perfusion imaging) nutzt gamma-aktive Isotope (Technetium
99m, Thallium 201) zur Markierung strömenden Blutes (Systole vs.
Diastole); auch die linksventrikuläre Auswurffraktion (ejection
fraction: Schlagvolumen als Prozentsatz der
enddiastolischen Füllung) kann damit bestimmt werden
 Das
Herzminutenvolumen kann nichtinvasiv über bildgebende Verfahren,
Impedanzkardiographie, Sauerstoffaufnahme, oder invasiv über
Indikatorpassage ermittelt werden. Druck- und
Strömungsmessungen (Thermodilution: Herzzeitvolumen über Zeitverlauf
der Bluttemperatur nach Injektion kühler Flüssigkeit) erfolgen mittels Herzkatheter (invasiv). Über diesen kann auch Kontrastmittel eingebracht werden (Koronarangiographie). Die maximale
Druckanstiegsgeschwindigkeit (pd/dtmax) während der Anspannungszeit
signalisiert die Schlagkraft (Inotropie), auch die Auswurffraktion
(ejection fraction: Schlagvolumen als Anteil der enddiastolischen Füllung,
normalerweise 50-70%). Die Vorlast des
linken Ventrikels wird über den pulmonalen Verschlussdruck
(PCWP) mittels Einschwemmkatheter ermittelt Das
Herzminutenvolumen kann nichtinvasiv über bildgebende Verfahren,
Impedanzkardiographie, Sauerstoffaufnahme, oder invasiv über
Indikatorpassage ermittelt werden. Druck- und
Strömungsmessungen (Thermodilution: Herzzeitvolumen über Zeitverlauf
der Bluttemperatur nach Injektion kühler Flüssigkeit) erfolgen mittels Herzkatheter (invasiv). Über diesen kann auch Kontrastmittel eingebracht werden (Koronarangiographie). Die maximale
Druckanstiegsgeschwindigkeit (pd/dtmax) während der Anspannungszeit
signalisiert die Schlagkraft (Inotropie), auch die Auswurffraktion
(ejection fraction: Schlagvolumen als Anteil der enddiastolischen Füllung,
normalerweise 50-70%). Die Vorlast des
linken Ventrikels wird über den pulmonalen Verschlussdruck
(PCWP) mittels Einschwemmkatheter ermittelt
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Untersuchung der Herzfunktion
Untersuchung der Herzfunktion
 Auskultation: auscultare = aufmerksam zuhören (auris = Ohr)
Auskultation: auscultare = aufmerksam zuhören (auris = Ohr)



 EKG-Diagnostik
EKG-Diagnostik  Systolische Zeitintervalle
Systolische Zeitintervalle  Echokardiographie (Sonographie)
Echokardiographie (Sonographie)  Ermittlung des Schlagvolumens
Ermittlung des Schlagvolumens  Nuklearmedizinische Untersuchung
Nuklearmedizinische Untersuchung  Enzymbestimmungen
Enzymbestimmungen  Invasive Methoden
Invasive Methoden  Herzminutenvolumenbestimmung
Herzminutenvolumenbestimmung
 Echokardiographie / Sonographie
Echokardiographie / Sonographie

 Abbildung: Echokardiographischer Untersuchungsplatz
Abbildung: Echokardiographischer Untersuchungsplatz

 Anamnese und körperliche Untersuchung
Anamnese und körperliche Untersuchung Gesamteindruck,
Bewusstseinslage (eingeschränkt?)
Gesamteindruck,
Bewusstseinslage (eingeschränkt?)
 Auskultation
Auskultation  , Perkussion
, Perkussion Organfunktionen (Durchblutung?)
Organfunktionen (Durchblutung?) Kreislauffunktion (Blutdruck stabil?)
Kreislauffunktion (Blutdruck stabil?) Apparativ-diagnostische Verfahren
Apparativ-diagnostische Verfahren Elektrokardiographie
Elektrokardiographie  ,
Phonokardiographie, Echokardiographie (
,
Phonokardiographie, Echokardiographie ( Abbildung: Untersuchungsplatz), Myokard (perfusions) szintigraphie (99mTechnetium
wird nur von gesunden Herzmuskelzellen aufgenommen),
Röntgenuntersuchung (Computertomographie).
Abbildung: Untersuchungsplatz), Myokard (perfusions) szintigraphie (99mTechnetium
wird nur von gesunden Herzmuskelzellen aufgenommen),
Röntgenuntersuchung (Computertomographie). Die Auswurffraktion
(ejection fraction) gibt an, welcher Prozentsatz der enddiastolischen Füllung während der
Systole ausgeworfen wird (normalerweise ≥0,5). Sie lässt sich z.B.
mittels Ultraschall-Bildgebungsverfahren bestimmen, meist kombiniert mit Doppler-Sonographie.
Die Auswurffraktion
(ejection fraction) gibt an, welcher Prozentsatz der enddiastolischen Füllung während der
Systole ausgeworfen wird (normalerweise ≥0,5). Sie lässt sich z.B.
mittels Ultraschall-Bildgebungsverfahren bestimmen, meist kombiniert mit Doppler-Sonographie. 
 Untersuchungen können bei körperlicher Ruhe oder während / nach Belastung
(Ergometrie) vorgenommen werden (kardiale Reserve, koronare Flussreserve: Maximale Koronarperfusion unter Belastung / Koronarperfusion in Ruhe). Das zeigt
auf, wie gut das Myokard bei Bedarf seine Pumpfunktion steigern kann.
Normalerweise lässt sich das Herzzeitvolumen mindestens 4-fach erhöhen
(bei erwachsenen Personen von ~5-7 auf ~20-30 Liter/Minute), insbesondere bei gutem Trainingszustand.
Untersuchungen können bei körperlicher Ruhe oder während / nach Belastung
(Ergometrie) vorgenommen werden (kardiale Reserve, koronare Flussreserve: Maximale Koronarperfusion unter Belastung / Koronarperfusion in Ruhe). Das zeigt
auf, wie gut das Myokard bei Bedarf seine Pumpfunktion steigern kann.
Normalerweise lässt sich das Herzzeitvolumen mindestens 4-fach erhöhen
(bei erwachsenen Personen von ~5-7 auf ~20-30 Liter/Minute), insbesondere bei gutem Trainingszustand.
 Über Herzschall s. dort
Über Herzschall s. dort Über Herzqualitäten (Chronotropie, Inotropie etc) s. dort
Über Herzqualitäten (Chronotropie, Inotropie etc) s. dort Über Herzfrequenzvariabilität s. dort
Über Herzfrequenzvariabilität s. dort
 Abbildung: Bipolare Ableitungen nach Einthoven
Abbildung: Bipolare Ableitungen nach Einthoven Abbildung). Sie erlauben mit ziemlicher Präzision die
"Projektion" des Verlaufs der elektrischen Herzaktivität auf die
Frontalebene des Körpers, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III).
Abbildung). Sie erlauben mit ziemlicher Präzision die
"Projektion" des Verlaufs der elektrischen Herzaktivität auf die
Frontalebene des Körpers, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III). 
 Abbildung: "Pseudo-unipolare" Ableitungen nach Goldberger
Abbildung: "Pseudo-unipolare" Ableitungen nach Goldberger
 Abbildung).
Abbildung). Die
6 Extremitätenableitungen bilden eine komplette 30°-Abdeckung in der
Frontalebene, von aVL (-30°) über I (0°), -aVR (30°), II (60°), aVF
(90°) bis III (120°). Die Abfolge dieser Ableitungen wird im Cabrera-Kreis (hexaxial reference system, Cabrera system -
Die
6 Extremitätenableitungen bilden eine komplette 30°-Abdeckung in der
Frontalebene, von aVL (-30°) über I (0°), -aVR (30°), II (60°), aVF
(90°) bis III (120°). Die Abfolge dieser Ableitungen wird im Cabrera-Kreis (hexaxial reference system, Cabrera system -  Abbildung) dargestellt.
Abbildung) dargestellt.
 Abbildung: Unipolare Brustwandableitungen nach Wilson
Abbildung: Unipolare Brustwandableitungen nach Wilson
 Abbildung) brauchbare Annäherungen an ein
"Abtasten" der EKG-Signale entlang einer horizontalen Projektion
(Transversalebene).
Abbildung) brauchbare Annäherungen an ein
"Abtasten" der EKG-Signale entlang einer horizontalen Projektion
(Transversalebene).
 Abbildung: Schematische Projektion von Extremitäten- und Brustwandableitungen auf die drei Schnittebenen des Körpers
Abbildung: Schematische Projektion von Extremitäten- und Brustwandableitungen auf die drei Schnittebenen des Körpers

 Abbildung: Vektorschleifen
Abbildung: Vektorschleifen Körperachsen vgl. dort
Körperachsen vgl. dort
 Abbildung) und wieder in diesen zurückfallen (P-Schleife,
QRS-Schleife, T-Schleife).
Abbildung) und wieder in diesen zurückfallen (P-Schleife,
QRS-Schleife, T-Schleife). 

 Abbildung: Referenzwerte der Anteile eines normalen EKG
Abbildung: Referenzwerte der Anteile eines normalen EKG
 P-Welle: Sie entsteht durch die Erregungsausbreitung über die Vorhöfe; und die
P-Welle: Sie entsteht durch die Erregungsausbreitung über die Vorhöfe; und die PQ-Strecke: Sie zeigt, dass sich die Erregungsfront auf dem Weg in die Kammern befindet.
PQ-Strecke: Sie zeigt, dass sich die Erregungsfront auf dem Weg in die Kammern befindet.  QRS-Komplex:
Dieser entsteht durch die Erregungsausbreitung über die Ventrikel. Der
Ablauf ist räumlich-zeitlich kompliziert gegliedert, daher stellt sich
der QRS-Komplex meist mehrzackig dar;
QRS-Komplex:
Dieser entsteht durch die Erregungsausbreitung über die Ventrikel. Der
Ablauf ist räumlich-zeitlich kompliziert gegliedert, daher stellt sich
der QRS-Komplex meist mehrzackig dar; ST-Strecke: Sie zeigt an, dass die Ventrikelmuskulatur erregt ist.
Die Zellen des Herzmuskels sind lange (~0,3 Sekunden) refraktär. Dies
schützt vor einer zusätzlichen Erregung, die den Ablauf des
Herzschlages stören könnte;
ST-Strecke: Sie zeigt an, dass die Ventrikelmuskulatur erregt ist.
Die Zellen des Herzmuskels sind lange (~0,3 Sekunden) refraktär. Dies
schützt vor einer zusätzlichen Erregung, die den Ablauf des
Herzschlages stören könnte; T-Welle: Sie entsteht durch die Erregungsrückbildung in den Ventrikeln.
T-Welle: Sie entsteht durch die Erregungsrückbildung in den Ventrikeln. Dauer der einzelnen Teile
Dauer der einzelnen Teile Größe (Amplitude)
Größe (Amplitude) Lagetyp
Lagetyp Rhythmik der Vorhof- und Kammerteile
Rhythmik der Vorhof- und Kammerteile Muster, das die Teile des
EKG bilden.
Muster, das die Teile des
EKG bilden.  Schädigungen des Myokards (z.B. Durchblutungsstörungen, Infarkt-EKG
Schädigungen des Myokards (z.B. Durchblutungsstörungen, Infarkt-EKG  )
) Störungen der Erregungsbildung und Erregungsleitung (z.B. Extrasystolen)
Störungen der Erregungsbildung und Erregungsleitung (z.B. Extrasystolen) Elektrolytstoffwechselstörungen (veränderte Kalium-, Calciumwerte im Blut).
Elektrolytstoffwechselstörungen (veränderte Kalium-, Calciumwerte im Blut).
 Abbildung: Klassische Versuchsanordnung zur Ableitung eines EKG
Abbildung: Klassische Versuchsanordnung zur Ableitung eines EKG
 Elektrische Ableitungen kardialer Aktivität wurden bereits im 19. Jahrhundert vorgenommen (Carlo Matteuchi: Taubenherzen, Augustus D. Waller: Hundeherzen). Willem Einthoven
untersuchte die Veränderung von Oberflächenpotentialen, die mit der
Herztätigeit zusammenhängen, legte mathematische Grundlagen
und Formalisierungen fest („Einthoven-Dreieck“ ) und beschrieb
zahlreiche pathologische Veränderungen. 1924 wurde er "für seine Entdeckung des Mechanismus des Elektrokardiogramms“ mit dem
Nobelpreis für Physiologie oder Medizin geehrt.
Elektrische Ableitungen kardialer Aktivität wurden bereits im 19. Jahrhundert vorgenommen (Carlo Matteuchi: Taubenherzen, Augustus D. Waller: Hundeherzen). Willem Einthoven
untersuchte die Veränderung von Oberflächenpotentialen, die mit der
Herztätigeit zusammenhängen, legte mathematische Grundlagen
und Formalisierungen fest („Einthoven-Dreieck“ ) und beschrieb
zahlreiche pathologische Veränderungen. 1924 wurde er "für seine Entdeckung des Mechanismus des Elektrokardiogramms“ mit dem
Nobelpreis für Physiologie oder Medizin geehrt. Abbildung):
Abbildung):
 Abbildung: Bestimmung der systolischen Zeitintervalle
Abbildung: Bestimmung der systolischen Zeitintervalle
 einer Pulskurve (Sphygmogramm
einer Pulskurve (Sphygmogramm  )
von einem herznahen Gefäß (a. carotis), sie zeigt die Dauer der
Austreibungszeit des linken Ventrikels an (Systole: left ventricular
ejection time, LVET);
)
von einem herznahen Gefäß (a. carotis), sie zeigt die Dauer der
Austreibungszeit des linken Ventrikels an (Systole: left ventricular
ejection time, LVET); eines PKG (Phonokardiogramm) - es zeigt den Zeitpunkt des Übergangs von Systole zu Diastole an (Kriterium: Beginn des 2. Herztons); und
eines PKG (Phonokardiogramm) - es zeigt den Zeitpunkt des Übergangs von Systole zu Diastole an (Kriterium: Beginn des 2. Herztons); und  eines EKG (Elektrokardiogramm) - es zeigt den Beginn der Erregungsausbreitung im Ventrikel an (QRS-Komplex).
eines EKG (Elektrokardiogramm) - es zeigt den Beginn der Erregungsausbreitung im Ventrikel an (QRS-Komplex). Man bestimmt
die Zeit von Beginn des QRS-Komplexes bis zum Beginn des 1. Herztons -
diese Dauer nennt man die "pre-ejection period" (PEP)
Man bestimmt
die Zeit von Beginn des QRS-Komplexes bis zum Beginn des 1. Herztons -
diese Dauer nennt man die "pre-ejection period" (PEP) Aus der Pulskurve bestimmt man die LVET
Aus der Pulskurve bestimmt man die LVET Die Summe der beiden Zeiten wird als die Dauer der "elektro-mechanische Systole" bezeichnet (
Die Summe der beiden Zeiten wird als die Dauer der "elektro-mechanische Systole" bezeichnet ( Abbildung).
Abbildung). ), oder unter Zuhilfenahme von
Ultraschall-Gefäßdarstellungen, z.B. von der Halsschlagader
(
), oder unter Zuhilfenahme von
Ultraschall-Gefäßdarstellungen, z.B. von der Halsschlagader
( Abbildung).
Abbildung). 
 Abbildung: Ultraschall-Scan von der Halsschlagader
Abbildung: Ultraschall-Scan von der Halsschlagader Als Echokardiographie bezeichnet man die Untersuchung des Herzens mittels Ultraschall. Echokardiographische
Methoden werden zur quantitativen Bewertung der Arbeit des Herzens
herangezogen. Aus dem aufgefangenen Signal wird ein Bild rekonstruiert. Die Verwendung von Ultraschall zur Darstellung anatomischer Strukturen mit unterschiedlichen Reflexionseigenschaften nennt man Sonographie
Als Echokardiographie bezeichnet man die Untersuchung des Herzens mittels Ultraschall. Echokardiographische
Methoden werden zur quantitativen Bewertung der Arbeit des Herzens
herangezogen. Aus dem aufgefangenen Signal wird ein Bild rekonstruiert. Die Verwendung von Ultraschall zur Darstellung anatomischer Strukturen mit unterschiedlichen Reflexionseigenschaften nennt man Sonographie  .
.  Abbildung).
Abbildung).
 Abbildung: EKG, Herztöne und Echokardiogramm
Abbildung: EKG, Herztöne und Echokardiogramm
 Im M-Mode erfolgt eine eindimensionale Darstellung von Bewegungsabläufen (motion) von Ventrikelwand, Klappensegel etc als Funktion der Zeit (Ort-Zeit-Diagramm, auch TM-mode nach time motion).
Die untersuchende Person haltet den Transducer auf eine fixe Stelle der
Brustwand, Resultat ist ein eindimensionales Schnittbild, die Bewegung
der betreffenden Strukturen (Herzwand, Septen, Klappen) stellt sich am
Bildschirm dar. Durch Schwenken des Schallkopfs ändert sich die
Schnittlinie.
Im M-Mode erfolgt eine eindimensionale Darstellung von Bewegungsabläufen (motion) von Ventrikelwand, Klappensegel etc als Funktion der Zeit (Ort-Zeit-Diagramm, auch TM-mode nach time motion).
Die untersuchende Person haltet den Transducer auf eine fixe Stelle der
Brustwand, Resultat ist ein eindimensionales Schnittbild, die Bewegung
der betreffenden Strukturen (Herzwand, Septen, Klappen) stellt sich am
Bildschirm dar. Durch Schwenken des Schallkopfs ändert sich die
Schnittlinie. Im A-Mode (A für amplitude
modulation) wird auf der x-Achse die Eindringtiefe und auf der y-Achse
die Echostärke dargestellt. Je höher der Ausschlag, desto echogener ist
das Gewebe in der jeweiligen Tiefe.
Im A-Mode (A für amplitude
modulation) wird auf der x-Achse die Eindringtiefe und auf der y-Achse
die Echostärke dargestellt. Je höher der Ausschlag, desto echogener ist
das Gewebe in der jeweiligen Tiefe. Im B-Mode (B für brightness
modulation) wird die Echointensität in Helligkeit umgesetzt. Durch
Bewegen der Sonde überstreicht der Messstrahl eine Fläche ungefähr
senkrecht zur Hautoberfläche. Der Grauwert der Bildpunkte ist ein Maß
für die Amplitude des Echos an dieser Stelle. Im
zweidimensionalen (2D-) Echtzeitmodus wird ein Schnittbild des Gewebes
durch Verschwenkung des Messstrahls und Synchronisierung der
B-mode-Darstellung in Echtzeit erzeugt. Man kann sehen, wie z.B. eine
Arterie pulsiert.
Im B-Mode (B für brightness
modulation) wird die Echointensität in Helligkeit umgesetzt. Durch
Bewegen der Sonde überstreicht der Messstrahl eine Fläche ungefähr
senkrecht zur Hautoberfläche. Der Grauwert der Bildpunkte ist ein Maß
für die Amplitude des Echos an dieser Stelle. Im
zweidimensionalen (2D-) Echtzeitmodus wird ein Schnittbild des Gewebes
durch Verschwenkung des Messstrahls und Synchronisierung der
B-mode-Darstellung in Echtzeit erzeugt. Man kann sehen, wie z.B. eine
Arterie pulsiert. Mittels zweidimensionaler Echokardiographie (2-D Modus) können linksventrikuläre Volumina abgeschätzt werden: Das enddiastolische (LVEDV: left ventricular end-diastolic volume) und endsystolische Volumen (LVESV: left ventricular end-systolic volume), also das Restvolumen. Daraus errechnet sich das Schlagvolumen (SV: LVEDV - LVESV) und die Auswurffraktion (LVEF, left ventricular ejection fraction: SV / LVEDV).
Mittels zweidimensionaler Echokardiographie (2-D Modus) können linksventrikuläre Volumina abgeschätzt werden: Das enddiastolische (LVEDV: left ventricular end-diastolic volume) und endsystolische Volumen (LVESV: left ventricular end-systolic volume), also das Restvolumen. Daraus errechnet sich das Schlagvolumen (SV: LVEDV - LVESV) und die Auswurffraktion (LVEF, left ventricular ejection fraction: SV / LVEDV).
 Durch Anwendung des Dopplereffekts (Doppler-Sonographie) werden Geschwindigkeiten darstellbar (in Farbe: F-Mode - Bewegung zur Schallquelle rot, von ihr weg blau dargestellt).
Bewegte Gewebeteile verändern die Frequenz des
zurückgeworfenen Schalls.
Durch Anwendung des Dopplereffekts (Doppler-Sonographie) werden Geschwindigkeiten darstellbar (in Farbe: F-Mode - Bewegung zur Schallquelle rot, von ihr weg blau dargestellt).
Bewegte Gewebeteile verändern die Frequenz des
zurückgeworfenen Schalls.  Die Kombination B-Bild mit gepulstem Doppler nennt man auch Duplex-Sonographie
Die Kombination B-Bild mit gepulstem Doppler nennt man auch Duplex-Sonographie Bei entsprechender Programmausstattung ist es auch möglich, aus 2D-Bildern in Echtzeit Rekonstruktionen in verschiedenen Schnittebenen anzeigen zu lassen (3D-Echokardiographie)
Bei entsprechender Programmausstattung ist es auch möglich, aus 2D-Bildern in Echtzeit Rekonstruktionen in verschiedenen Schnittebenen anzeigen zu lassen (3D-Echokardiographie)  Pulskonturanalyse.
Da der systolische Anteil der Pulswelle (zusammen mit anderen Faktoren)
in Zusammenhang mit dem Schlagvolumen steht, kann man aus der Fläche
unter der systolischen Druckkurve (auf Basis des diastolischen Drucks)
auf die Größe des Schlagvolumens rückschließen. Das Produkt aus dieser
Fläche (area under the curve AUC) mal der Pulsfrequenz (bpm) ergibt das Herzminutenvolumen. Die Standardisierung des Verfahrens sollte mittels einer invasiven Methode vorgenommen werden.
Pulskonturanalyse.
Da der systolische Anteil der Pulswelle (zusammen mit anderen Faktoren)
in Zusammenhang mit dem Schlagvolumen steht, kann man aus der Fläche
unter der systolischen Druckkurve (auf Basis des diastolischen Drucks)
auf die Größe des Schlagvolumens rückschließen. Das Produkt aus dieser
Fläche (area under the curve AUC) mal der Pulsfrequenz (bpm) ergibt das Herzminutenvolumen. Die Standardisierung des Verfahrens sollte mittels einer invasiven Methode vorgenommen werden. Radionuklid-Ventrikulographie:
Ein Gammastrahler - meist Technetium-99, das an Erythrozyten gekoppelt
ist - wird i.v. injiziert; eine präkordial positionierte Gammakamera
registriert anschließend die enddiastolische und endsystolische
Aktivität, woraus man Schlagvolumen und Auswurffraktion errechnen kann.
Radionuklid-Ventrikulographie:
Ein Gammastrahler - meist Technetium-99, das an Erythrozyten gekoppelt
ist - wird i.v. injiziert; eine präkordial positionierte Gammakamera
registriert anschließend die enddiastolische und endsystolische
Aktivität, woraus man Schlagvolumen und Auswurffraktion errechnen kann.
 Abbildung: Echokardiographische Untersuchung
Abbildung: Echokardiographische Untersuchung
 Echokardiographie
(
Echokardiographie
( Abbildung). Zweidimensionale Darstellung des endsystolischen und
enddiastolischen Zustandes in mehreren Achsen erlaubt die Berechnung
der Ventrikeldimensionen (bei angenommener Geometrie des Ventrikels).
Unter Ausnützung des Doppler-Effekts kann auch die Strömung in der
Aortenwurzel verfolgt werden. Multiplikation des
mittleren Schlagvolumens mit der Herzfrequenz ergibt das
Herzzeitvolumen. Vorteil: nichtinvasiv, hohe Zeitauflösung, in der
Anwendung
kostengünstig. Nachteil: Schwierige Eichung.
Abbildung). Zweidimensionale Darstellung des endsystolischen und
enddiastolischen Zustandes in mehreren Achsen erlaubt die Berechnung
der Ventrikeldimensionen (bei angenommener Geometrie des Ventrikels).
Unter Ausnützung des Doppler-Effekts kann auch die Strömung in der
Aortenwurzel verfolgt werden. Multiplikation des
mittleren Schlagvolumens mit der Herzfrequenz ergibt das
Herzzeitvolumen. Vorteil: nichtinvasiv, hohe Zeitauflösung, in der
Anwendung
kostengünstig. Nachteil: Schwierige Eichung. Impedanzkardiographie
- durch die Herzschläge bedingte Schwankungen des elektrischen
Widerstandes (Impedanz) über dem Brustkorb werden aus
Spannungsänderungen ermittelt, die sich bei Einwirken eines
applizierten konstanten Messstroms ergeben. Das Schlagvolumen in der Aorta wird ermittelt. Vorteil:
Beat-to-beat-Ermittlung des Schlagvolumens (ähnlich Echokardiographie),
Nichtinvasivität. Nachteil: Sehr indirektes Verfahren.
Impedanzkardiographie
- durch die Herzschläge bedingte Schwankungen des elektrischen
Widerstandes (Impedanz) über dem Brustkorb werden aus
Spannungsänderungen ermittelt, die sich bei Einwirken eines
applizierten konstanten Messstroms ergeben. Das Schlagvolumen in der Aorta wird ermittelt. Vorteil:
Beat-to-beat-Ermittlung des Schlagvolumens (ähnlich Echokardiographie),
Nichtinvasivität. Nachteil: Sehr indirektes Verfahren. Kernspinuntersuchung (Magnetresonanztomographie, magnetic resonance imaging
MRI) stellt - EKG-zeitgesteuert - die Strukturen des Herzens sehr genau
dar und kann auch (mit kontrastgebenden - z.B. Gadolinium-basierten -
Agentien) zur Messung von Blutströmung und myokardialer Durchblutung
genutzt werden. Vorteil: Nichinvasivität, bessere Darstellung der
Gewebegrenzen als bei der Echokardiographie. Nachteil: Hohe Kosten (
Kernspinuntersuchung (Magnetresonanztomographie, magnetic resonance imaging
MRI) stellt - EKG-zeitgesteuert - die Strukturen des Herzens sehr genau
dar und kann auch (mit kontrastgebenden - z.B. Gadolinium-basierten -
Agentien) zur Messung von Blutströmung und myokardialer Durchblutung
genutzt werden. Vorteil: Nichinvasivität, bessere Darstellung der
Gewebegrenzen als bei der Echokardiographie. Nachteil: Hohe Kosten ( vgl. dort).
vgl. dort).  Minimalinvasive Methoden sind ösophageale Doppler-Strömungsmessungen und transösophageale Echokardiographie.
Minimalinvasive Methoden sind ösophageale Doppler-Strömungsmessungen und transösophageale Echokardiographie.  Nimmt das Herzminutenvolumen ab, muss die Sauerstoffausnützung des Blutes (AVDO2) zunehmen, um das Gewebe ausreichend mit O2
zu versorgen. Ist die Sauerstoffsättigung im zentralvenösen Blut (d.h.
im rechten Herzen) inadäquat niedrig, weist das klinisch auf
herabgesetzte Herzleistung hin.
Nimmt das Herzminutenvolumen ab, muss die Sauerstoffausnützung des Blutes (AVDO2) zunehmen, um das Gewebe ausreichend mit O2
zu versorgen. Ist die Sauerstoffsättigung im zentralvenösen Blut (d.h.
im rechten Herzen) inadäquat niedrig, weist das klinisch auf
herabgesetzte Herzleistung hin.
 Abbildung) erfolgen. Über diese kann z.B. auch Kontrastmittel in
definierte Räume eingebracht werden (z.B. Koronarangiographie).
Abbildung) erfolgen. Über diese kann z.B. auch Kontrastmittel in
definierte Räume eingebracht werden (z.B. Koronarangiographie).

 Abbildung: Swan-Ganz-Katheter
Abbildung: Swan-Ganz-Katheter 

 s. dort.
s. dort. Abbildung) registriert werden.
Abbildung) registriert werden.  Um korrekte Werte zu erhalten, muss die Katheterspitze in der Zone 3
(nach J.B. West - Gefäße immer offen) zu
liegen kommen - andernfalls wäre eine kontinuierliche hydrostatische Verbindung zum linken
Vorhofbereich nicht gegeben.
Um korrekte Werte zu erhalten, muss die Katheterspitze in der Zone 3
(nach J.B. West - Gefäße immer offen) zu
liegen kommen - andernfalls wäre eine kontinuierliche hydrostatische Verbindung zum linken
Vorhofbereich nicht gegeben. Herzzeitvolumen (cardiac output)
Herzzeitvolumen (cardiac output)



 ) wird ein Indikatorstoff in das System, dessen Perfusion ermittelt
werden soll, eingebracht oder aus dem System entfernt. Dabei
ändert sich die Konzentration des Indikators zwischen Zufluss- und Abflussgefäßen (üblicherweise arteriell vs. venös). Die
Durchblutung (Q - Volumen pro Zeit) wird aus der aufgenommenen oder entfernten Menge der Indikartorsubstanz (M - Masse pro Zeit), seiner arteriellen (ca) und venösen (cv) Konzentration (Masse / Volumen) ermittelt (Fick'sche Gleichung):
) wird ein Indikatorstoff in das System, dessen Perfusion ermittelt
werden soll, eingebracht oder aus dem System entfernt. Dabei
ändert sich die Konzentration des Indikators zwischen Zufluss- und Abflussgefäßen (üblicherweise arteriell vs. venös). Die
Durchblutung (Q - Volumen pro Zeit) wird aus der aufgenommenen oder entfernten Menge der Indikartorsubstanz (M - Masse pro Zeit), seiner arteriellen (ca) und venösen (cv) Konzentration (Masse / Volumen) ermittelt (Fick'sche Gleichung):
 Abbildung: Herzminutenvolumenbestimmung mittels Sauerstoffmethode
Abbildung: Herzminutenvolumenbestimmung mittels Sauerstoffmethode
 Da das gesamte Herzminutenvolumen durch die Lungen strömt, kann zu seiner Bestimmung Sauerstoff als Indikator verwendet werden. Man bestimmt der Sauerstoffaufnahme (Atemluft) und die zentrale arterio-venösen Sauerstoffdifferenz (arterielle und rechtsherzvenöse Blutprobe:
Da das gesamte Herzminutenvolumen durch die Lungen strömt, kann zu seiner Bestimmung Sauerstoff als Indikator verwendet werden. Man bestimmt der Sauerstoffaufnahme (Atemluft) und die zentrale arterio-venösen Sauerstoffdifferenz (arterielle und rechtsherzvenöse Blutprobe:  Abbildung). Diese Methode hat mehrere Vorteile:
Abbildung). Diese Methode hat mehrere Vorteile: Sauerstoff ist ein physiologischer Indikator, der ohnehin eingeatmet
wird, sein Verbrauch wird für 5-10 Minuten spirometrisch bestimmt
(
Sauerstoff ist ein physiologischer Indikator, der ohnehin eingeatmet
wird, sein Verbrauch wird für 5-10 Minuten spirometrisch bestimmt
( Abbildung);
Abbildung); Die
arterielle (aus dem Herzen) und venöse Sauerstoffkonzentration im Blut (zur Lunge) bleibt während
der Beobachtungszeit konstant, soferne ein
Fließgleichgewicht zwischen Antransport und Verbrauch besteht (andernfalls ergibt die Messung keine validen Daten).
Die
arterielle (aus dem Herzen) und venöse Sauerstoffkonzentration im Blut (zur Lunge) bleibt während
der Beobachtungszeit konstant, soferne ein
Fließgleichgewicht zwischen Antransport und Verbrauch besteht (andernfalls ergibt die Messung keine validen Daten). Abbildung: a. radialis), die Sauerstoffsättigung
ist immer die gleiche (normalerweise knapp 100%).
Abbildung: a. radialis), die Sauerstoffsättigung
ist immer die gleiche (normalerweise knapp 100%). Der deutsche Arzt Werner Forßmann
löste als Erster das Problem der Gewinnung gemischt-venösen Blutes.
1929 schob er sich selbst unter Röntgenkontrolle einen Harnkatheter von
einer Armvene in das rechte Herz - die erste Herzkatheterisierung.
Zunächst fand sein mutiger Selbstversuch kaum Beachtung, 1956
schließlich erhielt er den Nobelpreis für Physiologie oder Medizin.
Der deutsche Arzt Werner Forßmann
löste als Erster das Problem der Gewinnung gemischt-venösen Blutes.
1929 schob er sich selbst unter Röntgenkontrolle einen Harnkatheter von
einer Armvene in das rechte Herz - die erste Herzkatheterisierung.
Zunächst fand sein mutiger Selbstversuch kaum Beachtung, 1956
schließlich erhielt er den Nobelpreis für Physiologie oder Medizin. Beispiel: Eine Person verbraucht 0,3 l Sauerstoff in der Minute. Das
arterielle Blut enthält 200 ml/l Blut, das gemischt-venöse
(Herzkatheter!) 150 ml/l - die AVDO2 beträgt 50 ml/l. - Berechnung des Herzminutenvolumens: O2-Verbrauch 300 ml/min, AVDO2 50 ml/l → HMV = (300 / 50) = 6 l/min
Beispiel: Eine Person verbraucht 0,3 l Sauerstoff in der Minute. Das
arterielle Blut enthält 200 ml/l Blut, das gemischt-venöse
(Herzkatheter!) 150 ml/l - die AVDO2 beträgt 50 ml/l. - Berechnung des Herzminutenvolumens: O2-Verbrauch 300 ml/min, AVDO2 50 ml/l → HMV = (300 / 50) = 6 l/min Bolusmethode:
Ein Bolus geeigneten Farbstoffs (Messung der Farbintensität) oder kalter Flüssigkeit (Messung der Temperatur) wird in den
Kreislauf gebracht und der Durchgang des Farb- (Blutproben → Zentrifugation →
Plasmaproben → Spektroskopie) oder Temperaturbolus aufgezeichnet (Thermosonde, Swan-Ganz-Katheter).
Bolusmethode:
Ein Bolus geeigneten Farbstoffs (Messung der Farbintensität) oder kalter Flüssigkeit (Messung der Temperatur) wird in den
Kreislauf gebracht und der Durchgang des Farb- (Blutproben → Zentrifugation →
Plasmaproben → Spektroskopie) oder Temperaturbolus aufgezeichnet (Thermosonde, Swan-Ganz-Katheter). 
 Abbildung: Zeitverlauf eines Indikatordurchganges
Abbildung: Zeitverlauf eines Indikatordurchganges
 Abbildung) ermittelt und für
diese die mittlere Konzentration (Temperatur) errechnet.
Abbildung) ermittelt und für
diese die mittlere Konzentration (Temperatur) errechnet. 
 Kardiologische Untersuchungen inkludieren Auskultation, Perkussion, Herzschall, Blutdruck, EKG, Ergometrie, Laboruntersuchungen
(myokardspezifische Enzyme: Kardiales Troponin T, Kreatinkinase,
Laktatdehydrogenase, Aspartat-Aminotransferase), bildgebende Verfahren, Herzkatheteruntersuchungen,
Myokardbiopsie. Bei der Erstuntersuchung besonders zu beachten sind
arterieller Puls (Frequenz, Intensität), Blutdruck (sytolisch /
diastolisch), Jugularvenenpuls, Herzspitzenstoß, Herztöne / -geräusche.
Die koronare Flussreserve ist die maximale Koronarperfusion unter Belastung bezogen auf den Ruhewert (das Herzzeitvolumen sollte mindestens 4-fach steigerbar sein)
Kardiologische Untersuchungen inkludieren Auskultation, Perkussion, Herzschall, Blutdruck, EKG, Ergometrie, Laboruntersuchungen
(myokardspezifische Enzyme: Kardiales Troponin T, Kreatinkinase,
Laktatdehydrogenase, Aspartat-Aminotransferase), bildgebende Verfahren, Herzkatheteruntersuchungen,
Myokardbiopsie. Bei der Erstuntersuchung besonders zu beachten sind
arterieller Puls (Frequenz, Intensität), Blutdruck (sytolisch /
diastolisch), Jugularvenenpuls, Herzspitzenstoß, Herztöne / -geräusche.
Die koronare Flussreserve ist die maximale Koronarperfusion unter Belastung bezogen auf den Ruhewert (das Herzzeitvolumen sollte mindestens 4-fach steigerbar sein)  Das EKG
besteht aus P-Welle (Ausbreitung der Erregung über die Vorhöfe),
QRS-Komplex (Ausbreitung der Erregung über die Ventrikel), T-Welle
(Repolarisierung beider Ventrikel), getrennt durch PQ-Strecke und
ST-Strecke. Die Signale starten von der Isopotentiallinie und kehren zu dieser zurück.
Extremitätenableitungen (Projektion auf die Frontalebene) nach
Einthoven sind bipolar, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III); diejenigen nach Goldberger
sind "pseudo-unipolar" mit -150° (aVR), -30° (aVL), +90° (aVF).
Als physiologische Lagetypen gelten: Linkstyp (-30° bis 30°),
Indifferenztyp (30 bis 60°), Steiltyp (60° bis 90°), Rechtstyp (90° bis
120°) - bei situs inversus entsprechend gespiegelt. Die
Brustwandableitungen nach Wilson (Projektion auf die Transversalebene)
sind unipolar (V1, V2...). Registriert man den Verlauf statt
eindimensional als Funktion der Zeit (EKG) auf eine Fläche projiziert
(zweidimensional), erhält man ein Vektorkardiogramm (VKG) mit
Vektorschleifen, die aus einem Isopotentialpunkt herauswachsen und in
diesen zurückfallen (P-Schleife, QRS-Schleife, T-Schleife).
Pathologische Veränderungen ergeben sich bei Myokardschäden (Infarkt),
Störungen des Erregungsablaufs (Extrasystolen), Elektrolytstoffwechselstörungen (Kalium, Calcium)
Das EKG
besteht aus P-Welle (Ausbreitung der Erregung über die Vorhöfe),
QRS-Komplex (Ausbreitung der Erregung über die Ventrikel), T-Welle
(Repolarisierung beider Ventrikel), getrennt durch PQ-Strecke und
ST-Strecke. Die Signale starten von der Isopotentiallinie und kehren zu dieser zurück.
Extremitätenableitungen (Projektion auf die Frontalebene) nach
Einthoven sind bipolar, mit Winkellagen von 0° (Ableitung I), 60°
(Ableitung II) und 120° (Ableitung III); diejenigen nach Goldberger
sind "pseudo-unipolar" mit -150° (aVR), -30° (aVL), +90° (aVF).
Als physiologische Lagetypen gelten: Linkstyp (-30° bis 30°),
Indifferenztyp (30 bis 60°), Steiltyp (60° bis 90°), Rechtstyp (90° bis
120°) - bei situs inversus entsprechend gespiegelt. Die
Brustwandableitungen nach Wilson (Projektion auf die Transversalebene)
sind unipolar (V1, V2...). Registriert man den Verlauf statt
eindimensional als Funktion der Zeit (EKG) auf eine Fläche projiziert
(zweidimensional), erhält man ein Vektorkardiogramm (VKG) mit
Vektorschleifen, die aus einem Isopotentialpunkt herauswachsen und in
diesen zurückfallen (P-Schleife, QRS-Schleife, T-Schleife).
Pathologische Veränderungen ergeben sich bei Myokardschäden (Infarkt),
Störungen des Erregungsablaufs (Extrasystolen), Elektrolytstoffwechselstörungen (Kalium, Calcium)  Echokardiographie (transthorakal oder transösophageal) rekonstruiert aus reflektierten Ultraschallsignalen anatomische Strukturen (Sonographie). Im M-Mode (motion) werden
Bewegungsabläufe, im A-Mode (amplitude) die Echostärke als Funktion der
Eindringtiefe dargestellt; im B-Mode (brightness) entspricht die
Helligkeit der Echointensität. Der zweidimensionale Echtzeitmodus zeigt
ein Schnittbild (z.B. Gefäßpulsationen). Doppler-Sonographie stellt
Geschwindigkeiten dar - mit alternierendem Senden / Empfangen (tiefenselektiver PW-Doppler: pulsed wave, lokalisiert Strukturen)
oder kontinuierlich (CW-Doppler: continuous wave - Bestimmung von
Strömungsgeschwindigkeiten). Zur Erhöhung der Abbildungsdeutlichkeit
dienen Kontrastmittel (Kontrastechokardiographie). Myokardperfusionsszintigraphie
(MPI: Nuclear perfusion imaging) nutzt gamma-aktive Isotope (Technetium
99m, Thallium 201) zur Markierung strömenden Blutes (Systole vs.
Diastole); auch die linksventrikuläre Auswurffraktion (ejection
fraction: Schlagvolumen als Prozentsatz der
enddiastolischen Füllung) kann damit bestimmt werden
Echokardiographie (transthorakal oder transösophageal) rekonstruiert aus reflektierten Ultraschallsignalen anatomische Strukturen (Sonographie). Im M-Mode (motion) werden
Bewegungsabläufe, im A-Mode (amplitude) die Echostärke als Funktion der
Eindringtiefe dargestellt; im B-Mode (brightness) entspricht die
Helligkeit der Echointensität. Der zweidimensionale Echtzeitmodus zeigt
ein Schnittbild (z.B. Gefäßpulsationen). Doppler-Sonographie stellt
Geschwindigkeiten dar - mit alternierendem Senden / Empfangen (tiefenselektiver PW-Doppler: pulsed wave, lokalisiert Strukturen)
oder kontinuierlich (CW-Doppler: continuous wave - Bestimmung von
Strömungsgeschwindigkeiten). Zur Erhöhung der Abbildungsdeutlichkeit
dienen Kontrastmittel (Kontrastechokardiographie). Myokardperfusionsszintigraphie
(MPI: Nuclear perfusion imaging) nutzt gamma-aktive Isotope (Technetium
99m, Thallium 201) zur Markierung strömenden Blutes (Systole vs.
Diastole); auch die linksventrikuläre Auswurffraktion (ejection
fraction: Schlagvolumen als Prozentsatz der
enddiastolischen Füllung) kann damit bestimmt werden Das
Herzminutenvolumen kann nichtinvasiv über bildgebende Verfahren,
Impedanzkardiographie, Sauerstoffaufnahme, oder invasiv über
Indikatorpassage ermittelt werden. Druck- und
Strömungsmessungen (Thermodilution: Herzzeitvolumen über Zeitverlauf
der Bluttemperatur nach Injektion kühler Flüssigkeit) erfolgen mittels Herzkatheter (invasiv). Über diesen kann auch Kontrastmittel eingebracht werden (Koronarangiographie). Die maximale
Druckanstiegsgeschwindigkeit (pd/dtmax) während der Anspannungszeit
signalisiert die Schlagkraft (Inotropie), auch die Auswurffraktion
(ejection fraction: Schlagvolumen als Anteil der enddiastolischen Füllung,
normalerweise 50-70%). Die Vorlast des
linken Ventrikels wird über den pulmonalen Verschlussdruck
(PCWP) mittels Einschwemmkatheter ermittelt
Das
Herzminutenvolumen kann nichtinvasiv über bildgebende Verfahren,
Impedanzkardiographie, Sauerstoffaufnahme, oder invasiv über
Indikatorpassage ermittelt werden. Druck- und
Strömungsmessungen (Thermodilution: Herzzeitvolumen über Zeitverlauf
der Bluttemperatur nach Injektion kühler Flüssigkeit) erfolgen mittels Herzkatheter (invasiv). Über diesen kann auch Kontrastmittel eingebracht werden (Koronarangiographie). Die maximale
Druckanstiegsgeschwindigkeit (pd/dtmax) während der Anspannungszeit
signalisiert die Schlagkraft (Inotropie), auch die Auswurffraktion
(ejection fraction: Schlagvolumen als Anteil der enddiastolischen Füllung,
normalerweise 50-70%). Die Vorlast des
linken Ventrikels wird über den pulmonalen Verschlussdruck
(PCWP) mittels Einschwemmkatheter ermittelt 