

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Autonomes Nervensystem
Autonomes Nervensystem
© H. Hinghofer-Szalkay
 adrenerg: ad = bei, ren = Niere, εργον = Arbeit
adrenerg: ad = bei, ren = Niere, εργον = Arbeit
cholinerg: χολή = Galle (Cholin in Galle), εργον = Arbeit
Edinger-Westphal-Kern: Ludwig Edinger, Carl F.O. Westphal
enterisch: ἔντερον = Darm
ergotrop: ἔργον = Arbeit, τροπή = Richtung
Katecholamin: katechu = Extrakt aus der Gerberakazie, Amin von Ammonium - Ἄμμων = Gottheit (Ammoniumchlorid als 'sal ammoniacus')
Parasympathikus: παρά = neben, bei; Sympathikus: συμ-πάθεια = Mit-empfindung (Jacob Winslow)
prä-, postganglionär: prae = vor, post = nach, γάγγλιον = Aufschwellung
Splanchnicus: σπλάγχνα = Eingeweide
trophotrop: τροφος = Nahrung, τροπή = Richtung
vegetativ: vegetare = beleben (von vegere = munter sein, vegetus = lebhaft)
Das autonome Nervensystem (Vegetativum) steuert komplexe
Vorgänge mit hohem Autonomiegrad. Es besteht aus drei Komponenten: Dem sympathischen, dem parasympathischen und dem
Darmnervensystem. Eine
zentrale Koordinationsstelle für autonom-nervöse Reflexe und
Steuerung ist der Hypothalamus, ein Teil des limbischen Systems.
Parasympathische Efferenzen verlassen Hirnstamm
(Hirnnerven) und Rückenmark (Sakralbereich), sympathische das
Rückenmark (Thorakolumbalbereich). Die von ihnen gesteuerten Funktionen
beziehen sich auf fast alle Systeme des Körpers, wie Kreislauf, Atmung,
Sinnesfunktionen, Verdauung, Hormonbildung.
Präganglionäre Neurone arbeiten cholinerg (nikotinische Rezeptoren). Die Zahl der von einer präganglionären Faser beeinflussten postganglionären Neuronen (Divergenz) ist unterschiedlich, das Verhältnis reicht
von 1:4 (Iris, Ziliarkörper - präzise Steuerbarkeit) bis zu mehreren
hundert (Blutgefäße, Schweißdrüsen - breit
gestreute Wirkung).
Von den Eingeweiden ziehen afferente (viszerosensible) Fasern zum ZNS (über N. facialis, glossopharyngeus, vagus, Beckennerven).
Sie melden Dehnungs-, chemische und Schmerzreize; ihre thalamischen und
kortikalen Projektionen tragen auch zu bewussten Empfindungen bei (Harn- und
Stuhldrang, Übelkeit, Atemnot, Schmerz).
Die efferenten Wirkungen von Sympathikus und Parasympathikus sind
außerordentlich vielfältig - teils lokal, teils breit gestreut.
Generell kann man das Wirkmuster beim Sympathikus als ergotrop (ergon = Arbeit; nach außen gerichtet), beim Parasympathikus als trophotrop (trophos = Nahrung; nach innen gerichtet) bezeichnen.
|
Übersicht  Zentren & Reflexe
Zentren & Reflexe  präganglionär
präganglionär  postganglionär
postganglionär  NANC
NANC  viszerale Afferenzen
viszerale Afferenzen  viszerale Efferenzen, Splanchnicussystem
viszerale Efferenzen, Splanchnicussystem  Kontrolle der Harnblase
Kontrolle der Harnblase  "Sympathikustonus"
"Sympathikustonus"  Synopsis: Sympathikus
Synopsis: Sympathikus
 Parasympathikus
Parasympathikus

Splanchnicussystem  Herzfrequenzvariabilität, respiratorische Arrhythmie
Herzfrequenzvariabilität, respiratorische Arrhythmie
 Core messages
Core messages
Das
"autonome" Nervensystem besteht aus drei Teilen: Dem sympathischen, dem
parasympathischen und dem Darmnervensystem. Letzteres ist tatsächlich
autonom (in dem Sinne, dass es ohne Einflüsse aus dem ZNS funktionieren
kann); der Sympathikus und der Parasympathikus hingegen sind Agenten
des ZNS und können ohne es nicht funktionieren. Allerdings: Bewusster
Kontrolle ist das autonome Nervensystem
weitgehend entzogen. Außer der Skelettmuskulatur versorgt es jedenfalls
alle Organe des Körpers mit efferenten Impulsen. Das bezieht sich
insbesondere auf Kreislauf (Herztätigkeit, Blutgefäße) und Lunge,
viszerale Motorik (Darm, Urogenitalsystem etc), Sinnesorgane, alle
exokrinen und einige endokrine Sekretionstätigkeiten, Energiehaushalt,
Stoffwechsel, Immunsystem.
Fast alle Gewebe werden vom autonomen Nervensystem versorgt
Das
autonome Nervensystem (vegetatives Nervensystem, "Vegetativum"  - autonomic nervous, vegetative, involuntary, visceral system)
ist die neuronale Maschinerie, welche vor allem die Funktion der
inneren Organe in Sekundenschnelle beeinflussen und koordinieren kann.
Diese Kontrollfunktion übt es kontinuierlich aus, Tag und Nacht - in
Abhängigkeit von Signalen, und Erfordernissen von Systemen, die mit
Vorgängen befasst sind, die dem Bewusstsein weitgehend verborgen
bleiben (Stoffwechsel, Kreislauf, Atmung, Verdauung, Funktionen der
Nieren, des Urogenitalsystems, der Immunabwehr u.a.).
- autonomic nervous, vegetative, involuntary, visceral system)
ist die neuronale Maschinerie, welche vor allem die Funktion der
inneren Organe in Sekundenschnelle beeinflussen und koordinieren kann.
Diese Kontrollfunktion übt es kontinuierlich aus, Tag und Nacht - in
Abhängigkeit von Signalen, und Erfordernissen von Systemen, die mit
Vorgängen befasst sind, die dem Bewusstsein weitgehend verborgen
bleiben (Stoffwechsel, Kreislauf, Atmung, Verdauung, Funktionen der
Nieren, des Urogenitalsystems, der Immunabwehr u.a.).
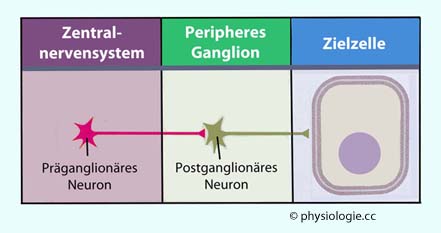
 Abbildung: Organisation prä- und postgalglionärer Neurone in Sympathikus und Parasympathikus
Abbildung: Organisation prä- und postgalglionärer Neurone in Sympathikus und Parasympathikus
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Grundsätzliches Schema: Ein zentrales
vegetatives Neuron tritt aus dem ZNS aus und bildet Synapsen an
Neuronen in - zentral oder peripher gelegenen - Ganglien (Gruppierungen
von Nervenzellen).
Das "zweite" (periphere) Neuron wirkt dann synaptisch / parakrin auf Zielzellen (z.B. glatte Muskelzellen, Drüsenzellen).
Ganglien sind keine simplen "Umschaltestationen", wie man aus der
vereinfachten Darstellung fälschlich ableiten könnte: Sie enthalten
neben afferenten und efferenten Nervenzellen auch Interneurone und sind
mit einem dichten Fasergeflecht (Neuropil) miteinander verbunden, das
eine beträchtliche Rechenleistung sowie Kon- und Divergenz ermöglicht

 sympathische,
sympathische,
 parasympathische und
parasympathische und

 intestinale
(enterische
intestinale
(enterische , Darm-) Nervensystem eingeteilt (Gegenstand der Neurogastroenterologie).
, Darm-) Nervensystem eingeteilt (Gegenstand der Neurogastroenterologie).
Erstere innervieren glatte und Herzmuskelzellen, Drüsen, lymphatische
Organe; letzteres stellt ein komplexes Nervengeflecht der
Darmeingeweide dar, das auch unter der Kontrolle des sympathischen und
parasympathischen Systems steht.
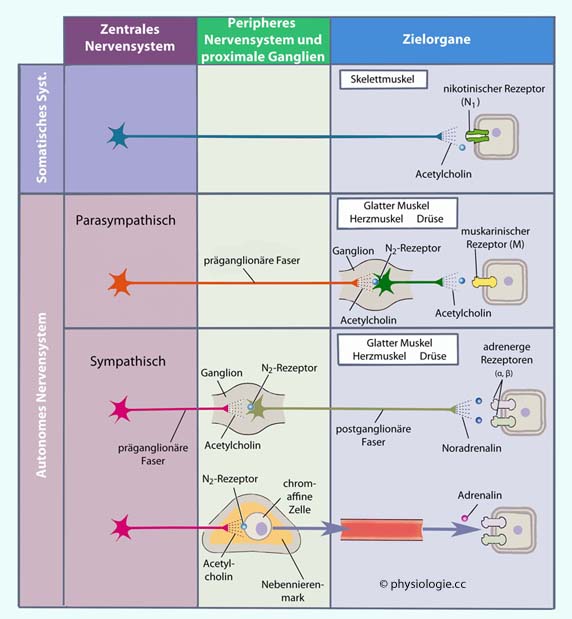
 Abbildung: Organisation efferenter Neurone
Abbildung: Organisation efferenter Neurone
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Alle das ZNS verlassenden Neurone funktionieren cholinerg - nikotinisch (N1) oder muskarinisch (N2).
Oben: Das somatische System steuert mit motorischen Vorderhornzellen die Skelettmuskulatur.
Darunter: Autonomes System. Im Parasympathikus erfolgt die ganglionäre "Umschaltung" in der Peripherie, im Sympathikus prävertebral.
Präganglionäre sympathische Fasern schalten in den beiden
paravertebralen Ketten von Ganglien ("sympathischer Grenzstrang") auf
postganglionäre Neurone um, deren Axone wieder mit Spinalnerven
verlaufen, oder sie schalten in unpaaren (median gelegenen) Ganglien
um, wenn sie an Eingeweise im Bauch- oder Beckenraum adressiert sind.
Chromaffine endokrine Zellen des Nebennierenmarks sind im Effekt
modifizierte postganglionäre Zellen.
Parasympathische Ganglienzellen geben Acetylcholin, sympathische
Noradrenalin ab. Das Nebennierenmark enthält chromaffine Zellen, die
Adrenalin sezernieren
 Das sympathische Nervensystem
ist nicht unbedingt lebensnotwendig, soferne Umweltfaktoren gut
kontrolliert und arm an Überraschungen sind. Es ist aber normalerweise
immer aktiv, und das in sehr unterschiedlichem Ausmaß - sowohl was die
Zeit als auch die betroffenen Organe angeht. Der Sympathikus macht den
Körper fit für Aktivität und Krisensituationen; in diesen steigt sein
"Tonus" (Aktivitätsgrad), und das wirkt sich auf zahlreiche
Körperfunktionen aus. Das macht sich in einem starken Divergenzcharakter
bei der Verschaltung von prä- auf postganglionäre Zellen bemerkbar: Die
sympathische Wirkung projiziert auf breit gefächerte Körperareale, und
sie kann ihre Intensität und ihr Muster je nach Anforderungen innerhalb
von Sekunden ändern ("fight or flight").
Das sympathische Nervensystem
ist nicht unbedingt lebensnotwendig, soferne Umweltfaktoren gut
kontrolliert und arm an Überraschungen sind. Es ist aber normalerweise
immer aktiv, und das in sehr unterschiedlichem Ausmaß - sowohl was die
Zeit als auch die betroffenen Organe angeht. Der Sympathikus macht den
Körper fit für Aktivität und Krisensituationen; in diesen steigt sein
"Tonus" (Aktivitätsgrad), und das wirkt sich auf zahlreiche
Körperfunktionen aus. Das macht sich in einem starken Divergenzcharakter
bei der Verschaltung von prä- auf postganglionäre Zellen bemerkbar: Die
sympathische Wirkung projiziert auf breit gefächerte Körperareale, und
sie kann ihre Intensität und ihr Muster je nach Anforderungen innerhalb
von Sekunden ändern ("fight or flight").
Ein Ausfall des sympathischen
Systems hat dramatische Folgen: So überhitzt der Organismus bei
steigender Wärmebelastung; die notwendigen Gefäßreaktionen bleiben bei
Muskelarbeit, Stress, Blutverlust oder Hypoxie aus; der
Blutzuckerspiegel reagiert nicht ausreichend
bzw. sinkt bei plötzlicher Belastung; Ermüdung macht sich rasch
bemerkbar.
Kurzum, der Sympathikus ist ein für generelle rasche Anpassung an Stressoren
notwendiges "Kampfsystem". Das Spektrum kann von eher harmlosen (z.B.
Absinken des Blutzuckerspiegels, Blutdruckabfall durch Aufrichten) bis
zu tatsächlich lebensbedrohlichen Situationen reichen. Für den "Alltag"
kann man sagen, dass beide Äste des autonomen Nervensystems - jeweils
ausgewogen - mehr oder weniger aktiv sind und sich in ihren Wirkungen
funktionell ergänzen.
Das parasympathische System ist auf jeden Fall lebensnotwendig. Es
zeigt im Gegensatz zum Sympathikus kaum Divergenz, vielmehr präzise
Steuerungseigenschaften. Es ist auf homöostatische Funktionen spezialisiert, vor allem die Erhaltung
von Organfunktionen und Energiekonservierung. Seine Funktionen machen
sich z.B. im Kreislauf (Herzschonung und Blutdrucksenkung),
respiratorischem System (Schutz- und Säuberungsfunktion in Bronchien),
Auge (Schutz vor Austrocknung und übermäßigem Lichteinfall),
Verdauungssystem (Anregung), Blase und Rektum (Entleerung), Immunsystem (Antigenerkennung u.a.) bemerkbar.
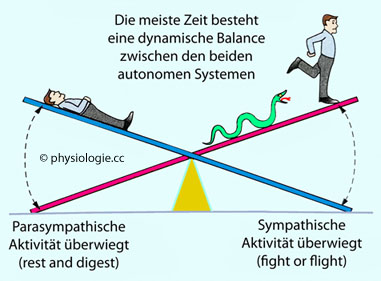

Abbildung: Homöostatisches Gleichgewicht
Nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. Pearson / Benjamin Cummings 2007
Während der
parasympathische Ast des autonomen Systems im Ruhezustand und
postprandial am aktivsten ist (links), überwiegt der Sympathikustonus
in Phasen hoher Ausrichtung auf externe Herausforderungen (Kampf,
Flucht, rechts). Bei üblichen Alltagsaktivitäten (mäßige Anspannung)
besteht ein ausbalanciertes Gleichgewicht der beiden Systemaktivitäten
 Das
autonome Nervensystem steuert Körperfunktionen
im Sinne der
Das
autonome Nervensystem steuert Körperfunktionen
im Sinne der

Aufrechterhaltung eines inneren Milieus (
Homöostase) und
der
 Anpassung
Anpassung an wechselnde Anforderungen der Umgebung des Organismus.
Seine Efferenzen versorgen alle innervierten Körperstrukturen bis auf die Skelettmuskulatur (die von somatischen
Nerven versorgt wird). Seine distalen Umschaltungen liegen in
autonomen Ganglien, sämtlich außerhalb des ZNS; postganglionäre Fasern
sind nichtmyelinisiert (langsame Leitung). Eine Blockade peripherer
autonomer Nerven führt nicht
zu totalem Funktionsausfall des betroffenen Gebietes, Drüsen- und
glatte Muskelzellen erhalten einige Spontanaktivität. (Im Gegensatz
dazu atrophiert denervierter Skelettmuskel.)
Afferenzen aus viszeralen Strukturen bringen sensorische Information zum ZNS (zentralen Nervensystem) und laufen über zwei Stränge:
 Kraniales System: Über parasympathische Afferenzen der V., VII., IX. und X. Hirnnerven zum Hirnstamm / nucl. tractus solitarii;
Kraniales System: Über parasympathische Afferenzen der V., VII., IX. und X. Hirnnerven zum Hirnstamm / nucl. tractus solitarii;
 Spinales System: über sympathische und parasympathische Fasern zum Rückenmark.
Spinales System: über sympathische und parasympathische Fasern zum Rückenmark.
Diese
Afferenzen ermöglichen autonome Reflexe, deren Bögen meistens über das
ZNS laufen (außer Axonreflexe). Dabei betreffen über das kraniale System geleitete Impulse hauptsächlich Mechano- und Chemosensibilität, das spinale System vorwiegend Information betreffend Temperatur und Gewebeverletzung / Schmerz (mechanisch, chemisch, thermisch).
Sensorische Informationen aus viszeralen Organen gelangen auch über Spinalnerven
in das ZNS, z.B. betreffend muskuläre Chemosensitivität.
Abhängig von der Umweltsituation steuert das autonome System u.a.
 Endogene Rhythmen, wie die
Schlaf-Wach-Folge,
Endogene Rhythmen, wie die
Schlaf-Wach-Folge,
 Kreislauffunktion,
Kreislauffunktion,
 Atemtätigkeit,
Atemtätigkeit,
 Ernährung /
Verdauungsfunktionen,
Ernährung /
Verdauungsfunktionen,
 Blasenmotorik,
Blasenmotorik,
 Genitalreflexe,
Genitalreflexe,
 Hautdurchblutung,
Hautdurchblutung,
 Pupillenweite und Akkommodation.
Pupillenweite und Akkommodation.
Das autonome
Nervensystem versorgt glatte Muskulatur (Iris- und Ziliarmuskel,
Bronchien, Darmmuskulatur, Urogenitaltrakt), Herzmuskel und Drüsen
efferent und afferent. Afferente Fasern vermitteln z.B. Informationen
über die Dehnung der Lunge, Blutgase, Blutvolumen und Blutdruck,
Nahrung und Verdauungssystem, Füllung von Blase und Mastdarm.
Ganglienzellen erhalten auch Impulse von afferenten Fasern, so dass der
Zustand der Peripherie (z.B. der Niere) in die efferente Steuerung für den postganglionären Ausgang einbezogen wird.
Bei autonomen Afferenzen sind zahlreiche Neurotransmitter im Spiel (Glutamat, VIP, CCK, Somatostatin,
Substanz P, ATP, CGRP?). Solche afferente Information kann durch Enkephaline blockiert werden.
Das autonome Nervensystem wird von einem zentralen Netzwerk
gesteuert, das sich durch das gesamte Gehirn erstreckt und dessen
Komponenten miteinander verknüpft sind. Es erhält Afferenzen aus der
viszeralen Körperperipherie ( Abbildung) und projiziert auf diese
zurück (nächste
Abbildung) und projiziert auf diese
zurück (nächste  Abbildung).
Abbildung).
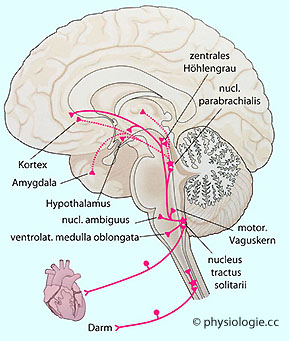
 Abbildung: Afferenzen aus der Peripherie zum zentralen autonomen Netzwerk
Abbildung: Afferenzen aus der Peripherie zum zentralen autonomen Netzwerk
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Neuronale Information aus den Eingeweiden (viszerale Sensibilität)
gelangt über Splanchnicus- und Hirnnerven zum nucleus tractus solitarii
und weiter zu parasympathischen Neuronen (dorsaler Vaguskern, nucleus
ambiguus), zur ventrolateralen medulla oblongata (Atmungs- und Kreislaufreflexe), zu Brücke (nucl. parabrachialis) und Mittelhirn (zentrales Höhlengrau) und schließlich zum Vorderhirn.
Die parabrachialen Kerne projizieren weiters auf zahlreiche rostral von
ihnen gelegene Teile des zentralen Netzwerks, z.B. viszerale und
Geschmackskerne des Thalamus (punktierte Linien)

Das Frontalhirn beteiligt sich an der
Steuerung autonomer Funktionen (was sich z.B. bei Stress, Angst,
Schlafmangel, Nervosität zeigt) und wird seinerseits von Meldungen aus
den Eingeweiden beeinflusst. Das gilt insbesondere für "überwältigende"
Sensationen wie Dyspnoe (Lufthunger), Vergiftung (Übelkeit),
Substratmangel (Hunger), Hyperthermie, Hypothermie, starke Dehnung der
Blase (Harndrang) oder des Rectums (Stuhldrang).
Neben den in der  Abbildung gezeignen Bahnen vermitteln andere
Impulse aus der Peripherie an verschiedene Teile des limbischen
Systems; viszerale Projektionen aus dem Rückenmark gelangen auch in den
somatosensorischen Thalamus (nucl. posterolateralis ventralis). Der Hypothalamus übernimmt zahlreiche "Vermittlerfunktionen" zwischen Großhirn (Frontalkortex, limbisches System) und Hirnstammkernen.
Abbildung gezeignen Bahnen vermitteln andere
Impulse aus der Peripherie an verschiedene Teile des limbischen
Systems; viszerale Projektionen aus dem Rückenmark gelangen auch in den
somatosensorischen Thalamus (nucl. posterolateralis ventralis). Der Hypothalamus übernimmt zahlreiche "Vermittlerfunktionen" zwischen Großhirn (Frontalkortex, limbisches System) und Hirnstammkernen.

Zur autonomen Regulation des
Kreislaufs s.
dort
Ein autonomer Kern von großer Bedeutung ist der nucleus tractus solitarii
(NTS) im verlängerten Mark. Seine ("zweiten") Neurone erhalten
Informationen von Chemo- und Barorezeptoren sowie weitere
nicht-nozizeptive Meldungen aus Thorax und Abdomen (insbesondere
viszerale Afferenzen des N. vagus). Der
NTS steht mit mehreren anderen Zentren (Frontalhirn, Hypothalamus,
Hirnstammkerne) in Verbindung, reguliert viszerale Funktionen und
beteiligt sich an zahlreichen autonomen Reflexen.

 Abbildung: Efferenzen des zentralen autonomen Netzwerks
Abbildung: Efferenzen des zentralen autonomen Netzwerks
Nach einer Vorlage in Kandel / Koester / Mack / Siegelbaum (eds), Principles of Neural Sciences, 6th ed. 2021 (McGraw Hill)
Die
hier dargestellen Bahnen ziehen direkt zu autonomen (präganglionären)
Neuronen. Projektionen aus dem Hypothalamus erfolgen sowohl auf
sympathische als auch auf parasympathische Nervenzellen.
Weitere Projektionen (nicht dargestellt) erfolgen von monoaminergen Zellgruppen des Hirnstamms (noradrenerg, serotoninerg)

Das Zentrale
Netzwerk vermittelt auch konditionierte emotionale vegetative
Reaktionen - spezifische Reize führen zu autonomen Antwortmustern, z.B.
Tachykardie (erhöhte Pulsfrequenz).
Läsionen im Bereich der Mandelkerne (nuclei amygdaloidei) können solche erlernten Reaktionen zum Verschwinden bringen.
Das zentrale Netzwerk ist mit Neuronen, welche - direkt oder indirekt - hormonbildende Zellen beeinflussen, zum neuroendokrinen System verknüpft - insbesondere im Bereich des Hypothalamus. Hormonsysteme und autonomes Nervensystem sind eng miteinander verbunden und ihre Funktionen aufeinander abgestimmt.
In diesem Kapitel wird der neuronale Anteil des neuroendokrinen Systems
dargestellt. Dieser besteht aus dem sympathischen, dem
parasympathischen und dem intestinalen Nervensystem:
Einige Organe / Gewebe werden (fast) ausschließlich durch den Parasympathikus beeinflusst (Bronchien, m. sphincter pupillae), andere (fast) nur durch den Sympathikus (Blutgefäße, Schweißdrüsen, m. dilatator pupillae), andere wiederum durch beide "Schenkel" des vegetativen Systems (Speicheldrüsen, Sinusknoten im Herz). Das Darmnervensystem stellt die dritte Komponente des autonomen Nervensystems dar ( s. dort).
s. dort).

 Abbildung: Vegetatives Nervensystem
Abbildung: Vegetatives Nervensystem
Nach einer Vorlage in Banich / Compton, Cognitive Neuroscience, 4th ed. 2018, Cambridge Univ. Pressu
Der
Sympathikus ist unter "Fight or flight"-Bedingungen aktiv, der
Parasympathikus unter "Rest or digest"-Bedingungen. Zwischen diesen
beiden Extrempolen gibt es zahlreiche Zwischenzustände, die Aktivierung
einzelner Systeme kann unterschiedlich gewichtet erfolgen.
Die Axone präganglionärer sympathischer
Neurone (in thorako-lumbalen Rückenmarkspartien gelegen) verzweigen
sich, viele steigen im Grenzstrang auf und ab und erreichen zahlreiche
postganglionäre (nor)adrenerge Zellen (starke Divergenz, breite
Streuung von Erregunsmustern). Die (langsamer leitenden, weil nicht
isolierten) postganglionären Fasern ziehen - mit Spinalnerven und Blutgefäßen - zu ihren Erfolgsorganen.
Parasympathische
präganglionäre Zellen in Hirnstamm und Sakralmark ziehen bis zum
Erfolgsorgan und schalten erst hier auf postganglionäre Zellen um, die
Wirkungen sind dadurch gezielter. Im Edinger-Westphal-Kern  des Mittelhirns entspringen parasympathische Fasern des III. Hirnnerven (N. oculomotorius). Diese vermitteln Pupillenverengung und Akkommodation.
Der
nucleus salivatorius superior steuert parasympathische Faserrn des VII.
Hirnnerven (N. facialis) und der nucleus salivatorius inferior solche
des IX. Hirnnerven (N. glossopharyngeus) bei (Tränen- und Speicheldrüsen).
des Mittelhirns entspringen parasympathische Fasern des III. Hirnnerven (N. oculomotorius). Diese vermitteln Pupillenverengung und Akkommodation.
Der
nucleus salivatorius superior steuert parasympathische Faserrn des VII.
Hirnnerven (N. facialis) und der nucleus salivatorius inferior solche
des IX. Hirnnerven (N. glossopharyngeus) bei (Tränen- und Speicheldrüsen).
Der dorsale Vaguskern (X. Hirnnerv)
versorgt den thorako-abdominalen Eingeweideblock (Herz, Lunge, Leber,
Pankreas, gastrointestinales System bis Teile des Colons) mit
parasympathischen Fasern.
Parasympathische Fasern für Becken- und untere Baucheingeweide (Blase, Rectum, Genitalien) entspringen aus dem Sakralmark (als Nn. erigentes) und schalten in pelvischen Ganglien (die sowohl sympathische als auch parasympathische Fasern enthalten) auf zielorgannahe postganglionäre Neuronen um

Zusammengefasst
sind die wichtigsten Eigenschaften und Kennzeichen des sympathischen
und des parasympathischen Systems die folgenden:
Eigenschaft
|
Modifiziert nach Mastenbjörk / Meloni, Pharmacological Review. Medical Creations 2021 |
Sympathikus
|
Parasympathikus
|
Lage
|
|
Thorakolumbalmark
|
Hirnnerven 3,7,9,10
Sakralmark
|
Axonlänge
|
präsynaptisch
postsynaptisch
|
kurz
lang
|
lang
kurz
|
Transmitter
|
präsynaptisch
postsynaptisch |
Acetylcholin
Noradrenalin (Acetylcholin)
|
Acetylcholin
Acetylcholin
|
Wirkungen auf Systeme
|
Gesamteffekt
|
fight or flight
|
rest and digest
|
Pupillen
|
Dilatation
|
Konstriktion
|
Speichelsekretion
|
gehemmt
|
angeregt
|
Luftwege
|
Bronchodilatation
|
Bronchokonstriktion
|
Herz
|
Tachykardie
|
Bradykardie
|
Verdauungssystem
|
Hemmt Digestion / Gallenblase
Fördert Glukosefreisetzung aus der Leber
motorische Relaxation
|
Fördert Digestion und Darmmotorik
Fördert Glukoseaufnahme in die Leber
|
Endokrines System
|
Regt Nebennierenmark an (Katecholaminfreisetzung)
|
--
|
Harnblase
|
Relaxation
|
Kontraktion
|
 "Vegetative Reflexe" laufen weitgehend unbewusst ab, z.B. betreffend
"Vegetative Reflexe" laufen weitgehend unbewusst ab, z.B. betreffend
Limbisches System und Hypothalamus (Koordinationsstelle für
hormonelle, autonom-nervöse und Verhaltensprogramme) steuern gemeinsam
das autonome Nervensystem. Ihnen sind die autonom-nervösen Zentren des
Hirnstamms (Bereich autonomer Hirnnervenkerne) und Rückenmarks (Bereich
des Seitenhorns)
zugeordnet. Sie koordinieren sympathische und parasympathische
Funktionen.
Teilsysteme können dabei - je nach erforderlichem
Funktionsmuster - antagonistisch (entgegengesetzt) oder synergistisch
(zusammenwirkend) aktiviert werden.
Die Zentren des Parasympathikus
liegen im Hirnstamm und im Sakralmark (S2-4) - ”kranio-sakrales
System“ (cranium = Schädel). Die Umschaltung von prä- auf postganglionär erfolgt organnah
(peripher) bzw. im Organ selbst
Die Zentren des Sympathikus
liegen im Thorakal- und Lumbalmark (Th1 bis L3) - ”thorako-lumbales
System“; die Umschaltung erfolgt organfern (im oder in der Nähe des
Grenzstrang(s), Ausnahme Nebennierenmark - s. Abbildungen).
Vereinfachend kann man das Funktionsgleichgewicht Sympathikus / Parasympathikus als "Fight-or-flight" vs. "Rest-and-digest"
bezeichnen: Ersterer steht bei Kampf- oder Fluchtsituationen im
Vordergrund (Ergotropie ), letzterer bei körperlicher Ruhe bzw.
Verdauungstätigkeit (Trophotropie
), letzterer bei körperlicher Ruhe bzw.
Verdauungstätigkeit (Trophotropie ).
).
Das efferente autonome Nervensystem hat einen vor der finalen Umschaltung in einem vegetativen Ganglion, und einen nach dieser Umschaltung gelegenen
Teil. Die Ausstattung mit Rezeptoren und z.T. die verwendeten
Transmitter sind unterschiedlich und daher pharmakologisch gezielt
beeinflussbar.
Präganglionäre autonome Nervenfasern sind myelinisiert; alle sind nikotionisch-cholinerg (der N2-Rezeptor-Subtyp unterscheidet sich vom N1-Subtyp an motorischen Endplatten).
Sympathische
präganglionäre Nervenfasern entspringen im Seitenhorn des Rückenmarks
(1. Thorakal- bis 3. Lumbarsegment) und bilden auf postganglionären
Neuronen in para- und prävertebralen Ganglien synaptische Kontakte; parasympathische
entspringen im Hirnstamm und Sakralmark (S2 bis S4) und haben
synaptische Kontakte auf postganglionären Neuronen in peripheren
Ganglien - in unmittelbarer Nähe des jeweiligen Zielorgans.
Der präganglionäre Transmitterstoff ist Acetylcholin (wirkt auf nikotinische Rezeptoren); dabei werden unterschiedlich viele postganglionäre Zellen
erreicht (Divergenz), das Verhältnis reicht von 1:4 (Ziliarganglion;
relativ präzise Steuerung der Iris und des Ziliarkörpers) bis 1 zu mehrere
hundert postganglionäre Zellen (Blutgefäße, Schweißdrüsen), wodurch
eine starke Verbreitung auf große Gebiete erreicht wird.
Diese cholinerge  Übertragung auf nikotinische NN-Rezeptoren der postganglionären Nervenzelle ist durch den - heute nur noch experimentell angewendeten - Ganglienblocker Hexamethonium
blockierbar. Die Rezeptoren werden mit den Buchstaben NN
charakterisiert, um sie von den - ebenfalls nikotinischen -
NM-Rezeptoren an der motorischen Endplatte zu unterscheiden (diese sind
durch D-Tubocurarin blockierbar). Nikotinische Rezeptoren öffnen Ionenkanäle, ihre Aktivierung depolarisiert die Zelle.
Übertragung auf nikotinische NN-Rezeptoren der postganglionären Nervenzelle ist durch den - heute nur noch experimentell angewendeten - Ganglienblocker Hexamethonium
blockierbar. Die Rezeptoren werden mit den Buchstaben NN
charakterisiert, um sie von den - ebenfalls nikotinischen -
NM-Rezeptoren an der motorischen Endplatte zu unterscheiden (diese sind
durch D-Tubocurarin blockierbar). Nikotinische Rezeptoren öffnen Ionenkanäle, ihre Aktivierung depolarisiert die Zelle.

 Abbildung: Organisation des peripheren sympathischen Systems
Abbildung: Organisation des peripheren sympathischen Systems
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Die
Axone der präganglionären sympathischen Neuronen verlassen das
Rückenmark über die Vorderwurzel (zusammen mit motorischen Fasern) und
laufen dann über den ramus communicans albus (albus = weiß: Markscheiden!) zu
postganglionären Neuronen.
Der ramus communicans griseus (griseus = grau) enthält langsamer leitende
postganglionär-efferente Zellen. Afferente (viszeral-sensorische)
Fasern mischen sich zu sympathisch-efferenten und ziehen über
die Hinterwurzel zum Rückenmark.
Präganglionäre Fasern rot, postganglionäre grün, afferente blau
unterlegt

Im sympathischen (thorakolumbaren) System treten präganglionäre ("weiße", da noch etwas markhaltige) Fasern über rami communicantes albi in den Grenzstrang ein und nehmen unterschiedliche Verläufe:
 Sie
schalten nur zum Teil auf gleicher Höhe um, viele breiten sich nach
oben und unten aus und schalten auf postganglionäre Zellen;
dieses Muster ist
typisch für die Versorgung von Gefäßmuskulatur und Schweißdrüsen in
Rumpf und Extremitäten, ferner Augen (Mydriasis!) und Thoraxeingeweiden
Sie
schalten nur zum Teil auf gleicher Höhe um, viele breiten sich nach
oben und unten aus und schalten auf postganglionäre Zellen;
dieses Muster ist
typisch für die Versorgung von Gefäßmuskulatur und Schweißdrüsen in
Rumpf und Extremitäten, ferner Augen (Mydriasis!) und Thoraxeingeweiden
 Sie
ziehen in Eingeweidenerven (Nn. splanchnici
Sie
ziehen in Eingeweidenerven (Nn. splanchnici  ) weiter und schalten in
einem prävertebralen Ganglion um (Versorgung von Bauch- und
Beckeneingeweiden)
) weiter und schalten in
einem prävertebralen Ganglion um (Versorgung von Bauch- und
Beckeneingeweiden)
 Sie
ziehen bis zum Nebennierenmark und schalten erst hier auf chromaffine
Zellen um, wobei diese zur Ausschüttung von Katecholaminen
Sie
ziehen bis zum Nebennierenmark und schalten erst hier auf chromaffine
Zellen um, wobei diese zur Ausschüttung von Katecholaminen  (4/5
Adrenalin, 1/5 Noradrenalin) angeregt werden.
(4/5
Adrenalin, 1/5 Noradrenalin) angeregt werden.
Dabei
treten an der postganglionären Zelle mehrere Effekte im Zeitbereich
zwischen Millisekunden (Spike-Generierung) bis Minuten auf (peptiderges
EPSP,  Abbildung).
Abbildung).


Abbildung: EPSP- und IPSP-Effekte an einer autonomen Ganglienzelle
Nach einer Vorlage bei Katzung BG, Masters SB, Trevor AJ: Basic and Clinical Pharmacology, 11th ed. McGraw-Hill 2009
Eine
Elektrode in der postganglionären Nervenzelle erlaubt intrazelluläre
Ableitungen des Membranpotentialverlaufs.
Erregung des präganglionären
Neurons setzt Acetylcholin frei (rosa Pfeil) und bindet an Acetylcholinrezeptoren, die postganglionäre Zelle reagiert zunächst mit zwei EPSPs (NN-Rezeptor), wobei in diesem Beispiel das zweite überschwellig wird und ein Spike (Aktionspotential) entsteht (Millisekundenbereich).
Es folgt ein IPSP durch Aktivierung von muskarinischen (M2-) Rezeptoren. Dann tritt ein weiteres, M1-Rezeptor-abhängiges EPSP auf (Sekundenbereich), schließlich ein noch langsameres, peptidinduziertes EPSP (Minutenbereich)
 Näheres s. dort
Näheres s. dort

Einzelne präganglionäre Aktionspotentiale reichen oftmals aus, um postganglionär überschwellig zu wirken (starke EPSPs,
ähnlich der Übertragungssicherheit an motorischen Endplatten). So
bilden sich - analog zur motorischen Einheit - "autonome Einheiten" zur
effizienten Ansteuerung bestimmter Aufgaben (wie Sudomotorik oder
Vasodilatation in definierten Hautgebieten zur Thermoregulation).
Weiters exprimieren Nervenzellen in vegetativen Ganglien neben
nikotinischen auch muskarinische (M) Acetylcholinrezeptoren. Diese
sind über G-Proteine funktionell an Kaliumkanäle (KCNQ)
gekoppelt und bewirken bei wiederholter Aktivierung (höherfrequente
präsynaptische Aktivität) über mehrere Sekunden andauernde,
erregungsfördernde Depolarisation ("langsame EPSPs",  Abbildung).
Abbildung).
Acetylcholin findet sich kaum
im Blut; seine Wirkungen sind lokal begrenzt und von kurzer Dauer (hohe
Konzentration von Acetylcholinesterase an cholinergen Synapsen).
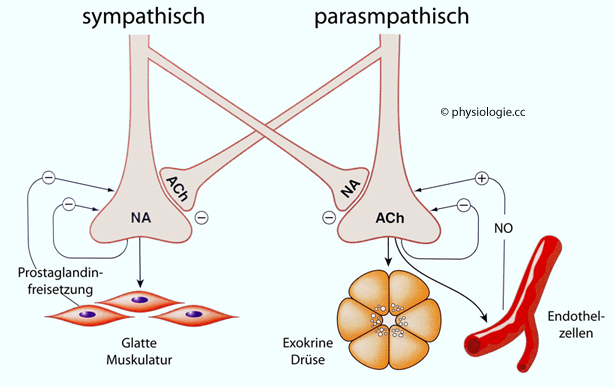
 Abbildung: Präsynaptische Beeinflussung der Transmitterfreisetuung
Abbildung: Präsynaptische Beeinflussung der Transmitterfreisetuung
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Links:
An sympathischen Synapsen freigesetztes Noradrenalin (NA) sowie vom
Zielgewebe gebildete Prostaglandine hemmen die präsynaptische
NA-Freisetzung.
Rechts: An parasympathischen Synapsen freigesetztes Acetylcholin (ACh) sowie von Endothelzellen freigesetztes NO hemmen die präsynaptische ACh-Freisetzung.
Zusätzlich
können Kollateralen präsynaptischer Fasern die
Transmitterfreisetzung präsynaptischer Neurone im jeweils anderen
autonomen System inhibieren (heterotrope Interaktion)
 Im Gegensatz zu
somatomotorischen Efferenzen (motorische Vorderhornzellen), welche
direkt auf ihre Zielzellen schalten (motorische Endplatten), verfügen
autonom-nervöse Efferenzen (zu Muskel- und Drüsenzellen) über eine
periphere Zwischenschaltung (autonome Ganglien) - ZNS-nahe beim
Sympathikus und zielgewebsnahe beim Parasympathikus. Dadurch eröffnet
sich die Möglichkeit vielfacher Rückkopplungen und zusätzlicher
Steuerungen. An diesen autonomen Synapsen wirken nicht nur freigesetzte
Transmitter und Mediatoren auf präganglionäre Fasern zurück, sondern es
gibt auch wechselseitige Inhibition durch präsynaptische Kollateralen
des jeweils anderen Zweigs des autonomnen Systems (heterotrope
Interaktion,
Im Gegensatz zu
somatomotorischen Efferenzen (motorische Vorderhornzellen), welche
direkt auf ihre Zielzellen schalten (motorische Endplatten), verfügen
autonom-nervöse Efferenzen (zu Muskel- und Drüsenzellen) über eine
periphere Zwischenschaltung (autonome Ganglien) - ZNS-nahe beim
Sympathikus und zielgewebsnahe beim Parasympathikus. Dadurch eröffnet
sich die Möglichkeit vielfacher Rückkopplungen und zusätzlicher
Steuerungen. An diesen autonomen Synapsen wirken nicht nur freigesetzte
Transmitter und Mediatoren auf präganglionäre Fasern zurück, sondern es
gibt auch wechselseitige Inhibition durch präsynaptische Kollateralen
des jeweils anderen Zweigs des autonomnen Systems (heterotrope
Interaktion,  Abbildung). Beeinflussung der Effizienz der
Transmitterfreisetzung an einer Synapse nennt man Neuromodulation.
Abbildung). Beeinflussung der Effizienz der
Transmitterfreisetzung an einer Synapse nennt man Neuromodulation.
 Über Neuromodulation in autonom-nervösen Systemen s. dort
Über Neuromodulation in autonom-nervösen Systemen s. dort

 Abbildung: Einige Einflüsse auf die Freisetzung von Noradrenalin aus sympathischen Ganglien
Abbildung: Einige Einflüsse auf die Freisetzung von Noradrenalin aus sympathischen Ganglien
Nach einer Vorlage in Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
Links: Hemmenden Einfluss üben u.a. Acetylcholin und Katecholamine (über alpha- und Dopaminrezeptoren), Purine (ATP, Adenosin), Histamin, Serotonin (5-HT), Prostaglandin E, Endorphine und Endocannabonoide aus.
Rechts: Anregend wirken Adrenalin (beta-adrenerg) sowie Angiotensin II

Sowohl im sympathischen als auch im parasympathischen System unterscheiden sich
präsynaptische Autorezeptoren von postsynaptischen.
 Dieser Unterschied kann pharmakologisch genutzt werden, wenn entsprechende Agonisten oder Antagonisten ihre Hauptwirkung entweder präsynaptisch
oder postsynaptisch entfalten. So können
ganglienstimulierende Stoffe oder Ganglienblocker selektiv
präsynaptisch, diverse Peptide oder Nichtpeptide postsynaptisch auf
adrenerge oder cholinerge Rezeptoren wirken.
Dieser Unterschied kann pharmakologisch genutzt werden, wenn entsprechende Agonisten oder Antagonisten ihre Hauptwirkung entweder präsynaptisch
oder postsynaptisch entfalten. So können
ganglienstimulierende Stoffe oder Ganglienblocker selektiv
präsynaptisch, diverse Peptide oder Nichtpeptide postsynaptisch auf
adrenerge oder cholinerge Rezeptoren wirken.
Postganglionäre
autonome Nervenfasern sind unmyelinisiert; parasympathische
funktionieren muskarinisch-cholinerg, die meisten sympathischen adrenerg (Ausnahme: Muskarinisch-sympathische Innervation der Schweißdrüsen).
Zahlreiche postganglionäre Fasern haben Auftreibungen
(Varikositäten) entlang des Neuriten, aus denen die Transmitter via Exozytose in das
Gewebe freigesetzt werden (folgende  Abbildung). Die Entfernung zu den Zielzellen (Diffusionsstrecke) kann bis zu einigen Zehntelmillimetern betragen (synapses à distance, synapses en passant).
Abbildung). Die Entfernung zu den Zielzellen (Diffusionsstrecke) kann bis zu einigen Zehntelmillimetern betragen (synapses à distance, synapses en passant).
Besonders zahlreich sind Varikositäten entlang sympathischer
postganglionärer Fasern, die ja bis zum Zielorgan teils lange Strecken
überspannen (vom sympathischen Grenzstrang bis zum peripheren Zielorgan
- parasympathische postganglionäre Fasern hingegen sind kurz, die
Umschaltung erfolgt peripher, d.h. zielorgannahe). Sympathische Neurone
setzen neben Noradrenalin Cotransmitter frei, typischerweise ATP und
Neuropeptid Y. In den meisten Zielgeweben ist die Noradrenalinkonzentration
proportional zur Innervationsdichte mit sympathischen Fasern (z.B. 5
bis 50 nM pro Gramm Gewebe in Herzmuskel, Samenleiter oder Milz).
Die Noradrenalinsynthese ist
kurzfristig durch Inhibition des Endproduktes (Noradrenalin) auf das
geschwindigkeitsbestimmende Enzym (Tyrosinhydroxylase) stabilisiert (s. dort), längerfristig (Stunden bis Tage) über Regulation der Synthese dieses Enzyms (Gentranskription).

 Abbildung: Vorgänge an autonom-nervösen Varikositäten: Beispiel noradrenerger (sympathischer) Neuroeffektor
Abbildung: Vorgänge an autonom-nervösen Varikositäten: Beispiel noradrenerger (sympathischer) Neuroeffektor

Nach
Wehrwein EA, Orer HS, Barman SM. Overview of the Anatomy, Physiology,
and Pharmacology of the Autonomic Nervous System. Compr Physiol 2016,
6: 1239-78
Varikositäten des
autonomen Nervensystems setzen bei Aktivierung postganglionärer
Fasern aus ihren Vesikeln gespeicherten Transmitter (z.B. Noradrenalin) in das umliegende
Interstitium frei ("synapse en passant"). Dadurch erreicht eine
ausreichende Menge Transmitter relativ zügig viele umliegende (glatte
Muskel- oder andere) Zellen (etwa bei einer fight & flight-Reaktion).
Dopamin (DA)
wird mittels VMAT (vesikulärer Monoamin-Transporter) aus dem Zytoplasma
in Vesikel transportiert und zu Noradrenalin (NE) verwandelt ( s. dort). Strömen - erregungsbedingt - Ca++-Ionen ein,
dann fusionieren Vesikel mit der Außenmembran und setzen Noradrenalin
frei, zusammen mit Cotransmittern - Neuropeptid Y (NPY) und Adenosintriphosphat (ATP).
s. dort). Strömen - erregungsbedingt - Ca++-Ionen ein,
dann fusionieren Vesikel mit der Außenmembran und setzen Noradrenalin
frei, zusammen mit Cotransmittern - Neuropeptid Y (NPY) und Adenosintriphosphat (ATP).
VAMPs (vesicle‐associated membrane proteins) befördern die Anlagerung der Vesikel, SNAPs (synaptosome‐associated proteins)
unterstützen die Freigabe der Transmittermoleküle.
 Über den Synaptobrevin- Syntaxin- Mechanismus s. auch dort
Über den Synaptobrevin- Syntaxin- Mechanismus s. auch dort
Noradrenalin und
Kotransmitter können an G-Protein-gekoppelten oder ligandengekoppelten
Ionenkanalrezeptoren ansetzen. Noradrenalin kann auch mittels des
Monoamintransporters NET (norepinephrine transporter) in die Varikosität zurückgelangen. Auto- und Heterorezeptoren modulieren die Transmitterfreigabe
 vgl. dort
vgl. dort
Nervenzellen in vegetativen (vor allem prävertebralen) Ganglien verarbeiten sowohl afferente als auch efferente Impulse (räumliche und zeitliche Summation).
Um Aktionspotentiale auszulösen, müssen ausreichend depolarisierende
Synapsenreize vorhanden sein - hemmende Impulse verzögern die
Erregungsbildung dementsprechend. Unterschiedliche Eingänge werden komplex verrechnet - vegetative Ganglien sind
mehr als nur "Relaisstationen".
Das Resultat dieser integrativen Leistung wird via postganglionäre Fasern in die Peripherie gesendet: Postganglionäre Fasern sind marklos ("grau") und verlassen den Grenzstrang über rami communicantes grisei.
 Der parasympathische
Der parasympathische  Transmitter ist Acetylcholin (wirkt auf muskarinische Rezeptoren vom M3-Typ). Die Rezeptoren stimulieren G-Proteine. Diese können unterschiedliche Wirkung haben:
Transmitter ist Acetylcholin (wirkt auf muskarinische Rezeptoren vom M3-Typ). Die Rezeptoren stimulieren G-Proteine. Diese können unterschiedliche Wirkung haben:
 Aktivierung des IP3-Mechanismus, Anstieg des intrazellulären Calciumspiegels und Aktivierung von Proteinkinase C;
Aktivierung des IP3-Mechanismus, Anstieg des intrazellulären Calciumspiegels und Aktivierung von Proteinkinase C;
 Hemmung der Adenylatzyklase und Senkung des cAMP-Spiegels; oder
Hemmung der Adenylatzyklase und Senkung des cAMP-Spiegels; oder
 direkte Modulierung von Kaliumkanälen durch den freigesetzten βγ-Komplex.
direkte Modulierung von Kaliumkanälen durch den freigesetzten βγ-Komplex.
 Im sympathischen
System wirken Katecholamine (Noradrenalin / Adrenalin ~ 20:1; adrenerge
Im sympathischen
System wirken Katecholamine (Noradrenalin / Adrenalin ~ 20:1; adrenerge  Rezeptoren), in Ausnahmefällen (Schweißdrüsen) Acetylcholin (Rezeptoren vom M3-Typ).
Rezeptoren), in Ausnahmefällen (Schweißdrüsen) Acetylcholin (Rezeptoren vom M3-Typ).
Hypersensitivität (supersensitivity):
Kommt es zu einem Verlust der Wiederaufnahme von Noradrenalin in
postganglionär- sympathische Nervenfasern, kommt es durch das längere
Verbleiben des Transmitters an der betreffenden Stelle zu Übererregung
(Hypersensitivität) der Zielzellen.
Andere Transmitter als Acetylcholin / Noradrenalin:
So wie andere Nervenzellen, benutzen auch autonome Neurone außer den
"klassischen" Transmitterstoffen auch weitere, die als NANC (non-adrenergic non-cholinergic) - autonom-nervöse Cotransmitter - bezeichnet werden. Zu diesen gehören ATP, VIP, NPY, NO (s. Tabelle). Cotransmitter können u.U. stärker wirksam sein als "klassische" Überträgerstoffe, sie wirken langsamer und länger anhaltend - ATP relativ schnell, NO mäßig
rasch, NPY und VIP langsam.
Nach der Geschwindigkeit des postganglionären Wirkungseintritts ergibt sich das folgende Muster:
 Rasche Antwort: Acetylcholin (parasympathisch), ATP (sympathisch)
Rasche Antwort: Acetylcholin (parasympathisch), ATP (sympathisch)
 Intermediäre Antwort: NO (parasympathisch), Noradrenalin (sympathisch)
Intermediäre Antwort: NO (parasympathisch), Noradrenalin (sympathisch)
 Langsame Antwort: VIP (parasympathisch), NPY (sympathisch)
Langsame Antwort: VIP (parasympathisch), NPY (sympathisch)
NANC und andere Cotransmitter

Nach Ritter / Flower / Henderson / Loke / MacEwan / Rang, Rang & Dale's Pharmacology, 9th ed. Elsevier 2020
|
Transmitter
|
Lage
|
Funktion
|
Nicht-Peptide
|
ATP
|
Postganglionäre sympathische Neurone
|
Rasche Depolarisierung / Kontraktion glatter Muskeln (z.B. Blutgefäße, vas deferens)
|
GABA
5-HT
|
Darmnerven
|
Peristaltik
|
Dopamin
|
Renale und andere sympathische Neuronen
|
Vasodilatation
|
NO
|
Nerven in Magen und Beckenregion
|
Magenentleerung
Erektion
|
Peptide
|
NPY
|
Postganglionäre sympathische Neurone |
Verstärkt konstriktorische Wirkung,
hemmt Freisetzung von Noradrenalin
|
VIP
|
Salivatorische parasympathische Nerven
NANC-Steuerung von Luftwegen
|
Vasodilatation
ACh-Cotransmitter
Bronchodilatation
|
| GnRH |
Sympathische Ganglien
|
Langsame Depolarisierung
ACh-Cotransmitter
|
| Substanz P |
Sympathische Ganglien
Darmnerven
|
Langsame Depolarisierung
ACh-Cotransmitter |
| CGRP |
Unmyelinisierte sensorische Neurone
|
Vasodilatation
Entzündung
|
Wozu mehrere Neurotransmitter? Zu den Vorteilen der Cotransmission
zählt man unterschiedliche Abbaucharakteristika der beteiligten
Signalstoffe (längerdauernde Effekte) und die Möglichkeit variierender
Transmitterbeteiligung (getrennte Ansteuerung der Exozytose
verschiedener Speichervesikelpopulationen bei unterschiedlichern Muster
der Nervenentladungen).

 Abbildung: Gestaffelte Kontrolle des autonomen Systems
Abbildung: Gestaffelte Kontrolle des autonomen Systems
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Der Informationsfluss erfolgt in der durch die Pfeile angegebenen Richtung.
Sensorische Afferenzen aus den Eingeweiden projizieren direkt
 auf präganglionäre Neurone
(die auf postganglionäre Neurone einwirken und unter der Kontrolle
autonomer Zentren im Hirnstamm sowie des Hypothalamus stehen),
auf präganglionäre Neurone
(die auf postganglionäre Neurone einwirken und unter der Kontrolle
autonomer Zentren im Hirnstamm sowie des Hypothalamus stehen),
 auf den nucleus tractus solitarii (der auf den nucl parabrachialis, den Hypothalamus, Zentren im Hirnstamm sowie auf präganglionäre Neurone projiziert), sowie
auf den nucleus tractus solitarii (der auf den nucl parabrachialis, den Hypothalamus, Zentren im Hirnstamm sowie auf präganglionäre Neurone projiziert), sowie
 auf parabrachiale Kerne
(diese projizieren auf Thalamus, autonomen Hirnstamm und präganglionäre
Neurone, und tauscht Information mit dem Hypothalamus aus).
auf parabrachiale Kerne
(diese projizieren auf Thalamus, autonomen Hirnstamm und präganglionäre
Neurone, und tauscht Information mit dem Hypothalamus aus).
Präfrontalhirn, Insel und Mandelkerne
kontrollieren einander in Bezug auf ihre Wirkung auf das autonome
Nervensystem wechselseitig. Der Präfrontal- und der Inselkortex bilden
zusammen das zerebrale Kontrollzentrum für das autonome Nervensystem

Viszerosensible Afferenzen
- sensorische Meldungen aus den Eingeweiden - reagieren
auf mechanische (Dehnung),
chemische (z.B. Darminhalt) sowie Schmerzreize. Ihre Fasern projizieren
auf präganglionäre Neurone, auf den nucleus tractus solitarii und
parabrachiale Kerne, und indirekt auf Hirnstamm, Thalamus, Teile des
limbischen Systems, die Insel und den präfrontalen Kortex ( Abbildung). Damit bilden sie nicht nur afferente Schenkel
vegetativ-viszeraler Reflexe, sondern führen auch zu bewussten
Empfindungen (Harn- und Stuhldrang, Übelkeit, Atemnot, Schmerz). Etwa 90% der viszeral-afferenten Fasern sind unmyelinisiert (C-Fasern).
Abbildung). Damit bilden sie nicht nur afferente Schenkel
vegetativ-viszeraler Reflexe, sondern führen auch zu bewussten
Empfindungen (Harn- und Stuhldrang, Übelkeit, Atemnot, Schmerz). Etwa 90% der viszeral-afferenten Fasern sind unmyelinisiert (C-Fasern).
Viszerosensible Afferenzen stammen von Eingeweiden, der Wand von
Hohlräumen (Peritoneum etc), Drüsen und Blutgefäßen. Sie sind meist zu
sympathischen oder
parasympathischen Fasern kolokalisiert und werden daher oft als
"vegetativ" eingestuft ("autonome sensible Nerven"); die Bezeichnung
"autonom" ist aber in Hinblick auf die efferente Innervation geprägt worden. Besser ist die Bezeichnung spinal-viszerale (Äste der Splanchnicusnerven) und vagal-afferente
(auch einige glossopharyngeale) Nerven (also Hirnnerven). Letztere
innervieren praktisch alle Eingeweide, etwa 20% von ihnen das
Respirationssystem.
Viszerale Sensibilität wird über Hirnnerven (VII - facialis, IX -
glossopharyngeus, X - vagus) und über Beckennerven
geleitet. Afferenzen
aus Gebieten über der Thorax- und unter der Becken-Schmerzlinie folgen
parasympathischen, solche von Gebieten dazwischen sympathischen Bahnen.
 Die größte Zahl viszeraler Afferenzen finden sich im
Vagusnerven, der zu 80%
afferente (sensorische) Fasern enthält (Dehnungszustand von
Blutgefäßen, Herzräumen, Bronchien; Chemorezeption: Blutgase,
Glucosespiegel etc; Zustand und Inhalt des Gastrointestinalsystems;
viszeraler
Schmerz).
Die größte Zahl viszeraler Afferenzen finden sich im
Vagusnerven, der zu 80%
afferente (sensorische) Fasern enthält (Dehnungszustand von
Blutgefäßen, Herzräumen, Bronchien; Chemorezeption: Blutgase,
Glucosespiegel etc; Zustand und Inhalt des Gastrointestinalsystems;
viszeraler
Schmerz).
Präganglionäre  Fasern ziehen aus dem ZNS zu autonomen Ganglien außerhalb des ZNS und projizieren hier cholinerg auf postganglionäre Nervenzellen.
Fasern ziehen aus dem ZNS zu autonomen Ganglien außerhalb des ZNS und projizieren hier cholinerg auf postganglionäre Nervenzellen.

 Abbildung: Autonom-nervöse Efferenzen
Nach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal Physiology - An Environmental Perspective, Oxford University Press 2021
Abbildung: Autonom-nervöse Efferenzen
Nach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal Physiology - An Environmental Perspective, Oxford University Press 2021
Links:
Der Zellkörper (soma) sympathisch-präganglionärer Neurone liegt im
Vorderhorn des Thorakal- und Lumbalmarks. Ihre Axone schalten
synaptisch auf postganglionäre Neurone - einige im Grenzstrang, einige in kollateralen Ganglien.
Rechts: Das parasympathische
System mit seinem kranialen (Hirnnerven) und sakralen Teil. Die
synaptische Projektion auf postganglionäre Neurone erfolgt organnahe
(peripher)

 Sympathische Efferenzen aus dem anterolateralen Bereich der Rückenmarksegmente Th1 bis
L3 gelangen zum Großteil über Blutgefäße an ihr Ziel - paravertebrale,
prävertebrale und terminale Ganglien.
Sympathische Efferenzen aus dem anterolateralen Bereich der Rückenmarksegmente Th1 bis
L3 gelangen zum Großteil über Blutgefäße an ihr Ziel - paravertebrale,
prävertebrale und terminale Ganglien.
 Rami communicantes verbinden die paravertebralen Ganglien (22 Paare, links und rechts vor der Wirbelsäule gelegen) mit den Segmentnerven; rami communicantes albi ("weiß", markhaltig) enthalten prävertebrale, rami communicantes grisei
("grau", marklos) postganglionäre Nervenfasern. Letztere ziehen zu
Schweißdrüsen und Piloerektoren in der Haut sowie zu Blutgefäßen in
Haut und Skelettmuskulatur. Die Kette des sympathischen Grenzstrangs beginnt mit den Zervikalnanglien (ggl cervicale superius,
Rami communicantes verbinden die paravertebralen Ganglien (22 Paare, links und rechts vor der Wirbelsäule gelegen) mit den Segmentnerven; rami communicantes albi ("weiß", markhaltig) enthalten prävertebrale, rami communicantes grisei
("grau", marklos) postganglionäre Nervenfasern. Letztere ziehen zu
Schweißdrüsen und Piloerektoren in der Haut sowie zu Blutgefäßen in
Haut und Skelettmuskulatur. Die Kette des sympathischen Grenzstrangs beginnt mit den Zervikalnanglien (ggl cervicale superius,
 Prävertebrale Ganglien liegen vor
der Wirbelsäule im Bauch- und Beckenbereich. Sie sind entlang der Aorta
angeordnet und durch zahlreiche neuronale Verbindungsstränge
miteinander verbunden. Diese bilden Geflechte aus (plexus aorticus mit plexus coeliacus, mesentericus superior, renalis, uretericus, testicularis / ovaricus, mesentericus inferior, hypogastricus superior und inferior), in denen die Ganglien "eingesponnen" sind.
Prävertebrale Ganglien liegen vor
der Wirbelsäule im Bauch- und Beckenbereich. Sie sind entlang der Aorta
angeordnet und durch zahlreiche neuronale Verbindungsstränge
miteinander verbunden. Diese bilden Geflechte aus (plexus aorticus mit plexus coeliacus, mesentericus superior, renalis, uretericus, testicularis / ovaricus, mesentericus inferior, hypogastricus superior und inferior), in denen die Ganglien "eingesponnen" sind.
Man unterscheidet zahlreiche, nach Lage und Versorgungsorganen bezeichnete Ganglien:
 Eingelagert in den sympathischen Grenzstrang finden sich folgende Paravertebralganglien:
Eingelagert in den sympathischen Grenzstrang finden sich folgende Paravertebralganglien:
 cervicale superius (das größte sympathische Ganglion, es enthält etwa eine Million Neurone; versorgt Auge und Speicheldrüsen),
cervicale superius (das größte sympathische Ganglion, es enthält etwa eine Million Neurone; versorgt Auge und Speicheldrüsen),
 cervicale medius / inferior (versorgen zusammen mit den oberen ggl. thoracica - T1 bis T5 - Thoraxorgane (Herz, Lunge) sowie Schweißdrüsen und Piloerektoren in der Haut),
cervicale medius / inferior (versorgen zusammen mit den oberen ggl. thoracica - T1 bis T5 - Thoraxorgane (Herz, Lunge) sowie Schweißdrüsen und Piloerektoren in der Haut),
 thoracica (T6 bis T12 zu ggl. coeliacum, aorticorenale, mesentericum superius, sowie zum Nebennierenmark),
thoracica (T6 bis T12 zu ggl. coeliacum, aorticorenale, mesentericum superius, sowie zum Nebennierenmark),
 lumbalia (L1 bis L3 zum ggl. mesentericum inferius).
lumbalia (L1 bis L3 zum ggl. mesentericum inferius).
 Vorgelagert - prävertebral - finden sich im Bauchraum folgende Ganglien, die miteinander über ein Geflecht von Nervenfaserbündeln (plexus coeliacus und hypogastricus) verflochten sind: Ganglion
Vorgelagert - prävertebral - finden sich im Bauchraum folgende Ganglien, die miteinander über ein Geflecht von Nervenfaserbündeln (plexus coeliacus und hypogastricus) verflochten sind: Ganglion
 coeliacum
(die zwei ggll. coeliaca sind die größten des autonomen Nervensystems,
sie versorgen den Großteil des Verdauungstrakts - Magen, Pankreas,
Leber),
coeliacum
(die zwei ggll. coeliaca sind die größten des autonomen Nervensystems,
sie versorgen den Großteil des Verdauungstrakts - Magen, Pankreas,
Leber),
 mesentericum superius auf der Höhe der a. mesenterica sup. (versorgt den Dickdarm),
mesentericum superius auf der Höhe der a. mesenterica sup. (versorgt den Dickdarm),
 aorticorenale dexter und sinister (Nieren),
aorticorenale dexter und sinister (Nieren),
 spermaticum / ovaricum (Geschlechtsorgane),
spermaticum / ovaricum (Geschlechtsorgane),
 mesentericum inferius (unterer Dickdarm, Geschlechtsorgane)
mesentericum inferius (unterer Dickdarm, Geschlechtsorgane)
 sowie weitere in den plexus hypogastricus (pelvicus) eingelagerte kleinere Ganglien (Harnblase, Urethra).
sowie weitere in den plexus hypogastricus (pelvicus) eingelagerte kleinere Ganglien (Harnblase, Urethra).

 Abbildung: Verschaltung im autonom-nervösen System (schematisch)
Abbildung: Verschaltung im autonom-nervösen System (schematisch)
Nach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal Physiology - An Environmental Perspective, Oxford University Press 2021
Synaptische
"Umschaltungen" von prä- auf postganglionäre Neurone (in einem
vegetativen Ganglion) erfolgen grundsätzlich cholinerg-nikotinisch (N-Rezeptoren, nAChRs).
Im parasympathischen System funktionieren auch die postganglionären
Neurone (also der Effekt am Zielorgan) cholinerg, aber muskarinisch (M-Rezeptoren, mAChRs) - wie auch einige postganglionär-sympathische Fasern. Die meisten postganglionär-sympathischen Neurone arbeiten adrenerg, involvierte Rezeptoren sind vom Typ α / β
 Als Splanchnicussystem (gr. splagchna = Eingeweide) wird das von vegetativen Splanchnicusfasern versorgte Gebiet bezeichnet. Es steuert die Funktion (Durchblutung,
Motorik, Sekretion) von Bauch- und Beckeneingeweiden. Der Nervus splanchnicus maior (Segmente Th5 - Th9) und minor (Th9 - Th11) sowie lumbale und sakrale Äste führen sympathische, solche zu Beckeneingeweiden parasympathische Fasern.
Als Splanchnicussystem (gr. splagchna = Eingeweide) wird das von vegetativen Splanchnicusfasern versorgte Gebiet bezeichnet. Es steuert die Funktion (Durchblutung,
Motorik, Sekretion) von Bauch- und Beckeneingeweiden. Der Nervus splanchnicus maior (Segmente Th5 - Th9) und minor (Th9 - Th11) sowie lumbale und sakrale Äste führen sympathische, solche zu Beckeneingeweiden parasympathische Fasern.
 Vereinzelt gibt es terminale sympathische Ganglien nahe dem Erfolgsorgan, wie Zervikalganglien im Halsbereich sowie Ganglien bei der Blase und dem Rectum.
Vereinzelt gibt es terminale sympathische Ganglien nahe dem Erfolgsorgan, wie Zervikalganglien im Halsbereich sowie Ganglien bei der Blase und dem Rectum.
Datüber hinaus gibt es auch einige kleine intermediäre Ganglien, vor allem in der thorakolumbalen Region, meist in der Nähe der rami communicantes.
Die wichtigsten Effekte sympathischer Aktivität beziehen sich auf den Kreislauf (Tachykardie, Durchblutungssteigerung in Herz- und aktivem Skelettmuskel durch Gefäßerweiterung),
die Atmung (Erleichterung der Luftströmung durch die Bronchien),
hormonelle Umstellung (Stimulierung der Nebennieren,
Blutzuckermobilisierung), Erweiterung der Pupillen.
 Parasympathische Efferenzen
- präganglionäre Fasern ziehen bis in die Nähe des Erfolgsorgans,
postganglionäre sind dementsprechend kurz - ziehen über
Parasympathische Efferenzen
- präganglionäre Fasern ziehen bis in die Nähe des Erfolgsorgans,
postganglionäre sind dementsprechend kurz - ziehen über
 Hirnnerven
Hirnnerven (III, VII, IX, X; 3/4 aller parasympathischen Fasern laufen über den N. vagus) oder den
 Pelvikusnerv
Pelvikusnerv (Nn. splanchnici pelvini - versorgen die Beckeneingeweide) an ihre Zielgewebe.
Die Transmitter werden in Blutgefäßen, Herz, Lunge,
Verdauungssystem, Hormondrüsen, Urogenitaltrakt, Haut, Sinnesorganen
und Nervensystem
freigesetzt und üben dort ihre spezifischen Wirkungen aus. Im Gegensatz
zu den eher globalen sympathischen Effekten sind die Auswirkungen
parasympathischer Aktivität enger gefasst und gezielter.
Beispiel: Steuerung der Harnblase
Das autonome Nervensystem steuert die Blasenmotorik ( Abbildung) in einer Weise, die beide Schenkel des autonomen Systems koordiniert nützt.
Abbildung) in einer Weise, die beide Schenkel des autonomen Systems koordiniert nützt.
Dichtigkeit:
Aktivität sympathischer
Fasern aus dem Lumbalmark fördert den Tonus des inneren Schließmuskels
und entspannt die Blasenwand (den Detrusormuskel). Das
"Kontinenzzentrum" in der Brücke (pontines Blasenzentrum) aktiviert
weiters somatomotorische Fasern im N. pudendus - diese entspringen im Onuf'schen Kern ( Abbildung) des Rückenmarks - und dadurch den äußeren Schließmuskel.
Abbildung) des Rückenmarks - und dadurch den äußeren Schließmuskel.
Ergebnis ist geringer Füllungsdruck und hoher Ausstromwiderstand, und dadurch Kontinenz (Blasendichtigkeit).
Blasenentleerung:
Mit steigender Blasenfüllung nimmt der Innendruck zu,
Dehnungsrezeptoren in der Wand der Harnblase werden gereízt, und
afferente Impulse aktivieren das pontine "Miktionszentrum" (soferne
dies von übergeordneten Zentren "freigegeben" wird).
Sympathische Neurone werden inhibiert (Hemmung des inneren Schließmuskels, Disinhibition des Detrusors), parasympathische Efferenzen aus dem Sakralmark regen den Detrusor (die Blasenwand) direkt an. Ergebnis ist die Blasenentleerung (Miktion).
Was ist der Sympathikustonus?
Der
Sympathikus sendet ständig Impulse aus, allerdings sind die Efferenzen
zu den verschiedenen Organen (z.B. Muskeln, Nieren, Haut) unterschiedlich aktiv: Die Neuronengruppen im ventrolateralen Rückenmark sind organotop organisiert, ihr Erregungsgrad und Versorgungsgebiet sind jeweils situations- und organspezifisch. So kann Stresseinfluss die Hautdurchblutung drosseln (Erblassen durch Vasokonstriktion) und gleichzeitig die Muskeldurchblutung erhöhen (Vasodilatation).
Vasokonstriktorisch
wirksame Fasern haben eine Grundaktivität von 0,5-1 Impulsen pro
Sekunde und erreichen eine maximale Entladungsfrequenz von etwa 10/s.
Die Aktivität oszilliert, die Aktionspotentiale kommen salvenartig
(Skelettmuskeln) oder irregulär daher (Haut). Steigt die sympathische
Aktivität zu einem Organ, dann sinkt üblicherweise dessen Durchblutung
(Vasokonstriktion), der Blutinhalt des Organs nimmt ab (Verlagerung
nach zentral), der periphere Widerstand nimmt zu (arterioläre
Konstriktion),der Kapillardruck sinkt (präkapilläre Konstriktion,
sinkende Filtration). Dieses Reflexmuster kann das Blutangebot an das
Herz steigern, den arteriellen Druck erhöhen und den Kreislauf
stabilisieren.
Je nach dem Einflussbereich auf die Aktivität der Neuronengruppen unterscheidet man hauptsächlich barosensitive Reflexbahnen (Ursprung Barorezeptoren, Einfluss auf Muskeln, Nieren, Baucheingeweide), thermosensitive (hypothalamische und emotionale Einflüsse auf die Durchblutung der Haut) und glukosensitive Reflexbahnen (aktiviert durch Blutzuckerabfall und körperlliche Belastung, Adrenalinfreisetzung aus dem Nebennierenmark).
Als Symparthikustonus bezeichnet man die Frequenz der Aktionspotentiale, die über efferente sympathische Fasern laufen. Wie lässt sich diese Aktivität bestimmen? Diese Frage ist nicht trivial,
denn der Sympathikus besteht aus mehreren Komponenten, die
unterschiedlich
aktiv sein können und deren spezifische Aktivität nur invasiv (oder gar nicht) messbar ist.
 Ableitungen von sympathischen
Nervenfasern zu Muskeln (Muscle sympathetic nerve activity, MSNA) spiegeln den Zustand des
Sympathikus
zwar wider, die registrierte Aktivität ist aber insbesondere mit dem
Baroreflex verknüpft (sie zeigt blutdruck- und atmungssynchrone
Frequenzoszillationen).
Ableitungen von sympathischen
Nervenfasern zu Muskeln (Muscle sympathetic nerve activity, MSNA) spiegeln den Zustand des
Sympathikus
zwar wider, die registrierte Aktivität ist aber insbesondere mit dem
Baroreflex verknüpft (sie zeigt blutdruck- und atmungssynchrone
Frequenzoszillationen).
 Sympathische Nervenfasern zur Haut (Skin sympathetic nerve activity, SSNA)
sind hingegen durch Temperaturwechsel, Emotionen und
Aufmerksamkeitswechsel beeinflusst, was wiederum MSNA-Signale nicht
tangiert.
Sympathische Nervenfasern zur Haut (Skin sympathetic nerve activity, SSNA)
sind hingegen durch Temperaturwechsel, Emotionen und
Aufmerksamkeitswechsel beeinflusst, was wiederum MSNA-Signale nicht
tangiert.
Die Aktivität der zuständigen Zentren und Fasern
gleichzeitig und getrennt zu registrieren ist schwierig bis unmöglich.
Die Aktivität des Sympathikus kann jedoch in bestimmten Situationen, insbesondere bei genereller Herausforderung ("ergotrope" Reaktionslage, insbesondere bei physischer oder auch orthostatischer Belastung) insgesamt gut abgeschätzt werden:


Abbildung: Registrierung der Sympathikusaktivität (MSNA, rosa Feld)
Nach
Diedrich A, Crossman AA, Beightol LA, Tahvanainen KUO, Kuusela TA, Ertl
AC, Eckberg EL, Baroreflex physiology studied in healthy subjects
with very infrequent muscle sympathetic bursts. J Appl Physiol
2013; 114: 203-10
Sinkender Blutdruck (blaue Linie) löst über der Barorezeptorreflex
einen "Burst" sympathischer Entladungen aus (roter Pfeil, synchron sinkende Dauer der RR-Intervalle).
Dies hebt
den Blutdruck, was wiederum die Herzfrequenz verlangsamt (Dauer der RR-Intervalle nimmt zu, grüne Linie)

 In Situationen genereller Herausforderung (Muskelarbeit, fight or flight
o.ä.) kommt es über die breite Aktivierung sympathischer Zentren
zu hoher Aktivität sympathischer Nervenfasern.
Dies kann z.B. im Bereich des Wadenbeinkopfs mit feinen, an den Fibularisnerv gebrachten Elektroden (die durch die Haut geführt werden) registriert werden (muskulär-sympathische Nervenaktivität,
MSNA -
In Situationen genereller Herausforderung (Muskelarbeit, fight or flight
o.ä.) kommt es über die breite Aktivierung sympathischer Zentren
zu hoher Aktivität sympathischer Nervenfasern.
Dies kann z.B. im Bereich des Wadenbeinkopfs mit feinen, an den Fibularisnerv gebrachten Elektroden (die durch die Haut geführt werden) registriert werden (muskulär-sympathische Nervenaktivität,
MSNA -  Abbildung).
Abbildung).
Dies ist eine (wenn auch invasive) Standardmethode zur Quantifizierung des
"Sympathikustonus" - zwischen MSNA und
Noradrenalinspiegel im Blut besteht eine enge Korrelation, beide sind
gute Indikatoren der aktuellen mittleren Sympathikusaktivität.
 Eine
andere (ebenfalls invasive) Vorgangsweise ist die - eventuell mehrfache
- Bestimmung der Noradrenalinkonzentration im Blut.
Eine
andere (ebenfalls invasive) Vorgangsweise ist die - eventuell mehrfache
- Bestimmung der Noradrenalinkonzentration im Blut.
 Noradrenalin (Plasma)
0,4-2 nM/l (80-520 ng/l)
Noradrenalin (Plasma)
0,4-2 nM/l (80-520 ng/l)
höhere Werte bei Muskelbelastung und Orthostase
(innerhalb weniger Minuten auf ein Mehrfaches der Liegewerte)
~90% des im
Blut befindlichen Noradrenalins stammt aus sympathischen Nervenfasern;
der Noradrenalinspiegel im Blut ist daher ein guter
Indikator der aktuellen Sympathikusaktivität. Noradrenalin ist kurzlebig
(biologische Halbwertszeit ~1 min) und der Blutspiegel ändert sich mit
der sympathischen Aktivität entsprechend rasch.
Die Konzentration im
Blut ist für Noradrenalin typischerweise 4-5mal höher als für
Adrenalin, die Harnausscheidungswerte verhalten sich etwa wie 10:1.
 Will
man sich auf nichtinvasive Abschätzungen beschränken, besteht die
Möglichkeit der Analyse autonom-nervöser Wirkungen an peripheren
Organen. So gibt eine Analyse von Frequenzanteilen der Herzrhythmik
(Puls-, Blutdruck- oder EKG-Registrierung) Hinweise über das
autonom-nervöse Gleichgewicht: Plötzliche Wechsel der Herzfrequenz deuten
auf überwiegenden Einfluss des Vagus (Acetylcholin: rasche Wirkung, s. oben), langsamere auf einen eher höheren
Sympathikuseinfluss hin. Das ist zwar nicht sehr spezifisch, doch kann diese Herzfrequenzvariabilität diagnostisch genützt werden.
Will
man sich auf nichtinvasive Abschätzungen beschränken, besteht die
Möglichkeit der Analyse autonom-nervöser Wirkungen an peripheren
Organen. So gibt eine Analyse von Frequenzanteilen der Herzrhythmik
(Puls-, Blutdruck- oder EKG-Registrierung) Hinweise über das
autonom-nervöse Gleichgewicht: Plötzliche Wechsel der Herzfrequenz deuten
auf überwiegenden Einfluss des Vagus (Acetylcholin: rasche Wirkung, s. oben), langsamere auf einen eher höheren
Sympathikuseinfluss hin. Das ist zwar nicht sehr spezifisch, doch kann diese Herzfrequenzvariabilität diagnostisch genützt werden.

Unter
Herzfrequenzvariabilität (HRV:
heart rate variability)
versteht man die physiologische Unregelmäßigkeit der Pulsrate, was mit
der Verknüpfung von Atmungs- und anderen Regulationsmechanismen im
Hirnstamm zusammenhängt. Gut
trainierte Menschen zeigen ausgeprägte HRV, umgekehrt kann die HRV bei
bestimmten Krankheitsbildern eingeschränkt sein. Unter
respiratorischer (Sinus-) Arrhythmie (respiratory sinus arrhythmia) versteht man atemsynchrone Herzfrequenzschwankungen (Frequenzsteigerung bei Einatmung, Absinken bei Ausatmung).
 Ansonsten geben die Auswirkungen auf verschiedene gut messbare physiologische Zustandsvariable, wie Herzfrequenz oder Blutdruck,
Hinweise auf den bestehenden "vegetativen Tonus".
Ansonsten geben die Auswirkungen auf verschiedene gut messbare physiologische Zustandsvariable, wie Herzfrequenz oder Blutdruck,
Hinweise auf den bestehenden "vegetativen Tonus".
 Der vegetative Tonus steht unter dem Einfluss mehrerer Regionen im Gehirn, insbesondere des
limbischen Systems (zentrale Mandelkerne).
Der vegetative Tonus steht unter dem Einfluss mehrerer Regionen im Gehirn, insbesondere des
limbischen Systems (zentrale Mandelkerne).
Die Rolle des sympathischen Nervensystems
 Über adrenerge Transmission s. dort
Über adrenerge Transmission s. dort
Die Funktionen
des - im Rückenmark (präganglionär) thorakolumbal angesiedelten - Sympathikus
können rasch aktiviert werden und stehen insgesamt im Zeichen komplexer Reaktionen auf
Situationen, in denen intensiv umweltbezogene Aktivitäten gefordert
sind:
 Leistungsanpassung (ergotrope
Leistungsanpassung (ergotrope  Reaktion). Der Sympathikus stellt Kreislauf, Atmung, Nervensystem und
Stoffwechsel (Hormone) auf die Akutbedürfnisse ein, die sich
durch intensive Strapazierung des Bewegungssystems ergeben
Reaktion). Der Sympathikus stellt Kreislauf, Atmung, Nervensystem und
Stoffwechsel (Hormone) auf die Akutbedürfnisse ein, die sich
durch intensive Strapazierung des Bewegungssystems ergeben
 Autonom-nervös
gesteuerte Reflexe, wie solche zur Blutdruckstabilisierung oder der
Kohabitation, haben sympathische Anteile. Sympathisch koordiniert ist auch die Kontinenz (Harnblase, Enddarm)
- diese Funktion steht im Dienste einer situationslogischen Abdichtung
in Situationen, wo Entleerung weder möglich noch
erwünscht wäre
Autonom-nervös
gesteuerte Reflexe, wie solche zur Blutdruckstabilisierung oder der
Kohabitation, haben sympathische Anteile. Sympathisch koordiniert ist auch die Kontinenz (Harnblase, Enddarm)
- diese Funktion steht im Dienste einer situationslogischen Abdichtung
in Situationen, wo Entleerung weder möglich noch
erwünscht wäre
 Spezielle Funktionen betreffen soziale Signale, zu denen
auch die Erweiterung der Pupille gehören kann (Mydriasis), die vom Gegenüber als Interesse oder auch Kampfbereitschaft gewertet wird.
Spezielle Funktionen betreffen soziale Signale, zu denen
auch die Erweiterung der Pupille gehören kann (Mydriasis), die vom Gegenüber als Interesse oder auch Kampfbereitschaft gewertet wird.
Selektivität: Der Sympathikus
kann im Normalzustand (ungestresst) gezielte organspezifische Wirkungen
ausüben, bei - insbesondere lebensbedrohlichen - Bedrohungssituationen
erfolgt eine generalísierte Fight-or-Flight-Reaktion.
 Über adrenerge Rezeptoren s. dort.
Über adrenerge Rezeptoren s. dort.


Abbildung: Innervation des sympathischen Systems
Nach einer Vorlage bei L.S. Constanzo, Physiology, 7th ed. 2022 (Elsevier)
Präganglionäre
Neurone entspringen in den Rückenmarksegmenten Th1 bis L3.
Postganglionäre Neurone entspringen teils im sympathischen Grenzstrang,
teils in den Ganglien des Sonnengeflechts (plexus coeliacus) und der
Mesenterialgeflechte und versorgen adrenerg Zielgewebe in Kopf, Thorax, Abdomen und Beckenbereich (rechts).
Links: Postganglionäre Neuronen
aus dem Grenzstrang versorgen Blutgefäße (Vasokonstriktion),
Schweißdrüsen (Sudomotorik - ausnahmsweise mit cholinergen, nicht
adrenergen Fasern) und Piloerektoren (Gänsehaut)

 Wirkungen auf glatte Muskulatur: In der Darmwend wirken sowohl α1- als auch ß-Rezeptoren relaxierend (außer in Sphinkteren, die α1-adrenerg kontrahieren), Bronchien und Myometrium relaxieren bei Reizung von ß2-Rezeptoren, der Blasenmuskel (Detrusor) bei Reizung seiner ß3-Rezeptoren. Ansonsten reagiert glatte Muskulatur auf Reizung von α1-Rezeptoren generell
mit Kontraktion - vor allem in kleinen Arterien und Arteriolen der Haut
und im Splanchnicusgebiet (Erhöhung des Strömungswiderstandes). Auch
viele größere Gefäße kontrahieren (Reduktion der Compliance). Gefäße in
Gehirn, Herzmuskel und Lunge reagieren kaum auf sympathische Impulse. ß2-Rezeptoren in Gefäßwänden wirken über NO vasodilatierend, vor allem in der Skelettmuskulatur.
Wirkungen auf glatte Muskulatur: In der Darmwend wirken sowohl α1- als auch ß-Rezeptoren relaxierend (außer in Sphinkteren, die α1-adrenerg kontrahieren), Bronchien und Myometrium relaxieren bei Reizung von ß2-Rezeptoren, der Blasenmuskel (Detrusor) bei Reizung seiner ß3-Rezeptoren. Ansonsten reagiert glatte Muskulatur auf Reizung von α1-Rezeptoren generell
mit Kontraktion - vor allem in kleinen Arterien und Arteriolen der Haut
und im Splanchnicusgebiet (Erhöhung des Strömungswiderstandes). Auch
viele größere Gefäße kontrahieren (Reduktion der Compliance). Gefäße in
Gehirn, Herzmuskel und Lunge reagieren kaum auf sympathische Impulse. ß2-Rezeptoren in Gefäßwänden wirken über NO vasodilatierend, vor allem in der Skelettmuskulatur.
 Wirkungen auf den Herzmuskel: Stimulation von ß1-Rezeptoren
wirkt positiv auf alle Herzqualitäten (Schlagkraft, Frequenz, Leitung
etc) und erhöht den Sauerstoffverbrauch des Myokards.
Wirkungen auf den Herzmuskel: Stimulation von ß1-Rezeptoren
wirkt positiv auf alle Herzqualitäten (Schlagkraft, Frequenz, Leitung
etc) und erhöht den Sauerstoffverbrauch des Myokards.
 Näheres s. dort
Näheres s. dort
 Wirkungen auf den Stoffwechsel:
Sympathische Stimulation steigert die Nutzung von Energiespeichern
(kurzzeitig Glykogen, über längere Dauer Fett) für den Verbrauch von
Glucose und Fettsäuren, deren Blutspiegel ansteigen.
Wirkungen auf den Stoffwechsel:
Sympathische Stimulation steigert die Nutzung von Energiespeichern
(kurzzeitig Glykogen, über längere Dauer Fett) für den Verbrauch von
Glucose und Fettsäuren, deren Blutspiegel ansteigen.
Die Insulinsekretion der pankreatischen Betazellen wird via α2-Adrenozeptoren
gehemmt (Senkung des [cAMP], Öffnung von Kaliumkanälen, Hemmung des
Calciumeinstroms, reduzierte Erregbarkeit der ß-Zelle, geringere
Exozytose von Insulingranula).
 Katecholaminspiegel im Blut: Im Vergleich zum Kontrollzustand (Ruhe, liegende Position) erhöht sich der Noradrenalinspiegel
Katecholaminspiegel im Blut: Im Vergleich zum Kontrollzustand (Ruhe, liegende Position) erhöht sich der Noradrenalinspiegel
 bei psychischer Belastung wie einem öffentlichen Vortrag um rund 50%
- der Adrenalinspiegel steigt stärker, auf mehr als das Doppelte (bei
der vortragenden Person, nicht unbedingt bei den Zuhörern
bei psychischer Belastung wie einem öffentlichen Vortrag um rund 50%
- der Adrenalinspiegel steigt stärker, auf mehr als das Doppelte (bei
der vortragenden Person, nicht unbedingt bei den Zuhörern  ),
),
 bei Wechsel zu stehender Position auf etwa das Doppelte (der Adrenalinspiegel um weniger als 50%),
bei Wechsel zu stehender Position auf etwa das Doppelte (der Adrenalinspiegel um weniger als 50%),
 bei starker Hypoglykämie (Glucose <30 mg/dl) auf knapp das Dreifache (der Adrenalinspiegel bis mehr als 20-fach),
bei starker Hypoglykämie (Glucose <30 mg/dl) auf knapp das Dreifache (der Adrenalinspiegel bis mehr als 20-fach),
 bei mittelschwerer körperlicher Belastung auf das Vierfache (der Adrenalinspiegel auf knapp das Doppelte).
bei mittelschwerer körperlicher Belastung auf das Vierfache (der Adrenalinspiegel auf knapp das Doppelte).
 Daraus ist zu erkennen, dass physische
Belastung (Lagewechsel, Muskelarbeit), die vor allem eine
Leistungssteigerung im kardiovaskulären System erfordert, eher die
noradrenerge Achse des Sympathikus anregt, psychische und metabolische (und pharmakologische, z.B. durch Nikotin oder Coffein) eher die adrenerge (Nebennierenmark).
Daraus ist zu erkennen, dass physische
Belastung (Lagewechsel, Muskelarbeit), die vor allem eine
Leistungssteigerung im kardiovaskulären System erfordert, eher die
noradrenerge Achse des Sympathikus anregt, psychische und metabolische (und pharmakologische, z.B. durch Nikotin oder Coffein) eher die adrenerge (Nebennierenmark).
Spitzenreiter der Anregung stellt der Zustand des hämorrhagischen Schocks
dar: In dieser Situation kann der Noradrenalinspiegel mehr als 8-fach,
der Adrenalinspiegel sogar 25-fach ansteigen (verglichen mit
Ruhe-Kontrollwerten).
Generell regen unterschiedliche Reizprofile unterschiedliche
Wirkungsprofile im Vegetativum an, d.h. "der Sympathikus" reagiert
situationsspezifisch und differenziert, nicht immer in gleicher Weise.

 Tabelle: Auswirkung der
Reizung von Rezeptoren im adrenergen System an verschiedenen Organen
und Geweben
Tabelle: Auswirkung der
Reizung von Rezeptoren im adrenergen System an verschiedenen Organen
und Geweben
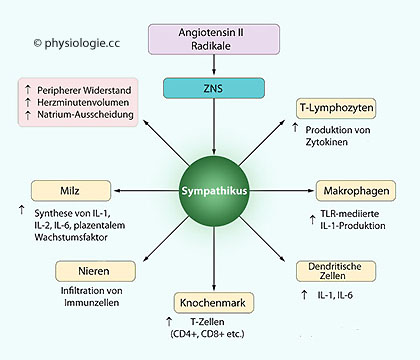

Abbildung: Beteiligung des Sympathikus an Immunantworten
Nach Rodriguez-Iturbe B, Pons H, Johnson RJ. Role of the Immune System in Hypertension. Physiol Rev 2017; 97: 1127-64
Das
sympathische Nervensystem ist die Hauptverbindung von ZNS und
Immunsystem. Seine Reizung erhöht Blutdruck und peripheren
(systemischen) Gefäßwiderstand, das
Herzminutenvolumen und die renale Wiederaufnahme von Natrium.
Immunzellen exprimieren Adrenozeptoren und setzen vielleicht auch
Noradrenalin frei, das die Mobilität von Lymphozyten sowie die
Sekretion von Zytokinen beeinflussen kann.
Die Mehrzahl der immunologisch relevanten sympathischen Effekte wurde experimentell durch Infusion von Angiotensin ermittelt.
CD = Cluster of differentiation, IL = Interleukin, TLR = Toll-like Rezeptor

Das sympathische System hat darüber hinaus vielfache Wirkung auf das
Immunsystem - dabei gibt es auch Zusammenhänge mit der Regulation der
Kreislauffunktion ( Abbildung):
Abbildung):
 Anregung
des Sympathikus steigert einerseits den Blutdruck durch Erhöhung von
peripherem Fließwiderstand (Arteriolentonus), Herzzeitvolumen (positive
Inoptropie) und extrazellulärem Flüssigkeitsvolumen
(Natrium-Rückresorption in der Niere).
Anregung
des Sympathikus steigert einerseits den Blutdruck durch Erhöhung von
peripherem Fließwiderstand (Arteriolentonus), Herzzeitvolumen (positive
Inoptropie) und extrazellulärem Flüssigkeitsvolumen
(Natrium-Rückresorption in der Niere).
 Immunzellen
exprimieren andererseits Adrenozeptoren, deren Aktivierung sich u.a.
auf die Bildung von Zytokinen auswirkt. Dabei können sowohl
entzündungsfördernde (proinflammatorische) als auch entzündungshemmende
(antiinflammatorische) Wirkungen auftreten, je nach auslösendem Reiz
und Wirkungsmuster.
Immunzellen
exprimieren andererseits Adrenozeptoren, deren Aktivierung sich u.a.
auf die Bildung von Zytokinen auswirkt. Dabei können sowohl
entzündungsfördernde (proinflammatorische) als auch entzündungshemmende
(antiinflammatorische) Wirkungen auftreten, je nach auslösendem Reiz
und Wirkungsmuster.
Der von der Milz produzierte plazentare Wachstumsfaktor (PlGF) kann
sich an Blutdrucksteigerung und Immunzellen-Invasion des Nierengewebes
beteiligen. Auf diesem Wege kann der Sympathikus in das Abwehrgeschehen
eingreifen, u.U. in schädlicher Weise (Bluthochdruck, Entzündung).
Der Parasympathikus beteiligt sich hingegen an anti-inflammatorischen Mechanismen - Immunzellen exprimieren u.a. cholinerge Rezeptoren.
Die Rolle des parasympathischen Nervensystems
 Über cholinerge Transmission s. dort
Über cholinerge Transmission s. dort
Der Parasympathikus (kranio-sakrales System, ursprünglich als "Nebensystem" zum Sympathikus aufgefasst, daher die Bezeichnung) dient der
Regeneration
(rest and digest - trophotrope  Reaktion). Die Steuerung des Darmnervensystems erfolgt vorwiegend über parasympathische Anteile.
Reaktion). Die Steuerung des Darmnervensystems erfolgt vorwiegend über parasympathische Anteile.
Die prä- zu postganglionäre Umschaltung erfolgt organnahe, d.h. vom Rückenmark entfernt (ggl. ciliare zum Auge, ggl. pterygopalatinum zur Tränendrüse, ggl. submandibulare und ggl. oticum zu Speicheldrüsen), oder direkt im Erfolgsorgan (Herz, Lunge, Leber, Darm, Urogenitalsystem).

Abbildung: Innervation des parasympathischen Systems
Nach einer Vorlage bei L.S. Constanzo, Physiology, 7th ed. 2022 (Elsevier)
Präganglionäre
Neurone entspringen in Kernen des Hirnstamms sowie in den
Sakralsegmenten 2 bis 4 des Rückenmarks, postganglionäre in Ganglien
des Kopfbereichs (ciliare, pterygopalatinum, submandibulare, parotis)
oder organnahe in der Peripherie (thorakal, abdominal, pelvikal).
CN = cervical nerve (Hirnnerv)


Parasympathische Anteile findet man in mehreren vegetativen Reflexen
(
Kohabitation,
Miktion,
Defäkation)

Dazu kommen spezielle Aufgaben, z.B. Kontraktion des Ziliarmuskels (
Akkommodation) und der Iris (
Miosis)

Der Parasympathikus verfügt über ein System von Nervenfasern, die
gefäßerweiternd (
vasodilatierend)
wirken. Über Hirnnerven werden so arterielle Gefäße in Gehirn,
Herzmuskel, Speicheldrüsen, Pankreas (exokrin) und gastrointestinale
Mukosa parasympathisch beeinflusst; und aus dem Sakralmark Genitalien,
Blase und Colon. Die aus der peripheren ganglionären Umschaltung
entspringenden, kurzen postganglionären Fasern haben (so wie
sympathische)
Varikositäten, aus denen die Transmitter freigesetzt werden.
Freigesetzt werden Acetylcholin (Wirkung auf muskarinische M
3- Rezeptoren),
VIP,
Substanz P und/oder
NO. Die Wirkung in den Speicheldrüsen (über die
chorda tympani) erfolgt über Acetylcholin, VIP und Substanz P; diejenige in der
Bauchspeicheldrüse
hauptsächlich über VIP ("peptiderg"); diejenige in der Submukosa des
Darms über Acetylcholin und endothelial gebildetes NO. Die Wirkung auf
die Gefäße der
Schwellkörper ist nitriderg.

Die
(relative) Aktivität des Parasympathikus kann über die Ermittlung der
Herzfrequenzvariabilität (Zeit- oder
Frequenzdomäne) abgeschätzt werden.
 Über Parasympathikolyse (Atropineffekt) s. dort.
Über Parasympathikolyse (Atropineffekt) s. dort.
 Die Bezeichnung "Sympathikus" und "Parasympathikus" geht auf Galen zurück. Er meinte, dass Wirkungen auf einen Teil des Körpers auch andere Teile in Mitleidenschaft
ziehen ("Sympathie der Teile"), und Reflexe wurden in diesem Licht
gesehen (als "Sympathikus" wurden ursprünglich alle autonomen Reflexe
eingeordnet). Später wurde der kraniosakrale Teil des autonomen
Nervensystems als "Neben- (Para-) Sympathikus" definiert. John N. Langley führte 1898 den Begriff "autonomes Nervensystem" ein.
Die Bezeichnung "Sympathikus" und "Parasympathikus" geht auf Galen zurück. Er meinte, dass Wirkungen auf einen Teil des Körpers auch andere Teile in Mitleidenschaft
ziehen ("Sympathie der Teile"), und Reflexe wurden in diesem Licht
gesehen (als "Sympathikus" wurden ursprünglich alle autonomen Reflexe
eingeordnet). Später wurde der kraniosakrale Teil des autonomen
Nervensystems als "Neben- (Para-) Sympathikus" definiert. John N. Langley führte 1898 den Begriff "autonomes Nervensystem" ein.


 Das autonome (sympathische, parasympathische und intestinale) Nervensystem steuert innere Organe. Der Sympathikus unterstützt die Anpassung an wechselnde Anforderungen des Organismus (Sauerstoff- und Substrattransport für Kampf- oder
Fluchtreaktionen, Schärfung der Sinne). Der Parasympathikus dient der Aufrechterhaltung eines inneren Milieus und zeigt
im Gegensatz zum Sympathikus kaum Divergenz (präzise Steuerung). Eine
Blockade peripherer autonomer Nerven führt (im Gegensatz zur
Skelettmuskel) nicht zu totalem Funktionsausfall des betroffenen
Gebietes, Drüsen- und glatte Muskelzellen erhalten ihre Spontanaktivität Das autonome (sympathische, parasympathische und intestinale) Nervensystem steuert innere Organe. Der Sympathikus unterstützt die Anpassung an wechselnde Anforderungen des Organismus (Sauerstoff- und Substrattransport für Kampf- oder
Fluchtreaktionen, Schärfung der Sinne). Der Parasympathikus dient der Aufrechterhaltung eines inneren Milieus und zeigt
im Gegensatz zum Sympathikus kaum Divergenz (präzise Steuerung). Eine
Blockade peripherer autonomer Nerven führt (im Gegensatz zur
Skelettmuskel) nicht zu totalem Funktionsausfall des betroffenen
Gebietes, Drüsen- und glatte Muskelzellen erhalten ihre Spontanaktivität
 Afferenzen
aus Eingeweiden bringen sensorische Information zum ZNS und laufen über
zwei Stränge: Das kraniale System über Hirnnerven zum Hirnstamm, das
spinale System zum Rückenmark. Diese Afferenzen (Dehnung der Lunge, Blutgase, Blutvolumen und Blutdruck, Nahrung und Verdauungssystem, Füllung von Blase und Mastdarm) ermöglichen
autonome Reflexe - über das kraniale System hauptsächlich für Mechano-
und Chemosensibilität, das spinale System vorwiegend betreffend
Temperatur / Gewebeverletzung / Schmerz. Die Afferenzen beeinflussen
endogene Rhythmen, Kreislauf und Atmung, Verdauung, Blasenmotorik,
Genitalreflexe, Hautdurchblutung, Pupillenweite, Akkommodation.
Autonome Efferenzen steuern glatte Muskulatur (Iris, Ziliarmuskel, Bronchien, Darmmuskulatur, Urogenitaltrakt), Herzmuskel und Drüsen Afferenzen
aus Eingeweiden bringen sensorische Information zum ZNS und laufen über
zwei Stränge: Das kraniale System über Hirnnerven zum Hirnstamm, das
spinale System zum Rückenmark. Diese Afferenzen (Dehnung der Lunge, Blutgase, Blutvolumen und Blutdruck, Nahrung und Verdauungssystem, Füllung von Blase und Mastdarm) ermöglichen
autonome Reflexe - über das kraniale System hauptsächlich für Mechano-
und Chemosensibilität, das spinale System vorwiegend betreffend
Temperatur / Gewebeverletzung / Schmerz. Die Afferenzen beeinflussen
endogene Rhythmen, Kreislauf und Atmung, Verdauung, Blasenmotorik,
Genitalreflexe, Hautdurchblutung, Pupillenweite, Akkommodation.
Autonome Efferenzen steuern glatte Muskulatur (Iris, Ziliarmuskel, Bronchien, Darmmuskulatur, Urogenitaltrakt), Herzmuskel und Drüsen
 Limbisches
System und Hypothalamus steuern das autonome Nervensystem. Je nach
Funktionsmuster werden Teilsysteme antagonistisch oder synergistisch
aktiviert. Das Funktionsgleichgewicht
Sympathikus / Parasympathikus entspricht der Balance Ergotropie /
Trophotropie. Parasympathische Neuronengruppen liegen im Hirnstamm und im
Sakralmark (S2-4, kraniosakrales System), die prä- auf postganglionäre Umschaltung
erfolgt organnah. Sympathische Neuronengruppen liegen im Thorakal- und
Lumbalmark (T1 bis L3, thorakolumbales System), die Umschaltung erfolgt
im oder in der Nähe des Grenzstrang(s) Limbisches
System und Hypothalamus steuern das autonome Nervensystem. Je nach
Funktionsmuster werden Teilsysteme antagonistisch oder synergistisch
aktiviert. Das Funktionsgleichgewicht
Sympathikus / Parasympathikus entspricht der Balance Ergotropie /
Trophotropie. Parasympathische Neuronengruppen liegen im Hirnstamm und im
Sakralmark (S2-4, kraniosakrales System), die prä- auf postganglionäre Umschaltung
erfolgt organnah. Sympathische Neuronengruppen liegen im Thorakal- und
Lumbalmark (T1 bis L3, thorakolumbales System), die Umschaltung erfolgt
im oder in der Nähe des Grenzstrang(s)
 Präganglionärer Transmitter ist generell Acetylcholin, die Rezeptoren nennt man nikotinisch. Die Wirkungen sind lokal begrenzt und von kurzer Dauer. Die
Divergenz prä- auf postganlionär reicht von 1:4
(Ziliarganglion: hohe Präzision) bis 1: mehrere hundert (Blutgefäße, Schweißdrüsen). In
den Ganglien erfolgt die Verrechnung zahlreicher Eingänge; postganglionäre Neuronen verteilen entsprechende Impulse auf die Peripherie. Varikositäten sezernieren via Ca++-Ionen, VAMPs und SNAPs den jeweiligen Transmitter zusammen mit Kotransmittern
in das umliegende Interstitium. Postsynaptisch- parasympathisches
Acetylcholin wirkt auf muskarinische (mit VIP, NO), sympathische auf
adrenerge Rezeptoren (mit NPY, ATP). Kotransmitter wirken langsam, aber
effektiv Präganglionärer Transmitter ist generell Acetylcholin, die Rezeptoren nennt man nikotinisch. Die Wirkungen sind lokal begrenzt und von kurzer Dauer. Die
Divergenz prä- auf postganlionär reicht von 1:4
(Ziliarganglion: hohe Präzision) bis 1: mehrere hundert (Blutgefäße, Schweißdrüsen). In
den Ganglien erfolgt die Verrechnung zahlreicher Eingänge; postganglionäre Neuronen verteilen entsprechende Impulse auf die Peripherie. Varikositäten sezernieren via Ca++-Ionen, VAMPs und SNAPs den jeweiligen Transmitter zusammen mit Kotransmittern
in das umliegende Interstitium. Postsynaptisch- parasympathisches
Acetylcholin wirkt auf muskarinische (mit VIP, NO), sympathische auf
adrenerge Rezeptoren (mit NPY, ATP). Kotransmitter wirken langsam, aber
effektiv
 Die Blasenmotorik wird vom autonomen System gesteuert. Der Sympathikus (lumbal) unterstützt die Dichtigkeit: Er fördert den Tonus des inneren Schließmuskels und entspannt die Blasenwand (geringer Füllungsdruck). Das pontine Kontinenzzentrum aktiviert über den Onuf'schen Kern im Rückenmark somatomotorische Fasern im N. pudendus und damit den äußeren Schließmuskel (hoher Ausstromwiderstand). Dehnungsrezeptoren in der Wand der Harnblase melden
steigenden Blasendruck an das pontine Miktionszentrum, bei Freigabe des
Detrusionsreflexes durch höhere Zentren wird die sympathische Aktivität
gehemmt, die parasympathische angeregt (Miktion) Die Blasenmotorik wird vom autonomen System gesteuert. Der Sympathikus (lumbal) unterstützt die Dichtigkeit: Er fördert den Tonus des inneren Schließmuskels und entspannt die Blasenwand (geringer Füllungsdruck). Das pontine Kontinenzzentrum aktiviert über den Onuf'schen Kern im Rückenmark somatomotorische Fasern im N. pudendus und damit den äußeren Schließmuskel (hoher Ausstromwiderstand). Dehnungsrezeptoren in der Wand der Harnblase melden
steigenden Blasendruck an das pontine Miktionszentrum, bei Freigabe des
Detrusionsreflexes durch höhere Zentren wird die sympathische Aktivität
gehemmt, die parasympathische angeregt (Miktion)
 Der
Sympathikustonus kann unterschiedlich abgeschätzt werden: Ableitung der
Aktivität sympathischer Efferenzen (MSNA, SSNA) , Noradrenalinspiegel
in Blut oder Harn,
Herzfrequenzvariabilität. Der Anstieg der Katecholaminspiegel im Blut
hängt von der Art der Belastung ab (psychische Belastung: NA um die
Hälfte, A
~2fach; Wechsel zu stehender Position: NA
~2fach, A um die Hälfte; körperliche Belastung NA
~4fach, A
~2fach; starke Hypoglykämie NA
~3fach, A
~20-fach; hämorrhagischer Schock NA
~8fach, A
~25fach).
Physischer Stress regt eher die noradrenerge (Sympathikus), psychischer
und metabolischer eher die adrenerge Achse an (Nebenniere) Der
Sympathikustonus kann unterschiedlich abgeschätzt werden: Ableitung der
Aktivität sympathischer Efferenzen (MSNA, SSNA) , Noradrenalinspiegel
in Blut oder Harn,
Herzfrequenzvariabilität. Der Anstieg der Katecholaminspiegel im Blut
hängt von der Art der Belastung ab (psychische Belastung: NA um die
Hälfte, A
~2fach; Wechsel zu stehender Position: NA
~2fach, A um die Hälfte; körperliche Belastung NA
~4fach, A
~2fach; starke Hypoglykämie NA
~3fach, A
~20-fach; hämorrhagischer Schock NA
~8fach, A
~25fach).
Physischer Stress regt eher die noradrenerge (Sympathikus), psychischer
und metabolischer eher die adrenerge Achse an (Nebenniere)
 Der
Parasympathikus fördert Regenerationsprozesse und verwaltet spezielle
vegetative Reflexe. Er
schont Organe (respiratorische Säuberungsfunktion, Schutz der Augen),
spart Energie (Herzverlangsamung)
und wirkt anregend auf Verdauungssystem, Blase und Rektum. Der
Parasympathikus fördert Regenerationsprozesse und verwaltet spezielle
vegetative Reflexe. Er
schont Organe (respiratorische Säuberungsfunktion, Schutz der Augen),
spart Energie (Herzverlangsamung)
und wirkt anregend auf Verdauungssystem, Blase und Rektum.
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Autonomes Nervensystem
Autonomes Nervensystem
 adrenerg: ad = bei, ren = Niere, εργον = Arbeit
adrenerg: ad = bei, ren = Niere, εργον = Arbeit Zentren & Reflexe
Zentren & Reflexe  präganglionär
präganglionär  postganglionär
postganglionär  NANC
NANC  viszerale Afferenzen
viszerale Afferenzen  viszerale Efferenzen, Splanchnicussystem
viszerale Efferenzen, Splanchnicussystem  Kontrolle der Harnblase
Kontrolle der Harnblase  "Sympathikustonus"
"Sympathikustonus"  Synopsis: Sympathikus
Synopsis: Sympathikus
 Parasympathikus
Parasympathikus

 Herzfrequenzvariabilität, respiratorische Arrhythmie
Herzfrequenzvariabilität, respiratorische Arrhythmie
 - autonomic nervous, vegetative, involuntary, visceral system)
ist die neuronale Maschinerie, welche vor allem die Funktion der
inneren Organe in Sekundenschnelle beeinflussen und koordinieren kann.
Diese Kontrollfunktion übt es kontinuierlich aus, Tag und Nacht - in
Abhängigkeit von Signalen, und Erfordernissen von Systemen, die mit
Vorgängen befasst sind, die dem Bewusstsein weitgehend verborgen
bleiben (Stoffwechsel, Kreislauf, Atmung, Verdauung, Funktionen der
Nieren, des Urogenitalsystems, der Immunabwehr u.a.).
- autonomic nervous, vegetative, involuntary, visceral system)
ist die neuronale Maschinerie, welche vor allem die Funktion der
inneren Organe in Sekundenschnelle beeinflussen und koordinieren kann.
Diese Kontrollfunktion übt es kontinuierlich aus, Tag und Nacht - in
Abhängigkeit von Signalen, und Erfordernissen von Systemen, die mit
Vorgängen befasst sind, die dem Bewusstsein weitgehend verborgen
bleiben (Stoffwechsel, Kreislauf, Atmung, Verdauung, Funktionen der
Nieren, des Urogenitalsystems, der Immunabwehr u.a.). 
 Abbildung: Organisation prä- und postgalglionärer Neurone in Sympathikus und Parasympathikus
Abbildung: Organisation prä- und postgalglionärer Neurone in Sympathikus und Parasympathikus
 sympathische,
sympathische, parasympathische und
parasympathische und 
 intestinale
(enterische
intestinale
(enterische , Darm-) Nervensystem eingeteilt (Gegenstand der Neurogastroenterologie).
, Darm-) Nervensystem eingeteilt (Gegenstand der Neurogastroenterologie). 
 Abbildung: Organisation efferenter Neurone
Abbildung: Organisation efferenter Neurone

 Abbildung: Homöostatisches Gleichgewicht
Abbildung: Homöostatisches Gleichgewicht
 Aufrechterhaltung eines inneren Milieus (Homöostase) und
der
Aufrechterhaltung eines inneren Milieus (Homöostase) und
der  Anpassung an wechselnde Anforderungen der Umgebung des Organismus.
Anpassung an wechselnde Anforderungen der Umgebung des Organismus.
 Kraniales System: Über parasympathische Afferenzen der V., VII., IX. und X. Hirnnerven zum Hirnstamm / nucl. tractus solitarii;
Kraniales System: Über parasympathische Afferenzen der V., VII., IX. und X. Hirnnerven zum Hirnstamm / nucl. tractus solitarii;  Spinales System: über sympathische und parasympathische Fasern zum Rückenmark.
Spinales System: über sympathische und parasympathische Fasern zum Rückenmark. Endogene Rhythmen, wie die
Schlaf-Wach-Folge,
Endogene Rhythmen, wie die
Schlaf-Wach-Folge,  Kreislauffunktion,
Kreislauffunktion,  Atemtätigkeit,
Atemtätigkeit,  Ernährung /
Verdauungsfunktionen,
Ernährung /
Verdauungsfunktionen,  Blasenmotorik,
Blasenmotorik, Genitalreflexe,
Genitalreflexe,
 Hautdurchblutung,
Hautdurchblutung,  Pupillenweite und Akkommodation.
Pupillenweite und Akkommodation. Abbildung) und projiziert auf diese
zurück (nächste
Abbildung) und projiziert auf diese
zurück (nächste  Abbildung).
Abbildung).
 Abbildung: Afferenzen aus der Peripherie zum zentralen autonomen Netzwerk
Abbildung: Afferenzen aus der Peripherie zum zentralen autonomen Netzwerk
 Abbildung gezeignen Bahnen vermitteln andere
Impulse aus der Peripherie an verschiedene Teile des limbischen
Systems; viszerale Projektionen aus dem Rückenmark gelangen auch in den
somatosensorischen Thalamus (nucl. posterolateralis ventralis). Der Hypothalamus übernimmt zahlreiche "Vermittlerfunktionen" zwischen Großhirn (Frontalkortex, limbisches System) und Hirnstammkernen.
Abbildung gezeignen Bahnen vermitteln andere
Impulse aus der Peripherie an verschiedene Teile des limbischen
Systems; viszerale Projektionen aus dem Rückenmark gelangen auch in den
somatosensorischen Thalamus (nucl. posterolateralis ventralis). Der Hypothalamus übernimmt zahlreiche "Vermittlerfunktionen" zwischen Großhirn (Frontalkortex, limbisches System) und Hirnstammkernen.
 Abbildung: Efferenzen des zentralen autonomen Netzwerks
Abbildung: Efferenzen des zentralen autonomen Netzwerks
 s. dort).
s. dort).
 Abbildung: Vegetatives Nervensystem
Abbildung: Vegetatives Nervensystem des Mittelhirns entspringen parasympathische Fasern des III. Hirnnerven (N. oculomotorius). Diese vermitteln Pupillenverengung und Akkommodation.
des Mittelhirns entspringen parasympathische Fasern des III. Hirnnerven (N. oculomotorius). Diese vermitteln Pupillenverengung und Akkommodation.
 "Vegetative Reflexe" laufen weitgehend unbewusst ab, z.B. betreffend
"Vegetative Reflexe" laufen weitgehend unbewusst ab, z.B. betreffend Blutdruckstabilisierung
Blutdruckstabilisierung Miktion
Miktion Defäkation
Defäkation Anpassung der Pupillenweite und Linsenkrümmung im Auge
Anpassung der Pupillenweite und Linsenkrümmung im Auge Sexualfunktionen
Sexualfunktionen ), letzterer bei körperlicher Ruhe bzw.
Verdauungstätigkeit (Trophotropie
), letzterer bei körperlicher Ruhe bzw.
Verdauungstätigkeit (Trophotropie ).
). Übertragung auf nikotinische NN-Rezeptoren der postganglionären Nervenzelle ist durch den - heute nur noch experimentell angewendeten - Ganglienblocker Hexamethonium
blockierbar. Die Rezeptoren werden mit den Buchstaben NN
charakterisiert, um sie von den - ebenfalls nikotinischen -
NM-Rezeptoren an der motorischen Endplatte zu unterscheiden (diese sind
durch D-Tubocurarin blockierbar). Nikotinische Rezeptoren öffnen Ionenkanäle, ihre Aktivierung depolarisiert die Zelle.
Übertragung auf nikotinische NN-Rezeptoren der postganglionären Nervenzelle ist durch den - heute nur noch experimentell angewendeten - Ganglienblocker Hexamethonium
blockierbar. Die Rezeptoren werden mit den Buchstaben NN
charakterisiert, um sie von den - ebenfalls nikotinischen -
NM-Rezeptoren an der motorischen Endplatte zu unterscheiden (diese sind
durch D-Tubocurarin blockierbar). Nikotinische Rezeptoren öffnen Ionenkanäle, ihre Aktivierung depolarisiert die Zelle.
 Abbildung: Organisation des peripheren sympathischen Systems
Abbildung: Organisation des peripheren sympathischen Systems
 Sie
schalten nur zum Teil auf gleicher Höhe um, viele breiten sich nach
oben und unten aus und schalten auf postganglionäre Zellen;
dieses Muster ist
typisch für die Versorgung von Gefäßmuskulatur und Schweißdrüsen in
Rumpf und Extremitäten, ferner Augen (Mydriasis!) und Thoraxeingeweiden
Sie
schalten nur zum Teil auf gleicher Höhe um, viele breiten sich nach
oben und unten aus und schalten auf postganglionäre Zellen;
dieses Muster ist
typisch für die Versorgung von Gefäßmuskulatur und Schweißdrüsen in
Rumpf und Extremitäten, ferner Augen (Mydriasis!) und Thoraxeingeweiden Sie
ziehen in Eingeweidenerven (Nn. splanchnici
Sie
ziehen in Eingeweidenerven (Nn. splanchnici  ) weiter und schalten in
einem prävertebralen Ganglion um (Versorgung von Bauch- und
Beckeneingeweiden)
) weiter und schalten in
einem prävertebralen Ganglion um (Versorgung von Bauch- und
Beckeneingeweiden) Sie
ziehen bis zum Nebennierenmark und schalten erst hier auf chromaffine
Zellen um, wobei diese zur Ausschüttung von Katecholaminen
Sie
ziehen bis zum Nebennierenmark und schalten erst hier auf chromaffine
Zellen um, wobei diese zur Ausschüttung von Katecholaminen  (4/5
Adrenalin, 1/5 Noradrenalin) angeregt werden.
(4/5
Adrenalin, 1/5 Noradrenalin) angeregt werden. Abbildung).
Abbildung).
 Abbildung: EPSP- und IPSP-Effekte an einer autonomen Ganglienzelle
Abbildung: EPSP- und IPSP-Effekte an einer autonomen Ganglienzelle Näheres s. dort
Näheres s. dort
 Abbildung).
Abbildung). 
 Abbildung: Präsynaptische Beeinflussung der Transmitterfreisetuung
Abbildung: Präsynaptische Beeinflussung der Transmitterfreisetuung
 Abbildung). Beeinflussung der Effizienz der
Transmitterfreisetzung an einer Synapse nennt man Neuromodulation.
Abbildung). Beeinflussung der Effizienz der
Transmitterfreisetzung an einer Synapse nennt man Neuromodulation. Über Neuromodulation in autonom-nervösen Systemen s. dort
Über Neuromodulation in autonom-nervösen Systemen s. dort
 Abbildung: Einige Einflüsse auf die Freisetzung von Noradrenalin aus sympathischen Ganglien
Abbildung: Einige Einflüsse auf die Freisetzung von Noradrenalin aus sympathischen Ganglien
 Dieser Unterschied kann pharmakologisch genutzt werden, wenn entsprechende Agonisten oder Antagonisten ihre Hauptwirkung entweder präsynaptisch
oder postsynaptisch entfalten. So können
ganglienstimulierende Stoffe oder Ganglienblocker selektiv
präsynaptisch, diverse Peptide oder Nichtpeptide postsynaptisch auf
adrenerge oder cholinerge Rezeptoren wirken.
Dieser Unterschied kann pharmakologisch genutzt werden, wenn entsprechende Agonisten oder Antagonisten ihre Hauptwirkung entweder präsynaptisch
oder postsynaptisch entfalten. So können
ganglienstimulierende Stoffe oder Ganglienblocker selektiv
präsynaptisch, diverse Peptide oder Nichtpeptide postsynaptisch auf
adrenerge oder cholinerge Rezeptoren wirken. Abbildung). Die Entfernung zu den Zielzellen (Diffusionsstrecke) kann bis zu einigen Zehntelmillimetern betragen (synapses à distance, synapses en passant).
Abbildung). Die Entfernung zu den Zielzellen (Diffusionsstrecke) kann bis zu einigen Zehntelmillimetern betragen (synapses à distance, synapses en passant). 
 Abbildung: Vorgänge an autonom-nervösen Varikositäten: Beispiel noradrenerger (sympathischer) Neuroeffektor
Abbildung: Vorgänge an autonom-nervösen Varikositäten: Beispiel noradrenerger (sympathischer) Neuroeffektor
 s. dort). Strömen - erregungsbedingt - Ca++-Ionen ein,
dann fusionieren Vesikel mit der Außenmembran und setzen Noradrenalin
frei, zusammen mit Cotransmittern - Neuropeptid Y (NPY) und Adenosintriphosphat (ATP).
s. dort). Strömen - erregungsbedingt - Ca++-Ionen ein,
dann fusionieren Vesikel mit der Außenmembran und setzen Noradrenalin
frei, zusammen mit Cotransmittern - Neuropeptid Y (NPY) und Adenosintriphosphat (ATP). Über den Synaptobrevin- Syntaxin- Mechanismus s. auch dort
Über den Synaptobrevin- Syntaxin- Mechanismus s. auch dort vgl. dort
vgl. dort Der parasympathische
Der parasympathische  Transmitter ist Acetylcholin (wirkt auf muskarinische Rezeptoren vom M3-Typ). Die Rezeptoren stimulieren G-Proteine. Diese können unterschiedliche Wirkung haben:
Transmitter ist Acetylcholin (wirkt auf muskarinische Rezeptoren vom M3-Typ). Die Rezeptoren stimulieren G-Proteine. Diese können unterschiedliche Wirkung haben:  Aktivierung des IP3-Mechanismus, Anstieg des intrazellulären Calciumspiegels und Aktivierung von Proteinkinase C;
Aktivierung des IP3-Mechanismus, Anstieg des intrazellulären Calciumspiegels und Aktivierung von Proteinkinase C;  Hemmung der Adenylatzyklase und Senkung des cAMP-Spiegels; oder
Hemmung der Adenylatzyklase und Senkung des cAMP-Spiegels; oder  direkte Modulierung von Kaliumkanälen durch den freigesetzten βγ-Komplex.
direkte Modulierung von Kaliumkanälen durch den freigesetzten βγ-Komplex. Im sympathischen
System wirken Katecholamine (Noradrenalin / Adrenalin ~ 20:1; adrenerge
Im sympathischen
System wirken Katecholamine (Noradrenalin / Adrenalin ~ 20:1; adrenerge  Rezeptoren), in Ausnahmefällen (Schweißdrüsen) Acetylcholin (Rezeptoren vom M3-Typ).
Rezeptoren), in Ausnahmefällen (Schweißdrüsen) Acetylcholin (Rezeptoren vom M3-Typ). 

 Abbildung: Gestaffelte Kontrolle des autonomen Systems
Abbildung: Gestaffelte Kontrolle des autonomen Systems auf präganglionäre Neurone
(die auf postganglionäre Neurone einwirken und unter der Kontrolle
autonomer Zentren im Hirnstamm sowie des Hypothalamus stehen),
auf präganglionäre Neurone
(die auf postganglionäre Neurone einwirken und unter der Kontrolle
autonomer Zentren im Hirnstamm sowie des Hypothalamus stehen), auf den nucleus tractus solitarii (der auf den nucl parabrachialis, den Hypothalamus, Zentren im Hirnstamm sowie auf präganglionäre Neurone projiziert), sowie
auf den nucleus tractus solitarii (der auf den nucl parabrachialis, den Hypothalamus, Zentren im Hirnstamm sowie auf präganglionäre Neurone projiziert), sowie  auf parabrachiale Kerne
(diese projizieren auf Thalamus, autonomen Hirnstamm und präganglionäre
Neurone, und tauscht Information mit dem Hypothalamus aus).
auf parabrachiale Kerne
(diese projizieren auf Thalamus, autonomen Hirnstamm und präganglionäre
Neurone, und tauscht Information mit dem Hypothalamus aus).
 Abbildung). Damit bilden sie nicht nur afferente Schenkel
vegetativ-viszeraler Reflexe, sondern führen auch zu bewussten
Empfindungen (Harn- und Stuhldrang, Übelkeit, Atemnot, Schmerz). Etwa 90% der viszeral-afferenten Fasern sind unmyelinisiert (C-Fasern).
Abbildung). Damit bilden sie nicht nur afferente Schenkel
vegetativ-viszeraler Reflexe, sondern führen auch zu bewussten
Empfindungen (Harn- und Stuhldrang, Übelkeit, Atemnot, Schmerz). Etwa 90% der viszeral-afferenten Fasern sind unmyelinisiert (C-Fasern). Die größte Zahl viszeraler Afferenzen finden sich im
Vagusnerven, der zu 80%
afferente (sensorische) Fasern enthält (Dehnungszustand von
Blutgefäßen, Herzräumen, Bronchien; Chemorezeption: Blutgase,
Glucosespiegel etc; Zustand und Inhalt des Gastrointestinalsystems;
viszeraler
Schmerz).
Die größte Zahl viszeraler Afferenzen finden sich im
Vagusnerven, der zu 80%
afferente (sensorische) Fasern enthält (Dehnungszustand von
Blutgefäßen, Herzräumen, Bronchien; Chemorezeption: Blutgase,
Glucosespiegel etc; Zustand und Inhalt des Gastrointestinalsystems;
viszeraler
Schmerz).  Fasern ziehen aus dem ZNS zu autonomen Ganglien außerhalb des ZNS und projizieren hier cholinerg auf postganglionäre Nervenzellen.
Fasern ziehen aus dem ZNS zu autonomen Ganglien außerhalb des ZNS und projizieren hier cholinerg auf postganglionäre Nervenzellen.
 Abbildung: Autonom-nervöse Efferenzen
Abbildung: Autonom-nervöse Efferenzen
 Sympathische Efferenzen aus dem anterolateralen Bereich der Rückenmarksegmente Th1 bis
L3 gelangen zum Großteil über Blutgefäße an ihr Ziel - paravertebrale,
prävertebrale und terminale Ganglien.
Sympathische Efferenzen aus dem anterolateralen Bereich der Rückenmarksegmente Th1 bis
L3 gelangen zum Großteil über Blutgefäße an ihr Ziel - paravertebrale,
prävertebrale und terminale Ganglien.  Rami communicantes verbinden die paravertebralen Ganglien (22 Paare, links und rechts vor der Wirbelsäule gelegen) mit den Segmentnerven; rami communicantes albi ("weiß", markhaltig) enthalten prävertebrale, rami communicantes grisei
("grau", marklos) postganglionäre Nervenfasern. Letztere ziehen zu
Schweißdrüsen und Piloerektoren in der Haut sowie zu Blutgefäßen in
Haut und Skelettmuskulatur. Die Kette des sympathischen Grenzstrangs beginnt mit den Zervikalnanglien (ggl cervicale superius,
Rami communicantes verbinden die paravertebralen Ganglien (22 Paare, links und rechts vor der Wirbelsäule gelegen) mit den Segmentnerven; rami communicantes albi ("weiß", markhaltig) enthalten prävertebrale, rami communicantes grisei
("grau", marklos) postganglionäre Nervenfasern. Letztere ziehen zu
Schweißdrüsen und Piloerektoren in der Haut sowie zu Blutgefäßen in
Haut und Skelettmuskulatur. Die Kette des sympathischen Grenzstrangs beginnt mit den Zervikalnanglien (ggl cervicale superius,  Prävertebrale Ganglien liegen vor
der Wirbelsäule im Bauch- und Beckenbereich. Sie sind entlang der Aorta
angeordnet und durch zahlreiche neuronale Verbindungsstränge
miteinander verbunden. Diese bilden Geflechte aus (plexus aorticus mit plexus coeliacus, mesentericus superior, renalis, uretericus, testicularis / ovaricus, mesentericus inferior, hypogastricus superior und inferior), in denen die Ganglien "eingesponnen" sind.
Prävertebrale Ganglien liegen vor
der Wirbelsäule im Bauch- und Beckenbereich. Sie sind entlang der Aorta
angeordnet und durch zahlreiche neuronale Verbindungsstränge
miteinander verbunden. Diese bilden Geflechte aus (plexus aorticus mit plexus coeliacus, mesentericus superior, renalis, uretericus, testicularis / ovaricus, mesentericus inferior, hypogastricus superior und inferior), in denen die Ganglien "eingesponnen" sind. Eingelagert in den sympathischen Grenzstrang finden sich folgende Paravertebralganglien:
Eingelagert in den sympathischen Grenzstrang finden sich folgende Paravertebralganglien: cervicale superius (das größte sympathische Ganglion, es enthält etwa eine Million Neurone; versorgt Auge und Speicheldrüsen),
cervicale superius (das größte sympathische Ganglion, es enthält etwa eine Million Neurone; versorgt Auge und Speicheldrüsen),  cervicale medius / inferior (versorgen zusammen mit den oberen ggl. thoracica - T1 bis T5 - Thoraxorgane (Herz, Lunge) sowie Schweißdrüsen und Piloerektoren in der Haut),
cervicale medius / inferior (versorgen zusammen mit den oberen ggl. thoracica - T1 bis T5 - Thoraxorgane (Herz, Lunge) sowie Schweißdrüsen und Piloerektoren in der Haut), thoracica (T6 bis T12 zu ggl. coeliacum, aorticorenale, mesentericum superius, sowie zum Nebennierenmark),
thoracica (T6 bis T12 zu ggl. coeliacum, aorticorenale, mesentericum superius, sowie zum Nebennierenmark), lumbalia (L1 bis L3 zum ggl. mesentericum inferius).
lumbalia (L1 bis L3 zum ggl. mesentericum inferius). Vorgelagert - prävertebral - finden sich im Bauchraum folgende Ganglien, die miteinander über ein Geflecht von Nervenfaserbündeln (plexus coeliacus und hypogastricus) verflochten sind: Ganglion
Vorgelagert - prävertebral - finden sich im Bauchraum folgende Ganglien, die miteinander über ein Geflecht von Nervenfaserbündeln (plexus coeliacus und hypogastricus) verflochten sind: Ganglion coeliacum
(die zwei ggll. coeliaca sind die größten des autonomen Nervensystems,
sie versorgen den Großteil des Verdauungstrakts - Magen, Pankreas,
Leber),
coeliacum
(die zwei ggll. coeliaca sind die größten des autonomen Nervensystems,
sie versorgen den Großteil des Verdauungstrakts - Magen, Pankreas,
Leber), mesentericum superius auf der Höhe der a. mesenterica sup. (versorgt den Dickdarm),
mesentericum superius auf der Höhe der a. mesenterica sup. (versorgt den Dickdarm), aorticorenale dexter und sinister (Nieren),
aorticorenale dexter und sinister (Nieren), spermaticum / ovaricum (Geschlechtsorgane),
spermaticum / ovaricum (Geschlechtsorgane), mesentericum inferius (unterer Dickdarm, Geschlechtsorgane)
mesentericum inferius (unterer Dickdarm, Geschlechtsorgane)  sowie weitere in den plexus hypogastricus (pelvicus) eingelagerte kleinere Ganglien (Harnblase, Urethra).
sowie weitere in den plexus hypogastricus (pelvicus) eingelagerte kleinere Ganglien (Harnblase, Urethra). 
 Abbildung: Verschaltung im autonom-nervösen System (schematisch)
Abbildung: Verschaltung im autonom-nervösen System (schematisch) Als Splanchnicussystem (gr. splagchna = Eingeweide) wird das von vegetativen Splanchnicusfasern versorgte Gebiet bezeichnet. Es steuert die Funktion (Durchblutung,
Motorik, Sekretion) von Bauch- und Beckeneingeweiden. Der Nervus splanchnicus maior (Segmente Th5 - Th9) und minor (Th9 - Th11) sowie lumbale und sakrale Äste führen sympathische, solche zu Beckeneingeweiden parasympathische Fasern.
Als Splanchnicussystem (gr. splagchna = Eingeweide) wird das von vegetativen Splanchnicusfasern versorgte Gebiet bezeichnet. Es steuert die Funktion (Durchblutung,
Motorik, Sekretion) von Bauch- und Beckeneingeweiden. Der Nervus splanchnicus maior (Segmente Th5 - Th9) und minor (Th9 - Th11) sowie lumbale und sakrale Äste führen sympathische, solche zu Beckeneingeweiden parasympathische Fasern.
 Vereinzelt gibt es terminale sympathische Ganglien nahe dem Erfolgsorgan, wie Zervikalganglien im Halsbereich sowie Ganglien bei der Blase und dem Rectum.
Vereinzelt gibt es terminale sympathische Ganglien nahe dem Erfolgsorgan, wie Zervikalganglien im Halsbereich sowie Ganglien bei der Blase und dem Rectum.  Parasympathische Efferenzen
- präganglionäre Fasern ziehen bis in die Nähe des Erfolgsorgans,
postganglionäre sind dementsprechend kurz - ziehen über
Parasympathische Efferenzen
- präganglionäre Fasern ziehen bis in die Nähe des Erfolgsorgans,
postganglionäre sind dementsprechend kurz - ziehen über Hirnnerven (III, VII, IX, X; 3/4 aller parasympathischen Fasern laufen über den N. vagus) oder den
Hirnnerven (III, VII, IX, X; 3/4 aller parasympathischen Fasern laufen über den N. vagus) oder den Pelvikusnerv (Nn. splanchnici pelvini - versorgen die Beckeneingeweide) an ihre Zielgewebe.
Pelvikusnerv (Nn. splanchnici pelvini - versorgen die Beckeneingeweide) an ihre Zielgewebe.  Abbildung) in einer Weise, die beide Schenkel des autonomen Systems koordiniert nützt.
Abbildung) in einer Weise, die beide Schenkel des autonomen Systems koordiniert nützt.
 Abbildung: Kontrolle der Blasentätigkeit
Abbildung: Kontrolle der Blasentätigkeit Abbildung) des Rückenmarks - und dadurch den äußeren Schließmuskel.
Abbildung) des Rückenmarks - und dadurch den äußeren Schließmuskel.  Ableitungen von sympathischen
Nervenfasern zu Muskeln (Muscle sympathetic nerve activity, MSNA) spiegeln den Zustand des
Sympathikus
zwar wider, die registrierte Aktivität ist aber insbesondere mit dem
Baroreflex verknüpft (sie zeigt blutdruck- und atmungssynchrone
Frequenzoszillationen).
Ableitungen von sympathischen
Nervenfasern zu Muskeln (Muscle sympathetic nerve activity, MSNA) spiegeln den Zustand des
Sympathikus
zwar wider, die registrierte Aktivität ist aber insbesondere mit dem
Baroreflex verknüpft (sie zeigt blutdruck- und atmungssynchrone
Frequenzoszillationen).  Sympathische Nervenfasern zur Haut (Skin sympathetic nerve activity, SSNA)
sind hingegen durch Temperaturwechsel, Emotionen und
Aufmerksamkeitswechsel beeinflusst, was wiederum MSNA-Signale nicht
tangiert.
Sympathische Nervenfasern zur Haut (Skin sympathetic nerve activity, SSNA)
sind hingegen durch Temperaturwechsel, Emotionen und
Aufmerksamkeitswechsel beeinflusst, was wiederum MSNA-Signale nicht
tangiert.

 Abbildung: Registrierung der Sympathikusaktivität (MSNA, rosa Feld)
Abbildung: Registrierung der Sympathikusaktivität (MSNA, rosa Feld)
 In Situationen genereller Herausforderung (Muskelarbeit, fight or flight
o.ä.) kommt es über die breite Aktivierung sympathischer Zentren
zu hoher Aktivität sympathischer Nervenfasern.
Dies kann z.B. im Bereich des Wadenbeinkopfs mit feinen, an den Fibularisnerv gebrachten Elektroden (die durch die Haut geführt werden) registriert werden (muskulär-sympathische Nervenaktivität,
MSNA -
In Situationen genereller Herausforderung (Muskelarbeit, fight or flight
o.ä.) kommt es über die breite Aktivierung sympathischer Zentren
zu hoher Aktivität sympathischer Nervenfasern.
Dies kann z.B. im Bereich des Wadenbeinkopfs mit feinen, an den Fibularisnerv gebrachten Elektroden (die durch die Haut geführt werden) registriert werden (muskulär-sympathische Nervenaktivität,
MSNA -  Abbildung).
Abbildung).  Eine
andere (ebenfalls invasive) Vorgangsweise ist die - eventuell mehrfache
- Bestimmung der Noradrenalinkonzentration im Blut.
Eine
andere (ebenfalls invasive) Vorgangsweise ist die - eventuell mehrfache
- Bestimmung der Noradrenalinkonzentration im Blut.  Noradrenalin (Plasma)
Noradrenalin (Plasma) Will
man sich auf nichtinvasive Abschätzungen beschränken, besteht die
Möglichkeit der Analyse autonom-nervöser Wirkungen an peripheren
Organen. So gibt eine Analyse von Frequenzanteilen der Herzrhythmik
(Puls-, Blutdruck- oder EKG-Registrierung) Hinweise über das
autonom-nervöse Gleichgewicht: Plötzliche Wechsel der Herzfrequenz deuten
auf überwiegenden Einfluss des Vagus (Acetylcholin: rasche Wirkung, s. oben), langsamere auf einen eher höheren
Sympathikuseinfluss hin. Das ist zwar nicht sehr spezifisch, doch kann diese Herzfrequenzvariabilität diagnostisch genützt werden.
Will
man sich auf nichtinvasive Abschätzungen beschränken, besteht die
Möglichkeit der Analyse autonom-nervöser Wirkungen an peripheren
Organen. So gibt eine Analyse von Frequenzanteilen der Herzrhythmik
(Puls-, Blutdruck- oder EKG-Registrierung) Hinweise über das
autonom-nervöse Gleichgewicht: Plötzliche Wechsel der Herzfrequenz deuten
auf überwiegenden Einfluss des Vagus (Acetylcholin: rasche Wirkung, s. oben), langsamere auf einen eher höheren
Sympathikuseinfluss hin. Das ist zwar nicht sehr spezifisch, doch kann diese Herzfrequenzvariabilität diagnostisch genützt werden. Unter Herzfrequenzvariabilität (HRV: heart rate variability)
versteht man die physiologische Unregelmäßigkeit der Pulsrate, was mit
der Verknüpfung von Atmungs- und anderen Regulationsmechanismen im
Hirnstamm zusammenhängt. Gut
trainierte Menschen zeigen ausgeprägte HRV, umgekehrt kann die HRV bei
bestimmten Krankheitsbildern eingeschränkt sein. Unter respiratorischer (Sinus-) Arrhythmie (respiratory sinus arrhythmia) versteht man atemsynchrone Herzfrequenzschwankungen (Frequenzsteigerung bei Einatmung, Absinken bei Ausatmung).
Unter Herzfrequenzvariabilität (HRV: heart rate variability)
versteht man die physiologische Unregelmäßigkeit der Pulsrate, was mit
der Verknüpfung von Atmungs- und anderen Regulationsmechanismen im
Hirnstamm zusammenhängt. Gut
trainierte Menschen zeigen ausgeprägte HRV, umgekehrt kann die HRV bei
bestimmten Krankheitsbildern eingeschränkt sein. Unter respiratorischer (Sinus-) Arrhythmie (respiratory sinus arrhythmia) versteht man atemsynchrone Herzfrequenzschwankungen (Frequenzsteigerung bei Einatmung, Absinken bei Ausatmung).  Ansonsten geben die Auswirkungen auf verschiedene gut messbare physiologische Zustandsvariable, wie Herzfrequenz oder Blutdruck,
Hinweise auf den bestehenden "vegetativen Tonus".
Ansonsten geben die Auswirkungen auf verschiedene gut messbare physiologische Zustandsvariable, wie Herzfrequenz oder Blutdruck,
Hinweise auf den bestehenden "vegetativen Tonus".  Der vegetative Tonus steht unter dem Einfluss mehrerer Regionen im Gehirn, insbesondere des
limbischen Systems (zentrale Mandelkerne).
Der vegetative Tonus steht unter dem Einfluss mehrerer Regionen im Gehirn, insbesondere des
limbischen Systems (zentrale Mandelkerne). Leistungsanpassung (ergotrope
Leistungsanpassung (ergotrope  Reaktion). Der Sympathikus stellt Kreislauf, Atmung, Nervensystem und
Stoffwechsel (Hormone) auf die Akutbedürfnisse ein, die sich
durch intensive Strapazierung des Bewegungssystems ergeben
Reaktion). Der Sympathikus stellt Kreislauf, Atmung, Nervensystem und
Stoffwechsel (Hormone) auf die Akutbedürfnisse ein, die sich
durch intensive Strapazierung des Bewegungssystems ergeben Autonom-nervös
gesteuerte Reflexe, wie solche zur Blutdruckstabilisierung oder der
Kohabitation, haben sympathische Anteile. Sympathisch koordiniert ist auch die Kontinenz (Harnblase, Enddarm)
- diese Funktion steht im Dienste einer situationslogischen Abdichtung
in Situationen, wo Entleerung weder möglich noch
erwünscht wäre
Autonom-nervös
gesteuerte Reflexe, wie solche zur Blutdruckstabilisierung oder der
Kohabitation, haben sympathische Anteile. Sympathisch koordiniert ist auch die Kontinenz (Harnblase, Enddarm)
- diese Funktion steht im Dienste einer situationslogischen Abdichtung
in Situationen, wo Entleerung weder möglich noch
erwünscht wäre Spezielle Funktionen betreffen soziale Signale, zu denen
auch die Erweiterung der Pupille gehören kann (Mydriasis), die vom Gegenüber als Interesse oder auch Kampfbereitschaft gewertet wird.
Spezielle Funktionen betreffen soziale Signale, zu denen
auch die Erweiterung der Pupille gehören kann (Mydriasis), die vom Gegenüber als Interesse oder auch Kampfbereitschaft gewertet wird.
 Abbildung: Innervation des sympathischen Systems
Abbildung: Innervation des sympathischen Systems
 Wirkungen auf glatte Muskulatur: In der Darmwend wirken sowohl α1- als auch ß-Rezeptoren relaxierend (außer in Sphinkteren, die α1-adrenerg kontrahieren), Bronchien und Myometrium relaxieren bei Reizung von ß2-Rezeptoren, der Blasenmuskel (Detrusor) bei Reizung seiner ß3-Rezeptoren. Ansonsten reagiert glatte Muskulatur auf Reizung von α1-Rezeptoren generell
mit Kontraktion - vor allem in kleinen Arterien und Arteriolen der Haut
und im Splanchnicusgebiet (Erhöhung des Strömungswiderstandes). Auch
viele größere Gefäße kontrahieren (Reduktion der Compliance). Gefäße in
Gehirn, Herzmuskel und Lunge reagieren kaum auf sympathische Impulse. ß2-Rezeptoren in Gefäßwänden wirken über NO vasodilatierend, vor allem in der Skelettmuskulatur.
Wirkungen auf glatte Muskulatur: In der Darmwend wirken sowohl α1- als auch ß-Rezeptoren relaxierend (außer in Sphinkteren, die α1-adrenerg kontrahieren), Bronchien und Myometrium relaxieren bei Reizung von ß2-Rezeptoren, der Blasenmuskel (Detrusor) bei Reizung seiner ß3-Rezeptoren. Ansonsten reagiert glatte Muskulatur auf Reizung von α1-Rezeptoren generell
mit Kontraktion - vor allem in kleinen Arterien und Arteriolen der Haut
und im Splanchnicusgebiet (Erhöhung des Strömungswiderstandes). Auch
viele größere Gefäße kontrahieren (Reduktion der Compliance). Gefäße in
Gehirn, Herzmuskel und Lunge reagieren kaum auf sympathische Impulse. ß2-Rezeptoren in Gefäßwänden wirken über NO vasodilatierend, vor allem in der Skelettmuskulatur. Wirkungen auf den Herzmuskel: Stimulation von ß1-Rezeptoren
wirkt positiv auf alle Herzqualitäten (Schlagkraft, Frequenz, Leitung
etc) und erhöht den Sauerstoffverbrauch des Myokards.
Wirkungen auf den Herzmuskel: Stimulation von ß1-Rezeptoren
wirkt positiv auf alle Herzqualitäten (Schlagkraft, Frequenz, Leitung
etc) und erhöht den Sauerstoffverbrauch des Myokards. Näheres s. dort
Näheres s. dort  Wirkungen auf den Stoffwechsel:
Sympathische Stimulation steigert die Nutzung von Energiespeichern
(kurzzeitig Glykogen, über längere Dauer Fett) für den Verbrauch von
Glucose und Fettsäuren, deren Blutspiegel ansteigen.
Wirkungen auf den Stoffwechsel:
Sympathische Stimulation steigert die Nutzung von Energiespeichern
(kurzzeitig Glykogen, über längere Dauer Fett) für den Verbrauch von
Glucose und Fettsäuren, deren Blutspiegel ansteigen. 
 Katecholaminspiegel im Blut: Im Vergleich zum Kontrollzustand (Ruhe, liegende Position) erhöht sich der Noradrenalinspiegel
Katecholaminspiegel im Blut: Im Vergleich zum Kontrollzustand (Ruhe, liegende Position) erhöht sich der Noradrenalinspiegel bei psychischer Belastung wie einem öffentlichen Vortrag um rund 50%
- der Adrenalinspiegel steigt stärker, auf mehr als das Doppelte (bei
der vortragenden Person, nicht unbedingt bei den Zuhörern
bei psychischer Belastung wie einem öffentlichen Vortrag um rund 50%
- der Adrenalinspiegel steigt stärker, auf mehr als das Doppelte (bei
der vortragenden Person, nicht unbedingt bei den Zuhörern  ),
), bei Wechsel zu stehender Position auf etwa das Doppelte (der Adrenalinspiegel um weniger als 50%),
bei Wechsel zu stehender Position auf etwa das Doppelte (der Adrenalinspiegel um weniger als 50%), bei starker Hypoglykämie (Glucose <30 mg/dl) auf knapp das Dreifache (der Adrenalinspiegel bis mehr als 20-fach),
bei starker Hypoglykämie (Glucose <30 mg/dl) auf knapp das Dreifache (der Adrenalinspiegel bis mehr als 20-fach), bei mittelschwerer körperlicher Belastung auf das Vierfache (der Adrenalinspiegel auf knapp das Doppelte).
bei mittelschwerer körperlicher Belastung auf das Vierfache (der Adrenalinspiegel auf knapp das Doppelte).  Daraus ist zu erkennen, dass physische
Belastung (Lagewechsel, Muskelarbeit), die vor allem eine
Leistungssteigerung im kardiovaskulären System erfordert, eher die
noradrenerge Achse des Sympathikus anregt, psychische und metabolische (und pharmakologische, z.B. durch Nikotin oder Coffein) eher die adrenerge (Nebennierenmark).
Daraus ist zu erkennen, dass physische
Belastung (Lagewechsel, Muskelarbeit), die vor allem eine
Leistungssteigerung im kardiovaskulären System erfordert, eher die
noradrenerge Achse des Sympathikus anregt, psychische und metabolische (und pharmakologische, z.B. durch Nikotin oder Coffein) eher die adrenerge (Nebennierenmark). 
 Tabelle: Auswirkung der
Reizung von Rezeptoren im adrenergen System an verschiedenen Organen
und Geweben
Tabelle: Auswirkung der
Reizung von Rezeptoren im adrenergen System an verschiedenen Organen
und Geweben
 Abbildung: Beteiligung des Sympathikus an Immunantworten
Abbildung: Beteiligung des Sympathikus an Immunantworten
 Abbildung):
Abbildung):  Anregung
des Sympathikus steigert einerseits den Blutdruck durch Erhöhung von
peripherem Fließwiderstand (Arteriolentonus), Herzzeitvolumen (positive
Inoptropie) und extrazellulärem Flüssigkeitsvolumen
(Natrium-Rückresorption in der Niere).
Anregung
des Sympathikus steigert einerseits den Blutdruck durch Erhöhung von
peripherem Fließwiderstand (Arteriolentonus), Herzzeitvolumen (positive
Inoptropie) und extrazellulärem Flüssigkeitsvolumen
(Natrium-Rückresorption in der Niere).  Immunzellen
exprimieren andererseits Adrenozeptoren, deren Aktivierung sich u.a.
auf die Bildung von Zytokinen auswirkt. Dabei können sowohl
entzündungsfördernde (proinflammatorische) als auch entzündungshemmende
(antiinflammatorische) Wirkungen auftreten, je nach auslösendem Reiz
und Wirkungsmuster.
Immunzellen
exprimieren andererseits Adrenozeptoren, deren Aktivierung sich u.a.
auf die Bildung von Zytokinen auswirkt. Dabei können sowohl
entzündungsfördernde (proinflammatorische) als auch entzündungshemmende
(antiinflammatorische) Wirkungen auftreten, je nach auslösendem Reiz
und Wirkungsmuster. Reaktion). Die Steuerung des Darmnervensystems erfolgt vorwiegend über parasympathische Anteile.
Reaktion). Die Steuerung des Darmnervensystems erfolgt vorwiegend über parasympathische Anteile. 
 Abbildung: Innervation des parasympathischen Systems
Abbildung: Innervation des parasympathischen Systems
 Parasympathische Anteile findet man in mehreren vegetativen Reflexen
(Kohabitation, Miktion, Defäkation)
Parasympathische Anteile findet man in mehreren vegetativen Reflexen
(Kohabitation, Miktion, Defäkation) Dazu kommen spezielle Aufgaben, z.B. Kontraktion des Ziliarmuskels (Akkommodation) und der Iris (Miosis)
Dazu kommen spezielle Aufgaben, z.B. Kontraktion des Ziliarmuskels (Akkommodation) und der Iris (Miosis) Der Parasympathikus verfügt über ein System von Nervenfasern, die gefäßerweiternd (vasodilatierend)
wirken. Über Hirnnerven werden so arterielle Gefäße in Gehirn,
Herzmuskel, Speicheldrüsen, Pankreas (exokrin) und gastrointestinale
Mukosa parasympathisch beeinflusst; und aus dem Sakralmark Genitalien,
Blase und Colon. Die aus der peripheren ganglionären Umschaltung
entspringenden, kurzen postganglionären Fasern haben (so wie
sympathische) Varikositäten, aus denen die Transmitter freigesetzt werden.
Der Parasympathikus verfügt über ein System von Nervenfasern, die gefäßerweiternd (vasodilatierend)
wirken. Über Hirnnerven werden so arterielle Gefäße in Gehirn,
Herzmuskel, Speicheldrüsen, Pankreas (exokrin) und gastrointestinale
Mukosa parasympathisch beeinflusst; und aus dem Sakralmark Genitalien,
Blase und Colon. Die aus der peripheren ganglionären Umschaltung
entspringenden, kurzen postganglionären Fasern haben (so wie
sympathische) Varikositäten, aus denen die Transmitter freigesetzt werden.  Die
(relative) Aktivität des Parasympathikus kann über die Ermittlung der
Herzfrequenzvariabilität (Zeit- oder
Frequenzdomäne) abgeschätzt werden.
Die
(relative) Aktivität des Parasympathikus kann über die Ermittlung der
Herzfrequenzvariabilität (Zeit- oder
Frequenzdomäne) abgeschätzt werden. Über Parasympathikolyse (Atropineffekt) s. dort.
Über Parasympathikolyse (Atropineffekt) s. dort. Die Bezeichnung "Sympathikus" und "Parasympathikus" geht auf Galen zurück. Er meinte, dass Wirkungen auf einen Teil des Körpers auch andere Teile in Mitleidenschaft
ziehen ("Sympathie der Teile"), und Reflexe wurden in diesem Licht
gesehen (als "Sympathikus" wurden ursprünglich alle autonomen Reflexe
eingeordnet). Später wurde der kraniosakrale Teil des autonomen
Nervensystems als "Neben- (Para-) Sympathikus" definiert. John N. Langley führte 1898 den Begriff "autonomes Nervensystem" ein.
Die Bezeichnung "Sympathikus" und "Parasympathikus" geht auf Galen zurück. Er meinte, dass Wirkungen auf einen Teil des Körpers auch andere Teile in Mitleidenschaft
ziehen ("Sympathie der Teile"), und Reflexe wurden in diesem Licht
gesehen (als "Sympathikus" wurden ursprünglich alle autonomen Reflexe
eingeordnet). Später wurde der kraniosakrale Teil des autonomen
Nervensystems als "Neben- (Para-) Sympathikus" definiert. John N. Langley führte 1898 den Begriff "autonomes Nervensystem" ein.
 Tabelle: Auswirkung der
Reizung von Rezeptoren im muskarinergen System an verschiedenen Organen
und Geweben
Tabelle: Auswirkung der
Reizung von Rezeptoren im muskarinergen System an verschiedenen Organen
und Geweben

 Das autonome (sympathische, parasympathische und intestinale) Nervensystem steuert innere Organe. Der Sympathikus unterstützt die Anpassung an wechselnde Anforderungen des Organismus (Sauerstoff- und Substrattransport für Kampf- oder
Fluchtreaktionen, Schärfung der Sinne). Der Parasympathikus dient der Aufrechterhaltung eines inneren Milieus und zeigt
im Gegensatz zum Sympathikus kaum Divergenz (präzise Steuerung). Eine
Blockade peripherer autonomer Nerven führt (im Gegensatz zur
Skelettmuskel) nicht zu totalem Funktionsausfall des betroffenen
Gebietes, Drüsen- und glatte Muskelzellen erhalten ihre Spontanaktivität
Das autonome (sympathische, parasympathische und intestinale) Nervensystem steuert innere Organe. Der Sympathikus unterstützt die Anpassung an wechselnde Anforderungen des Organismus (Sauerstoff- und Substrattransport für Kampf- oder
Fluchtreaktionen, Schärfung der Sinne). Der Parasympathikus dient der Aufrechterhaltung eines inneren Milieus und zeigt
im Gegensatz zum Sympathikus kaum Divergenz (präzise Steuerung). Eine
Blockade peripherer autonomer Nerven führt (im Gegensatz zur
Skelettmuskel) nicht zu totalem Funktionsausfall des betroffenen
Gebietes, Drüsen- und glatte Muskelzellen erhalten ihre Spontanaktivität Afferenzen
aus Eingeweiden bringen sensorische Information zum ZNS und laufen über
zwei Stränge: Das kraniale System über Hirnnerven zum Hirnstamm, das
spinale System zum Rückenmark. Diese Afferenzen (Dehnung der Lunge, Blutgase, Blutvolumen und Blutdruck, Nahrung und Verdauungssystem, Füllung von Blase und Mastdarm) ermöglichen
autonome Reflexe - über das kraniale System hauptsächlich für Mechano-
und Chemosensibilität, das spinale System vorwiegend betreffend
Temperatur / Gewebeverletzung / Schmerz. Die Afferenzen beeinflussen
endogene Rhythmen, Kreislauf und Atmung, Verdauung, Blasenmotorik,
Genitalreflexe, Hautdurchblutung, Pupillenweite, Akkommodation.
Autonome Efferenzen steuern glatte Muskulatur (Iris, Ziliarmuskel, Bronchien, Darmmuskulatur, Urogenitaltrakt), Herzmuskel und Drüsen
Afferenzen
aus Eingeweiden bringen sensorische Information zum ZNS und laufen über
zwei Stränge: Das kraniale System über Hirnnerven zum Hirnstamm, das
spinale System zum Rückenmark. Diese Afferenzen (Dehnung der Lunge, Blutgase, Blutvolumen und Blutdruck, Nahrung und Verdauungssystem, Füllung von Blase und Mastdarm) ermöglichen
autonome Reflexe - über das kraniale System hauptsächlich für Mechano-
und Chemosensibilität, das spinale System vorwiegend betreffend
Temperatur / Gewebeverletzung / Schmerz. Die Afferenzen beeinflussen
endogene Rhythmen, Kreislauf und Atmung, Verdauung, Blasenmotorik,
Genitalreflexe, Hautdurchblutung, Pupillenweite, Akkommodation.
Autonome Efferenzen steuern glatte Muskulatur (Iris, Ziliarmuskel, Bronchien, Darmmuskulatur, Urogenitaltrakt), Herzmuskel und Drüsen Limbisches
System und Hypothalamus steuern das autonome Nervensystem. Je nach
Funktionsmuster werden Teilsysteme antagonistisch oder synergistisch
aktiviert. Das Funktionsgleichgewicht
Sympathikus / Parasympathikus entspricht der Balance Ergotropie /
Trophotropie. Parasympathische Neuronengruppen liegen im Hirnstamm und im
Sakralmark (S2-4, kraniosakrales System), die prä- auf postganglionäre Umschaltung
erfolgt organnah. Sympathische Neuronengruppen liegen im Thorakal- und
Lumbalmark (T1 bis L3, thorakolumbales System), die Umschaltung erfolgt
im oder in der Nähe des Grenzstrang(s)
Limbisches
System und Hypothalamus steuern das autonome Nervensystem. Je nach
Funktionsmuster werden Teilsysteme antagonistisch oder synergistisch
aktiviert. Das Funktionsgleichgewicht
Sympathikus / Parasympathikus entspricht der Balance Ergotropie /
Trophotropie. Parasympathische Neuronengruppen liegen im Hirnstamm und im
Sakralmark (S2-4, kraniosakrales System), die prä- auf postganglionäre Umschaltung
erfolgt organnah. Sympathische Neuronengruppen liegen im Thorakal- und
Lumbalmark (T1 bis L3, thorakolumbales System), die Umschaltung erfolgt
im oder in der Nähe des Grenzstrang(s) Präganglionärer Transmitter ist generell Acetylcholin, die Rezeptoren nennt man nikotinisch. Die Wirkungen sind lokal begrenzt und von kurzer Dauer. Die
Divergenz prä- auf postganlionär reicht von 1:4
(Ziliarganglion: hohe Präzision) bis 1: mehrere hundert (Blutgefäße, Schweißdrüsen). In
den Ganglien erfolgt die Verrechnung zahlreicher Eingänge; postganglionäre Neuronen verteilen entsprechende Impulse auf die Peripherie. Varikositäten sezernieren via Ca++-Ionen, VAMPs und SNAPs den jeweiligen Transmitter zusammen mit Kotransmittern
in das umliegende Interstitium. Postsynaptisch- parasympathisches
Acetylcholin wirkt auf muskarinische (mit VIP, NO), sympathische auf
adrenerge Rezeptoren (mit NPY, ATP). Kotransmitter wirken langsam, aber
effektiv
Präganglionärer Transmitter ist generell Acetylcholin, die Rezeptoren nennt man nikotinisch. Die Wirkungen sind lokal begrenzt und von kurzer Dauer. Die
Divergenz prä- auf postganlionär reicht von 1:4
(Ziliarganglion: hohe Präzision) bis 1: mehrere hundert (Blutgefäße, Schweißdrüsen). In
den Ganglien erfolgt die Verrechnung zahlreicher Eingänge; postganglionäre Neuronen verteilen entsprechende Impulse auf die Peripherie. Varikositäten sezernieren via Ca++-Ionen, VAMPs und SNAPs den jeweiligen Transmitter zusammen mit Kotransmittern
in das umliegende Interstitium. Postsynaptisch- parasympathisches
Acetylcholin wirkt auf muskarinische (mit VIP, NO), sympathische auf
adrenerge Rezeptoren (mit NPY, ATP). Kotransmitter wirken langsam, aber
effektiv  Die Blasenmotorik wird vom autonomen System gesteuert. Der Sympathikus (lumbal) unterstützt die Dichtigkeit: Er fördert den Tonus des inneren Schließmuskels und entspannt die Blasenwand (geringer Füllungsdruck). Das pontine Kontinenzzentrum aktiviert über den Onuf'schen Kern im Rückenmark somatomotorische Fasern im N. pudendus und damit den äußeren Schließmuskel (hoher Ausstromwiderstand). Dehnungsrezeptoren in der Wand der Harnblase melden
steigenden Blasendruck an das pontine Miktionszentrum, bei Freigabe des
Detrusionsreflexes durch höhere Zentren wird die sympathische Aktivität
gehemmt, die parasympathische angeregt (Miktion)
Die Blasenmotorik wird vom autonomen System gesteuert. Der Sympathikus (lumbal) unterstützt die Dichtigkeit: Er fördert den Tonus des inneren Schließmuskels und entspannt die Blasenwand (geringer Füllungsdruck). Das pontine Kontinenzzentrum aktiviert über den Onuf'schen Kern im Rückenmark somatomotorische Fasern im N. pudendus und damit den äußeren Schließmuskel (hoher Ausstromwiderstand). Dehnungsrezeptoren in der Wand der Harnblase melden
steigenden Blasendruck an das pontine Miktionszentrum, bei Freigabe des
Detrusionsreflexes durch höhere Zentren wird die sympathische Aktivität
gehemmt, die parasympathische angeregt (Miktion)  Der
Sympathikustonus kann unterschiedlich abgeschätzt werden: Ableitung der
Aktivität sympathischer Efferenzen (MSNA, SSNA) , Noradrenalinspiegel
in Blut oder Harn,
Herzfrequenzvariabilität. Der Anstieg der Katecholaminspiegel im Blut
hängt von der Art der Belastung ab (psychische Belastung: NA um die
Hälfte, A
~2fach; Wechsel zu stehender Position: NA
~2fach, A um die Hälfte; körperliche Belastung NA
~4fach, A
~2fach; starke Hypoglykämie NA
~3fach, A
~20-fach; hämorrhagischer Schock NA
~8fach, A
~25fach).
Physischer Stress regt eher die noradrenerge (Sympathikus), psychischer
und metabolischer eher die adrenerge Achse an (Nebenniere)
Der
Sympathikustonus kann unterschiedlich abgeschätzt werden: Ableitung der
Aktivität sympathischer Efferenzen (MSNA, SSNA) , Noradrenalinspiegel
in Blut oder Harn,
Herzfrequenzvariabilität. Der Anstieg der Katecholaminspiegel im Blut
hängt von der Art der Belastung ab (psychische Belastung: NA um die
Hälfte, A
~2fach; Wechsel zu stehender Position: NA
~2fach, A um die Hälfte; körperliche Belastung NA
~4fach, A
~2fach; starke Hypoglykämie NA
~3fach, A
~20-fach; hämorrhagischer Schock NA
~8fach, A
~25fach).
Physischer Stress regt eher die noradrenerge (Sympathikus), psychischer
und metabolischer eher die adrenerge Achse an (Nebenniere) Der
Parasympathikus fördert Regenerationsprozesse und verwaltet spezielle
vegetative Reflexe. Er
schont Organe (respiratorische Säuberungsfunktion, Schutz der Augen),
spart Energie (Herzverlangsamung)
und wirkt anregend auf Verdauungssystem, Blase und Rektum.
Der
Parasympathikus fördert Regenerationsprozesse und verwaltet spezielle
vegetative Reflexe. Er
schont Organe (respiratorische Säuberungsfunktion, Schutz der Augen),
spart Energie (Herzverlangsamung)
und wirkt anregend auf Verdauungssystem, Blase und Rektum.
