




 Exokrines Pankreas
Exokrines Pankreas
 Azinus: acinus (lat) = Beere, Traube; Drüsenbeere
Azinus: acinus (lat) = Beere, Traube; Drüsenbeere| Bei
Verdauungsruhe sezerniert das Pankreas etwa 0,2 ml Sekret pro Minute,
bei Anregung (zephal, gastrisch, intestinal -
parasympathisch-reflektorisch und hormonell) kann die
Sekretionsleistung bis zu 20-fach ansteigen. Das Pankreassekret enthält Enzyme zur Spaltung von Eiweiß (Trypsinogen und Chomotrypsinogen als inaktive Vorstufe, Elastase etc), Fetten (Pankreaslipase - gallensaure Salze bilden Mizellen, in denen die Lipase volle Wirkung erlangt), Kohlenhydraten (Amylase) und Nukleinsäuren, sowie Bicarbonat (Pufferung des sauren Speisebreis aus dem Magen). Die Drüsenepithelzellen des Pankreas verfügen über Rezeptoren für Acetylcholin sowie für zahlreiche Hormone (Cholezystokinin, GRP, Insulin, Somatostatin, VIP). Besonders intensive Anregung der Enzymbildung erfolgt über Acetylcholin und CCK; Sekretin (Rezeptoren in Epithelzellen der Ausführungsgänge) stimuliert die Sekretion von Bicarbonat und die Bildung eines hohen Sekretvolumens. |
 Steuerung der azinären Sekretion
Steuerung der azinären Sekretion  Pankreatische Enzyme
Pankreatische Enzyme  Ausführungsgänge: Modifikation des Sekrets
Ausführungsgänge: Modifikation des Sekrets  Proteinverdauung
Proteinverdauung  Fettverdauung
Fettverdauung  Verdauungsphasen
Verdauungsphasen  Mukoviszidose, akute Pankreatitis
Mukoviszidose, akute Pankreatitis
 Core messages
Core messages ) einer erwachsenen Person bildet pro Tag gut einen Liter (0,7 - 3,0 l/d) plasmaisotones, alkalisches Sekret. Dieses Sekret besteht aus zwei Komponenten: Einer bicarbonatreichen (aqueous component),
welche den sauren Mageninhalt im Duodenum neutralisiert und vor allem
von Zellen des Gangsystems gebildet wird, und einer - weniger
voluminösen - enzymreichen Komponente (enzymatic / protein component), einem Produkt von Zellen der Azini.
) einer erwachsenen Person bildet pro Tag gut einen Liter (0,7 - 3,0 l/d) plasmaisotones, alkalisches Sekret. Dieses Sekret besteht aus zwei Komponenten: Einer bicarbonatreichen (aqueous component),
welche den sauren Mageninhalt im Duodenum neutralisiert und vor allem
von Zellen des Gangsystems gebildet wird, und einer - weniger
voluminösen - enzymreichen Komponente (enzymatic / protein component), einem Produkt von Zellen der Azini. 
 Abbildung: Organisation des Bauchspeicheldrüsengewebes
Abbildung: Organisation des Bauchspeicheldrüsengewebes
 "Hinter'm Magen liegt etwas ... und das ist das Pankreas" (alter Medizinerspruch)
"Hinter'm Magen liegt etwas ... und das ist das Pankreas" (alter Medizinerspruch) Die Ruhe (Basal-) sekretion beträgt ~5 ml/h (0,2 ml/min). Sie ist das Ergebnis einer Grundaktivität der Drüse (constitutive secretory pathway).
Während der interdigestiven Phase ist die Enzymsekretion am höchsten, wenn MMCs
auftreten.
Die Ruhe (Basal-) sekretion beträgt ~5 ml/h (0,2 ml/min). Sie ist das Ergebnis einer Grundaktivität der Drüse (constitutive secretory pathway).
Während der interdigestiven Phase ist die Enzymsekretion am höchsten, wenn MMCs
auftreten. Bei maximaler neurohumoraler Anregung
(regulated pathway - z.B. durch Sekretin) in der digestiven Phase steigt die Sekretion auf ~4 ml/min und mehr (bis zu 480 ml/h beschrieben, fast das Hundertfache des Basalwertes). Die
Zunahme der Sekretion beginnt 1-2 Minuten nach Anregung und dauert
~3
Stunden an.
Bei maximaler neurohumoraler Anregung
(regulated pathway - z.B. durch Sekretin) in der digestiven Phase steigt die Sekretion auf ~4 ml/min und mehr (bis zu 480 ml/h beschrieben, fast das Hundertfache des Basalwertes). Die
Zunahme der Sekretion beginnt 1-2 Minuten nach Anregung und dauert
~3
Stunden an.  Nach Einnahme einer Mahlzeit steigt der CCK-Spiegel im Blut innerhalb von 10-30 Minuten um das Fünf- bis Zehnfache an.
Nach Einnahme einer Mahlzeit steigt der CCK-Spiegel im Blut innerhalb von 10-30 Minuten um das Fünf- bis Zehnfache an. beginnt mit Transkription und Translation, gefolgt von Transfer in Zisternen des rauhen endoplasmatischen Retikulums, Überführung zum Golgi-Apparat, weiter zu Sekretionsvesikeln,
wo die Konzentrierung zu Zymogengranula erfolgt. Dies ist die
Speicherform, bevor die Granula durch Verschmelzung der Vesikelmembran
mit der apikalen Zellmembran lumenwärts sezerniert werden - der einzige
Schritt, der reizabhängig erfolgt.
beginnt mit Transkription und Translation, gefolgt von Transfer in Zisternen des rauhen endoplasmatischen Retikulums, Überführung zum Golgi-Apparat, weiter zu Sekretionsvesikeln,
wo die Konzentrierung zu Zymogengranula erfolgt. Dies ist die
Speicherform, bevor die Granula durch Verschmelzung der Vesikelmembran
mit der apikalen Zellmembran lumenwärts sezerniert werden - der einzige
Schritt, der reizabhängig erfolgt.  Abbildung), wobei der zytoplasmatische [Ca++] auch im Ruhezustand langsam oszilliert.
Abbildung), wobei der zytoplasmatische [Ca++] auch im Ruhezustand langsam oszilliert.
 Abbildung: Steuerung der Proteinsekretion azinärer Zellen im Pankreas
Abbildung: Steuerung der Proteinsekretion azinärer Zellen im Pankreas
 Abbildung zeigt die Wirkungsweise von VIP, Sekretin, CCK und Acetylcholin in Bezug auf die Anregung der Enzymproduktion azinärer Pankreaszellen. Der wichtigste Effektor in der Azinuszelle sind Proteinkinasen und Phosphatasen. Diese regen die Sekretion aus Vesikeln bzw. Zymogengranula in das Lumen an.
Abbildung zeigt die Wirkungsweise von VIP, Sekretin, CCK und Acetylcholin in Bezug auf die Anregung der Enzymproduktion azinärer Pankreaszellen. Der wichtigste Effektor in der Azinuszelle sind Proteinkinasen und Phosphatasen. Diese regen die Sekretion aus Vesikeln bzw. Zymogengranula in das Lumen an.  Die Sekretion von Pankreassaft wird angeregt durch
Die Sekretion von Pankreassaft wird angeregt durch parasympathische Aktivität (postganglionäre Fasern / Varikositäten → NO, Acetylcholin → enzymreiches Sekret)
parasympathische Aktivität (postganglionäre Fasern / Varikositäten → NO, Acetylcholin → enzymreiches Sekret) Sekretin,
dessen Produktion erst zu steigen beginnt (→ bicarbonatreiches Sekret), wenn der pH-Wert im Duodenum unter 4,5 absinkt (Ankuft sauren
Mageninhalts)
Sekretin,
dessen Produktion erst zu steigen beginnt (→ bicarbonatreiches Sekret), wenn der pH-Wert im Duodenum unter 4,5 absinkt (Ankuft sauren
Mageninhalts)  Cholecystokinin (→ enzymreiches Sekret)
Cholecystokinin (→ enzymreiches Sekret)| Ansäuerung des Duodenalinhalts steigert die Sekretin- und Pankreassaft-Produktion Sekretin erhöht die Bicarbonatkonzentration (und Pufferkapazität) des Pankreassekrets |
 Die Sekretion von Pankreassaft wird gehemmt durch
Die Sekretion von Pankreassaft wird gehemmt durch  sympathische Aktivität (Nn. splanchnici)
sympathische Aktivität (Nn. splanchnici) Somatostatin
Somatostatin Glucagon
Glucagon Pankreatisches Polypeptid (PP)
Pankreatisches Polypeptid (PP) Verzögerung der Magenentleerung
Verzögerung der Magenentleerung verstärkte Sekretion von Bicarbonat im Pankreas
verstärkte Sekretion von Bicarbonat im Pankreas verringerte Gastrinbildung im Magen
verringerte Gastrinbildung im Magen Alkalisierung der Galle in den Gallengängen
Alkalisierung der Galle in den Gallengängen
 Abbildung: Anregung der Kochsalzsekretion in Azinuszellen
Abbildung: Anregung der Kochsalzsekretion in Azinuszellen
 Abbildung). Überschüssiges Kalium verlässt die Zelle via
basolateraler Kaliumkanäle.
Abbildung). Überschüssiges Kalium verlässt die Zelle via
basolateraler Kaliumkanäle. 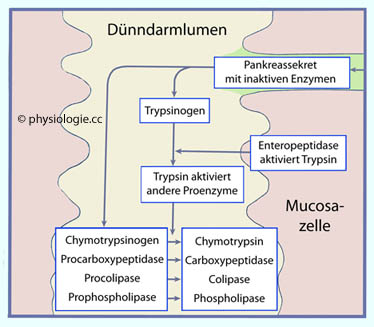
 Abbildung: Aktivierung pankreatischer Proenzyme
Abbildung: Aktivierung pankreatischer Proenzyme
| Pankreatische Enzyme werden - meist als inaktives Proenzym - exozytotisch freigesetzt |
 Proteolytische Enzyme, die als inaktive Vorstufe sezerniert werden (um das sezernierende Gewebe zu schützen) und durch
Enteropeptidase sowie Trypsin
Proteolytische Enzyme, die als inaktive Vorstufe sezerniert werden (um das sezernierende Gewebe zu schützen) und durch
Enteropeptidase sowie Trypsin  aktiviert werden: Trypsin, Chymotrypsin
aktiviert werden: Trypsin, Chymotrypsin  ,
Elastase, Carboxypeptidasen bzw. deren inaktive Vorstufen (Zymogene
,
Elastase, Carboxypeptidasen bzw. deren inaktive Vorstufen (Zymogene  ).
).  Trypsin greift an Peptidbindungen mit basischen Aminosäuren an
Trypsin greift an Peptidbindungen mit basischen Aminosäuren an Chymotrypsin greift an Peptidbindungen mit aromatischen Aminosäuren an (Leuzin, Glutamin, Methionin)
Chymotrypsin greift an Peptidbindungen mit aromatischen Aminosäuren an (Leuzin, Glutamin, Methionin) Elastase greift an Peptidbindungen mit neutralen aliphatischen Aminosäuren an
Elastase greift an Peptidbindungen mit neutralen aliphatischen Aminosäuren an  Carboxypeptidase A greift am C-terminalen Ende an aromatischen und neutralen aliphatischen Aminosäuren an
Carboxypeptidase A greift am C-terminalen Ende an aromatischen und neutralen aliphatischen Aminosäuren an Carboxypeptidase B greift am C-terminalen Ende an basischen Aminosäuren an
Carboxypeptidase B greift am C-terminalen Ende an basischen Aminosäuren an Kohlenhydratspaltende Enzyme: Die pankreatische α-Amylase
ist zu 94% homolog zur Speichelamylase; beide haben ein pH-Optimum nahe
dem Neutralpunkt und werden durch Chloridionen aktiviert. α-Amylase
spaltet Stärke und Glykogen (an der 1,4-Bindung) zu Maltose,
Maltotriose und Dextrinen. Die Produkte der Spaltung werden von Carbohydrasen im Bürstensaum der Enterozyten weiter abgebaut.
Kohlenhydratspaltende Enzyme: Die pankreatische α-Amylase
ist zu 94% homolog zur Speichelamylase; beide haben ein pH-Optimum nahe
dem Neutralpunkt und werden durch Chloridionen aktiviert. α-Amylase
spaltet Stärke und Glykogen (an der 1,4-Bindung) zu Maltose,
Maltotriose und Dextrinen. Die Produkte der Spaltung werden von Carbohydrasen im Bürstensaum der Enterozyten weiter abgebaut. Lipolytisch wirkende Enzyme (Lipasen: Pankreaslipase spaltet Triglyzeride in Monoglyzeride und Fettsäuren; Phospholipase A; Cholesterinesterase).
Lipolytisch wirkende Enzyme (Lipasen: Pankreaslipase spaltet Triglyzeride in Monoglyzeride und Fettsäuren; Phospholipase A; Cholesterinesterase). Nukleasen (DNAasen, RNAasen).
Nukleasen (DNAasen, RNAasen). Sonstige (Trypsininhibitoren: Schleimhautschutz), einige mit unklarer physiologischer Rolle (Glykoprotein
2: endozytoseregulierend? Lithostatin: lösungsstabilisierend, Verhinderung von Steinbildung?
Pankreatitis-assoziiertes Protein: bakteriostatisch?).
Inaktive Vorstufen bezeichnet man als Zymogene (Trypsinogene, Chymotrypsinogen, Proelastasen, Procarboxypeptidasen). Aktive Enzyme sind α-Amylase, Lipasen und Colipasen, Nukleasen (DNAase, RNAase).
Sonstige (Trypsininhibitoren: Schleimhautschutz), einige mit unklarer physiologischer Rolle (Glykoprotein
2: endozytoseregulierend? Lithostatin: lösungsstabilisierend, Verhinderung von Steinbildung?
Pankreatitis-assoziiertes Protein: bakteriostatisch?).
Inaktive Vorstufen bezeichnet man als Zymogene (Trypsinogene, Chymotrypsinogen, Proelastasen, Procarboxypeptidasen). Aktive Enzyme sind α-Amylase, Lipasen und Colipasen, Nukleasen (DNAase, RNAase).  Pankreatische Verdauungsenzyme (Auswahl)  = als inaktive Vorstufe (Zymogen) sezerniert = als inaktive Vorstufe (Zymogen) sezerniert |
|
| Enzym |
Funktion |
Trypsine 
|
Hydrolyse von Peptidbindungen (Arg / Lys) |
Chymotrypsine 
|
Hydrolyse von Peptidbindungen (Phe / Tyr / Trp) |
Elastase 
|
Hydrolyse aliphatischer Peptidbindungen |
Kallikrein 
|
Hydrolyse von Peptidbindungen (Arg / Lys) |
Carboxypeptidasen 
|
C-terminale Hydrolyse von Peptidbindungen |
Phospholipase 
|
Hydrolyse von Diazyl-Glyzero-Phosphocholinen |
| Pankreaslipase |
Hydrolyse von C1- und C3-Glyzerinesterbindungen |
| Colipasen | Cofaktor für Pankreaslipase |
| RNAasen |
Hydrolyse von RNA-Phosphatesterbindungen |
| DNAasen |
Hydrolyse von DNS-Phosphatesterbindungen (Typ I an 3'-, Typ II an 5'-Ende) |
| unspezifische Carboxylester-Lipase |
Hydrolyse aller Ester |
| Pankreas-α-Amylase |
Hydrolyse α-1,4-glykosidischer Bindungen |
 Die enge Verpackung zu Zymogengranula sowie selektive Sortierung der Enzyme minimiert ihre Aktivität
Die enge Verpackung zu Zymogengranula sowie selektive Sortierung der Enzyme minimiert ihre Aktivität
 Zymogengranula enthalten Inhibitoren
Zymogengranula enthalten Inhibitoren
 Kondensation sekretorischer Proteine limitiert enzymatische Aktivität
Kondensation sekretorischer Proteine limitiert enzymatische Aktivität
 Proteasen bauen Enzyme ab
Proteasen bauen Enzyme ab | Die apikale Membran der Ausführungsgangzelle sezerniert Bicarbonat im Austausch gegen Chlorid |
 Abbildung).
Abbildung).
 Abbildung: Bicarbonatsekretion im Ausführungsgang
Abbildung: Bicarbonatsekretion im Ausführungsgang

 Abbildung: Die Zusammensetzung des Pankreassafts hängt von der Sekretionsrate ab
Abbildung: Die Zusammensetzung des Pankreassafts hängt von der Sekretionsrate ab
 Mit
steigender Sekretmenge nimmt der Gehalt an Bicarbonat zu, der
Chloridanteil entsprechend ab
(die Konzentrationswerte der Kationen - Na, K - bleiben
konstant,
Mit
steigender Sekretmenge nimmt der Gehalt an Bicarbonat zu, der
Chloridanteil entsprechend ab
(die Konzentrationswerte der Kationen - Na, K - bleiben
konstant,  Abbildung). Der Grund könnte die Anregung der
Ausführungsgang-Epithelzellen zur Bicarbonatproduktion (
Abbildung). Der Grund könnte die Anregung der
Ausführungsgang-Epithelzellen zur Bicarbonatproduktion ( s. oben) sein:
s. oben) sein: 
 Abbildung oben). Der CFTR-Chloridtransporter bringt
Chloridionen in das Lumen, das entstehende negative Potential lockt
Natriumionen an, und der entstehende osmotische Effekt bringt Wasser
in das Sekret nach.
Abbildung oben). Der CFTR-Chloridtransporter bringt
Chloridionen in das Lumen, das entstehende negative Potential lockt
Natriumionen an, und der entstehende osmotische Effekt bringt Wasser
in das Sekret nach.| Volumen und Bicarbonatkonzentration des Pankreassaftes ändern sich gleichsinnig |
| Pankreassaft ist immer plasmaisoton |
 s. oben). Die membranständige Enterokinase (Enteropeptidase) im Duodenum spaltet aus Trypsinogen ein Peptid ab, wodurch Trypsin
(ein Gemisch aus drei Peptidasen) entsteht. Die Enteropeptidase spaltet Eiweißmoleküle, aktiviert seine eigene
Vorstufe (Selbstverstärkung) sowie auch alle anderen proteolytischen
Enzyme, wie z.B. Chymotrypsinogen zu Chymotrypsin (dieses hat milchgerinnende Wirkung).
s. oben). Die membranständige Enterokinase (Enteropeptidase) im Duodenum spaltet aus Trypsinogen ein Peptid ab, wodurch Trypsin
(ein Gemisch aus drei Peptidasen) entsteht. Die Enteropeptidase spaltet Eiweißmoleküle, aktiviert seine eigene
Vorstufe (Selbstverstärkung) sowie auch alle anderen proteolytischen
Enzyme, wie z.B. Chymotrypsinogen zu Chymotrypsin (dieses hat milchgerinnende Wirkung). Mechanismen zum Schutz azinärer Zellen vor Selbstverdauung  Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
|
| Protektiver Faktor |
Mechanismus |
| Sekretion als Zymogen |
fehlende enzymatische Aktivität |
| Selektive Sortierung in der Zelle, Einlagerung in Granlua |
Geringe Interaktion mit anderen zellulären Kompartimenten |
| Proteaseinhibitoren in Zymogengranula |
Blockieren frühzeitig aktivierte Enzyme |
| Kondensation sekretorischer Proteine bei niedrigem pH-Wert |
Limitiert Enzymaktivität |
| Nichtdigestive Proteasen |
bauen aktive Enzyme ab |

 Abbildung: Pankreas und Fettverdauung
Abbildung: Pankreas und Fettverdauung Fette werden
durch die Pankreaslipase
(Triglyzeridlipase)
abgebaut (
Fette werden
durch die Pankreaslipase
(Triglyzeridlipase)
abgebaut ( Abbildung). Diese wird erst durch leicht alkalischen pH
und die Anwesenheit eines zweiten - ebenfalls vom Pankreas produzierten und durch Trypsin aktivierten - Enzyms, der Colipase ("Colipase-Abhängigkeit"), sowie von Gallensalzen und Fettsäuren, vollständig
aktiviert.
Abbildung). Diese wird erst durch leicht alkalischen pH
und die Anwesenheit eines zweiten - ebenfalls vom Pankreas produzierten und durch Trypsin aktivierten - Enzyms, der Colipase ("Colipase-Abhängigkeit"), sowie von Gallensalzen und Fettsäuren, vollständig
aktiviert.  Sekretion im Pankreas: Drei Phasen  Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
|||
| Phase |
Anregung durch |
Regulation via |
Anteil an maximaler Enzym- sekretion |
| Zephal |
Anblick Geruch Geschmack Kauen |
Vagus |
~25% |
| Gastrisch |
Dehnung Gastrin (Peptide, Aminosäuren) |
Vagal-cholinerg |
10-20% |
| Intestinal |
Aminosäuren Fettsäuren H+ |
CCK Sekretin Entero- pankreatische Reflexe |
50-80% |
 Die zephale Phase
wird über den Vagusnerv mediiert (Wirkung auf Azinuszellen - atropinblockierbar), dauert kurz und steigert
die Bicarbonat- und Flüssigkeitssekretion auf
~25% des maximalen
Betrags. Angeregt wird sie durch sensorische Reize (Anblick, Geruch,
Geschmack, Kauen). Diese Phase kann bis zu 25% der maximalen
Enzymsekretion bewirken.
Die zephale Phase
wird über den Vagusnerv mediiert (Wirkung auf Azinuszellen - atropinblockierbar), dauert kurz und steigert
die Bicarbonat- und Flüssigkeitssekretion auf
~25% des maximalen
Betrags. Angeregt wird sie durch sensorische Reize (Anblick, Geruch,
Geschmack, Kauen). Diese Phase kann bis zu 25% der maximalen
Enzymsekretion bewirken.
 Abbildung: Zephale und gastrische Phase der Pankreasaktivität
Abbildung: Zephale und gastrische Phase der Pankreasaktivität
 Gastrale
(gastrische) Phase - Magendehnung löst zusammen mit dem Auftauchen sauren Mageninhalts im Duodenum sowie
Gastrinfreisetzung aus G-Zellen gastro-pankreatische Reflexe aus, welche eine geringe sekretorische Aktivität des Pankreas bewirken.
Gastrale
(gastrische) Phase - Magendehnung löst zusammen mit dem Auftauchen sauren Mageninhalts im Duodenum sowie
Gastrinfreisetzung aus G-Zellen gastro-pankreatische Reflexe aus, welche eine geringe sekretorische Aktivität des Pankreas bewirken.  Intestinale Phase, angeregt durch langkettige ([C]>8) Fettsäuren, hohe Konzentration an Wasserstoffionen, sowie Aminosäuren im Dünndarm. Diese Phase wirkt über
Intestinale Phase, angeregt durch langkettige ([C]>8) Fettsäuren, hohe Konzentration an Wasserstoffionen, sowie Aminosäuren im Dünndarm. Diese Phase wirkt über Sekretin
(angeregt durch niedrigen pH - 4,5 und darunter, ab pH
~3 keine weitere Steigerung der Bicarbonatproduktion),
Sekretin
(angeregt durch niedrigen pH - 4,5 und darunter, ab pH
~3 keine weitere Steigerung der Bicarbonatproduktion), Cholecystokinin (CCK - Sekretion pankreatischer Enzyme, früherer Name auch "Pankreozymin")
sowie
Cholecystokinin (CCK - Sekretion pankreatischer Enzyme, früherer Name auch "Pankreozymin")
sowie  entero-pankreatische Reflexe (vago-vagal, stimulieren vorwiegen Azinuszellen)
entero-pankreatische Reflexe (vago-vagal, stimulieren vorwiegen Azinuszellen)  Insgesamt steht die Aktivität des exokrinen Pankreas (und der Gallenblase) primär unter autonom-nervöser Kontrolle; in der intestinalen Phase der Verdauung hingegen wird sie primär durch die Wirkung von Sekretin und CCK angeregt. Sekretin
stimuliert in erster Linie die Sekretion bicarbonatreichen Saftes in
den Ausführungsgängen von Bauchspeicheldrüse und Gallengangssystem, CCK die
Enzymproduktion aus dem Pankreas (daher der alte Name
"Pankreozymin") und die Kontraktion der Gallenblase
("Cholecystokinin"). Alanin, Leuzin und Valin sind die Hauptauslöser
der CCK-Produktion.
Insgesamt steht die Aktivität des exokrinen Pankreas (und der Gallenblase) primär unter autonom-nervöser Kontrolle; in der intestinalen Phase der Verdauung hingegen wird sie primär durch die Wirkung von Sekretin und CCK angeregt. Sekretin
stimuliert in erster Linie die Sekretion bicarbonatreichen Saftes in
den Ausführungsgängen von Bauchspeicheldrüse und Gallengangssystem, CCK die
Enzymproduktion aus dem Pankreas (daher der alte Name
"Pankreozymin") und die Kontraktion der Gallenblase
("Cholecystokinin"). Alanin, Leuzin und Valin sind die Hauptauslöser
der CCK-Produktion.
 Abbildung: Intestinale Phase der Pankreasaktivität
Abbildung: Intestinale Phase der Pankreasaktivität
 CCK aus neuroendokrinen I-Zellen im Dünndarm (der
Plasma-CCK-Wert steigt auf das 5-10fache des Nüchtern-Ruhewertes) und
CCK aus neuroendokrinen I-Zellen im Dünndarm (der
Plasma-CCK-Wert steigt auf das 5-10fache des Nüchtern-Ruhewertes) und Acetylcholin
(aus parasympathischen Nervenfasern)
Acetylcholin
(aus parasympathischen Nervenfasern)  Insgesamt sind die stärksten Stimuli zur Anregung der Hormonsekretion der Dünndarmmucosa (Sekretin und CCK) und folglich der Sekretproduktion der Bauchspeicheldrüse niedriger pH-Wert und hoher Fettgehalt des Chymus. Dabei verstärkt CCK die Sekretinwirkung auf das Sekretvolumen.
Insgesamt sind die stärksten Stimuli zur Anregung der Hormonsekretion der Dünndarmmucosa (Sekretin und CCK) und folglich der Sekretproduktion der Bauchspeicheldrüse niedriger pH-Wert und hoher Fettgehalt des Chymus. Dabei verstärkt CCK die Sekretinwirkung auf das Sekretvolumen. 
 Abbildung: Von zystischer Fibrose betroffene Organe
Abbildung: Von zystischer Fibrose betroffene Organe s. oben). Bei zystischer Fibrose (Mukoviszidose
s. oben). Bei zystischer Fibrose (Mukoviszidose  ,
,  Abbildung),
die in der
Bevölkerung eine hohe Inzidenz (1:2000) aufweist, kommt es durch
Insuffizienz dieses Transportweges (exokrine Pankreasinsuffizienz) zu
Eindickung des Sekrets und Verstopfung der Ausführungsgänge. Gabe von
fettreicher Kost zusammen mit Verdauungsenzymen kann die Symptomatik
lindern.
Abbildung),
die in der
Bevölkerung eine hohe Inzidenz (1:2000) aufweist, kommt es durch
Insuffizienz dieses Transportweges (exokrine Pankreasinsuffizienz) zu
Eindickung des Sekrets und Verstopfung der Ausführungsgänge. Gabe von
fettreicher Kost zusammen mit Verdauungsenzymen kann die Symptomatik
lindern. Lungenfunktion s. dort,
Lungenfunktion s. dort,  Gallengänge s. dort,
Gallengänge s. dort,  Darm s. dort,
Darm s. dort,  Schweiß s. dort
Schweiß s. dort  Amylase spaltet Stärke, ein körperfremdes Kohlenhydrat; Lipase braucht für ihre Wirkung Cofaktoren aus der Galle. Auch Maltase, Ribo- und Desoxyribonuklease sind nicht gefährlich, sollten sie aus beschädigten Zellen austreten (Pankreatitis). Anders ist es bei Proteasen und Phospholipase A:
Diese können nicht zwischen körpereigenen Proteinen / Phospholipiden
und solchen aus der Nahrung unterscheiden und würden zu Selbstverdauung
führen, falls sie in das Pankreasgewebe austreten. Daher werden sie als
inaktive Vorstufe sezerniert (Trypsinogen, Chymotrypsinogen,
Proelastase, Proaminopeptidase, Prophospholipase A). Außerdem enthält
das Pankreassekret Trypsin-Inhibitor, der die Umwandlung von Trypsinogen zu Trypsin (das autokatalytisch sich selbst und andere Proteasen aktiviert) verhindert.
Amylase spaltet Stärke, ein körperfremdes Kohlenhydrat; Lipase braucht für ihre Wirkung Cofaktoren aus der Galle. Auch Maltase, Ribo- und Desoxyribonuklease sind nicht gefährlich, sollten sie aus beschädigten Zellen austreten (Pankreatitis). Anders ist es bei Proteasen und Phospholipase A:
Diese können nicht zwischen körpereigenen Proteinen / Phospholipiden
und solchen aus der Nahrung unterscheiden und würden zu Selbstverdauung
führen, falls sie in das Pankreasgewebe austreten. Daher werden sie als
inaktive Vorstufe sezerniert (Trypsinogen, Chymotrypsinogen,
Proelastase, Proaminopeptidase, Prophospholipase A). Außerdem enthält
das Pankreassekret Trypsin-Inhibitor, der die Umwandlung von Trypsinogen zu Trypsin (das autokatalytisch sich selbst und andere Proteasen aktiviert) verhindert. duodeni).
Symptome - wie
Fettstühle (Steatorrhoe) - treten erst auf, wenn ein großer Teil des Pankreas
(>80%) zerstört ist.
duodeni).
Symptome - wie
Fettstühle (Steatorrhoe) - treten erst auf, wenn ein großer Teil des Pankreas
(>80%) zerstört ist.

 Das Pankreas bildet 0,7-3 l/d plasmaisotones, alkalisches Sekret (Basalsekretion ~5 ml/h, bei maximaler Anregung bis 480 ml/h),
bestehend aus zwei Komponenten: Einer bicarbonatreichen aus dem
Gangsystem (Pufferung, Mizellenaufbau), und einer enzymreichen aus
Azinuszellen. Die basale
Bicarbonatproduktion beträgt 2-3% des digestiven Maximalwertes,
diejenige der Enzyme 10-15%. Myoepitheliale Zellen sind kontraktil und
stabilisieren die Azini während des Auspressens von Pankreassaft. Die
Zunahme der Sekretion beginnt 1-2 Minuten nach Anregung und dauert ~3
Stunden an. Die
Steuerungsmechanismen (neuronal und humoral) sind redundant angelegt:
Auch bei Ausfall eines der Systeme entspricht die Freisetzung von
Verdauungsenzymen dem Nahrungsangebot Das Pankreas bildet 0,7-3 l/d plasmaisotones, alkalisches Sekret (Basalsekretion ~5 ml/h, bei maximaler Anregung bis 480 ml/h),
bestehend aus zwei Komponenten: Einer bicarbonatreichen aus dem
Gangsystem (Pufferung, Mizellenaufbau), und einer enzymreichen aus
Azinuszellen. Die basale
Bicarbonatproduktion beträgt 2-3% des digestiven Maximalwertes,
diejenige der Enzyme 10-15%. Myoepitheliale Zellen sind kontraktil und
stabilisieren die Azini während des Auspressens von Pankreassaft. Die
Zunahme der Sekretion beginnt 1-2 Minuten nach Anregung und dauert ~3
Stunden an. Die
Steuerungsmechanismen (neuronal und humoral) sind redundant angelegt:
Auch bei Ausfall eines der Systeme entspricht die Freisetzung von
Verdauungsenzymen dem Nahrungsangebot Die anionische
Zusammensetzung des Pankreassafts hängt von der Bildungsrate ab: In
Ruhe überwiegt Chlorid, bei angeregter Sekretion Bicarbonat. Der Bicarbonatanteil des Basissekrets entspricht dem Blutplasma (~25 mM), bei Aktivierung steigt er bis ~120 mM (pH>8,0, Chlorid-Bicarbonat- Austauscher in der apikalen Membran der Ausführungsgangszellen). In die Zellen gelangtes Chlorid gelangt über apikale CFTR-Kanäle und Ca++-aktivierte Cl--Kanäle (ORCC) wieder in das Lumen. Das dadurch entstehende lumen-negative Potential treibt Na+ parazellulär lumenwärts. Volumen und Bicarbonatkonzentration des Pankreassaftes ändern sich gleichsinnig. Natriumbicarbonat im Sekret zieht Wasser osmotisch in das Lumen (Isotonie) Die anionische
Zusammensetzung des Pankreassafts hängt von der Bildungsrate ab: In
Ruhe überwiegt Chlorid, bei angeregter Sekretion Bicarbonat. Der Bicarbonatanteil des Basissekrets entspricht dem Blutplasma (~25 mM), bei Aktivierung steigt er bis ~120 mM (pH>8,0, Chlorid-Bicarbonat- Austauscher in der apikalen Membran der Ausführungsgangszellen). In die Zellen gelangtes Chlorid gelangt über apikale CFTR-Kanäle und Ca++-aktivierte Cl--Kanäle (ORCC) wieder in das Lumen. Das dadurch entstehende lumen-negative Potential treibt Na+ parazellulär lumenwärts. Volumen und Bicarbonatkonzentration des Pankreassaftes ändern sich gleichsinnig. Natriumbicarbonat im Sekret zieht Wasser osmotisch in das Lumen (Isotonie) Zymogengranula
in den Azinuszellen speichern Enzym-Vorstufen.
Die Vesikelmembran verschmilzt mit der apikalen Zellmembran
(Sekretion) reizabhängig: CCK und Acetylcholin → Phospholipase C → Proteinkinase C → Ca++-Einstrom aus endoplasmatischem Retikulum → Calmodulin → Proteinkinasen, Phosphatasen; Sekretin und VIP → Adenylylcyclase → Proteinkinase A. Saurer Duodenalinhalt (pH<4,5) steigert die Sekretinproduktion. Sekretin
verzögert die Magenentleerung, hemmt die Gastrinfreisetzung, stimuliert
die Bicarbonatsekretion in Pankreas- und Gallengängen. Gehemmt
wird die Sekretion von Pankreassaft durch sympathische Aktivität
(adrenerg), Somatostatin, Glucagon, pankreatisches Polypeptid. Die Ausführungsgänge produzieren - angeregt durch Sekretin - Muzine (Glykoproteine) und Proteoglykane (Schutz vor Selbstverdauung), protektiv wirken weiters die enge Verpackung zu Zymogengranula,
Inhibitoren in den Zymogengranula, Kondensation sekretorischer
Proteine, Proteasen (Enzymabbau) Zymogengranula
in den Azinuszellen speichern Enzym-Vorstufen.
Die Vesikelmembran verschmilzt mit der apikalen Zellmembran
(Sekretion) reizabhängig: CCK und Acetylcholin → Phospholipase C → Proteinkinase C → Ca++-Einstrom aus endoplasmatischem Retikulum → Calmodulin → Proteinkinasen, Phosphatasen; Sekretin und VIP → Adenylylcyclase → Proteinkinase A. Saurer Duodenalinhalt (pH<4,5) steigert die Sekretinproduktion. Sekretin
verzögert die Magenentleerung, hemmt die Gastrinfreisetzung, stimuliert
die Bicarbonatsekretion in Pankreas- und Gallengängen. Gehemmt
wird die Sekretion von Pankreassaft durch sympathische Aktivität
(adrenerg), Somatostatin, Glucagon, pankreatisches Polypeptid. Die Ausführungsgänge produzieren - angeregt durch Sekretin - Muzine (Glykoproteine) und Proteoglykane (Schutz vor Selbstverdauung), protektiv wirken weiters die enge Verpackung zu Zymogengranula,
Inhibitoren in den Zymogengranula, Kondensation sekretorischer
Proteine, Proteasen (Enzymabbau) Die relative Proteinsyntheserate des exokrinen Pankreas ist die höchste im Körper, ein
Liter Pankreassaft enthält bis zu 100 Gramm Enzymeiweiß. Die Enzyme wirken proteolytisch - Trypsin, Chymotrypsin , Elastase, Carboxypeptidasen werden als inaktives Proenzym (Zymogen) sezerniert und durch Enteropeptidase und Trypsin aktiviert -, spalten Kohlenhydrate (α-Amylase), Fette (Lipasen, Phospholipase A, Cholesterinesterase), Nukleinsäuren (DNAsen, RNAsen). Fette werden
emulgiert - teils mechanisch, teils durch die Oberflächenaktivität von
Gallensäuren -, es entstehen Mizellen, in denen die Triglyzeridlipase in leicht alkalischem Milieu und in Anwesenheit einer Colipase wirkt. Verbleibende
Mono- und Diglyzeride sowie Fettsäuren werden von der Mucosa
aufgenommen, wieder zu Triglyzeriden zusammengebaut und mit
Apoproteinen zu Chylomikronen verpackt. Diese gelangen über Lymphgefäße
in den Kreislauf Die relative Proteinsyntheserate des exokrinen Pankreas ist die höchste im Körper, ein
Liter Pankreassaft enthält bis zu 100 Gramm Enzymeiweiß. Die Enzyme wirken proteolytisch - Trypsin, Chymotrypsin , Elastase, Carboxypeptidasen werden als inaktives Proenzym (Zymogen) sezerniert und durch Enteropeptidase und Trypsin aktiviert -, spalten Kohlenhydrate (α-Amylase), Fette (Lipasen, Phospholipase A, Cholesterinesterase), Nukleinsäuren (DNAsen, RNAsen). Fette werden
emulgiert - teils mechanisch, teils durch die Oberflächenaktivität von
Gallensäuren -, es entstehen Mizellen, in denen die Triglyzeridlipase in leicht alkalischem Milieu und in Anwesenheit einer Colipase wirkt. Verbleibende
Mono- und Diglyzeride sowie Fettsäuren werden von der Mucosa
aufgenommen, wieder zu Triglyzeriden zusammengebaut und mit
Apoproteinen zu Chylomikronen verpackt. Diese gelangen über Lymphgefäße
in den Kreislauf Die Aktivität des exokrinen Pankreas wird in drei Phasen eingeteilt: Die zephale
Phase (mediiert über den Vagusnerv) dauert kurz und steigert die
Bicarbonat- und Flüssigkeitssekretion auf ~25% des maximalen Betrags;
die gastrische Phase (gastro-pankreatische Reflexe, Gastrinfreisetzung - höchstens ~20% der maximalen Sekretion); und die intestinale
Phase, angeregt durch langkettige Fettsäuren, niedrigen pH (<4,5)
sowie Aminosäuren im Dünndarm, angeregt über entero-pankreatische
Reflexe sowie Sekretin und CCK. Je länger die Dünndarmstrecke,
an der ein niedriger pH-Wert herrscht, desto mehr S-Zellen werden
stimuliert und umso stärker ist die Sekretinproduktion. Die
Aktivität von Pankreas und Gallenblase steht interdigestiv unter
autonom-nervöser Kontrolle, in der intestinalen Phase wird sie primär
durch Sekretin und CCK angeregt Die Aktivität des exokrinen Pankreas wird in drei Phasen eingeteilt: Die zephale
Phase (mediiert über den Vagusnerv) dauert kurz und steigert die
Bicarbonat- und Flüssigkeitssekretion auf ~25% des maximalen Betrags;
die gastrische Phase (gastro-pankreatische Reflexe, Gastrinfreisetzung - höchstens ~20% der maximalen Sekretion); und die intestinale
Phase, angeregt durch langkettige Fettsäuren, niedrigen pH (<4,5)
sowie Aminosäuren im Dünndarm, angeregt über entero-pankreatische
Reflexe sowie Sekretin und CCK. Je länger die Dünndarmstrecke,
an der ein niedriger pH-Wert herrscht, desto mehr S-Zellen werden
stimuliert und umso stärker ist die Sekretinproduktion. Die
Aktivität von Pankreas und Gallenblase steht interdigestiv unter
autonom-nervöser Kontrolle, in der intestinalen Phase wird sie primär
durch Sekretin und CCK angeregt |
