Was bedeutet pH?  Säurewirkung
Säurewirkung  Intrazellulärer pH
Intrazellulärer pH  Pufferbasen
Pufferbasen  Blutgasanalyse
Blutgasanalyse  Bicarbonat-pH-Diagramm
Bicarbonat-pH-Diagramm  Puffergleichung
Puffergleichung  Niere und pH-Regulation
Niere und pH-Regulation  Störungen
Störungen  Kompensationsmechanismen
Kompensationsmechanismen

pH  Nichtflüchtige Säuren
Nichtflüchtige Säuren  Titrierbare Säuren
Titrierbare Säuren  Puffer
Puffer  Pufferkapazität
Pufferkapazität  pK-Wert
pK-Wert  Standardbicarbonat
Standardbicarbonat  Anionenlücke
Anionenlücke
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
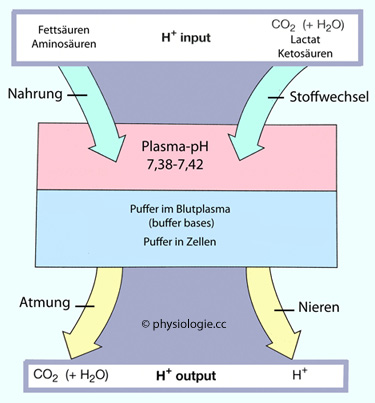
 Abbildung:
Abbildung: Vereinfachtes Schema des H
+-Haushalts
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Oben:
Wasserstoffionen werden dem Organismus in verschiedener Form zugeführt:
Von außen (mit der Nahrung) sind es vor allem Aminosäuren und
Fettsäuren, von innen (aus dem körpereigenen Stoffwechsel) Kohlensäure
(bzw. CO2), Lactat, manchmal auch Ketosäuren (Hungerzustand).
Mitte:
Im Blutplasma beträgt der pH-Wert zwischen 7,38 und 7,42 - das Blut ist
leicht alkalisch, denn es enthält "Blutpuffer": Bicarbonat, Eiweiße,
Phosphat. Der pH-Bereich von 7,38-7,42 entspricht einer
Konzentrationsspanne von Wasserstoffionen zwischen rund 42 und 38
nM, also von rund 10%. Oft wird die physiologische Bandbreite (jeweils
für Bedingungen körperlicher Ruhe) zwischen 7,3 und 7,5 definiert, was
einer Bandbreite der [H+] von knapp 50% entspricht (s. auch dort).
Unten: Die Atmung entfernt den allergrößten Teil (99,5%, ~15.000 mmol/d) saurer Valenzen über die Atmung (via CO2). Die Nieren scheiden pro Tag ~70 mmol saure Valenzen aus (~40 mmol Ammonium, ~30 mmol titrierbare Säure)
 Die Protonenkonzentration [H+]
an verschiedenen Stellen des Körpers wirkt sich empfindlich auf biochemische / physiologische Systeme aus,
und ihre Stabilisierung ist von großer Bedeutung für das normale
Funktionieren von Stoffwechsel und Lebensvorgängen - vor allem, weil Enzyme nur in einem engen pH-Bereich optimal funktionieren und Proteine bei starken pH-Abweichungen denaturiert werden können.
Die Protonenkonzentration [H+]
an verschiedenen Stellen des Körpers wirkt sich empfindlich auf biochemische / physiologische Systeme aus,
und ihre Stabilisierung ist von großer Bedeutung für das normale
Funktionieren von Stoffwechsel und Lebensvorgängen - vor allem, weil Enzyme nur in einem engen pH-Bereich optimal funktionieren und Proteine bei starken pH-Abweichungen denaturiert werden können.
Da sich die Protonenkonzentration ([H+]) von Körperflüssigkeiten - ein physiologisch entscheidender Wert - um mehrere Zehnerpotenzen unterscheiden kann (beispielsweise hat Magensäure eine [H+] von 10-1 bis 10-3 M, Blut 10-7,4 M, Pankreassekret ca. 10-9 M,  Abbildung unten), hat es sich bewährt, statt der molaren Konzentration ihre Hochzahl (=dekadischen Logarithmus) anzugeben und das
Minuszeichen wegzulassen. Das vereinfacht die Angabe (z.B. heißt es statt "10-7,4
mol/l Wasserstoffionenkonzentration" einfach pH = 7,4). Je höher [H+] (je saurer), desto geringer die negative Hochzahl und desto niedriger der pH-Wert.
Abbildung unten), hat es sich bewährt, statt der molaren Konzentration ihre Hochzahl (=dekadischen Logarithmus) anzugeben und das
Minuszeichen wegzulassen. Das vereinfacht die Angabe (z.B. heißt es statt "10-7,4
mol/l Wasserstoffionenkonzentration" einfach pH = 7,4). Je höher [H+] (je saurer), desto geringer die negative Hochzahl und desto niedriger der pH-Wert.
 Der pH-Wert - pH steht für potentia (Hochzahl) Hydrogenii (gemeint sind Wasserstoffionen) -
ist der negative dekadische Logarithmus der molaren
Wasserstoffionenkonzentration in der betreffenden wässrigen Lösung. Beispielsweise bedeutet ein pH von 7,4 (normaler pH-Wert des Blutes) eine Wasserstoffionenkonzentration von 10-7,4 mol/l (40 nM).
Der pH-Wert - pH steht für potentia (Hochzahl) Hydrogenii (gemeint sind Wasserstoffionen) -
ist der negative dekadische Logarithmus der molaren
Wasserstoffionenkonzentration in der betreffenden wässrigen Lösung. Beispielsweise bedeutet ein pH von 7,4 (normaler pH-Wert des Blutes) eine Wasserstoffionenkonzentration von 10-7,4 mol/l (40 nM).
Neutral ist eine wässrige Lösung, in der die Konzentration von Wasserstoffionen ([H+]) gleich groß ist wie die Konzentrationen von Hydroxylionen ([OH-]). Das ist in reinem Wasser immer der Fall, da jedes H2O-Molekül in nichts anderes als H+ und in OH- dissoziieren kann (und wieder zu H2O rekombiniert).
Das Ausmaß der Dissoziation von Wasser ist temperaturabhängig. Je wärmer, desto intensiver die Dissoziation, und desto höher die (jeweils gleich hohe) Konzentration von Wasserstoffionen (H+) und Hydroxylionen (OH-). [H+] und [OH-] betragen nur bei 25°C 10-7,0 (und der pH-Wert 7,0). Steigt die Temperatur, nimmt sowohl [H+] als auch [OH-] - und damit die molare Konzentration - zu, z.B. bei Körpertemperatur (37°C) auf 10-6,8 mol/l (158 nM). Im Vergleich zu 25°C ist bei Neutralität ([H+] = [OH-]) die molare Konzentration von H+ und OH- etwa 4-mal höher (158 statt 40 nM), der pH-Wert um 0,2 niedriger (6,8 statt 7,0).
 Ein pH-Wert von 7,0 bedeutet daher nur bei einer Temperatur von 25°C Neutralität der betreffenden wässrigen Lösung; bei 37°C beträgt der Neutral-pH 6,8 (bei ungefähr 4-fach höherer Konzentration der H+- und OH--Ionen im Vergleich zu 25°C).
Ein pH-Wert von 7,0 bedeutet daher nur bei einer Temperatur von 25°C Neutralität der betreffenden wässrigen Lösung; bei 37°C beträgt der Neutral-pH 6,8 (bei ungefähr 4-fach höherer Konzentration der H+- und OH--Ionen im Vergleich zu 25°C).
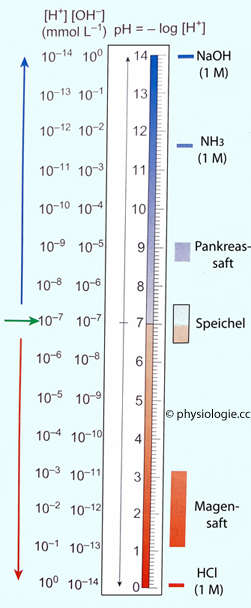
 Abbildung: pH-Skala
Abbildung: pH-Skala
Nach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal Physiology - An Environmental Perspective, Oxford University Press 2021
Molare Konzentration (M = mol/l) von Wasserstoffionen ([H+]) und Hydroxylionen ([OH-]) beim entsprechenden pH-Wert bei 25°C.
Mit steigender Konzentration an Wasserstoffionen sinkt diejenige von OH-Ionen und umgekehrt, das Produkt [H+] x [OH-] beträgt (bei 25°C) in jedem Fall 10-14.
Magensaft weist einen pH-Wert zwischen 1 und 3 auf (hohe Konzentration an
Salzsäure), Speichel zwischen 6,5 und 7,5 (ungefähr im Neutralbereich), Pankreassekret von etwa 9
(hoher Anteil an Bicarbonat). Blut hat (bei körperlicher Ruhe und 37°C) einen pH-Wert von 7,35 bis 7,45, ist also (wegen der
Anwesenheit von sogenannten Pufferbasen) leicht alkalisch.
Reines Wasser hat bei 25°C einen pH-Wert von 7,0 (grüner Pfeil), es ist "neutral". Der Neutralwert ist der pH-Wert bei [H+] = [OH-] und wird mit dem Kürzel pN bezeichnet. Bei Temperaturen >25°C liegt der pN-Wert unter, bei solchen <25°C
über 7,0; bei 37°C beträgt er 6,8. Hat also eine Flüssigkeit bei
Körpertemperatur einen pH von 7,0, ist sie nicht neutral, sondern
leicht alkalisch.
Für eine neutrale Lösung ([H+] = [OH-]) gilt [pH - pN] = 0, für eine saure ([H+] > [OH-]) gilt [pH - pN] < 0, und für eine alkalische ([H+] < [OH-]) gilt [pH - pN] > 0. Der Vorteil der so definierten relativen Alkalinität / Azidität: Sie ist unabhängig von der Temperatur
 Der
pH-Wert in den Zellen beträgt - bis auf wenige Ausnahmen - etwa 7,1
(6,9-7,2), er kann mit dem intrazellulären Kompartiment stark variieren (je nach Organelle zwischen 4,5 und 8,0). Extrazellulär (außerhalb der Zellen) ist sein
Betrag etwas höher - im Blut
7,4 (geringere H+-Konzentration als intrazellulär). Der physiologische Bereich des Blut-pH-Wertes beginnt bei etwa 6,9 (dieser Wert
kann kurzfristig bei extremer körperlicher Belastung auftreten). Bei
körperlicher Ruhe liegt er etwa zwischen 7,3 und 7,5 (ab Werten
dauerhaft unter 7,2 oder über 7,55 treten gravierende Probleme auf).
Werte unter 6,9 (entsprechend [H+] = 126 nM) oder über 7,8 (entsprechend [H+] = 16
nM) sind mit dem Leben nicht vereinbar (126 ist immerhin fast das 8-fache von 16).
Der
pH-Wert in den Zellen beträgt - bis auf wenige Ausnahmen - etwa 7,1
(6,9-7,2), er kann mit dem intrazellulären Kompartiment stark variieren (je nach Organelle zwischen 4,5 und 8,0). Extrazellulär (außerhalb der Zellen) ist sein
Betrag etwas höher - im Blut
7,4 (geringere H+-Konzentration als intrazellulär). Der physiologische Bereich des Blut-pH-Wertes beginnt bei etwa 6,9 (dieser Wert
kann kurzfristig bei extremer körperlicher Belastung auftreten). Bei
körperlicher Ruhe liegt er etwa zwischen 7,3 und 7,5 (ab Werten
dauerhaft unter 7,2 oder über 7,55 treten gravierende Probleme auf).
Werte unter 6,9 (entsprechend [H+] = 126 nM) oder über 7,8 (entsprechend [H+] = 16
nM) sind mit dem Leben nicht vereinbar (126 ist immerhin fast das 8-fache von 16).
Bei
Blut-pH-Werten von unter 7,35 spricht man von einer "Azidose", obwohl
der Neutralpunkt (pN) bei Körpertemperatur bei 6,8
liegt (klinisch-chemische
Blutgasanalysen werden üblicherweise bei 37°C durchgeführt). Demnach ist eine Körperflüssigkeit,
die bei 37°C einen pH-Wert von 6,9 hat, nicht sauer ([H+] > [OH-]), sondern leicht
alkalisch ([H+] < [OH-]).
Säuren sind Protonenlieferanten
Beim Verzehr einer typischen westlichen Diät werden dem Körper täglich etwa 70 mM (0,8-1,0 mEq/kg/d) Wasserstoffionen zugeführt - mehr als basische Valenzen, wie Bicarbonat (HCO3-).
Das Essen, dass die meisten von uns zu sich nehmen, ist also - wie man
sagt - säureüberschüssig. Was bedeutet dieser "Säureüberschuss"?
Dazu ist wichtig zu verstehen, was der Körper aus den aufgenommenen Nahrungsstoffen macht: Kohlenhydrate und Fette (~85% aller Kalorien) werden zum Großteil zu Wasser und CO2 - dem Anhydrid der Kohlensäure - metabolisiert. Der pCO2 des Extrazellulärraums wird über die Atemregulation stabilisiert, überschüssiges (neu entstandenes) CO2 verlässt den Körper prompt über die Atmung (ca. 15.000 mM pro 24 Stunden) -
er wird von dem "Säureüberschuss" der Nahrung über die Respiration
automatisch wieder befreit. Nur die vergleichsweise winzige Menge an
entstehenden nicht-CO2-Valenzen (70 mM/d - also weniger als 0,5% der insgesamt gebildeten Säurevalenzen: "nichtflüchtige Säure") muss über andere Routen - ganz überwiegend über den Harn - ausgeschieden werden, um das pH-Gleichgewicht des Körpers zu wahren.
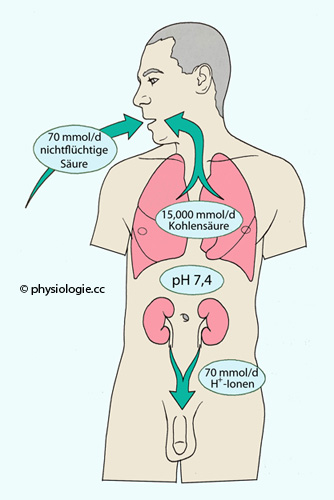
 Abbildung: Tägliche Aufnahme und Ausscheidung saurer Valenzen
Abbildung: Tägliche Aufnahme und Ausscheidung saurer Valenzen
Nach einer Vorlage in Danzinger / Zeidel / Parker:
Renal Physiology - A Clinical Approach. Wolters Kluwer / Lippincott
Williams & Wilkins 2012
Für eine ausgeglichene Säurebilanz muss der
Input (Aufnahme und Produktion) gleich dem Output (Ausscheidung) an
sauren Valenzen sein. Über die Nahrung werden in 24 Stunden ~70 mmol
nichtflüchtige saure (Nicht-Kohlensäure-) Valenzen �aufgenommen
(hauptsächlich Sulfat aus dem Proteinabbau: Cystein, Methionin); die Nieren scheiden etwa 70 mmol (ebenfalls nichtflüchtige)
saure Valenzen mit dem Harn aus.
Mehr als 200-mal so viele saure Valenzen entstehen im katabolen
Stoffwechsel in der Form von Kohlensäure, die in Form ihres Anhydrids
(CO2) abgeatmet wird. Die Atmung entfernt so bei weitem die größte Säuremenge aus dem Körper
 Der allergrößte Teil der im Stoffwechsel auftauchenden sauren Valenzen wird in Form von CO2 abgeatmet
(
Der allergrößte Teil der im Stoffwechsel auftauchenden sauren Valenzen wird in Form von CO2 abgeatmet
( Abbildung) und verliert dadurch seinen pH-Effekt.
Abbildung) und verliert dadurch seinen pH-Effekt.
Tatsächlich kann saure Nahrung
basisch wirken: Bezüglich der Säurewirkung von Speisen und Getränken kommt es nicht auf deren pH-Wert an, sondern darauf, was im Stoffwechsel daraus entsteht - das Endprodukt CO2 verschwindet laufend aus dem System. So hat etwa Orangenjuice einen niedrigen pH (~4.0), aber die daraus entstehenden Metabolisierungsprodukte (vor allem Bicarbonat) wirken als Pufferbasen.
Sämtliche Stoffwechselschritte im Körper haben jeweils einen der drei folgenden Effekte:

Sie
produzieren H+ (als Abfallprodukt) →
Säurebildung (Bicarbonatverbrauch, gesenkter Pufferbasenwert). Beispiel: Glucose → Laktat, Zystin → Sulfat

oder


Sie
verbrauchen H+ (als Reaktionspartner) →
Basenbildung (Bicarbonatzuwachs, gesteigerter Pufferbasenwert). Beispiel: Laktat → Glucose, Citrat → CO
2

oder



Keines von beiden (
pH-neutral). Beispiel: Triglyzeride, Zucker → CO
2 (wird abgeatmet und verlässt den Körper)
Genauer aufgeschlüsselt erbibt sich ein aus fünf Reaktionstypen aufgebautes Bild::
Substrat
|
Produkt
|
Säure-Basen-
Effekt
|
organische Kationen
|
neutrale Moleküle
|
Protonen freigesetzt
|
schwefelhältige Aminosäuren
|
Schwefelsäure
|
Protonen freigesetzt |
neutrale Moleküle
|
organische Säuren
|
Protonen freigesetzt |
organische Anionen
|
neutrale Moleküle
|
Protonen verbraucht
|
neutrale Moleküle
|
neutrale Moleküle
|
kein Effekt
|
Nach dieser Einteilung setzen drei Reaktionstypen Wasserstoffionen frei
(und konsumieren Bicarbonat), einer konsumiert sie (und produziert
Bicarbonat). Ein Beispiel für den ersten Typ ist die Verwandlung von
Ammonium zu Harnstoff in der Leber (Harnstoffzyklus), für den 2. Typ
der Abbau von schwefelhaltigen Aminosäuren zwecks Energiegewinnung, für
den 3. Typ der Abbau von Kohlenhydraten oder Fetten. Ein organisches
Anion ist z.B. Acetoacetat, sein Abbau verbraucht ein Proton (es
entsteht CO2); und der 5. Typ ist z.B. beim Abbau von Glucose gegeben.
Ob
Nahrungen / Getränke "säureüberschüssig" wirken oder nicht, hängt vor allem vom pH-Wert ihrer Stoffwechselprodukte ab
Saure Valenzen werden vorwiegend als CO2 abgeatmet
|
Wasserstoffionen (H+, Atommasse 1) kommen im Körper millionenfach seltener vor als Bicarbonat (HCO3-), sind aber dennoch bedeutsam, z.B. im Rahmen des Energiestoffwechsels (Regenerierung von ATP durch gekoppelte oxidative Phosphorylierung): Wasserstoff- und Phosphationen betreten Mitochondrien über einen Symporter, und H+
wird zur Oxidation von NADH verwendet. Das stellt den ersten Schritt
für die Elektronen-Transportkette im Mitochondrium dar, an deren Ende
Zytochrom B die Energie zum Hinauspumpen von H+ aus der Mitochondienmatrix liefert. Die im mitochondrialen Spaltraum angereicherten Wasserstoffionen treiben schließlich die H+-ATP-Synthase zur ATP-Neubildung an.
Die H+-Konzentration liegt im Organismus im nanomolaren Bereich (in Blut 10-7,4 Mol, entsprechend ~40 nM).
Sie wird in fast allen Kompartimenten des Körpers niedrig gehalten, da
Protonen eifrig mit Histidinresten in Proteinen reagieren und diese
positiv aufladen, was ihre Gestalt und Funktion verändern kann. Weil
Proteine wichtige Funktionsträger sind
(Transporter, Enzyme, Strukturelemente..), wäre dies rasch
lebensbedrohlich. Die Wasserstoffionenkonzentration im intrazellulären
Raum beträgt im Mittel ~80 nM,
liegt also rund doppelt so hoch wie im Blut; dementsprechend ist der
pH-Wert geringer, im Mittel bei 7,1 (das liegt über dem
Neutralwert von 6,8 bei 37°C, vgl. oben).
Vergleicht man diese Zahlen mit dem täglichen Umsatz des Körpers (etwa 15 Milliarden nmol H+/d),
wird klar, wie intensiv der Protonenstoffwechsel im Organismus ist. Das
wird an folgendem Beispiel klar: Das (zu 80% aus Intrazellulärvolumen
bestehende) Gehirn (~1,5 kg) enthält nur einige Gramm ATP (molare Masse
~700, Konzentration ~5 mM). Die zerebrale ATP-Synthese erreicht
hingegen fast 20 kg/d - Adenosintriphosphat wird im Gehirn in 24
Stunden mehrere tausend mal umgesetzt.
 Als nichtflüchtige Säuren (nonvolatile / metabolic / fixed acids) bezeichnet man im Körper gebildete Säuren, die nicht als CO2
mit der Atmung ausgeschieden werden können (Sulfat, Phosphat,
organische Säuren). Der Organismus kann auch nichtflüchtige Basen
erzeugen, die dann als Bicarbonat anfallen.
Als nichtflüchtige Säuren (nonvolatile / metabolic / fixed acids) bezeichnet man im Körper gebildete Säuren, die nicht als CO2
mit der Atmung ausgeschieden werden können (Sulfat, Phosphat,
organische Säuren). Der Organismus kann auch nichtflüchtige Basen
erzeugen, die dann als Bicarbonat anfallen.
Normalerweise stammen die
meisten nichtflüchtigen sauren Valenzen des Metabolismus aus dem Eiweißabbau (besonders
bei katabolen Patienten, die wenig Nahrung aufnehmen und körpereigenes
Protein für ihren Energiestoffwechsel verwenden). Früchte und Gemüse
hingegen liefern bei ihrer Verstoffwechslung eher basische Valenzen
(Bicarbonat).
 So wirken "saure" Fruchtgetränke, die reichlich Citrat, Laktat usw. enthalten, alkalisierend und steigern den Harn-pH.
So wirken "saure" Fruchtgetränke, die reichlich Citrat, Laktat usw. enthalten, alkalisierend und steigern den Harn-pH.
Ein 70 kg schwerer Mensch unter typischer Kost produziert netto (d.h. saure minus basische
Valenzen) etwa 40 mmol
nichtflüchtige saure Valenzen pro 24 Stunden. Der Großteil der metabolisch  generierten sauren Valenzen (rund 15.000 mmol/d,
generierten sauren Valenzen (rund 15.000 mmol/d,  Abbildung) fällt als CO2 aus dem Abbau neutraler Kohlenhydrate und Fette sowie der meisten neutralen Aminosäuren an - das ist mehr als das 100-fache der im Körper gelösten CO2-Menge. CO2 wird
ausgeatmet und belastet den
Säure-Basen-Haushalt bzw. die Pufferfähigkeit des Blutes überhaupt
nicht.
Abbildung) fällt als CO2 aus dem Abbau neutraler Kohlenhydrate und Fette sowie der meisten neutralen Aminosäuren an - das ist mehr als das 100-fache der im Körper gelösten CO2-Menge. CO2 wird
ausgeatmet und belastet den
Säure-Basen-Haushalt bzw. die Pufferfähigkeit des Blutes überhaupt
nicht.
| Die Atmung ist der bei weitem wichtigste Mechanismus der Säureausscheidung
|
Lediglich Ammoniumionen (NH+) und "titrierbare"  Säure - das ist die durch Rücktitration des Harns mit NaOH bestimmbare Säuremenge (Phosphat, Harnsäure, Kreatinin..) - müssen renal
ausgeschieden werden (
Säure - das ist die durch Rücktitration des Harns mit NaOH bestimmbare Säuremenge (Phosphat, Harnsäure, Kreatinin..) - müssen renal
ausgeschieden werden ( Abbildung: ~70 mmol/d) - rund 1 mmol / kg Körpergewicht / Tag oder ~0,5% der gesamten
Säureausscheidung (~99,5% erfolgen über die Armung). Zur Gesamtbilanz des Körpers kommt noch, dass mit dem Stuhl pro Tag typischerweise ~10 mmol basische Valenzen (OH-) verloren gehen (das bedeutet für den Organismus eine zusätzliche Säurelast von 10 mmol/d).
Abbildung: ~70 mmol/d) - rund 1 mmol / kg Körpergewicht / Tag oder ~0,5% der gesamten
Säureausscheidung (~99,5% erfolgen über die Armung). Zur Gesamtbilanz des Körpers kommt noch, dass mit dem Stuhl pro Tag typischerweise ~10 mmol basische Valenzen (OH-) verloren gehen (das bedeutet für den Organismus eine zusätzliche Säurelast von 10 mmol/d).

 Abbildung: Säure-Basen-Bilanz einer 70 kg schweren Person auf westlicher Standarddiät
Abbildung: Säure-Basen-Bilanz einer 70 kg schweren Person auf westlicher Standarddiät
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 1st ed. Saunders 2003
Etwa
70 mmol "nichtflüchtige" Säuren scheidet die Niere täglich aus - ~40 mmol
als Ammoniumionen, ~30 mmol als "titrierbare" Säure (Schwefel-,
Phorphorsäure u.a.).
Für die
Säure-Basen-Bilanz ist nicht entscheidend, wie viel Säure
mit Essen und Trinken aufgenommen wird ("säureüberschüssige Kost"),
sondern was der Metabolismus aus den resorbierten Stoffen macht, d.h.
die Gesamtbilanz im Stoffwechsel.
Die bei weitem intensivste Säureausscheidung erfolgt - als Kohlendioxid - über die Atmung (hier: 15.000 mmol/d)
Diese "nichtflüchtigen" Säuren entstehen bei
 Abbau
phosphorhaltiger Stoffe (Nukleinsäuren)
Abbau
phosphorhaltiger Stoffe (Nukleinsäuren)
 unvollständiger
Oxidation von Kohlenhydraten und Fetten (Laktat, Ketosäuren)
unvollständiger
Oxidation von Kohlenhydraten und Fetten (Laktat, Ketosäuren)
 Oxidation schwefelhaltiger (Zystin, Methionin - Ausscheidung von Sulfat) oder kationischer (wie Lysin, Arginin) Aminosäuren
Oxidation schwefelhaltiger (Zystin, Methionin - Ausscheidung von Sulfat) oder kationischer (wie Lysin, Arginin) Aminosäuren
und werden mit dem Harn ausgeschieden:
 ~40 mmol/d als Ammonium (aus Glutamin), das als Kation nicht mehr rückresorbiert und damit ausgeschieden wird (ion trapping - besonders bei Azidose
~40 mmol/d als Ammonium (aus Glutamin), das als Kation nicht mehr rückresorbiert und damit ausgeschieden wird (ion trapping - besonders bei Azidose ), und
), und
 bis zu ~30 mmol/d als "titrierbare Säure" - Phosphat (~80%), Harnsäure (~20%), andere organische Säuren, Sulfat (Harn-pH bis 4,7).
bis zu ~30 mmol/d als "titrierbare Säure" - Phosphat (~80%), Harnsäure (~20%), andere organische Säuren, Sulfat (Harn-pH bis 4,7).

 Abbildung: Pufferung titrierbarer Säuren im Tubuluslumen
Abbildung: Pufferung titrierbarer Säuren im Tubuluslumen
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Sezernieren Tubuluszellen H+ in das Lumen, kombiniert dieses mit Bicarbonat (oben), "titrierbaren" Anionen wie Phosphat (Mitte) sowie Ammoniak (unten).
Ammoniumausscheidung im proximalen Tubulus, Bicarbonatresorption und Bildung
titrierbarer Säure (hier Phosphat) auch in anderen
Tubulusabschnitten.
CA = Carboanhydrase
 Unter titrierbarer Säure versteht
man Anionen, die als Puffer im Harn wirken - sie binden
Wasserstoffionen und ermöglichen der Niere die Ausscheidung von Säuren
bei nur mäßiger Reduktion des Harn-pH.
Unter titrierbarer Säure versteht
man Anionen, die als Puffer im Harn wirken - sie binden
Wasserstoffionen und ermöglichen der Niere die Ausscheidung von Säuren
bei nur mäßiger Reduktion des Harn-pH.
 Dass die renale Ausscheidung nichtflüchtiger saurer Valenzen für die
Aufrechterhaltung des Säure-Basen-Gleichgewichts im Körper entscheidend
ist, wird durch die Tatsache unterstrichen, dass Nierenversagen zum Rückstau saurer Valenzen und metabolischer Azidose führt.
Dass die renale Ausscheidung nichtflüchtiger saurer Valenzen für die
Aufrechterhaltung des Säure-Basen-Gleichgewichts im Körper entscheidend
ist, wird durch die Tatsache unterstrichen, dass Nierenversagen zum Rückstau saurer Valenzen und metabolischer Azidose führt.
Die Säureausscheidung in Form von freien Wasserstoffionen spielt
mengenmäßig keine Rolle (Rechenbeispiel: pH 4 entspricht einer H+-Konzentration
von lediglich 0,1 mmol - um 70 mmol in Form von Protonen auszuscheiden,
müssten dann mindestens 700 l Harn produziert werden). Saure Valenzen werden mit dem Harn in Form saurer Salze entsorgt.
Um das pH-Gleichgewicht im Körper zu stabilisieren, muss die Niere so gut wie das gesamte (>99,9%) glomerulär filtrierte Bicarbonat
(die mengenmäßig führende Pufferbase) aus den Tubuli wieder
zurückgewinnen ( Abbildung) - das sind mehr als 4000 mmol in 24
Stunden (
Abbildung) - das sind mehr als 4000 mmol in 24
Stunden ( s. dort). Der Mechanismus
ist immer derselbe: Unter der beschleunigenden Wirkung von
Carboanhydrase (CA), die in mehreren Nephronabschnitten exprimiert
wird, entsteht im Tubulus aus Bicarbonat und H+ einer Säure CO2. Das Kohlendioxid diffundiert durch die apikale Membran (die für CO2
hohe Durchlässigkeit hat) in Tubulusepithelzellen; hier entsteht wieder
Bicarbonat (CA sei Dank), das basolateral die Zelle verlässt; das
entstandene H+ rezirkuliert in das Tubuluslumen.
s. dort). Der Mechanismus
ist immer derselbe: Unter der beschleunigenden Wirkung von
Carboanhydrase (CA), die in mehreren Nephronabschnitten exprimiert
wird, entsteht im Tubulus aus Bicarbonat und H+ einer Säure CO2. Das Kohlendioxid diffundiert durch die apikale Membran (die für CO2
hohe Durchlässigkeit hat) in Tubulusepithelzellen; hier entsteht wieder
Bicarbonat (CA sei Dank), das basolateral die Zelle verlässt; das
entstandene H+ rezirkuliert in das Tubuluslumen.

Zur
apikalen /
basolateralen Membran vgl.
dort
Das Bicarbonat kümmert sich um die laufende Säurelast (acid challenge) durch
 Neutralisierung des Großteils saurer Valenzen durch Bildung (und Ausatmung) von CO2
Neutralisierung des Großteils saurer Valenzen durch Bildung (und Ausatmung) von CO2
 Bildung neuen Bicarbonats in den Nieren.
Bildung neuen Bicarbonats in den Nieren.
Die renale Netto-Säureausscheidung stellt sich dar als
{H+ in Phosphat, Creatinin, Harnsäure} + {H+ in Ammonium} - {ausgeschiedenes Bicarbonat}
Der erste Klammerausdruck entspricht der titrierbaren Säure - die Anionen sind Nicht-Ammoniak- und Nicht-Bicarbonat-Puffer, hauptsächlich HPO42-, Creatinin und Urat. Saure Valenzen dieser Kategorie werden vor allem in der monovalenten Form von H2PO4- ausgeschieden. Für jedes ausgeschiedene H2PO4- gelangt ein neu gebildetes HCO3- in Richtung Blut ( Abbildung).
Abbildung).
Was den zweiten Klammerausdruck betrifft, liegt dieser praktisch vollständig in Form von Ammoniumionen vor, da der pK-Wert des NH3/NH4+-Systems bei >9,0 (also weit über dem Harn-pH) liegt ( vgl. dort). Ammoniak ist ein Protonenakzeptor; da die Konzentration an freiem Ammoniak (NH3)
im glomerulären Filtrat sehr niedrig ist (Plasmaspiegel <1 µM/l),
stammt das tubuläre Ammoniak im Wesentlichen aus den Tubuluszellen
durch Abspaltung von H+ - das in den Tubulus wandert und dort wieder NH4+ bildet (
vgl. dort). Ammoniak ist ein Protonenakzeptor; da die Konzentration an freiem Ammoniak (NH3)
im glomerulären Filtrat sehr niedrig ist (Plasmaspiegel <1 µM/l),
stammt das tubuläre Ammoniak im Wesentlichen aus den Tubuluszellen
durch Abspaltung von H+ - das in den Tubulus wandert und dort wieder NH4+ bildet ( Abbildung).
Abbildung).
Proximale Tubuluszellen können Glutamin zu α-Ketoglutarat und 2 NH4+ umwandeln, Quelle für je zwei Protonen und Ammoniakmoleküle; und zwei dabei entstandene OH--Ionen werden mit CO2 (CA-Wirkung) zu Bicarbonat, das wiederum über die basolaterale Membran Richtung Blut wandert ( Abbildung).
Abbildung).
Anionische
Aminosäuren (wie Glutamat oder Aspartat) werden zu neutralen
Stoffwechselprodukten verwandelt (Harnstoff, Glucose, CO2, H2O).

Über die
Zusammensetzung des Urins s.
dort
 Zum Ammoniummechanismus s. auch dort
Zum Ammoniummechanismus s. auch dort
Die "endogene" Säurebildung (ESB) (endogenous acid production EAP) bezieht sich auf relativ starke "nichtflüchtige"
Säuren und beruht auf zwei Komponenten:
 "Metabolische" Säurebildung
(MSB) (metabolic acid production MEP) - z.B. Laktatproduktion bei körperlicher Belastung - sowie
"Metabolische" Säurebildung
(MSB) (metabolic acid production MEP) - z.B. Laktatproduktion bei körperlicher Belastung - sowie

 Säure, die im Rahmen der Verdauungsfunktion (netto)
entsteht (gastrointestinale Säurebildung, GSB) (gastrointestinal acid production GAP). Daher ergibt sich
Säure, die im Rahmen der Verdauungsfunktion (netto)
entsteht (gastrointestinale Säurebildung, GSB) (gastrointestinal acid production GAP). Daher ergibt sich
 ESB = MSB + GSB (oder: EAP = MAP + GAP)
ESB = MSB + GSB (oder: EAP = MAP + GAP)
wobei die beiden zu etwa gleichen Teilen zur Belastung des Säure-Basen-Haushalts durch nichtflüchtige Säuren beitragen.
 Zur endogenen Säureproduktion vgl. dort
Zur endogenen Säureproduktion vgl. dort
Wie reagieren Zellen auf intrazelluläre pH-Änderungen?
Normalerweise
besteht über die Zellmembran ein Gleichgewicht zwischen der Aktivität
von Transportern, welche Säure aus der Zelle bringen (z.B. via
Natrium-Bicarbonat-Cotransport) und solchen, die saure Valenzen in die
Zelle bringen (z.B. via Chlorid-Bicarbonat-Austausch). Dann bleibt die Wasserstoffionenkonzentration in der Zelle stabil (der intrazelluläre pH-Wert beträgt meist ~7,1).
Ändert sich der pH-Wert im Extrazellulärraum, wirkt sich das oft auf den intrazellulären pH aus (und umgekehrt). So hemmt metabolische Azidose (Erhöhung der extrazellulären [H+])
den Export saurer Valenzen und fördert deren Import; dadurch sinkt auch
der intrazelluläre pH-Wert. Umgekehrt führt metabolische
(extrazelluläre) Alkalose zu vermehrter Aufnahme basischer Valenzen,
und auch der intrazelluläre pH-Wert steigt an.
Extrazelluläre Abweichungen (Azidose, Alkalose) führen also zu
gleichsinnigen Änderungen in der Zelle. Diese benötigt jedoch für eine
optimale Funktion eine stabile Wasserstoffionenkonzentration. Wie korrigiert die Zelle Störungen des pH-Wertes?

 Abbildung: Kompensation nach Einbringen von sauren oder basischen Valenzen in eine Zelle
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Kompensation nach Einbringen von sauren oder basischen Valenzen in eine Zelle
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Reaktion auf intrazelluläre metabolische Azidose (links): Einbringen von
Säure (hier: HCl mittels Mikropipette) in die Zelle regt die
Ausscheidung saurer Valenzen an (grüne Pfeile) und bremst deren Import
(roter Pfeil).
Reaktion auf intrazelluläre metabolische Alkalose (rechts):
Umgekehrt wird der Säureimport angeregt und der Import inhibiert, wenn
basische Valenzen in die Zelle verbracht werden (hier: Kaliumhydroxid).
In beiden Fällen kann die Zelle die metabolische Störung durch
Steuerung membranaler Transportsysteme metabolisch kompensieren.
NBCn1 = elektroneutraler Na/HCO3-Cotransporter, NHE1 = Na-H-Austauscher, AE2 = Cl-HCO3-Austauscher

Statt
eine Zelle azidotischer oder alkalotischer Umgebung auszusetzen, damit
sie saure oder basische Valenzen aufnimmt, könnte man mittels
Mikropipette direkt Säure oder Base injizieren, um festzustellen, wie
die Transporter in ihrer Membran auf die Änderung des intrazellulären
pH reagieren ( Abbildung): Dieser kehrt nach einiger Zeit zum
Normalwert zurück. Dabei spielen Cotransporter (Symport) und
Austauscher (Antiport) eine Rolle:
Abbildung): Dieser kehrt nach einiger Zeit zum
Normalwert zurück. Dabei spielen Cotransporter (Symport) und
Austauscher (Antiport) eine Rolle:
 Behebung einer intrazellulären Azidose: NBCn1 (elektroneutraler Na/HCO3-Cotransporter) und NHE1 = (Na-H-Austauscher) sind Säureausscheider (acid extruder) steigern den intrazellulären pH-Wert und beheben dadurch eine intrazelluläre Azidose. Beide Transporter nützen den Natriumgradienten, einerseits um mit Na (stark basisch) Bicarbonat (schwach sauer) aufzunehmen, andererseits um Wasserstoffionen gegen Na auszutauschen (und damit auszuscheiden).
Behebung einer intrazellulären Azidose: NBCn1 (elektroneutraler Na/HCO3-Cotransporter) und NHE1 = (Na-H-Austauscher) sind Säureausscheider (acid extruder) steigern den intrazellulären pH-Wert und beheben dadurch eine intrazelluläre Azidose. Beide Transporter nützen den Natriumgradienten, einerseits um mit Na (stark basisch) Bicarbonat (schwach sauer) aufzunehmen, andererseits um Wasserstoffionen gegen Na auszutauschen (und damit auszuscheiden).
 Behebung einer intrazellulären Alkalose: AE2 = Cl-HCO3-Austauscher (anion exchanger) ist ein Säureimporter (acid loader),
er importiert Chloridionen (stark sauer) im Austausch gegen Bicarbonat
(schwach sauer) und senkt dadurch den intrazellulären pH-Wert.
Behebung einer intrazellulären Alkalose: AE2 = Cl-HCO3-Austauscher (anion exchanger) ist ein Säureimporter (acid loader),
er importiert Chloridionen (stark sauer) im Austausch gegen Bicarbonat
(schwach sauer) und senkt dadurch den intrazellulären pH-Wert.
Puffer(basen) stabilisieren den pH-Wert
 Unter einem Puffer versteht man eine Substanz, die bei Zusatz von Säure (pH sinkt) oder alkalischer Stoffe (pH steigt) Wasserstoffionen (H+) so aufnimmt (Protonenakzeptor) oder abgibt (Protonendonator), dass die
Änderung des pH dabei geringer ist als das ohne Anwesenheit des Puffers
der Fall wäre. Der Puffer stabilisiert also den pH-Wert - Blutpuffer (buffer bases) tun das im Kreislauf.
Unter einem Puffer versteht man eine Substanz, die bei Zusatz von Säure (pH sinkt) oder alkalischer Stoffe (pH steigt) Wasserstoffionen (H+) so aufnimmt (Protonenakzeptor) oder abgibt (Protonendonator), dass die
Änderung des pH dabei geringer ist als das ohne Anwesenheit des Puffers
der Fall wäre. Der Puffer stabilisiert also den pH-Wert - Blutpuffer (buffer bases) tun das im Kreislauf.
 Als Pufferkapazität bezeichnet
man die Fähigkeit einer (gepufferten) Lösung, pH-Änderungen gering zu
halten. Als Maß für die Pufferkapazität gilt die Menge an H+ (eigentlich H3O+) bzw. OH+, die man einer Lösung zuführen muss, um deren pH-Wert um eine Einheit zu verändern.
Als Pufferkapazität bezeichnet
man die Fähigkeit einer (gepufferten) Lösung, pH-Änderungen gering zu
halten. Als Maß für die Pufferkapazität gilt die Menge an H+ (eigentlich H3O+) bzw. OH+, die man einer Lösung zuführen muss, um deren pH-Wert um eine Einheit zu verändern.
Ein Beispiel: Gibt man zu einem Liter Wasser (destilliert, 25°C) 1 ml 10-molare Salzsäure, sinkt der pH von 7 auf 2 (die [H+] nimmt von 10-7 auf 10-2 zu). Gibt man dieselbe Menge 10-molare HCl zu einem Liter Blutplasma, sinkt der pH-Wert von 7,4 lediglich auf 7,2 - also um 0,2 (statt 5) pH-Einheiten.
Pufferbasen halten Störungen des pH-Wertes gering. Ihre Konzentration im Blut beträgt 48 mM, die Hälfte davon (24 mM) geht auf das Konto von Bicarbonat. Die anderen werden als Nichtbicarbonatpuffer zusammengefasst, diese sind vorwiegend intrazellulär aktiv.
Pufferbasen im Blut
(gesamt: 48-50 mM)
|
Bicarbonatpuffer
|
24-25 mM
|
Nichtbicarbonatpuffer
(NBP: Hämoglobin, Proteine, Phosphat)
|
24-25 mM
|
Bicarbonat
 Die Nieren bilden in 24 Stunden ~70 mmol Bicarbonat neu - außer, wenn basische Valenzen
ausgeschieden werden müssen, z.B. nach massivem Erbrechen. Dies dient
der Pufferung des Blutes, das die Niere durchströmt: Würde die Niere
nämlich die in das Tubulussystem sezernierten Säuren nicht puffern, müsste sie den Harn auf pH=1,3 ansäuern (70 mmol H+ in 1,5 Liter Harn) - tatsächlich ist die maximal mögliche H+-Konzentration um mehrere Zehnerpotenzen geringer (Harn-pH meist über 5,0).
Die Nieren bilden in 24 Stunden ~70 mmol Bicarbonat neu - außer, wenn basische Valenzen
ausgeschieden werden müssen, z.B. nach massivem Erbrechen. Dies dient
der Pufferung des Blutes, das die Niere durchströmt: Würde die Niere
nämlich die in das Tubulussystem sezernierten Säuren nicht puffern, müsste sie den Harn auf pH=1,3 ansäuern (70 mmol H+ in 1,5 Liter Harn) - tatsächlich ist die maximal mögliche H+-Konzentration um mehrere Zehnerpotenzen geringer (Harn-pH meist über 5,0).
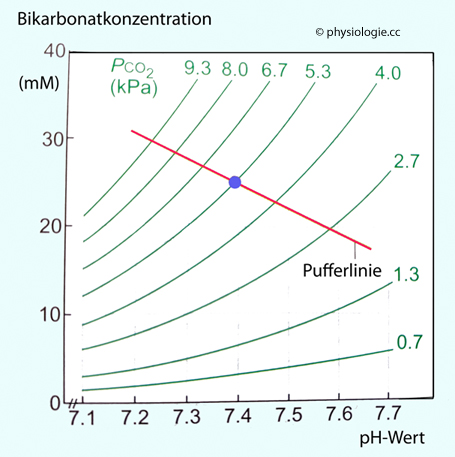
 Abbildung: pH- Bicarbonat- Diagramm (vgl. weiter unten)
Abbildung: pH- Bicarbonat- Diagramm (vgl. weiter unten)
Nach einer Vorlage in Butler / Brown / Stephenson / Speakman, Animal Physiology - An Environmental Perspective, Oxford University Press 2021
Beziehung zwischen pH-Wert (Abszisse), pCO2
(in kPa, grüne Linien) und Bicarbonatkonzentration (Ordinate) im
Blutplasma (rote Linie: Pufferlinie bei BE=0; blauer Punkt: Aktualwerte
pH 7,4, pCO2 = 5,3 kPa, [HCO3-] = 25 mM).
Ändert man den pCO2
(z.B. infolge einer respiratorischen Störung) bei gleich bleibender
Pufferkapazität (rote Linie), ändert sich der pH-Wert des Blutes
dementsprechend. Die Neigung der (in dieser Darstellung so gut wie linearen) Pufferlinie wird als Pufferwert (buffer value) ß bezeichnet, definiert als
ß = ∆ [HCO3-] / ∆ [pH]
Respiratorische Störungen bewegen die Aktualwerte entlang der Pufferlinie, metabolische Störungen entlang der betreffenden pCO2-Kurve (Linien gleicher CO2-Konzentration nennt man Isobare, gleichen pCO2 Isoplethen)

 Abbildung).
Es quantifiziert, wie Veränderungen des Kohlendioxidgehalts im Blut
dessen pH-Wert verändert (grüne Kurven: der pH-Wert ist ein
Logarithmus!) und stellt die Verortung der Aktualwerte in Abhängigkeit
von der Pufferkapazität des Blutes dar.
Abbildung).
Es quantifiziert, wie Veränderungen des Kohlendioxidgehalts im Blut
dessen pH-Wert verändert (grüne Kurven: der pH-Wert ist ein
Logarithmus!) und stellt die Verortung der Aktualwerte in Abhängigkeit
von der Pufferkapazität des Blutes dar.
Alternativ kann auf den Ordinate statt der Bicarbonatkonzentration der pCO2 aufgetragen sein (wie im van Slyke-Diagramm, s.  Abbildung unten).
Abbildung unten).
Glomerulär filtriertes Bicarbonat (4320 mmol/d in der  Abbildung oben) wird in der
Niere so gut wie vollständig rückresorbiert (80% im proximalen Tubulus,
10% im aufsteigenden Schenkel der Henle-Schleife, 10% im distalen
Tubulus). Die Neubildung von Bicarbonat (hauptsächlich im proximalen Tubulus) erfolgt vor allem über den
Ammoniummechanismus (Bicarbonatbildung durch NH3 → NH4+) sowie den Phosphatmechanismus (Bicarbonatbildung durch Hydrogenphosphat →
Dihydrogenhosphat).
Abbildung oben) wird in der
Niere so gut wie vollständig rückresorbiert (80% im proximalen Tubulus,
10% im aufsteigenden Schenkel der Henle-Schleife, 10% im distalen
Tubulus). Die Neubildung von Bicarbonat (hauptsächlich im proximalen Tubulus) erfolgt vor allem über den
Ammoniummechanismus (Bicarbonatbildung durch NH3 → NH4+) sowie den Phosphatmechanismus (Bicarbonatbildung durch Hydrogenphosphat →
Dihydrogenhosphat).
Durch die Offenheit des Bicarbonatsystems (CO2 kann abgeatmet, Bicarbonat von den Nieren nachgebildet werden) beträgt seine Kapazität 55 mM pro ΔpH (als geschlossenes System würde dieser Wert lediglich 2 mM pro ΔpH betragen).
Wovon hängt die Pufferkapazität ab? Zwei Faktoren spielen eine Rolle:
 Die Menge an vorhandenem Puffer
und
Die Menge an vorhandenem Puffer
und
 die Lage des aktuellen pH-Wertes zum pK-Wert des Puffers. Ein Puffersystem ist umso wirksamer, je näher sein pK-Wert beim vorherrschenden (physiologischen) pH-Bereich liegt (höchste Pufferkapazität bei pH = pK). Im Blut trifft dies recht gut für das Phosphatsystem (NaH2PO4
die Lage des aktuellen pH-Wertes zum pK-Wert des Puffers. Ein Puffersystem ist umso wirksamer, je näher sein pK-Wert beim vorherrschenden (physiologischen) pH-Bereich liegt (höchste Pufferkapazität bei pH = pK). Im Blut trifft dies recht gut für das Phosphatsystem (NaH2PO4  Na2HPO4)
zu, da bei einem pH=7,1 (Blut-pH 7,4) die Hälfte als primäres und die
andere Hälfte als sekundäres Phosphat vorliegt und daher bei Zugabe
einer basischeren oder saureren Substanz von beiden Seiten des
pH-Spektrums gut gepuffert werden kann.
Na2HPO4)
zu, da bei einem pH=7,1 (Blut-pH 7,4) die Hälfte als primäres und die
andere Hälfte als sekundäres Phosphat vorliegt und daher bei Zugabe
einer basischeren oder saureren Substanz von beiden Seiten des
pH-Spektrums gut gepuffert werden kann.
Nichtbicarbonatpuffer
 Glomerulär
filtriertes Phosphat wird zu 90% renal rückgewonnen; 10% werden
ausgeschieden und dienen der Pufferung. Phosphat ist in der Niere von Bedeutung; die
Konzentration im Plasma ist gering (~1 mM), daher ist die Beteiligung
des Phosphatpuffers an der Stabilisierung des Blut-pH trotz des
günstigen pK-Wertes des Systems primäres / sekundäres Phosphat (7,1)
gering. Im Intrazellulärraum spielt der Phosphatpuffer wegen seiner höheren Konzentration und der Nähe zum pK-Wert die Hauptrolle als Puffer.
Glomerulär
filtriertes Phosphat wird zu 90% renal rückgewonnen; 10% werden
ausgeschieden und dienen der Pufferung. Phosphat ist in der Niere von Bedeutung; die
Konzentration im Plasma ist gering (~1 mM), daher ist die Beteiligung
des Phosphatpuffers an der Stabilisierung des Blut-pH trotz des
günstigen pK-Wertes des Systems primäres / sekundäres Phosphat (7,1)
gering. Im Intrazellulärraum spielt der Phosphatpuffer wegen seiner höheren Konzentration und der Nähe zum pK-Wert die Hauptrolle als Puffer.
 Als pK-Wert kann
man denjenigen pH-Wert bezeichnen, bei dem eine schwache Säure oder
Base zu 50% in dissoziierter und zu 50% in undissoziierter Form
vorliegt (Halbäquivalenzpunkt).
Als pK-Wert kann
man denjenigen pH-Wert bezeichnen, bei dem eine schwache Säure oder
Base zu 50% in dissoziierter und zu 50% in undissoziierter Form
vorliegt (Halbäquivalenzpunkt).
Organische Puffer - Proteine, Peptide, Aminosäuren - puffern vor allem über Imidazol-, Sulfhydryl- und NH2-Gruppen.
 Bei Plasmaproteinen (
Bei Plasmaproteinen ( s. dort) - Kapazität 5 mM pro ΔpH - puffert vor allem Albumin.
s. dort) - Kapazität 5 mM pro ΔpH - puffert vor allem Albumin.
 Hämoglobin ist eine besonders bemerkenswerte Pufferbase, da es seine Pufferkapazität mit der Sauerstoffbeladung ändert (Haldane-Effekt). Dadurch ist seine physiologische Bedeutung besonders hoch: Die Pufferkapazität beträgt in den Erythrozyten 60 mM (Erys) pro ΔpH.
Hämoglobin ist eine besonders bemerkenswerte Pufferbase, da es seine Pufferkapazität mit der Sauerstoffbeladung ändert (Haldane-Effekt). Dadurch ist seine physiologische Bedeutung besonders hoch: Die Pufferkapazität beträgt in den Erythrozyten 60 mM (Erys) pro ΔpH.
Aktive Muskelzellen konsumieren oft mehr Sauerstoff, als der Blutfluss akut anbietet ("Sauerstoffschuld").
In derart "unterversorgten" Regionen steigt die Anforderung an die
Pufferkapazität des Blutes, pH-Wert, Pufferbasenkonzentration und
BE-Wert in venösen Blutproben aus solchem Gewebe sinken - natürlich
auch pO2 und die Sauerstoffsättigung des Hämoglobins.
 pH und Gesundheit. Die
Erhaltung des Säure-Basen-Gleichgewichts ist von großer Bedeutung für
den Gesundheitszustand des Körpers, und Störungen können u.a.
Wachstumsstörungen bei Neugeborenen, Elektrolytstörungen, Übelkeit,
Herzrhythmusstörungen, Kreislaufunempfindlichkeit gegenüber
Noradrenalin / Adrenalin, Muskelatrophie,
Osteoporose, Nierensteinbildung, Parästhesien, im Extremfall Koma
bedingen; Abweichungen des Bicarbonatspiegels im Blut sind mit erhöhter
Mortalität korreliert.
pH und Gesundheit. Die
Erhaltung des Säure-Basen-Gleichgewichts ist von großer Bedeutung für
den Gesundheitszustand des Körpers, und Störungen können u.a.
Wachstumsstörungen bei Neugeborenen, Elektrolytstörungen, Übelkeit,
Herzrhythmusstörungen, Kreislaufunempfindlichkeit gegenüber
Noradrenalin / Adrenalin, Muskelatrophie,
Osteoporose, Nierensteinbildung, Parästhesien, im Extremfall Koma
bedingen; Abweichungen des Bicarbonatspiegels im Blut sind mit erhöhter
Mortalität korreliert.
Blutproben spiegeln den systemischen
Zustand des Säure-Basen-Haushalts wider. Dazu
ist es nicht notwendig, eine
Arterie zu punktieren. Beim Einstechen in gut durchblutete
Akren (Fingerbeere, Ohrläppchen, Ferse bei Babys) werden kleine
Arterien geöffnet, aus denen - bedingt durch den arteriellen Druck -
arterielles (hellrotes)
Blut austritt. Durch Kapillarwirkung fließt es leicht in enge
Kunststoff- oder heparinisierte Glasröhrchen. Man spricht von "Kapillarblut" - es stammt aber aus kleinen Arterien, aus Kapillaren strömt kein Blut aus. Eine
lokale Störung des Säure-Basen-Haushalts (z.B. Säurebildung bei
Herzinfarkt oder in Tumoren) muss nicht zu systemischen Abweichungen
des Blut-pH führen; die Blutwerte "mitteln" vielmehr über den
Stoffwechsel des gesamten Organismus (zentral durchmischt). Nur wenn sich massive Veränderungen ergeben
(z. B. Muskelarbeit, veränderte Atmung, Erbrechen,
Nierenfunktionsstörung), sind auch pH und Blutgase merklich
beeinträchtigt.
Eine
lokale Störung des Säure-Basen-Haushalts (z.B. Säurebildung bei
Herzinfarkt oder in Tumoren) muss nicht zu systemischen Abweichungen
des Blut-pH führen; die Blutwerte "mitteln" vielmehr über den
Stoffwechsel des gesamten Organismus (zentral durchmischt). Nur wenn sich massive Veränderungen ergeben
(z. B. Muskelarbeit, veränderte Atmung, Erbrechen,
Nierenfunktionsstörung), sind auch pH und Blutgase merklich
beeinträchtigt.
Die Bestimmung von pH-Wert (bei 37°C), Sauerstoff- und CO2-Partialdruck nennt man Blutgasanalyse. Aus diesen Werten werden die Pufferkapazität
(buffer bases, BB, normalerweise ~50 mM) und vom Messgerät die
Bicarbonatkonzentration (~25 mM) ermittelt. Weicht der BB-Wert ab, wird die
Abweichung als Basenabweichung (BE, base excess) - positiv oder negativ - in mM angegeben.
Der BE ist negativ bei respiratorischen Alkalosen (als Kompensation) oder bei metabolischen Azidosen (als Ursache)
|
Die Bicarbonatkonzentration ist ein wichtiger Kennwert des
"metabolischen Schenkels" des Säure-Basen-Status. Sie ändert sich mit
Temperatur, pH-Wert und pCO2.
 Als Standardbicarbonat bezeichnet man die Bicarbonatkonzentration, den man in einer
Blutprobe bei Standardbedingungen findet, d.h.
Als Standardbicarbonat bezeichnet man die Bicarbonatkonzentration, den man in einer
Blutprobe bei Standardbedingungen findet, d.h.

37°C

vollständiger Sauerstoffsättigung des
Hämoglobins

pCO
2 = 40 mmHg (5,3 kPa)
Folgende Normalwert(bereich)e für den Säure-Basen-Status sollte man sich merkern:
Blut-pH-Wert: 7,4 (7,37-7,43)
arterieller pCO2: 5,3 kPa (40 mmHg)
(Standard-) Bicarbonatkonzentration: 24 mM (21-28)
Pufferbasen (BB): 48 mM (42-56)
Basenüberschuss (BE): 0 mM (-2,5 bis +2,5)
|

 Abbildung: Störungen des Säure-Basen-Haushalts im Van Slyke-Diagramm
Abbildung: Störungen des Säure-Basen-Haushalts im Van Slyke-Diagramm
Nach einer Vorlage in New Human Physiology
Durch
doppelt-logarithmische Darstellung des Kohlendioxidpartialdrucks als
Funktion des pH (= -log [H+])
ergeben sich Pufferlinien, die schräg durch das Diagramm ziehen (je
weniger Pufferbasen, desto weiter links, d.h. im saureren Bereich).
 Blaues Band: Pufferbasenkonzentration im Normbereich, rein respiratorische Störungen
Blaues Band: Pufferbasenkonzentration im Normbereich, rein respiratorische Störungen
 Braunes Band: Metabolisch kompensierte respiratorische Störungen (Pufferbasengehalt verändert)
Braunes Band: Metabolisch kompensierte respiratorische Störungen (Pufferbasengehalt verändert)
 Violette Bänder: Akute metabolische Störungen
Violette Bänder: Akute metabolische Störungen
 Rote Bänder: Respiratorisch kompensierte metabolische Störungen (pCO2 verändert)
Rote Bänder: Respiratorisch kompensierte metabolische Störungen (pCO2 verändert)
Linien gleichen pCO2 (isokapnische Linien) horizontal (Werte links in mmHg, rechts in kPa angegeben; 1 kPa = 7,5 mmHg).
Typische Positionen klinischer Zustandsbilder sind gezeigt (AMS = acute mountain sickness)

Dieser Wert lässt sich aus dem Blut-pH über die
Henderson-Hasselbalch-Gleichung (s. unten) berechnen (vorausgesetzt,
die Standardbedingungen sind eingehalten).
Der tatsächlich in einer Blutprobe vorliegende Bicarbonatwert wird als Aktualbicarbonat oder aktuelles Bicarbonat bezeichnet. Ein Van Slyke-Nomogramm  (
( Abbildung) stellt den pCO2 als Funktion des pH-Wertes dar (pCO2 logarithmisch, da der pH ein Logarithmus ist).
Abbildung) stellt den pCO2 als Funktion des pH-Wertes dar (pCO2 logarithmisch, da der pH ein Logarithmus ist).
Normalerweise beträgt der pCO2 ~40 mmHg und der pH ~7,4 (<grüner Bereich: "normal").
Ändert man an dieser Blutprobe den pCO2, kommt es - bei gegebener Pufferbasenkonzentration - zu
entsprechenden pH-Änderungen (blauer Bereich: akute respiratorische  Störung).
Störung).
Ändert man umgekehrt die Pufferbasenkonzentration (entspricht einer "metabolischen" Störung), bleibt der pCO2 (zunächst) gleich, der Zustandspunkt im Diagramm rückt "isokapnisch" (gleich bleibender pCO2) nach links (Azidose) oder rechts (Alkalose). 
Bicarbonat-pH-Diagramm
( vgl. oben)
vgl. oben)
Der Pufferstatus einer Blutprobe kann auch in Form eines Bicarbonat-pH-Plots
dargestellt werden ( Abbildung). Der Normalpunkt liegt in der
Mitte des Diagramms (pH 7,4 und aktueller Bicarbonatwert 24 mM). Die
grüne Linie gilt für einen bestimmten Pufferbasengehalt der Probe bei
variierendem pCO2, die rote Kurve für einen pCO2
Abbildung). Der Normalpunkt liegt in der
Mitte des Diagramms (pH 7,4 und aktueller Bicarbonatwert 24 mM). Die
grüne Linie gilt für einen bestimmten Pufferbasengehalt der Probe bei
variierendem pCO2, die rote Kurve für einen pCO2 = 40 mmHg bei unterschiedlichem Pufferbasengehalt.
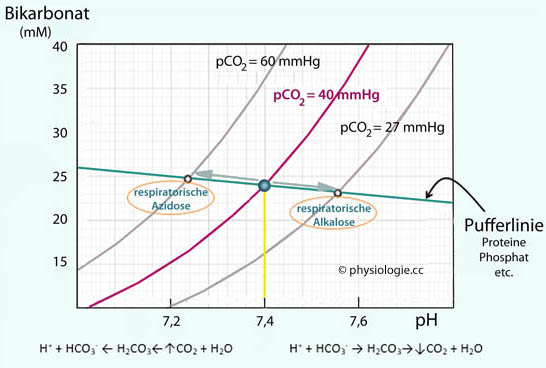
 Abbildung: Bicarbonat-pH-Plot einer normalen Blutprobe
Abbildung: Bicarbonat-pH-Plot einer normalen Blutprobe
Die grüne Linie stellt den Pufferstatus der Blutprobe dar, die Kurven entsprechen einem pCO2
von 60, 40 (arterieller Normalwert) und 27 mmHg. Die Werte können
durch Äquilibrierung einer Blutprobe (Begasung mit bekanntem pCO2) vorgegeben werden.
Der Normalpunkt
in der Mitte liegt bei einem pH=7,4 und einem Aktualbicarbonat von 24 mM

Mittels Durchströmung einer (motorisch geschüttelten) Blutprobe mit einem Testgas
("Äquilibrierung") kann der pCO2
beliebig eingestellt werden. Die in der Abbildung grau gezeigten Kurven
stellen den Effekt eines Einstellens auf 60 bzw. 27 mmHg pCO2
dar. Diese Werte entsprechen der Auswirkung respiratorischer Störungen
und der damit einhergehenden Hyper- bzw. Hypokapnie (bei unverändertem
Pufferbasengehalt).
Mit dem pH ändert sich auch ein wenig der Aktualbicarbonatwert. Steigt z.B. infolge einer Hypoventilation der pCO
2 (Pfeil nach links: Hyperkapnie, respiratorische Azidose), entstehen vermehrt H
2CO
3, Bik´carbonat und Wasserstoffionen (Formeln in der

Abbildung links unten). Die vermehrt gebildeten H
+-Ionen verbrauchen Nichtbicarbonatpuffer, und zwar in dem Ausmaß, in dem [HCO
3-]
ansteigt (Pufferlinie nach links) - die Gesamtpufferkonzentration
bleibt unverändert (und der BE bleibt bei Null), solange keine
Kompensation einsetzt. (Umgekehrtes gilt für respiratorische Alkalose -
Pfeil nach rechts.)
Kompensation. Hält eine Störung an, wird sie vom Körper kompensiert - durch veränderte Atmung (respiratorisch, Auswirkung auf den pCO
2) oder andere Organfunktionen, z.B. der Niere (nichtrespiratorisch, "metabolisch" - Änderung der Pufferkapazität).

 Abbildung: Beispiel einer Kompensation im Bicarbonat-pH-Plot
Abbildung: Beispiel einer Kompensation im Bicarbonat-pH-Plot
Theoretisch besteht der Vorgang aus zwei Schritten:
Schritt 1: Störung - respiratorische Alkalose durch Hyperventilation, Pufferbasengehalt (grüne Kurve) unverändert (Punkt A→C).
Schritt 2: Kompensation (Punkt C→F) - nichtrespiratorisch,
durch Erniedrigung des Pufferbasengehalts (negativer BE) - Bicarbonat
sinkt auf ~18 mM, pH wird von 7,55 (Alkalose) auf 7,42 reduziert
(kompensierte Alkalose, pH im Normbereich).
Tatsächlich greift die Kompensation kontinuierlich mit dem Ausmaß der Störung (Punkt A→F), der pH verlässt dabei den Normbereich nicht (vollständig kompensierte Störung)
 Kompensationen bezwecken eine Normalisierung des pH. Bei
"unvollständig" kompensierten Störungen wird die Abweichung des pH vom
Normwert 7,4 nur teilweise aufgefangen. Bei vollständig
kompensierten
Störungen bleibt der arterielle pH-Wert im Normbereich
(7,36 bis 7,42 - in der
Kompensationen bezwecken eine Normalisierung des pH. Bei
"unvollständig" kompensierten Störungen wird die Abweichung des pH vom
Normwert 7,4 nur teilweise aufgefangen. Bei vollständig
kompensierten
Störungen bleibt der arterielle pH-Wert im Normbereich
(7,36 bis 7,42 - in der  Abbildung direkte Verbindung von Punkt A zu
Punkt F).
Abbildung direkte Verbindung von Punkt A zu
Punkt F).
 Die allgemeine Puffergleichung lautet:
Die allgemeine Puffergleichung lautet:
| pH = pKa + log ([A-] / [HA]) |
Im Fall des Kohlensäuresystems (CO2  H2CO3
H2CO3  H+ + HCO3-) beträgt pKa 6,1, wenn man die molaren Werte von H2CO3 (ein Zwischenprodukt mit sehr geringer Konzentration) und CO2 (physiologisch relevant,
H+ + HCO3-) beträgt pKa 6,1, wenn man die molaren Werte von H2CO3 (ein Zwischenprodukt mit sehr geringer Konzentration) und CO2 (physiologisch relevant,  s. Atmung) zusammenzählt.
s. Atmung) zusammenzählt.
Diese Sonderform der allgemeinen Puffergleichung heißt Henderson-Hasselbalch-Gleichung  : Die Anionenkonzentration [A-] ist der Bicarbonatwert (z.B. 24 mM). Für die undissoziierte Säure [HA] setzt man den pCO2 (in mmHg, also z.B. 40) mal einem Umrechnungsfaktor (Partialdruck → molare Konzentration, d.h. Lösungskoeffizient entsprechend dem Henry-Gesetz - in diesem Fall 0,03) ein:
: Die Anionenkonzentration [A-] ist der Bicarbonatwert (z.B. 24 mM). Für die undissoziierte Säure [HA] setzt man den pCO2 (in mmHg, also z.B. 40) mal einem Umrechnungsfaktor (Partialdruck → molare Konzentration, d.h. Lösungskoeffizient entsprechend dem Henry-Gesetz - in diesem Fall 0,03) ein:
Dann ergibt sich z.B. als pH-Wert 7,4 aus 6,1 + log (24 / 1,2)
, weil

0,03 x 40 = 1,2
 und
und
 24 / 1,2 = 20
24 / 1,2 = 20
 und
und
 log 20 = 1,3
log 20 = 1,3
 und
und
 1,3 + 6,1 = 7,4
Der pH-Wert hängt also vom Gleichgewicht zwischen Bicarbonat und CO2 (molares Verhältnis 20 : 1)
ab - dieses steuert den pH-Wert:
1,3 + 6,1 = 7,4
Der pH-Wert hängt also vom Gleichgewicht zwischen Bicarbonat und CO2 (molares Verhältnis 20 : 1)
ab - dieses steuert den pH-Wert:

Gleichgewicht zwischen
"metabolischer" (Bicarbonat) und respiratorischer Komponente
(Kohlendioxid) oder anders ausgedrückt: Gleichgewicht
Nierenaktivität,
Leberfunktion,
Muskeltätigkeit etc. einerseits (
nichtrespiratorisch),
Atmung (
respiratorisch) andererseits (

Abbildung).

 Abbildung: pH-Gleichgewicht als "römische Schnellwaage"
Abbildung: pH-Gleichgewicht als "römische Schnellwaage"
Modifiziert nach einer Vorlage in H. Hinghofer-Szalkay: Praktische Physiologie, 3. Aufl. Blackwell Berlin 1994
Diese
Darstellung stellt schematisch das pH-relevante Funktionsgleichgewicht
Atmung / renale Säureausscheidung bei körperlicher Ruhe dar (andere
metabolische Faktoren wie z.B. Muskelarbeit sind ausgeklammert).
Beträgt das molare Verhältnis CO2 / HCO3- = 1 / 20, ergibt sich ein pH-Wert von 7,4 (Henderson-Hasselbalch-Gleichung)

Bedeutung der Niere für die pH-Stabilität
 vgl. dort
vgl. dort
Die
Nieren entfernen - je nach Ernährung und metabolischer Situation - über
den Harn saure (bei üblicher Ernährung) oder
auch basische Valenzen (metabolische Alkalose, vegetarische Kost) aus dem
Körper. Der [Harn-pH] kann zwischen 4,5 und 8,2 liegen (der pH ist eine
Hochzahl, d.h. diese Spanne bedeutet einen Konzentrationsunterschied
von 103,7!).
Üblicherweise fallen pro Tag ~70 (50-100) mmol (~1 mmol / kg Körpergewicht) "fixe" Säuren in Form von Ammoniumionen (NH4+) und "titrierbarer" Säure an (s. oben). 70 mmol Protonen in 1,5 l Wasser gelöst (~tägliche Harnmenge) würde einen pH von 1,3 ergeben, was verständlich macht, dass H+ in gepufferter Form aus dem Körper entfernt wird, z.B. als H2PO4- (das aus HPO4-- entsteht). Als freie Protonen werden nur ~5 µmol/d ausgeschieden (also weniger als 0,01%).

 Abbildung: Pufferung im Tubulus
Abbildung: Pufferung im Tubulus
Nach einer Vorlage bei veteriankey.com/acid-base-balance
Lumenseite
oben, Interstitium unten. Im proximalen Tubulus (rechts) überwiegt die
Pufferung durch filtriertes Bicarbonat - es entsteht CO2,
dieses gelangt in den Kreislauf (und wird abgeatmet). Im
Sammelrohrbereich (links) überwiegt die Pufferung durch Phosphat und
Ammonium
 Bicarbonat: Täglich filtrieren die Glomeruli einer
erwachsenen Person etwa 4200 mmol Bicarbonat, dieses wird zum Großteil tubulär wieder aufgenommen (Bicarbonatresorption) und neues HCO3- wird tubulär gebildet (Bicarbonatsynthese). Bicarbonat wird vor allem im proximalen Tubulus zu Zwecken der Pufferung verbraucht (
Bicarbonat: Täglich filtrieren die Glomeruli einer
erwachsenen Person etwa 4200 mmol Bicarbonat, dieses wird zum Großteil tubulär wieder aufgenommen (Bicarbonatresorption) und neues HCO3- wird tubulär gebildet (Bicarbonatsynthese). Bicarbonat wird vor allem im proximalen Tubulus zu Zwecken der Pufferung verbraucht ( Abbildung).
Abbildung).
Die Rückgewinnung filtrierten Bicarbonats ist für die Erhaltung des
Blut-pH kritisch, jedoch bei einer Ernährungsweise (viel Fleisch), die
intensive endogene Säurebildung zur Folge hat,
für die Aufrechterhaltung der Säure-Basen-Balance nicht ausreichend.
Daher die Notwendigkeit zur Synthese "neuen" Bicarbonats im Zuge der
Pufferung saurer Valenzen im Körper (wobei HCO3- laufend verbraucht wird).
Phosphat: Im Harn ist Phosphat das bedeutsamste Puffersystem. Der pK-Wert des primär / sekundären Phosphatsystems beträgt bei Körpertemperatur 6,8 (bei diesem pH sind die Konzentrationswerte für primäres und sekundäres Phosphat gleich hoch);
 bei pH>6,8 (wie im Blut: pH=7,4) überwiegt sekundäres Phosphat HPO4-- (im Blut 80:20),
bei pH>6,8 (wie im Blut: pH=7,4) überwiegt sekundäres Phosphat HPO4-- (im Blut 80:20),
 bei pH<6,8 (wie im Harn: pH meist 5-6) überwiegt primäres Phosphat H2PO4- (z.B. bei pH 6,2 ebenfalls 80:20, aber zugunsten des primären Phosphats, das bei niedrigerem Harn-pH noch stärker dominiert).
bei pH<6,8 (wie im Harn: pH meist 5-6) überwiegt primäres Phosphat H2PO4- (z.B. bei pH 6,2 ebenfalls 80:20, aber zugunsten des primären Phosphats, das bei niedrigerem Harn-pH noch stärker dominiert).
Ammonium: Die renale Neubildung von Bicarbonat beruht sowohl auf der Ausscheidung
titrierbarer Säurevalenzen als auch auf dem Ammonium-Mechanismus.
Letzterer hat quantitativ größere Bedeutung. Protonen werden mit dem Harn zu 30-50% als Ammonium ausgeschieden. (Zum Ammonium-Glutamin-Mechanismus  s. dort)
s. dort)
Alle Abschnitte des Nephrons können über die apikale Zellmembran H+
in das Tubuluslumen ausscheiden. Wasserstoffionen können in allen
Tubulusabschnitten unter ATP-Verbrauch über die apikale Zellmembran in
das Tubuluslumen sezerniert werden.
Tubulusepithelzellen des proximalen Tubulus gewinnen aus Glutamin (Nachschub über die basolaterale Membran)
Ammoniumionen und Bicarbonat (Glutaminase). Ein Na/H-Austauscher
befördert Protonen über die apikale
Membran in das Tubuluslumen, dort werden sie gepuffert, z.B. durch
Bildung von Ammoniumionen aus Ammoniak, das über die Membran
diffundiert ist. Die basolaterale Membran befördert Bicarbonat - das über Wirkung der Carboanhydrase (CAH) aus CO2 gewonnen werden kann - mittels eines Na/HCO3-Symporters Richtung Blut (Bicarbonatnachschub).
Im spätproximalen Tubulus und im absteigenden Schenkel der Henle-Schleife wird Bicarbonat im Cotransport mit Natrium, im
dicken aufsteigenden Schenkel im Austausch gegen Chlorid
zurückgewonnen. Der aufsteigende Schenkel kann mittels seines
Na/K/2Cl-Cotransporters statt Kalium auch
Ammoniumionen resorbieren (Anreicherung im Nierenmark). Das Ammonium
rezirkuliert (über den absteigenden Schenkel) im Nierenmark (so entgeht
es der Rückresorption in das Blut) und steht auch den Sammelrohren zur
Verfügung.
So kann NH4+ "auf kurzem Weg" direkt zum Sammelrohr
gelangen, das über eigene Ammonium-Transporter (Rh-assoziierte Glykoproteine)
verfügt. Die Schaltzellen können je
nach Bedarf
(Säure-Basen-Gleichgewicht) zwischen Typ-A-Zelle (Sekretion saurer
Valenzen, Abbildung) und Typ-B-Zelle (Sekretion von Bicarbonat)
wechseln.

 Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Alle Nephronabschnitte können H+ unter ATP-Verbrauch über die apikale Zellmembran in das Tubuluslumen sezernieren.
Oben:
Im proximalen Tubulus übernimmt der elektrogene Na/Bicarbonat- Symporter (1 Na+ und 3 HCO3-)
den Großteil der Bicarbonat- Rückresorption der basolateralen Membran.
In der pars recta arbeitet hier auch ein Chlorid-Bicarbonat-
Austauscher, so wie auch in späteren Nephronabschnitten (unten)
CA, Carboanhydrase

 Der proximale Tubulus sezerniert
Der proximale Tubulus sezerniert H
+ über einen apikalen
Na/H-Antiporter (NHE), der seine Energie aus dem Natriumgradienten (in die Zelle gerichtet) bezieht. H
+ stammt u.a. aus der Dissoziation von Kohlensäure, die aus CO
2
nachgeliefert wird (Wirkung der Carboanhydrase); das dabei entstehende
Bicarbonat wird über die basolaterale Membran exportiert (
Na/HCO3-Cotransporter NBC - effektiv wird
Natriumbicarbonat resorbiert). Insgesamt wird also sowohl Natrium als auch Bicarbonat resorbiert.
Ammoniumionen entstehen aus dem Abbau von Glutamin (Glutaminase,
Glutamatdehydrogenase - durch metabolische Azidose induzierbar). Ammoniak (das in sehr geringer
Konzentration vorliegt - pK-Wert 9,0!) diffundiert in den Tubulus, nimmt ein Wasserstoffion auf
und liegt wieder fast vollständig als Ammoniumion vor (Ammonium gelangt nur schwer über die Zellmembran).
 Im Bereich der Henle-Schleife
setzt sich die Rückgewinnung von Bicarbonat an der basolateralen
Membran fort; einerseits im Austausch gegen Chlorid, andererseits
(absteigender Schenkel) im Cotransport mit Natrium. Wasserstoffionen
werden unter ATP-Verbrauch in den Harn sezerniert. Der dicke Schenkel
resorbiert Ammoniumionen (statt Kalium) über den
Na/K/2Cl-Cotransporter; Ammoniumsalz rezirkuliert (der absteigende
Schenkel nimmt es wieder auf) und reichert sich dadurch im Nierenmark an.
So entgeht es einerseits der Resorption in das Blut (das würde in der
Rindenregion passieren) und steht andererseits dem Sammelrohrsystem zur
Verfügung (falls notwendig - abhängig vom Säure-Basen-Status).
Im Bereich der Henle-Schleife
setzt sich die Rückgewinnung von Bicarbonat an der basolateralen
Membran fort; einerseits im Austausch gegen Chlorid, andererseits
(absteigender Schenkel) im Cotransport mit Natrium. Wasserstoffionen
werden unter ATP-Verbrauch in den Harn sezerniert. Der dicke Schenkel
resorbiert Ammoniumionen (statt Kalium) über den
Na/K/2Cl-Cotransporter; Ammoniumsalz rezirkuliert (der absteigende
Schenkel nimmt es wieder auf) und reichert sich dadurch im Nierenmark an.
So entgeht es einerseits der Resorption in das Blut (das würde in der
Rindenregion passieren) und steht andererseits dem Sammelrohrsystem zur
Verfügung (falls notwendig - abhängig vom Säure-Basen-Status).
 Die Sammelrohre
können auf die Stoffwechselsituation (säure- vs. basenüberschüssig)
reagieren, indem sie zwischen einem "Säuresekretionsmodus" und einem
"Säureresorptionsmodus" wählen - durch Austausch der Transporter der
apikalen und der basolateralen Membran: Die Schaltzellen der Sammelrohre können zwischen
Die Sammelrohre
können auf die Stoffwechselsituation (säure- vs. basenüberschüssig)
reagieren, indem sie zwischen einem "Säuresekretionsmodus" und einem
"Säureresorptionsmodus" wählen - durch Austausch der Transporter der
apikalen und der basolateralen Membran: Die Schaltzellen der Sammelrohre können zwischen
 dem Typ A - diese Zellen tragen Protonenpumpen in ihrer apikalen Membran (H+-Sekretion) und exportieren Bicarbonat, das via HCO3/Cl-Austauscher durch die basolaterale Membran Richtung Blut wandert - und
dem Typ A - diese Zellen tragen Protonenpumpen in ihrer apikalen Membran (H+-Sekretion) und exportieren Bicarbonat, das via HCO3/Cl-Austauscher durch die basolaterale Membran Richtung Blut wandert - und
 dem Typ B
wechseln, bei dem die Transporter zwischen apikaler und basolateraler
Membran "geswitcht" worden sind (Bicarbonat gelangt in den
Tubulus, Protonen in das Interstitium).
Der
Membranbesatz mit Transportern hängt vom pH-Status ab: Müssen saure
Valenzen entfernt werden, dominiert Typ A; muss der Körper basische
Valenzen ausscheiden (metabolische Alkalose), überwiegen in den Sammelrohren Schaltzellen vom Typ B.
dem Typ B
wechseln, bei dem die Transporter zwischen apikaler und basolateraler
Membran "geswitcht" worden sind (Bicarbonat gelangt in den
Tubulus, Protonen in das Interstitium).
Der
Membranbesatz mit Transportern hängt vom pH-Status ab: Müssen saure
Valenzen entfernt werden, dominiert Typ A; muss der Körper basische
Valenzen ausscheiden (metabolische Alkalose), überwiegen in den Sammelrohren Schaltzellen vom Typ B.
Glucocorticoide und Mineralcorticoide regen über verschiedene Mechanismen die renale Säureausscheidung an.
Abweichungen
des pH-Wertes können in Richtung Azidose (pH<7,36) oder Alkalose
gehen (pH>7,42). Eine weitere Unterscheidung berücksichtigt die Ursache der Störung: durch die Atmung, d.h. den pCO2 (respiratorische Störung) oder den Metabolismus ("metabolische" Störung), d.h. über den Bicarbonatwert.
Respiratorische Alkalose tritt durch Hyperventilation, daraus resultierende CO
2-Abatmung und Senkung des pCO
2 auf (Hypokapnie bei <35 mmHg
). Dies kann z.B. durch Aufregung bedingt sein; die
Gehirndurchblutung sinkt, weil die Gefäße auf Hypokapnie kontrahieren.
Durch den pH-Anstieg (=Sinken der H+-Konzentration)
werden negative Bindungsstellen an Plasmaproteinen frei, es werden
vermehrt Calciumionen gebunden, der Plasma-[Ca++] sinkt ab, was zu Krampfneigung führt (Steigerung der neuromuskulären Erregbarkeit, tetanische Krämpfe, Hyperventilationstetanie). Zum Mechanismus der hypocalcämischen Krampfauslösung

s.
dort.
Umgekehrt wie bei respiratorischer Azidose, verringert das Absinken des pCO
2 sowohl [H
2CO
3], [HCO
3-] als auch die Wasserstoffionenkonzentration. Die Bindung von H
+-Ionen an Nichtbicarbonatpuffer sinkt, deren Konzentration steigt in dem Ausmaß, in dem [HCO
3-] absinkt. Auch hier gilt: Solange keine Kompensation eingesetzt hat, bleibt die
Gesamt-Pufferbasenkonzentration unverändert und der BE im
Normalbereich.
Weitere Beispiele: Enzephalitis, Fieber, Hypoxie

Alveoläre Hyperventilation → Hypokapnie → respiratorische Alkalose, Abfall Plasma-[Ca++] → erhöhte Erregbarkeit von Nerven und Muskeln
|
Die folgenden
Abbildungen stellen verschiedene Ursachen dar, welche Alkalose bzw.
Azidose bewirken können. Hyper- oder Hypoventilation bedingen
respiratorische Störungen, alle anderen sind nicht-respiratorisch
(früher: "metabolisch"):
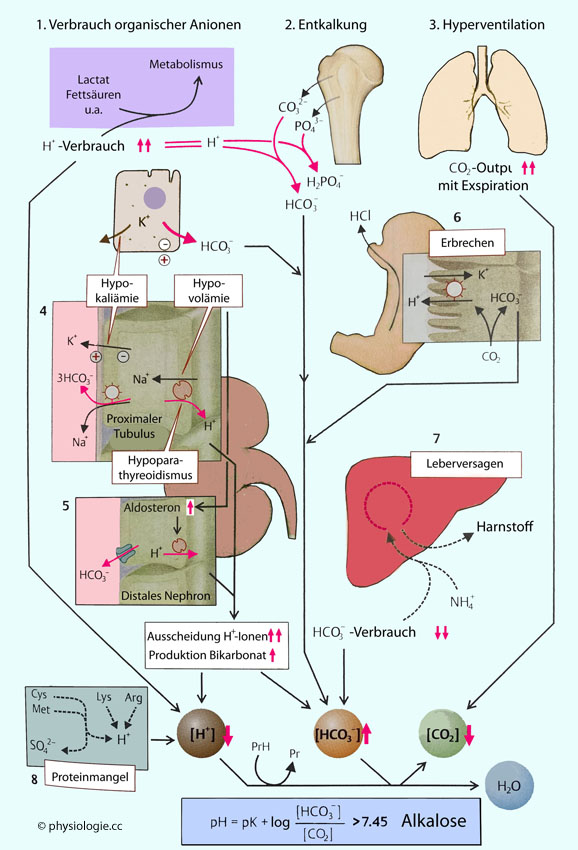
 Abbildung: Mögliche Ursachen einer Alkalose
Abbildung: Mögliche Ursachen einer Alkalose
Nach einer Vorlage bei Roger TannerThies: Physiology - An Illustrated Review. Thieme 2012
1: Die Metabolisierung von Säuren kann in
Kombination mit der Entfernung von H-Ionen zu Basenüberschuss und damit
zu Alkalose führen.
2: Ebenso die Herauslösung basischer Salze aus dem Knochen, z.B. bei Immobilisierung (mangelnde Knochenbelastung)
3: Hyperventilation entfernt mehr CO2 aus dem Körper als nachgebildet wird, Hypokapnie und respiratorische Alkalose ist die Folge.
4: Hypokaliämie erhöht den chemischen Gradienten des K+-Ausstroms
aus den Zellen. Einige Zellen laden sich dann stärker auf, was Anionen
wie Bicarbonat aus der Zelle treibt und den extrazellulären pH-Wert
anhebt.
5: Intrazellulär sinkt der pH-Wert; das regt in der Niere (proximale Nierentubuli) H+-Sekretion (Na/H-Austauscher der apikalen Membran) und Bicarbonatproduktion an (Na/HCO3- Cotransport der basolateralen Membran); Aldosteron regt die apikale H+-Sekretion in distalen Tubuli an; all das führt zu Alkalose.
6: Erbrechen führt zu Verlust von Salzsäure und damit Alkalose.
7: Bei gestörter Harnstoffsynthese in der Leber verbraucht diese
weniger Bicarbonat, erhöhte Bicarbonatwerte im Blut heben dessen
pH-Wert.
8: Wird weniger Protein abgebaut als üblich (z.B. Mangel an Nahrungseiweiß), favorisiert das eine sinkende H+-Konzentration (pH-Anstieg) im Extrazellulärraum

Respiratorische Azidose ensteht durch Hypoventilation (mangelnde pCO
2-Abatmung), Steigerung des pCO
2 (Hyperkapnie bei >45 mmHg) und Absinken des pH-Wertes. Beispielsweise ergibt sich beim
Apnoetauchen (Luftanhalten) eine respiratorische Azidose: Kohlendioxid
kann nicht abgeatmet werden, der resultierende Anstieg des pCO
2 erhöht im Atemzentrum den Atemantrieb ("Lufthunger").
Durch den Anstieg des pCO
2 entstehen vermehrt H
2CO
3, Bicarbonat und Wasserstoffionen (CO
2 + H
2O

H
2CO
3
HCO
3- + H
+). Die H
+-Ionen binden vorwiegend an Nichtbicarbonatpuffer, und deren Konzentration sinkt in dem Ausmaß, in dem [HCO
3-] ansteigt.
Solange
keine Kompensation eingesetzt hat, bleiben die
Gesamt-Pufferbasenkonzentration unverändert und der BE (base excess) im
Normalbereich (d.h. nahe 0).
Weitere Beispiele: Lungenemphysem, Lungenödem, Pneumothorax,
Kyphoskoliose, Asthma bronchiale, Verlegung der Atemwege,
neuromuskuläre Erkrankungen, Hemmung des Atemzentrums

Alveoläre Hypoventilation → Hyperkapnie → respiratorische Azidose, Bicarbonatanstieg
|
Nichtrespiratorische Alkalose
Nicht-respiratorische (früher "metabolische") Alkalose tritt durch
Verlust von Säure auf, z.B. durch starkes Erbrechen. Der HCl-Verlust
aus dem Magen wird wettgemacht (erhöhte Sekretionstätigkeit der
Belegzellen), was die Bicarbonatproduktion Richtung Blut steigert und zu Alkalose führt.

Ein Kennzeichen der nichtrespiratorischen Alkalose ist ein Ansteigen der
Pufferbasen und ein positiver BE- (base excess-) Wert.
Beispiele: Milch-Alkali-Syndrom,
Hypokaliämie,
Hyperaldosteronismus
Einen positiven BE findet man bei respiratorischer Azidose (als Kompensation) oder nicht-respiratorischer Alkalose (als Ursache)
|
Die folgende  Abbildung gibt weitere Beispiele für das Auftreten von Azidosen:
Abbildung gibt weitere Beispiele für das Auftreten von Azidosen:

 Abbildung: Mögliche Ursachen einer Azidose
Abbildung: Mögliche Ursachen einer Azidose
Nach einer Vorlage bei Roger TannerThies: Physiology - An Illustrated Review. Thieme 2012
1: Entstehen im Stoffwechsel vermehrt organische Säuren oder werden zu wenig davon abgebaut, sinkt der pH-Wert im Blut.
2: Vermehrte Mineralisierung
(Knochenwachstum) steigert ebenfalls die Bildung von H
+-Ionen.
3: Verminderte Abatmung von CO
2 (Hypoventilation) führt zu Hyperkapnie und respiratorischer Azidose.
4: Hypokaliämie senkt den
Austritt von Bicarbonat aus den (depolarisierten) Zellen und damit auch
die Pufferbasenkonzentration und den pH-Wert im Blutplasma.
5: Auch der Na/HCO
3-Cotransport in den
proximalen Nierentubuli - der zum Efflux von Bicarbonat beiträgt - wird
schächer, es kommt zu intrazellulärer Azidose, diese wiederum hemmt die
H
+-Sekretion und Bicarbonatproduktion. Dieses Muster tritt auch bei Hypoaldosteronismus in distalen Tubuli auf.
6: Durchfall bewirkt Bicarbonatverlust mit dem Stuhl.
7: Zur Synthese von Harnstoff benötigt die Leber Bicarbonat (und
Ammoniumionen). Verstärkte Harnstoffsynthese kann daher zu Azidose
führen.
8: Proteinexzess (eiweißreiche Kost) führt zu erhöhtem Abbau von Aminosäuren, dabei fallen vermehrt H
+-Ionen an

Nichtrespiratorische Azidose
Nicht-respiratorische (früher "metabolische") Azidose
entsteht durch erhöhte Zufuhr saurer Valenzen in den Kreislauf, z.B. durch starke
Muskeltätigkeit: Lactatanstieg, pH-Abfall.

Ein Kennzeichen der nichtrespiratorischen Azidose ist ein Absinken der
Pufferbasen und ein negativer BE- (base excess-) Wert.
Weitere Beispiele: Ketoazidose
(chronischer Hungerzustand, unkompensierter Diabetes mellitus),
Diarrhoe mit Bicarbonatverlust, Niereninsuffizienz mit Urämie. Die
respiratorische Kompensation erfolgt in Form einer vertieften Atmung
(Kußmaul-Atmung)
Der arterielle pCO2 ist bei einer (teil)kompensierten metabolische Azidose (z.B. diabetische Ketoazidose) vermindert
Metabolische Azidosen werden durch beschleunigte / vertiefte ("Kußmaul-") Atmung kompensiert
|
Kompensationsmechanismen
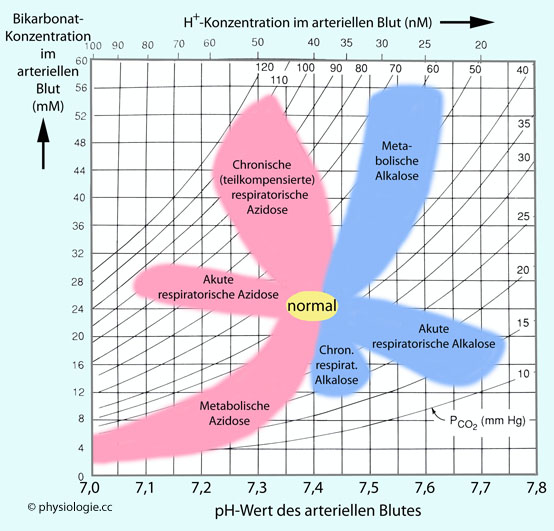
 Abbildung: Säure-Basen-Nomogramm im Bicarbonat-pH-Plot
Modifiziert nach Brenner / Rector (eds), The Kidney, 3rd ed. Saunders 1986
Abbildung: Säure-Basen-Nomogramm im Bicarbonat-pH-Plot
Modifiziert nach Brenner / Rector (eds), The Kidney, 3rd ed. Saunders 1986
Blut-pH- (untere Skala) bzw.
Wasserstoffionenkonzentration (obere Skala) auf der x-Achse,
Bikarbonatspiegel im Blut auf der y-Achse. In die kolorierten Flächen
fallen ~95% der beobachteten Datenpunkte. Die durch das Nomogramm laufenden Kurven deuten unterschiedliche pCO2-Niveaus an (Normalwert 40 mmHg).
Teilkompensierte chronische respiratorische Störungen nähren sich einem
pH-Bereich von ungefähr 7,3 bis 7,5 an (Normalbereich 7,35-7,45),
während akute respiratorische Störungen eine pH-Bereich zwischen 7,1
und 7,7, umspannen. Die pCO2-Werte können bei respiratorischen Störungen zwischen ~10 und ~110 mmHg liegen. Metabolische Azidosen können pH-Werte bis zu 7,0 und pCO2-Werte bis zu 10 mmHg erreichen (respiratorische Kompensation), metabolische Alkalosen bis zu 7,6 / 70 mmHg

Die Kompensation einer Störung erfolgt durch den Organismus selbst, indem das Gleichgewicht von pCO2 und [HCO3-] in der Henderson-Hasselbalch-Gleichung bestehen bleibt bzw. wiederhergestellt wird:
 Respiratorische Azidose wird (abgesehen von Steigerung der CO2-Abatmung) durch Erhöhung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert
(renal) → BE wird positiv. Renale Kompensation schließt ein: Erhöhte
Produktion "neuen" Bicarbonats, vermehrte Ausscheidung von NH4+, vermehrte Ausscheidung titrierbarer Säuren, vermehrte Resorption von Bicarbonat aus dem Tubulus.
Respiratorische Azidose wird (abgesehen von Steigerung der CO2-Abatmung) durch Erhöhung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert
(renal) → BE wird positiv. Renale Kompensation schließt ein: Erhöhte
Produktion "neuen" Bicarbonats, vermehrte Ausscheidung von NH4+, vermehrte Ausscheidung titrierbarer Säuren, vermehrte Resorption von Bicarbonat aus dem Tubulus.
 Nicht-respiratorische Azidose wird respiratorisch kompensiert, d.h. durch Steigerung der CO2-Abatmung (Hyperpnoe) →
Nicht-respiratorische Azidose wird respiratorisch kompensiert, d.h. durch Steigerung der CO2-Abatmung (Hyperpnoe) → pCO
2 sinkt.
Renale Kompensation schließt ein: Erhöhte Produktion "neuen" Bicarbonats, vermehrte Ausscheidung von NH4+, vermehrte Ausscheidung titrierbarer Säuren.

Nichtrespiratorische Azidose vertieft und beschleuningt die Atmung (Kußmaul-Atmung)
|
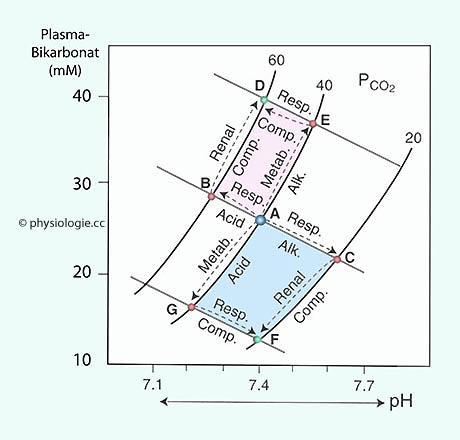
 Abbildung: Störungen und Kompensationen (schematisch)
Nach einer Vorlage bei memorangapp.com
Abbildung: Störungen und Kompensationen (schematisch)
Nach einer Vorlage bei memorangapp.com
Comp. = Kompensation, "Renal" = nichtrespiratorisch, "Resp" = respiratorisch
Acid. = Azidose, Alk. = Alkalose
Rote Punkte: Nichtkompensierte Störungen (Azidose bzw. Alkalose)
Grüne Punkte: Kompensierte Störungen (pH im Normbereich)
Linie D-E: Positiver BE (erhöhte Pufferbasenkonzentration)
Linie B-A-C: BE = 0 (normale Pufferbasenkonzentration)
Linie G-F: Negativer BE (erniedrigte Pufferbasenkonzentration)
Rosa Fläche: Erhöhte Pufferbasen (positiver BE)
Blaue Fläche: Erniedrigte Pufferbasen (negativer BE)
A: Normalpunkt
B: Nichtkompensierte respiratorische Azidose
C: Nichtkompensierte respiratorische Alkalose
D: Kompensierte respiratorische Azidose / nichtrespiratorische Alkalose
E: Nichtkompensierte nichrespiratorische Alkalose
F: Kompensierte respiratorische Alkalose / nichtrespiratorische Azidose
G: Nichtkompensierte nichrespiratorische Azidose
Auch hier gilt: Physiologischerweise werden - ausgehend vom Normalpunkt
A - die Punkte D bzw. F direkt erreicht, der pH-Normbereich nicht
verlassen. Die Abbildung verdeutlicht das gedankliche 2-Stufen-Schema -
zuerst kompletter Störungseffekt ohne Kompensation (rote Punkte), dann
vollständige Kompensation (grüne Punkte)

 Respiratorische Alkalose wird (abgesehen von Senkung der CO2-Abatmung) durch Senkung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert (renal) → BE wird negativ. Renale Kompensation schließt ein: Reduzierte Resorption von Bicarbonat aus dem Tubulus, verringerte Ausscheidung von NH4+, verringerte Ausscheidung titrierbarer Säuren.
Respiratorische Alkalose wird (abgesehen von Senkung der CO2-Abatmung) durch Senkung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert (renal) → BE wird negativ. Renale Kompensation schließt ein: Reduzierte Resorption von Bicarbonat aus dem Tubulus, verringerte Ausscheidung von NH4+, verringerte Ausscheidung titrierbarer Säuren.
 Nicht-respiratorische Alkalose wird respiratorisch kompensiert, d.h. durch Senkung der CO2-Abatmung (Hypopnoe) →
Nicht-respiratorische Alkalose wird respiratorisch kompensiert, d.h. durch Senkung der CO2-Abatmung (Hypopnoe) → pCO
2 steigt.
Renale Kompensation: Vermehrte Bicarbonatausscheidung.
Veränderungen des pH-Wertes im extrazellulären Raum beeinflussen auch den Kaliumhaushalt ( vgl. dort):
vgl. dort):
 Bei azidotischer Stoffwechsellage dringen H+-Ionen durch die Zellmembran und senken den intrazellulären pH.
Bei azidotischer Stoffwechsellage dringen H+-Ionen durch die Zellmembran und senken den intrazellulären pH.
 Die erhöhte Wasserstoffionenkonzentration hemmt sowohl die Tätigkeit der Na+-K+-ATPase (Na-K-Pumpe) als auch (wo vorhanden) der Na+-K+-Cl--Cotransporter, die Aufnahme von Kalium in die Zelle sinkt.
Die erhöhte Wasserstoffionenkonzentration hemmt sowohl die Tätigkeit der Na+-K+-ATPase (Na-K-Pumpe) als auch (wo vorhanden) der Na+-K+-Cl--Cotransporter, die Aufnahme von Kalium in die Zelle sinkt.
 Weiters konkurrieren Wasserstoffionen mit Kaliumionen um Bindungsstellen an zellulärem Eiweiß.
Weiters konkurrieren Wasserstoffionen mit Kaliumionen um Bindungsstellen an zellulärem Eiweiß.

Kalium diffundiert aus den Zellen, die extrazelluläre [K
+] steigt an und kann zu Hyperkaliämie führen.
Im Fall einer Azidose ( Abbildung) bedeutet das, dass einerseits
weniger Kalium in die Zelle aufgenommen wird und andererseits mehr
Kaliumionen von intrazellulären Bindungsstellen freiwerden und die
Zelle verlassen können.
Abbildung) bedeutet das, dass einerseits
weniger Kalium in die Zelle aufgenommen wird und andererseits mehr
Kaliumionen von intrazellulären Bindungsstellen freiwerden und die
Zelle verlassen können.
 Praktische Konsequenz: Azidose führt zu einer Umverlagerung
von Kalium aus dem Intra- in den Extrazellulärraum. Umgekehrt senkt Alkalose den Kaliumspiegel.
Praktische Konsequenz: Azidose führt zu einer Umverlagerung
von Kalium aus dem Intra- in den Extrazellulärraum. Umgekehrt senkt Alkalose den Kaliumspiegel.
Azidose → Hyperkaliämie
Alkalose → Hypokaliämie
|
 (Merkhilfe: Wasserstoffionen treiben der Zelle das Kalium aus.)
(Merkhilfe: Wasserstoffionen treiben der Zelle das Kalium aus.)

Behandlung einer Azidose (=pH-Wert <7,35, erhöhte [H+]) führt aufgrund des oben geschildertern Mechanismus automatisch zu einer Aufnahme von Kalium in die Zellen. Die Beseitigung einer Azidose senkt den Kaliumspiegel im Blut,
eine allenfalls mit der Azidose bestehende Hyperkaliämie muss u.U.
nicht eigens behandelt werden - oft normalisiert sich der Kaliumspiegel
schon durch eine Puffergabe.
 Über physiologische Kompensationsmechanismen bei Vorliegen einer Hyperkaliämie (Serum-[K+] > 5 mM) s. dort
Über physiologische Kompensationsmechanismen bei Vorliegen einer Hyperkaliämie (Serum-[K+] > 5 mM) s. dort
 Bei einem Mangel an Sauerstoff (oxidativer Apparat) oder Insulin (Glucoseaufnahme) fallen vermehrt nichtflüchtige ("fixe", endogene) Säuren
an: z.B. bei vermehrter Bildung von Milchsäure (Laktazidose) oder
Ketonkörpern (hungerbedingte oder diabetische Ketoazidose). Folge ist
eine metabolische Azidose, die sowohl renal (vermehrte Rückgewinnung
von Bicarbonat) als auch respiratorisch kompensiert wird (Mehratmung).
Bei einem Mangel an Sauerstoff (oxidativer Apparat) oder Insulin (Glucoseaufnahme) fallen vermehrt nichtflüchtige ("fixe", endogene) Säuren
an: z.B. bei vermehrter Bildung von Milchsäure (Laktazidose) oder
Ketonkörpern (hungerbedingte oder diabetische Ketoazidose). Folge ist
eine metabolische Azidose, die sowohl renal (vermehrte Rückgewinnung
von Bicarbonat) als auch respiratorisch kompensiert wird (Mehratmung).
Ein solcher vermehrter Anfall von nichtflüchtigen Säuren führt auch zu einer Vergrößerung der Anionenlücke (anion gap).
Diese ergibt sich aus der Tatsache, dass in der klinischen Laborroutine
nicht immer alle Ionen des Serums gemessen werden und der Wert der
"unter den Tisch gefallenen" dann nicht bekannt ist. (Der Kalium-Serumwert
wird vom Körper sehr genau reguliert (3,6 - 4,4 mM) und
bietet insoferne keine Überraschungen.)
Die Anionenlücke
ergibt sich aus dem Unterschied der Summe der routinemäßig bestimmten
Kationen und der routinemäßig bestimmten Anionen und ist (meist)
folgendermaßen definiert:
Anionenlücke = ([Na+] + [K+]) - ([HCO3-] + [Cl-])
|
Bei einem normalen Ionenmuster
im Blutplasma ergibt sich für die (so definierte) Anionenlücke ein
Normalwert von knapp 10 mM (sollte nicht über 12 mM betragen): Aminosäuren (~2,4 mM), Proteine
(~2 mM), Lactat (~1,5 mM), Phosphat (~1 mM), Sulfat (~0,5 mM),
Ketonkörpern (~0,4 mM), Pyruvat und Citrat (zusammen ~0,3 mM). Weitere
Anionen liegen in vergleichsweise sehr geringer Konzentration vor.
Akute Lactazidose erhöht den Betrag der Anionenlücke im Blutplasma
|


 Der pH-Wert in
den Zellen liegt meist um 7,1, der Blut-pH um 7,4 - die Wasserstoffionenkonzentration im intrazellulären Raum liegt doppelt so hoch wie im Extrazellulärraum. Die
biochemischen Systeme reagieren empfindlich auf Änderungen des pH,
der durch Pufferbasen stabilisiert und durch Atmung,
Leber- und Nierentätigkeit reguliert wird (Werte <6,9 und >7,8
sind lebensbedrohlich). Pro Tag fallen im Körper
~70 mM nichtflüchtige Säuren zur Ausscheidung an (~40 mM Ammonium, ~30 mM titrierbare Säure - Sulfat, Phosphat). Etwa 15.103 mM (>200mal so viel) verlassen den Körper über die Atmung (CO2: Anhydrid der Kohlensäure) Der pH-Wert in
den Zellen liegt meist um 7,1, der Blut-pH um 7,4 - die Wasserstoffionenkonzentration im intrazellulären Raum liegt doppelt so hoch wie im Extrazellulärraum. Die
biochemischen Systeme reagieren empfindlich auf Änderungen des pH,
der durch Pufferbasen stabilisiert und durch Atmung,
Leber- und Nierentätigkeit reguliert wird (Werte <6,9 und >7,8
sind lebensbedrohlich). Pro Tag fallen im Körper
~70 mM nichtflüchtige Säuren zur Ausscheidung an (~40 mM Ammonium, ~30 mM titrierbare Säure - Sulfat, Phosphat). Etwa 15.103 mM (>200mal so viel) verlassen den Körper über die Atmung (CO2: Anhydrid der Kohlensäure)
 Wie Speisen / Getränke den pH-Wert beeinflussen, hängt davon ab, was im Stoffwechsel aus ihnen entsteht - CO2
wird exspiriert, entstehendes Bicarbonat ist eine Pufferbase
("säureüberschüssiges" Essen kann als Base wirken). Stoffe wirken säureüberschüssig (z.B. Glucose → Laktat,
Zystin → Sulfat → saurer Harn), säureverbrauchend (z.B. Milchsäure → Glucose, Citrat → CO2 →) oder pH-neutral (z.B. Triglyzeride, Zucker → CO2 →) Wie Speisen / Getränke den pH-Wert beeinflussen, hängt davon ab, was im Stoffwechsel aus ihnen entsteht - CO2
wird exspiriert, entstehendes Bicarbonat ist eine Pufferbase
("säureüberschüssiges" Essen kann als Base wirken). Stoffe wirken säureüberschüssig (z.B. Glucose → Laktat,
Zystin → Sulfat → saurer Harn), säureverbrauchend (z.B. Milchsäure → Glucose, Citrat → CO2 →) oder pH-neutral (z.B. Triglyzeride, Zucker → CO2 →)
 Wasserstoffionen werden im Rahmen der mitochondrialen Elektronentransportkette zur Oxidation von NADH / NADPH benötigt. H+
wird aus der Mitochondienmatrix befördert (Zytochrom), die im
Intermembranraum angereicherten Wasserstoffionen treiben bei ihrer
Rückdiffusion H+-ATP-Synthase an Wasserstoffionen werden im Rahmen der mitochondrialen Elektronentransportkette zur Oxidation von NADH / NADPH benötigt. H+
wird aus der Mitochondienmatrix befördert (Zytochrom), die im
Intermembranraum angereicherten Wasserstoffionen treiben bei ihrer
Rückdiffusion H+-ATP-Synthase an
 Pufferbasen
halten Störungen des pH-Wertes gering. Ihre Konzentration beträgt 48
mM, jeweils zur Hälfte (24 mM) Bicarbonat und Nichtbicarbonatpuffer (Hämoglobin, ~10% des glomerulär filtrierten Phosphats). Hämoglobin
ändert seine Pufferkapazität mit der Sauerstoffbeladung
(Haldane-Effekt), das macht es zu einem effizienten Blutpuffer. Im
Intrazellulärraum ist Phosphat wegen seiner
Konzentration und Nähe zum pK-Wert der wichtigste Puffer Pufferbasen
halten Störungen des pH-Wertes gering. Ihre Konzentration beträgt 48
mM, jeweils zur Hälfte (24 mM) Bicarbonat und Nichtbicarbonatpuffer (Hämoglobin, ~10% des glomerulär filtrierten Phosphats). Hämoglobin
ändert seine Pufferkapazität mit der Sauerstoffbeladung
(Haldane-Effekt), das macht es zu einem effizienten Blutpuffer. Im
Intrazellulärraum ist Phosphat wegen seiner
Konzentration und Nähe zum pK-Wert der wichtigste Puffer
 Die Bestimmung von pH-Wert, pO2 und pCO2 nennt man Blutgasanalyse. Dazu
wird meist "Kapillarblut" (in eine Kapillare abgefülltes arterielles
Blut) verwendet. Pufferkapazität (~48 mM), Aktualbicarbonat (~24 mM) und Basenabweichung werden berechnet. StandardBicarbonat gilt für 37°C, pCO2 = 40 mmHg, 100% O2-Sättigung des Hämoglobins. Das Van Slyke-Nomogramm stellt den pCO2 (Maßstab logarithmisch) als Funktion des pH-Wertes (pH ist ein Logarithmus) dar. Störungen des pH-Gleichgewichts werden respiratorisch (pCO2)
oder nichtrespiratorisch ("metabolisch":
Pufferkapazität) kompensiert. Unvollständige Kompensation fängt die
Abweichung des pH vom Normwert nur teilweise auf, vollständig
kompensierte Störungen stellen den Normbereich (pH 7,36 bis 7,42)
wieder her Die Bestimmung von pH-Wert, pO2 und pCO2 nennt man Blutgasanalyse. Dazu
wird meist "Kapillarblut" (in eine Kapillare abgefülltes arterielles
Blut) verwendet. Pufferkapazität (~48 mM), Aktualbicarbonat (~24 mM) und Basenabweichung werden berechnet. StandardBicarbonat gilt für 37°C, pCO2 = 40 mmHg, 100% O2-Sättigung des Hämoglobins. Das Van Slyke-Nomogramm stellt den pCO2 (Maßstab logarithmisch) als Funktion des pH-Wertes (pH ist ein Logarithmus) dar. Störungen des pH-Gleichgewichts werden respiratorisch (pCO2)
oder nichtrespiratorisch ("metabolisch":
Pufferkapazität) kompensiert. Unvollständige Kompensation fängt die
Abweichung des pH vom Normwert nur teilweise auf, vollständig
kompensierte Störungen stellen den Normbereich (pH 7,36 bis 7,42)
wieder her
 Die Nieren
entfernen über den Harn (je nach Ernährung und Stoffwechsellage) saure oder auch basische Valenzen aus dem
Körper. Der [Harn-pH] liegt
zwischen 4,5 und 8,2. Harn wäre ohne renale Pufferung sehr sauer (pH 1,3: 70 mmol H+ in 1,5 l/d). Bicarbonat
wird vor allem im proximalen Tubulus zur Pufferung
verbraucht, zur Stabilisierung der Pufferbasen im Blut dient sowohl seine
Rückresorption als auch die Neusynthese (~70 mmol/d). Der proximale Tubulus gewinnt aus Glutamin Bicarbonat und Ammoniumionen; Bicarbonatsynthese erfolgt vor allem über
den Ammonium- und
Phosphatmechanismus. Der Ammonium-Mechanismus scheidet Protonen als Ammonium aus (Ammoniak diffundiert durch Zellmembranen; Ammonium kaum, zirkuliert im Nierenmark und kann vom Sammelrohrsystem genützt werden). Die
Schaltzellen im Sammelrohr können je nach Säure-Basen-Status zwischen Typ-A-Zelle (Sekretion saurer
Valenzen) und Typ-B-Zelle (Sekretion von Bicarbonat) wechseln. Phosphat ist das bedeutsamste Puffersystem im Harn (pK-Wert des primär / sekundären Phosphatsystems 6,8; bei niedrigerem pH (Harn) überwiegt primäres Phosphat (H2PO4-), bei höherem sekundäres Phosphat (HPO4--: Blut 80%) Die Nieren
entfernen über den Harn (je nach Ernährung und Stoffwechsellage) saure oder auch basische Valenzen aus dem
Körper. Der [Harn-pH] liegt
zwischen 4,5 und 8,2. Harn wäre ohne renale Pufferung sehr sauer (pH 1,3: 70 mmol H+ in 1,5 l/d). Bicarbonat
wird vor allem im proximalen Tubulus zur Pufferung
verbraucht, zur Stabilisierung der Pufferbasen im Blut dient sowohl seine
Rückresorption als auch die Neusynthese (~70 mmol/d). Der proximale Tubulus gewinnt aus Glutamin Bicarbonat und Ammoniumionen; Bicarbonatsynthese erfolgt vor allem über
den Ammonium- und
Phosphatmechanismus. Der Ammonium-Mechanismus scheidet Protonen als Ammonium aus (Ammoniak diffundiert durch Zellmembranen; Ammonium kaum, zirkuliert im Nierenmark und kann vom Sammelrohrsystem genützt werden). Die
Schaltzellen im Sammelrohr können je nach Säure-Basen-Status zwischen Typ-A-Zelle (Sekretion saurer
Valenzen) und Typ-B-Zelle (Sekretion von Bicarbonat) wechseln. Phosphat ist das bedeutsamste Puffersystem im Harn (pK-Wert des primär / sekundären Phosphatsystems 6,8; bei niedrigerem pH (Harn) überwiegt primäres Phosphat (H2PO4-), bei höherem sekundäres Phosphat (HPO4--: Blut 80%)
 Azidose liegt bei pH<7,36 vor, Alkalose bei pH>7,42. Störungen können respiratorisch (pCO2) oder nicht-respiratorisch bedingt sein (Pufferbasen). Hypoventilation (pCO2 >45 mmHg - Hyperkapnie) bewirkt respiratorische Azidose, Hyperventilation (pCO2 <45 mmHg - Hypokapnie) respiratorische Alkalose,
sinkende Hirndurchblutung und Hypocalcämie (Krampfneigung).
Nicht-respiratorische (metabolische) Störungen äußern sich primär in
verändertem Pufferbasengehalt und können respiratorisch kompensiert
werden. Veränderungen des extrazellulären pH beeinflussen den
Kaliumhaushalt: Dringen H+-Ionen in die Zelle, nimmt deren
Kaliumaufnahme ab; bei Alkalose ist es umgekehrt: Azidose →
Hyperkaliämie; Alkalose → Hypokaliämie Azidose liegt bei pH<7,36 vor, Alkalose bei pH>7,42. Störungen können respiratorisch (pCO2) oder nicht-respiratorisch bedingt sein (Pufferbasen). Hypoventilation (pCO2 >45 mmHg - Hyperkapnie) bewirkt respiratorische Azidose, Hyperventilation (pCO2 <45 mmHg - Hypokapnie) respiratorische Alkalose,
sinkende Hirndurchblutung und Hypocalcämie (Krampfneigung).
Nicht-respiratorische (metabolische) Störungen äußern sich primär in
verändertem Pufferbasengehalt und können respiratorisch kompensiert
werden. Veränderungen des extrazellulären pH beeinflussen den
Kaliumhaushalt: Dringen H+-Ionen in die Zelle, nimmt deren
Kaliumaufnahme ab; bei Alkalose ist es umgekehrt: Azidose →
Hyperkaliämie; Alkalose → Hypokaliämie
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Säure-Basen-Haushalt
Säure-Basen-Haushalt
 Azidose: acidus = sauer, unangenehm
Azidose: acidus = sauer, unangenehm Säurewirkung
Säurewirkung  Intrazellulärer pH
Intrazellulärer pH  Pufferbasen
Pufferbasen  Blutgasanalyse
Blutgasanalyse  Bicarbonat-pH-Diagramm
Bicarbonat-pH-Diagramm  Puffergleichung
Puffergleichung  Niere und pH-Regulation
Niere und pH-Regulation  Störungen
Störungen  Kompensationsmechanismen
Kompensationsmechanismen
 Nichtflüchtige Säuren
Nichtflüchtige Säuren  Titrierbare Säuren
Titrierbare Säuren  Puffer
Puffer  Pufferkapazität
Pufferkapazität  pK-Wert
pK-Wert  Standardbicarbonat
Standardbicarbonat  Anionenlücke
Anionenlücke
 Core messages
Core messages
 Abbildung: Vereinfachtes Schema des H+-Haushalts
Abbildung: Vereinfachtes Schema des H+-Haushalts Die Protonenkonzentration [H+]
an verschiedenen Stellen des Körpers wirkt sich empfindlich auf biochemische / physiologische Systeme aus,
und ihre Stabilisierung ist von großer Bedeutung für das normale
Funktionieren von Stoffwechsel und Lebensvorgängen - vor allem, weil Enzyme nur in einem engen pH-Bereich optimal funktionieren und Proteine bei starken pH-Abweichungen denaturiert werden können.
Die Protonenkonzentration [H+]
an verschiedenen Stellen des Körpers wirkt sich empfindlich auf biochemische / physiologische Systeme aus,
und ihre Stabilisierung ist von großer Bedeutung für das normale
Funktionieren von Stoffwechsel und Lebensvorgängen - vor allem, weil Enzyme nur in einem engen pH-Bereich optimal funktionieren und Proteine bei starken pH-Abweichungen denaturiert werden können. Abbildung unten), hat es sich bewährt, statt der molaren Konzentration ihre Hochzahl (=dekadischen Logarithmus) anzugeben und das
Minuszeichen wegzulassen. Das vereinfacht die Angabe (z.B. heißt es statt "10-7,4
mol/l Wasserstoffionenkonzentration" einfach pH = 7,4). Je höher [H+] (je saurer), desto geringer die negative Hochzahl und desto niedriger der pH-Wert.
Abbildung unten), hat es sich bewährt, statt der molaren Konzentration ihre Hochzahl (=dekadischen Logarithmus) anzugeben und das
Minuszeichen wegzulassen. Das vereinfacht die Angabe (z.B. heißt es statt "10-7,4
mol/l Wasserstoffionenkonzentration" einfach pH = 7,4). Je höher [H+] (je saurer), desto geringer die negative Hochzahl und desto niedriger der pH-Wert. Der pH-Wert - pH steht für potentia (Hochzahl) Hydrogenii (gemeint sind Wasserstoffionen) -
ist der negative dekadische Logarithmus der molaren
Wasserstoffionenkonzentration in der betreffenden wässrigen Lösung. Beispielsweise bedeutet ein pH von 7,4 (normaler pH-Wert des Blutes) eine Wasserstoffionenkonzentration von 10-7,4 mol/l (40 nM).
Der pH-Wert - pH steht für potentia (Hochzahl) Hydrogenii (gemeint sind Wasserstoffionen) -
ist der negative dekadische Logarithmus der molaren
Wasserstoffionenkonzentration in der betreffenden wässrigen Lösung. Beispielsweise bedeutet ein pH von 7,4 (normaler pH-Wert des Blutes) eine Wasserstoffionenkonzentration von 10-7,4 mol/l (40 nM). Ein pH-Wert von 7,0 bedeutet daher nur bei einer Temperatur von 25°C Neutralität der betreffenden wässrigen Lösung; bei 37°C beträgt der Neutral-pH 6,8 (bei ungefähr 4-fach höherer Konzentration der H+- und OH--Ionen im Vergleich zu 25°C).
Ein pH-Wert von 7,0 bedeutet daher nur bei einer Temperatur von 25°C Neutralität der betreffenden wässrigen Lösung; bei 37°C beträgt der Neutral-pH 6,8 (bei ungefähr 4-fach höherer Konzentration der H+- und OH--Ionen im Vergleich zu 25°C).
 Abbildung: pH-Skala
Abbildung: pH-Skala

 Abbildung: Tägliche Aufnahme und Ausscheidung saurer Valenzen
Abbildung: Tägliche Aufnahme und Ausscheidung saurer Valenzen
 Der allergrößte Teil der im Stoffwechsel auftauchenden sauren Valenzen wird in Form von CO2 abgeatmet
(
Der allergrößte Teil der im Stoffwechsel auftauchenden sauren Valenzen wird in Form von CO2 abgeatmet
( Abbildung) und verliert dadurch seinen pH-Effekt.
Abbildung) und verliert dadurch seinen pH-Effekt.
 Sie produzieren H+ (als Abfallprodukt) → Säurebildung (Bicarbonatverbrauch, gesenkter Pufferbasenwert). Beispiel: Glucose → Laktat, Zystin → Sulfat
Sie produzieren H+ (als Abfallprodukt) → Säurebildung (Bicarbonatverbrauch, gesenkter Pufferbasenwert). Beispiel: Glucose → Laktat, Zystin → Sulfat

 Sie verbrauchen H+ (als Reaktionspartner) → Basenbildung (Bicarbonatzuwachs, gesteigerter Pufferbasenwert). Beispiel: Laktat → Glucose, Citrat → CO2
Sie verbrauchen H+ (als Reaktionspartner) → Basenbildung (Bicarbonatzuwachs, gesteigerter Pufferbasenwert). Beispiel: Laktat → Glucose, Citrat → CO2


 Keines von beiden (pH-neutral). Beispiel: Triglyzeride, Zucker → CO2 (wird abgeatmet und verlässt den Körper)
Keines von beiden (pH-neutral). Beispiel: Triglyzeride, Zucker → CO2 (wird abgeatmet und verlässt den Körper) Als nichtflüchtige Säuren (nonvolatile / metabolic / fixed acids) bezeichnet man im Körper gebildete Säuren, die nicht als CO2
mit der Atmung ausgeschieden werden können (Sulfat, Phosphat,
organische Säuren). Der Organismus kann auch nichtflüchtige Basen
erzeugen, die dann als Bicarbonat anfallen.
Als nichtflüchtige Säuren (nonvolatile / metabolic / fixed acids) bezeichnet man im Körper gebildete Säuren, die nicht als CO2
mit der Atmung ausgeschieden werden können (Sulfat, Phosphat,
organische Säuren). Der Organismus kann auch nichtflüchtige Basen
erzeugen, die dann als Bicarbonat anfallen. So wirken "saure" Fruchtgetränke, die reichlich Citrat, Laktat usw. enthalten, alkalisierend und steigern den Harn-pH.
So wirken "saure" Fruchtgetränke, die reichlich Citrat, Laktat usw. enthalten, alkalisierend und steigern den Harn-pH.  generierten sauren Valenzen (rund 15.000 mmol/d,
generierten sauren Valenzen (rund 15.000 mmol/d,  Abbildung) fällt als CO2 aus dem Abbau neutraler Kohlenhydrate und Fette sowie der meisten neutralen Aminosäuren an - das ist mehr als das 100-fache der im Körper gelösten CO2-Menge. CO2 wird
ausgeatmet und belastet den
Säure-Basen-Haushalt bzw. die Pufferfähigkeit des Blutes überhaupt
nicht.
Abbildung) fällt als CO2 aus dem Abbau neutraler Kohlenhydrate und Fette sowie der meisten neutralen Aminosäuren an - das ist mehr als das 100-fache der im Körper gelösten CO2-Menge. CO2 wird
ausgeatmet und belastet den
Säure-Basen-Haushalt bzw. die Pufferfähigkeit des Blutes überhaupt
nicht.  Säure - das ist die durch Rücktitration des Harns mit NaOH bestimmbare Säuremenge (Phosphat, Harnsäure, Kreatinin..) - müssen renal
ausgeschieden werden (
Säure - das ist die durch Rücktitration des Harns mit NaOH bestimmbare Säuremenge (Phosphat, Harnsäure, Kreatinin..) - müssen renal
ausgeschieden werden ( Abbildung: ~70 mmol/d) - rund 1 mmol / kg Körpergewicht / Tag oder ~0,5% der gesamten
Säureausscheidung (~99,5% erfolgen über die Armung). Zur Gesamtbilanz des Körpers kommt noch, dass mit dem Stuhl pro Tag typischerweise ~10 mmol basische Valenzen (OH-) verloren gehen (das bedeutet für den Organismus eine zusätzliche Säurelast von 10 mmol/d).
Abbildung: ~70 mmol/d) - rund 1 mmol / kg Körpergewicht / Tag oder ~0,5% der gesamten
Säureausscheidung (~99,5% erfolgen über die Armung). Zur Gesamtbilanz des Körpers kommt noch, dass mit dem Stuhl pro Tag typischerweise ~10 mmol basische Valenzen (OH-) verloren gehen (das bedeutet für den Organismus eine zusätzliche Säurelast von 10 mmol/d).
 Abbildung: Säure-Basen-Bilanz einer 70 kg schweren Person auf westlicher Standarddiät
Abbildung: Säure-Basen-Bilanz einer 70 kg schweren Person auf westlicher Standarddiät
 Abbau
phosphorhaltiger Stoffe (Nukleinsäuren)
Abbau
phosphorhaltiger Stoffe (Nukleinsäuren) unvollständiger
Oxidation von Kohlenhydraten und Fetten (Laktat, Ketosäuren)
unvollständiger
Oxidation von Kohlenhydraten und Fetten (Laktat, Ketosäuren) Oxidation schwefelhaltiger (Zystin, Methionin - Ausscheidung von Sulfat) oder kationischer (wie Lysin, Arginin) Aminosäuren
Oxidation schwefelhaltiger (Zystin, Methionin - Ausscheidung von Sulfat) oder kationischer (wie Lysin, Arginin) Aminosäuren ~40 mmol/d als Ammonium (aus Glutamin), das als Kation nicht mehr rückresorbiert und damit ausgeschieden wird (ion trapping - besonders bei Azidose
~40 mmol/d als Ammonium (aus Glutamin), das als Kation nicht mehr rückresorbiert und damit ausgeschieden wird (ion trapping - besonders bei Azidose ), und
), und  bis zu ~30 mmol/d als "titrierbare Säure" - Phosphat (~80%), Harnsäure (~20%), andere organische Säuren, Sulfat (Harn-pH bis 4,7).
bis zu ~30 mmol/d als "titrierbare Säure" - Phosphat (~80%), Harnsäure (~20%), andere organische Säuren, Sulfat (Harn-pH bis 4,7). 
 Abbildung: Pufferung titrierbarer Säuren im Tubuluslumen
Abbildung: Pufferung titrierbarer Säuren im Tubuluslumen Unter titrierbarer Säure versteht
man Anionen, die als Puffer im Harn wirken - sie binden
Wasserstoffionen und ermöglichen der Niere die Ausscheidung von Säuren
bei nur mäßiger Reduktion des Harn-pH.
Unter titrierbarer Säure versteht
man Anionen, die als Puffer im Harn wirken - sie binden
Wasserstoffionen und ermöglichen der Niere die Ausscheidung von Säuren
bei nur mäßiger Reduktion des Harn-pH. Dass die renale Ausscheidung nichtflüchtiger saurer Valenzen für die
Aufrechterhaltung des Säure-Basen-Gleichgewichts im Körper entscheidend
ist, wird durch die Tatsache unterstrichen, dass Nierenversagen zum Rückstau saurer Valenzen und metabolischer Azidose führt.
Dass die renale Ausscheidung nichtflüchtiger saurer Valenzen für die
Aufrechterhaltung des Säure-Basen-Gleichgewichts im Körper entscheidend
ist, wird durch die Tatsache unterstrichen, dass Nierenversagen zum Rückstau saurer Valenzen und metabolischer Azidose führt. Abbildung) - das sind mehr als 4000 mmol in 24
Stunden (
Abbildung) - das sind mehr als 4000 mmol in 24
Stunden ( s. dort). Der Mechanismus
ist immer derselbe: Unter der beschleunigenden Wirkung von
Carboanhydrase (CA), die in mehreren Nephronabschnitten exprimiert
wird, entsteht im Tubulus aus Bicarbonat und H+ einer Säure CO2. Das Kohlendioxid diffundiert durch die apikale Membran (die für CO2
hohe Durchlässigkeit hat) in Tubulusepithelzellen; hier entsteht wieder
Bicarbonat (CA sei Dank), das basolateral die Zelle verlässt; das
entstandene H+ rezirkuliert in das Tubuluslumen.
s. dort). Der Mechanismus
ist immer derselbe: Unter der beschleunigenden Wirkung von
Carboanhydrase (CA), die in mehreren Nephronabschnitten exprimiert
wird, entsteht im Tubulus aus Bicarbonat und H+ einer Säure CO2. Das Kohlendioxid diffundiert durch die apikale Membran (die für CO2
hohe Durchlässigkeit hat) in Tubulusepithelzellen; hier entsteht wieder
Bicarbonat (CA sei Dank), das basolateral die Zelle verlässt; das
entstandene H+ rezirkuliert in das Tubuluslumen.  Neutralisierung des Großteils saurer Valenzen durch Bildung (und Ausatmung) von CO2
Neutralisierung des Großteils saurer Valenzen durch Bildung (und Ausatmung) von CO2 Bildung neuen Bicarbonats in den Nieren.
Bildung neuen Bicarbonats in den Nieren. Abbildung).
Abbildung). vgl. dort). Ammoniak ist ein Protonenakzeptor; da die Konzentration an freiem Ammoniak (NH3)
im glomerulären Filtrat sehr niedrig ist (Plasmaspiegel <1 µM/l),
stammt das tubuläre Ammoniak im Wesentlichen aus den Tubuluszellen
durch Abspaltung von H+ - das in den Tubulus wandert und dort wieder NH4+ bildet (
vgl. dort). Ammoniak ist ein Protonenakzeptor; da die Konzentration an freiem Ammoniak (NH3)
im glomerulären Filtrat sehr niedrig ist (Plasmaspiegel <1 µM/l),
stammt das tubuläre Ammoniak im Wesentlichen aus den Tubuluszellen
durch Abspaltung von H+ - das in den Tubulus wandert und dort wieder NH4+ bildet ( Abbildung).
Abbildung). 
 Abbildung).
Abbildung). Über die Zusammensetzung des Urins s. dort
Über die Zusammensetzung des Urins s. dort Zum Ammoniummechanismus s. auch dort
Zum Ammoniummechanismus s. auch dort "Metabolische" Säurebildung
(MSB) (metabolic acid production MEP) - z.B. Laktatproduktion bei körperlicher Belastung - sowie
"Metabolische" Säurebildung
(MSB) (metabolic acid production MEP) - z.B. Laktatproduktion bei körperlicher Belastung - sowie 
 Säure, die im Rahmen der Verdauungsfunktion (netto)
entsteht (gastrointestinale Säurebildung, GSB) (gastrointestinal acid production GAP). Daher ergibt sich
Säure, die im Rahmen der Verdauungsfunktion (netto)
entsteht (gastrointestinale Säurebildung, GSB) (gastrointestinal acid production GAP). Daher ergibt sich ESB = MSB + GSB (oder: EAP = MAP + GAP)
ESB = MSB + GSB (oder: EAP = MAP + GAP) Zur endogenen Säureproduktion vgl. dort
Zur endogenen Säureproduktion vgl. dort
 Abbildung: Kompensation nach Einbringen von sauren oder basischen Valenzen in eine Zelle
Abbildung: Kompensation nach Einbringen von sauren oder basischen Valenzen in eine Zelle
 Abbildung): Dieser kehrt nach einiger Zeit zum
Normalwert zurück. Dabei spielen Cotransporter (Symport) und
Austauscher (Antiport) eine Rolle:
Abbildung): Dieser kehrt nach einiger Zeit zum
Normalwert zurück. Dabei spielen Cotransporter (Symport) und
Austauscher (Antiport) eine Rolle:  Behebung einer intrazellulären Azidose: NBCn1 (elektroneutraler Na/HCO3-Cotransporter) und NHE1 = (Na-H-Austauscher) sind Säureausscheider (acid extruder) steigern den intrazellulären pH-Wert und beheben dadurch eine intrazelluläre Azidose. Beide Transporter nützen den Natriumgradienten, einerseits um mit Na (stark basisch) Bicarbonat (schwach sauer) aufzunehmen, andererseits um Wasserstoffionen gegen Na auszutauschen (und damit auszuscheiden).
Behebung einer intrazellulären Azidose: NBCn1 (elektroneutraler Na/HCO3-Cotransporter) und NHE1 = (Na-H-Austauscher) sind Säureausscheider (acid extruder) steigern den intrazellulären pH-Wert und beheben dadurch eine intrazelluläre Azidose. Beide Transporter nützen den Natriumgradienten, einerseits um mit Na (stark basisch) Bicarbonat (schwach sauer) aufzunehmen, andererseits um Wasserstoffionen gegen Na auszutauschen (und damit auszuscheiden). Behebung einer intrazellulären Alkalose: AE2 = Cl-HCO3-Austauscher (anion exchanger) ist ein Säureimporter (acid loader),
er importiert Chloridionen (stark sauer) im Austausch gegen Bicarbonat
(schwach sauer) und senkt dadurch den intrazellulären pH-Wert.
Behebung einer intrazellulären Alkalose: AE2 = Cl-HCO3-Austauscher (anion exchanger) ist ein Säureimporter (acid loader),
er importiert Chloridionen (stark sauer) im Austausch gegen Bicarbonat
(schwach sauer) und senkt dadurch den intrazellulären pH-Wert. Unter einem Puffer versteht man eine Substanz, die bei Zusatz von Säure (pH sinkt) oder alkalischer Stoffe (pH steigt) Wasserstoffionen (H+) so aufnimmt (Protonenakzeptor) oder abgibt (Protonendonator), dass die
Änderung des pH dabei geringer ist als das ohne Anwesenheit des Puffers
der Fall wäre. Der Puffer stabilisiert also den pH-Wert - Blutpuffer (buffer bases) tun das im Kreislauf.
Unter einem Puffer versteht man eine Substanz, die bei Zusatz von Säure (pH sinkt) oder alkalischer Stoffe (pH steigt) Wasserstoffionen (H+) so aufnimmt (Protonenakzeptor) oder abgibt (Protonendonator), dass die
Änderung des pH dabei geringer ist als das ohne Anwesenheit des Puffers
der Fall wäre. Der Puffer stabilisiert also den pH-Wert - Blutpuffer (buffer bases) tun das im Kreislauf.  Als Pufferkapazität bezeichnet
man die Fähigkeit einer (gepufferten) Lösung, pH-Änderungen gering zu
halten. Als Maß für die Pufferkapazität gilt die Menge an H+ (eigentlich H3O+) bzw. OH+, die man einer Lösung zuführen muss, um deren pH-Wert um eine Einheit zu verändern.
Als Pufferkapazität bezeichnet
man die Fähigkeit einer (gepufferten) Lösung, pH-Änderungen gering zu
halten. Als Maß für die Pufferkapazität gilt die Menge an H+ (eigentlich H3O+) bzw. OH+, die man einer Lösung zuführen muss, um deren pH-Wert um eine Einheit zu verändern. Die Nieren bilden in 24 Stunden ~70 mmol Bicarbonat neu - außer, wenn basische Valenzen
ausgeschieden werden müssen, z.B. nach massivem Erbrechen. Dies dient
der Pufferung des Blutes, das die Niere durchströmt: Würde die Niere
nämlich die in das Tubulussystem sezernierten Säuren nicht puffern, müsste sie den Harn auf pH=1,3 ansäuern (70 mmol H+ in 1,5 Liter Harn) - tatsächlich ist die maximal mögliche H+-Konzentration um mehrere Zehnerpotenzen geringer (Harn-pH meist über 5,0).
Die Nieren bilden in 24 Stunden ~70 mmol Bicarbonat neu - außer, wenn basische Valenzen
ausgeschieden werden müssen, z.B. nach massivem Erbrechen. Dies dient
der Pufferung des Blutes, das die Niere durchströmt: Würde die Niere
nämlich die in das Tubulussystem sezernierten Säuren nicht puffern, müsste sie den Harn auf pH=1,3 ansäuern (70 mmol H+ in 1,5 Liter Harn) - tatsächlich ist die maximal mögliche H+-Konzentration um mehrere Zehnerpotenzen geringer (Harn-pH meist über 5,0). 
 Abbildung: pH- Bicarbonat- Diagramm (vgl. weiter unten)
Abbildung: pH- Bicarbonat- Diagramm (vgl. weiter unten)
 Abbildung).
Es quantifiziert, wie Veränderungen des Kohlendioxidgehalts im Blut
dessen pH-Wert verändert (grüne Kurven: der pH-Wert ist ein
Logarithmus!) und stellt die Verortung der Aktualwerte in Abhängigkeit
von der Pufferkapazität des Blutes dar.
Abbildung).
Es quantifiziert, wie Veränderungen des Kohlendioxidgehalts im Blut
dessen pH-Wert verändert (grüne Kurven: der pH-Wert ist ein
Logarithmus!) und stellt die Verortung der Aktualwerte in Abhängigkeit
von der Pufferkapazität des Blutes dar.  Abbildung unten).
Abbildung unten). Abbildung oben) wird in der
Niere so gut wie vollständig rückresorbiert (80% im proximalen Tubulus,
10% im aufsteigenden Schenkel der Henle-Schleife, 10% im distalen
Tubulus). Die Neubildung von Bicarbonat (hauptsächlich im proximalen Tubulus) erfolgt vor allem über den
Ammoniummechanismus (Bicarbonatbildung durch NH3 → NH4+) sowie den Phosphatmechanismus (Bicarbonatbildung durch Hydrogenphosphat →
Dihydrogenhosphat).
Abbildung oben) wird in der
Niere so gut wie vollständig rückresorbiert (80% im proximalen Tubulus,
10% im aufsteigenden Schenkel der Henle-Schleife, 10% im distalen
Tubulus). Die Neubildung von Bicarbonat (hauptsächlich im proximalen Tubulus) erfolgt vor allem über den
Ammoniummechanismus (Bicarbonatbildung durch NH3 → NH4+) sowie den Phosphatmechanismus (Bicarbonatbildung durch Hydrogenphosphat →
Dihydrogenhosphat).  Die Menge an vorhandenem Puffer
und
Die Menge an vorhandenem Puffer
und  die Lage des aktuellen pH-Wertes zum pK-Wert des Puffers. Ein Puffersystem ist umso wirksamer, je näher sein pK-Wert beim vorherrschenden (physiologischen) pH-Bereich liegt (höchste Pufferkapazität bei pH = pK). Im Blut trifft dies recht gut für das Phosphatsystem (NaH2PO4
die Lage des aktuellen pH-Wertes zum pK-Wert des Puffers. Ein Puffersystem ist umso wirksamer, je näher sein pK-Wert beim vorherrschenden (physiologischen) pH-Bereich liegt (höchste Pufferkapazität bei pH = pK). Im Blut trifft dies recht gut für das Phosphatsystem (NaH2PO4  Na2HPO4)
zu, da bei einem pH=7,1 (Blut-pH 7,4) die Hälfte als primäres und die
andere Hälfte als sekundäres Phosphat vorliegt und daher bei Zugabe
einer basischeren oder saureren Substanz von beiden Seiten des
pH-Spektrums gut gepuffert werden kann.
Na2HPO4)
zu, da bei einem pH=7,1 (Blut-pH 7,4) die Hälfte als primäres und die
andere Hälfte als sekundäres Phosphat vorliegt und daher bei Zugabe
einer basischeren oder saureren Substanz von beiden Seiten des
pH-Spektrums gut gepuffert werden kann. Glomerulär
filtriertes Phosphat wird zu 90% renal rückgewonnen; 10% werden
ausgeschieden und dienen der Pufferung. Phosphat ist in der Niere von Bedeutung; die
Konzentration im Plasma ist gering (~1 mM), daher ist die Beteiligung
des Phosphatpuffers an der Stabilisierung des Blut-pH trotz des
günstigen pK-Wertes des Systems primäres / sekundäres Phosphat (7,1)
gering. Im Intrazellulärraum spielt der Phosphatpuffer wegen seiner höheren Konzentration und der Nähe zum pK-Wert die Hauptrolle als Puffer.
Glomerulär
filtriertes Phosphat wird zu 90% renal rückgewonnen; 10% werden
ausgeschieden und dienen der Pufferung. Phosphat ist in der Niere von Bedeutung; die
Konzentration im Plasma ist gering (~1 mM), daher ist die Beteiligung
des Phosphatpuffers an der Stabilisierung des Blut-pH trotz des
günstigen pK-Wertes des Systems primäres / sekundäres Phosphat (7,1)
gering. Im Intrazellulärraum spielt der Phosphatpuffer wegen seiner höheren Konzentration und der Nähe zum pK-Wert die Hauptrolle als Puffer. Als pK-Wert kann
man denjenigen pH-Wert bezeichnen, bei dem eine schwache Säure oder
Base zu 50% in dissoziierter und zu 50% in undissoziierter Form
vorliegt (Halbäquivalenzpunkt).
Als pK-Wert kann
man denjenigen pH-Wert bezeichnen, bei dem eine schwache Säure oder
Base zu 50% in dissoziierter und zu 50% in undissoziierter Form
vorliegt (Halbäquivalenzpunkt).  Bei Plasmaproteinen (
Bei Plasmaproteinen ( s. dort) - Kapazität 5 mM pro ΔpH - puffert vor allem Albumin.
s. dort) - Kapazität 5 mM pro ΔpH - puffert vor allem Albumin. Hämoglobin ist eine besonders bemerkenswerte Pufferbase, da es seine Pufferkapazität mit der Sauerstoffbeladung ändert (Haldane-Effekt). Dadurch ist seine physiologische Bedeutung besonders hoch: Die Pufferkapazität beträgt in den Erythrozyten 60 mM (Erys) pro ΔpH.
Hämoglobin ist eine besonders bemerkenswerte Pufferbase, da es seine Pufferkapazität mit der Sauerstoffbeladung ändert (Haldane-Effekt). Dadurch ist seine physiologische Bedeutung besonders hoch: Die Pufferkapazität beträgt in den Erythrozyten 60 mM (Erys) pro ΔpH. pH und Gesundheit. Die
Erhaltung des Säure-Basen-Gleichgewichts ist von großer Bedeutung für
den Gesundheitszustand des Körpers, und Störungen können u.a.
Wachstumsstörungen bei Neugeborenen, Elektrolytstörungen, Übelkeit,
Herzrhythmusstörungen, Kreislaufunempfindlichkeit gegenüber
Noradrenalin / Adrenalin, Muskelatrophie,
Osteoporose, Nierensteinbildung, Parästhesien, im Extremfall Koma
bedingen; Abweichungen des Bicarbonatspiegels im Blut sind mit erhöhter
Mortalität korreliert.
pH und Gesundheit. Die
Erhaltung des Säure-Basen-Gleichgewichts ist von großer Bedeutung für
den Gesundheitszustand des Körpers, und Störungen können u.a.
Wachstumsstörungen bei Neugeborenen, Elektrolytstörungen, Übelkeit,
Herzrhythmusstörungen, Kreislaufunempfindlichkeit gegenüber
Noradrenalin / Adrenalin, Muskelatrophie,
Osteoporose, Nierensteinbildung, Parästhesien, im Extremfall Koma
bedingen; Abweichungen des Bicarbonatspiegels im Blut sind mit erhöhter
Mortalität korreliert. Eine
lokale Störung des Säure-Basen-Haushalts (z.B. Säurebildung bei
Herzinfarkt oder in Tumoren) muss nicht zu systemischen Abweichungen
des Blut-pH führen; die Blutwerte "mitteln" vielmehr über den
Stoffwechsel des gesamten Organismus (zentral durchmischt). Nur wenn sich massive Veränderungen ergeben
(z. B. Muskelarbeit, veränderte Atmung, Erbrechen,
Nierenfunktionsstörung), sind auch pH und Blutgase merklich
beeinträchtigt.
Eine
lokale Störung des Säure-Basen-Haushalts (z.B. Säurebildung bei
Herzinfarkt oder in Tumoren) muss nicht zu systemischen Abweichungen
des Blut-pH führen; die Blutwerte "mitteln" vielmehr über den
Stoffwechsel des gesamten Organismus (zentral durchmischt). Nur wenn sich massive Veränderungen ergeben
(z. B. Muskelarbeit, veränderte Atmung, Erbrechen,
Nierenfunktionsstörung), sind auch pH und Blutgase merklich
beeinträchtigt. Als Standardbicarbonat bezeichnet man die Bicarbonatkonzentration, den man in einer
Blutprobe bei Standardbedingungen findet, d.h.
Als Standardbicarbonat bezeichnet man die Bicarbonatkonzentration, den man in einer
Blutprobe bei Standardbedingungen findet, d.h. 37°C
37°C vollständiger Sauerstoffsättigung des
Hämoglobins
vollständiger Sauerstoffsättigung des
Hämoglobins pCO2 = 40 mmHg (5,3 kPa)
pCO2 = 40 mmHg (5,3 kPa)
 Abbildung: Störungen des Säure-Basen-Haushalts im Van Slyke-Diagramm
Abbildung: Störungen des Säure-Basen-Haushalts im Van Slyke-Diagramm  Blaues Band: Pufferbasenkonzentration im Normbereich, rein respiratorische Störungen
Blaues Band: Pufferbasenkonzentration im Normbereich, rein respiratorische Störungen  Braunes Band: Metabolisch kompensierte respiratorische Störungen (Pufferbasengehalt verändert)
Braunes Band: Metabolisch kompensierte respiratorische Störungen (Pufferbasengehalt verändert)  Violette Bänder: Akute metabolische Störungen
Violette Bänder: Akute metabolische Störungen  Rote Bänder: Respiratorisch kompensierte metabolische Störungen (pCO2 verändert)
Rote Bänder: Respiratorisch kompensierte metabolische Störungen (pCO2 verändert)
 (
( Abbildung) stellt den pCO2 als Funktion des pH-Wertes dar (pCO2 logarithmisch, da der pH ein Logarithmus ist).
Abbildung) stellt den pCO2 als Funktion des pH-Wertes dar (pCO2 logarithmisch, da der pH ein Logarithmus ist).  Störung).
Störung). 
 vgl. oben)
vgl. oben) Abbildung). Der Normalpunkt liegt in der
Mitte des Diagramms (pH 7,4 und aktueller Bicarbonatwert 24 mM). Die
grüne Linie gilt für einen bestimmten Pufferbasengehalt der Probe bei
variierendem pCO2, die rote Kurve für einen pCO2 = 40 mmHg bei unterschiedlichem Pufferbasengehalt.
Abbildung). Der Normalpunkt liegt in der
Mitte des Diagramms (pH 7,4 und aktueller Bicarbonatwert 24 mM). Die
grüne Linie gilt für einen bestimmten Pufferbasengehalt der Probe bei
variierendem pCO2, die rote Kurve für einen pCO2 = 40 mmHg bei unterschiedlichem Pufferbasengehalt.
 Abbildung: Bicarbonat-pH-Plot einer normalen Blutprobe
Abbildung: Bicarbonat-pH-Plot einer normalen Blutprobe
 Abbildung links unten). Die vermehrt gebildeten H+-Ionen verbrauchen Nichtbicarbonatpuffer, und zwar in dem Ausmaß, in dem [HCO3-]
ansteigt (Pufferlinie nach links) - die Gesamtpufferkonzentration
bleibt unverändert (und der BE bleibt bei Null), solange keine
Kompensation einsetzt. (Umgekehrtes gilt für respiratorische Alkalose -
Pfeil nach rechts.)
Abbildung links unten). Die vermehrt gebildeten H+-Ionen verbrauchen Nichtbicarbonatpuffer, und zwar in dem Ausmaß, in dem [HCO3-]
ansteigt (Pufferlinie nach links) - die Gesamtpufferkonzentration
bleibt unverändert (und der BE bleibt bei Null), solange keine
Kompensation einsetzt. (Umgekehrtes gilt für respiratorische Alkalose -
Pfeil nach rechts.)
 Abbildung: Beispiel einer Kompensation im Bicarbonat-pH-Plot
Abbildung: Beispiel einer Kompensation im Bicarbonat-pH-Plot

 Abbildung direkte Verbindung von Punkt A zu
Punkt F).
Abbildung direkte Verbindung von Punkt A zu
Punkt F). Die allgemeine Puffergleichung lautet:
Die allgemeine Puffergleichung lautet:  H2CO3
H2CO3  H+ + HCO3-) beträgt pKa 6,1, wenn man die molaren Werte von H2CO3 (ein Zwischenprodukt mit sehr geringer Konzentration) und CO2 (physiologisch relevant,
H+ + HCO3-) beträgt pKa 6,1, wenn man die molaren Werte von H2CO3 (ein Zwischenprodukt mit sehr geringer Konzentration) und CO2 (physiologisch relevant,  s. Atmung) zusammenzählt.
s. Atmung) zusammenzählt.  : Die Anionenkonzentration [A-] ist der Bicarbonatwert (z.B. 24 mM). Für die undissoziierte Säure [HA] setzt man den pCO2 (in mmHg, also z.B. 40) mal einem Umrechnungsfaktor (Partialdruck → molare Konzentration, d.h. Lösungskoeffizient entsprechend dem Henry-Gesetz - in diesem Fall 0,03) ein:
: Die Anionenkonzentration [A-] ist der Bicarbonatwert (z.B. 24 mM). Für die undissoziierte Säure [HA] setzt man den pCO2 (in mmHg, also z.B. 40) mal einem Umrechnungsfaktor (Partialdruck → molare Konzentration, d.h. Lösungskoeffizient entsprechend dem Henry-Gesetz - in diesem Fall 0,03) ein: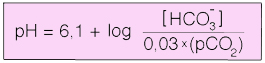








 Gleichgewicht zwischen
"metabolischer" (Bicarbonat) und respiratorischer Komponente
(Kohlendioxid) oder anders ausgedrückt: Gleichgewicht Nierenaktivität, Leberfunktion, Muskeltätigkeit etc. einerseits (nichtrespiratorisch), Atmung (respiratorisch) andererseits (
Gleichgewicht zwischen
"metabolischer" (Bicarbonat) und respiratorischer Komponente
(Kohlendioxid) oder anders ausgedrückt: Gleichgewicht Nierenaktivität, Leberfunktion, Muskeltätigkeit etc. einerseits (nichtrespiratorisch), Atmung (respiratorisch) andererseits ( Abbildung).
Abbildung). 
 Abbildung: pH-Gleichgewicht als "römische Schnellwaage"
Abbildung: pH-Gleichgewicht als "römische Schnellwaage"

 Abbildung: Pufferung im Tubulus
Abbildung: Pufferung im Tubulus
 Abbildung).
Abbildung). bei pH>6,8 (wie im Blut: pH=7,4) überwiegt sekundäres Phosphat HPO4-- (im Blut 80:20),
bei pH>6,8 (wie im Blut: pH=7,4) überwiegt sekundäres Phosphat HPO4-- (im Blut 80:20),  bei pH<6,8 (wie im Harn: pH meist 5-6) überwiegt primäres Phosphat H2PO4- (z.B. bei pH 6,2 ebenfalls 80:20, aber zugunsten des primären Phosphats, das bei niedrigerem Harn-pH noch stärker dominiert).
bei pH<6,8 (wie im Harn: pH meist 5-6) überwiegt primäres Phosphat H2PO4- (z.B. bei pH 6,2 ebenfalls 80:20, aber zugunsten des primären Phosphats, das bei niedrigerem Harn-pH noch stärker dominiert). s. dort)
s. dort)
 Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
Abbildung: Säureausscheidung in verschiedenen Nephronabschnitten
 Der proximale Tubulus sezerniert H+ über einen apikalen Na/H-Antiporter (NHE), der seine Energie aus dem Natriumgradienten (in die Zelle gerichtet) bezieht. H+ stammt u.a. aus der Dissoziation von Kohlensäure, die aus CO2
nachgeliefert wird (Wirkung der Carboanhydrase); das dabei entstehende
Bicarbonat wird über die basolaterale Membran exportiert (Na/HCO3-Cotransporter NBC - effektiv wird Natriumbicarbonat resorbiert). Insgesamt wird also sowohl Natrium als auch Bicarbonat resorbiert.
Der proximale Tubulus sezerniert H+ über einen apikalen Na/H-Antiporter (NHE), der seine Energie aus dem Natriumgradienten (in die Zelle gerichtet) bezieht. H+ stammt u.a. aus der Dissoziation von Kohlensäure, die aus CO2
nachgeliefert wird (Wirkung der Carboanhydrase); das dabei entstehende
Bicarbonat wird über die basolaterale Membran exportiert (Na/HCO3-Cotransporter NBC - effektiv wird Natriumbicarbonat resorbiert). Insgesamt wird also sowohl Natrium als auch Bicarbonat resorbiert.
 Im Bereich der Henle-Schleife
setzt sich die Rückgewinnung von Bicarbonat an der basolateralen
Membran fort; einerseits im Austausch gegen Chlorid, andererseits
(absteigender Schenkel) im Cotransport mit Natrium. Wasserstoffionen
werden unter ATP-Verbrauch in den Harn sezerniert. Der dicke Schenkel
resorbiert Ammoniumionen (statt Kalium) über den
Na/K/2Cl-Cotransporter; Ammoniumsalz rezirkuliert (der absteigende
Schenkel nimmt es wieder auf) und reichert sich dadurch im Nierenmark an.
So entgeht es einerseits der Resorption in das Blut (das würde in der
Rindenregion passieren) und steht andererseits dem Sammelrohrsystem zur
Verfügung (falls notwendig - abhängig vom Säure-Basen-Status).
Im Bereich der Henle-Schleife
setzt sich die Rückgewinnung von Bicarbonat an der basolateralen
Membran fort; einerseits im Austausch gegen Chlorid, andererseits
(absteigender Schenkel) im Cotransport mit Natrium. Wasserstoffionen
werden unter ATP-Verbrauch in den Harn sezerniert. Der dicke Schenkel
resorbiert Ammoniumionen (statt Kalium) über den
Na/K/2Cl-Cotransporter; Ammoniumsalz rezirkuliert (der absteigende
Schenkel nimmt es wieder auf) und reichert sich dadurch im Nierenmark an.
So entgeht es einerseits der Resorption in das Blut (das würde in der
Rindenregion passieren) und steht andererseits dem Sammelrohrsystem zur
Verfügung (falls notwendig - abhängig vom Säure-Basen-Status). Die Sammelrohre
können auf die Stoffwechselsituation (säure- vs. basenüberschüssig)
reagieren, indem sie zwischen einem "Säuresekretionsmodus" und einem
"Säureresorptionsmodus" wählen - durch Austausch der Transporter der
apikalen und der basolateralen Membran: Die Schaltzellen der Sammelrohre können zwischen
Die Sammelrohre
können auf die Stoffwechselsituation (säure- vs. basenüberschüssig)
reagieren, indem sie zwischen einem "Säuresekretionsmodus" und einem
"Säureresorptionsmodus" wählen - durch Austausch der Transporter der
apikalen und der basolateralen Membran: Die Schaltzellen der Sammelrohre können zwischen  dem Typ A - diese Zellen tragen Protonenpumpen in ihrer apikalen Membran (H+-Sekretion) und exportieren Bicarbonat, das via HCO3/Cl-Austauscher durch die basolaterale Membran Richtung Blut wandert - und
dem Typ A - diese Zellen tragen Protonenpumpen in ihrer apikalen Membran (H+-Sekretion) und exportieren Bicarbonat, das via HCO3/Cl-Austauscher durch die basolaterale Membran Richtung Blut wandert - und  dem Typ B
wechseln, bei dem die Transporter zwischen apikaler und basolateraler
Membran "geswitcht" worden sind (Bicarbonat gelangt in den
Tubulus, Protonen in das Interstitium).
dem Typ B
wechseln, bei dem die Transporter zwischen apikaler und basolateraler
Membran "geswitcht" worden sind (Bicarbonat gelangt in den
Tubulus, Protonen in das Interstitium).  Respiratorische Azidose
Respiratorische Azidose  Nicht-respiratorísche Alkalose
Nicht-respiratorísche Alkalose  Nicht-respiratorische Azidose
Nicht-respiratorische Azidose
 s. dort.
s. dort.

 Abbildung: Mögliche Ursachen einer Alkalose
Abbildung: Mögliche Ursachen einer Alkalose
 H2CO3
H2CO3 HCO3- + H+). Die H+-Ionen binden vorwiegend an Nichtbicarbonatpuffer, und deren Konzentration sinkt in dem Ausmaß, in dem [HCO3-] ansteigt.
HCO3- + H+). Die H+-Ionen binden vorwiegend an Nichtbicarbonatpuffer, und deren Konzentration sinkt in dem Ausmaß, in dem [HCO3-] ansteigt. 

 Abbildung gibt weitere Beispiele für das Auftreten von Azidosen:
Abbildung gibt weitere Beispiele für das Auftreten von Azidosen:
 Abbildung: Mögliche Ursachen einer Azidose
Abbildung: Mögliche Ursachen einer Azidose



 Abbildung: Säure-Basen-Nomogramm im Bicarbonat-pH-Plot
Abbildung: Säure-Basen-Nomogramm im Bicarbonat-pH-Plot
 Respiratorische Azidose wird (abgesehen von Steigerung der CO2-Abatmung) durch Erhöhung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert
(renal) → BE wird positiv. Renale Kompensation schließt ein: Erhöhte
Produktion "neuen" Bicarbonats, vermehrte Ausscheidung von NH4+, vermehrte Ausscheidung titrierbarer Säuren, vermehrte Resorption von Bicarbonat aus dem Tubulus.
Respiratorische Azidose wird (abgesehen von Steigerung der CO2-Abatmung) durch Erhöhung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert
(renal) → BE wird positiv. Renale Kompensation schließt ein: Erhöhte
Produktion "neuen" Bicarbonats, vermehrte Ausscheidung von NH4+, vermehrte Ausscheidung titrierbarer Säuren, vermehrte Resorption von Bicarbonat aus dem Tubulus. Nicht-respiratorische Azidose wird respiratorisch kompensiert, d.h. durch Steigerung der CO2-Abatmung (Hyperpnoe) → pCO2 sinkt. Renale Kompensation schließt ein: Erhöhte Produktion "neuen" Bicarbonats, vermehrte Ausscheidung von NH4+, vermehrte Ausscheidung titrierbarer Säuren.
Nicht-respiratorische Azidose wird respiratorisch kompensiert, d.h. durch Steigerung der CO2-Abatmung (Hyperpnoe) → pCO2 sinkt. Renale Kompensation schließt ein: Erhöhte Produktion "neuen" Bicarbonats, vermehrte Ausscheidung von NH4+, vermehrte Ausscheidung titrierbarer Säuren.


 Respiratorische Alkalose wird (abgesehen von Senkung der CO2-Abatmung) durch Senkung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert (renal) → BE wird negativ. Renale Kompensation schließt ein: Reduzierte Resorption von Bicarbonat aus dem Tubulus, verringerte Ausscheidung von NH4+, verringerte Ausscheidung titrierbarer Säuren.
Respiratorische Alkalose wird (abgesehen von Senkung der CO2-Abatmung) durch Senkung des Bicarbonatgehalts im Blut, d.h. "metabolisch" kompensiert (renal) → BE wird negativ. Renale Kompensation schließt ein: Reduzierte Resorption von Bicarbonat aus dem Tubulus, verringerte Ausscheidung von NH4+, verringerte Ausscheidung titrierbarer Säuren. Nicht-respiratorische Alkalose wird respiratorisch kompensiert, d.h. durch Senkung der CO2-Abatmung (Hypopnoe) → pCO2 steigt. Renale Kompensation: Vermehrte Bicarbonatausscheidung.
Nicht-respiratorische Alkalose wird respiratorisch kompensiert, d.h. durch Senkung der CO2-Abatmung (Hypopnoe) → pCO2 steigt. Renale Kompensation: Vermehrte Bicarbonatausscheidung.
























 vgl. dort):
vgl. dort): Bei azidotischer Stoffwechsellage dringen H+-Ionen durch die Zellmembran und senken den intrazellulären pH.
Bei azidotischer Stoffwechsellage dringen H+-Ionen durch die Zellmembran und senken den intrazellulären pH.  Die erhöhte Wasserstoffionenkonzentration hemmt sowohl die Tätigkeit der Na+-K+-ATPase (Na-K-Pumpe) als auch (wo vorhanden) der Na+-K+-Cl--Cotransporter, die Aufnahme von Kalium in die Zelle sinkt.
Die erhöhte Wasserstoffionenkonzentration hemmt sowohl die Tätigkeit der Na+-K+-ATPase (Na-K-Pumpe) als auch (wo vorhanden) der Na+-K+-Cl--Cotransporter, die Aufnahme von Kalium in die Zelle sinkt. Weiters konkurrieren Wasserstoffionen mit Kaliumionen um Bindungsstellen an zellulärem Eiweiß.
Weiters konkurrieren Wasserstoffionen mit Kaliumionen um Bindungsstellen an zellulärem Eiweiß.  Kalium diffundiert aus den Zellen, die extrazelluläre [K+] steigt an und kann zu Hyperkaliämie führen.
Kalium diffundiert aus den Zellen, die extrazelluläre [K+] steigt an und kann zu Hyperkaliämie führen. Abbildung) bedeutet das, dass einerseits
weniger Kalium in die Zelle aufgenommen wird und andererseits mehr
Kaliumionen von intrazellulären Bindungsstellen freiwerden und die
Zelle verlassen können.
Abbildung) bedeutet das, dass einerseits
weniger Kalium in die Zelle aufgenommen wird und andererseits mehr
Kaliumionen von intrazellulären Bindungsstellen freiwerden und die
Zelle verlassen können. Praktische Konsequenz: Azidose führt zu einer Umverlagerung
von Kalium aus dem Intra- in den Extrazellulärraum. Umgekehrt senkt Alkalose den Kaliumspiegel.
Praktische Konsequenz: Azidose führt zu einer Umverlagerung
von Kalium aus dem Intra- in den Extrazellulärraum. Umgekehrt senkt Alkalose den Kaliumspiegel. (Merkhilfe: Wasserstoffionen treiben der Zelle das Kalium aus.)
(Merkhilfe: Wasserstoffionen treiben der Zelle das Kalium aus.)
 Über physiologische Kompensationsmechanismen bei Vorliegen einer Hyperkaliämie (Serum-[K+] > 5 mM) s. dort
Über physiologische Kompensationsmechanismen bei Vorliegen einer Hyperkaliämie (Serum-[K+] > 5 mM) s. dort Bei einem Mangel an Sauerstoff (oxidativer Apparat) oder Insulin (Glucoseaufnahme) fallen vermehrt nichtflüchtige ("fixe", endogene) Säuren
an: z.B. bei vermehrter Bildung von Milchsäure (Laktazidose) oder
Ketonkörpern (hungerbedingte oder diabetische Ketoazidose). Folge ist
eine metabolische Azidose, die sowohl renal (vermehrte Rückgewinnung
von Bicarbonat) als auch respiratorisch kompensiert wird (Mehratmung).
Bei einem Mangel an Sauerstoff (oxidativer Apparat) oder Insulin (Glucoseaufnahme) fallen vermehrt nichtflüchtige ("fixe", endogene) Säuren
an: z.B. bei vermehrter Bildung von Milchsäure (Laktazidose) oder
Ketonkörpern (hungerbedingte oder diabetische Ketoazidose). Folge ist
eine metabolische Azidose, die sowohl renal (vermehrte Rückgewinnung
von Bicarbonat) als auch respiratorisch kompensiert wird (Mehratmung). 
 Der pH-Wert in
den Zellen liegt meist um 7,1, der Blut-pH um 7,4 - die Wasserstoffionenkonzentration im intrazellulären Raum liegt doppelt so hoch wie im Extrazellulärraum. Die
biochemischen Systeme reagieren empfindlich auf Änderungen des pH,
der durch Pufferbasen stabilisiert und durch Atmung,
Leber- und Nierentätigkeit reguliert wird (Werte <6,9 und >7,8
sind lebensbedrohlich). Pro Tag fallen im Körper
~70 mM nichtflüchtige Säuren zur Ausscheidung an (~40 mM Ammonium, ~30 mM titrierbare Säure - Sulfat, Phosphat). Etwa 15.103 mM (>200mal so viel) verlassen den Körper über die Atmung (CO2: Anhydrid der Kohlensäure)
Der pH-Wert in
den Zellen liegt meist um 7,1, der Blut-pH um 7,4 - die Wasserstoffionenkonzentration im intrazellulären Raum liegt doppelt so hoch wie im Extrazellulärraum. Die
biochemischen Systeme reagieren empfindlich auf Änderungen des pH,
der durch Pufferbasen stabilisiert und durch Atmung,
Leber- und Nierentätigkeit reguliert wird (Werte <6,9 und >7,8
sind lebensbedrohlich). Pro Tag fallen im Körper
~70 mM nichtflüchtige Säuren zur Ausscheidung an (~40 mM Ammonium, ~30 mM titrierbare Säure - Sulfat, Phosphat). Etwa 15.103 mM (>200mal so viel) verlassen den Körper über die Atmung (CO2: Anhydrid der Kohlensäure) Wie Speisen / Getränke den pH-Wert beeinflussen, hängt davon ab, was im Stoffwechsel aus ihnen entsteht - CO2
wird exspiriert, entstehendes Bicarbonat ist eine Pufferbase
("säureüberschüssiges" Essen kann als Base wirken). Stoffe wirken säureüberschüssig (z.B. Glucose → Laktat,
Zystin → Sulfat → saurer Harn), säureverbrauchend (z.B. Milchsäure → Glucose, Citrat → CO2 →) oder pH-neutral (z.B. Triglyzeride, Zucker → CO2 →)
Wie Speisen / Getränke den pH-Wert beeinflussen, hängt davon ab, was im Stoffwechsel aus ihnen entsteht - CO2
wird exspiriert, entstehendes Bicarbonat ist eine Pufferbase
("säureüberschüssiges" Essen kann als Base wirken). Stoffe wirken säureüberschüssig (z.B. Glucose → Laktat,
Zystin → Sulfat → saurer Harn), säureverbrauchend (z.B. Milchsäure → Glucose, Citrat → CO2 →) oder pH-neutral (z.B. Triglyzeride, Zucker → CO2 →) Wasserstoffionen werden im Rahmen der mitochondrialen Elektronentransportkette zur Oxidation von NADH / NADPH benötigt. H+
wird aus der Mitochondienmatrix befördert (Zytochrom), die im
Intermembranraum angereicherten Wasserstoffionen treiben bei ihrer
Rückdiffusion H+-ATP-Synthase an
Wasserstoffionen werden im Rahmen der mitochondrialen Elektronentransportkette zur Oxidation von NADH / NADPH benötigt. H+
wird aus der Mitochondienmatrix befördert (Zytochrom), die im
Intermembranraum angereicherten Wasserstoffionen treiben bei ihrer
Rückdiffusion H+-ATP-Synthase an Pufferbasen
halten Störungen des pH-Wertes gering. Ihre Konzentration beträgt 48
mM, jeweils zur Hälfte (24 mM) Bicarbonat und Nichtbicarbonatpuffer (Hämoglobin, ~10% des glomerulär filtrierten Phosphats). Hämoglobin
ändert seine Pufferkapazität mit der Sauerstoffbeladung
(Haldane-Effekt), das macht es zu einem effizienten Blutpuffer. Im
Intrazellulärraum ist Phosphat wegen seiner
Konzentration und Nähe zum pK-Wert der wichtigste Puffer
Pufferbasen
halten Störungen des pH-Wertes gering. Ihre Konzentration beträgt 48
mM, jeweils zur Hälfte (24 mM) Bicarbonat und Nichtbicarbonatpuffer (Hämoglobin, ~10% des glomerulär filtrierten Phosphats). Hämoglobin
ändert seine Pufferkapazität mit der Sauerstoffbeladung
(Haldane-Effekt), das macht es zu einem effizienten Blutpuffer. Im
Intrazellulärraum ist Phosphat wegen seiner
Konzentration und Nähe zum pK-Wert der wichtigste Puffer Die Bestimmung von pH-Wert, pO2 und pCO2 nennt man Blutgasanalyse. Dazu
wird meist "Kapillarblut" (in eine Kapillare abgefülltes arterielles
Blut) verwendet. Pufferkapazität (~48 mM), Aktualbicarbonat (~24 mM) und Basenabweichung werden berechnet. StandardBicarbonat gilt für 37°C, pCO2 = 40 mmHg, 100% O2-Sättigung des Hämoglobins. Das Van Slyke-Nomogramm stellt den pCO2 (Maßstab logarithmisch) als Funktion des pH-Wertes (pH ist ein Logarithmus) dar. Störungen des pH-Gleichgewichts werden respiratorisch (pCO2)
oder nichtrespiratorisch ("metabolisch":
Pufferkapazität) kompensiert. Unvollständige Kompensation fängt die
Abweichung des pH vom Normwert nur teilweise auf, vollständig
kompensierte Störungen stellen den Normbereich (pH 7,36 bis 7,42)
wieder her
Die Bestimmung von pH-Wert, pO2 und pCO2 nennt man Blutgasanalyse. Dazu
wird meist "Kapillarblut" (in eine Kapillare abgefülltes arterielles
Blut) verwendet. Pufferkapazität (~48 mM), Aktualbicarbonat (~24 mM) und Basenabweichung werden berechnet. StandardBicarbonat gilt für 37°C, pCO2 = 40 mmHg, 100% O2-Sättigung des Hämoglobins. Das Van Slyke-Nomogramm stellt den pCO2 (Maßstab logarithmisch) als Funktion des pH-Wertes (pH ist ein Logarithmus) dar. Störungen des pH-Gleichgewichts werden respiratorisch (pCO2)
oder nichtrespiratorisch ("metabolisch":
Pufferkapazität) kompensiert. Unvollständige Kompensation fängt die
Abweichung des pH vom Normwert nur teilweise auf, vollständig
kompensierte Störungen stellen den Normbereich (pH 7,36 bis 7,42)
wieder her Die Nieren
entfernen über den Harn (je nach Ernährung und Stoffwechsellage) saure oder auch basische Valenzen aus dem
Körper. Der [Harn-pH] liegt
zwischen 4,5 und 8,2. Harn wäre ohne renale Pufferung sehr sauer (pH 1,3: 70 mmol H+ in 1,5 l/d). Bicarbonat
wird vor allem im proximalen Tubulus zur Pufferung
verbraucht, zur Stabilisierung der Pufferbasen im Blut dient sowohl seine
Rückresorption als auch die Neusynthese (~70 mmol/d). Der proximale Tubulus gewinnt aus Glutamin Bicarbonat und Ammoniumionen; Bicarbonatsynthese erfolgt vor allem über
den Ammonium- und
Phosphatmechanismus. Der Ammonium-Mechanismus scheidet Protonen als Ammonium aus (Ammoniak diffundiert durch Zellmembranen; Ammonium kaum, zirkuliert im Nierenmark und kann vom Sammelrohrsystem genützt werden). Die
Schaltzellen im Sammelrohr können je nach Säure-Basen-Status zwischen Typ-A-Zelle (Sekretion saurer
Valenzen) und Typ-B-Zelle (Sekretion von Bicarbonat) wechseln. Phosphat ist das bedeutsamste Puffersystem im Harn (pK-Wert des primär / sekundären Phosphatsystems 6,8; bei niedrigerem pH (Harn) überwiegt primäres Phosphat (H2PO4-), bei höherem sekundäres Phosphat (HPO4--: Blut 80%)
Die Nieren
entfernen über den Harn (je nach Ernährung und Stoffwechsellage) saure oder auch basische Valenzen aus dem
Körper. Der [Harn-pH] liegt
zwischen 4,5 und 8,2. Harn wäre ohne renale Pufferung sehr sauer (pH 1,3: 70 mmol H+ in 1,5 l/d). Bicarbonat
wird vor allem im proximalen Tubulus zur Pufferung
verbraucht, zur Stabilisierung der Pufferbasen im Blut dient sowohl seine
Rückresorption als auch die Neusynthese (~70 mmol/d). Der proximale Tubulus gewinnt aus Glutamin Bicarbonat und Ammoniumionen; Bicarbonatsynthese erfolgt vor allem über
den Ammonium- und
Phosphatmechanismus. Der Ammonium-Mechanismus scheidet Protonen als Ammonium aus (Ammoniak diffundiert durch Zellmembranen; Ammonium kaum, zirkuliert im Nierenmark und kann vom Sammelrohrsystem genützt werden). Die
Schaltzellen im Sammelrohr können je nach Säure-Basen-Status zwischen Typ-A-Zelle (Sekretion saurer
Valenzen) und Typ-B-Zelle (Sekretion von Bicarbonat) wechseln. Phosphat ist das bedeutsamste Puffersystem im Harn (pK-Wert des primär / sekundären Phosphatsystems 6,8; bei niedrigerem pH (Harn) überwiegt primäres Phosphat (H2PO4-), bei höherem sekundäres Phosphat (HPO4--: Blut 80%)  Azidose liegt bei pH<7,36 vor, Alkalose bei pH>7,42. Störungen können respiratorisch (pCO2) oder nicht-respiratorisch bedingt sein (Pufferbasen). Hypoventilation (pCO2 >45 mmHg - Hyperkapnie) bewirkt respiratorische Azidose, Hyperventilation (pCO2 <45 mmHg - Hypokapnie) respiratorische Alkalose,
sinkende Hirndurchblutung und Hypocalcämie (Krampfneigung).
Nicht-respiratorische (metabolische) Störungen äußern sich primär in
verändertem Pufferbasengehalt und können respiratorisch kompensiert
werden. Veränderungen des extrazellulären pH beeinflussen den
Kaliumhaushalt: Dringen H+-Ionen in die Zelle, nimmt deren
Kaliumaufnahme ab; bei Alkalose ist es umgekehrt: Azidose →
Hyperkaliämie; Alkalose → Hypokaliämie
Azidose liegt bei pH<7,36 vor, Alkalose bei pH>7,42. Störungen können respiratorisch (pCO2) oder nicht-respiratorisch bedingt sein (Pufferbasen). Hypoventilation (pCO2 >45 mmHg - Hyperkapnie) bewirkt respiratorische Azidose, Hyperventilation (pCO2 <45 mmHg - Hypokapnie) respiratorische Alkalose,
sinkende Hirndurchblutung und Hypocalcämie (Krampfneigung).
Nicht-respiratorische (metabolische) Störungen äußern sich primär in
verändertem Pufferbasengehalt und können respiratorisch kompensiert
werden. Veränderungen des extrazellulären pH beeinflussen den
Kaliumhaushalt: Dringen H+-Ionen in die Zelle, nimmt deren
Kaliumaufnahme ab; bei Alkalose ist es umgekehrt: Azidose →
Hyperkaliämie; Alkalose → Hypokaliämie 