

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

 Burnett-Syndrom: Charles Hoyt Burnett (1913-1967)
Burnett-Syndrom: Charles Hoyt Burnett (1913-1967)
Calcium: calx = Kalk
Magnesium: μαγνησιη λιθός = Magnetstein (andere Deutungen: Nach antiken Städten, wie Magnisia oder Magnesia)
Phosphat: φως-φορος = licht-tragend (Phosphor leuchtet bei Kontakt mit Sauerstoff)
Calcium trägt etwa 2/3, Phosphat 1/3 zur Masse der anorganischen Knochensubstanz bei (die Hälfte der Knochenmasse entfällt auf Calciumphosphat).
Knochen enthält 99% der Calcium- und 85% der Phosphatreserven des
Körpers. Eine erwachsene Person benötigt mindestens 1 Gramm Calcium und
0,7 g Phosphor
(entsprechend 3-4 g Phosphat) pro Tag - bei Wachstumsschüben oder in
der Schwangerschaft entsprechend mehr. Calcium wird vor allem mit dem
Stuhl,
Phosphat mit dem Harn ausgeschieden.
Abgesehen vom Knochen: Calcium wird praktisch von jeder Zelle benötigt,
es hat u.a. eine Schlüsselfunktion als Signalstoff und bei der
elektromechanischen Kopplung (Muskelkontraktion); Phosphat dient als
Energieträger (ATP), Bestandteil der DNA / RNA, Puffer u.a.
Die Blutwerte unterliegen hormoneller Regulation; vor allem muss der Wert des ional freien Calciums stabilisiert sein, da dieser die Erregbarkeit von Zellmembranen beeinflusst (Hypocalcämie erhöht die Wahrscheinlichkeit der Depolarisation).
Das Elektrolytmuster in der extrazellulären Flüssigkeit wirkt sich
insgesamt auf das freie Calcium aus, z.B. senkt Alkalose (etwa bei
Hyperventilation) den Anteil des freien Calciums - das kann tetanische
(hypocalcämische) Krämpfe auslösen.
Um die benötigte Menge Magnesium
(0,1 g/d) resorbieren zu können, muß - wegen der nur teilweisen Resorption - das 3- bis 4-fache davon mit der
Nahrung angeboten werden. In der Zelle ist Magnesium nach Kalium das
zweithäufigste Kation, etwa 600 Enzyme benötigen es, um aktiv werden zu
können. Gehirn, Herz- und Skelettmuskel, Leber und Immunsystem gehören
zu den Geweben, die in ihrer Funktion besonders stark magnesiumabhängig
sind; Parathormon und Vassopressin wirken auf Umsatz und Verfügbarkeit
des Magnesiums.
|
Calcium (Ca++)  Phosphat (HPO4--)
Phosphat (HPO4--)  Magnesium
(Mg++)
Magnesium
(Mg++)
 Klinik
Klinik  Core messages
Core messages
Calcium (Ca++), Phosphat (Pi, "anorganisches" Phosphat PO43-) und Magnesium (Mg++) sind im Körper als Salze vor allem im Kollagen von Knochen und Zähnen gespeichert (Calcium >99%, bei erwachsenen Personen ca. 1 kg; Phosphor 85%; Magnesium ca. 50% des Körperbestandes).
Aus diesen Vorräten kann der Organismus Calcium-, Phosphat- und
Magnesiumionen mobilisieren und für verschiedene Zwecke nutzen.
Calcium (Ca++)
Freie Calciumionen
liegen im Zytoplasma in enorm geringer Konzentration vor, weil sie
einerseits durch die Zellmembran in den Extrazellulärraum befördert,
andererseits in Zellorganellen (endoplasmatisches Retikulum,
Mitochondrien) gespeichert werden. Der Konzentrationsunterschied (1:104-1:105) prädestiniert Calciumionen für eine Rolle als Signalsubstanz, Ca++ beteiligt sich an der Steuerung von Muskelkontraktion, Sekretion, Wachstum, Mitochondrienfunktion, Zilienmotorik.
Calcium 
(Ordnungszahl
20, Atommasse 40, in der Erdkruste zu 3,4% vertreten)
ist Bestandteil von Knochen und Zähnen; dieses
Calcium wird alle
6-7 Monate erneuert. Im Kreislauf liegt es frei gelöst,
proteingebunden und als Komplexsalz (Phosphat, Citrat..)
vor.
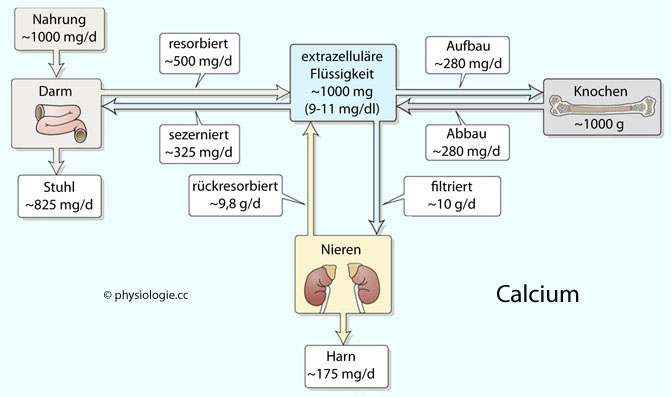
 Abbildung: Calciumbilanz einer erwachsenen Person
Modifiziert nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Calciumbilanz einer erwachsenen Person
Modifiziert nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Fast der gesamte Calciumvorrat des Körpers befindet sich in den Knochen.
Bei
ausgeglichener Calciumbilanz scheidet der Körper gleich viel Calcium
aus wie er mit der Nahrung aufnimmt (in diesem Beispiel 1 g/d). Beträgt
die Netto-Aufnahme aus dem Darm 175 mg/d, dann werden 175 mg/d mit dem
Harn ausgeschieden. Innerhalb des Organismus wird Calcium zum
größeren Teil wiederverwertet, z.B. werden ~280 mg/d (oder mehr) aus dem Knochen
resorbiert und die gleiche Menge neu eingelagert.
Diese Bilanz kann sich zu Netto-Aufnahme verschieben, z.B. während des Wachstums, bei Krafttraining oder bei Schwangeren (Calciumeinbau in zunehmende Knochenmasse) - vorausgesetzt, es wird genügend Calcium mit der Nahrung zugeführt (Milchprodukte).
Umgekehrt scheidet man bei sinkender Belastung des Bewegungsapparates
vermehrt Calcium aus (Bettlägrigkeit, Gefahr von Nierensteinbildung)
 Funktionen: Zu den Aufgaben des Calciums gehören der Aufbau von Knochen
und Zähnen, die Beeinflussung der Permeabilität der Zelle, intrazelluläre Signalwirkung,
Blutgerinnung, Impulsübertragung im Nervensystem, Muskelkontraktion,
Schrittmachertätigkeit (Herzmuskel).
Funktionen: Zu den Aufgaben des Calciums gehören der Aufbau von Knochen
und Zähnen, die Beeinflussung der Permeabilität der Zelle, intrazelluläre Signalwirkung,
Blutgerinnung, Impulsübertragung im Nervensystem, Muskelkontraktion,
Schrittmachertätigkeit (Herzmuskel).
 Calcium
Calcium (Serum)
~2,4 (2,1-2,6) mM
oder ~4,8 (4,25-5,2)
mequ/l oder ~9,6 (8,5-10,4) mg/dl
(Hypocalcämie bei <2,1 mM, Hypercalcämie bei >2,6 mM)
Anteil des freien (biologisch wirksamen, ionisierten) Ca
++ ~50%, d.h. 1,15-1,30 mM
Gebunden: ~40% an Albumin und Globulin, ~10% an Phosphat, Citrat u.a. (komplexiert)
Freier (ungebundener) Anteil nimmt
ab mit Proteinkonzentration (mehr Valenzen) und Blut-pH (Alkalose: Steigende Bindung an Protein)
Ausscheidung mit dem Harn: 130-400 mg/24h (2,5-7,5 mmol/24h)
Calciumionen liegen im Blutplasma in drei Formen vor:
* Ionisiert (~50%), die physiologisch aktive Form
* proteingebunden (~40%)
* als Komplexsalz (~10%)
|
Damit sind ~60% des Plasma-Ca++ diffusibel (in mikromolekularer Form), treten ohne weiteres durch Kapillarwände und können auch Zellmembranen (über Ca++-Kanäle)
passieren. 40% sind an Eiweiß gebunden (davon ~90% an Albumin) und
können dies nur bei hoher Durchlässigkeit (diskontinuierliches
Endothel), z.B. in der Leber.
Im extrazellulären Raum stabilisiert Calcium das
elektrische Potential an Zellmembranen und aktiviert verschiedene
Enzyme, u.a. solche der Blutgerinnung. Dieser Pool ist sehr mobil; das im Blut zirkulierende Calcium wird in kurzer Zeit gegen solches aus den Knochen ausgetauscht ( Abbildung).
Abbildung).
 Bei Knochenwachstum (Kinder, Jugendliche) und -aufbau (Training) nimmt
der Calciumpool im Körper zu; bei mangelnder mechanischer Belastung
nimmt er ab. In der Postmenopause kommt es jährlich zu Verlust von etwa 1% der Calciummasse aus den Knochen. Bei Immobilisierung
(Bettlägrigkeit, Lähmung, Aufenthalt im schwerelosen Zustand..) kann
der Verlust an unbelasteten Stellen viel höher sein (bis >1% pro Monat),
je nach (mangelnder) Beanspruchung der jeweiligen Strukturen. In
Abwesenheit entsprechender mechanischer Belastung (die Druck- und
Zugbelastbarkeit von Lamellenknochen liegt bei ~1000 kg/cm2!) setzt sich der Abbau über unbegrenzte Zeit fort.
Bei Knochenwachstum (Kinder, Jugendliche) und -aufbau (Training) nimmt
der Calciumpool im Körper zu; bei mangelnder mechanischer Belastung
nimmt er ab. In der Postmenopause kommt es jährlich zu Verlust von etwa 1% der Calciummasse aus den Knochen. Bei Immobilisierung
(Bettlägrigkeit, Lähmung, Aufenthalt im schwerelosen Zustand..) kann
der Verlust an unbelasteten Stellen viel höher sein (bis >1% pro Monat),
je nach (mangelnder) Beanspruchung der jeweiligen Strukturen. In
Abwesenheit entsprechender mechanischer Belastung (die Druck- und
Zugbelastbarkeit von Lamellenknochen liegt bei ~1000 kg/cm2!) setzt sich der Abbau über unbegrenzte Zeit fort.
 Die tägliche Ca++-Aufnahme des Erwachsenen sollte ~1 Gramm (Empfehlung: 1200-1500 mg/d) betragen. Unterversorgung kann
die Entwicklung von Osteoporose fördern. Körperliche
Fitness ist neben ausreichender Calciumzufuhr (Milch, Milchprodukte, Fisch, Meerestiere, Getreideprodukte) die
wichtigste Maßnahme, um das Skelettsystem belastbar zu halten. Bei
verringerter Belastung der Knochen
wird Calcium mobilisiert und ausgeschieden und kann der Bildung von Nierensteinen Vorschub leisten
(so sind z.B. Astronauten potentiell nierensteingefährdet).
Die tägliche Ca++-Aufnahme des Erwachsenen sollte ~1 Gramm (Empfehlung: 1200-1500 mg/d) betragen. Unterversorgung kann
die Entwicklung von Osteoporose fördern. Körperliche
Fitness ist neben ausreichender Calciumzufuhr (Milch, Milchprodukte, Fisch, Meerestiere, Getreideprodukte) die
wichtigste Maßnahme, um das Skelettsystem belastbar zu halten. Bei
verringerter Belastung der Knochen
wird Calcium mobilisiert und ausgeschieden und kann der Bildung von Nierensteinen Vorschub leisten
(so sind z.B. Astronauten potentiell nierensteingefährdet).
 Über das Calcium-Handling in der Niere s. dort
Über das Calcium-Handling in der Niere s. dort
Nur ein kleiner
Teil des Knochencalciums
ist für die schnelle Regulation des Calciumspiegels in den extrazellulären Flüssigkeiten verfügbar.
 Freies (ungebundenes, ionales) extrazelluläres Calcium bestimmt die Erregbarkeit von Zellmembranen:
Freies (ungebundenes, ionales) extrazelluläres Calcium bestimmt die Erregbarkeit von Zellmembranen:
Extrazelluläre
Abnahme der Konzentration an freien Calciumionen (normalerweise ~1mM) kann
bei Werten unter 0,6 mM zu Tetanie (hypocalcämischen Muskelkrämpfen) sowie Herzrhythmusstörungen führen.

 Abbildung: Erklärungsmodell für die Abhängigkeit der Membranerregbarkeit vom extrazellulären Calciumspiegel
Abbildung: Erklärungsmodell für die Abhängigkeit der Membranerregbarkeit vom extrazellulären Calciumspiegel
Nach Ma Z, Siebert AP, Cheung KH, Foskett JK, Calcium homeostasis modulator 1
(CALHM1) is the pore-forming subunit of an ion channel that mediates
extracellular Ca2+ regulation of neuronal excitability. PNAS 2012; 109:
E1963-71
Nach
diesem Modell erhöht sich die Öffnungswahrscheinlichkeit spezieller
Membrankanäle bei Depolarisation und/oder erniedrigtem extrazellulärem Calciumspiegel. Beides führt zum Einstrom von Kationen und Auslösung
von Aktionspotentialen.
CALHM1 (Calcium homeostasis modulator 1) ist der porenbildende Anteil des Ionenkanals. Dieser enthält einen Spannungs- und einen Ca++-Sensor, der die extrazelluläre Calciumkonzentration detektiert. Der CALMH1-Kanal ist bei physiologischen Calciumkonzentrationen und aufgeladener
Membran geschlossen (oben). Depolarisierung oder Hypocalcämie erhöht die
Öffnungswahrscheinlichkeit des Kanals, worauf Kationen (Natrium, Calcium) einströmen und die Zelle depolarisieren (unten)

Es war lange nicht klar, wie die Höhe des extrazellulären Calciumspiegels die Erregbarkeit von Nervenzellen beeinflusst. Der
Mechanismus ist durch Calcium- / Spannungssensoren erklärbar, die Teil
von Ionenkanälen in der Zellmembran sind.
CALHM1 (Calcium homeostasis modulator 1) ist Teil eines Ionenkanals, über den der extrazelluläre Ca++-Spiegel die Erregbarkeit von Nervenzellen beeinflusst.
Der CALMH1-Kanal enthält einen Spannunssensor und einen Calciumsensor
und ist bei physiologischen Calciumkonzentrationen (s. oben) und aufgeladener
Membran geschlossen. Verringerung des Membranpotentials oder der extrazellulären Calciumkonzentration (Hypocalcämie) erhöht die
Öffnungswahrscheinlichkeit des Kanals, worauf Kationen einströmen und die Zelle (weiter) depolarisieren ( Abbildung). Das kann zur
Auslösung von Aktionspotentialen führen (Motorische Vorderhornzellen übererregt → tetanische Krämpfe).
Abbildung). Das kann zur
Auslösung von Aktionspotentialen führen (Motorische Vorderhornzellen übererregt → tetanische Krämpfe).
 Erhöhung des Calciumspiegels im Blut (Hypercalcämie) senkt den
Natriumeinstrom (u.a. über spannungsgesteuerte Natriumkanäle) und
steigert den Kaliumausstrom (über mehrere Kaliumpermeasen), was in
einer Hyperpolarisierung der Zellen resultiert. Damit nimmt auch die
Erregbarkeit der Muskeln ab.
Erhöhung des Calciumspiegels im Blut (Hypercalcämie) senkt den
Natriumeinstrom (u.a. über spannungsgesteuerte Natriumkanäle) und
steigert den Kaliumausstrom (über mehrere Kaliumpermeasen), was in
einer Hyperpolarisierung der Zellen resultiert. Damit nimmt auch die
Erregbarkeit der Muskeln ab.
Freie Calciumionen sind für
die Funktion zahlreicher Enzymsysteme wesentlich. So ist der Ablauf der Blutgerinnung im Extrazellulärraum u.a. calciumabhängig.
Calcium ist mit
über 1g/kg in Milch und Milchprodukten, Makrelen, Sardinen, Soja- und
Weizenprodukten enthalten. Der tägliche Umsatz im Knochen (bone
remodeling) beträgt ~500-700 mg.
Die Aufnahme im Darm ist an Calbindin (ein in verschiedenen Geweben exprimiertes Ca++-Bindungs- und Transportprotein) gebunden, welches von Calcitriol
(Vit. D3) reguliert wird. Dies ist wahrscheinlich der bedeutendste
Ca++-regulierende Mechanismus; die Calciumausscheidung mit dem Harn ist
ziemlich konstant, wenn auch Hypercalcämie die Ausscheidung mit dem
Harn steigen, und Hypocalcämie die Ca++-Ausscheidung sinken lässt.
 Über Mangel und Überschuss s. unten
Über Mangel und Überschuss s. unten
Phosphat
Phosphor
 findet sich in den Knochen (80-85%) und in anderen Geweben: In Form von
Phospholipiden (Zellmembran) und energiereichen Phosphaten (ATP, CP),
in Botenstoffen (cAMP) und Nukleinsäuren (DNA, RNA). Als "anorganisch" (Pi: inorganic)
bezeichnet man das Element in Phosphatsalzen, als "organisch" z.B. in
Nukleinsäuren, Phospholipiden, verschiedenen Estern. Bei
Neugeborenen macht der Anteil des Phosphors am Körpergewicht 0,5%
(16-18 g), bei erwachsenen Personen etwa 1% aus (600-700 g).
findet sich in den Knochen (80-85%) und in anderen Geweben: In Form von
Phospholipiden (Zellmembran) und energiereichen Phosphaten (ATP, CP),
in Botenstoffen (cAMP) und Nukleinsäuren (DNA, RNA). Als "anorganisch" (Pi: inorganic)
bezeichnet man das Element in Phosphatsalzen, als "organisch" z.B. in
Nukleinsäuren, Phospholipiden, verschiedenen Estern. Bei
Neugeborenen macht der Anteil des Phosphors am Körpergewicht 0,5%
(16-18 g), bei erwachsenen Personen etwa 1% aus (600-700 g).
Die Resorption von Phosphat ist Vit-D3-abhängig, die Einlagerung in die Knochen wird über Parathormon gesteuert (Calciumphosphat aus dem Knochen mobilisiert), die renale Ausscheidung wird durch Parathormon gefördert (die tubuläre Resorption gehemmt).
Im Zytoplasma liegt Phosphat in höherer Konzentration vor als in der extrazellulären
Flüssigkeit. In der Zelle findet es sich vor allem in energiereichen Phosphaten (z.B.
ATP), als Bestandteil der DNA / RNA, und in Membran-Phospholipiden.
Da Phosphat (anders als Calcium) in zahlreiche verschiedene organische
Verbindungen integriert ist, enthält (unverkalktes) Gewebe etwa 10-mal
so viel Phosphat als Ca++ und ist ein führender Bestandteil der Zelle.
Ausgebreitete Gewebeverletzungen (z.B. Quetschungen) führen zu Austritt von Phosphat in den Extrazellulärraum und zu Hyperphosphatämie, was wiederum Komplexierung mit Ca++ und Hypocalcämie bedingen kann.

 Abbildung: Phosphorbilanz einer erwachsenen Person
Modifiziert nach einer Vorlage in in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Phosphorbilanz einer erwachsenen Person
Modifiziert nach einer Vorlage in in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Die Werte können auch höher liegen, z.B. Ingestion von 2 g/d oder 600 mg/d Ausscheidung mit dem Stuhl.
Rund 600 g Phospat befinden sich in den Knochen, etwa 100 g in
unverkalktem Gewebe; der Phosphatpool in der extrazellulären
Flüssigkeit beträgt ~0,5 g.
Bei ausgeglichenem Phosphathaushalt werden mit der Nahrung täglich ~1,4 g zugeführt, davon ~1,1 g resorbiert und ~0,2 g sezerniert (im Stuhl ~0,5 g/d ausgeschieden). Die Netto-Aufnahme in der Körper beträgt in diesem Beispiel 900 mg/d, diese Menge gelangt mit dem Harn zur Ausscheidung

Phosphat wird im Darm zu etwa 80% der mit der Nahrung angebotenen Menge resorbiert (sowohl
tierische als auch pflanzliche Kost enthält Phosphor in verwertbarer
Form, mangelnde Phosphatzufuhr ist selten), die restlichen 20% werden
zusammen mit einem Teil des in den Darm sezernierten Phosphats mit dem
Stuhl ausgeschieden.
Bei ausgeglichener Phosphatbilanz scheiden die Nieren dieselbe Menge Phosphat mit dem Harn aus, die netto aufgenommen wird ( Abbildung: 800 mg/d). In der Wachstumsphase
ist die Phosphatbilanz positiv, es wird mehr aufgenommen (in die
Knochen eingebaut) als ausgeschieden. Wachsende Kinder zeigen auch
höhere Phosphatspiegel im Blut als erwachsene Personen.
Abbildung: 800 mg/d). In der Wachstumsphase
ist die Phosphatbilanz positiv, es wird mehr aufgenommen (in die
Knochen eingebaut) als ausgeschieden. Wachsende Kinder zeigen auch
höhere Phosphatspiegel im Blut als erwachsene Personen.
Funktionen: Knochenaufbau, Energiestoffwechsel, Nukleinsäuren, Aufgaben im Blut und bei der neuromuskulären Koppelung.
Die
tägliche Phosphoraufnahme einer erwachsenen Person sollte mindestens ~0,7 Gramm betragen (Fleisch, Fisch, Milchprodukte, Brot); in entwickelten Ländern kann man von einem täglichen Austausch von 1-2 Gramm Phosphor mit der Umwelt ausgehen ( Abbildung: 1200 mg).
Abbildung: 1200 mg).
 Phosphat
Phosphat (Serum)
~1 mM (2,5-5,0 mg/dl / 0,85-1,5 mM)

Ausscheidung mit dem Harn: ~800 mg/24h (13-42 mmol/24h)
Phosphat-Clearance 6-16 ml/min - tubuläre Resorption >85%

Ausscheidung mit dem Stuhl: ~400 mg/d
Der
Phosphathaushalt wird in Niere und Gastrointestinaltrakt reguliert:

In der Niere wird glomerulär filtriertes Phosphat zu 90%
rückresorbiert: 80% von proximalen und 10% vom distalen Tubulus.
Die Vorstufe des Vitamin D wird durch enzymatische Hydroxylierung in
Leber (D25-Hydroxylase → Calcidiol) und Niere (1α-Hydroxylase) zum
biologisch aktiven Calcitriol (1,25(OH)2-Form). Die
1α-Hydroxylase-Aktivität in der Niere wird durch Parathormon und
niedrigen Calcium- oder Phosphatspiegel im Blut angeregt, durch
Calcitriol (Selbsthemmung) sowie Hypercalcämie oder Hyperphosphatämie
gehemmt. Das bedeutet, dass niedrige Phosphatspiegel das
D-Hormon-System aktivieren (Steigerung des Phosphatspiegels) und
umgekehrt (negative Rückkopplung).
Phosphat hat weiters Pufferfunktion. Primäres
und sekundäres Phosphat ergeben zusammen ein Puffersystem mit einem
pK-Wert von 6,8, also recht nahe am zu stabilisierenden Wert von ~7,4.
Das macht den Phosphatpuffer - vor allem intrazellulär - zu einem
wichtigen Stabilisator des pH-Wertes im Körper.
 Über Mangel und Überschuss s. unten
Über Mangel und Überschuss s. unten
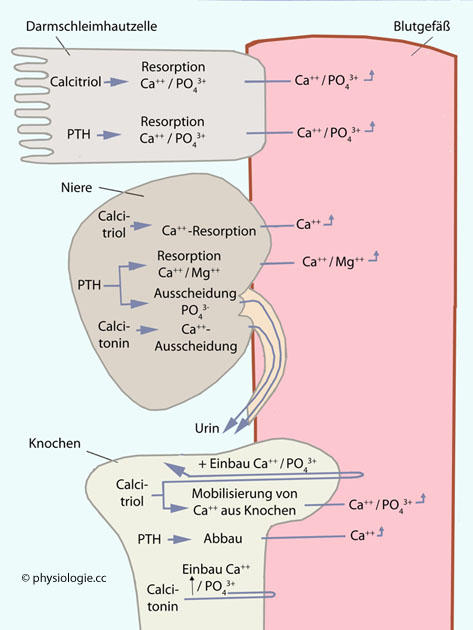
 Abbildung: Übersicht Calcium-, Phosphat- und Magnesiumregulation
Abbildung: Übersicht Calcium-, Phosphat- und Magnesiumregulation
Nach einer Vorlage in Panini SR, Medical Biochemistry, 2nd ed. 2021 (Thieme)
Vor allem drei Hormone können den extrazellulären Calcium- und
Phosphatspiegel beeinflussen: PTH (Parathormon), Calcitriol (aktive
Form von Vit. D3) und Calcitonin.
 PTH steigert den Calciumspiegel, indem es im Darm die Resorption von Ca++ (und Phosphat) anregt, in der Niere die Resorption von Ca++ (auch die von Mg++), und im Knochen dessen Abbau fördert.
PTH steigert den Calciumspiegel, indem es im Darm die Resorption von Ca++ (und Phosphat) anregt, in der Niere die Resorption von Ca++ (auch die von Mg++), und im Knochen dessen Abbau fördert.
 Calcitriol regt die intestinale Resorption von Ca++ und PO43- an sowie die renale Resorption von Ca++. Im Knochen fördert es den Umsatz von Ca++ und PO43- (Mobilisierung und gleichzeitiger Neuanbau). Insgesamt stabilisiert oder steigert es den Calcium- und Phosphatspiegel im Blut.
Calcitriol regt die intestinale Resorption von Ca++ und PO43- an sowie die renale Resorption von Ca++. Im Knochen fördert es den Umsatz von Ca++ und PO43- (Mobilisierung und gleichzeitiger Neuanbau). Insgesamt stabilisiert oder steigert es den Calcium- und Phosphatspiegel im Blut.
 Calcitonin fördert die renale Calciumausscheidung und fördert die Einlagerung von Ca++ und PO43- im Knochen - ohne wesentlichen Effekt auf den Calciumspiegel im Blut
Calcitonin fördert die renale Calciumausscheidung und fördert die Einlagerung von Ca++ und PO43- im Knochen - ohne wesentlichen Effekt auf den Calciumspiegel im Blut

Calciummangel
/ Hypocalcämie führt zu Muskelkrämpfen (tetanische Krämpfe), kardialen
Arrhythmien, über längere Zeit Entkalkung der Knochen (Osteoporose).
Calciummangel kann u.a. entstehen bei Unterfunktion der
Epithelkörperchen (primärer Hypoparathyreoidisums), Vitamin-D-Mangel,
Hypoalbuminämie (normalerweise sind 45% des Calciums im Blut
proteingebunden, vor allem an Albumin).
Calciumüberschuss /
Hypercalcämie kann bei längerer Dauer u.a. zur Bildung von
Nierensteinen führen und die Psyche beeinflussen (Psychosen, depressive
Gemütslagen). Ursache kann primärer Hyperparathyreoidismus sein.
Phosphatmangel /
Hypophosphatämie verursacht u.a. Muskelschwäche und tritt bei
ungenügender intestinaler Resorption (Malabsorption) oder exzessiven
renalen Verlusten auf.
Phosphatüberschuss / Hyperphosphatämie kann sekundären Hyperparathyreoidismus verursachen und auf ungenügende renale Ausscheidung zurückzuführen sein.
Magnesiummangel /
Hypomagnesiämie kann hinter Muskelschäche oder -krämpfen, Tachykardie
oder Reizbarkeit stecken und tritt bei erhöhten renalen Verlusten auf
(z.B. als Nebenwirkung von Diuretika).
Magnesiumüberschuss /
Hypermagnesiämie kann kardiale Arrhythmien, niedrigen Blutdruck oder
Muskelschwäche bewirken; Ursache kann ungenügende renale Ausscheidung
sein.
Calcium und Phosphat im Blutplasma
(Werte gerundet)

Nach Koeppen BM, Stanton BA: Renal Physiology, 4th ed., Mosby 2007
|
|
gesamt
|
ionisiert
|
proteingebunden
|
komplexiert
|
Ion
|
mg/dl
|
%
|
%
|
%
|
Ca++
|
10
|
50
|
45
|
5
|
Pi
|
4
|
84
|
10
|
6
|
Magnesium
Magnesium
 (Mg++; Ordnungszahl 12, Atommasse ~34, in der Erdkruste zu 1,9% vertreten) ist
ein Cofaktor von Transport- und Enzymsystemen. In
der Zelle wirkt es u.a. im Energiestoffwechsel (ATP muss Magnesiumionen
binden, um mit verschiedenen Proteinen interagieren zu können). Etwa
die
Hälfte des Körperbestandes ist in den Knochen gespeichert.
(Mg++; Ordnungszahl 12, Atommasse ~34, in der Erdkruste zu 1,9% vertreten) ist
ein Cofaktor von Transport- und Enzymsystemen. In
der Zelle wirkt es u.a. im Energiestoffwechsel (ATP muss Magnesiumionen
binden, um mit verschiedenen Proteinen interagieren zu können). Etwa
die
Hälfte des Körperbestandes ist in den Knochen gespeichert.
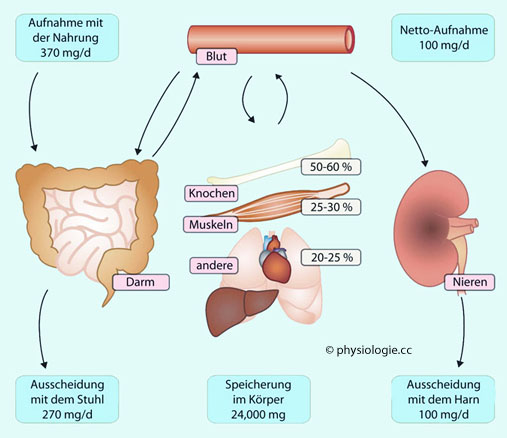
 Abbildung: Magnesiumbilanz einer erwachsenen Person
Abbildung: Magnesiumbilanz einer erwachsenen Person
Mehr
als die Hälfte des im Körper gespeicherten Magnesiums befindet sich in
den Knochen, gut ein Viertel in der Skelettmuskulatur. Im freien
Extrazellulärraum befinden sich etwas mehr als 10 mM Magnesium, das
Blut
enthält nur ~1% des Körperspeichers.
Nimmt man z.B. 370 mg Magnesium mit der Nahrung auf, extrahiert der Darm 30-50% davon (ca. 120 mg) - hauptsächlich parazellulär
im unteren Dünndarm (100 mg/d), feinabgestimmt transzellulär im Colon. Bei Magnesiummangel kann der Anteil des resorbierten Magnesiums auf ~80% der mit der Nahrung zugeführten Menge ansteigen

Der Körper einer
erwachsenen Person enthält insgesamt etwa 20-24 Gramm Magnesium. Mehr als die Hälfte des Körper-Magnesiums befindet sich in der Knochenmatrix, der Rest zum größten Teil im Intrazellulärraum
(27% im Skelettmuskel, ~7% in anderen Zellen,  Abbildung).
Abbildung).
Über die intrazelluläre Magnesiumkonzentration divergieren die Angaben; im Blutplasma beträgt sie ~1 mM/l (ionisiert bei pH=7,4 etwa 60%).
Der Körper speichert Magnesium vor allem in Knochen und Muskeln
|
Funktionen: Magnesium
unterstützt die neuromuskuläre Kommunikation,
regt die
Parathormonsekretion an (was sich auf die Calciumhomöostase auswirkt),
aktiviert zahlreiche Enzyme im Kohlenhydrat- und Proteinstoffwechsel,
und regt allgemein den Zellstoffwechsel an (Transport von Natrium,
Kalium und Calcium über die Zellmembran, Proteintransport). In der
Zelle liegt es vor allem als ATP-Komplex vor (Cofaktor aller ATPasen)
und hemmt Ionenkanäle (NMDA, K+- und Ca++-Kanäle).
Die neuromuskuläre Erregbarkeit ist bei Hypomagnesiämie erhöht, es können Muskelkrämpfe auftreten.
Magnesium im Blutplasma: Rund
20% sind an Albumin gebunden, etwa 60% sind frei (ionisiert) und damit
glomerulär filtrierbar (~3,5 g/d), ~20% sind komplex gebunden (als
Phosphat, Oxalat, Sulfat u.a.)
Der
tägliche Bedarf beträgt bei Männern ~420 mg/d und bei Frauen ~320
mg/d - etwa ein Drittel wird tatsächlich resorbiert (in der  Abbildung wird
von 100 mg Mg++/d Netto-Resorption ausgegangen; 120 mg resorbiert, 20 mg/d sezerniert).
Abbildung wird
von 100 mg Mg++/d Netto-Resorption ausgegangen; 120 mg resorbiert, 20 mg/d sezerniert).
 Über Mangel und Überschuss s. unten
Über Mangel und Überschuss s. unten
Magnesium wird hauptsächlich aus
Vollkornprodukten,
Leber, Geflügel, Fisch, Nüssen aufgenommen.
 Magnesium
Magnesium (Serum)
~1 mM (0,75-1,10 mM / 1,8-2,6 mg/dl)
Ionisierter Anteil (pH 7,4): 0,53-0,67 mM
Hypomagnesiämie bei ≤1,7 mg/dl
Hypermagnesiämie bei >4 mg/dl -
Bereich zwischen 2,6 und 4 mg/dl klinisch unbedeutend

Harn: 2,5-8,5 mM
 Nur ~1% des Körper-Magnesiums befindet sich im Blut.
Nur ~1% des Körper-Magnesiums befindet sich im Blut.
Magnesiummangel kann auch bei normalen Blutwerten vorliegen!
Starke Schweißsekretion
kann zu Magnesiummangel führen; Muskelschwäche, Zittern, Krämpfe,
erhöhter Gefäßwiderstand (Wadenkrämpfe durch Gefäßspasmen) sind die
Folge.

 Abbildung: Zelluläre Physiologie des Magnesiums
Nach
de Baaij JHF, Hoenderop JGJ, Bindels RJM. Magnesium in Man:
Implications for Health and Disease. Physiol Rev 2015; 95: 1-46
Abbildung: Zelluläre Physiologie des Magnesiums
Nach
de Baaij JHF, Hoenderop JGJ, Bindels RJM. Magnesium in Man:
Implications for Health and Disease. Physiol Rev 2015; 95: 1-46
Die Magnesium- Homöostase in der Zelle wird durch die gemeinsame Funktion mehrerer Transporter in der Zellmembran reguliert.
Die Mg++-Aufnahme kann durch Wachstumsfaktoren erhöht werden (EGFR = epidermal growth factor receptor), dabei wird mTOR (mammalian target of rapamycin) aktiviert und Ca++ aus dem endoplasmatischen Retikulum freigesetzt - ein für Zellwachstum und Proliferation wesentlicher Mechanismus.
MRS2-Transporter (mitochondrial RNA splicing 2) regulieren die Mg++-Konzentration in den Mitochondrien. Im Zellkern beteiligt sich Mg++ an Stabilität und Reparatur der DNA und reguliert die Aktivität von Polymerasen. Im Zytoplasma beeinflusst Mg++ die Aktivität hunderter Enzyme sowie RNA-Stabilität und ATP-Bindung.
CNNM3, cyclin M3  IP3, Inositoltrisphosphat
IP3, Inositoltrisphosphat  MagT1, magnesium transporter 1
MagT1, magnesium transporter 1  PI3K, Phosphoinositol-3-Kinase
PI3K, Phosphoinositol-3-Kinase  PIP3, Phosphatidylinositol 3,4,5-Trisphosphat
PIP3, Phosphatidylinositol 3,4,5-Trisphosphat  PLCγ, Phospholipase C-γ
PLCγ, Phospholipase C-γ  SLC41A1, solute carrier family 41 type 1
SLC41A1, solute carrier family 41 type 1  TRPM7, transient receptor potential melastatin type 7
TRPM7, transient receptor potential melastatin type 7

Biologische Bedeutung.
Magnesium ist nach Kalium das zweithäufigste Kation in der Zelle. Es
ist für die Funktion von über 600 Enzymen notwendig. Die physiologische
Bedeutung zeigt sich vor allem für das Funktionieren von
 Gehirn
Gehirn (der neuronale Magnesiumgehalt ist wesentlich für die Regulierung der Empfindlichkeit von
NMDA-Rezeptoren; Magnesiummangel kann Migräne, Depressionen und Epilepsie verursachen),
 Herz
Herz
(Magnesium beeinflusst die Aktivität von kardialen Ionenrezeptoren,
reguliert die Kontraktilität über die Verfügbarkeit intrazellulärer
Calciumionen - Kompetition um Bindungsstellen am kontraktilen Apparat!
-, und wirkt vasodilatierend sowie antiinflammatorisch)
 Skelettmuskulatur
Skelettmuskulatur (als Ca
++-Antagonist, dessen Bindung an Troponin durch Mg
++ kompetitiv gehemmt wird - in der ruhenden Muskelzelle ist [Mg
++] etwa 10
4-fach höher als [Ca
++],
und
Calciumionen verdrängen im Rahmen der elektromechanischen Kopplung
Magnesium von den Bindungsstellen. Das Gleichgewicht ist bei
Magnesiummangel zugunsten der
Calciumbindung verschoben, und es können
Muskelkrämpfe auftreten)
Aber auch die Funktion anderer Organe, wie Leber und Immunsystem, hängt von der Verfügbarkeit von Mg++ ab. Magnesium wirkt entzündungshemmend und Ca++-antagonistisch. Es ist wichtig für Energiehaushalt, Eiweißsynthese,
Protein- und Nukleotidstruktur: Es bildet eine wesentliche Komponente
der DNA- und RNA-Tertiärstruktur und ist notwendig für Struktur und
Aktivität der DNA- und RNA-Polymerasen. Die Funktion zahlreicher Enzyme
der Glykolyse hängen von der Anwesenheit von Mg++ ab; Mg-ATP
ist für mehrere Enzyme notwendig. Aber auch darüber hinaus gibt es kaum
einen Stoffwechselweg, der nicht der Anwesenheit von Magnesiumionen
bedarf.
Magnesium ist auch ein wichtiger Faktor für die Kontrolle der
Zellproliferation (die wiederum von der Proteinsynthese abhängt -  Abbildung). Steigt [Mg++] in der Zelle, dann nimmt die Eiweißsynthese innerhalb einer Stunde zu (die DNA-Synthese innerhalb von 10 Stunden).
Abbildung). Steigt [Mg++] in der Zelle, dann nimmt die Eiweißsynthese innerhalb einer Stunde zu (die DNA-Synthese innerhalb von 10 Stunden).
Regulierung. Der Magnesiumhaushalt wird u.a. in den Nieren und
im Gastrointestinaltrakt reguliert (Parathormon, Vasopressin - Vasopressin steigert u.a. die Mg++-Verfügbarkeit
in der Zelle). Im Knochen fördert Magnesium den Knochenaufbau - es
stimuliert die Proliferation von Osteoblasten und Knorpelzellen in den
Wachstumsfugen.
 Die Resorption im Darm (25-60% der mit der Nahrung angebotenen Menge) erfolgt zum Großteil parazellulär im unteren Jejunum und im Ileum (unreguliert, konzentrationsabhängig - kaum durch Claudine in tight junctions behindert) sowie transzellulär (TRPM - epitheliale Transportsysteme s.
Die Resorption im Darm (25-60% der mit der Nahrung angebotenen Menge) erfolgt zum Großteil parazellulär im unteren Jejunum und im Ileum (unreguliert, konzentrationsabhängig - kaum durch Claudine in tight junctions behindert) sowie transzellulär (TRPM - epitheliale Transportsysteme s.  Abbildung) im Dickdarm. Bei Magnesiummangel nimmt die Effizienz der intestinalen Magnesiumresorption zu.
Abbildung) im Dickdarm. Bei Magnesiummangel nimmt die Effizienz der intestinalen Magnesiumresorption zu.
Rund die Hälfte der resorbierten Magnesiummenge wird mit dem Stuhl ausgeschieden.
 Die Nieren sind der Hauptort der Regulation des Magnesiumspiegels: Die Magnesium-Rückresorption aus dem Nephron erfolgt in erster Linie (~70%)
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife -
vorwiegend parazellulär (das tight-junction-Protein Claudin reguliert die Diffusion),
bei Bedarf (Magnesiummangel) auch transzellulär. Die kortikalen Tubuli
resorbieren zusammen ~25% der filtrierten Menge. 5% der primär
filtrierten Menge werden mit dem Harn ausgeschieden (etwa dieselbe
Menge wie im Darm aufgenommen, d.h. ~0,1 g/d).
Die Nieren sind der Hauptort der Regulation des Magnesiumspiegels: Die Magnesium-Rückresorption aus dem Nephron erfolgt in erster Linie (~70%)
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife -
vorwiegend parazellulär (das tight-junction-Protein Claudin reguliert die Diffusion),
bei Bedarf (Magnesiummangel) auch transzellulär. Die kortikalen Tubuli
resorbieren zusammen ~25% der filtrierten Menge. 5% der primär
filtrierten Menge werden mit dem Harn ausgeschieden (etwa dieselbe
Menge wie im Darm aufgenommen, d.h. ~0,1 g/d).

Calcium
 Übertriebene Calciumaufnahme
Übertriebene Calciumaufnahme kann zum
Burnett-Syndrom 
(
Milch-Alkali-Syndrom) führen:
Überangebot an
Calcium (Milch!) und leicht resorbierbaren Alkalien
(Bionat) führt zu Alkalose (erhöhter Phosphatspiegel) mit Übelkeit,
Erbrechen, Schwindelgefühl und Ataxie, längerfristig zu
Kalkablagerungen in conjunktiva und evt. cornea des Auges sowie in die
Nierentubuli (Niereninsuffizienz!).
 Chronischer Calciummangel
Chronischer Calciummangel (streng vegetarische Diät ohne Milchprodukte, Verdauungs- und
Resorptionsstörungen, Magnesium- oder Vit. D-Mangel) kann eine
Neigung zu Muskelkrämpfen bewirken (Hypocalcämie!).

Die Konzentration an
ionisiertem Calcium wird mittels selektiver Messelektroden bestimmt (Ionenaustauscher, Ag/AgCl-Bezugselektrode). Das
Gesamt-Calcium
wird mittels Atomabsorptions-Spektroskopie (Referenzmethode),
Flammenphotometrie (spezifische Wellenlänge) oder Photometrie ermittelt
(Farbkomplexreaktion).
Phosphat
 Phosphatmangel
Phosphatmangel:
Im Bereich von 1,0 - 2,5 mg/dl spricht man von milder, unter 1 mg/dl
von schwerer Hypophosphatämie. Chronischer Phosphatverlust kann sich -
außer infolge Mangelernährung - durch chronische Sekretverluste oder
bei Alkoholmißbrauch ergeben (verminderte Zufuhr, Phosphat →
Intrazellulärraum etc). Akut kann sich Phosphatmangel z.B. durch
Insulingabe einstellen (Phosphat → intrazellulär, zusammen mit
Glucose). Es kann zu ATP-Mangel mit Zellschäden kommen (Myopathien,
Atemstörungen..)
 Hyperphosphatämie
Hyperphosphatämie
liegt bei Werten über 5 mg/dl vor (ab 9 mg/dl schwer). Häufigste
Ursache ist verringerte renale Ausscheidung (Niereninsuffizienz). Folge
können extraossäre Verkalkungen sein. Verringerte Zufuhr wird durch
eiweißarme Diät erreicht.
Magnesium
 Magnesiummangel
Magnesiummangel: Eine mangelnde
Deckung dieses Bedarfs mit der Nahrung ist häufig, z.T. wegen des
geringen Mineralgehalts landwirtschaftlich genutzter Böden; z.B. ist in
den letzten 50 Jahren der durchschnittliche Magnesiumgehalt von Obst um
20-30% gesunken. Außerdem gehen bei der Nahrungsmittelaufarbeitung
80-90% des ursprünglich enthaltenen Magnesiums verloren. Achtung:
Magnesiummangel kann auch bei normalen Blutwerten vorliegen (99% des Magnesiums befindet sich außerhalb der Blutbahn).
Hypomagnesiämie kann - außer durch verminderte Zufuhr - bedingt sein durch

renale Verluste (Hemmung der Rückresorption durch Diuretika, Hypercalcämie, Hyperthyreose, tubuläre Schäden u.a.)

intestinale Verluste (Malabsorption infolge Durchfall, Entzündung, Laxantienmissbrauch u.a.).

Ein
Magnesiummangel ist schwer zu diagnostizieren, da Magnesium zum
Großteil in den Zellen gespeichert wird und die Messung des
Serumspiegels kaum aussagekräftig ist. Eine Möglichkeit ist eine
Magnesiumbelastung:
Nach einer Magnesiuminfusion wird über 2 Tage die Ausscheidung mit dem
Harn ermittelt; hält die Person viel Magnesium zurück, hatte der Körper
vermutlich wenig gespeichert und es liegt ein Magnesiummangel vor.
 Magnesiumüberschuss
Magnesiumüberschuss: Bei Magnesiumspiegeln über 5 mg/dl (vgl. Referenzwerte) ist die
muskuläre Erregungsübertragung blockiert
(
motorische Endplatte, Herzmuskel, glatte Muskulatur). Folge sind u.a.
schlaffe Lähmungen, Schließmuskelschwäche, Obstipationen u.a.; ab
Magnesiumwerten über ~9 mg/dl Atemschwäche; und ab ~12 mg/dl drohen
Herz- und Atemstillstand.
Hypermagnesiämie kann - außer durch übertriebene Magnesiumsubstitution - bedingt sein durch

Niereninsuffizienz
(akut oder chronisch) - filtriertes Magnesium wird nicht ausreichend
tubulär rückresorbiert, Magnesium staut sich im Körper zurück.

Magnesiumüberschuss zeigt sich in einem erhöhten
Serumspiegel.


 Calcium (Ca) - zu über 99% in den Knochen gespeichert - hat als freies Ion (Ca++)
vielfältige Funktionen (extrazellulär: Enzyme - Permeabilität, Blutgerinnung, Komplementsystem;
intrazellulär: Signalübertragung, Muskelkontraktion). Die Aufnahme im Darm ist an Calbindin - ein Vitamin D3-abhängiges Ca++-Transportprotein - geknüpft Calcium (Ca) - zu über 99% in den Knochen gespeichert - hat als freies Ion (Ca++)
vielfältige Funktionen (extrazellulär: Enzyme - Permeabilität, Blutgerinnung, Komplementsystem;
intrazellulär: Signalübertragung, Muskelkontraktion). Die Aufnahme im Darm ist an Calbindin - ein Vitamin D3-abhängiges Ca++-Transportprotein - geknüpft
 Extrazelluläres
[Ca++] wird hormonell reguliert; Hypocalcämie besteht bei
<2,1 mM, Hypercalcämie bei >2,6 mM. ~40% des Serum-Calciums ist
proteingebunden, ~10% an Bionat, Phosphat und Citrat komplexiert.
Der biologisch wirksame ~50%-Anteil des Ca++ (1,15-1,30 mM/l) sinkt mit Proteinkonzentration und
Blut-pH. Unter 0,6 mM treten hypocalcämische Tetanie und
Herzrhythmusstörungen auf Extrazelluläres
[Ca++] wird hormonell reguliert; Hypocalcämie besteht bei
<2,1 mM, Hypercalcämie bei >2,6 mM. ~40% des Serum-Calciums ist
proteingebunden, ~10% an Bionat, Phosphat und Citrat komplexiert.
Der biologisch wirksame ~50%-Anteil des Ca++ (1,15-1,30 mM/l) sinkt mit Proteinkonzentration und
Blut-pH. Unter 0,6 mM treten hypocalcämische Tetanie und
Herzrhythmusstörungen auf
 Phosphor findet sich zu 4/5 als Bausubstanz (Apatit) in den Knochen,
sowie als Phosphatpuffer, in Phospholipiden (Zellmembran),
energiereichen Phosphaten (ATP, CP), Botenstoffen (cAMP) und
Nukleinsäuren (DNA, RNA) überall im Körper - dieser enthält ~10 g P /
kg Körpergewicht. Phosphat wird im Darm zu ~80% resorbiert. In der
Wachstumsphase ist die Phosphatbilanz positiv, wachsende Kinder haben
höhere Serum-Phosphatspiegel als erwachsene Personen. Die tägliche
Phosphataufnahme beträgt 1-2 g (Minimum 0,7 g/d); die Ausscheidung
erfolgt über Harn (~0,8 g/d) und Stuhl (~0,4 g/d) - reguliert über
Parathormon, Glucocorticoide, Phosphatbilanz Phosphor findet sich zu 4/5 als Bausubstanz (Apatit) in den Knochen,
sowie als Phosphatpuffer, in Phospholipiden (Zellmembran),
energiereichen Phosphaten (ATP, CP), Botenstoffen (cAMP) und
Nukleinsäuren (DNA, RNA) überall im Körper - dieser enthält ~10 g P /
kg Körpergewicht. Phosphat wird im Darm zu ~80% resorbiert. In der
Wachstumsphase ist die Phosphatbilanz positiv, wachsende Kinder haben
höhere Serum-Phosphatspiegel als erwachsene Personen. Die tägliche
Phosphataufnahme beträgt 1-2 g (Minimum 0,7 g/d); die Ausscheidung
erfolgt über Harn (~0,8 g/d) und Stuhl (~0,4 g/d) - reguliert über
Parathormon, Glucocorticoide, Phosphatbilanz
 Magnesium ist Bestandteil vieler (>600) Transport- und Enzymsysteme;
99% intrazellulär. Im Blutplasma sind ~20% an Albumin, ~20% komplex
gebunden, ~60% ionisiert (filtrierbar). Mehr als die Hälfte des
Körperbestandes (≥20 g) befindet sich in den Knochen, gut ein Viertel
in der Muskulatur. Der Darm resorbiert ~120 mg/d (parazellulär - das
Dreifache muss mit der Nahrung zugeführt werden), die Nieren - Hauptort
der Regulation des Magnesiumspiegels - scheiden eine gleiche Menge aus.
Magnesium erleichtert den Ionentransport über die Zellmembran,
reguliert glutamaterge Rezeptoren und aktiviert Enzyme im Kohlenhydrat-
und Proteinstoffwechsel. In der Muskelzelle gibt es eine Kompetition
mit Calciumionen. Magnesiummangel oder erhöhter Verlust (starkes
Schwitzen) erhöht die neuromuskuläre Erregbarkeit, es können
Muskelkrämpfe und Gefäßspasmen auftreten Magnesium ist Bestandteil vieler (>600) Transport- und Enzymsysteme;
99% intrazellulär. Im Blutplasma sind ~20% an Albumin, ~20% komplex
gebunden, ~60% ionisiert (filtrierbar). Mehr als die Hälfte des
Körperbestandes (≥20 g) befindet sich in den Knochen, gut ein Viertel
in der Muskulatur. Der Darm resorbiert ~120 mg/d (parazellulär - das
Dreifache muss mit der Nahrung zugeführt werden), die Nieren - Hauptort
der Regulation des Magnesiumspiegels - scheiden eine gleiche Menge aus.
Magnesium erleichtert den Ionentransport über die Zellmembran,
reguliert glutamaterge Rezeptoren und aktiviert Enzyme im Kohlenhydrat-
und Proteinstoffwechsel. In der Muskelzelle gibt es eine Kompetition
mit Calciumionen. Magnesiummangel oder erhöhter Verlust (starkes
Schwitzen) erhöht die neuromuskuläre Erregbarkeit, es können
Muskelkrämpfe und Gefäßspasmen auftreten
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Calcium, Phosphat, Magnesium
Calcium, Phosphat, Magnesium
 Burnett-Syndrom: Charles Hoyt Burnett (1913-1967)
Burnett-Syndrom: Charles Hoyt Burnett (1913-1967) Phosphat (HPO4--)
Phosphat (HPO4--)  Magnesium
(Mg++)
Magnesium
(Mg++)
 Core messages
Core messages (Ordnungszahl
20, Atommasse 40, in der Erdkruste zu 3,4% vertreten)
ist Bestandteil von Knochen und Zähnen; dieses Calcium wird alle
6-7 Monate erneuert. Im Kreislauf liegt es frei gelöst,
proteingebunden und als Komplexsalz (Phosphat, Citrat..)
vor.
(Ordnungszahl
20, Atommasse 40, in der Erdkruste zu 3,4% vertreten)
ist Bestandteil von Knochen und Zähnen; dieses Calcium wird alle
6-7 Monate erneuert. Im Kreislauf liegt es frei gelöst,
proteingebunden und als Komplexsalz (Phosphat, Citrat..)
vor. 
 Abbildung: Calciumbilanz einer erwachsenen Person
Abbildung: Calciumbilanz einer erwachsenen Person
 Calcium (Serum)
Calcium (Serum) Abbildung).
Abbildung).  Bei Knochenwachstum (Kinder, Jugendliche) und -aufbau (Training) nimmt
der Calciumpool im Körper zu; bei mangelnder mechanischer Belastung
nimmt er ab. In der Postmenopause kommt es jährlich zu Verlust von etwa 1% der Calciummasse aus den Knochen. Bei Immobilisierung
(Bettlägrigkeit, Lähmung, Aufenthalt im schwerelosen Zustand..) kann
der Verlust an unbelasteten Stellen viel höher sein (bis >1% pro Monat),
je nach (mangelnder) Beanspruchung der jeweiligen Strukturen. In
Abwesenheit entsprechender mechanischer Belastung (die Druck- und
Zugbelastbarkeit von Lamellenknochen liegt bei ~1000 kg/cm2!) setzt sich der Abbau über unbegrenzte Zeit fort.
Bei Knochenwachstum (Kinder, Jugendliche) und -aufbau (Training) nimmt
der Calciumpool im Körper zu; bei mangelnder mechanischer Belastung
nimmt er ab. In der Postmenopause kommt es jährlich zu Verlust von etwa 1% der Calciummasse aus den Knochen. Bei Immobilisierung
(Bettlägrigkeit, Lähmung, Aufenthalt im schwerelosen Zustand..) kann
der Verlust an unbelasteten Stellen viel höher sein (bis >1% pro Monat),
je nach (mangelnder) Beanspruchung der jeweiligen Strukturen. In
Abwesenheit entsprechender mechanischer Belastung (die Druck- und
Zugbelastbarkeit von Lamellenknochen liegt bei ~1000 kg/cm2!) setzt sich der Abbau über unbegrenzte Zeit fort. Die tägliche Ca++-Aufnahme des Erwachsenen sollte ~1 Gramm (Empfehlung: 1200-1500 mg/d) betragen. Unterversorgung kann
die Entwicklung von Osteoporose fördern. Körperliche
Fitness ist neben ausreichender Calciumzufuhr (Milch, Milchprodukte, Fisch, Meerestiere, Getreideprodukte) die
wichtigste Maßnahme, um das Skelettsystem belastbar zu halten. Bei
verringerter Belastung der Knochen
wird Calcium mobilisiert und ausgeschieden und kann der Bildung von Nierensteinen Vorschub leisten
(so sind z.B. Astronauten potentiell nierensteingefährdet).
Die tägliche Ca++-Aufnahme des Erwachsenen sollte ~1 Gramm (Empfehlung: 1200-1500 mg/d) betragen. Unterversorgung kann
die Entwicklung von Osteoporose fördern. Körperliche
Fitness ist neben ausreichender Calciumzufuhr (Milch, Milchprodukte, Fisch, Meerestiere, Getreideprodukte) die
wichtigste Maßnahme, um das Skelettsystem belastbar zu halten. Bei
verringerter Belastung der Knochen
wird Calcium mobilisiert und ausgeschieden und kann der Bildung von Nierensteinen Vorschub leisten
(so sind z.B. Astronauten potentiell nierensteingefährdet). Freies (ungebundenes, ionales) extrazelluläres Calcium bestimmt die Erregbarkeit von Zellmembranen:
Freies (ungebundenes, ionales) extrazelluläres Calcium bestimmt die Erregbarkeit von Zellmembranen: 
 Abbildung: Erklärungsmodell für die Abhängigkeit der Membranerregbarkeit vom extrazellulären Calciumspiegel
Abbildung: Erklärungsmodell für die Abhängigkeit der Membranerregbarkeit vom extrazellulären Calciumspiegel
 Abbildung). Das kann zur
Auslösung von Aktionspotentialen führen (Motorische Vorderhornzellen übererregt → tetanische Krämpfe).
Abbildung). Das kann zur
Auslösung von Aktionspotentialen führen (Motorische Vorderhornzellen übererregt → tetanische Krämpfe). Erhöhung des Calciumspiegels im Blut (Hypercalcämie) senkt den
Natriumeinstrom (u.a. über spannungsgesteuerte Natriumkanäle) und
steigert den Kaliumausstrom (über mehrere Kaliumpermeasen), was in
einer Hyperpolarisierung der Zellen resultiert. Damit nimmt auch die
Erregbarkeit der Muskeln ab.
Erhöhung des Calciumspiegels im Blut (Hypercalcämie) senkt den
Natriumeinstrom (u.a. über spannungsgesteuerte Natriumkanäle) und
steigert den Kaliumausstrom (über mehrere Kaliumpermeasen), was in
einer Hyperpolarisierung der Zellen resultiert. Damit nimmt auch die
Erregbarkeit der Muskeln ab. Über Mangel und Überschuss s. unten
Über Mangel und Überschuss s. unten findet sich in den Knochen (80-85%) und in anderen Geweben: In Form von
Phospholipiden (Zellmembran) und energiereichen Phosphaten (ATP, CP),
in Botenstoffen (cAMP) und Nukleinsäuren (DNA, RNA). Als "anorganisch" (Pi: inorganic)
bezeichnet man das Element in Phosphatsalzen, als "organisch" z.B. in
Nukleinsäuren, Phospholipiden, verschiedenen Estern. Bei
Neugeborenen macht der Anteil des Phosphors am Körpergewicht 0,5%
(16-18 g), bei erwachsenen Personen etwa 1% aus (600-700 g).
findet sich in den Knochen (80-85%) und in anderen Geweben: In Form von
Phospholipiden (Zellmembran) und energiereichen Phosphaten (ATP, CP),
in Botenstoffen (cAMP) und Nukleinsäuren (DNA, RNA). Als "anorganisch" (Pi: inorganic)
bezeichnet man das Element in Phosphatsalzen, als "organisch" z.B. in
Nukleinsäuren, Phospholipiden, verschiedenen Estern. Bei
Neugeborenen macht der Anteil des Phosphors am Körpergewicht 0,5%
(16-18 g), bei erwachsenen Personen etwa 1% aus (600-700 g). 
 Abbildung: Phosphorbilanz einer erwachsenen Person
Abbildung: Phosphorbilanz einer erwachsenen Person
 Abbildung: 800 mg/d). In der Wachstumsphase
ist die Phosphatbilanz positiv, es wird mehr aufgenommen (in die
Knochen eingebaut) als ausgeschieden. Wachsende Kinder zeigen auch
höhere Phosphatspiegel im Blut als erwachsene Personen.
Abbildung: 800 mg/d). In der Wachstumsphase
ist die Phosphatbilanz positiv, es wird mehr aufgenommen (in die
Knochen eingebaut) als ausgeschieden. Wachsende Kinder zeigen auch
höhere Phosphatspiegel im Blut als erwachsene Personen. Abbildung: 1200 mg).
Abbildung: 1200 mg). Phosphat (Serum)
Phosphat (Serum)


 Parathormon, Glucocorticoide,
Hyperphosphatämie, Azidose
steigern die renale Phosphatausscheidung (Parathormon steigert auch die Phosphatresorption im Darm und Knochen und wirkt sich unter physiologischen Umständen nicht auf den Phosphatspiegel aus);
Parathormon, Glucocorticoide,
Hyperphosphatämie, Azidose
steigern die renale Phosphatausscheidung (Parathormon steigert auch die Phosphatresorption im Darm und Knochen und wirkt sich unter physiologischen Umständen nicht auf den Phosphatspiegel aus); Vit. D (Calcitriol), Insulin, GH, T3 und Alkalose senken die Phosphatausscheidung.
Vit. D (Calcitriol), Insulin, GH, T3 und Alkalose senken die Phosphatausscheidung.  Über Mangel und Überschuss s. unten
Über Mangel und Überschuss s. unten
 Abbildung: Übersicht Calcium-, Phosphat- und Magnesiumregulation
Abbildung: Übersicht Calcium-, Phosphat- und Magnesiumregulation PTH steigert den Calciumspiegel, indem es im Darm die Resorption von Ca++ (und Phosphat) anregt, in der Niere die Resorption von Ca++ (auch die von Mg++), und im Knochen dessen Abbau fördert.
PTH steigert den Calciumspiegel, indem es im Darm die Resorption von Ca++ (und Phosphat) anregt, in der Niere die Resorption von Ca++ (auch die von Mg++), und im Knochen dessen Abbau fördert. Calcitriol regt die intestinale Resorption von Ca++ und PO43- an sowie die renale Resorption von Ca++. Im Knochen fördert es den Umsatz von Ca++ und PO43- (Mobilisierung und gleichzeitiger Neuanbau). Insgesamt stabilisiert oder steigert es den Calcium- und Phosphatspiegel im Blut.
Calcitriol regt die intestinale Resorption von Ca++ und PO43- an sowie die renale Resorption von Ca++. Im Knochen fördert es den Umsatz von Ca++ und PO43- (Mobilisierung und gleichzeitiger Neuanbau). Insgesamt stabilisiert oder steigert es den Calcium- und Phosphatspiegel im Blut. Calcitonin fördert die renale Calciumausscheidung und fördert die Einlagerung von Ca++ und PO43- im Knochen - ohne wesentlichen Effekt auf den Calciumspiegel im Blut
Calcitonin fördert die renale Calciumausscheidung und fördert die Einlagerung von Ca++ und PO43- im Knochen - ohne wesentlichen Effekt auf den Calciumspiegel im Blut

 (Mg++; Ordnungszahl 12, Atommasse ~34, in der Erdkruste zu 1,9% vertreten) ist
ein Cofaktor von Transport- und Enzymsystemen. In
der Zelle wirkt es u.a. im Energiestoffwechsel (ATP muss Magnesiumionen
binden, um mit verschiedenen Proteinen interagieren zu können). Etwa
die
Hälfte des Körperbestandes ist in den Knochen gespeichert.
(Mg++; Ordnungszahl 12, Atommasse ~34, in der Erdkruste zu 1,9% vertreten) ist
ein Cofaktor von Transport- und Enzymsystemen. In
der Zelle wirkt es u.a. im Energiestoffwechsel (ATP muss Magnesiumionen
binden, um mit verschiedenen Proteinen interagieren zu können). Etwa
die
Hälfte des Körperbestandes ist in den Knochen gespeichert. 
 Abbildung: Magnesiumbilanz einer erwachsenen Person
Abbildung: Magnesiumbilanz einer erwachsenen Person
 Abbildung).
Abbildung). 
 Abbildung wird
von 100 mg Mg++/d Netto-Resorption ausgegangen; 120 mg resorbiert, 20 mg/d sezerniert).
Abbildung wird
von 100 mg Mg++/d Netto-Resorption ausgegangen; 120 mg resorbiert, 20 mg/d sezerniert).  Über Mangel und Überschuss s. unten
Über Mangel und Überschuss s. unten Magnesium (Serum)
Magnesium (Serum)
 Nur ~1% des Körper-Magnesiums befindet sich im Blut.
Nur ~1% des Körper-Magnesiums befindet sich im Blut.
 Abbildung: Zelluläre Physiologie des Magnesiums
Abbildung: Zelluläre Physiologie des Magnesiums IP3, Inositoltrisphosphat
IP3, Inositoltrisphosphat  MagT1, magnesium transporter 1
MagT1, magnesium transporter 1  PI3K, Phosphoinositol-3-Kinase
PI3K, Phosphoinositol-3-Kinase  PIP3, Phosphatidylinositol 3,4,5-Trisphosphat
PIP3, Phosphatidylinositol 3,4,5-Trisphosphat  PLCγ, Phospholipase C-γ
PLCγ, Phospholipase C-γ  SLC41A1, solute carrier family 41 type 1
SLC41A1, solute carrier family 41 type 1  TRPM7, transient receptor potential melastatin type 7
TRPM7, transient receptor potential melastatin type 7
 Gehirn (der neuronale Magnesiumgehalt ist wesentlich für die Regulierung der Empfindlichkeit von NMDA-Rezeptoren; Magnesiummangel kann Migräne, Depressionen und Epilepsie verursachen),
Gehirn (der neuronale Magnesiumgehalt ist wesentlich für die Regulierung der Empfindlichkeit von NMDA-Rezeptoren; Magnesiummangel kann Migräne, Depressionen und Epilepsie verursachen),  Herz
(Magnesium beeinflusst die Aktivität von kardialen Ionenrezeptoren,
reguliert die Kontraktilität über die Verfügbarkeit intrazellulärer Calciumionen - Kompetition um Bindungsstellen am kontraktilen Apparat!
-, und wirkt vasodilatierend sowie antiinflammatorisch)
Herz
(Magnesium beeinflusst die Aktivität von kardialen Ionenrezeptoren,
reguliert die Kontraktilität über die Verfügbarkeit intrazellulärer Calciumionen - Kompetition um Bindungsstellen am kontraktilen Apparat!
-, und wirkt vasodilatierend sowie antiinflammatorisch) Skelettmuskulatur (als Ca++-Antagonist, dessen Bindung an Troponin durch Mg++ kompetitiv gehemmt wird - in der ruhenden Muskelzelle ist [Mg++] etwa 104-fach höher als [Ca++],
und Calciumionen verdrängen im Rahmen der elektromechanischen Kopplung
Magnesium von den Bindungsstellen. Das Gleichgewicht ist bei
Magnesiummangel zugunsten der Calciumbindung verschoben, und es können
Muskelkrämpfe auftreten)
Skelettmuskulatur (als Ca++-Antagonist, dessen Bindung an Troponin durch Mg++ kompetitiv gehemmt wird - in der ruhenden Muskelzelle ist [Mg++] etwa 104-fach höher als [Ca++],
und Calciumionen verdrängen im Rahmen der elektromechanischen Kopplung
Magnesium von den Bindungsstellen. Das Gleichgewicht ist bei
Magnesiummangel zugunsten der Calciumbindung verschoben, und es können
Muskelkrämpfe auftreten) Abbildung). Steigt [Mg++] in der Zelle, dann nimmt die Eiweißsynthese innerhalb einer Stunde zu (die DNA-Synthese innerhalb von 10 Stunden).
Abbildung). Steigt [Mg++] in der Zelle, dann nimmt die Eiweißsynthese innerhalb einer Stunde zu (die DNA-Synthese innerhalb von 10 Stunden).  Die Resorption im Darm (25-60% der mit der Nahrung angebotenen Menge) erfolgt zum Großteil parazellulär im unteren Jejunum und im Ileum (unreguliert, konzentrationsabhängig - kaum durch Claudine in tight junctions behindert) sowie transzellulär (TRPM - epitheliale Transportsysteme s.
Die Resorption im Darm (25-60% der mit der Nahrung angebotenen Menge) erfolgt zum Großteil parazellulär im unteren Jejunum und im Ileum (unreguliert, konzentrationsabhängig - kaum durch Claudine in tight junctions behindert) sowie transzellulär (TRPM - epitheliale Transportsysteme s.  Abbildung) im Dickdarm. Bei Magnesiummangel nimmt die Effizienz der intestinalen Magnesiumresorption zu.
Abbildung) im Dickdarm. Bei Magnesiummangel nimmt die Effizienz der intestinalen Magnesiumresorption zu.  Die Nieren sind der Hauptort der Regulation des Magnesiumspiegels: Die Magnesium-Rückresorption aus dem Nephron erfolgt in erster Linie (~70%)
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife -
vorwiegend parazellulär (das tight-junction-Protein Claudin reguliert die Diffusion),
bei Bedarf (Magnesiummangel) auch transzellulär. Die kortikalen Tubuli
resorbieren zusammen ~25% der filtrierten Menge. 5% der primär
filtrierten Menge werden mit dem Harn ausgeschieden (etwa dieselbe
Menge wie im Darm aufgenommen, d.h. ~0,1 g/d).
Die Nieren sind der Hauptort der Regulation des Magnesiumspiegels: Die Magnesium-Rückresorption aus dem Nephron erfolgt in erster Linie (~70%)
im dicken Teil des aufsteigenden Schenkels der Henle-Schleife -
vorwiegend parazellulär (das tight-junction-Protein Claudin reguliert die Diffusion),
bei Bedarf (Magnesiummangel) auch transzellulär. Die kortikalen Tubuli
resorbieren zusammen ~25% der filtrierten Menge. 5% der primär
filtrierten Menge werden mit dem Harn ausgeschieden (etwa dieselbe
Menge wie im Darm aufgenommen, d.h. ~0,1 g/d). 
 Übertriebene Calciumaufnahme kann zum Burnett-Syndrom
Übertriebene Calciumaufnahme kann zum Burnett-Syndrom  (Milch-Alkali-Syndrom) führen:
Überangebot an Calcium (Milch!) und leicht resorbierbaren Alkalien
(Bionat) führt zu Alkalose (erhöhter Phosphatspiegel) mit Übelkeit,
Erbrechen, Schwindelgefühl und Ataxie, längerfristig zu
Kalkablagerungen in conjunktiva und evt. cornea des Auges sowie in die
Nierentubuli (Niereninsuffizienz!).
(Milch-Alkali-Syndrom) führen:
Überangebot an Calcium (Milch!) und leicht resorbierbaren Alkalien
(Bionat) führt zu Alkalose (erhöhter Phosphatspiegel) mit Übelkeit,
Erbrechen, Schwindelgefühl und Ataxie, längerfristig zu
Kalkablagerungen in conjunktiva und evt. cornea des Auges sowie in die
Nierentubuli (Niereninsuffizienz!). Chronischer Calciummangel (streng vegetarische Diät ohne Milchprodukte, Verdauungs- und
Resorptionsstörungen, Magnesium- oder Vit. D-Mangel) kann eine
Neigung zu Muskelkrämpfen bewirken (Hypocalcämie!).
Chronischer Calciummangel (streng vegetarische Diät ohne Milchprodukte, Verdauungs- und
Resorptionsstörungen, Magnesium- oder Vit. D-Mangel) kann eine
Neigung zu Muskelkrämpfen bewirken (Hypocalcämie!).  Die Konzentration an ionisiertem Calcium wird mittels selektiver Messelektroden bestimmt (Ionenaustauscher, Ag/AgCl-Bezugselektrode). Das Gesamt-Calcium
wird mittels Atomabsorptions-Spektroskopie (Referenzmethode),
Flammenphotometrie (spezifische Wellenlänge) oder Photometrie ermittelt
(Farbkomplexreaktion).
Die Konzentration an ionisiertem Calcium wird mittels selektiver Messelektroden bestimmt (Ionenaustauscher, Ag/AgCl-Bezugselektrode). Das Gesamt-Calcium
wird mittels Atomabsorptions-Spektroskopie (Referenzmethode),
Flammenphotometrie (spezifische Wellenlänge) oder Photometrie ermittelt
(Farbkomplexreaktion). Phosphatmangel:
Im Bereich von 1,0 - 2,5 mg/dl spricht man von milder, unter 1 mg/dl
von schwerer Hypophosphatämie. Chronischer Phosphatverlust kann sich -
außer infolge Mangelernährung - durch chronische Sekretverluste oder
bei Alkoholmißbrauch ergeben (verminderte Zufuhr, Phosphat →
Intrazellulärraum etc). Akut kann sich Phosphatmangel z.B. durch
Insulingabe einstellen (Phosphat → intrazellulär, zusammen mit
Glucose). Es kann zu ATP-Mangel mit Zellschäden kommen (Myopathien,
Atemstörungen..)
Phosphatmangel:
Im Bereich von 1,0 - 2,5 mg/dl spricht man von milder, unter 1 mg/dl
von schwerer Hypophosphatämie. Chronischer Phosphatverlust kann sich -
außer infolge Mangelernährung - durch chronische Sekretverluste oder
bei Alkoholmißbrauch ergeben (verminderte Zufuhr, Phosphat →
Intrazellulärraum etc). Akut kann sich Phosphatmangel z.B. durch
Insulingabe einstellen (Phosphat → intrazellulär, zusammen mit
Glucose). Es kann zu ATP-Mangel mit Zellschäden kommen (Myopathien,
Atemstörungen..) Hyperphosphatämie
liegt bei Werten über 5 mg/dl vor (ab 9 mg/dl schwer). Häufigste
Ursache ist verringerte renale Ausscheidung (Niereninsuffizienz). Folge
können extraossäre Verkalkungen sein. Verringerte Zufuhr wird durch
eiweißarme Diät erreicht.
Hyperphosphatämie
liegt bei Werten über 5 mg/dl vor (ab 9 mg/dl schwer). Häufigste
Ursache ist verringerte renale Ausscheidung (Niereninsuffizienz). Folge
können extraossäre Verkalkungen sein. Verringerte Zufuhr wird durch
eiweißarme Diät erreicht. Magnesiummangel: Eine mangelnde
Deckung dieses Bedarfs mit der Nahrung ist häufig, z.T. wegen des
geringen Mineralgehalts landwirtschaftlich genutzter Böden; z.B. ist in
den letzten 50 Jahren der durchschnittliche Magnesiumgehalt von Obst um
20-30% gesunken. Außerdem gehen bei der Nahrungsmittelaufarbeitung
80-90% des ursprünglich enthaltenen Magnesiums verloren. Achtung:
Magnesiummangel kann auch bei normalen Blutwerten vorliegen (99% des Magnesiums befindet sich außerhalb der Blutbahn).
Magnesiummangel: Eine mangelnde
Deckung dieses Bedarfs mit der Nahrung ist häufig, z.T. wegen des
geringen Mineralgehalts landwirtschaftlich genutzter Böden; z.B. ist in
den letzten 50 Jahren der durchschnittliche Magnesiumgehalt von Obst um
20-30% gesunken. Außerdem gehen bei der Nahrungsmittelaufarbeitung
80-90% des ursprünglich enthaltenen Magnesiums verloren. Achtung:
Magnesiummangel kann auch bei normalen Blutwerten vorliegen (99% des Magnesiums befindet sich außerhalb der Blutbahn). renale Verluste (Hemmung der Rückresorption durch Diuretika, Hypercalcämie, Hyperthyreose, tubuläre Schäden u.a.)
renale Verluste (Hemmung der Rückresorption durch Diuretika, Hypercalcämie, Hyperthyreose, tubuläre Schäden u.a.) intestinale Verluste (Malabsorption infolge Durchfall, Entzündung, Laxantienmissbrauch u.a.).
intestinale Verluste (Malabsorption infolge Durchfall, Entzündung, Laxantienmissbrauch u.a.). Ein
Magnesiummangel ist schwer zu diagnostizieren, da Magnesium zum
Großteil in den Zellen gespeichert wird und die Messung des
Serumspiegels kaum aussagekräftig ist. Eine Möglichkeit ist eine Magnesiumbelastung:
Nach einer Magnesiuminfusion wird über 2 Tage die Ausscheidung mit dem
Harn ermittelt; hält die Person viel Magnesium zurück, hatte der Körper
vermutlich wenig gespeichert und es liegt ein Magnesiummangel vor.
Ein
Magnesiummangel ist schwer zu diagnostizieren, da Magnesium zum
Großteil in den Zellen gespeichert wird und die Messung des
Serumspiegels kaum aussagekräftig ist. Eine Möglichkeit ist eine Magnesiumbelastung:
Nach einer Magnesiuminfusion wird über 2 Tage die Ausscheidung mit dem
Harn ermittelt; hält die Person viel Magnesium zurück, hatte der Körper
vermutlich wenig gespeichert und es liegt ein Magnesiummangel vor. Magnesiumüberschuss: Bei Magnesiumspiegeln über 5 mg/dl (vgl. Referenzwerte) ist die muskuläre Erregungsübertragung blockiert
(motorische Endplatte, Herzmuskel, glatte Muskulatur). Folge sind u.a.
schlaffe Lähmungen, Schließmuskelschwäche, Obstipationen u.a.; ab
Magnesiumwerten über ~9 mg/dl Atemschwäche; und ab ~12 mg/dl drohen
Herz- und Atemstillstand.
Magnesiumüberschuss: Bei Magnesiumspiegeln über 5 mg/dl (vgl. Referenzwerte) ist die muskuläre Erregungsübertragung blockiert
(motorische Endplatte, Herzmuskel, glatte Muskulatur). Folge sind u.a.
schlaffe Lähmungen, Schließmuskelschwäche, Obstipationen u.a.; ab
Magnesiumwerten über ~9 mg/dl Atemschwäche; und ab ~12 mg/dl drohen
Herz- und Atemstillstand. Niereninsuffizienz
(akut oder chronisch) - filtriertes Magnesium wird nicht ausreichend
tubulär rückresorbiert, Magnesium staut sich im Körper zurück.
Niereninsuffizienz
(akut oder chronisch) - filtriertes Magnesium wird nicht ausreichend
tubulär rückresorbiert, Magnesium staut sich im Körper zurück. Magnesiumüberschuss zeigt sich in einem erhöhten Serumspiegel.
Magnesiumüberschuss zeigt sich in einem erhöhten Serumspiegel.
 Calcium (Ca) - zu über 99% in den Knochen gespeichert - hat als freies Ion (Ca++)
vielfältige Funktionen (extrazellulär: Enzyme - Permeabilität, Blutgerinnung, Komplementsystem;
intrazellulär: Signalübertragung, Muskelkontraktion). Die Aufnahme im Darm ist an Calbindin - ein Vitamin D3-abhängiges Ca++-Transportprotein - geknüpft
Calcium (Ca) - zu über 99% in den Knochen gespeichert - hat als freies Ion (Ca++)
vielfältige Funktionen (extrazellulär: Enzyme - Permeabilität, Blutgerinnung, Komplementsystem;
intrazellulär: Signalübertragung, Muskelkontraktion). Die Aufnahme im Darm ist an Calbindin - ein Vitamin D3-abhängiges Ca++-Transportprotein - geknüpft Extrazelluläres
[Ca++] wird hormonell reguliert; Hypocalcämie besteht bei
<2,1 mM, Hypercalcämie bei >2,6 mM. ~40% des Serum-Calciums ist
proteingebunden, ~10% an Bionat, Phosphat und Citrat komplexiert.
Der biologisch wirksame ~50%-Anteil des Ca++ (1,15-1,30 mM/l) sinkt mit Proteinkonzentration und
Blut-pH. Unter 0,6 mM treten hypocalcämische Tetanie und
Herzrhythmusstörungen auf
Extrazelluläres
[Ca++] wird hormonell reguliert; Hypocalcämie besteht bei
<2,1 mM, Hypercalcämie bei >2,6 mM. ~40% des Serum-Calciums ist
proteingebunden, ~10% an Bionat, Phosphat und Citrat komplexiert.
Der biologisch wirksame ~50%-Anteil des Ca++ (1,15-1,30 mM/l) sinkt mit Proteinkonzentration und
Blut-pH. Unter 0,6 mM treten hypocalcämische Tetanie und
Herzrhythmusstörungen auf Phosphor findet sich zu 4/5 als Bausubstanz (Apatit) in den Knochen,
sowie als Phosphatpuffer, in Phospholipiden (Zellmembran),
energiereichen Phosphaten (ATP, CP), Botenstoffen (cAMP) und
Nukleinsäuren (DNA, RNA) überall im Körper - dieser enthält ~10 g P /
kg Körpergewicht. Phosphat wird im Darm zu ~80% resorbiert. In der
Wachstumsphase ist die Phosphatbilanz positiv, wachsende Kinder haben
höhere Serum-Phosphatspiegel als erwachsene Personen. Die tägliche
Phosphataufnahme beträgt 1-2 g (Minimum 0,7 g/d); die Ausscheidung
erfolgt über Harn (~0,8 g/d) und Stuhl (~0,4 g/d) - reguliert über
Parathormon, Glucocorticoide, Phosphatbilanz
Phosphor findet sich zu 4/5 als Bausubstanz (Apatit) in den Knochen,
sowie als Phosphatpuffer, in Phospholipiden (Zellmembran),
energiereichen Phosphaten (ATP, CP), Botenstoffen (cAMP) und
Nukleinsäuren (DNA, RNA) überall im Körper - dieser enthält ~10 g P /
kg Körpergewicht. Phosphat wird im Darm zu ~80% resorbiert. In der
Wachstumsphase ist die Phosphatbilanz positiv, wachsende Kinder haben
höhere Serum-Phosphatspiegel als erwachsene Personen. Die tägliche
Phosphataufnahme beträgt 1-2 g (Minimum 0,7 g/d); die Ausscheidung
erfolgt über Harn (~0,8 g/d) und Stuhl (~0,4 g/d) - reguliert über
Parathormon, Glucocorticoide, Phosphatbilanz  Magnesium ist Bestandteil vieler (>600) Transport- und Enzymsysteme;
99% intrazellulär. Im Blutplasma sind ~20% an Albumin, ~20% komplex
gebunden, ~60% ionisiert (filtrierbar). Mehr als die Hälfte des
Körperbestandes (≥20 g) befindet sich in den Knochen, gut ein Viertel
in der Muskulatur. Der Darm resorbiert ~120 mg/d (parazellulär - das
Dreifache muss mit der Nahrung zugeführt werden), die Nieren - Hauptort
der Regulation des Magnesiumspiegels - scheiden eine gleiche Menge aus.
Magnesium erleichtert den Ionentransport über die Zellmembran,
reguliert glutamaterge Rezeptoren und aktiviert Enzyme im Kohlenhydrat-
und Proteinstoffwechsel. In der Muskelzelle gibt es eine Kompetition
mit Calciumionen. Magnesiummangel oder erhöhter Verlust (starkes
Schwitzen) erhöht die neuromuskuläre Erregbarkeit, es können
Muskelkrämpfe und Gefäßspasmen auftreten
Magnesium ist Bestandteil vieler (>600) Transport- und Enzymsysteme;
99% intrazellulär. Im Blutplasma sind ~20% an Albumin, ~20% komplex
gebunden, ~60% ionisiert (filtrierbar). Mehr als die Hälfte des
Körperbestandes (≥20 g) befindet sich in den Knochen, gut ein Viertel
in der Muskulatur. Der Darm resorbiert ~120 mg/d (parazellulär - das
Dreifache muss mit der Nahrung zugeführt werden), die Nieren - Hauptort
der Regulation des Magnesiumspiegels - scheiden eine gleiche Menge aus.
Magnesium erleichtert den Ionentransport über die Zellmembran,
reguliert glutamaterge Rezeptoren und aktiviert Enzyme im Kohlenhydrat-
und Proteinstoffwechsel. In der Muskelzelle gibt es eine Kompetition
mit Calciumionen. Magnesiummangel oder erhöhter Verlust (starkes
Schwitzen) erhöht die neuromuskuläre Erregbarkeit, es können
Muskelkrämpfe und Gefäßspasmen auftreten