

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert


 Physiologie
des weiblichen Zyklus
Physiologie
des weiblichen Zyklus
© H. Hinghofer-Szalkay
 Arborisation: arbor = Baum
Arborisation: arbor = Baum
corpus luteum: luteus = gelb (Lutealphase, Luteinisation)
Döderlein-Flora: Albert Döderlein
Gestagen, Gestation: gestare = (mit sich) tragen (des Embryos); Progesteron: πρό = vor (der Schwangerschaft)
Graaf'scher Follikel: Reinier de Graaf
Hohlweg-Effekt: Walter Hohlweg
Klimakterium: κλῖμαξ = Leiter (kritischer Zeitpunkt)
Luteinisierung, corpus luteum: luteus = gelb
Menstruation: mensis = Monat, menstruus = monatlich
Ovulation: ovum = Ei (Eisprung)
Der plötzliche mittzyklische Anstieg des Gonadotropinspiegels ist eine Wegmarke im Zyklus der Frau: Phasenabhängig wirken Östrogene negativ oder positiv rückkoppelnd auf das hypothalamisch-hypophysäre System:
-- In der frühen Follikelphase hemmen sie die Gonadotropinbildung (negative Rückkopplung)
-- Gegen Ende der Follikelphase, mit Östrogenwerten über 150 pg/ml,
kippt das System auf positive Rückkopplung (Sensibilisierung der
Hypophyse gegenüber GnRH), und die Gonadotropine bauen den FSH- /
LH-peak auf. Das schließt in der Eizelle des sprungreifen Follikels die zweite
Reifeteilung ab und bewirkt innerhalb von Stunden den Eisprung (Ovulation).
Die Zeit vor dem Eisprung heißt Follikelphase (Follikelreifung im Ovar) bzw. Proliferationsphase (Uterusschleimhaut), sie dauert im Schnitt 17 Tage, mit starken individuellen Schwankungen. Postovulatorisch folgt die Lutealphase (corpus luteum im Ovar) bzw. Sekretionsphase
(Uterus), sie dauert 12-14 Tage. Bei der anschließenden
Mensenblutung gehen 20-80 ml Blut verloren (was sich auf den
Eisenstatus auswirkt und die Aufnahme von zusätzlich ~1 mg Fe/d
erfordert).
Die Bestimmung des Ovulationszeitpunkts ist für die Feststellung der Empfängnisfähigkeit entscheidend; neben dem Gonadotropingipfel gibt es Zeichen wie Temperaturanstieg, Vaginalabstrich, Beschaffenheit des Zervixsekrets (Zyklusdiagnostik).
|
Zyklus im Überblick  1. Zyklusphase
1. Zyklusphase  Ovulation
Ovulation  Zyklusdiagnostik
Zyklusdiagnostik  2. Zylusphase
2. Zylusphase  Klimakterium
Klimakterium
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Der
Zyklus der Frau erhöht die reproduktive Effizienz, indem er die Reifung
der Eizellen mit physiologischen Veränderungen koordiniert, welche den
Geburtstrakt für Transport (von Ei- und Samenzellen), Fertilisierung,
Implantation und Gravidität vorbereiten. Der Zyklus beruht auf
rhythmischen Veränderungen von Ovar und Uterus, die auf einander
abgestimmt sind und wird durch endokrine Sekretionsmuster gesteuert.
Der Zyklus ist um die Befruchtungsfähigkeit organisiert
Der Menstruationszyklus  reflektiert ein komplexes Zusammenspiel von Gehirn, Hypophyse
und Ovarien. Die stärkste Kontrolle übt der Hypothalamus mittels
Bildung, Speicherung und Freisetzung von GnRH aus. Dieses steuert die Freisetzung von LH und FSH
aus dem Hypophysenlappen, welche wiederum die Funktion der Ovarien
koordinieren.
reflektiert ein komplexes Zusammenspiel von Gehirn, Hypophyse
und Ovarien. Die stärkste Kontrolle übt der Hypothalamus mittels
Bildung, Speicherung und Freisetzung von GnRH aus. Dieses steuert die Freisetzung von LH und FSH
aus dem Hypophysenlappen, welche wiederum die Funktion der Ovarien
koordinieren.
 Zum Gonadotropin-Peak s. auch dort
Zum Gonadotropin-Peak s. auch dort
Der Hypothalamus setzt GnRH in pulsatiler Weise frei. Dabei bestimmt
die "Pulsfrequenz", welches Vorderlappenhormon der Hypophysenlappen
vorzugsweise sezerniert:
 Eine hohe GnRH-Frequenz - etwa ein Puls pro 60-90 Minuten - regt selektiv die Freisetzung von LH an,
Eine hohe GnRH-Frequenz - etwa ein Puls pro 60-90 Minuten - regt selektiv die Freisetzung von LH an,
 Eine niedrige GnRH-Frequenz - etwa ein Puls alle 120 Minuten - die Freisetzung von FSH.
Eine niedrige GnRH-Frequenz - etwa ein Puls alle 120 Minuten - die Freisetzung von FSH.
 Abbildung: Hormoneller Zyklus der geschlechtsreifen Frau
Abbildung: Hormoneller Zyklus der geschlechtsreifen Frau
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Der menstruelle Zyklus umfasst den ovariellen (Eierstock: Follikuläre Phase, Ovulation, Lutealphase) sowie den endometriellen Zyklus (Uterusschleimhaut: Proliferationsphase, Sekretionsphase).
Die Östrogensynthese des jeweils dominanten Follikels nimmt in der späten Follikelphase rapide zu. Dieser steile Anstieg (Östrogenpeak)
bewirkt im hypothalamisch-hypophysären System eine positive (statt
einer - wie sonst üblich - negativen) Rückkopplung (Hohlweg-Effekt, s. unten) und erhöht auch die Sensitivität der Hypophyse gegenüber GnR. Dieses Muster bewirkt einen 24-36 Stunden nach dem Östrogengipfel auftretenden LH-peak, der wiederum - etwa 12 Stunden nach dem LH-Gipfel - die Ovulation auslöst.
Die LH-Produktionn nimmt dann wieder ab, teils bedingt durch den
Ausfall des verstärkenden Effekts durch den früheren Östrogenpeak,
teils wegen des bremsenden Effekts durch den steigenden
Progesteronspiegel (negative Rückkopplung)
Im Rahmen der 3-5 Tage währenden Monatsblutung (Menses, Periode) - 25-35 (20-80, maximal 200) ml Blut, dessen
Gerinnungsaktivität stark herabgesetzt ist - lösen sich die inneren 2/3 (die Functionalis, stratum functionale) der
Gebärmutterschleimhaut (Endometrium)
ab - das restliche Drittel der Schleimhaut (stratum basale) verbleibt.
Der Blutverlust bedeutet einen
Abgang von
Eisen,
der durch zusätzliche Aufnahme von ~1 mg Fe pro Tag wettgemacht
werden kann.
Der Tag, an dem die Mensesblutung auftritt, wird als Tag 1
des Zyklus gewertet. Tritt eine Schwangerschaft auf, gilt die Periode klinisch als zeitlicher Orientierungspunkt (Schwangerschaftswoche SSW, gerechnet vom 1. Tag der letzten Blutung - biologisch besteht die Schwangerschaft ab der Implantation, die meist in der SSW 3 erfolgt, aber dieser Zeitpunkt ist unsicher).

 Abbildung: Endometrieller Zyklus der geschlechtsreifen Frau
Abbildung: Endometrieller Zyklus der geschlechtsreifen Frau
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Die
Dauer der Follikelphase ist variabel (am letzten Tag dieser Phase - typischerweise Tag 14 - erfolgt der Eisprung = Ovulation), die Lutealphase dauert 12-16
Tage
Grund ist der Abfall der Hormonspiegel gegen Ende der
Sekretionsphase des Uterus, der zu einer Verengung der uterinen Gefäße
führt. Die Spiralarterien
des stratum functionale kontrahieren, es kommt zu hypoxischer
Gewebsnekrose. Intermittierende Vasodilatation führt dann zu Blutungen aus den geschwächten Gefäßen und schließlich zu Atrophie und Abstoßung der Functionalis. An den Vorgängen, die sich bei Blutung, Schleimhautabstoßung und Regenaration abspielen, beteiligen sich Prostaglandine
(insbesondere PGF2α - Kontraktion der Uterusmuskulatur) aus Endothelzellen, weiters VEGF, NO und diverse Proteasen.
Die Basalschicht wird durch persistierende
Arterien weiter versorgt und bleibt intakt. Sie verfügt über alle für
eine vollständige Regeneration der Schleimhaut (die voll entwickelt
etwa 5 mm dick ist) erforderlichen Zellen, was - unter Östrogenwirkung
- den Wiederaufbau während der ersten Zyklusphase ermöglicht. Zellen
der in der Basalis erhaltenen Drüsen teilen sich in dieser Periode
mehrfach und breiten sich auf der (nach Verlust der Functionalis
zunächst "nackten") Oberfläche der Schleimhaut aus, Stromazellen bilden
extrazelluläre Matrix, in der sich zahlreiche Leukozyten (Lymphozyten,
Granulozyten, Makrophagen u.a.) einnisten können.
Kontraktionen des Uterus: Rhythmische elektro-motorische Aktivität wird durch Schrittmacherzellen (die Aktionspotentialwellen über das Myometrium senden) im Bereich des Uterusfundus ausgelöst. Die Aktivität dieser Zellen steht unter dem (zyklusabhängigen) Einfluss von Geschlechtshormonen.
In der ersten Zyklushälfte (Proliferationsphase) treten regelmäßige,
aber zarte Kontraktionen auf (Östrogene hyperpolarisieren
Myometriumzellen); in der zweiten (Sekretionsphase) und während der
Menstruation nimmt die Stärke der Kontraktionen zu. Noradrenalin regt vor allem α-Adrenozeptoren an und damit die kontraktile Aktivität des Uterus, Adrenalin wirkt stark auf ß2-Adrenozeptoren und hemmt sie.
Die Dauer eines Zyklus (Zykluslänge) ist im Wesentlichen durch die Dauer der 1. Zyklushälfte (Follikelphase,
Proliferationsphase) bestimmt, da diese stark variieren kann (21 bis 35
Tage); die Länge der 2. Zyklushälfte (Gelbkörper-, Lutealphase,
Corpus-luteum-Phase, Sekretionsphase) ist mit 14 Tagen ziemlich
konstant.
FSH regt Follikelreifung und Östrogenbildung in den Ovarien an (daher "Follikelphase" des Ovars), die Zahl der Östrogenrezeptoren
im Endometrium nimmt zu. Dies bewirkt - ausgehend von der verbliebenen
Basalschicht - Restitution (abgeschlossen mit Zyklustag 5) und
Wachstum der Uterusschleimhaut (Östrogen induziert die Bildung von
Wachstumsfaktoren in der Schleimhaut), die sich zu einer ~5 mm dicken
Schicht regeneriert (daher "Proliferationsphase" des Uterus).
Die hypothalamisch-hypophysäre Achse regt via FSH die Entwicklung von 15-20 Follikeln
an. Die Entwicklung vom primordialen bis zum sprungreifen Follikel
dauert mehrere Monate und ist daher nicht an einen einzelnen Zyklus
gebunden.
Thekazellen exprimieren
LH-Rezeptoren, Granulosazellen FSH- und LH-Rezeptoren.
Insbesondere Thekazellen verfügen
außerdem über LDL-Rezeptoren, mit deren Hilfe sie LDL-Cholesterin aus
dem Interstitium aufnehmen und für die Steroidsynthese verwenden.
In der Follikelphase produzieren die Ovarien Östradiol, in der
Lutealphase dominiert Progesteron. Theka- und Granulosazellen
kooperieren bei der Steroidsynthese ( s. dort):
s. dort):
 Die Thekazelle bildet 17α-Hydroxylase und 17,20-Desmolase und kann somit aus Progesteron Androstendion bilden.
Die Thekazelle bildet 17α-Hydroxylase und 17,20-Desmolase und kann somit aus Progesteron Androstendion bilden.
 Die Granulosazelle
verfügt über
Aromatase und kann daher aus Androgenen (Androstendion und Testosteron)
Östrogene (Östron und das 10-fach stärker wirkende 17ß-Östradiol)
bilden.
Die Granulosazelle
verfügt über
Aromatase und kann daher aus Androgenen (Androstendion und Testosteron)
Östrogene (Östron und das 10-fach stärker wirkende 17ß-Östradiol)
bilden.
Progesteron wandert von der Granulosa- zur Thekazelle, um das Fehlen
der Enzyme für die Androstendionsynthese zu überbrücken; und Androstendion
diffundiert zur Granulosazelle, die aus Androgenen mittels Aromatase
Östrogene bilden kann.

 Abbildung: Pulsatile Sekretion von GnRH und LH
Abbildung: Pulsatile Sekretion von GnRH und LH
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Kurz
nach der Mensesblutung (links) ist die Emnpfindlichkeit der
Vorderlappenzellen auf GnRH-Pulse geringer als vor dem Eisprung
(rechts): Die Amplitude der LH-peaks auf GnRH-Spitzen (deren Stärke
sich nicht ändert) nimmt deutlich zu
Östrogene regen auch
die Bildung von Progesteronrezeptoren an, was das Endometrium auf
die Lutealphase vorbereitet. In der späten Follikelphase (~2. Woche)
werden Progesteronrezeptoren im Myometrium des Uterus induziert, die
Muskulatur wird so durch Progesteronsignale ruhiggestellt.
Die Follikelphase dauert im "Lehrbuchfall" 14, im Durchschnitt wohl eher 17 Tage,
mit starken individuellen Schwankungen. 70% der Follikelphasen
dauern zwischen 12 und 23 Tagen. Das in diesem Zeitraum dickflüssige
Zervixsekret (Schleim, der vom Gebärmutterhals abgesondert
wird) dient als Infektionsschutz der Gebärmutterhöhle.
Die Gonadotropin-Ausschüttung des Hypophysenvorderlappens erfolgt - der Sekretion
von GnRH folgend - pulsatil, wobei die Frequenz der LH-Pulse in der
ersten Zyklushälfte relativ hoch (alle ~90 Minuten), die Amplitude der
Pulse eher gering ist. Die Empfindlichkeit
der gonadotropinproduzierenden Zellen auf Stimulation durch
hypothalamisches Liberin (GnRH) ist nicht immer gleich: präovulatorisch
ist sie - bedingt durch den höheren Östrogenspiegel im Blut - deutlich höher als in der frühen Follikelphase ( Abbildung links). Dies begünstigt die anregende Wirkung auf die Ovulation.
Abbildung links). Dies begünstigt die anregende Wirkung auf die Ovulation.
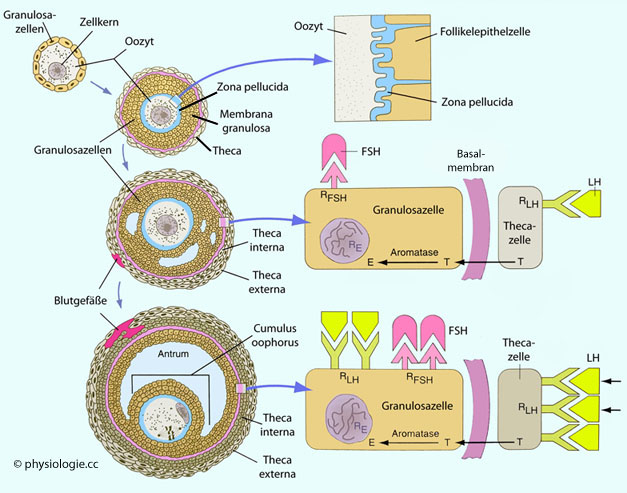
 Abbildung: Follikelwachstum und Interaktion mit Thekazellen
Abbildung: Follikelwachstum und Interaktion mit Thekazellen
Modifiziert nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Im primären Follikel bildet sich zwischen
Eizelle und umgebenden Follikelzellen eine 13 µm dicke zona pellucida
aus (durchscheinend, daher der Name). Ihre Grundlage besteht aus
Glycoproteinen (ZP1 bis ZP4) und
Glycosaminoglycanen und wird von beiden Zellarten gemeinsam gebildet.
Die zona pellucida enthält Rezeptoren für Spermien sowie andere für
Fertilisierung und darauffolgende Vorgänge wichtige Komponenten.
Mit Beginn der Pubertät erfordert die weitere Reifung der Follikel die
Wirkung von FSH auf Granulosazellen (die zu dieser Zeit FSH-Rezeptoren
exprimieren und in ihre Zellmembran einlagern). Die Eizelle übt
ebenfalls Einfluss auf die Follikelentwicklung aus: Sie bildet
Wachstumsfaktoren, die Follikelzellen zu Cumuluszellen werden lassen.
Cumuluszellen haben für die Ernährung der Eizelle entscheidende
Bedeutung: Sie versorgen diese mit Pyruvat und kompensieren dadurch die
Unfähigkeit des Oozyten zur Glykolyse.
Zellen der theca interna bilden LH-Rezeptoren aus (Cumuluszellen tun
das nicht) und bilden Androgene (T = Testosteron), die durch die
Basalmembran zu Granulosazellen in der membrana granulosa diffundieren.
Deren Aromatase
macht daraus unter FSH-Wirkung Östrogene (E), die u.a. die Exprimierung
von LH-Rezeptoren anregen. So können Follikelzellen auf den
mittzyklischen LH-Peak reagieren.
R = Rezeptor
Dieser Mechanismus findet Unterstützung: cGMP wird über gap junctions von
benachbarten Granulosa- und Cumuluszellen in
die Eizelle "injiziert". cGMP hemmt die Aktivität einer speziellen Phosphodiesterase
(PDE3A), was den Abbau von cAMP hemmt ( s. dort).
s. dort).
Entzügelung der Phosphodiesterase PDE3A (durch sinkendes cGMP) und
damit Abbau von cAMP ist Voraussetzung für die Fortsetzung der
Reifeteilung. Der mittzyklische LH-Anstieg (im Schnitt: Zyklustag 13) hebt die Inhibition über cAMP auf, indem es auf somatische Zellen
einwirkt: Diese verbringen nun kein weiteres cGMP in die Eizelle (die mit somatischen Zellen gap junctions teilt), die
Inhibition des cAMP-Abbaus wird aufgehoben.
Nun kann
[cAMP] in der Eizelle sinken,
sie nimmt die erste Reifeteilung wieder auf, stößt schließlich das erste Polkörperchen
ab und verharrt ab diesem Zeitpunkt (im Schnitt: Zyklustag 15, etwa 35 Stunden nach Beginn des LH-Peaks) in der Metaphase II.
Das Wachstum und die Reifung der Eizelle wirkt sich u.a. auch auf eine wachsende Zahl von Mitochondrien sowie die Bildung einer zona pellucida (egg coat)
aus. Diese der Zellmembran aufliegende Glykoproteinschichte wird sowohl
von der Eizelle als auch von umliegenden Granulosazellen (corona
radiata) gebildet. Die zona pellucida enthält Eiweiße (ZP1 bis ZP4), welche Spermien
binden und die akrosomale Reaktion triggern.
Kommt es zu einer Befruchtung (im Schnitt: Zyklustag 16), wird die zweite Reifeteilung vollendet.
Die Eizelle liefert einen wesentlichen Beitrag zur Entwicklung des Follikels: Sie produziert Wachstumsfaktoren wie den growth differentiation factor-9 (Mitglied der TGFß-Superfamilie von Proteinen) und (X-chromosomal codiertes) BMP-15 (bone morphogenetic protein 15). Diese Faktoren veranlassen die umliegenden Follikelzellen zur Differenzierung in Cumuluszellen.
Für die Ernährung der Eizelle spielen die Zellen des Cumulus oophorus eine wichtige
Rolle: Sie steigern ihre glykolytische Aktivität und versorgen die
Eizelle - die in diesem Entwicklungsstadium Glucose nicht
metabolisieren kann - mit Pyruvat. Im Gegensatz zu Granulosazellen exprimieren Cumuluszellen keine LH-Rezeptoren.
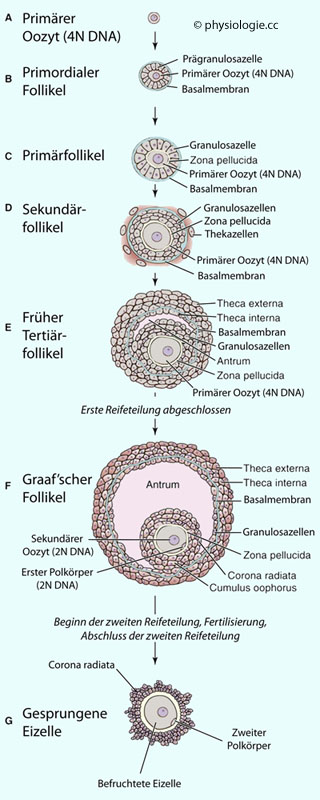
 Abbildung: Reifung eines ovariellen Follikels
Abbildung: Reifung eines ovariellen Follikels
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
In der 8.
Schwangerschaftswoche (SSW) verfügt jedes Ovar über etwa 300.000
Oogonien. Einige davon treten in die 1. Reifeteilung ein (4N DNA) und
werden zu primären Oozyten (A).
In der 20.
Woche sind die mitotischen Teilungen abgeschlossen, die Zahl der
Eizellen erreicht den Spitzenwert von 6-7 Millionen. Oogonien, die bis
zur 28.-30. SSW noch nicht in die Prophase der Meiose I eingetreten
sind, sterben durch Apoptose. Die anderen verharren im Diktyotän
(Diplotänstadium der Prophase I), das erst Jahre später knapp vor der
Ovulation wieder verlassen wird (und der erste Polkörper entsteht). Im
Diktyotän angelangte Oozyten sind von Prägranulose-Zellen umgeben. Mit SSW 30 liegen etwa 5-6 Millionen solcher primordialer Follikel
vor (B). Dieser Pool wird stetig kleiner (1 Million bei der Gburt, 0,3
Millionen bei der Pubertät, von denen 400-500 bis zur Ovulation
gelangen).
Die durch Gonadotropine gesteuerte Follikulogenese führt von primordialen zu Primärfollikeln
(C). Die Oozyten wachsen und bilden die zona pellucida aus; die
Granulosazellen (in ihrer Funktion - Schutz und Ernährung der Gameten -
vergleichbar mit Sertoli-Zellen im Hoden) proliferieren.
Mit dem Auftreten einer äußeren Thekazellschicht ist das Stadium der Sekundärfollikel erreicht (D). Sekundärfollikel entwickeln sich aus Primordialfollikeln während
der gesamten Zeitspanne vom fetalem Leben bis zur Menopause; die
meisten fallen der Apoptose anheim. Zwischen Granulosa- und Thekazellen
bildet sich eine Basalmembran aus.
Ab der Pubertät
erhöhte Gonadotropinspiegel (FSH, LH) führen zur Vergrößerung der
Granulosazellschicht (die eine Flüssigkeit produziert, die sich in
einem als Antrum bezeichneten Hohlraum ansammelt: antrales Stadium) einiger Sekundärfollikel zu Tertiärfollikeln (E).
Mit weiterer Vergrößerung des Antrums wird eines der teriären zu einem "dominanten" Graaf'schen Follikel
(F). Der nunmehr sekundäre Oozyt (2N DNA nach Abschluss von Meiose I)
im Eihügel (cumulus oophorus) ist nur mehr mit einer schmalen
Zellbrücke mit der Granulosaschicht verbunden.
Die gesamte
Entwicklung eines Graaf-Follikels dauert etwa 3-4 Monatyzyklen, d.h.
seine Rekrutierung aus einem Sekundärfollikel hat etwa 3 Monate vor dem
Eisprung begonnen.
Nach der
Ovulation ist der Oozyt frei - nach allfälliger Befruchtung für seine
Transposisiton in den Uterus, wo sich die Zygote in das Myometrium
einlagert (Nidation)

Eisprung (Ovulation  )
)
Damit das Ovum in die freie Bauchhöhle gelangen kann, muss auch in der
äußeren Wand des Ovars eine Öffnung entstehen. Diese Wand besteht aus Tunica albuginea (Bindegewebskapsel), Basalmembran des Ovars und Oberflächenepithel des Ovars (einschichtiges epithelium superficiale).
Östrogene
haben je nach Hormonstatus und Zyklusphase negative oder positive
Wirkung auf die Gonadotropinsekretion des Hypothalamus:

In der (frühen)
Follikelphase hemmen sie das System (
negative Rückkopplung).

Steigt die Östrogenkonzentration gegen Ende der Follikelphase (~12.-13. Zyklustag) für ~35 bis 50
Stunden über einen
Schwellenwert von
150-200 pg/ml, dann kippt der Effekt in Richtung
einer
positiven Rückkopplung (Hohlweg-Effekt )
), die basophilen Zellen in der Hypophyse
werden gegenüber
GnRH sensibilisiert (Östradiol erhöht die
Zahl der GnRH-Rezeptoren im Vorderlappen) und es kommt zum
präovulatorischen LH- und FSH-Gipfel (LH-surge).
 Abbildung: Ovulation
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
Abbildung: Ovulation
Nach einer Vorlage in Carlson BM, Human Embryology and Developmental Biology, 7th ed. 2024 (Elsevier)
In
der Zyklusmitte wandert der reife Graaf'sche Follikel mit dem in der
Prophase I arretierten Oozyten zur Oberfläche des Ovars und nimmt unter
dem Einfluss hoher Gonadotropinspiegel (FSH, LH) weiter an Größe zu.
Die erste Reifeteilung wird abgeschlossen und die zweite bis zur
Metaphase fortgesetzt, dann gestoppt.
Die Rezeptordichte für LH, dann für EGF steigt hormonbedingt an, der
cAMP-Spiegel in der Eizelle sinkt, und die erste Reifeteilung wird
beendet. Hyaluronsäure und Versican spielen eine Rolle für das Expandieren des Eihügels; der Follikel reift weiter, zusätzliche
Blutgefäße bilden sich und steigern die Perfusion bis zur Bildung eines
lokalen Ödems. Es kommt zu einem entzündungsähnlichen
Zustand mit Abbau der Matrix, Vasokonstriktion und Ischämie, schließlich Ruptur
der Follikelwand 28-36 Stunden nach Beginn des LH-Anstiegs

Der LH-Peak
verändert innerhalb weniger Stunden das Programm der Genexpression der
Follikelzellen von ihrer Entwicklung zur Bildung von EGF-artigen
Molekülen und zur Expression von EGF-Rezeptoren durch Cumuluszellen,
was die Follikelruptur und den Eisprung ermöglicht. Der LH-Gipfel löst
die folgenden Vorgänge im Ovar aus:
 Oozyt: Das Absinken des cAMP-Spiegels (s. dort) regt die Komplettierung der Meiose 1 an. Es kommt zur Auflösung der Kernmembran (germinal vesicle breakdown), Ausbildung einer Metaphasenspindel, Beginn der Zellteilung.
Oozyt: Das Absinken des cAMP-Spiegels (s. dort) regt die Komplettierung der Meiose 1 an. Es kommt zur Auflösung der Kernmembran (germinal vesicle breakdown), Ausbildung einer Metaphasenspindel, Beginn der Zellteilung.
 Expansion des cumulus oophorus durch Ablagerung von Hyaluronsäure
(die viel Wasser bindet) und das Seitenkettenmolekül Versican (ein
extrazelluläres Proteoglycan der Lecticanfamilie) durch
Granulosazellen, Auflösung der Follikelwand und der Zone um das Stigma;
Ovulation 28-36 Stunden nach Auftreten des LH-Gipfels.
Expansion des cumulus oophorus durch Ablagerung von Hyaluronsäure
(die viel Wasser bindet) und das Seitenkettenmolekül Versican (ein
extrazelluläres Proteoglycan der Lecticanfamilie) durch
Granulosazellen, Auflösung der Follikelwand und der Zone um das Stigma;
Ovulation 28-36 Stunden nach Auftreten des LH-Gipfels.
 Blutgefäße
wachsen vor und steigern die Perfusion der äußeren Theka der
Follikelwand. Dadurch verlassen Plasmaproteine die Gefäße, dringen
durch postkapilläre Venolen in das Gewebe ein und verursachen ein
lokales Ödem. Zusammen mit der Wirkung weiterer Substanzen
(Prostaglandine, Histamin, Vasopressin, Plasminogenaktivator) wird
dadurch die Produktion von Matrix-Metalloproteinasen
angeregt. Diese proteolytischen Enzyme bauen Komponenten der
extrazellulären Matrix ab. Das führt zu einer entzündungsähnlichen
Reaktion, die zusammen mit Konstriktion thekaler Blutgefäße innerhalb
von 28-36 Stunden nach dem LH-Peak die Ruptur der äußeren Follikelwand
bewirkt.
Blutgefäße
wachsen vor und steigern die Perfusion der äußeren Theka der
Follikelwand. Dadurch verlassen Plasmaproteine die Gefäße, dringen
durch postkapilläre Venolen in das Gewebe ein und verursachen ein
lokales Ödem. Zusammen mit der Wirkung weiterer Substanzen
(Prostaglandine, Histamin, Vasopressin, Plasminogenaktivator) wird
dadurch die Produktion von Matrix-Metalloproteinasen
angeregt. Diese proteolytischen Enzyme bauen Komponenten der
extrazellulären Matrix ab. Das führt zu einer entzündungsähnlichen
Reaktion, die zusammen mit Konstriktion thekaler Blutgefäße innerhalb
von 28-36 Stunden nach dem LH-Peak die Ruptur der äußeren Follikelwand
bewirkt.
 Innerhalb weniger Minuten löst sich nun der cumulus oophorus von der
Granulosa ab. Die Eizelle ist nunmehr ein sekundärer Oozyt, die Reifeteilung wird
in der Metaphase der Meiose 2 angehalten. In diesem Stadium verbleibt
sie, bis sie eventuell von einem Spermatozoon befruchtet wird. Sie ist
ummantelt von der zona pellucida, einer corona radiata (2-3 Zellen
dick) und einer zähen extrazellulären Matrix mit Begleitzellen aus dem
cumulus oophorus.
Innerhalb weniger Minuten löst sich nun der cumulus oophorus von der
Granulosa ab. Die Eizelle ist nunmehr ein sekundärer Oozyt, die Reifeteilung wird
in der Metaphase der Meiose 2 angehalten. In diesem Stadium verbleibt
sie, bis sie eventuell von einem Spermatozoon befruchtet wird. Sie ist
ummantelt von der zona pellucida, einer corona radiata (2-3 Zellen
dick) und einer zähen extrazellulären Matrix mit Begleitzellen aus dem
cumulus oophorus.
 Granulosa- und Thekazellen verwandeln sich in das - stark vaskularisierte, endokrin aktive - corpus luteum; dieses produziert Progesteron,
Östrogen, Inhibin A. Etwa 11 Tage nach der Ovulation beginnt das corpus luteum zu atresieren.
Granulosa- und Thekazellen verwandeln sich in das - stark vaskularisierte, endokrin aktive - corpus luteum; dieses produziert Progesteron,
Östrogen, Inhibin A. Etwa 11 Tage nach der Ovulation beginnt das corpus luteum zu atresieren.
LH
induziert den Eisprung. Die höchsten LH- Konzentrationen im Blutplasma bestehen vom
2.-3. präovulatorischen bis zum 1. postovulatorischen Tag
|
 zur Physiologie der Follikel und zur Ovulation s. auch dort
zur Physiologie der Follikel und zur Ovulation s. auch dort
An der Stelle des Stigma in der Wand des Ovars werden mehrere Schichten aufgelöst, welche den Follikel (Graafian follicle) abdichten (s. oben).
abdichten (s. oben).
Die Bildung des Stigma ist ein lokal streng begrenzter
Destruktionsvorgang, an dem sich Lysozyme, Plasmin und
Prostaglandine beteiligen ( Abbildung):
Abbildung):
 Lysozyme
Lysozyme
stammen aus Epithelzellen der Zone, die zum Stigma werden soll. Die
Wirkung der Enzyme schreitet von der tunica albuginea zur Theka fort.

FSH wirkt über
FSH-Rezeptoren (G-Protein → cAMP →
Proteinkinase A → Phosphorylierungen →
CRE). Es aktiviert nicht nur die Mobilisierung des Eihügels, sondern auch
selektiv in Granulosazellen den Plasminaktivator, dieser setzt aus
Plasminogen der Follikelflüssigkeit (gleiche Konzentration wie im
Blutplasma)
Plasmin frei; dieses beteiligt sich vermutlich durch proteolytische Aktivität an der Stigmabildung (lysosomale Enzyme für den Eisprung)
.

LH wirkt über
LH-Rezeptoren (G-Protein → cAMP →
Proteinkinase A → Phosphorylierungen →
CRE). Es regt die Bildung von
Prostaglandinen an, diese haben eine wesentliche Rolle für die Stimulusausbildung
(experimentelle Prostaglandin-Blockade unterdrückt die Ovulation).
LH regt die Fortsetzung der Meiose II an und fördert die Luteinisierung.
Vom Beginn des LH-Anstiegs bis zum Eisprung dauert es etwa 32-36
Stunden.
Das Stigma an
der Oberfläche des Ovars, durch das die Ovulation erfolgt ist, schließt
sich anschließend wieder durch sich rasch teilende oberflächliche
Epithelzellen - diese stellen eine intensiv mitogene Zellpopulation dar.
Diese Zellpopulation kann auch Ausgangspunkt für malignes Wachstum sein (~80% der Ovarialkarzinome).
Die LH-stimulierte
Produktion von Progesteron und die Expression von Progesteronrezeptoren
in Follikelzellen spielen eine Schlüsselrolle. Es kommt zur
Luteinisierung  von Granulosa- und
Thekazellen (s. unten), d.h. ein Wechsel der
steroidogenen Funktion der Theka- und Granulosazellen im Ovar. Dies
führt durch Lipideinlagerungen zur Bildung des Gelbkörpers (corpus luteum), der während der
zweiten Zyklusphase große Mengen Progesteron produziert.
von Granulosa- und
Thekazellen (s. unten), d.h. ein Wechsel der
steroidogenen Funktion der Theka- und Granulosazellen im Ovar. Dies
führt durch Lipideinlagerungen zur Bildung des Gelbkörpers (corpus luteum), der während der
zweiten Zyklusphase große Mengen Progesteron produziert.
Die Eizelle wird durch das stigma in der Wand
des Ovars in die freie Bauchhöhle bzw. die Ampulle des Eileiters (Tubenampulle) ausgespült. Diese hat
sich mittels ihrer Fimbrien zu einem
Auffang-Apparat formiert, der die Eizelle aufnimmt und mittels
Flimmerstrom und Muskelkontraktionen aus der Ampulle in den Uterus transportiert.
Kommt es zu einer Implantation der Morula in die Wand des Eileiters, resultiert Tubargravidität (Eileiterschwangerschaft)
- die häufigste Form einer Extrauteringravidität (die bei 1-2% aller
Schwangerschaften auftritt). Bei spontanem Abgang spricht man von einem
Tubararbort. Wächst der Embryo
weiter, wird der Zustand lebensbedrohlich, da der Eileiter durch den
wachsenden Embryo überdehnt wird und zu rupturieren droht, was bei der Mutter schwere innere Blutungen und Kreislaufschock zur Folge haben kann.
Das Scheidensekret, normalerweise als Schutzfunktion stark
sauer aufgrund der Anwesenheit milchsäurebildender Bakterien
(Döderlein-Stäbchen  ), wird um den Ovulationszeitpunkt neutral, was den
Spermien günstige Lebensbedingungen schafft (Sperma ist leicht alkalisch, pH 7,2-8,0).
), wird um den Ovulationszeitpunkt neutral, was den
Spermien günstige Lebensbedingungen schafft (Sperma ist leicht alkalisch, pH 7,2-8,0).
Das
Zervixsekret wird um den
Ovulationstermin durch Östrogenwirkung dünnflüssiger. Der
alkalische pH-Wert des Mucus (8-9) und sein hoher Gehalt an Proteinen
und Kohlenhydraten begünstigen den Eintritt von Spermatozoen und die Passage der Spermien durch den
Zervixkanal ebenso wie die aufgelockerte Struktur des Zervixschleims ( Abbildung).
Abbildung).

 Abbildung: Fertilität (Fruchtbarkeit) und Zyklus
Abbildung: Fertilität (Fruchtbarkeit) und Zyklus
Nach einer Vorlage bei nfpta.org.uk
1:
Der wachsende Östrogenspiegel führt zur Öffnung der Zervix und zu
Schleimproduktion (P steht für "peak day of fertility"). Spermien
finden einen offenen Zugang zum Ovar.
2: LH führt zum Eisprung.
3:
Der leere Follikel verwandelt sich zum corpus luteum. Dieses produziert
Progesteron: Das bedingt die "Schließung" des Zervixschleims (Spermein
werden gestoppt), verhindert weitere Ovulationen und beteiligt sich am
Umbau der Uterusschleimhaut

Beim
Spinnbarkeitstest wird ein Faden des Zervixsekrets ausgespannt und seine Länge bestimmt. Um den
Ovulationstermin wird er über 10 cm lang, bevor der Schleimfaden reißt.
Lässt man den auf einem Objektträger ausgestrichenen Zervixschleim
trocknen, so kristallisiert er um den Zeitpunkt der Ovulation
farnkrautähnlich aus (Arborisationsphänomen  , "Farnkrautphänomen" -
, "Farnkrautphänomen" -  Abbildung).
Abbildung).
Abstriche der
Scheidenschleimhaut können gefärbt und mikroskopisch auf das Zellmuster
untersucht werden; dieses ist von der Zyklusphase abhängig. Kenntnis
der Zyklusphase ermöglicht die Bestimmung des Konzeptionsoptimums
(=günstigster Zeitpunkt für eine Empfängnis).

Abbildung: Getrockneter Scheidenabstrich (schwache mikroskopische Vergrößerung)
Nach einer Vorlage in Ganongs's Review of Medical Physiology, 24th ed. Lange Basic Science 2012
Unter Östrogeneinfluss steigt die Elektrolytkonzentration des Sekretes der Uterusschleimhaut. Aus diesem Grund bilden sich in Proben von Zervixschleim, die auf einem Objetträger getrocknet wurden, charakteristische farnkrautähnliche Salzkristalle

Die Befruchtungsfähigkeit der Eizelle beträgt bis zu zwölf Stunden post ovulationem; Spermien überleben nach der Ejakulation in der Vagina nur wenige Stunden, im Gebärmutterhals und Uterus drei Tage oder länger.
Die Vagina hat eine resorptionsfähige Fläche von 100-150 cm2; das ermöglicht die Applikation bestimmter Pharmaka, die lokal oder auch systemisch (z.B. Steroidhormone) wirksam sind.
Der Zervixschleim
schützt das cavum uteri vor Infekten. Seine Zusammensetzung ist
zyklusabhängig (s. oben); er besteht zu ~90% aus Wasser und enthält
Salze, Spurenelemente, Glucose, Aminosäuren, verschiedene Proteine,
Enzyme, Glycerin (Gehalt steigt bei sexueller Erregung), Muzine.
Die zweite Zyklushälfte beginnt mit der
Ovulation.
Die Rektaltemperatur erhöht sich infolge
Anregung des
Stoffwechsels 2-3 Tage nach der Ovulation um etwa 0,5°C.
Ovar
Bald nach der Ovulation löst sich die Basalmembran zwischen Granulosa-
und Theka interna-Zellen auf, was das Einwachsen von Blutgefäßen in das
Innere des rupturierten Follikels ermöglicht. Der Rest des geöffneten
Follikelantrums füllt sich zunächst mit
gerinnendem Blut aus geöffneten Gefäßen in der Umgebung des Stigma (es
bildet sich ein corpus haemorrhagicum).
Innerhalb weniger Tage räumen Makrophagen Blut und Gewebereste ab,
Fibroblasten füllen den verbliebenen Hohlraum mit hyalinartiger
extrazellulärer Matrix.
Aus den Granulosa- und Thekazellen des Follikels
entstehen unter dem Einfluss von LH (LH ist hier absolut notwendig) innerhalb von knapp zwei Tagen Granulosa- und Theka- Luteinzellen:
 Granulosaluteinzellen nehmen durch eingelagerte Cholesterintröpfchen an Volumen zu und produzieren Progesteron. Dieses wird ziemlich synchron mit LH-Pulsen ausgeschüttet. Außerdem bilden Granulosaluteinzellen Inhibin A,
das ebenfalls die Gonadotropinsekretion hemmt. Sie teilen sich nicht
weiter, setzen aber ihre Hormonsekretion für etwa 10 Tage fort, bevor
sie abzusterben beginnen.
Granulosaluteinzellen nehmen durch eingelagerte Cholesterintröpfchen an Volumen zu und produzieren Progesteron. Dieses wird ziemlich synchron mit LH-Pulsen ausgeschüttet. Außerdem bilden Granulosaluteinzellen Inhibin A,
das ebenfalls die Gonadotropinsekretion hemmt. Sie teilen sich nicht
weiter, setzen aber ihre Hormonsekretion für etwa 10 Tage fort, bevor
sie abzusterben beginnen.
 Thekaluteinzellen produzieren Östrogene
- die sich, wie Progesteron, an der Hemmung der Gonadotropinproduktion in der Hypophyse beteiligen - und Androgene.
Thekaluteinzellen produzieren Östrogene
- die sich, wie Progesteron, an der Hemmung der Gonadotropinproduktion in der Hypophyse beteiligen - und Androgene.
Diese Zellen - zusammen mit Bindegewebebe, Leukozyten, Blutgefäßen - bilden zusammen den Gelbkörper (corpus luteum  :
"Lutealphase" des Ovars). Etwa
eine Woche nach dem mittzyklischen LH-Anstieg ist die
Progesteronsynthese des Gelbkörpers an seinem höchsten Wert im Zyklus
angelangt. Die
Gelbkörperphase dauert (wenn es zu keiner Befruchtung kommt) 14±2 Tage, man spricht von einem corpus luteum menstruationis, das nach 2 Wochen regrediert.
:
"Lutealphase" des Ovars). Etwa
eine Woche nach dem mittzyklischen LH-Anstieg ist die
Progesteronsynthese des Gelbkörpers an seinem höchsten Wert im Zyklus
angelangt. Die
Gelbkörperphase dauert (wenn es zu keiner Befruchtung kommt) 14±2 Tage, man spricht von einem corpus luteum menstruationis, das nach 2 Wochen regrediert.
Andernfalls entsteht ein corpus luteum graviditatis,
das dann für 2-3 Monate die Progesteronproduktion fortsetzt - bis die
Plazenta diese Aufgabe übernimmt - und während der gesamten
Schwangerschaft überdauert).
Der Progesteronspiegel ist während der zweiten Zyklushälfte hoch
|
Progesteron antagonisiert
die proliferativen (mitogenen) Wirkungen des Östradiols, regelt den
Östrogenrezeptor in Zielzellen herunter, fördert die Umwandlung von
Östradiol zu unwirksamem Östriol (durch Induktion einer inaktiven Form
der 17ß-Hyroxysteroiddehydrogenase) und durch erhöhte Synthese von
Sulfotransferase, die Östradiol inaktiviert.
Follikuläre Atresie:
Bei weitem die meisten Follikel, die sich am zyklischen Wachstumsschub
beteiligen, gelangen nicht zur Ovulation; Granulosazellen und Eizelle unterliegen dann der Apoptose.
Thekazellen überdauern in der Regel, behalten ihre LH-Rezeptoren und
bilden im Ovarialstroma kollektiv eine "interstitielle Drüse", die Androgene
produziert.
Entsprechend den unterschiedlichen endokrinen Regulationsmustern des Zyklus können vier Abschnitte unterschieden werden ( Abbildung):
Abbildung):
 Früher und mittlerer Abschnitt der Follikelphase
Früher und mittlerer Abschnitt der Follikelphase
 Später Abschnitt der Follikelphase einschließlich Ovulation
Später Abschnitt der Follikelphase einschließlich Ovulation
 Früher und mittlerer Abschnitt der Lutealphase
Früher und mittlerer Abschnitt der Lutealphase
 Späte Lutealphase
Späte Lutealphase
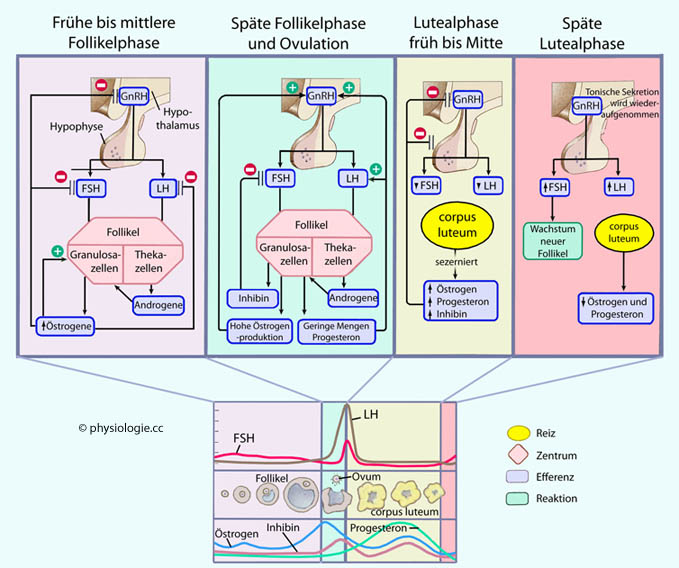
 Abbildung: Hormonelle Regulation des weiblichen Zyklus
Abbildung: Hormonelle Regulation des weiblichen Zyklus
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Frühe bis mittlere Follikelphase:
Mehrere Follikel beginnen zu reifen; FSH stimuliert Granulosazellen, LH
Thekazellen zur Hormonproduktion. Androgene aus Thekazellen
diffundieren zu Granulosazellen, deren Aromatase verwandelt sie zu
Östrogenen. Diese regen die Östrogensekretion der Granulosazellen
weiter an (positive Rückkopplung), hemmen aber gleichzeitig die
Freisetzung von GnRH, FSH und LH im hypothamalisch-hypophysären System
(negative Rückkopplung), was die Reifung weiterer Follikel unterbindet.
Späte Follikelphase und Ovulation:
Der Östrogenspiegel erreicht seinen Spitzenwert. Nur ein Follikel (der
dominante) entwickelt sich weiter und beginnt Inhibin sowie etwas
Progesteron zu sezernieren. Hohe Östrogenwerte haben nunmehr einen
anregenden Effekt auf die hypothalamische GnRH-Freisetzung, die unter
dem gleichzeitigen Progesteroneinfluss maximal angeregt wird. Der
FSH-Peak ist wegen des Inhibineinflusses weniger stark ausgeprägt als
der LH-Peak. 16-24 Stunden nach dem LH-Peak kommt es zum Eisprung.
Frühe bis mittlere Lutealphase:
Der Gelbkörper produziert steigende Mengen an Progesteron und
Östrogenen. Zusammen mit Inhibin hat das einen inhibierenden Effekt auf
die hypothalamisch-hypophysäre Achse.
Späte Lutealphase: Wenn keine
Implantation stattgefunden hat, atresiert der Gelbkörper, Progesteron
und Östrogene werden nicht weiter sezerniert. Das negative Feedback an
das hypothalamisch-hypophysäre
System fällt weg, GnRH wird wieder tonisch produziert, die Sekretion
der Gonadotropine wieder aufgenommen

Mäßig
hohe Östrogenspiegel hemmen, präovulatorisch erhöhte fördern
die Gonadotropinbildung. Der Gonadotropingipfel triggert die Ovulation,
es entsteht ein Gelbkörper; dessen Hormone (Östrogene, Progesteron und Inhibin) hemmen die GnRH-Produktion
im Hypothalamus. Die
maximale Progesteronbildung zeigt sich eine Woche nach dem LH-Gipfel;
zusammen mit dem leichten Östrogenanstieg der Lutealphase bewirkt dies
einen Abfall des LH- und FSH-Spiegels (negative Rückkopplung).
LH-Pulse: In der zweiten Zyklushälfte bewirkt die inhibitorische Wirkung des Progesterons auf den hypothalamischen GnRH-Pulsgeber eine niedrigere Frequenz der LH-Pulse (mehrere Stunden Zwischenzeit), bei höherer Amplitude.
~11 Tage nach der
Ovulation beginnt die Lutealfunktion nachzulassen - es sei denn, es
tritt hCG auf -,
der Gelbkörper regrediert (Luteolyse) zum corpus albicans. Der drastische Abfall des
Progesteron-, Östrogen- und Inhibinspiegels bedeutet für die
hypothalamisch-hypophysäre Achse einen Wegfall der Inhibition, und 2
Tage vor Beginn der Menstruation nimmt [FSH] im Blut wieder zu.
Die zyklischen
Hormonschwankungen beeinflussen den ganzen Körper der Frau: So
unterliegen die Zellen der Mund-, Rachen-, Kehlkopf- und
Blasenschleimhaut, in den Brüsten und im Bindegewebe zyklischen
Veränderungen. Die Kapillarresistenz ist in der Follikelphase erhöht,
in der Gelbkörperphase zeigen sich Gefäßerweiterungen und erhöhte
Kapillardurchlässigkeit. Die Thrombozytenzahl steigt nach der Ovulation
an. Die Haut ist vor der Menstruation empfindlicher und erhöht
die Talgsekretion. Die Belastbarkeit nimmt ab
(prämenstruelles Syndrom).
 Das Ovar steuert die menstruelle Rhythmik.
Der vorübergehende FSH-Anstieg (der große antrale Follikel rekrutiert)
und der mittzyklische LH-Gipfel (der die Ovulation triggert) hängen von
zwei ovariellen Konstanten ab:
Das Ovar steuert die menstruelle Rhythmik.
Der vorübergehende FSH-Anstieg (der große antrale Follikel rekrutiert)
und der mittzyklische LH-Gipfel (der die Ovulation triggert) hängen von
zwei ovariellen Konstanten ab:
 Der zeitlich definierten Lebensdauer des Gelbkörpers (2 Wochen) und
Der zeitlich definierten Lebensdauer des Gelbkörpers (2 Wochen) und
 dem
dominanten Follikel, der ausreichend Östrogene produziert, um den
Kipppunkt zu erreichen, ab dem in der Hypophyse die Umschaltung auf Selbstverstärkung der
Gonadotropinausschüttung erfolgt.
dem
dominanten Follikel, der ausreichend Östrogene produziert, um den
Kipppunkt zu erreichen, ab dem in der Hypophyse die Umschaltung auf Selbstverstärkung der
Gonadotropinausschüttung erfolgt.
Ohne Fertilisation (und damit verbundene hormonelle Signale vom sich entwickelnden Embryo) kommt es am ~26. Zyklustag zur Luteolyse: Einserseits durch Anregung der Zellen zur Apoptose, andererseits durch luteolytische Faktoren
(wie Prostaglandin F2). Das führt zum Absinken des Progesteronspiegels
im Blut und folglich zu Degeneration innerer Endometriumschichten.
Letztlich verbleibt vom zurückgebildeten
Gelbkörper ein kollagenhaltiges Narbengewebe (corpus albicans, "weißer Körper"), das dann allmählich resorbiert wird.
Uterus
Progesteron bringt das Endometrium in die "Sekretionsphase" des Uterus: Die
Hormonkonzentrationen nehmen eine Woche lang zu, das Endometrium ist
voll entwickelt. Glykogen
und Moleküle, die dem Gewebeaufbau dienen (Kollagen, Laminin,
Heparansulfat etc.: "Dezidualisierung") bereiten die Schleimhaut auf
eine Implantation vor. Das
Zervixsekret erlaubt keine weitere Passage von Spermien.
Die abnehmenden Geschlechtshormonspiegel veranlassen die Spiralarterien zu rhythmischen Spasmen (Ischämie → Zelluntergang). Anschließende Relaxation und Gefäßnekrose leitet
die Menstruation ein (Desquamation: Ablösung der Functionalisschichte, Menstruationsblutung).
Ischämie in der Functionalis geht der Desquamation / Mensesblutung voraus
|
Klimakterium
Als Menopause wird die letzte Regelblutung bezeichnet; sie trennt den prämenopausalen vom postmenopausalen Teil des Klimakteriums (menopausal transition, climacteric), das mehrere Jahre dauert. Das Ausbleiben der Regelblutungen bezeichnet man als Amenorrhoe.
 Abbildung: Gonadotropine in verschiedenen Lebensabschnitten
Abbildung: Gonadotropine in verschiedenen Lebensabschnitten
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Die
FSH- und LH-Spiegel sind im fetalen Leben und später während der frühen
Kindheit hoch, um ab dem 4. Lebensmonat wieder zu sinken.
Zwischen dem
6. und 8. Lebensjahr sind die Pegel am niedrigsten (dies ist nicht
durch einen negativen Feedbackeffekt hoher Steroidspiegel erklärbar,
sondern wahrscheinlich durch hohe Sensitivität des
hypothalamisch-hypophysären Systems - s. unten).
Mit Erreichen der Pubertät beginnen die Gonadotropinspiegel
(insbesondere LH) zu oszillieren.
Mit Erreichen der Menopause und dem
starken Absinken der Steroidspiegel kommt es wieder zu starker
Gonadotropinausschüttung

Die Menopause erfolgt meist am Ende des 5. Dezenniums (46-55 Jahre). Die
menopausale Abnahme der Östradiolkonzentration geht mit reduziertem
Energieumsatz einher (Östradiolgabe kann diesen Trend dämpfen).
Niedrige Sexualhormonspiegel verändern u.a. auch die Fettverteilung
(Zunahme viszeralen / abdominellen Fetts).
Die Prämenopause geht mit Dysmenorrhoen (unregelmäßige, beschwerliche Regelblutungen) einher.
In der Postmenopause stoppen die Ovarien die Hormonproduktion; der
Östrogenspiegel reduziert sich auf ~15%, der Progesteronspiegel auf
~30% der Werte jüngerer Frauen in der Follikelphase. Bedingt durch den
niedrigen Östrogen- und Progesteronspiegel fehlt der trophische Anreiz
für das Myometrium, und die Wanddicke des Uterus nimmt fortlaufend ab.
Die verbleibenden
Hormone stammen vorwiegend aus der peripheren Konversion adrenaler
Androgene; Östron wird zum dominierenden Östrogen. Wegen der negativen
Rückkopplung auf den Hypothalamus steigt der Gonadotropinspiegel für mehrere Jahre stark an ( Abbildung). Die in dieser Phase häufig auftretenden Depressionen und Stimmungslabilität hängen mit den dabei erfolgenden Umstellungen zusammen.
Abbildung). Die in dieser Phase häufig auftretenden Depressionen und Stimmungslabilität hängen mit den dabei erfolgenden Umstellungen zusammen.
Ordinate logarithmisch. Blaue Rechtecke:
prämenopausal (regelmäßige Zyklen), rote Kreise: perimenopausal
(unregelmäßige Zyklen über ≥1 Jahr); rote Dreiecke: postmenopausal (≥1
Jahr ohne Zyklus).
Im untersuchten Kollektiv (N=17) lag die Zahl der Primordialfollikel im Alter bis 10 Jahre bei >105, bis 20 Jahre bei >104, bis 40 Jahre bei >103; mit über 40 Jahren kann die Zahl auf <103 absinken, postmenopausal auf Null

Die Anzahl von Primordialfollikeln im Ovar - und damit die ovarielle Reserve - nimmt mit dem Lebensalter
von mehreren hunderttausenden bis zu Null in der Postmenopause ab
( Abbildung). Werte von unter 1000 / Ovar treten ab
einem Alter von 40 Jahren mit zunehmender Häufigkeit auf.
Abbildung). Werte von unter 1000 / Ovar treten ab
einem Alter von 40 Jahren mit zunehmender Häufigkeit auf.

 Ovulationshemmer
("Antibabypille") verändern die physiologische hormonelle Regelung des
Zyklus. Steroide mit östrogener und gestagener
Ovulationshemmer
("Antibabypille") verändern die physiologische hormonelle Regelung des
Zyklus. Steroide mit östrogener und gestagener  Wirksamkeit hemmen die
Sekretion von Gonadoliberin aus dem Hypothalamus. Dies reduziert die
Freisetzung von LH und FSH aus dem Hypophysenvorderlappen und
unterdrückt den LH-Peak, der normalerweise den Eisprung bewirkt.
Wirksamkeit hemmen die
Sekretion von Gonadoliberin aus dem Hypothalamus. Dies reduziert die
Freisetzung von LH und FSH aus dem Hypophysenvorderlappen und
unterdrückt den LH-Peak, der normalerweise den Eisprung bewirkt.
Präparate mit ausschließlich gestagener Wirkung ("Minipille") hemmen
die FSH-Ausschüttung nur mäßig, es können Ovulationen stattfinden. Dass
dennoch eine empfängnisverhütende Wirkung besteht, ist auf die
Verdickung des Zervixsekrets zurückzuführen (s. oben).


 Eine Monatsblutung tritt am Ende der Sekretionsphase des Uterus auf,
ist durch sinkende Hormonspiegel bedingt und dauert 3-5 Tage (Tag 1 =
1. Zyklustag). Unter dem Einfluss hydrolytischer Proteasen - und unter
Verlust von ~20-80
ml Blut - lösen sich infolge hypoxischer Atrophie (Kontraktion von
Spiralarterien) 2/3 des Endometriums (stratum functionale) ab, 1/3
verbleibt (stratum basale) und baut unter Östrogenwirkung die
Schleimhaut wieder vollständig auf. Tritt eine Schwangerschaft auf,
wird Tag 1 als Beginn der 1. Schwangerschaftswoche (SSW) gewertet,
obwohl die Schwangerschaft im biologischen Sinne erst mit der
Implantation beginnt, meist in SSW 3 Eine Monatsblutung tritt am Ende der Sekretionsphase des Uterus auf,
ist durch sinkende Hormonspiegel bedingt und dauert 3-5 Tage (Tag 1 =
1. Zyklustag). Unter dem Einfluss hydrolytischer Proteasen - und unter
Verlust von ~20-80
ml Blut - lösen sich infolge hypoxischer Atrophie (Kontraktion von
Spiralarterien) 2/3 des Endometriums (stratum functionale) ab, 1/3
verbleibt (stratum basale) und baut unter Östrogenwirkung die
Schleimhaut wieder vollständig auf. Tritt eine Schwangerschaft auf,
wird Tag 1 als Beginn der 1. Schwangerschaftswoche (SSW) gewertet,
obwohl die Schwangerschaft im biologischen Sinne erst mit der
Implantation beginnt, meist in SSW 3
 FSH regt in den Ovarien Östrogenbildung und die Entwicklung mehrerer Follikel an (Follikelphase des Ovars), das Endometrium wird durch Wachstumsfaktoren aufgebaut (Proliferationsphase des Uterus). Follikelzellen exprimieren Rezeptoren für Gonadotropine und LDL
(Cholesterin für Steroidsynthese). Granulosazellen bilden Progesteron,
Thekazellen aus Progesteron Androstendion, Granulosazellen aus
Androstendion Östradiol (Aromatase). Im Oozyten halten hohe
cAMP-Spiegel den Arrest in Prophase I, unterstützt durch cGMP, das über
gap junctions von Nachbarzellen in die Eizelle gelangt und die
Aktivität der Phosphodiesterase PDE3A und damit den Abbau von cAMP
hemmt. Fortsetzung der
Reifeteilung erfolgt durch sinkendes cGMP, Entzügelung der PDE3A und
Abbau von cAMP FSH regt in den Ovarien Östrogenbildung und die Entwicklung mehrerer Follikel an (Follikelphase des Ovars), das Endometrium wird durch Wachstumsfaktoren aufgebaut (Proliferationsphase des Uterus). Follikelzellen exprimieren Rezeptoren für Gonadotropine und LDL
(Cholesterin für Steroidsynthese). Granulosazellen bilden Progesteron,
Thekazellen aus Progesteron Androstendion, Granulosazellen aus
Androstendion Östradiol (Aromatase). Im Oozyten halten hohe
cAMP-Spiegel den Arrest in Prophase I, unterstützt durch cGMP, das über
gap junctions von Nachbarzellen in die Eizelle gelangt und die
Aktivität der Phosphodiesterase PDE3A und damit den Abbau von cAMP
hemmt. Fortsetzung der
Reifeteilung erfolgt durch sinkendes cGMP, Entzügelung der PDE3A und
Abbau von cAMP
 Am Ende der Follikelphase steigt die Östrogenkonzentration über einen
Schwellenwert, was den Effekt auf den Hypothalamus kippen lässt:
Basophile Zellen erhöhen die Zahl ihrer GnRH-Rezeptoren, der
präovulatorische LH/FSH-Gipfel tritt auf (Hohlweg-Effekt). LH induziert
den Eisprung, seine höchste Konzentration findet sich vom 2.-3.
präovulatorischen bis zum 1. postovulatorischen Tag. Der LH-Peak
lässt die Eizelle bis zur Arretierung in der Meiose 2-Metaphase
fortfahren und löst die Ovulation aus, die verbliebenen Granulosa- und
Thekazellen verwandeln sich in das corpus luteum. Die Eizelle ist bis
zu 12 Stunden befruchtungsfähig; sie gelangt
mittels Flimmerstrom und Muskelkontraktionen über den Eileiter in den
Uterus. Das Zervixsekret ist dünnflüssig und reich an Protein und
Kohlenhydraten. Der alkalische pH-Wert begünstigt die Passage der
Spermien
Am Ende der Follikelphase steigt die Östrogenkonzentration über einen
Schwellenwert, was den Effekt auf den Hypothalamus kippen lässt:
Basophile Zellen erhöhen die Zahl ihrer GnRH-Rezeptoren, der
präovulatorische LH/FSH-Gipfel tritt auf (Hohlweg-Effekt). LH induziert
den Eisprung, seine höchste Konzentration findet sich vom 2.-3.
präovulatorischen bis zum 1. postovulatorischen Tag. Der LH-Peak
lässt die Eizelle bis zur Arretierung in der Meiose 2-Metaphase
fortfahren und löst die Ovulation aus, die verbliebenen Granulosa- und
Thekazellen verwandeln sich in das corpus luteum. Die Eizelle ist bis
zu 12 Stunden befruchtungsfähig; sie gelangt
mittels Flimmerstrom und Muskelkontraktionen über den Eileiter in den
Uterus. Das Zervixsekret ist dünnflüssig und reich an Protein und
Kohlenhydraten. Der alkalische pH-Wert begünstigt die Passage der
Spermien
 Mit der Ovulation beginnt die zweite Zyklushälfte (Lutealphase
des Ovars), Dauer 14±2 Tage. Granulosaluteinzellen produzieren
Progesteron und Inhibin, Thekaluteinzellen Östrogene und Androgene. Der
Progesteronspiegel ist während der 2. Zyklushälfte hoch: Progesteron
senkt die Zahl an Östrogenrezeptoren und fördert die Umwandlung von
Östradiol zu Östriol. Das Endometrium bereitet sich auf eine
Implantation vor: Für den Gewebeaufbau bildet es Glykogen, Kollagen,
Laminin, Heparansulfat (Dezidualisierung, Sekretionsphase des Uterus). Die Rektaltemperatur erhöht sich 2-3 Tage nach der Ovulation um ~0,5°C.
Das Zervixsekret erlaubt keine weitere Passage von Spermien. Maximale
Progesteronbildung erfolgt eine Woche nach dem LH-Gipfel, negative
Rückkopplung senkt die Gonadotropinsekretion (niedrigere Frequenz der
Pulse). ~11 Tage nach der Ovulation beginnt die Lutealfunktion
nachzulassen (außer, es tritt hCG auf). Mit der Luteolyse (~26.
Zyklustag) nimmt die Progesteron-, Östrogen- und Inhibinproduktion
stark ab, 2 Tage vor Beginn der Menstruation steigt der FSH-Spiegel
infolgedessen wieder an. Spiralarterien kontrahieren sich
(Östrogenmangel → Ischämie
→ Gefäßnekrose), es kommt zu Desquamation und Menstruationsblutung Mit der Ovulation beginnt die zweite Zyklushälfte (Lutealphase
des Ovars), Dauer 14±2 Tage. Granulosaluteinzellen produzieren
Progesteron und Inhibin, Thekaluteinzellen Östrogene und Androgene. Der
Progesteronspiegel ist während der 2. Zyklushälfte hoch: Progesteron
senkt die Zahl an Östrogenrezeptoren und fördert die Umwandlung von
Östradiol zu Östriol. Das Endometrium bereitet sich auf eine
Implantation vor: Für den Gewebeaufbau bildet es Glykogen, Kollagen,
Laminin, Heparansulfat (Dezidualisierung, Sekretionsphase des Uterus). Die Rektaltemperatur erhöht sich 2-3 Tage nach der Ovulation um ~0,5°C.
Das Zervixsekret erlaubt keine weitere Passage von Spermien. Maximale
Progesteronbildung erfolgt eine Woche nach dem LH-Gipfel, negative
Rückkopplung senkt die Gonadotropinsekretion (niedrigere Frequenz der
Pulse). ~11 Tage nach der Ovulation beginnt die Lutealfunktion
nachzulassen (außer, es tritt hCG auf). Mit der Luteolyse (~26.
Zyklustag) nimmt die Progesteron-, Östrogen- und Inhibinproduktion
stark ab, 2 Tage vor Beginn der Menstruation steigt der FSH-Spiegel
infolgedessen wieder an. Spiralarterien kontrahieren sich
(Östrogenmangel → Ischämie
→ Gefäßnekrose), es kommt zu Desquamation und Menstruationsblutung
 Menopause ist die letzte Regelblutung, sie trennt den prämenopausalen
vom postmenopausalen Teil des Klimakteriums (Amenorrhoe ist das
Ausbleiben von Menstruationsblutungen). Der sinkende Steroidspiegel
(Östrogene auf ~15%, Progesteron auf ~30% der Werte jüngerer Frauen in
der Follikelphase reduziert) erhöht für mehrere Jahre die
Gonadotropinausschüttung. Östrogene stammen vorwiegend aus der
peripheren Konversion adrenaler Androgene; Östron wird zum
dominierenden Östrogen. Die Anzahl der ovariellen Follikel nimmt weiter
ab
Menopause ist die letzte Regelblutung, sie trennt den prämenopausalen
vom postmenopausalen Teil des Klimakteriums (Amenorrhoe ist das
Ausbleiben von Menstruationsblutungen). Der sinkende Steroidspiegel
(Östrogene auf ~15%, Progesteron auf ~30% der Werte jüngerer Frauen in
der Follikelphase reduziert) erhöht für mehrere Jahre die
Gonadotropinausschüttung. Östrogene stammen vorwiegend aus der
peripheren Konversion adrenaler Androgene; Östron wird zum
dominierenden Östrogen. Die Anzahl der ovariellen Follikel nimmt weiter
ab
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.




 Arborisation: arbor = Baum
Arborisation: arbor = Baum 1. Zyklusphase
1. Zyklusphase  Ovulation
Ovulation  Zyklusdiagnostik
Zyklusdiagnostik  2. Zylusphase
2. Zylusphase  Klimakterium
Klimakterium
 Core messages
Core messages reflektiert ein komplexes Zusammenspiel von Gehirn, Hypophyse
und Ovarien. Die stärkste Kontrolle übt der Hypothalamus mittels
Bildung, Speicherung und Freisetzung von GnRH aus. Dieses steuert die Freisetzung von LH und FSH
aus dem Hypophysenlappen, welche wiederum die Funktion der Ovarien
koordinieren.
reflektiert ein komplexes Zusammenspiel von Gehirn, Hypophyse
und Ovarien. Die stärkste Kontrolle übt der Hypothalamus mittels
Bildung, Speicherung und Freisetzung von GnRH aus. Dieses steuert die Freisetzung von LH und FSH
aus dem Hypophysenlappen, welche wiederum die Funktion der Ovarien
koordinieren. Eine hohe GnRH-Frequenz - etwa ein Puls pro 60-90 Minuten - regt selektiv die Freisetzung von LH an,
Eine hohe GnRH-Frequenz - etwa ein Puls pro 60-90 Minuten - regt selektiv die Freisetzung von LH an, Eine niedrige GnRH-Frequenz - etwa ein Puls alle 120 Minuten - die Freisetzung von FSH.
Eine niedrige GnRH-Frequenz - etwa ein Puls alle 120 Minuten - die Freisetzung von FSH.
 Abbildung: Hormoneller Zyklus der geschlechtsreifen Frau
Abbildung: Hormoneller Zyklus der geschlechtsreifen Frau

 Abbildung: Endometrieller Zyklus der geschlechtsreifen Frau
Abbildung: Endometrieller Zyklus der geschlechtsreifen Frau
 s. dort):
s. dort): Die Thekazelle bildet 17α-Hydroxylase und 17,20-Desmolase und kann somit aus Progesteron Androstendion bilden.
Die Thekazelle bildet 17α-Hydroxylase und 17,20-Desmolase und kann somit aus Progesteron Androstendion bilden. Die Granulosazelle
verfügt über
Aromatase und kann daher aus Androgenen (Androstendion und Testosteron)
Östrogene (Östron und das 10-fach stärker wirkende 17ß-Östradiol)
bilden.
Die Granulosazelle
verfügt über
Aromatase und kann daher aus Androgenen (Androstendion und Testosteron)
Östrogene (Östron und das 10-fach stärker wirkende 17ß-Östradiol)
bilden.
 Abbildung: Pulsatile Sekretion von GnRH und LH
Abbildung: Pulsatile Sekretion von GnRH und LH
 Abbildung links). Dies begünstigt die anregende Wirkung auf die Ovulation.
Abbildung links). Dies begünstigt die anregende Wirkung auf die Ovulation.
 Abbildung: Follikelwachstum und Interaktion mit Thekazellen
Abbildung: Follikelwachstum und Interaktion mit Thekazellen
 s. dort).
s. dort). 
 Abbildung: Reifung eines ovariellen Follikels
Abbildung: Reifung eines ovariellen Follikels
 Granulosazellen.
Diese grenzen an die Eizelle (s. oben), zwischen ihnen und der
Oozytenmembran liegt die zona pellucida. Unter dem Einfluss von FSH
exprimieren Granulosazellen Aromatase,
dadurch können sie Androgene (aus der theca interna) zu Östrogenen
(hauptsächlich 17ß-Östradiol) unbauen. Diese regen ihrerseits die
Expression von LH-Rezeptoren an
Granulosazellen.
Diese grenzen an die Eizelle (s. oben), zwischen ihnen und der
Oozytenmembran liegt die zona pellucida. Unter dem Einfluss von FSH
exprimieren Granulosazellen Aromatase,
dadurch können sie Androgene (aus der theca interna) zu Östrogenen
(hauptsächlich 17ß-Östradiol) unbauen. Diese regen ihrerseits die
Expression von LH-Rezeptoren an Basalmembran des Follikels (membrana granulosa, 1-2 µm dicke Schicht glykoproteinhältiger Fibrillen und Fasern)
Basalmembran des Follikels (membrana granulosa, 1-2 µm dicke Schicht glykoproteinhältiger Fibrillen und Fasern) Theca interna - die Zellen
dieser gefäßreichen Schichte bilden angiogenetische Faktoren, welche
das Gefäßwachstum anregen und die Ernährung des Follikels
sicherstellen. Sie bilden weiters LH-Rezeptoren und produzieren
Androgene (wie die Östrogenvorstufe Androstendion), diese diffundieren durch die membrana granulosa zu Granulosazellen. Nach dem Eisprung differenzieren sie
in Theka-Luteinzellen des Gelbkörpers und produzieren Androgene und
Progesteron
Theca interna - die Zellen
dieser gefäßreichen Schichte bilden angiogenetische Faktoren, welche
das Gefäßwachstum anregen und die Ernährung des Follikels
sicherstellen. Sie bilden weiters LH-Rezeptoren und produzieren
Androgene (wie die Östrogenvorstufe Androstendion), diese diffundieren durch die membrana granulosa zu Granulosazellen. Nach dem Eisprung differenzieren sie
in Theka-Luteinzellen des Gelbkörpers und produzieren Androgene und
Progesteron Theca externa (äußere
Follikelschicht aus fibroblastenähnlichen
kontraktionsfähigen Zellen). Beim Eisprung erhöht der LH-Gipfel die
Produktion von cAMP und damit PGF2α; dieses veranlasst Kontraktion
glatter Muskelzellen, der Follikeldruck steigt an. Zusammen mit der
Wirkung von Kollagenase und Plasmin bewirkt das die Ruptur der
Follikelwand.
Theca externa (äußere
Follikelschicht aus fibroblastenähnlichen
kontraktionsfähigen Zellen). Beim Eisprung erhöht der LH-Gipfel die
Produktion von cAMP und damit PGF2α; dieses veranlasst Kontraktion
glatter Muskelzellen, der Follikeldruck steigt an. Zusammen mit der
Wirkung von Kollagenase und Plasmin bewirkt das die Ruptur der
Follikelwand. )
) In der (frühen)
Follikelphase hemmen sie das System (negative Rückkopplung).
In der (frühen)
Follikelphase hemmen sie das System (negative Rückkopplung).
 Steigt die Östrogenkonzentration gegen Ende der Follikelphase (~12.-13. Zyklustag) für ~35 bis 50
Stunden über einen Schwellenwert von 150-200 pg/ml, dann kippt der Effekt in Richtung
einer positiven Rückkopplung (Hohlweg-Effekt
Steigt die Östrogenkonzentration gegen Ende der Follikelphase (~12.-13. Zyklustag) für ~35 bis 50
Stunden über einen Schwellenwert von 150-200 pg/ml, dann kippt der Effekt in Richtung
einer positiven Rückkopplung (Hohlweg-Effekt ), die basophilen Zellen in der Hypophyse
werden gegenüber GnRH sensibilisiert (Östradiol erhöht die Zahl der GnRH-Rezeptoren im Vorderlappen) und es kommt zum präovulatorischen LH- und FSH-Gipfel (LH-surge).
), die basophilen Zellen in der Hypophyse
werden gegenüber GnRH sensibilisiert (Östradiol erhöht die Zahl der GnRH-Rezeptoren im Vorderlappen) und es kommt zum präovulatorischen LH- und FSH-Gipfel (LH-surge).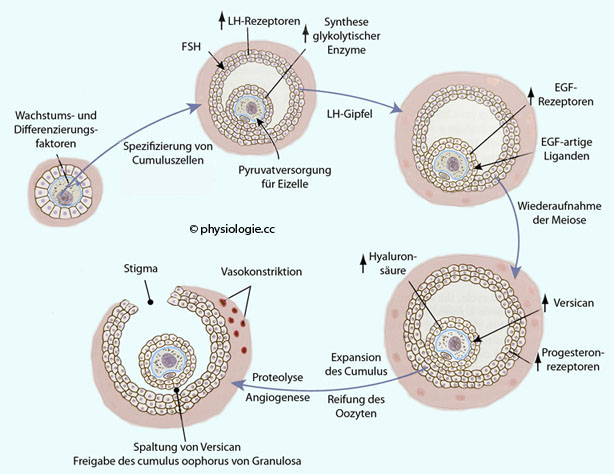
 Abbildung: Ovulation
Abbildung: Ovulation
 Oozyt: Das Absinken des cAMP-Spiegels (s. dort) regt die Komplettierung der Meiose 1 an. Es kommt zur Auflösung der Kernmembran (germinal vesicle breakdown), Ausbildung einer Metaphasenspindel, Beginn der Zellteilung.
Oozyt: Das Absinken des cAMP-Spiegels (s. dort) regt die Komplettierung der Meiose 1 an. Es kommt zur Auflösung der Kernmembran (germinal vesicle breakdown), Ausbildung einer Metaphasenspindel, Beginn der Zellteilung. Expansion des cumulus oophorus durch Ablagerung von Hyaluronsäure
(die viel Wasser bindet) und das Seitenkettenmolekül Versican (ein
extrazelluläres Proteoglycan der Lecticanfamilie) durch
Granulosazellen, Auflösung der Follikelwand und der Zone um das Stigma;
Ovulation 28-36 Stunden nach Auftreten des LH-Gipfels.
Expansion des cumulus oophorus durch Ablagerung von Hyaluronsäure
(die viel Wasser bindet) und das Seitenkettenmolekül Versican (ein
extrazelluläres Proteoglycan der Lecticanfamilie) durch
Granulosazellen, Auflösung der Follikelwand und der Zone um das Stigma;
Ovulation 28-36 Stunden nach Auftreten des LH-Gipfels. Blutgefäße
wachsen vor und steigern die Perfusion der äußeren Theka der
Follikelwand. Dadurch verlassen Plasmaproteine die Gefäße, dringen
durch postkapilläre Venolen in das Gewebe ein und verursachen ein
lokales Ödem. Zusammen mit der Wirkung weiterer Substanzen
(Prostaglandine, Histamin, Vasopressin, Plasminogenaktivator) wird
dadurch die Produktion von Matrix-Metalloproteinasen
angeregt. Diese proteolytischen Enzyme bauen Komponenten der
extrazellulären Matrix ab. Das führt zu einer entzündungsähnlichen
Reaktion, die zusammen mit Konstriktion thekaler Blutgefäße innerhalb
von 28-36 Stunden nach dem LH-Peak die Ruptur der äußeren Follikelwand
bewirkt.
Blutgefäße
wachsen vor und steigern die Perfusion der äußeren Theka der
Follikelwand. Dadurch verlassen Plasmaproteine die Gefäße, dringen
durch postkapilläre Venolen in das Gewebe ein und verursachen ein
lokales Ödem. Zusammen mit der Wirkung weiterer Substanzen
(Prostaglandine, Histamin, Vasopressin, Plasminogenaktivator) wird
dadurch die Produktion von Matrix-Metalloproteinasen
angeregt. Diese proteolytischen Enzyme bauen Komponenten der
extrazellulären Matrix ab. Das führt zu einer entzündungsähnlichen
Reaktion, die zusammen mit Konstriktion thekaler Blutgefäße innerhalb
von 28-36 Stunden nach dem LH-Peak die Ruptur der äußeren Follikelwand
bewirkt. Innerhalb weniger Minuten löst sich nun der cumulus oophorus von der
Granulosa ab. Die Eizelle ist nunmehr ein sekundärer Oozyt, die Reifeteilung wird
in der Metaphase der Meiose 2 angehalten. In diesem Stadium verbleibt
sie, bis sie eventuell von einem Spermatozoon befruchtet wird. Sie ist
ummantelt von der zona pellucida, einer corona radiata (2-3 Zellen
dick) und einer zähen extrazellulären Matrix mit Begleitzellen aus dem
cumulus oophorus.
Innerhalb weniger Minuten löst sich nun der cumulus oophorus von der
Granulosa ab. Die Eizelle ist nunmehr ein sekundärer Oozyt, die Reifeteilung wird
in der Metaphase der Meiose 2 angehalten. In diesem Stadium verbleibt
sie, bis sie eventuell von einem Spermatozoon befruchtet wird. Sie ist
ummantelt von der zona pellucida, einer corona radiata (2-3 Zellen
dick) und einer zähen extrazellulären Matrix mit Begleitzellen aus dem
cumulus oophorus. Granulosa- und Thekazellen verwandeln sich in das - stark vaskularisierte, endokrin aktive - corpus luteum; dieses produziert Progesteron,
Östrogen, Inhibin A. Etwa 11 Tage nach der Ovulation beginnt das corpus luteum zu atresieren.
Granulosa- und Thekazellen verwandeln sich in das - stark vaskularisierte, endokrin aktive - corpus luteum; dieses produziert Progesteron,
Östrogen, Inhibin A. Etwa 11 Tage nach der Ovulation beginnt das corpus luteum zu atresieren. zur Physiologie der Follikel und zur Ovulation s. auch dort
zur Physiologie der Follikel und zur Ovulation s. auch dort abdichten (s. oben).
abdichten (s. oben). Abbildung):
Abbildung): Lysozyme
stammen aus Epithelzellen der Zone, die zum Stigma werden soll. Die
Wirkung der Enzyme schreitet von der tunica albuginea zur Theka fort.
Lysozyme
stammen aus Epithelzellen der Zone, die zum Stigma werden soll. Die
Wirkung der Enzyme schreitet von der tunica albuginea zur Theka fort.  FSH wirkt über FSH-Rezeptoren (G-Protein → cAMP → Proteinkinase A → Phosphorylierungen → CRE). Es aktiviert nicht nur die Mobilisierung des Eihügels, sondern auch
selektiv in Granulosazellen den Plasminaktivator, dieser setzt aus
Plasminogen der Follikelflüssigkeit (gleiche Konzentration wie im
Blutplasma) Plasmin frei; dieses beteiligt sich vermutlich durch proteolytische Aktivität an der Stigmabildung (lysosomale Enzyme für den Eisprung).
FSH wirkt über FSH-Rezeptoren (G-Protein → cAMP → Proteinkinase A → Phosphorylierungen → CRE). Es aktiviert nicht nur die Mobilisierung des Eihügels, sondern auch
selektiv in Granulosazellen den Plasminaktivator, dieser setzt aus
Plasminogen der Follikelflüssigkeit (gleiche Konzentration wie im
Blutplasma) Plasmin frei; dieses beteiligt sich vermutlich durch proteolytische Aktivität an der Stigmabildung (lysosomale Enzyme für den Eisprung). LH wirkt über LH-Rezeptoren (G-Protein → cAMP → Proteinkinase A → Phosphorylierungen → CRE). Es regt die Bildung von Prostaglandinen an, diese haben eine wesentliche Rolle für die Stimulusausbildung
(experimentelle Prostaglandin-Blockade unterdrückt die Ovulation). LH regt die Fortsetzung der Meiose II an und fördert die Luteinisierung.
LH wirkt über LH-Rezeptoren (G-Protein → cAMP → Proteinkinase A → Phosphorylierungen → CRE). Es regt die Bildung von Prostaglandinen an, diese haben eine wesentliche Rolle für die Stimulusausbildung
(experimentelle Prostaglandin-Blockade unterdrückt die Ovulation). LH regt die Fortsetzung der Meiose II an und fördert die Luteinisierung. von Granulosa- und
Thekazellen (s. unten), d.h. ein Wechsel der
steroidogenen Funktion der Theka- und Granulosazellen im Ovar. Dies
führt durch Lipideinlagerungen zur Bildung des Gelbkörpers (corpus luteum), der während der
zweiten Zyklusphase große Mengen Progesteron produziert.
von Granulosa- und
Thekazellen (s. unten), d.h. ein Wechsel der
steroidogenen Funktion der Theka- und Granulosazellen im Ovar. Dies
führt durch Lipideinlagerungen zur Bildung des Gelbkörpers (corpus luteum), der während der
zweiten Zyklusphase große Mengen Progesteron produziert. ), wird um den Ovulationszeitpunkt neutral, was den
Spermien günstige Lebensbedingungen schafft (Sperma ist leicht alkalisch, pH 7,2-8,0).
), wird um den Ovulationszeitpunkt neutral, was den
Spermien günstige Lebensbedingungen schafft (Sperma ist leicht alkalisch, pH 7,2-8,0). Abbildung).
Abbildung). 
 Abbildung: Fertilität (Fruchtbarkeit) und Zyklus
Abbildung: Fertilität (Fruchtbarkeit) und Zyklus
 , "Farnkrautphänomen" -
, "Farnkrautphänomen" -  Abbildung).
Abbildung). 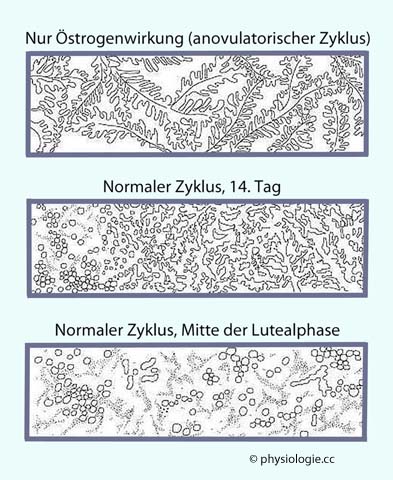
 Abbildung: Getrockneter Scheidenabstrich (schwache mikroskopische Vergrößerung)
Abbildung: Getrockneter Scheidenabstrich (schwache mikroskopische Vergrößerung)
 Granulosaluteinzellen nehmen durch eingelagerte Cholesterintröpfchen an Volumen zu und produzieren Progesteron. Dieses wird ziemlich synchron mit LH-Pulsen ausgeschüttet. Außerdem bilden Granulosaluteinzellen Inhibin A,
das ebenfalls die Gonadotropinsekretion hemmt. Sie teilen sich nicht
weiter, setzen aber ihre Hormonsekretion für etwa 10 Tage fort, bevor
sie abzusterben beginnen.
Granulosaluteinzellen nehmen durch eingelagerte Cholesterintröpfchen an Volumen zu und produzieren Progesteron. Dieses wird ziemlich synchron mit LH-Pulsen ausgeschüttet. Außerdem bilden Granulosaluteinzellen Inhibin A,
das ebenfalls die Gonadotropinsekretion hemmt. Sie teilen sich nicht
weiter, setzen aber ihre Hormonsekretion für etwa 10 Tage fort, bevor
sie abzusterben beginnen. Thekaluteinzellen produzieren Östrogene
- die sich, wie Progesteron, an der Hemmung der Gonadotropinproduktion in der Hypophyse beteiligen - und Androgene.
Thekaluteinzellen produzieren Östrogene
- die sich, wie Progesteron, an der Hemmung der Gonadotropinproduktion in der Hypophyse beteiligen - und Androgene. :
"Lutealphase" des Ovars). Etwa
eine Woche nach dem mittzyklischen LH-Anstieg ist die
Progesteronsynthese des Gelbkörpers an seinem höchsten Wert im Zyklus
angelangt. Die
Gelbkörperphase dauert (wenn es zu keiner Befruchtung kommt) 14±2 Tage, man spricht von einem corpus luteum menstruationis, das nach 2 Wochen regrediert.
:
"Lutealphase" des Ovars). Etwa
eine Woche nach dem mittzyklischen LH-Anstieg ist die
Progesteronsynthese des Gelbkörpers an seinem höchsten Wert im Zyklus
angelangt. Die
Gelbkörperphase dauert (wenn es zu keiner Befruchtung kommt) 14±2 Tage, man spricht von einem corpus luteum menstruationis, das nach 2 Wochen regrediert.  Abbildung):
Abbildung): Früher und mittlerer Abschnitt der Follikelphase
Früher und mittlerer Abschnitt der Follikelphase Später Abschnitt der Follikelphase einschließlich Ovulation
Später Abschnitt der Follikelphase einschließlich Ovulation Früher und mittlerer Abschnitt der Lutealphase
Früher und mittlerer Abschnitt der Lutealphase Späte Lutealphase
Späte Lutealphase
 Abbildung: Hormonelle Regulation des weiblichen Zyklus
Abbildung: Hormonelle Regulation des weiblichen Zyklus
 Das Ovar steuert die menstruelle Rhythmik.
Der vorübergehende FSH-Anstieg (der große antrale Follikel rekrutiert)
und der mittzyklische LH-Gipfel (der die Ovulation triggert) hängen von
zwei ovariellen Konstanten ab:
Das Ovar steuert die menstruelle Rhythmik.
Der vorübergehende FSH-Anstieg (der große antrale Follikel rekrutiert)
und der mittzyklische LH-Gipfel (der die Ovulation triggert) hängen von
zwei ovariellen Konstanten ab:  Der zeitlich definierten Lebensdauer des Gelbkörpers (2 Wochen) und
Der zeitlich definierten Lebensdauer des Gelbkörpers (2 Wochen) und  dem
dominanten Follikel, der ausreichend Östrogene produziert, um den
Kipppunkt zu erreichen, ab dem in der Hypophyse die Umschaltung auf Selbstverstärkung der
Gonadotropinausschüttung erfolgt.
dem
dominanten Follikel, der ausreichend Östrogene produziert, um den
Kipppunkt zu erreichen, ab dem in der Hypophyse die Umschaltung auf Selbstverstärkung der
Gonadotropinausschüttung erfolgt. 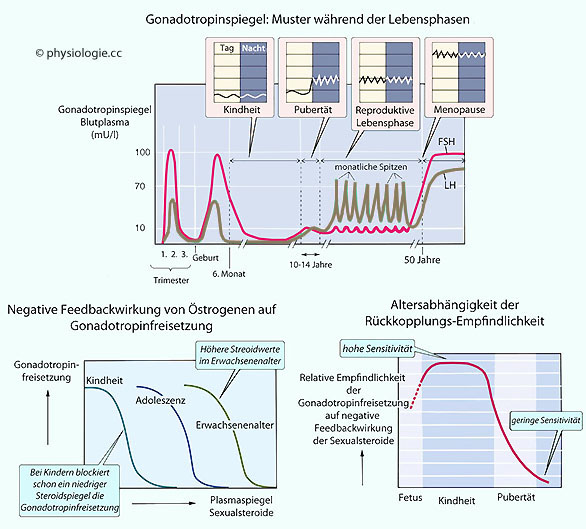
 Abbildung: Gonadotropine in verschiedenen Lebensabschnitten
Abbildung: Gonadotropine in verschiedenen Lebensabschnitten
 Abbildung). Die in dieser Phase häufig auftretenden Depressionen und Stimmungslabilität hängen mit den dabei erfolgenden Umstellungen zusammen.
Abbildung). Die in dieser Phase häufig auftretenden Depressionen und Stimmungslabilität hängen mit den dabei erfolgenden Umstellungen zusammen. 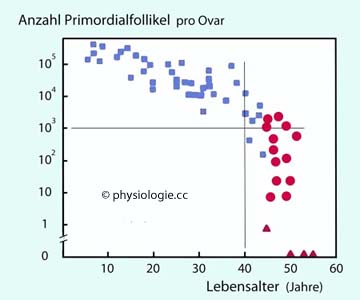

 Abbildung: Zahl von Primordialfollikeln pro Ovar als Funktion des Lebensalters
Abbildung: Zahl von Primordialfollikeln pro Ovar als Funktion des Lebensalters
 Abbildung). Werte von unter 1000 / Ovar treten ab
einem Alter von 40 Jahren mit zunehmender Häufigkeit auf.
Abbildung). Werte von unter 1000 / Ovar treten ab
einem Alter von 40 Jahren mit zunehmender Häufigkeit auf.
 Ovulationshemmer
("Antibabypille") verändern die physiologische hormonelle Regelung des
Zyklus. Steroide mit östrogener und gestagener
Ovulationshemmer
("Antibabypille") verändern die physiologische hormonelle Regelung des
Zyklus. Steroide mit östrogener und gestagener  Wirksamkeit hemmen die
Sekretion von Gonadoliberin aus dem Hypothalamus. Dies reduziert die
Freisetzung von LH und FSH aus dem Hypophysenvorderlappen und
unterdrückt den LH-Peak, der normalerweise den Eisprung bewirkt.
Wirksamkeit hemmen die
Sekretion von Gonadoliberin aus dem Hypothalamus. Dies reduziert die
Freisetzung von LH und FSH aus dem Hypophysenvorderlappen und
unterdrückt den LH-Peak, der normalerweise den Eisprung bewirkt.
 Eine Monatsblutung tritt am Ende der Sekretionsphase des Uterus auf,
ist durch sinkende Hormonspiegel bedingt und dauert 3-5 Tage (Tag 1 =
1. Zyklustag). Unter dem Einfluss hydrolytischer Proteasen - und unter
Verlust von ~20-80
ml Blut - lösen sich infolge hypoxischer Atrophie (Kontraktion von
Spiralarterien) 2/3 des Endometriums (stratum functionale) ab, 1/3
verbleibt (stratum basale) und baut unter Östrogenwirkung die
Schleimhaut wieder vollständig auf. Tritt eine Schwangerschaft auf,
wird Tag 1 als Beginn der 1. Schwangerschaftswoche (SSW) gewertet,
obwohl die Schwangerschaft im biologischen Sinne erst mit der
Implantation beginnt, meist in SSW 3
Eine Monatsblutung tritt am Ende der Sekretionsphase des Uterus auf,
ist durch sinkende Hormonspiegel bedingt und dauert 3-5 Tage (Tag 1 =
1. Zyklustag). Unter dem Einfluss hydrolytischer Proteasen - und unter
Verlust von ~20-80
ml Blut - lösen sich infolge hypoxischer Atrophie (Kontraktion von
Spiralarterien) 2/3 des Endometriums (stratum functionale) ab, 1/3
verbleibt (stratum basale) und baut unter Östrogenwirkung die
Schleimhaut wieder vollständig auf. Tritt eine Schwangerschaft auf,
wird Tag 1 als Beginn der 1. Schwangerschaftswoche (SSW) gewertet,
obwohl die Schwangerschaft im biologischen Sinne erst mit der
Implantation beginnt, meist in SSW 3  FSH regt in den Ovarien Östrogenbildung und die Entwicklung mehrerer Follikel an (Follikelphase des Ovars), das Endometrium wird durch Wachstumsfaktoren aufgebaut (Proliferationsphase des Uterus). Follikelzellen exprimieren Rezeptoren für Gonadotropine und LDL
(Cholesterin für Steroidsynthese). Granulosazellen bilden Progesteron,
Thekazellen aus Progesteron Androstendion, Granulosazellen aus
Androstendion Östradiol (Aromatase). Im Oozyten halten hohe
cAMP-Spiegel den Arrest in Prophase I, unterstützt durch cGMP, das über
gap junctions von Nachbarzellen in die Eizelle gelangt und die
Aktivität der Phosphodiesterase PDE3A und damit den Abbau von cAMP
hemmt. Fortsetzung der
Reifeteilung erfolgt durch sinkendes cGMP, Entzügelung der PDE3A und
Abbau von cAMP
FSH regt in den Ovarien Östrogenbildung und die Entwicklung mehrerer Follikel an (Follikelphase des Ovars), das Endometrium wird durch Wachstumsfaktoren aufgebaut (Proliferationsphase des Uterus). Follikelzellen exprimieren Rezeptoren für Gonadotropine und LDL
(Cholesterin für Steroidsynthese). Granulosazellen bilden Progesteron,
Thekazellen aus Progesteron Androstendion, Granulosazellen aus
Androstendion Östradiol (Aromatase). Im Oozyten halten hohe
cAMP-Spiegel den Arrest in Prophase I, unterstützt durch cGMP, das über
gap junctions von Nachbarzellen in die Eizelle gelangt und die
Aktivität der Phosphodiesterase PDE3A und damit den Abbau von cAMP
hemmt. Fortsetzung der
Reifeteilung erfolgt durch sinkendes cGMP, Entzügelung der PDE3A und
Abbau von cAMP Am Ende der Follikelphase steigt die Östrogenkonzentration über einen
Schwellenwert, was den Effekt auf den Hypothalamus kippen lässt:
Basophile Zellen erhöhen die Zahl ihrer GnRH-Rezeptoren, der
präovulatorische LH/FSH-Gipfel tritt auf (Hohlweg-Effekt). LH induziert
den Eisprung, seine höchste Konzentration findet sich vom 2.-3.
präovulatorischen bis zum 1. postovulatorischen Tag. Der LH-Peak
lässt die Eizelle bis zur Arretierung in der Meiose 2-Metaphase
fortfahren und löst die Ovulation aus, die verbliebenen Granulosa- und
Thekazellen verwandeln sich in das corpus luteum. Die Eizelle ist bis
zu 12 Stunden befruchtungsfähig; sie gelangt
mittels Flimmerstrom und Muskelkontraktionen über den Eileiter in den
Uterus. Das Zervixsekret ist dünnflüssig und reich an Protein und
Kohlenhydraten. Der alkalische pH-Wert begünstigt die Passage der
Spermien
Am Ende der Follikelphase steigt die Östrogenkonzentration über einen
Schwellenwert, was den Effekt auf den Hypothalamus kippen lässt:
Basophile Zellen erhöhen die Zahl ihrer GnRH-Rezeptoren, der
präovulatorische LH/FSH-Gipfel tritt auf (Hohlweg-Effekt). LH induziert
den Eisprung, seine höchste Konzentration findet sich vom 2.-3.
präovulatorischen bis zum 1. postovulatorischen Tag. Der LH-Peak
lässt die Eizelle bis zur Arretierung in der Meiose 2-Metaphase
fortfahren und löst die Ovulation aus, die verbliebenen Granulosa- und
Thekazellen verwandeln sich in das corpus luteum. Die Eizelle ist bis
zu 12 Stunden befruchtungsfähig; sie gelangt
mittels Flimmerstrom und Muskelkontraktionen über den Eileiter in den
Uterus. Das Zervixsekret ist dünnflüssig und reich an Protein und
Kohlenhydraten. Der alkalische pH-Wert begünstigt die Passage der
Spermien Mit der Ovulation beginnt die zweite Zyklushälfte (Lutealphase
des Ovars), Dauer 14±2 Tage. Granulosaluteinzellen produzieren
Progesteron und Inhibin, Thekaluteinzellen Östrogene und Androgene. Der
Progesteronspiegel ist während der 2. Zyklushälfte hoch: Progesteron
senkt die Zahl an Östrogenrezeptoren und fördert die Umwandlung von
Östradiol zu Östriol. Das Endometrium bereitet sich auf eine
Implantation vor: Für den Gewebeaufbau bildet es Glykogen, Kollagen,
Laminin, Heparansulfat (Dezidualisierung, Sekretionsphase des Uterus). Die Rektaltemperatur erhöht sich 2-3 Tage nach der Ovulation um ~0,5°C.
Das Zervixsekret erlaubt keine weitere Passage von Spermien. Maximale
Progesteronbildung erfolgt eine Woche nach dem LH-Gipfel, negative
Rückkopplung senkt die Gonadotropinsekretion (niedrigere Frequenz der
Pulse). ~11 Tage nach der Ovulation beginnt die Lutealfunktion
nachzulassen (außer, es tritt hCG auf). Mit der Luteolyse (~26.
Zyklustag) nimmt die Progesteron-, Östrogen- und Inhibinproduktion
stark ab, 2 Tage vor Beginn der Menstruation steigt der FSH-Spiegel
infolgedessen wieder an. Spiralarterien kontrahieren sich
(Östrogenmangel → Ischämie
→ Gefäßnekrose), es kommt zu Desquamation und Menstruationsblutung
Mit der Ovulation beginnt die zweite Zyklushälfte (Lutealphase
des Ovars), Dauer 14±2 Tage. Granulosaluteinzellen produzieren
Progesteron und Inhibin, Thekaluteinzellen Östrogene und Androgene. Der
Progesteronspiegel ist während der 2. Zyklushälfte hoch: Progesteron
senkt die Zahl an Östrogenrezeptoren und fördert die Umwandlung von
Östradiol zu Östriol. Das Endometrium bereitet sich auf eine
Implantation vor: Für den Gewebeaufbau bildet es Glykogen, Kollagen,
Laminin, Heparansulfat (Dezidualisierung, Sekretionsphase des Uterus). Die Rektaltemperatur erhöht sich 2-3 Tage nach der Ovulation um ~0,5°C.
Das Zervixsekret erlaubt keine weitere Passage von Spermien. Maximale
Progesteronbildung erfolgt eine Woche nach dem LH-Gipfel, negative
Rückkopplung senkt die Gonadotropinsekretion (niedrigere Frequenz der
Pulse). ~11 Tage nach der Ovulation beginnt die Lutealfunktion
nachzulassen (außer, es tritt hCG auf). Mit der Luteolyse (~26.
Zyklustag) nimmt die Progesteron-, Östrogen- und Inhibinproduktion
stark ab, 2 Tage vor Beginn der Menstruation steigt der FSH-Spiegel
infolgedessen wieder an. Spiralarterien kontrahieren sich
(Östrogenmangel → Ischämie
→ Gefäßnekrose), es kommt zu Desquamation und Menstruationsblutung Menopause ist die letzte Regelblutung, sie trennt den prämenopausalen
vom postmenopausalen Teil des Klimakteriums (Amenorrhoe ist das
Ausbleiben von Menstruationsblutungen). Der sinkende Steroidspiegel
(Östrogene auf ~15%, Progesteron auf ~30% der Werte jüngerer Frauen in
der Follikelphase reduziert) erhöht für mehrere Jahre die
Gonadotropinausschüttung. Östrogene stammen vorwiegend aus der
peripheren Konversion adrenaler Androgene; Östron wird zum
dominierenden Östrogen. Die Anzahl der ovariellen Follikel nimmt weiter
ab
Menopause ist die letzte Regelblutung, sie trennt den prämenopausalen
vom postmenopausalen Teil des Klimakteriums (Amenorrhoe ist das
Ausbleiben von Menstruationsblutungen). Der sinkende Steroidspiegel
(Östrogene auf ~15%, Progesteron auf ~30% der Werte jüngerer Frauen in
der Follikelphase reduziert) erhöht für mehrere Jahre die
Gonadotropinausschüttung. Östrogene stammen vorwiegend aus der
peripheren Konversion adrenaler Androgene; Östron wird zum
dominierenden Östrogen. Die Anzahl der ovariellen Follikel nimmt weiter
ab