Neurotransmitter und Neuropeptide  Faktoren der Hormonproduktion
Faktoren der Hormonproduktion  Hypophysenvorder-, Zwischen-, Hinterlappen
Hypophysenvorder-, Zwischen-, Hinterlappen  Vorderlappenhormone
Vorderlappenhormone  Hypothalamische Kerne
Hypothalamische Kerne  Hypophysenhinterlappen
Hypophysenhinterlappen
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages
Direkt
unter dem Hypothalamus - einer zentralen Verbindungsstelle neuronaler
und endokriner Funktionen - liegt die Hirnanhangsdrüse (Hypophyse) mit
dem (aus der Rathke'schen Tasche des oralen Epithels ausgesprossten)
Vorderlappen und dem (aus hypothalamischem Nervengewebe gebildeten)
Hinterlappen. Der aus nicht-neuronalem Drüsengewebe aufgebaute
Vorderlappen heißt auch Adenohypophyse, er steuert das Körperwachstum, die Schilddrüse, Nebennierenrinde sowie Geschlechtsdrüsen. Der Hinterlappen heißt auch Neurohypophyse, er setzt nach Anregung die Peptidhormone Vasopressin und Oxytocin frei.
Hypothalamische Kerne verarbeiten Signale aus übergeordneten Zentren und aus der Peripherie, und steuern Körperfunktionen neuroendokrin
Nucleus paraventricularis  Neuropeptide
Neuropeptide

 Abbildung: Hypothalamus und Hypophyse
Abbildung: Hypothalamus und Hypophyse
Nach einer Vorlage in Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
Links: Der Hypothalamus setzt in das Blut von Pfortadergefäßen steuernde Faktoren (rot: Liberine, Statine) frei,
die so direkt zu endokrinen Zellen im Hypophysenvorderlappen gelangen.
Sie stimulieren oder hemmen dort die Freisetzung von Hormonen (orange),
ohne im gesamten Kreislauf stark verdünnt worden zu sein (hohe
Wirkkonzentration). Pfortadergefäße verbinden zwei in Serie liegende
Kapillarnetze. Die Kapillarwände sind fenestriert und daher sehr durchlässig (permeabel), sie erlauben raschen Stoffaustausch zwischen Blutbahn und Gewebe.
Rechts: Einige hypothalamische Neuronen haben Axone, die sich in den
Hypophysenhinterlappen erstrecken (blau) und dort Hormone (Oxytocin,
Vasopressin) in die Blutbahn (Kapillarnetze im Hinterlappen) abgeben. Auf diese Weise ist endokrine
Aktivität des Hypothalamus direkt an den Blutkreislauf angebunden

Der Hypothalamus
 hat zahlreiche Funktionen:
hat zahlreiche Funktionen:
 Autonome Reaktionen auf Belastung / Stress (Vasokonstriktion, Tachykardie, Blutdruckerhöhung; Hyperglykämie; Proteinabbau; Hypokaliämie; Hypervolämie u.a.)
Autonome Reaktionen auf Belastung / Stress (Vasokonstriktion, Tachykardie, Blutdruckerhöhung; Hyperglykämie; Proteinabbau; Hypokaliämie; Hypervolämie u.a.)
 Einstellung des Energiegleichgewichts, Thermoregulation
Einstellung des Energiegleichgewichts, Thermoregulation
 Hunger (metabolisches Gleichgewicht) und Durst (Trinkverhalten, Osmo- und Volumenregulation)
Hunger (metabolisches Gleichgewicht) und Durst (Trinkverhalten, Osmo- und Volumenregulation)
 Schlaf-Wach-Zyklen
Schlaf-Wach-Zyklen
 Endokrine Steuerfunktion (Hypophyse)
Endokrine Steuerfunktion (Hypophyse)
 Verhalten (einschließlich Sexualverhalten)
Der Hypothalamus erhält Informationszuflüsse von allen bedeutenden Zonen des
Zentralnervensystems (und allen Sinnesorganen). Er beantwortet
entsprechende Reizmuster u.a. durch Sekretion von Neurotransmittern und
Neurohormonen.
Verhalten (einschließlich Sexualverhalten)
Der Hypothalamus erhält Informationszuflüsse von allen bedeutenden Zonen des
Zentralnervensystems (und allen Sinnesorganen). Er beantwortet
entsprechende Reizmuster u.a. durch Sekretion von Neurotransmittern und
Neurohormonen.
Von hypothalamischen Neuronen bzw. endokrinen Zellen in der Hypophyse freigesetzte Hormone

Nach Liqun Luo, Principles of Neurobiology, 2nd ed. CRC Press 2021
|
Hormon
|
Funktion
|
Direkte Freisetzung im Hypophysenhinterlappen
|
Oxytocin
|
Beeinflusst mütterliches und soziales Verhalten
|
Vasopressin
|
Reguliert Wasserhaushalt, beeinflusst soziales Verhalten
|
Stimulierende Wirkung hypothalamischer Neurone auf endokrine Zellen des Hypophysenvorderlappens
|
Hypothalamus
|
Hypophysen-
vorderlappen
|
|
CRH
|
ACTH
|
Reguliert Stressreaktionen, Glucocorticoidfreisetzung
|
GnRH
|
LH, FSH
|
Regt Freisetzung von Geschlechtshormonen, Reifung und sexuelles Verhalten an
|
GHRH
|
GH
|
Regt Wachstum an
|
TRH
|
TSH, Prolactin
|
Regt Stoffwechsel und Milchproduktion an
|
| Inhibierende Wirkung hypothalamischer Neurone auf endokrine Zellen des Hypophysenvorderlappens |
| Hypothalamus |
Hypophysen-
vorderlappen |
|
Somatostatin
|
GH
|
Wachstum
|
Dopamin
|
Prolactin
|
lactogenese
|

 Abbildung: Hypothalamisch- hypophysäres System
Abbildung: Hypothalamisch- hypophysäres System
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Zum Hypophysenvorderlappen: Parvozelluläre (kleinzellige) Neuronen im Hypothalamus sezernieren anregende (releasing) und hemmende (inhibiting) Faktoren in ein Geflecht von Blutkapillaren (primärer Plexus
des Pfortadersystems), welches das Infundibulum umgibt. Die Zellkörper
dieser Neuronen liegen in Kernen, welche den dritten Ventrikel umgeben.
Die Kapillaren des Blutplexus liegen außerhalb der Blut-Hirn-Schranke
und geben das (mit Releasing- bzw. Inhibiting-Faktoren angereicherte)
Blut über Pfortaderäste an den Vorderlappen weiter. Hier verzweigen
sich die Gefäße zum sekundären Kapillarplexus,
der die Hormone an trope (GH-, TSH-, ACTH-, LH-, FSH-,
Prolactin-produzierende) Zellen weitergibt.
Zum Hypophysenhinterlappen:
Magnozelluläre (großzellige) Neuronen im Hypothalamus (nucleus
supraopticus und paraventricularis) produzieren Vasopressin und
Oxytocin. Diese Hormone wandern durch die Axone der Neuriten (tractus
hypothalamo-hypophysialis) bis zum Hinterlappen, werden hier
freigesetzt und vom Kapillargeflecht aufgenommen
 Zu hypothalamischen Kernen s. auch dort , zum nucl. arcuatus s. auch dort
Zu hypothalamischen Kernen s. auch dort , zum nucl. arcuatus s. auch dort

Neurohormone
werden von neurosekretorischen
Zellen produziert ( Abbildung) - modifizierten Neuronen, welche auf neuronale, u.a.
reflexbedingte Reize hin (gelegentlich nach zwischenzeitlicher
intrazellulärer Speicherung) "ihre" Signalsubstanz an den
Extrazellulärraum abgeben, hier entweder parakrin wirken oder mit der
Blutbahn weitergetragen werden (dadurch werden sie definitionsgemäß zu
"Hormonen"). Neurohormone sind GnRH, CRH, TRH und Somatostatin (
Abbildung) - modifizierten Neuronen, welche auf neuronale, u.a.
reflexbedingte Reize hin (gelegentlich nach zwischenzeitlicher
intrazellulärer Speicherung) "ihre" Signalsubstanz an den
Extrazellulärraum abgeben, hier entweder parakrin wirken oder mit der
Blutbahn weitergetragen werden (dadurch werden sie definitionsgemäß zu
"Hormonen"). Neurohormone sind GnRH, CRH, TRH und Somatostatin (
s.
dort), sowie Vasopressin und Oxytocin.
 Die Neuriten neuroendokriner (neurosekretorischer) Zellen - also von Nervenzellen,
die Neurohormone sezernieren - enden oft in der unmittelbaren Nähe von
Blutkapillaren. So gelangen die Neurohormone zügig in den Kreislauf.
Die Neuriten neuroendokriner (neurosekretorischer) Zellen - also von Nervenzellen,
die Neurohormone sezernieren - enden oft in der unmittelbaren Nähe von
Blutkapillaren. So gelangen die Neurohormone zügig in den Kreislauf.
Nucleus paraventricularis
Der nucleus paraventricularis
besteht aus mehreren Funktionszonen: Einem neuroendokrinen (Bildung von
Hormonen) - magnozellulär und parvozellulär - und einen deszendierenden
Abschnitt (Projektionen auf Hirnstamm und Rückermark).
 Der magnozelluläre neuroendokrine
Abschnitt besitzt zwei Neuronenpools: Der eine bildet Vasopressin, der
andere Oxytocin (wie im nucleus supraopticus). Dieses sind die
"Hinterlappenhormone", sie wandern über die Axone (die den tractus hypothalamo-hypophysialis aufbauen) zur Neurohypophyse und werden dort je nach Bedarf in den Kreislauf abgegeben.
Der magnozelluläre neuroendokrine
Abschnitt besitzt zwei Neuronenpools: Der eine bildet Vasopressin, der
andere Oxytocin (wie im nucleus supraopticus). Dieses sind die
"Hinterlappenhormone", sie wandern über die Axone (die den tractus hypothalamo-hypophysialis aufbauen) zur Neurohypophyse und werden dort je nach Bedarf in den Kreislauf abgegeben.
 Der parvozelluläre neuroendokrine Abschnitt produziert
TRH, CRH und Somatostatin (sowie GIH: growth-hormone inhibiting
hormone) - ebenfalls in separaten (spezialisierten) Zellen, deren Axone
in der eminentia mediana enden und ihr Peptid an den
hypothalamisch-hypophysären Pfortaderkreislauf abgeben.
Der parvozelluläre neuroendokrine Abschnitt produziert
TRH, CRH und Somatostatin (sowie GIH: growth-hormone inhibiting
hormone) - ebenfalls in separaten (spezialisierten) Zellen, deren Axone
in der eminentia mediana enden und ihr Peptid an den
hypothalamisch-hypophysären Pfortaderkreislauf abgeben.
 Der deszendierende Abschnitt des nucl. paraventrivularis hat wiederum drei Abschnitte (dorsal, lateral, ventral), deren Nervenzellen Axone das zentrale autonome Netzwerk, die Marginalzone (lamina I) des Hinterhorns / Trigeminuskerns, das zentrale Höhlengrau sowie die formatio reticularis kontaktieren.
Der deszendierende Abschnitt des nucl. paraventrivularis hat wiederum drei Abschnitte (dorsal, lateral, ventral), deren Nervenzellen Axone das zentrale autonome Netzwerk, die Marginalzone (lamina I) des Hinterhorns / Trigeminuskerns, das zentrale Höhlengrau sowie die formatio reticularis kontaktieren.
Die Aufgabe des deszendierenden Abschnitts ist die Bearbeitung
autonomer Ein- und Ausgänge - inklusive Schmerzreize sowie
Nahrungsaufnahme- und Trinkverhalten.
Neuropeptide unterscheiden sich funktionell in mehrfacher Hinsicht von klassischen Neurotransmittern, zum Beispiel in Hinblick auf
 Entladungscharakteristik: Die präsynaptischen Entladungsfrequenzen liegen höher als die zur Freisetzung von Transmittern (impulse trains). So kann an derselben Synapse
Entladungscharakteristik: Die präsynaptischen Entladungsfrequenzen liegen höher als die zur Freisetzung von Transmittern (impulse trains). So kann an derselben Synapse
 durch niedrigfrequente Entladung aus kleinen Vesikeln ein exzitatorischer Transmitter,
durch niedrigfrequente Entladung aus kleinen Vesikeln ein exzitatorischer Transmitter,
 durch hochfrequente hingegen aus großen Vesikeln ein inhibitorisches
Neuropeptid freigesetzt werden;
durch hochfrequente hingegen aus großen Vesikeln ein inhibitorisches
Neuropeptid freigesetzt werden;
 die präsynaptische
Entladungscharakteristik entscheidet dann über die Art des
postsynaptischen Effekts (De- oder Hyperpolarisierung).
die präsynaptische
Entladungscharakteristik entscheidet dann über die Art des
postsynaptischen Effekts (De- oder Hyperpolarisierung).
Spezielle Speichervesikel (Large dense core vesicles, LDCV) geben Neuropeptide frei (im Vergleich zu Neurotransmittern geringe Mengen)
 Synaptische Charakteristika: Die Moleküle sind groß, ihre Konzentration im synaptischen Spalt geringer als bei Neurotransmittern; als komplexe Moleküle übermitteln sie eine höhere Informationsdichte, die Selektivität ist größer; ihre Rezeptoren finden sich postsynaptisch auch außerhalb der Synapse, die Bindungsaffinität ist höher
Synaptische Charakteristika: Die Moleküle sind groß, ihre Konzentration im synaptischen Spalt geringer als bei Neurotransmittern; als komplexe Moleküle übermitteln sie eine höhere Informationsdichte, die Selektivität ist größer; ihre Rezeptoren finden sich postsynaptisch auch außerhalb der Synapse, die Bindungsaffinität ist höher
 Diffusionsstrecken: Neurotransmitter
diffundieren nach ihrer Freisetzung höchstens ~50 µm weit, bevor sie
einerseits wiederaufgenommen, andererseits abgebaut werden. Neuropeptide
hingegen können über Strecken von mehr als 1000 µm diffundieren; sie haben eine entsprechend längere Verweildauer im
Extrazellulärraum. Der Neurotransmitter wird nicht gleich wiederaufgenommen, sondern bleibt relativ lange bioaktiv.
Diffusionsstrecken: Neurotransmitter
diffundieren nach ihrer Freisetzung höchstens ~50 µm weit, bevor sie
einerseits wiederaufgenommen, andererseits abgebaut werden. Neuropeptide
hingegen können über Strecken von mehr als 1000 µm diffundieren; sie haben eine entsprechend längere Verweildauer im
Extrazellulärraum. Der Neurotransmitter wird nicht gleich wiederaufgenommen, sondern bleibt relativ lange bioaktiv.
Faktoren der Hormonproduktion
Neurosekretorische Zellen haben bestimmte elektrophysiologische Eigenschaften
- je nach Zellart. Ihre Entladungsmuster (Aktionspotentiale)
korrelieren mit ihrer Freisetzung von Neurohormonen ( Abbildung).
Abbildung).
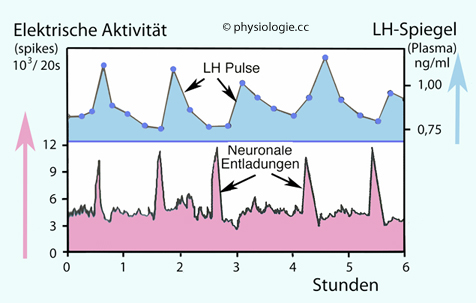
 Abbildung: LH-Spiegel im Blut als Funktion elektrischer Entladungsmuster hypothalamischer Zellen
Abbildung: LH-Spiegel im Blut als Funktion elektrischer Entladungsmuster hypothalamischer Zellen
Nach Okamura et al 2010 (Vorlage in Wilkinson / Brown,
An Introduction to Neuroendocrinology, 2nd ed. Cambridge University
Press 2015)
Ableitungen
von Zellgruppen im nucl. arcuatus und der eminentia mediana einer
wachen Ziege (Anästhetika verändern neurosekretorische Verhaltensmuster)

Afferenzen: Auf die neurosekretorischen Zellen des Hypothalamus wirken ihrerseits verschiedene Neurotransmitter
ein: Glutamat, GABA, Kisspeptin  , Opioide, Dopamin, Noradrenalin,
Serotonin.
, Opioide, Dopamin, Noradrenalin,
Serotonin.
Die neurosekretorischen Zellen erhalten neuronale Eingänge von nach "außen" und "innen" gerichteten Sinnesrezeptoren:

 Exterozeptoren
Exterozeptoren: Fühlen, Temperatur, Schmerz, Sehen, Hören, Riechen, Schmecken
 Enterozeptoren
Enterozeptoren: Volumen-, Baro-, Chemo-, Osmo-, Glucorezeptoren)
Einige dieser Eingänge stehen unter direktem Einfluss von
Stress, andere stehen mit zirkadianen Rhythmen in Zusammenhang (
Schlaf-Wach-Regulation), wieder andere mit
Fortpflanzung und
Stillen (Rezeptoren in Brustwarze, Zervix, Uterus).
Regulierende Einflüsse: Ein typisches Beispiel ist GnRH, das Gonadotropin-Releasing
Hormon: Nicht nur wird die Hormonproduktion der GnRH-Neurone von Östrogenen inhibiert, sie steht auch unter dem Einfluss zahlreicher neuronaler Eingänge. Diese geben ihren
Signalstoff über einen kurzen Pfortaderkreislauf an GnRH-empfindliche
Epithelzellen im Hypophysenlappen ab ( Abbildung oben).
Abbildung oben).
GnRH ist auch ein
Beispiel für vielfältige Sekretions- und Wirkorte, da es auch im
limbischen (Amygdala und Hippokampus) und olfaktorischen System, in
Kleinhirn und Rückenmark vorkommt. Wahrscheinlich ist es dort in
Funktionen wie motorische Kontrolle und Sexualverhalten involviert.


Abbildung: Wirkungskaskade neurosekretorischer Zellen
Nach einer Vorlage in Wilkinson / Brown, An Introduction to Neuroendocrinology (2nd ed.), Cambridge University Press 2015
Durch Vernetzung regulatorischer und neurosekretorischer Zellen eröffnen sich verschiedene Zugriffsmöglichkeiten
+ = exzitatorische, - = inhibitorische Transmitterwirkung

 Die Proteingruppe Kisspeptin (früher Metastin) wird von Neuronen in Hypothalamus, Mandelkernen und Hippocampus sowie in der Nebennierenrinde exprimiert.
Die Proteingruppe Kisspeptin (früher Metastin) wird von Neuronen in Hypothalamus, Mandelkernen und Hippocampus sowie in der Nebennierenrinde exprimiert.
Kisspeptin wirkt über metabotrope Kisspeptin- (GPR54-) Rezeptoren (KiSS1-derived peptide receptors). Im Hypothalamus (nucl. periventricularis, praeopticus, arcuatus  ) steuert es zusammen mit Neurokinin B und Dynorphinen die Freisetzung von GnRH-"Pulsen" (
) steuert es zusammen mit Neurokinin B und Dynorphinen die Freisetzung von GnRH-"Pulsen" (
Abbildung
) und hat vermutlich altersabhängige Wirkungen (es beteiligt sich an der
pubertären Umstellung auf den adulten Sekretionsmodus). Kisspeptin scheint weiters sexuelle Bindungen zu beeinflussen.
Der führende Ort, an dem Neurohormone gebildet werden, ist der Hypothalamus. "Nachgeordnet" ist ihm in diesem Zusammenhang die Hirnanhangsdrüse (Hypophyse  ). Diese bildet vor allem "trope"
(auf etwas gerichtet, gemeint sind periphere
Hormondrüsen) Hormone (Tropine), sie steht unter dem steuernden
Einfluss des Hypothalamus.
). Diese bildet vor allem "trope"
(auf etwas gerichtet, gemeint sind periphere
Hormondrüsen) Hormone (Tropine), sie steht unter dem steuernden
Einfluss des Hypothalamus.

Die Interaktion
verschiedener Neurone im Rahmen der Steuerung hypothalamischer
Neurosekretion kann verschiedene Muster annehmen (

Abbildung):
 Axosomatische
Axosomatische synaptische Einflüsse auf hypothalamisch-neurosekretorische Zellen können
direkt (z.B. durch Kisspeptin) oder
indirekt
erfolgen (z.B. wirken auf somatisch-afferente Neurone ihrerseits
fördernde (z.B. noradrenerge) und hemmende (z.B. GABAerge) Zellen ein

Opioiderge hemmende Afferenzen wirken
axoaxonal (präsynaptisch) auf hypothalamisch-neurosekretorische Zellen

Dopaminerge Neuronen sezernieren ihren Transmitter direkt in
Pfortadergefäße der eminentia mediana (Hemmung der
Prolactinfreisetzung im Vorderlappen)

 Abbildung:
Magnozelluläre und parvozelluläre Projektionen: Beispiel Oxytocin
Abbildung:
Magnozelluläre und parvozelluläre Projektionen: Beispiel Oxytocin
Nach Dölen G: Oxytocin: Parallel Processing in the Social Brain? J Neuroendocrinol 2015: 27, 516-35
Oben: Magno- und parvozelluläre Projektionen aus dem nucl. paraventricularis (PVN) und supraopticus (SON) des Hypothalamus.
Unten: Endokrine (links) und parakrine Wirkungen (Mitte) des
parvozellulären Weges, synaptische des parvozellulären Weges (rechts).
Oxytocin kann in die Blutbahn (endokrin: Rascher Transport, aber kurze
Halbwertszeit) und an den Liquor (parakrin: Langsamer Transport, aber
lange Halbwertszeit) abgegeben werden
BHS, Blut-Hirn-Schranke; LDCV,
large dense core vesicle - aus solchen Speichervesikeln wird Oxytocin abgegeben
 Neurosekretorische Aktivität findet sich im Körper an mehreren Stellen:
Neurosekretorische Aktivität findet sich im Körper an mehreren Stellen:
 Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei (Hypophysenhinterlappen,
Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei (Hypophysenhinterlappen,  Abbildung)
Abbildung)
 Parvozelluläre Neurone setzen Liberine / Inhibine frei (eminentia mediana) und projizieren auf den nucleus accumbens
Parvozelluläre Neurone setzen Liberine / Inhibine frei (eminentia mediana) und projizieren auf den nucleus accumbens
 Postganglionäre sympathische Zellen setzen Adrenalin frei (Nebennierenmark)
Postganglionäre sympathische Zellen setzen Adrenalin frei (Nebennierenmark)
 Pinealozyten setzen (auf adrenerge Impulse hin) Melatonin frei (Epiphyse)
Diskontinuierliche Sekretion: Die Freisetzung der Neurohormone erfolgt in aller Regel nicht kontiunuierlich, sondern pulsatil, wobei die jeweiligen Frequenzen und Amplituden typisch
für das Neurohormon, aber gleichzeitig auch von der Situation
beeinflusst sind, in der sich der Organismus gerade befindet
(Tageszeit, Stoffwechselzustand, Stresslevel u.a.).
Pinealozyten setzen (auf adrenerge Impulse hin) Melatonin frei (Epiphyse)
Diskontinuierliche Sekretion: Die Freisetzung der Neurohormone erfolgt in aller Regel nicht kontiunuierlich, sondern pulsatil, wobei die jeweiligen Frequenzen und Amplituden typisch
für das Neurohormon, aber gleichzeitig auch von der Situation
beeinflusst sind, in der sich der Organismus gerade befindet
(Tageszeit, Stoffwechselzustand, Stresslevel u.a.).
Die Interaktionen im hypothalamisch-hypophysären System sind komplex, was aus folgenden Beispielen klar wird:

Einige hypothalamische Hormone sind
multifunktional,
d.h. sie richten sich an mehrere "Adressaten" - beispielsweise fördert
TRH nicht nur die TSH-, sondern auch Prolactinausschüttung; GnRH
stimuliert sowohl die LH- als auch FSH-Produktion; Somatostatin hemmt
nicht nur die GH-, sondern auch die TSH-Sekretion; Dopamin hemmt neben
der Freisetzung von Prolactin auch die von TSH und α-MSH.

Hypophysenhormone können als
Neuromodulatoren
auf den Hypothalamus rückwirken. Dazu gibt es verschiedene Wege:
Hinterlappenhormone können über retrograden axonalen Transport zum
Hypothalamus gelangen; Vorderlappenhormone können das auf dem Blutweg -
direkt über lokale Pfortaderäste, oder über den systemischen Kreislauf.

Nicht alle hypothalamischen Hormone werden in den Pfortaderkreislauf
sezerniert; sie können auch an anderen Stellen als Neuromodulatorern
wirken und dort Transmitterfreisetzung und
Verhalten beeinflussen. So wirkt z.B. im Gehirn freigesetztes GnRH auf das Sexualverhalten.

Die Freisetzung hypophysärer Hormone steht auch unter dem Einfluss verschiedener
Neurotransmitter und Neuropeptide (z.B. GABA, VIP, Enkephaline, Substanz P). Hypophysenzellen verfügen über entsprechende Rezeptoren.
Die 0,5-0,8 Gramm schwere Hypophyse liegt auf Nasenhöhe in der sella turcica des Keilbeins. Sie besteht aus der Adenohypophyse  (Vorder- und Zwischenlappen), die durch Auswachsen der endodermalen Rachentasche (Rathke'sche Tasche
(Vorder- und Zwischenlappen), die durch Auswachsen der endodermalen Rachentasche (Rathke'sche Tasche  ) entsteht, und der Neurohypophyse:
) entsteht, und der Neurohypophyse:
 Der Vorderlappen
(HVL) bildet trope
Der Vorderlappen
(HVL) bildet trope Hormone (vo
n τρεπω
= auf etwas gerichtet sein - nicht "troph", wie in vielen (vor allem
amerikanischen) Büchern fälschlich steht - "troph" steht für τροφή =
Ernährung, z.B. atroph, hypertroph).
Vorderlappenhormone sind somatotrop (GH) und glandotrop  (ACTH, TSH, FSH, LH, Prolactin), sie steuern die Hormonfreisetzung peripherer Drüsen (Glucocorticoide,
Schilddrüsenhormone, Geschlechtshormone), Ovulation und Spermatogenese,
Wachstum und Brustdrüsenentwicklung.
Melatotropine (MSH) und ACTH stammen vom selben Vorläufermolekül - Pro-opiomelanocortin (POMC) - ab (
(ACTH, TSH, FSH, LH, Prolactin), sie steuern die Hormonfreisetzung peripherer Drüsen (Glucocorticoide,
Schilddrüsenhormone, Geschlechtshormone), Ovulation und Spermatogenese,
Wachstum und Brustdrüsenentwicklung.
Melatotropine (MSH) und ACTH stammen vom selben Vorläufermolekül - Pro-opiomelanocortin (POMC) - ab ( Abbildung):
Abbildung):
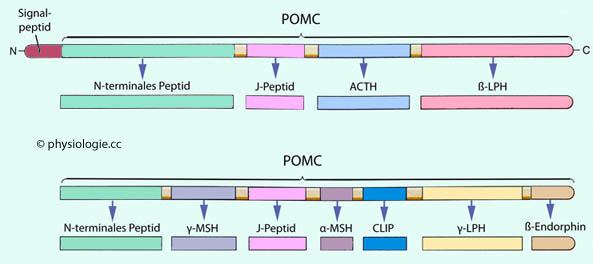
 Abbildung: Was aus POMC entsteht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Abbildung: Was aus POMC entsteht
Nach einer Vorlage in Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Proopiomelanocortin (POMC) - ein aus 241
Aminosäuren bestehendes Peptid - ist Teil des
zentralen Melanocortinsystems. Es entsteht in Zellen des Hypophysenvorderlappens sowie des Zwischenlappens
aus der Vorstufe Prä-POMC (257 AS), von
der die Signalsequenz abgetrennt wurde. Aus der Spaltung des
POMC-Moleküls (die in Vorder- und Zwischenlappen unterschiedlich
erfolgt) resultieren mehrere Peptide:
Oben: POMC-Spaltprodukte des Hypophysenvorderlappens. N-terminale Peptide
können die Proliferation von Nebennierenrindenzellen fördern und die
Freisetzung anderer Hypophysenhormone beeinflussen. Die physiologische
Rolle von J-Peptiden ist unklar. ACTH regt die Nebennierenrinde an. ß-LPH (ß-Lipotropin) mobilisiert Fett aus Adipozyten und ist eine Vorstufe für ß-Endorphin.
Unten: POMC-Spaltprodukte des Hypophysenzwischenlappens - diese sind in der fetalen Lebensperiode und während der Schwangerschaft bedeutsam. γ-MSH (melanozytenstimulierendes
Hormon) beteiligt sich an der Regulation von Nahrungsaufnahme und
Energiehaushalt, es kann auch natriuretisch und blutdrucksenkend
wirken. α-MSH wirkt über Melanocortinrezeptoren, es regt
die Melaninproduktion in der Haut an (Schutz vor UV-bedingten Schäden),
wirkt entzündungshemmend, senkt den Appetit und spielt eine Rolle für
Aufmerksamkeit und Lernen. CLIP (corticotropin-like intermediate peptide) besteht aus 22 Aminosäuren des ACTH und wirkt auf Atmung, Schlaf und Schmerzkontrolle. γ-LPH ist ein Fragment des ß-LPH, seine physiologische Bedeutung beim Menschen ist unklar. ß-Endorphin ist im Blut normalerweise nicht nachweisbar, wohl aber nach starker körperlicher Belastung, Stress oder bei Schmerzzuständen

 Der Zwischenlappen bildet Melanotropine = Melanozyten-stimulierende Hormone (MSH, Intermedine),
Peptidhormone, welche auf Melanozyten wirken und die Pigmentierung
erhöhen. Man kennt α-MSH (verantwortlich für die Pigmentierung von Haut und Haaren, Wirkung über den Melanocortinrezeptor MC1), β-MSH und γ-MSH (wirken an MC1-, MC3-, MC4- und MC5-Rezeptoren).
Der Zwischenlappen bildet Melanotropine = Melanozyten-stimulierende Hormone (MSH, Intermedine),
Peptidhormone, welche auf Melanozyten wirken und die Pigmentierung
erhöhen. Man kennt α-MSH (verantwortlich für die Pigmentierung von Haut und Haaren, Wirkung über den Melanocortinrezeptor MC1), β-MSH und γ-MSH (wirken an MC1-, MC3-, MC4- und MC5-Rezeptoren).
 Die gemeinsame Sekretion von ACTH uns ß-Endorphin kann vorteilhaft
sein, wenn physischer Stress durch eine Verletzung auftritt -
ß-Endorphin ist ein Opioid und kann zur Schmerzlinderung beitragen.
Die gemeinsame Sekretion von ACTH uns ß-Endorphin kann vorteilhaft
sein, wenn physischer Stress durch eine Verletzung auftritt -
ß-Endorphin ist ein Opioid und kann zur Schmerzlinderung beitragen.
 Über Melanocortinrezeptoren s. dort
Über Melanocortinrezeptoren s. dort
Der MSH-Spiegel steigt in der Schwangerschaft, was - zusammen mit erhöhten Östrogenspiegeln - die
erhöhte Pigmentierung (chloasma uterinum) erklärt.
 Der Hinterlappen
(HHL) entsteht aus dem neuralen Ektoderm. Fasern aus dem nucl.
supraopticus und paraventricularis setzen Vasopressin (=ADH) und Oxytocin
frei (Abbildung). Dazu müssen diese Kerne im Rahmen entsprechender
Regelungsvorgänge angeregt werden, z.B. durch Blutdruckabfall oder
Wassermangel (ADH) oder Saugreiz an der Brustwarze (Oxytocin).
Der Hinterlappen
(HHL) entsteht aus dem neuralen Ektoderm. Fasern aus dem nucl.
supraopticus und paraventricularis setzen Vasopressin (=ADH) und Oxytocin
frei (Abbildung). Dazu müssen diese Kerne im Rahmen entsprechender
Regelungsvorgänge angeregt werden, z.B. durch Blutdruckabfall oder
Wassermangel (ADH) oder Saugreiz an der Brustwarze (Oxytocin).

 Abbildung: Hypothalamisch-hypophysäres System
Abbildung: Hypothalamisch-hypophysäres System
Nach einer Vorlage in Melmed S, Polonsky K., Larsen PR, Kronenberg HM (eds.): Williams Textbook of Endocrinology, Saunders
Die
zentrale Bedeutung des hypothalamisch- hypophysären Systems für die
Aufrechterhaltung lebenswichtiger Funktionskreise kommt in seinem
breiten Wirkungsspektrum in der Körperperipherie zum Ausdruck
 Die
Freisetzung troper Hormone ist in Regelkreise eingebunden,
erfolgt großteils pulsatil
(
Die
Freisetzung troper Hormone ist in Regelkreise eingebunden,
erfolgt großteils pulsatil
( Abbildung) und abhängig von biologischen Rhythmen. Die pulsatile Freisetzung
gewährleistet Wirksamkeit: Kontinuierliche Ausschüttung würde durch
Rezeptor-Endozytose (Herunterregulierung) die Zielzellen refraktär
gegenüber dem Hormon machen.
Abbildung) und abhängig von biologischen Rhythmen. Die pulsatile Freisetzung
gewährleistet Wirksamkeit: Kontinuierliche Ausschüttung würde durch
Rezeptor-Endozytose (Herunterregulierung) die Zielzellen refraktär
gegenüber dem Hormon machen.
Tatsächlich ist hier die hormonelle
Übertragung "frequenzmoduliert", d.h. die Frequenz der Freisetzungen im
"Sender"-Gewebe ist auf die Dauer der Refrakterität an den
"Empfänger"-Zellen abgestimmt.
 Bei Hypophyseninsuffizienz (z.B. Sheehan-Syndrom:
Bei Hypophyseninsuffizienz (z.B. Sheehan-Syndrom:  Defekt des mütterlichen Hypophysenvorderlappens infolge postpartaler Perfusionsminderung) werden trope Hormone diskontinuierlich infundiert (was ja die Hypophyse physiologischerweise tut), da sie sonst ihre Wirksamkeit verlieren (Rezeptor-downregulation).
Defekt des mütterlichen Hypophysenvorderlappens infolge postpartaler Perfusionsminderung) werden trope Hormone diskontinuierlich infundiert (was ja die Hypophyse physiologischerweise tut), da sie sonst ihre Wirksamkeit verlieren (Rezeptor-downregulation).
 Hypothalamuskerne s. auch dort
Hypothalamuskerne s. auch dort
Vorderlappenhormone
werden in der Adenohypophyse
gebildet und üben die im Folgenden detailliert beschriebenen Funktionen
aus. Ihre Produktion wird allesamt durch regulierende Hormone des
Hypothalamus beeinflusst; sowohl Hypothalamus als auch
Hypophyse unterliegen weiters rückkoppelnden Wirkungen peripherer
Hormone.
Vorderlappenhormone entstehen auch in diversen Hirnregionen und üben hier neuromodulatorische und verhaltensbeeinflussende
Wirkungen aus. Erkenntnisse auf diesem Gebiet wurden
vor allem aus Tierversuchen gewonnen, für die Physiologie des Menschen relevante
Aspekte werden erforscht.

 Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem
Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem
Zwischen
Immun- und Zentralnervensystem wirken Interleukine 1, 2 und 6,
Interferone, TNF-α, β-Endorphine; Somatostatin, GH, ACTH, Prolactin,
VIP, Substanz P wirken auf das Immunsystem.
Zwischen Immun- und endokrinem System wirken ACTH, β-Endorphine; auf das endokrine System wirken Interleukine 1 und 6, Interferone, TNF-α.
Zwischen endokrinem und Zentralnervensystem wirken CRH, ACTH, β-Endorphine
 Weiters wirken Vorderlappenhormone auf das Abwehrsystem ein (Immunzellen haben Rezeptoren für GH, ACTH, Prolactin u.a.), und Zytokine
aus dem Immunsystem wirken ihrerseits auf die hypothalamische Steuerung
der Sekretion von Vorderlappenhormonen ein (
Weiters wirken Vorderlappenhormone auf das Abwehrsystem ein (Immunzellen haben Rezeptoren für GH, ACTH, Prolactin u.a.), und Zytokine
aus dem Immunsystem wirken ihrerseits auf die hypothalamische Steuerung
der Sekretion von Vorderlappenhormonen ein ( Abbildung). Daraus ergibt sich ein
komplexes Feedback-System zwischen hormoneller und immunologischer
Kontrolle.
Abbildung). Daraus ergibt sich ein
komplexes Feedback-System zwischen hormoneller und immunologischer
Kontrolle.
Nach ihrer chemischen Struktur können hypophysäre Hormone in drei Gruppen eingeteilt werden:
 ACTH und α-MSH sind Abkömmlinge des POMC.
ACTH und α-MSH sind Abkömmlinge des POMC.
 Zu den somatotropen Hormonen zählt man GH und Prolactin (und plazentares Lactogen) - sie wirken über Mitglieder der Zytokinrezeptor-Familie.
Zu den somatotropen Hormonen zählt man GH und Prolactin (und plazentares Lactogen) - sie wirken über Mitglieder der Zytokinrezeptor-Familie.
 TSH, LH, FSH und hCG sind glykosylierte Proteine.
TSH, LH, FSH und hCG sind glykosylierte Proteine.

 Abbildung: Hypothalamus und Hypophyse (Vorder- und Hinterlappen)
Abbildung: Hypothalamus und Hypophyse (Vorder- und Hinterlappen)
Nach einer Vorlage in Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
Links:
Die hypothalamischen nucll. supraopticus und paraventricularis
synthetisieren die "Hinterlappenhormone" Vasopressin (=Adiuretin) und
Oxytocin, speichern sie zum größten Teil im Hinterlappen und geben sie bei Erregung der Neurone in den Blutkreislauf ab.
Rechts: Den Vorderlappen
steuernde Neurone gruppieren sich im mediobasalen Hypothalamus. Dazu
gehören der nucl. paraventricularis und nucl. arcuatus.
Diese Kerne geben
steuernde Hormone (hauptsächlich Liberine = releasing hormones)
an das Blut des hypothalamisch-hypophysären Pfortaderkreislaufs ab. So
gelangen diese zum Vorderlappen und beeinflussen definierte
Zellgruppen, die dann bestimmte trope Hormone abgeben
 GH
GH  ACTH
ACTH  TSH
TSH  Prolactin
Prolactin  Gonadotropine
Gonadotropine
In diesem Abschnitt werden die Vorderlappenhormone kurz vorgestellt; Genaueres findet sich im
übernächsten Kapitel.


Abbildung: Pulsatile Freisetzung des Wachstumshormons
Nach einer Vorlage in Guyton/Hall, Textbook of Medical Physiology, 12th ed.
Die
STH-Freisetzung kann durch die aktuelle Situation angeregt werden
(intensive körperliche Belastung) und unterliegt einem zirkadianen Rhythmus (hier: Peak
um Mitternacht)
 vgl. dort
vgl. dort

Somatotropin wird vorwiergend bei intensiver körperlicher Aktivität sowie in der ersten Nachthälfte freigesetzt
|

 Abbildung: Steuerung und Wirkung von Wachstumshormon
Abbildung: Steuerung und Wirkung von Wachstumshormon
Nach einer Vorlage bei Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
GH = Wachstumshormon, GHRH = GH-Liberin, IGF-1 = Insulin-like growth factor 1 (Somatomedin C)
 Die
Steuerung der Somatotropinfreisetzung durch hypothalamische Faktoren
ist beispielhaft (
Die
Steuerung der Somatotropinfreisetzung durch hypothalamische Faktoren
ist beispielhaft ( Abbildung): GHRH fördert, Somatostatin hemmt die
Freisetzung von GH aus dem Hypophysenvorderlappen. Zusätzlich hemmen
sowohl Somatostatin als auch GH die GHRH-Sekretion, und zahlreiche
weitere Faktoren (Metabolite, Neurotransmitter, Medikamente)
beeinflussen diesen komplexen Steuerungsmechanismus.
Das appetitanregende Peptidhormon Ghrelin, das bei Substratmangel (Hunger, Hypoglykämie)
aus dem oberen Gastrointestinaltrakt (hauptsächlich Magenfundus) freigesetzt wird, regt die
Waschstumshormonsekretion über GPC-Rezeptoren (secretagogue receptor) doppelt an: Direkt an der Hypophyse, und über
Hemmung der Somatostatinfreisetzung im Hypothalamus.
Über Wirkung an Leber- und Knochenzellen, Adipozyten und Myozyten regt
GH die Bildung von IGF-1 an; dies ist das hauptsächlich
stoffwechselwirksame Hormon.
Negative Rückkopplung erfolgt durch IGF-1 sowohl am Hypothalamus
(Hemmung GHRH-) als auch an der Hypophyse (Hemmung GH-Freisetzung).
Abbildung): GHRH fördert, Somatostatin hemmt die
Freisetzung von GH aus dem Hypophysenvorderlappen. Zusätzlich hemmen
sowohl Somatostatin als auch GH die GHRH-Sekretion, und zahlreiche
weitere Faktoren (Metabolite, Neurotransmitter, Medikamente)
beeinflussen diesen komplexen Steuerungsmechanismus.
Das appetitanregende Peptidhormon Ghrelin, das bei Substratmangel (Hunger, Hypoglykämie)
aus dem oberen Gastrointestinaltrakt (hauptsächlich Magenfundus) freigesetzt wird, regt die
Waschstumshormonsekretion über GPC-Rezeptoren (secretagogue receptor) doppelt an: Direkt an der Hypophyse, und über
Hemmung der Somatostatinfreisetzung im Hypothalamus.
Über Wirkung an Leber- und Knochenzellen, Adipozyten und Myozyten regt
GH die Bildung von IGF-1 an; dies ist das hauptsächlich
stoffwechselwirksame Hormon.
Negative Rückkopplung erfolgt durch IGF-1 sowohl am Hypothalamus
(Hemmung GHRH-) als auch an der Hypophyse (Hemmung GH-Freisetzung).
Adrenocorticotropin (ACTH)
ACTH (adrenocorticotropes Hormon) regt die Nebennierenrinde zur Hormonbildung an, insbesondere die von Cortisol.
Auch die Ausschüttung des ACTH unterliegt zirkadianen Rhythmen, mit den
höchsten Blutwerten frühmorgens. Die Rhythmen sind von Hypothalamus
(CRH) vorgegeben.
 Näheres zum ACTH s. dort
Näheres zum ACTH s. dort
Thyreotropin (TSH)
TSH (Thyreotropin, Thyreoidea-stimulierendes Hormon) regt die Freisetzung von Hormonen in der Schilddrüse an. Es steht unter dem Einfluss von TRH und Somatostatin ( Abbildung).
Abbildung).

 Abbildung: TRH steuert die Schilddrüsenfunktion
Nach einer Vorlage in Melmed S, Polonsky K., Larsen PR, Kronenberg HM (eds.): Williams Textbook of Endocrinology, 12th ed., Saunders, 2011
Abbildung: TRH steuert die Schilddrüsenfunktion
Nach einer Vorlage in Melmed S, Polonsky K., Larsen PR, Kronenberg HM (eds.): Williams Textbook of Endocrinology, 12th ed., Saunders, 2011
 Näheres s. dort
Näheres s. dort
 nucleus arcuatus
nucleus arcuatus s.
dort
Prolactin
(PRL)
- auch lactotropes Hormon - aus lactotropen (=mammotropen) Vorderlappenzellen bewirkt die Bildung
der Milch in den Brustdrüsen (postpartale Lactation).
Sein Wirkungsspektrum ist aber viel breiter: Es beeinflusst auch
Wachstum, Osmoregulation, Kohlenhydrat- und Fettstoffwechsel, moduliert
immunologische Prozesse und interagiert mit anderen Hormonen (Östradiol,
Progesteron, Oxytocin). Hohe Prolactinspiegel hemmen die Ovulation
(Stillperiode!).
 Über Regulation und Wirkungen des Prolactins s. dort
Über Regulation und Wirkungen des Prolactins s. dort
Die Sekretion des Prolactins erfolgt pulsatil - alle ~90 Minuten, vor allem im Schlaf, mit höheren Amplituden bei Frauen. Stress
(körperlich und seelisch) steigert die Prolactinfreisetzung, was
Angstgefühle mindert und die hypothalamisch-hypophysäre Achse hemmt;
wahrscheinlich hat das bei Schwangeren und Lactierenden beruhigende
Effekte
 Näheres über Gonadotropine s. dort
Näheres über Gonadotropine s. dort
Hypothalamische Kerne
Der Hypothalamus
ist Teil des Zwischenhirns und empfängt Signale sowohl von
übergeordneten Zentren (Kortex, limbisches System, Thalamus) als auch
aus der Peripherie (z.B. Konzentrationen peripherer Hormone, afferente
Meldungen über Nervenbahnen). Die Funktionen des Hypothalamus sind in
Kerngebieten organisiert.
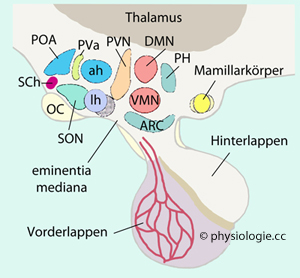
 Abbildung: Kerne des Hypothalamus, Funktionen, Hormonbildungsorte (vgl. dort)
Nach Brown RE, An Introduction to Neuroendocrinology. Cambridge University Press 1994
Abbildung: Kerne des Hypothalamus, Funktionen, Hormonbildungsorte (vgl. dort)
Nach Brown RE, An Introduction to Neuroendocrinology. Cambridge University Press 1994
Der anteriore (supraoptische) Hypothalamus
enthält das präoptische Areal (POA: Regulierung der Körpertemperatur
etc), den nucl. supraopticus (SON: Produktion von
Hinterlappenhormonen), paraventricularis (PVa: Vorderlappenhormone),
hypothalamicus anterior (
ah: Thermoregulation), suprachiasmaticus (SCh: zirkadiane Rhythmen), lateralis (lh: orexinproduzierende Neurone).
Der mittlere (tuberale) Hypothalamus enthält medial u.a. den nucl. dorsomedialis (DMN: Kreislauf, Verdauung), ventromedialis (Sattheit), arcuatus (ARC: Wachstum, Nahrungsaufnahme, Prolactinhemmung), lateral den nucl. lateralis (Appetit).
Der posteriore Hypothalamus enthält
medial die Mamillarkörper (Gedächtnis) und den nucl. posterior (PH: Blutdruckanstieg, Pupillenweitung, Kältezittern),
lateral den nucl. lateralis und tuberomamillaris (Energiehaushalt, Aufmerksamkeit, Lernen, Gedächtnis, Schlaf)
OC = chiasma opticum - vgl. folgende Tabelle

Einige hypothalamische Kerne verfügen
über Hormonrezeptoren (endokrine Rückkopplungen), einige über
Osmorezeptoren (Osmoregulation), einige haben thermosensitive Zellen
(Temperaturregulation), wieder andere messen die Konzentration
bestimmter Metabolite, wie Glucose oder Fettsäuren (Hunger- bzw.
Sattheitsregulation).
Dementsprechend sind hypothalamische Steuer- und Korrekturmechanismen
aufgebaut. Die Efferenzen hypothalamischer Kerngebiete betreffen
einerseits - im medialen Hypothalamus - Hormone (Liberine und Statine, die auf den Hypophysenvorderlappen wirken), andererseits - im lateralen Hypothalamus - neuronale Efferenzen, insbesondere des autonomen Systems (Aktivität sympathischer und parasympathischer Neuronen).
Kleinzellige Neurone des medialen Hypothalamus bilden hypophysiotrope Hormone (releasing und release-inhibiting hormones), welche die Funktion des Hypophysenvorderlappens beeinflussen (Steuerhormone).
Großzellige Neurone im
rostralen Gebiet des Hypothalamus (nucl. supraopticus, magnozelluläre
Teile des nucleus paraventricularis) bilden Hormone (Vasopressin und
Oxytocin), die über axonalen Transport in den Hinterlappen der
Hypophyse gelangen und hier gespeichert werden, bis sie bei Erregung
der Axone in den Kreislauf freigesetzt werden.

Funktionen hypothalamischer Kerne
(vgl. >Abbildung oben)

Modifiziert nach Wilkinson / Brown, An Introduction to Neuroendocrinology, 2nd ed, Cambridge University Press 2015
|
Präoptisches Areal (POA) und vorderer Hypothalamus (ah)
|
Temperaturregulation
Sexualverhalten, mütterliches Verhalten
|
Nucl. suprachiasmaticus (SCh)
|
Steuerung von Glucocorticoiden, Melatonin, u.a.
Schlaf-Wach- und andere zirkadiane Rhythmen
|
Periventrikulärer Kern (PVa)
|
Somatostatin-Synthese
|
Nucl. supraopticus (SON)
|
Synthese von Vasopressin, Oxytocin
und Neurotensinen (magnozelluläre Neuronen); Flüssigkeitsbalance, Stillen
|
Nucl. paraventricularis (PVN)
|
Synthese von Vasopressin, Oxytocin (magnozelluläre Neuronen), CRH, TRH
(parvozelluläre Neuronen); Sympathische Kontrolle von Herz, Blutdruck
|
Lateraler Hypothalamus (lh)
|
Bildung von Orexin; Schlaf-Wach-Zyklus, Energiebalance, Nahrungsaufnahme (orexigene / anorexigene Faktoren) |
Nucl. dorsomedialis (DMN)
|
Regulation zirkadianer Rhythmen; Ess- und Trinkverhalten; Kreislaufantwort auf Stress; Aggressionskontrolle
|
Nucl. ventromedialis (VMN)
|
Kontrolle des Verdauungssystems via Cholecystokinin; Glucorezeptor, Energie- und Nahrungsaufnahme-bilanz; Sexualverhalten; Kreislauffunktionen
|
Posteriorer Hypothalamus (PH)
|
Temperaturregulation
Kontrolle des Sympathikus / viszeraler Funktionen
Schlaf, Weckreaktionen, Angst
|
Nucleus arcuatus (ARC) und eminentia mediana
|
Synthese von GnRH und GHRH, Dopamin, ß-Endorphin, α-MSH: Kontrolle des Körpergewichts (NPY-Neurone)
Kisspeptine → Reproduktionssystem
|
Steuerung und Rückkopplung.
Endokrine Systeme sind in der Regel durch negative Rückkopplung
stabilisiert. Je höher die Konzentration des gesteuerten (peripheren)
Hormons, desto geringer die Freisetzung des steuernden (zentralen)
Hormons (z.B. eines tropen Hypophysenhormons) - und vice versa.
Beispielsweise hemmt Cortisol die ACTH-Ausschüttung, Thyroxin die
TRH-Sekretion, Östradiol die LH-Freisetzung, Somatostatin die Abgabe
des Wachstumshormons (jeweils in die Blutbahn).
Es können aber auch begrenzte Phasen der positiven Rückkopplung auftreten.
So
haben Östrogene je nach Hormonstatus und Zyklusphase negative oder
positive Wirkung auf die Gonadotropinsekretion des Hypothalamus:
 In der (frühen) Follikelphase hemmen sie das System (negative Rückkopplung).
In der (frühen) Follikelphase hemmen sie das System (negative Rückkopplung).
 Steigt die Östrogenkonzentration gegen Ende der Follikelphase für
mehrere Stunden über einen Schwellenwert (150-200 pg/ml), dann kippt
der Effekt in Richtung einer positiven Rückkopplung, die basophilen
Zellen in der Hypophyse werden gegenüber GnRH sensibilisiert (Östradiol
erhöht die Zahl der GnRH-Rezeptoren im Vorderlappen) und es kommt zum
präovulatorischen LH- und FSH-Gipfel (LH-surge).
Der LH-Peak
löst mehrere Vorgänge im Ovar aus (in der Eizelle Beendigung der Meiose
1 und Arretierung in der Metaphase der Meiose 2, Auflösung der
Kernmembran, Ausbildung einer Metaphasenspindel, Beginn der
Zellteilung; Ovulation 32-36 Stunden nach Auftreten des LH-Gipfels;
u.a.)
Steigt die Östrogenkonzentration gegen Ende der Follikelphase für
mehrere Stunden über einen Schwellenwert (150-200 pg/ml), dann kippt
der Effekt in Richtung einer positiven Rückkopplung, die basophilen
Zellen in der Hypophyse werden gegenüber GnRH sensibilisiert (Östradiol
erhöht die Zahl der GnRH-Rezeptoren im Vorderlappen) und es kommt zum
präovulatorischen LH- und FSH-Gipfel (LH-surge).
Der LH-Peak
löst mehrere Vorgänge im Ovar aus (in der Eizelle Beendigung der Meiose
1 und Arretierung in der Metaphase der Meiose 2, Auflösung der
Kernmembran, Ausbildung einer Metaphasenspindel, Beginn der
Zellteilung; Ovulation 32-36 Stunden nach Auftreten des LH-Gipfels;
u.a.)

Vasopressin (Adiuretin, antidiuretisches Hormon, ADH)  Oxytocin
Oxytocin
Vasopressin und Oxytocin nennt man "Hinterlappenhormone", weil sie hier gespeichert und auf Bedarf hin ins Blut abgegeben werden. Es sind
Peptidhormone (9 Aminosäuren, 7 davon sind bei den beiden ident) mit geringer biologischer Halbwertszeit (wenige Minuten).
Neben ihren "klassischen" Wirkungen - Vasopressin steigert den
Blutdruck und veranlasst die Niere zu sparsamem Umgang mit Wasser,
Oxytocin fördert die Wehentätigkeit sowie das Einschießen der Milch in
die Ausführungsgänge der stillenden Brust - wirken diese Peptidhormone
auch auf das Sozialverhalten (
gesteigerte Empathie, erhöhtes Vertrauen, Partnerbindung, Kontaktfreudigkeit, sexuelle Aktivität , elterliches Verhalten - "Kuschelhormone").
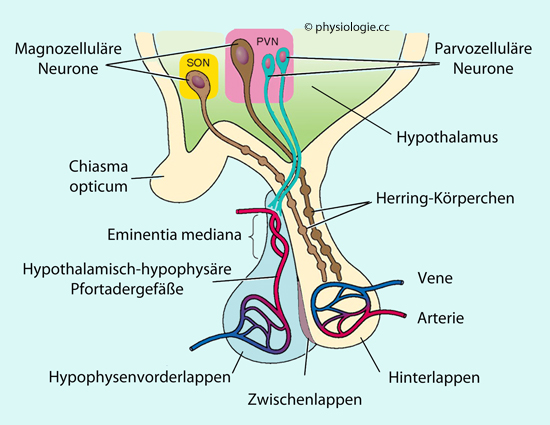

Abbildung: Vasopressinneurone und hypothalamisch- hypophysäres System
Nach
Koshimitsu T et al, Vasopressin V1a and V1b Receptors: From Molecules
to Physiological Systems, Physiol Rev 2012; 92: 1814-64
Vasopressinproduzierende Neuronen bilden das Hormon als Präprohormon und verwandeln es während des Transfers in die Axonperipherie zu Vasopressin (=Adiuretin, antidiuretisches Hormon ADH).
Axone von magnozellulären Nervenzellen - deren Körper im nucl. paraventricularis (PVN) und supraopticus (SON) liegen - speichern das Hormon in Form von Herring-Körperchen
 . Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System").
. Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System").
Parvozelluläre
Vasopressinneurone im PVN hingegen enden an äußeren Kapillarnetzen der
eminentia mediana und setzen hier
Vasopressin frei, das über hypothalamisch-hypophysäre Pfortadergefäße
in den Vorderlappen gelangt und hier die Freisetzung von ACTH anregt
Vasopressin und Oxytocin werden hauptsächlich von großzelligen hypothalamischen Neuronen synthetisiert, die im nucl. supraopticus und nucl. paraventricularis
liegen (Oxytocin und Vasopressin sezernierende Zellen sind distinkt und
kommen jeweils in beiden Kernen vor, 
Abbildung). Die beiden Hormone sind ähnlich aufgebaut:

Vasopressin:
Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly

Oxytocin:
Cys-Tyr-
Ile-Gln-Asn-Cys-Pro-
Leu-Gly
Oxytocin und Vasopressin haben bis auf zwei Aminosäuren die selbe Zusammensetzung
|
Die Hormone wandern nach ihrer
Bildung vom Zellsoma über den Neuriten in den Hinterlappen; freigesetzt
werden sie in das Versorgungsgebiet der unteren Hypophysenarterie.
Oxytocin und Vasopressin werden aus dem Hypophysenhinterlappen freigesetzt
|
Synthese, Transport und Sekretion: Vasopressin und Oxytocin entstehen (wie auch andere Proteohormone) zunächst als Präprohormone - Präprovasophysin und Präprooxyphysin
genannt. Nach Abspaltung des N-terminalen Signalpeptids gelangen die
Prohormone in das endoplasmatische Retikulum und von dort in den
Golgi-Apparat der magnozellulären Zellen des Hypothalamus. Dann werden sie zusammen mit Prohormon-Konvertasen in sekretorische Granula gepackt und intraaxonal durch Fasern des hypothalamisch-hypophysären Trakts ATP-abhängig transportiert
("rascher" Transport: ~15 mm/h). Hier erfolgt auch die enzymatische
Spaltung des Prohormons, was äquimolare Mengen an Hormon und
Neurophysin ergibt.
Neurophysin I ist der Transporter des Oxytocins, Neurophysin II der Transporter des Vasopressins.
Im terminalen Ende des Neuriten (in der pars nervosa der Hypophyse)
werden diese in sekretorischen Vesikeln (Herring-Körperchen ) gespeichert.
) gespeichert.
Bei Erregung der Zelle (im nucl. supraopticus / paraventricularis - Aktionspotentiale von Hypothalamus zu Hypophysenhinterlappen) werden - über intrazelluläre Erhöhung von [Ca++] (excitation-secretion coupling) - Hormone und Neurophysine exozytotisch in das Interstitium freigesetzt, von wo die
Moleküle in Kapillaren des Hinterlappens und damit in den Kreislauf
gelangen. Im Blut kann dann sowohl eine Erhöhung der Hormon- als auch
der Neurophysinkonzentration nachgewiesen werden.
Die Freisetzung der Hinterlappenhormone wird durch zahlreiche
Faktoren beeinflusst - einige, wie Noradrenalin (je nach Rezeptoren)
oder NO, können sowohl hemmend als auch anregend wirken:

Sie wird
stimuliert durch Glutamat, Acetylcholin, Dopamin, Noradrenalin
(insbesondere Oxytocinausschüttung unter der Geburt), ATP, CCK


Sie wird
gehemmt durch GABA, Glyzin, Dopamin, Somatostatin,
Endocannabinoide (insbesondere Oxytocinausschüttung unter der Geburt)
Vasopressin (Arginin-Vasopressin AVP) wirkt unter physiologischen Normalbedingungen begünstigend auf die Rückresorption von Wasser in den Nieren (daher auch Adiuretin, ADH - antidiuretisches Hormon).
Zusätzlich kann es als potenter Vasokonstriktor wirken - allerdings
nur, wenn es als Reaktion auf sinkenden Blutrückstrom zum Herzen in
höherer Menge in die Blutbahn ausgeschüttet wird. In der Klinik
wird Vasopressin zur Kreislaufstabilisierung eingesetzt.
 Vasopressin hält in der Niere - über V2-Rezeptoren - bereits bei niedrigen Blutspiegeln Wasser zurück ("Wassersparhormon"). Bei höheren Konzentrationen kann es - über V1-Rezeptoren - stark vasokonstriktorisch wirken und insbesondere bei Gefahr einer arteriellen Hypotonie den Blutdruck stabilisieren.
Vasopressin hält in der Niere - über V2-Rezeptoren - bereits bei niedrigen Blutspiegeln Wasser zurück ("Wassersparhormon"). Bei höheren Konzentrationen kann es - über V1-Rezeptoren - stark vasokonstriktorisch wirken und insbesondere bei Gefahr einer arteriellen Hypotonie den Blutdruck stabilisieren.
Wirkungen  Rezeptoren
Rezeptoren
Vasopressin ist das "Wassersparhormon" des Körpers. Genaueres über seine Wirkungen auf die Niere s. dort.

 Abbildung: Vom Vasopressin-Präprohormon zu Vasopressin
Abbildung: Vom Vasopressin-Präprohormon zu Vasopressin
Nach einer Vorlage bei Boron / Boulpaep, Medical Physiology, 3rd ed., Elsevier 2016
Arginin-Vasopressin
(AVP) entsteht in Neuronen des Hypothalamus (nucl. supraopticus und
paraventricularis). Diese bilden zunächst ein aus 168 Aminosäuren (As)
bestehendes Präprohormon. Enzyme machen daraus Vasopressin, Neurophysin
und ein Glykopeptid.
Osmorezeptoren im OVLT (organum vasculosum laminae terminalis) und SFO (subfornikales Organ) liegen außerhalb der Blut-Hirn-Schranke und reagieren auf Hypertonie mit Anregung der AVP-Freisetzung. Afferenzen aus dem nucleus tractus solitarii (NTS) regen die Vasopressinfreisetzung bei Absinken von Blutvolumen und/oder Blutdruck an.
Genmutationen im Bereich des Signalpeptids oder des Neurophysins führen zu Diabetes indipidus

Unter der Wirkung von Vasopressin erfolgt im distalen Nephronsystem die
Rückresorption von etwa 20 Liter glomerulär filtrierten Wassers pro
Tag. Ohne diese Wirkung geht vermehrt Wasser mit dem
Harn verloren (Diabetes insipidus  in Vollausprägung: stündlich ~1 Liter).
in Vollausprägung: stündlich ~1 Liter).
Vasopressin fördert die Expression des Na+/K+/2Cl--Kotransporters in Zellen des dicken aufsteigenden Schenkels der Henle'schen Schleife sowie die Einlagerung von Aquaporinen
in spät-distale Tubuli, wodurch einerseits die Salzresorption und damit
die Aufrechterhaltung des osmotischen Gradienten im Nierenmark (als
treibende Kraft), andererseits die Rückresorption von Wasser aus den
Tubuli gefördert wird.
Vasopressinmangel bedingt Diabetes insipidus (Harnproduktion bis ~1 l/h)
|
Vasopressin ist damit ein entscheidender Faktor für die
Regulation von Osmolarität, Volumen- und Kreislauffunktion. Darüber
hinaus wirkt es auch extrarenal - vor allem direkt vasokonstriktorisch und
damit blutdrucksteigernd.
Vasopressin steigert die zelluläre Magnesium-Verfügbarkeit. Im Knochen stimuliert es die Proliferation von Osteoblasten und Knorpelzellen in den Wachstumsfugen, und fördert so den Knochenaufbau.
Außerdem wirkt Vasopressin auf komplexe Hirnfunktionen ein: Es beeinflusst Aggressivität (positive Korrelation zwischen Vasopressinspiegel im Liquor und feindseligem Verhalten gegenüber Mitmenschen), Lernen und Gedächtnis (positive Korrelation).
 Vasopressin wird in Form des Prähormons im Hypothalamus gebildet (
Vasopressin wird in Form des Prähormons im Hypothalamus gebildet ( Abbildung oben) und
durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei wird das Prähormon durch
Enzyme, die sich in den Transportvesikeln befinden, zu Vasopressin und
Begleitpeptiden gespalten, u.a. Neurophysin II, das als Transportprotein dient.
Abbildung oben) und
durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei wird das Prähormon durch
Enzyme, die sich in den Transportvesikeln befinden, zu Vasopressin und
Begleitpeptiden gespalten, u.a. Neurophysin II, das als Transportprotein dient.


Abbildung: Osmoregulatorischer Vasopressin-Regelkreis
Nach einer Vorlage bei openpr.com/news (2022)
Die Bezeichnung ADH = Antidiuretisches Hormon (Adiuretin) deutet auf den "wassersparenden" Effekt des Hormons hin

 Auslösende Reize:
Auslösende Reize:
 Vasopressin wird bei
Anstieg der osmotischen Konzentration der Körperflüssigkeiten (Rezeptoren im Bereich des nucl. supraopticus des Hypothalamus) oder
Volumenmangel bzw. Blutdruckabfall (Rezeptoren im Kreislauf: Pulmonalvenen, linker Vorhof, Karotissinus, Aortenbogen) freigesetzt und verringert über V2-Rezeptoren (s. unten) die Wasserausscheidung in der
Niere (daher “antidiuretisches Hormon”).
Vasopressin wird bei
Anstieg der osmotischen Konzentration der Körperflüssigkeiten (Rezeptoren im Bereich des nucl. supraopticus des Hypothalamus) oder
Volumenmangel bzw. Blutdruckabfall (Rezeptoren im Kreislauf: Pulmonalvenen, linker Vorhof, Karotissinus, Aortenbogen) freigesetzt und verringert über V2-Rezeptoren (s. unten) die Wasserausscheidung in der
Niere (daher “antidiuretisches Hormon”).
 Die
Vasopressinausschüttung wird durch Signale von kardiovaskulären
Barorezeptoren gehemmt (tonische Inhibition). Blutdruckabfall fördert
daher die Vasopressinsekretion (Disinhibition), und umgekehrt. In höherer
Konzentration wirkt Vasopressin über V1-Rezeptoren vasokonstriktorisch und blutdrucksteigernd (daher
“Vaso-pressin”). Volumenmangel dominiert den Gesamteffekt, sodass u.a. auch bei hypotoner Dehydratation Vasopressin vermehrt ausgeschüttet wird (obwohl die Osmolalität erniedrigt ist).
Die
Vasopressinausschüttung wird durch Signale von kardiovaskulären
Barorezeptoren gehemmt (tonische Inhibition). Blutdruckabfall fördert
daher die Vasopressinsekretion (Disinhibition), und umgekehrt. In höherer
Konzentration wirkt Vasopressin über V1-Rezeptoren vasokonstriktorisch und blutdrucksteigernd (daher
“Vaso-pressin”). Volumenmangel dominiert den Gesamteffekt, sodass u.a. auch bei hypotoner Dehydratation Vasopressin vermehrt ausgeschüttet wird (obwohl die Osmolalität erniedrigt ist).
 Vasopressin wird bei Belastungssituationen (Stress, Trauma, Schmerz, intensive olfaktorische, visuelle, auditive Reize)
in die Blutbahn freigesetzt - es wirkt volumensparend (Kreislauf!) und in
höherer Konzentration gefäßverengend (Blutdruck!). Vasopressin ist Teil einer
"Alarmachse", zusammen mit "klassischen Stresshormonen" (Adrenalin, Cortisol).
Vasopressin wird bei Belastungssituationen (Stress, Trauma, Schmerz, intensive olfaktorische, visuelle, auditive Reize)
in die Blutbahn freigesetzt - es wirkt volumensparend (Kreislauf!) und in
höherer Konzentration gefäßverengend (Blutdruck!). Vasopressin ist Teil einer
"Alarmachse", zusammen mit "klassischen Stresshormonen" (Adrenalin, Cortisol).
 Bei intensiver orthostatischer Belastung und insbesondere präsynkopal (bei drohendem orthostatischem Kollaps)
sowie bei Auftreten von Übelkeit oder Schmerz steigen Ausschüttung
und Plasmaspiegel des Vasopressins besonders stark und rasch an - bis weit über das
Zehnfache des Kontrollwertes. Aufgrund der geringen Halbwertszeit
(~2-5 Minuten, Abbau vor allem in Leber und Niere) nimmt der
AVP-Plasmaspiegel nach einem solchen Ereignis auch rasch wieder ab. Auch Angiotensin II stimuliert die Freisetzung von Vasopressin.
Bei intensiver orthostatischer Belastung und insbesondere präsynkopal (bei drohendem orthostatischem Kollaps)
sowie bei Auftreten von Übelkeit oder Schmerz steigen Ausschüttung
und Plasmaspiegel des Vasopressins besonders stark und rasch an - bis weit über das
Zehnfache des Kontrollwertes. Aufgrund der geringen Halbwertszeit
(~2-5 Minuten, Abbau vor allem in Leber und Niere) nimmt der
AVP-Plasmaspiegel nach einem solchen Ereignis auch rasch wieder ab. Auch Angiotensin II stimuliert die Freisetzung von Vasopressin.
Die
Vasopressinsekretion wird u.a. durch Volumenmangel (Dehnungsrezeptoren)
oder ansteigende Serumosmolarität (Osmorezeptoren) angeregt
|
 Gehemmt wird die Vasopressinfreisetzung durch GABA, Cortisol und Atriopeptin.
Gehemmt wird die Vasopressinfreisetzung durch GABA, Cortisol und Atriopeptin.
 Opiate, Barbiturate, Alkohol
gehören zu Stoffen, welche die Sekretion von Vasopressin unterdrücken.
Daher kann z.B. die Einnahme alkoholischer Getränke zu Dehydrierung
führen ("Alkoholkater", von καταρρεῖν = herabfließen).
Opiate, Barbiturate, Alkohol
gehören zu Stoffen, welche die Sekretion von Vasopressin unterdrücken.
Daher kann z.B. die Einnahme alkoholischer Getränke zu Dehydrierung
führen ("Alkoholkater", von καταρρεῖν = herabfließen).

 Abbildung: Steuerung der Vasopressinsekretion
Abbildung: Steuerung der Vasopressinsekretion
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Einflüsse
von Kreislaufrezeptoren (CVLM: kaudale ventrolaterale medulla
oblongata), Osmorezeptoren (OVLT: organum vasculosum laminae
terminalis; SFO, subfornikales Organ) und komplexe Reizmuster
(Übelkeit) konvergieren auf vasopressinbildende hypothalamische
Neuronen (SON, nucl supraopticus; PVN, nucl. paraventricularis).
Übelkeit (Nausea) kann den Vasopressinspiegel auf das ~50-fache des für Antidiurese nötigen steigern (z.B. auch präsynkopal).
Inset: "hypovolämisch" = 15% Reduktion des Blutvolumens

Übelkeit
stimuliert die
Vasopressinausschüttung im Gehirn ( Abbildung), was die Niere zu
verstärkter Rückresorption von Wasser veranlasst. Das wirkt auch dem
Effekt allfälligen Alkoholkonsums entgegen (Alhohol wirkt dehydrierend).
Abbildung), was die Niere zu
verstärkter Rückresorption von Wasser veranlasst. Das wirkt auch dem
Effekt allfälligen Alkoholkonsums entgegen (Alhohol wirkt dehydrierend).
Vasopressin wird auch außerhalb des Gehirns bebildet: Von der
Nebenniere sowie vom Herzmuskel (hier führt erhöhte Wandspannung zu
einer mehrfachen Steigerung der Vasopressinproduktion).
Vasopressinrezeptoren
Vasopressin (ADH) wirkt auf verschiedene Rezeptoren:
 V1
V1-
Rezeptoren
finden sich in hoher Dichte auf der glatten Gefäßmuskulatur, auch am
Herzmuskel. Weiters werden sie exprimiert von Zellen in Gehirn, Hoden,
Leber und Nieren, sowie auf Thrombozyten, wo Vasopressin
prothrombotisch wirkt.
V1-Rezeptoren sprechen erst bei höheren Vasopressinkonzentrationen an (geringere Affinität) als V2-Rezeptoren (höhere Affinität). Sie funktionieren über Gq, PLC und IP3, sie steigern den intrazellulären Ca++-Spiegel.
Sie bringen Mesangiumzellen im Glomerulus (→ reduzierte glomeruläre Filtration) sowie Gefäßmuskelzellen in
efferenten Arteriolen und vasa recta (→ verringerte Perfusion) zur Kontraktion. Die reduzierte
Durchblutung des inneren Markbereichs erhöht das renale
Konzentrierungsvermögen (das vor allem durch die Wirkung über V2-Rezeptoren am Sammelrohrsystem ansteigt).
V1A-Rezeptoren finden sich an Blutgefäßen (vor allem im Splanchnicusbereich), Uterus-, Nerven- und Leberzellen, Blutplättchen; V1B (V3)-Rezeptoren im Hypophysenvorderlappen (corticotrope Zellen).
Ihre physiologischen Funktionen (lokale Durchblutung,
Trinkverhalten etc) sind im Einzelnen Gegenstand der Forschung.
Bei Hypovolämie
führen die hohen Vasopressinspiegel zu allgemeiner Vasokonstriktion
(was den Blutdruck stabilisiert) und zu einer charakteristischen Blässe
der Haut; im Gehirn und Herzmuskel stimuliert Vasopressin endotheliale
NO-Freisetzung und damit Vasodilatation (Umverteilung des
Herzminutenvolumens zugunsten zerebraler und myokardialer Perfusion).
 V2-Rezeptoren sind G-Protein-gekoppelte Rezeptoren - sie wirken über cAMP. Sie finden sich in den Sammelrohren der Niere, wo sie die Einlagerung von Aquaporin-2 in die apikale Membran der Tubulus-Hauptzellen ("Wasserspareffekt") sowie des Harnstofftransporters
fördern. Diese Wirkungen treten schon bei
wesentlich niedrigerem Vasopressinspiegel (ab ~0,05 pM) auf als sie für die Aktivierung von V1-Rezeptoren erforderlich sind.
V2-Rezeptoren sind G-Protein-gekoppelte Rezeptoren - sie wirken über cAMP. Sie finden sich in den Sammelrohren der Niere, wo sie die Einlagerung von Aquaporin-2 in die apikale Membran der Tubulus-Hauptzellen ("Wasserspareffekt") sowie des Harnstofftransporters
fördern. Diese Wirkungen treten schon bei
wesentlich niedrigerem Vasopressinspiegel (ab ~0,05 pM) auf als sie für die Aktivierung von V1-Rezeptoren erforderlich sind.
V1-Rezeptoren wirken vasokonstriktorisch, V2-Rezeptoren antidiuretisch
|
 Auch V3-Rezeptoren (früher: V1B-Rezeptoren) sind
G-Protein-gekoppelte Rezeptoren - sie unterscheiden sich in ihrem
pharmakologischen Ansprechmuster und wurden auf Zellen in Gehirn und
Hypophysenvorderlappen (ACTH) nachgewiesen.
Auch V3-Rezeptoren (früher: V1B-Rezeptoren) sind
G-Protein-gekoppelte Rezeptoren - sie unterscheiden sich in ihrem
pharmakologischen Ansprechmuster und wurden auf Zellen in Gehirn und
Hypophysenvorderlappen (ACTH) nachgewiesen.

 Abbildung: Wirkungsmechanismus von Vasopressin über V2-Rezeptoren
Abbildung: Wirkungsmechanismus von Vasopressin über V2-Rezeptoren
Nach einer Vorlage bei Hilal-Dandan / Brunton, Goodman
& Gilman's Manual of Pharmacology and Therapeutics, 2nd ed., McGraw
Hill Education 2014
Vasopressin bindet an basolaterale (blutseitige) V2-Rezeptoren
an Sammelrohrepithelzellen und aktiviert über G-Proteine, Adenylylcyclase, cAMP und Proteinkinase A (PKA). Dies hemmt an der
luminalen (apikalen) Membran die Endo- und fördert die Exozytose
aquaporinhältiger Vesikel. Die Resorption von Wasser steigt an

In hohen Konzentrationen steigert Vasopressin die Konzentration des von Willebrand-Faktors (Freisetzung aus Endothelzellen?) sowie des Faktors VIII, was die Gerinnungsbereitschaft des Blutes erhöht.
 Blutdruckabfall / Volumenmangel regt die Vasopressinausschüttung an.
Blutdruckabfall / Volumenmangel regt die Vasopressinausschüttung an.
Umgekehrt kann plötzlicher Blutdruckanstieg die Vasopressinsekretion so
stark unterdrücken, dass es zu einer Verringerung der antidiuretischen
(wassersparenden) Hormonwirkung kommt und die Harnmenge zunimmt.
Arterielle Hypertonie kann über Vasopressinabfall das Harnvolumen steigern
|
Ebenso kommt es bei einem Abfall des Zentralvenendrucks
(z.B. bei Aufrichten aus liegender Position) reflektorisch zu einer
Erhöhung des Vasopressinspiegels im Serum, und ein ZVD-Anstieg (z.B.
beim Hinlegen) hemmt umgekehrt die Vasopressinfreisetzung aus dem
Hypophysenhinterlappen.
Absinken des Zentralvenendrucks steigert die Vasopressinfreisetzung
|

 Abbildung: Vasopressinrezeptoren und ihre Kreislaufwirkungen
Abbildung: Vasopressinrezeptoren und ihre Kreislaufwirkungen
Nach einer Vorlage bei cvpharmacology.com
V1-Rezeptoren kontrahieren Blutgefäße
V2-Rezeptoren fördern die tubuläre Rückresorption von Wasser

Eine weitere Wirkung aktivierter V2-Rezeptoren ist eine bis zu 4-fache Erhöhung der Permeabilität für Harnstoff in den Sammelrohren des inneren Nierenmarks. Dies geschieht durch Aktivierung von Harnstofftransportern (VRUT: vasopressin-regulated urea transporter).
Außerdem erhöhen stimulierte V2-Rezeptoren den Natriumtransport (Resorption) im dicken aufsteigenden Schenkel der Henle-Schleife durch
 Aktivierung
und Translokation von Na/K/Cl-Symportern an / zu der apikalen
(luminalen) Membran der Tubulusepithelzellen (rascher Effekt), sowie
Aktivierung
und Translokation von Na/K/Cl-Symportern an / zu der apikalen
(luminalen) Membran der Tubulusepithelzellen (rascher Effekt), sowie
 deren Expression (länger anhaltender Effekt).
deren Expression (länger anhaltender Effekt).
Vasopressineffekte ergänzen sich gegenseitig:
Anstieg der Durchblutung im inneren Nierenmark (über V1-Rezeptoren),
erhöhte Resorption von Salz und Harnstoffresorption.
Die hohe
Osmolarität treibt die Resorption von Wasser an, ermöglicht durch die
apikale Membraneinlagerung sowie gesteigerte Expression von
Aquaporinkanälen in Sammelrohrzellen (beides wird über V2-Rezeptoren stimuliert) |
 Vasopressin (ADH, Adiuretin)
Vasopressin (ADH, Adiuretin)
Plasma > Serum
0,5-5 pM (1 pmol = 0,4 mU = 1,1 ng)
Abhängig von Plasma-Osmolalität: Bei ≤280 mosm/l unter 1,4 pM, über 280 mosm/l bis 5 pM
Alkohol-, Koffein-, Nikotinabstinenz für 48 Stunden vor der Abnahme
Blutabnahme im Liegen und in entspannter Situation
Bei aufrechter Körperlage und/oder Stresseinwirkung höhere Werte
Bei kardiovaskulären Reizen und insbesondere präkollaptisch steigen die Werte stark an (um ~1 Zehnerpotenz)

Vor allem hepatische und renale Peptidasen bauen das Hormon rasch ab
(biologische Halbwertszeit im Kreislauf 10-20 Minuten).
 Oxytocin
Oxytocin
 Mehr über Oxytocin und Lactation s. dort
Mehr über Oxytocin und Lactation s. dort
 Oxytocin wird im Hypothalamus gebildet und durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei ist es an ein Transportprotein
- Neurophysin I - gebunden; in den Vesikeln wird es dann vom Transporter enzymatisch entkoppelt.
Oxytocin wird im Hypothalamus gebildet und durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei ist es an ein Transportprotein
- Neurophysin I - gebunden; in den Vesikeln wird es dann vom Transporter enzymatisch entkoppelt.
Oxytocin wird im Hypothalamus gebildet
|
Auslösende Reize. Oxytocinproduzierende magnozelluläre Neurone im nucl. supraopticus und nucl. paraventricularis werden vom nucl. arcuatus, der lamina terminalis und dem nucl. tractus solitarii angeregt; sie setzen im Rahmen neurohumoraler Reflexe Oxytocin in die Blutbahn frei. Allgemein fördert Stress die Oxytocinausschüttung. Beim Geburtsvorgang löst Dehnung des
Geburtskanals (Uterus, Vagina; Ferguson-Reflex  )
Oxytocinfreisetzung aus, was die Wehentätigkeit unterstützt. Auch der
Koitus führt zu Oxytocinausschüttung, ferner Reize, welche eine
Vasopressinsekretion fördern. Östradiol stimuliert die Oxytocinfreisetzung, Relaxine hemmen sie.
)
Oxytocinfreisetzung aus, was die Wehentätigkeit unterstützt. Auch der
Koitus führt zu Oxytocinausschüttung, ferner Reize, welche eine
Vasopressinsekretion fördern. Östradiol stimuliert die Oxytocinfreisetzung, Relaxine hemmen sie.
Parvozelluläre oxytocinerge Neurone im nucl. paraventricularis projizieren in das limbische System.

Der Oxytocinrezeptor ist metabotrop, exprimiert von Zellen in Uterus und Brustdrüsen sowie von Nervenzellen im ZNS
 Die Gq-gekoppelten Oxytocinrezeptoren wirken über den PLC-IP3-Ca++-Weg und aktivieren spannungsabhängige Calciumkanäle. Uterus- und (gegen Ende der Schwangerschaft)
Brustdrüsenzellen exprimieren die Rezeptoren, die Hormonwirkung korreliert mit der
Rezeptorexpression (diese ist gegen Ende der Gravidität am höchsten).
Die Gq-gekoppelten Oxytocinrezeptoren wirken über den PLC-IP3-Ca++-Weg und aktivieren spannungsabhängige Calciumkanäle. Uterus- und (gegen Ende der Schwangerschaft)
Brustdrüsenzellen exprimieren die Rezeptoren, die Hormonwirkung korreliert mit der
Rezeptorexpression (diese ist gegen Ende der Gravidität am höchsten).
Östrogene steigern (sie fördern die Expression von Oxytocinrezeptoren), Progesteron senkt die Empfindlichkeit des Uterus (Myometrium) auf Oxytocin. In der zweiten Hälfte der
Schwangerschaft nimmt die Zahl der Oxytocinrezeptoren an den
Myometriumzellen 30-fach zu, die Sensitivität für Oxytocin steigt 8-fach
an.
Ob Oxytocin primär die Wehentätigkeit auslöst, ist umstritten; die Geburt
kann auch bei fehlender Oxytocinausschüttung normal ablaufen. Dehnung
der Zervix und Vaginalwand triggert jedenfalls die
Oxytocinausschüttung, das unterstützt den Geburtsvorgang
(selbstverstärkender neuroendokriner Reflex, also mit der
Charakteristik einer positiven Rückkopplung, bis eine maximale Anregung
erreicht - und das Baby geboren - ist).
Durch das Saugen des Babys an der Brustwarze reflektorisch freigesetztes Oxytocin regt innerhalb von einer Minute über Kontraktion myoepithelialet Zellen in
der Brustdrüse die Sekretion bereits gebildeter Milch an (Stillreflex, letdown reflex - ein neuroendokriner Reflex).
Stillen regt die Ausschüttung von Oxytozin stark an (galactokinetischer Effekt) und kann auch Krämpfe im Uterus auslösen, dessen Rückbildung durch Oxytocin gefördert wird.
Oxytocin regt die Wehentätigkeit an
Stillen (Oxytocinwirkung) begünstigt die postpartale Rückbildung des Uterus
|
Im Gehirn finden sich Oxytocinrezeptoren besonders im limbischen System
und im Hirnstamm. Hier bewirkt Oxytocin Verhaltensweisen wie gesteigerte Empathie, erhöhtes Vertrauen, Partnerbindung, Kontaktfreudigkeit,
Wohlgefühl, Angstreduktion, romantische Empfindungen, sexuelles Interesse (sexuelle Aktivität steigert die Oxytocinproduktion), auch elterliches Verhalten. Außerdem begünstigt Oxytocin die Bewegung der Spermatozoen im
weiblichen Genitaltrakt.
 Erhöhte Oxytocinproduktion senkt die Freisetzung von GnRH aus dem
Hypothalamus und kann so - in der Stillperiode - den menstruellen
Zyklus unterbrechen. Eine verlässliche empfängnisverhütende Wirkung ist
dadurch nicht gegeben; insbesondere bei längerem Stillen kehren die
Zyklen wieder zurück.
Erhöhte Oxytocinproduktion senkt die Freisetzung von GnRH aus dem
Hypothalamus und kann so - in der Stillperiode - den menstruellen
Zyklus unterbrechen. Eine verlässliche empfängnisverhütende Wirkung ist
dadurch nicht gegeben; insbesondere bei längerem Stillen kehren die
Zyklen wieder zurück.
Die Oxytocinfreisetzung steht unter dem Einfluss versxhiedener
psychischer Faktoren. Sie wird nicht nur durch den Saugreiz des
Neugeborenen an der Brustwarze angeregt, sondernb auch durch andere
Faktoren, z.B. der Anblick eines Babys oder die Geräusche, die ein
solches mach. Umgekehrt wird die Oxytocinsekretion durch
Stresseinfluss, Amgst oder Wut gehemmt. Oxytocin kann die
Blut-Hirn-Schranke nicht überwinden. Freigesetzt wird es vorwiegend im limbischen System sowie im Hypophysenhinterlappen (von wo es in den Kreislauf gelangt).
Neue Befunde legen weiters eine schmerzhemmende
Wirkung des Oxytozins nahe; die Wirkung wird über einen modifizierenden Einfluss auf die GABA-erge
Hemmung der Schmerzübertragung im Hinterhorn des Rückenmarks erklärt.
Auch die Wundheilung scheint durch
Oxytocin (über geänderte Zytokinausschüttung) beschleunigt zu werden.
 Abbau und Ausscheidung erfolgen, ähnlich wie bei Vasopressin, über
Leber und Nieren. Zusätzlich bilden Plazenta und vermutlich Uterus eine Peptidase
(Oxytocinase), die bei Schwangeren Oxytoin inaktiviert. Die
biologische Halbwertszeit des Oxytocins beträgt nur wenige Minuten.
Abbau und Ausscheidung erfolgen, ähnlich wie bei Vasopressin, über
Leber und Nieren. Zusätzlich bilden Plazenta und vermutlich Uterus eine Peptidase
(Oxytocinase), die bei Schwangeren Oxytoin inaktiviert. Die
biologische Halbwertszeit des Oxytocins beträgt nur wenige Minuten.
 Oxytocin
Oxytocin
Ruhewerte im Serum ~10-20 pM
Bei spezieller Stimulation (Stillen, soziale Interaktion u.ä.) Werte bis zu
mehreren hundert pM (pulsatile Ausschüttung)
Biologische
Halbwertszeit 1-5 / ~13 min (je nach Quelle und Methode)



 Neurosekretorische Zellen befinden sich vor allem im Hypothalamus und
setzen im Rahmen regulatorischer Vorgänge Neurohormone frei (GnRH, CRH,
TRH, GH, Vasopressin, Oxytocin) - in das Blut (endokrin) oder in
umliegendes Gewebe bzw. den liquor cerebrospinalis (parakrin). Die
Aktionspotentialfrequenz entscheidet über die Art der exozytierten
Speichervesikel und damit über die Art des freigesetzten Stoffes.
Neurotransmitter diffundieren höchstens ~50 µm bis zu ihrer
Inaktivierung; Neuropeptide kommen mehr als 1000 µm weit und haben
längere Verweildauer im Extrazellulärraum. Neurosekretorische Zellen
erhalten multiple sensorische, zirkadiane und limbische Eingänge und
stehen unter dem Einfluss von Glutamat, GABA, Kisspeptin, Opioiden,
Dopamin, Noradrenalin, Serotonin Neurosekretorische Zellen befinden sich vor allem im Hypothalamus und
setzen im Rahmen regulatorischer Vorgänge Neurohormone frei (GnRH, CRH,
TRH, GH, Vasopressin, Oxytocin) - in das Blut (endokrin) oder in
umliegendes Gewebe bzw. den liquor cerebrospinalis (parakrin). Die
Aktionspotentialfrequenz entscheidet über die Art der exozytierten
Speichervesikel und damit über die Art des freigesetzten Stoffes.
Neurotransmitter diffundieren höchstens ~50 µm bis zu ihrer
Inaktivierung; Neuropeptide kommen mehr als 1000 µm weit und haben
längere Verweildauer im Extrazellulärraum. Neurosekretorische Zellen
erhalten multiple sensorische, zirkadiane und limbische Eingänge und
stehen unter dem Einfluss von Glutamat, GABA, Kisspeptin, Opioiden,
Dopamin, Noradrenalin, Serotonin
 Neurosekretorische Aktivität findet sich im Körper an mehreren Stellen:
Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei
(Hypophysenhinterlappen); parvozelluläre Liberine /
Inhibine (eminentia mediana); postganglionäre sympathische Zellen
Adrenalin (Nebennierenmark); Pinealozyten Melatonin (Epiphyse). Die
Freisetzung der Neurohormone erfolgt pulsatil und abhängig von
Tageszeit, Stoffwechselzustand, Stress u.a.
Neurosekretorische Aktivität findet sich im Körper an mehreren Stellen:
Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei
(Hypophysenhinterlappen); parvozelluläre Liberine /
Inhibine (eminentia mediana); postganglionäre sympathische Zellen
Adrenalin (Nebennierenmark); Pinealozyten Melatonin (Epiphyse). Die
Freisetzung der Neurohormone erfolgt pulsatil und abhängig von
Tageszeit, Stoffwechselzustand, Stress u.a.
 Der Hypophysenvorderlappen bildet trope Hormone - somatotrop (GH) und
glandotrop (ACTH, TSH, FSH, LH, Prolactin) -, diese steuern Wachstum
und Entwicklung des Körpers und die Freisetzung von Glucocorticoiden,
Schilddrüsenhormonen, Geschlechtshormonen. Die Hormonfreisetzung steht unter Einwirkung
hypothalamischer Faktoren (Liberine, Statine); sowohl
Hypothalamus als auch Hypophyse unterliegen (meist negativ) rückkoppelnden Wirkungen
peripherer Hormone. Der Zwischenlappen bildet
Melanotropine. Der Hinterlappen speichert Hormone, die durch
neurohumorale Reflexe freigesetzt werden (Vasopressin: Blutdruckabfall
oder Wassermangel, Oxytocin: Dehnung des Geburtskanals, Saugreiz an der
Brustwarze) Der Hypophysenvorderlappen bildet trope Hormone - somatotrop (GH) und
glandotrop (ACTH, TSH, FSH, LH, Prolactin) -, diese steuern Wachstum
und Entwicklung des Körpers und die Freisetzung von Glucocorticoiden,
Schilddrüsenhormonen, Geschlechtshormonen. Die Hormonfreisetzung steht unter Einwirkung
hypothalamischer Faktoren (Liberine, Statine); sowohl
Hypothalamus als auch Hypophyse unterliegen (meist negativ) rückkoppelnden Wirkungen
peripherer Hormone. Der Zwischenlappen bildet
Melanotropine. Der Hinterlappen speichert Hormone, die durch
neurohumorale Reflexe freigesetzt werden (Vasopressin: Blutdruckabfall
oder Wassermangel, Oxytocin: Dehnung des Geburtskanals, Saugreiz an der
Brustwarze)
 Sowohl zwischen Immun- und endokrinem System (ACTH, β-Endorphine;
Interleukine, Interferone, TNF-α) als auch zwischen endokrinem und
Zentralnervensystem gibt es wechselseitige Beeinflussung (CRH, ACTH,
β-Endorphine). Immunzellen haben Rezeptoren für GH, ACTH, Prolactin;
Zytokine beeinflussen die Sekretion von Vorderlappenhormonen Sowohl zwischen Immun- und endokrinem System (ACTH, β-Endorphine;
Interleukine, Interferone, TNF-α) als auch zwischen endokrinem und
Zentralnervensystem gibt es wechselseitige Beeinflussung (CRH, ACTH,
β-Endorphine). Immunzellen haben Rezeptoren für GH, ACTH, Prolactin;
Zytokine beeinflussen die Sekretion von Vorderlappenhormonen
 Der Hypothalamus wird von übergeordneten Zentren (Kortex, limbisches
System, Thalamus) und der Peripherie beeinflusst (Hormonrezeptoren,
Osmorezeptoren, thermosensitive Zellen, metabolische Rezeptoren).
Efferenzen aus dem Hypothalamus sind hormoneller und neuronaler Natur.
Kleinzellige Neurone des medialen Hypothalamus bilden Liberine und
Statine, großzellige (nucl. supraopticus und paraventricularis) bilden
Vasopressin und Oxytocin (Unterschied: 2 Aminosäuren), die im
Hinterlappen zwischengespeichert werden können. Auf dem Weg dorthin
fungieren Neurophysin I als Transporter des Oxytocins, Neurophysin II
des Vasopressins
Der Hypothalamus wird von übergeordneten Zentren (Kortex, limbisches
System, Thalamus) und der Peripherie beeinflusst (Hormonrezeptoren,
Osmorezeptoren, thermosensitive Zellen, metabolische Rezeptoren).
Efferenzen aus dem Hypothalamus sind hormoneller und neuronaler Natur.
Kleinzellige Neurone des medialen Hypothalamus bilden Liberine und
Statine, großzellige (nucl. supraopticus und paraventricularis) bilden
Vasopressin und Oxytocin (Unterschied: 2 Aminosäuren), die im
Hinterlappen zwischengespeichert werden können. Auf dem Weg dorthin
fungieren Neurophysin I als Transporter des Oxytocins, Neurophysin II
des Vasopressins
 Vasopressin (AVP - Arginin-Vasopressin, ADH - antidiuretisches Hormon,
Adiuretin) wirkt als "Wassersparhormon" (Rückresorption von ~20 l/d,
sonst Diabetes insipidus) über die Expression des
Na/K/2Cl--Kotransporters im dicken aufsteigenden Schenkel der
Henle-Schleife sowie die Einlagerung von Aquaporinen in spätdistale
Nierentubuli. Vasopressin ist ein zentraler Player für die Regulation
von Osmolarität, Volumen- und Kreislauffunktion und wirkt direkt
vasokonstriktorisch (blutdrucksteigernd). Es wird in verschiedenen
Belastungssituationen, bei Schmerz, Blutdruckabfall, Volumenmangel oder
erhöhter Serumosmolarität freigesetzt. Es gibt verschiedene
Vasopressinrezeptoren: V2 (antidiuretisch, erhöhte
Harnstoffpermeabilität)
sprechen schon bei niedrigeren Konzentrationen an als V1
(vasokonstriktorisch). Die Vasopressineffekte ergänzen einander
gegenseitig
Vasopressin (AVP - Arginin-Vasopressin, ADH - antidiuretisches Hormon,
Adiuretin) wirkt als "Wassersparhormon" (Rückresorption von ~20 l/d,
sonst Diabetes insipidus) über die Expression des
Na/K/2Cl--Kotransporters im dicken aufsteigenden Schenkel der
Henle-Schleife sowie die Einlagerung von Aquaporinen in spätdistale
Nierentubuli. Vasopressin ist ein zentraler Player für die Regulation
von Osmolarität, Volumen- und Kreislauffunktion und wirkt direkt
vasokonstriktorisch (blutdrucksteigernd). Es wird in verschiedenen
Belastungssituationen, bei Schmerz, Blutdruckabfall, Volumenmangel oder
erhöhter Serumosmolarität freigesetzt. Es gibt verschiedene
Vasopressinrezeptoren: V2 (antidiuretisch, erhöhte
Harnstoffpermeabilität)
sprechen schon bei niedrigeren Konzentrationen an als V1
(vasokonstriktorisch). Die Vasopressineffekte ergänzen einander
gegenseitig
 Oxytocin hat wehen- (Ferguson-Reflex) und lactationsfördernde Wirkung
und ist auch als "Kuschelhormon" bekannt. Östrogene steigern
(Expression von Oxytocinrezeptoren), Progesteron senkt die
Oxytocin-Empfindlichkeit des Myometriums. In der zweiten Hälfte der
Schwangerschaft nimmt die Zahl der Oxytocinrezeptoren an den
Myometriumzellen 30-fach zu, die Sensitivität für Oxytocin 8-fach. Stillen begünstigt die postpartale Rückbildung des Uterus
(Stillreflex). Limbisches System und Hirnstamm sind reich an
Oxytocinrezeptoren (Empathie, Vertrauen,
Kontaktfreudigkeit, Angstreduktion, sexuelles Interesse,
elterliches Verhalten) Oxytocin hat wehen- (Ferguson-Reflex) und lactationsfördernde Wirkung
und ist auch als "Kuschelhormon" bekannt. Östrogene steigern
(Expression von Oxytocinrezeptoren), Progesteron senkt die
Oxytocin-Empfindlichkeit des Myometriums. In der zweiten Hälfte der
Schwangerschaft nimmt die Zahl der Oxytocinrezeptoren an den
Myometriumzellen 30-fach zu, die Sensitivität für Oxytocin 8-fach. Stillen begünstigt die postpartale Rückbildung des Uterus
(Stillreflex). Limbisches System und Hirnstamm sind reich an
Oxytocinrezeptoren (Empathie, Vertrauen,
Kontaktfreudigkeit, Angstreduktion, sexuelles Interesse,
elterliches Verhalten)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.



 Adenohypophyse: αδένας = Drüse
Adenohypophyse: αδένας = Drüse Faktoren der Hormonproduktion
Faktoren der Hormonproduktion  Hypophysenvorder-, Zwischen-, Hinterlappen
Hypophysenvorder-, Zwischen-, Hinterlappen  Vorderlappenhormone
Vorderlappenhormone  Hypothalamische Kerne
Hypothalamische Kerne  Hypophysenhinterlappen
Hypophysenhinterlappen
 Core messages
Core messages Neuropeptide
Neuropeptide
 Abbildung: Hypothalamus und Hypophyse
Abbildung: Hypothalamus und Hypophyse
 hat zahlreiche Funktionen:
hat zahlreiche Funktionen: Autonome Reaktionen auf Belastung / Stress (Vasokonstriktion, Tachykardie, Blutdruckerhöhung; Hyperglykämie; Proteinabbau; Hypokaliämie; Hypervolämie u.a.)
Autonome Reaktionen auf Belastung / Stress (Vasokonstriktion, Tachykardie, Blutdruckerhöhung; Hyperglykämie; Proteinabbau; Hypokaliämie; Hypervolämie u.a.) Einstellung des Energiegleichgewichts, Thermoregulation
Einstellung des Energiegleichgewichts, Thermoregulation Hunger (metabolisches Gleichgewicht) und Durst (Trinkverhalten, Osmo- und Volumenregulation)
Hunger (metabolisches Gleichgewicht) und Durst (Trinkverhalten, Osmo- und Volumenregulation) Schlaf-Wach-Zyklen
Schlaf-Wach-Zyklen Endokrine Steuerfunktion (Hypophyse)
Endokrine Steuerfunktion (Hypophyse) Verhalten (einschließlich Sexualverhalten)
Verhalten (einschließlich Sexualverhalten)

 Abbildung: Hypothalamisch- hypophysäres System
Abbildung: Hypothalamisch- hypophysäres System Zu hypothalamischen Kernen s. auch dort , zum nucl. arcuatus s. auch dort
Zu hypothalamischen Kernen s. auch dort , zum nucl. arcuatus s. auch dort
 Abbildung) - modifizierten Neuronen, welche auf neuronale, u.a.
reflexbedingte Reize hin (gelegentlich nach zwischenzeitlicher
intrazellulärer Speicherung) "ihre" Signalsubstanz an den
Extrazellulärraum abgeben, hier entweder parakrin wirken oder mit der
Blutbahn weitergetragen werden (dadurch werden sie definitionsgemäß zu
"Hormonen"). Neurohormone sind GnRH, CRH, TRH und Somatostatin (
Abbildung) - modifizierten Neuronen, welche auf neuronale, u.a.
reflexbedingte Reize hin (gelegentlich nach zwischenzeitlicher
intrazellulärer Speicherung) "ihre" Signalsubstanz an den
Extrazellulärraum abgeben, hier entweder parakrin wirken oder mit der
Blutbahn weitergetragen werden (dadurch werden sie definitionsgemäß zu
"Hormonen"). Neurohormone sind GnRH, CRH, TRH und Somatostatin ( s. dort), sowie Vasopressin und Oxytocin.
s. dort), sowie Vasopressin und Oxytocin. Die Neuriten neuroendokriner (neurosekretorischer) Zellen - also von Nervenzellen,
die Neurohormone sezernieren - enden oft in der unmittelbaren Nähe von
Blutkapillaren. So gelangen die Neurohormone zügig in den Kreislauf.
Die Neuriten neuroendokriner (neurosekretorischer) Zellen - also von Nervenzellen,
die Neurohormone sezernieren - enden oft in der unmittelbaren Nähe von
Blutkapillaren. So gelangen die Neurohormone zügig in den Kreislauf.  Der magnozelluläre neuroendokrine
Abschnitt besitzt zwei Neuronenpools: Der eine bildet Vasopressin, der
andere Oxytocin (wie im nucleus supraopticus). Dieses sind die
"Hinterlappenhormone", sie wandern über die Axone (die den tractus hypothalamo-hypophysialis aufbauen) zur Neurohypophyse und werden dort je nach Bedarf in den Kreislauf abgegeben.
Der magnozelluläre neuroendokrine
Abschnitt besitzt zwei Neuronenpools: Der eine bildet Vasopressin, der
andere Oxytocin (wie im nucleus supraopticus). Dieses sind die
"Hinterlappenhormone", sie wandern über die Axone (die den tractus hypothalamo-hypophysialis aufbauen) zur Neurohypophyse und werden dort je nach Bedarf in den Kreislauf abgegeben. Der parvozelluläre neuroendokrine Abschnitt produziert
TRH, CRH und Somatostatin (sowie GIH: growth-hormone inhibiting
hormone) - ebenfalls in separaten (spezialisierten) Zellen, deren Axone
in der eminentia mediana enden und ihr Peptid an den
hypothalamisch-hypophysären Pfortaderkreislauf abgeben.
Der parvozelluläre neuroendokrine Abschnitt produziert
TRH, CRH und Somatostatin (sowie GIH: growth-hormone inhibiting
hormone) - ebenfalls in separaten (spezialisierten) Zellen, deren Axone
in der eminentia mediana enden und ihr Peptid an den
hypothalamisch-hypophysären Pfortaderkreislauf abgeben. Der deszendierende Abschnitt des nucl. paraventrivularis hat wiederum drei Abschnitte (dorsal, lateral, ventral), deren Nervenzellen Axone das zentrale autonome Netzwerk, die Marginalzone (lamina I) des Hinterhorns / Trigeminuskerns, das zentrale Höhlengrau sowie die formatio reticularis kontaktieren.
Der deszendierende Abschnitt des nucl. paraventrivularis hat wiederum drei Abschnitte (dorsal, lateral, ventral), deren Nervenzellen Axone das zentrale autonome Netzwerk, die Marginalzone (lamina I) des Hinterhorns / Trigeminuskerns, das zentrale Höhlengrau sowie die formatio reticularis kontaktieren.  Entladungscharakteristik: Die präsynaptischen Entladungsfrequenzen liegen höher als die zur Freisetzung von Transmittern (impulse trains). So kann an derselben Synapse
Entladungscharakteristik: Die präsynaptischen Entladungsfrequenzen liegen höher als die zur Freisetzung von Transmittern (impulse trains). So kann an derselben Synapse  durch niedrigfrequente Entladung aus kleinen Vesikeln ein exzitatorischer Transmitter,
durch niedrigfrequente Entladung aus kleinen Vesikeln ein exzitatorischer Transmitter,  durch hochfrequente hingegen aus großen Vesikeln ein inhibitorisches
Neuropeptid freigesetzt werden;
durch hochfrequente hingegen aus großen Vesikeln ein inhibitorisches
Neuropeptid freigesetzt werden; 
 Synaptische Charakteristika: Die Moleküle sind groß, ihre Konzentration im synaptischen Spalt geringer als bei Neurotransmittern; als komplexe Moleküle übermitteln sie eine höhere Informationsdichte, die Selektivität ist größer; ihre Rezeptoren finden sich postsynaptisch auch außerhalb der Synapse, die Bindungsaffinität ist höher
Synaptische Charakteristika: Die Moleküle sind groß, ihre Konzentration im synaptischen Spalt geringer als bei Neurotransmittern; als komplexe Moleküle übermitteln sie eine höhere Informationsdichte, die Selektivität ist größer; ihre Rezeptoren finden sich postsynaptisch auch außerhalb der Synapse, die Bindungsaffinität ist höher Diffusionsstrecken: Neurotransmitter
diffundieren nach ihrer Freisetzung höchstens ~50 µm weit, bevor sie
einerseits wiederaufgenommen, andererseits abgebaut werden. Neuropeptide
hingegen können über Strecken von mehr als 1000 µm diffundieren; sie haben eine entsprechend längere Verweildauer im
Extrazellulärraum. Der Neurotransmitter wird nicht gleich wiederaufgenommen, sondern bleibt relativ lange bioaktiv.
Diffusionsstrecken: Neurotransmitter
diffundieren nach ihrer Freisetzung höchstens ~50 µm weit, bevor sie
einerseits wiederaufgenommen, andererseits abgebaut werden. Neuropeptide
hingegen können über Strecken von mehr als 1000 µm diffundieren; sie haben eine entsprechend längere Verweildauer im
Extrazellulärraum. Der Neurotransmitter wird nicht gleich wiederaufgenommen, sondern bleibt relativ lange bioaktiv.
 Abbildung).
Abbildung). 
 Abbildung: LH-Spiegel im Blut als Funktion elektrischer Entladungsmuster hypothalamischer Zellen
Abbildung: LH-Spiegel im Blut als Funktion elektrischer Entladungsmuster hypothalamischer Zellen
 , Opioide, Dopamin, Noradrenalin,
Serotonin.
, Opioide, Dopamin, Noradrenalin,
Serotonin.
 Exterozeptoren: Fühlen, Temperatur, Schmerz, Sehen, Hören, Riechen, Schmecken
Exterozeptoren: Fühlen, Temperatur, Schmerz, Sehen, Hören, Riechen, Schmecken Enterozeptoren: Volumen-, Baro-, Chemo-, Osmo-, Glucorezeptoren)
Enterozeptoren: Volumen-, Baro-, Chemo-, Osmo-, Glucorezeptoren) Abbildung oben).
Abbildung oben). 
 Abbildung: Wirkungskaskade neurosekretorischer Zellen
Abbildung: Wirkungskaskade neurosekretorischer Zellen
 ) steuert es zusammen mit Neurokinin B und Dynorphinen die Freisetzung von GnRH-"Pulsen" (
) steuert es zusammen mit Neurokinin B und Dynorphinen die Freisetzung von GnRH-"Pulsen" ( Abbildung) und hat vermutlich altersabhängige Wirkungen (es beteiligt sich an der
pubertären Umstellung auf den adulten Sekretionsmodus). Kisspeptin scheint weiters sexuelle Bindungen zu beeinflussen.
Abbildung) und hat vermutlich altersabhängige Wirkungen (es beteiligt sich an der
pubertären Umstellung auf den adulten Sekretionsmodus). Kisspeptin scheint weiters sexuelle Bindungen zu beeinflussen. ). Diese bildet vor allem "trope"
(auf etwas gerichtet, gemeint sind periphere
Hormondrüsen) Hormone (Tropine), sie steht unter dem steuernden
Einfluss des Hypothalamus.
). Diese bildet vor allem "trope"
(auf etwas gerichtet, gemeint sind periphere
Hormondrüsen) Hormone (Tropine), sie steht unter dem steuernden
Einfluss des Hypothalamus. 
 Abbildung):
Abbildung): Axosomatische synaptische Einflüsse auf hypothalamisch-neurosekretorische Zellen können direkt (z.B. durch Kisspeptin) oder indirekt
erfolgen (z.B. wirken auf somatisch-afferente Neurone ihrerseits
fördernde (z.B. noradrenerge) und hemmende (z.B. GABAerge) Zellen ein
Axosomatische synaptische Einflüsse auf hypothalamisch-neurosekretorische Zellen können direkt (z.B. durch Kisspeptin) oder indirekt
erfolgen (z.B. wirken auf somatisch-afferente Neurone ihrerseits
fördernde (z.B. noradrenerge) und hemmende (z.B. GABAerge) Zellen ein Opioiderge hemmende Afferenzen wirken axoaxonal (präsynaptisch) auf hypothalamisch-neurosekretorische Zellen
Opioiderge hemmende Afferenzen wirken axoaxonal (präsynaptisch) auf hypothalamisch-neurosekretorische Zellen Dopaminerge Neuronen sezernieren ihren Transmitter direkt in Pfortadergefäße der eminentia mediana (Hemmung der Prolactinfreisetzung im Vorderlappen)
Dopaminerge Neuronen sezernieren ihren Transmitter direkt in Pfortadergefäße der eminentia mediana (Hemmung der Prolactinfreisetzung im Vorderlappen)
 Abbildung:
Magnozelluläre und parvozelluläre Projektionen: Beispiel Oxytocin
Abbildung:
Magnozelluläre und parvozelluläre Projektionen: Beispiel Oxytocin
 Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei (Hypophysenhinterlappen,
Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei (Hypophysenhinterlappen,  Abbildung)
Abbildung) Parvozelluläre Neurone setzen Liberine / Inhibine frei (eminentia mediana) und projizieren auf den nucleus accumbens
Parvozelluläre Neurone setzen Liberine / Inhibine frei (eminentia mediana) und projizieren auf den nucleus accumbens Postganglionäre sympathische Zellen setzen Adrenalin frei (Nebennierenmark)
Postganglionäre sympathische Zellen setzen Adrenalin frei (Nebennierenmark) Pinealozyten setzen (auf adrenerge Impulse hin) Melatonin frei (Epiphyse)
Pinealozyten setzen (auf adrenerge Impulse hin) Melatonin frei (Epiphyse) Einige hypothalamische Hormone sind multifunktional,
d.h. sie richten sich an mehrere "Adressaten" - beispielsweise fördert
TRH nicht nur die TSH-, sondern auch Prolactinausschüttung; GnRH
stimuliert sowohl die LH- als auch FSH-Produktion; Somatostatin hemmt
nicht nur die GH-, sondern auch die TSH-Sekretion; Dopamin hemmt neben
der Freisetzung von Prolactin auch die von TSH und α-MSH.
Einige hypothalamische Hormone sind multifunktional,
d.h. sie richten sich an mehrere "Adressaten" - beispielsweise fördert
TRH nicht nur die TSH-, sondern auch Prolactinausschüttung; GnRH
stimuliert sowohl die LH- als auch FSH-Produktion; Somatostatin hemmt
nicht nur die GH-, sondern auch die TSH-Sekretion; Dopamin hemmt neben
der Freisetzung von Prolactin auch die von TSH und α-MSH. Hypophysenhormone können als Neuromodulatoren
auf den Hypothalamus rückwirken. Dazu gibt es verschiedene Wege:
Hinterlappenhormone können über retrograden axonalen Transport zum
Hypothalamus gelangen; Vorderlappenhormone können das auf dem Blutweg -
direkt über lokale Pfortaderäste, oder über den systemischen Kreislauf.
Hypophysenhormone können als Neuromodulatoren
auf den Hypothalamus rückwirken. Dazu gibt es verschiedene Wege:
Hinterlappenhormone können über retrograden axonalen Transport zum
Hypothalamus gelangen; Vorderlappenhormone können das auf dem Blutweg -
direkt über lokale Pfortaderäste, oder über den systemischen Kreislauf. Nicht alle hypothalamischen Hormone werden in den Pfortaderkreislauf
sezerniert; sie können auch an anderen Stellen als Neuromodulatorern
wirken und dort Transmitterfreisetzung und Verhalten beeinflussen. So wirkt z.B. im Gehirn freigesetztes GnRH auf das Sexualverhalten.
Nicht alle hypothalamischen Hormone werden in den Pfortaderkreislauf
sezerniert; sie können auch an anderen Stellen als Neuromodulatorern
wirken und dort Transmitterfreisetzung und Verhalten beeinflussen. So wirkt z.B. im Gehirn freigesetztes GnRH auf das Sexualverhalten. Die Freisetzung hypophysärer Hormone steht auch unter dem Einfluss verschiedener Neurotransmitter und Neuropeptide (z.B. GABA, VIP, Enkephaline, Substanz P). Hypophysenzellen verfügen über entsprechende Rezeptoren.
Die Freisetzung hypophysärer Hormone steht auch unter dem Einfluss verschiedener Neurotransmitter und Neuropeptide (z.B. GABA, VIP, Enkephaline, Substanz P). Hypophysenzellen verfügen über entsprechende Rezeptoren. (Vorder- und Zwischenlappen), die durch Auswachsen der endodermalen Rachentasche (Rathke'sche Tasche
(Vorder- und Zwischenlappen), die durch Auswachsen der endodermalen Rachentasche (Rathke'sche Tasche  ) entsteht, und der Neurohypophyse:
) entsteht, und der Neurohypophyse: Der Vorderlappen
(HVL) bildet trope Hormone (von τρεπω
= auf etwas gerichtet sein - nicht "troph", wie in vielen (vor allem
amerikanischen) Büchern fälschlich steht - "troph" steht für τροφή =
Ernährung, z.B. atroph, hypertroph).
Der Vorderlappen
(HVL) bildet trope Hormone (von τρεπω
= auf etwas gerichtet sein - nicht "troph", wie in vielen (vor allem
amerikanischen) Büchern fälschlich steht - "troph" steht für τροφή =
Ernährung, z.B. atroph, hypertroph).  (ACTH, TSH, FSH, LH, Prolactin), sie steuern die Hormonfreisetzung peripherer Drüsen (Glucocorticoide,
Schilddrüsenhormone, Geschlechtshormone), Ovulation und Spermatogenese,
Wachstum und Brustdrüsenentwicklung.
Melatotropine (MSH) und ACTH stammen vom selben Vorläufermolekül - Pro-opiomelanocortin (POMC) - ab (
(ACTH, TSH, FSH, LH, Prolactin), sie steuern die Hormonfreisetzung peripherer Drüsen (Glucocorticoide,
Schilddrüsenhormone, Geschlechtshormone), Ovulation und Spermatogenese,
Wachstum und Brustdrüsenentwicklung.
Melatotropine (MSH) und ACTH stammen vom selben Vorläufermolekül - Pro-opiomelanocortin (POMC) - ab ( Abbildung):
Abbildung):
 Abbildung: Was aus POMC entsteht
Abbildung: Was aus POMC entsteht
 Der Zwischenlappen bildet Melanotropine = Melanozyten-stimulierende Hormone (MSH, Intermedine),
Peptidhormone, welche auf Melanozyten wirken und die Pigmentierung
erhöhen. Man kennt α-MSH (verantwortlich für die Pigmentierung von Haut und Haaren, Wirkung über den Melanocortinrezeptor MC1), β-MSH und γ-MSH (wirken an MC1-, MC3-, MC4- und MC5-Rezeptoren).
Der Zwischenlappen bildet Melanotropine = Melanozyten-stimulierende Hormone (MSH, Intermedine),
Peptidhormone, welche auf Melanozyten wirken und die Pigmentierung
erhöhen. Man kennt α-MSH (verantwortlich für die Pigmentierung von Haut und Haaren, Wirkung über den Melanocortinrezeptor MC1), β-MSH und γ-MSH (wirken an MC1-, MC3-, MC4- und MC5-Rezeptoren). Die gemeinsame Sekretion von ACTH uns ß-Endorphin kann vorteilhaft
sein, wenn physischer Stress durch eine Verletzung auftritt -
ß-Endorphin ist ein Opioid und kann zur Schmerzlinderung beitragen.
Die gemeinsame Sekretion von ACTH uns ß-Endorphin kann vorteilhaft
sein, wenn physischer Stress durch eine Verletzung auftritt -
ß-Endorphin ist ein Opioid und kann zur Schmerzlinderung beitragen. Der Hinterlappen
(HHL) entsteht aus dem neuralen Ektoderm. Fasern aus dem nucl.
supraopticus und paraventricularis setzen Vasopressin (=ADH) und Oxytocin
frei (Abbildung). Dazu müssen diese Kerne im Rahmen entsprechender
Regelungsvorgänge angeregt werden, z.B. durch Blutdruckabfall oder
Wassermangel (ADH) oder Saugreiz an der Brustwarze (Oxytocin).
Der Hinterlappen
(HHL) entsteht aus dem neuralen Ektoderm. Fasern aus dem nucl.
supraopticus und paraventricularis setzen Vasopressin (=ADH) und Oxytocin
frei (Abbildung). Dazu müssen diese Kerne im Rahmen entsprechender
Regelungsvorgänge angeregt werden, z.B. durch Blutdruckabfall oder
Wassermangel (ADH) oder Saugreiz an der Brustwarze (Oxytocin).
 Abbildung: Hypothalamisch-hypophysäres System
Abbildung: Hypothalamisch-hypophysäres System
 Abbildung) und abhängig von biologischen Rhythmen. Die pulsatile Freisetzung
gewährleistet Wirksamkeit: Kontinuierliche Ausschüttung würde durch
Rezeptor-Endozytose (Herunterregulierung) die Zielzellen refraktär
gegenüber dem Hormon machen.
Abbildung) und abhängig von biologischen Rhythmen. Die pulsatile Freisetzung
gewährleistet Wirksamkeit: Kontinuierliche Ausschüttung würde durch
Rezeptor-Endozytose (Herunterregulierung) die Zielzellen refraktär
gegenüber dem Hormon machen. Bei Hypophyseninsuffizienz (z.B. Sheehan-Syndrom:
Bei Hypophyseninsuffizienz (z.B. Sheehan-Syndrom:  Defekt des mütterlichen Hypophysenvorderlappens infolge postpartaler Perfusionsminderung) werden trope Hormone diskontinuierlich infundiert (was ja die Hypophyse physiologischerweise tut), da sie sonst ihre Wirksamkeit verlieren (Rezeptor-downregulation).
Defekt des mütterlichen Hypophysenvorderlappens infolge postpartaler Perfusionsminderung) werden trope Hormone diskontinuierlich infundiert (was ja die Hypophyse physiologischerweise tut), da sie sonst ihre Wirksamkeit verlieren (Rezeptor-downregulation).
 Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem
Abbildung: Signalstoffe zur Interaktion zwischen endokrinem, Immun- und Nervensystem
 Abbildung). Daraus ergibt sich ein
komplexes Feedback-System zwischen hormoneller und immunologischer
Kontrolle.
Abbildung). Daraus ergibt sich ein
komplexes Feedback-System zwischen hormoneller und immunologischer
Kontrolle. ACTH und α-MSH sind Abkömmlinge des POMC.
ACTH und α-MSH sind Abkömmlinge des POMC. Zu den somatotropen Hormonen zählt man GH und Prolactin (und plazentares Lactogen) - sie wirken über Mitglieder der Zytokinrezeptor-Familie.
Zu den somatotropen Hormonen zählt man GH und Prolactin (und plazentares Lactogen) - sie wirken über Mitglieder der Zytokinrezeptor-Familie. TSH, LH, FSH und hCG sind glykosylierte Proteine.
TSH, LH, FSH und hCG sind glykosylierte Proteine.
 Abbildung: Hypothalamus und Hypophyse (Vorder- und Hinterlappen)
Abbildung: Hypothalamus und Hypophyse (Vorder- und Hinterlappen)
 ACTH
ACTH  TSH
TSH  Prolactin
Prolactin  Gonadotropine
Gonadotropine
 Abbildung: Pulsatile Freisetzung des Wachstumshormons
Abbildung: Pulsatile Freisetzung des Wachstumshormons  vgl. dort
vgl. dort

 Abbildung: Steuerung und Wirkung von Wachstumshormon
Abbildung: Steuerung und Wirkung von Wachstumshormon
 Abbildung): GHRH fördert, Somatostatin hemmt die
Freisetzung von GH aus dem Hypophysenvorderlappen. Zusätzlich hemmen
sowohl Somatostatin als auch GH die GHRH-Sekretion, und zahlreiche
weitere Faktoren (Metabolite, Neurotransmitter, Medikamente)
beeinflussen diesen komplexen Steuerungsmechanismus.
Abbildung): GHRH fördert, Somatostatin hemmt die
Freisetzung von GH aus dem Hypophysenvorderlappen. Zusätzlich hemmen
sowohl Somatostatin als auch GH die GHRH-Sekretion, und zahlreiche
weitere Faktoren (Metabolite, Neurotransmitter, Medikamente)
beeinflussen diesen komplexen Steuerungsmechanismus. Abbildung).
Abbildung).
 Abbildung: TRH steuert die Schilddrüsenfunktion
Abbildung: TRH steuert die Schilddrüsenfunktion sind ependymale Gliazellen am Boden der eminentia mediana. Sie beeinflussen u.a. die Dejodierung von T4 zu T3 und TRH-Freisetzung.
Sie regeln auch die Freisetzung von tropen Hormonen in den
hypothalamisch-hypophysären Pfortaderkreislauf, indem sie sich von dem Raum zwischen hypothalamischen
Neuritenendigungen und Kapillaren zurückziehen (dieser Vorgang ist in
Kooperation mit Astrozyten über mehrere Faktoren reguliert).
sind ependymale Gliazellen am Boden der eminentia mediana. Sie beeinflussen u.a. die Dejodierung von T4 zu T3 und TRH-Freisetzung.
Sie regeln auch die Freisetzung von tropen Hormonen in den
hypothalamisch-hypophysären Pfortaderkreislauf, indem sie sich von dem Raum zwischen hypothalamischen
Neuritenendigungen und Kapillaren zurückziehen (dieser Vorgang ist in
Kooperation mit Astrozyten über mehrere Faktoren reguliert). POMC, Pro-opiomelanocortin
POMC, Pro-opiomelanocortin  CART, Cocaine and amphetamine related transcript
CART, Cocaine and amphetamine related transcript Über Regulation und Wirkungen des Prolactins s. dort
Über Regulation und Wirkungen des Prolactins s. dort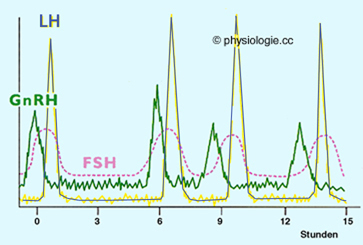
 Abbildung: Pulsatile Ausschüttung von GnRH, LH, FSH
Abbildung: Pulsatile Ausschüttung von GnRH, LH, FSH
 Abbildung).
Diese pulsatile Freisetzung korreliert mit einer hormonellen
"Frequenzkodierung" des Systems Gehirn - Geschlechtsdrüsen: Fällt der
Hypophysenvorderlappen aus (Sheehan-Syndrom infolge ischämischer
Nekrose), hat diskontinuierliche Hormonsubstitution mit einer ähnlichen
Sequenz wie physiologische Hormonpeaks den stärksten therapeutischen
Effekt.
Abbildung).
Diese pulsatile Freisetzung korreliert mit einer hormonellen
"Frequenzkodierung" des Systems Gehirn - Geschlechtsdrüsen: Fällt der
Hypophysenvorderlappen aus (Sheehan-Syndrom infolge ischämischer
Nekrose), hat diskontinuierliche Hormonsubstitution mit einer ähnlichen
Sequenz wie physiologische Hormonpeaks den stärksten therapeutischen
Effekt. GnRH, FSH und LH sind die hypothalamisch-hypophysären Schlüsselhormone der Fortpflanzung.
GnRH, FSH und LH sind die hypothalamisch-hypophysären Schlüsselhormone der Fortpflanzung. Näheres über Gonadotropine s. dort
Näheres über Gonadotropine s. dort
 Abbildung: Kerne des Hypothalamus, Funktionen, Hormonbildungsorte (vgl. dort)
Abbildung: Kerne des Hypothalamus, Funktionen, Hormonbildungsorte (vgl. dort)


 In der (frühen) Follikelphase hemmen sie das System (negative Rückkopplung).
In der (frühen) Follikelphase hemmen sie das System (negative Rückkopplung).  Steigt die Östrogenkonzentration gegen Ende der Follikelphase für
mehrere Stunden über einen Schwellenwert (150-200 pg/ml), dann kippt
der Effekt in Richtung einer positiven Rückkopplung, die basophilen
Zellen in der Hypophyse werden gegenüber GnRH sensibilisiert (Östradiol
erhöht die Zahl der GnRH-Rezeptoren im Vorderlappen) und es kommt zum
präovulatorischen LH- und FSH-Gipfel (LH-surge).
Steigt die Östrogenkonzentration gegen Ende der Follikelphase für
mehrere Stunden über einen Schwellenwert (150-200 pg/ml), dann kippt
der Effekt in Richtung einer positiven Rückkopplung, die basophilen
Zellen in der Hypophyse werden gegenüber GnRH sensibilisiert (Östradiol
erhöht die Zahl der GnRH-Rezeptoren im Vorderlappen) und es kommt zum
präovulatorischen LH- und FSH-Gipfel (LH-surge).  Oxytocin
Oxytocin
 Abbildung: Vasopressinneurone und hypothalamisch- hypophysäres System
Abbildung: Vasopressinneurone und hypothalamisch- hypophysäres System . Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System").
. Sie enden
im Hypophysenhinterlappen, wo Vasopressin über das Blut aus der a.
hypophysealis inferior in den Kreislauf abtransportiert wird
("hypothalamisch- neurohypophysäres System"). Abbildung). Die beiden Hormone sind ähnlich aufgebaut:
Abbildung). Die beiden Hormone sind ähnlich aufgebaut:

 ) gespeichert.
) gespeichert. Sie wird stimuliert durch Glutamat, Acetylcholin, Dopamin, Noradrenalin
(insbesondere Oxytocinausschüttung unter der Geburt), ATP, CCK
Sie wird stimuliert durch Glutamat, Acetylcholin, Dopamin, Noradrenalin
(insbesondere Oxytocinausschüttung unter der Geburt), ATP, CCK
 Sie wird gehemmt durch GABA, Glyzin, Dopamin, Somatostatin,
Endocannabinoide (insbesondere Oxytocinausschüttung unter der Geburt)
Sie wird gehemmt durch GABA, Glyzin, Dopamin, Somatostatin,
Endocannabinoide (insbesondere Oxytocinausschüttung unter der Geburt) Vasopressin hält in der Niere - über V2-Rezeptoren - bereits bei niedrigen Blutspiegeln Wasser zurück ("Wassersparhormon"). Bei höheren Konzentrationen kann es - über V1-Rezeptoren - stark vasokonstriktorisch wirken und insbesondere bei Gefahr einer arteriellen Hypotonie den Blutdruck stabilisieren.
Vasopressin hält in der Niere - über V2-Rezeptoren - bereits bei niedrigen Blutspiegeln Wasser zurück ("Wassersparhormon"). Bei höheren Konzentrationen kann es - über V1-Rezeptoren - stark vasokonstriktorisch wirken und insbesondere bei Gefahr einer arteriellen Hypotonie den Blutdruck stabilisieren. Rezeptoren
Rezeptoren
 Abbildung: Vom Vasopressin-Präprohormon zu Vasopressin
Abbildung: Vom Vasopressin-Präprohormon zu Vasopressin
 in Vollausprägung: stündlich ~1 Liter).
in Vollausprägung: stündlich ~1 Liter). 
 Vasopressin wird in Form des Prähormons im Hypothalamus gebildet (
Vasopressin wird in Form des Prähormons im Hypothalamus gebildet ( Abbildung oben) und
durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei wird das Prähormon durch
Enzyme, die sich in den Transportvesikeln befinden, zu Vasopressin und
Begleitpeptiden gespalten, u.a. Neurophysin II, das als Transportprotein dient.
Abbildung oben) und
durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei wird das Prähormon durch
Enzyme, die sich in den Transportvesikeln befinden, zu Vasopressin und
Begleitpeptiden gespalten, u.a. Neurophysin II, das als Transportprotein dient.
 Abbildung: Osmoregulatorischer Vasopressin-Regelkreis
Abbildung: Osmoregulatorischer Vasopressin-Regelkreis
 Auslösende Reize:
Auslösende Reize: Vasopressin wird bei
Anstieg der osmotischen Konzentration der Körperflüssigkeiten (Rezeptoren im Bereich des nucl. supraopticus des Hypothalamus) oder
Volumenmangel bzw. Blutdruckabfall (Rezeptoren im Kreislauf: Pulmonalvenen, linker Vorhof, Karotissinus, Aortenbogen) freigesetzt und verringert über V2-Rezeptoren (s. unten) die Wasserausscheidung in der
Niere (daher “antidiuretisches Hormon”).
Vasopressin wird bei
Anstieg der osmotischen Konzentration der Körperflüssigkeiten (Rezeptoren im Bereich des nucl. supraopticus des Hypothalamus) oder
Volumenmangel bzw. Blutdruckabfall (Rezeptoren im Kreislauf: Pulmonalvenen, linker Vorhof, Karotissinus, Aortenbogen) freigesetzt und verringert über V2-Rezeptoren (s. unten) die Wasserausscheidung in der
Niere (daher “antidiuretisches Hormon”).  Die
Vasopressinausschüttung wird durch Signale von kardiovaskulären
Barorezeptoren gehemmt (tonische Inhibition). Blutdruckabfall fördert
daher die Vasopressinsekretion (Disinhibition), und umgekehrt. In höherer
Konzentration wirkt Vasopressin über V1-Rezeptoren vasokonstriktorisch und blutdrucksteigernd (daher
“Vaso-pressin”). Volumenmangel dominiert den Gesamteffekt, sodass u.a. auch bei hypotoner Dehydratation Vasopressin vermehrt ausgeschüttet wird (obwohl die Osmolalität erniedrigt ist).
Die
Vasopressinausschüttung wird durch Signale von kardiovaskulären
Barorezeptoren gehemmt (tonische Inhibition). Blutdruckabfall fördert
daher die Vasopressinsekretion (Disinhibition), und umgekehrt. In höherer
Konzentration wirkt Vasopressin über V1-Rezeptoren vasokonstriktorisch und blutdrucksteigernd (daher
“Vaso-pressin”). Volumenmangel dominiert den Gesamteffekt, sodass u.a. auch bei hypotoner Dehydratation Vasopressin vermehrt ausgeschüttet wird (obwohl die Osmolalität erniedrigt ist). Vasopressin wird bei Belastungssituationen (Stress, Trauma, Schmerz, intensive olfaktorische, visuelle, auditive Reize)
in die Blutbahn freigesetzt - es wirkt volumensparend (Kreislauf!) und in
höherer Konzentration gefäßverengend (Blutdruck!). Vasopressin ist Teil einer
"Alarmachse", zusammen mit "klassischen Stresshormonen" (Adrenalin, Cortisol).
Vasopressin wird bei Belastungssituationen (Stress, Trauma, Schmerz, intensive olfaktorische, visuelle, auditive Reize)
in die Blutbahn freigesetzt - es wirkt volumensparend (Kreislauf!) und in
höherer Konzentration gefäßverengend (Blutdruck!). Vasopressin ist Teil einer
"Alarmachse", zusammen mit "klassischen Stresshormonen" (Adrenalin, Cortisol). Bei intensiver orthostatischer Belastung und insbesondere präsynkopal (bei drohendem orthostatischem Kollaps)
sowie bei Auftreten von Übelkeit oder Schmerz steigen Ausschüttung
und Plasmaspiegel des Vasopressins besonders stark und rasch an - bis weit über das
Zehnfache des Kontrollwertes. Aufgrund der geringen Halbwertszeit
(~2-5 Minuten, Abbau vor allem in Leber und Niere) nimmt der
AVP-Plasmaspiegel nach einem solchen Ereignis auch rasch wieder ab. Auch Angiotensin II stimuliert die Freisetzung von Vasopressin.
Bei intensiver orthostatischer Belastung und insbesondere präsynkopal (bei drohendem orthostatischem Kollaps)
sowie bei Auftreten von Übelkeit oder Schmerz steigen Ausschüttung
und Plasmaspiegel des Vasopressins besonders stark und rasch an - bis weit über das
Zehnfache des Kontrollwertes. Aufgrund der geringen Halbwertszeit
(~2-5 Minuten, Abbau vor allem in Leber und Niere) nimmt der
AVP-Plasmaspiegel nach einem solchen Ereignis auch rasch wieder ab. Auch Angiotensin II stimuliert die Freisetzung von Vasopressin. Gehemmt wird die Vasopressinfreisetzung durch GABA, Cortisol und Atriopeptin.
Gehemmt wird die Vasopressinfreisetzung durch GABA, Cortisol und Atriopeptin. Opiate, Barbiturate, Alkohol
gehören zu Stoffen, welche die Sekretion von Vasopressin unterdrücken.
Daher kann z.B. die Einnahme alkoholischer Getränke zu Dehydrierung
führen ("Alkoholkater", von καταρρεῖν = herabfließen).
Opiate, Barbiturate, Alkohol
gehören zu Stoffen, welche die Sekretion von Vasopressin unterdrücken.
Daher kann z.B. die Einnahme alkoholischer Getränke zu Dehydrierung
führen ("Alkoholkater", von καταρρεῖν = herabfließen). 
 Abbildung: Steuerung der Vasopressinsekretion
Abbildung: Steuerung der Vasopressinsekretion
 Abbildung), was die Niere zu
verstärkter Rückresorption von Wasser veranlasst. Das wirkt auch dem
Effekt allfälligen Alkoholkonsums entgegen (Alhohol wirkt dehydrierend).
Abbildung), was die Niere zu
verstärkter Rückresorption von Wasser veranlasst. Das wirkt auch dem
Effekt allfälligen Alkoholkonsums entgegen (Alhohol wirkt dehydrierend). V1-Rezeptoren
finden sich in hoher Dichte auf der glatten Gefäßmuskulatur, auch am
Herzmuskel. Weiters werden sie exprimiert von Zellen in Gehirn, Hoden,
Leber und Nieren, sowie auf Thrombozyten, wo Vasopressin
prothrombotisch wirkt.
V1-Rezeptoren
finden sich in hoher Dichte auf der glatten Gefäßmuskulatur, auch am
Herzmuskel. Weiters werden sie exprimiert von Zellen in Gehirn, Hoden,
Leber und Nieren, sowie auf Thrombozyten, wo Vasopressin
prothrombotisch wirkt.  V2-Rezeptoren sind G-Protein-gekoppelte Rezeptoren - sie wirken über cAMP. Sie finden sich in den Sammelrohren der Niere, wo sie die Einlagerung von Aquaporin-2 in die apikale Membran der Tubulus-Hauptzellen ("Wasserspareffekt") sowie des Harnstofftransporters
fördern. Diese Wirkungen treten schon bei
wesentlich niedrigerem Vasopressinspiegel (ab ~0,05 pM) auf als sie für die Aktivierung von V1-Rezeptoren erforderlich sind.
V2-Rezeptoren sind G-Protein-gekoppelte Rezeptoren - sie wirken über cAMP. Sie finden sich in den Sammelrohren der Niere, wo sie die Einlagerung von Aquaporin-2 in die apikale Membran der Tubulus-Hauptzellen ("Wasserspareffekt") sowie des Harnstofftransporters
fördern. Diese Wirkungen treten schon bei
wesentlich niedrigerem Vasopressinspiegel (ab ~0,05 pM) auf als sie für die Aktivierung von V1-Rezeptoren erforderlich sind. Auch V3-Rezeptoren (früher: V1B-Rezeptoren) sind
G-Protein-gekoppelte Rezeptoren - sie unterscheiden sich in ihrem
pharmakologischen Ansprechmuster und wurden auf Zellen in Gehirn und
Hypophysenvorderlappen (ACTH) nachgewiesen.
Auch V3-Rezeptoren (früher: V1B-Rezeptoren) sind
G-Protein-gekoppelte Rezeptoren - sie unterscheiden sich in ihrem
pharmakologischen Ansprechmuster und wurden auf Zellen in Gehirn und
Hypophysenvorderlappen (ACTH) nachgewiesen.
 Abbildung: Wirkungsmechanismus von Vasopressin über V2-Rezeptoren
Abbildung: Wirkungsmechanismus von Vasopressin über V2-Rezeptoren
 Blutdruckabfall / Volumenmangel regt die Vasopressinausschüttung an.
Blutdruckabfall / Volumenmangel regt die Vasopressinausschüttung an.

 Abbildung: Vasopressinrezeptoren und ihre Kreislaufwirkungen
Abbildung: Vasopressinrezeptoren und ihre Kreislaufwirkungen
 Aktivierung
und Translokation von Na/K/Cl-Symportern an / zu der apikalen
(luminalen) Membran der Tubulusepithelzellen (rascher Effekt), sowie
Aktivierung
und Translokation von Na/K/Cl-Symportern an / zu der apikalen
(luminalen) Membran der Tubulusepithelzellen (rascher Effekt), sowie  deren Expression (länger anhaltender Effekt).
deren Expression (länger anhaltender Effekt). Vasopressin (ADH, Adiuretin)
Vasopressin (ADH, Adiuretin)  Vor allem hepatische und renale Peptidasen bauen das Hormon rasch ab (biologische Halbwertszeit im Kreislauf 10-20 Minuten).
Vor allem hepatische und renale Peptidasen bauen das Hormon rasch ab (biologische Halbwertszeit im Kreislauf 10-20 Minuten). Oxytocin wird im Hypothalamus gebildet und durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei ist es an ein Transportprotein
- Neurophysin I - gebunden; in den Vesikeln wird es dann vom Transporter enzymatisch entkoppelt.
Oxytocin wird im Hypothalamus gebildet und durch axonalen Transport in den
Hypophysenhinterlappen befördert. Dabei ist es an ein Transportprotein
- Neurophysin I - gebunden; in den Vesikeln wird es dann vom Transporter enzymatisch entkoppelt.  )
Oxytocinfreisetzung aus, was die Wehentätigkeit unterstützt. Auch der
Koitus führt zu Oxytocinausschüttung, ferner Reize, welche eine
Vasopressinsekretion fördern. Östradiol stimuliert die Oxytocinfreisetzung, Relaxine hemmen sie.
)
Oxytocinfreisetzung aus, was die Wehentätigkeit unterstützt. Auch der
Koitus führt zu Oxytocinausschüttung, ferner Reize, welche eine
Vasopressinsekretion fördern. Östradiol stimuliert die Oxytocinfreisetzung, Relaxine hemmen sie.
 Abbildung: Oxytocinrezeptor
Abbildung: Oxytocinrezeptor
 Erhöhte Oxytocinproduktion senkt die Freisetzung von GnRH aus dem
Hypothalamus und kann so - in der Stillperiode - den menstruellen
Zyklus unterbrechen. Eine verlässliche empfängnisverhütende Wirkung ist
dadurch nicht gegeben; insbesondere bei längerem Stillen kehren die
Zyklen wieder zurück.
Erhöhte Oxytocinproduktion senkt die Freisetzung von GnRH aus dem
Hypothalamus und kann so - in der Stillperiode - den menstruellen
Zyklus unterbrechen. Eine verlässliche empfängnisverhütende Wirkung ist
dadurch nicht gegeben; insbesondere bei längerem Stillen kehren die
Zyklen wieder zurück.  Abbau und Ausscheidung erfolgen, ähnlich wie bei Vasopressin, über
Leber und Nieren. Zusätzlich bilden Plazenta und vermutlich Uterus eine Peptidase
(Oxytocinase), die bei Schwangeren Oxytoin inaktiviert. Die
biologische Halbwertszeit des Oxytocins beträgt nur wenige Minuten.
Abbau und Ausscheidung erfolgen, ähnlich wie bei Vasopressin, über
Leber und Nieren. Zusätzlich bilden Plazenta und vermutlich Uterus eine Peptidase
(Oxytocinase), die bei Schwangeren Oxytoin inaktiviert. Die
biologische Halbwertszeit des Oxytocins beträgt nur wenige Minuten. Oxytocin
Oxytocin
 .
Reduktion der Trainingsintensität bzw. Normalisierung des
Körpergewichts stellt die pulsatile GnRH-Freisetzung üblicherweise wieder her;
die Zyklusstörungen verschwinden.
.
Reduktion der Trainingsintensität bzw. Normalisierung des
Körpergewichts stellt die pulsatile GnRH-Freisetzung üblicherweise wieder her;
die Zyklusstörungen verschwinden.  Eingriff in die Regelkreise: Die Verabreichung von GnRH-Analoga
als Depotpräparat führt kurzfristig über Anregung der
gonadotropinproduzierenden Zellen im Hypophysenvorderlappen zu einer
Erhöhung ("flare up-Effekt"), danach aber infolge der auftretenden
Refrakterität (Downregulation der Rezeptoren) zu verminderter
FSH- und LH-Ausschüttung. Die Östrogensynthese im Ovar wird so
supprimiert, was man sich z.B. für die Therapie eines Mamma-Ca zunutze
machen kann.
Eingriff in die Regelkreise: Die Verabreichung von GnRH-Analoga
als Depotpräparat führt kurzfristig über Anregung der
gonadotropinproduzierenden Zellen im Hypophysenvorderlappen zu einer
Erhöhung ("flare up-Effekt"), danach aber infolge der auftretenden
Refrakterität (Downregulation der Rezeptoren) zu verminderter
FSH- und LH-Ausschüttung. Die Östrogensynthese im Ovar wird so
supprimiert, was man sich z.B. für die Therapie eines Mamma-Ca zunutze
machen kann. Vasopressin-Rezeptoragonisten können zur Behandlung eines diabetes insipidus eingesetzt werden, soferne der V2-Rezeptor wirksam ist (Unterstützung der Wasserdiffusion ins Nierenmark).
Hochdosiert verwendet man Vasopressinagonisten auch zur Behandlung von
Blutungen im Ösophagus (Varizen: Anregung von vasokonstriktorisch
wirksamen V1-Rezeptoren).
Vasopressin-Rezeptoragonisten können zur Behandlung eines diabetes insipidus eingesetzt werden, soferne der V2-Rezeptor wirksam ist (Unterstützung der Wasserdiffusion ins Nierenmark).
Hochdosiert verwendet man Vasopressinagonisten auch zur Behandlung von
Blutungen im Ösophagus (Varizen: Anregung von vasokonstriktorisch
wirksamen V1-Rezeptoren).

 Neurosekretorische Zellen befinden sich vor allem im Hypothalamus und
setzen im Rahmen regulatorischer Vorgänge Neurohormone frei (GnRH, CRH,
TRH, GH, Vasopressin, Oxytocin) - in das Blut (endokrin) oder in
umliegendes Gewebe bzw. den liquor cerebrospinalis (parakrin). Die
Aktionspotentialfrequenz entscheidet über die Art der exozytierten
Speichervesikel und damit über die Art des freigesetzten Stoffes.
Neurotransmitter diffundieren höchstens ~50 µm bis zu ihrer
Inaktivierung; Neuropeptide kommen mehr als 1000 µm weit und haben
längere Verweildauer im Extrazellulärraum. Neurosekretorische Zellen
erhalten multiple sensorische, zirkadiane und limbische Eingänge und
stehen unter dem Einfluss von Glutamat, GABA, Kisspeptin, Opioiden,
Dopamin, Noradrenalin, Serotonin
Neurosekretorische Zellen befinden sich vor allem im Hypothalamus und
setzen im Rahmen regulatorischer Vorgänge Neurohormone frei (GnRH, CRH,
TRH, GH, Vasopressin, Oxytocin) - in das Blut (endokrin) oder in
umliegendes Gewebe bzw. den liquor cerebrospinalis (parakrin). Die
Aktionspotentialfrequenz entscheidet über die Art der exozytierten
Speichervesikel und damit über die Art des freigesetzten Stoffes.
Neurotransmitter diffundieren höchstens ~50 µm bis zu ihrer
Inaktivierung; Neuropeptide kommen mehr als 1000 µm weit und haben
längere Verweildauer im Extrazellulärraum. Neurosekretorische Zellen
erhalten multiple sensorische, zirkadiane und limbische Eingänge und
stehen unter dem Einfluss von Glutamat, GABA, Kisspeptin, Opioiden,
Dopamin, Noradrenalin, Serotonin  Neurosekretorische Aktivität findet sich im Körper an mehreren Stellen:
Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei
(Hypophysenhinterlappen); parvozelluläre Liberine /
Inhibine (eminentia mediana); postganglionäre sympathische Zellen
Adrenalin (Nebennierenmark); Pinealozyten Melatonin (Epiphyse). Die
Freisetzung der Neurohormone erfolgt pulsatil und abhängig von
Tageszeit, Stoffwechselzustand, Stress u.a.
Neurosekretorische Aktivität findet sich im Körper an mehreren Stellen:
Magnozelluläre Neurone setzen Vasopressin und Oxytocin frei
(Hypophysenhinterlappen); parvozelluläre Liberine /
Inhibine (eminentia mediana); postganglionäre sympathische Zellen
Adrenalin (Nebennierenmark); Pinealozyten Melatonin (Epiphyse). Die
Freisetzung der Neurohormone erfolgt pulsatil und abhängig von
Tageszeit, Stoffwechselzustand, Stress u.a. Der Hypophysenvorderlappen bildet trope Hormone - somatotrop (GH) und
glandotrop (ACTH, TSH, FSH, LH, Prolactin) -, diese steuern Wachstum
und Entwicklung des Körpers und die Freisetzung von Glucocorticoiden,
Schilddrüsenhormonen, Geschlechtshormonen. Die Hormonfreisetzung steht unter Einwirkung
hypothalamischer Faktoren (Liberine, Statine); sowohl
Hypothalamus als auch Hypophyse unterliegen (meist negativ) rückkoppelnden Wirkungen
peripherer Hormone. Der Zwischenlappen bildet
Melanotropine. Der Hinterlappen speichert Hormone, die durch
neurohumorale Reflexe freigesetzt werden (Vasopressin: Blutdruckabfall
oder Wassermangel, Oxytocin: Dehnung des Geburtskanals, Saugreiz an der
Brustwarze)
Der Hypophysenvorderlappen bildet trope Hormone - somatotrop (GH) und
glandotrop (ACTH, TSH, FSH, LH, Prolactin) -, diese steuern Wachstum
und Entwicklung des Körpers und die Freisetzung von Glucocorticoiden,
Schilddrüsenhormonen, Geschlechtshormonen. Die Hormonfreisetzung steht unter Einwirkung
hypothalamischer Faktoren (Liberine, Statine); sowohl
Hypothalamus als auch Hypophyse unterliegen (meist negativ) rückkoppelnden Wirkungen
peripherer Hormone. Der Zwischenlappen bildet
Melanotropine. Der Hinterlappen speichert Hormone, die durch
neurohumorale Reflexe freigesetzt werden (Vasopressin: Blutdruckabfall
oder Wassermangel, Oxytocin: Dehnung des Geburtskanals, Saugreiz an der
Brustwarze)  Sowohl zwischen Immun- und endokrinem System (ACTH, β-Endorphine;
Interleukine, Interferone, TNF-α) als auch zwischen endokrinem und
Zentralnervensystem gibt es wechselseitige Beeinflussung (CRH, ACTH,
β-Endorphine). Immunzellen haben Rezeptoren für GH, ACTH, Prolactin;
Zytokine beeinflussen die Sekretion von Vorderlappenhormonen
Sowohl zwischen Immun- und endokrinem System (ACTH, β-Endorphine;
Interleukine, Interferone, TNF-α) als auch zwischen endokrinem und
Zentralnervensystem gibt es wechselseitige Beeinflussung (CRH, ACTH,
β-Endorphine). Immunzellen haben Rezeptoren für GH, ACTH, Prolactin;
Zytokine beeinflussen die Sekretion von Vorderlappenhormonen Der Hypothalamus wird von übergeordneten Zentren (Kortex, limbisches
System, Thalamus) und der Peripherie beeinflusst (Hormonrezeptoren,
Osmorezeptoren, thermosensitive Zellen, metabolische Rezeptoren).
Efferenzen aus dem Hypothalamus sind hormoneller und neuronaler Natur.
Kleinzellige Neurone des medialen Hypothalamus bilden Liberine und
Statine, großzellige (nucl. supraopticus und paraventricularis) bilden
Vasopressin und Oxytocin (Unterschied: 2 Aminosäuren), die im
Hinterlappen zwischengespeichert werden können. Auf dem Weg dorthin
fungieren Neurophysin I als Transporter des Oxytocins, Neurophysin II
des Vasopressins
Der Hypothalamus wird von übergeordneten Zentren (Kortex, limbisches
System, Thalamus) und der Peripherie beeinflusst (Hormonrezeptoren,
Osmorezeptoren, thermosensitive Zellen, metabolische Rezeptoren).
Efferenzen aus dem Hypothalamus sind hormoneller und neuronaler Natur.
Kleinzellige Neurone des medialen Hypothalamus bilden Liberine und
Statine, großzellige (nucl. supraopticus und paraventricularis) bilden
Vasopressin und Oxytocin (Unterschied: 2 Aminosäuren), die im
Hinterlappen zwischengespeichert werden können. Auf dem Weg dorthin
fungieren Neurophysin I als Transporter des Oxytocins, Neurophysin II
des Vasopressins Vasopressin (AVP - Arginin-Vasopressin, ADH - antidiuretisches Hormon,
Adiuretin) wirkt als "Wassersparhormon" (Rückresorption von ~20 l/d,
sonst Diabetes insipidus) über die Expression des
Na/K/2Cl--Kotransporters im dicken aufsteigenden Schenkel der
Henle-Schleife sowie die Einlagerung von Aquaporinen in spätdistale
Nierentubuli. Vasopressin ist ein zentraler Player für die Regulation
von Osmolarität, Volumen- und Kreislauffunktion und wirkt direkt
vasokonstriktorisch (blutdrucksteigernd). Es wird in verschiedenen
Belastungssituationen, bei Schmerz, Blutdruckabfall, Volumenmangel oder
erhöhter Serumosmolarität freigesetzt. Es gibt verschiedene
Vasopressinrezeptoren: V2 (antidiuretisch, erhöhte
Harnstoffpermeabilität)
sprechen schon bei niedrigeren Konzentrationen an als V1
(vasokonstriktorisch). Die Vasopressineffekte ergänzen einander
gegenseitig
Vasopressin (AVP - Arginin-Vasopressin, ADH - antidiuretisches Hormon,
Adiuretin) wirkt als "Wassersparhormon" (Rückresorption von ~20 l/d,
sonst Diabetes insipidus) über die Expression des
Na/K/2Cl--Kotransporters im dicken aufsteigenden Schenkel der
Henle-Schleife sowie die Einlagerung von Aquaporinen in spätdistale
Nierentubuli. Vasopressin ist ein zentraler Player für die Regulation
von Osmolarität, Volumen- und Kreislauffunktion und wirkt direkt
vasokonstriktorisch (blutdrucksteigernd). Es wird in verschiedenen
Belastungssituationen, bei Schmerz, Blutdruckabfall, Volumenmangel oder
erhöhter Serumosmolarität freigesetzt. Es gibt verschiedene
Vasopressinrezeptoren: V2 (antidiuretisch, erhöhte
Harnstoffpermeabilität)
sprechen schon bei niedrigeren Konzentrationen an als V1
(vasokonstriktorisch). Die Vasopressineffekte ergänzen einander
gegenseitig Oxytocin hat wehen- (Ferguson-Reflex) und lactationsfördernde Wirkung
und ist auch als "Kuschelhormon" bekannt. Östrogene steigern
(Expression von Oxytocinrezeptoren), Progesteron senkt die
Oxytocin-Empfindlichkeit des Myometriums. In der zweiten Hälfte der
Schwangerschaft nimmt die Zahl der Oxytocinrezeptoren an den
Myometriumzellen 30-fach zu, die Sensitivität für Oxytocin 8-fach. Stillen begünstigt die postpartale Rückbildung des Uterus
(Stillreflex). Limbisches System und Hirnstamm sind reich an
Oxytocinrezeptoren (Empathie, Vertrauen,
Kontaktfreudigkeit, Angstreduktion, sexuelles Interesse,
elterliches Verhalten)
Oxytocin hat wehen- (Ferguson-Reflex) und lactationsfördernde Wirkung
und ist auch als "Kuschelhormon" bekannt. Östrogene steigern
(Expression von Oxytocinrezeptoren), Progesteron senkt die
Oxytocin-Empfindlichkeit des Myometriums. In der zweiten Hälfte der
Schwangerschaft nimmt die Zahl der Oxytocinrezeptoren an den
Myometriumzellen 30-fach zu, die Sensitivität für Oxytocin 8-fach. Stillen begünstigt die postpartale Rückbildung des Uterus
(Stillreflex). Limbisches System und Hirnstamm sind reich an
Oxytocinrezeptoren (Empathie, Vertrauen,
Kontaktfreudigkeit, Angstreduktion, sexuelles Interesse,
elterliches Verhalten) 