




 Steuerung
der Nierenfunktion
Steuerung
der Nierenfunktion
 Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel
Autoregulation: αὐτός = selbst, regula = Latte, Leiste, Maßstab, Regel| Die Durchblutung der Nieren (renale Perfusion ~1
l/min) beträgt bei körperlicher Ruhe etwa 20% des Herzminutenvolumens.
Bei physischer oder psychischer Belastung kann sie wegen des steigenden
Sympathikustonus bis
auf ~0,5 l/min abnehmen (Vasokonstriktion unter
Stresseinfluss). Die renale Perfusion ist mehrfach reguliert: -- Sie wird über einen weiten Blutdruckbereich so gut wie konstant gehalten. Diese autoregulative Fähigkeit beruht auf mehreren Mechanismen: Einer Erhöhung der arteriolären Konstriktion bei Steigerung von Innendruck und Wandspannung (Bayliss-Effekt); der Rückwirkung von Salzfiltration auf das vas afferens (tubulo-glomeruläres Feedback); und die Tatsache, dass erhöhter Blutdruck die Wasserausscheidung erhöht (Druckdiurese) -- Zweitens stehen die Nierengefäße unter dem steuernden Einfluss sympathischer Fasern. Geringe sympathische Aktivität fördert die Reninbildung (und damit Aldosteronproduktion), mittelstarke die Kochsalzresorption (direkt), intensive bewirkt renale Vasokonstriktion -- Das Nierenenzym Renin wird auf tubuläre und nervale Einflüsse hin freigesetzt und steht am Anfang eines breit wirksamen Systems (Angiotensin, Aldosteron), das auf die Nieren zurückwirkt (Gefäßtonus, Natriurese, Kaliurese, pH-Regulation). Zu weiteren nierenwirksamen endokrinen Faktoren gehören Vasopressin (erhöht Wasserresorption), natriuretische Peptide (Wirkung siehe Name) und ebenfalls natriuretische Prostaglandine. |
 Neuronale Mechanismen
Neuronale Mechanismen  Humorale Mechanismen
Humorale Mechanismen
 Core messages
Core messages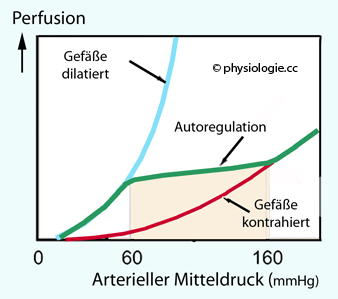
 Abbildung: Renale Autoregulation
Abbildung: Renale Autoregulation
 bezeichnete Fähigkeit ist durch mehrere Mechanismen bedingt:
bezeichnete Fähigkeit ist durch mehrere Mechanismen bedingt: Myogen (Bayliss-Effekt: vermehrte Wandspannung → Ca++-Einstrom in Gefäßmuskelzellen → Vasokontraktion (Abbildungen). Der Hauptangriffsort der renalen Autoregulation ist das vas afferens. Der arterielle Blutdruck kann sich z.B. durch Lageänderung,
Muskelbelastung oder im Schlaf ändern, die autoregulative Antwort der
vasa afferentia stabilisiert Perfusion, Filtrations- und
Reabsorptionsdrucke in den Nieren. Bei niedrigen Blutdruckwerten (z.B.
bei Herzinsuffizienz) beteiligen sich auch die vasa efferentia an der
Stabilisierung der Filtration.
Myogen (Bayliss-Effekt: vermehrte Wandspannung → Ca++-Einstrom in Gefäßmuskelzellen → Vasokontraktion (Abbildungen). Der Hauptangriffsort der renalen Autoregulation ist das vas afferens. Der arterielle Blutdruck kann sich z.B. durch Lageänderung,
Muskelbelastung oder im Schlaf ändern, die autoregulative Antwort der
vasa afferentia stabilisiert Perfusion, Filtrations- und
Reabsorptionsdrucke in den Nieren. Bei niedrigen Blutdruckwerten (z.B.
bei Herzinsuffizienz) beteiligen sich auch die vasa efferentia an der
Stabilisierung der Filtration. Tubulo-glomeruläres Feedback bedingt (vermehrte Filtration → mehr Kochsalz an macula densa → Feedbacksignale an das Glomerulum durch parakrine Mediatoren →
Kontraktion vas afferens → Filtration zurück in den Normbereich).
Tubulo-glomeruläres Feedback bedingt (vermehrte Filtration → mehr Kochsalz an macula densa → Feedbacksignale an das Glomerulum durch parakrine Mediatoren →
Kontraktion vas afferens → Filtration zurück in den Normbereich). Druckdiurese (Flüssigkeitsverlust durch Blutdruckanstieg → erhöhten Filtrationsdruck → vermehrte Wasserausscheidung).
Druckdiurese (Flüssigkeitsverlust durch Blutdruckanstieg → erhöhten Filtrationsdruck → vermehrte Wasserausscheidung). 
 Abbildung: Bayliss-Effekt
Abbildung: Bayliss-Effekt 


 Abbildung). Der Signalweg involviert G-Protein, Phospholipase C
(PLC), Diacylglycerin (DAG), Kationeneinstrom durch TRPC6-Permease,
Depolarisierung und elektromechanische Koppelung.
Abbildung). Der Signalweg involviert G-Protein, Phospholipase C
(PLC), Diacylglycerin (DAG), Kationeneinstrom durch TRPC6-Permease,
Depolarisierung und elektromechanische Koppelung.| Druckabfall in der a. renalis führt als myogene Reaktion zu Dilatation der vasa afferentia (Autoregulation der Durchblutung) |
 Mehr zum Bayliss-Effekt s. dort
Mehr zum Bayliss-Effekt s. dort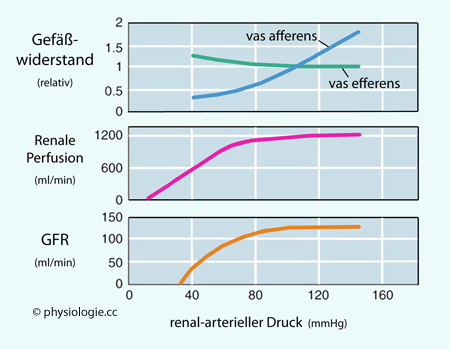
 Abbildung: Autoregulation der renalen Perfusion und glomerulären Filtration (GFR) in Abhängigkeit vom Blutdruck
Abbildung: Autoregulation der renalen Perfusion und glomerulären Filtration (GFR) in Abhängigkeit vom Blutdruck
 Abbildung).
Abbildung).
| Autoregulation: Bis ~180 mmHg renal-arteriellem Druck bleiben Durchblutung und glomerulärer Kapillardruck weitgehend konstant |
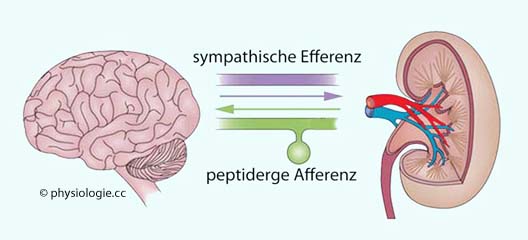
 Abbildung: Renale Efferenzen und Afferenzen
Abbildung: Renale Efferenzen und Afferenzen
 bewirken Vasokonstriktion,
bewirken Vasokonstriktion,  fördern
die Rückresorption von Natrium im proximalen Tubulus
fördern
die Rückresorption von Natrium im proximalen Tubulus  sowie die
Freisetzung von Renin aus dem juxtaglomerulären Apparat (ß-Rezeptor-vermittelt).
sowie die
Freisetzung von Renin aus dem juxtaglomerulären Apparat (ß-Rezeptor-vermittelt).  Niedrige Aktivität regt über ß1-Rezeptoren die Reninsekretion im juxtaglomerulären Apparat an, was den Angiotensin-Aldosteron- Mechanismus aktiviert.
Niedrige Aktivität regt über ß1-Rezeptoren die Reninsekretion im juxtaglomerulären Apparat an, was den Angiotensin-Aldosteron- Mechanismus aktiviert. Mittlere Aktivität regt über α1B-Rezeptoren die tubuläre Wasser- und Kochsalz-Rückresorption an. Diese Hauptfunktion der sympathischen Beeinflussung der Niere ist
unter Bedingungen beschränkter Verfügbarkeit von Kochsalz besonders wichtig
(bei übermäßigem Salzangebot besteht das Risiko arterieller Hypertonie).
Mittlere Aktivität regt über α1B-Rezeptoren die tubuläre Wasser- und Kochsalz-Rückresorption an. Diese Hauptfunktion der sympathischen Beeinflussung der Niere ist
unter Bedingungen beschränkter Verfügbarkeit von Kochsalz besonders wichtig
(bei übermäßigem Salzangebot besteht das Risiko arterieller Hypertonie). Hohe Aktivität bewirkt über α1A-Rezeptoren Vasokonstriktion und Senkung der renalen Perfusion.
Hohe Aktivität bewirkt über α1A-Rezeptoren Vasokonstriktion und Senkung der renalen Perfusion. Der sympathische Einfluss auf die Nierengefäße kann intensiv sein: Bei
exzessivem Sympathikustonus (extremer Stress, starker Blutverlust)
sinkt die renale Durchblutung auf praktisch Null. Solche Situationen
gefährden die Nierenfunktion.
Der sympathische Einfluss auf die Nierengefäße kann intensiv sein: Bei
exzessivem Sympathikustonus (extremer Stress, starker Blutverlust)
sinkt die renale Durchblutung auf praktisch Null. Solche Situationen
gefährden die Nierenfunktion. von arteriellen und venösen Barorezeptoren
(lokaler
Blutdruck) und
von arteriellen und venösen Barorezeptoren
(lokaler
Blutdruck) und  Chemorezeptoren im Nierenbecken (Zusammensetzung der
interstitiellen Flüssigkeit: R1-Rezeptoren reagieren auf Hypoxie, R2-Rezeptoren auf das Ionenmuster)
Chemorezeptoren im Nierenbecken (Zusammensetzung der
interstitiellen Flüssigkeit: R1-Rezeptoren reagieren auf Hypoxie, R2-Rezeptoren auf das Ionenmuster)  Abbildung).
Abbildung). 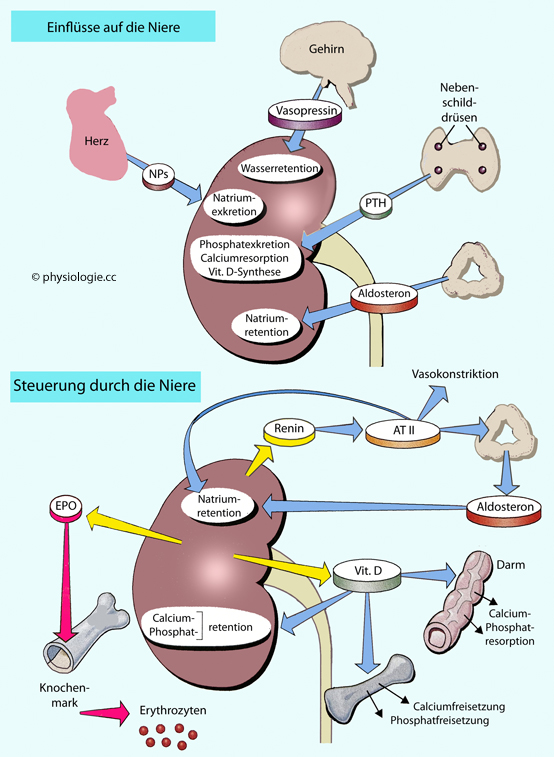
 Abbildung: Einbindung der Niere in endokrine Regelkreise
Abbildung: Einbindung der Niere in endokrine Regelkreise
 Renin / Angiotensin / Aldosteron-System
Renin / Angiotensin / Aldosteron-System  Vasopressin
Vasopressin  Natriuretische Peptide
Natriuretische Peptide  Erythropoetin
Erythropoetin  Vitamin D
Vitamin D  Kurzlebige Mediatoren
Kurzlebige Mediatoren oder renovaskuläre Hypertonie).
Man kann dies so interpretieren, dass die Niere die mangelnde
Durchblutung durch systemische Blutdrucksteigerung zu kompensieren
versucht. (Die Niere ist das einzige Organ, das enzymatisch aktives Renin freisetzen kann.)
oder renovaskuläre Hypertonie).
Man kann dies so interpretieren, dass die Niere die mangelnde
Durchblutung durch systemische Blutdrucksteigerung zu kompensieren
versucht. (Die Niere ist das einzige Organ, das enzymatisch aktives Renin freisetzen kann.)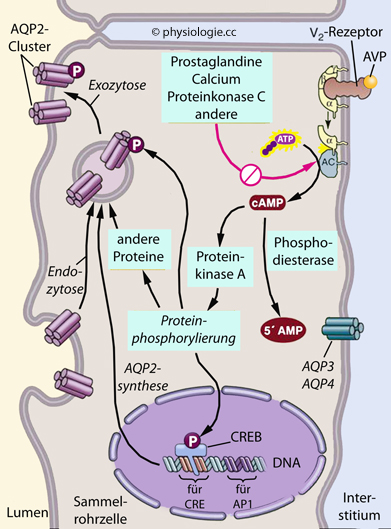
 Abbildung: Vasopressinwirkung auf Tubulusepithelzelle eines Sammelrohrs
Abbildung: Vasopressinwirkung auf Tubulusepithelzelle eines Sammelrohrs
 Vasopressin wirkt als
"Wassersparhormon", indem es die Resorption von H2O durch Einlagerung von Aquaporin 2 in die apikale Membran der Hauptzellen des Sammelrohrepithels erhöht (in der basolateralen Membran sitzt das vasopressinunabhängige Aquaporin 3) sowie auch über CREB die Neusynthese im Zellkern anregt (
Vasopressin wirkt als
"Wassersparhormon", indem es die Resorption von H2O durch Einlagerung von Aquaporin 2 in die apikale Membran der Hauptzellen des Sammelrohrepithels erhöht (in der basolateralen Membran sitzt das vasopressinunabhängige Aquaporin 3) sowie auch über CREB die Neusynthese im Zellkern anregt ( Abbildung).
Abbildung).  Vasopressin regt aber auch die Resorption von Natrium an, indem
es im äußeren Markbereich Na/K/Cl-Cotransporter
in der apikalen Membran stimuliert - damit ist es ebenfalls
volumenaktiv (Natrium ist das Leitkation der extrazellulären
Flüssigkeit).
Vasopressin regt aber auch die Resorption von Natrium an, indem
es im äußeren Markbereich Na/K/Cl-Cotransporter
in der apikalen Membran stimuliert - damit ist es ebenfalls
volumenaktiv (Natrium ist das Leitkation der extrazellulären
Flüssigkeit).  Vasopressin steigert die Permeabilität der Wand des inneren medullären
Sammelrohrs für Harnstoff
- durch cAMP-abhängige Phosphorylierung der Harnstofftranspoirter UT-A1
(apikal) und UT-A3 (basolateral) und erleichtert auch auf diesem Wege
die
Resorption von Wasser.
Vasopressin steigert die Permeabilität der Wand des inneren medullären
Sammelrohrs für Harnstoff
- durch cAMP-abhängige Phosphorylierung der Harnstofftranspoirter UT-A1
(apikal) und UT-A3 (basolateral) und erleichtert auch auf diesem Wege
die
Resorption von Wasser. durchblutungssteigernde Prostaglandine und
Kinine
durchblutungssteigernde Prostaglandine und
Kinine  , die auch die Salz-Wasser-Ausscheidung fördern.
, die auch die Salz-Wasser-Ausscheidung fördern.  Thromboxane sind hingegen
durchblutungshemmend und spielen wahrscheinlich bei zahlreichen
Erkrankungen der Niere eine Rolle.
Thromboxane sind hingegen
durchblutungshemmend und spielen wahrscheinlich bei zahlreichen
Erkrankungen der Niere eine Rolle.| Hormon / Mediator |
Mechanismus |
Wirkung |
Wirkungsort |
| Parathormon |
Starke Hemmung der Phosphatresorption aus dem proximalen Tubulus Förderung der Ca++- und Mg++-Resorption aus dem distalen Tubulus (Henle-Schleife) |
Steigerung [Ca++] im Blut, Senkung [HPO4--] (kurzfristig) |
Tubulus: Proximal, frühdistal |
| Calcitonin |
Hemmt Einbau des Natrium/Phosphat- Cotransporters im proximalen Tubulus (luminal) Steigert Einbau von TRPV5-Kanälen, erhöht Ca++-Resorption im distalen Tubulus |
Bei Hypocalcämie: Senkung der Rückresorption von Phosphat, Steigerung der Rückresorption von Ca++ | Proximaler und distaler Tubulus |
| Natriuretische Peptide |
Dilatation vas afferens / Konstriktion vas efferens: Filtration + Erhöhter Blutfluss durch vasa recta (Auswaschen von Kochsalz und Harnstoff aus hypertonem Mark) Phosphorylierung von Na-Kanälen (ENaC) Hemmung der Reninsekretion Senkung der Aldosteronfreisetzung |
verminderte Na+-Resorption Natriurese, Diurese |
Gefäße Glomerulum distaler Tubulus iuxtaglomeruläre Zellen Nebennierenrinde |
| Angiotensin II |
Konstriktion vas efferens → glomeruläre Filtration Stimulierung der Aldosteronfreisetzung Stimulierung der Vasopressinfreisetzung |
Na+: erhöhte Resorption, verminderte Ausscheidung + Wasserresorption |
Gefäße Nebenniere Hypophyse |
| Aldosteron |
Expression
/ Insertion v. Na-Permease (ENaC) in apikale Membran, und Na-K-Pumpe in
basolaterale Membran im distalen Tubulus / Sammelrohr |
erhöhte Na+-Resorption |
Sammelrohr |
| Vasopressin (ADH) |
Insertion von Aquaporinen in apikale Membran im distalen Tubulus / Sammelrohr |
erhöhte H2O-Resorption |
Sammelrohr |
| Prostaglandine |
Hemmung Na-Permease, Cl-Permease |
verminderte Na+-Resorption |
Henle-Schleife, Sammelrohr |
 Arterieller
Blutdruckabfall erniedrigt den Filtrationsdruck und bedingt verringerte
Harnbildung - im Kreislaufschock kann vollständige Anurie auftreten. Nierenerkrankungen
führen zu Störungen der Wasser- und Salzausscheidung, der
Blutdruckregulation, des Säure-Basen-Haushalts, der Blutbildung, und
der Ausscheidung harnpflichtiger Stoffe. Ferner sinkt die Bildung von
Mediatoren (Kinine, Prostaglandine) und der Abbau von Peptidhormonen.
Arterieller
Blutdruckabfall erniedrigt den Filtrationsdruck und bedingt verringerte
Harnbildung - im Kreislaufschock kann vollständige Anurie auftreten. Nierenerkrankungen
führen zu Störungen der Wasser- und Salzausscheidung, der
Blutdruckregulation, des Säure-Basen-Haushalts, der Blutbildung, und
der Ausscheidung harnpflichtiger Stoffe. Ferner sinkt die Bildung von
Mediatoren (Kinine, Prostaglandine) und der Abbau von Peptidhormonen. Einengung (Stenose) einer Nierenarterie veranlasst die betroffene Niere
zur erhöhten Freisetzung von Renin, und zwar so lange, bis der dadurch
erhöhte Blutdruck (Renin → Angiotensin!) den erhöhten
Strömungswiderstand der betroffenen Niere überwindet und die Perfusion
normalisiert (renale bzw. renovaskuläre Hypertonie, eine sekundäre
Hypertonieform, auch Goldblatt-Hochdruck genannt). Mögliche Therapie:
Nierenarterien-Angioplastie.
Einengung (Stenose) einer Nierenarterie veranlasst die betroffene Niere
zur erhöhten Freisetzung von Renin, und zwar so lange, bis der dadurch
erhöhte Blutdruck (Renin → Angiotensin!) den erhöhten
Strömungswiderstand der betroffenen Niere überwindet und die Perfusion
normalisiert (renale bzw. renovaskuläre Hypertonie, eine sekundäre
Hypertonieform, auch Goldblatt-Hochdruck genannt). Mögliche Therapie:
Nierenarterien-Angioplastie.

 Autoregulation ist unabhängig von neuraler oder
endokriner Beeinflussung und ermöglicht der Niere, ihre Perfusion zwischen ~75 (Gefäße dilatiert) und ~180 mmHg
(Gefäße kontrahiert) weitgehend konstant zu halten - bedingt durch mehrere Mechanismen: Myogen (Bayliss-Effekt), tubulo-glomeruläres Feedback
(vermehrte Filtration → mehr Kochsalz an macula densa → Feedbacksignale
an das Glomerulum durch parakrine Mediatoren → Kontraktion vas afferens
→ Filtration zurück in den Normbereich), Druckdiurese (Flüssigkeitsverlust durch
Blutdruckanstieg → erhöhter Filtrationsdruck → vermehrte
Wasserausscheidung). Die Autoregulation stabilisiert auch die
glomeruläre Filtration. Bei arteriellen Druckwerten unter 75 mmHg nimmt die Filtration
druckproportional ab, unter ~25 mmHg Kapillardruck
versiegt die glomeruläre Filtration vollständig Autoregulation ist unabhängig von neuraler oder
endokriner Beeinflussung und ermöglicht der Niere, ihre Perfusion zwischen ~75 (Gefäße dilatiert) und ~180 mmHg
(Gefäße kontrahiert) weitgehend konstant zu halten - bedingt durch mehrere Mechanismen: Myogen (Bayliss-Effekt), tubulo-glomeruläres Feedback
(vermehrte Filtration → mehr Kochsalz an macula densa → Feedbacksignale
an das Glomerulum durch parakrine Mediatoren → Kontraktion vas afferens
→ Filtration zurück in den Normbereich), Druckdiurese (Flüssigkeitsverlust durch
Blutdruckanstieg → erhöhter Filtrationsdruck → vermehrte
Wasserausscheidung). Die Autoregulation stabilisiert auch die
glomeruläre Filtration. Bei arteriellen Druckwerten unter 75 mmHg nimmt die Filtration
druckproportional ab, unter ~25 mmHg Kapillardruck
versiegt die glomeruläre Filtration vollständig  Die Niere ist dicht mit sympathischen (nicht mit parasympathischen) Nervenfasern ausgestattet; ß-adrenerge Efferenzen bewirken Vasokonstriktion (über α1A-Rezeptoren bei hoher sympathischer Aktivität), NaCl-Resorption (über α1B-Rezeptoren bei mittlerer sympathischer Aktivität), Reninsekretion (über ß-Rezeptoren bei niedriger sympathischer Aktivität). Bei exzessivem
Sympathikustonus (extremer Stress, starker Blutverlust) sinkt die
renale Durchblutung auf praktisch Null (gefährdete Nierenfunktion). Dopamin (D1-Rezeptoren) bewirkt Dilatation der Nierengefäße. Peptiderge Afferenzen leiten
Informationen von arteriellen und venösen Barorezeptoren (lokaler
Blutdruck) und Chemorezeptoren im Nierenbecken (Zusammensetzung der
interstitiellen Flüssigkeit: R1-Rezeptoren reagieren auf Hypoxie,
R2-Rezeptoren auf das Ionenmuster) an das ZNS Die Niere ist dicht mit sympathischen (nicht mit parasympathischen) Nervenfasern ausgestattet; ß-adrenerge Efferenzen bewirken Vasokonstriktion (über α1A-Rezeptoren bei hoher sympathischer Aktivität), NaCl-Resorption (über α1B-Rezeptoren bei mittlerer sympathischer Aktivität), Reninsekretion (über ß-Rezeptoren bei niedriger sympathischer Aktivität). Bei exzessivem
Sympathikustonus (extremer Stress, starker Blutverlust) sinkt die
renale Durchblutung auf praktisch Null (gefährdete Nierenfunktion). Dopamin (D1-Rezeptoren) bewirkt Dilatation der Nierengefäße. Peptiderge Afferenzen leiten
Informationen von arteriellen und venösen Barorezeptoren (lokaler
Blutdruck) und Chemorezeptoren im Nierenbecken (Zusammensetzung der
interstitiellen Flüssigkeit: R1-Rezeptoren reagieren auf Hypoxie,
R2-Rezeptoren auf das Ionenmuster) an das ZNS Die Niere kann
Kinine, Prostaglandine (durchblutungssteigernd), Thromboxane (durchblutungshemmend) bilden und reagiert auf
Parathormon, Calcitonin, Aldosteron, Angiotensin II, natriuretische
Peptide, Vasopressin. Renovaskuläre Hypertonie (Goldblatt-Mechanismus): Einengung
einer Nierenarterie auf <50% des normalen Durchmessers löst eine
Aktivierung des Renin-Angiotensin-Aldosteron-Systems aus (vermehrter
Kochsalzresorption, Steigerung des Blutdrucks) Die Niere kann
Kinine, Prostaglandine (durchblutungssteigernd), Thromboxane (durchblutungshemmend) bilden und reagiert auf
Parathormon, Calcitonin, Aldosteron, Angiotensin II, natriuretische
Peptide, Vasopressin. Renovaskuläre Hypertonie (Goldblatt-Mechanismus): Einengung
einer Nierenarterie auf <50% des normalen Durchmessers löst eine
Aktivierung des Renin-Angiotensin-Aldosteron-Systems aus (vermehrter
Kochsalzresorption, Steigerung des Blutdrucks) |
