

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Transport
im kardiovaskulären System (Kreislauf, Blut, Lymphe)

 Prinzipien der Hämodynamik, Hochdrucksystem
Prinzipien der Hämodynamik, Hochdrucksystem
© H. Hinghofer-Szalkay
 Aneurysma: ἀνά = hinauf, εὐρύς = weit (Erweiterung)
Aneurysma: ἀνά = hinauf, εὐρύς = weit (Erweiterung)
Aorta: ἀείρω = emporheben (um zu tragen)
Arterie:
ἀήρ = Luft (ar-teria = "die Luft Enthaltende" - der Befund von Luft in
den Schlagadern Verstorbener veranlasste die alexandrinische Schule zu
dem Schluss, dass den Arterien Luft aus der Lunge zugeführt wird)
Ballistokardiographie: βάλλειν = werfen (Blut wird in Aorta ausgeworfen)
Bayliss-Effekt: Sir William Bayliss (Schwager von Ernest Starling)
Blut: indogermanische Wurzel - "bhle" = quellen, aufblähen
Compliance (engl) = Fügsamkeit, Einverständnis
Darcy-Weisbach-Gleichung: Henry Darcy, Julius Weisbach
Dikrotie: δι = doppelt, κρὁτος = Schlag
Endothel: ἔνδον = innen, ζήλέὦ = wachsen
Hämodynamik: αἷμα = Blut, δύναμις = Kraft
Kapillare: capillus (lat) = Haar (Haar-Röhrchen)
Kirchhoff-Gesetze: Gustav Robert Kirchhoff
Laplace-Gesetz: Pierre-Simon Marquis de Laplace
Ohmsches Gesetz: Georg Simon Ohm
Puls: pellere, pulsum = klopfen, schlagen
Sphygmo-manometrie, -graphie: σφυγμός = Puls, Herzklopfen; μανός = dünn, μέτρον = Maß(stab), γραφή = Schrift
Traube-Hering-Mayer-Wellen: Ludwig Traube, Ewald Hering, Siegmund Mayer
vasoaktiv: vas = Gefäß, agere = bewegen, treiben
Vasodilatation: vas = Gefäß, dilatare = (aus) dehnen
Das
einfachste Kreislaufmodell besteht aus einer Pumpe (Herz) und einer
Gefäßschleife: vom Herzen weg (arteriell - hoher Druck) und zum
Herzen zurück (venös - geringer Druck).
Der periphere Widerstand enger Gefäße (vor allem der Arteriolen, aber auch kleiner
Arterien und präkapillärer Sphinkteren) ist eine virtuelle Größe; steigt sein Betrag, dann nimmt
die Strömung (Durchblutung) ab, und der Druckunterschied vor / hinter dem Widerstand nimmt zu.
Schon dieses
simple Modell zeigt fundamentale
hämodynamische Charakteristika: (1) Je höher das (Blut)Volumen, desto höher die
(Blut)Druckwerte; (2) die periphere Durchblutung im Kreislauf entspricht
dem Herzzeitvolumen; (3) je größer der periphere
Widerstand, desto stärker unterscheiden sich arterieller und venöser
Druck; (4) das (gut dehnbarere) Venensystem hat geringere Drucke (und
Druckschwankungen) als das weniger dehnbare Arteriensystem.
Unter Berücksichtigung der Gefäßaufzweigungen im Kreislauf ergibt sich, dass die hydrodynamische Leitfähigkeit des
Gefäßsystems der Summe der (parallel zueinander angeordneten)
Leitfähigkeiten der Teilkreisläufe entspricht; anders ausgedrückt: der Kehrwert des peripheren
Widerstandes ist die Summe der Kehrwerte der Einzelwiderstände.
Jedes Schlagvolumen des Herzens gelangt stoßweise in
die Aorta. Der Druck pulsiert, gedämpft durch die
Dehnbarkeit der Schlagader ("Windkesseleffekt").
Je steifer die Wände, desto größer die Blutdruckamplitude, der Unterschied zwischen maximalem
("systolischem") und minimalem ("diastolischem") Blutdruckwert.
Der periphere Widerstand
ergibt sich aus dem Zustand der Gefäße: Werden sie
enger, spricht man von Vasokonstriktion, erweitern sie sich, von
Vasodilatation. Vasokonstriktion bewirken sympathische Nervenfasern (Noradrenalin), Angiotensin, Endothelin,
Thromboxane u.a. Kollaterale Vasokonstriktion leitet Blut in Nachbargebiete mit geringerem Widerstand um.
Vasodilatation
ergibt
sich durch den weitenden Effekt des Blutdrucks (druckpassiv), insbesondere wenn vasokonstriktorische Einflüsse nachlassen (sinkender Sympathikustonus). Das kann durch Substanzen
unterstützt werden, die bei Gewebeaktivität freiwerden und auf diese Weise
perfusionsfördernd wirken (z.B. Adenosin, Stickstoffmonoxid, Prostazyklin, CO2, CGRP).
|
Form und Funktion
 Hydromechanik
Hydromechanik  Blutvolumen / Plasmavolumen
Blutvolumen / Plasmavolumen  Grundlagen der Hämodynamik
Grundlagen der Hämodynamik  Strömungsgesetz
Strömungsgesetz  Arterieller Blutdruck
Arterieller Blutdruck  Arterielle Druckwelle und Blutdruckamplitude
Arterielle Druckwelle und Blutdruckamplitude  Blutdruckschwankungen
Blutdruckschwankungen  Windkesseleffekt
Windkesseleffekt  Peripherer Widerstand
Peripherer Widerstand  Compliance
Compliance  Gefäßtonus
Gefäßtonus  Vasokonstriktion
Vasokonstriktion
 Vasodilatation und Autoregulation
Vasodilatation und Autoregulation  Kininsystem
Kininsystem

Effektives Blutvolumen  Zentrales Blutvolumen
Zentrales Blutvolumen  Hypo-, Hypervolämie
Hypo-, Hypervolämie  Transmuraler Druck
Transmuraler Druck  Blutdruckamplitude
Blutdruckamplitude  Blutdruckschwankungen 1., 2., 3. Ordnung
Blutdruckschwankungen 1., 2., 3. Ordnung  Peripherer Widerstand
Peripherer Widerstand
 Praktische Aspekte
Praktische Aspekte  Core messages
Core messages

 Abbildung: Grundlegende Organisation des Blutkreislaufsystems
Abbildung: Grundlegende Organisation des Blutkreislaufsystems
Nach einer Vorlage bei Guyton and Hall, Textbook of Medical Physiology, 15th ed. Elsevier 2026
Das Blutvolumen entspricht ungefähr 7% des Körpergewichts. Diese Blutmenge passiert im
Schnitt bei körperlicher Ruhe einmal, bei extremer Muskelanstrengung
ungefähr sechsmal pro Minute den Kreislauf. Dabei wird das Blut in der
Lunge arterialisiert (Sauerstoff aufgenommen, Kohlendioxid abgegeben);
im Darm werden Nährstoffe resorbiert; die Nieren scheiden Harn aus und
regulieren damit den Flüssigkeits- und Elektrolythaushalt; und überall
im Körper erlaubt das Kapillarnetz den Austausch von Stoffen zwischen
Blutbahn und extravasalen Räumen
 Aufgabe
des Kreislaufs (kardiovaskulären Systems) ist die Verteilung von
Stoffen im Körper - zum Zweck von Ernährung, Wachstum, Reparatur etc. Dazu
kommen die Verteilung von Wärmeenergie, Informationsübertragung
(Hormone, Zytokine, Transmitter) und Immunschutz. Schließlich kann Blut
seine hydrodynamischen Eigenschaften an die Umstände anpassen:
Einerseits ist es gut fließfähig (geringe Viskosität), andererseits
stoppt es Blutungen bei Gefäßverletzungen (hohe Viskosität).
Aufgabe
des Kreislaufs (kardiovaskulären Systems) ist die Verteilung von
Stoffen im Körper - zum Zweck von Ernährung, Wachstum, Reparatur etc. Dazu
kommen die Verteilung von Wärmeenergie, Informationsübertragung
(Hormone, Zytokine, Transmitter) und Immunschutz. Schließlich kann Blut
seine hydrodynamischen Eigenschaften an die Umstände anpassen:
Einerseits ist es gut fließfähig (geringe Viskosität), andererseits
stoppt es Blutungen bei Gefäßverletzungen (hohe Viskosität).
Die Wand von Blutgefäßen ist entsprechend ihrer Funktion aufgebaut - von einer einzigen Lage Endothelzellen  in Kapillaren
in Kapillaren  (mit
geringem Innendruck und minimaler Strömungsgeschwindigkeit) bis zu
einem dreischichtigen Bau größerer Gefäße, in denen größere Druck- und
Strömungsbelastungen herrschen. Hier unterscheidet man folgende Systeme (
(mit
geringem Innendruck und minimaler Strömungsgeschwindigkeit) bis zu
einem dreischichtigen Bau größerer Gefäße, in denen größere Druck- und
Strömungsbelastungen herrschen. Hier unterscheidet man folgende Systeme ( Abbildung):
Abbildung):
 Eine das Blut umschließende tunica intima, bestehend aus Endothelzellen
- Funktion: Unterschiedliche Durchlässigkeit (Permeabilität) für den
Austausch von Stoffen zwischen Blut und Gewebe, Limitierung / Steuerung
der Filtration (druckabhängiger Flüssigkeitsaustausch), des Gefäßtonus (Vasokonstriktion), der Angiogenese (Neubildung von Gefäßen) und der Hämostase
(Blutstillung).
Eine das Blut umschließende tunica intima, bestehend aus Endothelzellen
- Funktion: Unterschiedliche Durchlässigkeit (Permeabilität) für den
Austausch von Stoffen zwischen Blut und Gewebe, Limitierung / Steuerung
der Filtration (druckabhängiger Flüssigkeitsaustausch), des Gefäßtonus (Vasokonstriktion), der Angiogenese (Neubildung von Gefäßen) und der Hämostase
(Blutstillung).
Endothelzellen produzieren eine Basalmembran (basal lamina - <0,1 µm dick), die sie von subendothelialem Bindegewebe trennt. In
größeren Gefäßen enthält die Intima auch einige glatte Muskelzellen.
 Eine tunica media,
die von der Intima durch eine dünne elastische Schicht abgegrenzt ist.
Sie enthält glatte Muskelzellen, eingebettet in Bindegewebe aus
Kollagen, Elastin und Proteoglycanen. Zahl und Anordnung der Zellen
hängt von der Größe und Belastung der Gefäßwand ab (Arterien, Venen).
Die Muskelzellen sind über gap junctions miteinander funktionell verknüpft.
Eine tunica media,
die von der Intima durch eine dünne elastische Schicht abgegrenzt ist.
Sie enthält glatte Muskelzellen, eingebettet in Bindegewebe aus
Kollagen, Elastin und Proteoglycanen. Zahl und Anordnung der Zellen
hängt von der Größe und Belastung der Gefäßwand ab (Arterien, Venen).
Die Muskelzellen sind über gap junctions miteinander funktionell verknüpft.
 Eine tunica adventitia (tunica externa), von der tunica media wiederum durch
eine dünne elastische Schicht abgegrenzt. Diese Schicht enthält
Bindegewebe und Nerven, in größeren Gefäßen auch kleine Blutgefäße
(vasa vasorum) zur externen Versorgung mit Sauerstoff, Nährstoffen u.a.
Das Bindegewebe festigt die innere Struktur und verleiht Druckresistenz.
Eine tunica adventitia (tunica externa), von der tunica media wiederum durch
eine dünne elastische Schicht abgegrenzt. Diese Schicht enthält
Bindegewebe und Nerven, in größeren Gefäßen auch kleine Blutgefäße
(vasa vasorum) zur externen Versorgung mit Sauerstoff, Nährstoffen u.a.
Das Bindegewebe festigt die innere Struktur und verleiht Druckresistenz.

 Abbildung: Struktur der Blutgefäße
Modifiziert nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings - nach Daten in Burton AC, Relation of structure to function of the tissues of the wall of blood vessels. Physiol Rev 1954; 34: 619-42
Abbildung: Struktur der Blutgefäße
Modifiziert nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings - nach Daten in Burton AC, Relation of structure to function of the tissues of the wall of blood vessels. Physiol Rev 1954; 34: 619-42
Innendurchmesser, Wanddicke und relativer Anteil der Gewebearten
von großen und kleinen Blutgefäßen. Die Beteiligung von elastischem,
Muskel- und Bindegewebe (Kollagenfasern) richtet sich nach den kolalen
Belastungen. Transplantiert man z.B. eine Vene in den arteriellen
Kreislaufteil, organisiert sie ihre Morphologie entsprechend den
veränderten mechanischen Anforderungen um.
Große Arterien - insbesondere die Aorta - haben einen
hohen Anteil an Elastin, das passive Windkesselfunktion (Auffangen
eines Teils des Schlagvolumens, Zwischenspeicherung kinetischer zu
potentieller Energie) unterstützt.
Arteriolen
weisen eine starke Muscularis ihrer Wand auf, die sich aktiv an die
aktuellen Erfordernisse (Perfusion, Widerstand) anpassen kann
(gesteuert durch den Einfluss autonomer Nerven, durch Autoregulation,
hormonelle und thermische Einflüsse).
Kapillaren haben keine Muscularis, verfügen nur über Endothelien, ihre dünne Wand erlaubt die Passage von Nährstoffen, Elektrolyten, Signalsubstanzen, Wasser.
Venen haben meist relativ gering ausgebildete Muscularis und einen niedrigeren Anteil an
elastischem Gewebe, es gibt aber lokale Unterschiede (z.B. sind die
Venen der unteren Extremitäten im Stehen stark druckbelastet und entsprechend wandstark, auch die beträchtlichen mechanischen Belastungen ausgesetzte Hohlvene hat gut entwickelte Bindegewebs- und Muscularisschichten). Venen zeichnen sich durch hohe
Volumenspeicherkapazität (Dehnungscompliance) aus
 Endothelzellen bilden eine einschichtige Innenlage in allen Blutgefäßen. Kapillaren bestehen nur aus Endothel (
Endothelzellen bilden eine einschichtige Innenlage in allen Blutgefäßen. Kapillaren bestehen nur aus Endothel ( s. dort), alle anderen Gefäße verfügen auch - in unterschiedlichem Ausmaß, je nach Funktion - über folgende Komponenten:
s. dort), alle anderen Gefäße verfügen auch - in unterschiedlichem Ausmaß, je nach Funktion - über folgende Komponenten:
 Elastische Fasern können gummiartig Dehnungskräfte aufnehmen, speichern und retournieren - insbesondere in Arterien (über Elastin
Elastische Fasern können gummiartig Dehnungskräfte aufnehmen, speichern und retournieren - insbesondere in Arterien (über Elastin  s. dort)
s. dort)
 Kollagenfasern stellen eine kaum dehnbare Stützstruktur dar (zu Kollagen
Kollagenfasern stellen eine kaum dehnbare Stützstruktur dar (zu Kollagen  vgl. dort)
vgl. dort)
 Glatte Muskulatur
ist in der Gefäßwand spiralig angeordnet, in elastischen Arterien eher
parallel zur Längsachse, in muskulären eher ringförmig (je nach
Funktion) - näheres zu Gefäßwand, Vasokonstriktion und Vasodilatation
Glatte Muskulatur
ist in der Gefäßwand spiralig angeordnet, in elastischen Arterien eher
parallel zur Längsachse, in muskulären eher ringförmig (je nach
Funktion) - näheres zu Gefäßwand, Vasokonstriktion und Vasodilatation  s. dort
s. dort
Zusammensetzung der Gefäßwände (%)

Werte nach Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
|
|
Endothel
|
Glatter Muskel
|
Elastin
|
Kollagen
|
Arterie
(Windkessel)
|
5
|
25
|
40
|
27
|
Arteriole
|
10
|
60
|
10
|
20
|
Kapillare
|
95
|
0
|
0
|
5 *
|
Venole
|
20
|
20
|
0
|
60
|
* Basalmembran
Anpassungsfähigkeit: Wird ein
Gefäß an eine Stelle mit unterschiedlichem Belastungsprofil verbracht
(z.B. Transplantation einer Vene in einen arteriellen Abschnitt),
ändert es seine Zusammensetzung und damit seine biologischen
Eigenschaften entsprechend den Anforderungen seiner neuen Umgebung.
(Hydro-) Mechanik und Kreislauffunktionen
Hydromechanik
beschreibt das Verhalten von Flüssigkeiten - sowohl von
unbewegten (Hydrostatik) als auch strömenden (Hydrodynamik). Blut ist eine komplexe (nicht-Newtonische) Flüssigkeit, sein Verhalten im
Kreislauf lässt sich aber gut über hydromechanische Prinzipien
beschreiben.
So gilt beispielsweise, dass eine bereits beschleunigte
(etwa aus dem Ventrikel ausgeworfene) Blutsäule wegen
ihrer Massenträgheit dazu tendiert, weiter zu strömen; dass der Aufbau
eines Druckgradienten (wie durch Kontraktion von Herz-, Gefäß- oder
Skelettmuskulatur) Blut strömen lässt; oder dass in einem
flüssigkeitsgefüllten System Druckunterschiede auftreten, wenn es einer
Beschleunigung unterworfen wird (hydrostatische Druckgradienten in
Arterien, Venen und anderen flüssigkeitsgefüllten Hohlräumen) - wie im
alltäglichen Beispiel der Verhinderung des freien Falls durch eine
Gegenkraft (etwa beim Stehen auf festem Untergrund).

 Abbildung: Stark vereinfachte Darstellung des kardiovaskulären Systems
Nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Abbildung: Stark vereinfachte Darstellung des kardiovaskulären Systems
Nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Reduziert auf Pumpe (Herz), Verteilersystem
unter hohem Druck (Arterien), Druckreduktion (Arteriolen),
Versorgungsgefäße (Kapillaren), Blutspeicher (periphere Venen) und
Gefäße, deren Füllung die Vorlast des Herzens bestimmt (zentralvenöser
Teil)

Hämodynamik  ist die Übertragung
der Gesetze der Hydrodynamik auf das spezielle Anwendungsgebiet der
Blutströmung. Sie muss u.a. berücksichtigen, dass Blut als "flüssiges
Gewebe" (Blutkörperchen in Blutplasma suspendiert, mit
unterschiedlichem und jeweils komplexem biomechanischem Eigenschaften)
in seinem hydrodynamischen Verhalten zum Teil erheblich von einer
einfachen Flüssigkeit (wie Wasser, aus dem Blut hauptsächlich besteht)
abweicht.
ist die Übertragung
der Gesetze der Hydrodynamik auf das spezielle Anwendungsgebiet der
Blutströmung. Sie muss u.a. berücksichtigen, dass Blut als "flüssiges
Gewebe" (Blutkörperchen in Blutplasma suspendiert, mit
unterschiedlichem und jeweils komplexem biomechanischem Eigenschaften)
in seinem hydrodynamischen Verhalten zum Teil erheblich von einer
einfachen Flüssigkeit (wie Wasser, aus dem Blut hauptsächlich besteht)
abweicht.
Das
Herz beansprucht bis zu 10% des Energieumsatzes im Körper (steigt dessen Umsatz, hat auch der Herzmuskel mehr zu leisten). Jeden Tag werden bis zu ~10.000
Liter Blut  transportiert, gegen einen arteriellen
transportiert, gegen einen arteriellen  Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel).
Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel).
Da es immer
noch üblich ist, den Blutdruck in Millimetern Quecksilbersäule
anzugeben, ist die Kenntnis der Umrechnung in die SI-Einheit Kilopascal
wichtig (1 mmHg entspricht etwa 0,13 kPa).

Über das
SI-System (Präfixe und Einheiten)
s.
dort
Blutvolumen und Plasmavolumen
 Zum Blutvolumen s. auch dort, zu seiner Messung s. dort
Zum Blutvolumen s. auch dort, zu seiner Messung s. dort
Das Blutvolumen insgesamt beträgt 5-10% des Körpergewichts,
je nach Körperzusammensetzung (bei hohem Fettanteil ist der Prozentsatz niedrig, bei schlanken
Menschen höher, bei normalgewichtigen Kindern recht hoch - 8-9%). Bei 70 kg Körpermasse kann man von ~5 Liter Blut ausgehen (7-8% des Körpergewichts).

 Abbildung: Verteilung hämodynamischer Grundgrößen über den systemischen Kreislauf (schematisch)
Nach einer Vorlage in Thies R, Physiology, 3rd ed. Springer 1992
Abbildung: Verteilung hämodynamischer Grundgrößen über den systemischen Kreislauf (schematisch)
Nach einer Vorlage in Thies R, Physiology, 3rd ed. Springer 1992
Oben: Den größten Anteil am Strömungswiderstand des Gefäßbaums haben die Arteriolen. Der Hauptanteil des Blutvolumens liegt in den Venolen, gefolgt von den Venen. Die größte Querschnittsfläche bieten insgesamt die Kapillaren (daher ist ihr Anteil am Strömungswiderstand vergleichsweise gering).
Darunter: Die Strömungsgeschwindigkeit des Blutes ist im Kapillarbereich am geringsten. Der mittlere Blutdruck sinkt vom arteriellen zum venösen Schenkel des Kreislaufs kontinuierlich ab

 Derjenige Teil des venösen Blutvolumens, den das
rechte
Herz unmittelbar als funktionelle Reserve mobilisieren kann (unscharfe Definition), wird manchmal als effektives
Blutvolumen (effective circulating volume) bezeichnet. Man versteht darunter
die Blutmenge, die für die Perfusion lebenswichtiger Organe zur
Verfügung stehen muss (also für die "Notversorgung" des Kreislaufs).
Die Kontrolle dieses Volumens (das über Mikrozirkulation und Lymphkreislauf eng mit dem extrazellulären Volumen verknüpft ist) unterliegt einerseits den Barorezeptoren (ausreichender arterieller Druck?), andererseits den Niederdruckrezeptoren (kardiopulmonäre
Rezeptoren in Ventrikeln, Vorhöfen, a. pulmonalis). Beteiligt an der
Stabilisierung des effektiven Blutvolumens sind weiters Gefäßrezeptoren
in Nieren, Leber sowie Osmorezeptoren im Gehirn.
Derjenige Teil des venösen Blutvolumens, den das
rechte
Herz unmittelbar als funktionelle Reserve mobilisieren kann (unscharfe Definition), wird manchmal als effektives
Blutvolumen (effective circulating volume) bezeichnet. Man versteht darunter
die Blutmenge, die für die Perfusion lebenswichtiger Organe zur
Verfügung stehen muss (also für die "Notversorgung" des Kreislaufs).
Die Kontrolle dieses Volumens (das über Mikrozirkulation und Lymphkreislauf eng mit dem extrazellulären Volumen verknüpft ist) unterliegt einerseits den Barorezeptoren (ausreichender arterieller Druck?), andererseits den Niederdruckrezeptoren (kardiopulmonäre
Rezeptoren in Ventrikeln, Vorhöfen, a. pulmonalis). Beteiligt an der
Stabilisierung des effektiven Blutvolumens sind weiters Gefäßrezeptoren
in Nieren, Leber sowie Osmorezeptoren im Gehirn.
Die Größe des effektiven Blutvolumens steht unter dem Einfluss folgender Steuerfaktoren ( vgl. dort):
vgl. dort):
 Sympathische Aktivität
wirkt volumenerhaltend bzw. -steigernd. Der Sympathikustonus kann als
Antwort auf sinkendes effektives Blutvolumen oder im Rahmen einer
generellen Stressreaktion (körperliche Belastung, Blutverlust,
Trauma..) zunehmen. Schon niedrige sympathische Aktivität erhöht die
tubuläre Natriumresorption und
damit extrazelluläres Volumen und effektives Blutvolumen (Stützung der
Kreislauffunktion). Zunehmende Aktionspotentialfrequenz sympathischer
Efferenzen zur Niere regt die Reninfreisetzung an, was das Angiotensinsystem stimuliert (s. nächster Punkt). Höhere sympathische Aktivität schließlich bewirkt Vasokonstriktion,
dies senkt renale Durchblutung und Filtration. Zunächst konzentriert
sich die Wirkung auf die vasa efferentia, was die glomeruläre
Filtration stabilisiert; bei sehr hoher Aktivität nimmt die Wirkung
auch an den vasa afferentia stark zu, und auch die glomeruläre
Filtration nimmt deutlich ab.
Sympathische Aktivität
wirkt volumenerhaltend bzw. -steigernd. Der Sympathikustonus kann als
Antwort auf sinkendes effektives Blutvolumen oder im Rahmen einer
generellen Stressreaktion (körperliche Belastung, Blutverlust,
Trauma..) zunehmen. Schon niedrige sympathische Aktivität erhöht die
tubuläre Natriumresorption und
damit extrazelluläres Volumen und effektives Blutvolumen (Stützung der
Kreislauffunktion). Zunehmende Aktionspotentialfrequenz sympathischer
Efferenzen zur Niere regt die Reninfreisetzung an, was das Angiotensinsystem stimuliert (s. nächster Punkt). Höhere sympathische Aktivität schließlich bewirkt Vasokonstriktion,
dies senkt renale Durchblutung und Filtration. Zunächst konzentriert
sich die Wirkung auf die vasa efferentia, was die glomeruläre
Filtration stabilisiert; bei sehr hoher Aktivität nimmt die Wirkung
auch an den vasa afferentia stark zu, und auch die glomeruläre
Filtration nimmt deutlich ab.
 Renin-Angiotensin-System:
Angiotensin II hat mehrere Wirkungen auf die renale Hämodynamik, der
Gesamteffekt kann je nach den Umständen verschieden ausfallen.
Normalerweise überwiegt die Wirkung auf die vasa efferentia (Prostaglandine wirken am vas afferens antikonstriktorisch), was die glomeruläre Filtration auch bei geringerer Perfusion kaum sinken läßt.
Renin-Angiotensin-System:
Angiotensin II hat mehrere Wirkungen auf die renale Hämodynamik, der
Gesamteffekt kann je nach den Umständen verschieden ausfallen.
Normalerweise überwiegt die Wirkung auf die vasa efferentia (Prostaglandine wirken am vas afferens antikonstriktorisch), was die glomeruläre Filtration auch bei geringerer Perfusion kaum sinken läßt.
 Vasopressin
wirkt als "Wassersparhormon" und kann (bei höherer Konzentration) auch
den Gefäßwiderstand erhöhen (was den Blutdruck zu stabilisieren hilft).
Vasopressin kann die Durchblutung des Nierenmarks
reduzieren und dadurch das "Ausschwemmen" des hypertonen Markgewebes
gering halten (die hohe Osmolalität im Mark ist für die
Wasserresorption nötig).
Vasopressin
wirkt als "Wassersparhormon" und kann (bei höherer Konzentration) auch
den Gefäßwiderstand erhöhen (was den Blutdruck zu stabilisieren hilft).
Vasopressin kann die Durchblutung des Nierenmarks
reduzieren und dadurch das "Ausschwemmen" des hypertonen Markgewebes
gering halten (die hohe Osmolalität im Mark ist für die
Wasserresorption nötig).
 Natriuretische Peptide: Auf Erhöhung des zentralen Blutvolumens reagieren Herzmuskelzellen im Vorhof mit der Freisetzung von ANP. Dieses bewirkt Vasodilatation der vasa afferentia und efferentia - auch die Empfindlichkeit des tubulo-glomerulären Feedbacks (TGF) nimmt ab - und
wirkt dadurch durchblutungs- und filtrationssteigernd. Indirekt wird
auch die Reninfreisetzung gehemmt. Das bewirkt insgesamt einen
natriuretisch-diuretischen Effekt, das extrazelluläre
Flüssigkeitsvolumen, effektive Blutvolumen und damit die kardiale Vorlast nehmen ab.
Natriuretische Peptide: Auf Erhöhung des zentralen Blutvolumens reagieren Herzmuskelzellen im Vorhof mit der Freisetzung von ANP. Dieses bewirkt Vasodilatation der vasa afferentia und efferentia - auch die Empfindlichkeit des tubulo-glomerulären Feedbacks (TGF) nimmt ab - und
wirkt dadurch durchblutungs- und filtrationssteigernd. Indirekt wird
auch die Reninfreisetzung gehemmt. Das bewirkt insgesamt einen
natriuretisch-diuretischen Effekt, das extrazelluläre
Flüssigkeitsvolumen, effektive Blutvolumen und damit die kardiale Vorlast nehmen ab.

Zur
Bestimmung des extrazellulären Flüssigkeitsvolumens s.
dort
Auch niedrige ANP-Spiegel (bei denen die glomeruläre Filtration noch unbeeinflusst bleibt) können natriuretisch wirken, indem sie die tubuläre Natriumresorption senken: Durch Senkung der Aldosteronfreisetzung aus der Nebenniere und durch direkte Reduktion der Natriumresorption im Sammelrohr.
 Das zentrale Blutvolumen liegt zwischen Pulmonal- und Aortenklappe - ein Teil davon kann vom linkenHerzen
als unmittelbare Füllungsreserve herangezogen werden (wenn der
venöse Blutnachschub aus der Peripherie zum rechten Herzen
vorübergehend nachlässt). Auch diese Definition ist insoferne unscharf,
als der Inhalt des rechten Ventrikels manchmal dazugezählt wird
("volumes of heart chambers and pulmonary circulation").
Das zentrale Blutvolumen liegt zwischen Pulmonal- und Aortenklappe - ein Teil davon kann vom linkenHerzen
als unmittelbare Füllungsreserve herangezogen werden (wenn der
venöse Blutnachschub aus der Peripherie zum rechten Herzen
vorübergehend nachlässt). Auch diese Definition ist insoferne unscharf,
als der Inhalt des rechten Ventrikels manchmal dazugezählt wird
("volumes of heart chambers and pulmonary circulation").
Der Großteil des Blutvolumens (84%) befindet sich im systemischen
Kreislauf, und hier vor allem im Venensystem (64%); knapp 9% entfallen
auf den Pulmonalkreislauf, gut 7% auf das Herz am Ende der Diastole
(Tabelle):

Verteilung des Blutvolumens

Absolutwerte: 70 kg schwere Frau. Bei einem 70 kg schweren Mann liegen die Absolutwerte um 10% höher.

Nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
|
Region
|
Absolutes Volumen (ml)
|
Relatives Volumen (%)
|
Systemischer Kreislauf
|
4200
|
84
|
Aorta und große Arterien
|
300
|
6
|
Kleine Arterien
|
400
|
8
|
Kapillaren
|
300
|
6
|
Kleine Venen
|
2300
|
46
|
Große Venen
|
900
|
18
|
Pulmonal-
kreislauf
|
440
|
8,8
|
Arterien
|
130
|
2,6
|
Kapillaren
|
110
|
2,2
|
Venen
|
200
|
4,0
|
Herz (Ventrikel,
enddiastolisch)
|
360
|
7,2
|
Gesamt
|
5000
|
100
|
Gerundet bedeutet das: Das Hochdrucksystem beinhaltet ~15%, das Niederdrucksystem ~80%, die Herzräume haben ~5% des gesamten Blutvolumens. Also bei 5 Liter Blutvolumen: Hochdrucksystem ~0,75 Liter, Niederdrucksystem ~4 Liter, Herzräume ~0,25 Liter (enddiastolisches Ventrikelvolumen jeweils ~0,13 l).
Das größte Blutreservoir liegt in den Venen;
Vasodilatation in diesem Kreislaufabschnitt hat große funktionelle
Folgen, wenn hier der Druck sinkt und weniger Blut zur Herzen
zurückströmt, mit der möglichen Folge eines Kreislaufkollapses (Synkope). Auch Veränderungen des Blutvolumens haben entsprechende Folgen:
 Als Hypovolämie bezeichnet man ein reduziertes Blutvolumen infolge
Als Hypovolämie bezeichnet man ein reduziertes Blutvolumen infolge
 Blutverlust (Stadium 1: bis -15%, Stadium 2: bis -30%, Stadium 3: bis -40%, Stadium 4: über -40%),
Blutverlust (Stadium 1: bis -15%, Stadium 2: bis -30%, Stadium 3: bis -40%, Stadium 4: über -40%),
 Dehydration (Abnahme des extrazellulären und damit auch Blutvolumens),
Dehydration (Abnahme des extrazellulären und damit auch Blutvolumens),
 Salzmangel (weil NaCl Wasser im Körper hält, s. Osmoregulation).
Unter Hypervolämie versteht man ein erhöhtes Blutvolumen - z.B. infolge
Salzmangel (weil NaCl Wasser im Körper hält, s. Osmoregulation).
Unter Hypervolämie versteht man ein erhöhtes Blutvolumen - z.B. infolge
 Salz-Wasser-Retention (Nierenversagen),
Salz-Wasser-Retention (Nierenversagen),
 Infusion von Plasmaersatzflüssigkeiten, Plasmaeiweiß, hypertonen
Flüssigkeiten.
Infusion von Plasmaersatzflüssigkeiten, Plasmaeiweiß, hypertonen
Flüssigkeiten.
Je größer ein Volumenverlust, desto schwieriger ist die physiologische
Kompensation der unzureichenden Füllung des Herzens (mangelhaftes preload) und
Aufrechterhaltung von Blutdruck und Durchblutung.
Rechtes und linkes Herz greifen bei plötzlicher Steigerung der Herzleistung auf das ihnen vorgelagerte Blutvolumen zurück:

Zur
Regulation des Blutvolumens s. dort, zur
Messung des Blutvolumens s. dort
Grundlagen der Hämodynamik
Hämodynamik beschreibt die Wechselwirkungen zwischen Volumen, Druck, Blutströmung
und mechanischen / geometrischen Eigenschaften der Gefäßwände.
Die zugrundeliegenden hydrodynamischen Prinzipien beschreiben z.B.
Umstellungen bei Änderung der Körperlage, der Durchblutung von
Teilkreisläufen, plötzlicher Verringerung (Hämorrhagie) oder Erhöhung
(Transfusion) des Blutvolumens.

 Abbildung:
Einfluss von Blutvolumen, Herzleistung, Gefäßwiderstand und -dehnbarkeit
auf hämodynamische Kenngrößen in einem simplen mechanischen Modell
Abbildung:
Einfluss von Blutvolumen, Herzleistung, Gefäßwiderstand und -dehnbarkeit
auf hämodynamische Kenngrößen in einem simplen mechanischen Modell
Nach einer Vorlage in H. Hinghofer-Szalkay: Praktische Physiologie, 3. Aufl. Blackwell Berlin 1994

Blutströmung: Damit Blut durch ein Hohlorgan bzw. Gefäß fließt, muss es entweder beschleunigt worden sein (und strömt aufgrund der Massenträgheit wie ein abgefeuertes Geschoß weiter, z.B. aus dem Herzen Richtung Aorta während der Austreibungszeit); oder es wird durch einen Druckgradienten befördert (z.B. von einer Arterie in eine Vene). Druckunterschiede im Kreislauf können hydrostatisch auftreten ("unten" höher als "oben") oder durch Kräfte aus dem Herzen (Systole) oder der Gefäßwand (Vasokonstriktion). Der wichtigste Faktor, der Blut durch den Kreislauf treibt, ist der Aufbau und Erhalt von Druckunterschieden.
Obwohl die Höhe und Regulation von
Blutdruck und Durchblutung von vielen zusätzlichen biologischen Faktoren abhängt, wie z.B. von der
Salz-Wasser-Bilanz des Körpers, kann der
Kreislauf für Kurzzeiteffekte als geschlossenes, elastisches System
betrachtet werden, in dem die Gesetze der Hämodynamik gelten.
Gesamtkreislauf: Den größten
Anteil des Strömungswiderstandes im Kreislauf bieten kleine Arterien und vor allem die Arteriolen, in
den Kapillaren ist der Druck (mit wenigen Ausnahmen, z.B. Glomerulumkapillaren) fast auf venöses Niveau abgesunken.

 Abbildung: Kreislauf in Zahlen
Abbildung: Kreislauf in Zahlen
Modifiziert nach einer Vorlage bei R. TannerThies: Physiology - An Illustrated Review. Thieme 2011
Arteriensystem: Größter Druck, größte Strömungsgeschwindigkeit
Arteriolen: Größter Strömungswiderstand
Kapillaren  : Größte Anzahl, größte Oberfläche
: Größte Anzahl, größte Oberfläche
Venen: Größtes Volumen
Die Zahlen verstehen sich als Annäherungen.
Große Arterien haben einen Durchmesser von >10 mm, kleine ~1 mm, Arteriolen ~0,03 mm, Kapillaren ~6 µm, große Venen
>15 mm.
Der Gesamtquerschnitt der Kapillaren ist im Lungenkreislauf (~4000 cm2) größer - und der Strömungswiderstand geringer - als im großen Kreislauf (~3000 cm2).
Kapillaren bieten bei einer erwachsenen Person eine
Austauschfläche von ~90 m2 in der Lunge, ~280 m2 in der Skelettmuskulatur.

Der venöse Druck im Kreislauf ist (im Mittel) gering und verändert
sich kaum - abgesehen von lageabhängigen
(hydrostatischen) Druckunterschieden:
Im Stehen ist der Venendruck über
die Längsachse des Körpers sehr unterschiedlich (kollabierte Venen im
Kopf-Hals-Bereich, prall gefüllte Venen in unteren Körperpartien), und
bei Lagewechsel kommt es zu starken Volumenverschiebungen und
Veränderungen des Herzzeitvolumens (Stehen ~5 l/min, Liegen ~7 l/min).
 Der transmurale Druck ist der
Unterschied zwischen Innen- und Außendruck (Blutdruck minus Gewebedruck) an
der Gefäßwand. Steigt der transmurale Druck, wird das
Gefäß gedehnt, sein Durchmesser nimmt zu.
Der transmurale Druck ist der
Unterschied zwischen Innen- und Außendruck (Blutdruck minus Gewebedruck) an
der Gefäßwand. Steigt der transmurale Druck, wird das
Gefäß gedehnt, sein Durchmesser nimmt zu.
Eine Zunahme des Innendurchmessers senkt den
Gefäßwiderstand. Bei Gefäßen, die sich druckpassiv verhalten (z.B. im Pulmonalkreislauf), ist dieser Zusammenhang sozusagen ungestört, und jeweils unten gelegene Lungenabschnitte (Gefäße durch höheren hydrostatischen Druck stark aufgedehnt) werden so besser durchblutet als jeweils oben gelegene (was zur besseren Belüftung unten gelegener Alveolen passt).
Anders verhält es sich, wenn das Gefäß auf Dehnung aktiv mit Kontraktion seiner media reagiert (Bayliss-Effekt).
Zahlen zu Blutgefäßen (gerundet)
Nach
Camasao DB, Mantovani D, The mechanical characterization of blood
vessels and their substitutes in the continuous quest for
physiological-relevant performances. A critical review. Materials Today
Bio 2021; 10: 100106
|
|
große Arterien
|
mittlere Arterien
|
kleine Arterien
|
kleine Venen
|
mittlere Venen
|
große Venen
|
Durchmesser (mm)
|
>10
|
6-10
|
1-6
|
1-6
|
6-15
|
>15
|
Wanddicke (µm)
|
1500
|
1000
|
125-800
|
40-500
|
800
|
1200
|
Gesamtlänge (mm)
|
400
|
8000
|
160000
|
160000
|
8000
|
400
|
Druck (mmHg)
|
100
|
100
|
90-95
|
15
|
10
|
5
|
Die Aorta unterliegt
hohem transmuralem Druck (systolisch bis 29 kPa - 220 mmHg - bei
sportlichen Spitzenbelastungen) und hat einen großen Gefäßdurchmesser
(innen ~25 mm). Das bedeutet hohe
Wandspannung.
Diese wird durch eine besonders stark ausgeprägte Elastinschicht in der Außenwand aufgefangen. Elastin ist ein auf das Doppelte seiner Ruhelänge dehnbares
Protein; es ermöglicht die Zwischenspeicherung eines Teils des vom linken
Ventikel ausgeworfenen Schlagvolumens.
Auch die mittlere Muscularis- und die innere Kollagenlage sind kräftig
entwickelt. Gemeinsam fangen diese Schichten die hohe Wandspannung der
Aorta auf.
Elastische Fasern
kommen nicht nur im Kreislauf vor (druckresistente Gefäße,
Herzklappen), sondern auch in Lunge, Haut, Auge (Linse), Skelettsystem
(Bänder) u.a. Sie bestehen in erster Linie aus dem Protein Elastin,
das stark hydrophobe Abschnitte enthält (diese vermitteln die
elastischen Eigenschaften) und dessen gekrümmte Moleküle miteinander
quervernetzt sind. Bei Dehnung orientieren sie sich gemeinsam in
Zugrichtung um, wobei sie kollektiv eine dehnungsproportionale
Gegenkraft entwickeln.
Bei der Bildung elastischer Fasern gehen der Sekretion von Elastin Mikrofibrillen voraus (insbesondere das Glykoprotein Fibrillin,
an das dann Elastin - das aus seiner Vorstufe Tropoelastin entsteht - bindet). Sie wirken als "Platzhalter" (z.B. bei der
Entwicklung der Linse im Auge) und bilden ein Gerüstwerk, an dem sich
die Organisation des Elastins im betreffenden Bindegewebe orientiert.
Mutation des Fibrillin-1-Gens (in der Mehrzahl der Fälle vererbt) verursacht das Marfan-Syndrom, bei dem bindegewebig-elastische Elemente in Skelettsystem, Augen, Herz, Gefäßsystem, Lunge betroffen sind.
Elastin ist besonders gut
dehnbar - ein Netzwerk aus Elastinfasern kann um mehr als 100% der
Ausgangslänge seiner Elemente gedehnt werden, bevor es zu Einrissen
kommt (Kollagen kann nur um 3-4% ohne strukturelle Schäden gedehnt werden).
Arterielle Hypertonie kombiniert mit Wandschwäche kann zur Ausbildung von Aortenaneurysmen
 (Aussackungen)
führen. An der betroffenen Stelle nimmt der
Gefäßdurchmesser noch mehr zu, und ein circulus vitiosus tritt auf: Die
Wandspannung steigt weiter, es kann zum Einreißen der Gefäßwand kommen.
Rupturiert die Innenwand (tunica intima), dringt Blut in die Aortenwand
ein (Aortendissektion). Das kann zu Aortenruptur führen - mit Blutverlust nach retroperitoneal (20%) oder in die freie Bauchhöhle (80%).
(Aussackungen)
führen. An der betroffenen Stelle nimmt der
Gefäßdurchmesser noch mehr zu, und ein circulus vitiosus tritt auf: Die
Wandspannung steigt weiter, es kann zum Einreißen der Gefäßwand kommen.
Rupturiert die Innenwand (tunica intima), dringt Blut in die Aortenwand
ein (Aortendissektion). Das kann zu Aortenruptur führen - mit Blutverlust nach retroperitoneal (20%) oder in die freie Bauchhöhle (80%).
 Arterien sind durch den Blutdruck meist aufgedehnt (positiver transmuraler Druck); sie verfügen über eine stark ausgeprägte Muskelschicht
zwischen der äußeren Elastin- und der inneren Kollagenlage, um dem
Dehnungsdruck standzuhalten und ihm aktiv zu begegnen (Gefäßtonus). Gelegentlich können auch Arterien kollabieren (negativer transmuraler Druck), z.B. subendokardiale Gefäße im linken Ventrikel während der Systole. Der Lungenkreislauf
ist durch entsprechende Zonen ausgezeichnet (in aufrechter Lage sind
die apikalen Gebiete nur während der systolischen Blutdruckspitzen
geöffnet).
Arterien sind durch den Blutdruck meist aufgedehnt (positiver transmuraler Druck); sie verfügen über eine stark ausgeprägte Muskelschicht
zwischen der äußeren Elastin- und der inneren Kollagenlage, um dem
Dehnungsdruck standzuhalten und ihm aktiv zu begegnen (Gefäßtonus). Gelegentlich können auch Arterien kollabieren (negativer transmuraler Druck), z.B. subendokardiale Gefäße im linken Ventrikel während der Systole. Der Lungenkreislauf
ist durch entsprechende Zonen ausgezeichnet (in aufrechter Lage sind
die apikalen Gebiete nur während der systolischen Blutdruckspitzen
geöffnet).
 In Arteriolen ist die relative
Ausprägung der Muscularisschicht am höchsten; Arteriolen können ihren
Durchmesser aktiv besonders gut regulieren (lokal-metabolisch,
neuronal-sympathisch oder humoral bedingt).
In Arteriolen ist die relative
Ausprägung der Muscularisschicht am höchsten; Arteriolen können ihren
Durchmesser aktiv besonders gut regulieren (lokal-metabolisch,
neuronal-sympathisch oder humoral bedingt).
 Etwa 1-3.1010 Kapillaren (Länge ≤1 mm, Durchmesser 4-8 µm) versorgen den Körper mit Blut. Ihre Austauschoberfläche kann mehrere dm2 pro Gramm Gewebe betragen.
Etwa 1-3.1010 Kapillaren (Länge ≤1 mm, Durchmesser 4-8 µm) versorgen den Körper mit Blut. Ihre Austauschoberfläche kann mehrere dm2 pro Gramm Gewebe betragen.
Arteriolen verzweigen sich stark, ihre Zahl ist geringer als die der entsprechenden (parallel geschalteten) Kapillaren
|
 Venen
können
gut mit Blut gefüllt (vor allem im Stehen in der unteren Körperhälfte)
oder auch kollabiert sein (bei negativem transmuralen Druckbetrag -
vgl. dort). Bei 45-Grad-Lagerung liegt der Kollapspunkt der Jugularvene normalerweise etwa 2 cm über dem Sternum (
Venen
können
gut mit Blut gefüllt (vor allem im Stehen in der unteren Körperhälfte)
oder auch kollabiert sein (bei negativem transmuralen Druckbetrag -
vgl. dort). Bei 45-Grad-Lagerung liegt der Kollapspunkt der Jugularvene normalerweise etwa 2 cm über dem Sternum ( s. dort).
Die Venenwand besteht zu mehr als der Hälfte aus Kollagen; dieses ist
wesentlich weniger dehnbar als Elastin (Faktor 100) und verhindert eine
Überdehnung der Kapazitätsgefäße bei Steigerung des Innendrucks (bis zu
einem Punkt, bei dem sich die locker angeordneten Kollagenfasern zu
einer scherengitterartigen, festen Struktur ordnen, sind die Venen sehr
leicht dehnbar).
s. dort).
Die Venenwand besteht zu mehr als der Hälfte aus Kollagen; dieses ist
wesentlich weniger dehnbar als Elastin (Faktor 100) und verhindert eine
Überdehnung der Kapazitätsgefäße bei Steigerung des Innendrucks (bis zu
einem Punkt, bei dem sich die locker angeordneten Kollagenfasern zu
einer scherengitterartigen, festen Struktur ordnen, sind die Venen sehr
leicht dehnbar).
Der funktionelle Unterschied zwischen den Gefäßabschnitten spiegelt
sich in ihrer Zusammensetzung wider: In Kapillaren überwiegt das
Endothel (95%), das in elastischen Arterien nur 5% ihrer Masse
ausmacht; glatte Muskulatur dominiert in Arteriolen (60%); elastische
Arterien sind reich an Elastin (40%); und Venolen bestehen zu 60% aus
Kollagen (Tabelle):
Zusammensetzung der Wand von Blutgefäßen (%, gerundet)

Nach Herring / Paterson: Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
|
|
Endothel
|
glatter Muskel
|
Elastin
|
Kollagen
|
Elastische Arterie
|
5
|
25
|
40
|
27
|
Arteriole
|
10
|
60
|
10
|
20
|
Kapillare
|
95
|
0
|
0
|
5 *
|
Venole
|
20
|
20
|
0
|
60
|
* Basalmembran
Die
Aorta (Durchmesser 2,6 cm) sowie die Hauptschlagadern der Beine (aa.
iliacae) und der Lunge (aa. pulmonales) - jeweils mit 1-2 cm
Durchmesser - expandieren mit jedem Herzschlag um etwa 10% und nehmen
so das Schlagvolumen elastisch auf (Windkesselgefäße) - ermöglicht
durch ihren hohen Massenanteil an Elastin, das 6-mal dehnbarer als Gummi ist.
Diese "Windkesselfunktion" wirkt wie ein Stoßdämpfer und entlastet das
Herz. Während der Systole wird so mechanische Energie gespeichert, in
der Zeit der Diastole wieder abgerufen, der Blutdruck stabilisiert, und
die Perfusion der Peripherie erfolgt ziemlich stetig.
Versteifung der elastischen Gefäße (Arteriosklerose) erhöht den Anteil der notwendigen kardialen Beschleunigungsarbeit und kann den Energieaufwand bis zu verdoppeln.
 Die Laplace-Beziehung besagt, dass die dehnende Kraft in der Gefäßwand
(der diese standhalten muss, meist unter Zuhilfenahme der glatten
Gefäßmuskulatur) mit
Druckbelastung und Gefäßdurchmesser zunimmt; und dass die Spannung in
der Gefäßwand mit deren Dicke (d) abnimmt. Aus
diesem Grund haben große Arterien besonders dicke Wände, während Venen
mit dünnen Wänden auskommen.
Die Laplace-Beziehung besagt, dass die dehnende Kraft in der Gefäßwand
(der diese standhalten muss, meist unter Zuhilfenahme der glatten
Gefäßmuskulatur) mit
Druckbelastung und Gefäßdurchmesser zunimmt; und dass die Spannung in
der Gefäßwand mit deren Dicke (d) abnimmt. Aus
diesem Grund haben große Arterien besonders dicke Wände, während Venen
mit dünnen Wänden auskommen.

Mehr zur
Laplace-Beziehung s.
dort
Als Elastizitätsmodul (E-Modul E,Young elastic modulus Y, Einheit Pa) bezeichnet man einen Proportionalitätsfaktor,
definiert als die Kraft, die benöigt wird, um das betreffende Material
um einen bestimmten Betrag zu dehnen (beispielsweise ist Kollagen um
drei Größenordnungen steifer als Elastin). Bei mäßigem Innendruck
fangen Elastinfasern einen Großteil der Dehnungskräfte (elastisch) auf;
ist das Gefäß stark gedehnt, nimmt der Beitrag der (rigiden)
Kollagenfasern an der Abstützung der Gefäßwand zu.
"Druckbelastung": Die Gefäßwand muß nicht dem Innendruck (bzw. transmuralen Druck) an sich widerstehen, sondern der Wandspannung
(K). Je größer diese ist, desto mehr Elastin und Kollagen findet sich in der
Gefäßwand. (Kapillaren haben gar keine Media, nur Endothel - die Wandspannung ist
minimal, trotz eines Innendrucks, der größer als der venöse ist.)
Die Wandspannung in Gefäßen und anderen Hohlorganen hat zwei einander ergänzende Komponenten: Passive durch Dehnung der Elastin- und Kollagengitter und aktive durch den Tonus der glatten Gefäßmuskulatur. Kontrahieren die Muskelfasern (bei konstantem [p
i - p
o])
,
verschiebt sich das Kräftegleichgewicht: Der Radius nimmt ab, die
bindegewebigen Elemente werden entlastet, die Fibrillen weniger
gedehnt. Umgekehrt verhält es sich bei Vasodilatation: Die Muskelfasern
entspannen, der Gefäßradius nimmt zu, und die Elastin- und
Kollagenfasern müssen höhere Dehnungskräfte aufnehmen.
Blutgefäße sind durch sympathische Nervenfasern beeinflussbar. Noradrenalin wirkt über α-Rezeptoren anregend auf glatte Gefäßmuskelzellen und bringt diese zur Verengung (Vasokonstriktion).
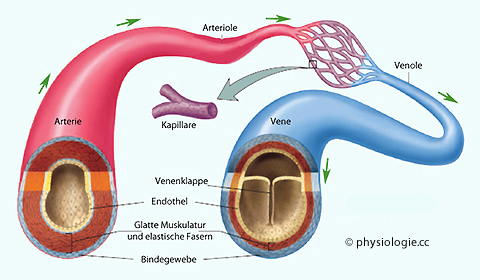
 Abbildung: Strukturelle Merkmale von Blutgefäßen (schematisch)
Nach einer Vorlage bei biology-igcse.weebly.com
Abbildung: Strukturelle Merkmale von Blutgefäßen (schematisch)
Nach einer Vorlage bei biology-igcse.weebly.com
Blutgefäße (außer Kapillaren) haben eine dreischichtige Wand:
Die Intima, bestehend aus
abgeflachten Endothelzellen und einer Basalmembran, durch die
Endothelzellen Fortsätze zu Muskelzellen (myoepithelial junctions)
hindurchstrecken und so mit der Media kommunizieren können. Die Intima
ist die wichtigste Abdichtung gegen Verlust von Plasma und bildet
vasoaktive Substanzen, z.B. Stickstoffmonoxid
Die Media
sorgt für strukturelle Festigkeit (Kollagen, Elastin, spiralig angeordnet)
und Kontraktionsvermögen (miteinander verknüpfte spindelförmige
Muskelfasern). Diese Schicht widersteht der Belastung durch den
Blutdruck, vor allem in Arterien
Die
Adventitia ist eine nach außen unscharf gegen umgebendes Gewebe
abgegrenzte Bindegewebsschicht. Hier befinden sich sympathische Varikositäten
(Bildung, Speicherung und Freisetzung von Noradrenalin) und in größeren
Gefäßen eigene Blutgefäße (vasa vasorum) für die Versorgung der (hier
umfangreichen) Media. Extremitätenvenen enthalten auch Schmerzfasern (Schmerz bei Thrombophlebitis)
Die Ausprägung der Gefäßwand hängt von der
Druckbelastung ab: Venen entwickeln z.B. dickere Wände, wenn sie als Bypass Verwendung finden (Gefäßchirurgie)

Die elastischen Eigenschaften relaxierter Blutgefäße bedingen eine Nichtlinearität ihrer Druck-Strömungs-Beziehung:
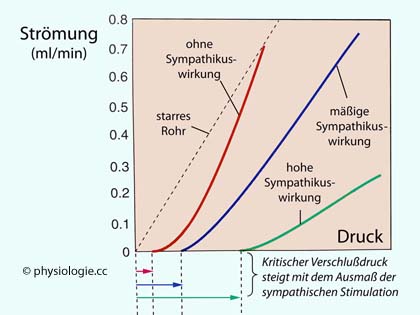
 Abbildung: Nichtlinearität der Druck-Strömungs-Charakteristik und Einfluss des Sympathikus
Abbildung: Nichtlinearität der Druck-Strömungs-Charakteristik und Einfluss des Sympathikus
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Nach dem Poiseuille-Gesetz
steigt die Fließrate (in einem starrwandigen Rohr und bei laminarer
Strömung) linear mit dem treibenden Druck (schwarz strichlierte Linie)
- ab dem Nullpunkt. Das ist bei Blutgefäßen anders: Erstes braucht es
einen "kritischen Verschlussdruck", um das Gefäß aus einem kollabierten
Zustand heraus zu öffnen (erst ab hier kommt es zu Perfusion); und
zweitens nimmt der Durchmesser mit steigendem Druck zu, der Widerstand
ab (nichtlinearer Anstieg der Strömung mit dem treibenden Druck).
Ohne Sympathikuseinfluss liegt der kritische Verschlussdruck bei etwa 6 mmHg (rote Kurve). Sympathische Aktivität (Wirkung auf α-Adrenozeptoren) erhöht den Gefäßtonus und steigert einerseits
den kritischen Verschlussdruck, verflacht andererseits den
Strömungsanstieg mit der Druckzunahme (engeres Gefäß, höherer
Strömungswiderstand - blaue Kurve moderater, grüne Kurve intensiver Sympathikuseffekt)

Arteriensystem: Größter Druck, größte Strömungsgeschwindigkeit
Die Aorta speichert vorübergehend einen Teil des vom linken
Ventrikel ausgeworfenen Schlagvolumens (Windkesselwirkung), was
 das Herz entlastet (geringere Nachlast),
das Herz entlastet (geringere Nachlast),
 die Pulsamplitude reduziert und
die Pulsamplitude reduziert und
 die Blutströmung kontinuierlicher werden lässt.
die Blutströmung kontinuierlicher werden lässt.
Der Querschnitt der Aorta beträgt etwa 4 cm2 - so strömt das Blut hier am raschesten (Durchschnittwert 23 cm/s, Pulsationen zwischen 0 und ~60 cm/s). Die Aorta ist der Prototyp eines elastischen Gefäßes.
Mittelgroße Arterien (Durchmesser 0,1 - 1 cm) verteilen das Herzzeitvolumen auf die verschiedenen Organe und Gewebe. Ihr Tonus wird
durch sympathische Nerven sowie autoregulativ beeinflusst (Dilatation
z.B. bei Muskelarbeit, Kontraktion z.B. beim Tauchreflex).
Mittelgroße Arterien übertragen arterielle Druckwellen, die
an den engen Arteriolen (hoher Widerstand) teilweise reflektiert werden
und zum Herzen zurücklaufen, wo sie an der geschlossenen Aortenklappe
nochmals reflektiert werden können (hin- und herlaufende Wellen).
Terminale Arterien haben einen Durchmesser unter 0,5 mm und bieten -
neben Arteriolen - einen Teil des peripheren Strömungswiderstandes im
Kreislauf. Sie sind reich innerviert durch noradrenerge sympathische
Fasern, die vasokonstriktorisch wirken.
Arteriolen: Größter Strömungswiderstand
Arteriolen
(Durchmesser 10-100 µm) können durch Verringerung ihres Querschnitts (Vasokonstriktion;
Poiseuille-Gleichung) den Strömungswiderstand erhöhen (Widerstandsgefäße)
und - entsprechend dem Tonusmuster im Kreislauf - die
Verteilung von Blutstrom und Blutvolumen verändern. Terminale
Arteriolen sind nur schwach sympathisch beeinflusst, unterliegen aber
lokalen Einflüssen und stellen so die Durchblutung entsprechend dem
Bedarf des umliegenden Gewebes ein.
Der Körper einer erwachsenen Person enthält 20-50 Millionen Arteriolen (unterschiedliche Angaben in der Literatur).
Kapillaren: Größte Anzahl, größter Gesamtquerschnitt
Kapillaren (etwa 10 Milliarden offene, insgesamt ~4.1010) , mittlere Länge ~0,5-1 mm; einzelne Kapillare: Durchmesser ~5-10 µm, Gesamtquerschnitt ~5.10-7 cm2) haben eine Wandfläche von insgesamt über 100 m2, was (bei einer Wanddicke von ~1 µm) den Austausch
von Stoffen und Gasen zwischen Blut und Zellen in ausreichendem Maße
ermöglicht (maximale Diffusionsstrecke zwischen Kapillaren und Zellen ~10 µm).
Die Zahl an parallel geschalteten Gefäßen ist im Bereich der Kapillaren am höchsten
|
Die Geschwindigkeit der Blutströmung in den Kapillaren beträgt aufgrund ihres hohen Gesamtquerschnittes nur etwa ein Zweihundertstel (~1 mm/s) derjeniger
in der Aorta (Mittelwert 23 cm/s) - abhängigkeit von der Zahl offener
Kapillaren (diese steigt bei körperlicher Belastung sowohl im großen
Kreislauf als auch in der Lunge an). Das ergibt eine ausreichende
Austauschzeit für die Blutgase.
Dass Kapillaren trotz ihres engen Durchmessers nur einen geringen Widerstand bieten (durchschnittlicher Druckabfall ~20 mmHg), ist auf mehrere Faktoren zurückzuführen: Ihre große Zahl, ihre geringe Länge (
~1 mm), sowie die Tatsache, dass sich Blutkörperchen dem
Strömungsprofil entsprechend verformen und sich in der Mitte der
Kapillare "pfeilspitzenförmig" zu einer Art Gänsemarsch anordnen (vgl. Blutviskosität), was einen niedrigen Strömungswiderstand ergibt.
Auch unmittelbar vor echten Kapillaren - Metarteriolen - sowie nachher
- kleine Venolen ohne Muscularis - ist ein gewisses Maß an
Stoffaustausch möglich; man spricht insgesamt von Austauschgefäßen (exchange vessels) bzw. der Mikrozirkulation (dominiert wird diese von der Funktion der Kapillaren).

 Abbildung: Hydrostatischer Druckgradient entlang des Arterien- und Venensystems
Abbildung: Hydrostatischer Druckgradient entlang des Arterien- und Venensystems
Links nach L.B. Rowell, Human circulation - regulation
during physical stress. Oxford University Press 1986; rechts nach
Hargens AR, Millard RW, Pettersson K, Johansen K. Gravitational
hemodynamics and oedema prevention in the giraffe. Nature 1987; 329: 59-60
Zu den Druckverhältnissen beim Menschen (links) vgl. dort.
Bei der Giraffe (rechts) nimmt die Wandstärke der Ventrikel mit der Länge des
Körpers zu (Wachstumsphase), was den steigenden Druckanforderungen an die Pumpleistung
entspricht. Die beobachteten Verhältnisse in den Halsvenen (Abnahme des
Drucks in Richtung Herz, konträr zu dem zu erwartenden Druckanstieg
nach unten) haben möglicherweise mit einem Siphoneffekt zu tun. In den Beinen
ist der hydrostatische Druck in den Gefäßen (und damit die Gefahr einer
Ödembildung) hoch, die kapilläre Durchlässigkeit für Proteine minimal
(hoher Reflexionskoeffizient σ), sodass der kolloidosmotische Effekt (der Flüssigkeit im Gefäß hält) voll zur Wirkung kommen kann.
Senkt die
Giraffe den Kopf zum Boden (was sie beim Trinken tun muss), kommt es zu
einem enormen Druckanstieg in den Gefäßen des Kopfbereichs (um ca. 30
kPa, entsprechend einer Höhendifferenz von 3 m). Dieser wird durch eine
Erweiterung der Jugularvenen gedämpft
Venen: Größtes Volumen

 Venolen (Durchmesser 50-200 µm) und Venen speichern mehr als 50% des gesamten Blutvolumens (Kapazitätsgefäße). Aktivität ihrer sympathischen Fasern
kontrahiert ihre Wand, das steigert den Innendruck und erhöht das Blutangebot an das Herz (Vorlast).
Da Venen zahlreicher und weiter als Arterien sind, ist ihr Strömungswiderstand und Druckabfall (10-15 mmHg) relativ gering.
Venolen (Durchmesser 50-200 µm) und Venen speichern mehr als 50% des gesamten Blutvolumens (Kapazitätsgefäße). Aktivität ihrer sympathischen Fasern
kontrahiert ihre Wand, das steigert den Innendruck und erhöht das Blutangebot an das Herz (Vorlast).
Da Venen zahlreicher und weiter als Arterien sind, ist ihr Strömungswiderstand und Druckabfall (10-15 mmHg) relativ gering.
Unterstützt wird der Blutstrom Richtung Herz in den Extremitätenvenen durch Venenklappen (z.B.
in der Muskulatur: "Muskelpumpe"). Die sympathische
Beeinflussung der Venen wirkt sich - über das venöse Blutangebot - unmittelbar auf die Volumenleistung
des Herzens aus.
 Genau beschrieben wurden Venenklappen beim Menschen erstmals 1603 durch Girolamo Fabrizio
(Hieronymus Fabricius ab Aquapendente) von der Universität in Padua (De
Venarum Ostiolis). Dem gingen weniger akkurate Schilderungen im 16. Jh
voraus (Vesalius, Lusitanus, Sylvius, Estienne). Fabrizio war der Lehrer von William Harvey, dem Autor der berühmten Analyse des Blutkreislaufs (Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus)
Genau beschrieben wurden Venenklappen beim Menschen erstmals 1603 durch Girolamo Fabrizio
(Hieronymus Fabricius ab Aquapendente) von der Universität in Padua (De
Venarum Ostiolis). Dem gingen weniger akkurate Schilderungen im 16. Jh
voraus (Vesalius, Lusitanus, Sylvius, Estienne). Fabrizio war der Lehrer von William Harvey, dem Autor der berühmten Analyse des Blutkreislaufs (Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus)
 s. dort.
s. dort.
Einige Daten zu Gefäßabschnitten im Vergleich:
|
Arterien |
Arteriolen
|
Kapillaren
|
Venolen
|
Venen
|
Aorta
|
|
|
Vv. cavae
|
Innen-
durchmesser
(pro Gefäß)
|
25 mm
|
~4 mm
|
~30 µm
|
~5 µm
|
~70 µm
|
~5 mm
|
30 mm
|
Wanddicke
|
2 mm
|
~1 mm
|
~20 µm
|
~1 µm
|
~7 µm
|
~0,5 mm
|
1,5 mm
|
Zahl
|
1
|
~160
|
5x107
|
1010
|
108
|
~200
|
2
|
Querschnitt, cm2 (gesamt / Kategorie)
|
4,5
|
20
|
400
|
4500
|
4000
|
40
|
18
|
Werte aus Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Aus diesen Zahlen (die erheblichen individuellen Schwankungen
unterliegen, in verschiedenen Quellen deutlich differieren und daher
nur als Richtwerte zu verstehen sind - vgl. die Zahlen in der oberen  Abbildung) lassen sich interessante Fakten herauslesen:
Beispielsweise, dass der Gesamtquerschnitt in der Mikrozirkulation
(Kapillaren) 1000-mal so groß ist (3000-4500 cm2) als derjenige der Aorta (3-4,5 cm2).
Daraus folgt, dass sich die mittleren Strömungsgeschwindigkeiten in
diesen beiden Kreislaufabschnitten um den Faktor 1000 unterscheiden
(Aorta ~25 cm/s, Kapillaren ~0,25 mm/s). In den Hohlvenen (mit je ~7-9 cm2
Querschnittsfläche) ergibt sich eine mittlere Strömungsgeschwindigkeit
um die 7 cm/s. Die niedrige Strömungsgeschwindigkeit im Kapillarbereich
ermöglicht ausreichenden Austausch von Atemgasen, Nährstoffen etc.
Abbildung) lassen sich interessante Fakten herauslesen:
Beispielsweise, dass der Gesamtquerschnitt in der Mikrozirkulation
(Kapillaren) 1000-mal so groß ist (3000-4500 cm2) als derjenige der Aorta (3-4,5 cm2).
Daraus folgt, dass sich die mittleren Strömungsgeschwindigkeiten in
diesen beiden Kreislaufabschnitten um den Faktor 1000 unterscheiden
(Aorta ~25 cm/s, Kapillaren ~0,25 mm/s). In den Hohlvenen (mit je ~7-9 cm2
Querschnittsfläche) ergibt sich eine mittlere Strömungsgeschwindigkeit
um die 7 cm/s. Die niedrige Strömungsgeschwindigkeit im Kapillarbereich
ermöglicht ausreichenden Austausch von Atemgasen, Nährstoffen etc.
Die Strömung (I) an sich (Volumen pro Zeit) ist - zumindest über die Zeit gemittelt - nach dem Kontinuitätsgesetz
in allen (hintereinander geschalteten!) Kreislaufabschnitten gleich und
identisch mit dem Herzzeitvolumen. Da Strömung gleich Gesamtquerschnitt
(Q) mal Strömungsgeschwindigkeit (v), gilt
I = Qx . vx = Qy . vy .... etc
Ausnahmen können sich vorübergehend bei Umverteilung von Blut zwischen konsekutiven Abschnitten ergeben. Allerdings erfolgen solche Verschiebungen physiologischerweise (z.B. im Rahmen des DeJager-Krogh-Mechanismus) im Wesentlichen innerhalb des Venensystems mit seiner hohen Dehnbarkeit (Compliance).
Eine weitere Ausnahme wäre bei akuter Veränderung des Blutvolumens gegeben: Kommt es zu einer arteriellen Blutung,
pumpt das Herz mehr Blut (in das Arteriensystem) hinein als es (venös)
empfängt (Blut geht nach außen verloren, das Blutvolumen nimmt ab). Bei
einer Transfusion wäre es umgekehrt (venöser Zufluss vorübergehend höher als arterieller Abfluss).
Welche Faktoren bestimmen die Strömung?
Blut strömt infolge eines Druckunterschieds durch Gefäße (wenn es in Bewegung ist, hat es dann ein Trägheitsmoment):
 Je größer der Druckunterschied (p1-p2 oder ∂p) und je
kleiner der Strömungswiderstand (R) zwischen zwei miteinander kommunizierenden Gefäßabschnitten, desto
stärker ist die Strömung (Q) zwischen ihnen - z.B. die
Durchblutung (Perfusion) der betreffenden Region:
Je größer der Druckunterschied (p1-p2 oder ∂p) und je
kleiner der Strömungswiderstand (R) zwischen zwei miteinander kommunizierenden Gefäßabschnitten, desto
stärker ist die Strömung (Q) zwischen ihnen - z.B. die
Durchblutung (Perfusion) der betreffenden Region:
Q = (p1 - p2) / R
Strömung = Druckgradient / Widerstand
|
Diese Strömungsgleichung wird auch als Sonderform der Darcy-Gleichung (Darcy-Weisbach: Strömungsmechanik in porösen Medien) beschrieben und ist analog zum
Ohm'schen Gesetz
(Darcy-Weisbach: Strömungsmechanik in porösen Medien) beschrieben und ist analog zum
Ohm'schen Gesetz der Elektrizitätslehre (R = U / I) zu sehen, das
aussagt, dass der elektrische Strom (I) sich proportional zum
Potenzialgefälle U (analog: Druckgefälle p1 - p2) und umgekehrt proportional zum elektrischen Widerstand R (analog: Strömungswiderstand W) verhält.
der Elektrizitätslehre (R = U / I) zu sehen, das
aussagt, dass der elektrische Strom (I) sich proportional zum
Potenzialgefälle U (analog: Druckgefälle p1 - p2) und umgekehrt proportional zum elektrischen Widerstand R (analog: Strömungswiderstand W) verhält.
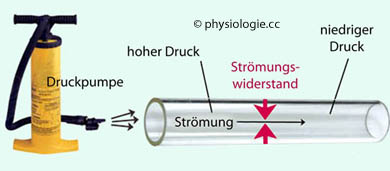
 Abbildung: Strömung folgt einem Druckunterschied
Abbildung: Strömung folgt einem Druckunterschied
Je
größer der Druckunterschied - verursacht durch eine Pumpe (wie das
Herz) -, desto mehr Flüssigkeit (Blut) strömt durch die Röhre (durch
den Kreislauf), d.h. umso stärker kann die Perfusion sein.
Je größer der Strömungswiderstand (je enger die Widerstandsgefäße),
desto größer wird der Druckunterschied (arterio-venös) - die Perfusion
nimmt dabei ab (jeweils ceteris paribus)
 Der arterielle Blutdruck (mean arterial pressure
MAP) steigt und fällt umgekehrt proportional dem Durchmesser der
Widerstandsgefäße: Je enger diese sind, desto schwerer tut sich das
Blut mit der Passage und der Druck in den vorgeschalteten Arterien
nimmt zu. Auch die Blutviskosität
beeinflusst den Blutduck, wenn auch weniger stark: Nimmt diese zu (vor
allem durch Erhöhung des Hämatokrit), fließt das Blut weniger leicht
durch enge Gefäße, es steigt der Widerstand und damit der Blutdruck;
nimmt sie ab, ist es umgekehrt (blutdrucksenkender Effekt - jeweils
ceteris paribus).
Der arterielle Blutdruck (mean arterial pressure
MAP) steigt und fällt umgekehrt proportional dem Durchmesser der
Widerstandsgefäße: Je enger diese sind, desto schwerer tut sich das
Blut mit der Passage und der Druck in den vorgeschalteten Arterien
nimmt zu. Auch die Blutviskosität
beeinflusst den Blutduck, wenn auch weniger stark: Nimmt diese zu (vor
allem durch Erhöhung des Hämatokrit), fließt das Blut weniger leicht
durch enge Gefäße, es steigt der Widerstand und damit der Blutdruck;
nimmt sie ab, ist es umgekehrt (blutdrucksenkender Effekt - jeweils
ceteris paribus).
Wo sitzt der Kreislaufwiderstand? Geht man vom linken Herzen aus und misst den arteriellen Mitteldruck entlang der Gefäßstrecke (Aorta → große Arterien → kleine Arterien), stellt man fest, dass der Druck bis in das Gebiet der kleinen Arterien kaum (~2 mmHg) absinkt, hier also auch kaum ein Strömungswiderstand besteht. Erst bei den feinen Aufzweigungen (kleine Arterien →
Arteriolen) findet ein steiler Druckabfall bis zu kapillären Werten
statt, ergo liegt an dieser Stelle der Großteil des
Kreislaufwiderstandes: Der periphere Widerstand (total peripheral resistance TPR).

Abbildung: Sympathikustonus, Gefäßdurchmesser und Strömungswiderstand
Nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Im
Normalzustand sind sympathische Fasern über das ZNS mäßig aktiviert,
was (über Noradrenalinwirkung) eine mittlere Kontraktion der Blutgefäße
und mittleren Strömungswiderstand ergibt (
oben).
Bei Erhöhung der Aktivität sympathischer Nervenfasern (gesteigerte Aktionspotentialfrequenz) wird mehr
Noradrenalin
freigesetzt, die Gefäße kontrahieren, der Strömungswiderstand nimmt zu
(
links unten), die Durchblutung sinkt.
Bei erniedrigter Sympathikusaktivität ist es umgekehrt
(
rechts unten):
Die Noradrenalinfreisetzung nimmt ab, der anregende Effekt auf die Gefäßmuskulatur schwindet, der Innendruck
weitet das Gefäß: Vasodilatation; Resultat ist ein erniedrigter
Widerstand und steigende Durchblutung

Der (virtuelle, da nicht direkt messbare, sondern aus Strömung und Druckdifferenz errechenbare) Wert für den Strömungswiderstand des gesamten Kreislaufs (TPR) oder eines Organs kann durch Umstellung der Strömungsgleichung aus entsprechender
Durchblutung (Herzzeitvolumen oder Organperfusion), arteriellem und venösem Druck errechnet
werden:
Strömungswiderstand R =
arteriovenöse Druckdifferenz / Durchblutung |
Je höher der Betrag des Strömungswiderstandes (je enger das Gefäß), desto größer muss der
Druck(unterschied) sein, um eine bestimmte Strömung (Durchblutung,
Perfusion) zu bewerkstelligen.
Und:
Je stärker die Strömung bei gegebenem Druckgefälle, desto niedriger ist der Strömungswiderstand (desto weiter das Gefäß).
Dieser Zusammenhang ist dem Ohm'schen Gesetz analog und gilt in entsprechend adaptierter Form allgemein
für Strömungen (Flüssigkeit oder Gas), z.B. von
 Atemluft zwischen Lunge und Außenluft (Widerstand der Atemwege: Druckunterschied Alveolen - Außenluft) - Je enger die Bronchien, desto schwerer die Atmung
Atemluft zwischen Lunge und Außenluft (Widerstand der Atemwege: Druckunterschied Alveolen - Außenluft) - Je enger die Bronchien, desto schwerer die Atmung
 Blut - Durchblutung (Perfusion) von Organen
(Gefäßwiderstand) - bei Entspannung der glatten Mukulatur weitet der
Blutdruck die Arteriolen, das Organ wird besser durchblutet
Blut - Durchblutung (Perfusion) von Organen
(Gefäßwiderstand) - bei Entspannung der glatten Mukulatur weitet der
Blutdruck die Arteriolen, das Organ wird besser durchblutet
 Lymphe - auch Lymphflüssigkeit strömt nach einem Druckgradienten, "Lymphherzen" können einen Druckgradienten erzeugen
Lymphe - auch Lymphflüssigkeit strömt nach einem Druckgradienten, "Lymphherzen" können einen Druckgradienten erzeugen
 Liquor- bzw. Hirndruck (Davson-Gleichung) - erhöhter Abflusswiderstand (Verengung der Spalträume) steigert den Hirndruck
Liquor- bzw. Hirndruck (Davson-Gleichung) - erhöhter Abflusswiderstand (Verengung der Spalträume) steigert den Hirndruck
 Kammerwasser aus Auge in Tränengänge (Goldmann-Gleichung: Widerstand im Kammerwinkel) - Strömungswiderstand und Augeninnendruck steigen bei Pupillenerweiterung (Mydriasis)
Kammerwasser aus Auge in Tränengänge (Goldmann-Gleichung: Widerstand im Kammerwinkel) - Strömungswiderstand und Augeninnendruck steigen bei Pupillenerweiterung (Mydriasis)
 Harn (Widerstand der Harnröhre:
Druckunterschied Blase - Außenwelt) - bei Prostatavergrößerung ist der
Harnabfluss behindert, die Entleerungszeit der Blase steigt
Harn (Widerstand der Harnröhre:
Druckunterschied Blase - Außenwelt) - bei Prostatavergrößerung ist der
Harnabfluss behindert, die Entleerungszeit der Blase steigt
Am Beginn des Arteriensystems beträgt der Gefäßquerschnitt (der aorta ascendens) 4 cm2, die mittlere Strömungsgeschwindigkeit ~20
cm/s (gemittelt über Systole und Diastole). Daraus ergibt sich eine
Blutströmung von 80 ml/s (Werte für eine erwachsene Person bei
körperlicher Ruhe). Bei einer Schlagfrequenz von 60 bpm entspricht
diesen Werten ein Schlagvolumen von 80 ml.
Im
Arteriensystem - dessen Gefäßwände reichlich mit elastischen Fasern
ausgestattet sind - baut sich ein Druck (der arterielle Blutdruck) auf,
da einerseits der linke Ventrikel Blut hineinbefördert, andererseits am
Ausgang des Systems ein hoher Strömungswiderstand vor allem im Bereich
der Arteriolen (der "periphere Widerstand") herrscht:
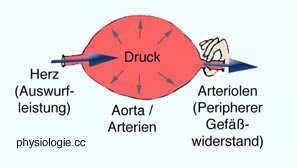
 Abbildung: Engstellung der Arteriolen erhöht den Blutdruck
Abbildung: Engstellung der Arteriolen erhöht den Blutdruck
Nach einer Vorlage bei courses.washington.edu
Einfaches Modell bestehend aus Pumpe (Herz), Ballon (Arteriensystem) und Fingern, die den Ausstrom aus dem Ballon erschweren (Arteriolen).
Die Pumpe fördert Blut (catdiac output CO) und erzeugt im artriellen System einen relativ hohen Versorgungsdruck (mean arterial pressure MAP) gemeinsam mit dem peripheren Strömungswiderstand der kleinen arteriellen Gefäße (total peripheral resistance TPR)

Die vereinfachte
Formel (mean blood pressure equation) für den gesamten Kreislauf (venöse Druckwerte vernachlässigt) formuliert den mittleren arteriellen Druck pA als das Produkt aus Herzzeitvolumen (HZV) und peripherem Strömungswiderstand TPR (total peripheral resistance):
 Beispiel: Blutdruck 100 mmHg, Herzzeitvolumen 5 l/min → 100 mmHg = 5 l/min x 20 Widerstandseinheiten (hier: mmHg / (l/min))
Beispiel: Blutdruck 100 mmHg, Herzzeitvolumen 5 l/min → 100 mmHg = 5 l/min x 20 Widerstandseinheiten (hier: mmHg / (l/min))
Der
Pulmonalkreislauf ("kleiner" Kreislauf) - d.h. die vom rechten Herzen
zur Arterialisierung durch die Lunge beförderte Blutmenge - und der
systemische ("große") Kreislauf - von Aorta bis zum rechten Vorhof -
sind in Serie angeordnet ( Abbildung unten), was bedeutet, dass das
Herzminutenvolumen durch beide Systeme gepumpt wird. (Kleine
Unterschiede im Betrag ergeben sich durch den Bronchialkreislauf, s. dort.)
Abbildung unten), was bedeutet, dass das
Herzminutenvolumen durch beide Systeme gepumpt wird. (Kleine
Unterschiede im Betrag ergeben sich durch den Bronchialkreislauf, s. dort.)
Steigt der Blutfluss im großen Kreislauf (z.B. bei Muskelarbeit), nimmt er im kleinen Kreislauf um einen gleichen Betrag zu
|
Dabei
unterscheiden sich typische Eigenschaften und Beträge zwischen "großem"
(systemischer Kreislauf) und "kleinem" System (Pulmonalkreislauf) zum
Teil sehr deutlich:
Unterschiede systemischer vs. Lungenreislauf
|
|
systemisch
|
pulmonal
|
Arterien
|
Druck
|
120/80 mmHg
Mitteldruck ~95mmHg
|
25/8 mmHg
Mitteldruck ~15mmHg
|
Gefäßwand
|
dick, elastisch
|
dünn, dehnbar
|
Ruhetonus
|
Vasokonstriktion
|
kein Tonus
|
Arteriolen
|
Gefäßwand
|
dick, eng, muskulär
|
dünn, weit
|
Widerstand
|
hoch
(1600 dyn.s.cm-5)
|
niedrig
(160 dyn.s.cm-5) |
bei Hypoxie
|
Vasodilatation
|
Vasokonstriktion
|
Kapillaren
|
Gefäßwand
|
Austausch von Atemgasen, Nährstoffen etc
|
extrem dünn
Austausch von Atemgasen
|
Strömung
|
kontinuierlich
|
pulsatil
|
Dehnbarkeit
|
Gefäßradius relativ stabil
|
Alveolardruck komprimiert, Pulmonalvenendruck dehnt auf
|
Venen
|
Druck
|
2 mmHg
|
5 mmHg
|
Reservoir
|
hohe Kapazität
(>1000 ml)
|
geringere Kapazität
(~500 ml)
|

 Abbildung: Kreislaufschema
Abbildung: Kreislaufschema
Nach einer Vorlage bei Aaronson / Ward / Connolly, The Cardiovascular System at a Glance, 5th ed. Wiley Blackwell 2020
Das Arteriensystem verteilt arterialisiertes Blut auf Organe und Gewebe im Körper, es enthält ca. 17% des gesamten Blutvolumens.
Entlang der Widerstandsgefäße
(kleine Arterien, Arteriolen) nimmt der Blutdruck stark ab, das Blut
strömt vorzugsweise durch relativ weite (weniger kontrahierte)
arterielle Gefäße.
Im Pfortaderkreislauf sind zwei Widerstandszonen
hintereinander (in Serie) geschaltet, der Druck in der Pfortader ist
niedrig.
Kapillaren dienen dem Stoffaustausch mit dem Gewebe und sind Quelle filtrierter / lymphatischer Flüssigkeit.
Venengeflechte sind besonders
speicherfähig, insbesondere diejenigen der Bauchorgane sowie in der
Haut. Das Venensystem enthält ca. 70% des gesamten Blutvolumens
 das Herz seine Auswurfleistung erhöht und / oder
das Herz seine Auswurfleistung erhöht und / oder

 der periphere Widerstand durch Kontraktion der
betreffenden Gefäße (kleinste Arterien, Arteriolen, Metarteriolen)
zunimmt.
der periphere Widerstand durch Kontraktion der
betreffenden Gefäße (kleinste Arterien, Arteriolen, Metarteriolen)
zunimmt.
Beides wird durch den Sympathikus insgesamt angeregt (der arterielle
Druck nimmt zu); kleine Gefäße (insbesondere Metarteriolen) reagieren
auf lokale Faktoren, sichern die regionale Durchblutung,  s. dort.
s. dort.
Der arterielle Blutdruck (genauer: der Druck an der Aortenwurzel) stellt für den linken Ventrikel die Belastung dar, gegen die er in seiner aktiver Phase (der Austreibungszeit) anarbeiten muss (Nachlast).
Genau genommen ist es der dynamische Widerstand (Impedanz), den das
Arteriensystem der Herzaktion entgegensetzt. Klinisch wird der
arterielle Druck als Maß für die linkskardiale Nachlast gewertet.
Analog sind es die Druckverhältnisse im Lungenkreislauf (a. pulmonalis), welche die Nachlast für den rechten Ventrikel bedeuten.
Ruheblutdruck: Die Höhe des arteriellen Blutdrucks ist von mehreren Faktoren abhängig:
 Zustand
- die Sollwerte des arteriellen Drucks beziehen sich auf psychischen und körperlichen Ruhezustand.
Zustand
- die Sollwerte des arteriellen Drucks beziehen sich auf psychischen und körperlichen Ruhezustand.
 Alter -
Der Ruheblutdruck sollte bei Erwachsenen unter 130 / 85 liegen - auch
in höherem Alter, soferne das Gefäßsystem nicht verändert ist
(Arteriosklerose), in diesem Fall nimmt vor allem der systolische
Blutdruck zu (geringer Windkesseleffekt, s. unten). Kinder zeigen etwas
niedrigeren Ruheblutdruck:
Alter -
Der Ruheblutdruck sollte bei Erwachsenen unter 130 / 85 liegen - auch
in höherem Alter, soferne das Gefäßsystem nicht verändert ist
(Arteriosklerose), in diesem Fall nimmt vor allem der systolische
Blutdruck zu (geringer Windkesseleffekt, s. unten). Kinder zeigen etwas
niedrigeren Ruheblutdruck:
Alter
|
systolisch (mmHg)
|
diastolisch (mmHg)
|
1-12 Monate
|
75–100
|
50–70
|
1-5 Jahre
|
80–110
|
50–80
|
6-12 Jahre
|
85–120
|
50–80
|
13-18 Jahre
|
95–140
|
60–90
|
Nach Kirkpatrick T & Tobias K, Pediatric Age Specific. UCLA Health System
 Bei physischer Belastung
(Muskelarbeit) nimmt der systolische
Blutdruck proportional mit der Belastung zu (bis auf ~200
mmHg); der diastolische Wert steigt mit der Belastung nur geringgradig an.
Bei physischer Belastung
(Muskelarbeit) nimmt der systolische
Blutdruck proportional mit der Belastung zu (bis auf ~200
mmHg); der diastolische Wert steigt mit der Belastung nur geringgradig an.
 Näheres zur Blutdruckmessung s. dort
Näheres zur Blutdruckmessung s. dort
Arterieller Puls 
Wirft der linke Ventrikel ein
Schlagvolumen aus, baut sich Druck in der Aorta auf, der bis zu einem -
während der Austreibungszeit erreichten - Maximalwert (systolischer Druck)
ansteigt. Anschließend nimmt die Fördermenge ab und der Druck beginnt
zu sinken. Elastische Strukturen in der Wand der großen arteriellen
Gefäße dämpfen die Druckpulsation, sie wandeln einen Teil (70-80%) der kinetischen Energie (Beschleunigung der Blutsäule gegen den arteriellen Druck) in potentielle Energie
um - die anschließend in kinetische Energie zurückverwandelt wird und
zwischengespeichertes Blut weiterbefördert. Der Ventrikel investiert
nur 20-30% seiner Energie unmittelbar in den Transport des Blutes in
die Peripherie (run-off).
Dieser Windkesseleffekt wirkt wie ein Stoßdämpfer; der systolische Druck steigt nicht exzessiv an (wie bei versteifter Aortenwand), der diastolische (geringste) Druck sinkt nicht zu stark ab.
 Die Spanne zwischen systolischem und diastolischem Druck nennt man die Blutdruckamplitude (pulse pressure).
Die Spanne zwischen systolischem und diastolischem Druck nennt man die Blutdruckamplitude (pulse pressure).
| Den jeweils höchsten Druck während eines Herzzyklus nennt man den systolischen, den jeweils niedrigsten den diastolischen Druck. |
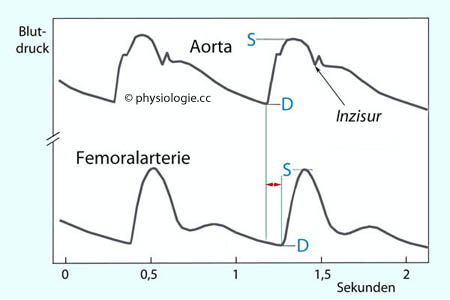
 Abbildung: Arterielle Pulswellen, die an Aorta und Femoralarterie synchron registriert wurden
Abbildung: Arterielle Pulswellen, die an Aorta und Femoralarterie synchron registriert wurden
Nach einer Vorlage in Mark JB: Atlas of Cardiovascular Monitoring. Churchill Livingstone NY 1998
Die
Druckaufnehmer liegen - auf den Kreislauf bezogen - "hintereinander"
(Aorta - Femoralarterie). Dividiert man ihren Abstand durch die
Zeitverzögerung des beginnenden systolischen Druckanstiegs (roter
Doppelpfeil), ergibt sich die
Pulswellengeschwindigkeit (m/s).
Der Schluss der Aortenklappe am Ende der Austreibungszeit stoppt den
kurzzeitigen Reflux von Blut und erzeugt in der Druckkurve eine Inzisur. Diese markiert die Grenze zwischen Systole und Diastole
Der Blutdruck in der Aorta beträgt z.B. 115 zu 75, in der Femoralarterie 125 zu 70 mmHg (Amplitude 40 vs. 55 mmHg). Der Mitteldruck
separiert zwei gleich große Flächen (Druck mal Zeit) - in der Aorta
etwa 50%, in peripheren Arterien etwa 35% der Amplitude über [D]. Er
sinkt von der Aorta zu peripheren Arterien um etwa 2 mmHg
S = höchster (systolischer), D = niedrigster
(diastolischer) Druck eines Pulses an der jeweiligen Messstelle

Eine scharfe Inzisur in der Druckkurve ist kennzeichnend für herznahe Gefäße
|
Die Systole läßt eine Druckwelle entstehen
(Pulswellengeschwindigkeit: zentral ~4 m/s, peripher bis 10 m/s), die
über das Arteriensystem in die
Peripherie läuft (antegrad) und von dort infolge (teilweiser) Druckwellenreflexion
zum Herzen zurück (retrograd).
So ergeben sich an den verschiedenen Stellen des
Arterienbaums unterschiedliche Pulswellenformen ( Abbildung), die an
jeder Registrierstelle anders aussehen. Die Pulskurven sind auf Grund
solcher
Druckwellenreflexionen meist dikrot
Abbildung), die an
jeder Registrierstelle anders aussehen. Die Pulskurven sind auf Grund
solcher
Druckwellenreflexionen meist dikrot  (zweigipflig, Abbildungen), insbesondere bei jüngeren Menschen; und sie verlaufen
gegen Ende eines Druckzyklus flacher als zu dessen Beginn
(nichtlinearer Druckverlauf).
(zweigipflig, Abbildungen), insbesondere bei jüngeren Menschen; und sie verlaufen
gegen Ende eines Druckzyklus flacher als zu dessen Beginn
(nichtlinearer Druckverlauf).
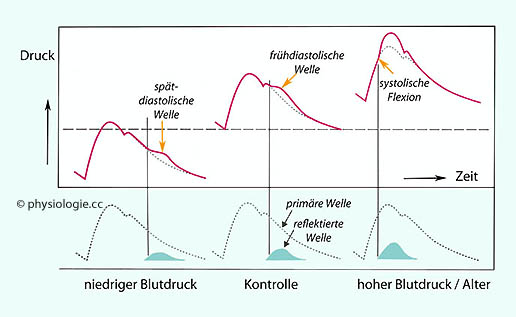
 Abbildung: Druckwellen im Aortenpuls
Nach einer Vorlage in Nichols WW, O'Rourke M: McDonald's Blood Flow in Arteries: Theoretical, Experimental and Clinical Principles, 5th ed.
Abbildung: Druckwellen im Aortenpuls
Nach einer Vorlage in Nichols WW, O'Rourke M: McDonald's Blood Flow in Arteries: Theoretical, Experimental and Clinical Principles, 5th ed.
Rot:
Registrierte Druckkurven bei Hypotonie (links), normalem Blutdruck
(Kontrolle, Mitte) und Hypertonie bzw. altersbedingter Gefäßversteifung
(rechts). Die punktierten Kurven geben den Druckverlauf an, der sich
ohne Reflexion aus der Peripherie abzeichnen würde. Reflektierte
Druckwellen (grüne Flächen) wandern zum Herzen zurück und addieren sich
zur primären Welle des Aortenpulses.
Bei normalem Blutdruck wanden die Druckwellen gemäß der arteriellen
Dehnbarkeit mit 4 bis 10 m/s durch das System, die reflektierte
Druckwelle erzeugt eine frühdiastolische Dikrotie.
Bei Hypotonie
sind die Gefäße dehnbarer (hohe Compliance), die Druckwellen wandern
langsamer durch das Arteriensystem und die Reflexionen kommen erst
später an der Aorta an - es entsteht eine spätdiastolische Dikrotie
(links).
Bei hohem
Blutdruck bzw. Arteriosklerose sind die Gefäße weniger dehnbar (geringe
Compliance), die Wellen wandern mit bis zu 15 m/s durch das System und
die reflektierte Druckwelle trifft schon während der Systole an der
Aorta ein, erzeugt eine systolische Flexion und erhöht den systolischen
Druck (rechts)
Die  Abbildung demonstriert unterschiedliche Pulsformen anhand des
Vergleichs eines hypotonen, normotonen und hypertonen Aortenpulses. Die
primäre, vom Herzen ausgehende Druckwelle wird vor allem an den großen
Gefäßaufzweigungen (nach ca. 0,5 m) teilweise reflektiert und wandert
zum Herzen zurück.
Abbildung demonstriert unterschiedliche Pulsformen anhand des
Vergleichs eines hypotonen, normotonen und hypertonen Aortenpulses. Die
primäre, vom Herzen ausgehende Druckwelle wird vor allem an den großen
Gefäßaufzweigungen (nach ca. 0,5 m) teilweise reflektiert und wandert
zum Herzen zurück.
Je dehnbarer die Gefäße (hohe Compliance bzw.
geringe Elastanz), desto geringer ist die Druckwellengeschwindigkeit
und desto später trifft die reflektierte Welle an der Aortenwurzel ein
(spätdiastolische Dikrotie bei Hypotonie, frühdiastolische bei
Normotonie, systolische Überhöhung bei Hypertonie).
| Die
Pulswellengeschwindigkeit (Aorta: ≥400 cm/s) ist höher als
die Strömungsgeschwindigkeit des Blutes (Aorta ≤25 cm/s)
|
 Zur Bestimmung der Pulswellengeschwindigkeit (transmission velocity) s. auch dort
Zur Bestimmung der Pulswellengeschwindigkeit (transmission velocity) s. auch dort
Die vom Herzen ausgeworfene Blutsäule wandert mit einer mittleren
Geschwindigkeit von 0,2 m/s vom linken Ventrikel durch die Aortenwurzel
(0,2 m in einer Sekunde: stroke distance).
Dass die Pulswelle viel rascher wandert als das Blut selbst, lässt sich
am Beispiel einer mit Münzen gefüllten Röhre veranschaulichen: Drückt
man eine Münze hinein, fällt eine Münze am anderen Ende aus der Röhre
(hohe Druckwellengeschwindigkeit), während die Säule selbst nur um die
Dicke
einer Münze weitergerückt ist (geringe Strömungsgeschwindigkeit).
Klinische Bedeutung: Man kann den systolischen Druck als Maß
für das Schlagvolumen, den diastolischen für den peripheren
Widerstand, und den mittleren Arteriendruck als Maß für die Steifigkeit der Arterienwände werten. Doch liegen die Dinge nicht ganz so einfach:
 Der mittlere arterielle Druck (mean arterial pressure) ist ausschließlich durch das
Herzminutenvolumen und den peripheren Widerstand bestimmt, entsprechend
dem oben ausgeführten Strömungsgesetz.
Der mittlere arterielle Druck (mean arterial pressure) ist ausschließlich durch das
Herzminutenvolumen und den peripheren Widerstand bestimmt, entsprechend
dem oben ausgeführten Strömungsgesetz.
Der arterielle Mitteldruck teilt die jeweilige Druckkurve in zwei gleich große Flächen: Eine zwischen der Druckkurve über, und eine unter ihm. Die Druckkurve der Aorta
ist so geformt, dass der Mitteldruck ziemlich genau in der Mitte
zwischen dem systolischen und dem diastolischen liegt. Bei einer peripheren Arterie (Femoralis, Brachialis) liegt dieser Wert etwa 35% des Amplitudenbetrags über dem diastolischen Druck:
Arterieller Mitteldruck in einer peripheren Arterie ~ diastolischer Druck + (1/3 x Blutdruckamplitude)
|
 Systolischer und diastolischer Druck - und damit auch die
Blutdruckamplitude - sind in komplexer Weise durch Schlagvolumen,
Herzschlagfrequenz, peripheren Widerstand sowie arterielle Compliance
beeinflusst.
Systolischer und diastolischer Druck - und damit auch die
Blutdruckamplitude - sind in komplexer Weise durch Schlagvolumen,
Herzschlagfrequenz, peripheren Widerstand sowie arterielle Compliance
beeinflusst.

 Abbildung: Arterienpulsformen entlang des Gefäßbaumes
Abbildung: Arterienpulsformen entlang des Gefäßbaumes
Nach einer Vorlage bei Chambers / Huang / Matthews, Basic physiology for anaesthetics (2nd ed), Cambridge Medicine 2019
Fünf Registrierungen wurden an einer liegenden gesunden Versuchsperson vorgenommen und die Druckkurven aneinandergereiht.
Der mittlere arterielle Druck (MAP) bleibt im Wesentlichen konstant.
Sie systolischen Werte nehmen zur Peripherie hin zu, die diastolischen
ab. Der systolische Druckanstieg wird zur Peripherie hin steiler, die
Inzisur erfolgt zusehends später, die Dikrotie wird deutlicher
ausgeprägt. Diese Veränderungen erklären sich durch die
Verzweigungsstruktur, veränderte Eigenschaften der Gefäße und die
Reflexion von Druckwellen entlang des Gefäßbaums

 Der Kehrwert der Compliance (ΔV/Δp) wird als Volumenelastizitätskoeffizient E´
(Δp/ΔV) bezeichnet. E' ist ein Maß für den Widerstand, den die
Gefäßwand ihrer elastischen Verformung (reversibel) entgegensetzt. Gut
dehnbare Gefäße - insbesondere Venen - haben
einen niedrigen [E´], weniger gut dehnbare (Arterien) einen hohen [E´].
Der Kehrwert der Compliance (ΔV/Δp) wird als Volumenelastizitätskoeffizient E´
(Δp/ΔV) bezeichnet. E' ist ein Maß für den Widerstand, den die
Gefäßwand ihrer elastischen Verformung (reversibel) entgegensetzt. Gut
dehnbare Gefäße - insbesondere Venen - haben
einen niedrigen [E´], weniger gut dehnbare (Arterien) einen hohen [E´].
| Mit dem Betrag des Elastizitätskoeffizienten steigt die Pulswellengeschwindigkeit
|
Das Druck-Volumen-Verhältnis ist nichtlinear: Je stärker Gefäße gefüllt
sind, desto rigider werden ihre Wände (angespannte Kollagenstrukturen).
Mit zunehmendem Innendruck nimmt der Betrag der Compliance ab,
derjenige des Elastizitätskoeffizienten zu (Versteifung).
Der Volumenelastizitätsmodul κ (kappa) setzt eine Volumenänderung in Beziehung zum Gesamtvolumen, ist also ein Maß für eine relative Volumenänderung
und damit für die Dehnbarkeit einer Gefäßwand. Definiert ist er als
Volumenelastizitätskoeffizient (E') mal Gesamtvolumen (V) des betreffenden
Gefäßes:
Eine Pulswelle läuft umso schneller, je größer der Betrag des Volumenelastizitätsmoduls κ des betreffenden Gefäßes ist
|
[κ]
wird als Kennzahl für die Bestimmung der Pulswellengeschwindigkeit
genutzt, da der Betrag umso höher ist, je härter (weniger dehnbar) das
Gefäß ist - und damit die Pulswelle rascher durch das Gefäß läuft.
"Altershochdruck": Falls
die Wände der großen Arterien verhärtet sind, erzeugt die Austreibung
des Blutes aus dem linken Ventrikel eine höhere systolische
Druckzunahme (abnehmender Windkesseleffekt). Falls der Tonus der Arteriolen alterungsbedingt erhöht ist (was nicht sein muss), resultiert durch Erhöhung des peripheren Widerstandes ein Anstieg des arteriellen Mitteldruckes.

 Abbildung: Pulswellen und dazugehörige Druck-Volumen-Kurven
Nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Abbildung: Pulswellen und dazugehörige Druck-Volumen-Kurven
Nach einer Vorlage bei Mohrman DE / Heller LJ, Cardiovascular Physiology, 8th ed. McGraw Hill 2014
Arterielle
Pulskurven sowie Druck (blau) / Volumen (grün) -Beziehung bei einer
20-jährigen (links) und einer 70-jährigen Person (rechts).
Die
arterielle Dehnbarkeit (Compliance, durch rotes Dreieck angedeutet)
nimmt mit zunehmendem Alter meist ab, das Füllungsvolumen der Arterien
zu. Die Menge an Kollagen in der Gefäßwand steigt an, die Fasern sind stärker miteinander verknüpft, die Compliance nimmt ab

Die  Abbildung zeigt, dass die arterielle Compliance mit zunehmendem Blutdruck (bzw. Blutvolumen) abnimmt.
Ein erhöhtes Schlagvolumen führt sofort zu einer deutlichen Steigerung
von systolischem Druck und Blutdruckamplitude; Änderungen des
peripheren Widerstandes wirken sich hingegen kaum auf den Betrag der
Blutdruckamplitude aus.
Abbildung zeigt, dass die arterielle Compliance mit zunehmendem Blutdruck (bzw. Blutvolumen) abnimmt.
Ein erhöhtes Schlagvolumen führt sofort zu einer deutlichen Steigerung
von systolischem Druck und Blutdruckamplitude; Änderungen des
peripheren Widerstandes wirken sich hingegen kaum auf den Betrag der
Blutdruckamplitude aus.
Auch die Geschwindigkeit des
Zustroms an Blut in ein arterielles Gefäß beeinflusst dessen
Compliance: Je rascher das Gefäß gefüllt wird, desto stärker steigt der
Druck pro eingefülltem Volumen (Viskoelastizität der Arterienwand). Aus
diesem Grund nimmt die effektive arterielle Compliance bei körperlicher
Belastung ab (raschere arterielle Füllung bei gesteigerter kardialer
Pumpfunktion).
 Pulsatile Strömung und Beschleunigung: Zwischen Druckdifferenz, Beschleunigung und Strömung besteht ein Zusammenhang, der nicht aus dem Strömungsgesetz alleine zu erklären ist (die Darcy-Gleichung gilt für eine stete Strömung, nicht für Beschleunigungspulse).
Pulsatile Strömung und Beschleunigung: Zwischen Druckdifferenz, Beschleunigung und Strömung besteht ein Zusammenhang, der nicht aus dem Strömungsgesetz alleine zu erklären ist (die Darcy-Gleichung gilt für eine stete Strömung, nicht für Beschleunigungspulse).

 Abbildung: Druck, Beschleunigung und Strömung in der Aorta
Nach Snell RE, Clements JM, Patel DJ, Frey DL,
Luchsinger PC. Instantaneous blood flow in the human aorta. J Appl
Physiol 1965; 20: 691-5
Abbildung: Druck, Beschleunigung und Strömung in der Aorta
Nach Snell RE, Clements JM, Patel DJ, Frey DL,
Luchsinger PC. Instantaneous blood flow in the human aorta. J Appl
Physiol 1965; 20: 691-5
Der Druckgradient ∆p beschleunigt zunächst die Blutsäule in der Aorta peripherwärts (p1>p2 - Zeit zwischen a und b, Beschleunigung positiv, grüne Kurve), dreht zum Zeitpunkt b um (p2>p1) und bremst den Blutstrom ab (Beschleunigung negativ), bis dieser herzwärts umdreht (Zeitpunkt c) und die Aortenklappe schließt

Die Blutpulsationen verhalten sich
entsprechend dem 2. Newton'schen Gesetz (Beschleunigung ∆p = Kraft /
Masse). Zu Beginn der Systole steigt der Druck zunächst in der
proximalen Aorta, und der Druckgradient zur Peripherie treibt Blut aus
dem Ventrikel Richtung Arterien.
Nach etwa 0,1 s erhöht sich der Druck
in den Arterien über den in der Aortenwurzel (s.
oben
und

Abbildung; Punkt b), [∆p] wird negativ und die Blutsäule wird
jetzt abgebremst. Schließlich dreht sich die Blutströmung Richtung
Ventrikel um (sie wird negativ), was die Aortenklappe zudrückt
(Zeitpunkt c in der

Abbildung).
Beschleunigungskurven können vom Körper registriert werden mit dem Ziel einer Abschätzung des Schlagvolumens (
Ballistokardiographie
).
Mit modernen Registrier- und Berechnungsmethoden scheint diese als
veraltet geltende Methode ein Revival zu erfahren. Im Zustand der
Schwerelosigkeit bietet sich diese Methode an, weil der für die
Registrierung problematische Effekt der Schwerkraft wegfällt
(Monitoring des Herzminutenvolumens im Raumflug).
 Die Blutdruckamplitude (systolischer minus diastolischer Druckwert)
kann für die Systolendauer näherungsweise als das Verhältnis
Schlagvolumen / Compliance (Compliance
Die Blutdruckamplitude (systolischer minus diastolischer Druckwert)
kann für die Systolendauer näherungsweise als das Verhältnis
Schlagvolumen / Compliance (Compliance  =
Volumenänderung / Druckänderung) quantifiziert werden (der
gleichzeitige systolische Abfluss des Blutes wird dabei
vernachlässigt). Je größer das Schlagvolumen und je kleiner die
Compliance (je größer ihr Kehrwert, die Elastance), desto größer ist die Blutdruckamplitude (und vice versa).
=
Volumenänderung / Druckänderung) quantifiziert werden (der
gleichzeitige systolische Abfluss des Blutes wird dabei
vernachlässigt). Je größer das Schlagvolumen und je kleiner die
Compliance (je größer ihr Kehrwert, die Elastance), desto größer ist die Blutdruckamplitude (und vice versa).
Steigt der Blutdruck, werden die Gefäße weniger dehnbar:
Die Blutdruckamplitude nimmt oft mit dem Alter zu
(  Abbildung oben), was teils mit arterieller Hypertonie, teils mit abnehmender Compliance ("Gefäßverhärtung")
erklärt wird: Ein gegebenes Schlagvolumen bewirkt einen größeren
Drucksprung. Ebenso
nimmt der systolische Druck stärker zu, wenn die Auswurfgeschwindigkeit
größer wird, wie bei körperlicher Belastung - die visköse Relaxation
hat weniger Zeit, den Blutstoß weich abzufangen.
Abbildung oben), was teils mit arterieller Hypertonie, teils mit abnehmender Compliance ("Gefäßverhärtung")
erklärt wird: Ein gegebenes Schlagvolumen bewirkt einen größeren
Drucksprung. Ebenso
nimmt der systolische Druck stärker zu, wenn die Auswurfgeschwindigkeit
größer wird, wie bei körperlicher Belastung - die visköse Relaxation
hat weniger Zeit, den Blutstoß weich abzufangen.
 Wenn z.B. das Schlagvolumen 80 ml und die Compliance der herznahen Gefäße 2 ml/mmHg beträgt, ergibt sich eine Blutdruckamplitude von 40 mmHg (80 ml / 2 ml/mmHg).
Wenn z.B. das Schlagvolumen 80 ml und die Compliance der herznahen Gefäße 2 ml/mmHg beträgt, ergibt sich eine Blutdruckamplitude von 40 mmHg (80 ml / 2 ml/mmHg).

Blutdruckschwankungen

 Abbildung: Hämodynamik (Mensch, Ruhezustand)
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Abbildung: Hämodynamik (Mensch, Ruhezustand)
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Oben:
Der mittlere Druck fällt im Hochdrucksystem (große arterielle Gefäße)
nur um etwa 2 mmHg (strichlierte Linie). Die größte Druckreduktion erfolgt im Bereich der
terminalen Arterien und Arteriolen (Gefäßdurchmesser unter 0,5 mm),
hier wirkt der größte Strömungswiderstand. Im Pulmonalkreislauf sind
Drucke und Widerstände wesentlich geringer.
Mitte: Mittlere
Blutströmungsgeschwindigkeit (schwarze Kurve) und Größe derer
Pulsationen (rote Kurve) im Gesamtkreislauf. Die Menge an strömendem
Blut ist entlang der vertikalen Linien immer identisch
(Herzminutenvolumen), Strömungsgeschwindigkeit = Strömung /
Gesamtquerschnitt der Gefäße.
Unten: Der Gesamtquerschnitt der Gefäße (pro Abschnitt) ist im Bereich der Mikrozirkulation (Kapillaten) am größten

Man kann unterschiedliche Oszillationen des arteriellen Blutdrucks beobachten, die sehr verschiedene Ursachen haben:
 Der rhythmische Wechsel zwischen "systolischem" und "diastolischem" Druck, der in Arterien auftritt, ergibt Druckpulse, die als Blutdruckschwankungen I. Ordnung bezeichnet werden (Abbildungen oben). Die Periodendauer
entspricht dem Kehrwert der Pulsfrequenz (z.B. eine Sekunde bei 60 bpm)
und ist direkt vom autonom-nervösen Gleichgewicht abhängig
(Sympathikus: vasokonstriktorisch und positiv chronotrop,
Parasympathikus: negativ chronotrop wirksam). Die Höhe des systolischen
Drucks hängt vor allem von der Auswurfleistung des linken Herzens und
der Dehnbarkeit des Arteriensystems ab, die des diastolischen Drucks
vor allem von Pulsfrequenz und peripherem Strömungswiderstand.
Der rhythmische Wechsel zwischen "systolischem" und "diastolischem" Druck, der in Arterien auftritt, ergibt Druckpulse, die als Blutdruckschwankungen I. Ordnung bezeichnet werden (Abbildungen oben). Die Periodendauer
entspricht dem Kehrwert der Pulsfrequenz (z.B. eine Sekunde bei 60 bpm)
und ist direkt vom autonom-nervösen Gleichgewicht abhängig
(Sympathikus: vasokonstriktorisch und positiv chronotrop,
Parasympathikus: negativ chronotrop wirksam). Die Höhe des systolischen
Drucks hängt vor allem von der Auswurfleistung des linken Herzens und
der Dehnbarkeit des Arteriensystems ab, die des diastolischen Drucks
vor allem von Pulsfrequenz und peripherem Strömungswiderstand.
Die Größe der Blutdruckschwankungen I. Ordnung entspricht dem Betrag der Blutdruckamplitude.
Oszillationen des Blutdrucks, die im Rhythmus der Atmung auftreten, nennt man
Blutdruckschwankungen II. Ordnung - respiratorische (Sinus-) Arrhythmie, respiratorische Blutdruckschwankungen. Bei einer Atemfrequenz von 12-20/min entspricht das einer Periodendauer von 3-5 Sekunden. Einatmung (intrathorakaler Druck und Vagustonus↓) erhöht, Ausatmung senkt die Herzfrequenz (intrathorakaler Druck und Vagustonus↑). Die Größe dieser Oszillationen wird häufig als Maß für den Vagustonus verwendet (mittels EKG-Monitoring leicht registrierbar, aber begrenzt spezifisch).
Blutdruckschwankungen III. Ordnung (Traube-Hering-Meyer-Wellen  bzw- -Oszillationen, THM-Wellen) treten vermutlich im Zusammenhang mit Oszillationen der Baro- bzw. Chemorezeptorreflexe
und des (vom Sympathikus gesteuerten) peripheren Gefäßtonus auf. Die
Oszillationen lassen sich sowohl in Blutdruck- als auch
EKG-Registrierungen erkennen und hängen eng mit solchen des Sympathikustonus
zusammen (pharmakologische Blockade der vaskulären α-Adrenozeptoren
lässt Blutdruckschwankungen III. Ordnung verschwinden). Die Periodendauer beträgt ~10 Sekunden (Frequenz ~0,1 Hz) und ist unabhängig von Körperlage, Geschlecht oder Alter.
bzw- -Oszillationen, THM-Wellen) treten vermutlich im Zusammenhang mit Oszillationen der Baro- bzw. Chemorezeptorreflexe
und des (vom Sympathikus gesteuerten) peripheren Gefäßtonus auf. Die
Oszillationen lassen sich sowohl in Blutdruck- als auch
EKG-Registrierungen erkennen und hängen eng mit solchen des Sympathikustonus
zusammen (pharmakologische Blockade der vaskulären α-Adrenozeptoren
lässt Blutdruckschwankungen III. Ordnung verschwinden). Die Periodendauer beträgt ~10 Sekunden (Frequenz ~0,1 Hz) und ist unabhängig von Körperlage, Geschlecht oder Alter.
Blutdruckschwankungen II. und III. Ordnung haben normalerweise ein relativ geringes Ausmaß (bis 5 mmHg, im Stehen bis 20 mmHg).
Intensivere Blutdruckschwankungen II. und III. Ordnung legen eine Labilität der Blutdruckregulation nahe.
Stresseinflüsse physikalischer,
seelischer oder körperlicher Art bewirken schließlich
belastungsabhängige Veränderungen des Blutdrucks, die z.B.
 hydrostatische Ursache haben (so folgt der Blutdruck - arteriell, venös - positionsabhängig Lageänderungen des Körpers, außer im jeweiligen hydrostatischen Indifferenzpunkt),
hydrostatische Ursache haben (so folgt der Blutdruck - arteriell, venös - positionsabhängig Lageänderungen des Körpers, außer im jeweiligen hydrostatischen Indifferenzpunkt),
 vom Gehirn ausgehen (vegetative Reaktionen auf Erregung, Freude, Angst, Verunsicherung etc), oder
vom Gehirn ausgehen (vegetative Reaktionen auf Erregung, Freude, Angst, Verunsicherung etc), oder
 aus der aktiven Körperperipherie erzwungen werden (z.B. Autoregulation der Muskelperfusion).
aus der aktiven Körperperipherie erzwungen werden (z.B. Autoregulation der Muskelperfusion).
Zirkadiane Rhythmen bewirken, dass der
Blutdruck im Schlaf auf niedrigere Werte reguliert wird als im
Wachzustand, wo Gipfelwerte am frühen Vormittag sowie am späten
Nachmittag beobachtet werden (unabhängig von aktivitätsabhängigen
Schwankungen bei psychischer oder physischer Belastung).
Pumpt
der linke Ventrikel ein Schlagvolumen in Aorta und zentrale arterielle
Gefäße, dehnen sich deren Wände elastisch auf und nehmen während der Austreibungszeit einen Großteil davon (70-80%) auf - kinetische wird in potentielle Energie verwandelt. Das
dämpft den Druckanstieg während des Herzschlags ("Windkesseleffekt", man nennt mit zahlreichen elastischen Fasern ausgestattete arterielle Gefäße auch Windkesselgefäße - windkessel vessels).
Das bedeutet, die großen Arterien haben - im Vergleich zu kleineren - eine relativ hohe Dehnbarkeit (Compliance): ~2 ml / mmHg.
Während der Diastole geben die großen arteriellen Gefäße das aufgefangene Blut an
die
Peripherie weiter (potentielle Energie wird zu kinetischer
zurückverwandelt), die Strömung des Blutes zur Peripherie erfolgt
relativ kontinuierlich, und die Blutdruckamplitude (pulse pressure) bleibt in einem Bereich
von ~5-6 kPa (~40 mmHg, z.B. 120/80).
Versteift sich die Wand der großen Arterien durch abnehmende Dehnbarkeit der Media (Arteriosklerose), nimmt dieser
dämpfende Effekt ab und die Blutdruckamplitude zu - ein häufiger Befund in höherem Alter.


 Abbildung: Windkesseleffekt
Abbildung: Windkesseleffekt
Modifiziert nach einer Vorlage bei Silverthorn, Human Physiology, an integrated approach, 4th Int'l ed. 2007, Pearson / Benjamin Cummings
Oben:
Kontraktion des Kammermyokards (1) öffnet die Semilunarklappe (2), das
Schlagvolumen wird ausgetrieben. Die Aorta und großen Gefäße
expandieren (3), ein Teil des Schlagvolumens wird hier deponiert und
kinetische in potentielle Energie umgewandelt (elastische Dehnung
der herznahen Gefäße), der Ventrikel wird entlastet (geringere
Nachlast). Sind die Gefäßwände verhärtet (sklerosiert), entfällt dieser
Effekt und die Belastung des Ventrikels während der Austreibungszeit
nimmt zu (erhöhte Beschleunigungsarbeit, zunehmender systolischer
Druck).
Unten: Der
Ventrikel entspannt sich (4), die Semilunarklappe schließt (5), die
während der Systole investierte kinetische Energie wird zurückgewonnen, Blut strömt
weiter in die Peripherie (6)

Herznahe arterielle Gefäße, die zur Zwischenspeicherung des
Schlagvolumens und Dämpfung der Druckamplitude beitragen, nennt man
"Windkesselgefäße" (Windkessel vessels).
Mit sinkender Dehnbarkeit der Aorta nimmt der systolische Druck zu (abnehmende Windkesselwirkung)
|
Pulswellengeschwindigkeit (PWG, pulse wave velocity):
Die Geschwindigkeit, mit der die Pulswelle durch das Arteriensystem
läuft, beträgt 4-5 (Aortenwurzel) bis ~10 m/s (Peripherie - die
Pulswelle braucht vom Herzen bis zur Fußarterie ~0,2 Sekunden). Aus der  Abbildung unten
ist ersichtlich, dass die Pulswellengeschwindigkeit bei mittelgroßen
(nicht-sklerosierten) Arterien im Blutdruckbereich von 75-125 mmHg
zwischen etwa 4 und 8 m/s beträgt.
Abbildung unten
ist ersichtlich, dass die Pulswellengeschwindigkeit bei mittelgroßen
(nicht-sklerosierten) Arterien im Blutdruckbereich von 75-125 mmHg
zwischen etwa 4 und 8 m/s beträgt.

Abbildung: Arterieller Gefäßquerschnitt (Fläche), Dehnbarkeit und Pulswellengeschwindigkeit als Funktion des Innendrucks
Nach Lacolley P, Regnault V, Segers P, Laurent S. Vascular
Smooth Muscle Cells and Arterial Stiffening: Relevance in Development,
Aging, and Disease. Physiol Rev 2017; 97: 1555-617
Schwarze Kurve: Typische nonlineare Abhängigkeit der luminalen Querschnittsfläche
einer mittelgroßen Arterie als Funktion des Blutdrucks. Der physiologische Druckbereich ist blau gekennzeichnet.
Bei steigendem Druck wird die
mechanische Belastung zunehmend vom Elastin auf (das steifere) Kollagen
übertragen - daher die Nonlinearität sowie die mit dem Druck abnehmende
Dehnbarkeit (grün) und zunehmende Pulswellengeschwindigkeit (magenta)

 Aus
Registrierungen arterieller Pulse (Sphygmographie
Aus
Registrierungen arterieller Pulse (Sphygmographie  ) können Rückschlüsse
auf Eigenschaften der Arterienwand gezogen werden, da diese
Eigenschaften die Propagation der Druckwellen mitbestimmen. Dabei
müssen Begleitumstände berücksichtigt werden, wie z.B. die Größe des
Herzminutenvolumens, die vegetativ-neurale Aktivität, die Körperlage
u.a.
) können Rückschlüsse
auf Eigenschaften der Arterienwand gezogen werden, da diese
Eigenschaften die Propagation der Druckwellen mitbestimmen. Dabei
müssen Begleitumstände berücksichtigt werden, wie z.B. die Größe des
Herzminutenvolumens, die vegetativ-neurale Aktivität, die Körperlage
u.a.
 Die Messung der Pulswellengeschwindigkeit
im Aortenbereich gilt als "Goldstandard" zur Abschätzung der
Elastitität (Dehnbarkeit) des zentralen (herznahen) Arteriensystems.
Abnehmende Dehnbarkeit (Versteifung: Arteriosklerose) bewirkt ein rascheres Fortschreiten der
Druckwelle, d.h. sie erhöht die Pulswellengeschwindigkeit - sie nimmt im Durchschnitt der Population mit zunehmendem Lebensalter etwa auf das Doppelte der Werte von Kindern / Jungendlichen zu.
Die Messung der Pulswellengeschwindigkeit
im Aortenbereich gilt als "Goldstandard" zur Abschätzung der
Elastitität (Dehnbarkeit) des zentralen (herznahen) Arteriensystems.
Abnehmende Dehnbarkeit (Versteifung: Arteriosklerose) bewirkt ein rascheres Fortschreiten der
Druckwelle, d.h. sie erhöht die Pulswellengeschwindigkeit - sie nimmt im Durchschnitt der Population mit zunehmendem Lebensalter etwa auf das Doppelte der Werte von Kindern / Jungendlichen zu.
 Der periphere (systemische) Strömungswiderstand (total peripheral / systemic vascular resistance TPR) ist eine virtuelle Größe und berechnet sich aus dem Quotienten Druckgefälle (arterieller - venöser Druck) / Durchblutung.
Er entsteht im Wesentlichen durch die Passage des Blutes durch kleinste
arterielle Gefäße, die mit ihrer geringen inneren Weite wenig
hydraulische Leitfähigkeit bieten.
Der periphere (systemische) Strömungswiderstand (total peripheral / systemic vascular resistance TPR) ist eine virtuelle Größe und berechnet sich aus dem Quotienten Druckgefälle (arterieller - venöser Druck) / Durchblutung.
Er entsteht im Wesentlichen durch die Passage des Blutes durch kleinste
arterielle Gefäße, die mit ihrer geringen inneren Weite wenig
hydraulische Leitfähigkeit bieten.
Anders ausgedrückt, setzen sie ihrer
Durchströmung einen hohen Widerstand entgegen. Das Resultat ist ein -
durch Reibungsverlust bedingter - Druckabfall gegen den Ausgang des
Gefäßes hin.
Der arterielle Blutdruck (pA) kann als das Produkt aus Herzzeitvolumen (HZV) und Strömungswiderstand (TPR) formuliert werden (s. oben), daher kann der periphere Widerstand geschrieben werden als
Der Betrag des Widerstandes wird z.B. in mmHg / (ml/s) angegeben (PRUs: peripheral resistance units).
Da die arteriolären Gefäße im Kreislauf nebeneinander (parallel, nicht
seriell) angeordnet sind, ergibt die Summe all ihrer Leitfähigkeiten
die Gesamt-Leitfähigkeit des (großen bzw. kleinen) Kreislaufs.
Die gesamte hydrodynamische Leitfähigkeit (Lgesamt) der Kreislaufperipherie ergibt sich aus der Summe der Leitfähigkeiten (L1 + L2 + ... Ln)
in den einzelnen Perfusionsstrecken.
Da der
Widerstand als Kehrwert der Leitfähigkeit definiert ist, ergibt sich
weiter, dass der Kehrwert des Gesamtwiderstands gleich der Summe der
Kehrwerte der Einzelwiderstände ist. Statt der Summe der Leitfähigkeiten ergibt sich daher für den gesamten peripheren Strömungswiderstand (total peripheral resistance) analog zum ersten Kirchhoff-Gesetz  :
:
| 1 / Rgesamt = 1 / R1 + 1 / R2 + ... 1 / Rn |
Liegen Widerstände ausnahmsweise hintereinander - wie bei bei arteriellen Gefäßen zum Darm plus Pfortadergefäßen zur Leber -, ergibt sich (analog zum zweiten Kirchhoff-Gesetz) der Gesamtwiderstand der Gefäße, die durch Darm und anschließend Leber führen, aus der Summe ihrer Einzelwiderstände, also
R = RDarm + RLeber
Öffnen sich die Widerstandsgefäße eines Teilkreislaufs (z.B. in der
Haut), dann wird ein größerer Teil des Herzzeitvolumens durch dieses
Gebiet geleitet ("shunt").
Soll der Blutdruck dabei nicht absinken, muss sich das Herzzeitvolumen
entsprechend erhöhen, wenn der Blutdruck und die Durchblutung anderer
Gebiete nicht sinken soll (z.B. bei Hitzeeinfluss oder körperlicher Belastung).
Welche physiologischen Messwerte sind für die Berechnung eines peripheren Widerstandswertes relevant?
 Im großen Kreislauf kann der Gesamtbetrag des Strömungswiderstandes aus der Differenz Aortendruck (z.B. 13,4 kPa) minus
Druck im rechten Vorhof (0,4 kPa) - hier also 13 kPa - dividiert durch
das Herzminutenvolumen (~6 l/min oder 0,1 l/s) - errechnet werden: In
diesem Beispiel ergibt sich ein Richtwert (SI-Einheiten) von
Im großen Kreislauf kann der Gesamtbetrag des Strömungswiderstandes aus der Differenz Aortendruck (z.B. 13,4 kPa) minus
Druck im rechten Vorhof (0,4 kPa) - hier also 13 kPa - dividiert durch
das Herzminutenvolumen (~6 l/min oder 0,1 l/s) - errechnet werden: In
diesem Beispiel ergibt sich ein Richtwert (SI-Einheiten) von
Ein anderer Lehrbuch-Richtwert (Annahme: 100 - 3 mmHg, 5 l/min) lautet
Da das
Herzminutenvolumen stärker von der Position des Körpers
abhängt (z.B. im Liegen 7 l/min, im Stehen 5 l/min) als der Blutdruck
(der reflektorisch stabilisiert wird), ist der periphere Widerstand in aufrechter Körperlage (upright) wesentlich höher als in liegender (supine) Position - bedingt durch den höheren Sympathikustonus.
Zum Beispiel:
|
Aortendruck (gemittelt)
|
Druck im rechten Vorhof (gemittelt)
|
Herzminuten-
volumen
|
Liegen
|
100 mmHg
|
4 mmHg
|
7 l/min
|
Stehen
|
96 mmHg
|
0 mmHg
|
5 l/min
|
 Wie stark unterscheidet sich in diesem Beispiel der periphere Widerstand (Liegen vs. Stehen)?
Wie stark unterscheidet sich in diesem Beispiel der periphere Widerstand (Liegen vs. Stehen)?

Liegen: 96 / 7 = 13,7 mmHg pro l/min
Stehen: 96 / 5 = 19,2 mmHg pro l/min

Ergebnis: Der Widerstand steigt durch das Aufrichten des Körpers um 40% des Liege-Wertes an.
Der Widerstand im großen Kreislauf entsteht zu
 3/4 in den "Widerstandsgefäßen" (kleine Arterien, Arteriolen, Metarteriolen);
3/4 in den "Widerstandsgefäßen" (kleine Arterien, Arteriolen, Metarteriolen);
 1/4 tragen die Kapillaren (Mikrozirkulation) bei.
1/4 tragen die Kapillaren (Mikrozirkulation) bei.
 Der Widerstand im Lungenkreislauf ("kleinen" Kreislauf)
ist wesentlich geringer, er beträgt nur ~7% des Widerstandes im großen
Kreislauf. Physiologisch steht er vor allem unter dem Einfluss des pCO2.
Der Widerstand im Lungenkreislauf ("kleinen" Kreislauf)
ist wesentlich geringer, er beträgt nur ~7% des Widerstandes im großen
Kreislauf. Physiologisch steht er vor allem unter dem Einfluss des pCO2.
 Der Widerstand der arteriellen Gefäße hängt von ihrem Kontraktionszustand ab. Arteriolen sind relativ muskelstark und verfügen über einen basalen, vom Innendruck abhängigen Tonus, der aktiv erzeugt wird, also aus der Kontraktion ihrer Muskulatur stammt (myogener Tonus).
Seine Entstehung ist nicht ganz geklärt, wahrscheinlich spielen
dehnungsempfindliche Ionenkanäle eine Rolle.
Der Widerstand der arteriellen Gefäße hängt von ihrem Kontraktionszustand ab. Arteriolen sind relativ muskelstark und verfügen über einen basalen, vom Innendruck abhängigen Tonus, der aktiv erzeugt wird, also aus der Kontraktion ihrer Muskulatur stammt (myogener Tonus).
Seine Entstehung ist nicht ganz geklärt, wahrscheinlich spielen
dehnungsempfindliche Ionenkanäle eine Rolle.
Zu beachten ist, dass der
Blutdruck eine stetige mechanische Dehnung der Gefäßwände verursacht
und den myogenen Tonus hervorruft (die dilatierende Kraft stammt letztlich - via Blutdruck - vom
Herzen).
Zusätzlich zum myogenen Tonus stehen die Gefäße unter dem steuernden Einfluß des Sympathikus. Sympathische Fasern setzen Noradrenalin frei, das über α1-Rezeptoren, Aktivierung der Phospholipase C
und Proteinkinase C Calciumionen aus endoplasmatischen Speichern
freisetzt und zu weiterer Kontraktion der glatten Muskelzellen führt (neurogener Tonus).
Weiters kommen lokale Faktoren
zur Beeinflussung des arteriolären Tonus dazu: So können endotheliale
"Messergebnisse" stromaufwärts an die Arteriolen vermittelt werden
(vielleicht erfolgt Übertragung über die Endothelzellen), und im
Interstitium kann sich bei Aktivität des Gewebes oder Organs eine
Fülle verschiedener Stoffe anhäufen und die Arteiolen entsprechend
beeinflussen - typischerweise im Sinne von Tonusverminderung,
Dilatation und damit Durchblutungssteigerung.
 In einigen Organen (wie Skelettmuskulatur, Myokard, Gehirn) sind lokale Faktoren
von führender Bedeutung für den Zustand der Widerstandsgefäße - sie
bestimmen ihre Durchblutung selbst, entsprechend dem Bedarf. In anderen
(wie Haut, Nieren, Splanchnikusorgane) ist es vorwiegend der Sympathikustonus,
der den Tonus der Arteriolen steuert - die Perfusion dieser Organe
steht im Dienste der allgemeinen Kreislaufregulation. In einem Notfall
(Zentralisation im Kreislaufschock) ist die Durchblutung von Gehirn und Herzmuskel - vor allen anderen Abnehmern - so am längsten gesichert.
In einigen Organen (wie Skelettmuskulatur, Myokard, Gehirn) sind lokale Faktoren
von führender Bedeutung für den Zustand der Widerstandsgefäße - sie
bestimmen ihre Durchblutung selbst, entsprechend dem Bedarf. In anderen
(wie Haut, Nieren, Splanchnikusorgane) ist es vorwiegend der Sympathikustonus,
der den Tonus der Arteriolen steuert - die Perfusion dieser Organe
steht im Dienste der allgemeinen Kreislaufregulation. In einem Notfall
(Zentralisation im Kreislaufschock) ist die Durchblutung von Gehirn und Herzmuskel - vor allen anderen Abnehmern - so am längsten gesichert.
Bedeutung des Gefäßdurchmessers (Innenradius)
Von welchen physikalischen Randbedingungen hängt die Durchblutung
(Blutströmung durch Widerstandsgefäße) ab? Bei laminarer Strömung gilt
das Hagen-Poiseuille-Gesetz,
wonach die Durchlässigkeit eines Gefäßes mit der vierten Potenz des
Radius zunimmt:
Q = ∂p x (π . r4) / (8ηl)
|
wobei Q = Strömung, ∂p = Druckdifferenz, r = Innenradius, η = Viskosität der Flüssigkeit und l = Gefäßlänge.

Abbildung: Gefäßdurchmesser und Strömung
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Aus
dem Gefäß in der Mitte strömt eine Flüssigkeit mit gegebener Viskosität
in die gleich langen Rohre A und B ein. Diese liegen auf gleicher Höhe,
der hydrostatische Druck am Rohreingang ist für A und B daher identisch.
Der Strömungswiderstand ist proportional 1/r4,
daher fließt (in einer gegebenen Zeitspanne) durch das Rohr B (dessen
Durchmesser doppelt so groß wie der von A ist) die 16-fache Menge
Flüssigkeit im
Vergleich zu Rohr A.
Für den Kreislauf bedeutet das, dass eine Verdoppelung eines
Gefäßdurchmessers (Vasodilatation) - unter sonst gleichbleibenden
Bedingungen (Druckdifferenz, Blutviskosität) - die Perfusion des
betreffenden Gefäßabschnittes ungefähr um einen Faktor 16 erhöht

Da Strömung = ∂p / R (Poiseuille-Gesetz), gilt für den Strömungswiderstand R

 Abbildung: Innendurchmesser vs. Strömungswiderstand
Abbildung: Innendurchmesser vs. Strömungswiderstand
Nach einer Vorlage bei Thibodeau / Patton, Anatomy & Physiology (6th ed), Mosby Elsevier 2007
Bei gegebenem Druckgefälle (z.B. 100 mmHg
zwischen Eingang und Ausgang des Gefäßes) verhält sich der
Strömungswiderstand nach dem Hagen-Poiseuille-Gesetz proportional dem
Kehrwert des Innenradius zur 4. Potenz, die Strömung nimmt
proportional zu [r4] zu.
Die Beziehung zwischen Gefäßdurchmesser und Strömung (bzw. Strömungswiderstand) ist deshalb stark nichtlinear:
Beträgt z.B. der Innendurchmesser (d) bei Vasokonstriktion (oben) eine halbe Längeneinheit (d=1/2) und die Strömung
dabei eine Strömungseinheit (z.B. 1 ml/min), erhöht sich der Betrag der
Strömung bei Verdopplung (d=1) auf das 16-fache (24=16 ml/min) (normaler Muskeltonus, Mitte) und bei d=2 mm um das 256-fache (44=256 ml/min) (Vasodilatation, unten)
Dass der Strömungswiderstand mit der
vierten Potenz des Innenradius abnimmt, ist ein ganz wesentliches
Prinzip für die Kreislaufregulation, denn schon geringe Veränderungen
des Gefäßzustandes (Vasokonstriktion-
z.B. über Aktivierung von α-Rezeptoren - vs. Vasodilatation) führt zu deutlichen Effekten bei der Durchblutung des betreffenden Gewebeareals.
Die Leitfähigkeit eines Gefäßes steigt mit der vierten Potenz des Gefäßradius - der Strömungswiderstand verhält sich umgekehrt proportional dazu
|
 Die
Durchblutung eines Gefäßes wird im Wesentlichen über seinen Innendurchmesser
beeinflusst.
Andere Faktoren - wie Gefäßlänge oder Blutviskosität - sind vorgegebene Größen und
nicht als Stellglied zur raschen Änderung von Perfusion oder Blutdruck geeignet.
Die
Durchblutung eines Gefäßes wird im Wesentlichen über seinen Innendurchmesser
beeinflusst.
Andere Faktoren - wie Gefäßlänge oder Blutviskosität - sind vorgegebene Größen und
nicht als Stellglied zur raschen Änderung von Perfusion oder Blutdruck geeignet.
Die meisten Blutgefäße stehen unter Dauerbeeinflussung durch sympathische Impulse ("Sympathikustonus":
Ausschüttung von Noradrenalin → Vasokonstriktion). Andererseits weitet der Blutdruck die
Gefäßwände (mechanische Vasodilatation). Die systemische
Blutdruckregulation bedient sich daher aktiver vasokonstriktorischer Wirkung des Sympathikus.
So wirken einerseits die zentrale Blutdruckregulation, andererseits gezielt-lokale
Einflüsse zusammen.
 Perfusionsbudget:
Perfusionsbudget:
Die Blutdruckregulation kann mit dem Staatshaushalt verglichen werden:
Die einzelnen Ressorts geben Geld aus, das Finanzministerium muss mit
begrenzten Mitteln haushalten. Umgesetzt auf den Kreislauf: Einerseits
haben verschiedene Ressorts (Organe) Eigenbedarf
(weite Gefäße → hoher Blutstrom), andererseits ist die Geldmenge
(Blutvolumen) begrenzt, und der gesamte
periphere Widerstand muss hoch genug sein, um den Blutdruck stabil zu
halten (enge Gefäße → hoher Druck).
Die Blutdruckregulation beruht auf einem Kompromiss, der -
nachfrageorientiert - auf optimale Durchblutungswerte abzielt. Ist die
Summe dieses Bedarfs erhöht (wie bei
körperlicher Belastung), muss das Blut rascher zirkulieren:
Das Herzzeitvolumen steigt an.
Die stärkste Steigerung des Bedarfs entsteht bei körperlicher Belastung: Das Herzzeitvolumen kann ~4-5-fach (auf ≥20 l/min bei erwachsenen Personen) ansteigen. Bei Hitzeeinwirkung
kann ferner die Hautdurchblutung auf ~5 l/min steigen (Kühlung des
Körpers über die Haut!), dann verdoppelt sich das Herzzeitvolumen (auf ~10 l/min).
 Über Vasodilatation s. weiter unten
Über Vasodilatation s. weiter unten
Venen speichern schon bei geringem Füllungsdruck viel Blut
Unter Compliance (C) versteht man (physikalisch und physiologisch) die mechanische Dehnbarkeit eines Hohlkörpers. Sie ist definiert als
 Volumen V pro Druck p - z.B. ergibt sich bei einer bestimmten
Blasenfüllung (im steady state) ein entsprechender Blaseninnendruck; oder als
Volumen V pro Druck p - z.B. ergibt sich bei einer bestimmten
Blasenfüllung (im steady state) ein entsprechender Blaseninnendruck; oder als
 Volumenänderung ∂V pro Druckänderung ∂p,
eine Größe, die auch ohne Kenntnis des absoluten Füllungsvolumens (z.B.
des Blutvolumens im Kreislauf) ermittelt werden kann :
Volumenänderung ∂V pro Druckänderung ∂p,
eine Größe, die auch ohne Kenntnis des absoluten Füllungsvolumens (z.B.
des Blutvolumens im Kreislauf) ermittelt werden kann :
Die Definition der Compliance als ∂V/∂p ist besonders nützlich und funktionell relevant.
Zeitabhängige Veränderungen der Gefäßwandeigenschaften können die Compliance verändern ("Plastizität", Wachstumsvorgänge, ..).
Der Kehrwert der Compliance ist der Volumen-Elastizitätskoeffizient E' (definiert als Druckänderung pro Volumenänderung, s. oben).
Man kann die Compliance der herznahen Arterien vereinfacht mit ~2 ml/mm Hg angeben.
Die Compliance im Arteriensystem
ermöglicht es, Druckschwankungen infolge der Herztätigkeit zu dämpfen
(Windkesselfunktion). Als Faustregel gilt, dass (bei einer
gesunden erwachsenen Person) pro ml zugeführtem Volumen der Druck um 1 mmHg (0,13 kPa) ansteigt.
In das Venensystem
müssen hingegen etwa 200 ml zugeführt werden (Bluttransfusion!), um den
Druck um 1 mmHg zu steigern. Die Volumendehnbarkeit ist also etwa
200-fach höher als im Arteriensystem (Speichersystem).
Compliance
ml/mm Hg, gerundete Mittelwerte
|
Aorta (herznahe)
|
Arterien (systemisch)
|
Venen (Niederdrucksystem)
|
2
|
1
|
200
|
Venen
können allerdings arterienähnliche Eigenschaften annehmen, wenn sie in
eine arterielle Position verbracht, d.h. anderen hämodynamischen
Umständen ausgesetzt werden (z.B. koronarer Shunt aus transplantiertem
Venenabschnitt).
 Das Arteriensystem beinhaltet etwa 750 ml Blut; die arterielle
Compliance beträgt ca. 7,5 ml/kPa (1 ml / mmHg). Im Niederdrucksystem
befinden sich mehr als 4 Liter Blut; die venöse Compliance beträgt 1500
ml/kPa (200 ml / mm Hg).
Das Arteriensystem beinhaltet etwa 750 ml Blut; die arterielle
Compliance beträgt ca. 7,5 ml/kPa (1 ml / mmHg). Im Niederdrucksystem
befinden sich mehr als 4 Liter Blut; die venöse Compliance beträgt 1500
ml/kPa (200 ml / mm Hg).

 Abbildung: Kongestionsversuche zur Erforschung des venösen Kreislaufs
Aus William Harvey, Exercitatio anatomica de motu cordis et sanguinis in animalibus. Rotterdam: Arnold Leer, 1654
Abbildung: Kongestionsversuche zur Erforschung des venösen Kreislaufs
Aus William Harvey, Exercitatio anatomica de motu cordis et sanguinis in animalibus. Rotterdam: Arnold Leer, 1654

 Noch
im 16. Jahrhundert war es medizinische Lehrmeinung, dass das oszillierende Herz Blut
in den Gefäßen lediglich hin-und herbewegt, um diese zu "durchspülen";
über die Funktionsweise des Lungenkreislaufs herrschten völlig falsche
Vorstellungen.
Noch
im 16. Jahrhundert war es medizinische Lehrmeinung, dass das oszillierende Herz Blut
in den Gefäßen lediglich hin-und herbewegt, um diese zu "durchspülen";
über die Funktionsweise des Lungenkreislaufs herrschten völlig falsche
Vorstellungen.
1628 präsentierte William Harvey das Konzept eines geschlossenen Kreislaufs und der
Pumpfunktion des Herzens - mit einem zwischen rechtes und linkes Herz geschalteten
Lungenkreislauf ("De Motu Cordis"). Dieses Konzept beruhte auf dem Ergebnis systematischer Untersuchungen und logischer Schlussfolgerungen
(und fasste auch Ergebnisse früherer Forscher, wie Serveto, Caesalpinus, Fabricius, zusammen).
Freilich hatte man schon im Altertum wichtige Erkenntnisse zur
Physiologie des Kreislaufs gewonnen, die dann wieder verlorengingen; so
betonte Eristratos
im 3. Jh. vor unserer Zeitrechnung, dass der Puls in herznahen Arterien
früher auftritt als in peripheren (Propagation der Pulswelle!). Der römische Arzt Archigenes
beschrieb im 2. Jh. vuZ erstmals die Dikrotie (Zweigipfligkeit) des arteriellen Pulses. Galen
stellte Untersuchungen zu verschiedenen Pulsformen an. Der Puls galt
auch in der chinesischen Medizin als wichtiges diagnostisches
Kriterium, hier wurden mehr als 30 Pulsqualitäten beschrieben.
Eine erste korrekte Beschreibung des Lungenkreislaufs gelang bereits im 13. Jahrhundert durch Ibn an-Nafis
in Syrien (in Vergessenheit geraten, Schriften 1914 wiederentdeckt);
allerdings rein theoretisch, während Harvey auch empirische Befunde nutzen
konnte.
Die Frage der Verbindung zwischen arteriellen und venösen Gefäßen wurde schließlich Mitte des 17. Jh. durch Marcello Malpighi
gelöst, indem er die Blutkapillaren beschrieb und so die Annahmen
Harveys betreffend die Geschlossenheit des Blutkreislaufs bestätigte.
Der Gefäßtonus
ist der Zustand der Gefäßwand, der eine definierte
Druck-Volumen-Charakteristik ergibt. Eine solche ist schon durch
passive bindegewebige Elemente gegeben. Physiologischerweise stehen
Blutgefäße aber immer unter dem Einfluss von Faktoren, welche die
glatte Muskulatur (konstitutiv) anregen, wie myogene Antworten, aktive TRP-Kanäle (TRPC) in der Myozytenmembran, Endotheline - sowie auch dilatierender Effekte, z.B. durch NO oder endothelabhängige Hyperpolarisierung.
Der Effekt der - bei Venen generell niedrigen - konstitutiven
glattmuskulären Kontraktion addiert sich zu dem rein durch das Bindegewebe verursachten. Diesen Zustand nennt man Ruhetonus (basal tone). Da für die Kontraktion der Muskelfasern ein Einstrom von Ca++-Ionen erfolgen muss (elektromechanische Kopplung), können Ca++-Antagonisten den Muskeltonus minimieren und bei entsprechender Dosierung einen rein passiven Basistonus herstellen.
Gefäße weisen meist einen gewissen
Aktivierungsgrad auf; zusätzlich zum
Ruhetonus addieren sich verschiedene Effekte auf die glatten Muskelzellen - meistens mündend in eine
Vasokonstriktion, gelegentlich auch eine Vasodilatation, oder die
Auslösung rhythmischer Vorgänge (Autorhythmie) - je nach Reiz und
Beschaffenheit des konkreten Gefäßes.
 Der Gefäßtonus unterliegt dem Einfluss zahlreicher Faktoren:
Der Gefäßtonus unterliegt dem Einfluss zahlreicher Faktoren:
 Autoregulation der Durchblutung (Gehirn, Myokard, Nieren etc): Bayliss-Effekt.
Autoregulation der Durchblutung (Gehirn, Myokard, Nieren etc): Bayliss-Effekt.
 Temperatur, z.B. Lewis-Reaktion.
Temperatur, z.B. Lewis-Reaktion.
 Lokalen vasoaktiven Substanzen: Intrinsische wie die Vasodilatatoren Adenosin, CO2, Laktat, Phosphat, Hyperosmolarität, H2O2
sowie endotheliale Faktoren wie die Dilatatoren Stickstoffmonoxid,
endothelial bewirkte Hyperpolarisation; Endotheline; Autakoide (Moleküle, die wie Hormone wirken, z.B. Histamin, Bradykinin, Serotonin, Eikosanoide, plättchenaktivierender Faktor PAF - hauptsächlich bei Entzündungen oder Blutungen aktiv.
Lokalen vasoaktiven Substanzen: Intrinsische wie die Vasodilatatoren Adenosin, CO2, Laktat, Phosphat, Hyperosmolarität, H2O2
sowie endotheliale Faktoren wie die Dilatatoren Stickstoffmonoxid,
endothelial bewirkte Hyperpolarisation; Endotheline; Autakoide (Moleküle, die wie Hormone wirken, z.B. Histamin, Bradykinin, Serotonin, Eikosanoide, plättchenaktivierender Faktor PAF - hauptsächlich bei Entzündungen oder Blutungen aktiv.
 Autonom-nervösen Einflüssen (sympathisch, vereinzelt
parasympathisch),
insbesondere Noradrenalin.
Autonom-nervösen Einflüssen (sympathisch, vereinzelt
parasympathisch),
insbesondere Noradrenalin.
 Vasoaktiven Hormonen - entweder direkt (Adrenalin, Vasopressin, Angiotensin) oder indirekt: Insulin regt das Endothel zur Produktion von NO an und wirkt so vasodilatierend und antithrombotisch; Östradiol bewirkt in zahlreichen Geweben Vasodilatation - teils über Aktivierung von Kaliumkanälen, teils durch Wirkung auf eNOS.
Vasoaktiven Hormonen - entweder direkt (Adrenalin, Vasopressin, Angiotensin) oder indirekt: Insulin regt das Endothel zur Produktion von NO an und wirkt so vasodilatierend und antithrombotisch; Östradiol bewirkt in zahlreichen Geweben Vasodilatation - teils über Aktivierung von Kaliumkanälen, teils durch Wirkung auf eNOS.


Abbildung: Lokale und externe Faktoren der Gefäßsteuerung
Nach einer Vorlage in Herring / Paterson, Levick's Introduction to Cardiovascular Physiology, 6th ed. 2018
Die myogene Antwort ist der Bayliss-Effekt. Autakoide sind körpereigene vasoaktive Substanzen wie Histamin, Serotonin, Kinine, Eikosanoide, Angiotensin
NO, Stickstoffmonoxid

Die Einflussnahme auf den Tonus der Gefäßwand kann lokal oder von außen erfolgen ( Abbildung).
Abbildung).
Zahlreiche Zellen regulieren die Durchblutung ihres Versorgungsgebietes
auf lokaler Ebene über vasoaktive Substanzen, wie Nerven- und
Muskelzellen (funktionelle oder metabolische Hyperämie oder metabolische Vasodilatation).
Der Vorteil liegt in der stufenlosen Anpassung der Durchblutung an den
Sauerstoffbedarf des Gewebes. Dieser Effekt wirkt sich vor allem auf
die kleinen Gefäße (Arteriolen) aus.
Große Gefäße reagieren hingegen vor allem auf Belastung des Endothels über Schubspannung (Scherkräfte infolge Blutströmung) mittels Freisetzung von Vasodilatantien wie Stickstoffmonoxid oder Prostazyklin, aber auch auf Axonreflexe (aszendierende Vasodilatation).
Sympathische (noradrenerge) Effekte sowie myogene Antworten
(Bayliss-Effekt) lassen sich an allen Arterien beobachten, vor allem an
Widerstandsgefäßen.

Der Zweck dieses Mechanismus liegt
darin, den Tonus der Gefäßwand zu stabilisieren und die Durchblutung
trotz wechselnden Blutdrucks weitgehend konstant zu halten. Der
Bayliss-Effekt ist eine Reaktion der Gefäßmuskulatur und bedarf keiner
Nervenversorgung.
Der myogene Mechanismus funktioniert über Depolarisierung der Myozyten und Ca
++-Einstrom: Dehnung der glatten Muskelzellen reduziert das Membranpotential auf etwa -40 mV (via
TRP-Kanäle, volumenregulierte Antionenkanäle
VRACs und
ENaCs), worauf
L-Typ-Ca++-Kanäle öffnen und das einströmende Ca
++
zur Kontraktion führt. Die Kontraktion wird durch die erhöhte
Strömungsbelastung des Endothels
(shear stress), die bei Verengung des
Gefäßes auftritt, begrenzt (endotheliale Produktion von NO,
endothelbedingte Hyperpolarisierung
EDH).
Myogene
autoregulative Vasokonstriktion erfolgt über Zunahme der
Öffnungswahrscheinlichkeit spannungsgesteuerter Calciumkanäle in der
Zellmembran glatter Gefäßmuskelzellen
Hemmung der Calciumkanäle erniedrigt den Gefäßtonus und erhöht die Durchblutung
|
So lange der Innendruck im Gefäß erhöht ist, bleibt auch die myogene
Antwort aufrecht, denn die Wandspannung ist nach wie vor erhöht, auch
im kontrahierten Zustand (
Laplace-Gesetz).
Offensichtlich reagieren die dehnungsempfindlichen Membrankanäle auf
die Wandspannung, vermittelt über Integrine in der Membran, die auf
Proteinkinasen wirken.
Die myogene Gefäßreaktion ist der wichtigste Mechanismus zur Autoregulation von Durchblutung und kapillärem Druck in
Gehirn,
Leber,
Milz und
Darm, und trägt auch zur Stabilisierung der Perfusion in Nieren und Herzmuskel wesentlich bei.
Funktionelle (metabolische) Hyperämie
In Gehirn und quergestreifter Muskulatur nimmt die Durchblutung fast linear mit dem Sauerstoffverbrauch zu - bedingt durch metabolische Vasodilatation,
vermutlich vermittelt über vasodilatatorisch wirkende Substanzen, die
im Interstitium des aktiven Gewebes vermehrt anfallen (wie K+,
Adenosin, Azidose, Hypertonizität etc).
Periphere Vasodilatation
erhöht die Blutströmung in vorgeschalteten größeren Arterien, und dies
löst über endothelial bewirkte Steigerung des Membranpotentials der
glatten Muskelzellen in der Gefäßwand (endothelial
bedingte Hyperpolarisierung) eine Erweiterung der größeren Gefäße
aus. Beide Effekte tragen zu etwa gleichen Teilen zur funktionellen
Hyperämie bei.
Vasokonstriktion: Engere Gefäße, erhöhter Widerstand

Zu Vasokonstriktion s. auch
dort
Die Gefäßmuskulatur gehört zum single-unit-Typ,
d.h. die Zellen sind über gap junctions verbunden und Aktionspotentiale pflanzen sich über
Gruppen benachbarter Zellen fort. Gesteuert werden sie einerseits durch lokal entstandene Mediatoren bzw. "Gewebehormone", andererseits durch den Sympathikus (Noradrenalin). Solche Substanzen bezeichnet man als vasoaktiv. 

 Abbildung: Calcium-abhängige Aktivierung einer Gefäßmuskelzelle
Nach
Touyz RM,
Alves-Lopes R, Rios FJ, Camargo LL, Anagnostoupoulou A, Arner A,
Montezano AC. Vascular smooth muscle contraction in hypertension. Cardiovasc Res 2018; 114: 529–39
Abbildung: Calcium-abhängige Aktivierung einer Gefäßmuskelzelle
Nach
Touyz RM,
Alves-Lopes R, Rios FJ, Camargo LL, Anagnostoupoulou A, Arner A,
Montezano AC. Vascular smooth muscle contraction in hypertension. Cardiovasc Res 2018; 114: 529–39
Vasokonstriktoren
wirken über Erhöhung des intrazellulären Calciumspiegels. Peptide (z.B.
Angiotensin II) binden an G-Protein-gekoppelte Rezeptoren (GPCRs),
aktivieren Phospholipase C (PLC) und erzeugen so DAG und IP3. Letzteres
bindet an den IP-Rezeptor-Calciumkanal (InsP3R), dies führt zu Freigabe
con Ca++ aus dem sarkoplasmatischen Retikulum. DAG aktiviert Proteinkinase C (PKC), die Calciumkanäle wie SOC (store-operated), SMOC (second-messenger operated), ROC (receptor-operated), VOC (voltage-gated calcium channels)
und NCX (Na/Ca-Austauscher) steuert. Proteinkinase C regt darüber
hinaus die Aktivität von Ryanodin-Calciumkanälen (RyR) an, was den Ca++-Ausstrom aus dem sarkoplasmatischen Retikulum weiter fördert. Calciumionen binden an Calmodulin und aktivieren die Myosin-Leichtkettenkinase MLCK (Myosin light-chain kinase), dies
phosphoryliert die regulatorische leichte Kette des Myosinmoleküls (MLC) in
glatten Muskelzellen (insbesondere Gefäße und Bronchien) und führt zu Aktinpolymerisierung und Kontraktion:
Depolarisierung öffnet spannungsabhängige Ca++-Kanäle → Ca++ bindet an Calmodulin → der entstandene Komplex aktiviert die Myosin-Leichtkettenkinase → aktivierte MLCK phosphoryliert die leichte Kette des Myosins, wodurch es enthemmt wird → der Myosinkopf wird als ATPase aktiv → die glatte Muskelzelle kontrahiert sich.
Relaxation: Die MLK-Phosphatase dephosphoryliert die leichte Kette des Myosins und wirkt relaxierend

Mechanismen der Vasokonstriktion.
Dehnung des Gefäßes kann selbständig (myogen) Kontraktion auslösen (Bayliss-Effekt). Die aktive Verengung des Gefäßdurchmessers erfolgt durch Kontraktion
von Gefäßmuskelzellen. Diese kann durch mechanische, elektrische oder
chemische Reize ausgelöst werden. Der auslösende molekulare Faktor kann
eine Erhöhung der intrazellulären Calciumkonzentration oder eine
Senkung der Konzentration an cAMP bzw. cGMP sein:
[Ca++]i↑ → Calmodulin → MLCK-Aktivität↑ → MLC-Phosphorylierung↑ → Kontraktion Gefäßwand
[cAMP]↓ → PKA↓ → MLCK-Phosphorylierung↓ → MLCK-Aktivität↑ → MLC-Phosphorylierung↑ → Kontraktion Gefäßwand
[cGMP]↓ → PKG↓ → MLCK-Phosphorylierung↓ → MLCK-Aktivität↑ → MLC-Phosphorylierung↑ → Kontraktion Gefäßwand
Depolarisation der Zellen löst ebenso Kontraktion aus - wohl über Öffnung von spannungsgesteuerten Ionenkanälen
- wie das Aufbringen vasoaktiver Stoffe (Noradrenalin, Angiotensin,
Vasopressin, Endothelin, Thromboxan), die über rezeptorvermittelte
Mechanismen Calcium in die Zelle diffundieren lassen.
 Spannunsgesteuerte Calciumkanäle öffnen sich aufgrund einer Depolarisation, Ca++-Ionen
diffundieren aus dem Extrazellulärraum und aus dem endoplasmatischen
(sarkoplasmatischen) Retikulum in das Zytosol. Dort bindet es
(reversibel) an Calmodulin, der entstehende Komplex aktiviert die Myosin-Leichtkettenkinase.
Dieses Enzym phosphoryliert Myosin-Querbrücken, und der
Kontraktionsvorgang ist aktiviert (
Spannunsgesteuerte Calciumkanäle öffnen sich aufgrund einer Depolarisation, Ca++-Ionen
diffundieren aus dem Extrazellulärraum und aus dem endoplasmatischen
(sarkoplasmatischen) Retikulum in das Zytosol. Dort bindet es
(reversibel) an Calmodulin, der entstehende Komplex aktiviert die Myosin-Leichtkettenkinase.
Dieses Enzym phosphoryliert Myosin-Querbrücken, und der
Kontraktionsvorgang ist aktiviert ( Abbildung unten).
Abbildung unten).
"Ausgeschaltet" wird
dies durch eine Phosphatase, welche die Phosphatgruppe vom Myosin
entfernt und die Zelle wieder entspannen läßt. Ca++-Ionen
schließlich werden über eine ATP-abhängige Calciumpumpe des sarkoplasmatischen / endoplasmatischen Retikulums
in dieses zurückbefördert; beim Transport nach
extrazellulär hilft zusätzlich ein Na+-Ca++-Austauscher.
 Mediatoren / Transmitter lagern sich an Rezeptoren an, welche wiederum über nachgeschaltete molekulare Mechanismen (G-Protein) Calciumkanäle aktivieren und so die Zelle zur Kontraktion anregen (s. oben).
Mediatoren / Transmitter lagern sich an Rezeptoren an, welche wiederum über nachgeschaltete molekulare Mechanismen (G-Protein) Calciumkanäle aktivieren und so die Zelle zur Kontraktion anregen (s. oben).
Beispiele:
 Katecholamine
Katecholamine: Die Kontraktion glatter Muskelzellen über
α1-Adrenozeptoren erfolgt auf zwei Wegen:

Noradrenalin dockt an den Rezeptor, aktiviert G
q-Protein, was PLC aktiviert und IP
3 freisetzt; dieses wirkt auf einen IP
3-Rezeptor am sarkoplasmatischen Retikulum und bewirkt
Calciumfreisetzung und Aktivierung der Myosin-Leichtkettenkinase (MLCK)

Depolarisation (Zwischenschritte unklar) öffnet L-Typ-
Calciumkanäle (→ Aktivierung MLCK)
Adrenalin wirkt über α1-Rezeptoren gefäßverengend
|

Das Oktapeptid
Angiotensin II entsteht im
Renin-Angiotensin-Weg und wirkt auf einen Angiotensinrezeptor; weiters über PLC, IP
3 wie oben
 Vasopressin
Vasopressin
wird bei Blutdruckabfall (Barorezeptoren) oder Volumenmangel
(
kardiopulmonale Rezeptoren) freigesetzt und erhöht über Wirkung
an
V1A-Rezeptoren (PLC /
IP3) den Gefäßtonus - vor allem im Splanchnikusbereich. Signale von
Baro- und Volumenrezeptoren hemmen die
Vasopressinausschüttung
(
tonische Inhibition), Blutdruckabfall fördert die Vasopressinsekretion
(
Disinhibition). Volumenmangel dominiert den Gesamteffekt auf die
Hormonfreisetzung, sodass auch bei hypotoner Dehydratation Vasopressin
trotz erniedrigter Osmolalität vermehrt ausgeschüttet wird.
Bei
Belastungssituationen wie intensiver orthostatischer Belastung
(insbesondere präsynkopal),
Trauma, Schmerz, intensiven olfaktorischen, visuellen, auditiven Reizen
oder Übelkeit wird Vasopressin in die Blutbahn freigesetzt (die
Konzentration steigt vorübergehend auf
mehr das Zehnfache des
Ruhewertes) und wirkt volumensteigernd ("Wasserspareffekt",
Kreislauf!), gefäßverengend und blutdrucksteigernd.
 Endotheline
Endotheline (ET1 bis ET3) aus Endothelzellen bewirken je nach Rezeptorreizung
Vasokonstriktion (ET
A-Rezeptor sowie
ETB2-Rezeptor) - was für die meisten Gefäße zutrifft - oder
Vasodilatation (
ETB1-Rezeptor). ET
A-Rezeptoren überwiegen im
Hochdrucksystem, ET
B-Rezeptoren im
Niederdrucksystem des Kreislaufs.
Der Mechanismus der Vasokonstriktion funktioniert im Prinzip wie oben
beschrieben; eine initiale Phase wirkt über Phospholipase C, IP
3, DAG und öffnet intrazelluläre Ca
++-Speicher; eine verzögerte Phase involviert Calciumeinstrom aus dem Extrazellulärraum.
Endothelin 1 stammt aus Endothelzellen und wirkt gefäßverengend
|
Endothelin 1 wird auch über Prostaglandine im Gelbkörper des Ovars freigesetzt, was hier die Durchblutung senkt und die
Luteolyse einleitet.
 Thromboxan A2 aus Endothelien und aktivierten Blutplättchen wirkt ebenfalls über einen G-Protein-gekoppelten Rezeptor (TP-Rezeptor), der L-Typ Calciumkanäle öffnet.
Thromboxan A2 aus Endothelien und aktivierten Blutplättchen wirkt ebenfalls über einen G-Protein-gekoppelten Rezeptor (TP-Rezeptor), der L-Typ Calciumkanäle öffnet.
 Katecholamine und Kreislauf. Infusion mittelgroßer Dosen (10 µg/min) von Adrenalin und Noradrenalin haben unterschiedliche Wirkungen:
Katecholamine und Kreislauf. Infusion mittelgroßer Dosen (10 µg/min) von Adrenalin und Noradrenalin haben unterschiedliche Wirkungen:
 Noradrenalin
Noradrenalin wirkt vorwiegend über α-Rezeptoren
stark vasokonstriktorisch, der Blutdruck steigt (systolisch und
diastolisch) deutlich an. Der Baroreflex antwortet mit einer
Senkung der Herzfrequenz.
 Adrenalin
Adrenalin wirkt stark an ß-Rezeptoren; dadurch steigen Schlagkraft und Herzfrequenz (ß
1),
der systolische Blutdruck nimmt zu (erhöhte Herzleistung), der
diastolische Blutdruck hingegen ab (vasodilatatorischer Effekt der ß
2-Rezeptoren).
Blockiert man vorher die ß-Rezeptoren, bewirkt eine Adrenalininfusion
keine Steigerung, sondern Senkung der Herzfrequenz ("
Adrenalinumkehr",
adrenaline reversal).
Geringe Dosen Dopamin (≤2,5 µg/kg/min) kontrahieren selektiv über Dopamin-(D1)-Rezeptoren renale und mesenteriale Blutgefäße; mittlere Dosen (2,5-5 µg/kg/min) steigern über kardiale ß1-Rezeptoren Schlagkraft und Herzfrequenz; hohe Dosen (>5 µg/kg/min) wirken zusätzlich über α-Rezeptoren vasokonstriktorisch und blutdrucksteigernd.
Bei Kreislaufschock kann einer drohenden Unterdurchblutung der Nieren
durch Dopamin-Infusion gegengesteuert und die Filtrationsleistung
gesteigert werden. Direkter Dopamineffekt an α-Rezeptoren kann aber die Perfusion peripherer Gewebe (Akren) gefährlich reduzieren. Dopamin wirkt außerdem an Tubulusepithelzellen natriuretisch.

Vasodilatation kann die Durchblutung bis zu 20-fach steigern, insbesondere in der Haut (Thermoregulation), in Skelettmuskeln (Arbeitsleistung) oder in exokrinen Drüsen (Sekretion).
Der molekulare Mechanismus der Vasodilatation stellt sozusagen das Spiegelbild der Vasokonstriktion dar:
[Ca++]i↓ → Calmodulin → MLCK-Aktivität↓ → MLC-Phosphorylierung↓ → Dilatation Gefäßwand
[cAMP]↑ → PKA↑ → MLCK-Phosphorylierung↑ → MLCK-Aktivität↓ → MLC-Phosphorylierung↓ → Dilatation Gefäßwand
[cGMP]↑ → PKG↑ → MLCK-Phosphorylierung↑ → MLCK-Aktivität↓ → MLC-Phosphorylierung↓ → Dilatation Gefäßwand
Zu den chemischen Faktoren im Extrazellulärraum, die diese intrazellulären Reaktionen anstoßen, zählen niedriger pO2, erhöhter pCO2, Azidose, Kaliumionen, Laktat, ADP, Adenosin. Sie signalisieren den Bedarf nach erhöhter Perfusion. Im Pulmonalkreislauf sind die Gefäßreaktionen auf pO2, pCO2 und pH entgegengesetzt (je besser ein Lungenabschnitt belüftet ist - hoher pO2, niedriger pCO2 -, desto stärker wird er durchblutet).
Die Erschlaffung eines Gefäßes erfolgt oft indirekt: So kann die Aktivität vasokonstriktorischer Nervenfasern über
cholinergen Einfluss (Muskarinrezeptoren M2, M4) gehemmt und dadurch die Freisetzung von Noradrenalin unterdrückt werden. Erweiterung von Arteriolen steigert den Kapillardruck und damit die Filtration von Flüssigkeit in das Gewebe. Generelle Vasodilatation senkt den Blutdruck und kann zu Kreislaufversagen ("Widerstandsverlustschock") führen.
Eine zentral gesteuerte
Vasodilatation erfolgt nur ausnahmsweise - cholinerg-parasympathisch in
den Genitalorganen (Erektion von Schwellkörpern) und Herzkranzgefäßen
(myokardiale Perfusionssteigerung).
Ansonsten stellt sich
Vasodilatation lokal ein - je nach den Bedürfnissen des jeweiligen Gewebes (Autoregulation): Auf diese Weise wird vor allem in Gehirn, Nieren, Skelett- und Herzmuskulatur die Durchblutung bedarfsgemäß lokal eingestellt, und zwar:
 Mechanisch: Gesteigerte Blutströmung erhöht die Schubspannung im Endothel und löst die Freisetzung verschiedener Stoffe aus, wie Stickstoffmonoxid, Prostazyklin, EDHF und CGRP.
Mechanisch: Gesteigerte Blutströmung erhöht die Schubspannung im Endothel und löst die Freisetzung verschiedener Stoffe aus, wie Stickstoffmonoxid, Prostazyklin, EDHF und CGRP.
 Metabolisch: Lokale Faktoren,
die bei Aktivität von Zellen vermehrt auftreten, führen im Bedarfsfall
zu Gefäßerweiterung und Durchblutungssteigerung. Man spricht von lokal-chemischen bzw. -metabolischen Faktoren wie H+-Ionen (Azidose, Laktat), K+-Ionen, Hypoxie, CO2, Adenosin, ATP, Phosphationen, Hyperosmolalität, H2O2 (durch mitochondriale Superoxid-Dismutase aus Superoxid generiert).
In der interstitiellen
Flüssigkeit aktivierten Gewebes steigt die Konzentration all dieser Faktoren mit gefäßerweiternder Wirkung,
aber welche genau für die metabolische Hyperämie verantwortlich sind, ist
trotz eines Jahrhunderts intensiver Forschung immer noch ungewiss.
Metabolisch: Lokale Faktoren,
die bei Aktivität von Zellen vermehrt auftreten, führen im Bedarfsfall
zu Gefäßerweiterung und Durchblutungssteigerung. Man spricht von lokal-chemischen bzw. -metabolischen Faktoren wie H+-Ionen (Azidose, Laktat), K+-Ionen, Hypoxie, CO2, Adenosin, ATP, Phosphationen, Hyperosmolalität, H2O2 (durch mitochondriale Superoxid-Dismutase aus Superoxid generiert).
In der interstitiellen
Flüssigkeit aktivierten Gewebes steigt die Konzentration all dieser Faktoren mit gefäßerweiternder Wirkung,
aber welche genau für die metabolische Hyperämie verantwortlich sind, ist
trotz eines Jahrhunderts intensiver Forschung immer noch ungewiss.
Wahrscheinlich hängt ihre relative Bedeutung von Situation,
Belastungsausmaß und Organ / Gewebe ab. So reagieren Gefäße im Herz- oder Skelettmuskel besonders intensiv auf K+ und Adenosin, im Gehirn auf K+ und pCO2.
Adenosin entsteht durch Abbau von AMP
(Adenosin-Monophosphat), das beim Verbrauch von ATP aus aktiven Zellen
in das Interstitium abgegeben wurde. Es kann bis zu 40% der länger
anhaltenden metabolischen Hyperämie quergestreifter Muskeln bewirken.
Adenosin wirkt vasodilatierend über A2A-Rezeptoren → cAMP → Proteinkinase A (→ Erniedrigung zytosolisches [Ca++], verstärkter K-Ausstrom), über A1-Rezeptoren → Öffnung KATP-Kanäle, und über Reduktion cAMP-stimulierter Noradrenalinfreisetzung sympathischer Varikositäten.
Metabolische Vasodilatation kann durch Steigerung der Adenosinkonzentration erfolgen
|
Hyperpolarisierung von Gefäßmuskelzellen senkt den Ca++-Einstrom, das Gefäß senkt seinen Tonus. Dies kann metabolisch oder mechanisch bewirkt sein: Durch Anreicherung von K+
im Interstitium aktiver Skelettmuskulatur (metabolische
Autoregulation), durch endotheliale Faktoren wie NO, PGI2 (EDH: Endothelium-derived hyperpolarisation), intensive Hypoxie.

Sowohl mechanisch als auch metabolisch bedingte Vasodilatation beginnt mit
 zunehmender Öffnungswa
zunehmender Öffnungswahrscheinlichkeit von
Ca++-Kanälen in der Membran von
Endothelzellen.

Der
Calciumeinstrom aktiviert eine
NO-Synthase
in der Zelle, diese spaltet NO von Arginin ab. Dieses kurzlebige Gas
(Halbwertszeit einige Sekunden) diffundiert zu benachbarten glatten
Muskelzellen.
 Im Zytoplasma glatter Muskelzellen
Im Zytoplasma glatter Muskelzellen aktiviert NO zytosolische
Guanylylcyclase. Diese bildet cGMP.
 cGMP aktiviert Proteinkinase G (PKG) und diese die Myosin-Leichtketten-Phosphatase (MLCP).
cGMP aktiviert Proteinkinase G (PKG) und diese die Myosin-Leichtketten-Phosphatase (MLCP).
 Myosin-Leichtkettenphosphatase (MLCP) dephosphoryliert Myosin-Leichtketten und dies führt zur Relaxation der glatten Muskelzelle.
Myosin-Leichtkettenphosphatase (MLCP) dephosphoryliert Myosin-Leichtketten und dies führt zur Relaxation der glatten Muskelzelle.
Aktivierung der Proteinkinase G führt in der glatten Muskelzelle über folgende Mechanismen zu Vasodilatation:
 Hemmung der IP3-vermittelten Freisetzung von Ca++ aus intrazellulären Speichern
Hemmung der IP3-vermittelten Freisetzung von Ca++ aus intrazellulären Speichern
 Phosphorylierung spannungsgesteuerter Ca++-Kanäle und damit Hemmung des Ca++-Einstroms
Phosphorylierung spannungsgesteuerter Ca++-Kanäle und damit Hemmung des Ca++-Einstroms
 Phosphorylierung von Phospholamban, einem Modulator der sarkoplasmatischen Ca++-Pumpe. Im dephosphorylierten Zustand ist Phospholamban aktiv,
und es bremst die Calciumpumpe des endoplasmatischen Retikulums
(SERCA), Calciumionen verbleiben länger im Zytoplasma der angeregten
Muskelzelle und halten den kontrahierten Zustand aufrecht; wird
Phospholamban phosphoryliert (durch Proteinkinase), ist die Rückgewinnung der Calciumionen in das SERCA beschleunigt, der Muskel kann relaxieren
Phosphorylierung von Phospholamban, einem Modulator der sarkoplasmatischen Ca++-Pumpe. Im dephosphorylierten Zustand ist Phospholamban aktiv,
und es bremst die Calciumpumpe des endoplasmatischen Retikulums
(SERCA), Calciumionen verbleiben länger im Zytoplasma der angeregten
Muskelzelle und halten den kontrahierten Zustand aufrecht; wird
Phospholamban phosphoryliert (durch Proteinkinase), ist die Rückgewinnung der Calciumionen in das SERCA beschleunigt, der Muskel kann relaxieren
 Phosphorylierung und Öffnung Ca++-aktivierter Kaliumkanäle; die resultierende Depolarisation schließt L-Typ Ca++-Kanäle, der Ca++-Einstrom nimmt ab
Phosphorylierung und Öffnung Ca++-aktivierter Kaliumkanäle; die resultierende Depolarisation schließt L-Typ Ca++-Kanäle, der Ca++-Einstrom nimmt ab
Arterioläre Vasodilatation senkt den arteriellen Blutdruck
|
Übersicht: Vasodilatatorische Einflüsse
 Transmuraler Druck: Der Blutdruck dehnt die Gefäßwand "passiv" auf, die Kraft stammt von der Herzaktion
Transmuraler Druck: Der Blutdruck dehnt die Gefäßwand "passiv" auf, die Kraft stammt von der Herzaktion
 Metabolisch (lokal): Purine (Adenosin, ADP, ATP), pCO2-Anstieg, pO2-Abfall, pH-Senkung, Anstieg extrazellulären [K+]
Metabolisch (lokal): Purine (Adenosin, ADP, ATP), pCO2-Anstieg, pO2-Abfall, pH-Senkung, Anstieg extrazellulären [K+]
 Endothelial: Prostazyklin, NO, EDHF (endothelium-derived hyperpolarizing factor)
Endothelial: Prostazyklin, NO, EDHF (endothelium-derived hyperpolarizing factor)
 Nerval: ß-adrenerg
Nerval: ß-adrenerg
 Humoral: Histamin, Kinine
Humoral: Histamin, Kinine
Vasodilatation kann erfolgen
 cAMP-PKA-mediiert: Arteriolen in Skelettmuskel, Myokard und Leber sind reich an ß-Adrenozeptoren, die - wie auch Adenosin- (A2A), Histamin- (H2) und Prostazyklinrezeptoren (EP4) - wenn aktiviert - die Aktivität an Proteinkinase A erhöhen und dadurch
cAMP-PKA-mediiert: Arteriolen in Skelettmuskel, Myokard und Leber sind reich an ß-Adrenozeptoren, die - wie auch Adenosin- (A2A), Histamin- (H2) und Prostazyklinrezeptoren (EP4) - wenn aktiviert - die Aktivität an Proteinkinase A erhöhen und dadurch
 Phospholamban phosphoryliert (inaktiviert) und so das "Abpumpen" von Ca++ in das sarkoplasmatische Retikulum fördert,
Phospholamban phosphoryliert (inaktiviert) und so das "Abpumpen" von Ca++ in das sarkoplasmatische Retikulum fördert,
 verschiedene Kaliumkanäle phosporyliert und so ihre Öffnungswahrscheinlichkeit erhöht (Kaliumausstrom → Hyperpolarisierung),
verschiedene Kaliumkanäle phosporyliert und so ihre Öffnungswahrscheinlichkeit erhöht (Kaliumausstrom → Hyperpolarisierung),
 die Leichtkettenphosphatase MLCP phosphoryliert / aktiviert und damit eine Entkoppelung des Kontraktionsmechanismus (Relaxation) bewirkt
die Leichtkettenphosphatase MLCP phosphoryliert / aktiviert und damit eine Entkoppelung des Kontraktionsmechanismus (Relaxation) bewirkt
 cGMP/PKG-mediiert: Stickstoffmonoxid (NO) und atriale natriuretische Peptide (ANP)
aktivieren über cGMP die Proteinkinase G (PKG). Diese öffnet
calciumaktivierte Kaliumkanäle und hyperpolarisiert glatte
Muskelzellen, was bei Arteriolen zu Widerstandssenkung und Reduktion
des arteriellen Drucks führt. Auch senkt es durch Blockade der
Phospholipase C die 3 IP3-bedingte Freisetzung intrazellulär gespeicherter Calciumionen, was den Gefäßmuskeltonus weiter senkt.
cGMP/PKG-mediiert: Stickstoffmonoxid (NO) und atriale natriuretische Peptide (ANP)
aktivieren über cGMP die Proteinkinase G (PKG). Diese öffnet
calciumaktivierte Kaliumkanäle und hyperpolarisiert glatte
Muskelzellen, was bei Arteriolen zu Widerstandssenkung und Reduktion
des arteriellen Drucks führt. Auch senkt es durch Blockade der
Phospholipase C die 3 IP3-bedingte Freisetzung intrazellulär gespeicherter Calciumionen, was den Gefäßmuskeltonus weiter senkt.
Guanylylcyclase bildet cGMP, dieses aktiviert Proteinkinase G → Tonusreduktion der Gefäßmuskulatur → arterieller Blutdruck sinkt
|
Proteinkinase G (cGMP-dependent protein kinase) kommt in allen Arten glatter Muskulatur sowie in Thrombozyten in hoher Konzentration vor. Sie findet sich in zahlreichen verschiedenen Zelltypen und hat
außer für die Relaxation glatter Muskulatur noch weitere Funktionen
(Nukleinsäuresynthese, Zellteilung, Plättchenaktivität,
Spermienmotilität etc).
 Durch sinkende Empfindlichkeit (Desensibilisierung) gegenüber Ca++, was durch reduzierte Phosphorylierung des Myosins bei Hypoxie erfolgen kann
Durch sinkende Empfindlichkeit (Desensibilisierung) gegenüber Ca++, was durch reduzierte Phosphorylierung des Myosins bei Hypoxie erfolgen kann
 Durch vasodilatierende Mediatoren wie Kinine, Histamin, NO, Prostacyclin, EDHF, CGRP
Durch vasodilatierende Mediatoren wie Kinine, Histamin, NO, Prostacyclin, EDHF, CGRP
Bradykinin und Histamin wirken vasodilatatorisch
|
 Durch spezielle autonome Einflüsse:
Durch spezielle autonome Einflüsse:
 ß-adrenerg: Zirkulierendes Adrenalin kann auf diesem Wege (Sympathikus → Nebennierenmark (Sympathikus → Adrenalinausschüttung) bei mentalem Stress Vasodilatation in Muskeln (z.B. des Unterarmes) bewirken (alerting response). Beteiligt ist an dieser Reaktion auch ein Nachlassen der Aktivität vasokonstriktorisch wirkender sympathischer Fasern.
ß-adrenerg: Zirkulierendes Adrenalin kann auf diesem Wege (Sympathikus → Nebennierenmark (Sympathikus → Adrenalinausschüttung) bei mentalem Stress Vasodilatation in Muskeln (z.B. des Unterarmes) bewirken (alerting response). Beteiligt ist an dieser Reaktion auch ein Nachlassen der Aktivität vasokonstriktorisch wirkender sympathischer Fasern.
 Cholinerg - sympathisch:
Schweißdrüsen sind mit cholinergen (sudomotorischen) sympathischen
Fasern innerviert. Diese begünstigen kutane Vasodilatation und
Schweißproduktion. Das freigesetzte Acetylcholin veranlasst
Endothelzellen zur Produktion von Prostazyklin (PGI2) und endothelialem hyperpolarisierendem Faktor (EDHF), VIP sowie NO.
Cholinerg - sympathisch:
Schweißdrüsen sind mit cholinergen (sudomotorischen) sympathischen
Fasern innerviert. Diese begünstigen kutane Vasodilatation und
Schweißproduktion. Das freigesetzte Acetylcholin veranlasst
Endothelzellen zur Produktion von Prostazyklin (PGI2) und endothelialem hyperpolarisierendem Faktor (EDHF), VIP sowie NO.
 Parasympathisch:
Hirnnerven dilatieren arterielle Gefäße in Gehirn, Herzmuskel,
Speicheldrüsen, Pankreas (exokrin) und gastrointestinale Mukosa;
parasympathische Fasern aus dem Sakralmark in Genitalien, Blase und
Colon. Die aus der peripheren ganglionären Umschaltung entspringenden,
kurzen postganglionären Fasern haben (so wie sympathische) Varikositäten, aus denen die Transmitter freigesetzt werden: Acetylcholin (M3-Rezeptoren),
VIP, Substanz P und/oder NO.
Parasympathisch:
Hirnnerven dilatieren arterielle Gefäße in Gehirn, Herzmuskel,
Speicheldrüsen, Pankreas (exokrin) und gastrointestinale Mukosa;
parasympathische Fasern aus dem Sakralmark in Genitalien, Blase und
Colon. Die aus der peripheren ganglionären Umschaltung entspringenden,
kurzen postganglionären Fasern haben (so wie sympathische) Varikositäten, aus denen die Transmitter freigesetzt werden: Acetylcholin (M3-Rezeptoren),
VIP, Substanz P und/oder NO.
Die Wirkung in den Speicheldrüsen (übertragen via
die chorda tympani) erfolgt über Acetylcholin, VIP und Substanz P;
diejenige in der Bauchspeicheldrüse hauptsächlich über VIP
("peptiderg"); diejenige in der Submukosa des Darms über Acetylcholin
und endothelial gebildetes NO. Die Wirkung auf die Gefäße der
Schwellkörper ist nitriderg.
NO
(Stickstoffmonoxid), ursprünglich als EDRF (endothelium-derived relaxing factor) bezeichnet, steigert die Durchblutung:
Endothelzellen bilden es aus Arginin durch Wirkung der NO-Synthase III (endotheliale Synthase eNOS) - teils konstitutiv (endogen aktiv), teils angeregt durch am Endothel wirkende Scherkräfte bzw. durch Stoffe wie Acetylcholin (M3-muskarinerg) oder Bradykinin.
NO diffundiert (kontinuierlich in Widerstandsgefäßen, als Element
der Regulierung des peripheren Widerstandes) aus Endothel- in umgebende
glatte Gefäßmuskelzellen und regt hier eine lösliche Guanylatcyclase ("NO-Rezeptor") an. Es entsteht cGMP, dieses aktiviert cGMP-abhängige Proteinkinasen (PKG) und in der Folge
 Phosphorylierung der MLCK (was diese hemmt und die Interaktion zwischen Aktin und Myosin reduziert),
Phosphorylierung der MLCK (was diese hemmt und die Interaktion zwischen Aktin und Myosin reduziert),
 Phosphorylierung der SERCA-Calciumpumpe (was diese anregt, den sarkoplasmatischen Calciumspiegel senkt),
Phosphorylierung der SERCA-Calciumpumpe (was diese anregt, den sarkoplasmatischen Calciumspiegel senkt),
 Phosphorylierung calciumabhängiger Kaliumkanäle (was diese anregt und die Zelle hyperpolarisiert),
Phosphorylierung calciumabhängiger Kaliumkanäle (was diese anregt und die Zelle hyperpolarisiert),
Daraus resultiert Erschlaffung der Muskelzellen und Vasodilatation.
In kleinen Arterien und Arteriolen ist diese Komponente ein konstant
wirksamer (konstitutiver) Teil der insgesamt Gefäßtonus und
Fließwiderstand regulierenden Faktoren, zusammen mit dem transmuralen
Druck ist NO ein ständig gefäßweitender Einfluss und damit auch eine
wichtige Komponente der Regulation von Durchblutung und Blutdruck:
Vasodilatation senkt den
hydrodynamischen Widerstand und steigert die Durchblutung.
 NO ist einer der bedeutendsten Vasodilatatoren (Nitrate wie
Nitroglyzerin werden in Akutsituationen verwendet, um über
das entstehende NO Gefäße zu weiten, z.B. bei Angina pectoris).
NO ist einer der bedeutendsten Vasodilatatoren (Nitrate wie
Nitroglyzerin werden in Akutsituationen verwendet, um über
das entstehende NO Gefäße zu weiten, z.B. bei Angina pectoris).
 Einfluss auf den Ruhetonus, Reduktion während der Schwangerschaft (erniedrigter Blutdruck trotz eines um bis zu 50% gesteigerten Herzminutenvolumens)
Einfluss auf den Ruhetonus, Reduktion während der Schwangerschaft (erniedrigter Blutdruck trotz eines um bis zu 50% gesteigerten Herzminutenvolumens)
 Strömungsabhängige Vasodilatation bei Muskelarbeit
(reduzierter peripherer Widerstand im Bereich der aktiven Muskeln
steigert die Blutströmung und damit die Schubspannung am Endothel des
versorgenden Gefäßes)
Strömungsabhängige Vasodilatation bei Muskelarbeit
(reduzierter peripherer Widerstand im Bereich der aktiven Muskeln
steigert die Blutströmung und damit die Schubspannung am Endothel des
versorgenden Gefäßes)
 Vasodilatation durch cholinerge parasympathische Fasern (Erektion)
Prostanoide - insbesondere Prostacyclin (PGI2), das wie NO bei Erhöhung der Schubspannung
über Wirkung von Prostacyclinsynthase (Abbau von Arachidonsäure) aus dem Endothel freigesetzt wird, die Adenylatcyclase in
Gefäßmuskelzellen aktiviert und diese so über cAMP (das die MLCK phosphoryliert, s. oben) entspannt. (Prostacyclin hemmt auch die Plättchenaggregation, ebenfalls über Anregung der Adenylatcyclase.)
Vasodilatation durch cholinerge parasympathische Fasern (Erektion)
Prostanoide - insbesondere Prostacyclin (PGI2), das wie NO bei Erhöhung der Schubspannung
über Wirkung von Prostacyclinsynthase (Abbau von Arachidonsäure) aus dem Endothel freigesetzt wird, die Adenylatcyclase in
Gefäßmuskelzellen aktiviert und diese so über cAMP (das die MLCK phosphoryliert, s. oben) entspannt. (Prostacyclin hemmt auch die Plättchenaggregation, ebenfalls über Anregung der Adenylatcyclase.)
Auch PGE1wirkt
stark vasodilatierend, es hemmt auch die Noradrenalinfreisetzung
sympathischer Fasern (auf Thrombozyten hat es keine Wirkung).
Prostaglandin E1 und I2 (=Prostazyklin) wirken stark gefäßerweiternd
|
 Besondere Bedeutung hat Prostacyclin für die Erschlaffung der Pulmonalarterie bei Neugeborenen.
Besondere Bedeutung hat Prostacyclin für die Erschlaffung der Pulmonalarterie bei Neugeborenen.
 Für die Umwandlung von Arachidonsäure in Prostaglandine braucht man Cyclooxygenasen (COX: Cyclooxygenase);
wird diese medikamentös gehemmt (COX-Hemmer zur Dämpfung entzündlicher
Prozesse), sinkt die Produktion von Prostazyklin.
Für die Umwandlung von Arachidonsäure in Prostaglandine braucht man Cyclooxygenasen (COX: Cyclooxygenase);
wird diese medikamentös gehemmt (COX-Hemmer zur Dämpfung entzündlicher
Prozesse), sinkt die Produktion von Prostazyklin.
Zu Cyclooxygenasehemmern gehören Propionate (z.B. Ibuprofen), Indole (z.B. Indometacin), Phenylacetate (z.B. Dicolfenac), Salicylate (z.B. Aspirin) u.a.
 Abbildung: Endothelabhängige Muskelrelaxation
Abbildung: Endothelabhängige Muskelrelaxation
Die Darstellung zeigt diffusible (EETs = nichtklassische Eikosanoide, Kaliumionen, Wasserstoffperoxid H2O2) und kontaktmediierte Mechanismen (über gap junctions zwischen Muskel- und Endothelzellen).
Diffusible Faktoren erhöhen das Membranpotential glatter Muskelzellen durch Öffnung von Ionenkanälen (TRP, SKCa = small-conductance calciumaktivierter Kaliumkanal, IKCa = intermediate-conductance calciumaktivierter Kaliumkanal, Kir = "einwärtsgerichteter" Kaliumkanal, BKCa = large-conductance calciumaktivierter Kaliumkanal) oder Aktivierung der Na/K-Pumpe.
An
gap junction zwischen Endothel- und glatten Muskelzellen kann sich
Hyperolarisierung des Membranpotentials direkt von Endothel- auf
Gefäßmuskelzellen fortpflanzen und so zu Relaxation / Vasodilatation
beitragen. Solche Mechanismen tragen zum Phänomen des EDHF bei, das
kein singulärer Faktor, sondern ein Mechanismus ist, der aus mehreren
Komponenten aufgebaut ist.
R = Rezeptor, eNOS = endotheliale Stickstoffmonoxid-Synthase, SOD = Superoxid-Dismutase
 EDHF
(Endothelium-derived hyperpolarizing factor), ein Konzept (mehrere
Komponenten: Prostacyclin, Gasotransmitter, diverse Eikosanoide) eher als ein einzelner Faktor (
EDHF
(Endothelium-derived hyperpolarizing factor), ein Konzept (mehrere
Komponenten: Prostacyclin, Gasotransmitter, diverse Eikosanoide) eher als ein einzelner Faktor ( Abbildung). EDHF wird durch Erhöhung
der Schubspannung aus dem Endothel freigesetzt - vor allem in kleinen
Arterien und in Arteriolen. EDHF überträgt den hyperpolarisierenden Effekt
über Aktivierung von Ionenkanälen und über direkte Kontakte zwischen
Endothel- und Muskelzellen.
Das Endothel sezerniert mehrere Peptide, darunter Vasodilatatoren wie CGRP, C-Typ natriuretisches Peptid (CNP), Adrenomedullin, sowie das Kininsystem:
Abbildung). EDHF wird durch Erhöhung
der Schubspannung aus dem Endothel freigesetzt - vor allem in kleinen
Arterien und in Arteriolen. EDHF überträgt den hyperpolarisierenden Effekt
über Aktivierung von Ionenkanälen und über direkte Kontakte zwischen
Endothel- und Muskelzellen.
Das Endothel sezerniert mehrere Peptide, darunter Vasodilatatoren wie CGRP, C-Typ natriuretisches Peptid (CNP), Adrenomedullin, sowie das Kininsystem:
CGRP
Der Neurotransmitter CGRP (Calcitonin gene related peptide),
ein aus 37 Aminosäuren bestehendes Produkt alternativen neuronalen RNS-Processing des Calcitoningens,
wirkt ~10fach stärker vasodilatierend als gefäßerweiternde Prostaglandine und
bis zu ~100mal stärker als Acetylcholin - schon in
femtomolarer Konzentration. Damit ist es (auf molarer Basis) der stärkste bekannte
Vasodilatator.
CGRP wird von Nervenzellen gebildet - zentral und peripher. Über Stimulierung noradrenerger Neurone kann es (indirekt) auch blutdrucksteigernd
wirken. Am Herzmuskel wirkt es positiv inotrop und auch chronotrop; direkt in den Kreislauf eingebracht wirkt es blutdrucksenkend.
Weiters wirkt CGRP als parakriner Mediator im Schmerzsystem.
Kininsystem
Auch Kinine
sind gefäßerweiternde Stoffe. Es
sind Peptide, die aus
in der Leber gebildeten Kininogenen entstehen.
Im Körper kommen mindestens drei Formen vor: Bradykinin, Kallidin, Methionyl-Lysyl-Bradykinin.

 Abbildung: Kallikrein-Kinin-System
Abbildung: Kallikrein-Kinin-System
Nach Pathak M, Wonf S, Dreweny I, Emsley J. Structure
of plasma and tissue kallikreins. Thrombosis and Hemostasis. March
2013; 110: 623-33
Aktivierter
Hageman-Faktor (F XIIa) lässt aus dem im Blutplasma zirkulierenden
Präkallikrein Plasmakallikrein entstehen, Proteinaseeinfluss oder
Autolyse im Gewebe aus Prokallikrein Gewebekallikrein.
Diese Kallikreine wirken auf Kininogene, es entstehen Kinine (Bradykinin, Kallidin). Bradykinin wirkt auf B2-Kininrezeptoren. Aus Kallidin und Bradykinin kann Kininase I Arginin entfernen, es entstehen Des-Arg-Kallidin und Des-Arg-Bradykinin, die auf B1-Kininrezeptoren wirken.
B2R ist ein konstitutiver Rezeptor (er wird regulär exprimiert), er erkennt Bradykinin. B1-R ist induzierbar (tritt nur bei entsprechender Reizung der Zelle auf) und ist Angriffspunkt für Des-Arg-Kallidin und Des-Arg-Bradykinin

 Bradykinin (bestehend aus 9 Aminosäuren) entsteht
Bradykinin (bestehend aus 9 Aminosäuren) entsteht
 im Plasma durch Einwirken der Serinprotease Kallikrein (Plasmakallikrein) aus dem α-Globulin Kininogen (zwei Fraktionen: Molekulargewicht 70 - niedermolekulares
Kininogen LMWK - und 110 kDa - hochmolekulares HMWK) und hat 9 Aminosäuren. Kallikrein entsteht aus der Vorstufe Präkallikrein durch Einwirken aktivierten Hageman-Faktors (F. XII der Blutgerinnung) und kann auch das Komplementsystem aktivieren.
im Plasma durch Einwirken der Serinprotease Kallikrein (Plasmakallikrein) aus dem α-Globulin Kininogen (zwei Fraktionen: Molekulargewicht 70 - niedermolekulares
Kininogen LMWK - und 110 kDa - hochmolekulares HMWK) und hat 9 Aminosäuren. Kallikrein entsteht aus der Vorstufe Präkallikrein durch Einwirken aktivierten Hageman-Faktors (F. XII der Blutgerinnung) und kann auch das Komplementsystem aktivieren.
 im Gewebe durch andere Isoenzyme (Gewebekallikreine in Pankreas, Speicheldrüsen, Dickdarm, Haut)
im Gewebe durch andere Isoenzyme (Gewebekallikreine in Pankreas, Speicheldrüsen, Dickdarm, Haut)
 Kallidin (Lysyl-Bradykinin) entsteht im Gewebe und hat 10 Aminosäuren
Kallidin (Lysyl-Bradykinin) entsteht im Gewebe und hat 10 Aminosäuren
 Methionyl-Lysyl-Bradykinin findet sich im Harn.
Methionyl-Lysyl-Bradykinin findet sich im Harn.
 Die Kinine werden durch Kininasen (Kininase I und II) wieder abgebaut.
Die Kinine werden durch Kininasen (Kininase I und II) wieder abgebaut.
Kininase II ist identisch mit dem Angiotensin-aktivierenden ACE ( s. dort);
dieses Enzym inaktiviert einen Vasodilator (Kinin) und aktiviert einen
Vasokonstriktor (Angiotensin II), wirkt also in doppelter Weise
blutdrucksteigernd.
s. dort);
dieses Enzym inaktiviert einen Vasodilator (Kinin) und aktiviert einen
Vasokonstriktor (Angiotensin II), wirkt also in doppelter Weise
blutdrucksteigernd.


Abbildung: Kininsystem
Nach Tomita H, Sanford RB, Smithies O, Kakoki M. The kallikrein–kinin system in diabetic nephropathy. Kidney Int 2012; 81: 733-44
Kinine entstehen durch die Einwirkung von Kallikreinen
(plasmatischen Enzymen) auf Kininogene. Sie wirken vor allem über
Bradykinin-2-Rezeptoren (B2R - dicker Pfeil: starke Aktivierung), ein
wenig auch über B1R
(dünner Pfeil: schwache Aktivierung).
Kininase I spaltet Arginin von Kininen ab, die Produkte wirken vor allem auf B1R. Kininase II
inaktivieren Kinine, indem sie zwei Aminosäuren entfernen.
Intrazelluläre Mechanismen umfassen Anstieg von
Ca
++ und Phospholipase-2
(PLA2). Die Aktivierung der
intrazellulären Signalketten führt zur Bildung von
Stickstoffmonoxid (NO) und
Prostaglandinen (PG).
ACE,
Angiotensin converting enzyme 
ECE,
Endothelin-converting enzyme, Protease, die aus Präpro-Endothelinen Endothelin freisetzt 
NEP,
Neprilysin (=Neutrale Endopeptidase, Membran-Metallo-Endopeptidase), baut Peptidhormone ab

PI-PLC, Phosphatidylinositol-spezifische Phospholipase C, spaltet Protein von Phosphatidylinositol ab

Serumproteasen greifen diese Vorstufe an,
insbesondere die am spezifischsten kininogenwirksame Kallikreine (Gewebskallikrein bildet Kallidin, Plasmakallikrein Bradykinin).
Bradykinin weitet die Gefäße
(und wirkt blutdrucksenkend)
|
Rezeptoren
Kinine wirken auf Kininrezeptoren; diese sind Gq/i-Protein-gekoppelt. B1-R aktivieren Phospholipase A (PLA), B2-R Pospholipase C (PLC) und steigern intrazelluläres [Ca++] ( Abbildung):
Abbildung):
 B1-Rezeptoren werden normalerweise nur in sehr geringer Menge exprimiert und treten vor allem im Rahmen von Entzündungen
auf (via Wirkung von Interleukin 1), aktivieren Leukozyten und bewirken die Freisetzung von
Prostaglandinen und NO, Vasodilatation und gegebenenfalls chronischen Schmerz . Diese Rezeptoren reagieren auf desargininierte Kininformen (Des-Arg9-Bradykinin, Des-Arg-Kallidin,
B1-Rezeptoren werden normalerweise nur in sehr geringer Menge exprimiert und treten vor allem im Rahmen von Entzündungen
auf (via Wirkung von Interleukin 1), aktivieren Leukozyten und bewirken die Freisetzung von
Prostaglandinen und NO, Vasodilatation und gegebenenfalls chronischen Schmerz . Diese Rezeptoren reagieren auf desargininierte Kininformen (Des-Arg9-Bradykinin, Des-Arg-Kallidin,  Abbildung oben).
Abbildung oben).

 B2-Rezeptoren sind konstitutiv, sie werden von den meisten Zellen exprimiert und reagieren vor allem auf Bradykinin (nicht auf die Des-Arg-Formen der Kinine). Gq regt die PLC an und steigert [Ca++] im Zytoplasma, Gi inhibiert die Adenylylcyclase und senkt [cAMP]. Auch wird der MAP-Kinase-Mechanismus aktiviert. B2-Rezeptoren bewirken die Mehrzahl der Bradykinineffekte - u.a.
B2-Rezeptoren sind konstitutiv, sie werden von den meisten Zellen exprimiert und reagieren vor allem auf Bradykinin (nicht auf die Des-Arg-Formen der Kinine). Gq regt die PLC an und steigert [Ca++] im Zytoplasma, Gi inhibiert die Adenylylcyclase und senkt [cAMP]. Auch wird der MAP-Kinase-Mechanismus aktiviert. B2-Rezeptoren bewirken die Mehrzahl der Bradykinineffekte - u.a.

 Vasodilatation (über endotheliales NO) - direkte Wirkung an glatten Muskelzellen kann über gesteigertes intrazelluläres [Ca++] konstriktorisch
sein,
Vasodilatation (über endotheliales NO) - direkte Wirkung an glatten Muskelzellen kann über gesteigertes intrazelluläres [Ca++] konstriktorisch
sein,

 Natriumausscheidung in der Niere (erhöhte Durchblutung, Hemmung
der Resorption im Sammelrohr),
Natriumausscheidung in der Niere (erhöhte Durchblutung, Hemmung
der Resorption im Sammelrohr),

 Freisetzung von Mediatoren
Freisetzung von Mediatoren

 akuten Schmerz.
akuten Schmerz.
Kinine bewirken weiters

 erhöhte Gefäßpermeabilität,
erhöhte Gefäßpermeabilität,

 hemmen die
Plättchenaggregation,
hemmen die
Plättchenaggregation,

 triggern bei direkter Einwirkung Kontraktion
glatter Muskeln (Bronchien, Darm, Uterus),
triggern bei direkter Einwirkung Kontraktion
glatter Muskeln (Bronchien, Darm, Uterus),

 wirken als Radikalfänger,
wirken als Radikalfänger,

 stellen den fetalen Kreislauf auf postpartale Verhältnisse um (Schließen des ductus arteriosus, Kontraktion der Nabelgefäße, Dilatation der Pulmonalarterie).
stellen den fetalen Kreislauf auf postpartale Verhältnisse um (Schließen des ductus arteriosus, Kontraktion der Nabelgefäße, Dilatation der Pulmonalarterie).


 Systemisch
ist ein vasodilatatorisches System (als Gegenpol zum
vasokonstriktorischen Sympathikus) nicht notwendig, da der Blutdruck
überall gefäßerweiternd wirkt und vasodilatatorische Mechanismen lokal
verfügbar sind. Das erklärt, warum Blutgefäße auf
parasympathische Versorgung weitgehend verzichten können (Ausnahme:
Schwellkörperfüllung, Steigerung der Koronardurchblutung, vielleicht
auch der Durchblutung der Skelettmuskulatur).
Systemisch
ist ein vasodilatatorisches System (als Gegenpol zum
vasokonstriktorischen Sympathikus) nicht notwendig, da der Blutdruck
überall gefäßerweiternd wirkt und vasodilatatorische Mechanismen lokal
verfügbar sind. Das erklärt, warum Blutgefäße auf
parasympathische Versorgung weitgehend verzichten können (Ausnahme:
Schwellkörperfüllung, Steigerung der Koronardurchblutung, vielleicht
auch der Durchblutung der Skelettmuskulatur).
Gefäßverengende und gefäßerweiternde Stoffe

Nach Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
|
Stoff
|
Physiologische Stellung
|
Quelle
|
Typ
|
Vasokonstriktion
|
Noradrenalin
(α-Rezeptoren)
|
Barorezeptorreflex
|
Sympathische Neurone
|
Neurotransmitter
|
Serotonin
|
Plättchenaggregation
Kontraktion glatte Muskeln
|
Neurone
Verdauungstrakt
Thrombozyten
|
Parakrin
Neurotransmitter
|
Substanz P
|
Schmerz
Erhöhte Kapillarpermeabilität
|
Neurone
Verdauungstrakt
|
Parakrin
Neurotransmitter |
Endothelin
|
Parakriner Mediatorstoff
|
Gefäßendothel
|
Parakrin
|
Vasopressin
|
Blutdruckerhöhung bei Hämorrhagie
|
Hypophysen-
hinterlappen
|
Neurohormon
|
Angiotensin II
|
Blutdruckerhöhung
|
Blutplasma
|
Hormon
|
Vasodilatation
|
Adrenalin
(ß2-Rezeptoren)
|
Perfusionserhöhung Skelettmuskel, Herz, Leber
|
Nebennierenmark
|
Neurohormon
|
Acetylcholin
(via NO) |
Erektion
|
Parasympathische Neurone
|
Neurotransmitter
|
VIP
|
Enterale Sekretion
Relaxation glatter Muskel
|
Neurone
|
Neurotransmitter
Neurohormon
|
NO
|
Parakriner Mediatorstoff |
Endothel
|
Parakrin
|
Bradykinin
(via NO)
|
Perfusionssteigerung
|
Zahlreiche Gewebe
|
Parakrin
|
Adenosin
|
Bedarfsadäquate Perfusion
|
Hypoxische Zellen
|
Parakrin |
↓O2,↑CO2,↑H+,↑K+
|
Bedarfsadäquate Perfusion |
Zellmetabolismus
|
Parakrin |
Histamin
|
Perfusionserhöhung
|
Mastzellen
|
Parakrin |
Atriale natriuretische Peptide
|
Blutdrucksenkung
|
Atriales Myokard
Gehirn
|
Neurohormon
Neurotransmitter
|

 Durch den Zusatz von Adrenalin und Noradrenalin zu Lokalanästhetika-Lösungen
verbleibt das Pharmakon infolge der verringerten Durchblutung
länger am Wirkort; gleichzeitig sinkt dessen systemische Toxizität.
Adrenalinapplikation kann Herzrasen verursachen (ß1-Rezeptoren!).
Durch den Zusatz von Adrenalin und Noradrenalin zu Lokalanästhetika-Lösungen
verbleibt das Pharmakon infolge der verringerten Durchblutung
länger am Wirkort; gleichzeitig sinkt dessen systemische Toxizität.
Adrenalinapplikation kann Herzrasen verursachen (ß1-Rezeptoren!).
Herzinsuffizienz: Rechtsherzinsuffizienz führt zu Druckerhöhung in Venen und Kapillaren und dadurch (Starling-Kräfte) zu Ödemen in der Körperperipherie, vor allem in den Beinen (zusätzliche hydrostatische Belastung).
Linksherzinsuffizienz führt
hingegen zu pulmonaler Hypertonie (mittlerer Druck in den
Pulmonalarterien >20 mmHg), Druckbelastung in den Alveolarkapillaren
und zu Lungenödem, was zu Atemnot und zum Auftreten feuchter Rasselgeräusche über der Lunge führt.
Hypervolämie (Erhöhung des
Blutvolumens) kann verschiedene Ursachen haben (erhöhte Zufuhr, z.B.
bei Infusion von Plasmaersatzstoffen; verringerte Ausscheidung, z.B.
bei Nierenversagen). Das Herz findet eine erhöhte Vorlast vor und muss
verstärkt Arbeit leisten, die koronare Durchblutung kann zu gering und
das Myokard ischämisch geschädigt werden.
Chronische Volumenüberlastung
des Herzens kann bei Klappeninsuffizienz auftreten, z.B. führt
Mitralklappeninsuffizienz zu linksseitiger Vorhofhypertrophie,
Aortenklappeninsuffizienz zu Hypertrophie des linken Ventrikels.
Dilatiert dabei der Herzmuskel, spricht man von exzentrischer Hypertrophie.
Hypovolämie (Erniedrigung des
Blutvolumens) kann z.B. durch Blutverlust (gastrointestinale Blutungen
sind eine häufige Ursache) oder verminderten Kochsalzgehalt im Körper
(z.B. Nebennierenrindeninsuffizienz)
bedingt sein. Die Kreislauffunktionen sind eingeschränkt, weil ein
normales Blutvolumen Grundlage aller hämodynamischen
Regulationsvorgänge ist. Es kann zu Synkopenneigung, hypovolämischem
Schock und (unbehandelt) zum Tod durch Kreislaufversagen kommen.
 Bei schwerer Anaphylaxie mit Kreislaufschock und Kehlkopfödem kann Adrenalin
verabreicht werden, insbesondere um einen vasokonstriktorischen Effekt
zu bewirken und Blut aus dem Niederdrucksystem zu mobilisieren.
Bei schwerer Anaphylaxie mit Kreislaufschock und Kehlkopfödem kann Adrenalin
verabreicht werden, insbesondere um einen vasokonstriktorischen Effekt
zu bewirken und Blut aus dem Niederdrucksystem zu mobilisieren.


 Das Herz transportiert bis zu ~10.000 Liter Blut pro Tag, gegen einen Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel), und konsumiert dabei ~10% der Stoffwechselenergie des Körpers.
Das Blutvolumen beträgt 5-10% des Körpergewichts (bei 70 kg KG ~5 Liter) und wird mittels Indikatorverdünnung bestimmt: Je größer das
Volumen, desto stärker wird der Indikator verdünnt → niedrige
Konzentration. Die verwendete Substanz muss ungiftig, verlässlich messbar sein und während der Messdauer im Blutkreislauf
verbleiben (Bindung an Protein oder Erythrozyten). Als effektives Blutvolumen gilt die funktionelle Füllungsreserve des rechten, als zentrales Blutvolumen
(zwischen Pulmonal- und Aortenklappe) des linken Herzens Das Herz transportiert bis zu ~10.000 Liter Blut pro Tag, gegen einen Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel), und konsumiert dabei ~10% der Stoffwechselenergie des Körpers.
Das Blutvolumen beträgt 5-10% des Körpergewichts (bei 70 kg KG ~5 Liter) und wird mittels Indikatorverdünnung bestimmt: Je größer das
Volumen, desto stärker wird der Indikator verdünnt → niedrige
Konzentration. Die verwendete Substanz muss ungiftig, verlässlich messbar sein und während der Messdauer im Blutkreislauf
verbleiben (Bindung an Protein oder Erythrozyten). Als effektives Blutvolumen gilt die funktionelle Füllungsreserve des rechten, als zentrales Blutvolumen
(zwischen Pulmonal- und Aortenklappe) des linken Herzens
 Hämodynamik
beschreibt Wechselwirkungen zwischen Volumen, Druck, Blutströmung und
Eigenschaften der Gefäßwände für den Kreislauf als geschlossenes hydrodynamisches System. Sie erklärt Phänomene bei Änderung des Blutvolumens (Hämorrhagie, Transfusion), der Körperlage oder der Durchblutung von Teilkreisläufen. Der Unterschied zwischen Innen- und Außendruck an der Gefäßwand (transmuraler Druck: Blutdruck minus Gewebedruck) bestimmt
deren Dehnung und damit auch den Gefäßwiderstand. Steigt der
transmurale Druck, wird das Gefäß gedehnt, sein Durchmesser nimmt zu. Der höchste Druck (hohe Wandspannung) herrscht
in den Arterien (reich an Elastin). Den größten Anteil des Strömungswiderstandes im
Kreislauf bieten kleine Arterien und Arteriolen (>50% glatte Muskulatur; terminale
Arteriolen steuern die Durchblutung entsprechend dem
lokalen Bedarf). Kapillaren (~1 mm lang, ~95% Endothel) haben
den größten Gesamtquerschnitt; Blut durchströmt sie mit ~1 mm/s, der Druck sinkt um ~20 mmHg; Blutkörperchen
verformen sich entsprechend dem Strömungsprofil, was den Reibungswiderstand minimiert Hämodynamik
beschreibt Wechselwirkungen zwischen Volumen, Druck, Blutströmung und
Eigenschaften der Gefäßwände für den Kreislauf als geschlossenes hydrodynamisches System. Sie erklärt Phänomene bei Änderung des Blutvolumens (Hämorrhagie, Transfusion), der Körperlage oder der Durchblutung von Teilkreisläufen. Der Unterschied zwischen Innen- und Außendruck an der Gefäßwand (transmuraler Druck: Blutdruck minus Gewebedruck) bestimmt
deren Dehnung und damit auch den Gefäßwiderstand. Steigt der
transmurale Druck, wird das Gefäß gedehnt, sein Durchmesser nimmt zu. Der höchste Druck (hohe Wandspannung) herrscht
in den Arterien (reich an Elastin). Den größten Anteil des Strömungswiderstandes im
Kreislauf bieten kleine Arterien und Arteriolen (>50% glatte Muskulatur; terminale
Arteriolen steuern die Durchblutung entsprechend dem
lokalen Bedarf). Kapillaren (~1 mm lang, ~95% Endothel) haben
den größten Gesamtquerschnitt; Blut durchströmt sie mit ~1 mm/s, der Druck sinkt um ~20 mmHg; Blutkörperchen
verformen sich entsprechend dem Strömungsprofil, was den Reibungswiderstand minimiert
 Die Intima ist die wichtigste Abdichtung gegen Verlust von Plasma und
bildet vasoaktive Substanzen, z.B. Stickstoffmonoxid. Das Endothel (Wandfläche insgesamt >100 m2) kommuniziert mittels Zellfortsätzen mit Muskelzellen in der Media.
Die Media
verleiht strukturelle Festigkeit (Kollagen, Elastin) und
Kontraktionsvermögen (glatte Muskelfasern). Die Adventitia beinhaltet
sympathische Varikositäten und in größeren Gefäßen vasa vasorum für die
Versorgung der Media. Extremitätenvenen enthalten auch Schmerzfasern. Das Laplace-Gesetz beschreibt die
Beziehung zwischen Wanddicke, Wandspannung und transmuralem Druck: Dehnung der Gefäßwand nimmt mit Druckbelastung und
Gefäßdurchmesser zu, mit dem Wanddurchmesser ab.
Kontraktion der Muskelschicht entlastet die bindegewebigen
Elemente. Bei Vasodilatation nimmt der Gefäßradius - und damit die Dehnung der Elastin- und Kollagenfasern - zu Die Intima ist die wichtigste Abdichtung gegen Verlust von Plasma und
bildet vasoaktive Substanzen, z.B. Stickstoffmonoxid. Das Endothel (Wandfläche insgesamt >100 m2) kommuniziert mittels Zellfortsätzen mit Muskelzellen in der Media.
Die Media
verleiht strukturelle Festigkeit (Kollagen, Elastin) und
Kontraktionsvermögen (glatte Muskelfasern). Die Adventitia beinhaltet
sympathische Varikositäten und in größeren Gefäßen vasa vasorum für die
Versorgung der Media. Extremitätenvenen enthalten auch Schmerzfasern. Das Laplace-Gesetz beschreibt die
Beziehung zwischen Wanddicke, Wandspannung und transmuralem Druck: Dehnung der Gefäßwand nimmt mit Druckbelastung und
Gefäßdurchmesser zu, mit dem Wanddurchmesser ab.
Kontraktion der Muskelschicht entlastet die bindegewebigen
Elemente. Bei Vasodilatation nimmt der Gefäßradius - und damit die Dehnung der Elastin- und Kollagenfasern - zu
 Gelegentlich
ist der transmurale Druck in Arterien negativ, z.B. systolisch bei
linksventrikulären subendokardialen Gefäßen
(Durchblutung während der Diastole); im Lungenkreislauf sind apikale
Regionen in aufrechter Lage nur während der systolischen
Blutdruckspitzen geöffnet. Arteriolen können ihren Durchmesser aktiv
besonders stark verändern. Venen speichern >50% des Blutvolumens (Kapazitätsgefäße) und sind teils stark mit Blut gefüllt (in den Beinen im
Stehen), teils kollabiert. Aktivität
sympathischer Fasern steigert den Innendruck und erhöht das Blutangebot
an das Herz (Vorlast), assistiert von Venenklappen ("Muskelpumpe"). Im Stehen
ist der hydrostatische Druck über die Längsachse des Körpers
unterschiedlich, Lagewechsel bedingt Volumenverschiebungen und
Veränderungen des Herzzeitvolumens (Stehen ~5 l/min, Liegen ~7 l/min). Bei 45°-Lagerung liegt der
Kollapspunkt der Jugularvene
~2
cm über dem Sternum. Venen sind bis zu einem Punkt, an dem sich die
Kollagenfasern scherengitterartig formieren, sehr gut dehnbar Gelegentlich
ist der transmurale Druck in Arterien negativ, z.B. systolisch bei
linksventrikulären subendokardialen Gefäßen
(Durchblutung während der Diastole); im Lungenkreislauf sind apikale
Regionen in aufrechter Lage nur während der systolischen
Blutdruckspitzen geöffnet. Arteriolen können ihren Durchmesser aktiv
besonders stark verändern. Venen speichern >50% des Blutvolumens (Kapazitätsgefäße) und sind teils stark mit Blut gefüllt (in den Beinen im
Stehen), teils kollabiert. Aktivität
sympathischer Fasern steigert den Innendruck und erhöht das Blutangebot
an das Herz (Vorlast), assistiert von Venenklappen ("Muskelpumpe"). Im Stehen
ist der hydrostatische Druck über die Längsachse des Körpers
unterschiedlich, Lagewechsel bedingt Volumenverschiebungen und
Veränderungen des Herzzeitvolumens (Stehen ~5 l/min, Liegen ~7 l/min). Bei 45°-Lagerung liegt der
Kollapspunkt der Jugularvene
~2
cm über dem Sternum. Venen sind bis zu einem Punkt, an dem sich die
Kollagenfasern scherengitterartig formieren, sehr gut dehnbar
 Druckgradienten
und Masseträgheit bestimmen die Strömung von Blut. Je größer der
Druckunterschied und je kleiner der Strömungswiderstand, desto stärker die Strömung (analog Ohm'sches Gesetz). Für den gesamten Kreislauf gilt: Arterieller Mitteldruck ~ Herzzeitvolumen x peripherer Widerstand (TPR). Bis zu kleinen
Arterien sinkt der mittlere Druck im Arteriensystem kaum, der
Strömungswiderstand ist gering; der periphere Widerstand liegt im
Bereich der Arteriolen. Je enger ein Gefäß (Poiseuille: R~1/r4), desto geringer seine
Perfusion Druckgradienten
und Masseträgheit bestimmen die Strömung von Blut. Je größer der
Druckunterschied und je kleiner der Strömungswiderstand, desto stärker die Strömung (analog Ohm'sches Gesetz). Für den gesamten Kreislauf gilt: Arterieller Mitteldruck ~ Herzzeitvolumen x peripherer Widerstand (TPR). Bis zu kleinen
Arterien sinkt der mittlere Druck im Arteriensystem kaum, der
Strömungswiderstand ist gering; der periphere Widerstand liegt im
Bereich der Arteriolen. Je enger ein Gefäß (Poiseuille: R~1/r4), desto geringer seine
Perfusion
 Die Aorta wandelt
~75%
der systolischen kinetischen Energie (Beschleunigung der Blutsäule) in
potentielle Energie um, sie wird anschließend in kinetische Energie
zurückverwandelt (zwischengespeichertes Blut weiterbefördert). Dieser
Windkesseleffekt hält die
Blutdruckamplitude gering (z.B. 120/80). Die Druckwelle
(Pulswellengeschwindigkeit: zentral ~4 m/s, peripher bis 10 m/s; steigt
mit sinkender Dehnbarkeit der Gefäßwände) läuft antegrad in die
Peripherie und durch Reflexion zum Herzen zurück (retrograd) - viel
schneller als die Strömung (Aorta 0,2 m/s).
An verschiedenen Stellen des Arteriensystems resultieren
unterschiedliche Pulswellenformen - diese sind meist dikrot und
verlaufen gegen Ende eines Druckzyklus flacher als zu dessen Beginn.
Der systolische Druck gilt als Maß für das Schlagvolumen, der
diastolische für den peripheren Widerstand. Der arterielle Mitteldruck
ist durch Herzminutenvolumen und peripheren Widerstand bestimmt, die
Blutdruckamplitude durch Schlagvolumen, Pulsfrequenz und arterielle
Compliance. Je größer das Schlagvolumen und je geringer die Compliance, desto größer die Blutdruckamplitude. Die
Druck-Volumen-Beziehung der Gefäße ist nichtlinear (sinkende Compliance
mit zunehmendem Innendruck) Die Aorta wandelt
~75%
der systolischen kinetischen Energie (Beschleunigung der Blutsäule) in
potentielle Energie um, sie wird anschließend in kinetische Energie
zurückverwandelt (zwischengespeichertes Blut weiterbefördert). Dieser
Windkesseleffekt hält die
Blutdruckamplitude gering (z.B. 120/80). Die Druckwelle
(Pulswellengeschwindigkeit: zentral ~4 m/s, peripher bis 10 m/s; steigt
mit sinkender Dehnbarkeit der Gefäßwände) läuft antegrad in die
Peripherie und durch Reflexion zum Herzen zurück (retrograd) - viel
schneller als die Strömung (Aorta 0,2 m/s).
An verschiedenen Stellen des Arteriensystems resultieren
unterschiedliche Pulswellenformen - diese sind meist dikrot und
verlaufen gegen Ende eines Druckzyklus flacher als zu dessen Beginn.
Der systolische Druck gilt als Maß für das Schlagvolumen, der
diastolische für den peripheren Widerstand. Der arterielle Mitteldruck
ist durch Herzminutenvolumen und peripheren Widerstand bestimmt, die
Blutdruckamplitude durch Schlagvolumen, Pulsfrequenz und arterielle
Compliance. Je größer das Schlagvolumen und je geringer die Compliance, desto größer die Blutdruckamplitude. Die
Druck-Volumen-Beziehung der Gefäße ist nichtlinear (sinkende Compliance
mit zunehmendem Innendruck)
 Der Gefäßtonus entspricht einer definierten Druck-Volumen-Charakteristik und steht unter dem Einfluss zahlreicher Faktoren: Autoregulation der Durchblutung (Gehirn, Myokard, Nieren); lokale vasoaktive Substanzen (Adenosin, NO, Endothelin); extrinsische - autonom-nervöse (Sympathikus), endokrine (Adrenalin, Vasopressin, Angiotensin), Dehnung (Bayliss-Effekt), Temperatur (Lewis-Reaktion). Große Gefäße
reagieren vor allem auf Belastung des Endothels über Schubspannung
(Blutströmung) und auf
Axonreflexe (aszendierende Vasodilatation). Sympathische Effekte sowie myogene Antworten (Bayliss) wirken vor allem an Widerstandsgefäßen. Der myogene
Mechanismus funktioniert über dehnungsbedingte Depolarisierung und
Ca++-Einstrom; erhöhte
Strömungsbelastung des Endothels begrenzt die Kontraktion (NO,
endothelbedingte Hyperpolarisierung): Autoregulation von Durchblutung und kapillärem Druck in Gehirn, Leber,
Milz und Darm, Stabilisierung der Perfusion in
Nieren und Herzmuskel. In
Gehirn und quergestreifter Muskulatur steigt die Perfusion linear mit
dem Sauerstoffverbrauch (metabolische Vasodilatation). Periphere
Vasodilatation erhöht die Blutströmung in größeren Arterien, führt zu
endothelial bedingter Hyperpolarisierung und Dilatation der
größeren Gefäße Der Gefäßtonus entspricht einer definierten Druck-Volumen-Charakteristik und steht unter dem Einfluss zahlreicher Faktoren: Autoregulation der Durchblutung (Gehirn, Myokard, Nieren); lokale vasoaktive Substanzen (Adenosin, NO, Endothelin); extrinsische - autonom-nervöse (Sympathikus), endokrine (Adrenalin, Vasopressin, Angiotensin), Dehnung (Bayliss-Effekt), Temperatur (Lewis-Reaktion). Große Gefäße
reagieren vor allem auf Belastung des Endothels über Schubspannung
(Blutströmung) und auf
Axonreflexe (aszendierende Vasodilatation). Sympathische Effekte sowie myogene Antworten (Bayliss) wirken vor allem an Widerstandsgefäßen. Der myogene
Mechanismus funktioniert über dehnungsbedingte Depolarisierung und
Ca++-Einstrom; erhöhte
Strömungsbelastung des Endothels begrenzt die Kontraktion (NO,
endothelbedingte Hyperpolarisierung): Autoregulation von Durchblutung und kapillärem Druck in Gehirn, Leber,
Milz und Darm, Stabilisierung der Perfusion in
Nieren und Herzmuskel. In
Gehirn und quergestreifter Muskulatur steigt die Perfusion linear mit
dem Sauerstoffverbrauch (metabolische Vasodilatation). Periphere
Vasodilatation erhöht die Blutströmung in größeren Arterien, führt zu
endothelial bedingter Hyperpolarisierung und Dilatation der
größeren Gefäße
 Vasopressin wird bei Blutdruckabfall (Barorezeptoren), Volumenmangel (kardiopulmonale Rezeptoren) oder anderen Belastungssituationen freigesetzt (zentrale Disinhibition) und
erhöht den Gefäßtonus vor allem im Splanchnikusbereich. Volumenmangel
dominiert den Gesamteffekt auf die Hormonfreisetzung, sodass auch bei
hypotoner Dehydratation Vasopressin trotz erniedrigter Osmolalität
vermehrt ausgeschüttet wird. Vasopressin wirkt volumensteigernd,
gefäßverengend, blutdrucksteigernd. Endotheline bewirken Vasokonstriktion (ETA-Rezeptor) oder Vasodilatation (ETB-Rezeptor). Noradrenalin wirkt vorwiegend über α-Rezeptoren stark vasokonstriktorisch, der Baroreflex antwortet mit einer Senkung der Herzfrequenz. Adrenalin steigert über ß-Rezeptoren Schlagkraft, Herzfrequenz und systolischen Druck. Geringe Dosen Dopamin
kontrahieren renale und mesenteriale Blutgefäße, mittlere steigern
Schlagkraft und Herzfrequenz, hohe Dosen wirken zusätzlich
vasokonstriktorisch / blutdrucksteigernd Vasopressin wird bei Blutdruckabfall (Barorezeptoren), Volumenmangel (kardiopulmonale Rezeptoren) oder anderen Belastungssituationen freigesetzt (zentrale Disinhibition) und
erhöht den Gefäßtonus vor allem im Splanchnikusbereich. Volumenmangel
dominiert den Gesamteffekt auf die Hormonfreisetzung, sodass auch bei
hypotoner Dehydratation Vasopressin trotz erniedrigter Osmolalität
vermehrt ausgeschüttet wird. Vasopressin wirkt volumensteigernd,
gefäßverengend, blutdrucksteigernd. Endotheline bewirken Vasokonstriktion (ETA-Rezeptor) oder Vasodilatation (ETB-Rezeptor). Noradrenalin wirkt vorwiegend über α-Rezeptoren stark vasokonstriktorisch, der Baroreflex antwortet mit einer Senkung der Herzfrequenz. Adrenalin steigert über ß-Rezeptoren Schlagkraft, Herzfrequenz und systolischen Druck. Geringe Dosen Dopamin
kontrahieren renale und mesenteriale Blutgefäße, mittlere steigern
Schlagkraft und Herzfrequenz, hohe Dosen wirken zusätzlich
vasokonstriktorisch / blutdrucksteigernd
 Vasodilatation erfolgt durch Hyperpolarisierung - vermittelt über mechanische Reizung (Schubspannung), metabolische Autoregulation, endotheliale Faktoren, intensive Hypoxie,
ß-adrenerg (Adrenalin), cholinerg (sympathisch oder parasympathisch).
Vasodilatation kann die Durchblutung bis zu 20-fach steigern,
insbesondere in der Haut (Thermoregulation), Skelettmuskeln
(Arbeitsleistung), exokrinen Drüsen (Sekretion). Erweiterung von
Arteriolen steigert den Kapillardruck und damit die Filtration von
Flüssigkeit in das Gewebe. Generelle Vasodilatation senkt den Blutdruck
und kann zu Kreislaufversagen ("Widerstandsverlustschock") führen Vasodilatation erfolgt durch Hyperpolarisierung - vermittelt über mechanische Reizung (Schubspannung), metabolische Autoregulation, endotheliale Faktoren, intensive Hypoxie,
ß-adrenerg (Adrenalin), cholinerg (sympathisch oder parasympathisch).
Vasodilatation kann die Durchblutung bis zu 20-fach steigern,
insbesondere in der Haut (Thermoregulation), Skelettmuskeln
(Arbeitsleistung), exokrinen Drüsen (Sekretion). Erweiterung von
Arteriolen steigert den Kapillardruck und damit die Filtration von
Flüssigkeit in das Gewebe. Generelle Vasodilatation senkt den Blutdruck
und kann zu Kreislaufversagen ("Widerstandsverlustschock") führen
 Kinine sind gefäßerweiternde Peptide, die aus hepatisch gebildetem Kininogen durch Kininasewirkung entstehen. Sie wirken auf Kininrezeptoren, die von den meisten Zellen exprimiert werden,
gefäßdilatierend (Bradykinin!), steigern die Gefäßpermeabilität, hemmen
Plättchenaggregation, kontrahieren Bronchien, Darm und Uterus, wirken
als Radikalfänger und stellen den fetalen Kreislauf auf postpartale
Verhältnisse um (ductus arteriosus, Kontraktion der Nabelgefäße,
Dilatation der Pulmonalarterie) Kinine sind gefäßerweiternde Peptide, die aus hepatisch gebildetem Kininogen durch Kininasewirkung entstehen. Sie wirken auf Kininrezeptoren, die von den meisten Zellen exprimiert werden,
gefäßdilatierend (Bradykinin!), steigern die Gefäßpermeabilität, hemmen
Plättchenaggregation, kontrahieren Bronchien, Darm und Uterus, wirken
als Radikalfänger und stellen den fetalen Kreislauf auf postpartale
Verhältnisse um (ductus arteriosus, Kontraktion der Nabelgefäße,
Dilatation der Pulmonalarterie)
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Prinzipien der Hämodynamik, Hochdrucksystem
Prinzipien der Hämodynamik, Hochdrucksystem
 Aneurysma: ἀνά = hinauf, εὐρύς = weit (Erweiterung)
Aneurysma: ἀνά = hinauf, εὐρύς = weit (Erweiterung) Hydromechanik
Hydromechanik  Blutvolumen / Plasmavolumen
Blutvolumen / Plasmavolumen  Grundlagen der Hämodynamik
Grundlagen der Hämodynamik  Strömungsgesetz
Strömungsgesetz  Arterieller Blutdruck
Arterieller Blutdruck  Arterielle Druckwelle und Blutdruckamplitude
Arterielle Druckwelle und Blutdruckamplitude  Blutdruckschwankungen
Blutdruckschwankungen  Windkesseleffekt
Windkesseleffekt  Peripherer Widerstand
Peripherer Widerstand  Compliance
Compliance  Gefäßtonus
Gefäßtonus  Vasokonstriktion
Vasokonstriktion
 Vasodilatation und Autoregulation
Vasodilatation und Autoregulation  Kininsystem
Kininsystem
 Zentrales Blutvolumen
Zentrales Blutvolumen  Hypo-, Hypervolämie
Hypo-, Hypervolämie  Transmuraler Druck
Transmuraler Druck  Blutdruckamplitude
Blutdruckamplitude  Blutdruckschwankungen 1., 2., 3. Ordnung
Blutdruckschwankungen 1., 2., 3. Ordnung  Peripherer Widerstand
Peripherer Widerstand
 Core messages
Core messages
 Abbildung: Grundlegende Organisation des Blutkreislaufsystems
Abbildung: Grundlegende Organisation des Blutkreislaufsystems
 in Kapillaren
in Kapillaren  (mit
geringem Innendruck und minimaler Strömungsgeschwindigkeit) bis zu
einem dreischichtigen Bau größerer Gefäße, in denen größere Druck- und
Strömungsbelastungen herrschen. Hier unterscheidet man folgende Systeme (
(mit
geringem Innendruck und minimaler Strömungsgeschwindigkeit) bis zu
einem dreischichtigen Bau größerer Gefäße, in denen größere Druck- und
Strömungsbelastungen herrschen. Hier unterscheidet man folgende Systeme ( Abbildung):
Abbildung): Eine das Blut umschließende tunica intima, bestehend aus Endothelzellen
- Funktion: Unterschiedliche Durchlässigkeit (Permeabilität) für den
Austausch von Stoffen zwischen Blut und Gewebe, Limitierung / Steuerung
der Filtration (druckabhängiger Flüssigkeitsaustausch), des Gefäßtonus (Vasokonstriktion), der Angiogenese (Neubildung von Gefäßen) und der Hämostase
(Blutstillung).
Eine das Blut umschließende tunica intima, bestehend aus Endothelzellen
- Funktion: Unterschiedliche Durchlässigkeit (Permeabilität) für den
Austausch von Stoffen zwischen Blut und Gewebe, Limitierung / Steuerung
der Filtration (druckabhängiger Flüssigkeitsaustausch), des Gefäßtonus (Vasokonstriktion), der Angiogenese (Neubildung von Gefäßen) und der Hämostase
(Blutstillung). Eine tunica media,
die von der Intima durch eine dünne elastische Schicht abgegrenzt ist.
Sie enthält glatte Muskelzellen, eingebettet in Bindegewebe aus
Kollagen, Elastin und Proteoglycanen. Zahl und Anordnung der Zellen
hängt von der Größe und Belastung der Gefäßwand ab (Arterien, Venen).
Die Muskelzellen sind über gap junctions miteinander funktionell verknüpft.
Eine tunica media,
die von der Intima durch eine dünne elastische Schicht abgegrenzt ist.
Sie enthält glatte Muskelzellen, eingebettet in Bindegewebe aus
Kollagen, Elastin und Proteoglycanen. Zahl und Anordnung der Zellen
hängt von der Größe und Belastung der Gefäßwand ab (Arterien, Venen).
Die Muskelzellen sind über gap junctions miteinander funktionell verknüpft. Eine tunica adventitia (tunica externa), von der tunica media wiederum durch
eine dünne elastische Schicht abgegrenzt. Diese Schicht enthält
Bindegewebe und Nerven, in größeren Gefäßen auch kleine Blutgefäße
(vasa vasorum) zur externen Versorgung mit Sauerstoff, Nährstoffen u.a.
Das Bindegewebe festigt die innere Struktur und verleiht Druckresistenz.
Eine tunica adventitia (tunica externa), von der tunica media wiederum durch
eine dünne elastische Schicht abgegrenzt. Diese Schicht enthält
Bindegewebe und Nerven, in größeren Gefäßen auch kleine Blutgefäße
(vasa vasorum) zur externen Versorgung mit Sauerstoff, Nährstoffen u.a.
Das Bindegewebe festigt die innere Struktur und verleiht Druckresistenz.
 Abbildung: Struktur der Blutgefäße
Abbildung: Struktur der Blutgefäße Endothelzellen bilden eine einschichtige Innenlage in allen Blutgefäßen. Kapillaren bestehen nur aus Endothel (
Endothelzellen bilden eine einschichtige Innenlage in allen Blutgefäßen. Kapillaren bestehen nur aus Endothel ( s. dort), alle anderen Gefäße verfügen auch - in unterschiedlichem Ausmaß, je nach Funktion - über folgende Komponenten:
s. dort), alle anderen Gefäße verfügen auch - in unterschiedlichem Ausmaß, je nach Funktion - über folgende Komponenten: Elastische Fasern können gummiartig Dehnungskräfte aufnehmen, speichern und retournieren - insbesondere in Arterien (über Elastin
Elastische Fasern können gummiartig Dehnungskräfte aufnehmen, speichern und retournieren - insbesondere in Arterien (über Elastin  s. dort)
s. dort) Kollagenfasern stellen eine kaum dehnbare Stützstruktur dar (zu Kollagen
Kollagenfasern stellen eine kaum dehnbare Stützstruktur dar (zu Kollagen  vgl. dort)
vgl. dort) Glatte Muskulatur
ist in der Gefäßwand spiralig angeordnet, in elastischen Arterien eher
parallel zur Längsachse, in muskulären eher ringförmig (je nach
Funktion) - näheres zu Gefäßwand, Vasokonstriktion und Vasodilatation
Glatte Muskulatur
ist in der Gefäßwand spiralig angeordnet, in elastischen Arterien eher
parallel zur Längsachse, in muskulären eher ringförmig (je nach
Funktion) - näheres zu Gefäßwand, Vasokonstriktion und Vasodilatation  s. dort
s. dort

 Abbildung: Stark vereinfachte Darstellung des kardiovaskulären Systems
Abbildung: Stark vereinfachte Darstellung des kardiovaskulären Systems
 ist die Übertragung
der Gesetze der Hydrodynamik auf das spezielle Anwendungsgebiet der
Blutströmung. Sie muss u.a. berücksichtigen, dass Blut als "flüssiges
Gewebe" (Blutkörperchen in Blutplasma suspendiert, mit
unterschiedlichem und jeweils komplexem biomechanischem Eigenschaften)
in seinem hydrodynamischen Verhalten zum Teil erheblich von einer
einfachen Flüssigkeit (wie Wasser, aus dem Blut hauptsächlich besteht)
abweicht.
ist die Übertragung
der Gesetze der Hydrodynamik auf das spezielle Anwendungsgebiet der
Blutströmung. Sie muss u.a. berücksichtigen, dass Blut als "flüssiges
Gewebe" (Blutkörperchen in Blutplasma suspendiert, mit
unterschiedlichem und jeweils komplexem biomechanischem Eigenschaften)
in seinem hydrodynamischen Verhalten zum Teil erheblich von einer
einfachen Flüssigkeit (wie Wasser, aus dem Blut hauptsächlich besteht)
abweicht. transportiert, gegen einen arteriellen
transportiert, gegen einen arteriellen  Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel).
Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel).
 Abbildung: Verteilung hämodynamischer Grundgrößen über den systemischen Kreislauf (schematisch)
Abbildung: Verteilung hämodynamischer Grundgrößen über den systemischen Kreislauf (schematisch)
 Derjenige Teil des venösen Blutvolumens, den das
rechte
Herz unmittelbar als funktionelle Reserve mobilisieren kann (unscharfe Definition), wird manchmal als effektives
Blutvolumen (effective circulating volume) bezeichnet. Man versteht darunter
die Blutmenge, die für die Perfusion lebenswichtiger Organe zur
Verfügung stehen muss (also für die "Notversorgung" des Kreislaufs).
Die Kontrolle dieses Volumens (das über Mikrozirkulation und Lymphkreislauf eng mit dem extrazellulären Volumen verknüpft ist) unterliegt einerseits den Barorezeptoren (ausreichender arterieller Druck?), andererseits den Niederdruckrezeptoren (kardiopulmonäre
Rezeptoren in Ventrikeln, Vorhöfen, a. pulmonalis). Beteiligt an der
Stabilisierung des effektiven Blutvolumens sind weiters Gefäßrezeptoren
in Nieren, Leber sowie Osmorezeptoren im Gehirn.
Derjenige Teil des venösen Blutvolumens, den das
rechte
Herz unmittelbar als funktionelle Reserve mobilisieren kann (unscharfe Definition), wird manchmal als effektives
Blutvolumen (effective circulating volume) bezeichnet. Man versteht darunter
die Blutmenge, die für die Perfusion lebenswichtiger Organe zur
Verfügung stehen muss (also für die "Notversorgung" des Kreislaufs).
Die Kontrolle dieses Volumens (das über Mikrozirkulation und Lymphkreislauf eng mit dem extrazellulären Volumen verknüpft ist) unterliegt einerseits den Barorezeptoren (ausreichender arterieller Druck?), andererseits den Niederdruckrezeptoren (kardiopulmonäre
Rezeptoren in Ventrikeln, Vorhöfen, a. pulmonalis). Beteiligt an der
Stabilisierung des effektiven Blutvolumens sind weiters Gefäßrezeptoren
in Nieren, Leber sowie Osmorezeptoren im Gehirn.  vgl. dort):
vgl. dort): Sympathische Aktivität
wirkt volumenerhaltend bzw. -steigernd. Der Sympathikustonus kann als
Antwort auf sinkendes effektives Blutvolumen oder im Rahmen einer
generellen Stressreaktion (körperliche Belastung, Blutverlust,
Trauma..) zunehmen. Schon niedrige sympathische Aktivität erhöht die
tubuläre Natriumresorption und
damit extrazelluläres Volumen und effektives Blutvolumen (Stützung der
Kreislauffunktion). Zunehmende Aktionspotentialfrequenz sympathischer
Efferenzen zur Niere regt die Reninfreisetzung an, was das Angiotensinsystem stimuliert (s. nächster Punkt). Höhere sympathische Aktivität schließlich bewirkt Vasokonstriktion,
dies senkt renale Durchblutung und Filtration. Zunächst konzentriert
sich die Wirkung auf die vasa efferentia, was die glomeruläre
Filtration stabilisiert; bei sehr hoher Aktivität nimmt die Wirkung
auch an den vasa afferentia stark zu, und auch die glomeruläre
Filtration nimmt deutlich ab.
Sympathische Aktivität
wirkt volumenerhaltend bzw. -steigernd. Der Sympathikustonus kann als
Antwort auf sinkendes effektives Blutvolumen oder im Rahmen einer
generellen Stressreaktion (körperliche Belastung, Blutverlust,
Trauma..) zunehmen. Schon niedrige sympathische Aktivität erhöht die
tubuläre Natriumresorption und
damit extrazelluläres Volumen und effektives Blutvolumen (Stützung der
Kreislauffunktion). Zunehmende Aktionspotentialfrequenz sympathischer
Efferenzen zur Niere regt die Reninfreisetzung an, was das Angiotensinsystem stimuliert (s. nächster Punkt). Höhere sympathische Aktivität schließlich bewirkt Vasokonstriktion,
dies senkt renale Durchblutung und Filtration. Zunächst konzentriert
sich die Wirkung auf die vasa efferentia, was die glomeruläre
Filtration stabilisiert; bei sehr hoher Aktivität nimmt die Wirkung
auch an den vasa afferentia stark zu, und auch die glomeruläre
Filtration nimmt deutlich ab. Renin-Angiotensin-System:
Angiotensin II hat mehrere Wirkungen auf die renale Hämodynamik, der
Gesamteffekt kann je nach den Umständen verschieden ausfallen.
Normalerweise überwiegt die Wirkung auf die vasa efferentia (Prostaglandine wirken am vas afferens antikonstriktorisch), was die glomeruläre Filtration auch bei geringerer Perfusion kaum sinken läßt.
Renin-Angiotensin-System:
Angiotensin II hat mehrere Wirkungen auf die renale Hämodynamik, der
Gesamteffekt kann je nach den Umständen verschieden ausfallen.
Normalerweise überwiegt die Wirkung auf die vasa efferentia (Prostaglandine wirken am vas afferens antikonstriktorisch), was die glomeruläre Filtration auch bei geringerer Perfusion kaum sinken läßt.  Vasopressin
wirkt als "Wassersparhormon" und kann (bei höherer Konzentration) auch
den Gefäßwiderstand erhöhen (was den Blutdruck zu stabilisieren hilft).
Vasopressin kann die Durchblutung des Nierenmarks
reduzieren und dadurch das "Ausschwemmen" des hypertonen Markgewebes
gering halten (die hohe Osmolalität im Mark ist für die
Wasserresorption nötig).
Vasopressin
wirkt als "Wassersparhormon" und kann (bei höherer Konzentration) auch
den Gefäßwiderstand erhöhen (was den Blutdruck zu stabilisieren hilft).
Vasopressin kann die Durchblutung des Nierenmarks
reduzieren und dadurch das "Ausschwemmen" des hypertonen Markgewebes
gering halten (die hohe Osmolalität im Mark ist für die
Wasserresorption nötig). Natriuretische Peptide: Auf Erhöhung des zentralen Blutvolumens reagieren Herzmuskelzellen im Vorhof mit der Freisetzung von ANP. Dieses bewirkt Vasodilatation der vasa afferentia und efferentia - auch die Empfindlichkeit des tubulo-glomerulären Feedbacks (TGF) nimmt ab - und
wirkt dadurch durchblutungs- und filtrationssteigernd. Indirekt wird
auch die Reninfreisetzung gehemmt. Das bewirkt insgesamt einen
natriuretisch-diuretischen Effekt, das extrazelluläre
Flüssigkeitsvolumen, effektive Blutvolumen und damit die kardiale Vorlast nehmen ab.
Natriuretische Peptide: Auf Erhöhung des zentralen Blutvolumens reagieren Herzmuskelzellen im Vorhof mit der Freisetzung von ANP. Dieses bewirkt Vasodilatation der vasa afferentia und efferentia - auch die Empfindlichkeit des tubulo-glomerulären Feedbacks (TGF) nimmt ab - und
wirkt dadurch durchblutungs- und filtrationssteigernd. Indirekt wird
auch die Reninfreisetzung gehemmt. Das bewirkt insgesamt einen
natriuretisch-diuretischen Effekt, das extrazelluläre
Flüssigkeitsvolumen, effektive Blutvolumen und damit die kardiale Vorlast nehmen ab. Das zentrale Blutvolumen liegt zwischen Pulmonal- und Aortenklappe - ein Teil davon kann vom linkenHerzen
als unmittelbare Füllungsreserve herangezogen werden (wenn der
venöse Blutnachschub aus der Peripherie zum rechten Herzen
vorübergehend nachlässt). Auch diese Definition ist insoferne unscharf,
als der Inhalt des rechten Ventrikels manchmal dazugezählt wird
("volumes of heart chambers and pulmonary circulation").
Das zentrale Blutvolumen liegt zwischen Pulmonal- und Aortenklappe - ein Teil davon kann vom linkenHerzen
als unmittelbare Füllungsreserve herangezogen werden (wenn der
venöse Blutnachschub aus der Peripherie zum rechten Herzen
vorübergehend nachlässt). Auch diese Definition ist insoferne unscharf,
als der Inhalt des rechten Ventrikels manchmal dazugezählt wird
("volumes of heart chambers and pulmonary circulation").


 Als Hypovolämie bezeichnet man ein reduziertes Blutvolumen infolge
Als Hypovolämie bezeichnet man ein reduziertes Blutvolumen infolge Blutverlust (Stadium 1: bis -15%, Stadium 2: bis -30%, Stadium 3: bis -40%, Stadium 4: über -40%),
Blutverlust (Stadium 1: bis -15%, Stadium 2: bis -30%, Stadium 3: bis -40%, Stadium 4: über -40%),  Dehydration (Abnahme des extrazellulären und damit auch Blutvolumens),
Dehydration (Abnahme des extrazellulären und damit auch Blutvolumens),  Salzmangel (weil NaCl Wasser im Körper hält, s. Osmoregulation).
Salzmangel (weil NaCl Wasser im Körper hält, s. Osmoregulation).  Salz-Wasser-Retention (Nierenversagen),
Salz-Wasser-Retention (Nierenversagen), Infusion von Plasmaersatzflüssigkeiten, Plasmaeiweiß, hypertonen
Flüssigkeiten.
Infusion von Plasmaersatzflüssigkeiten, Plasmaeiweiß, hypertonen
Flüssigkeiten.
 Abbildung:
Einfluss von Blutvolumen, Herzleistung, Gefäßwiderstand und -dehnbarkeit
auf hämodynamische Kenngrößen in einem simplen mechanischen Modell
Abbildung:
Einfluss von Blutvolumen, Herzleistung, Gefäßwiderstand und -dehnbarkeit
auf hämodynamische Kenngrößen in einem simplen mechanischen Modell




 Abbildung: Kreislauf in Zahlen
Abbildung: Kreislauf in Zahlen : Größte Anzahl, größte Oberfläche
: Größte Anzahl, größte Oberfläche
 Der transmurale Druck ist der
Unterschied zwischen Innen- und Außendruck (Blutdruck minus Gewebedruck) an
der Gefäßwand. Steigt der transmurale Druck, wird das
Gefäß gedehnt, sein Durchmesser nimmt zu.
Der transmurale Druck ist der
Unterschied zwischen Innen- und Außendruck (Blutdruck minus Gewebedruck) an
der Gefäßwand. Steigt der transmurale Druck, wird das
Gefäß gedehnt, sein Durchmesser nimmt zu.  (Aussackungen)
führen. An der betroffenen Stelle nimmt der
Gefäßdurchmesser noch mehr zu, und ein circulus vitiosus tritt auf: Die
Wandspannung steigt weiter, es kann zum Einreißen der Gefäßwand kommen.
Rupturiert die Innenwand (tunica intima), dringt Blut in die Aortenwand
ein (Aortendissektion). Das kann zu Aortenruptur führen - mit Blutverlust nach retroperitoneal (20%) oder in die freie Bauchhöhle (80%).
(Aussackungen)
führen. An der betroffenen Stelle nimmt der
Gefäßdurchmesser noch mehr zu, und ein circulus vitiosus tritt auf: Die
Wandspannung steigt weiter, es kann zum Einreißen der Gefäßwand kommen.
Rupturiert die Innenwand (tunica intima), dringt Blut in die Aortenwand
ein (Aortendissektion). Das kann zu Aortenruptur führen - mit Blutverlust nach retroperitoneal (20%) oder in die freie Bauchhöhle (80%).  Arterien sind durch den Blutdruck meist aufgedehnt (positiver transmuraler Druck); sie verfügen über eine stark ausgeprägte Muskelschicht
zwischen der äußeren Elastin- und der inneren Kollagenlage, um dem
Dehnungsdruck standzuhalten und ihm aktiv zu begegnen (Gefäßtonus). Gelegentlich können auch Arterien kollabieren (negativer transmuraler Druck), z.B. subendokardiale Gefäße im linken Ventrikel während der Systole. Der Lungenkreislauf
ist durch entsprechende Zonen ausgezeichnet (in aufrechter Lage sind
die apikalen Gebiete nur während der systolischen Blutdruckspitzen
geöffnet).
Arterien sind durch den Blutdruck meist aufgedehnt (positiver transmuraler Druck); sie verfügen über eine stark ausgeprägte Muskelschicht
zwischen der äußeren Elastin- und der inneren Kollagenlage, um dem
Dehnungsdruck standzuhalten und ihm aktiv zu begegnen (Gefäßtonus). Gelegentlich können auch Arterien kollabieren (negativer transmuraler Druck), z.B. subendokardiale Gefäße im linken Ventrikel während der Systole. Der Lungenkreislauf
ist durch entsprechende Zonen ausgezeichnet (in aufrechter Lage sind
die apikalen Gebiete nur während der systolischen Blutdruckspitzen
geöffnet). In Arteriolen ist die relative
Ausprägung der Muscularisschicht am höchsten; Arteriolen können ihren
Durchmesser aktiv besonders gut regulieren (lokal-metabolisch,
neuronal-sympathisch oder humoral bedingt).
In Arteriolen ist die relative
Ausprägung der Muscularisschicht am höchsten; Arteriolen können ihren
Durchmesser aktiv besonders gut regulieren (lokal-metabolisch,
neuronal-sympathisch oder humoral bedingt). Etwa 1-3.1010 Kapillaren (Länge ≤1 mm, Durchmesser 4-8 µm) versorgen den Körper mit Blut. Ihre Austauschoberfläche kann mehrere dm2 pro Gramm Gewebe betragen.
Etwa 1-3.1010 Kapillaren (Länge ≤1 mm, Durchmesser 4-8 µm) versorgen den Körper mit Blut. Ihre Austauschoberfläche kann mehrere dm2 pro Gramm Gewebe betragen. Venen
können
gut mit Blut gefüllt (vor allem im Stehen in der unteren Körperhälfte)
oder auch kollabiert sein (bei negativem transmuralen Druckbetrag -
vgl. dort). Bei 45-Grad-Lagerung liegt der Kollapspunkt der Jugularvene normalerweise etwa 2 cm über dem Sternum (
Venen
können
gut mit Blut gefüllt (vor allem im Stehen in der unteren Körperhälfte)
oder auch kollabiert sein (bei negativem transmuralen Druckbetrag -
vgl. dort). Bei 45-Grad-Lagerung liegt der Kollapspunkt der Jugularvene normalerweise etwa 2 cm über dem Sternum ( s. dort).
Die Venenwand besteht zu mehr als der Hälfte aus Kollagen; dieses ist
wesentlich weniger dehnbar als Elastin (Faktor 100) und verhindert eine
Überdehnung der Kapazitätsgefäße bei Steigerung des Innendrucks (bis zu
einem Punkt, bei dem sich die locker angeordneten Kollagenfasern zu
einer scherengitterartigen, festen Struktur ordnen, sind die Venen sehr
leicht dehnbar).
s. dort).
Die Venenwand besteht zu mehr als der Hälfte aus Kollagen; dieses ist
wesentlich weniger dehnbar als Elastin (Faktor 100) und verhindert eine
Überdehnung der Kapazitätsgefäße bei Steigerung des Innendrucks (bis zu
einem Punkt, bei dem sich die locker angeordneten Kollagenfasern zu
einer scherengitterartigen, festen Struktur ordnen, sind die Venen sehr
leicht dehnbar). 

 Abbildung: Mechanik der Wandspannung in einem Blutgefäß
Abbildung: Mechanik der Wandspannung in einem Blutgefäß : Der Innendruck pi drückt auf eine Fläche 2r.l (Innendurchmesser mal Länge des Gefäßabschnittes) und wirkt vasodilatatorisch, der Außendruck po wirkt in die Gegenrichtung (Kompression des Gefäßes). T (wall tension) ist die auf diese Fläche ausgeübte Kraft (Wandspannung) und setzt sich aus zwei Komponenten zusammen: Ta = aktive (Muskeltonus), Tp = passive Wandspannumg (Elastin und Kollagen).
: Der Innendruck pi drückt auf eine Fläche 2r.l (Innendurchmesser mal Länge des Gefäßabschnittes) und wirkt vasodilatatorisch, der Außendruck po wirkt in die Gegenrichtung (Kompression des Gefäßes). T (wall tension) ist die auf diese Fläche ausgeübte Kraft (Wandspannung) und setzt sich aus zwei Komponenten zusammen: Ta = aktive (Muskeltonus), Tp = passive Wandspannumg (Elastin und Kollagen).
 Abbildung
gezeigte Modell eines Hohlzylinders beschreibt gut die Verhältnisse für
Gefäße (die ja eine entsprechende Form haben): Der Innendruck (p) ist proportional der Wandspannung (T) und umgekehrt proportional zum Innendurchmesser (2r) des Zylinders.
Abbildung
gezeigte Modell eines Hohlzylinders beschreibt gut die Verhältnisse für
Gefäße (die ja eine entsprechende Form haben): Der Innendruck (p) ist proportional der Wandspannung (T) und umgekehrt proportional zum Innendurchmesser (2r) des Zylinders.  Die Laplace-Beziehung besagt, dass die dehnende Kraft in der Gefäßwand
(der diese standhalten muss, meist unter Zuhilfenahme der glatten
Gefäßmuskulatur) mit
Druckbelastung und Gefäßdurchmesser zunimmt; und dass die Spannung in
der Gefäßwand mit deren Dicke (d) abnimmt. Aus
diesem Grund haben große Arterien besonders dicke Wände, während Venen
mit dünnen Wänden auskommen.
Die Laplace-Beziehung besagt, dass die dehnende Kraft in der Gefäßwand
(der diese standhalten muss, meist unter Zuhilfenahme der glatten
Gefäßmuskulatur) mit
Druckbelastung und Gefäßdurchmesser zunimmt; und dass die Spannung in
der Gefäßwand mit deren Dicke (d) abnimmt. Aus
diesem Grund haben große Arterien besonders dicke Wände, während Venen
mit dünnen Wänden auskommen.
 Abbildung: Strukturelle Merkmale von Blutgefäßen (schematisch)
Abbildung: Strukturelle Merkmale von Blutgefäßen (schematisch)

 Abbildung: Nichtlinearität der Druck-Strömungs-Charakteristik und Einfluss des Sympathikus
Abbildung: Nichtlinearität der Druck-Strömungs-Charakteristik und Einfluss des Sympathikus
 das Herz entlastet (geringere Nachlast),
das Herz entlastet (geringere Nachlast),  die Pulsamplitude reduziert und
die Pulsamplitude reduziert und  die Blutströmung kontinuierlicher werden lässt.
die Blutströmung kontinuierlicher werden lässt. 
 Abbildung: Hydrostatischer Druckgradient entlang des Arterien- und Venensystems
Abbildung: Hydrostatischer Druckgradient entlang des Arterien- und Venensystems
 Venolen (Durchmesser 50-200 µm) und Venen speichern mehr als 50% des gesamten Blutvolumens (Kapazitätsgefäße). Aktivität ihrer sympathischen Fasern
kontrahiert ihre Wand, das steigert den Innendruck und erhöht das Blutangebot an das Herz (Vorlast).
Da Venen zahlreicher und weiter als Arterien sind, ist ihr Strömungswiderstand und Druckabfall (10-15 mmHg) relativ gering.
Venolen (Durchmesser 50-200 µm) und Venen speichern mehr als 50% des gesamten Blutvolumens (Kapazitätsgefäße). Aktivität ihrer sympathischen Fasern
kontrahiert ihre Wand, das steigert den Innendruck und erhöht das Blutangebot an das Herz (Vorlast).
Da Venen zahlreicher und weiter als Arterien sind, ist ihr Strömungswiderstand und Druckabfall (10-15 mmHg) relativ gering. Genau beschrieben wurden Venenklappen beim Menschen erstmals 1603 durch Girolamo Fabrizio
(Hieronymus Fabricius ab Aquapendente) von der Universität in Padua (De
Venarum Ostiolis). Dem gingen weniger akkurate Schilderungen im 16. Jh
voraus (Vesalius, Lusitanus, Sylvius, Estienne). Fabrizio war der Lehrer von William Harvey, dem Autor der berühmten Analyse des Blutkreislaufs (Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus)
Genau beschrieben wurden Venenklappen beim Menschen erstmals 1603 durch Girolamo Fabrizio
(Hieronymus Fabricius ab Aquapendente) von der Universität in Padua (De
Venarum Ostiolis). Dem gingen weniger akkurate Schilderungen im 16. Jh
voraus (Vesalius, Lusitanus, Sylvius, Estienne). Fabrizio war der Lehrer von William Harvey, dem Autor der berühmten Analyse des Blutkreislaufs (Exercitatio Anatomica de Motu Cordis et Sanguinis in Animalibus) s. dort.
s. dort. Abbildung) lassen sich interessante Fakten herauslesen:
Beispielsweise, dass der Gesamtquerschnitt in der Mikrozirkulation
(Kapillaren) 1000-mal so groß ist (3000-4500 cm2) als derjenige der Aorta (3-4,5 cm2).
Daraus folgt, dass sich die mittleren Strömungsgeschwindigkeiten in
diesen beiden Kreislaufabschnitten um den Faktor 1000 unterscheiden
(Aorta ~25 cm/s, Kapillaren ~0,25 mm/s). In den Hohlvenen (mit je ~7-9 cm2
Querschnittsfläche) ergibt sich eine mittlere Strömungsgeschwindigkeit
um die 7 cm/s. Die niedrige Strömungsgeschwindigkeit im Kapillarbereich
ermöglicht ausreichenden Austausch von Atemgasen, Nährstoffen etc.
Abbildung) lassen sich interessante Fakten herauslesen:
Beispielsweise, dass der Gesamtquerschnitt in der Mikrozirkulation
(Kapillaren) 1000-mal so groß ist (3000-4500 cm2) als derjenige der Aorta (3-4,5 cm2).
Daraus folgt, dass sich die mittleren Strömungsgeschwindigkeiten in
diesen beiden Kreislaufabschnitten um den Faktor 1000 unterscheiden
(Aorta ~25 cm/s, Kapillaren ~0,25 mm/s). In den Hohlvenen (mit je ~7-9 cm2
Querschnittsfläche) ergibt sich eine mittlere Strömungsgeschwindigkeit
um die 7 cm/s. Die niedrige Strömungsgeschwindigkeit im Kapillarbereich
ermöglicht ausreichenden Austausch von Atemgasen, Nährstoffen etc. Je größer der Druckunterschied (p1-p2 oder ∂p) und je
kleiner der Strömungswiderstand (R) zwischen zwei miteinander kommunizierenden Gefäßabschnitten, desto
stärker ist die Strömung (Q) zwischen ihnen - z.B. die
Durchblutung (Perfusion) der betreffenden Region:
Je größer der Druckunterschied (p1-p2 oder ∂p) und je
kleiner der Strömungswiderstand (R) zwischen zwei miteinander kommunizierenden Gefäßabschnitten, desto
stärker ist die Strömung (Q) zwischen ihnen - z.B. die
Durchblutung (Perfusion) der betreffenden Region: (Darcy-Weisbach: Strömungsmechanik in porösen Medien) beschrieben und ist analog zum
Ohm'schen Gesetz
(Darcy-Weisbach: Strömungsmechanik in porösen Medien) beschrieben und ist analog zum
Ohm'schen Gesetz der Elektrizitätslehre (R = U / I) zu sehen, das
aussagt, dass der elektrische Strom (I) sich proportional zum
Potenzialgefälle U (analog: Druckgefälle p1 - p2) und umgekehrt proportional zum elektrischen Widerstand R (analog: Strömungswiderstand W) verhält.
der Elektrizitätslehre (R = U / I) zu sehen, das
aussagt, dass der elektrische Strom (I) sich proportional zum
Potenzialgefälle U (analog: Druckgefälle p1 - p2) und umgekehrt proportional zum elektrischen Widerstand R (analog: Strömungswiderstand W) verhält.
 Abbildung: Strömung folgt einem Druckunterschied
Abbildung: Strömung folgt einem Druckunterschied Der arterielle Blutdruck (mean arterial pressure
MAP) steigt und fällt umgekehrt proportional dem Durchmesser der
Widerstandsgefäße: Je enger diese sind, desto schwerer tut sich das
Blut mit der Passage und der Druck in den vorgeschalteten Arterien
nimmt zu. Auch die Blutviskosität
beeinflusst den Blutduck, wenn auch weniger stark: Nimmt diese zu (vor
allem durch Erhöhung des Hämatokrit), fließt das Blut weniger leicht
durch enge Gefäße, es steigt der Widerstand und damit der Blutdruck;
nimmt sie ab, ist es umgekehrt (blutdrucksenkender Effekt - jeweils
ceteris paribus).
Der arterielle Blutdruck (mean arterial pressure
MAP) steigt und fällt umgekehrt proportional dem Durchmesser der
Widerstandsgefäße: Je enger diese sind, desto schwerer tut sich das
Blut mit der Passage und der Druck in den vorgeschalteten Arterien
nimmt zu. Auch die Blutviskosität
beeinflusst den Blutduck, wenn auch weniger stark: Nimmt diese zu (vor
allem durch Erhöhung des Hämatokrit), fließt das Blut weniger leicht
durch enge Gefäße, es steigt der Widerstand und damit der Blutdruck;
nimmt sie ab, ist es umgekehrt (blutdrucksenkender Effekt - jeweils
ceteris paribus).
 Abbildung: Sympathikustonus, Gefäßdurchmesser und Strömungswiderstand
Abbildung: Sympathikustonus, Gefäßdurchmesser und Strömungswiderstand
 Atemluft zwischen Lunge und Außenluft (Widerstand der Atemwege: Druckunterschied Alveolen - Außenluft) - Je enger die Bronchien, desto schwerer die Atmung
Atemluft zwischen Lunge und Außenluft (Widerstand der Atemwege: Druckunterschied Alveolen - Außenluft) - Je enger die Bronchien, desto schwerer die Atmung Blut - Durchblutung (Perfusion) von Organen
(Gefäßwiderstand) - bei Entspannung der glatten Mukulatur weitet der
Blutdruck die Arteriolen, das Organ wird besser durchblutet
Blut - Durchblutung (Perfusion) von Organen
(Gefäßwiderstand) - bei Entspannung der glatten Mukulatur weitet der
Blutdruck die Arteriolen, das Organ wird besser durchblutet Lymphe - auch Lymphflüssigkeit strömt nach einem Druckgradienten, "Lymphherzen" können einen Druckgradienten erzeugen
Lymphe - auch Lymphflüssigkeit strömt nach einem Druckgradienten, "Lymphherzen" können einen Druckgradienten erzeugen Liquor- bzw. Hirndruck (Davson-Gleichung) - erhöhter Abflusswiderstand (Verengung der Spalträume) steigert den Hirndruck
Liquor- bzw. Hirndruck (Davson-Gleichung) - erhöhter Abflusswiderstand (Verengung der Spalträume) steigert den Hirndruck Kammerwasser aus Auge in Tränengänge (Goldmann-Gleichung: Widerstand im Kammerwinkel) - Strömungswiderstand und Augeninnendruck steigen bei Pupillenerweiterung (Mydriasis)
Kammerwasser aus Auge in Tränengänge (Goldmann-Gleichung: Widerstand im Kammerwinkel) - Strömungswiderstand und Augeninnendruck steigen bei Pupillenerweiterung (Mydriasis) Harn (Widerstand der Harnröhre:
Druckunterschied Blase - Außenwelt) - bei Prostatavergrößerung ist der
Harnabfluss behindert, die Entleerungszeit der Blase steigt
Harn (Widerstand der Harnröhre:
Druckunterschied Blase - Außenwelt) - bei Prostatavergrößerung ist der
Harnabfluss behindert, die Entleerungszeit der Blase steigt
 Abbildung: Engstellung der Arteriolen erhöht den Blutdruck
Abbildung: Engstellung der Arteriolen erhöht den Blutdruck

 Beispiel: Blutdruck 100 mmHg, Herzzeitvolumen 5 l/min → 100 mmHg = 5 l/min x 20 Widerstandseinheiten (hier: mmHg / (l/min))
Beispiel: Blutdruck 100 mmHg, Herzzeitvolumen 5 l/min → 100 mmHg = 5 l/min x 20 Widerstandseinheiten (hier: mmHg / (l/min)) Abbildung unten), was bedeutet, dass das
Herzminutenvolumen durch beide Systeme gepumpt wird. (Kleine
Unterschiede im Betrag ergeben sich durch den Bronchialkreislauf, s. dort.)
Abbildung unten), was bedeutet, dass das
Herzminutenvolumen durch beide Systeme gepumpt wird. (Kleine
Unterschiede im Betrag ergeben sich durch den Bronchialkreislauf, s. dort.)
 Abbildung: Kreislaufschema
Abbildung: Kreislaufschema
 das Herz seine Auswurfleistung erhöht und / oder
das Herz seine Auswurfleistung erhöht und / oder 
 der periphere Widerstand durch Kontraktion der
betreffenden Gefäße (kleinste Arterien, Arteriolen, Metarteriolen)
zunimmt.
der periphere Widerstand durch Kontraktion der
betreffenden Gefäße (kleinste Arterien, Arteriolen, Metarteriolen)
zunimmt.
 s. dort.
s. dort. Zustand
- die Sollwerte des arteriellen Drucks beziehen sich auf psychischen und körperlichen Ruhezustand.
Zustand
- die Sollwerte des arteriellen Drucks beziehen sich auf psychischen und körperlichen Ruhezustand.  Alter -
Der Ruheblutdruck sollte bei Erwachsenen unter 130 / 85 liegen - auch
in höherem Alter, soferne das Gefäßsystem nicht verändert ist
(Arteriosklerose), in diesem Fall nimmt vor allem der systolische
Blutdruck zu (geringer Windkesseleffekt, s. unten). Kinder zeigen etwas
niedrigeren Ruheblutdruck:
Alter -
Der Ruheblutdruck sollte bei Erwachsenen unter 130 / 85 liegen - auch
in höherem Alter, soferne das Gefäßsystem nicht verändert ist
(Arteriosklerose), in diesem Fall nimmt vor allem der systolische
Blutdruck zu (geringer Windkesseleffekt, s. unten). Kinder zeigen etwas
niedrigeren Ruheblutdruck: Bei physischer Belastung
(Muskelarbeit) nimmt der systolische
Blutdruck proportional mit der Belastung zu (bis auf ~200
mmHg); der diastolische Wert steigt mit der Belastung nur geringgradig an.
Bei physischer Belastung
(Muskelarbeit) nimmt der systolische
Blutdruck proportional mit der Belastung zu (bis auf ~200
mmHg); der diastolische Wert steigt mit der Belastung nur geringgradig an.
 Die Spanne zwischen systolischem und diastolischem Druck nennt man die Blutdruckamplitude (pulse pressure).
Die Spanne zwischen systolischem und diastolischem Druck nennt man die Blutdruckamplitude (pulse pressure). 
 Abbildung: Arterielle Pulswellen, die an Aorta und Femoralarterie synchron registriert wurden
Abbildung: Arterielle Pulswellen, die an Aorta und Femoralarterie synchron registriert wurden
 Abbildung), die an
jeder Registrierstelle anders aussehen. Die Pulskurven sind auf Grund
solcher
Druckwellenreflexionen meist dikrot
Abbildung), die an
jeder Registrierstelle anders aussehen. Die Pulskurven sind auf Grund
solcher
Druckwellenreflexionen meist dikrot  (zweigipflig, Abbildungen), insbesondere bei jüngeren Menschen; und sie verlaufen
gegen Ende eines Druckzyklus flacher als zu dessen Beginn
(nichtlinearer Druckverlauf).
(zweigipflig, Abbildungen), insbesondere bei jüngeren Menschen; und sie verlaufen
gegen Ende eines Druckzyklus flacher als zu dessen Beginn
(nichtlinearer Druckverlauf).
 Abbildung: Druckwellen im Aortenpuls
Abbildung: Druckwellen im Aortenpuls Abbildung demonstriert unterschiedliche Pulsformen anhand des
Vergleichs eines hypotonen, normotonen und hypertonen Aortenpulses. Die
primäre, vom Herzen ausgehende Druckwelle wird vor allem an den großen
Gefäßaufzweigungen (nach ca. 0,5 m) teilweise reflektiert und wandert
zum Herzen zurück.
Abbildung demonstriert unterschiedliche Pulsformen anhand des
Vergleichs eines hypotonen, normotonen und hypertonen Aortenpulses. Die
primäre, vom Herzen ausgehende Druckwelle wird vor allem an den großen
Gefäßaufzweigungen (nach ca. 0,5 m) teilweise reflektiert und wandert
zum Herzen zurück.  Der mittlere arterielle Druck (mean arterial pressure) ist ausschließlich durch das
Herzminutenvolumen und den peripheren Widerstand bestimmt, entsprechend
dem oben ausgeführten Strömungsgesetz.
Der mittlere arterielle Druck (mean arterial pressure) ist ausschließlich durch das
Herzminutenvolumen und den peripheren Widerstand bestimmt, entsprechend
dem oben ausgeführten Strömungsgesetz.  Systolischer und diastolischer Druck - und damit auch die
Blutdruckamplitude - sind in komplexer Weise durch Schlagvolumen,
Herzschlagfrequenz, peripheren Widerstand sowie arterielle Compliance
beeinflusst.
Systolischer und diastolischer Druck - und damit auch die
Blutdruckamplitude - sind in komplexer Weise durch Schlagvolumen,
Herzschlagfrequenz, peripheren Widerstand sowie arterielle Compliance
beeinflusst.
 Abbildung: Arterienpulsformen entlang des Gefäßbaumes
Abbildung: Arterienpulsformen entlang des Gefäßbaumes
 Der Kehrwert der Compliance (ΔV/Δp) wird als Volumenelastizitätskoeffizient E´
(Δp/ΔV) bezeichnet. E' ist ein Maß für den Widerstand, den die
Gefäßwand ihrer elastischen Verformung (reversibel) entgegensetzt. Gut
dehnbare Gefäße - insbesondere Venen - haben
einen niedrigen [E´], weniger gut dehnbare (Arterien) einen hohen [E´].
Der Kehrwert der Compliance (ΔV/Δp) wird als Volumenelastizitätskoeffizient E´
(Δp/ΔV) bezeichnet. E' ist ein Maß für den Widerstand, den die
Gefäßwand ihrer elastischen Verformung (reversibel) entgegensetzt. Gut
dehnbare Gefäße - insbesondere Venen - haben
einen niedrigen [E´], weniger gut dehnbare (Arterien) einen hohen [E´].

 Abbildung: Pulswellen und dazugehörige Druck-Volumen-Kurven
Abbildung: Pulswellen und dazugehörige Druck-Volumen-Kurven
 Abbildung zeigt, dass die arterielle Compliance mit zunehmendem Blutdruck (bzw. Blutvolumen) abnimmt.
Ein erhöhtes Schlagvolumen führt sofort zu einer deutlichen Steigerung
von systolischem Druck und Blutdruckamplitude; Änderungen des
peripheren Widerstandes wirken sich hingegen kaum auf den Betrag der
Blutdruckamplitude aus.
Abbildung zeigt, dass die arterielle Compliance mit zunehmendem Blutdruck (bzw. Blutvolumen) abnimmt.
Ein erhöhtes Schlagvolumen führt sofort zu einer deutlichen Steigerung
von systolischem Druck und Blutdruckamplitude; Änderungen des
peripheren Widerstandes wirken sich hingegen kaum auf den Betrag der
Blutdruckamplitude aus. Pulsatile Strömung und Beschleunigung: Zwischen Druckdifferenz, Beschleunigung und Strömung besteht ein Zusammenhang, der nicht aus dem Strömungsgesetz alleine zu erklären ist (die Darcy-Gleichung gilt für eine stete Strömung, nicht für Beschleunigungspulse).
Pulsatile Strömung und Beschleunigung: Zwischen Druckdifferenz, Beschleunigung und Strömung besteht ein Zusammenhang, der nicht aus dem Strömungsgesetz alleine zu erklären ist (die Darcy-Gleichung gilt für eine stete Strömung, nicht für Beschleunigungspulse). 
 Abbildung: Druck, Beschleunigung und Strömung in der Aorta
Abbildung: Druck, Beschleunigung und Strömung in der Aorta
 Abbildung; Punkt b), [∆p] wird negativ und die Blutsäule wird
jetzt abgebremst. Schließlich dreht sich die Blutströmung Richtung
Ventrikel um (sie wird negativ), was die Aortenklappe zudrückt
(Zeitpunkt c in der
Abbildung; Punkt b), [∆p] wird negativ und die Blutsäule wird
jetzt abgebremst. Schließlich dreht sich die Blutströmung Richtung
Ventrikel um (sie wird negativ), was die Aortenklappe zudrückt
(Zeitpunkt c in der  Abbildung).
Abbildung). ).
Mit modernen Registrier- und Berechnungsmethoden scheint diese als
veraltet geltende Methode ein Revival zu erfahren. Im Zustand der
Schwerelosigkeit bietet sich diese Methode an, weil der für die
Registrierung problematische Effekt der Schwerkraft wegfällt
(Monitoring des Herzminutenvolumens im Raumflug).
).
Mit modernen Registrier- und Berechnungsmethoden scheint diese als
veraltet geltende Methode ein Revival zu erfahren. Im Zustand der
Schwerelosigkeit bietet sich diese Methode an, weil der für die
Registrierung problematische Effekt der Schwerkraft wegfällt
(Monitoring des Herzminutenvolumens im Raumflug). Die Blutdruckamplitude (systolischer minus diastolischer Druckwert)
kann für die Systolendauer näherungsweise als das Verhältnis
Schlagvolumen / Compliance (Compliance
Die Blutdruckamplitude (systolischer minus diastolischer Druckwert)
kann für die Systolendauer näherungsweise als das Verhältnis
Schlagvolumen / Compliance (Compliance  =
Volumenänderung / Druckänderung) quantifiziert werden (der
gleichzeitige systolische Abfluss des Blutes wird dabei
vernachlässigt). Je größer das Schlagvolumen und je kleiner die
Compliance (je größer ihr Kehrwert, die Elastance), desto größer ist die Blutdruckamplitude (und vice versa).
=
Volumenänderung / Druckänderung) quantifiziert werden (der
gleichzeitige systolische Abfluss des Blutes wird dabei
vernachlässigt). Je größer das Schlagvolumen und je kleiner die
Compliance (je größer ihr Kehrwert, die Elastance), desto größer ist die Blutdruckamplitude (und vice versa).  Abbildung oben), was teils mit arterieller Hypertonie, teils mit abnehmender Compliance ("Gefäßverhärtung")
erklärt wird: Ein gegebenes Schlagvolumen bewirkt einen größeren
Drucksprung. Ebenso
nimmt der systolische Druck stärker zu, wenn die Auswurfgeschwindigkeit
größer wird, wie bei körperlicher Belastung - die visköse Relaxation
hat weniger Zeit, den Blutstoß weich abzufangen.
Abbildung oben), was teils mit arterieller Hypertonie, teils mit abnehmender Compliance ("Gefäßverhärtung")
erklärt wird: Ein gegebenes Schlagvolumen bewirkt einen größeren
Drucksprung. Ebenso
nimmt der systolische Druck stärker zu, wenn die Auswurfgeschwindigkeit
größer wird, wie bei körperlicher Belastung - die visköse Relaxation
hat weniger Zeit, den Blutstoß weich abzufangen. Wenn z.B. das Schlagvolumen 80 ml und die Compliance der herznahen Gefäße 2 ml/mmHg beträgt, ergibt sich eine Blutdruckamplitude von 40 mmHg (80 ml / 2 ml/mmHg).
Wenn z.B. das Schlagvolumen 80 ml und die Compliance der herznahen Gefäße 2 ml/mmHg beträgt, ergibt sich eine Blutdruckamplitude von 40 mmHg (80 ml / 2 ml/mmHg).
 Abbildung: Hämodynamik (Mensch, Ruhezustand)
Abbildung: Hämodynamik (Mensch, Ruhezustand)
 Der rhythmische Wechsel zwischen "systolischem" und "diastolischem" Druck, der in Arterien auftritt, ergibt Druckpulse, die als Blutdruckschwankungen I. Ordnung bezeichnet werden (Abbildungen oben). Die Periodendauer
entspricht dem Kehrwert der Pulsfrequenz (z.B. eine Sekunde bei 60 bpm)
und ist direkt vom autonom-nervösen Gleichgewicht abhängig
(Sympathikus: vasokonstriktorisch und positiv chronotrop,
Parasympathikus: negativ chronotrop wirksam). Die Höhe des systolischen
Drucks hängt vor allem von der Auswurfleistung des linken Herzens und
der Dehnbarkeit des Arteriensystems ab, die des diastolischen Drucks
vor allem von Pulsfrequenz und peripherem Strömungswiderstand.
Der rhythmische Wechsel zwischen "systolischem" und "diastolischem" Druck, der in Arterien auftritt, ergibt Druckpulse, die als Blutdruckschwankungen I. Ordnung bezeichnet werden (Abbildungen oben). Die Periodendauer
entspricht dem Kehrwert der Pulsfrequenz (z.B. eine Sekunde bei 60 bpm)
und ist direkt vom autonom-nervösen Gleichgewicht abhängig
(Sympathikus: vasokonstriktorisch und positiv chronotrop,
Parasympathikus: negativ chronotrop wirksam). Die Höhe des systolischen
Drucks hängt vor allem von der Auswurfleistung des linken Herzens und
der Dehnbarkeit des Arteriensystems ab, die des diastolischen Drucks
vor allem von Pulsfrequenz und peripherem Strömungswiderstand. bzw- -Oszillationen, THM-Wellen) treten vermutlich im Zusammenhang mit Oszillationen der Baro- bzw. Chemorezeptorreflexe
und des (vom Sympathikus gesteuerten) peripheren Gefäßtonus auf. Die
Oszillationen lassen sich sowohl in Blutdruck- als auch
EKG-Registrierungen erkennen und hängen eng mit solchen des Sympathikustonus
zusammen (pharmakologische Blockade der vaskulären α-Adrenozeptoren
lässt Blutdruckschwankungen III. Ordnung verschwinden). Die Periodendauer beträgt ~10 Sekunden (Frequenz ~0,1 Hz) und ist unabhängig von Körperlage, Geschlecht oder Alter.
bzw- -Oszillationen, THM-Wellen) treten vermutlich im Zusammenhang mit Oszillationen der Baro- bzw. Chemorezeptorreflexe
und des (vom Sympathikus gesteuerten) peripheren Gefäßtonus auf. Die
Oszillationen lassen sich sowohl in Blutdruck- als auch
EKG-Registrierungen erkennen und hängen eng mit solchen des Sympathikustonus
zusammen (pharmakologische Blockade der vaskulären α-Adrenozeptoren
lässt Blutdruckschwankungen III. Ordnung verschwinden). Die Periodendauer beträgt ~10 Sekunden (Frequenz ~0,1 Hz) und ist unabhängig von Körperlage, Geschlecht oder Alter. hydrostatische Ursache haben (so folgt der Blutdruck - arteriell, venös - positionsabhängig Lageänderungen des Körpers, außer im jeweiligen hydrostatischen Indifferenzpunkt),
hydrostatische Ursache haben (so folgt der Blutdruck - arteriell, venös - positionsabhängig Lageänderungen des Körpers, außer im jeweiligen hydrostatischen Indifferenzpunkt),  vom Gehirn ausgehen (vegetative Reaktionen auf Erregung, Freude, Angst, Verunsicherung etc), oder
vom Gehirn ausgehen (vegetative Reaktionen auf Erregung, Freude, Angst, Verunsicherung etc), oder  aus der aktiven Körperperipherie erzwungen werden (z.B. Autoregulation der Muskelperfusion).
aus der aktiven Körperperipherie erzwungen werden (z.B. Autoregulation der Muskelperfusion).

 Abbildung: Windkesseleffekt
Abbildung: Windkesseleffekt
 Abbildung unten
ist ersichtlich, dass die Pulswellengeschwindigkeit bei mittelgroßen
(nicht-sklerosierten) Arterien im Blutdruckbereich von 75-125 mmHg
zwischen etwa 4 und 8 m/s beträgt.
Abbildung unten
ist ersichtlich, dass die Pulswellengeschwindigkeit bei mittelgroßen
(nicht-sklerosierten) Arterien im Blutdruckbereich von 75-125 mmHg
zwischen etwa 4 und 8 m/s beträgt.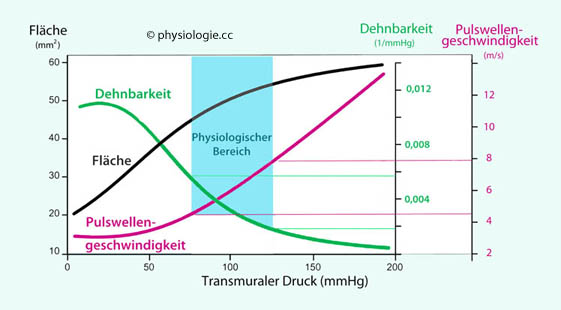
 Abbildung: Arterieller Gefäßquerschnitt (Fläche), Dehnbarkeit und Pulswellengeschwindigkeit als Funktion des Innendrucks
Abbildung: Arterieller Gefäßquerschnitt (Fläche), Dehnbarkeit und Pulswellengeschwindigkeit als Funktion des Innendrucks
 Aus
Registrierungen arterieller Pulse (Sphygmographie
Aus
Registrierungen arterieller Pulse (Sphygmographie  ) können Rückschlüsse
auf Eigenschaften der Arterienwand gezogen werden, da diese
Eigenschaften die Propagation der Druckwellen mitbestimmen. Dabei
müssen Begleitumstände berücksichtigt werden, wie z.B. die Größe des
Herzminutenvolumens, die vegetativ-neurale Aktivität, die Körperlage
u.a.
) können Rückschlüsse
auf Eigenschaften der Arterienwand gezogen werden, da diese
Eigenschaften die Propagation der Druckwellen mitbestimmen. Dabei
müssen Begleitumstände berücksichtigt werden, wie z.B. die Größe des
Herzminutenvolumens, die vegetativ-neurale Aktivität, die Körperlage
u.a. Die Messung der Pulswellengeschwindigkeit
im Aortenbereich gilt als "Goldstandard" zur Abschätzung der
Elastitität (Dehnbarkeit) des zentralen (herznahen) Arteriensystems.
Abnehmende Dehnbarkeit (Versteifung: Arteriosklerose) bewirkt ein rascheres Fortschreiten der
Druckwelle, d.h. sie erhöht die Pulswellengeschwindigkeit - sie nimmt im Durchschnitt der Population mit zunehmendem Lebensalter etwa auf das Doppelte der Werte von Kindern / Jungendlichen zu.
Die Messung der Pulswellengeschwindigkeit
im Aortenbereich gilt als "Goldstandard" zur Abschätzung der
Elastitität (Dehnbarkeit) des zentralen (herznahen) Arteriensystems.
Abnehmende Dehnbarkeit (Versteifung: Arteriosklerose) bewirkt ein rascheres Fortschreiten der
Druckwelle, d.h. sie erhöht die Pulswellengeschwindigkeit - sie nimmt im Durchschnitt der Population mit zunehmendem Lebensalter etwa auf das Doppelte der Werte von Kindern / Jungendlichen zu. Der periphere (systemische) Strömungswiderstand (total peripheral / systemic vascular resistance TPR) ist eine virtuelle Größe und berechnet sich aus dem Quotienten Druckgefälle (arterieller - venöser Druck) / Durchblutung.
Er entsteht im Wesentlichen durch die Passage des Blutes durch kleinste
arterielle Gefäße, die mit ihrer geringen inneren Weite wenig
hydraulische Leitfähigkeit bieten.
Der periphere (systemische) Strömungswiderstand (total peripheral / systemic vascular resistance TPR) ist eine virtuelle Größe und berechnet sich aus dem Quotienten Druckgefälle (arterieller - venöser Druck) / Durchblutung.
Er entsteht im Wesentlichen durch die Passage des Blutes durch kleinste
arterielle Gefäße, die mit ihrer geringen inneren Weite wenig
hydraulische Leitfähigkeit bieten.  :
: Im großen Kreislauf kann der Gesamtbetrag des Strömungswiderstandes aus der Differenz Aortendruck (z.B. 13,4 kPa) minus
Druck im rechten Vorhof (0,4 kPa) - hier also 13 kPa - dividiert durch
das Herzminutenvolumen (~6 l/min oder 0,1 l/s) - errechnet werden: In
diesem Beispiel ergibt sich ein Richtwert (SI-Einheiten) von
Im großen Kreislauf kann der Gesamtbetrag des Strömungswiderstandes aus der Differenz Aortendruck (z.B. 13,4 kPa) minus
Druck im rechten Vorhof (0,4 kPa) - hier also 13 kPa - dividiert durch
das Herzminutenvolumen (~6 l/min oder 0,1 l/s) - errechnet werden: In
diesem Beispiel ergibt sich ein Richtwert (SI-Einheiten) von Wie stark unterscheidet sich in diesem Beispiel der periphere Widerstand (Liegen vs. Stehen)?
Wie stark unterscheidet sich in diesem Beispiel der periphere Widerstand (Liegen vs. Stehen)?

 3/4 in den "Widerstandsgefäßen" (kleine Arterien, Arteriolen, Metarteriolen);
3/4 in den "Widerstandsgefäßen" (kleine Arterien, Arteriolen, Metarteriolen);  1/4 tragen die Kapillaren (Mikrozirkulation) bei.
1/4 tragen die Kapillaren (Mikrozirkulation) bei.  Der Widerstand im Lungenkreislauf ("kleinen" Kreislauf)
ist wesentlich geringer, er beträgt nur ~7% des Widerstandes im großen
Kreislauf. Physiologisch steht er vor allem unter dem Einfluss des pCO2.
Der Widerstand im Lungenkreislauf ("kleinen" Kreislauf)
ist wesentlich geringer, er beträgt nur ~7% des Widerstandes im großen
Kreislauf. Physiologisch steht er vor allem unter dem Einfluss des pCO2. Der Widerstand der arteriellen Gefäße hängt von ihrem Kontraktionszustand ab. Arteriolen sind relativ muskelstark und verfügen über einen basalen, vom Innendruck abhängigen Tonus, der aktiv erzeugt wird, also aus der Kontraktion ihrer Muskulatur stammt (myogener Tonus).
Seine Entstehung ist nicht ganz geklärt, wahrscheinlich spielen
dehnungsempfindliche Ionenkanäle eine Rolle.
Der Widerstand der arteriellen Gefäße hängt von ihrem Kontraktionszustand ab. Arteriolen sind relativ muskelstark und verfügen über einen basalen, vom Innendruck abhängigen Tonus, der aktiv erzeugt wird, also aus der Kontraktion ihrer Muskulatur stammt (myogener Tonus).
Seine Entstehung ist nicht ganz geklärt, wahrscheinlich spielen
dehnungsempfindliche Ionenkanäle eine Rolle.  In einigen Organen (wie Skelettmuskulatur, Myokard, Gehirn) sind lokale Faktoren
von führender Bedeutung für den Zustand der Widerstandsgefäße - sie
bestimmen ihre Durchblutung selbst, entsprechend dem Bedarf. In anderen
(wie Haut, Nieren, Splanchnikusorgane) ist es vorwiegend der Sympathikustonus,
der den Tonus der Arteriolen steuert - die Perfusion dieser Organe
steht im Dienste der allgemeinen Kreislaufregulation. In einem Notfall
(Zentralisation im Kreislaufschock) ist die Durchblutung von Gehirn und Herzmuskel - vor allen anderen Abnehmern - so am längsten gesichert.
In einigen Organen (wie Skelettmuskulatur, Myokard, Gehirn) sind lokale Faktoren
von führender Bedeutung für den Zustand der Widerstandsgefäße - sie
bestimmen ihre Durchblutung selbst, entsprechend dem Bedarf. In anderen
(wie Haut, Nieren, Splanchnikusorgane) ist es vorwiegend der Sympathikustonus,
der den Tonus der Arteriolen steuert - die Perfusion dieser Organe
steht im Dienste der allgemeinen Kreislaufregulation. In einem Notfall
(Zentralisation im Kreislaufschock) ist die Durchblutung von Gehirn und Herzmuskel - vor allen anderen Abnehmern - so am längsten gesichert.
 Abbildung: Gefäßdurchmesser und Strömung
Abbildung: Gefäßdurchmesser und Strömung

 Abbildung: Innendurchmesser vs. Strömungswiderstand
Abbildung: Innendurchmesser vs. Strömungswiderstand Die
Durchblutung eines Gefäßes wird im Wesentlichen über seinen Innendurchmesser
beeinflusst.
Andere Faktoren - wie Gefäßlänge oder Blutviskosität - sind vorgegebene Größen und
nicht als Stellglied zur raschen Änderung von Perfusion oder Blutdruck geeignet.
Die
Durchblutung eines Gefäßes wird im Wesentlichen über seinen Innendurchmesser
beeinflusst.
Andere Faktoren - wie Gefäßlänge oder Blutviskosität - sind vorgegebene Größen und
nicht als Stellglied zur raschen Änderung von Perfusion oder Blutdruck geeignet. Perfusionsbudget:
Die Blutdruckregulation kann mit dem Staatshaushalt verglichen werden:
Die einzelnen Ressorts geben Geld aus, das Finanzministerium muss mit
begrenzten Mitteln haushalten. Umgesetzt auf den Kreislauf: Einerseits
haben verschiedene Ressorts (Organe) Eigenbedarf
(weite Gefäße → hoher Blutstrom), andererseits ist die Geldmenge
(Blutvolumen) begrenzt, und der gesamte
periphere Widerstand muss hoch genug sein, um den Blutdruck stabil zu
halten (enge Gefäße → hoher Druck).
Perfusionsbudget:
Die Blutdruckregulation kann mit dem Staatshaushalt verglichen werden:
Die einzelnen Ressorts geben Geld aus, das Finanzministerium muss mit
begrenzten Mitteln haushalten. Umgesetzt auf den Kreislauf: Einerseits
haben verschiedene Ressorts (Organe) Eigenbedarf
(weite Gefäße → hoher Blutstrom), andererseits ist die Geldmenge
(Blutvolumen) begrenzt, und der gesamte
periphere Widerstand muss hoch genug sein, um den Blutdruck stabil zu
halten (enge Gefäße → hoher Druck). Volumen V pro Druck p - z.B. ergibt sich bei einer bestimmten
Blasenfüllung (im steady state) ein entsprechender Blaseninnendruck; oder als
Volumen V pro Druck p - z.B. ergibt sich bei einer bestimmten
Blasenfüllung (im steady state) ein entsprechender Blaseninnendruck; oder als Volumenänderung ∂V pro Druckänderung ∂p,
eine Größe, die auch ohne Kenntnis des absoluten Füllungsvolumens (z.B.
des Blutvolumens im Kreislauf) ermittelt werden kann :
Volumenänderung ∂V pro Druckänderung ∂p,
eine Größe, die auch ohne Kenntnis des absoluten Füllungsvolumens (z.B.
des Blutvolumens im Kreislauf) ermittelt werden kann :

 Abbildung: Compliance (V/p) von Aorta und V. cava
Abbildung: Compliance (V/p) von Aorta und V. cava
 Abbildung). Da
die Druck-Volumen-Kurve von Hohlorganen nichtlinear ist, nimmt die Compliance
mit zunehmender Füllung immer mehr ab (die Wände des Hohlkörpers
werden steifer).
Abbildung). Da
die Druck-Volumen-Kurve von Hohlorganen nichtlinear ist, nimmt die Compliance
mit zunehmender Füllung immer mehr ab (die Wände des Hohlkörpers
werden steifer).  Das Arteriensystem beinhaltet etwa 750 ml Blut; die arterielle
Compliance beträgt ca. 7,5 ml/kPa (1 ml / mmHg). Im Niederdrucksystem
befinden sich mehr als 4 Liter Blut; die venöse Compliance beträgt 1500
ml/kPa (200 ml / mm Hg).
Das Arteriensystem beinhaltet etwa 750 ml Blut; die arterielle
Compliance beträgt ca. 7,5 ml/kPa (1 ml / mmHg). Im Niederdrucksystem
befinden sich mehr als 4 Liter Blut; die venöse Compliance beträgt 1500
ml/kPa (200 ml / mm Hg).

 Abbildung: Kongestionsversuche zur Erforschung des venösen Kreislaufs
Abbildung: Kongestionsversuche zur Erforschung des venösen Kreislaufs
 Noch
im 16. Jahrhundert war es medizinische Lehrmeinung, dass das oszillierende Herz Blut
in den Gefäßen lediglich hin-und herbewegt, um diese zu "durchspülen";
über die Funktionsweise des Lungenkreislaufs herrschten völlig falsche
Vorstellungen.
Noch
im 16. Jahrhundert war es medizinische Lehrmeinung, dass das oszillierende Herz Blut
in den Gefäßen lediglich hin-und herbewegt, um diese zu "durchspülen";
über die Funktionsweise des Lungenkreislaufs herrschten völlig falsche
Vorstellungen. Der Gefäßtonus unterliegt dem Einfluss zahlreicher Faktoren:
Der Gefäßtonus unterliegt dem Einfluss zahlreicher Faktoren:
 Abbildung: Lokale und externe Faktoren der Gefäßsteuerung
Abbildung: Lokale und externe Faktoren der Gefäßsteuerung
 Abbildung).
Abbildung). benannt. Wird der Druck in
einer Arterie oder Arteriole plötzlich erhöht, wird sie dadurch
zunächst für einige Sekunden aufgedehnt (erhöhter Innenradius,
reduzierter Strömungswiderstand, verstärkte Blutströmung), aber dann kontrahieren die meisten Gefäße (Druckanstieg → Dehnung → Konstriktion: Barinogene
benannt. Wird der Druck in
einer Arterie oder Arteriole plötzlich erhöht, wird sie dadurch
zunächst für einige Sekunden aufgedehnt (erhöhter Innenradius,
reduzierter Strömungswiderstand, verstärkte Blutströmung), aber dann kontrahieren die meisten Gefäße (Druckanstieg → Dehnung → Konstriktion: Barinogene Kontraktion) - insbesondere in Gehirn, Nieren, Myokard (nicht in der Lunge oder Haut). Umgekehrt führt Druckerniedrigung zu Dilatation des Gefäßes (
Kontraktion) - insbesondere in Gehirn, Nieren, Myokard (nicht in der Lunge oder Haut). Umgekehrt führt Druckerniedrigung zu Dilatation des Gefäßes ( Abbildung).
Abbildung).
 Abbildung: Myogene Gefäßreaktion (Bayliss-Effekt)
Abbildung: Myogene Gefäßreaktion (Bayliss-Effekt)



 Abbildung: Calcium-abhängige Aktivierung einer Gefäßmuskelzelle
Abbildung: Calcium-abhängige Aktivierung einer Gefäßmuskelzelle
 Spannunsgesteuerte Calciumkanäle öffnen sich aufgrund einer Depolarisation, Ca++-Ionen
diffundieren aus dem Extrazellulärraum und aus dem endoplasmatischen
(sarkoplasmatischen) Retikulum in das Zytosol. Dort bindet es
(reversibel) an Calmodulin, der entstehende Komplex aktiviert die Myosin-Leichtkettenkinase.
Dieses Enzym phosphoryliert Myosin-Querbrücken, und der
Kontraktionsvorgang ist aktiviert (
Spannunsgesteuerte Calciumkanäle öffnen sich aufgrund einer Depolarisation, Ca++-Ionen
diffundieren aus dem Extrazellulärraum und aus dem endoplasmatischen
(sarkoplasmatischen) Retikulum in das Zytosol. Dort bindet es
(reversibel) an Calmodulin, der entstehende Komplex aktiviert die Myosin-Leichtkettenkinase.
Dieses Enzym phosphoryliert Myosin-Querbrücken, und der
Kontraktionsvorgang ist aktiviert ( Abbildung unten).
Abbildung unten).  Mediatoren / Transmitter lagern sich an Rezeptoren an, welche wiederum über nachgeschaltete molekulare Mechanismen (G-Protein) Calciumkanäle aktivieren und so die Zelle zur Kontraktion anregen (s. oben).
Mediatoren / Transmitter lagern sich an Rezeptoren an, welche wiederum über nachgeschaltete molekulare Mechanismen (G-Protein) Calciumkanäle aktivieren und so die Zelle zur Kontraktion anregen (s. oben).  Katecholamine: Die Kontraktion glatter Muskelzellen über α1-Adrenozeptoren erfolgt auf zwei Wegen:
Katecholamine: Die Kontraktion glatter Muskelzellen über α1-Adrenozeptoren erfolgt auf zwei Wegen: Noradrenalin dockt an den Rezeptor, aktiviert Gq-Protein, was PLC aktiviert und IP3 freisetzt; dieses wirkt auf einen IP3-Rezeptor am sarkoplasmatischen Retikulum und bewirkt Calciumfreisetzung und Aktivierung der Myosin-Leichtkettenkinase (MLCK)
Noradrenalin dockt an den Rezeptor, aktiviert Gq-Protein, was PLC aktiviert und IP3 freisetzt; dieses wirkt auf einen IP3-Rezeptor am sarkoplasmatischen Retikulum und bewirkt Calciumfreisetzung und Aktivierung der Myosin-Leichtkettenkinase (MLCK) Depolarisation (Zwischenschritte unklar) öffnet L-Typ-Calciumkanäle (→ Aktivierung MLCK)
Depolarisation (Zwischenschritte unklar) öffnet L-Typ-Calciumkanäle (→ Aktivierung MLCK) Das Oktapeptid Angiotensin II entsteht im Renin-Angiotensin-Weg und wirkt auf einen Angiotensinrezeptor; weiters über PLC, IP3 wie oben
Das Oktapeptid Angiotensin II entsteht im Renin-Angiotensin-Weg und wirkt auf einen Angiotensinrezeptor; weiters über PLC, IP3 wie oben Vasopressin
wird bei Blutdruckabfall (Barorezeptoren) oder Volumenmangel
(kardiopulmonale Rezeptoren) freigesetzt und erhöht über Wirkung
an V1A-Rezeptoren (PLC /
IP3) den Gefäßtonus - vor allem im Splanchnikusbereich. Signale von
Baro- und Volumenrezeptoren hemmen die Vasopressinausschüttung
(tonische Inhibition), Blutdruckabfall fördert die Vasopressinsekretion
(Disinhibition). Volumenmangel dominiert den Gesamteffekt auf die
Hormonfreisetzung, sodass auch bei hypotoner Dehydratation Vasopressin
trotz erniedrigter Osmolalität vermehrt ausgeschüttet wird.
Vasopressin
wird bei Blutdruckabfall (Barorezeptoren) oder Volumenmangel
(kardiopulmonale Rezeptoren) freigesetzt und erhöht über Wirkung
an V1A-Rezeptoren (PLC /
IP3) den Gefäßtonus - vor allem im Splanchnikusbereich. Signale von
Baro- und Volumenrezeptoren hemmen die Vasopressinausschüttung
(tonische Inhibition), Blutdruckabfall fördert die Vasopressinsekretion
(Disinhibition). Volumenmangel dominiert den Gesamteffekt auf die
Hormonfreisetzung, sodass auch bei hypotoner Dehydratation Vasopressin
trotz erniedrigter Osmolalität vermehrt ausgeschüttet wird. Endotheline (ET1 bis ET3) aus Endothelzellen bewirken je nach Rezeptorreizung Vasokonstriktion (ETA-Rezeptor sowie ETB2-Rezeptor) - was für die meisten Gefäße zutrifft - oder Vasodilatation (ETB1-Rezeptor). ETA-Rezeptoren überwiegen im Hochdrucksystem, ETB-Rezeptoren im Niederdrucksystem des Kreislaufs.
Endotheline (ET1 bis ET3) aus Endothelzellen bewirken je nach Rezeptorreizung Vasokonstriktion (ETA-Rezeptor sowie ETB2-Rezeptor) - was für die meisten Gefäße zutrifft - oder Vasodilatation (ETB1-Rezeptor). ETA-Rezeptoren überwiegen im Hochdrucksystem, ETB-Rezeptoren im Niederdrucksystem des Kreislaufs.  Thromboxan A2 aus Endothelien und aktivierten Blutplättchen wirkt ebenfalls über einen G-Protein-gekoppelten Rezeptor (TP-Rezeptor), der L-Typ Calciumkanäle öffnet.
Thromboxan A2 aus Endothelien und aktivierten Blutplättchen wirkt ebenfalls über einen G-Protein-gekoppelten Rezeptor (TP-Rezeptor), der L-Typ Calciumkanäle öffnet. Katecholamine und Kreislauf. Infusion mittelgroßer Dosen (10 µg/min) von Adrenalin und Noradrenalin haben unterschiedliche Wirkungen:
Katecholamine und Kreislauf. Infusion mittelgroßer Dosen (10 µg/min) von Adrenalin und Noradrenalin haben unterschiedliche Wirkungen: Noradrenalin wirkt vorwiegend über α-Rezeptoren
stark vasokonstriktorisch, der Blutdruck steigt (systolisch und
diastolisch) deutlich an. Der Baroreflex antwortet mit einer Senkung der Herzfrequenz.
Noradrenalin wirkt vorwiegend über α-Rezeptoren
stark vasokonstriktorisch, der Blutdruck steigt (systolisch und
diastolisch) deutlich an. Der Baroreflex antwortet mit einer Senkung der Herzfrequenz. Adrenalin wirkt stark an ß-Rezeptoren; dadurch steigen Schlagkraft und Herzfrequenz (ß1),
der systolische Blutdruck nimmt zu (erhöhte Herzleistung), der
diastolische Blutdruck hingegen ab (vasodilatatorischer Effekt der ß2-Rezeptoren).
Blockiert man vorher die ß-Rezeptoren, bewirkt eine Adrenalininfusion
keine Steigerung, sondern Senkung der Herzfrequenz ("Adrenalinumkehr", adrenaline reversal).
Adrenalin wirkt stark an ß-Rezeptoren; dadurch steigen Schlagkraft und Herzfrequenz (ß1),
der systolische Blutdruck nimmt zu (erhöhte Herzleistung), der
diastolische Blutdruck hingegen ab (vasodilatatorischer Effekt der ß2-Rezeptoren).
Blockiert man vorher die ß-Rezeptoren, bewirkt eine Adrenalininfusion
keine Steigerung, sondern Senkung der Herzfrequenz ("Adrenalinumkehr", adrenaline reversal).

 Abbildung: Glatte Muskelzelle: Dilatation und Konstriktion
Abbildung: Glatte Muskelzelle: Dilatation und Konstriktion CGRP = calcitonin gene-related peptide
CGRP = calcitonin gene-related peptide  GC = Guanylylcyclase
GC = Guanylylcyclase  PKA = Proteinkinase A
PKA = Proteinkinase A  PKG = Proteinkinase G
PKG = Proteinkinase G  PLC = Phospholipase C
PLC = Phospholipase C  VIP = vasoaktives intestinales Peptid
VIP = vasoaktives intestinales Peptid Zu Vasodilatation s. auch dort
Zu Vasodilatation s. auch dort bedeutet, dass Gefäße erweitert werden. Die Gefäßwand selbst kann sich
nicht aktiv erweitern; die Kraft, die zu einer Zunahme des
Innendurchmessers führt, stammt
bedeutet, dass Gefäße erweitert werden. Die Gefäßwand selbst kann sich
nicht aktiv erweitern; die Kraft, die zu einer Zunahme des
Innendurchmessers führt, stammt  aus dem Herzen (das über den Blutdruck einen positiven transmuralen Druck aufbaut, dem eine relaxierende Gefäßwand nachgeben kann - durch die Wirkung von Vasodilatantien, s. unten) oder
aus dem Herzen (das über den Blutdruck einen positiven transmuralen Druck aufbaut, dem eine relaxierende Gefäßwand nachgeben kann - durch die Wirkung von Vasodilatantien, s. unten) oder  aus
einer sonstigen Steigerung des Drucks in einem Abschnitt des
Gefäßsystems (wie bei Veränderung der Körperlage jeweils unterhalb des
betreffenden hydrostatischen Indifferenzpunktes - z.B. in den Beinen bei Wechsel von liegender zu stehender Position).
aus
einer sonstigen Steigerung des Drucks in einem Abschnitt des
Gefäßsystems (wie bei Veränderung der Körperlage jeweils unterhalb des
betreffenden hydrostatischen Indifferenzpunktes - z.B. in den Beinen bei Wechsel von liegender zu stehender Position). Mechanisch: Gesteigerte Blutströmung erhöht die Schubspannung im Endothel und löst die Freisetzung verschiedener Stoffe aus, wie Stickstoffmonoxid, Prostazyklin, EDHF und CGRP.
Mechanisch: Gesteigerte Blutströmung erhöht die Schubspannung im Endothel und löst die Freisetzung verschiedener Stoffe aus, wie Stickstoffmonoxid, Prostazyklin, EDHF und CGRP. Metabolisch: Lokale Faktoren,
die bei Aktivität von Zellen vermehrt auftreten, führen im Bedarfsfall
zu Gefäßerweiterung und Durchblutungssteigerung. Man spricht von lokal-chemischen bzw. -metabolischen Faktoren wie H+-Ionen (Azidose, Laktat), K+-Ionen, Hypoxie, CO2, Adenosin, ATP, Phosphationen, Hyperosmolalität, H2O2 (durch mitochondriale Superoxid-Dismutase aus Superoxid generiert).
In der interstitiellen
Flüssigkeit aktivierten Gewebes steigt die Konzentration all dieser Faktoren mit gefäßerweiternder Wirkung,
aber welche genau für die metabolische Hyperämie verantwortlich sind, ist
trotz eines Jahrhunderts intensiver Forschung immer noch ungewiss.
Metabolisch: Lokale Faktoren,
die bei Aktivität von Zellen vermehrt auftreten, führen im Bedarfsfall
zu Gefäßerweiterung und Durchblutungssteigerung. Man spricht von lokal-chemischen bzw. -metabolischen Faktoren wie H+-Ionen (Azidose, Laktat), K+-Ionen, Hypoxie, CO2, Adenosin, ATP, Phosphationen, Hyperosmolalität, H2O2 (durch mitochondriale Superoxid-Dismutase aus Superoxid generiert).
In der interstitiellen
Flüssigkeit aktivierten Gewebes steigt die Konzentration all dieser Faktoren mit gefäßerweiternder Wirkung,
aber welche genau für die metabolische Hyperämie verantwortlich sind, ist
trotz eines Jahrhunderts intensiver Forschung immer noch ungewiss.

 zunehmender Öffnungswahrscheinlichkeit von Ca++-Kanälen in der Membran von Endothelzellen.
zunehmender Öffnungswahrscheinlichkeit von Ca++-Kanälen in der Membran von Endothelzellen.  Der Calciumeinstrom aktiviert eine NO-Synthase
in der Zelle, diese spaltet NO von Arginin ab. Dieses kurzlebige Gas
(Halbwertszeit einige Sekunden) diffundiert zu benachbarten glatten
Muskelzellen.
Der Calciumeinstrom aktiviert eine NO-Synthase
in der Zelle, diese spaltet NO von Arginin ab. Dieses kurzlebige Gas
(Halbwertszeit einige Sekunden) diffundiert zu benachbarten glatten
Muskelzellen. Im Zytoplasma glatter Muskelzellen aktiviert NO zytosolische Guanylylcyclase. Diese bildet cGMP.
Im Zytoplasma glatter Muskelzellen aktiviert NO zytosolische Guanylylcyclase. Diese bildet cGMP. cGMP aktiviert Proteinkinase G (PKG) und diese die Myosin-Leichtketten-Phosphatase (MLCP).
cGMP aktiviert Proteinkinase G (PKG) und diese die Myosin-Leichtketten-Phosphatase (MLCP). Myosin-Leichtkettenphosphatase (MLCP) dephosphoryliert Myosin-Leichtketten und dies führt zur Relaxation der glatten Muskelzelle.
Myosin-Leichtkettenphosphatase (MLCP) dephosphoryliert Myosin-Leichtketten und dies führt zur Relaxation der glatten Muskelzelle. Hemmung der IP3-vermittelten Freisetzung von Ca++ aus intrazellulären Speichern
Hemmung der IP3-vermittelten Freisetzung von Ca++ aus intrazellulären Speichern  Phosphorylierung spannungsgesteuerter Ca++-Kanäle und damit Hemmung des Ca++-Einstroms
Phosphorylierung spannungsgesteuerter Ca++-Kanäle und damit Hemmung des Ca++-Einstroms  Phosphorylierung von Phospholamban, einem Modulator der sarkoplasmatischen Ca++-Pumpe. Im dephosphorylierten Zustand ist Phospholamban aktiv,
und es bremst die Calciumpumpe des endoplasmatischen Retikulums
(SERCA), Calciumionen verbleiben länger im Zytoplasma der angeregten
Muskelzelle und halten den kontrahierten Zustand aufrecht; wird
Phospholamban phosphoryliert (durch Proteinkinase), ist die Rückgewinnung der Calciumionen in das SERCA beschleunigt, der Muskel kann relaxieren
Phosphorylierung von Phospholamban, einem Modulator der sarkoplasmatischen Ca++-Pumpe. Im dephosphorylierten Zustand ist Phospholamban aktiv,
und es bremst die Calciumpumpe des endoplasmatischen Retikulums
(SERCA), Calciumionen verbleiben länger im Zytoplasma der angeregten
Muskelzelle und halten den kontrahierten Zustand aufrecht; wird
Phospholamban phosphoryliert (durch Proteinkinase), ist die Rückgewinnung der Calciumionen in das SERCA beschleunigt, der Muskel kann relaxieren Phosphorylierung und Öffnung Ca++-aktivierter Kaliumkanäle; die resultierende Depolarisation schließt L-Typ Ca++-Kanäle, der Ca++-Einstrom nimmt ab
Phosphorylierung und Öffnung Ca++-aktivierter Kaliumkanäle; die resultierende Depolarisation schließt L-Typ Ca++-Kanäle, der Ca++-Einstrom nimmt ab Transmuraler Druck: Der Blutdruck dehnt die Gefäßwand "passiv" auf, die Kraft stammt von der Herzaktion
Transmuraler Druck: Der Blutdruck dehnt die Gefäßwand "passiv" auf, die Kraft stammt von der Herzaktion Metabolisch (lokal): Purine (Adenosin, ADP, ATP), pCO2-Anstieg, pO2-Abfall, pH-Senkung, Anstieg extrazellulären [K+]
Metabolisch (lokal): Purine (Adenosin, ADP, ATP), pCO2-Anstieg, pO2-Abfall, pH-Senkung, Anstieg extrazellulären [K+] Endothelial: Prostazyklin, NO, EDHF (endothelium-derived hyperpolarizing factor)
Endothelial: Prostazyklin, NO, EDHF (endothelium-derived hyperpolarizing factor) Nerval: ß-adrenerg
Nerval: ß-adrenerg Humoral: Histamin, Kinine
Humoral: Histamin, Kinine cAMP-PKA-mediiert: Arteriolen in Skelettmuskel, Myokard und Leber sind reich an ß-Adrenozeptoren, die - wie auch Adenosin- (A2A), Histamin- (H2) und Prostazyklinrezeptoren (EP4) - wenn aktiviert - die Aktivität an Proteinkinase A erhöhen und dadurch
cAMP-PKA-mediiert: Arteriolen in Skelettmuskel, Myokard und Leber sind reich an ß-Adrenozeptoren, die - wie auch Adenosin- (A2A), Histamin- (H2) und Prostazyklinrezeptoren (EP4) - wenn aktiviert - die Aktivität an Proteinkinase A erhöhen und dadurch  Phospholamban phosphoryliert (inaktiviert) und so das "Abpumpen" von Ca++ in das sarkoplasmatische Retikulum fördert,
Phospholamban phosphoryliert (inaktiviert) und so das "Abpumpen" von Ca++ in das sarkoplasmatische Retikulum fördert, verschiedene Kaliumkanäle phosporyliert und so ihre Öffnungswahrscheinlichkeit erhöht (Kaliumausstrom → Hyperpolarisierung),
verschiedene Kaliumkanäle phosporyliert und so ihre Öffnungswahrscheinlichkeit erhöht (Kaliumausstrom → Hyperpolarisierung), die Leichtkettenphosphatase MLCP phosphoryliert / aktiviert und damit eine Entkoppelung des Kontraktionsmechanismus (Relaxation) bewirkt
die Leichtkettenphosphatase MLCP phosphoryliert / aktiviert und damit eine Entkoppelung des Kontraktionsmechanismus (Relaxation) bewirkt cGMP/PKG-mediiert: Stickstoffmonoxid (NO) und atriale natriuretische Peptide (ANP)
aktivieren über cGMP die Proteinkinase G (PKG). Diese öffnet
calciumaktivierte Kaliumkanäle und hyperpolarisiert glatte
Muskelzellen, was bei Arteriolen zu Widerstandssenkung und Reduktion
des arteriellen Drucks führt. Auch senkt es durch Blockade der
Phospholipase C die 3 IP3-bedingte Freisetzung intrazellulär gespeicherter Calciumionen, was den Gefäßmuskeltonus weiter senkt.
cGMP/PKG-mediiert: Stickstoffmonoxid (NO) und atriale natriuretische Peptide (ANP)
aktivieren über cGMP die Proteinkinase G (PKG). Diese öffnet
calciumaktivierte Kaliumkanäle und hyperpolarisiert glatte
Muskelzellen, was bei Arteriolen zu Widerstandssenkung und Reduktion
des arteriellen Drucks führt. Auch senkt es durch Blockade der
Phospholipase C die 3 IP3-bedingte Freisetzung intrazellulär gespeicherter Calciumionen, was den Gefäßmuskeltonus weiter senkt. Durch sinkende Empfindlichkeit (Desensibilisierung) gegenüber Ca++, was durch reduzierte Phosphorylierung des Myosins bei Hypoxie erfolgen kann
Durch sinkende Empfindlichkeit (Desensibilisierung) gegenüber Ca++, was durch reduzierte Phosphorylierung des Myosins bei Hypoxie erfolgen kann Durch vasodilatierende Mediatoren wie Kinine, Histamin, NO, Prostacyclin, EDHF, CGRP
Durch vasodilatierende Mediatoren wie Kinine, Histamin, NO, Prostacyclin, EDHF, CGRP Durch spezielle autonome Einflüsse:
Durch spezielle autonome Einflüsse:  ß-adrenerg: Zirkulierendes Adrenalin kann auf diesem Wege (Sympathikus → Nebennierenmark (Sympathikus → Adrenalinausschüttung) bei mentalem Stress Vasodilatation in Muskeln (z.B. des Unterarmes) bewirken (alerting response). Beteiligt ist an dieser Reaktion auch ein Nachlassen der Aktivität vasokonstriktorisch wirkender sympathischer Fasern.
ß-adrenerg: Zirkulierendes Adrenalin kann auf diesem Wege (Sympathikus → Nebennierenmark (Sympathikus → Adrenalinausschüttung) bei mentalem Stress Vasodilatation in Muskeln (z.B. des Unterarmes) bewirken (alerting response). Beteiligt ist an dieser Reaktion auch ein Nachlassen der Aktivität vasokonstriktorisch wirkender sympathischer Fasern. Cholinerg - sympathisch:
Schweißdrüsen sind mit cholinergen (sudomotorischen) sympathischen
Fasern innerviert. Diese begünstigen kutane Vasodilatation und
Schweißproduktion. Das freigesetzte Acetylcholin veranlasst
Endothelzellen zur Produktion von Prostazyklin (PGI2) und endothelialem hyperpolarisierendem Faktor (EDHF), VIP sowie NO.
Cholinerg - sympathisch:
Schweißdrüsen sind mit cholinergen (sudomotorischen) sympathischen
Fasern innerviert. Diese begünstigen kutane Vasodilatation und
Schweißproduktion. Das freigesetzte Acetylcholin veranlasst
Endothelzellen zur Produktion von Prostazyklin (PGI2) und endothelialem hyperpolarisierendem Faktor (EDHF), VIP sowie NO. Parasympathisch:
Hirnnerven dilatieren arterielle Gefäße in Gehirn, Herzmuskel,
Speicheldrüsen, Pankreas (exokrin) und gastrointestinale Mukosa;
parasympathische Fasern aus dem Sakralmark in Genitalien, Blase und
Colon. Die aus der peripheren ganglionären Umschaltung entspringenden,
kurzen postganglionären Fasern haben (so wie sympathische) Varikositäten, aus denen die Transmitter freigesetzt werden: Acetylcholin (M3-Rezeptoren),
VIP, Substanz P und/oder NO.
Parasympathisch:
Hirnnerven dilatieren arterielle Gefäße in Gehirn, Herzmuskel,
Speicheldrüsen, Pankreas (exokrin) und gastrointestinale Mukosa;
parasympathische Fasern aus dem Sakralmark in Genitalien, Blase und
Colon. Die aus der peripheren ganglionären Umschaltung entspringenden,
kurzen postganglionären Fasern haben (so wie sympathische) Varikositäten, aus denen die Transmitter freigesetzt werden: Acetylcholin (M3-Rezeptoren),
VIP, Substanz P und/oder NO. 
 Phosphorylierung der MLCK (was diese hemmt und die Interaktion zwischen Aktin und Myosin reduziert),
Phosphorylierung der MLCK (was diese hemmt und die Interaktion zwischen Aktin und Myosin reduziert), Phosphorylierung der SERCA-Calciumpumpe (was diese anregt, den sarkoplasmatischen Calciumspiegel senkt),
Phosphorylierung der SERCA-Calciumpumpe (was diese anregt, den sarkoplasmatischen Calciumspiegel senkt), Phosphorylierung calciumabhängiger Kaliumkanäle (was diese anregt und die Zelle hyperpolarisiert),
Phosphorylierung calciumabhängiger Kaliumkanäle (was diese anregt und die Zelle hyperpolarisiert), NO ist einer der bedeutendsten Vasodilatatoren (Nitrate wie
Nitroglyzerin werden in Akutsituationen verwendet, um über
das entstehende NO Gefäße zu weiten, z.B. bei Angina pectoris).
NO ist einer der bedeutendsten Vasodilatatoren (Nitrate wie
Nitroglyzerin werden in Akutsituationen verwendet, um über
das entstehende NO Gefäße zu weiten, z.B. bei Angina pectoris). Einfluss auf den Ruhetonus, Reduktion während der Schwangerschaft (erniedrigter Blutdruck trotz eines um bis zu 50% gesteigerten Herzminutenvolumens)
Einfluss auf den Ruhetonus, Reduktion während der Schwangerschaft (erniedrigter Blutdruck trotz eines um bis zu 50% gesteigerten Herzminutenvolumens) Strömungsabhängige Vasodilatation bei Muskelarbeit
(reduzierter peripherer Widerstand im Bereich der aktiven Muskeln
steigert die Blutströmung und damit die Schubspannung am Endothel des
versorgenden Gefäßes)
Strömungsabhängige Vasodilatation bei Muskelarbeit
(reduzierter peripherer Widerstand im Bereich der aktiven Muskeln
steigert die Blutströmung und damit die Schubspannung am Endothel des
versorgenden Gefäßes) Vasodilatation durch cholinerge parasympathische Fasern (Erektion)
Vasodilatation durch cholinerge parasympathische Fasern (Erektion) Besondere Bedeutung hat Prostacyclin für die Erschlaffung der Pulmonalarterie bei Neugeborenen.
Besondere Bedeutung hat Prostacyclin für die Erschlaffung der Pulmonalarterie bei Neugeborenen. Für die Umwandlung von Arachidonsäure in Prostaglandine braucht man Cyclooxygenasen (COX: Cyclooxygenase);
wird diese medikamentös gehemmt (COX-Hemmer zur Dämpfung entzündlicher
Prozesse), sinkt die Produktion von Prostazyklin.
Für die Umwandlung von Arachidonsäure in Prostaglandine braucht man Cyclooxygenasen (COX: Cyclooxygenase);
wird diese medikamentös gehemmt (COX-Hemmer zur Dämpfung entzündlicher
Prozesse), sinkt die Produktion von Prostazyklin.
 Abbildung: Endothelabhängige Muskelrelaxation
Abbildung: Endothelabhängige Muskelrelaxation
 Abbildung). EDHF wird durch Erhöhung
der Schubspannung aus dem Endothel freigesetzt - vor allem in kleinen
Arterien und in Arteriolen. EDHF überträgt den hyperpolarisierenden Effekt
über Aktivierung von Ionenkanälen und über direkte Kontakte zwischen
Endothel- und Muskelzellen.
Abbildung). EDHF wird durch Erhöhung
der Schubspannung aus dem Endothel freigesetzt - vor allem in kleinen
Arterien und in Arteriolen. EDHF überträgt den hyperpolarisierenden Effekt
über Aktivierung von Ionenkanälen und über direkte Kontakte zwischen
Endothel- und Muskelzellen.
 Abbildung: Kallikrein-Kinin-System
Abbildung: Kallikrein-Kinin-System
 Bradykinin (bestehend aus 9 Aminosäuren) entsteht
Bradykinin (bestehend aus 9 Aminosäuren) entsteht  im Plasma durch Einwirken der Serinprotease Kallikrein (Plasmakallikrein) aus dem α-Globulin Kininogen (zwei Fraktionen: Molekulargewicht 70 - niedermolekulares
Kininogen LMWK - und 110 kDa - hochmolekulares HMWK) und hat 9 Aminosäuren. Kallikrein entsteht aus der Vorstufe Präkallikrein durch Einwirken aktivierten Hageman-Faktors (F. XII der Blutgerinnung) und kann auch das Komplementsystem aktivieren.
im Plasma durch Einwirken der Serinprotease Kallikrein (Plasmakallikrein) aus dem α-Globulin Kininogen (zwei Fraktionen: Molekulargewicht 70 - niedermolekulares
Kininogen LMWK - und 110 kDa - hochmolekulares HMWK) und hat 9 Aminosäuren. Kallikrein entsteht aus der Vorstufe Präkallikrein durch Einwirken aktivierten Hageman-Faktors (F. XII der Blutgerinnung) und kann auch das Komplementsystem aktivieren.  im Gewebe durch andere Isoenzyme (Gewebekallikreine in Pankreas, Speicheldrüsen, Dickdarm, Haut)
im Gewebe durch andere Isoenzyme (Gewebekallikreine in Pankreas, Speicheldrüsen, Dickdarm, Haut) Kallidin (Lysyl-Bradykinin) entsteht im Gewebe und hat 10 Aminosäuren
Kallidin (Lysyl-Bradykinin) entsteht im Gewebe und hat 10 Aminosäuren Methionyl-Lysyl-Bradykinin findet sich im Harn.
Methionyl-Lysyl-Bradykinin findet sich im Harn.  Die Kinine werden durch Kininasen (Kininase I und II) wieder abgebaut.
Die Kinine werden durch Kininasen (Kininase I und II) wieder abgebaut.  s. dort);
dieses Enzym inaktiviert einen Vasodilator (Kinin) und aktiviert einen
Vasokonstriktor (Angiotensin II), wirkt also in doppelter Weise
blutdrucksteigernd.
s. dort);
dieses Enzym inaktiviert einen Vasodilator (Kinin) und aktiviert einen
Vasokonstriktor (Angiotensin II), wirkt also in doppelter Weise
blutdrucksteigernd.
 Abbildung: Kininsystem
Abbildung: Kininsystem ECE, Endothelin-converting enzyme, Protease, die aus Präpro-Endothelinen Endothelin freisetzt
ECE, Endothelin-converting enzyme, Protease, die aus Präpro-Endothelinen Endothelin freisetzt  NEP, Neprilysin (=Neutrale Endopeptidase, Membran-Metallo-Endopeptidase), baut Peptidhormone ab
NEP, Neprilysin (=Neutrale Endopeptidase, Membran-Metallo-Endopeptidase), baut Peptidhormone ab  PI-PLC, Phosphatidylinositol-spezifische Phospholipase C, spaltet Protein von Phosphatidylinositol ab
PI-PLC, Phosphatidylinositol-spezifische Phospholipase C, spaltet Protein von Phosphatidylinositol ab

 Abbildung):
Abbildung): B1-Rezeptoren werden normalerweise nur in sehr geringer Menge exprimiert und treten vor allem im Rahmen von Entzündungen
auf (via Wirkung von Interleukin 1), aktivieren Leukozyten und bewirken die Freisetzung von
Prostaglandinen und NO, Vasodilatation und gegebenenfalls chronischen Schmerz . Diese Rezeptoren reagieren auf desargininierte Kininformen (Des-Arg9-Bradykinin, Des-Arg-Kallidin,
B1-Rezeptoren werden normalerweise nur in sehr geringer Menge exprimiert und treten vor allem im Rahmen von Entzündungen
auf (via Wirkung von Interleukin 1), aktivieren Leukozyten und bewirken die Freisetzung von
Prostaglandinen und NO, Vasodilatation und gegebenenfalls chronischen Schmerz . Diese Rezeptoren reagieren auf desargininierte Kininformen (Des-Arg9-Bradykinin, Des-Arg-Kallidin,  Abbildung oben).
Abbildung oben).
 B2-Rezeptoren sind konstitutiv, sie werden von den meisten Zellen exprimiert und reagieren vor allem auf Bradykinin (nicht auf die Des-Arg-Formen der Kinine). Gq regt die PLC an und steigert [Ca++] im Zytoplasma, Gi inhibiert die Adenylylcyclase und senkt [cAMP]. Auch wird der MAP-Kinase-Mechanismus aktiviert. B2-Rezeptoren bewirken die Mehrzahl der Bradykinineffekte - u.a.
B2-Rezeptoren sind konstitutiv, sie werden von den meisten Zellen exprimiert und reagieren vor allem auf Bradykinin (nicht auf die Des-Arg-Formen der Kinine). Gq regt die PLC an und steigert [Ca++] im Zytoplasma, Gi inhibiert die Adenylylcyclase und senkt [cAMP]. Auch wird der MAP-Kinase-Mechanismus aktiviert. B2-Rezeptoren bewirken die Mehrzahl der Bradykinineffekte - u.a.
 Vasodilatation (über endotheliales NO) - direkte Wirkung an glatten Muskelzellen kann über gesteigertes intrazelluläres [Ca++] konstriktorisch
sein,
Vasodilatation (über endotheliales NO) - direkte Wirkung an glatten Muskelzellen kann über gesteigertes intrazelluläres [Ca++] konstriktorisch
sein, 
 Natriumausscheidung in der Niere (erhöhte Durchblutung, Hemmung
der Resorption im Sammelrohr),
Natriumausscheidung in der Niere (erhöhte Durchblutung, Hemmung
der Resorption im Sammelrohr), 
 Freisetzung von Mediatoren
Freisetzung von Mediatoren 
 akuten Schmerz.
akuten Schmerz.
 erhöhte Gefäßpermeabilität,
erhöhte Gefäßpermeabilität, 
 hemmen die
Plättchenaggregation,
hemmen die
Plättchenaggregation, 
 triggern bei direkter Einwirkung Kontraktion
glatter Muskeln (Bronchien, Darm, Uterus),
triggern bei direkter Einwirkung Kontraktion
glatter Muskeln (Bronchien, Darm, Uterus), 
 wirken als Radikalfänger,
wirken als Radikalfänger,
 stellen den fetalen Kreislauf auf postpartale Verhältnisse um (Schließen des ductus arteriosus, Kontraktion der Nabelgefäße, Dilatation der Pulmonalarterie).
stellen den fetalen Kreislauf auf postpartale Verhältnisse um (Schließen des ductus arteriosus, Kontraktion der Nabelgefäße, Dilatation der Pulmonalarterie).

 Systemisch
ist ein vasodilatatorisches System (als Gegenpol zum
vasokonstriktorischen Sympathikus) nicht notwendig, da der Blutdruck
überall gefäßerweiternd wirkt und vasodilatatorische Mechanismen lokal
verfügbar sind. Das erklärt, warum Blutgefäße auf
parasympathische Versorgung weitgehend verzichten können (Ausnahme:
Schwellkörperfüllung, Steigerung der Koronardurchblutung, vielleicht
auch der Durchblutung der Skelettmuskulatur).
Systemisch
ist ein vasodilatatorisches System (als Gegenpol zum
vasokonstriktorischen Sympathikus) nicht notwendig, da der Blutdruck
überall gefäßerweiternd wirkt und vasodilatatorische Mechanismen lokal
verfügbar sind. Das erklärt, warum Blutgefäße auf
parasympathische Versorgung weitgehend verzichten können (Ausnahme:
Schwellkörperfüllung, Steigerung der Koronardurchblutung, vielleicht
auch der Durchblutung der Skelettmuskulatur).

 Durch den Zusatz von Adrenalin und Noradrenalin zu Lokalanästhetika-Lösungen
verbleibt das Pharmakon infolge der verringerten Durchblutung
länger am Wirkort; gleichzeitig sinkt dessen systemische Toxizität.
Adrenalinapplikation kann Herzrasen verursachen (ß1-Rezeptoren!).
Durch den Zusatz von Adrenalin und Noradrenalin zu Lokalanästhetika-Lösungen
verbleibt das Pharmakon infolge der verringerten Durchblutung
länger am Wirkort; gleichzeitig sinkt dessen systemische Toxizität.
Adrenalinapplikation kann Herzrasen verursachen (ß1-Rezeptoren!). Bei schwerer Anaphylaxie mit Kreislaufschock und Kehlkopfödem kann Adrenalin
verabreicht werden, insbesondere um einen vasokonstriktorischen Effekt
zu bewirken und Blut aus dem Niederdrucksystem zu mobilisieren.
Bei schwerer Anaphylaxie mit Kreislaufschock und Kehlkopfödem kann Adrenalin
verabreicht werden, insbesondere um einen vasokonstriktorischen Effekt
zu bewirken und Blut aus dem Niederdrucksystem zu mobilisieren.
 Das Herz transportiert bis zu ~10.000 Liter Blut pro Tag, gegen einen Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel), und konsumiert dabei ~10% der Stoffwechselenergie des Körpers.
Das Blutvolumen beträgt 5-10% des Körpergewichts (bei 70 kg KG ~5 Liter) und wird mittels Indikatorverdünnung bestimmt: Je größer das
Volumen, desto stärker wird der Indikator verdünnt → niedrige
Konzentration. Die verwendete Substanz muss ungiftig, verlässlich messbar sein und während der Messdauer im Blutkreislauf
verbleiben (Bindung an Protein oder Erythrozyten). Als effektives Blutvolumen gilt die funktionelle Füllungsreserve des rechten, als zentrales Blutvolumen
(zwischen Pulmonal- und Aortenklappe) des linken Herzens
Das Herz transportiert bis zu ~10.000 Liter Blut pro Tag, gegen einen Druck von ~2 kPa (rechter Ventrikel) bzw. ~13 kPa (linker Ventrikel), und konsumiert dabei ~10% der Stoffwechselenergie des Körpers.
Das Blutvolumen beträgt 5-10% des Körpergewichts (bei 70 kg KG ~5 Liter) und wird mittels Indikatorverdünnung bestimmt: Je größer das
Volumen, desto stärker wird der Indikator verdünnt → niedrige
Konzentration. Die verwendete Substanz muss ungiftig, verlässlich messbar sein und während der Messdauer im Blutkreislauf
verbleiben (Bindung an Protein oder Erythrozyten). Als effektives Blutvolumen gilt die funktionelle Füllungsreserve des rechten, als zentrales Blutvolumen
(zwischen Pulmonal- und Aortenklappe) des linken Herzens Hämodynamik
beschreibt Wechselwirkungen zwischen Volumen, Druck, Blutströmung und
Eigenschaften der Gefäßwände für den Kreislauf als geschlossenes hydrodynamisches System. Sie erklärt Phänomene bei Änderung des Blutvolumens (Hämorrhagie, Transfusion), der Körperlage oder der Durchblutung von Teilkreisläufen. Der Unterschied zwischen Innen- und Außendruck an der Gefäßwand (transmuraler Druck: Blutdruck minus Gewebedruck) bestimmt
deren Dehnung und damit auch den Gefäßwiderstand. Steigt der
transmurale Druck, wird das Gefäß gedehnt, sein Durchmesser nimmt zu. Der höchste Druck (hohe Wandspannung) herrscht
in den Arterien (reich an Elastin). Den größten Anteil des Strömungswiderstandes im
Kreislauf bieten kleine Arterien und Arteriolen (>50% glatte Muskulatur; terminale
Arteriolen steuern die Durchblutung entsprechend dem
lokalen Bedarf). Kapillaren (~1 mm lang, ~95% Endothel) haben
den größten Gesamtquerschnitt; Blut durchströmt sie mit ~1 mm/s, der Druck sinkt um ~20 mmHg; Blutkörperchen
verformen sich entsprechend dem Strömungsprofil, was den Reibungswiderstand minimiert
Hämodynamik
beschreibt Wechselwirkungen zwischen Volumen, Druck, Blutströmung und
Eigenschaften der Gefäßwände für den Kreislauf als geschlossenes hydrodynamisches System. Sie erklärt Phänomene bei Änderung des Blutvolumens (Hämorrhagie, Transfusion), der Körperlage oder der Durchblutung von Teilkreisläufen. Der Unterschied zwischen Innen- und Außendruck an der Gefäßwand (transmuraler Druck: Blutdruck minus Gewebedruck) bestimmt
deren Dehnung und damit auch den Gefäßwiderstand. Steigt der
transmurale Druck, wird das Gefäß gedehnt, sein Durchmesser nimmt zu. Der höchste Druck (hohe Wandspannung) herrscht
in den Arterien (reich an Elastin). Den größten Anteil des Strömungswiderstandes im
Kreislauf bieten kleine Arterien und Arteriolen (>50% glatte Muskulatur; terminale
Arteriolen steuern die Durchblutung entsprechend dem
lokalen Bedarf). Kapillaren (~1 mm lang, ~95% Endothel) haben
den größten Gesamtquerschnitt; Blut durchströmt sie mit ~1 mm/s, der Druck sinkt um ~20 mmHg; Blutkörperchen
verformen sich entsprechend dem Strömungsprofil, was den Reibungswiderstand minimiert Die Intima ist die wichtigste Abdichtung gegen Verlust von Plasma und
bildet vasoaktive Substanzen, z.B. Stickstoffmonoxid. Das Endothel (Wandfläche insgesamt >100 m2) kommuniziert mittels Zellfortsätzen mit Muskelzellen in der Media.
Die Media
verleiht strukturelle Festigkeit (Kollagen, Elastin) und
Kontraktionsvermögen (glatte Muskelfasern). Die Adventitia beinhaltet
sympathische Varikositäten und in größeren Gefäßen vasa vasorum für die
Versorgung der Media. Extremitätenvenen enthalten auch Schmerzfasern. Das Laplace-Gesetz beschreibt die
Beziehung zwischen Wanddicke, Wandspannung und transmuralem Druck: Dehnung der Gefäßwand nimmt mit Druckbelastung und
Gefäßdurchmesser zu, mit dem Wanddurchmesser ab.
Kontraktion der Muskelschicht entlastet die bindegewebigen
Elemente. Bei Vasodilatation nimmt der Gefäßradius - und damit die Dehnung der Elastin- und Kollagenfasern - zu
Die Intima ist die wichtigste Abdichtung gegen Verlust von Plasma und
bildet vasoaktive Substanzen, z.B. Stickstoffmonoxid. Das Endothel (Wandfläche insgesamt >100 m2) kommuniziert mittels Zellfortsätzen mit Muskelzellen in der Media.
Die Media
verleiht strukturelle Festigkeit (Kollagen, Elastin) und
Kontraktionsvermögen (glatte Muskelfasern). Die Adventitia beinhaltet
sympathische Varikositäten und in größeren Gefäßen vasa vasorum für die
Versorgung der Media. Extremitätenvenen enthalten auch Schmerzfasern. Das Laplace-Gesetz beschreibt die
Beziehung zwischen Wanddicke, Wandspannung und transmuralem Druck: Dehnung der Gefäßwand nimmt mit Druckbelastung und
Gefäßdurchmesser zu, mit dem Wanddurchmesser ab.
Kontraktion der Muskelschicht entlastet die bindegewebigen
Elemente. Bei Vasodilatation nimmt der Gefäßradius - und damit die Dehnung der Elastin- und Kollagenfasern - zu Gelegentlich
ist der transmurale Druck in Arterien negativ, z.B. systolisch bei
linksventrikulären subendokardialen Gefäßen
(Durchblutung während der Diastole); im Lungenkreislauf sind apikale
Regionen in aufrechter Lage nur während der systolischen
Blutdruckspitzen geöffnet. Arteriolen können ihren Durchmesser aktiv
besonders stark verändern. Venen speichern >50% des Blutvolumens (Kapazitätsgefäße) und sind teils stark mit Blut gefüllt (in den Beinen im
Stehen), teils kollabiert. Aktivität
sympathischer Fasern steigert den Innendruck und erhöht das Blutangebot
an das Herz (Vorlast), assistiert von Venenklappen ("Muskelpumpe"). Im Stehen
ist der hydrostatische Druck über die Längsachse des Körpers
unterschiedlich, Lagewechsel bedingt Volumenverschiebungen und
Veränderungen des Herzzeitvolumens (Stehen ~5 l/min, Liegen ~7 l/min). Bei 45°-Lagerung liegt der
Kollapspunkt der Jugularvene
~2
cm über dem Sternum. Venen sind bis zu einem Punkt, an dem sich die
Kollagenfasern scherengitterartig formieren, sehr gut dehnbar
Gelegentlich
ist der transmurale Druck in Arterien negativ, z.B. systolisch bei
linksventrikulären subendokardialen Gefäßen
(Durchblutung während der Diastole); im Lungenkreislauf sind apikale
Regionen in aufrechter Lage nur während der systolischen
Blutdruckspitzen geöffnet. Arteriolen können ihren Durchmesser aktiv
besonders stark verändern. Venen speichern >50% des Blutvolumens (Kapazitätsgefäße) und sind teils stark mit Blut gefüllt (in den Beinen im
Stehen), teils kollabiert. Aktivität
sympathischer Fasern steigert den Innendruck und erhöht das Blutangebot
an das Herz (Vorlast), assistiert von Venenklappen ("Muskelpumpe"). Im Stehen
ist der hydrostatische Druck über die Längsachse des Körpers
unterschiedlich, Lagewechsel bedingt Volumenverschiebungen und
Veränderungen des Herzzeitvolumens (Stehen ~5 l/min, Liegen ~7 l/min). Bei 45°-Lagerung liegt der
Kollapspunkt der Jugularvene
~2
cm über dem Sternum. Venen sind bis zu einem Punkt, an dem sich die
Kollagenfasern scherengitterartig formieren, sehr gut dehnbar Druckgradienten
und Masseträgheit bestimmen die Strömung von Blut. Je größer der
Druckunterschied und je kleiner der Strömungswiderstand, desto stärker die Strömung (analog Ohm'sches Gesetz). Für den gesamten Kreislauf gilt: Arterieller Mitteldruck ~ Herzzeitvolumen x peripherer Widerstand (TPR). Bis zu kleinen
Arterien sinkt der mittlere Druck im Arteriensystem kaum, der
Strömungswiderstand ist gering; der periphere Widerstand liegt im
Bereich der Arteriolen. Je enger ein Gefäß (Poiseuille: R~1/r4), desto geringer seine
Perfusion
Druckgradienten
und Masseträgheit bestimmen die Strömung von Blut. Je größer der
Druckunterschied und je kleiner der Strömungswiderstand, desto stärker die Strömung (analog Ohm'sches Gesetz). Für den gesamten Kreislauf gilt: Arterieller Mitteldruck ~ Herzzeitvolumen x peripherer Widerstand (TPR). Bis zu kleinen
Arterien sinkt der mittlere Druck im Arteriensystem kaum, der
Strömungswiderstand ist gering; der periphere Widerstand liegt im
Bereich der Arteriolen. Je enger ein Gefäß (Poiseuille: R~1/r4), desto geringer seine
Perfusion Die Aorta wandelt
~75%
der systolischen kinetischen Energie (Beschleunigung der Blutsäule) in
potentielle Energie um, sie wird anschließend in kinetische Energie
zurückverwandelt (zwischengespeichertes Blut weiterbefördert). Dieser
Windkesseleffekt hält die
Blutdruckamplitude gering (z.B. 120/80). Die Druckwelle
(Pulswellengeschwindigkeit: zentral ~4 m/s, peripher bis 10 m/s; steigt
mit sinkender Dehnbarkeit der Gefäßwände) läuft antegrad in die
Peripherie und durch Reflexion zum Herzen zurück (retrograd) - viel
schneller als die Strömung (Aorta 0,2 m/s).
An verschiedenen Stellen des Arteriensystems resultieren
unterschiedliche Pulswellenformen - diese sind meist dikrot und
verlaufen gegen Ende eines Druckzyklus flacher als zu dessen Beginn.
Der systolische Druck gilt als Maß für das Schlagvolumen, der
diastolische für den peripheren Widerstand. Der arterielle Mitteldruck
ist durch Herzminutenvolumen und peripheren Widerstand bestimmt, die
Blutdruckamplitude durch Schlagvolumen, Pulsfrequenz und arterielle
Compliance. Je größer das Schlagvolumen und je geringer die Compliance, desto größer die Blutdruckamplitude. Die
Druck-Volumen-Beziehung der Gefäße ist nichtlinear (sinkende Compliance
mit zunehmendem Innendruck)
Die Aorta wandelt
~75%
der systolischen kinetischen Energie (Beschleunigung der Blutsäule) in
potentielle Energie um, sie wird anschließend in kinetische Energie
zurückverwandelt (zwischengespeichertes Blut weiterbefördert). Dieser
Windkesseleffekt hält die
Blutdruckamplitude gering (z.B. 120/80). Die Druckwelle
(Pulswellengeschwindigkeit: zentral ~4 m/s, peripher bis 10 m/s; steigt
mit sinkender Dehnbarkeit der Gefäßwände) läuft antegrad in die
Peripherie und durch Reflexion zum Herzen zurück (retrograd) - viel
schneller als die Strömung (Aorta 0,2 m/s).
An verschiedenen Stellen des Arteriensystems resultieren
unterschiedliche Pulswellenformen - diese sind meist dikrot und
verlaufen gegen Ende eines Druckzyklus flacher als zu dessen Beginn.
Der systolische Druck gilt als Maß für das Schlagvolumen, der
diastolische für den peripheren Widerstand. Der arterielle Mitteldruck
ist durch Herzminutenvolumen und peripheren Widerstand bestimmt, die
Blutdruckamplitude durch Schlagvolumen, Pulsfrequenz und arterielle
Compliance. Je größer das Schlagvolumen und je geringer die Compliance, desto größer die Blutdruckamplitude. Die
Druck-Volumen-Beziehung der Gefäße ist nichtlinear (sinkende Compliance
mit zunehmendem Innendruck)  Der Gefäßtonus entspricht einer definierten Druck-Volumen-Charakteristik und steht unter dem Einfluss zahlreicher Faktoren: Autoregulation der Durchblutung (Gehirn, Myokard, Nieren); lokale vasoaktive Substanzen (Adenosin, NO, Endothelin); extrinsische - autonom-nervöse (Sympathikus), endokrine (Adrenalin, Vasopressin, Angiotensin), Dehnung (Bayliss-Effekt), Temperatur (Lewis-Reaktion). Große Gefäße
reagieren vor allem auf Belastung des Endothels über Schubspannung
(Blutströmung) und auf
Axonreflexe (aszendierende Vasodilatation). Sympathische Effekte sowie myogene Antworten (Bayliss) wirken vor allem an Widerstandsgefäßen. Der myogene
Mechanismus funktioniert über dehnungsbedingte Depolarisierung und
Ca++-Einstrom; erhöhte
Strömungsbelastung des Endothels begrenzt die Kontraktion (NO,
endothelbedingte Hyperpolarisierung): Autoregulation von Durchblutung und kapillärem Druck in Gehirn, Leber,
Milz und Darm, Stabilisierung der Perfusion in
Nieren und Herzmuskel. In
Gehirn und quergestreifter Muskulatur steigt die Perfusion linear mit
dem Sauerstoffverbrauch (metabolische Vasodilatation). Periphere
Vasodilatation erhöht die Blutströmung in größeren Arterien, führt zu
endothelial bedingter Hyperpolarisierung und Dilatation der
größeren Gefäße
Der Gefäßtonus entspricht einer definierten Druck-Volumen-Charakteristik und steht unter dem Einfluss zahlreicher Faktoren: Autoregulation der Durchblutung (Gehirn, Myokard, Nieren); lokale vasoaktive Substanzen (Adenosin, NO, Endothelin); extrinsische - autonom-nervöse (Sympathikus), endokrine (Adrenalin, Vasopressin, Angiotensin), Dehnung (Bayliss-Effekt), Temperatur (Lewis-Reaktion). Große Gefäße
reagieren vor allem auf Belastung des Endothels über Schubspannung
(Blutströmung) und auf
Axonreflexe (aszendierende Vasodilatation). Sympathische Effekte sowie myogene Antworten (Bayliss) wirken vor allem an Widerstandsgefäßen. Der myogene
Mechanismus funktioniert über dehnungsbedingte Depolarisierung und
Ca++-Einstrom; erhöhte
Strömungsbelastung des Endothels begrenzt die Kontraktion (NO,
endothelbedingte Hyperpolarisierung): Autoregulation von Durchblutung und kapillärem Druck in Gehirn, Leber,
Milz und Darm, Stabilisierung der Perfusion in
Nieren und Herzmuskel. In
Gehirn und quergestreifter Muskulatur steigt die Perfusion linear mit
dem Sauerstoffverbrauch (metabolische Vasodilatation). Periphere
Vasodilatation erhöht die Blutströmung in größeren Arterien, führt zu
endothelial bedingter Hyperpolarisierung und Dilatation der
größeren Gefäße Vasopressin wird bei Blutdruckabfall (Barorezeptoren), Volumenmangel (kardiopulmonale Rezeptoren) oder anderen Belastungssituationen freigesetzt (zentrale Disinhibition) und
erhöht den Gefäßtonus vor allem im Splanchnikusbereich. Volumenmangel
dominiert den Gesamteffekt auf die Hormonfreisetzung, sodass auch bei
hypotoner Dehydratation Vasopressin trotz erniedrigter Osmolalität
vermehrt ausgeschüttet wird. Vasopressin wirkt volumensteigernd,
gefäßverengend, blutdrucksteigernd. Endotheline bewirken Vasokonstriktion (ETA-Rezeptor) oder Vasodilatation (ETB-Rezeptor). Noradrenalin wirkt vorwiegend über α-Rezeptoren stark vasokonstriktorisch, der Baroreflex antwortet mit einer Senkung der Herzfrequenz. Adrenalin steigert über ß-Rezeptoren Schlagkraft, Herzfrequenz und systolischen Druck. Geringe Dosen Dopamin
kontrahieren renale und mesenteriale Blutgefäße, mittlere steigern
Schlagkraft und Herzfrequenz, hohe Dosen wirken zusätzlich
vasokonstriktorisch / blutdrucksteigernd
Vasopressin wird bei Blutdruckabfall (Barorezeptoren), Volumenmangel (kardiopulmonale Rezeptoren) oder anderen Belastungssituationen freigesetzt (zentrale Disinhibition) und
erhöht den Gefäßtonus vor allem im Splanchnikusbereich. Volumenmangel
dominiert den Gesamteffekt auf die Hormonfreisetzung, sodass auch bei
hypotoner Dehydratation Vasopressin trotz erniedrigter Osmolalität
vermehrt ausgeschüttet wird. Vasopressin wirkt volumensteigernd,
gefäßverengend, blutdrucksteigernd. Endotheline bewirken Vasokonstriktion (ETA-Rezeptor) oder Vasodilatation (ETB-Rezeptor). Noradrenalin wirkt vorwiegend über α-Rezeptoren stark vasokonstriktorisch, der Baroreflex antwortet mit einer Senkung der Herzfrequenz. Adrenalin steigert über ß-Rezeptoren Schlagkraft, Herzfrequenz und systolischen Druck. Geringe Dosen Dopamin
kontrahieren renale und mesenteriale Blutgefäße, mittlere steigern
Schlagkraft und Herzfrequenz, hohe Dosen wirken zusätzlich
vasokonstriktorisch / blutdrucksteigernd Vasodilatation erfolgt durch Hyperpolarisierung - vermittelt über mechanische Reizung (Schubspannung), metabolische Autoregulation, endotheliale Faktoren, intensive Hypoxie,
ß-adrenerg (Adrenalin), cholinerg (sympathisch oder parasympathisch).
Vasodilatation kann die Durchblutung bis zu 20-fach steigern,
insbesondere in der Haut (Thermoregulation), Skelettmuskeln
(Arbeitsleistung), exokrinen Drüsen (Sekretion). Erweiterung von
Arteriolen steigert den Kapillardruck und damit die Filtration von
Flüssigkeit in das Gewebe. Generelle Vasodilatation senkt den Blutdruck
und kann zu Kreislaufversagen ("Widerstandsverlustschock") führen
Vasodilatation erfolgt durch Hyperpolarisierung - vermittelt über mechanische Reizung (Schubspannung), metabolische Autoregulation, endotheliale Faktoren, intensive Hypoxie,
ß-adrenerg (Adrenalin), cholinerg (sympathisch oder parasympathisch).
Vasodilatation kann die Durchblutung bis zu 20-fach steigern,
insbesondere in der Haut (Thermoregulation), Skelettmuskeln
(Arbeitsleistung), exokrinen Drüsen (Sekretion). Erweiterung von
Arteriolen steigert den Kapillardruck und damit die Filtration von
Flüssigkeit in das Gewebe. Generelle Vasodilatation senkt den Blutdruck
und kann zu Kreislaufversagen ("Widerstandsverlustschock") führen  Kinine sind gefäßerweiternde Peptide, die aus hepatisch gebildetem Kininogen durch Kininasewirkung entstehen. Sie wirken auf Kininrezeptoren, die von den meisten Zellen exprimiert werden,
gefäßdilatierend (Bradykinin!), steigern die Gefäßpermeabilität, hemmen
Plättchenaggregation, kontrahieren Bronchien, Darm und Uterus, wirken
als Radikalfänger und stellen den fetalen Kreislauf auf postpartale
Verhältnisse um (ductus arteriosus, Kontraktion der Nabelgefäße,
Dilatation der Pulmonalarterie)
Kinine sind gefäßerweiternde Peptide, die aus hepatisch gebildetem Kininogen durch Kininasewirkung entstehen. Sie wirken auf Kininrezeptoren, die von den meisten Zellen exprimiert werden,
gefäßdilatierend (Bradykinin!), steigern die Gefäßpermeabilität, hemmen
Plättchenaggregation, kontrahieren Bronchien, Darm und Uterus, wirken
als Radikalfänger und stellen den fetalen Kreislauf auf postpartale
Verhältnisse um (ductus arteriosus, Kontraktion der Nabelgefäße,
Dilatation der Pulmonalarterie)