

Eine Reise durch die Physiologie - Wie der Körper des Menschen funktioniert

Energie- und Stoffwechsel

 Fettgewebe, Körpergewicht, Körperzusammensetzung
Fettgewebe, Körpergewicht, Körperzusammensetzung
© H. Hinghofer-Szalkay




 Fettgewebe, Körpergewicht, Körperzusammensetzung
Fettgewebe, Körpergewicht, Körperzusammensetzung
 Bromid: βρῶμος = Gestank (bei Zimmertemperatur flüssig, verbreitet elementares Brom einen ätzenden Geruch)
Bromid: βρῶμος = Gestank (bei Zimmertemperatur flüssig, verbreitet elementares Brom einen ätzenden Geruch)| Das
Körpergewicht kann sich durch veränderte Flüssigkeitsbilanz rasch ändern (Trinken; intensives Schwitzen, Entleeren der Blase). Wasser im
Organismus verteilt sich auf den Intrazellulärraum (~65% des Körpergewichts)
und den Extrazellulärraum (~35%) und macht etwa 2/3 der jeweiligen
Masse aus (ein 70 kg schwerer Mensch hat z.B. ~45 Liter Wasser: ~30 l
intra-, ~15 l extrazellulär). Diese Volumina sind nicht direkt messbar, man kann aber Indikatorstoffe ("Marker") in den Körper einbringen, die sich in einem bestimmten Flüssigkeitsvolumen (Blutplasma, extrazelluläre Flüssigkeit oder Ganzkörperwasser) verteilen. Dann ist ihre Konzentration (Menge / Volumen) umso geringer, je größer das betreffende Volumen ist (Indikatorverdünnungsprinzip). Indikatoren sollten sich idealerweise vollständig und gleichmäßig verteilen, sie tun das aber z.T. diffus oder langsam; und sie verbleiben auch nicht in "ihrem" Raum, sondern werden abgebaut und wieder ausgeschieden. Die Körperzusammensetzung (wieviel Fettgewebe? Muskelmasse? ..) kann auf verschiedenen Wegen abgeschätzt werden; keine Methode ist perfekt. So können das spezifische Gewicht (nimmt mit dem Fettanteil ab) oder die Leitfähigkeit (steigt mit dem Flüssigkeitsanteil) ermittelt werden. Auch die Morphologie gibt Aufschluss (Hautfaltenmessung, Bauchumfang, bildgebende Verfahren). Muskelgewebe bildet die muskelspezifische Markersubstanz Kreatinin. Je größer die Muskelmasse, umso mehr Kreatinin entsteht - seine renale Ausscheidung ist proportional der Muskelmasse. Fettgewebe hat verschiedene Funktionen: Baufett benötigt der Körper für mechanische Stützfunktion (z.B. Nierenfett) oder thermische Isolation (Unterhautfett), viszerales ("Bauch-") Fett hingegen hat Speicheraufgaben (und eine andere Rezeptorausstattung). Muskel- und Fettgewebe produzieren Myokine und Adipokine - hormonähnliche Substanzen, die sich in vielfacher Weise auf den Stoffwechsel auswirken. Das aus Lipozyten stammende Leptin hemmt das Hungerzentrum, und sein Blutspiegel ist proportional der Masse an Fettgewebe im Körper. Umgekehrt beeinflussen viele Hormone (z.B. Glucocorticoide, Schilddrüsenhormone) den Metabolismus und damit auch den Fettanteil am Körper. Und sie reagieren auf die Größe der Energiespeicher: So nimmt der Insulinspiegel mit der Fettmasse zu, denn lipogene Signalsubstanzen erniedrigen die Insulinempfindlichkeit der Zielgewebe und steigern damit die Insulinmenge, die zur Regulierung des Blutzuckerspiegels notwendig ist. Sind die ß-Zellen im Pankreas überfordert, ist die Insulinbildung unzureichend und Diabetes tritt auf (metabolisches Syndrom). |
 Körpergewicht, Flüssigkeitsvolumina, Verteilungsräume
Körpergewicht, Flüssigkeitsvolumina, Verteilungsräume  Körperzusammensetzung
Körperzusammensetzung  Muskel und Kreatininausscheidung
Muskel und Kreatininausscheidung  Body mass index
Body mass index
 Fettgewebe
Fettgewebe Magermasse (LBM), Fettmasse
Magermasse (LBM), Fettmasse
 Core messages
Core messages Energiespeicherung. Fettzellen (Adipozyten) speichern Triglyzeride,
Verbindungen mit besonders hoher Dichte verfügbarer (freier) Energie (mit 9,3 Cal/g mehr als doppelt so viel als in Kohlenhydraten oder Protein).
Energiespeicherung. Fettzellen (Adipozyten) speichern Triglyzeride,
Verbindungen mit besonders hoher Dichte verfügbarer (freier) Energie (mit 9,3 Cal/g mehr als doppelt so viel als in Kohlenhydraten oder Protein). Strukturkomponente. Lipide bauen Zellmembranen auf und für die
Erhaltung derer strukturellen Integrität und Funktion unverzichtbar.
Strukturkomponente. Lipide bauen Zellmembranen auf und für die
Erhaltung derer strukturellen Integrität und Funktion unverzichtbar. Signalübermittlung. Mehrere Informationsträger - z.B. für Überleben und
Wachstum von Zellen, Immunreaktionen - sind Lipide.
Signalübermittlung. Mehrere Informationsträger - z.B. für Überleben und
Wachstum von Zellen, Immunreaktionen - sind Lipide. Thermische Isolierung. Weißes Fettgewebe leitet Wärme nicht gut und hilft vor zu rascher Abkühlung des Körpers.
Thermische Isolierung. Weißes Fettgewebe leitet Wärme nicht gut und hilft vor zu rascher Abkühlung des Körpers. Thermogenese. Braunes Fettgewebe kann mittels Thermogenin - einem Protein, das (vor allem bei Neugeborenen) die ATP-Synthese von der Elektronentransportkette / Protonenpumpe in den Mitochondrien abkoppelt - den Fettsäureabbau zur Wärmebildung verwenden ("zitterfreie" Wärmebildung).
Thermogenese. Braunes Fettgewebe kann mittels Thermogenin - einem Protein, das (vor allem bei Neugeborenen) die ATP-Synthese von der Elektronentransportkette / Protonenpumpe in den Mitochondrien abkoppelt - den Fettsäureabbau zur Wärmebildung verwenden ("zitterfreie" Wärmebildung). Beteiligung an der Fettresorption im Darm.
Beteiligung an der Fettresorption im Darm. - energiesparende Erbanlagen - scheinen unseren Vorfahren einen Überlebensvorteil verliehen zu haben,
indem sie eine sehr effiziente Speicherung von Energie in Form von
Triglyceriden erleichtern und so Hungerzeiten besser überstehen
helfen. Dieser Mechanismus verwandelt sich in einer
Überflussgesellschaft zu einem Nachteil und trägt zum Problem des Übergewichts bei ("Globesity": global obesity).
- energiesparende Erbanlagen - scheinen unseren Vorfahren einen Überlebensvorteil verliehen zu haben,
indem sie eine sehr effiziente Speicherung von Energie in Form von
Triglyceriden erleichtern und so Hungerzeiten besser überstehen
helfen. Dieser Mechanismus verwandelt sich in einer
Überflussgesellschaft zu einem Nachteil und trägt zum Problem des Übergewichts bei ("Globesity": global obesity).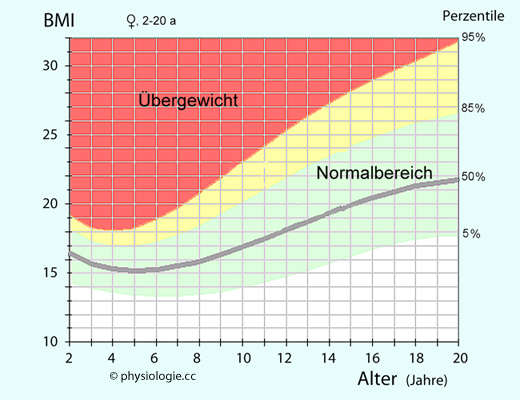
 Abbildung: Body mass index (BMI)-Tabelle (Mädchen / junge Frauen)
Abbildung: Body mass index (BMI)-Tabelle (Mädchen / junge Frauen)
 Das Volumen von Gas- und Flüssigkeitsvolumina im Körper wird meist über das Indikatorverdünnungsprinzip
ermittelt:
In einen (nicht direkt der Volumenmessung zugänglichen) Verteilungsraum
wird ein Indikatorstoff eingebracht. Dieser Indikator
Das Volumen von Gas- und Flüssigkeitsvolumina im Körper wird meist über das Indikatorverdünnungsprinzip
ermittelt:
In einen (nicht direkt der Volumenmessung zugänglichen) Verteilungsraum
wird ein Indikatorstoff eingebracht. Dieser Indikator 
 muss ungiftig und
muss ungiftig und

 gut messbar sein;
gut messbar sein; 
 er sollte im Verteilungsraum nicht
bereits (in nennenswerter Konzentration) vorhanden sein,
er sollte im Verteilungsraum nicht
bereits (in nennenswerter Konzentration) vorhanden sein, 
 sich in diesem gleichmäßig verteilen
sich in diesem gleichmäßig verteilen 
 und ihn
während der Messperiode möglichst nicht verlassen.
und ihn
während der Messperiode möglichst nicht verlassen.  Abbildung) anzunähern:
Abbildung) anzunähern:
 Abbildung: Schema des Indikatorverdünnungsprinzips
Abbildung: Schema des Indikatorverdünnungsprinzips
| V = M / c |
 Intrazelluläres Flüssigkeitsvolumen
Intrazelluläres Flüssigkeitsvolumen Zur Bestimmung des intrazellulären Flüssigkeitsvolumens s. auch dort
Zur Bestimmung des intrazellulären Flüssigkeitsvolumens s. auch dort Der Verteilungsraum für jeden
einzelnen Stoff ist von der jeweiligen Kinetik
abhängig und daher sehr unterschiedlich, man spricht vom
“Inulinraum”, “Natriumraum” usw.
Der Verteilungsraum für jeden
einzelnen Stoff ist von der jeweiligen Kinetik
abhängig und daher sehr unterschiedlich, man spricht vom
“Inulinraum”, “Natriumraum” usw.  Extrazelluläres Flüssigkeitsvolumen
Extrazelluläres Flüssigkeitsvolumen Farbstoffe zur Markierung von Plasmaeiweiß (z.B. Indocyaningrün, Cardiogreen)
Farbstoffe zur Markierung von Plasmaeiweiß (z.B. Indocyaningrün, Cardiogreen) 
 oder das 51Chrom-Isotop
zur Markierung von roten Blutkörperchen.
oder das 51Chrom-Isotop
zur Markierung von roten Blutkörperchen.  Blutvolumen
Blutvolumen , D2O)
oder anderen Stoffen,
welche die Zellwand leicht passieren, ermittelt werden. In der Praxis orientiert man sich an klinischen Zeichen
einer eventuellen Hyper- (Ödeme?) oder Hypohydration (trockene
Schleimhäute, geringe Schweißproduktion).
, D2O)
oder anderen Stoffen,
welche die Zellwand leicht passieren, ermittelt werden. In der Praxis orientiert man sich an klinischen Zeichen
einer eventuellen Hyper- (Ödeme?) oder Hypohydration (trockene
Schleimhäute, geringe Schweißproduktion). Faustregel: Zur Metabolisierung von 1 kCal Energie (und
Ausscheidung der dabei auftretenden Abbauprodukte) benötigt der Körper
1 ml Wasser.
Faustregel: Zur Metabolisierung von 1 kCal Energie (und
Ausscheidung der dabei auftretenden Abbauprodukte) benötigt der Körper
1 ml Wasser. Für den Umsatz von 2000 Cal (~8,3 MJ - etwa der Ruhe-Tagesumsatz einer erwachsenen Person) ist demnach der
Austausch von ~2 Liter H2O notwendig.
Für den Umsatz von 2000 Cal (~8,3 MJ - etwa der Ruhe-Tagesumsatz einer erwachsenen Person) ist demnach der
Austausch von ~2 Liter H2O notwendig.
| Dehydration (Flüssigkeitsmangel) |
Hyperhydration (Flüssigkeitsüberschuss) |
| Starkes Schwitzen / chronischer Durst Durchfälle, starkes Erbrechen Verbrennungen, Blutverlust |
Exzessives Trinken (vorübergehend) Rechtsherzinsuffizient mit Ödemen Niereninsuffizienz |
 ) bestimmt werden. Diese Methoden sind
nichtinvasiv und unbelastend, aber kaum verlässlich.
) bestimmt werden. Diese Methoden sind
nichtinvasiv und unbelastend, aber kaum verlässlich. 
 Abbildung: Gewebe-Massenverteilung
Abbildung: Gewebe-Massenverteilung
 Als Magermasse (LBM, lean body mass) bezeichnet man die Differenz Gesamtmasse (BW: body weight) minus Fettmasse (BF: body fat) des Körpers (LBM = BW - BF). Der Begriff Fettmasse bezieht sich nur auf das Fett in Adipozyten; die Zellmembranen im Körper werden der Magermasse zugeschlagen. Die fettfreie Körpermasse (FFM: fat free mass) schließt (im Gegensatz zur Magermasse) die Zellmembranen nicht ein, ihr Betrag liegt um 3-5% unter dem der Magermasse.
Als Magermasse (LBM, lean body mass) bezeichnet man die Differenz Gesamtmasse (BW: body weight) minus Fettmasse (BF: body fat) des Körpers (LBM = BW - BF). Der Begriff Fettmasse bezieht sich nur auf das Fett in Adipozyten; die Zellmembranen im Körper werden der Magermasse zugeschlagen. Die fettfreie Körpermasse (FFM: fat free mass) schließt (im Gegensatz zur Magermasse) die Zellmembranen nicht ein, ihr Betrag liegt um 3-5% unter dem der Magermasse.  Zur Messung wird die Massendichte
(Masse /
Volumen) des Organismus mittels des archimedischen Prinzips herangezogen (Fett: spezifisches Gewicht 0,9; Magermasse: 1,1): Wägung des
Körpers und Bestimmung des
Körpervolumens (Untertauchen des Patienten, Bestimmen der verdrängten
Wassermenge).
Zur Messung wird die Massendichte
(Masse /
Volumen) des Organismus mittels des archimedischen Prinzips herangezogen (Fett: spezifisches Gewicht 0,9; Magermasse: 1,1): Wägung des
Körpers und Bestimmung des
Körpervolumens (Untertauchen des Patienten, Bestimmen der verdrängten
Wassermenge). 
 Abbildung: Hautfaltenmessung mittels Caliper
Abbildung: Hautfaltenmessung mittels Caliper
 ,
,  Abbildung) zur Abschätzung der Schichtdicke des Fettgewebes in der Subcutis (Calipometrie).
Allerdings ist das Ausmaß dieses subkutanen Depots kein verlässlicher
Indikator für die Menge des gesamten Körperfetts. Diese Einschränkung
gilt auch für andere (z.B. optische) Methoden zur Abschätzung der
(lokalen) subkutanen Fettmenge.
Abbildung) zur Abschätzung der Schichtdicke des Fettgewebes in der Subcutis (Calipometrie).
Allerdings ist das Ausmaß dieses subkutanen Depots kein verlässlicher
Indikator für die Menge des gesamten Körperfetts. Diese Einschränkung
gilt auch für andere (z.B. optische) Methoden zur Abschätzung der
(lokalen) subkutanen Fettmenge. Man unterscheidet folgende Anteile der Körpermasse:
Man unterscheidet folgende Anteile der Körpermasse:  Fettfreie Masse (FFM, fat-free body mass), bestehend aus
Fettfreie Masse (FFM, fat-free body mass), bestehend aus Körperzellmasse (BBC, body cell mass, intrazelluläres Kompartiment) und
Körperzellmasse (BBC, body cell mass, intrazelluläres Kompartiment) und Extrazellulärer Masse (ECM, extracellular body mass, extrazelluläres Kompartiment)
Extrazellulärer Masse (ECM, extracellular body mass, extrazelluläres Kompartiment) Fettmasse (FM, fat mass).
Fettmasse (FM, fat mass).
 Die organische Säure Kreatin wird (durch Methylierung von Guanidinoacetat) in Leber (hauptsächlich) und Nieren (etwas auch im Pankreas) aus
den Aminosäuren Glycin und Arginin gebildet. Etwa 90% des im Körper
vorhandenen Kreatins befinden sich in der quergestreiften Muskulatur,
wo es als Kurzzeit-Energiereserve (Kreatinphosphat) dient.
Die organische Säure Kreatin wird (durch Methylierung von Guanidinoacetat) in Leber (hauptsächlich) und Nieren (etwas auch im Pankreas) aus
den Aminosäuren Glycin und Arginin gebildet. Etwa 90% des im Körper
vorhandenen Kreatins befinden sich in der quergestreiften Muskulatur,
wo es als Kurzzeit-Energiereserve (Kreatinphosphat) dient. 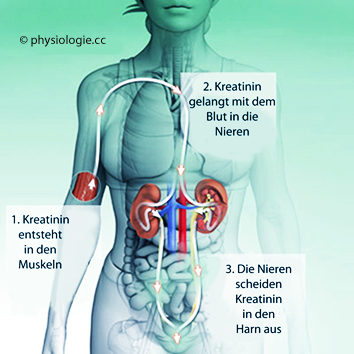
 Abbildung: Die Kreatininausscheidung erlaubt eine Abschätzung der Muskelmasse
Abbildung: Die Kreatininausscheidung erlaubt eine Abschätzung der Muskelmasse
| LBM = 7,38 + (0,029 x Kreatininausscheidung) Forbes & Bruining, Am J Clin Nutr 1976 |
 Beispiel: Eine Person scheidet 1,2 g Kreatinin in 24 Stunden aus. Die LBM berechnet sich als 7,38 + (0,029 x 1200) = ~42 kg
Beispiel: Eine Person scheidet 1,2 g Kreatinin in 24 Stunden aus. Die LBM berechnet sich als 7,38 + (0,029 x 1200) = ~42 kg Der body mass index
(BMI) ist außerordentlich bekannt, hat aber nur einigermaßen
beschränkte medizinische Aussagekraft. Er korreliert einigermaßen mit
dem Anteil des Fettgewebes am Körpergewicht und ist ist definidert als Körpermasse M (in Kilogramm) dividiert durch das Quadrat der Körpergröße L (in Metern):
Der body mass index
(BMI) ist außerordentlich bekannt, hat aber nur einigermaßen
beschränkte medizinische Aussagekraft. Er korreliert einigermaßen mit
dem Anteil des Fettgewebes am Körpergewicht und ist ist definidert als Körpermasse M (in Kilogramm) dividiert durch das Quadrat der Körpergröße L (in Metern):| BMI = M / L2 |
 Abbildung
ganz oben gezeigt.
Abbildung
ganz oben gezeigt. Die
Fettmasse kann zunehmen und Stoffwechselenergie speichern (wenn die
Zufuhr an Energie größer ist als der Verbrauch),
Die
Fettmasse kann zunehmen und Stoffwechselenergie speichern (wenn die
Zufuhr an Energie größer ist als der Verbrauch), 
 oder aber
Stoffwechselenergie abgeben und sich verringern (wenn der Verbrauch an
Energie größer ist als die Zufuhr).
oder aber
Stoffwechselenergie abgeben und sich verringern (wenn der Verbrauch an
Energie größer ist als die Zufuhr).  vgl. dort
vgl. dort Weißes Fetttgewebe
Weißes Fetttgewebe  Viszerales Fettgewebe
Viszerales Fettgewebe  Regionale Unterschiede
Regionale Unterschiede
 Adipokine
Adipokine 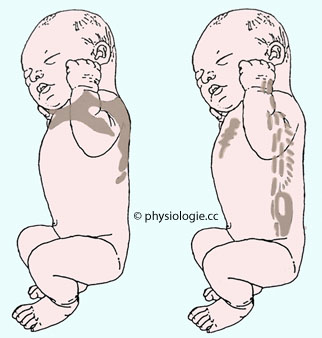
 Abbildung: Lage braunen Fettgewebes beim Neugeborenen
Abbildung: Lage braunen Fettgewebes beim Neugeborenen
 Abbildung), bei erwachsenen Personen finden
sich Restbestände (<0,5% des Körpergewichts) im Bereich des oberen Thorax (Hals- bis
Schulterregion). Der Bestand an braunem Fettgewebe ist saisonal
unterschiedlich ausgeprägt (weniger im Sommer, mehr im Winter).
Abbildung), bei erwachsenen Personen finden
sich Restbestände (<0,5% des Körpergewichts) im Bereich des oberen Thorax (Hals- bis
Schulterregion). Der Bestand an braunem Fettgewebe ist saisonal
unterschiedlich ausgeprägt (weniger im Sommer, mehr im Winter). 
 Abbildung: Triglyceridsynthese in Fettzellen
Abbildung: Triglyceridsynthese in Fettzellen
 Abbildung). Dann
folgen weitere Schritte (Enzyme 2 bis 5), bis Triglyceride
(Neutralfette) synthetisiert sind und in die Fettzelle eingelagert
werden. Die Fettspeicherung wird durch Insulin gefördert.
Abbildung). Dann
folgen weitere Schritte (Enzyme 2 bis 5), bis Triglyceride
(Neutralfette) synthetisiert sind und in die Fettzelle eingelagert
werden. Die Fettspeicherung wird durch Insulin gefördert. Aus gespeichertem Triglycerid setzt hormonsensitive Lipase eine Fettsäure frei, es entsteht ein Diglycerid. Glucagon,
Adrenalin, Noradrenalin, ANP regen ihre Aktivität und damit Lipolyse
an; gehemmt wird sie durch Insulin (das die Lipolyse hemmt). Der Mechanismus: Hormonsensitive Lipase wird bei Phosphorylierung (durch Proteinkinase A) aktiver, bei Dephosphorylierung (durch Proteinphosphatase 1) weniger aktiv.
Aus gespeichertem Triglycerid setzt hormonsensitive Lipase eine Fettsäure frei, es entsteht ein Diglycerid. Glucagon,
Adrenalin, Noradrenalin, ANP regen ihre Aktivität und damit Lipolyse
an; gehemmt wird sie durch Insulin (das die Lipolyse hemmt). Der Mechanismus: Hormonsensitive Lipase wird bei Phosphorylierung (durch Proteinkinase A) aktiver, bei Dephosphorylierung (durch Proteinphosphatase 1) weniger aktiv. Lipoproteinlipase spaltet eine weitere Fettsäure ab, es entsteht ein Monoglycerid.
Lipoproteinlipase spaltet eine weitere Fettsäure ab, es entsteht ein Monoglycerid. Aus diesem spaltet schließlich Monoglyceridlipase
die letzte Fettsäure ab, freies Glycerin ist entstanden.
Aus diesem spaltet schließlich Monoglyceridlipase
die letzte Fettsäure ab, freies Glycerin ist entstanden.
 Abbildung).
Abbildung). 
 Abbildung: Fett- und Glucosestoffwechsel in weißem Fettgewebe
Abbildung: Fett- und Glucosestoffwechsel in weißem Fettgewebe
 Es gibt Übergangsformen (beige Adipozyten, deren Funktion denen brauner Fettzellen ähnelt) sowie "rosa" Fettzellen in der laktierenden Brustdrüse. Weiße Adipozyten können sich in die beige Form verwandeln und thermogenetisch aktiv werden (vermehrte Expression von uncoupling protein 1, UCP-1, welches die Atmungskette entkoppelt, indem es Protonen unter Umgehung der chemiosmotischen Kopplung durch die innere Mitochondrienmembran dringen läßt). Dieser Effekt ist günstig und verringert das Risiko, dass sich ein metabolisches Syndrom / Diabetes 2 entwickeln. Auch "rosa" Fettzellen
entwickeln sich aus (subkutanen) weißen Adipozyten; sie produzieren
u.a. Leptin, das in die Milch sezerniert wird und beim gestillten Baby
die Neigung zu Fettsucht reduziert. Nach der Laktationsperiode
entwickeln sie sich zu weißen Adipozyten zurück.
Es gibt Übergangsformen (beige Adipozyten, deren Funktion denen brauner Fettzellen ähnelt) sowie "rosa" Fettzellen in der laktierenden Brustdrüse. Weiße Adipozyten können sich in die beige Form verwandeln und thermogenetisch aktiv werden (vermehrte Expression von uncoupling protein 1, UCP-1, welches die Atmungskette entkoppelt, indem es Protonen unter Umgehung der chemiosmotischen Kopplung durch die innere Mitochondrienmembran dringen läßt). Dieser Effekt ist günstig und verringert das Risiko, dass sich ein metabolisches Syndrom / Diabetes 2 entwickeln. Auch "rosa" Fettzellen
entwickeln sich aus (subkutanen) weißen Adipozyten; sie produzieren
u.a. Leptin, das in die Milch sezerniert wird und beim gestillten Baby
die Neigung zu Fettsucht reduziert. Nach der Laktationsperiode
entwickeln sie sich zu weißen Adipozyten zurück.  Das Fettgewebe mit ~10-20% des Körpergewichts beansprucht ~10% des Herzzeitvolumens (je nach Anteil am Körpergewicht).
Das Fettgewebe mit ~10-20% des Körpergewichts beansprucht ~10% des Herzzeitvolumens (je nach Anteil am Körpergewicht).
 Vermehrung des viszeralen Fetts ist ein Risikofaktor für Insulinresistenz, Typ-2-Diabetes und koronare Herzkrankheit. Regelmäßige körperliche Betätigung ist der beste Schutz vor Vermehrung von Bauchfett. Dessen Volumen läßt sich am einfachsten über den Bauchumfang (2 Querfinger über dem Beckenkamm gemessen) abschätzen: Er sollte bei Männern nicht über 94, bei Frauen nicht über 80 cm betragen.
Vermehrung des viszeralen Fetts ist ein Risikofaktor für Insulinresistenz, Typ-2-Diabetes und koronare Herzkrankheit. Regelmäßige körperliche Betätigung ist der beste Schutz vor Vermehrung von Bauchfett. Dessen Volumen läßt sich am einfachsten über den Bauchumfang (2 Querfinger über dem Beckenkamm gemessen) abschätzen: Er sollte bei Männern nicht über 94, bei Frauen nicht über 80 cm betragen. hüllt die Bauchorgane ein und ist anders mit Rezeptoren und Enzymen
ausgestattet als z.B. Unterhautfett.
hüllt die Bauchorgane ein und ist anders mit Rezeptoren und Enzymen
ausgestattet als z.B. Unterhautfett.  Viszerales Fettgewebe produziert in hohem Umfang
Viszerales Fettgewebe produziert in hohem Umfang  Adiponektin, das die Fettsäureoxidation fördert, entzündungshemmend wirkt, oxidativen Stress mindert und die Zellen stärkt.
Adiponektin, das die Fettsäureoxidation fördert, entzündungshemmend wirkt, oxidativen Stress mindert und die Zellen stärkt.  Leptin,
das periphere Gewebe (Leber, Herz- und Skelettmuskeln, ß-Zellen) vor
übermäßiger Fetteinlagerung bewahrt (Fette werden zu Adipozyten
"umleitet") und deren Insulinempfindlichkeit
(definiert als insulinabhängige Glucoseaufnahme) stärkt. Leptin
signalisiert, dass der Körper über genügend Energie z.B. für
Blutbildung und Reproduktion verfügt.
Leptin,
das periphere Gewebe (Leber, Herz- und Skelettmuskeln, ß-Zellen) vor
übermäßiger Fetteinlagerung bewahrt (Fette werden zu Adipozyten
"umleitet") und deren Insulinempfindlichkeit
(definiert als insulinabhängige Glucoseaufnahme) stärkt. Leptin
signalisiert, dass der Körper über genügend Energie z.B. für
Blutbildung und Reproduktion verfügt.  Mit steigender Fettmasse nimmt auch der Insulinspiegel zu.
Mit steigender Fettmasse nimmt auch der Insulinspiegel zu. 
 Abbildung: Periphere Hunger- und Sättigungssignale
Abbildung: Periphere Hunger- und Sättigungssignale
 So
verfügen Adipozyten der Gesäß- und Oberschenkelregion bei Frauen über
eine hohe Rezeptordichte für die (strukturverwandten) antilipolytischen
Hormone PYY und NPY:
So
verfügen Adipozyten der Gesäß- und Oberschenkelregion bei Frauen über
eine hohe Rezeptordichte für die (strukturverwandten) antilipolytischen
Hormone PYY und NPY: Peptid YY
(PYY) stammt hauptsächlich aus L-Zellen der Darmschleimhaut und
wird von diesen u.a. fettinduziert freigesetzt (außer der fettaufbauenden
Wirkung reduziert es Hungergefühl und hemmt die Magen-Darmmotorik);
Peptid YY
(PYY) stammt hauptsächlich aus L-Zellen der Darmschleimhaut und
wird von diesen u.a. fettinduziert freigesetzt (außer der fettaufbauenden
Wirkung reduziert es Hungergefühl und hemmt die Magen-Darmmotorik); Neuropeptid Y (NPY) wird von Gehirn und autonomem Nervensystem produziert, vermehrt die Fetteinlagerung und trägt zur Ausbildung der für Frauen typischen Hüftform bei.
Neuropeptid Y (NPY) wird von Gehirn und autonomem Nervensystem produziert, vermehrt die Fetteinlagerung und trägt zur Ausbildung der für Frauen typischen Hüftform bei. Der
lipogenetische Effekt ist an Fettzellen der Extremitäten weniger
ausgeprägt als an Zellen des Körperstamms. Dies erklärt z.B. die Stammfettsucht
beim metabolischen Syndrom oder einer Cortisontherapie: Glucocorticoide
steigern den Blutzuckerspiegel und dies erhöht die Insulinausschüttung.
Der
lipogenetische Effekt ist an Fettzellen der Extremitäten weniger
ausgeprägt als an Zellen des Körperstamms. Dies erklärt z.B. die Stammfettsucht
beim metabolischen Syndrom oder einer Cortisontherapie: Glucocorticoide
steigern den Blutzuckerspiegel und dies erhöht die Insulinausschüttung.

 Abbildung: Von Fettzellen sezernierte Faktoren
Abbildung: Von Fettzellen sezernierte Faktoren
 Leptin
Leptin  ,
das auch aus anderen Geweben stammen kann. Der Leptinspiegel im Blut
ist proportional zur Größe der Fettspeicher und unterliegt einem zirkadianen Rhythmus, er ist in der Nacht am höchsten; vielleicht trägt das zur Unterdrückung
von Hungen im Schlaf bei. Leptin hemmt den Hunger über komplexe Wirkung
an hypothalamischen Rezeptoren, beteiligt sich an der Regulierung des
Fettstoffwechsels und hat weitere Wirkungen auf zahlreiche Gewebe
(kardiovaskuläres, Immun-, Reproduktions-, Nervensystem, Knochengewebe). Leptin wirkt vasoaktiv - über verschiedene Angriffspunkte kann es Gefäße kurzfristig dilatieren, längerfristig möglicherweise kontrahieren.
,
das auch aus anderen Geweben stammen kann. Der Leptinspiegel im Blut
ist proportional zur Größe der Fettspeicher und unterliegt einem zirkadianen Rhythmus, er ist in der Nacht am höchsten; vielleicht trägt das zur Unterdrückung
von Hungen im Schlaf bei. Leptin hemmt den Hunger über komplexe Wirkung
an hypothalamischen Rezeptoren, beteiligt sich an der Regulierung des
Fettstoffwechsels und hat weitere Wirkungen auf zahlreiche Gewebe
(kardiovaskuläres, Immun-, Reproduktions-, Nervensystem, Knochengewebe). Leptin wirkt vasoaktiv - über verschiedene Angriffspunkte kann es Gefäße kurzfristig dilatieren, längerfristig möglicherweise kontrahieren. 
 Abbildung: Adiponektinrezeptor
Abbildung: Adiponektinrezeptor
 Adiponektin wird von "leeren" Fettzellen gebildet, sein
Blutspiegel - 2-20 μg/ml Serum - verhält sich umgekehrt proportional zur
Größe der Fettspeicher. Der Rezeptor (
Adiponektin wird von "leeren" Fettzellen gebildet, sein
Blutspiegel - 2-20 μg/ml Serum - verhält sich umgekehrt proportional zur
Größe der Fettspeicher. Der Rezeptor ( Abbildung) ist heptahelikal, ist also G-Protein-betrieben (metabotrop). Adiponektin wirkt vasodilatierend und entzündungshemmend. Es erhöht die Insulinsensitivität, die Glucoseaufnahme und ß-Oxidation sowie die Menge des Uncoupling Protein in Mitochondrien. Bei Adipositas und arterieller Hypertonie ist die Expression von Adinponektin verringert, sein Serumspiegel reduziert.
Abbildung) ist heptahelikal, ist also G-Protein-betrieben (metabotrop). Adiponektin wirkt vasodilatierend und entzündungshemmend. Es erhöht die Insulinsensitivität, die Glucoseaufnahme und ß-Oxidation sowie die Menge des Uncoupling Protein in Mitochondrien. Bei Adipositas und arterieller Hypertonie ist die Expression von Adinponektin verringert, sein Serumspiegel reduziert. Visfatin,
auch Nicotinamid-Phosphoribosyltransferase, der Visfatinspiegel korreliert mit der
Größe der Fettspeicher. Visfatin aktiviert Insulinrezeptoren
(erhöhte Insulin-Sensitivität!) und hat insulinähnliche Effekte, wie
eine Senkung des Blutzuckerspiegels.
Visfatin,
auch Nicotinamid-Phosphoribosyltransferase, der Visfatinspiegel korreliert mit der
Größe der Fettspeicher. Visfatin aktiviert Insulinrezeptoren
(erhöhte Insulin-Sensitivität!) und hat insulinähnliche Effekte, wie
eine Senkung des Blutzuckerspiegels. Mehr zu Leptin, Adiponektin, Visfatin, Resistin s. dort
Mehr zu Leptin, Adiponektin, Visfatin, Resistin s. dort Stickstoffmonoxid (NO)
Stickstoffmonoxid (NO) Steroidhormone (Kostisol, Östradiol)
Steroidhormone (Kostisol, Östradiol) Zytokine (IL-1, IL-6, TNFα)
Zytokine (IL-1, IL-6, TNFα) Prostaglandine
Prostaglandine Vasoaktive Substanzen (Histamin, Dopamin, Noradrenalin..)
Vasoaktive Substanzen (Histamin, Dopamin, Noradrenalin..)
 Abbildung: MRI-Scanner (Magnetic resonance imaging)
Abbildung: MRI-Scanner (Magnetic resonance imaging)
 Abbildung) erlaubt eine
Differenzierung zwischen der Gewichtsentwicklung von Fett- und fettfreiem Anteil
(Magermasse). Bestimmungen mittels Impedanzanalyse,
die sehr verbreitet sind, haben sich als unzuverlässig erwiesen (die
ermittelten Werte beruhen vor allem auf den einzugebenden biometrischen
Daten wie Gewicht, Körpergröße, Alter und Geschlecht, aber kaum auf
gemessenen Impedanzwerten).
Abbildung) erlaubt eine
Differenzierung zwischen der Gewichtsentwicklung von Fett- und fettfreiem Anteil
(Magermasse). Bestimmungen mittels Impedanzanalyse,
die sehr verbreitet sind, haben sich als unzuverlässig erwiesen (die
ermittelten Werte beruhen vor allem auf den einzugebenden biometrischen
Daten wie Gewicht, Körpergröße, Alter und Geschlecht, aber kaum auf
gemessenen Impedanzwerten). Photonen-Absorptiometrie (Single photon absorptiometry SPA, Dual photon absorptiometry DPA),
Photonen-Absorptiometrie (Single photon absorptiometry SPA, Dual photon absorptiometry DPA),
 Röntgenanalyse: Absorptiometrie (DEXA), Radiogrammetrie (Röntgenstrahlen - DXR)
Röntgenanalyse: Absorptiometrie (DEXA), Radiogrammetrie (Röntgenstrahlen - DXR) Elementare Zusammensetzung des menschlichen Körpers s. dort
Elementare Zusammensetzung des menschlichen Körpers s. dort
 Das Körpergewicht (Muskeln, Knochen, Fettgewebe etc.) hängt von Körpergröße, Geschlecht, Alter, Fitness ab. Einer Volumenmessung (Volumen V) nicht direkt zugängliche Volumina werden über Indikatorverdünnung
ermittelt. Indikatoren (Menge M) müssen sich im fraglichen Kompartiment möglichst gleichmäßig verteilen, eindeutig bestimmbar (Konzentration c) und
ungiftig sein. Nach Äquilibrierung gilt V = M / c (je größer das Volumen, desto geringer die Konzentration des Indikators). Der Indikator wird meist während des
Verteilungsprozesses teilweise ausgeschieden. Das extrazelluläre Flüssigkeitsvolumen bestimmt man mit Inulin, Sulfat, Natrium-, Chlorid-,
Bromidionen ("Inulin-, Sulfatraum" etc); das Gesamtkörperwasser u.a. mit schwerem Wasser (D2O)
Das Körpergewicht (Muskeln, Knochen, Fettgewebe etc.) hängt von Körpergröße, Geschlecht, Alter, Fitness ab. Einer Volumenmessung (Volumen V) nicht direkt zugängliche Volumina werden über Indikatorverdünnung
ermittelt. Indikatoren (Menge M) müssen sich im fraglichen Kompartiment möglichst gleichmäßig verteilen, eindeutig bestimmbar (Konzentration c) und
ungiftig sein. Nach Äquilibrierung gilt V = M / c (je größer das Volumen, desto geringer die Konzentration des Indikators). Der Indikator wird meist während des
Verteilungsprozesses teilweise ausgeschieden. Das extrazelluläre Flüssigkeitsvolumen bestimmt man mit Inulin, Sulfat, Natrium-, Chlorid-,
Bromidionen ("Inulin-, Sulfatraum" etc); das Gesamtkörperwasser u.a. mit schwerem Wasser (D2O) Erwachsene bestehen zu ~60 Gewichtsprozent aus Wasser - Frauen 55-60, Männer / trainierte Personen bis 65; Adipöse
~50 (massive Adipositas bis 30%), Neugeborene 70-80% (mit
zunehmendem Alter nimmt der Wasseranteil an der Körpermasse ab). Pro Cal metabolisierter Energie und Ausscheidung der Abbauprodukte benötigt man 1 ml Wasser (~2 l für einen
Ruhe-Tagesumsatz von 2000 Cal). Der Intrazellulärraum bestreitet 2/3, der Extrazellulärraum
(Interstitium, Knochen / Knorpel, Bindegewebe, Blutplasma, transzelluläre Raume) 1/3 des Körpergewichts (Neugeborene 1:1). Der Kaliumgehalt des
Körpers korreliert mit dem intrazellulären Volumen. Der Großteil
des intrazellulären Wassers befindet sich in der Muskulatur (je nach Trainingszustand 35-50% der Körpermasse). Änderungen des Plasmavolumens
korrelieren in der Regel mit solchen des extrazellulären Volumens. Zur Messung
des
Blutvolumens markiert man Plasmaeiweiß (z.B. Cardiogreen; Umrechnung über den Hämatokrit) oder
Erythrozyten (Chrom-51). Eine erwachsene Person (~70 kg) hat ~3 l
Plasmavolumen und ~2 l Erythrozytenvolumen (~5
Liter Blutvolumen) Erwachsene bestehen zu ~60 Gewichtsprozent aus Wasser - Frauen 55-60, Männer / trainierte Personen bis 65; Adipöse
~50 (massive Adipositas bis 30%), Neugeborene 70-80% (mit
zunehmendem Alter nimmt der Wasseranteil an der Körpermasse ab). Pro Cal metabolisierter Energie und Ausscheidung der Abbauprodukte benötigt man 1 ml Wasser (~2 l für einen
Ruhe-Tagesumsatz von 2000 Cal). Der Intrazellulärraum bestreitet 2/3, der Extrazellulärraum
(Interstitium, Knochen / Knorpel, Bindegewebe, Blutplasma, transzelluläre Raume) 1/3 des Körpergewichts (Neugeborene 1:1). Der Kaliumgehalt des
Körpers korreliert mit dem intrazellulären Volumen. Der Großteil
des intrazellulären Wassers befindet sich in der Muskulatur (je nach Trainingszustand 35-50% der Körpermasse). Änderungen des Plasmavolumens
korrelieren in der Regel mit solchen des extrazellulären Volumens. Zur Messung
des
Blutvolumens markiert man Plasmaeiweiß (z.B. Cardiogreen; Umrechnung über den Hämatokrit) oder
Erythrozyten (Chrom-51). Eine erwachsene Person (~70 kg) hat ~3 l
Plasmavolumen und ~2 l Erythrozytenvolumen (~5
Liter Blutvolumen)  Referenzmethode zur Bestimmung von Fett- und Magermasse (lean body mass) ist die
Bestimmung des spezifischen Gewichts (Fettgewebe 0,9, Magermasse 1,1) des Körpers (Unterwasserwägung). Alle anderen Methoden erbringen in den meisten Fällen unverlässliche Resultate:
Hautfaltendicke, Körperimpedanz, Röntgenbildauswertungen,
(Nah-)Infrarotmessungen, Ultraschallanalysen u.a. Der
body mass
index (BMI) - definidert als Körpermasse M (in Kilogramm) dividiert
durch das Quadrat der Körpergröße L (in Metern) - berücksichtigt weder
Alter, Geschlecht, Trainingszustand noch Gesundheitszustand. Die Kreatininausscheidung im Harn (~1-2 g/d) nimmt linear mit der Muskelmasse zu:
Kreatinin ist ein Endprodukt des Muskelstoffwechsels und wird
kontinuierlich renal eliminiert. Aufbautraining erhöht, Immobilisierung
senkt die Kreatininausscheidung. Die Kreatininkonzentration dient als
Bezugsgröße zur Beurteilung anderer Konzentrationswerte im Harn Referenzmethode zur Bestimmung von Fett- und Magermasse (lean body mass) ist die
Bestimmung des spezifischen Gewichts (Fettgewebe 0,9, Magermasse 1,1) des Körpers (Unterwasserwägung). Alle anderen Methoden erbringen in den meisten Fällen unverlässliche Resultate:
Hautfaltendicke, Körperimpedanz, Röntgenbildauswertungen,
(Nah-)Infrarotmessungen, Ultraschallanalysen u.a. Der
body mass
index (BMI) - definidert als Körpermasse M (in Kilogramm) dividiert
durch das Quadrat der Körpergröße L (in Metern) - berücksichtigt weder
Alter, Geschlecht, Trainingszustand noch Gesundheitszustand. Die Kreatininausscheidung im Harn (~1-2 g/d) nimmt linear mit der Muskelmasse zu:
Kreatinin ist ein Endprodukt des Muskelstoffwechsels und wird
kontinuierlich renal eliminiert. Aufbautraining erhöht, Immobilisierung
senkt die Kreatininausscheidung. Die Kreatininkonzentration dient als
Bezugsgröße zur Beurteilung anderer Konzentrationswerte im Harn Der Anteil des Fettgewebes beträgt 5 bis 50% des Körpergewichts (Männer 10-25%, Frauen 15-30%), es beansprucht mit 10-20% des Körpergewichts ~10% des Herzzeitvolumens. Fettzellen sind reich an Insulinrezeptoren, postprandial werden Neutralfette aus Glycerin und Fettsäuren gebildet; Glukagon, Adrenalin, Cortisol bauen
Fett zu Glycerin und Fettsäuren ab. Es gibt
verschiedene Arten von Fettgewebe (Baufett, Speicherfett; subkutanes, viszerales, epikardiales, perivasales
Fett), diese exprimieren Hormonrezeptoren unterschiedlich intensiv.
Intraabdominelles (viszerales) Fettgewebe ist metabolisch und hormonell
besonders aktiv (Adiponektin, Leptin etc, Zytokine). Mit steigender Fettmasse nimmt der Insulinspiegel zu Der Anteil des Fettgewebes beträgt 5 bis 50% des Körpergewichts (Männer 10-25%, Frauen 15-30%), es beansprucht mit 10-20% des Körpergewichts ~10% des Herzzeitvolumens. Fettzellen sind reich an Insulinrezeptoren, postprandial werden Neutralfette aus Glycerin und Fettsäuren gebildet; Glukagon, Adrenalin, Cortisol bauen
Fett zu Glycerin und Fettsäuren ab. Es gibt
verschiedene Arten von Fettgewebe (Baufett, Speicherfett; subkutanes, viszerales, epikardiales, perivasales
Fett), diese exprimieren Hormonrezeptoren unterschiedlich intensiv.
Intraabdominelles (viszerales) Fettgewebe ist metabolisch und hormonell
besonders aktiv (Adiponektin, Leptin etc, Zytokine). Mit steigender Fettmasse nimmt der Insulinspiegel zu Braune Fettzellen sind klein, haben eine runden Zellkern und zahlreiche Mitochondrien. Braunes Fettgewebe ist stark vaskularisiert, erzeugt Wärme und ist aktivierbar durch Irisin (bei Kindern ausgeprägt). Weiße
Fettzellen sind größer , speichern Neutralfette in einem zentralen
Fettropfen (Zellkern sichelförmig); ihre kleinen Mitochondrien sind
lipolytisch aktiv (sympathisch / durch Muskelaktivität anregbar), es ist endokrin aktiv und verfügt über zahlreiche
Rezeptoren. Es kommt subkutan (größerer Masseanteil) und viszeral
(intraabdominell - in Omentum, Mesenterien) vor; Blut aus subkutanem
Fett gelangt in den systemischen Kreislauf (freie Fettsäuren von
Subkutis zur Muskulatur), aus viszeralem Fett zu Pfortadersystem und
Leber. Weiße Adipozyten können sich in beige oder rosa Zellen
verwandeln und thermogenetisch aktiv werden (verringertes Risiko für
Diabetes 2); sie produzieren Leptin, das bei gestillten Babies die Neigung zu Fettsucht reduziert Braune Fettzellen sind klein, haben eine runden Zellkern und zahlreiche Mitochondrien. Braunes Fettgewebe ist stark vaskularisiert, erzeugt Wärme und ist aktivierbar durch Irisin (bei Kindern ausgeprägt). Weiße
Fettzellen sind größer , speichern Neutralfette in einem zentralen
Fettropfen (Zellkern sichelförmig); ihre kleinen Mitochondrien sind
lipolytisch aktiv (sympathisch / durch Muskelaktivität anregbar), es ist endokrin aktiv und verfügt über zahlreiche
Rezeptoren. Es kommt subkutan (größerer Masseanteil) und viszeral
(intraabdominell - in Omentum, Mesenterien) vor; Blut aus subkutanem
Fett gelangt in den systemischen Kreislauf (freie Fettsäuren von
Subkutis zur Muskulatur), aus viszeralem Fett zu Pfortadersystem und
Leber. Weiße Adipozyten können sich in beige oder rosa Zellen
verwandeln und thermogenetisch aktiv werden (verringertes Risiko für
Diabetes 2); sie produzieren Leptin, das bei gestillten Babies die Neigung zu Fettsucht reduziert  Der Leptinspiegel
im Blut ist proportional zur Größe der Fettspeicher (Höchstwerte in der
Nacht). Leptin hemmt den Hunger (hypothalamische Rezeptoren) und wirkt
auf Fett-, kardiovaskuläres, Immun-, Reproduktions-, Nerven-,
Knochengewebe. Der Leptinrezeptor gehört zur Zytokinrezeptor-Familie
und funktioniert über den JAK-STAT- Mechanismus. Adiponektin
wird von "leeren" Fettzellen gebildet, sein Blutspiegel verhält sich
umgekehrt proportional zur Größe der Fettspeicher. Es wirkt
vasodilatierend,
entzündungshemmend, erhöht die Insulinsensitivität, die Glucoseaufnahme und vermittelt unmittelbare Wärmebildung durch Entkopplung der Atmungskette (UCP). Der Rezeptor ist heptahelikal (metabotrop). Der Visfatinspiegel
korreliert mit der Größe der Fettspeicher. Visfatin aktiviert
Insulinrezeptoren und senkt den Blutzuckerspiegel. - Fettzellen bilden
weiters Stickstoffmonoxid (NO), Steroidhormone (Cortisol, Östradiol),
Zytokine (IL-1, IL-6, TNFα), Prostaglandine, Histamin, Katecholamine Der Leptinspiegel
im Blut ist proportional zur Größe der Fettspeicher (Höchstwerte in der
Nacht). Leptin hemmt den Hunger (hypothalamische Rezeptoren) und wirkt
auf Fett-, kardiovaskuläres, Immun-, Reproduktions-, Nerven-,
Knochengewebe. Der Leptinrezeptor gehört zur Zytokinrezeptor-Familie
und funktioniert über den JAK-STAT- Mechanismus. Adiponektin
wird von "leeren" Fettzellen gebildet, sein Blutspiegel verhält sich
umgekehrt proportional zur Größe der Fettspeicher. Es wirkt
vasodilatierend,
entzündungshemmend, erhöht die Insulinsensitivität, die Glucoseaufnahme und vermittelt unmittelbare Wärmebildung durch Entkopplung der Atmungskette (UCP). Der Rezeptor ist heptahelikal (metabotrop). Der Visfatinspiegel
korreliert mit der Größe der Fettspeicher. Visfatin aktiviert
Insulinrezeptoren und senkt den Blutzuckerspiegel. - Fettzellen bilden
weiters Stickstoffmonoxid (NO), Steroidhormone (Cortisol, Östradiol),
Zytokine (IL-1, IL-6, TNFα), Prostaglandine, Histamin, Katecholamine |
