Die Einheit der Energie im SI-System ist das
Joule (J):

Das Newton (N) ist die SI-Einheit für die Kraft: Masse x Beschleunigung (kg x m/s2). Energie (Arbeit) kann also als Kraft mal Weg dargestellt werden. Arbeit ist der mechanische Ausdruck einer (umgesetzten) Energiemenge.

Über das
SI-System (Präfixe und Einheiten)
s.
dort
 (W) ist die Einheit der Leistung: 1 W = 1 J/s. Leistung ist die in einer Zeitspanne umgesetzte Energie.
(W) ist die Einheit der Leistung: 1 W = 1 J/s. Leistung ist die in einer Zeitspanne umgesetzte Energie.
1 J/s entspricht 1 W (entspricht 0,06 kJ/min)
|

Eine 100-Watt-Glühlampe
verbraucht gleich viel (oder sogar mehr) Energie als eine erwachsene
Person bei körperlicher Ruhe (≤100 J/s). Das zeugt vom effizienten Umgang des
Stoffwechsels mit seinen
Ressourcen.
Energie wird im Stoffwechsel hauptsächlich durch den
oxidativen Abbau von Kohlenhydraten und Fetten bereitgestellt.
Metabolisiert eine Person z.B. 400 g Glucose, bringt dies 6,8 MJ - mehr
als die Hälfte des 24-Stunden-Energiebedarfs einer erwachsenen Person, die mäßig
körperlich aktiv ist (der Rest kommt aus dem Abbau anderer Energieträger - wie Lipiden und Proteinen).
Zum Beispiel: Metabolisiert man 1 mol Glucose (180 g), entstehen
6 mol Wasser (~0,1 Liter), und 6 mol Sauerstoff (~134
Liter) werden
verbraucht (6 x 22,4).


Energiequellen: Zufuhr an Eiweiß, Fetten und Kohlenhydraten (Richtwerte)

|
Protein
|
Fette |
Kohlenhydrate / Ballaststoffe (Nahrungsfasern)
|
| ~1
g/kg KG /d (0,8 bis 2,5), im Regelfall ~10% des Energiebedarfs -
abhängig von Alter und Geschlecht; bei Frauen auch Gravidität /
Stillperiode
|
30% der Energiezufuhr
(≤10% gesättigte, ~7% mehrfach ungesättigte FS) |
50-60% des Energiebedarfs, Ballaststoffe (Erwachsene) 30 g/d (auch bei Reduktionskost / Gewichtsabnahme)
|
Die mit der Nahrung zugeführten Biomoleküle werden in drei Hauptrichtungen genutzt:
 Als unmittelbare Energielieferanten - Bindungsenergie für den Aufbau
energiereicher Phosphate (ATP, CP), was vor allem benötigt wird
Als unmittelbare Energielieferanten - Bindungsenergie für den Aufbau
energiereicher Phosphate (ATP, CP), was vor allem benötigt wird

für aktiven Transport über Kompartmentgrenzen (z.B. Na-K-Pumpe) als
Grundlage von Homöostase, Membranpotentialaufbau, Ausscheidungsvorgängen

zum Antreiben mechanischer Arbeit
(Bewegung, Verformung, Muskelkontraktion)
 Zur Biosynthese neuer Moleküle (Erneuerung, Wachstum, Immunabwehr, Sekretion..)
Zur Biosynthese neuer Moleküle (Erneuerung, Wachstum, Immunabwehr, Sekretion..)
 Zur Energiespeicherung (vor allem Fett, Glykogen). Kohlenhydrate
sind wasserlöslich und üben in der Zelle einen deutlichen osmotischen
Effekt aus (Leber- und Muskelzellen schützen sich, indem sie Glucose zu
Glykogen polymerisieren und den osmotischen Effekt so minimieren). Fette hingegen sind nicht wasserlöslich und bilden Fetttröpfchen
als Speicherform (Neutralfette und Fettsäuren); Wasser ist hier
ausgeschlossen, und Energie kann in hoher Dichte gespeichert werden.
Zur Energiespeicherung (vor allem Fett, Glykogen). Kohlenhydrate
sind wasserlöslich und üben in der Zelle einen deutlichen osmotischen
Effekt aus (Leber- und Muskelzellen schützen sich, indem sie Glucose zu
Glykogen polymerisieren und den osmotischen Effekt so minimieren). Fette hingegen sind nicht wasserlöslich und bilden Fetttröpfchen
als Speicherform (Neutralfette und Fettsäuren); Wasser ist hier
ausgeschlossen, und Energie kann in hoher Dichte gespeichert werden.
 Zur Zeitabhängigkeit der Nutzung verschiedener Energiequellen im Muskel s. dort
Zur Zeitabhängigkeit der Nutzung verschiedener Energiequellen im Muskel s. dort
 Als Grundumsatz (Basal metabolic rate BMR) bezeichnet man den Energieumsatz
Als Grundumsatz (Basal metabolic rate BMR) bezeichnet man den Energieumsatz
nach ruhig durchschlafener
Nacht, Nahrungskarenz für mindestens 12 Stunden, mindestens einer
Stunde körperlicher Ruhe, Indifferenztemperatur (an der Luft normalerweise zwischen 27 und 31°C, in Wasser ~35°C) sowie Abwesenheit psychischer und physischer
Belastung. Er beträgt bei einer erwachsenen Person etwa 6 kJ/min. Am Grundumsatz sind vor allem folgende Organe bzw. Gewebe beteiligt:
Gehirn ~24%, Skelettmuskulatur ~22%, Leber ~21%, Herzmuskel ~10%, Nieren ~10%.
Die Referenzwerte für den physiologischen Grundumsatz sind durch zahlreiche Faktoren beeinflusst, wie
 Körpergewicht
Körpergewicht
 Körpergröße (beide steigern den Grundumsatz)
Körpergröße (beide steigern den Grundumsatz)
 Körperzusammensetzung
- diese ist u.a. geschlechtsabhängig (Fettanteil bei
Männern ~10-15%, bei Frauen ~20-25% des Körpergewichts). Männer weisen
daher im Mittel einen höheren Grundumsatz auf als gleich schwere Frauen.
Körperzusammensetzung
- diese ist u.a. geschlechtsabhängig (Fettanteil bei
Männern ~10-15%, bei Frauen ~20-25% des Körpergewichts). Männer weisen
daher im Mittel einen höheren Grundumsatz auf als gleich schwere Frauen.

 Die fettfreie Masse (FFM - Frauen 75-80%, Männer 85-90% der Körpermasse) besteht hauptsächlich aus Muskulatur und ist
stoffwechselintensiv, ihr Gewicht steht mit der Energieproduktion des
Körpers in linearem Zusammenhang; Aufgabe des Fettgewebes ist hingegen
die Speicherung von Energie über längere Zeit (nicht deren akute
Freisetzung).
Die fettfreie Masse (FFM - Frauen 75-80%, Männer 85-90% der Körpermasse) besteht hauptsächlich aus Muskulatur und ist
stoffwechselintensiv, ihr Gewicht steht mit der Energieproduktion des
Körpers in linearem Zusammenhang; Aufgabe des Fettgewebes ist hingegen
die Speicherung von Energie über längere Zeit (nicht deren akute
Freisetzung).


Tageszyklische Schwankungen - nach Nahrungsaufnahme ist der Grundumsatz erhöht (
spezifisch-dynamische Wirkung)
 Fieber, posttraumatische Stoffwechsellagen
Fieber, posttraumatische Stoffwechsellagen


Einige Hormone (
Thyroxin,
Progesteron,
Adrenalin,
Wachstumshormone,
Cortisol) erhöhen den Grundumsatz.
 Als Ruheumsatz (Resting metabilic rate RMR) wird der Energieumsatz bezeichnet, bei dem keine Muskelarbeit geleistet
wird. Wie beim Grundumsatz sollte
die Person nüchtern sein (letzte Nahrungsaufnahme 8 Stunden vor der
Messung), um eine spezifisch-dynamische Wirkung auszuschließen. Im Gegensatz zum Grundumsatz ist keine psychische Entspanntheit gefordert; der Ruheumsatz dies dient als Vergleichsmaß
für Arbeitsumsatzmessungen, sein Betrag liegt um 5-10% über dem des
Grundumsatzes. Der
Ruheumsatz macht meist 50-75% des täglichen Energieumsatzes aus.
Als Ruheumsatz (Resting metabilic rate RMR) wird der Energieumsatz bezeichnet, bei dem keine Muskelarbeit geleistet
wird. Wie beim Grundumsatz sollte
die Person nüchtern sein (letzte Nahrungsaufnahme 8 Stunden vor der
Messung), um eine spezifisch-dynamische Wirkung auszuschließen. Im Gegensatz zum Grundumsatz ist keine psychische Entspanntheit gefordert; der Ruheumsatz dies dient als Vergleichsmaß
für Arbeitsumsatzmessungen, sein Betrag liegt um 5-10% über dem des
Grundumsatzes. Der
Ruheumsatz macht meist 50-75% des täglichen Energieumsatzes aus.
 Als Arbeits- bzw. Leistungsumsatz (Aktivitätsbedingter Erergieverbrauch, Physical activity energy expenditure) bezeichnet man den Energieumsatz einer Person, die eine entsprechende Muskelarbeit vollbringt. Bei maximaler Belastung nimmt der Energieumsatz (je nach
Trainingszustand) um das 10- bis 20-fache zu. Der
Sauerstoffverbrauch steigt proportional dazu an, da die Energie zum Großteil aerob gewonnen wird.
Als Arbeits- bzw. Leistungsumsatz (Aktivitätsbedingter Erergieverbrauch, Physical activity energy expenditure) bezeichnet man den Energieumsatz einer Person, die eine entsprechende Muskelarbeit vollbringt. Bei maximaler Belastung nimmt der Energieumsatz (je nach
Trainingszustand) um das 10- bis 20-fache zu. Der
Sauerstoffverbrauch steigt proportional dazu an, da die Energie zum Großteil aerob gewonnen wird.

Zur
Bestimmung des Energieumsatzes s.
dort
Lipide, Kohlenhydrate, Aminosäuren / Peptide
Man kann sich die Energieversorgung wie ein
System kommunizierender Kompartimente vorstellen, wobei einige Verbindungswege nur in einer Richtung ablaufen (Pfeile in der  Abbildung):
Abbildung):

 Abbildung: Stoffwechselwege
Abbildung: Stoffwechselwege
Nach einer Vorlage bei Langley LL, Homeostasis. Reinhold, New York 1965
Der Körper verfügt über drei unmittelbare Nährstoffpools (freie Fettsäuren, Glucose, Aminosäuren) - hauptsächlich im Blutplasma -, diese stehen für den sofortigen Verbrauch
zur Verfügung: Für freie Fettsäuren (links), Glucose (Mitte) und
Aminosäuren (rechts).
In diesem hydrostatischen Modell deutet die Position (Höhe) der
Reservoirs - wie bei einem System kommunizierender Gefäße - die
Verfügbarkeit
von Metaboliten für die Energiegewinnung in Abhängigkeit von der
Speichergröße ("Wasserstand")
an.
Zum Beispiel gelangt bei Hyperglykämie Zucker in den Harn (Überforderung des tubulären Maximums),
während umgekehrt der Gehirnstoffwechsel auch bei geringem
Blutzuckerspiegel (Hypoglycämie) noch Zugang zum Glucosepool hat.
Glucose kann zu Fettsäuren, aber Fettsäuren können nicht zu Zucker
(oder Aminosäuren) konvertiert werden. Einige Aminosäuren können in
Glucose umgewandelt werden, sie sind "glucoplastisch"
 Diese Pools bieten einen kurzfristigen Vorrat für den Stoffwechsel und werden von verschiedenen anderen
Kompartimenten gespeist - und versorgen diese andererseits mit
Bausteinmolekülen:
Diese Pools bieten einen kurzfristigen Vorrat für den Stoffwechsel und werden von verschiedenen anderen
Kompartimenten gespeist - und versorgen diese andererseits mit
Bausteinmolekülen:
Lipide
sind eine sehr heterogene Gruppe von Verbindungen. Sie dienen verschiedenen Aufgaben, wie
 Energiespeicherung und thermische Isolierung (Triglyzeride in Fettgewebe)
Energiespeicherung und thermische Isolierung (Triglyzeride in Fettgewebe)
 Strukturträger (in Zellmembranen, als mechanischer Schutz von Organen)
Strukturträger (in Zellmembranen, als mechanischer Schutz von Organen)
 Signalmoleküle (Immunsystem, Zellwachstum etc)
Signalmoleküle (Immunsystem, Zellwachstum etc)
 Thermogenese (braunes Fettgewebe)
Thermogenese (braunes Fettgewebe)
 Verdauung (Lipidanteil von Gallensäuren)
Verdauung (Lipidanteil von Gallensäuren)
 Lipide aus der Nahrung werden gespalten und die Bruchstücke dem Speicherpool
zugeführt. Der Pool freier (=nicht glycerinester-gebundener) Fettsäuren (non-esterified fatty acids, NEFA) erhält solche Bruchstücke aus der Nahrung sowie als "Überschussmoleküle" aus dem
allgemeinen Stoffwechsel.
Lipide aus der Nahrung werden gespalten und die Bruchstücke dem Speicherpool
zugeführt. Der Pool freier (=nicht glycerinester-gebundener) Fettsäuren (non-esterified fatty acids, NEFA) erhält solche Bruchstücke aus der Nahrung sowie als "Überschussmoleküle" aus dem
allgemeinen Stoffwechsel.
 Lipogenese (de-novo-Biosynthese) versorgt den Körperfettspeicher aus dem Pool freier Fettsäuren sowie aus dem Pool überschüssiger Glucose (das geht nur in dieser Richtung, nicht zu Glucose zurück). Die wichtigsten Orte der Fettsäuresynthese sind Leber, Fettgewebe, Muskelfett und bei Frauen die Brustdrüse.
Lipogenese (de-novo-Biosynthese) versorgt den Körperfettspeicher aus dem Pool freier Fettsäuren sowie aus dem Pool überschüssiger Glucose (das geht nur in dieser Richtung, nicht zu Glucose zurück). Die wichtigsten Orte der Fettsäuresynthese sind Leber, Fettgewebe, Muskelfett und bei Frauen die Brustdrüse.
 Lipolyse
leitet
freie Fettsäuren aus der Spaltung von Körperfett in den
Fettsäurepool. Fettsäuren werden dann über ß-Oxidation zu Acetat und
dieses über den Citratzyklus für die Energiegewinnung verbraucht (
Lipolyse
leitet
freie Fettsäuren aus der Spaltung von Körperfett in den
Fettsäurepool. Fettsäuren werden dann über ß-Oxidation zu Acetat und
dieses über den Citratzyklus für die Energiegewinnung verbraucht ( Abbildung). Die Lipolyse wird u.a. ß-adrenerg und durch
Wachstumshormon angeregt (dann steigt der Spiegel freier Fettsäuren im
Kreislauf), α2-adrenerg gehemmt.
Abbildung). Die Lipolyse wird u.a. ß-adrenerg und durch
Wachstumshormon angeregt (dann steigt der Spiegel freier Fettsäuren im
Kreislauf), α2-adrenerg gehemmt.

 Abbildung: Lipolyse
Abbildung: Lipolyse
Nach einer Vorlage in in Silverthorn, Human Physiology - an integrated approach, 4th ed. 2007 (Pearson International)
Aus
körpereigenen Triglyzeriden werden Fettsäuren (gelangen in
Mitochondrien) und Glyzerin (dient als Substrat für die Glykolyse, es
entsteht Pyruvat). Fettsäuren unterliegen der Beta-Oxidation, es
entsteht Acetat. Sowohl Acetat als auch Pyruvat können in die oxidative
Phosphorylierung eintreten (letzteres nach Abspaltung eines C-Atoms).
Acetyl-CoA reicht Acetat an den Citratzyklus weiter. Dieser stellt Proteinkomplexen der Atmungskette an der inneren Mitochoindrienmembran energiereiche Elektronen über Coenzyme (NADH, FADH2) zur Verfügung. Resultat ist die Synthese von ATP

 Fettsäuren im Extrazellulärraum stammen aus dem Fettgewebe - Lipoproteinlipase spaltet sie aus Neutralfetten ab, Adipozyten nehmen sie auf und deponieren sie durch Veresterung
wieder als Neutralfette. Bei Bedarf werden diese gespalten
(hormonsensitive Lipasen) und Fettsäuren wieder an das Blut abgegeben.
Fettsäuren im Extrazellulärraum stammen aus dem Fettgewebe - Lipoproteinlipase spaltet sie aus Neutralfetten ab, Adipozyten nehmen sie auf und deponieren sie durch Veresterung
wieder als Neutralfette. Bei Bedarf werden diese gespalten
(hormonsensitive Lipasen) und Fettsäuren wieder an das Blut abgegeben.
Ihr Blutspiegel (um 1 mM, hauptsächlich albumingebunden) verhält sich umgekehrt proportional
zum Blutzuckerspiegel; nach einer "durchfasteten" Nacht ist [NEFA] am
höchsten (Fettutilisation), der Glucosespiegel am niedrigsten
(Glykogenvorräte erschöpft). Nach Einnahme eines Frühstücks nimmt der
Insulinspiegel zu, das senkt die Lipolyse im Fettgewebe und folglich
den Fettsäurespiegel (bis unter 0,1 mM). Der NEFA-Spiegel schwankt
also wesentlich stärker als der des Blutzuckers.
Die relativ niedrigen Serumwerte (im Vergleich zu Glucose: 4-5 mM)
dürfen nicht darüber hinwegtäuschen, dass Fettsäuren eine wichtige
Energiequelle für den Organismus darstellen - sie werden sehr rasch
umgesetzt (vor allem von Muskel- und Leberzellen).
Im Blutplasma sind Fettsäuren hauptsächlich an Albumin angelagert; dennoch werden sie rasch umgesetzt, ihre Halbwertszeit im Blutplasma beträgt nur wenige Minuten. Je mehr Fettsäuren die Adipozyten abgeben und je höher ihre Konzentration im Blut ist, desto rascher werden sie umgesetzt (angebotsorientierter Metabolismus).
An Chylomikronen oder VLDL-Partikel gebundene Triglyzeride werden ebenfalls rasch umgesetzt (Halbwertszeit 5-10 Minuten), andere Triglyzeride verweilen über mehrere Stunden im Kreislauf (Triglyzeridkonzentration im Plasma individuell sehr unterschiedlich, Richtwert ~1 mM, nach nächtlichen Fastenperioden ~0,5 mM).
Nahrungsfette liegen fast ausschließlich in der Form von Triglyzeriden
vor; ihre Resorption erfolgt viel langsamer als die von Zucker oder
Aminosäuren. Sie werden in Chylomikronen eingelagert (die über die
Lymphe abtransportiert werden und an der Leber vorbei in den Kreislauf
gelangen), diese trüben das Plasma einige Stunden nach der
Nahrungsaufnahme sichtlich ein (milchiges Aussehen). Die Konzentration
an Neutralfetten im Plasma kann bis auf ~2
mM ansteigen (in Chylomikronen bis auf 0,4 mM). Hauptabnehmer der
Triglyzeride sind dann Fett- und Muskelgewebe (beide exprimieren Lipoproteinlipase,
deren Aktivität durch Insulin angeregt wird) - Fettzellen speichern,
Skelett- und Herzmuskelzellen oxidieren die aufgenommenen Fettsäuren.
In beiden Fällen werden die aufgenommenen Fettsäuren durch zelleigene
Fetttröpfchen geroutet, bevor sie vom oxidativen System utilisiert
werden.
Kohlenhydrate
stammen einerseits aus der Nahrung
(postprandial  ), andererseits fallweise aus körpereigenen Glykogenreserven (Glykogenolyse) und auch aus glucoplastischen
Aminosäuren (postresorptiv, Hungerstoffwechsel). Bei hoher Glucoseverfügbarkeit bildet der Körper Glykogenreserven (Glykogensynthese), bei Bedarf baut er diese wieder ab (Glykogenolyse).
), andererseits fallweise aus körpereigenen Glykogenreserven (Glykogenolyse) und auch aus glucoplastischen
Aminosäuren (postresorptiv, Hungerstoffwechsel). Bei hoher Glucoseverfügbarkeit bildet der Körper Glykogenreserven (Glykogensynthese), bei Bedarf baut er diese wieder ab (Glykogenolyse).
Glucosepool: Das Blut und extrazelluläre Flüssigkeiten verfügen über einen begrenzten Glucosevorrat:
Der Blutzuckerspiegel beträgt ~5 mM (~90 mg/dl), bei 13 l
extrazellulärer Flüssigkeit (10 l interstitiell plus 3 l Blutplasma) entspricht das einer Menge von
~12 Gramm. Wie weit kommt man damit?
Eine erwachsene Person
verstoffwechselt in 24 Stunden mindestens 200 g Glucose. Ohne
Glucosenachschub würde in diesem Fall der Blutzuckerspiegel innerhalb
einer halben Stunde etwa auf die Hälfte absinken, was starke Hypoglykämie
(mit entsprechenden Symptomen) bedeutet. Daraus folgt, dass der
Glucosenachschub in den extrazellulären Glucosepool verlässlich
gesichert sein muss - entweder durch Resorption von Zucker aus dem Darm
oder durch Bereitstellung aus körpereigenen Reserven (Glykogenolyse,
Gluconeogenese) -, insbesondere um das Gehirn leistungsfähig zu
erhalten.
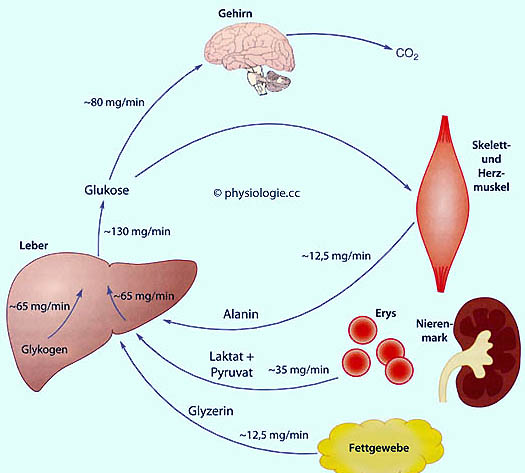
 Abbildung: Glucosemetabolismus im Nüchternzustand (postdigestiv)
Abbildung: Glucosemetabolismus im Nüchternzustand (postdigestiv)
Nach einer Vorlage in Frayn / Evans, Human Metabolism - A Regulatory Perspective, 4th ed. Wiley Blackwell 2019
Die Zahlen beziehen sich auf eine etwa 65 kg schwere Person. Das Gehirn oxidiert die Glucose vollständig tzu CO2.
Die an Muskulatur, Fettgewebe und andere Gewebe (die auch Fettsäuren
verbrennen) gehende Glucose wird zum Teil oxidativ abgebaut, zum Teil
recycelt.
Im Cori-Zyklus "sendet" die Leber
Glucose an arbeitende Muskeln sowie an Erythrozyten, die wiederum
Lactat an die Leber zum Zweck der Gluconeogenese "retournieren" -
wodurch Lactacidose verhindert werden kann, Glucose neu gebildet wird
und NADH (über Lactatdehydrogenase) regeneriert wird

Zur digestiven Phase s.
dort
 Glucose ist das führende Substrat für die Energieproduktion der Zelle,
denn die aerobe Glykolyse (Citratzyklus) ist der effizienteste Weg, ATP
zu produzieren. Außerdem ist Glucose normalerweise das einzige Substrat
für die ATP-Synthese in Nervenzellen. Für kurze Zeit (wenige Stunden)
kann Glucose bei Bedarf aus Glykogen gewonnen werden (Glykogenolyse
in Leber- und Muskelzellen), über längere Zeitspannen reicht dieser
Vorrat nicht aus, und Glucose muss aus Lipiden (bzw. deren Glyzerin)
und Protein (bzw. deren Aminosäuren) gewonnen werden (Gluconeogenese).
Glucose ist das führende Substrat für die Energieproduktion der Zelle,
denn die aerobe Glykolyse (Citratzyklus) ist der effizienteste Weg, ATP
zu produzieren. Außerdem ist Glucose normalerweise das einzige Substrat
für die ATP-Synthese in Nervenzellen. Für kurze Zeit (wenige Stunden)
kann Glucose bei Bedarf aus Glykogen gewonnen werden (Glykogenolyse
in Leber- und Muskelzellen), über längere Zeitspannen reicht dieser
Vorrat nicht aus, und Glucose muss aus Lipiden (bzw. deren Glyzerin)
und Protein (bzw. deren Aminosäuren) gewonnen werden (Gluconeogenese).
 Als Gluconeogenese bezeichnet man die Bildung von Glucose aus Glyzerin (aus Fetten), aus Aminosäuren (aus Peptiden / Proteinen) oder aus Lactat (nonglucose precursors). Nur Leber- und Nierenzellen verfügen über ausreichende Mengen an Glucose-6-Phosphatase,
um aus dem dabei auftretenden Metaboliten Glucose-6-Phosphat
wesentliche Mengen Phosphat zu entfernen und Glucose freizusetzen.
Als Gluconeogenese bezeichnet man die Bildung von Glucose aus Glyzerin (aus Fetten), aus Aminosäuren (aus Peptiden / Proteinen) oder aus Lactat (nonglucose precursors). Nur Leber- und Nierenzellen verfügen über ausreichende Mengen an Glucose-6-Phosphatase,
um aus dem dabei auftretenden Metaboliten Glucose-6-Phosphat
wesentliche Mengen Phosphat zu entfernen und Glucose freizusetzen.
Gluconeogenese erfolgt zu 90% des Körperbedarfs in der Leber, die dazu ihren Glykogenvorrat, aber auch andere Substrate (wie Lactat, Pyruvat, Alanin
- vor allem aus der Muskulatur) gluconeogenetisch nützen kann ( Abbildung), zu 10% in Dünndarm und Nieren. Hauptabnehmer sind Gehirn (Verbrauch 5-6 g/h), arbeitende Muskulatur, Erythrozyten (denen die Fähigkeit zur aeroben Glykolyse fehlt) und Nieren.
Abbildung), zu 10% in Dünndarm und Nieren. Hauptabnehmer sind Gehirn (Verbrauch 5-6 g/h), arbeitende Muskulatur, Erythrozyten (denen die Fähigkeit zur aeroben Glykolyse fehlt) und Nieren.
Die Muskulatur kann aus ihrem Glykogenvorrat (im
Gegensatz zur Leber) auf direktem Wege nichts zum Auffüllen des
extrazellulären Glucosepools beitragen, da sie keine Glucose-6-Phosphatase exprimiert. Indirekt kann sie das aber doch:
Durch Lactat, das beim anaeroben Glucoseabbau anfällt (Lactazidose bei
erschöpfender Muskelarbeit) und von der Leber für Gluconeogenese
genutzt werden kann.
 Als aerob bezeichnet man zelluläre Energiegewinnung unter Nutzung von Sauerstoff und damit der oxidativen Phosphorylierung, als anaerob zelluläre Energiegewinnung durch anoxidativen Stoffwechsel (anaerobe Glykolyse).
Als aerob bezeichnet man zelluläre Energiegewinnung unter Nutzung von Sauerstoff und damit der oxidativen Phosphorylierung, als anaerob zelluläre Energiegewinnung durch anoxidativen Stoffwechsel (anaerobe Glykolyse).
Zufuhr in den, und Abtransport aus dem Glucosepool stehen unter hormoneller Kontrolle (Insulin, Glucagon usw.) in einer Weise, die den Blutzuckerspiegel im Normbereich halten soll. Der Gehirnstoffwechsel
ist ein exklusiver Verbraucher des Glucosemetabolismus, er saugt auch
bei niedrigem Blutzuckerspiegel - der Zucker für andere Verbraucher
unerreichbar macht - Glucose für seinen Bedarf ab.
 Obligat glucoseabhängig sind das Gehirn (kein Zugang für Fettsäuren über die Blut-Hirn-Schranke), das Nierenmark, Erythrozyten (keine Mitochondrien!) und Fibroblasten.
Regulation der Gluconeogenese: Diese erfolgt durch Einfluss auf involvierte Enzyme,
sowohl über Hormone als auch über Teilnehmer des metabolischen Ablaufs.
Gluconeogenese wird vor allem bei niedrigem Blutzuckerspiegel und
geringen hepatischen Glykogenreserven aktiviert.
Obligat glucoseabhängig sind das Gehirn (kein Zugang für Fettsäuren über die Blut-Hirn-Schranke), das Nierenmark, Erythrozyten (keine Mitochondrien!) und Fibroblasten.
Regulation der Gluconeogenese: Diese erfolgt durch Einfluss auf involvierte Enzyme,
sowohl über Hormone als auch über Teilnehmer des metabolischen Ablaufs.
Gluconeogenese wird vor allem bei niedrigem Blutzuckerspiegel und
geringen hepatischen Glykogenreserven aktiviert.

Gluconeogenese wird
angeregt durch Glucagon, Cortisol, Thyroxin; Citrat, Acetyl-Coenzym A

Gluconeogenese wird
inhibiert durch ADP, AMP, Fructose 2,6-Biphosphat
Aminosäuren
 Zu Aminosäuren und Proteinen s. auch dort
Zu Aminosäuren und Proteinen s. auch dort
Aminosäuren sind die Bausteine, aus denen Proteine aufgebaut sind. Proteine
(der Körper einer erwachsenen Person enthält ungefähr 10 kg Eiweiß)
sind die Werkzeuge und Funktionsträger der Zelle und haben enorme
Funktionsbreite, wie die folgenden Beispiele zeigen:
 Sie verleihen Strukturen Festigkeit (Knochen, Bindegewebe, Muskeln, Nägel, Haare etc)
Sie verleihen Strukturen Festigkeit (Knochen, Bindegewebe, Muskeln, Nägel, Haare etc)
 Als Enzyme regulieren sie praktisch jeden Schritt des Stoffwechsels (einschließlich ihre eigene Synthese)
Als Enzyme regulieren sie praktisch jeden Schritt des Stoffwechsels (einschließlich ihre eigene Synthese)
 Proteine
können andere Moleküle transportieren (einschließlich Atemgase, Lipide,
Spurenelemente, Hormone; spezielle Proteinkomplexe befördern Stoffe
durch Zellmembranen)
Proteine
können andere Moleküle transportieren (einschließlich Atemgase, Lipide,
Spurenelemente, Hormone; spezielle Proteinkomplexe befördern Stoffe
durch Zellmembranen)
 Sie beteiligen sich an der Speicherung anderer Stoffe (z.B. Eisen via Ferritin)
Sie beteiligen sich an der Speicherung anderer Stoffe (z.B. Eisen via Ferritin)
 Sie haben Schutzfunktion (z.B. Antikörper, Komplementfaktoren)
Sie haben Schutzfunktion (z.B. Antikörper, Komplementfaktoren)
 Proteine dienen auch als Informationsträger (Hormone, Transmitter, Mediatoren).
Proteine dienen auch als Informationsträger (Hormone, Transmitter, Mediatoren).

 Abbildung: Aminosäuren
Nach einer Vorlage in Campbell / Urry / Cain /
Wasserman / Minorsky / Orr: Biology, A Global Approach, 12th ed.
Pearson Education Ltd 2021
Abbildung: Aminosäuren
Nach einer Vorlage in Campbell / Urry / Cain /
Wasserman / Minorsky / Orr: Biology, A Global Approach, 12th ed.
Pearson Education Ltd 2021
Carboxy-
und Aminogruppen in ionisierter Form gezeigt (üblich bei einem pH von
7,2 in typischen Zellen). Nonpolare Seitengruppen verhalten sich
hydrophob, andere sind wasserlöslich. Saure Aminosäuren haben negativ
geladene, basische positiv geladene Seitenketten

 Als Aminosäurepool bezeichnet
man die Gesamtheit der frei verfügbaren Aminosäuren, die in
verschiedenen Kompartimenten des Körpers verteilt sind. Er unterliegt
einem dynamischen Gleichgewicht, d.h. der konstanten Neusynthese und
ständigem Abbau. Primär wird er (außer im Hungerzustand oder bei
Fehlernährung) durch Nachschub aus dem Darm aufgefüllt; in der Niere
filtrierte Aminosäuren werden in den Kreislauf rückresorbiert.
Nicht-essentielle Aminosäuren können metabolisch neu synthetosoert
werden, essentielle müssen mit der Nahrung zugeführt werden. Ist der
Aminosäurepool "überfüllt", werden einige zu Pyruvat und weiter über
den Citratzyklus abgebaut. Dabei fällt Stickstoff an, dieser wird
(hauptsächlich über Harnstoff) renal ausgeschieden.
Als Aminosäurepool bezeichnet
man die Gesamtheit der frei verfügbaren Aminosäuren, die in
verschiedenen Kompartimenten des Körpers verteilt sind. Er unterliegt
einem dynamischen Gleichgewicht, d.h. der konstanten Neusynthese und
ständigem Abbau. Primär wird er (außer im Hungerzustand oder bei
Fehlernährung) durch Nachschub aus dem Darm aufgefüllt; in der Niere
filtrierte Aminosäuren werden in den Kreislauf rückresorbiert.
Nicht-essentielle Aminosäuren können metabolisch neu synthetosoert
werden, essentielle müssen mit der Nahrung zugeführt werden. Ist der
Aminosäurepool "überfüllt", werden einige zu Pyruvat und weiter über
den Citratzyklus abgebaut. Dabei fällt Stickstoff an, dieser wird
(hauptsächlich über Harnstoff) renal ausgeschieden.
Der Aminosäurepool dient in erster Linie dem Eiweißaufbau (300-400 g/d). Bei niedrigem Blutzuckerspiegel allerdings können einige (glucoplastische) Aminosäuren für Gluconeogenese herangezogen werden (insbesondere Alanin,
das in Pyruvat verwandelt werden kann - wie auch Lactat). (Zur
Gluconeogenese wird auch Glycerin genutzt, das aus dem Abbau von Fetten
bezogen werden kann.)
Der Aminosäurepool wird einerseits durch "neues" Eiweiß aus der Ernährung gespeist (~100 g/d), etwa dieselbe Menge wird oxidativ abgebaut (dabei entstehen CO2, Harnstoff, NH3, die ausgeatmet bzw. ausgeschieden werden) - beides entspricht einem Umsatz von ~16 g Stickstoff pro Tag und liefert 10-20% der benötigten Stoffwechselenergie des Körpers; andererseits werden von den rund 10 kg körpereigenem Protein täglich ~300g
ab- und wieder aufgebaut. Einige der Aminosäuren aus dem "Pool" werden
zur Synthese von Hormonen und Nukleinsäuren benötigt; sehr wenig an
Aminosäuren geht nach außen verloren (etwa 2 g/d im Stuhl, ~0,5 g/d mit Hautschuppen).
Die Konzentration freier Aminosäuren unterscheidet sich in der intra-
vs. extrazellulären Flüssigkeit, meist intrazellulär höher als
extrazellulär, wie die folgenden Beispiele zeigen (intrazellulär
gemessen an schockgefrorenen Muskelbiopsieproben):
Konzentration freier Aminosäuren
in Blutplasma vs. Muskelzellen
Werte (teils gerundet) aus Bergström J,
Fürst P, Norée LO, Vinnars E: Intracellular free amino acid
concentration in human muscle tissue. J Appl Physiol 1974; 36: 693-7 |
Aminosäure
|
Plasma, mM
|
Intrazellulär, mM
|
Konzentrations-
verhältnis I:P
|
Glutamin
|
0,57
|
19,5
|
34:1
|
Glutamat
|
0,06
|
4,4
|
73:1
|
Alanin
|
0,33
|
2,3
|
7:1
|
Serin
|
0,12
|
1,0
|
8:1
|
Asparagin
|
0,05
|
0,5
|
10:1
|
Die Leber nimmt verzweigtkettige Aminosäuren (Valin, Leuzin, Isoleuzin) aus der Nahrung (hier stellen sie ~20% der resorbierten Aminosäuren) - im Gegensatz zu anderen - nicht auf, sondern gibt sie an den Kreislauf weiter (vor allem die Muskulatur braucht sie), sodass ihr Anteil nach der Leberpassage ~70%
aller resorbierten Aminosäuren ausmacht. Ihre Aufnahme in die
Muskelzellen entspricht der Plasmakonzentration (als essentielle
Aminosäuren können sie nicht aus anderen synthetisiert werden), und sie
werden teils transaminiert, teils oxidiert (Energiequelle).
Verzweigtkettige Aminosäuren regen die Eiweißsynthese an und hemmen die
Proteolyse.
Zwei weitere Aminosäuren stechen mengenmäßig hervor: Alanin und Glutamin verlassen Muskelzellen - vor allem postresorptiv
- in hohem Ausmaß und werden von der Leber aufgenommen - viel mehr, als
es ihrem Anteil im Muskelgewebe entspricht. Das deutet auf spezifische
Stoffwechselwege für individuelle Aminosäuren hin. Der Glucose-Alanin-Zyklus exportiert Stickstoff aus dem Muskel zwecks Entgiftung zur Leber (dabei
entstehen Harnstoff und Glucose). Glutamin ist u.a. ein wichtiger
Brennstoff für mitotisch aktive Zellen; die Nieren können es
desaminieren (dabei entstehen Glutamat und Oxoglutarat). Glutamin wird
weiters im Darm zu Citrullin umgebaut, dieses gelangt über den
Kreislauf zu den Nieren, die daraus Arginin machen, welches weiter zur
Leber gelangt (Proteinsynthese, Harnstoffzyklus, Energiegewinnung).
 Über den Glucose-Alanin-Zyklus s. dort
Über den Glucose-Alanin-Zyklus s. dort
Verzweigtkettige und aromatische Aminosäuren (Phenylalanin, Tyrosin, Tryptophan, Histidin) werden über natriumunabhängige, andere über natriumabhängige Aminosäuretransporter der SLC (solute carrier) -Familie
in die Zelle befördert. Solche Transporter spielen insbesondere an
Epithelien eine Rolle, die Aminosäuren resorbieren, wie in der Niere (Tubulusepithel) oder im Dünndarm (Enterozyten).
All diese Speichersubstanzen können im Metabolismus in mehreren Stufen für die Energiegewinnung utilisiert werden:
 Abbau zu kleineren Bruchstückmolekülen
Abbau zu kleineren Bruchstückmolekülen
 Umwandlung in Acetyl-Coenzym A (AcCoA) als gemeinsames "Brennstoffmolekül"
Umwandlung in Acetyl-Coenzym A (AcCoA) als gemeinsames "Brennstoffmolekül"
 Vollständige Oxidation des AcCoA zu CO2 und H2O im Citratzyklus, Gewinnung von ATP
Vollständige Oxidation des AcCoA zu CO2 und H2O im Citratzyklus, Gewinnung von ATP
Das komplex (aus Pantothensäure, ATP und Cystein) aufgebaute Coenzym A
(CoA) entsteht im Rahmen des Abbaus von Kohlenhydraten, Fettsäuren und
Aminosäuren. CoA baut energiereiche Thioesterbrücken mit Acylgruppen
(z.B.
Fettsäuren) auf. Aktivierung solcher Gruppen erleichtert verschiedene
Reaktionen: Redox, Kondensierung, Transacylierung. CoA
wird für zahlreiche metabolische Funktionen benötigt, inklusive die
Synthese von Fettsäuren, Cholesterin, Steroiden, Ketonkörpern u.a.
Die Acetylierung von CoA zu Acetyl-Coenzym A(AcCoA)
ist durch diejeweilige C-Quelle bestimmt. Sie erfolgt sowohl außerhalb
als auch in Mitochondrien beim Abbau von Kohlenhydraten (via Glucose
und
Pyruvat), Lipiden (via Fettsäuren) und Proteinen (via die Aminosäuren
Lysin, Leucin, Isoleucin, Phenylalanin / Tyrosin, Threonin / Glycin,
Tryptophan / Alanin). Die gewonnene Energie wird durch Oxidation von
AcCoA freigesetzt, dabei entsteht ATP und CO2.
Proteine im Körper (10-15 kg, davon ~5 kg in der Skelettmuskulatur) repräsentieren
einen Energievorrat von ungefähr 200 MJ, der aber nur sehr beschränkt
und nur unter funktionellem Verlust zum Zweck der Energiegewinnung
mobilisierbar ist. Tatsächlich sind es vorwiegend kontraktile Filamente
(Aktin, Myosin), die im chronischen Hungerzustand zur Mobilisierung von
Aminosäuren zwecks ATP-Synthese herangezogen werden. Ist etwa die
Hälfte davon abgebaut, zeigt sich die Atemmuskulatur bereits kritisch
geschwächt.
Die folgende Tabelle informiert über den Proteinumsatz verschiedener Gewebe / Organe und deren Anteil an der Eiweißbilanz des gesamten Körpers:

Proteinumsatz (erwachsene Person)
nach Frayn / Evans, Human Metabolism - A Regulatory Perspective, 4th ed. Wiley Blackwell 2019
|
Organ
|
% täglich erneuert
|
Synthese (g/d)
|
Anteil am Protein-
umsatz des Körpers (%)
|
Körper
|
3
|
300
|
(100)
|
Skelettmuskel
|
2
|
120
|
41
|
Leber
|
7-10
|
80
|
25
|
Dünndarm
|
4
|
70
|
23
|
Dickdarm
|
7
|
8
|
3
|
Nieren
|
5
|
3
|
1
|
Herz
|
2
|
1
|
0,4
|
Man erkennt, dass jeden Tag 3% des
Proteinpools des Körpers erneuert werden - am raschesten in
Verdauungssystem (Leber bis 10%) und Nieren (5%), Muskelgewebe (40% der
Körpermasse) zu 2%.
 Mehr über den Proteinpool s. dort
Mehr über den Proteinpool s. dort
Wie Stoffwechselenergie gewonnen wird
Für Wachstum, Differenzierung, Bewegung,
Strukturerhaltung, Kontraktion, Sekretion, Abwehr, elektrische
Phänomene usw. benötigen Zellen Energie. Dazu werden kohlenstoffhaltige Substratmoleküle
oxidiert, um thermodynamisches Potential - chemisch verfügbare "freie"
Enthalpie ("Gibbs-Energie" G ) - zu gewinnen.
) - zu gewinnen.
 Als freie Energie (Gibbs-Energie G)
bezeichnet man denjenigen Anteil der Energie eines Systems, der zur
Erbringung einer Arbeit genutzt werden kann. ΔG
- die Veränderung an freier Energie - ist die Differenz zwischen G
des/der Produkts/Produkte und des/der Substrats/Substrate einer
Reaktion. Die Geschwindigkeit der Reaktion hängt nicht von ΔG, sondern vom (die Reaktion katalysierenden) Enzym ab.
Als freie Energie (Gibbs-Energie G)
bezeichnet man denjenigen Anteil der Energie eines Systems, der zur
Erbringung einer Arbeit genutzt werden kann. ΔG
- die Veränderung an freier Energie - ist die Differenz zwischen G
des/der Produkts/Produkte und des/der Substrats/Substrate einer
Reaktion. Die Geschwindigkeit der Reaktion hängt nicht von ΔG, sondern vom (die Reaktion katalysierenden) Enzym ab.
Nutzt man sie (z.B. für
eine chemische Reaktion), nimmt [G] (d.h. die Enthalpie im System) ab (negativer Betrag von ∆G). Spontane Abläufe senken den Betrag an freier Energie im System. Prozesse mit positivem ∆G laufen niemals spontan ab; soll eine Reaktion ablaufen, muss das System freie Energie abgeben.
Im Energiestoffwerhsel der Zelle geht es um den Transfer von Elektronen (vgl. dort): Wird ein Stoff oxidiert, verliert er Elektronen, wird er reduziert, nimmt er Elektronen auf und erhält damit einen höheren
Energiestatus. Dabei geht es zu wie bei einer Tauschbörse: Da das Elektron jeweils von einem "Donor" auf einen "Akzeptor"
übertragen wird, erfolgen Oxidation und Reduktion gleichzeitig (man
spricht von Redox-Reaktionen).
 Redox-Reaktionen
sind die wichtigste Klasse biochemischer Reaktionen (Bio-Oxidationen
verschaffen das größte Ausmaß an Energie für den aeroben Stoffwechsel).
Die Energie wird frei, wenn Elektronen von Substratmolekülen über die
mitochondrielle Elektronentransportkette (entlang eines Redox-Potentials) auf Sauerstoff übertragen wird. Die freigesetzte Energie wird anschließend verwendet, um H+
über die innere Mitochondrienmembran zu befördern. Der entstehende
Protonengradient treibt die Phosphorylierung von ADP zu ATP an.
Redox-Reaktionen
sind die wichtigste Klasse biochemischer Reaktionen (Bio-Oxidationen
verschaffen das größte Ausmaß an Energie für den aeroben Stoffwechsel).
Die Energie wird frei, wenn Elektronen von Substratmolekülen über die
mitochondrielle Elektronentransportkette (entlang eines Redox-Potentials) auf Sauerstoff übertragen wird. Die freigesetzte Energie wird anschließend verwendet, um H+
über die innere Mitochondrienmembran zu befördern. Der entstehende
Protonengradient treibt die Phosphorylierung von ADP zu ATP an.
 Energiereiche Substrate haben verfügbare Elektronen -
in Assoziation mit C-H-Bindungen, die man als reduzierten
(elektronenreichen) Kohlenstoff sehen kann. Im Energiestoffwechsel können sie Elektronenakzeptoren reduzieren (auf
den sie ihre Elektronen übertragen und dabei selbst oxidiert werden).
Energiereiche Substrate haben verfügbare Elektronen -
in Assoziation mit C-H-Bindungen, die man als reduzierten
(elektronenreichen) Kohlenstoff sehen kann. Im Energiestoffwechsel können sie Elektronenakzeptoren reduzieren (auf
den sie ihre Elektronen übertragen und dabei selbst oxidiert werden).
Kohlenstoff wird dabei letztlich vollständig oxidiert - zu CO2, und Wasserstoff zu H2O. Sauerstoff ist der ultimative Elektronenakzeptor, z.B. bei der Reaktion
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O
Sauerstoff als Elektronenakzeptor wird benötigt, um einen
ausreichenden Elektronentransfer von energiereichen Verbindungen zu
gewährleisten. Fette sind viel stärker reduziert (und enthalten mehr
energiereiche Elektronen) als z.B. Kohlenhydrate (deren
Kohlenstoffatome zum Teil oxidiert sind), daher sind sie auch
energiereicher. Die energietragenden Elektronen werden von Fett-,
Kohlenhydrat- oder Aminosäuremolekülen allerdings nicht direkt auf
Sauerstoff übertragen - eine solche Reaktion ist zu energiehaltig und
wäre weder kontrollier- noch nutzbar -, sondern über mehrere Stufen auf
Zwischenträger - also eine Kette von Redox-Reaktionen.
Als Elektronenüberträger fungieren die Coenzyme NAD+ (oxidiertes Nikotinamid- Adenin- Dinukleotid), NADP+
(oxidiertes Nikotinamid- Adenin- Dinukleotid- Phosphat) und FAD
(Flavin- Adenin- Dinukleotid). Diese können Elektronen (in der Form eines
Hydridions H-: ein Wasserstoffatom mit einem Extra-Elektron)
aufnehmen, dabei werden sie reduziert (und energiereicher) und es
entsteht NADH, NADPH und / oder FADH2.
Anschließend geben sie das Elektron an einen nächsten Reaktionspartner
weiter, bis schließlich Sauerstoff selbst reduziert wird (und Wasser
entsteht: "Oxidationswasser", etwa 0,3 l/d).
Als Redox-Potential einer Zelle
bezeichnet man das Verhältnis der reduzierten (energiereichen) zur
oxidierten (energiearmen) Form der Elektronenüberträger, z.B. [NAD+]/[NADH] oder [NADP+]/[NADPH]. Dies läßt die energetische "Aufladung" der Zelle abschätzen - nicht nur das Phosphorylierungspotential ([ATP]/]ADP], [ATP]/]AMP]. Der zelluläre Energiestatus ist also einerseits durch die Konzentration an ATP, andererseits an NADH, NADPH und FADH2 bestimmt.
ATP wird von den Zellen insbesondere durch die Atmungskette ständig nachgebildet. Man hat errechnet, dass jedes ATP-Molekül (eine typische Zelle verfügt über ~109
davon) pro Tag einige tausend Mal phosphoryliert / hydrolysiert wird
(Recycling; neu werden ATP-Moleküle nur synthetisiert, wenn dies
notwendig ist).
 Zellen bilden gerade so viel ATP, wie im Stoffwechsel
verbraucht wird; ATP-Speicher werden nicht angelegt (nur Creatinphosphat im Muskel). Deshalb
kann Sauerstoffmangel auch sehr rasch zu Energieengpässen führen - und
es werden alternative Wege zur Energiegewinnung beschritten (anaerob ..
weniger effizient).
Zellen bilden gerade so viel ATP, wie im Stoffwechsel
verbraucht wird; ATP-Speicher werden nicht angelegt (nur Creatinphosphat im Muskel). Deshalb
kann Sauerstoffmangel auch sehr rasch zu Energieengpässen führen - und
es werden alternative Wege zur Energiegewinnung beschritten (anaerob ..
weniger effizient).
 Glucose ist ein Molekül, aus dem rasch Energie für den Stoffwechsel gewonnen werden kann. Um
an diese Energie heranzukommen, muss die Zelle Glucose erst unter
ATP-Aufwand zu Fructosebiphosphat umwandeln. Diese kann in zwei
C3-Körper gespalten und diese in fünf weiteren Schritten zu Pyruvat
abgebaut werden.
Dabei wird mehr ATP gewonnen als zunächst investiert wurde. Dieser
phylogenetisch sehr alte, von Sauerstoff unabhängige Stoffwechselweg
wird als Glykolyse bezeichnet:
Glucose ist ein Molekül, aus dem rasch Energie für den Stoffwechsel gewonnen werden kann. Um
an diese Energie heranzukommen, muss die Zelle Glucose erst unter
ATP-Aufwand zu Fructosebiphosphat umwandeln. Diese kann in zwei
C3-Körper gespalten und diese in fünf weiteren Schritten zu Pyruvat
abgebaut werden.
Dabei wird mehr ATP gewonnen als zunächst investiert wurde. Dieser
phylogenetisch sehr alte, von Sauerstoff unabhängige Stoffwechselweg
wird als Glykolyse bezeichnet:
 Glykolyse ist
der Abbau von Glucose zu Pyruvat (unter aeroben Bedingungen) bzw.
Lactat (unter anaeroben Bedingungen). Sie findet im Zytoplasma statt.
Dabei werden pro mol Glucose 2 mol ATP investiert und 4 mol ATP
gewonnen, die Netto-Ausbeute beträgt daher 2 mol ATP (plus 2 mol NADH)
pro mol abgebauter Glucose.
Was folgt auf die Glykolyse? Die weitere Energiegewinnung
(Pyruvatabbau, Citratzyklus) erfolgt (unter aeroben Bedingungen, d.h.
Verbrauch von O2 ) in Mitochondrien - dabei werden beträchtliche Mengen ATP gewonnen. Ist dafür nicht genügend Sauerstoff vorhanden
(hypoxisches / gering vaskularisiertes Gewebe) oder fehlen der Zelle
Mitochondrien (wie den Erythrozyten), ist dieser Weg versperrt, und die Glucoseutilisation bleibt auf der
Stufe der Milchsäure stehen.
Glykolyse ist
der Abbau von Glucose zu Pyruvat (unter aeroben Bedingungen) bzw.
Lactat (unter anaeroben Bedingungen). Sie findet im Zytoplasma statt.
Dabei werden pro mol Glucose 2 mol ATP investiert und 4 mol ATP
gewonnen, die Netto-Ausbeute beträgt daher 2 mol ATP (plus 2 mol NADH)
pro mol abgebauter Glucose.
Was folgt auf die Glykolyse? Die weitere Energiegewinnung
(Pyruvatabbau, Citratzyklus) erfolgt (unter aeroben Bedingungen, d.h.
Verbrauch von O2 ) in Mitochondrien - dabei werden beträchtliche Mengen ATP gewonnen. Ist dafür nicht genügend Sauerstoff vorhanden
(hypoxisches / gering vaskularisiertes Gewebe) oder fehlen der Zelle
Mitochondrien (wie den Erythrozyten), ist dieser Weg versperrt, und die Glucoseutilisation bleibt auf der
Stufe der Milchsäure stehen.

 Abbildung: Energiegewinnung durch Glucoseabbau
Abbildung: Energiegewinnung durch Glucoseabbau
Nach einer Vorlage in Panini SR, Medical Biochemistry, 2nd ed. 2021 (Thieme)
Links: Mitochondrien- /
kernhaltige Zellen können Glucose unter Sauerstoffverbrauch zu Pyruvat
oxidieren (dabei werden je mol Glucose 2 mol ATP und 2 mol NADH
gewonnen) und das Pyruvat in weiterer Folge zu CO2 oxidieren (dabei entstehen je mol Glucose theoretisch 34-36, in der Realität ~28 mol ATP - aerobe Glykolyse).
Rechts: Bei anaerober Glykolyse - hier am Beispiel eines Erythrozyten - wird das Pyruvat zu
Lactat reduziert, was je mol Glucose zusätzlich zu den gewonnenen 2 mol
ATP und 2 mol NADH 2 mol NAD+
ergibt. Die Energieausbeute je mol Glucose ist im Vergleich zur aeroben
Energiegewinnung wesentlich geringer. Rote Blutkörperchen sind für
ihren Energiestoffwechsel auf anaerobe Glykolyse angewiesen, um ihre
Ionenpumpen mit ATP zu versorgen; ist dies nicht möglich, gehen sie
zugrunde (Hämolyse). Der Erythrozyt hätte
zwar besonders viel Sauerstoff zur Verfügung, kann diesen aber nicht
zur Energiegewinnung nutzen, da er über keine Mitochondrien verfügt.
Auf anaerobe Glykolyse greifen auch Muskelzellen zurück, deren
Sauerstoffbedarf über dem Angebot liegt (Ischämie, Infarktgeschehen)
oder Zellen mit größerer Distanz zu Blutgefäßen (z.B. im dioptrischen
Apparat des Auges)

Aerob gewonnene ATP-Ausbeute
ist wesentlich ergiebiger als anaerob erzeugte (der aerobe Abbau von 1 mol Glucose bringt ungefähr 28 mol ATP
(das 14-fache der anaerob gewonnenen Energie) - theoretisch möglich
wären bis zu 38 mol, aber die metabolische Kopplungseffizienz (coupling efficiency) ist deutlich geringer als 100%.
Kohlenhydrate können auch anaerob genutzt werden, was aber nur kurzzeitig
funktioniert (Spitzenbelastung von Skelettmuskeln), da einerseits die
Energieausbeute gering ist, andererseits Lactat entsteht und den
Säure-Basen-Haushalt belastet. Der für die
aerobe Glykolyse benötigte Glucosenachschub stammt aus Glucose,
Fructose und Galactose, vom Glycogenabbau und allenfalls aus
Gluconeogenese (aus Fettsäuren, Glycerin, glucogenen Aminosäuren). Fettsäuren können nur
aerob (also unter O2-Verbrauch) genutzt werden.
Wie bereits erwähnt, werden im Laufe des glykolytischen
Glucoseabbaus pro mol Glucose 2 mol ATP investiert und 4 mol ATP
gewonnen, die Netto-Ausbeute beträgt daher 2 mol ATP (plus 2 mol NADH)
pro mol abgebauter Glucose. Dazu bedarf es einer Reihe enzymatischer
Schritte, und man kann sich den gesamten Ablauf der Glykolyse aus drei
Phasen aufgebaut vorstellen:
 1. ATP-Investitionsphase (investment phase): Sie "fängt" Glucose im Inneren der Zelle ein, da
diese in
phosphorylierter Form nicht mehr durch die Zellmembran entweichen kann,
und besteht aus drei (weitgehend irreversiblen) glykolytischen
Schritten:
1. ATP-Investitionsphase (investment phase): Sie "fängt" Glucose im Inneren der Zelle ein, da
diese in
phosphorylierter Form nicht mehr durch die Zellmembran entweichen kann,
und besteht aus drei (weitgehend irreversiblen) glykolytischen
Schritten:
 Phosphorylierung von Glucose zu Glucose-6-Phosphat durch Hexokinase
(alle Zelltypen) oder ihr Isoenzym Glucokinase
Phosphorylierung von Glucose zu Glucose-6-Phosphat durch Hexokinase
(alle Zelltypen) oder ihr Isoenzym Glucokinase (Hepatozyten, Enterozyten, pankreatische ß-Zellen)
. Dadurch bleibt die zytoplasmatische
Glucosekonzentration niedrig (Erhaltung des extra/intrazellulären
Konzentrationsgradienten). Dieser Schritt wird durch Glucose und Insulin angeregt und ist ATP-abhängig.
Hexokinase hat hohe Affinität zu Glucose (Km-Wert
0,1 mM) und ist daher auch bei sehr niedrigem Glucosespiegel aktiv. Die
Aktivität der Glucokinase hingegen steigt erst mit höheren
Blutzuckerspiegel (nüchtern 4-6 mM, zwei Stunden nach dem Essen bis 7,8
mM) deutlich an (halbmaximale Aktivität bei 8 mM Glucose; der
postprandiale Glucosespiegel im Pfortaderblut kann bis auf ~20 mM ansteigen). Die Expression und Aktivität der Glucokinase ist hormonell und metabolisch reguliert.
 Umwandlung von Glucose-6-Phosphat in Fructose-6-Phosphat durch Phosphoglucose-Isomerase.
Umwandlung von Glucose-6-Phosphat in Fructose-6-Phosphat durch Phosphoglucose-Isomerase.
 Phosphorylierung von Fructose-6-Phosphat zu Fructose-1,6-Biphosphat durch Phosphofructokinase 1. Auch dieser Schritt ist ATP-abhängig.
Die
Enzyme der ATP-abhängigen Schritte regulieren die Glykolyse, deren
geschwindigkeitslimitierendes Enzym ist die Phosphofructokinase 1
(PFK-1). Erhöhung des Insulin / Glukagon-Quotienten (postprandial) regt
die Aktivität der PFK-1 (und damit die Glykolyse) an, Erniedrigung
dieses Quotienten (nüchtern) reduziert sie.
Die "Investitionsphase" läuft nur unter ATP-Verbrauch ab
(Phosphorylierung von Glucose, Phosphorylierung von
Fructose-6-Phosphat). Pro mol Glucose werden 2 mol ATP utilisiert.
Anschließend erfolgt der Abbau zu C3-Körpern
(Sauerstoff wird dabei nicht benötigt, und es entsteht kein CO2):
Phosphorylierung von Fructose-6-Phosphat zu Fructose-1,6-Biphosphat durch Phosphofructokinase 1. Auch dieser Schritt ist ATP-abhängig.
Die
Enzyme der ATP-abhängigen Schritte regulieren die Glykolyse, deren
geschwindigkeitslimitierendes Enzym ist die Phosphofructokinase 1
(PFK-1). Erhöhung des Insulin / Glukagon-Quotienten (postprandial) regt
die Aktivität der PFK-1 (und damit die Glykolyse) an, Erniedrigung
dieses Quotienten (nüchtern) reduziert sie.
Die "Investitionsphase" läuft nur unter ATP-Verbrauch ab
(Phosphorylierung von Glucose, Phosphorylierung von
Fructose-6-Phosphat). Pro mol Glucose werden 2 mol ATP utilisiert.
Anschließend erfolgt der Abbau zu C3-Körpern
(Sauerstoff wird dabei nicht benötigt, und es entsteht kein CO2):
 2. Aufspaltungsphase (splitting phase): Dieser Teil spaltet einen C6-Körper
(Fructose-1,6-BP) in zwei C3-Körper (Dihydroxyacetonphosphat DHAP,
Glycerinaldehyd-3-phosphat G3P). Diese beiden Isomere können durch ein
spezielles Enzym (Triosephosphat-Isomerase) ineinander übergeführt
werden. G3P wird dann im nachfolgenden Glykolysesystem in Pyruvat /
Lactat verwandelt:
2. Aufspaltungsphase (splitting phase): Dieser Teil spaltet einen C6-Körper
(Fructose-1,6-BP) in zwei C3-Körper (Dihydroxyacetonphosphat DHAP,
Glycerinaldehyd-3-phosphat G3P). Diese beiden Isomere können durch ein
spezielles Enzym (Triosephosphat-Isomerase) ineinander übergeführt
werden. G3P wird dann im nachfolgenden Glykolysesystem in Pyruvat /
Lactat verwandelt:
 3. ATP-Rückgewinnungsphase (yield phase, recoup phase): Diese generiert pro mol verbrauchtem C6-Körper 4
mol ATP und 2 mol NADH. Es entstehen mol 2 Pyruvat, die entweder - via
Acetyl-Coenzym A - in den Citratzyklus münden (oxidativer Abbau) oder
via Lactatdehydrogenase
in Lactat umgewandelt (und anderweitig
abgebaut) wird. Dem Verlust von 2 ATP in Phase 1 steht der Gewinn von 4
ATP in Phase 3 gegenüber (Netto-Gewinn 2 mol ATP pro mol abgebauter
Glucose).
Pyruvat ist ein zentrales
Molekül der Zellatmung, denn es wird nicht nur für die ATP-Synthese
(Citratzyklus) benötigt, sondern auch für den Aufbau von Proteinen,
Fettsäuren sowie für die Gluconeogenese. Dabei wird Pyruvat zu
verschiedenen Metaboliten - Acetyl-CoA (postprandial), Oxalacetat
(nüchtern), Lactat (Cori-Zyklus), Alanin (Hypoxie im Muskel)
umgewandelt. Andererseits können mehrere Aminosäuren in Pyruvat
umgewandelt werden.
3. ATP-Rückgewinnungsphase (yield phase, recoup phase): Diese generiert pro mol verbrauchtem C6-Körper 4
mol ATP und 2 mol NADH. Es entstehen mol 2 Pyruvat, die entweder - via
Acetyl-Coenzym A - in den Citratzyklus münden (oxidativer Abbau) oder
via Lactatdehydrogenase
in Lactat umgewandelt (und anderweitig
abgebaut) wird. Dem Verlust von 2 ATP in Phase 1 steht der Gewinn von 4
ATP in Phase 3 gegenüber (Netto-Gewinn 2 mol ATP pro mol abgebauter
Glucose).
Pyruvat ist ein zentrales
Molekül der Zellatmung, denn es wird nicht nur für die ATP-Synthese
(Citratzyklus) benötigt, sondern auch für den Aufbau von Proteinen,
Fettsäuren sowie für die Gluconeogenese. Dabei wird Pyruvat zu
verschiedenen Metaboliten - Acetyl-CoA (postprandial), Oxalacetat
(nüchtern), Lactat (Cori-Zyklus), Alanin (Hypoxie im Muskel)
umgewandelt. Andererseits können mehrere Aminosäuren in Pyruvat
umgewandelt werden.
 Coenzym A (CoA) ist ein komplexes Molekül (es enthält u.a. Pantothensäure
und ATP), das Acylgruppen (R-C=O) überträgt, insbesondere für Nutzung
im Citratzyklus. Als Acetyl-Coenzym A (Ac-CoA) stellt es hier die
"aktivierte" Form von Acetat dar, das mittels einer energiereichen
Bindung an CoA befestigt ist. Quelle des Ac-CoA ist der Abbau von
Kohlenhydraten (via Glykolyse), Fettsäuren (via ß-Oxidation) und
Proteinen (aus ketogenen Aminosäuren - Glycin und Alanin - via Pyruvatdehydrogenase).
Coenzym A (CoA) ist ein komplexes Molekül (es enthält u.a. Pantothensäure
und ATP), das Acylgruppen (R-C=O) überträgt, insbesondere für Nutzung
im Citratzyklus. Als Acetyl-Coenzym A (Ac-CoA) stellt es hier die
"aktivierte" Form von Acetat dar, das mittels einer energiereichen
Bindung an CoA befestigt ist. Quelle des Ac-CoA ist der Abbau von
Kohlenhydraten (via Glykolyse), Fettsäuren (via ß-Oxidation) und
Proteinen (aus ketogenen Aminosäuren - Glycin und Alanin - via Pyruvatdehydrogenase).
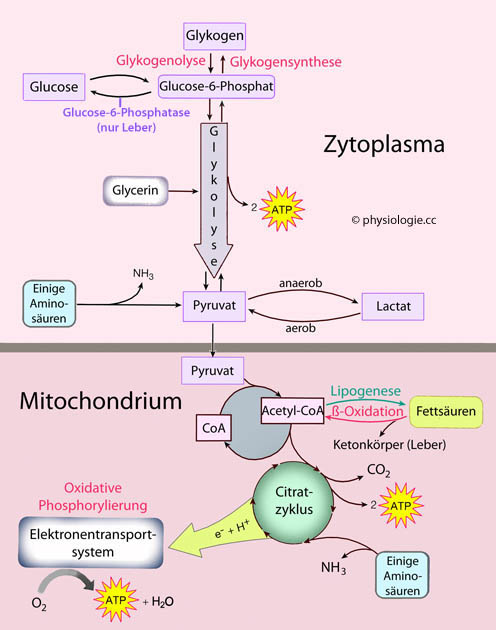

 Abbildung: Energiegewinnung im Stoffwechsel
Abbildung: Energiegewinnung im Stoffwechsel
Nach einer Vorlage bei Silverthorn, Human Physiology - an integrated approach, 4th ed. Pearson International 2007
Vereinfachte
Übersicht der wichtigsten Stoffwechselwege mit Betonung ihrer
Verknüpfung und die Gewinnung metabolischer Energie (ATP). Die einzelnen Schritte sind enzymatisch gesteuert, und
die Synthese der Enzyme unterliegt hormonellen Einflüssen. Auf diese
Weise werden die Abläufe kontrolliert und an veränderte Bedürfnisse des
Organismus angepasst.
Nur die Leber exprimiert Glucose-6-Phosphatase; damit kann sie
ihre Glykogenspeicher direkt zur Lieferung von Glucose einsetzen -
andere Gewebe (z.B. Muskelzellen) können das nicht und müssen auf
Gluconeogenese via Pyruvat ausweichen.
Der Schritt von Pyruvat zu Acetyl-Coenzym A (Ac-CoA) ist irreversibel,
daher können Aminosäuren hier nicht für den Aufbau von Glucose
herangezogen werden.
Nähreres s. weiter unten

 Abbildung).
Abbildung).
Die Substrate stammen entweder aus der Nahrung
(postprandial) oder aus Zellen, die energiereiche Moleküle zur
Verfügung stellen (vor allem Leber und Fettgewebe).
Um energiereiche Moleküle in die Zelle zu transportieren und hier zu verwerten, benötigt diese entsprechende
 Transporter - teils membran-assoziierte, teils intrazelluläre (organellen-assoziierte) - sowie
Transporter - teils membran-assoziierte, teils intrazelluläre (organellen-assoziierte) - sowie
 Enzyme
Enzyme und
Cofaktoren, welche den zügigen Ablauf der erforderlichen Interkonversionen innerhalb metabolischer Wege ermöglichen.
Schlüsselfaktoren in diesen Stoffwechselpfaden werden durch
Hormone, aber auch Energiesensoren und Metabolite reguliert. Dadurch sind die Abläufe stabilisiert und dem jeweiligen Bedarf angepasst.
Die führenden regulatorischen Gewebe sind
 Leber (Fett-, Kohlenhydrat-, Proteinstoffwechsel),
Leber (Fett-, Kohlenhydrat-, Proteinstoffwechsel),
 Skelettmuskel (Energieverbrauch) und
Skelettmuskel (Energieverbrauch) und
 Fettgewebe (Energiespeicherung).
Fettgewebe (Energiespeicherung).
Die meiste Energie wird im Rahmen des Citratzyklus gewonnen; dazu bedarf es der Mitochondrien  ,
welche die dazu nötigen Enzme enthalten. Zellen ohne Mitochondrien
(Erythrozyten) sind dazu nicht in der Lage; sie decken ihren
Energiebedarf ohne Sauerstoff (anoxidativ = anaerob
,
welche die dazu nötigen Enzme enthalten. Zellen ohne Mitochondrien
(Erythrozyten) sind dazu nicht in der Lage; sie decken ihren
Energiebedarf ohne Sauerstoff (anoxidativ = anaerob  - scheinbar paradoxerweise, da sie ja Sauerstoff transportieren),
indem sie anaerobe Glykolyse
nutzen.
- scheinbar paradoxerweise, da sie ja Sauerstoff transportieren),
indem sie anaerobe Glykolyse
nutzen.
Anaerobe Glykolyse läuft vollständig im Zytoplasma ab, während der oxidative
Weg auch Mitochondrien benötigt - über welche Erythrozyten nicht
verfügen. Dabei entsteht aus
Pyruvat (Salz der Brenztraubensäure) Lactat (Salz der Milchsäure), die von Erythrozyten (mittels eines Carboxylattransporters) an das Blut abgegeben
wird.
Diesen "sidestep" der Glykolyse bis zum Lactat nutzen z.B. auch
Skelettmuskelzellen, wenn sie vorübergehend mehr ATP verbrauchen als
von arterieller Versorgung bzw. oxydativem Abbau nachgeliefert werden
kann (z.B. zu Beginn einer intensiven Muskelbelastung). Muskelzellen,
die nicht oxidativ überfordert sind, können Lactat wiederverwerten. Die
Leber wandelt Lactat in Glucose um, die wiederum zur Deckung des
allgemeinen Energiebedarfs verwendet wird (Cori-Zyklus).
Staut sich Lactat im Blut zurück, belastet es den Säure-Basen-Haushalt (metabolische Azidose).
 Zur Veränderung des Lactatspiegels im Blut durch körperliche Belastung s. dort
Zur Veränderung des Lactatspiegels im Blut durch körperliche Belastung s. dort
Aufgaben der Mitochondrien
Mitochondrien
(Durchmesser bis zu 1 µm) haben zahlreiche Funktionen:
 Energiestoffwechsel (
Energiestoffwechsel ( Abbildung): Der wichtigste Weg zur Generierung von ATP ist die oxidative Phosphorylierung.
Diese findet in Mitochondrien statt und fasst verschiedene
Stoffwechselwege zusammen, welche den Abbau von Nährstoffen mit
Redox-Reaktionen verknüpft. Dies mündet in die Übertragung von
Elektronen auf Sauerstoff sowie die Phosphorylierung von ADP
(ATP-Synthese).
Abbildung): Der wichtigste Weg zur Generierung von ATP ist die oxidative Phosphorylierung.
Diese findet in Mitochondrien statt und fasst verschiedene
Stoffwechselwege zusammen, welche den Abbau von Nährstoffen mit
Redox-Reaktionen verknüpft. Dies mündet in die Übertragung von
Elektronen auf Sauerstoff sowie die Phosphorylierung von ADP
(ATP-Synthese).


Abbildung: Aerobe Glykolyse und Mitochondrien
Nach einer Vorlage bei nature.com/scitable
Acetyl-Co
A aus dem Abbau von Glucose (Glykolyse) betritt den Krebs-Zyklus
(Citratzyklus) in den Mitochondrien, wo der Elektronentransport (NADH,
FADH2) Energie freisetzt. Diese wird genutzt, um
Wasserstoffionen in den Intermembranraum (zwischen innerer und äußerer
Mitochondrienmembran) zu pumpen. Der entstandene elektrochemische Gradient treibt die ATP-Synthese an


Der Citrat-Zyklus (Krebs-Zyklus) findet in der Mitochondrienmatrix statt

Beta-Oxidation von Fettsäuren. Dabei werden Fettsäuren zu
Acetyl-Coenzym A abgebaut. Dies erfolgt in der Mitochondrienmatrix

Beteiligung an der Gluconeogenese - dem Aufbau von Glucose aus
Substraten, die keine Kohlenhydrate sind. Ein Teil der dafür
notwendigen Enzyme befindet sich in der Mitochondrienmatrix, ein
anderer Teil im Zytoplasma

Signaltransduktion, Speicherung von
Ca
++ und Beeinflussung des Membranpotentials der Zelle: Mitochondrien sind in der Lage,
Ca++ rasch zwischenzuspeichern
- ein Wechselspiel mit dem endoplasmatischen Retikulum: Mittels eines
Uniporters an der inneren Mitochondrienmembran nimmt die Matrix Ca
++ auf und kann sie dann über einen
Na+-Ca++-Austauscher
wieder abgeben. Entsprechend reagiert das Membranpotential, was
second-messenger-Proteine aktiviert und zu Freisetzung von Hormonen
oder Neurotransmittern führen kann

Informationsverarbeitung
(mitochondriale
DNA: 13 Gene für Teile der Atmungskomplexe I, III, IV und V, 22 für mitochondriale tRNA, 2 für rRNA. Jedes
Mitochondrium kann 2 bis 10 Kopien ihrer DNA enthalten

Beteiligung an
der Steroidsynthese (Mitochondrien in steroidproduzierenden Zellen haben röhrenförmige innere Membranen)

Hämsynthese (Protoporphyrinogen → Protoporphyrin → Häm; dieses wird aus dem Mitochondrion ins Zytoplasma exportiert)

Energieversorgung für Zellteilung und -differenzierung

Werden Mitochondrien beschädigt, geben sie via äußere Mitochondrienmembran den Elektronentransporter
Cytochrom c in das Zytoplasma frei und lösen so
Apoptose aus.
Der Krebs-Zyklus (Citratzyklus, tricarboxylic acid cycle TCA)
 generiert Wasserstoffatome, die über reduzierte Coenzyme (NADH, FADH2)
zur Elektronen-Transportkette der Mitochondrien transportiert werden -
der Transfer von Wasserstoff erfolgt über Dehydrogenasen (Enzyme #3, 4,
6, 8 in der folgenden
generiert Wasserstoffatome, die über reduzierte Coenzyme (NADH, FADH2)
zur Elektronen-Transportkette der Mitochondrien transportiert werden -
der Transfer von Wasserstoff erfolgt über Dehydrogenasen (Enzyme #3, 4,
6, 8 in der folgenden  Abbildung), und
Abbildung), und oxidiert Wasserstoff in der Atmungskette über das Elektronentransportsystem der
Zytochrome. Pro Durchgang entstehen folgende Moleküle: 3 NADH, 1 FADH2, 1 GTP (kann seine Energie auf ATP übertragen), weiters CO2 und H2O.
oxidiert Wasserstoff in der Atmungskette über das Elektronentransportsystem der
Zytochrome. Pro Durchgang entstehen folgende Moleküle: 3 NADH, 1 FADH2, 1 GTP (kann seine Energie auf ATP übertragen), weiters CO2 und H2O.
Der Citratzyklus produziert direkt kein ATP; aber die Energieäquivalente der entstandenen NADH-, FADH2- und GTP-Moleküle werden schließlich auf ATP übertragen, und pro mol abgebauter Glucose entstehen insgesamt 24 mol ATP.
Der
Energiestatus der Zelle beeinflusst die metabolischen Abläufe: Das
Mengenverhältnis von [ATP] zu [ADP] bestimmt über Einfluss auf Enzyme, ob die ATP-Synthese gefördert oder
angehalten wird.
ADP + Pi + Energie

ADP
~P (=ATP)
 Abbildung: Citratzyklus
Nach einer Vorlage in
Campbell / Urry / Cain / Wasserman / Minorsky / Orr: Biology, A Global
Approach, 12th ed. Pearson Education Ltd 2021
Abbildung: Citratzyklus
Nach einer Vorlage in
Campbell / Urry / Cain / Wasserman / Minorsky / Orr: Biology, A Global
Approach, 12th ed. Pearson Education Ltd 2021
Der Citratzyklus überträgt Energie auf NAD
+ und FADH. Die reduzierten Coenzyme NADH und FADH
2
versorgen die mitochondrielle Transportkette ("Atmungskette") mit
energiereichen Elektronen, diese treiben Protonenpumpen an, und der H
+-Gradient
an der inneren Mitochondrienmembran schließlich die ATP-Synthase. Es
entsteht ATP, das aus dem Mitochondrium in das Zytoplasma befördert
wird.
Der
Wirkungsgrad der ATP-Synthese wird durch den Protonen-shunt der
uncoupling proteins (UCP) verringert. Dadurch wird die Effizienz der
Übertragung von Energie auf Moleküle verringert, die
Thermogenese verstärkt.
UCP's lassen sich durch
Leptin,
Katecholamine oder
Schilddrüsenhormone induzieren

 Im Citratzyklus entsteht CO2 (Isocitrat → Ketoglutarat, Ketoglutarat → Succinat).
Im Citratzyklus entsteht CO2 (Isocitrat → Ketoglutarat, Ketoglutarat → Succinat).
 Mit zunehmendem (oxidativem) Energieumsatz steigt auch die Mitochondriendichte der Zelle - diese kann die metabolische
Mit zunehmendem (oxidativem) Energieumsatz steigt auch die Mitochondriendichte der Zelle - diese kann die metabolische  Ausdauer z.B. einer Muskelzelle bestimmen. Mitochondrien können nicht nur neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
sie können auch verschmelzen oder sich aufspalten (
Ausdauer z.B. einer Muskelzelle bestimmen. Mitochondrien können nicht nur neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
sie können auch verschmelzen oder sich aufspalten ( Abbildung),
wodurch sich ihre Zahl bzw. ihr Volumen je nach metabolischen
Anforderungen in der Zelle dynamisch anpassen kann.
Abbildung),
wodurch sich ihre Zahl bzw. ihr Volumen je nach metabolischen
Anforderungen in der Zelle dynamisch anpassen kann.

Über
Mitochondrien und Energiegewinnung s. auch
dort


Abbildung: Dynamik der Mitochondrienzahl und -größe
Nach Seo AY, Joseph AM, Dutta D, Hwang JCY, Aris JP,
Leeuwenburgh C: New insights into the role of mitochondria in aging:
mitochondrial dynamics and more. J Cell Sci 2010; 123: 2533-42
Das Bild zeigt Möglichkeiten der
mitochondriellen Fusion, Spaltung, Biogenese und Degradation. Solche
Vorgänge spielen sich bei der Anpassung der Mitochondriendichte an den
jeweiligen Bedarf ab. Neubildung,
Verschmelzung und Spaltung adaptieren
Zahl und Volumen von Mitochondrien (z.B. bei Teilung
oder Wachstum).
Legen sich kappenförmige Membranausstülpungen (
Phagophoren) um die
abzubauenden Mitochondrien, werden sie so für die Mitophagie markiert

Acetyl-Coenzym A
ist auch die Ausgangsstelle zur Synthese des Cholesterins, aus dem Isoprenoide (Steroidhormone, Gallensäuren)
gebildet werden können. Weiters dient es als Baustein für die Synthese
von Fettsäuren. Unter chronischen Hungerzuständen (oder bei
unbehandeltem Diabetes mellitus) entsteht beim Fettsäureabbau viel
Acetyl-Coenzym A, das in diesem Fall von der Leber zu Ketonkörpern
verwandelt wird und als alternative Energiequelle für Gehirn und
Muskulatur dient.
Der Citratzyklus dient nicht nur der Energieversorgung der Zelle, sondern hat auch anabole Funktionen; so kann
 Citrat postprandial (über Acetyl-CoA) zur Lipidsynthese herangezogen werden,
Citrat postprandial (über Acetyl-CoA) zur Lipidsynthese herangezogen werden,
 Oxalacetat im Nüchternzustand (über Phosphoenolpyruvat) zur Glucosesynthese (Gluconeogenese);
Oxalacetat im Nüchternzustand (über Phosphoenolpyruvat) zur Glucosesynthese (Gluconeogenese);
 Oxalacetat und α-Ketoglutarat zur Aminosäuresynthese (Bildung von Aspartat bzw. Glutamat).
Oxalacetat und α-Ketoglutarat zur Aminosäuresynthese (Bildung von Aspartat bzw. Glutamat).
Cholesterin ist ein essentieller Bestandteil von Zellmembranen, es wird im Körper zum Großteil (~90%) neu synthetisiert
(1-2 g/d beim Erwachsenen - über Acetyl-CoA, Mevalonsäure, Squalen,
Lanosterin, insgesamt rund 20 enzymatische Stufen, ein beträchtlicher
metabolischer Aufwand), ein kleinerer Teil aus der Nahrung aufgenommen
(maximale Resorptionskapazität ~0,5 g/d). Für die Biosynthese des Cholesterins wird Sauerstoff benötigt
(Mitochondrienmembranen enthalten kaum Cholesterin).
Täglich
werden ~0,5 Gramm Gallensäuren in den Darm sezerniert, etwa 50 mg/d
ausgeschieden, ~90% rückresorbiert (enterohepatischer Kreislauf).
 Zu Cholesterin s. auch dort.
Zu Cholesterin s. auch dort.
Wie für die
Fettsäuresynthese kann hier der Pentosephosphatweg benutzt werden.
Dieser
im Zytoplasma ablaufende Vorgang ist eine alternative Möglichkeit der
Zelle zur Metabolisierung von Glucose. Statt Pyruvat, ATP und NADH
produziert er den Elektronentransporter (reduziertes Coenzym) NADPH
sowie die Pentose Ribulose 5-Phosphat. Die meisten Zellen nutzen diesen
Mechanismus, vor allem aber Leber- und Fettzellen (Fettsynthese).
 Ribulose 5-Phosphat liefert den Kohlenhydratbaustein für die Synthese von Nukleotiden.
Ribulose 5-Phosphat liefert den Kohlenhydratbaustein für die Synthese von Nukleotiden.
 NADPH ist unverzichtbar für sie Synthese u.a. von Fettsäuren und Steroiden. Es verleiht Zellen auch antioxidativen Schutz gegen Oxidantien / bei Infektionen.
NADPH ist unverzichtbar für sie Synthese u.a. von Fettsäuren und Steroiden. Es verleiht Zellen auch antioxidativen Schutz gegen Oxidantien / bei Infektionen.
Wofür wird Stoffwechselenergie benötigt?
Bei geringer Muskelbelastung setzt eine Erwachsener täglich 7-10 MJ Energie um (~30 Cal/kg
Körpergewicht). Bei Stresseinwirkung, stärkerer
Muskelbelastung oder verschiedenen Erkrankungen (Postaggressionsstoffwechsel) steigt diese Zahl an und kann mehr als das Doppelte
erreichen.

 Abbildung: Energiebilanz
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Abbildung: Energiebilanz
Nach einer Vorlage in Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021
Die Summe der
aufgenommenen Energie (Input) ist gleich der Summe an im steady state
verbrauchter (Output), freier, sowie zusätzlich gespeicherter und für
Wachstumsprozesse konsumierter Energie.
Im
Gleichgewicht entspricht die Energiezufuhr (links) dem Energieverbrauch
für verschiedene laufende Mechanismen - Bewegung, Synthese und Abbau,
Signalübertragung, Wärmebildung (Mitte) plus der Investition in
Energiespeicherung und Wachstum (rechts)
 Mehr als die Hälfte des Energieumsatzes dient biosynthetischen
Vorgängen, der Erhaltung der elektrophysiologischen Funktion erregbarer
Zellen, dem Transport von Stoffen und Information.
Mehr als die Hälfte des Energieumsatzes dient biosynthetischen
Vorgängen, der Erhaltung der elektrophysiologischen Funktion erregbarer
Zellen, dem Transport von Stoffen und Information.
Etwa ein Viertel
wird (im Tagesdurchschnitt unter "normalen" Bedingungen) für
die Kontraktion von Skelett-, Herz- und glattem Muskel konsumiert.
Weiters steigern Verdauung und Verwertung von Nährstoffen den
Stoffwechsel um bis zu einem Zehntel (spezifisch-dynamische Wirkung, thermic effect of food); Abgabe von Harn und Stuhl führt zu einem Energieverlust von einigen Prozent des Gesamtumsatzes.
Der Energieumsatz dient Auf-, Abbau- und
Ausscheidungsvorgängen, der Erbringung mechanischer Arbeit,
Transportvorgängen über Kompartimentgrenzen, Signalübermittlung und Wärmebildung.
Nimmt der Körper mehr Energie auf als er verbraucht, liegt eine
positive Energiebilanz vor und die Masse der Gewebe (z.B. Fettgewebe)
nimmt zu, da Energie in chemischer Form (Glykogen, Fett, Protein)
gespeichert wird. Umgekehrt nimmt die Masse an energiespeichernden Stoffen und damit das Körpergewicht bei negativer Energiebilanz mit Verbrauch von körpereigenen Energiereserven ab.
 Unter Ruhebedingungen verbrauchen Organe / Gewebe etwa folgenden prozentuellen Anteil am gesamten Energieumsatz des Körpers:
Unter Ruhebedingungen verbrauchen Organe / Gewebe etwa folgenden prozentuellen Anteil am gesamten Energieumsatz des Körpers:

Gehirn ≥20% (

<

) - Absolutwert physiologischerweise ziemlich konstant

Muskeln ≥20% (

>

) - Absolutwert steigend mit der körperlichen Belastung (bis ~10fach)

Immunsystem ~10% - Absolutwert bei Infektionen stark steigend

Leber ~20%

Nieren ~10%

Myokard ~10% - Absolutwert steigt mit körperlicher Belastung
|
Anteil am Ruhe-
Energieverbrauch
(%)
|
Anteil an der Körpermasse
(%)
|
m
|
f
|
m
|
f
|
Muskeln
|
25
|
20
|
43
|
33
|
Gehirn
|
22
|
26
|
2
|
2,5
|
Myokard
|
10
|
10
|
0,5
|
0,5
|
Leber
|
20
|
22
|
2
|
2,5
|
Fettgewebe
|
4
|
8
|
20
|
37
|
Bei körperlicher Belastung nimmt die Skelett- und Herzmuskulatur einen zunehmend größeren Anteil (bis ~90%) am Gesamtverbrauch in Anspruch ( s. dort), ein herausgefordertes Immunsystem verbraucht ebenfalls zunehmend mehr Energie.
s. dort), ein herausgefordertes Immunsystem verbraucht ebenfalls zunehmend mehr Energie.
Der Umsatz korreliert mit dem Sauerstoffbedarf, daher kann aus letzterem auf ersteren rückgeschlossen werden (Energieäquivalent).
Der physiologische Brennwert
sagt aus, wie viel Energie beim Abbau (Katabolismus) im Stoffwechsel
pro Gewichtseinheit eines Nahrungsmittels freigesetzt wird. Er beträgt

für
Kohlenhydrate und
Eiweiß 17 kJ/g (4,1 Cal/g)


für
Fette 39 kJ/g (9,3 Cal/g)
Ethanol liefert 7 Cal/g (29-30 kJ/g), hat also einen Brennwert, der näher an Fett als an Zucker oder Eiweiß liegt.
Der Brennwert von Kohlenhydraten und Eiweiß liegt bei ~17, von Alkohol bei ~30, von Fetten bei ~39 kJ/g
(4,1 / 7 / 9,3 Cal/g)
|
Es gilt also: Den höchsten Brennwert haben Fette (9,3 Cal/g), gefolgt
von Äthanol (7 Cal/g), schließlich Kohlenhydraten und Proteinen
(jeweils 4,1 Cal/g).
 Sollen z.B. 90 g Fett kaloriengleich durch Proteine ersetzt werden, braucht man dazu 200 g Eiweiß.
Sollen z.B. 90 g Fett kaloriengleich durch Proteine ersetzt werden, braucht man dazu 200 g Eiweiß.
 Über den Begriff Controllable Amount of Energy (CAEN) s. dort
Über den Begriff Controllable Amount of Energy (CAEN) s. dort
Zur Verbrennung von einem mol Glucose (=180 g) werden rund 134 Liter Sauerstoff benötigt. Das kalorische Äquivalent gibt an, wie viel Energie pro verbrauchter Sauerstoffmenge frei wird ("indirekte Kalorimetrie"). Für Glucose errechnet sich ein kalorisches Äquivalent 21,4 kJ / l O2. Für die Verbrennung von Fetten gilt ein Wert von 19,6, für die Verbrennung von Protein 18,8 kJ/l O2.
Diese Werte sind nicht weit voneinander entfernt, der Anteil der für
die Energiegewinnung verwendeten Substrate ist für die Berechnung daher von untergeordneter Bedeutung, und man kann etwa ein kalorisches
Äquivalent von 5 Cal pro Liter verbrauchten Sauerstoffs annehmen, oder (ebefalls gerundet):
Energieausbeute: ~20 kJ / l O2
(Energieäquivalent)
|
-
letztere Zahl ist insbesondere bei einem hohen Fettanteil am
Energiestoffwechsel (z.B. Ausdauersport) ein sehr guter Annäherungswert.
Fette
stellen die bei weitem ausgiebigste Energiespeicherform im Organismus
dar (Tabelle). Sie werden dann in aller Regel oxidativ und
vollständig abgebaut; es entsteht CO2, das (als Säureanhydrid) abgeatmet
wird, der Säure-Basen-Haushalt wird dabei nicht belastet.
Energiespeicherung
Das metabolische System ermöglicht die geordnete Umsetzung von Stoffen und Energie. Aufbauvorgänge bezeichnet man als anabol, Abbauvorgänge als katabol.  Die Aufnahme
von Aminosäuren, Kohlenhydraten, Fetten, Sauerstoff, Elektrolyten, Wasser sowie die Ausscheidung von CO2, Harnstoff und anderen Endprodukten ist
Voraussetzung für das Funktionieren des Stoffwechsels.
Die Aufnahme
von Aminosäuren, Kohlenhydraten, Fetten, Sauerstoff, Elektrolyten, Wasser sowie die Ausscheidung von CO2, Harnstoff und anderen Endprodukten ist
Voraussetzung für das Funktionieren des Stoffwechsels.


Abbildung: Energiespeicher einer gut ernährten erwachsenen Person (typisches Beispiel)
Nach Daten in: Cahill GF, Owen OE, Morgan AP. The
consumption of fuels during prolonged starvation. Adv Enz Regul 1968;
6: 143-50
Das
Blut transportiert - als "Sofortreserve" - nur einen winzigen Anteil
(<0,1%) der Energiereserven, die im Körper verfügbar sind. Der Glucosebedarf kann von ~5 g/kg/d auf ~3 (Hunger) oder (chronischer Hunger) bis ~1 g/kg/d abnehmen. Der Proteinabbau kann bei schwerer Katabolie bis zu 100 g/d betragen.
Die Speicherwerte können sich - z.B. trainingsbedingt - wesentlich von
den in dieser Abbildung gezeigten unterscheiden, insbesondere der Protein- (trainingsabhängig) und Fettspeicher

 Mäßige Muskelarbeit
wird energetisch etwa zu 3/4 aus dem Abbau von Fetten betrieben (1/4
aus Kohlenhydraten). Dementsprechend ist die Ausdauer bei dieser
Belastungsform sehr hoch: Bei einer Körperreserve von z.B. 15 kg
Fettgewebe errechnet sich für vollständige Utilisation (theoretisch)
ein Energieangebot von über 140.000 Kalorien, das wäre der Bedarf für
mindestens zwei Monate (erwachsene Person, mäßige Muskelaktivität).
Mäßige Muskelarbeit
wird energetisch etwa zu 3/4 aus dem Abbau von Fetten betrieben (1/4
aus Kohlenhydraten). Dementsprechend ist die Ausdauer bei dieser
Belastungsform sehr hoch: Bei einer Körperreserve von z.B. 15 kg
Fettgewebe errechnet sich für vollständige Utilisation (theoretisch)
ein Energieangebot von über 140.000 Kalorien, das wäre der Bedarf für
mindestens zwei Monate (erwachsene Person, mäßige Muskelaktivität).
 Über den Kohlenhydrat-, Fett- und Eiweißbedarf s. dort
Über den Kohlenhydrat-, Fett- und Eiweißbedarf s. dort
 Über den Bedarf an Mineralien, Vitaminen und Spurenelementen s. dort
Über den Bedarf an Mineralien, Vitaminen und Spurenelementen s. dort
In die Zellen gelangte Stoffe werden entsprechend der Ausstattung an Enzymen
umgebaut. Es entstehen neue
Substanzen, manche verlassen die Zellen, erscheinen im Blut und können
diagnostische Hinweise auf den Zustand der Zellen geben (z.B. Leberfunktionsindikatoren).
Einige Plasmaproteine (=mobile Eiweißmoleküle im Extrazellulärraum) sind
organspezifische Enzyme, deren Menge etwas über
Schäden des Ursprungsorgans aussagt. Das wird in der Enzymdiagnostik
labordiagnostisch ausgenützt (z.B. Leber- und Muskelschäden, Herzinfarkt).
Nutzbare Energiespeicher im Körper

Modifiziert nach Boron / Boulpaep: Concise Medical Physiology, Elsevier 2021 |
Stoffgruppe
|
Masse (kg)
|
Energiedichte (kcal/g)
|
Gespeicherte Energie (kcal)
|
Glykogen
|
0,5-1
|
~1
|
1000-2000
|
Proteine
|
~5
|
~4
|
~20.000
|
Lipide
|
~15
|
~9
|
~135.000
|
 Energiespeicher:
Energiespeicher: Die
folgenden Organe / Gewebe speichern Energie, die im Bedarfsfall für den
Organismus bereitgestellt werden kann:

die
Leber
vor allem in Form von Glykogen (nach Glykogenolyse wird Glucose an das
Blut abgegeben, der Bedarf der Peripherie - vor allem des Gehirns -
kann so im Nüchternzustand für
mehrere Stunden gedeckt werden)

die
Muskulatur
in Form von Glykogen (für den Eigenbedarf) und (im Notfall) Proteinen
(im Hungerzustand werden glukoplastische Aminosäuren von der Leber in Glucose
umgebaut; Überbrückung für
1-2 Tage)

das
Fettgewebe deckt den Energiebedarf des Körpers bei fehlendem Nahrungsangebot für
mehrere Wochen (Neutralfette, aus denen Fettsäuren gewonnen werden können)

Der
Körper speichert den größten Anteil von Überschußenergie in Form von
Fett, nicht Glykogen - denn Lipide haben eine wesentlich höhere
nutzbare Energiedichte (
~9 Cal/g) als Glykogen (
~1
Cal/g). Proteine sind hochwertige Baustoffe des Körpers und sind
normalerweise von einer Nutzung als Energiespeicher weitgehend
ausgenommen. Die in Lipiden gespeicherte Energiemenge beträgt ungefähr
das Hundertfache der in Form von Glykogen gespeicherten (s. Tabelle).
Um die Homöostase im Körper zu erhalten, braucht dieser Energie, um
mechanische und chemische Arbeit leisten zu können (Kontraktion und
Bewegung, Synthese, Transport, Konzentrationsgradienten). Diese Energie
wird aus dem Stoffwechsel gewonnen - letztlich durch den Abbau von
Kohlenhydraten, Lipiden, Aminosäuren (Katabolismus). Dabei entstehen einerseits energieärmere Zwischenprodukte (Elektronenübertragung s. oben) und schließlich Endprodukte wie Kohlendioxid, Wasser, Ammoniak; andererseits werden Energieträger wie ATP, NADH, NADPH und FADH2 "aufgeladen" und diese Energie u.a. für die Biosynthese komplexer Moleküle aus Vorläufermolekülen verwendet (Anabolismus; Abbildung).

 Abbildung: Katabolismus und Anabolismus
Nach einer Vorlage in Frayn / Evans, Human Metabolism - A Regulatory Perspective, 4th ed. Wiley Blackwell 2019
Abbildung: Katabolismus und Anabolismus
Nach einer Vorlage in Frayn / Evans, Human Metabolism - A Regulatory Perspective, 4th ed. Wiley Blackwell 2019
Täglich
verbraucht der Organismus einer erwachsenen Person ~500 Gramm
Nährstoffe und ~500 Liter Sauerstoff. Täglich entstehen ~450 Liter
Kohlendioxid, ~0,3 Liter Wasser ("Oxidationswasser") und ~50 Gramm
Harnstoff, Ammoniak und andere Endprodukte. Dabei werden ~10 MJ Energie umgesetzt (körperliche Ruhe, sonst höhere Werte)
 Sofern Biomoleküle nicht als eigentliche Endprodukte gelten, kann man sie grob einteilen in
Sofern Biomoleküle nicht als eigentliche Endprodukte gelten, kann man sie grob einteilen in

Substrate (Ausgangsstoffe für den
Stoffwechsel) - z.B. Zucker,
Aminosäuren, Fettsäuren, Nukleinsäuren

Zwischenprokukte (z.B. Lactat, Ketonkörper)


Endprodukte des Stoffwechsels (z.B. CO
2, Ammoniumionen, Harnstoff - zur Harnstoffausscheidung

s.
dort)
Spezielle Produkte sind
z.B. Hormone, Transmitter, Mediatoren ("Signalmoleküle"), Wirkstoffe im
Immunsystem (Zytokine, Antikörper, Komplementfaktoren), Gerinnungsfaktoren, Strukturproteine (Kollagen, kontraktile Filamente etc).
So
wird Glucose mit Phosphat verknüpft und dadurch “gefangen” (die
Zellmembran ist für Glucosephosphat undurchlässig). Sie kann zur
Energiegewinnung abgebaut
werden (Glucoseabbau = Glykolyse), oder sie wird zu Glykogen (polymere
Speicherform) oder Glucuronsäure (Lösungsvermittler z.B. von
Gallenfarbstoffen) umgewandelt.
Das Zuckersystem ist weiters (über den
Pentosephosphat-Zyklus) mit der Bildung von Nukleinsäuren, und über das
Glycerinphosphat mit dem Stoffwechsel der Neutralfette (Fettsäuren und
Triglyceriden) verknüpft. Ernähungstherapeutisch
bedeutsame Zuckeraustauschstoffe (Diabetiker!) - Galactose, Fructose; Sorbit, Xylit -
umgehen den Glucoseabbau-Mechanismus und münden über eigene Wege in den
Kohlenhydratmetabolismus ein.
Zellen
müssen ihre Energiebilanz den jeweiligen Umständen anpassen: Aufbau von
Nukleinsäuren, Eiweiß, Nukleinsäuren, Zellorganellen. Dazu verfügen sie
über Sensoren ( Abbildung), die in der Lage
sind, die aktuellen Speicher in der Zelle zu messen und - auch
entsprechend der verfügbaren ATP-Konzentration - aufbauende (anabole)
und abbauende (katabole) Vorgänge in Balance zu halten.
Abbildung), die in der Lage
sind, die aktuellen Speicher in der Zelle zu messen und - auch
entsprechend der verfügbaren ATP-Konzentration - aufbauende (anabole)
und abbauende (katabole) Vorgänge in Balance zu halten.

 Abbildung: Stoffwechselsensoren
Abbildung: Stoffwechselsensoren
Nach einer Vorlage bei White / Harrison / Mehlmann, Endocrine and reproductive physiology, 5th ed. Elsevier 2019
mTORC1 und AMPK
sind zentrale Energie- und Substratsensoren der Zelle. Sie regulieren
zusammen mit Hormonen den Stoffwechsel:
Der Kinasekomplex mTORC
stimuliert anabole Vorgänge wie die Proteinsynthese.
Die Kinase AMPK regt katabole
Vorgänge wie Glykolyse und Oxidation freier Fettsäuren an. Ihre
Aktivität steigt bei körperlicher Belastung (antidiabetogener Effekt).
AMP (Adenosinmonophosphat) ist ein allosterischer Regulator und Agonist für AMPK.
mTORC und AMPK antagonisieren ihre Wirkungen wechselseitig.
 Insulin, Ghrelin, Adiponektin
Insulin, Ghrelin, Adiponektin

Zwei dieser "master sensors" sind mTORC1 (mammalian target of rapamycin complex 1) und AMPK (AMP-activated kinase):
 Der Kinasekomplex mTORC1 ist
zusammengesetzt aus der Kinase mTOR - einem Sensor für Nährstoffverfügbarkeit, Energiegehalt und Redoxstatus der Zelle -
und Begleitfaktoren. Seine Aktivität steht unter dem Einfluss von
Wachstumsfaktoren, Insulin, bestimmten Aminosäuren, mechanischen Stimuli, oxidativem Stress
(
Der Kinasekomplex mTORC1 ist
zusammengesetzt aus der Kinase mTOR - einem Sensor für Nährstoffverfügbarkeit, Energiegehalt und Redoxstatus der Zelle -
und Begleitfaktoren. Seine Aktivität steht unter dem Einfluss von
Wachstumsfaktoren, Insulin, bestimmten Aminosäuren, mechanischen Stimuli, oxidativem Stress
( Abbildung). TORC regt die Organisation von Ribonukleinsäuren und die Eiweißsynthese an.
Abbildung). TORC regt die Organisation von Ribonukleinsäuren und die Eiweißsynthese an.
 Die Aktivität des Enzyms AMPK
tritt in den Vordergrund, wenn die Energiereserven der Zelle niedrig
sind. Es unterstützt die Aufnahme von Energieträgern in Zellen, die es
exprimieren, vor allem in Gehirn, Leber, Muskel- und Fettgewebe. Dabei
erhöht es die Bildung mitochondrialer Enzyme wie Cytochrom c. AMPK
vermittelt u.a. Ketogenese (Leber) und Fettsäureoxidation (Leber,
Muskel), Glucoseaufnahme (Muskel), Triglyceridsynthese und Hemmung der
Lipolyse (Fettgewebe). Angeregt wird seine Aktivität durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, und Signalstoffe wie
Ghrelin und Adiponektin (
Die Aktivität des Enzyms AMPK
tritt in den Vordergrund, wenn die Energiereserven der Zelle niedrig
sind. Es unterstützt die Aufnahme von Energieträgern in Zellen, die es
exprimieren, vor allem in Gehirn, Leber, Muskel- und Fettgewebe. Dabei
erhöht es die Bildung mitochondrialer Enzyme wie Cytochrom c. AMPK
vermittelt u.a. Ketogenese (Leber) und Fettsäureoxidation (Leber,
Muskel), Glucoseaufnahme (Muskel), Triglyceridsynthese und Hemmung der
Lipolyse (Fettgewebe). Angeregt wird seine Aktivität durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, und Signalstoffe wie
Ghrelin und Adiponektin ( Abbildung); Leptin und Insulin wirken
inhibierend.
Abbildung); Leptin und Insulin wirken
inhibierend.

 Abbildung: Zu- und Abfluss von Glucose in das / aus dem Blut
Abbildung: Zu- und Abfluss von Glucose in das / aus dem Blut
Zustrom
von Glucose (aus Darm oder Leber) erhöht den Blutzuckerspiegel,
Verbrauch (Gehirn, Muskulatur, Fettgewebe etc) senkt ihn.
Die Nieren entfernen Glucose nur dann aus dem Kreislauf, wenn die
maximale Transportkapazität der Nephrone für Glucose überschritten wird
(Glucosurie)

Triglyzeride (Serum): <200 mg/dl
Glucose (Serum)
: 3,3-6,0 mM (60-110 mg/dl)
Nutzung von Glucose: Der Zuckerabbau
erfolgt zunächst bis zur Stufe der Brenztraubensäure (Pyruvat). Bei
Sauerstoffmangel endet die Glykolyse auf dieser Stufe, und es entsteht
- anoxidativ, d.h. ohne Verbrauch von Sauerstoff - Milchsäure (Lactat).
Zu Beginn einer - und bei hoher - Muskelbelastung ist der Energiedurchsatz größer als die
oxidative Nachbildung (Sauerstoffdefizit, "Sauerstoffschuld"); ein Teil der metabolisch benötigten
Energie wird dann aus anaerober Phosphorylierung (bis zur Pyruvat / Lactat-Stufe) gewonnen. Das Lactat belastet die Pufferkapazität der extrazellulären Flüssigkeiten, wird in den Kreislauf ausgespült und senkt den Blut-pH (nicht-respiratorische Azidose).
Bei nachlassender / beendeter Muskelbelastung stellt sich der
Stoffwechsel nach einer Übergangsphase, in der die "Sauerstoffschuld
zurückgezahlt" und der Speicher an energiereichen Phosphaten in den
Muskelzellen wieder aufgefüllt wird, auf den Ruhezustand zurück. Auch
der Blut-pH normalisiert sich, der Lactat-Überschuss im Blut wird u.a.
vom Herzmuskel entfernt. In der Übergangsphase ist die Herz- und Atemfrequenz so lange erhöht, bis die Ruhe-Basisbedingungen wieder erreicht sind.
Lactat (das Salz der Milchsäure) ist nicht nur ein "Abfallprodukt" des
Stoffwechsels, es kann für Gluconeogenese und Energiegewinnung
verwendet werden und findet Verwendung als Signalmolekül, das u.a. für
Energieregulation, Immunmodulation, Gedächtnisbildung und Wundheilung
eine Rolle spielt.
Wie gelangt Lactat durch Zellmembranen? Dazu gibt es verschiedene Transportsysteme (MCTs, monocarboxylate transporters). Einige von ihnen bringen außer Milchsäure auch Ketonkörper durch die Membran. Weiters sind sogenannte Lactatrezeptoren im Spiel, wie das GPR81
(ein Gi-Protein-gekoppelter Rezeptor). Exprimiert werden diese vor
allem von Fett-, aber auch von Muskel-, Leber-, Nerven- und
Tubuluszellen. Lactat kann die Zelle über MCTs verlassen und dabei den
GPR-Mechanismus aktivieren (wobei die cAMP-Bildung absinkt), was wiederum die Lipolyse hemmt und die Fettspeicher schont ( Abbildung).
Abbildung).

 Abbildung: Lactatkinetik und -wirkungen
Abbildung: Lactatkinetik und -wirkungen
Nach Sun S, Li H, Chen J, Qian Q. Lactic Acid: No Longer an Inert and End-Product of Glycolysis. Physiology 2017; 32: 453-63
Lactat fördert Immuntoleranz (anti-inflammatorischer Effekt), Wundheilung,
kontinuierliche ATP-Produktion durch oxidative Phosphorylierung sowie das
Langzeitgedächtnis.
Lactat wird
über ein MCT-System durch die Zellmembran transportiert. Dieses
aktiviert GPR81, das die Adenylatzyklase hemmt und auch alternative
Signalwege nützt. Lactat, MCTs und GPR81 bilden ein System, das die
Lipolyse im Fettgewebe limitiert
GPR81, G-Protein-gekoppelter Lactatligand, hemmt cAMP-Bildung  GLUT, Glucosetransporter
GLUT, Glucosetransporter  MCT,
Monocarboxylat-Transporter (12 Transmembrandomänen, befördert u.a. Lactat, Pyruvat und Ketonkörper durch die Zellmembran)
MCT,
Monocarboxylat-Transporter (12 Transmembrandomänen, befördert u.a. Lactat, Pyruvat und Ketonkörper durch die Zellmembran)  PKA, Proteinkinase A
PKA, Proteinkinase A
 Lactat-Homöostase:
Lactat-Homöostase:

In den Blutkreislauf einer erwachsenen Person gelangen täglich etwa 1500 mmol Lactat - jeweils ein Viertel davon aus Muskulatur, Gehirn und Haut, der Rest aus roten Blutkörperchen und Darm.

 Fast zur Gänze entfernt die Leber das Lactat über den Cori-Zyklus (Gluconeogenese) bzw. über oxidative Phorphorylierung (ATP-Synthese, Krebs-Zyklus) - bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen.
Fast zur Gänze entfernt die Leber das Lactat über den Cori-Zyklus (Gluconeogenese) bzw. über oxidative Phorphorylierung (ATP-Synthese, Krebs-Zyklus) - bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen.
 Auch das Myokard kann Lactat für seinen Erergiestoffwechsel nutzen - zu 10-15% bei körperlicher Ruhe, bis zu 30% bei Belastung.
Auch das Myokard kann Lactat für seinen Erergiestoffwechsel nutzen - zu 10-15% bei körperlicher Ruhe, bis zu 30% bei Belastung.
 Die Niere
utilisiert in der Rindenzone Lactat für ihren Energiestoffwechsel (das
Mark kann Lactat bilden), es wird zu mehr als 50% für die renale
Gluconeogenese verwendet. Der Anteil des renal gebildeten Blutzuckers
an der Einspeisung von Glucose in den Kreislauf kann von ~10% im
normalen Ruhezustand auf ~40% ansteigen (körperliche Belastung,
Hypoglykämie, längeres Fasten, Adrenalinanstieg).
Die Niere
utilisiert in der Rindenzone Lactat für ihren Energiestoffwechsel (das
Mark kann Lactat bilden), es wird zu mehr als 50% für die renale
Gluconeogenese verwendet. Der Anteil des renal gebildeten Blutzuckers
an der Einspeisung von Glucose in den Kreislauf kann von ~10% im
normalen Ruhezustand auf ~40% ansteigen (körperliche Belastung,
Hypoglykämie, längeres Fasten, Adrenalinanstieg).
 Lactat (Blutserum, körperliche Ruhe / nüchtern):
Lactat (Blutserum, körperliche Ruhe / nüchtern):
Venös 0,5-2,2 mM (4,5-20 mg/dl), arteriell <1,8 mM
vgl. dort


 Nährstoffe werden gebraucht für Biosynthese (Wachstum, Regeneration, Immunabwehr, Sekretion, Strukturerhaltung) und Energienutzung (Transport, Bewegung, Verformung, Energiespeicherung). Bindungsenergie für den Aufbau energiereicher Phosphate (ATP, CP) stammt zum Großteil aus oxidativem Abbau
von Kohlenhydraten und Fetten.
Lipolyse liefert freie Fettsäuren aus der Spaltung
von Neutralfett. Insulin, Glukagon, Adrenalin u.a. stabilisieren den Blutzuckerspiegel. Primärer Glucoseverbraucher ist
das Gehirn, obligat glucoseabhängig sind weiters Nebenniere,
Erythrozyten, Fibroblasten Nährstoffe werden gebraucht für Biosynthese (Wachstum, Regeneration, Immunabwehr, Sekretion, Strukturerhaltung) und Energienutzung (Transport, Bewegung, Verformung, Energiespeicherung). Bindungsenergie für den Aufbau energiereicher Phosphate (ATP, CP) stammt zum Großteil aus oxidativem Abbau
von Kohlenhydraten und Fetten.
Lipolyse liefert freie Fettsäuren aus der Spaltung
von Neutralfett. Insulin, Glukagon, Adrenalin u.a. stabilisieren den Blutzuckerspiegel. Primärer Glucoseverbraucher ist
das Gehirn, obligat glucoseabhängig sind weiters Nebenniere,
Erythrozyten, Fibroblasten
 Zellen bilden ATP nach
Maßgabe des aktuellen Bedarfs, aerob
~20-mal effizienter als anaerob. Abbau von Kohlenhydraten, Fetten,
Proteinen ergibt Acetyl-Coenzym A (auch Ausgangspunkt der Cholesterinsynthese), bei dessen Abbau entsteht H+ (Elektronentransport über Coenzyme NAD+, NADP+, FAD, die Elektronen und damit Energie aufnehmen und zu NADH, NADPH, FADH2
werden: Redox-Reaktion) und wird im mitochondrialen Intermembranraum
angereichert; dieser Protonengradient treibt die ATP-Synthese an (H+-Rückdiffusion durch ATP-Synthase in der inneren Mitochondrienmembran). Die aerobe Oxidation von 1 mol Glucose liefert 38
mol ATP, der Rest geht als Wärme verloren. Der Wirkungsgrad (~40%) kann durch uncoupling proteins in den
Mitochondrien reduziert werden (verstärkte Wärmebildung).
Mitochondrien
können neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
verschmelzen oder sich aufspalten, wodurch sich Zahl und Volumen
je nach Anforderung ändern; mit
zunehmendem Energieumsatz steigt die Mitochondriendichte
Zellen bilden ATP nach
Maßgabe des aktuellen Bedarfs, aerob
~20-mal effizienter als anaerob. Abbau von Kohlenhydraten, Fetten,
Proteinen ergibt Acetyl-Coenzym A (auch Ausgangspunkt der Cholesterinsynthese), bei dessen Abbau entsteht H+ (Elektronentransport über Coenzyme NAD+, NADP+, FAD, die Elektronen und damit Energie aufnehmen und zu NADH, NADPH, FADH2
werden: Redox-Reaktion) und wird im mitochondrialen Intermembranraum
angereichert; dieser Protonengradient treibt die ATP-Synthese an (H+-Rückdiffusion durch ATP-Synthase in der inneren Mitochondrienmembran). Die aerobe Oxidation von 1 mol Glucose liefert 38
mol ATP, der Rest geht als Wärme verloren. Der Wirkungsgrad (~40%) kann durch uncoupling proteins in den
Mitochondrien reduziert werden (verstärkte Wärmebildung).
Mitochondrien
können neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
verschmelzen oder sich aufspalten, wodurch sich Zahl und Volumen
je nach Anforderung ändern; mit
zunehmendem Energieumsatz steigt die Mitochondriendichte
 Biosynthetische
Vorgänge, Transport von Stoffen und
Information konsumieren >50% des Energieumsatzes;
~25% Kontraktionsvorgänge
(Skelett-, Herz-, glatte Muskulatur). Verdauung und Verwertung von Nährstoffen steigern den Energieumsatz um bis zu 10%
(spezifisch-dynamische Wirkung). Bei positiver Energiebilanz speichern Zellen Glykogen, Fett, Protein. Unter Ruhebedingungen
verbrauchen das Gehirn ≥20%, Muskeln ≥20% (mehr mit körperlicher
Belastung), Immunsystem ~10%, Leber ~20%, Nieren ~10%, Myokard ~10% des gesamten Energieumsatzes. Dieser
korreliert mit dem Sauerstoffverbrauch (indirekte Kalorimetrie: Energieäquivalent 21,4 kJ / l O2). Der physiologische Brennwert beträgt für Kohlenhydrate und Eiweiß 17 kJ/g, für Fette 39 kJ/g Biosynthetische
Vorgänge, Transport von Stoffen und
Information konsumieren >50% des Energieumsatzes;
~25% Kontraktionsvorgänge
(Skelett-, Herz-, glatte Muskulatur). Verdauung und Verwertung von Nährstoffen steigern den Energieumsatz um bis zu 10%
(spezifisch-dynamische Wirkung). Bei positiver Energiebilanz speichern Zellen Glykogen, Fett, Protein. Unter Ruhebedingungen
verbrauchen das Gehirn ≥20%, Muskeln ≥20% (mehr mit körperlicher
Belastung), Immunsystem ~10%, Leber ~20%, Nieren ~10%, Myokard ~10% des gesamten Energieumsatzes. Dieser
korreliert mit dem Sauerstoffverbrauch (indirekte Kalorimetrie: Energieäquivalent 21,4 kJ / l O2). Der physiologische Brennwert beträgt für Kohlenhydrate und Eiweiß 17 kJ/g, für Fette 39 kJ/g
 Eine
erwachsene Person braucht pro Tag ≥2 l Wasser, ~500 Gramm Nährstoffe
und ~500 Liter Sauerstoff, dabei entstehen ~450 Liter Kohlendioxid,
~0,3 Liter Wasser
("Oxidationswasser") und ~50 Gramm Harnstoff, Ammoniak und andere
Endprodukte. Der Energiebedarf beträgt
~10 MJ/d. Blut enthält mit ~20 g Glucose, ~3 g Triglyzeriden und
~0,3 g Fettsäuren nur <0,1% (~110 Cal) der Energiereserven des Körpers (>150.000 Cal). Der Glucosebedarf beträgt
~5 g/kg/d und kann bei chronischem Hunger bis auf
~1 g/kg/d abnehmen (dabei Proteinabbau bis zu 100 g/d). Mäßige Muskelarbeit wird zum Großteil aus dem Abbau von Fettsäuren, zu
~1/4 aus Kohlenhydraten angetrieben (hohe Ausdauer). Die
Leber kann den Bedarf der Peripherie für einige Stunden decken
(Glykogenabbau), das Fettgewebe für mehrere Wochen (Lipolyse, Gewinnung
von Fettsäuren) Eine
erwachsene Person braucht pro Tag ≥2 l Wasser, ~500 Gramm Nährstoffe
und ~500 Liter Sauerstoff, dabei entstehen ~450 Liter Kohlendioxid,
~0,3 Liter Wasser
("Oxidationswasser") und ~50 Gramm Harnstoff, Ammoniak und andere
Endprodukte. Der Energiebedarf beträgt
~10 MJ/d. Blut enthält mit ~20 g Glucose, ~3 g Triglyzeriden und
~0,3 g Fettsäuren nur <0,1% (~110 Cal) der Energiereserven des Körpers (>150.000 Cal). Der Glucosebedarf beträgt
~5 g/kg/d und kann bei chronischem Hunger bis auf
~1 g/kg/d abnehmen (dabei Proteinabbau bis zu 100 g/d). Mäßige Muskelarbeit wird zum Großteil aus dem Abbau von Fettsäuren, zu
~1/4 aus Kohlenhydraten angetrieben (hohe Ausdauer). Die
Leber kann den Bedarf der Peripherie für einige Stunden decken
(Glykogenabbau), das Fettgewebe für mehrere Wochen (Lipolyse, Gewinnung
von Fettsäuren)
 Zellen passen
ihre Energiebilanz den jeweiligen Umständen an. Dazu haben sie Sensoren, welche die aktuellen Speicher in der
Zelle messen und anabole / katabole
Vorgänge in Balance halten. Zwei dieser "master sensors" sind der Kinasekomplex mTORC (stimuliert anabole Vorgänge wie die Proteinsynthese) und die Kinase AMPK (stimuliert katabole Vorgänge wie Glykolyse und Oxidation freier Fettsäuren) - sie antagonisieren ihre Wirkungen wechselseitig. mTORC wird gesteuert durch Wachstumsfaktoren, Insulin, Aminosäuren, mechanische Stimuli, oxidativen Stress. AMPK vermittelt
Ketogenese (Leber) und Fettsäureoxidation (Leber, Muskel), Glucoseaufnahme (Muskel), Triglyzeridsynthese / Hemmung der Lipolyse
(Fettgewebe), es wird angeregt durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, Ghrelin, Adiponektin; Leptin und Insulin wirken
inhibierend Zellen passen
ihre Energiebilanz den jeweiligen Umständen an. Dazu haben sie Sensoren, welche die aktuellen Speicher in der
Zelle messen und anabole / katabole
Vorgänge in Balance halten. Zwei dieser "master sensors" sind der Kinasekomplex mTORC (stimuliert anabole Vorgänge wie die Proteinsynthese) und die Kinase AMPK (stimuliert katabole Vorgänge wie Glykolyse und Oxidation freier Fettsäuren) - sie antagonisieren ihre Wirkungen wechselseitig. mTORC wird gesteuert durch Wachstumsfaktoren, Insulin, Aminosäuren, mechanische Stimuli, oxidativen Stress. AMPK vermittelt
Ketogenese (Leber) und Fettsäureoxidation (Leber, Muskel), Glucoseaufnahme (Muskel), Triglyzeridsynthese / Hemmung der Lipolyse
(Fettgewebe), es wird angeregt durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, Ghrelin, Adiponektin; Leptin und Insulin wirken
inhibierend
 Erythrozyten arbeiten
anaerob, sie geben Lactat an das Blutplasma
ab. Diesen Weg nutzen auch Muskelzellen, wenn sie mehr ATP verbrauchen
als durch oxydativen Abbau nachgeliefert
werden kann ("Sauerstoffschuld"): Sie bilden Lactat, das von anderen Geweben (Leber, Herz- und nichtaktive Muskulatur, Nieren) genutzt werden kann, aber die Pufferkapazität des Blutes belastet
(metabolische Azidose). Lactat fördert Immuntoleranz (anti-inflammatorischer
Effekt), Wundheilung, ATP-Produktion, Langzeitgedächtnis, und reduziert
die lipolytische Aktivität in Fettzellen. In den Blutkreislauf gelangen täglich
~1500
mmol Lactat, die Leber entfernt es
über den Cori-Zyklus (Glukoneogenese) und oxidative
Phorphorylierung (Citratzyklus), bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen Erythrozyten arbeiten
anaerob, sie geben Lactat an das Blutplasma
ab. Diesen Weg nutzen auch Muskelzellen, wenn sie mehr ATP verbrauchen
als durch oxydativen Abbau nachgeliefert
werden kann ("Sauerstoffschuld"): Sie bilden Lactat, das von anderen Geweben (Leber, Herz- und nichtaktive Muskulatur, Nieren) genutzt werden kann, aber die Pufferkapazität des Blutes belastet
(metabolische Azidose). Lactat fördert Immuntoleranz (anti-inflammatorischer
Effekt), Wundheilung, ATP-Produktion, Langzeitgedächtnis, und reduziert
die lipolytische Aktivität in Fettzellen. In den Blutkreislauf gelangen täglich
~1500
mmol Lactat, die Leber entfernt es
über den Cori-Zyklus (Glukoneogenese) und oxidative
Phorphorylierung (Citratzyklus), bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen
|

 Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.
Die Informationen in dieser Website basieren auf verschiedenen Quellen:
Lehrbüchern, Reviews, Originalarbeiten u.a. Sie
sollen zur Auseinandersetzung mit physiologischen Fragen, Problemen und
Erkenntnissen anregen. Soferne Referenzbereiche angegeben sind, dienen diese zur Orientierung; die Grenzen sind aus biologischen, messmethodischen und statistischen Gründen nicht absolut. Wissenschaft fragt, vermutet und interpretiert; sie ist offen, dynamisch und evolutiv. Sie strebt nach Erkenntnis, erhebt aber nicht den Anspruch, im Besitz der "Wahrheit" zu sein.





 Intermediärstoffwechsel, Substratflüsse zwischen Organen
Intermediärstoffwechsel, Substratflüsse zwischen Organen
 anabol: ανα = hinauf, βάλλειν = werfen
anabol: ανα = hinauf, βάλλειν = werfen Lipide, Kohlenhydrate, Aminosäuren
Lipide, Kohlenhydrate, Aminosäuren  Energiegewinnung
Energiegewinnung  Funktion der Mitochondrien
Funktion der Mitochondrien  Citratzyklus
Citratzyklus  Energieutilisation, Brennwert
Energieutilisation, Brennwert  Energieäquivalent
Energieäquivalent  Energiespeicherung
Energiespeicherung  Energieumsatz
Energieumsatz  Lactat
Lactat

 Grundumsatz
Grundumsatz  Ruheumsatz
Ruheumsatz  Arbeitsumsatz
Arbeitsumsatz  Gluconeogenese
Gluconeogenese  aerob / anaerob
aerob / anaerob  Aminosäurepool
Aminosäurepool  Freie Energie
Freie Energie  Glykolyse
Glykolyse  Coenzym A
Coenzym A
 )
versteht man die Gesamtheit der Transportvorgänge und chemischen
Reaktionen in und zwischen den Zellen des Organismus. Dazu werden pro
Tag bei körperlicher Ruhe etwa 30 kcal/kg Körpermasse Energie umgesetzt
(Ruheumsatz); Belastung oder Stress erhöhen den Energiebedarf. Als Grundumsatz bezeichnet man den Energiemusatz unter entsprechenden Normbedingungen.
)
versteht man die Gesamtheit der Transportvorgänge und chemischen
Reaktionen in und zwischen den Zellen des Organismus. Dazu werden pro
Tag bei körperlicher Ruhe etwa 30 kcal/kg Körpermasse Energie umgesetzt
(Ruheumsatz); Belastung oder Stress erhöhen den Energiebedarf. Als Grundumsatz bezeichnet man den Energiemusatz unter entsprechenden Normbedingungen.  Energie
Energie  ist - als Maß für die Fähigkeit eines Systems, Arbeit zu verrichten - eine Basisgröße, die in mehreren Formen auftritt (potentiell,
kinetisch, elektrisch, chemisch, Wärme), auch als Materie (E = mc2). Alleine zum Betreiben der Na/K-ATPase im Organismus werden rund 30% der gesamten Stoffwechselenergie des Organismus aufgebracht.
ist - als Maß für die Fähigkeit eines Systems, Arbeit zu verrichten - eine Basisgröße, die in mehreren Formen auftritt (potentiell,
kinetisch, elektrisch, chemisch, Wärme), auch als Materie (E = mc2). Alleine zum Betreiben der Na/K-ATPase im Organismus werden rund 30% der gesamten Stoffwechselenergie des Organismus aufgebracht.
 Abbildung: Auf jeweils 100g Gewebe normierte Wärmeproduktion des ruhenden Körpers
Abbildung: Auf jeweils 100g Gewebe normierte Wärmeproduktion des ruhenden Körpers

 (W) ist die Einheit der Leistung: 1 W = 1 J/s. Leistung ist die in einer Zeitspanne umgesetzte Energie.
(W) ist die Einheit der Leistung: 1 W = 1 J/s. Leistung ist die in einer Zeitspanne umgesetzte Energie. 



 Als unmittelbare Energielieferanten - Bindungsenergie für den Aufbau
energiereicher Phosphate (ATP, CP), was vor allem benötigt wird
Als unmittelbare Energielieferanten - Bindungsenergie für den Aufbau
energiereicher Phosphate (ATP, CP), was vor allem benötigt wird  für aktiven Transport über Kompartmentgrenzen (z.B. Na-K-Pumpe) als
Grundlage von Homöostase, Membranpotentialaufbau, Ausscheidungsvorgängen
für aktiven Transport über Kompartmentgrenzen (z.B. Na-K-Pumpe) als
Grundlage von Homöostase, Membranpotentialaufbau, Ausscheidungsvorgängen zum Antreiben mechanischer Arbeit
(Bewegung, Verformung, Muskelkontraktion)
zum Antreiben mechanischer Arbeit
(Bewegung, Verformung, Muskelkontraktion) Zur Biosynthese neuer Moleküle (Erneuerung, Wachstum, Immunabwehr, Sekretion..)
Zur Biosynthese neuer Moleküle (Erneuerung, Wachstum, Immunabwehr, Sekretion..) Zur Energiespeicherung (vor allem Fett, Glykogen). Kohlenhydrate
sind wasserlöslich und üben in der Zelle einen deutlichen osmotischen
Effekt aus (Leber- und Muskelzellen schützen sich, indem sie Glucose zu
Glykogen polymerisieren und den osmotischen Effekt so minimieren). Fette hingegen sind nicht wasserlöslich und bilden Fetttröpfchen
als Speicherform (Neutralfette und Fettsäuren); Wasser ist hier
ausgeschlossen, und Energie kann in hoher Dichte gespeichert werden.
Zur Energiespeicherung (vor allem Fett, Glykogen). Kohlenhydrate
sind wasserlöslich und üben in der Zelle einen deutlichen osmotischen
Effekt aus (Leber- und Muskelzellen schützen sich, indem sie Glucose zu
Glykogen polymerisieren und den osmotischen Effekt so minimieren). Fette hingegen sind nicht wasserlöslich und bilden Fetttröpfchen
als Speicherform (Neutralfette und Fettsäuren); Wasser ist hier
ausgeschlossen, und Energie kann in hoher Dichte gespeichert werden. Zur Zeitabhängigkeit der Nutzung verschiedener Energiequellen im Muskel s. dort
Zur Zeitabhängigkeit der Nutzung verschiedener Energiequellen im Muskel s. dort Als Grundumsatz (Basal metabolic rate BMR) bezeichnet man den Energieumsatz
Als Grundumsatz (Basal metabolic rate BMR) bezeichnet man den Energieumsatz  Körpergewicht
Körpergewicht Körpergröße (beide steigern den Grundumsatz)
Körpergröße (beide steigern den Grundumsatz) Körperzusammensetzung
- diese ist u.a. geschlechtsabhängig (Fettanteil bei
Männern ~10-15%, bei Frauen ~20-25% des Körpergewichts). Männer weisen
daher im Mittel einen höheren Grundumsatz auf als gleich schwere Frauen.
Körperzusammensetzung
- diese ist u.a. geschlechtsabhängig (Fettanteil bei
Männern ~10-15%, bei Frauen ~20-25% des Körpergewichts). Männer weisen
daher im Mittel einen höheren Grundumsatz auf als gleich schwere Frauen.
 Die fettfreie Masse (FFM - Frauen 75-80%, Männer 85-90% der Körpermasse) besteht hauptsächlich aus Muskulatur und ist
stoffwechselintensiv, ihr Gewicht steht mit der Energieproduktion des
Körpers in linearem Zusammenhang; Aufgabe des Fettgewebes ist hingegen
die Speicherung von Energie über längere Zeit (nicht deren akute
Freisetzung).
Die fettfreie Masse (FFM - Frauen 75-80%, Männer 85-90% der Körpermasse) besteht hauptsächlich aus Muskulatur und ist
stoffwechselintensiv, ihr Gewicht steht mit der Energieproduktion des
Körpers in linearem Zusammenhang; Aufgabe des Fettgewebes ist hingegen
die Speicherung von Energie über längere Zeit (nicht deren akute
Freisetzung).
 Tageszyklische Schwankungen - nach Nahrungsaufnahme ist der Grundumsatz erhöht (spezifisch-dynamische Wirkung)
Tageszyklische Schwankungen - nach Nahrungsaufnahme ist der Grundumsatz erhöht (spezifisch-dynamische Wirkung)  Fieber, posttraumatische Stoffwechsellagen
Fieber, posttraumatische Stoffwechsellagen
 Einige Hormone (Thyroxin, Progesteron, Adrenalin, Wachstumshormone, Cortisol) erhöhen den Grundumsatz.
Einige Hormone (Thyroxin, Progesteron, Adrenalin, Wachstumshormone, Cortisol) erhöhen den Grundumsatz.  Als Ruheumsatz (Resting metabilic rate RMR) wird der Energieumsatz bezeichnet, bei dem keine Muskelarbeit geleistet
wird. Wie beim Grundumsatz sollte
die Person nüchtern sein (letzte Nahrungsaufnahme 8 Stunden vor der
Messung), um eine spezifisch-dynamische Wirkung auszuschließen. Im Gegensatz zum Grundumsatz ist keine psychische Entspanntheit gefordert; der Ruheumsatz dies dient als Vergleichsmaß
für Arbeitsumsatzmessungen, sein Betrag liegt um 5-10% über dem des
Grundumsatzes. Der
Ruheumsatz macht meist 50-75% des täglichen Energieumsatzes aus.
Als Ruheumsatz (Resting metabilic rate RMR) wird der Energieumsatz bezeichnet, bei dem keine Muskelarbeit geleistet
wird. Wie beim Grundumsatz sollte
die Person nüchtern sein (letzte Nahrungsaufnahme 8 Stunden vor der
Messung), um eine spezifisch-dynamische Wirkung auszuschließen. Im Gegensatz zum Grundumsatz ist keine psychische Entspanntheit gefordert; der Ruheumsatz dies dient als Vergleichsmaß
für Arbeitsumsatzmessungen, sein Betrag liegt um 5-10% über dem des
Grundumsatzes. Der
Ruheumsatz macht meist 50-75% des täglichen Energieumsatzes aus. Als Arbeits- bzw. Leistungsumsatz (Aktivitätsbedingter Erergieverbrauch, Physical activity energy expenditure) bezeichnet man den Energieumsatz einer Person, die eine entsprechende Muskelarbeit vollbringt. Bei maximaler Belastung nimmt der Energieumsatz (je nach
Trainingszustand) um das 10- bis 20-fache zu. Der
Sauerstoffverbrauch steigt proportional dazu an, da die Energie zum Großteil aerob gewonnen wird.
Als Arbeits- bzw. Leistungsumsatz (Aktivitätsbedingter Erergieverbrauch, Physical activity energy expenditure) bezeichnet man den Energieumsatz einer Person, die eine entsprechende Muskelarbeit vollbringt. Bei maximaler Belastung nimmt der Energieumsatz (je nach
Trainingszustand) um das 10- bis 20-fache zu. Der
Sauerstoffverbrauch steigt proportional dazu an, da die Energie zum Großteil aerob gewonnen wird. Abbildung):
Abbildung): 
 Abbildung: Stoffwechselwege
Abbildung: Stoffwechselwege
 Energiespeicherung und thermische Isolierung (Triglyzeride in Fettgewebe)
Energiespeicherung und thermische Isolierung (Triglyzeride in Fettgewebe) Strukturträger (in Zellmembranen, als mechanischer Schutz von Organen)
Strukturträger (in Zellmembranen, als mechanischer Schutz von Organen) Signalmoleküle (Immunsystem, Zellwachstum etc)
Signalmoleküle (Immunsystem, Zellwachstum etc) Thermogenese (braunes Fettgewebe)
Thermogenese (braunes Fettgewebe) Verdauung (Lipidanteil von Gallensäuren)
Verdauung (Lipidanteil von Gallensäuren) Lipide aus der Nahrung werden gespalten und die Bruchstücke dem Speicherpool
zugeführt. Der Pool freier (=nicht glycerinester-gebundener) Fettsäuren (non-esterified fatty acids, NEFA) erhält solche Bruchstücke aus der Nahrung sowie als "Überschussmoleküle" aus dem
allgemeinen Stoffwechsel.
Lipide aus der Nahrung werden gespalten und die Bruchstücke dem Speicherpool
zugeführt. Der Pool freier (=nicht glycerinester-gebundener) Fettsäuren (non-esterified fatty acids, NEFA) erhält solche Bruchstücke aus der Nahrung sowie als "Überschussmoleküle" aus dem
allgemeinen Stoffwechsel.  Lipogenese (de-novo-Biosynthese) versorgt den Körperfettspeicher aus dem Pool freier Fettsäuren sowie aus dem Pool überschüssiger Glucose (das geht nur in dieser Richtung, nicht zu Glucose zurück). Die wichtigsten Orte der Fettsäuresynthese sind Leber, Fettgewebe, Muskelfett und bei Frauen die Brustdrüse.
Lipogenese (de-novo-Biosynthese) versorgt den Körperfettspeicher aus dem Pool freier Fettsäuren sowie aus dem Pool überschüssiger Glucose (das geht nur in dieser Richtung, nicht zu Glucose zurück). Die wichtigsten Orte der Fettsäuresynthese sind Leber, Fettgewebe, Muskelfett und bei Frauen die Brustdrüse.  Lipolyse
leitet
freie Fettsäuren aus der Spaltung von Körperfett in den
Fettsäurepool. Fettsäuren werden dann über ß-Oxidation zu Acetat und
dieses über den Citratzyklus für die Energiegewinnung verbraucht (
Lipolyse
leitet
freie Fettsäuren aus der Spaltung von Körperfett in den
Fettsäurepool. Fettsäuren werden dann über ß-Oxidation zu Acetat und
dieses über den Citratzyklus für die Energiegewinnung verbraucht ( Abbildung). Die Lipolyse wird u.a. ß-adrenerg und durch
Wachstumshormon angeregt (dann steigt der Spiegel freier Fettsäuren im
Kreislauf), α2-adrenerg gehemmt.
Abbildung). Die Lipolyse wird u.a. ß-adrenerg und durch
Wachstumshormon angeregt (dann steigt der Spiegel freier Fettsäuren im
Kreislauf), α2-adrenerg gehemmt.
 Abbildung: Lipolyse
Abbildung: Lipolyse

 ), andererseits fallweise aus körpereigenen Glykogenreserven (Glykogenolyse) und auch aus glucoplastischen
Aminosäuren (postresorptiv, Hungerstoffwechsel). Bei hoher Glucoseverfügbarkeit bildet der Körper Glykogenreserven (Glykogensynthese), bei Bedarf baut er diese wieder ab (Glykogenolyse).
), andererseits fallweise aus körpereigenen Glykogenreserven (Glykogenolyse) und auch aus glucoplastischen
Aminosäuren (postresorptiv, Hungerstoffwechsel). Bei hoher Glucoseverfügbarkeit bildet der Körper Glykogenreserven (Glykogensynthese), bei Bedarf baut er diese wieder ab (Glykogenolyse). 
 Abbildung: Glucosemetabolismus im Nüchternzustand (postdigestiv)
Abbildung: Glucosemetabolismus im Nüchternzustand (postdigestiv) Glucose ist das führende Substrat für die Energieproduktion der Zelle,
denn die aerobe Glykolyse (Citratzyklus) ist der effizienteste Weg, ATP
zu produzieren. Außerdem ist Glucose normalerweise das einzige Substrat
für die ATP-Synthese in Nervenzellen. Für kurze Zeit (wenige Stunden)
kann Glucose bei Bedarf aus Glykogen gewonnen werden (Glykogenolyse
in Leber- und Muskelzellen), über längere Zeitspannen reicht dieser
Vorrat nicht aus, und Glucose muss aus Lipiden (bzw. deren Glyzerin)
und Protein (bzw. deren Aminosäuren) gewonnen werden (Gluconeogenese).
Glucose ist das führende Substrat für die Energieproduktion der Zelle,
denn die aerobe Glykolyse (Citratzyklus) ist der effizienteste Weg, ATP
zu produzieren. Außerdem ist Glucose normalerweise das einzige Substrat
für die ATP-Synthese in Nervenzellen. Für kurze Zeit (wenige Stunden)
kann Glucose bei Bedarf aus Glykogen gewonnen werden (Glykogenolyse
in Leber- und Muskelzellen), über längere Zeitspannen reicht dieser
Vorrat nicht aus, und Glucose muss aus Lipiden (bzw. deren Glyzerin)
und Protein (bzw. deren Aminosäuren) gewonnen werden (Gluconeogenese). Als Gluconeogenese bezeichnet man die Bildung von Glucose aus Glyzerin (aus Fetten), aus Aminosäuren (aus Peptiden / Proteinen) oder aus Lactat (nonglucose precursors). Nur Leber- und Nierenzellen verfügen über ausreichende Mengen an Glucose-6-Phosphatase,
um aus dem dabei auftretenden Metaboliten Glucose-6-Phosphat
wesentliche Mengen Phosphat zu entfernen und Glucose freizusetzen.
Als Gluconeogenese bezeichnet man die Bildung von Glucose aus Glyzerin (aus Fetten), aus Aminosäuren (aus Peptiden / Proteinen) oder aus Lactat (nonglucose precursors). Nur Leber- und Nierenzellen verfügen über ausreichende Mengen an Glucose-6-Phosphatase,
um aus dem dabei auftretenden Metaboliten Glucose-6-Phosphat
wesentliche Mengen Phosphat zu entfernen und Glucose freizusetzen. Abbildung), zu 10% in Dünndarm und Nieren. Hauptabnehmer sind Gehirn (Verbrauch 5-6 g/h), arbeitende Muskulatur, Erythrozyten (denen die Fähigkeit zur aeroben Glykolyse fehlt) und Nieren.
Abbildung), zu 10% in Dünndarm und Nieren. Hauptabnehmer sind Gehirn (Verbrauch 5-6 g/h), arbeitende Muskulatur, Erythrozyten (denen die Fähigkeit zur aeroben Glykolyse fehlt) und Nieren.  Als aerob bezeichnet man zelluläre Energiegewinnung unter Nutzung von Sauerstoff und damit der oxidativen Phosphorylierung, als anaerob zelluläre Energiegewinnung durch anoxidativen Stoffwechsel (anaerobe Glykolyse).
Als aerob bezeichnet man zelluläre Energiegewinnung unter Nutzung von Sauerstoff und damit der oxidativen Phosphorylierung, als anaerob zelluläre Energiegewinnung durch anoxidativen Stoffwechsel (anaerobe Glykolyse). Obligat glucoseabhängig sind das Gehirn (kein Zugang für Fettsäuren über die Blut-Hirn-Schranke), das Nierenmark, Erythrozyten (keine Mitochondrien!) und Fibroblasten.
Obligat glucoseabhängig sind das Gehirn (kein Zugang für Fettsäuren über die Blut-Hirn-Schranke), das Nierenmark, Erythrozyten (keine Mitochondrien!) und Fibroblasten. Gluconeogenese wird angeregt durch Glucagon, Cortisol, Thyroxin; Citrat, Acetyl-Coenzym A
Gluconeogenese wird angeregt durch Glucagon, Cortisol, Thyroxin; Citrat, Acetyl-Coenzym A Gluconeogenese wird inhibiert durch ADP, AMP, Fructose 2,6-Biphosphat
Gluconeogenese wird inhibiert durch ADP, AMP, Fructose 2,6-Biphosphat
 Sie verleihen Strukturen Festigkeit (Knochen, Bindegewebe, Muskeln, Nägel, Haare etc)
Sie verleihen Strukturen Festigkeit (Knochen, Bindegewebe, Muskeln, Nägel, Haare etc) Als Enzyme regulieren sie praktisch jeden Schritt des Stoffwechsels (einschließlich ihre eigene Synthese)
Als Enzyme regulieren sie praktisch jeden Schritt des Stoffwechsels (einschließlich ihre eigene Synthese) Proteine
können andere Moleküle transportieren (einschließlich Atemgase, Lipide,
Spurenelemente, Hormone; spezielle Proteinkomplexe befördern Stoffe
durch Zellmembranen)
Proteine
können andere Moleküle transportieren (einschließlich Atemgase, Lipide,
Spurenelemente, Hormone; spezielle Proteinkomplexe befördern Stoffe
durch Zellmembranen) Sie beteiligen sich an der Speicherung anderer Stoffe (z.B. Eisen via Ferritin)
Sie beteiligen sich an der Speicherung anderer Stoffe (z.B. Eisen via Ferritin) Sie haben Schutzfunktion (z.B. Antikörper, Komplementfaktoren)
Sie haben Schutzfunktion (z.B. Antikörper, Komplementfaktoren) Proteine dienen auch als Informationsträger (Hormone, Transmitter, Mediatoren).
Proteine dienen auch als Informationsträger (Hormone, Transmitter, Mediatoren).
 Abbildung: Aminosäuren
Abbildung: Aminosäuren
 Als Aminosäurepool bezeichnet
man die Gesamtheit der frei verfügbaren Aminosäuren, die in
verschiedenen Kompartimenten des Körpers verteilt sind. Er unterliegt
einem dynamischen Gleichgewicht, d.h. der konstanten Neusynthese und
ständigem Abbau. Primär wird er (außer im Hungerzustand oder bei
Fehlernährung) durch Nachschub aus dem Darm aufgefüllt; in der Niere
filtrierte Aminosäuren werden in den Kreislauf rückresorbiert.
Nicht-essentielle Aminosäuren können metabolisch neu synthetosoert
werden, essentielle müssen mit der Nahrung zugeführt werden. Ist der
Aminosäurepool "überfüllt", werden einige zu Pyruvat und weiter über
den Citratzyklus abgebaut. Dabei fällt Stickstoff an, dieser wird
(hauptsächlich über Harnstoff) renal ausgeschieden.
Als Aminosäurepool bezeichnet
man die Gesamtheit der frei verfügbaren Aminosäuren, die in
verschiedenen Kompartimenten des Körpers verteilt sind. Er unterliegt
einem dynamischen Gleichgewicht, d.h. der konstanten Neusynthese und
ständigem Abbau. Primär wird er (außer im Hungerzustand oder bei
Fehlernährung) durch Nachschub aus dem Darm aufgefüllt; in der Niere
filtrierte Aminosäuren werden in den Kreislauf rückresorbiert.
Nicht-essentielle Aminosäuren können metabolisch neu synthetosoert
werden, essentielle müssen mit der Nahrung zugeführt werden. Ist der
Aminosäurepool "überfüllt", werden einige zu Pyruvat und weiter über
den Citratzyklus abgebaut. Dabei fällt Stickstoff an, dieser wird
(hauptsächlich über Harnstoff) renal ausgeschieden. Abbau zu kleineren Bruchstückmolekülen
Abbau zu kleineren Bruchstückmolekülen Umwandlung in Acetyl-Coenzym A (AcCoA) als gemeinsames "Brennstoffmolekül"
Umwandlung in Acetyl-Coenzym A (AcCoA) als gemeinsames "Brennstoffmolekül" Vollständige Oxidation des AcCoA zu CO2 und H2O im Citratzyklus, Gewinnung von ATP
Vollständige Oxidation des AcCoA zu CO2 und H2O im Citratzyklus, Gewinnung von ATP

 ) - zu gewinnen.
) - zu gewinnen.  Als freie Energie (Gibbs-Energie G)
bezeichnet man denjenigen Anteil der Energie eines Systems, der zur
Erbringung einer Arbeit genutzt werden kann. ΔG
- die Veränderung an freier Energie - ist die Differenz zwischen G
des/der Produkts/Produkte und des/der Substrats/Substrate einer
Reaktion. Die Geschwindigkeit der Reaktion hängt nicht von ΔG, sondern vom (die Reaktion katalysierenden) Enzym ab.
Als freie Energie (Gibbs-Energie G)
bezeichnet man denjenigen Anteil der Energie eines Systems, der zur
Erbringung einer Arbeit genutzt werden kann. ΔG
- die Veränderung an freier Energie - ist die Differenz zwischen G
des/der Produkts/Produkte und des/der Substrats/Substrate einer
Reaktion. Die Geschwindigkeit der Reaktion hängt nicht von ΔG, sondern vom (die Reaktion katalysierenden) Enzym ab. vgl. dort
vgl. dort Redox-Reaktionen
sind die wichtigste Klasse biochemischer Reaktionen (Bio-Oxidationen
verschaffen das größte Ausmaß an Energie für den aeroben Stoffwechsel).
Die Energie wird frei, wenn Elektronen von Substratmolekülen über die
mitochondrielle Elektronentransportkette (entlang eines Redox-Potentials) auf Sauerstoff übertragen wird. Die freigesetzte Energie wird anschließend verwendet, um H+
über die innere Mitochondrienmembran zu befördern. Der entstehende
Protonengradient treibt die Phosphorylierung von ADP zu ATP an.
Redox-Reaktionen
sind die wichtigste Klasse biochemischer Reaktionen (Bio-Oxidationen
verschaffen das größte Ausmaß an Energie für den aeroben Stoffwechsel).
Die Energie wird frei, wenn Elektronen von Substratmolekülen über die
mitochondrielle Elektronentransportkette (entlang eines Redox-Potentials) auf Sauerstoff übertragen wird. Die freigesetzte Energie wird anschließend verwendet, um H+
über die innere Mitochondrienmembran zu befördern. Der entstehende
Protonengradient treibt die Phosphorylierung von ADP zu ATP an. Energiereiche Substrate haben verfügbare Elektronen -
in Assoziation mit C-H-Bindungen, die man als reduzierten
(elektronenreichen) Kohlenstoff sehen kann. Im Energiestoffwechsel können sie Elektronenakzeptoren reduzieren (auf
den sie ihre Elektronen übertragen und dabei selbst oxidiert werden).
Energiereiche Substrate haben verfügbare Elektronen -
in Assoziation mit C-H-Bindungen, die man als reduzierten
(elektronenreichen) Kohlenstoff sehen kann. Im Energiestoffwechsel können sie Elektronenakzeptoren reduzieren (auf
den sie ihre Elektronen übertragen und dabei selbst oxidiert werden).
 Zellen bilden gerade so viel ATP, wie im Stoffwechsel
verbraucht wird; ATP-Speicher werden nicht angelegt (nur Creatinphosphat im Muskel). Deshalb
kann Sauerstoffmangel auch sehr rasch zu Energieengpässen führen - und
es werden alternative Wege zur Energiegewinnung beschritten (anaerob ..
weniger effizient).
Zellen bilden gerade so viel ATP, wie im Stoffwechsel
verbraucht wird; ATP-Speicher werden nicht angelegt (nur Creatinphosphat im Muskel). Deshalb
kann Sauerstoffmangel auch sehr rasch zu Energieengpässen führen - und
es werden alternative Wege zur Energiegewinnung beschritten (anaerob ..
weniger effizient). Glucose ist ein Molekül, aus dem rasch Energie für den Stoffwechsel gewonnen werden kann. Um
an diese Energie heranzukommen, muss die Zelle Glucose erst unter
ATP-Aufwand zu Fructosebiphosphat umwandeln. Diese kann in zwei
C3-Körper gespalten und diese in fünf weiteren Schritten zu Pyruvat
abgebaut werden.
Dabei wird mehr ATP gewonnen als zunächst investiert wurde. Dieser
phylogenetisch sehr alte, von Sauerstoff unabhängige Stoffwechselweg
wird als Glykolyse bezeichnet:
Glucose ist ein Molekül, aus dem rasch Energie für den Stoffwechsel gewonnen werden kann. Um
an diese Energie heranzukommen, muss die Zelle Glucose erst unter
ATP-Aufwand zu Fructosebiphosphat umwandeln. Diese kann in zwei
C3-Körper gespalten und diese in fünf weiteren Schritten zu Pyruvat
abgebaut werden.
Dabei wird mehr ATP gewonnen als zunächst investiert wurde. Dieser
phylogenetisch sehr alte, von Sauerstoff unabhängige Stoffwechselweg
wird als Glykolyse bezeichnet: Glykolyse ist
der Abbau von Glucose zu Pyruvat (unter aeroben Bedingungen) bzw.
Lactat (unter anaeroben Bedingungen). Sie findet im Zytoplasma statt.
Dabei werden pro mol Glucose 2 mol ATP investiert und 4 mol ATP
gewonnen, die Netto-Ausbeute beträgt daher 2 mol ATP (plus 2 mol NADH)
pro mol abgebauter Glucose.
Glykolyse ist
der Abbau von Glucose zu Pyruvat (unter aeroben Bedingungen) bzw.
Lactat (unter anaeroben Bedingungen). Sie findet im Zytoplasma statt.
Dabei werden pro mol Glucose 2 mol ATP investiert und 4 mol ATP
gewonnen, die Netto-Ausbeute beträgt daher 2 mol ATP (plus 2 mol NADH)
pro mol abgebauter Glucose. 
 Abbildung: Energiegewinnung durch Glucoseabbau
Abbildung: Energiegewinnung durch Glucoseabbau
 1. ATP-Investitionsphase (investment phase): Sie "fängt" Glucose im Inneren der Zelle ein, da
diese in
phosphorylierter Form nicht mehr durch die Zellmembran entweichen kann,
und besteht aus drei (weitgehend irreversiblen) glykolytischen
Schritten:
1. ATP-Investitionsphase (investment phase): Sie "fängt" Glucose im Inneren der Zelle ein, da
diese in
phosphorylierter Form nicht mehr durch die Zellmembran entweichen kann,
und besteht aus drei (weitgehend irreversiblen) glykolytischen
Schritten:  Phosphorylierung von Glucose zu Glucose-6-Phosphat durch Hexokinase
(alle Zelltypen) oder ihr Isoenzym Glucokinase (Hepatozyten, Enterozyten, pankreatische ß-Zellen). Dadurch bleibt die zytoplasmatische
Glucosekonzentration niedrig (Erhaltung des extra/intrazellulären
Konzentrationsgradienten). Dieser Schritt wird durch Glucose und Insulin angeregt und ist ATP-abhängig.
Phosphorylierung von Glucose zu Glucose-6-Phosphat durch Hexokinase
(alle Zelltypen) oder ihr Isoenzym Glucokinase (Hepatozyten, Enterozyten, pankreatische ß-Zellen). Dadurch bleibt die zytoplasmatische
Glucosekonzentration niedrig (Erhaltung des extra/intrazellulären
Konzentrationsgradienten). Dieser Schritt wird durch Glucose und Insulin angeregt und ist ATP-abhängig.  Umwandlung von Glucose-6-Phosphat in Fructose-6-Phosphat durch Phosphoglucose-Isomerase.
Umwandlung von Glucose-6-Phosphat in Fructose-6-Phosphat durch Phosphoglucose-Isomerase. Phosphorylierung von Fructose-6-Phosphat zu Fructose-1,6-Biphosphat durch Phosphofructokinase 1. Auch dieser Schritt ist ATP-abhängig.
Phosphorylierung von Fructose-6-Phosphat zu Fructose-1,6-Biphosphat durch Phosphofructokinase 1. Auch dieser Schritt ist ATP-abhängig. 2. Aufspaltungsphase (splitting phase): Dieser Teil spaltet einen C6-Körper
(Fructose-1,6-BP) in zwei C3-Körper (Dihydroxyacetonphosphat DHAP,
Glycerinaldehyd-3-phosphat G3P). Diese beiden Isomere können durch ein
spezielles Enzym (Triosephosphat-Isomerase) ineinander übergeführt
werden. G3P wird dann im nachfolgenden Glykolysesystem in Pyruvat /
Lactat verwandelt:
2. Aufspaltungsphase (splitting phase): Dieser Teil spaltet einen C6-Körper
(Fructose-1,6-BP) in zwei C3-Körper (Dihydroxyacetonphosphat DHAP,
Glycerinaldehyd-3-phosphat G3P). Diese beiden Isomere können durch ein
spezielles Enzym (Triosephosphat-Isomerase) ineinander übergeführt
werden. G3P wird dann im nachfolgenden Glykolysesystem in Pyruvat /
Lactat verwandelt: 3. ATP-Rückgewinnungsphase (yield phase, recoup phase): Diese generiert pro mol verbrauchtem C6-Körper 4
mol ATP und 2 mol NADH. Es entstehen mol 2 Pyruvat, die entweder - via
Acetyl-Coenzym A - in den Citratzyklus münden (oxidativer Abbau) oder
via Lactatdehydrogenase
in Lactat umgewandelt (und anderweitig
abgebaut) wird. Dem Verlust von 2 ATP in Phase 1 steht der Gewinn von 4
ATP in Phase 3 gegenüber (Netto-Gewinn 2 mol ATP pro mol abgebauter
Glucose).
3. ATP-Rückgewinnungsphase (yield phase, recoup phase): Diese generiert pro mol verbrauchtem C6-Körper 4
mol ATP und 2 mol NADH. Es entstehen mol 2 Pyruvat, die entweder - via
Acetyl-Coenzym A - in den Citratzyklus münden (oxidativer Abbau) oder
via Lactatdehydrogenase
in Lactat umgewandelt (und anderweitig
abgebaut) wird. Dem Verlust von 2 ATP in Phase 1 steht der Gewinn von 4
ATP in Phase 3 gegenüber (Netto-Gewinn 2 mol ATP pro mol abgebauter
Glucose). Coenzym A (CoA) ist ein komplexes Molekül (es enthält u.a. Pantothensäure
und ATP), das Acylgruppen (R-C=O) überträgt, insbesondere für Nutzung
im Citratzyklus. Als Acetyl-Coenzym A (Ac-CoA) stellt es hier die
"aktivierte" Form von Acetat dar, das mittels einer energiereichen
Bindung an CoA befestigt ist. Quelle des Ac-CoA ist der Abbau von
Kohlenhydraten (via Glykolyse), Fettsäuren (via ß-Oxidation) und
Proteinen (aus ketogenen Aminosäuren - Glycin und Alanin - via Pyruvatdehydrogenase).
Coenzym A (CoA) ist ein komplexes Molekül (es enthält u.a. Pantothensäure
und ATP), das Acylgruppen (R-C=O) überträgt, insbesondere für Nutzung
im Citratzyklus. Als Acetyl-Coenzym A (Ac-CoA) stellt es hier die
"aktivierte" Form von Acetat dar, das mittels einer energiereichen
Bindung an CoA befestigt ist. Quelle des Ac-CoA ist der Abbau von
Kohlenhydraten (via Glykolyse), Fettsäuren (via ß-Oxidation) und
Proteinen (aus ketogenen Aminosäuren - Glycin und Alanin - via Pyruvatdehydrogenase). Abbildung: Energiegewinnung im Stoffwechsel
Abbildung: Energiegewinnung im Stoffwechsel
 Abbildung).
Abbildung).  Transporter - teils membran-assoziierte, teils intrazelluläre (organellen-assoziierte) - sowie
Transporter - teils membran-assoziierte, teils intrazelluläre (organellen-assoziierte) - sowie Enzyme und Cofaktoren, welche den zügigen Ablauf der erforderlichen Interkonversionen innerhalb metabolischer Wege ermöglichen.
Enzyme und Cofaktoren, welche den zügigen Ablauf der erforderlichen Interkonversionen innerhalb metabolischer Wege ermöglichen. Leber (Fett-, Kohlenhydrat-, Proteinstoffwechsel),
Leber (Fett-, Kohlenhydrat-, Proteinstoffwechsel), Skelettmuskel (Energieverbrauch) und
Skelettmuskel (Energieverbrauch) und  Fettgewebe (Energiespeicherung).
Fettgewebe (Energiespeicherung). ,
welche die dazu nötigen Enzme enthalten. Zellen ohne Mitochondrien
(Erythrozyten) sind dazu nicht in der Lage; sie decken ihren
Energiebedarf ohne Sauerstoff (anoxidativ = anaerob
,
welche die dazu nötigen Enzme enthalten. Zellen ohne Mitochondrien
(Erythrozyten) sind dazu nicht in der Lage; sie decken ihren
Energiebedarf ohne Sauerstoff (anoxidativ = anaerob  - scheinbar paradoxerweise, da sie ja Sauerstoff transportieren),
indem sie anaerobe Glykolyse
nutzen.
- scheinbar paradoxerweise, da sie ja Sauerstoff transportieren),
indem sie anaerobe Glykolyse
nutzen. Energiestoffwechsel (
Energiestoffwechsel ( Abbildung): Der wichtigste Weg zur Generierung von ATP ist die oxidative Phosphorylierung.
Diese findet in Mitochondrien statt und fasst verschiedene
Stoffwechselwege zusammen, welche den Abbau von Nährstoffen mit
Redox-Reaktionen verknüpft. Dies mündet in die Übertragung von
Elektronen auf Sauerstoff sowie die Phosphorylierung von ADP
(ATP-Synthese).
Abbildung): Der wichtigste Weg zur Generierung von ATP ist die oxidative Phosphorylierung.
Diese findet in Mitochondrien statt und fasst verschiedene
Stoffwechselwege zusammen, welche den Abbau von Nährstoffen mit
Redox-Reaktionen verknüpft. Dies mündet in die Übertragung von
Elektronen auf Sauerstoff sowie die Phosphorylierung von ADP
(ATP-Synthese). 
 Abbildung: Aerobe Glykolyse und Mitochondrien
Abbildung: Aerobe Glykolyse und Mitochondrien
 Der Citrat-Zyklus (Krebs-Zyklus) findet in der Mitochondrienmatrix statt
Der Citrat-Zyklus (Krebs-Zyklus) findet in der Mitochondrienmatrix statt Beta-Oxidation von Fettsäuren. Dabei werden Fettsäuren zu
Acetyl-Coenzym A abgebaut. Dies erfolgt in der Mitochondrienmatrix
Beta-Oxidation von Fettsäuren. Dabei werden Fettsäuren zu
Acetyl-Coenzym A abgebaut. Dies erfolgt in der Mitochondrienmatrix Beteiligung an der Gluconeogenese - dem Aufbau von Glucose aus
Substraten, die keine Kohlenhydrate sind. Ein Teil der dafür
notwendigen Enzyme befindet sich in der Mitochondrienmatrix, ein
anderer Teil im Zytoplasma
Beteiligung an der Gluconeogenese - dem Aufbau von Glucose aus
Substraten, die keine Kohlenhydrate sind. Ein Teil der dafür
notwendigen Enzyme befindet sich in der Mitochondrienmatrix, ein
anderer Teil im Zytoplasma Signaltransduktion, Speicherung von
Ca++ und Beeinflussung des Membranpotentials der Zelle: Mitochondrien sind in der Lage, Ca++ rasch zwischenzuspeichern
- ein Wechselspiel mit dem endoplasmatischen Retikulum: Mittels eines
Uniporters an der inneren Mitochondrienmembran nimmt die Matrix Ca++ auf und kann sie dann über einen Na+-Ca++-Austauscher
wieder abgeben. Entsprechend reagiert das Membranpotential, was
second-messenger-Proteine aktiviert und zu Freisetzung von Hormonen
oder Neurotransmittern führen kann
Signaltransduktion, Speicherung von
Ca++ und Beeinflussung des Membranpotentials der Zelle: Mitochondrien sind in der Lage, Ca++ rasch zwischenzuspeichern
- ein Wechselspiel mit dem endoplasmatischen Retikulum: Mittels eines
Uniporters an der inneren Mitochondrienmembran nimmt die Matrix Ca++ auf und kann sie dann über einen Na+-Ca++-Austauscher
wieder abgeben. Entsprechend reagiert das Membranpotential, was
second-messenger-Proteine aktiviert und zu Freisetzung von Hormonen
oder Neurotransmittern führen kann  Informationsverarbeitung
(mitochondriale
DNA: 13 Gene für Teile der Atmungskomplexe I, III, IV und V, 22 für mitochondriale tRNA, 2 für rRNA. Jedes
Mitochondrium kann 2 bis 10 Kopien ihrer DNA enthalten
Informationsverarbeitung
(mitochondriale
DNA: 13 Gene für Teile der Atmungskomplexe I, III, IV und V, 22 für mitochondriale tRNA, 2 für rRNA. Jedes
Mitochondrium kann 2 bis 10 Kopien ihrer DNA enthalten Beteiligung an
der Steroidsynthese (Mitochondrien in steroidproduzierenden Zellen haben röhrenförmige innere Membranen)
Beteiligung an
der Steroidsynthese (Mitochondrien in steroidproduzierenden Zellen haben röhrenförmige innere Membranen) Hämsynthese (Protoporphyrinogen → Protoporphyrin → Häm; dieses wird aus dem Mitochondrion ins Zytoplasma exportiert)
Hämsynthese (Protoporphyrinogen → Protoporphyrin → Häm; dieses wird aus dem Mitochondrion ins Zytoplasma exportiert) Energieversorgung für Zellteilung und -differenzierung
Energieversorgung für Zellteilung und -differenzierung  Werden Mitochondrien beschädigt, geben sie via äußere Mitochondrienmembran den Elektronentransporter Cytochrom c in das Zytoplasma frei und lösen so Apoptose aus.
Werden Mitochondrien beschädigt, geben sie via äußere Mitochondrienmembran den Elektronentransporter Cytochrom c in das Zytoplasma frei und lösen so Apoptose aus.
 generiert Wasserstoffatome, die über reduzierte Coenzyme (NADH, FADH2)
zur Elektronen-Transportkette der Mitochondrien transportiert werden -
der Transfer von Wasserstoff erfolgt über Dehydrogenasen (Enzyme #3, 4,
6, 8 in der folgenden
generiert Wasserstoffatome, die über reduzierte Coenzyme (NADH, FADH2)
zur Elektronen-Transportkette der Mitochondrien transportiert werden -
der Transfer von Wasserstoff erfolgt über Dehydrogenasen (Enzyme #3, 4,
6, 8 in der folgenden  Abbildung), und
Abbildung), und oxidiert Wasserstoff in der Atmungskette über das Elektronentransportsystem der
Zytochrome. Pro Durchgang entstehen folgende Moleküle: 3 NADH, 1 FADH2, 1 GTP (kann seine Energie auf ATP übertragen), weiters CO2 und H2O.
oxidiert Wasserstoff in der Atmungskette über das Elektronentransportsystem der
Zytochrome. Pro Durchgang entstehen folgende Moleküle: 3 NADH, 1 FADH2, 1 GTP (kann seine Energie auf ATP übertragen), weiters CO2 und H2O.  ADP~P (=ATP)
ADP~P (=ATP) Abbildung: Citratzyklus
Abbildung: Citratzyklus
 Im Citratzyklus entsteht CO2 (Isocitrat → Ketoglutarat, Ketoglutarat → Succinat).
Im Citratzyklus entsteht CO2 (Isocitrat → Ketoglutarat, Ketoglutarat → Succinat).  Mit zunehmendem (oxidativem) Energieumsatz steigt auch die Mitochondriendichte der Zelle - diese kann die metabolische
Mit zunehmendem (oxidativem) Energieumsatz steigt auch die Mitochondriendichte der Zelle - diese kann die metabolische  Ausdauer z.B. einer Muskelzelle bestimmen. Mitochondrien können nicht nur neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
sie können auch verschmelzen oder sich aufspalten (
Ausdauer z.B. einer Muskelzelle bestimmen. Mitochondrien können nicht nur neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
sie können auch verschmelzen oder sich aufspalten ( Abbildung),
wodurch sich ihre Zahl bzw. ihr Volumen je nach metabolischen
Anforderungen in der Zelle dynamisch anpassen kann.
Abbildung),
wodurch sich ihre Zahl bzw. ihr Volumen je nach metabolischen
Anforderungen in der Zelle dynamisch anpassen kann.
 Abbildung: Dynamik der Mitochondrienzahl und -größe
Abbildung: Dynamik der Mitochondrienzahl und -größe
 Citrat postprandial (über Acetyl-CoA) zur Lipidsynthese herangezogen werden,
Citrat postprandial (über Acetyl-CoA) zur Lipidsynthese herangezogen werden,  Oxalacetat im Nüchternzustand (über Phosphoenolpyruvat) zur Glucosesynthese (Gluconeogenese);
Oxalacetat im Nüchternzustand (über Phosphoenolpyruvat) zur Glucosesynthese (Gluconeogenese); Oxalacetat und α-Ketoglutarat zur Aminosäuresynthese (Bildung von Aspartat bzw. Glutamat).
Oxalacetat und α-Ketoglutarat zur Aminosäuresynthese (Bildung von Aspartat bzw. Glutamat). Ribulose 5-Phosphat liefert den Kohlenhydratbaustein für die Synthese von Nukleotiden.
Ribulose 5-Phosphat liefert den Kohlenhydratbaustein für die Synthese von Nukleotiden. NADPH ist unverzichtbar für sie Synthese u.a. von Fettsäuren und Steroiden. Es verleiht Zellen auch antioxidativen Schutz gegen Oxidantien / bei Infektionen.
NADPH ist unverzichtbar für sie Synthese u.a. von Fettsäuren und Steroiden. Es verleiht Zellen auch antioxidativen Schutz gegen Oxidantien / bei Infektionen.
 Abbildung: Energiebilanz
Abbildung: Energiebilanz
 Unter Ruhebedingungen verbrauchen Organe / Gewebe etwa folgenden prozentuellen Anteil am gesamten Energieumsatz des Körpers:
Unter Ruhebedingungen verbrauchen Organe / Gewebe etwa folgenden prozentuellen Anteil am gesamten Energieumsatz des Körpers: Gehirn ≥20% (
Gehirn ≥20% ( <
< ) - Absolutwert physiologischerweise ziemlich konstant
) - Absolutwert physiologischerweise ziemlich konstant Muskeln ≥20% (
Muskeln ≥20% ( >
> ) - Absolutwert steigend mit der körperlichen Belastung (bis ~10fach)
) - Absolutwert steigend mit der körperlichen Belastung (bis ~10fach) Immunsystem ~10% - Absolutwert bei Infektionen stark steigend
Immunsystem ~10% - Absolutwert bei Infektionen stark steigend Leber ~20%
Leber ~20%  Nieren ~10%
Nieren ~10%  Myokard ~10% - Absolutwert steigt mit körperlicher Belastung
Myokard ~10% - Absolutwert steigt mit körperlicher Belastung 
 s. dort), ein herausgefordertes Immunsystem verbraucht ebenfalls zunehmend mehr Energie.
s. dort), ein herausgefordertes Immunsystem verbraucht ebenfalls zunehmend mehr Energie. Sollen z.B. 90 g Fett kaloriengleich durch Proteine ersetzt werden, braucht man dazu 200 g Eiweiß.
Sollen z.B. 90 g Fett kaloriengleich durch Proteine ersetzt werden, braucht man dazu 200 g Eiweiß. Die Aufnahme
von Aminosäuren, Kohlenhydraten, Fetten, Sauerstoff, Elektrolyten, Wasser sowie die Ausscheidung von CO2, Harnstoff und anderen Endprodukten ist
Voraussetzung für das Funktionieren des Stoffwechsels.
Die Aufnahme
von Aminosäuren, Kohlenhydraten, Fetten, Sauerstoff, Elektrolyten, Wasser sowie die Ausscheidung von CO2, Harnstoff und anderen Endprodukten ist
Voraussetzung für das Funktionieren des Stoffwechsels. 
 Abbildung: Energiespeicher einer gut ernährten erwachsenen Person (typisches Beispiel)
Abbildung: Energiespeicher einer gut ernährten erwachsenen Person (typisches Beispiel)
 Mäßige Muskelarbeit
wird energetisch etwa zu 3/4 aus dem Abbau von Fetten betrieben (1/4
aus Kohlenhydraten). Dementsprechend ist die Ausdauer bei dieser
Belastungsform sehr hoch: Bei einer Körperreserve von z.B. 15 kg
Fettgewebe errechnet sich für vollständige Utilisation (theoretisch)
ein Energieangebot von über 140.000 Kalorien, das wäre der Bedarf für
mindestens zwei Monate (erwachsene Person, mäßige Muskelaktivität).
Mäßige Muskelarbeit
wird energetisch etwa zu 3/4 aus dem Abbau von Fetten betrieben (1/4
aus Kohlenhydraten). Dementsprechend ist die Ausdauer bei dieser
Belastungsform sehr hoch: Bei einer Körperreserve von z.B. 15 kg
Fettgewebe errechnet sich für vollständige Utilisation (theoretisch)
ein Energieangebot von über 140.000 Kalorien, das wäre der Bedarf für
mindestens zwei Monate (erwachsene Person, mäßige Muskelaktivität).  Über den Kohlenhydrat-, Fett- und Eiweißbedarf s. dort
Über den Kohlenhydrat-, Fett- und Eiweißbedarf s. dort Über den Bedarf an Mineralien, Vitaminen und Spurenelementen s. dort
Über den Bedarf an Mineralien, Vitaminen und Spurenelementen s. dort
 Energiespeicher: Die
folgenden Organe / Gewebe speichern Energie, die im Bedarfsfall für den
Organismus bereitgestellt werden kann:
Energiespeicher: Die
folgenden Organe / Gewebe speichern Energie, die im Bedarfsfall für den
Organismus bereitgestellt werden kann:  die Leber
vor allem in Form von Glykogen (nach Glykogenolyse wird Glucose an das
Blut abgegeben, der Bedarf der Peripherie - vor allem des Gehirns -
kann so im Nüchternzustand für mehrere Stunden gedeckt werden)
die Leber
vor allem in Form von Glykogen (nach Glykogenolyse wird Glucose an das
Blut abgegeben, der Bedarf der Peripherie - vor allem des Gehirns -
kann so im Nüchternzustand für mehrere Stunden gedeckt werden) die Muskulatur
in Form von Glykogen (für den Eigenbedarf) und (im Notfall) Proteinen
(im Hungerzustand werden glukoplastische Aminosäuren von der Leber in Glucose
umgebaut; Überbrückung für 1-2 Tage)
die Muskulatur
in Form von Glykogen (für den Eigenbedarf) und (im Notfall) Proteinen
(im Hungerzustand werden glukoplastische Aminosäuren von der Leber in Glucose
umgebaut; Überbrückung für 1-2 Tage)  das Fettgewebe deckt den Energiebedarf des Körpers bei fehlendem Nahrungsangebot für mehrere Wochen (Neutralfette, aus denen Fettsäuren gewonnen werden können)
das Fettgewebe deckt den Energiebedarf des Körpers bei fehlendem Nahrungsangebot für mehrere Wochen (Neutralfette, aus denen Fettsäuren gewonnen werden können) Der
Körper speichert den größten Anteil von Überschußenergie in Form von
Fett, nicht Glykogen - denn Lipide haben eine wesentlich höhere
nutzbare Energiedichte (~9 Cal/g) als Glykogen (~1
Cal/g). Proteine sind hochwertige Baustoffe des Körpers und sind
normalerweise von einer Nutzung als Energiespeicher weitgehend
ausgenommen. Die in Lipiden gespeicherte Energiemenge beträgt ungefähr
das Hundertfache der in Form von Glykogen gespeicherten (s. Tabelle).
Der
Körper speichert den größten Anteil von Überschußenergie in Form von
Fett, nicht Glykogen - denn Lipide haben eine wesentlich höhere
nutzbare Energiedichte (~9 Cal/g) als Glykogen (~1
Cal/g). Proteine sind hochwertige Baustoffe des Körpers und sind
normalerweise von einer Nutzung als Energiespeicher weitgehend
ausgenommen. Die in Lipiden gespeicherte Energiemenge beträgt ungefähr
das Hundertfache der in Form von Glykogen gespeicherten (s. Tabelle).

 Abbildung: Katabolismus und Anabolismus
Abbildung: Katabolismus und Anabolismus
 Substrate (Ausgangsstoffe für den
Stoffwechsel) - z.B. Zucker,
Aminosäuren, Fettsäuren, Nukleinsäuren
Substrate (Ausgangsstoffe für den
Stoffwechsel) - z.B. Zucker,
Aminosäuren, Fettsäuren, Nukleinsäuren Zwischenprokukte (z.B. Lactat, Ketonkörper)
Zwischenprokukte (z.B. Lactat, Ketonkörper)
 Endprodukte des Stoffwechsels (z.B. CO2, Ammoniumionen, Harnstoff - zur Harnstoffausscheidung
Endprodukte des Stoffwechsels (z.B. CO2, Ammoniumionen, Harnstoff - zur Harnstoffausscheidung  s. dort)
s. dort) Abbildung), die in der Lage
sind, die aktuellen Speicher in der Zelle zu messen und - auch
entsprechend der verfügbaren ATP-Konzentration - aufbauende (anabole)
und abbauende (katabole) Vorgänge in Balance zu halten.
Abbildung), die in der Lage
sind, die aktuellen Speicher in der Zelle zu messen und - auch
entsprechend der verfügbaren ATP-Konzentration - aufbauende (anabole)
und abbauende (katabole) Vorgänge in Balance zu halten.
 Abbildung: Stoffwechselsensoren
Abbildung: Stoffwechselsensoren Insulin, Ghrelin, Adiponektin
Insulin, Ghrelin, Adiponektin
 Der Kinasekomplex mTORC1 ist
zusammengesetzt aus der Kinase mTOR - einem Sensor für Nährstoffverfügbarkeit, Energiegehalt und Redoxstatus der Zelle -
und Begleitfaktoren. Seine Aktivität steht unter dem Einfluss von
Wachstumsfaktoren, Insulin, bestimmten Aminosäuren, mechanischen Stimuli, oxidativem Stress
(
Der Kinasekomplex mTORC1 ist
zusammengesetzt aus der Kinase mTOR - einem Sensor für Nährstoffverfügbarkeit, Energiegehalt und Redoxstatus der Zelle -
und Begleitfaktoren. Seine Aktivität steht unter dem Einfluss von
Wachstumsfaktoren, Insulin, bestimmten Aminosäuren, mechanischen Stimuli, oxidativem Stress
( Abbildung). TORC regt die Organisation von Ribonukleinsäuren und die Eiweißsynthese an.
Abbildung). TORC regt die Organisation von Ribonukleinsäuren und die Eiweißsynthese an. Die Aktivität des Enzyms AMPK
tritt in den Vordergrund, wenn die Energiereserven der Zelle niedrig
sind. Es unterstützt die Aufnahme von Energieträgern in Zellen, die es
exprimieren, vor allem in Gehirn, Leber, Muskel- und Fettgewebe. Dabei
erhöht es die Bildung mitochondrialer Enzyme wie Cytochrom c. AMPK
vermittelt u.a. Ketogenese (Leber) und Fettsäureoxidation (Leber,
Muskel), Glucoseaufnahme (Muskel), Triglyceridsynthese und Hemmung der
Lipolyse (Fettgewebe). Angeregt wird seine Aktivität durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, und Signalstoffe wie
Ghrelin und Adiponektin (
Die Aktivität des Enzyms AMPK
tritt in den Vordergrund, wenn die Energiereserven der Zelle niedrig
sind. Es unterstützt die Aufnahme von Energieträgern in Zellen, die es
exprimieren, vor allem in Gehirn, Leber, Muskel- und Fettgewebe. Dabei
erhöht es die Bildung mitochondrialer Enzyme wie Cytochrom c. AMPK
vermittelt u.a. Ketogenese (Leber) und Fettsäureoxidation (Leber,
Muskel), Glucoseaufnahme (Muskel), Triglyceridsynthese und Hemmung der
Lipolyse (Fettgewebe). Angeregt wird seine Aktivität durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, und Signalstoffe wie
Ghrelin und Adiponektin ( Abbildung); Leptin und Insulin wirken
inhibierend.
Abbildung); Leptin und Insulin wirken
inhibierend.
 Abbildung: Zu- und Abfluss von Glucose in das / aus dem Blut
Abbildung: Zu- und Abfluss von Glucose in das / aus dem Blut

 Abbildung).
Abbildung).
 Abbildung: Lactatkinetik und -wirkungen
Abbildung: Lactatkinetik und -wirkungen GLUT, Glucosetransporter
GLUT, Glucosetransporter  MCT,
Monocarboxylat-Transporter (12 Transmembrandomänen, befördert u.a. Lactat, Pyruvat und Ketonkörper durch die Zellmembran)
MCT,
Monocarboxylat-Transporter (12 Transmembrandomänen, befördert u.a. Lactat, Pyruvat und Ketonkörper durch die Zellmembran)  PKA, Proteinkinase A
PKA, Proteinkinase A


 Fast zur Gänze entfernt die Leber das Lactat über den Cori-Zyklus (Gluconeogenese) bzw. über oxidative Phorphorylierung (ATP-Synthese, Krebs-Zyklus) - bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen.
Fast zur Gänze entfernt die Leber das Lactat über den Cori-Zyklus (Gluconeogenese) bzw. über oxidative Phorphorylierung (ATP-Synthese, Krebs-Zyklus) - bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen.  Auch das Myokard kann Lactat für seinen Erergiestoffwechsel nutzen - zu 10-15% bei körperlicher Ruhe, bis zu 30% bei Belastung.
Auch das Myokard kann Lactat für seinen Erergiestoffwechsel nutzen - zu 10-15% bei körperlicher Ruhe, bis zu 30% bei Belastung.  Die Niere
utilisiert in der Rindenzone Lactat für ihren Energiestoffwechsel (das
Mark kann Lactat bilden), es wird zu mehr als 50% für die renale
Gluconeogenese verwendet. Der Anteil des renal gebildeten Blutzuckers
an der Einspeisung von Glucose in den Kreislauf kann von ~10% im
normalen Ruhezustand auf ~40% ansteigen (körperliche Belastung,
Hypoglykämie, längeres Fasten, Adrenalinanstieg).
Die Niere
utilisiert in der Rindenzone Lactat für ihren Energiestoffwechsel (das
Mark kann Lactat bilden), es wird zu mehr als 50% für die renale
Gluconeogenese verwendet. Der Anteil des renal gebildeten Blutzuckers
an der Einspeisung von Glucose in den Kreislauf kann von ~10% im
normalen Ruhezustand auf ~40% ansteigen (körperliche Belastung,
Hypoglykämie, längeres Fasten, Adrenalinanstieg). Lactat (Blutserum, körperliche Ruhe / nüchtern):
Lactat (Blutserum, körperliche Ruhe / nüchtern):
 Nährstoffe werden gebraucht für Biosynthese (Wachstum, Regeneration, Immunabwehr, Sekretion, Strukturerhaltung) und Energienutzung (Transport, Bewegung, Verformung, Energiespeicherung). Bindungsenergie für den Aufbau energiereicher Phosphate (ATP, CP) stammt zum Großteil aus oxidativem Abbau
von Kohlenhydraten und Fetten.
Lipolyse liefert freie Fettsäuren aus der Spaltung
von Neutralfett. Insulin, Glukagon, Adrenalin u.a. stabilisieren den Blutzuckerspiegel. Primärer Glucoseverbraucher ist
das Gehirn, obligat glucoseabhängig sind weiters Nebenniere,
Erythrozyten, Fibroblasten
Nährstoffe werden gebraucht für Biosynthese (Wachstum, Regeneration, Immunabwehr, Sekretion, Strukturerhaltung) und Energienutzung (Transport, Bewegung, Verformung, Energiespeicherung). Bindungsenergie für den Aufbau energiereicher Phosphate (ATP, CP) stammt zum Großteil aus oxidativem Abbau
von Kohlenhydraten und Fetten.
Lipolyse liefert freie Fettsäuren aus der Spaltung
von Neutralfett. Insulin, Glukagon, Adrenalin u.a. stabilisieren den Blutzuckerspiegel. Primärer Glucoseverbraucher ist
das Gehirn, obligat glucoseabhängig sind weiters Nebenniere,
Erythrozyten, Fibroblasten  Zellen bilden ATP nach
Maßgabe des aktuellen Bedarfs, aerob
~20-mal effizienter als anaerob. Abbau von Kohlenhydraten, Fetten,
Proteinen ergibt Acetyl-Coenzym A (auch Ausgangspunkt der Cholesterinsynthese), bei dessen Abbau entsteht H+ (Elektronentransport über Coenzyme NAD+, NADP+, FAD, die Elektronen und damit Energie aufnehmen und zu NADH, NADPH, FADH2
werden: Redox-Reaktion) und wird im mitochondrialen Intermembranraum
angereichert; dieser Protonengradient treibt die ATP-Synthese an (H+-Rückdiffusion durch ATP-Synthase in der inneren Mitochondrienmembran). Die aerobe Oxidation von 1 mol Glucose liefert 38
mol ATP, der Rest geht als Wärme verloren. Der Wirkungsgrad (~40%) kann durch uncoupling proteins in den
Mitochondrien reduziert werden (verstärkte Wärmebildung).
Mitochondrien
können neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
verschmelzen oder sich aufspalten, wodurch sich Zahl und Volumen
je nach Anforderung ändern; mit
zunehmendem Energieumsatz steigt die Mitochondriendichte
Zellen bilden ATP nach
Maßgabe des aktuellen Bedarfs, aerob
~20-mal effizienter als anaerob. Abbau von Kohlenhydraten, Fetten,
Proteinen ergibt Acetyl-Coenzym A (auch Ausgangspunkt der Cholesterinsynthese), bei dessen Abbau entsteht H+ (Elektronentransport über Coenzyme NAD+, NADP+, FAD, die Elektronen und damit Energie aufnehmen und zu NADH, NADPH, FADH2
werden: Redox-Reaktion) und wird im mitochondrialen Intermembranraum
angereichert; dieser Protonengradient treibt die ATP-Synthese an (H+-Rückdiffusion durch ATP-Synthase in der inneren Mitochondrienmembran). Die aerobe Oxidation von 1 mol Glucose liefert 38
mol ATP, der Rest geht als Wärme verloren. Der Wirkungsgrad (~40%) kann durch uncoupling proteins in den
Mitochondrien reduziert werden (verstärkte Wärmebildung).
Mitochondrien
können neu gebildet (Biosynthese) und abgebaut werden (Mitophagie),
verschmelzen oder sich aufspalten, wodurch sich Zahl und Volumen
je nach Anforderung ändern; mit
zunehmendem Energieumsatz steigt die Mitochondriendichte Biosynthetische
Vorgänge, Transport von Stoffen und
Information konsumieren >50% des Energieumsatzes;
~25% Kontraktionsvorgänge
(Skelett-, Herz-, glatte Muskulatur). Verdauung und Verwertung von Nährstoffen steigern den Energieumsatz um bis zu 10%
(spezifisch-dynamische Wirkung). Bei positiver Energiebilanz speichern Zellen Glykogen, Fett, Protein. Unter Ruhebedingungen
verbrauchen das Gehirn ≥20%, Muskeln ≥20% (mehr mit körperlicher
Belastung), Immunsystem ~10%, Leber ~20%, Nieren ~10%, Myokard ~10% des gesamten Energieumsatzes. Dieser
korreliert mit dem Sauerstoffverbrauch (indirekte Kalorimetrie: Energieäquivalent 21,4 kJ / l O2). Der physiologische Brennwert beträgt für Kohlenhydrate und Eiweiß 17 kJ/g, für Fette 39 kJ/g
Biosynthetische
Vorgänge, Transport von Stoffen und
Information konsumieren >50% des Energieumsatzes;
~25% Kontraktionsvorgänge
(Skelett-, Herz-, glatte Muskulatur). Verdauung und Verwertung von Nährstoffen steigern den Energieumsatz um bis zu 10%
(spezifisch-dynamische Wirkung). Bei positiver Energiebilanz speichern Zellen Glykogen, Fett, Protein. Unter Ruhebedingungen
verbrauchen das Gehirn ≥20%, Muskeln ≥20% (mehr mit körperlicher
Belastung), Immunsystem ~10%, Leber ~20%, Nieren ~10%, Myokard ~10% des gesamten Energieumsatzes. Dieser
korreliert mit dem Sauerstoffverbrauch (indirekte Kalorimetrie: Energieäquivalent 21,4 kJ / l O2). Der physiologische Brennwert beträgt für Kohlenhydrate und Eiweiß 17 kJ/g, für Fette 39 kJ/g Eine
erwachsene Person braucht pro Tag ≥2 l Wasser, ~500 Gramm Nährstoffe
und ~500 Liter Sauerstoff, dabei entstehen ~450 Liter Kohlendioxid,
~0,3 Liter Wasser
("Oxidationswasser") und ~50 Gramm Harnstoff, Ammoniak und andere
Endprodukte. Der Energiebedarf beträgt
~10 MJ/d. Blut enthält mit ~20 g Glucose, ~3 g Triglyzeriden und
~0,3 g Fettsäuren nur <0,1% (~110 Cal) der Energiereserven des Körpers (>150.000 Cal). Der Glucosebedarf beträgt
~5 g/kg/d und kann bei chronischem Hunger bis auf
~1 g/kg/d abnehmen (dabei Proteinabbau bis zu 100 g/d). Mäßige Muskelarbeit wird zum Großteil aus dem Abbau von Fettsäuren, zu
~1/4 aus Kohlenhydraten angetrieben (hohe Ausdauer). Die
Leber kann den Bedarf der Peripherie für einige Stunden decken
(Glykogenabbau), das Fettgewebe für mehrere Wochen (Lipolyse, Gewinnung
von Fettsäuren)
Eine
erwachsene Person braucht pro Tag ≥2 l Wasser, ~500 Gramm Nährstoffe
und ~500 Liter Sauerstoff, dabei entstehen ~450 Liter Kohlendioxid,
~0,3 Liter Wasser
("Oxidationswasser") und ~50 Gramm Harnstoff, Ammoniak und andere
Endprodukte. Der Energiebedarf beträgt
~10 MJ/d. Blut enthält mit ~20 g Glucose, ~3 g Triglyzeriden und
~0,3 g Fettsäuren nur <0,1% (~110 Cal) der Energiereserven des Körpers (>150.000 Cal). Der Glucosebedarf beträgt
~5 g/kg/d und kann bei chronischem Hunger bis auf
~1 g/kg/d abnehmen (dabei Proteinabbau bis zu 100 g/d). Mäßige Muskelarbeit wird zum Großteil aus dem Abbau von Fettsäuren, zu
~1/4 aus Kohlenhydraten angetrieben (hohe Ausdauer). Die
Leber kann den Bedarf der Peripherie für einige Stunden decken
(Glykogenabbau), das Fettgewebe für mehrere Wochen (Lipolyse, Gewinnung
von Fettsäuren)  Zellen passen
ihre Energiebilanz den jeweiligen Umständen an. Dazu haben sie Sensoren, welche die aktuellen Speicher in der
Zelle messen und anabole / katabole
Vorgänge in Balance halten. Zwei dieser "master sensors" sind der Kinasekomplex mTORC (stimuliert anabole Vorgänge wie die Proteinsynthese) und die Kinase AMPK (stimuliert katabole Vorgänge wie Glykolyse und Oxidation freier Fettsäuren) - sie antagonisieren ihre Wirkungen wechselseitig. mTORC wird gesteuert durch Wachstumsfaktoren, Insulin, Aminosäuren, mechanische Stimuli, oxidativen Stress. AMPK vermittelt
Ketogenese (Leber) und Fettsäureoxidation (Leber, Muskel), Glucoseaufnahme (Muskel), Triglyzeridsynthese / Hemmung der Lipolyse
(Fettgewebe), es wird angeregt durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, Ghrelin, Adiponektin; Leptin und Insulin wirken
inhibierend
Zellen passen
ihre Energiebilanz den jeweiligen Umständen an. Dazu haben sie Sensoren, welche die aktuellen Speicher in der
Zelle messen und anabole / katabole
Vorgänge in Balance halten. Zwei dieser "master sensors" sind der Kinasekomplex mTORC (stimuliert anabole Vorgänge wie die Proteinsynthese) und die Kinase AMPK (stimuliert katabole Vorgänge wie Glykolyse und Oxidation freier Fettsäuren) - sie antagonisieren ihre Wirkungen wechselseitig. mTORC wird gesteuert durch Wachstumsfaktoren, Insulin, Aminosäuren, mechanische Stimuli, oxidativen Stress. AMPK vermittelt
Ketogenese (Leber) und Fettsäureoxidation (Leber, Muskel), Glucoseaufnahme (Muskel), Triglyzeridsynthese / Hemmung der Lipolyse
(Fettgewebe), es wird angeregt durch körperliche
Belastung, niedrige Sauerstoffverfügbarkeit, Ghrelin, Adiponektin; Leptin und Insulin wirken
inhibierend Erythrozyten arbeiten
anaerob, sie geben Lactat an das Blutplasma
ab. Diesen Weg nutzen auch Muskelzellen, wenn sie mehr ATP verbrauchen
als durch oxydativen Abbau nachgeliefert
werden kann ("Sauerstoffschuld"): Sie bilden Lactat, das von anderen Geweben (Leber, Herz- und nichtaktive Muskulatur, Nieren) genutzt werden kann, aber die Pufferkapazität des Blutes belastet
(metabolische Azidose). Lactat fördert Immuntoleranz (anti-inflammatorischer
Effekt), Wundheilung, ATP-Produktion, Langzeitgedächtnis, und reduziert
die lipolytische Aktivität in Fettzellen. In den Blutkreislauf gelangen täglich
~1500
mmol Lactat, die Leber entfernt es
über den Cori-Zyklus (Glukoneogenese) und oxidative
Phorphorylierung (Citratzyklus), bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen
Erythrozyten arbeiten
anaerob, sie geben Lactat an das Blutplasma
ab. Diesen Weg nutzen auch Muskelzellen, wenn sie mehr ATP verbrauchen
als durch oxydativen Abbau nachgeliefert
werden kann ("Sauerstoffschuld"): Sie bilden Lactat, das von anderen Geweben (Leber, Herz- und nichtaktive Muskulatur, Nieren) genutzt werden kann, aber die Pufferkapazität des Blutes belastet
(metabolische Azidose). Lactat fördert Immuntoleranz (anti-inflammatorischer
Effekt), Wundheilung, ATP-Produktion, Langzeitgedächtnis, und reduziert
die lipolytische Aktivität in Fettzellen. In den Blutkreislauf gelangen täglich
~1500
mmol Lactat, die Leber entfernt es
über den Cori-Zyklus (Glukoneogenese) und oxidative
Phorphorylierung (Citratzyklus), bei Muskelarbeit kann die Lactatverarbeitung durch die Leber mehr als 10-fach ansteigen